Строение атома кислорода и схема электронной оболочки элемента
4.5
Средняя оценка: 4.5
Всего получено оценок: 325.
4.5
Средняя оценка: 4.5
Всего получено оценок: 325.
Кислород (O) – жизненно важный газ, необходимый для дыхания, поддержания горения, окисления. Относится к группе халькогенов. Самый распространённый на Земле элемент. Строение атома кислорода позволяет ему соединяться с металлами и неметаллами, образуя оксиды.
Строение
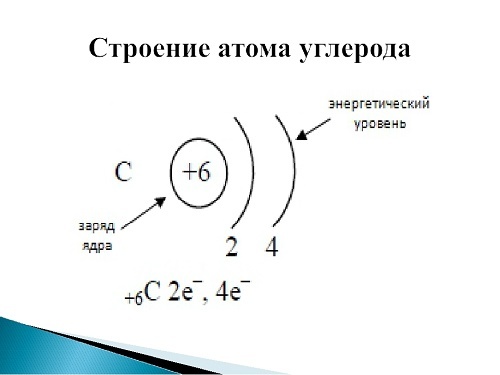
По положению в периодической таблице Менделеева можно определить строение атома элемента кислорода. Это восьмой элемент, расположенный в VI группе, втором периоде. Относительная атомная масса – 16. Существует три изотопа элемента:
- 16O;
- 17O;
- 18O.
Наиболее распространён 16O.
Рис. 1. Положение кислорода в периодической таблице.Электронная конфигурация атома кислорода – 1s22s22p4. Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Молекула кислорода имеет два атома – О2. При присоединении ещё одного атома образуется озон – О3.
Физические свойства
Кислород – бесцветный и безвкусный газ, плохо растворимый в воде и спирте. Хорошо растворим в жидком серебре. В сжиженном виде приобретает светло-голубой цвет, в твёрдом – синий. Занимает 21 % атмосферного воздуха.
Рис. 3. Твёрдый кислород.Кислород поддерживает горение, поэтому его легко обнаружить с помощью тлеющей лучины (вспыхивает).
Химические свойства
Благодаря электронному строению обладает высокой степенью окисления. Однако большую активность проявляет при нагревании из-за прочных двойных связей между атомами.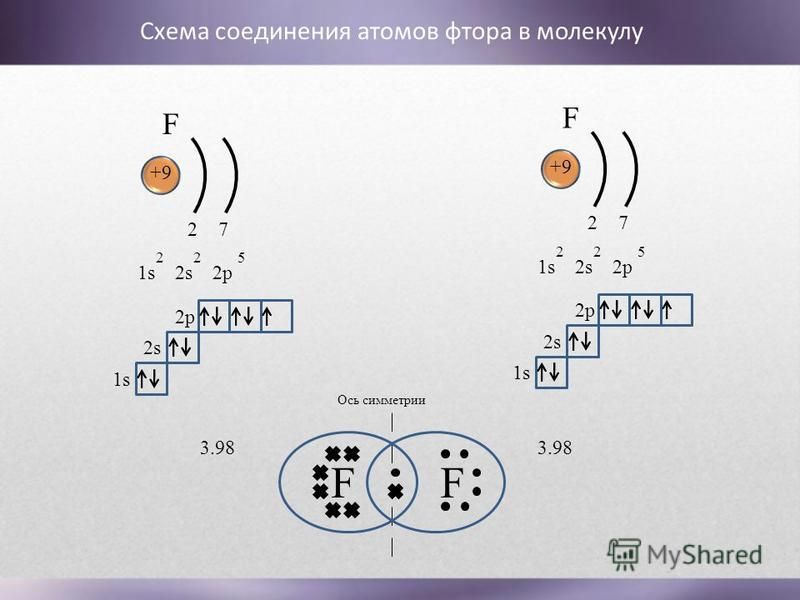 При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
Соединяясь с элементами, образует оксиды. Окисляет органические вещества. Примеры реакций с простыми веществами:
- K + O2 → KO2;
- 3Fe + 2O2 → Fe3
- S + O2 → SO2.
С фосфором, серой, углеродом (графитом), водородом кислород реагирует при нагревании:
- 4Р + 5О2 → 2Р2О5;
- S + O2 → SO2;
- С + О2 → СО2;
- 2Н2 + О2 → 2Н2О.
Быстро пропуская фтор через щёлочь, получают реакцию кислорода с фтором:
2F2 + 2NaOH → 2NaF + H2O + OF2.
Кислород с фтором непосредственно взаимодействует при электрическом разряде. В этом случае кислород играет роль восстановителя:
O2 + F
Кислород реагирует со сложными веществами, образуя оксиды:
- 2CuS + 3O2 → 2CuO + 2SO2;
- 2H2S + 3O2 → 2SO2 + 2H2O;
- 2C6H6 + 15O2 → 12CO2 + 6H2O;
- CH4 + 2O2 → CO2 + 2H2O.
Кислород не реагирует с золотом и инертными газами. Взаимодействие с галогенами происходит в условиях ультрафиолета или электрического тока.
Что мы узнали?

Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
5/5
Мила Кондратьева
5/5
Семён Гольдфарб
5/5
Александр Котков
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 325.
А какая ваша оценка?
Химия Кеннета Снельсона (структура электрона) / Хабр
В циклосферной теории строения электронных оболочек атомов и молекул, предложенной Кеннетом Снельсоном, электроны считаются отрицательно заряженными кольцевыми магнитами. При противоположной ориентации магнитных полей у смежных электронов их края притягиваются друг к другу и формируют электронные оболочки. Наиболее устойчивые оболочки атомов получаются из 8, 10 и 14 электронов.
Рис. 1. Иллюстрации к описанию атомных электронных оболочек из патента К.
Эта теория хорошо объясняет известные химические свойства и структурные особенности различных простейших молекул, а также длину периодов в таблице Менделеева (см. «Химия Кеннета Снельсона»). И объясняет явно лучше квантовой механики с её многочисленными постулатами — орбиталями, принципом неопределённости, волновыми функциями и т.п.. Зато квантовая механика неплохо справляется с описанием спектральных свойств атома водорода, которые сложно объяснить исходя из простой кольцевой формы электрона. Но можно предположить, что у электрона кольцо не простое, а составное – состоящее из замкнутой цепочки мелких колечек. И попытаться обосновать этим линейчатость спектра водородного атома.
Предположим, что электрон атома водорода в наивысшем возбуждённом состоянии имеет простую кольцевую форму — ту же, что и свободный электрон. А переходы на нижележащие энергетические уровни (стационарные состояния) сопровождаются не только излучением, но и увеличением количества образующих его уменьшенных колечек. Точнее – пар колечек, поскольку только при чётном количестве они удерживаются вместе магнитным полем (Рис. 2).
Точнее – пар колечек, поскольку только при чётном количестве они удерживаются вместе магнитным полем (Рис. 2).
Рис. 2. Схема основных стационарных состояний электрона
Такая плоская схема демонстрирует только общий принцип дробления электронного кольца. Но в атоме водорода все колечки, образующие электронную цепь, должны располагаться на эквипотенциальной сфере, для показа которой лучше использовать объёмные изображения (Рис. 3).
* Цифры соответствуют количеству пар электронных колец
Рис. 3. Низшие многокольцевые состояния электрона
Существование пяти основных спектральных серий атомарного водорода – Лаймана, Бальмера, Пашена, Брэккета и Пфунда – может объясняться излучательными переходами электрона на энергетические уровни, соответствующие этой пятёрке стационарных состояний (2, 3, 4, 5 и 6 пар колец). В таком случае существование серии Хэмпфри объясняется переходом электрона из однокольцевого состояния в двухкольцевое (или в соответствующее ему двухволновое).
* Цифры соответствуют количеству стоячих волн в электронном кольце
Рис. 4. Низшие колебательные состояния электрона
На схеме основных стационарных состояний электрона (Рис. 2) показана его гипотетическая двухкольцевая форма. Логично предположить, что она может формироваться из однокольцевого двухволнового варианта. Но ещё логичнее выглядит трансформация двухволнового кольца в четырёхкольцевую форму. Во всяком случае, при построении 3D-моделей трансформация четырёх колец в две волны (и наоборот) не вызывает затруднений (Рис. 5).
Рис. 5. Переходные формы электрона (двухволновой <–> четырёхкольцевой)
Если переходная двухкольцевая форма всё-таки существует, то её энергетический уровень не должен отличаться от уровня двухволновой формы. Поэтому её совсем не обязательно показывать на схеме излучательных переходов электрона в атоме водорода (Рис.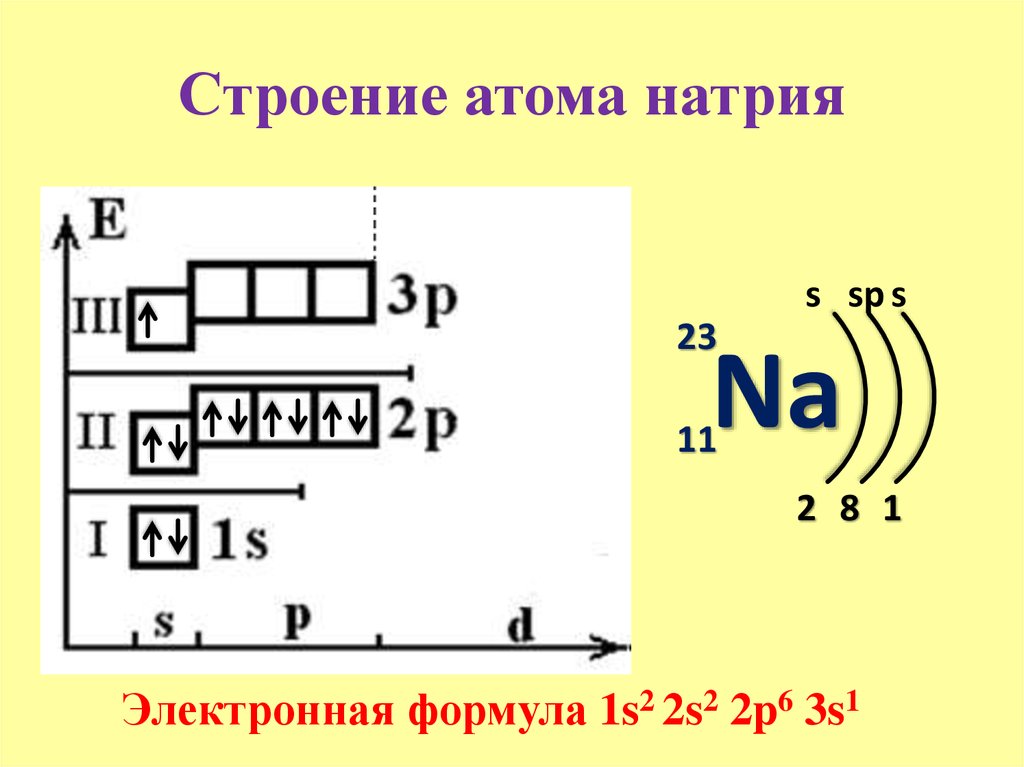
Рис. 6. Серии излучательных переходов электрона в атоме водорода
Известны и другие серии излучения электрона, но все они лежат в далёкой инфракрасной области и с трудом поддаются изучению. Последняя, получившая именное название, — серия Хансена-Стронга – была описана в 1972 году. На приведённой выше схеме её основному энергетическому уровню соответствует трёхволновое состояние электрона.
У свободного кольцевого электрона, на который не действует поле притяжения атомного ядра, невозбуждённое состояние в идеале должно соответствовать наивысшему (нулевому) энергетическому уровню, показанному на Рис. 6. Такой идеал возможен только при бесконечно большом количестве стоячих волн, энергия которых стремится к нулевому пределу. Но достичь этого предела невозможно. Поэтому свободный кольцевой электрон всегда близок к идеалу (нулевому энергетическому состоянию), но не идеален. Причём его энергия при снижении количества (и увеличении амплитуды) стоячих волн не уменьшается, как в атоме водорода, а увеличивается.
Существование множества колебательных состояний свободного кольцевого электрона не представляет особого интереса для химиков, но способно пролить свет на некоторые астрофизические явления. Например, объяснить причины существования реликтового микроволнового излучения, обосновать концепцию старения света, дать альтернативное объяснение красному смещению, опровергнуть теорию Большого взрыва и доказать вечность и бесконечность Вселенной. Но сначала нужно доработать теорию Кеннета Снельсона – доказать, что электронные оболочки атомов и молекул можно строить не только из простых колец, но и из их многокольцевых цепочек.
Иллюстрации к этой заметке подготовлены 3DKiwi, за что автор выражает ему свою глубочайшую благодарность. Им же построены наглядные 3D-модели основных стационарных состояний электрона атома водорода, позволяющие детально рассмотреть все подробности:
https://p3d.in/2d5ol — 6 пар колец
https://p3d.in/DtkLu — 5 пар
https://p3d.in/TrAmL — 4 пары
https://p3d. in/fhaVp — 3 пары
in/fhaVp — 3 пары
https://p3d.in/9uWEb — 2 пары
https://p3d.in/gAwto — 2 волны
https://p3d.in/Te4xo — 3 волны
https://p3d.in/DkhLr — 4 волны
https://p3d.in/ZChp6 — 5 волн
https://p3d.in/o3S47 — 6 волн
https://p3d.in/CkBMl — 7 волн
Наверное, Снельсон одобрил бы эти модели. Если бы не умер в конце 2016 года.
Как построить схему атома
••• Creatas Images/Creatas/Getty Images
Обновлено 24 апреля 2017 г.
Майя Остин элемент. Атомы состоят из трех субатомных частиц, называемых протонами, нейтронами и электронами. Положительно заряженные протоны и нейтроны (не имеющие заряда) составляют ядро атома, или центр, в то время как отрицательно заряженные электроны вращаются вокруг ядра. Чтобы точно изобразить атом, вы должны знать, сколько протонов, нейтронов и электронов содержит атом, в дополнение к «конфигурации электронной оболочки» атома.
Обратитесь к Периодической таблице элементов, чтобы узнать атомный номер и атомный вес элемента, для которого вы хотите создать диаграмму. Периодическая таблица представляет собой диаграмму в виде сетки, отображающую все известные элементы. В каждом отдельном квадрате сетки Периодической таблицы указан атомный номер, атомный символ и атомный вес каждого элемента; элементы расположены в порядке возрастания по атомному номеру. Чтобы найти атомный номер нужного вам элемента в Периодической таблице, найдите квадрат сетки в таблице, назначенный этому элементу, найдя имя элемента или атомный символ (атомарный символ — это аббревиатура имени элемента). Атомный номер элемента написан мелким шрифтом в верхней части каждого квадрата сетки; атомный вес написан мелким шрифтом внизу квадрата.
Периодическая таблица представляет собой диаграмму в виде сетки, отображающую все известные элементы. В каждом отдельном квадрате сетки Периодической таблицы указан атомный номер, атомный символ и атомный вес каждого элемента; элементы расположены в порядке возрастания по атомному номеру. Чтобы найти атомный номер нужного вам элемента в Периодической таблице, найдите квадрат сетки в таблице, назначенный этому элементу, найдя имя элемента или атомный символ (атомарный символ — это аббревиатура имени элемента). Атомный номер элемента написан мелким шрифтом в верхней части каждого квадрата сетки; атомный вес написан мелким шрифтом внизу квадрата.
Определите количество протонов и электронов в выбранном элементе. Атомный номер элемента представляет собой количество протонов, которые содержит этот элемент. Поскольку атомы не имеют общего электрического заряда, каждый атом имеет равное количество протонов и электронов. Например, азот (N) имеет атомный номер 7, поэтому атом азота состоит из семи протонов и семи электронов.
Подсчитайте, из скольких нейтронов состоит выбранный элемент. Формула для определения количества нейтронов в атоме:
Массовое число – количество протонов = количество нейтронов.
Чтобы найти массовое число элемента, округлите его атомный вес до ближайшего целого числа. Атом азота, например, имеет атомный вес 14,0067. Массовое число азота, округленное до ближайшего целого числа, равно 14. Вычтем количество протонов, чтобы получить 14 – 7 = 7; азот имеет семь нейтронов.
Нарисуйте кружком каждый протон и каждый нейтрон, содержащиеся в выбранном элементе. Убедитесь, что эти круги сгруппированы вместе. Поместите положительный знак внутри каждого протонного круга или раскрасьте каждый круг, представляющий протон, в один и тот же цвет. Оставьте внутреннюю часть каждого нейтронного круга пустой или раскрасьте все круги, представляющие нейтроны, одним цветом. Эта группа кругов представляет собой ядро атома. 93; это означает, что у него есть две оболочки с 2 электронами в первой оболочке и 5 электронами во второй оболочке, потому что «1» имеет надстрочный индекс 2; а «двойки» имеют надстрочные числа 2 и 3, которые вместе составляют 5.
Нарисуйте по одному кольцу вокруг ядра атома для каждой оболочки, которую имеет атом. Нарисуйте маленькие кружки на каждом кольце, чтобы обозначить количество электронов на этой оболочке. первая оболочка — кольцо, ближайшее к ядру
Статьи по теме
Ссылки
- Sciencedaily: Atom
- JLAB: Как сделать модель атома?
Об авторе
Майя Остин начала писать внештатно в 2009 году. Она писала для многих интернет-изданий на самые разные темы, от физической подготовки до любительской астрономии. Она также является автором и издателем электронных книг. Остин имеет степень бакалавра искусств в области коммуникаций Института искусств Новой Англии и в настоящее время живет в Бостоне, штат Массачусетс.
Фото:
Creatas Images/Creatas/Getty Images
Концепция диаграммы атома бария Royalty Free Vector Image
Концепция диаграммы атома бария Royalty Free Vector ImageЛицензияПодробнее
Стандарт Вы можете использовать вектор в личных и коммерческих целях. Расширенный Вы можете использовать вектор на предметах для перепродажи и печати по требованию.Тип лицензии определяет, как вы можете использовать этот образ.
| Станд. | Расшир. | |
|---|---|---|
| Печатный / редакционный | ||
| Графический дизайн | ||
| Веб-дизайн | ||
| Социальные сети | ||
| Редактировать и изменять | ||
| Многопользовательский | ||
| Предметы перепродажи | ||
| Печать по требованию |
Владение Узнать больше
Эксклюзивный Если вы хотите купить исключительно этот вектор, отправьте художнику запрос ниже: Хотите, чтобы это векторное изображение было только у вас? Эксклюзивный выкуп обеспечивает все права этого вектора.
Мы удалим этот вектор из нашей библиотеки, а художник прекратит продажу работ.
Способы покупкиСравнить
Плата за изображение $ 14,99 Кредиты $ 3,00 Подписка $ 0,69Оплатить стандартные лицензии можно тремя способами. Цены $ $ .
| Оплата с помощью | Цена изображения |
|---|---|
| Плата за изображение $ 14,99 Одноразовый платеж | |
| Предоплаченные кредиты $ 3 Загружайте изображения по запросу (1 кредит = 1 доллар США). Минимальная покупка 30р. | |
| План подписки От 69 центов Выберите месячный план. Неиспользованные загрузки автоматически переносятся на следующий месяц. | |
Способы покупкиСравнить
Плата за изображение $ 39,99 Кредиты $ 30,00 Существует два способа оплаты расширенных лицензий.