Урок 1. Схема строения атомов – HIMI4KA
Архив уроков › Основные законы химии
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.
Содержание
- Основы строения атома
- Состав ядра атома
- Атомная единица массы
- Порядковый номер атома и атомная масса элемента
Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели.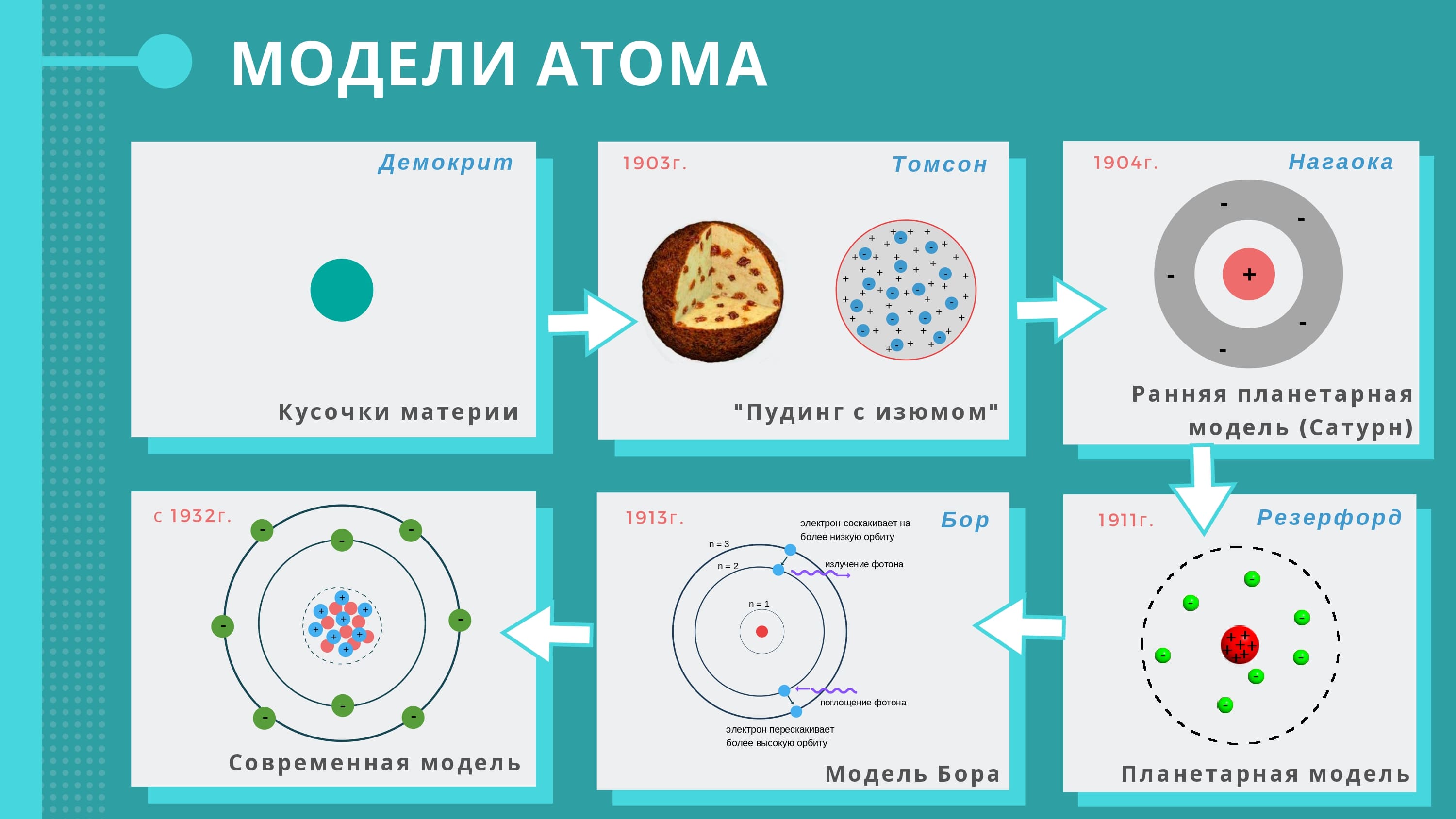 Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала, поэтому в данном случае с ней даже не считаются.
Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала, поэтому в данном случае с ней даже не считаются.
Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×1023 а.е.м и наоборот 1 а.е.м. = 1,66×10-24 г. Число 6,022×1023 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10-19 | 1,67·10-24 | 1,00728 |
| Нейтрон | 0 | 1,67·10-24 | 1,00866 |
| Электрон | -1,6·10-19 | 9,10·10-28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т. д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 2. Изотопы элементов →
← Глоссарий к главе «Атомы, молекулы и ионы»
Химическая связь — основные виды, типы и характеристики
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Важно!
Существует несколько систем измерения ЭО, но пользоваться для расчетов можно любой из них. Для образования химической связи важно не конкретное значение ЭО, а разница между этими показателями у двух атомов.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой.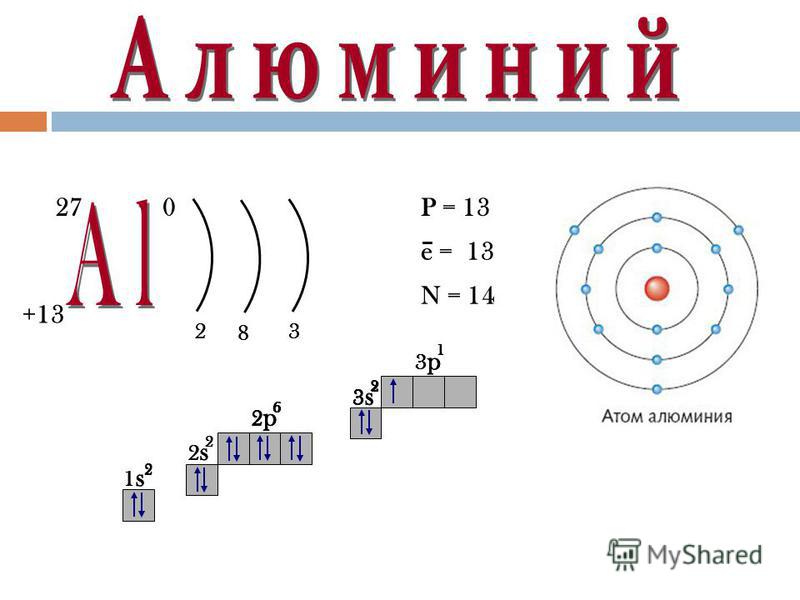 Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Механизм образования химической ковалентной связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов.
 С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную.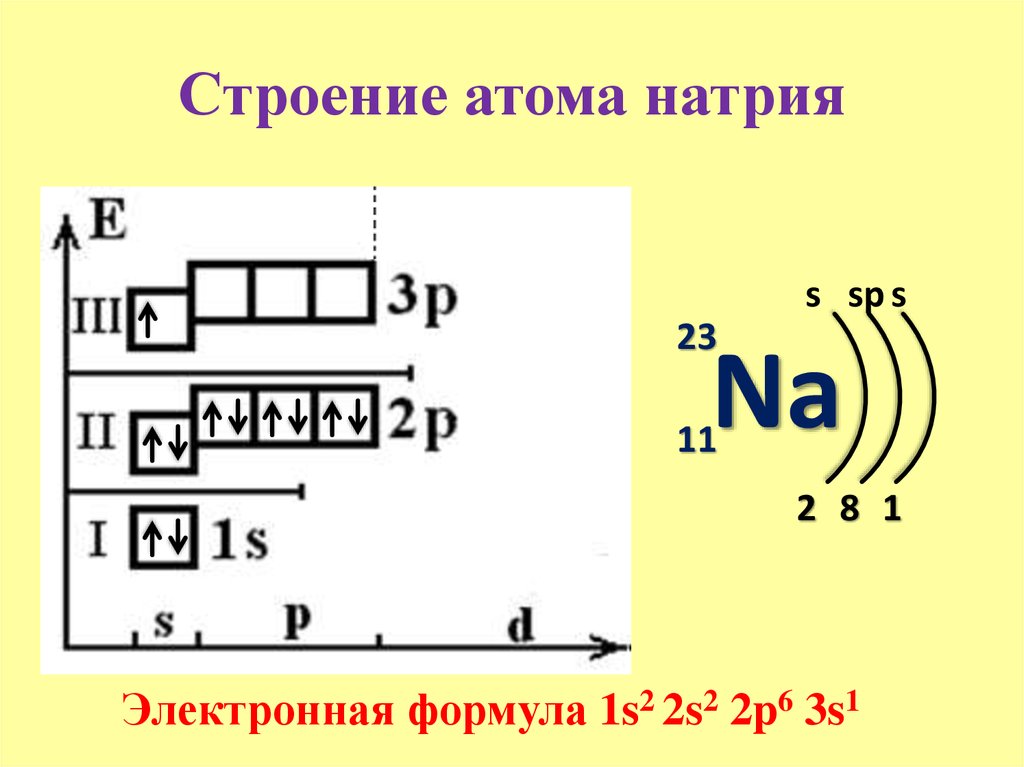 Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Важно!
В зависимости от того, сколько получилось электронных пар, химические связи могут быть одинарными, двойными или тройными.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.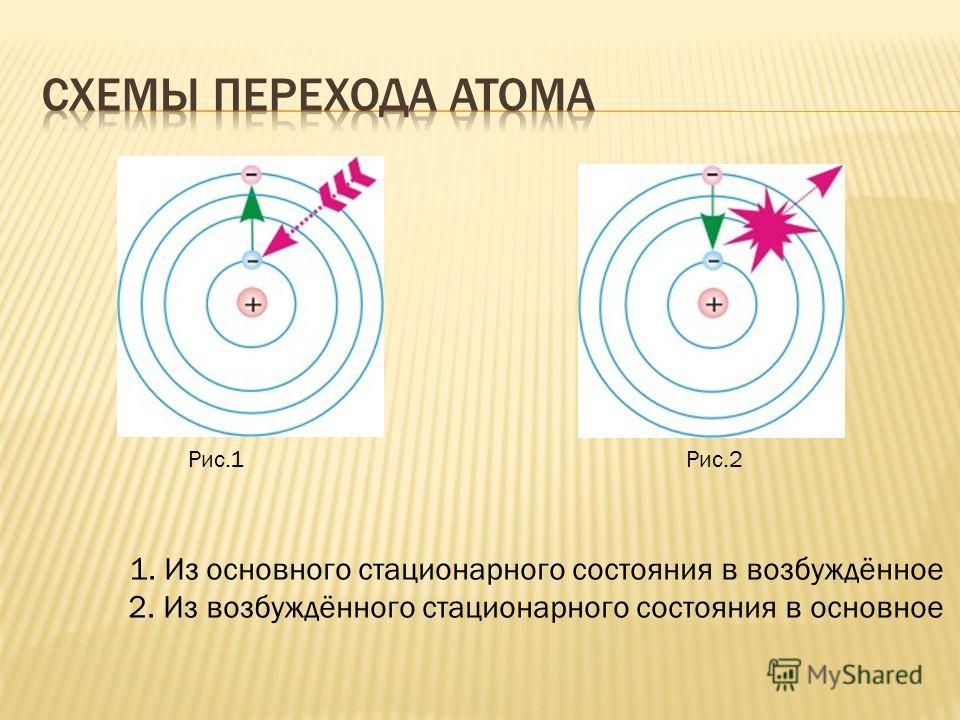
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью. |
Характеристики ковалентной связи:
- насыщена,
- направлена,
- имеет полярность.
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Важно!
Все соли образованы с помощью ионных связей, поэтому в задачах, где нужно определить тип химической связи в веществах, в качестве подсказки можно использовать таблицу растворимости.
Характеристики ионной связи:
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Ковалентная связь | Ионная связь |
|---|---|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. | Характеризуется появлением и взаимным притяжением ионов. |
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. | Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
Имеет направленность и насыщенность. | Ненасыщенна и не имеет направленности. |
Количество связей, образуемых атомом, называется валентностью. | Количество ближайших соседей атома называется координационным числом. |
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. | Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Физики предложили схему получения спин-поляризованной метастабильной материи
Физика
Сложность
6. 9
9
Horst Schmidt-Böcking and Gernot Gruber / Atoms, 2022
Немецкие физики предложили схему получения спин-поляризованной метастабильной материи. Для этого необходимо смешивать пучок ионов с пучком водорода, все электронные спины которого выстроены вдоль одного направления. Такие атомы смогут накапливать огромное количество энергии, а также будут создавать очень большое магнитное поле. Исследование опубликовано в Atoms.
Электроны — это фермионы. Два электрона не могут находиться в одинаковых состояниях. В случае многоэлектронного атома это заставляет электроны распределяться по орбитам с различными квантовыми числами. Одним из этих чисел оказывается проекция полуцелого спина электрона, способная принимать лишь два значения +1/2 и –1/2.
Электроны крайне неохотно дают излучению переворачивать свои спины. Например, основное состояние атома гелия содержит два электрона на 1s оболочке с противоположно направленными спинами, формируя синглетное состояние 1S0.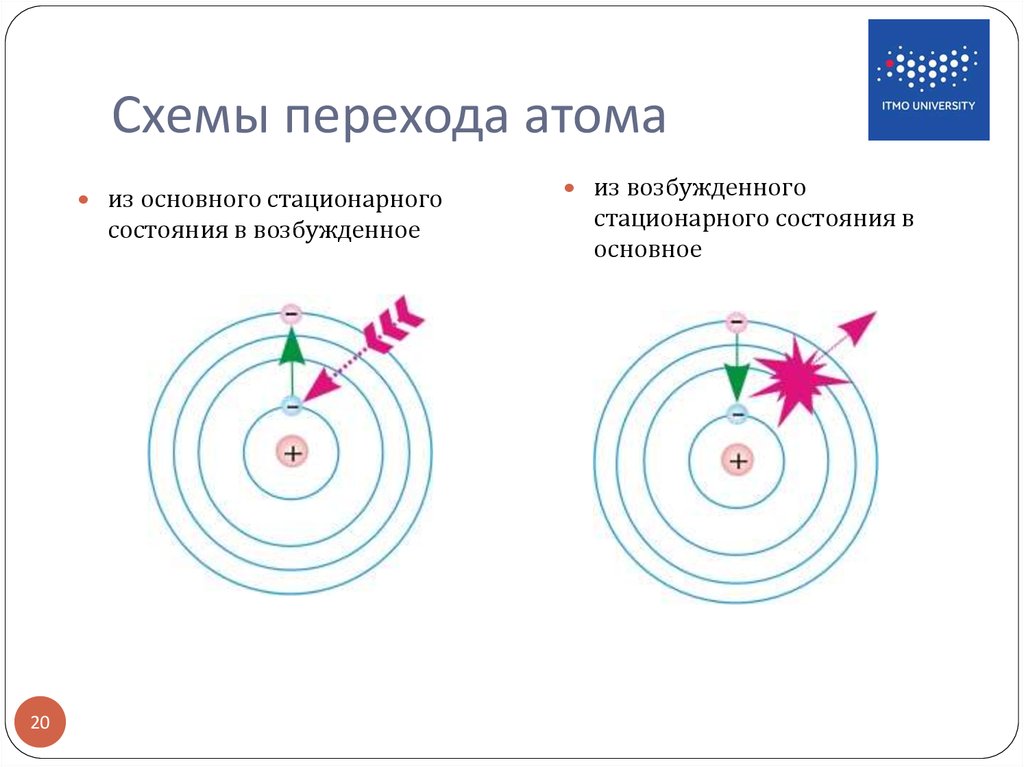 Физики называют такой гелий парагелием. Если же каким-то образом (например, ударно) возбудить один из электронов с переворотом его спина, то он надолго (примерно на 8 × 103 секунд) застрянет в метастабильном триплетном состоянии 3S1 в конфигурации 1s2s (ортогелий). Распад ортогелия может произойти ударно, либо за счет редких двухфотонных или магнитно-дипольных переходов.
Физики называют такой гелий парагелием. Если же каким-то образом (например, ударно) возбудить один из электронов с переворотом его спина, то он надолго (примерно на 8 × 103 секунд) застрянет в метастабильном триплетном состоянии 3S1 в конфигурации 1s2s (ортогелий). Распад ортогелия может произойти ударно, либо за счет редких двухфотонных или магнитно-дипольных переходов.
Консервативный характер спиновой проекции электрона побудил физиков к рассуждениям о спин-полязированной метастабильной материи, состоящей из атомов, у которых все или достаточно много электронов имеют одинаковое спиновое квантовое число. В таких атомах придется возбудить множество электронов, поскольку исключение одной из проекций спина уменьшит количество нижних вакантных уровней. Это означает, что количество энергии, которую сможет запасти атом, сильно вырастет. В числе прочего из спин-поляризованного азота могла бы состоять шаровая молния.
Электронная конфигурация атома азота в основном (слева) и спин-поляризованном (справа) состоянии
Horst Schmidt-Böcking and Gernot Gruber / Atoms, 2022
Поделиться
Концепция спин-поляризованных атомов подразумевает, что на внутренних оболочках многоэлектронных атомов появятся вакансии. Такие «пустые» атомы, как правило, рождаются в медленных ион-атомных столкновениях, а затем за пикосекунды релаксируют через оже-процесс или излучение рентгеновских фотонов. Обычно экспериментаторы не интересуются спиновой структурой электронных оболочек в этих процессах. Известно единственное исследование, в котором переворот спина одного электрона, возбужденного из внутренних оболочек, увеличил время жизни «пустых» атомов до наносекунд.
Такие «пустые» атомы, как правило, рождаются в медленных ион-атомных столкновениях, а затем за пикосекунды релаксируют через оже-процесс или излучение рентгеновских фотонов. Обычно экспериментаторы не интересуются спиновой структурой электронных оболочек в этих процессах. Известно единственное исследование, в котором переворот спина одного электрона, возбужденного из внутренних оболочек, увеличил время жизни «пустых» атомов до наносекунд.
Хорст Шмидт-Бёкинг (Horst Schmidt-Böcking) и Гернот Грубер (Gernot Gruber) из Франкфуртского университета решили разобраться в том, как поведет себя множество электронов с одинаковой проекцией спина. Из общих соображений им стало ясно, что с ростом числа таких электронов энергетический барьер для переворота их спинов должен возрастать из-за очень сильного внутреннего магнитного поля. Однако процесс многократного возбуждения должен быть очень быстрым (не более микросекунды), чтобы до образования сильного поля атом не успел распасться.
Для количественных оценок физики обратились за консультацией к своим коллегам, специализирующихся на расчете конфигурации многократно возбужденных ионов или атомов. Оказалось, однако, что существующие теории не способны рассчитать переходы в столь сильных магнитных полях, которые, например, создают электроны с суммарным спиновым числом, равным девяти. Теоретики, тем не менее, подтвердили их предположение о том, что рост поля должен замораживать релаксацию, но посчитали маловероятным, что это время будет достаточно большим для повседневных приложений, например, для накопления энергии.
Оказалось, однако, что существующие теории не способны рассчитать переходы в столь сильных магнитных полях, которые, например, создают электроны с суммарным спиновым числом, равным девяти. Теоретики, тем не менее, подтвердили их предположение о том, что рост поля должен замораживать релаксацию, но посчитали маловероятным, что это время будет достаточно большим для повседневных приложений, например, для накопления энергии.
Чтобы стимулировать теоретическую работу в этом направлении, авторы предложили экспериментальную схему получения метастабильных спин-поляризованных атомов. Для этого сначала нужно создать пучок ионов с таким зарядом, чтобы его основное состояние обладало максимальным спиновым числом. Современные источники на основе электронного циклотронного резонанса позволяют производить большое количество различных ионов в широком диапазоне зарядов.
Затем с помощью магнита следует смешать ионный пучок с пучком спин-поляризованного водорода, который физики также умеют создавать. По оценкам авторов 10-сантиметровой длины совместного распространения достаточно, чтобы ионы перетянули на себя электроны с водорода. Часть из них перевернет спин, что приведет к образованию нейтральных атомов с разной степенью спин-поляризации. Чтобы их разделить, исследователи предлагают установить на их пути селектор, сортирующий атомы по спину с помощью эффекта Штерна — Герлаха. Максимально спин-поляризованный пучок должен отклоняться сильнее всего.
По оценкам авторов 10-сантиметровой длины совместного распространения достаточно, чтобы ионы перетянули на себя электроны с водорода. Часть из них перевернет спин, что приведет к образованию нейтральных атомов с разной степенью спин-поляризации. Чтобы их разделить, исследователи предлагают установить на их пути селектор, сортирующий атомы по спину с помощью эффекта Штерна — Герлаха. Максимально спин-поляризованный пучок должен отклоняться сильнее всего.
Схема предполагаемой установки по производству спин-поляризованной материи
Horst Schmidt-Böcking and Gernot Gruber / Atoms, 2022
Поделиться
Авторы описали детали этого процесса применительно к ионам криптона и урана. В первом случае лучше всего использовать 13-кратную ионизацию, поскольку в этом случае незаполненной остается лишь половина 3d оболочки. По правилам Хунда это приводит к суммарному спину S, равному 5/2, при нулевом орбитальном моменте.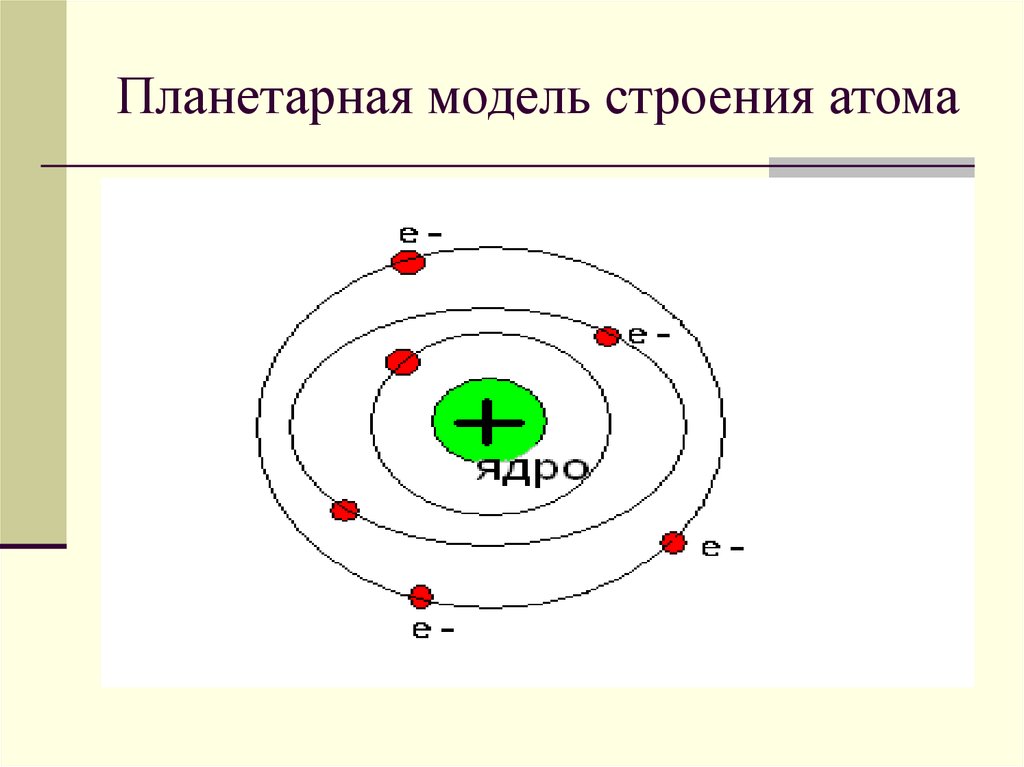 Поглощение тринадцати спин-поляризованных электронов доведет это значение до 9. В случае с ураном лучше использовать 69-кратную ионизацию. Так можно будет получить S, равный 37.
Поглощение тринадцати спин-поляризованных электронов доведет это значение до 9. В случае с ураном лучше использовать 69-кратную ионизацию. Так можно будет получить S, равный 37.
Электронная конфигурация атома урана. Слева: нейтральный атом в основном состоянии, посередине: ион U69+, справа: максимально спин-поляризованный нейтральный атом.
Horst Schmidt-Böcking and Gernot Gruber / Atoms, 2022
Поделиться
По оценкам физиков, энергия, заточенная в одном максимально спин-поляризованном атоме урана, может превышать 30 килоэлектронвольт, что на четыре порядка превышает аналогичные показатели у обычных батарей. Другим интересным свойством таких атомов станет сильное магнитное взаимодействие атомов, которое может проявить неожиданные электрон-электронные корреляции.
Магнитного упорядочения пучка атомов можно добиться и более известным способом. Недавно мы рассказывали, как физики намагнитили гелиевый газ, переведя его в ридберговское состояние.
Недавно мы рассказывали, как физики намагнитили гелиевый газ, переведя его в ридберговское состояние.
Марат Хамадеев
Электронная оболочка атома 8 класс онлайн-подготовка на Ростелеком Лицей
Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
Рис. 1. Бор Нильс Хендрих Давид (1885–1962)
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Правила распределения электронов
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na – элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br – 4 энергетических уровня, т. к. бром расположен в 4-м периоде (рис. 2).
| Модель атома натрия: | Модель атома брома: |
| Рис. 2. Модели строения электронных оболочек атомов натрия и брома | |
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n2, где n – номер энергетического уровня.
Таким образом, максимальное число электронов на:
1 слое – 2
2 слое – 8
3 слое – 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия – 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома – 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1-4 периодов
Строение электронных оболочек элементов 1–3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (рис. 3).
Рис. 3. Схема строения атома водорода
Следующий за водородом элемент – гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
4). Это максимально возможное число электронов для первого энергетического уровня.
Рис 4. Схема строения атома гелия
Элемент № 3 – это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое –1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (рис. 5).
| Рис. 5. Схемы строения атомов лития и бериллия | |
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (рис. 6).
Рис. 6. Схемы строения атомов некоторых элементов второго периода
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода – натрий. В атоме натрия – 3 электронных слоя, на которых расположены 11 электронов (рис. 7).
Na
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.
Четвертый период начинается с калия. Калий – щелочной металл, проявляющий в соединениях валентность I. Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент – скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп – это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (рис. 9):
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т. к. на третьем слое максимально допустимое количество электронов – 18, т. е. восемь электронов на 3-м слое – это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое – два электрона, на предвнешнем – 18 (рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т.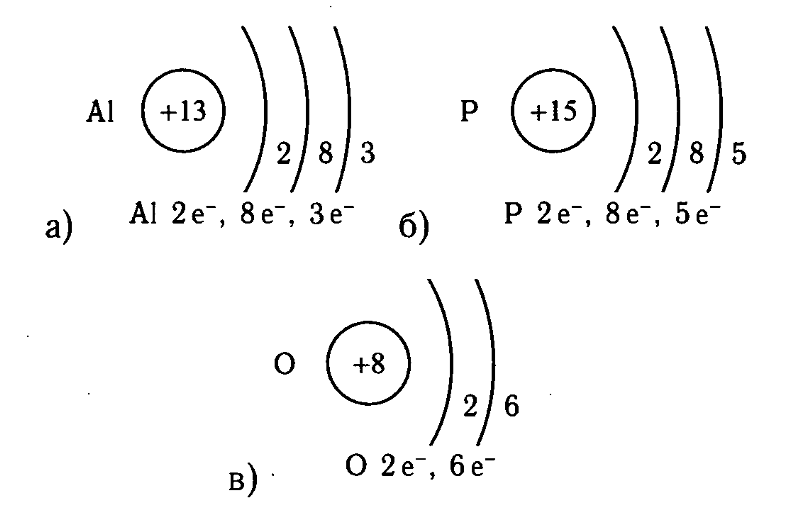 д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности. Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Список литературы
- Оржековский П. А. Химия: 8-й класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§44)
- Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§37)
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы.
 – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37–38)
– М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37–38) - Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с. 38–41)
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «chem.msu.su» (Источник).
- Интернет-портал «dic.academic.ru» (Источник).
- Интернет-портал «krugosvet.ru» (Источник).
Домашнее задание
- с. 250 №№ 2–4 из учебника П. А. Оржековского «Химия: 8-й класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
- Запишите распределение электронов по слоям в атоме аргона и криптона. Объясните, почему атомы этих элементов с большим трудом вступают в химическое взаимодействие.
Электронная формула и схема строения атома. Строение электронной оболочки атома
Давайте рассмотрим, как построен атом. Учитывайте, что речь будет вестись исключительно о моделях. На практике атомы представляют собой гораздо более сложную структуру. Но благодаря современным разработкам мы имеем возможность объяснять и даже успешно предсказывать свойства (пускай даже и не все). Итак, какова схема строения атома? Из чего он «сделаны»?
Учитывайте, что речь будет вестись исключительно о моделях. На практике атомы представляют собой гораздо более сложную структуру. Но благодаря современным разработкам мы имеем возможность объяснять и даже успешно предсказывать свойства (пускай даже и не все). Итак, какова схема строения атома? Из чего он «сделаны»?
Планетарная модель атома
Впервые была предложена датским физиком Н. Бором в 1913 году. Это первая теория строения атома, основанная на научных фактах. К тому же она положила основу современной тематической терминологии. В ней электроны-частицы производят вращательные движения вокруг атома по такому же принципу, как планеты вокруг Солнца. Бор высказал предположение, что они могут существовать исключительно на орбитах, находящихся на строго определённом расстоянии от ядра. Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру.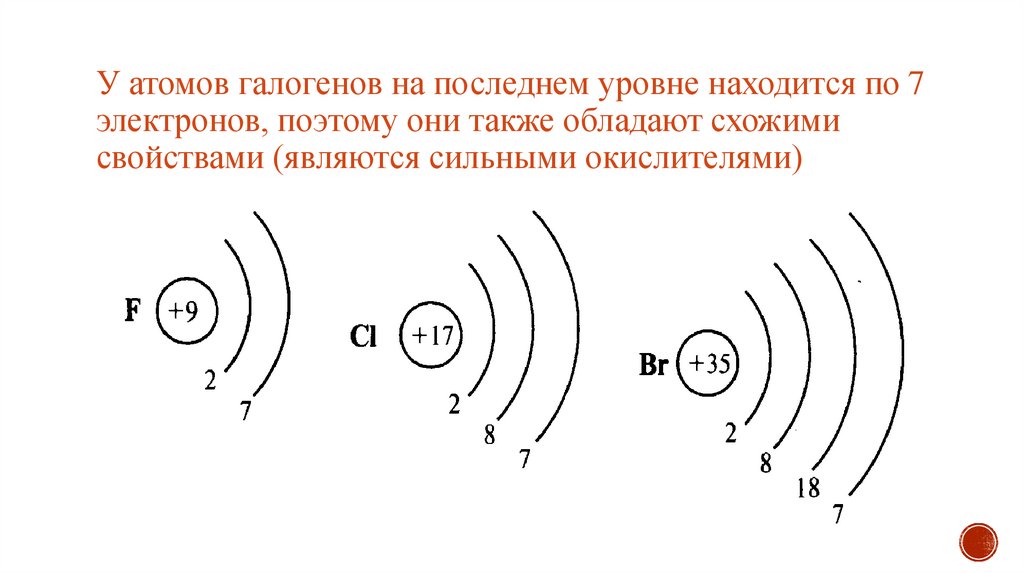 Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Волновая модель атома
Но со временем планетарная модель подверглась пересмотру.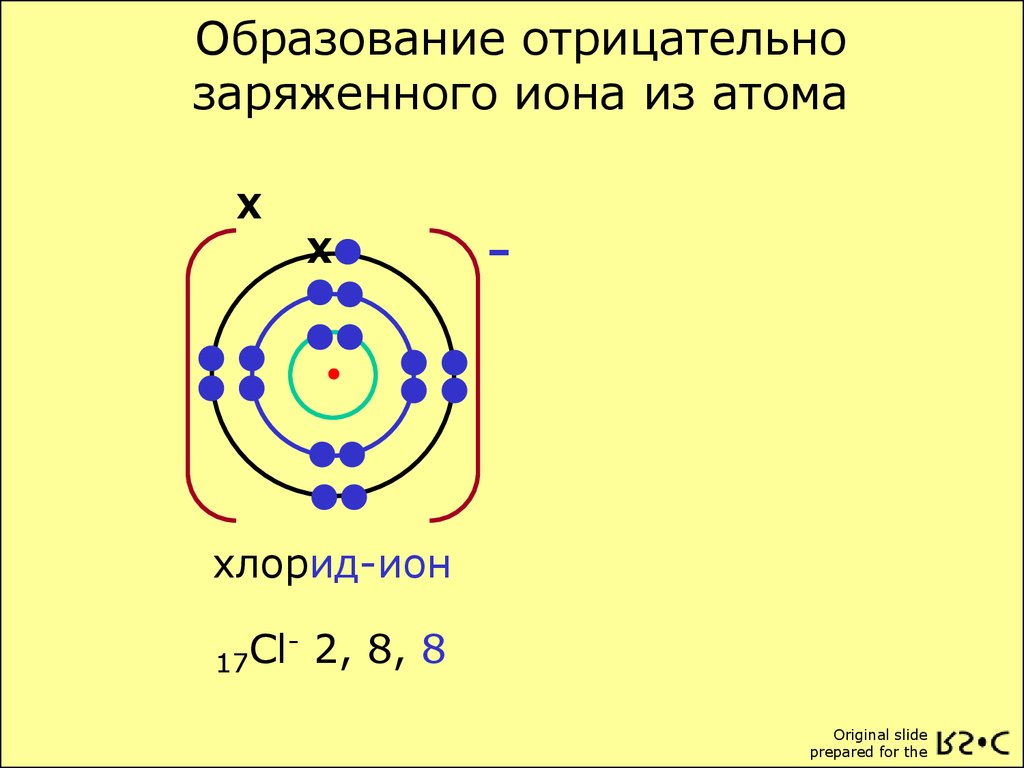 Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример – в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%. На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример – в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%. На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Понятие вероятности в данном случае
Почему был использован этот термин? Гейзенбергом в 1927 г. был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры. И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства.
был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры. И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Состав атома
Но давайте сконцентрируемся на всём объекте рассмотрения. Итак, кроме неплохо рассмотренной электронной оболочки, второй составляющей атома является ядро. Оно состоит из позитивно заряженных протонов и нейтральных нейтронов. Все мы знакомы с таблицей Менделеева. Номер каждого элемента соответствует количеству протонов, что в нём есть. Количество нейтронов равняется разнице между массой атома и его количеством протонов. Могут и быть отклонения от этого правила. Тогда говорят о том, что присутствует изотоп элемента. Схема строения атома такова, что его «окружает» электронная оболочка. обычно равняется количеству протонов. Масса последнего примерно в 1840 раз больше, чем у первого, и примерно равна весу нейтрона. Радиус ядра составляет около 1/200000 диаметра атома. Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Орбиты
Говоря о том, что такое схема строения атома, нельзя умолчать о них. Итак, есть такие виды:
- s. Имеют сферическую форму.
- p. Являются похожими на объемные восьмерки или веретено.
- d и f. Имеют сложную форму, которая с трудом описывается формальным языком.
Электрон каждого типа можно с вероятностью в 95% найти на территории соответствующей орбитали. К представленной информации необходимо относиться спокойно, поскольку это, скорее, абстрактная математическая модель, нежели физическое реальное положение дел. Но при всём этом она обладает хорошей предсказательной силой относительно химических свойств атомов и даже молекул. Чем дальше от ядра расположен уровень, тем больше электронов можно на нём разместить. Так, количество орбиталей можно подсчитать с помощью специальной формулы: х 2 . Здесь х равно количеству уровней. А поскольку на орбитали можно разместить до двух электронов, то в конечном итоге формула их численного поиска будет выглядеть следующим образом: 2х 2 .
Орбиты: технические данные
Если говорить про строение атома фтора, то он будет иметь три орбитали. Все они будут заполнены. Энергия орбиталей в рамках одного подуровня одинакова. Чтобы их обозначить, добавляют номер слоя: 2s, 4p, 6d. Возвращаемся к разговору про строение атома фтора. У него будет два s- и один p-подуровень. У него девять протонов и столько же электронов. Сначала один s-уровень. Это два электрона. Потом второй s-уровень. Ещё два электрона. И 5 заполняют p-уровень. Вот такое у него строение. После прочтения следующего подзаголовка можно собственноручно проделать необходимые действия и убедиться в этом. Если говорить про к которым относится и фтор, то следует отметить, что они, хотя и в одной группе, полностью различаются по своим характеристикам. Так, их температура кипения колеблется от -188 до 309 градусов Цельсия. Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью.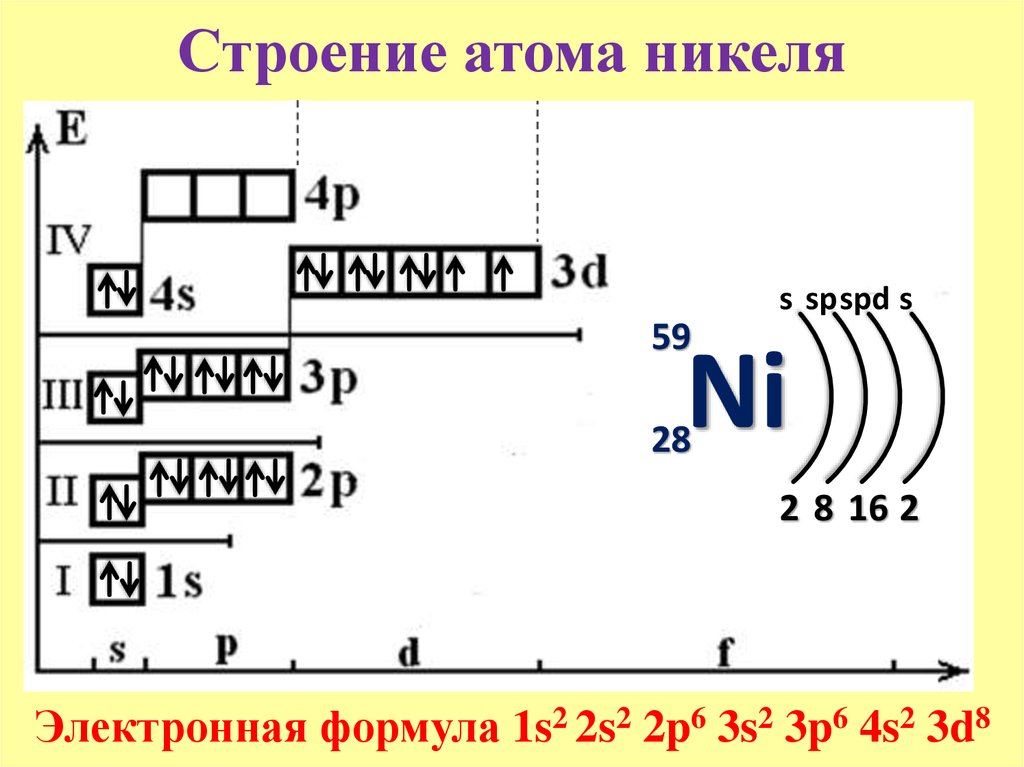 Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Как заполняются орбиты?
По каким правилам и принципам располагаются электроны? Предлагаем ознакомиться с тремя основными, формулировка которых была упрощена для лучшего понимания:
- Принцип наименьшей энергии. Электронам свойственно заполнять орбитали в порядке увеличения их энергии.
- Принцип Паули. На одной орбитали не может располагаться больше двух электронов.
- Правило Хунда. В пределах одного подуровня электроны заполняют сначала свободные орбитали, и только потом образуют пары.
В деле заполнения поможет и строение атома в таком случае станет более понятным в плане изображения. Поэтому при практической работе с построением схем элементов, необходимо держать её под рукой.
Пример
Для того, чтобы обобщить всё сказанное в рамках статьи, можно составить образец, как же распределяются электроны атома по своим уровням, подуровням и орбиталям (то есть, какой является конфигурация уровней).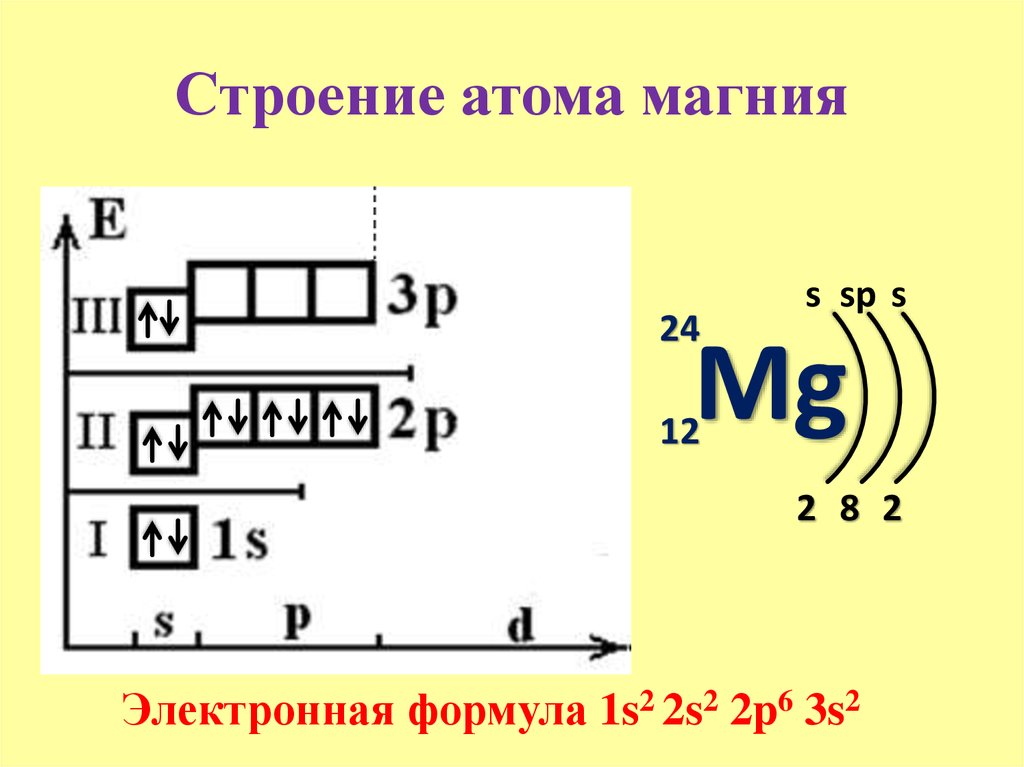 Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень.
Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Заключение
Как видите, строение атома – не такая сложная тема (если подходить к ней с позиции школьного курса химии, конечно). И понять данную тему не составляет труда. Напоследок хочется сообщить про некоторые особенности. К примеру, говоря про строение атома кислорода, мы знаем, что он имеет восемь протонов, и 8-10 нейтронов. И так как все в природе стремится к равновесию, два атома кислорода образуют молекулу, где два непарных электрона образуют ковалентную связь. Подобным же образом образуется другая стойкая молекула кислорода – озон (O 3). Зная строение атома кислорода, можно правильно составлять формулы окислительных реакций, в которых участвует самое распространенное на Земле вещество.
Так как при химических реакциях ядра
реагирующих атомов остаются без изменений
(за исключением радиоактивных превращений),
то химические свойства атомов зависят
от строения их электронных оболочек.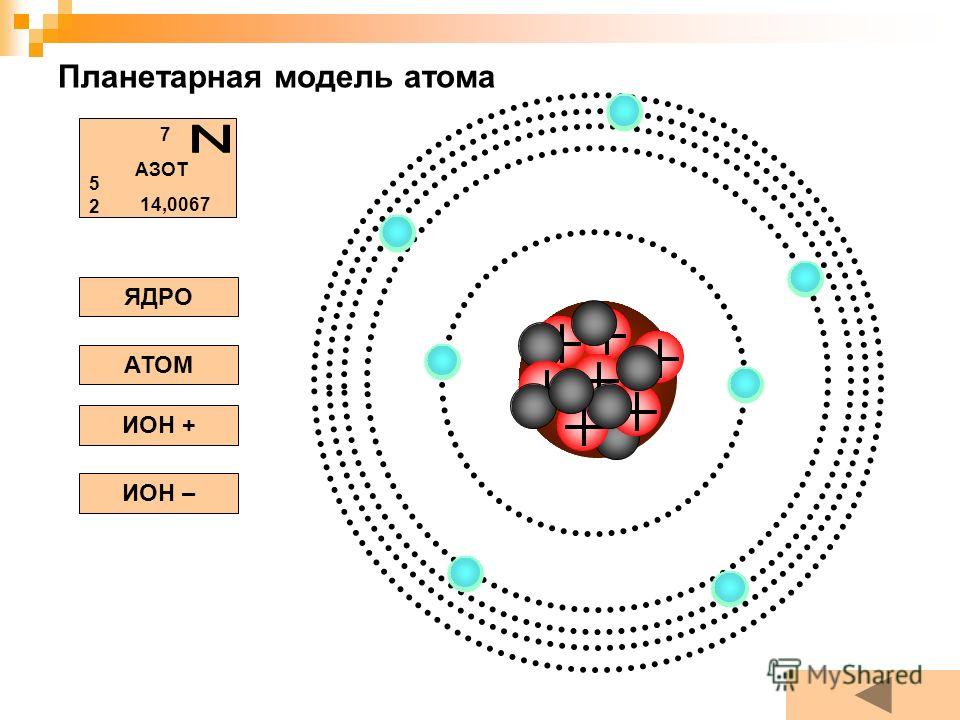 Теория электронного строения атома построена на основе аппарата квантовой
механики. Так, структура энергетических
уровней атома может быть получена на
основе квантовомеханических расчетов
вероятностей нахождения электронов в
пространстве вокруг атомного ядра (рис.
4.5 ).
Теория электронного строения атома построена на основе аппарата квантовой
механики. Так, структура энергетических
уровней атома может быть получена на
основе квантовомеханических расчетов
вероятностей нахождения электронов в
пространстве вокруг атомного ядра (рис.
4.5 ).
Рис. 4.5 . Схема подразделения энергетических уровней на подуровни
Основы теории электронного строения атома сводятся к следующим положениям: состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: главным квантовым числом n = 1, 2, 3, ; орбитальным (азимутальным)l=0,1,2, n–1 ; магнитнымm l = –l, –1,0,1, l ; спиновымm s = -1/2, 1/2 .
Согласно принципу Паули , в одном и
том же атоме не может быть двух электронов,
обладающих одинаковой совокупностью
четырех квантовых чиселn,
l, m l ,
m s ; совокупности электронов с одинаковыми
главными квантовыми числами n образуют
электронные слои, или энергетические
уровни атома, нумеруемые от ядра и
обозначаемые какK,
L, M, N, O, P, Q , причем в энергетическом
слое с данным значениемn могут находиться не более, чем2n 2 электронов. Совокупности электронов с одинаковыми
квантовыми числамиn иl , образуют подуровни, обозначаемые
по мере удаления их от ядра какs,
p, d, f .
Совокупности электронов с одинаковыми
квантовыми числамиn иl , образуют подуровни, обозначаемые
по мере удаления их от ядра какs,
p, d, f .
Вероятностное нахождение положения
электрона в пространстве вокруг атомного
ядра соответствует принципу
неопределенностей Гейзенберга. По
квантовомеханическим представлениям,
электрон в атоме не имеет определенной
траектории движения и может находиться
в любой части пространства вокруг ядра,
а различные его положения рассматриваются
как электронное облако с определенной
плотностью отрицательного заряда.
Пространство вокруг ядра, в котором
наиболее вероятно нахождение электрона,
называется орбиталью . В нем заключено
порядка 90% электронного облака. Каждому
подуровню1s,
2s, 2p и т.д. соответствует определенное
количество орбиталей определенной
формы. Например,1s –
и2s- орбитали
имеют сферическую форму, а2p -орбитали
(2p x ,
2p y ,
2p z -орбитали)
ориентированы во взаимно перпендикулярных
направлениях и имеют форму гантели
(рис.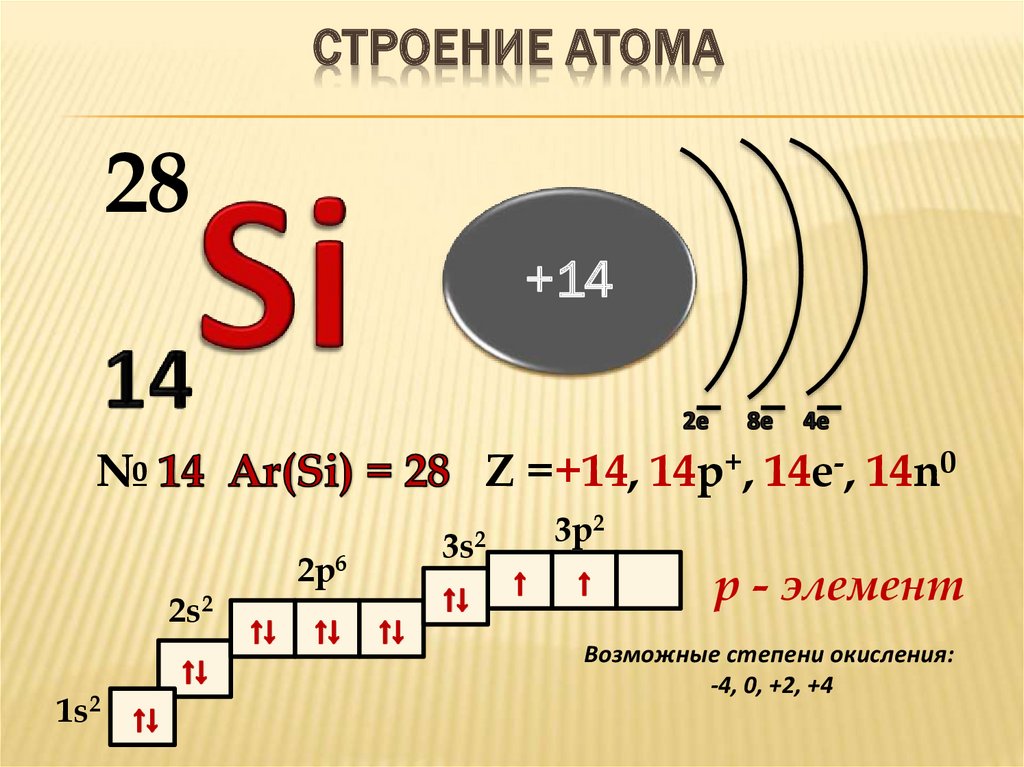 4.6 ).
4.6 ).
Рис. 4.6 . Форма и ориентация электронных орбиталей.
При химических реакциях атомное ядро не претерпевает изменений, изменяются лишь электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. На основе теории электронного строения атома был установлен глубокий физический смысл периодического закона химических элементов Менделеева и создана теория химической связи.
Теоретическое обоснование периодической системы химических элементов включает в себя данные о строении атома, подтверждающие существование связи между периодичностью изменения свойств химических элементов и периодическим повторением сходных типов электронных конфигураций их атомов.
В свете учения о строении атома становится
обоснованным разделение Менделеевым
всех элементов на семь периодов: номер
периода соответствует числу энергетических
уровней атомов, заполняемых электронами.
В малых периодах с ростом положительных
заряда ядер атомов возрастает число
электронов на внешнем уровне (от 1 до 2
в первом периоде, и от 1 до 8 во втором и
третьем периодах), что объясняет изменение
свойств элементов: в начале периода
(кроме первого) находится щелочной
металл, затем наблюдается постепенное
ослабление металлических свойств и
усиление неметаллических.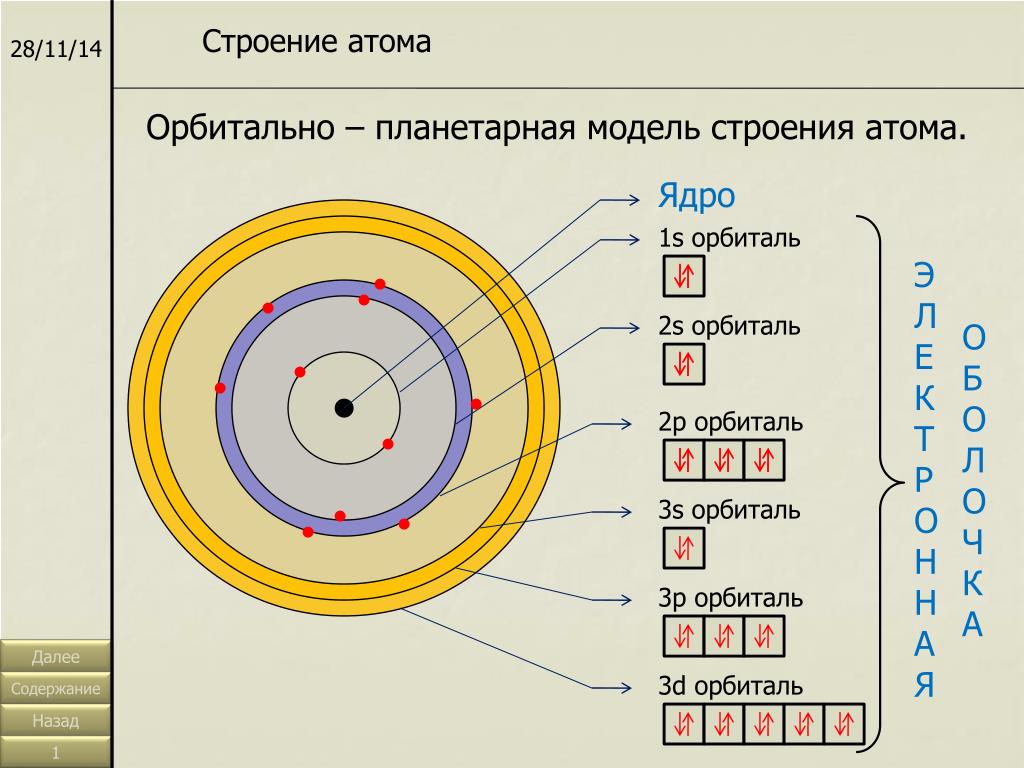 Эта
закономерность прослеживается для
элементов второго периода в таблице
4.2.
Эта
закономерность прослеживается для
элементов второго периода в таблице
4.2.
Таблица 4.2.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что и объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов.
Одинаковый характер свойств химических элементов в подгруппах объясняется сходным строением внешнего энергетического уровня, как это показано в табл. 4.3 , иллюстрирующей последовательность заполнения электронами энергетических уровней для подгрупп щелочных металлов.
Таблица 4.3.
Номер группы, как правило, указывает на
число электронов в атоме, которые могут
участвовать в образовании химических
связей. В этом заключается физический
смысл номера группы. В четырех местах
периодической системы элементы
расположены не в порядке возрастания
атомных масс: Ar иK ,Co иNi ,T e иI ,Th иPa .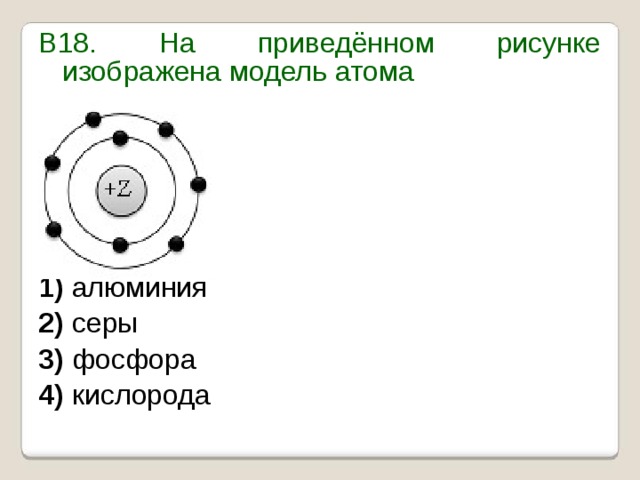 Эти отступления считались
недостатками периодической системы
химических элементов. Учение о строении
атома объяснило указанные отступления.
Опытное определение зарядов ядер
показало, что расположение этих элементов
соответствует возрастанию зарядов их
ядер. Кроме того, опытное определение
зарядов ядер атомов дало возможность
определить число элементов между
водородом и ураном, а также число
лантаноидов. Ныне все места в периодической
системе заполнены в промежутке
отZ=1 доZ=114 ,
однако периодическая система не
закончена, возможно открытие новых
трансурановых элементов.
Эти отступления считались
недостатками периодической системы
химических элементов. Учение о строении
атома объяснило указанные отступления.
Опытное определение зарядов ядер
показало, что расположение этих элементов
соответствует возрастанию зарядов их
ядер. Кроме того, опытное определение
зарядов ядер атомов дало возможность
определить число элементов между
водородом и ураном, а также число
лантаноидов. Ныне все места в периодической
системе заполнены в промежутке
отZ=1 доZ=114 ,
однако периодическая система не
закончена, возможно открытие новых
трансурановых элементов.
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В 1891 г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь». Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с.) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с.) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится . Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра .
Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено приблизительно 90 % электронного облака , и это означает, что около 90 % времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей , которые обозначаются латинскими буквами s, p, d и f . Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром . Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, – 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n 2 ,
где N – максимальное число электронов; n – номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором – не более 8; на третьем – не более 18; на четвертом – не более 32.
Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором – не более 8; на третьем – не более 18; на четвертом – не более 32.
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй – два; третий – три; четвертый – четыре подуровня . Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, p, d, f.
Протоны и нейтроныАтом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной .
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов – протонов и нейтронов .
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus – ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом . Например, массовое число атома алюминия:
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e — .
Поскольку атом электронейтрален , то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
N = A — Z
Например, число нейтронов в атоме железа равно:
56 — 26 = 30
ИзотопыРазновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами .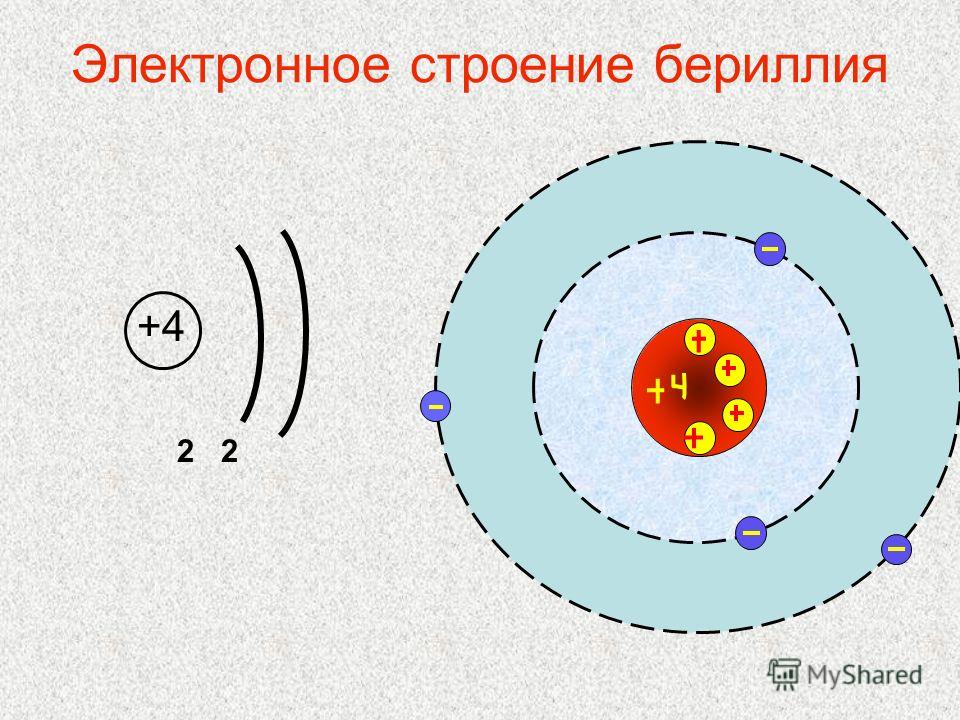 Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород – три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород – три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Схема электронного строения атома водорода:
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен – в нем 2 электрона. Водород и гелий – s-элементы; у этих атомов заполняется электронами s-орбиталь.
У всех элементов второго периода первый электронный слой заполнен , и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен – в нем 8 электронов.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s- электронная орбиталь. Na и Mg – s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar – р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са – s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10:
В атоме цинка третий электронный слой завершен – в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr – р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов.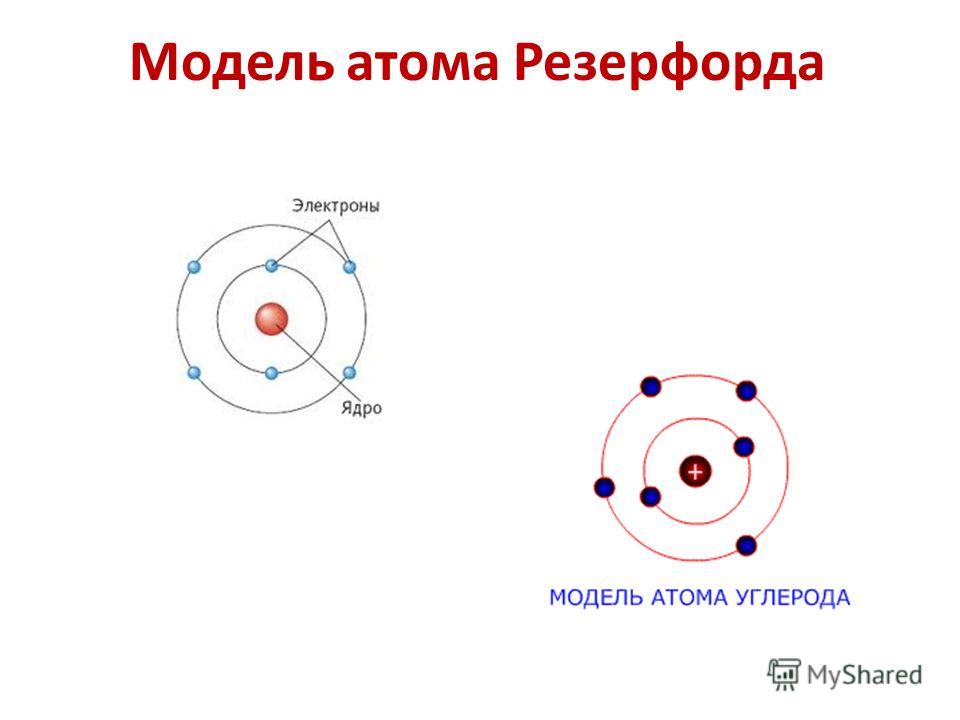 Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.У элементов пятого периода идет заполнение по-дуровней в следующем порядке: 5s — 4d — 5р. И так-же встречаются исключения, связанные с «провалом » электронов, у 41 Nb, 42 Мо, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.У элементов пятого периода идет заполнение по-дуровней в следующем порядке: 5s — 4d — 5р. И так-же встречаются исключения, связанные с «провалом » электронов, у 41 Nb, 42 Мо, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55 Cs и 56 Ва – 6s-элементы; 57 La … 6s 2 5d x – 5d-элемент; 58 Се – 71 Lu – 4f-элементы; 72 Hf — 80 Hg – 5d-элементы; 81 Т1 — 86 Rn – 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т.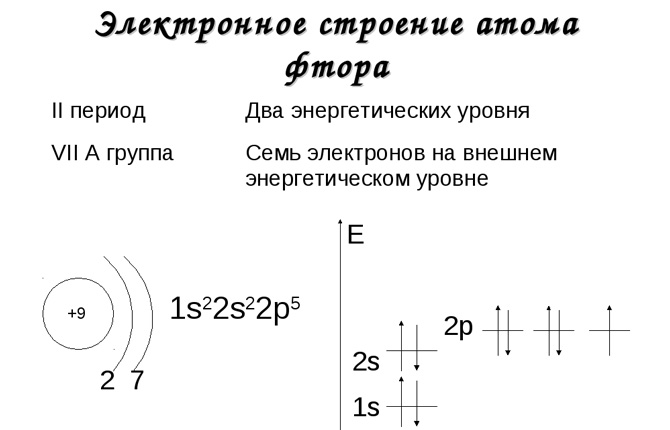 е. nf 7 и nf 14 . В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
е. nf 7 и nf 14 . В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
- s-элементы . Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
- p-элементы . Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
- d-элементы . Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I-VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
- f-элементы . Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского – «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки.
установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского – «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки.
Этот принцип носит название принципа Паули . Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек – записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда , согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда , согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
Правило Хунда и принцип Паули
Правило Хунда – правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.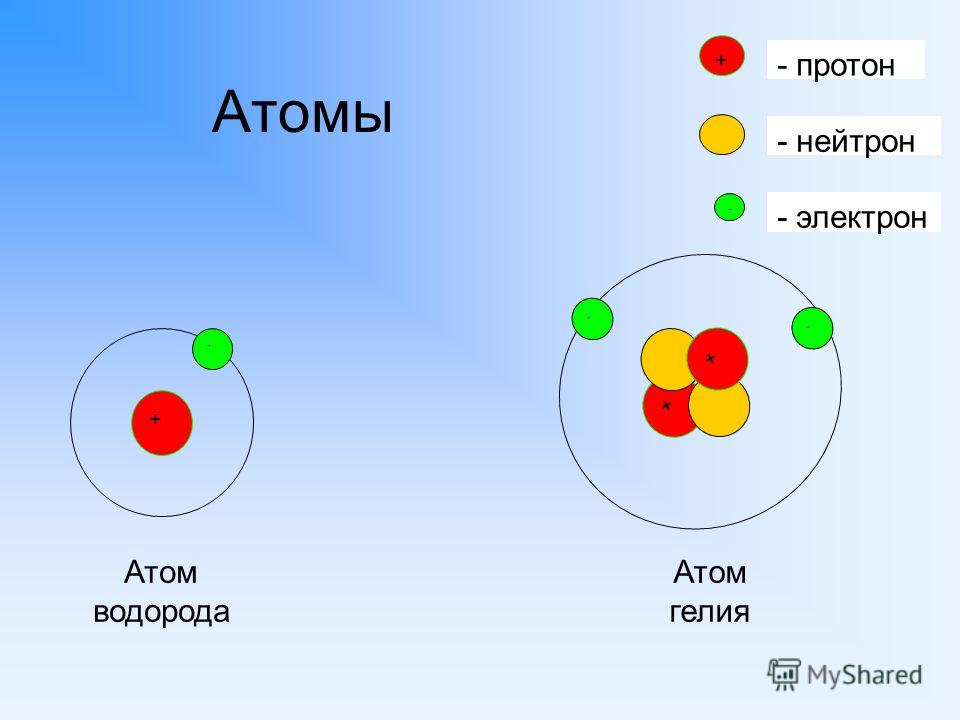
Другая формулировка : Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
- Мультиплетность максимальна
- При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p -элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками – электроны, причём направление стрелки обозначает ориентацию спина).
Правило Клечковского
Правило Клечковского — по мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречатреальной энергетической последовательности атомых орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слояна d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, аименно: после заполнения двумя электронами орбитали 6s
Любое вещество состоит из очень маленьких частиц, называемых атомами . Атом-это наименьшая частица химического элемента, сохраняющая все его характерные свойства. Чтобы представить себе размеры атома, достаточно сказать что если бы их удалось уложить вплотную один к другому, то один миллион атомов занял бы расстояние всего в 0,1 мм.
Дальнейшее развитие науки о строении вещества показало, что атом также имеет сложное строение и состоит из электронов и протонов. Так возникла электронная теория строения вещества.
В глубокой древности было обнаружено, что существуют два рода электричества: положительное и отрицательное.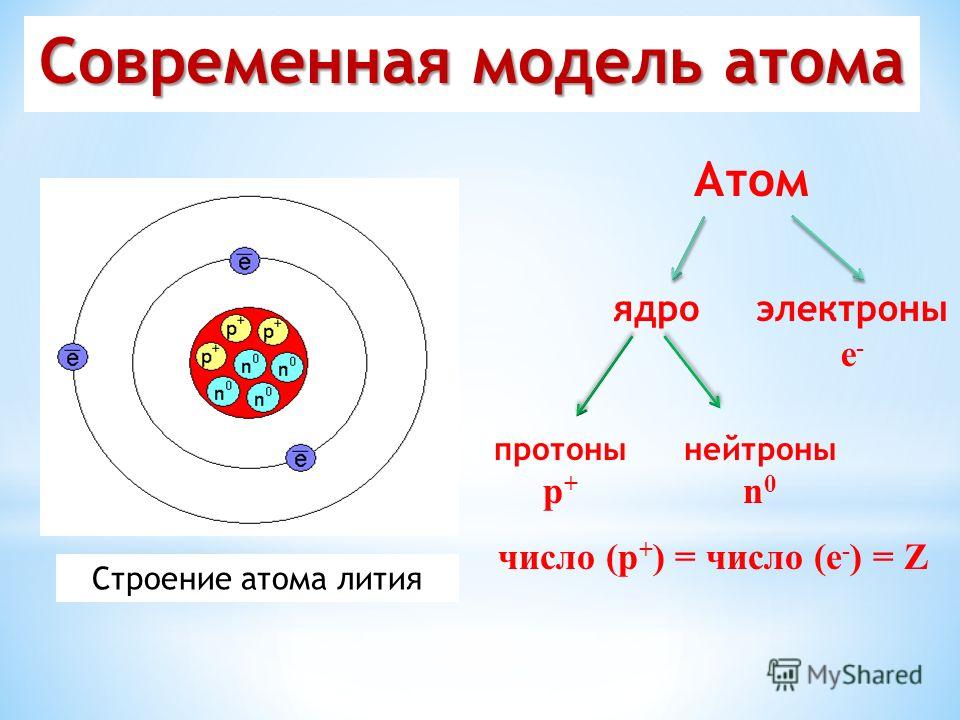 Количество электричества, содержащееся в теле, стали называть зарядом. В зависимости от рода электричества, которым обладает тело, заряд может быть положительным или отрицательным.
Количество электричества, содержащееся в теле, стали называть зарядом. В зависимости от рода электричества, которым обладает тело, заряд может быть положительным или отрицательным.
Было также установлено опытным путем, что одноименные заряды отталкиваются, а разноименные притягиваются.
Рассмотрим электронное строение атома . Атомы состоят из еще более мелких частиц, чем они сами, называемых электронами .
ОПРЕДЕЛЕНИЕ: Электрон – это мельчайшая частица вещества, имеющая наименьший отрицательный электрический заряд.
Электроны вращаются вокруг центрального ядра, состоящего из одного или более протонов и нейтронов , по концентрическим орбитам. Электроны являются отрицательно заряженными частицами, протоны – положительными, а нейтроны – нейтральными (рисунок 1.1).
ОПРЕДЕЛЕНИЕ: Протон – мельчайшая частица вещества, имеющая наименьший положительный электрический заряд.
Существование электронов и протонов не вызывает никакого сомнения. Ученые не только определили массу, заряд и размеры электронов и протонов, но даже заставили их работать в различных электрических и радиотехнических приборах.
Ученые не только определили массу, заряд и размеры электронов и протонов, но даже заставили их работать в различных электрических и радиотехнических приборах.
Было также установлено, что масса электрона зависит от скорости его движения и что электрон не только поступательно движется в пространстве, но и вращается вокруг своей оси.
Наиболее простым по своему строению является атом водорода (рис. 1.1). Он состоит из ядра-протона и вращающегося с огромной скоростью вокруг ядра электрона, образующего внешнюю оболочку (орбиту) атома. Более сложные атомы имеют несколько оболочек, по которым вращаются электроны.
Эти оболочки последовательно от ядра заполняются электронами (рисунок 1.2).
Теперь разберем . Самая внешняя оболочка называется валентной , а число электронов, содержащееся в ней, называется валентностью . Чем дальше находится от ядра валентная оболочка, следовательно, тем меньшую силу притяжения испытывает каждый валентный электрон со стороны ядра.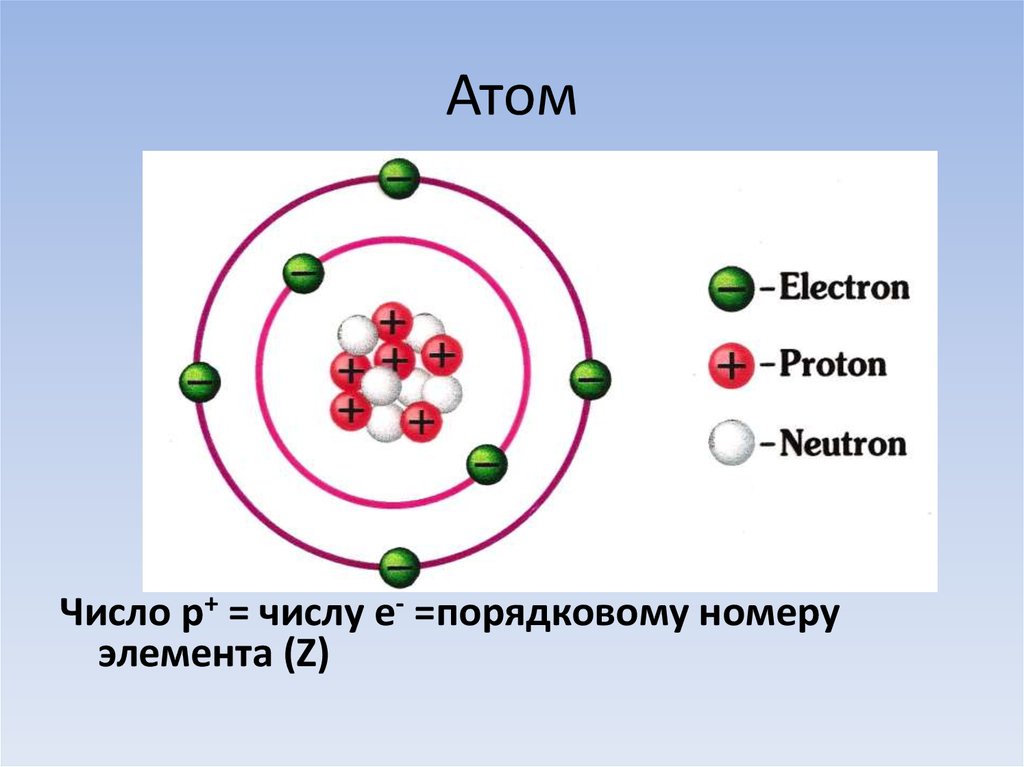 Тем самым у атома увеличивается возможность присоединять к себе электроны в том случае, если валентная оболочка не заполнена и расположена далеко от ядра, либо терять их.
Тем самым у атома увеличивается возможность присоединять к себе электроны в том случае, если валентная оболочка не заполнена и расположена далеко от ядра, либо терять их.
Электроны внешней оболочки могут получать энергию. Если электроны находящиеся в валентной оболочке получат необходимый уровень энергии от внешних сил, они могут оторваться от нее и покинуть атом, то есть стать свободными электронами. Свободные электроны способны произвольно перемещаться от одного атома к атому. Те материалы, в которых содержится большое число свободных электронов, называются проводниками .
Изоляторы , есть противоположность проводникам. Они препятствуют протеканию электрического тока. Изоляторы стабильны потому, что валентные электроны одних атомов заполняют валентные оболочки других атомов, присоединяясь к ним. Это препятствует образованию свободных электронов.
Промежуточное положение между изоляторами и проводниками занимают полупроводники , но о них мы поговорим позже
Рассмотрим свойства атома . Атом, который имеет одинаковое число электронов и протонов, электрически нейтрален. Атом, получающий один или более электронов, становится отрицательно заряженным и имеет название отрицательный ион. Если атом теряет один или более электронов, то он становится положительным ионом, то есть заряжается положительно.
Атом, который имеет одинаковое число электронов и протонов, электрически нейтрален. Атом, получающий один или более электронов, становится отрицательно заряженным и имеет название отрицательный ион. Если атом теряет один или более электронов, то он становится положительным ионом, то есть заряжается положительно.
Записывается в виде так называемых электронных формул. В электронных формулах буквами s, p, d, f обозначаются энергетические подуровни электронов; цифры впереди букв означают энергетический уровень, в котором находится данный электрон, а индекс вверху справа – число электронов на данном подуровне. Чтобы составить электронную формулу атома любого элемента, достаточно знать номер данного элемента в периодической системе и выполнить основные положения, которым подчиняется распределение электронов в атоме.
Структура электронной оболочки атома может быть изображена и в виде схемы размещения электронов по энергетическим ячейкам.
Для атомов железа такая схема имеет следующий вид:
На этой схеме наглядно видно выполнение правила Гунда .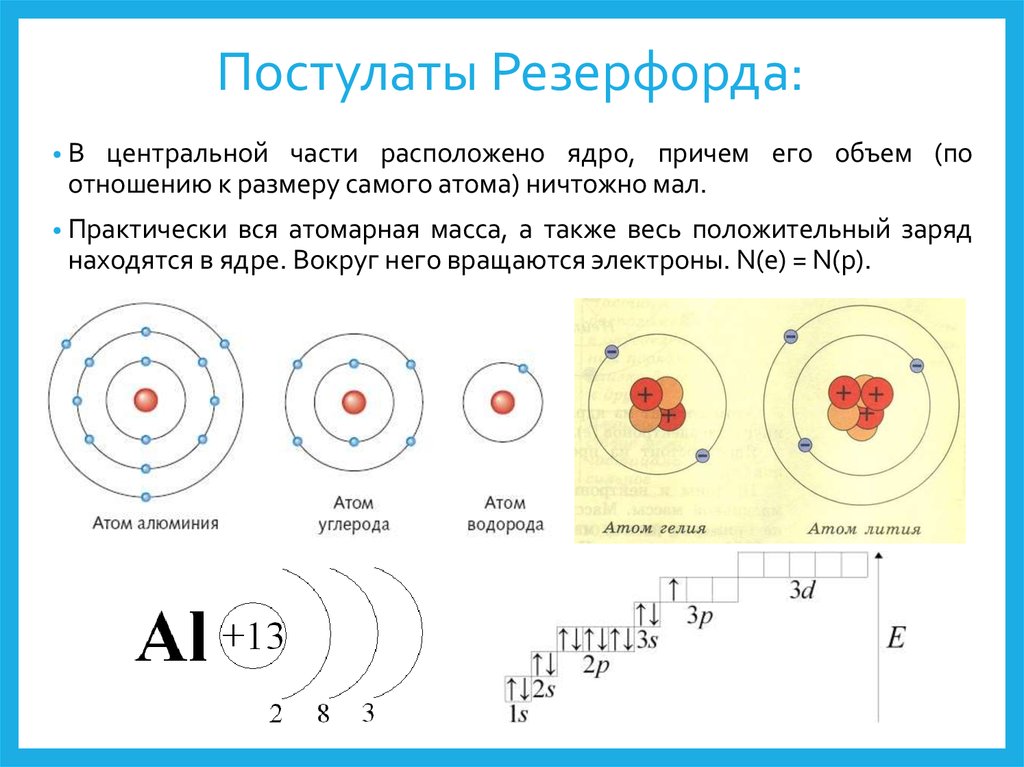 На Зd-подуровне максимальное количество, ячеек (четыре) заполнено неспаренными электронами. Изображение структуры электронной оболочки в атоме в виде электронных формул и в виде схем наглядно не отражает волновых свойств электрона.
На Зd-подуровне максимальное количество, ячеек (четыре) заполнено неспаренными электронами. Изображение структуры электронной оболочки в атоме в виде электронных формул и в виде схем наглядно не отражает волновых свойств электрона.
Формулировка периодического закона в редакции Д.А. Менделеева : свойства простых тел, а так же формы и свойства соединений элементов находятся в периодической зависимости величины атомных весов элементов.
Современная формулировка Периодического закона : свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра их атомов.
Таким образом, положительный заряд ядра (а не атомная масса) оказался более точным аргументом, от которого зависят свойства элементов и их соединений
Валентность – это число химических связей, которым один атом связан с другим.
Валентные возможности атома определяются числом неспаренных электронов и наличием на внешнем уровне свободных атомных орбиталей. Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Стехиометрическая валентность химического элемента– это число эквивалентов, которое может к себе присоединить данный атом, или – число эквивалентов в атоме.
Эквиваленты определяются по числу присоединённых или замещённых атомов водорода , поэтому стехиометрическая валентность равна числу атомов водорода, с которыми взаимодействует данный атом. Но свободно взаимодействуют не все элементы, а с кислородом – практически все, поэтому стехиометрическую валентность можно определить как удвоенное число присоединённых атомов кислорода.
Например, стехиометрическая валентность серы в сероводороде H 2 S равна 2, в оксиде SO 2 – 4 , в оксиде SO 3 -6.
При определении стехиометрической валентности элемента по формуле бинарного соединения следует руководствоваться правилом: суммарная валентность всех атомов одного элемента должна быть равна суммарной валентности всех атомов другого элемента.
Степень окисления также характеризует состав вещества и равна стехиометрической валентности со знаком плюс (для металла или более электроположительного элемента в молекуле) или минус.
1. В простых веществах степень окисления элементов равна нулю.
2. Степень окисления фтора во всех соединениях равна -1. Остальные галогены (хлор, бром, иод) с металлами, водородом и другими более электроположительными элементами тоже имеют степень окисления -1, но в соединениях с более электроотрицательными элементами они имеют положительные значения степеней окисления.
3. Кислород в соединениях имеет степень окисления -2; исключением являются пероксид водорода Н 2 О 2 и его производные (Na 2 O 2 , BaO 2 и т.п., в которых кислород имеет степень окисления -1, а также фторид кислорода OF 2 , степень окисления кислорода в котором равна +2.
4. Щелочные элементы (Li, Na, K и др.) и элементы главной подгруппы второй группы Периодической системы (Be, Mg, Ca и др.) всегда имеют степень окисления, равную номеру группы, то есть +1 и +2, соответственно.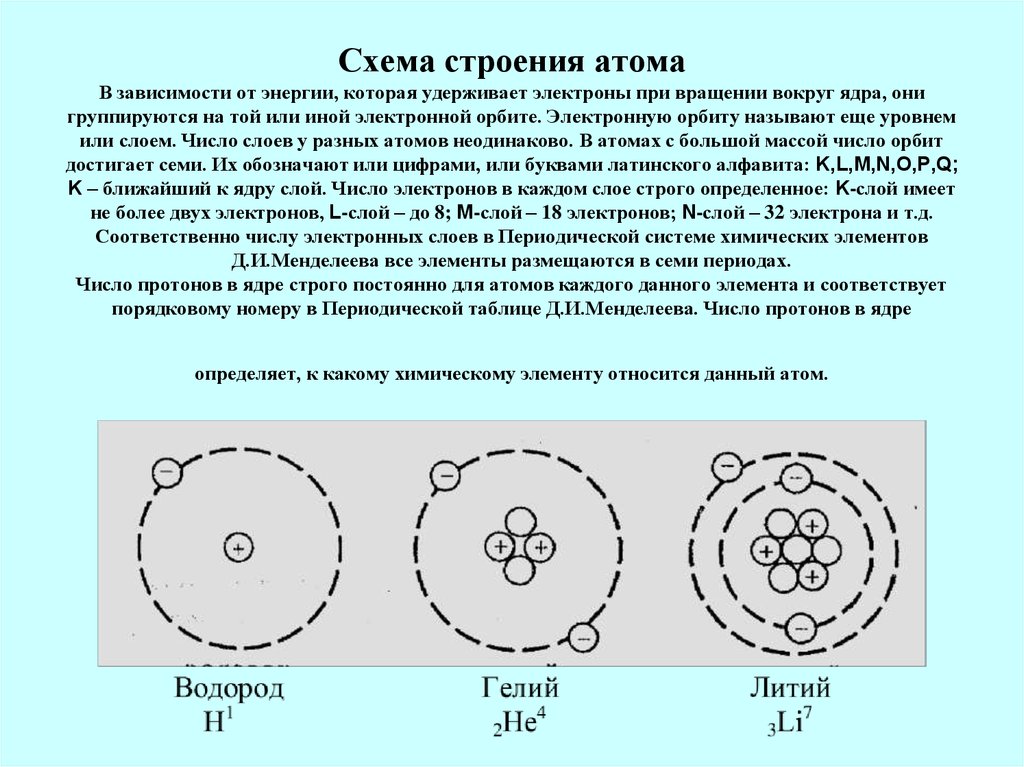
5. Все элементы третьей группы, кроме таллия имеют постоянную степень окисления, равную номеру группы, т.е. +3.
6. Высшая степень окисления элемента равна номеру группы Периодической системы, а низшая – разности: № группы – 8. Например, высшая степень окисления азота (он расположен в пятой группе) равна +5 (в азотной кислоте и её солях), а низшая равна -3 (в аммиаке и солях аммония).
7. Степени окисления элементов в соединении компенсируют друг друга так, что их сумма для всех атомов в молекуле или нейтральной формульной единице равна нулю, а для иона – его заряду.
Эти правила можно использовать для определения неизвестной степени окисления элемента в соединении, если известны степени окисления остальных, и составления формул многоэлементных соединений.
Сте?пень окисле?ния (окислительное число, ) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность . Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов).
Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов).
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома:
Al 3+ + 3e − → Al
S 2− → S + 2e − (S 2− − 2e − → S)
Свойства элементов, зависящие от строения электронной оболочки атома, изменяются по периодам и группам периодической системы. Поскольку в ряду элементов-аналогов электронные структуры лишь сходны, но не тождественны, то при переходе от одного элемента в группе к другому для них наблюдается не простое повторение свойств, а их более или менее отчетливо выраженное закономерное изменение.
Химическая природа элемента обусловлена способностью его атома терять или приобретать электроны. Эта способность количественно оценивается величинами энергий ионизации и сродства к электрону.
Эта способность количественно оценивается величинами энергий ионизации и сродства к электрону.
Энергией ионизации (Eи ) называется минимальное количество энергии, необходимое для отрыва и полного удаления электрона из атома в газовой фазе при T = 0
K без передачи освобожденному электрону кинетической энергии с превращением атома в положительно заряженный ион: Э + Eи = Э+ + e-. Энергия ионизации является положительной величиной и имеет наименьшие значения у атомов щелочных металлов и наибольшие у атомов благородных (инертных) газов.
Сродством к электрону (Ee ) называется энергия, выделяемая или поглощаемая при присоединении электрона атому в газовой фазе при T = 0
K с превращением атома в отрицательно заряженный ион без передачи частице кинетической энергии:
Э + e- = Э- + Ee.
Максимальным сродством к электрону обладают галогены, особенно фтор (Ee = -328 кДж/моль).
Величины Eи и Ee выражают в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ).
Способность связанного атома смещать к себе электроны химических связей, повышая около себя электронную плотность называется электроотрицательностью.
Это понятие в науку введено Л. Полингом . Электроотрицательность обозначается символом ÷ и характеризует стремление данного атома к присоединению электронов при образовании им химической связи.
По Р. Маликену электротрицательность атома оценивается полусуммой энергий ионизации и сродства к электрону свободных атом÷ = (Ee + Eи)/2
В периодах наблюдается общая тенденция роста энергии ионизации и электроотрицательности с ростом заряда ядра атома, в группах эти величины с увеличением порядкового номера элемента убывают.
Следует подчеркнуть, что элементу нельзя приписать постоянное значение электроотрицательности, так как оно зависит от многих факторов, в частности от валентного состояния элемента, типа соединения, в которое он входит, числа и вида атомов-соседей.
Атомные и ионные радиусы . Размеры атомов и ионов определяются размерами электронной оболочки. Согласно квантово-механическим представления электронная оболочка не имеет строго определенных границ. Поэтому за радиус свободного атома или иона можно принять теоретически рассчитанное расстояние от ядра до положения главного максимума плотности внешних электронных облаков. Это расстояние называется орбитальным радиусом. На практике обычно используют значения радиусов атомов и ионов, находящихся в соединениях, вычисленные исходя из экспериментальных данных. При этом различают ковалентные и металлические радиусы атомов.
Размеры атомов и ионов определяются размерами электронной оболочки. Согласно квантово-механическим представления электронная оболочка не имеет строго определенных границ. Поэтому за радиус свободного атома или иона можно принять теоретически рассчитанное расстояние от ядра до положения главного максимума плотности внешних электронных облаков. Это расстояние называется орбитальным радиусом. На практике обычно используют значения радиусов атомов и ионов, находящихся в соединениях, вычисленные исходя из экспериментальных данных. При этом различают ковалентные и металлические радиусы атомов.
Зависимость атомных и ионных радиусов от заряда ядра атома элемента и носит периодический характер . В периодах по мере увеличения атомного номера радиусы имеют тенденцию к уменьшению. Наибольшее уменьшение характерно для элементов малых периодов, поскольку у них заполняется внешний электронный уровень. В больших периодах в семействах d- и f- элементов это изменение менее резкое, так как у них заполнение электронов происходит в предпредвнешнем слое. В подгруппах радиусы атомов и однотипных ионов в общем увеличиваются.
В подгруппах радиусы атомов и однотипных ионов в общем увеличиваются.
Периодическая система элементов есть наглядный пример проявления различного рода периодичности в свойствах элементов, которая соблюдается по горизонтали (в периоде слева направо), по вертикали (в группе, например, сверху вниз), по диагонали, т.е. какое-то свойство атома усиливается или уменьшается, но периодичность сохраняется.
В периоде слева направо (→) увеличиваются окислительные и неметаллические свойства элементов, а восстановительные и металлические свойства уменьшаются. Так, из всех элементов 3 периода натрий будет самым активным металлом и самым сильным восстановителем, а хлор – самым сильным окислителем.
Химическая связь – это взаимное соединение атомов в молекуле, или кристаллической решетке, в результате действия между атомами электрических сил притяжения.
Это взаимодействие всех электронов и всех ядер, приводящих к образованию устойчивой, многоатомной системы (радикал, молекулярный ион, молекула, кристалл).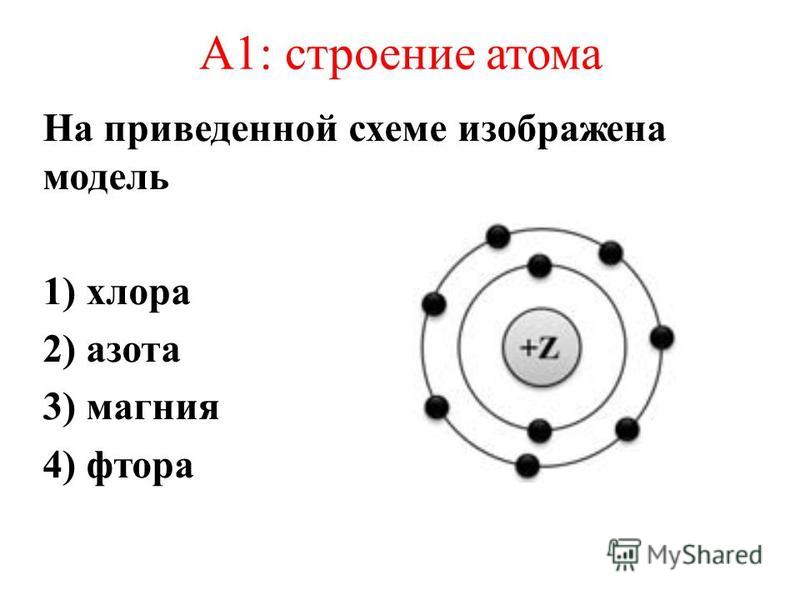
Химическая связь осуществляется валентными электронами. По современным представлениям химическая связь имеет электронную природу, но осуществляется она по-разному. Поэтому различают три основных типа химической связи: ковалентную, ионную, металлическую .Между молекулами возникает водородная связь, и происходят вандерваальсовые взаимодействия .
К основным характеристикам химической связи относятся:
– длина связи – это межъядерное расстояние между химически связанными атомами.
Она зависит от природы взаимодействующих атомов и от кратности связи. С увеличением кратности длина связи уменьшается, а, следовательно, увеличивается ее прочность;
– кратность связи – определяется числом электронных пар, связывающих два атома. С увеличением кратности энергия связи возрастает;
– угол связи – угол между воображаемыми прямыми проходящими через ядра двух химически взаимосвязанных соседних атомов;
Энергия связи Е СВ – это энергия, которая выделяется при образовании данной связи и затрачивается на ее разрыв, кДж/моль.
Ковалентная связь – Химическая связь, образованная путем обобществления пары электронов двумя атомами.
Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС) , открытый Льюисом в 1916 г. Для квантово-механического описания химической связи и строения молекул применяют ещё один метод – метод молекулярных орбиталей (ММО) .
Метод валентных связей
Основные принципы образования химической связи по МВС:
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается.
4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение.
5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Существует два механизма образования ковалентной связи:
Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
Рис. 7. Обменный механизм образования ковалентной связи: а – неполярной; б – полярной
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям
Рис. 8. Донорно-акцепторный механизм образования ковалентной связи
Ковалентная связь имеет определенные характеристики.
Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав.
Благодаря насыщаемости связей молекулы имеют определенный состав.
Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков . Относительно линии соединяющей центры атомов образующих связь различают: σ и π(рис. 9): σ-связь – образована перекрыванием АО по линии соединяющей центры взаимодействующих атомов; π-связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома. Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму. Гибридизация
– это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание. Различают следующие виды гибридизации (рис. 10, табл. |
sp 2 -гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp 2 -гибридизация, имеют плоскую геометрию (BF 3 , AlCl 3).
sp 3 –гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28″. Молекулы, в которых осуществляется sp 3 -гибридизация, имеют тетраэдрическую геометрию (CH 4 , NH 3).
Рис. 10. Виды гибридизаций валентных орбиталей: а – sp -гибридизация валентных орбиталей; б – sp 2 – гибридизация валентных орбиталей; в – sp 3 -гибридиза-ция валентных орбиталей
Основы строения атома для чайников.
 Схемы, теории современного представления об атоме
Схемы, теории современного представления об атомеВсе в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
Планетарная модель
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц – кварков.
Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц – кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие “моль”. 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?
Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами – 126) элементов, не считая изотопов. Но так было далеко не всегда.
Но так было далеко не всегда.
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
Вселенная
Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.
Ядерный взрыв
Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Определение, структура и части с маркированной схемой
Что такое атом
Атомы — это мельчайшие частицы, которые образуют основные строительные блоки всей материи во Вселенной, твердой, жидкой или газообразной. Все живые организмы и неживые объекты на Земле состоят из триллионов и триллионов атомов. Меньшие частицы, из которых состоит атом, известны как субатомные частицы.
Части диаграммы атомаТермин «атом» произошел от греческого слова «атомос», что означает «неделимый». Древнегреческие и индийские философы были первыми, кто считал атом основной единицей всей материи во Вселенной. В начале 19В -м -м веке ученые начали более подробно понимать структуру атома с его внутренними частями. В 1926 году Эрвин Шредингер предложил современную модель атома, которую мы используем до сих пор.
Существует множество различных атомов, каждый из которых имеет свое название, размер, массу и количество субатомных частиц. Они известны как элементы. Таким образом, атом можно определить и как простейшую структурную единицу элемента, сохраняющую все его свойства. На сегодняшний день существует 92 природных элемента и 118 созданных человеком элементов.
На сегодняшний день существует 92 природных элемента и 118 созданных человеком элементов.
Структура с частями
Размер атома крошечный, с диаметром от 0,1 до 0,5 нанометров (от 1 × 10 −10 до 5 × 10 −10 м). Таким образом, их нельзя увидеть невооруженным глазом. Слой атома чем-то похож на лист бумаги.
Атомная структураВсе атомы, кроме водорода, содержат три основные субатомные частицы: 1) электроны, 2) протоны и нейтроны. Электроны и протоны находятся в центре атома в плотной области, называемой ядром. Напротив, электроны находятся вне ядра в области, называемой электронным облаком или электронной оболочкой.
1) Электроны
Отрицательно заряженные частицы, вращающиеся вокруг ядра по фиксированной орбите. В отличие от протонов и нейтронов, электроны — элементарные частицы, значительно меньшие (почти в 1800 раз) по размерам, чем протоны и нейтроны. Стандартный символ, используемый для обозначения электрона, — e или e — . Британский физик Дж.Дж. Томсон открыл его в 1897 году.
Британский физик Дж.Дж. Томсон открыл его в 1897 году.
Электроны движутся вокруг ядра так быстро, что их точное положение внутри атома невозможно определить с точностью. Когда число отрицательно заряженных электронов равно числу положительно заряженных протонов, атом имеет нейтральный заряд.
2) Протоны
Протоны – это положительно заряженные частицы, находящиеся в плотной области в центре атома, называемой ядром. Они были открыты Эрнестом Резерфордом в 1917 году и обозначаются символом p или p + . Протоны состоят из еще более мелких частиц, называемых кварками и глюонами.
Плотно упакованные в ядро, они вместе с нейтронами составляют практически всю массу атома.
3) Нейтроны
Они также находятся внутри ядра вместе с протонами в плотно упакованном виде. Нейтроны, как и протоны, состоят из кварков и глюонов. Они были обнаружены Джеймсом Чедвиком в 19 году.32 и обозначаются символом n или n 0 .
Нейтроны — это нейтральные частицы без заряда, но имеющие значительный размер и массу, подобные протону.
Ниже приведена таблица, показывающая заряд, массу и расположение трех субтомических частиц:
| Наименование частицы | Символ | Относительный заряд | . Атом | |
| 1. Proton | p/p + | +1 | Nucleus | |
| 2. Neutron | n/n 0 | 0 | Nucleus | |
| 3. Electron | E/E – | -1 | Оболочка или орбита |
Другие фундаментальные частицы
- КАРКИ : они являются фундаментальными. Они были независимо обнаружены Мюрреем Гелл-Манном и Джорджем Цвейгом в 1964. Однако их точное положение в атоме невозможно точно измерить. Кварки бывают шести различных типов: верхние, нижние, верхние, нижние, обаятельные и странные.
 Протон содержит три кварка (два верхних кварка и один нижний кварк), а нейтрон содержит (два нижних кварка и один верхний кварк).
Протон содержит три кварка (два верхних кварка и один нижний кварк), а нейтрон содержит (два нижних кварка и один верхний кварк).
- Глюоны : Также обнаруженные в протонах и электронах, они действуют как обменные частицы, которые помогают передавать сильное взаимодействие между кварками. Джон Эллис и его коллеги обнаружили их в 1979.
- Нейтрино : Они похожи на электроны, образующиеся в результате ядерных реакций. Нейтрино не имеет заряда, но движется с очень высокой скоростью, близкой к скорости света, и может пройти сквозь любой твердый объект. Огромная энергия Солнца, получаемая в результате ядерного синтеза, каждую секунду испускает триллионы нейтрино.
Часто задаваемые вопросы
Q1. Сколько атомов во Вселенной?
Ответ . Примерно между 10 9От 0007 78 до 10 82 атомов, присутствующих во Вселенной.
Q2. Как связаны атомы и элементы?
Ответ . Элемент полностью состоит только из атомов одного типа. Другими словами, элемент состоит из нескольких атомов одного типа.
Q3. Чем молекулы отличаются от атомов?
Ответ . Атом — это наименьшая единица элемента, тогда как молекула состоит из двух или более атомов.
Q4. Что происходит, когда атом теряет электрон?
Ответ . Когда атом теряет электрон, он становится положительным ионом.
Ссылки
Последний раз статья была рассмотрена в субботу, 23 октября 2021 г.
Структура атома, объясненная с помощью маркированной схемы
Атом является основной единицей материи. В следующей статье представлены диаграммы, которые помогут вам лучше понять структуру атома.
Атом — это наименьший строительный блок всей материи, состоящий из нейтронов, протонов и электронов. Атомы как основная единица материи были концептуализированы еще в 500 г. до н.э., когда это было предложено греческим философом Левкиппом и его учеником Демокритом. Затем, к сожалению, на следующие 2000 лет эта концепция была утеряна, и люди верили только в четыре элемента: землю, огонь, воздух и воду. Однако сегодня мы все знаем, что атомы выходят. В этой статье мы познакомим вас с базовой структурой атома.
Базовая схема атома
Большая часть атома представляет собой пустое пространство и состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Центром атома является ядро и один или несколько электронов, окружающих ядро. Когда говорят, что атом электрически нейтрален, это означает, что количество электронов равно количеству положительных зарядов на ядре. Это означает, что положительный заряд протонов и отрицательный заряд электронов компенсируют друг друга, в результате чего получается электрически нейтральный атом.
Модель атома на диаграмме ниже показывает протоны и нейтроны, сконцентрированные в атомном ядре, и электроны на окружающих его орбитах. Протоны заряжены положительно, электроны — отрицательно, а нейтроны не несут заряда.
Дж.Дж. Thomson Plum Pudding Model
Первоначально люди не понимали атом, и было проведено множество научных исследований, чтобы понять модель атома. Первый человек, открывший электроны, сэр Дж.Дж. Томпсон выдвинул свою модель атома «Сливовый пудинг». Он считал, что атом представляет собой однородную сферу с положительным зарядом, в которую встроены электроны. Он мог объяснить электрическую нейтральность атома, но не мог объяснить расположение элементарных частиц в атоме.
Модель атома Резерфорда
Позднее Эрнест Резерфорд изучал свойства спонтанно испускаемых частиц радиоактивных веществ. В своем эксперименте по бомбардировке альфа-частицами фольги из атомов золота он обнаружил, что альфа-частицы проходят прямо через золотую фольгу без отклонения. Это показало, что в атоме много пустого пространства.
Это показало, что в атоме много пустого пространства.
Затем он заметил, что некоторые альфа-частицы отклоняются на малые и большие углы. Это доказывало существование в атоме «центра положительного заряда». Этот центр отталкивал положительно заряженные альфа-частицы и отклонял их от первоначального пути. Лишь несколько альфа-частиц отскочили после удара о золотую фольгу, и это доказывает, что ядро очень плотное и твердое.
Таким образом, Резерфорд смог доказать, что ядро положительно заряжено, плотно и твердо. Ядро очень мало по сравнению с размером атома, и вся масса атома сосредоточена в ядре. Этот вывод помог ему предложить «Модель атома Резерфорда».
Согласно его диаграмме атома, в центре атома находится маленькое положительно заряженное ядро. Это ядро несет всю массу атома. Электроны вращаются вокруг ядра с большой скоростью. Число электронов было равно числу протонов и, следовательно, атом электрически нейтрален. Объем ядра считался ничтожным по сравнению с объемом атома. В атоме было много пустого пространства. Резерфорд сравнил свою схему атома с солнечной системой, где ядро подобно солнцу, а электрон вращается вокруг него подобно планетам.
В атоме было много пустого пространства. Резерфорд сравнил свою схему атома с солнечной системой, где ядро подобно солнцу, а электрон вращается вокруг него подобно планетам.
Тем не менее, его модель имела несколько существенных недостатков. Его теория предполагала, что электроны вращаются с большой скоростью вокруг положительно заряженного ядра. Но, согласно электромагнитной теории, это привело бы к непрерывному излучению энергии. Потеря энергии в конечном итоге замедлит скорость электрона, и, в конце концов, электрон упадет на ядро. Однако этого не происходит, и модель Резерфорда не могла объяснить, почему коллапса не происходит.
Модель атома Бора
В 1913 году Нил Бор предложил теорию, объясняющую стабильность атома, когда электроны вращаются вокруг ядра на определенных энергетических уровнях. Каждая орбиталь имела разный радиус, и электроны, вращающиеся по определенной орбите, не излучали энергию. Это происходило даже в том случае, если электрон имел ускоренное движение вокруг ядра. Бор выдвинул несколько постулатов, подтверждающих его схему атома.
Бор выдвинул несколько постулатов, подтверждающих его схему атома.
Постулаты Бора
- Электроны вращаются вокруг ядра. Электростатические силы удерживают электроны на орбите.
- Электрон может находиться только на определенной орбите, и когда он находится на этой конкретной орбите, он не излучает энергию.
- Когда электрон падает из более высокого энергетического состояния в более низкое, только тогда он испускает излучение.
- Радиусы орбиталей квантуются, и каждое энергетическое состояние имеет определенный радиус, пропорциональный h/2n.
- Угловой момент электрона будет mvr = nh/2n, где n — главное квантовое число.
Боровская модель атома смогла объяснить стабильность атома, а также объяснить явление атомных спектров и ионизацию газов.
Джеймс Чедвик и открытие нейтронов
Было много проблем, связанных с вычислением массы ядра, хотя модель Резерфорда могла объяснить проблему рассеяния альфа. Можно было вычислить заряд ядра с помощью экспериментов по рассеянию, но нельзя было найти массу ядра, так как протоны составляли только половину массы ядра. Уильям Дрейпер Харкинс, 19 лет20, предположил, что в ядре могут быть какие-то другие частицы, подобные протонам. Он назвал эту частицу нейтроном, не имеющим заряда. В 1932 году Джеймс Чедвик в своем эксперименте открыл нейтрон. Чедвик бомбардировал элемент бериллий альфа-частицами и обнаружил, что излучение имеет высокую проникающую способность и не подвергается воздействию электрического или магнитного поля. Это показало, что излучение было нейтральным. Эти испускаемые частицы имели ту же массу, что и протоны, и относительная масса такой частицы составляла 1 а.е.м. Абсолютная масса составляла примерно 1,6×10 9 .0007 -24 г. Эти частицы были электрически нейтральны и назывались нейтронами.
Уильям Дрейпер Харкинс, 19 лет20, предположил, что в ядре могут быть какие-то другие частицы, подобные протонам. Он назвал эту частицу нейтроном, не имеющим заряда. В 1932 году Джеймс Чедвик в своем эксперименте открыл нейтрон. Чедвик бомбардировал элемент бериллий альфа-частицами и обнаружил, что излучение имеет высокую проникающую способность и не подвергается воздействию электрического или магнитного поля. Это показало, что излучение было нейтральным. Эти испускаемые частицы имели ту же массу, что и протоны, и относительная масса такой частицы составляла 1 а.е.м. Абсолютная масса составляла примерно 1,6×10 9 .0007 -24 г. Эти частицы были электрически нейтральны и назывались нейтронами.
С открытием протонов, нейтронов и электронов физики смогли составить схему атома. Они могли объяснить, что атом состоит из электронов, нейтронов и протонов. Центром атома является ядро, содержащее протоны и нейтроны. Это делает ядро положительно заряженным. Электроны находятся на разных оболочках или орбитах, вращающихся вокруг ядра. Это помогает определить размер атома.
Это помогает определить размер атома.
Многие ученые усердно работали, чтобы помочь проанализировать мельчайшие из всех веществ и предложить правильную схему атома.
Определение и примеры, диаграмма I StudySmarter
Более 2000 лет назад греческий философ Демокрит высказал следующую знаменитую цитату:
Не существует ничего, кроме атомов и пустого пространства; все остальное мнение.
Отчасти он был прав. Все, от камней и звезд до крови и батареек, состоит из атомов . Но Демокрит считал, что атомы были наименьшими возможными единицами — даже само слово, атом происходит от греческого слова неделимый. Теперь мы знаем лучше, и изучение частиц внутри атома создало поле атомной структуры .
Атомная структура — это расположение субатомных частиц внутри атома. Атом — это наименьшая единица обычной материи внутри элемента.
Атомы содержат три типа субатомных частиц: протоны, нейтроны и электроны.
Протоны
Протоны являются положительно заряженными частицами. Они довольно малы — один протон весит всего около килограмма, но мы склонны измерять их массу по особой шкале, называемой 9.0052 углерод-12 шкала . В этом масштабе атом углерода-12 имеет массу ровно 12, а протон имеет массу приблизительно 1. Позже в этой статье мы рассмотрим, что такое атом углерода-12.
Вы найдете протоны, плотно упакованные вместе в ядре в центре атома. Они очень важны, потому что, зная количество протонов в атоме, вы знаете, где в периодической таблице вы его найдете и частью какого элемента он является.
Нейтроны
Нейтроны являются нейтральными частицами. Они также имеют относительную массу около 1 и находятся вместе с протонами в ядре . Число нейтронов может варьироваться между атомами одного и того же элемента без особого влияния на их химические свойства.
Электроны
Электроны — отрицательные частицы. Если вы думали, что протоны крошечные, вас ждет шок: электроны имеют фактическую массу или относительную массу 1/1840 по шкале углерода-12. Они не встречаются рядом с протонами и нейтронами. Вместо этого электроны проводят время в энергетических уровней , также известных как оболочки , вращающихся вокруг ядра. Энергетические уровни увеличиваются по мере удаления от ядра, и электроны всегда будут стараться находиться на самом низком возможном энергетическом уровне. Взгляните на «Электронные оболочки, подоболочки и орбитали» для получения дополнительной информации.
Количество электронов в атоме определяет его химические свойства и реакцию.
Строение атома. Электроны, показанные синим цветом, вращаются вокруг положительного ядра, которое содержит плотную массу протонов и нейтронов.
istockphoto.com
В таблице ниже приведены относительные заряды, массы и положения внутри атома различных субатомных частиц:
| Частица | Масса | Заряд | Расположение внутри атома | Протон | 1 | +1 | Внутри ядра |
| Нейтрон | 1 | 0 | Электрон | Внутри ядра 4 | 0 | -1 | В оболочках, вращающихся вокруг ядра | |
Хотя атомы могут показаться переполненными всеми их субатомными частицами, на самом деле они в основном представляют собой пустое пространство – оказывается, Демокрит не так уж ошибался!
Нахождение атомной структуры элемента
Это очень хорошо, когда говорят, что у вас есть атом определенного элемента, но как узнать его атомную структуру и точное количество элементарных частиц каждого типа в нем содержится? Здесь на помощь приходит периодическая таблица. Давайте посмотрим на углерод в качестве примера:
Давайте посмотрим на углерод в качестве примера:
Углерод
commons.wikimedia.org
6 → Атомный номер
12 → Массовое число
Атомный номер , Z, дает количество протонов в атоме 900 элемента53 и, следовательно, говорит вам, какой элемент атома53 принадлежит. Массовое число , A, дает объединенное общее количество протонов и нейтронов в атоме . Следовательно, вы можете найти количество нейтронов, вычитая А из Z. В незаряженном атоме количество электронов всегда равно количеству протонов , поэтому также определяется атомным номером. В нашем примере выше этот конкретный атом углерода имеет шесть протонов, шесть электронов и шесть нейтронов.
Атомная структура лития
Lithiumcommons.wikimedia.org
Литий имеет массовое число 7 (с точностью до одного десятичного знака) и атомный номер 3. Это означает, что он имеет:
Это означает, что он имеет:
Три протона.
Четыре нейтрона.
Три электрона.
Атомная структура кислорода
Oxygencommons.wikimedia.org
Кислород имеет массовое число 16 и атомный номер 8. Следовательно, он имеет:
Восемь протонов.
Восемь нейтронов.
Восемь электронов.
Снова взяв наш пример с углеродом, мы можем представить атомные и массовые числа следующим образом:
Проще говоря, массовое число атома можно представить, написав его после названия элемента. Например, углерод-12 имеет массовое число 12,9.0005
Для получения дополнительной информации о субатомных частицах см. «Фундаментальные частицы» и «Изотопы и массовое число».
Что такое ионы и изотопы?
Что произойдет, если атом потеряет электрон? Незаряженные атомы по определению имеют одинаковое количество протонов и электронов. Поскольку электроны являются отрицательными частицами, если атом теряет электрон, он становится положительно заряженным. Он известен как ион .
Поскольку электроны являются отрицательными частицами, если атом теряет электрон, он становится положительно заряженным. Он известен как ион .
Ионы — это атомы, которые либо приобрели, либо потеряли электроны, образуя заряженную частицу.
Ионы обладают различными химическими свойствами из-за их различных электронных конфигураций .
А если бы атом потерял нейтрон? Это не сильно повлияет на его реакцию, потому что нейтроны — нейтральные частицы и не влияют на химические свойства атома. Однако он изменит свою массу. Мы называем эту частицу изотопом .
Изотопы — это атомы одного и того же элемента с разным числом нейтронов.
Поскольку их электронные конфигурации одинаковы, изотопы имеют схожие химические свойства.
Ионы и изотопы более подробно рассмотрены в статье “Ионы и изотопы”.
Что такое относительная атомная масса?
Если вы посмотрите на периодическую таблицу, показанную ниже, вы увидите, что массовые числа редко бывают целыми числами. Это связано с тем, что они учитывают пропорции изотопов, естественно встречающихся в образцах элемента. Например, вы часто встречаете атомы хлора с разной массой. Некоторые из них имеют массовое число 35, а некоторые имеют массовое число 37. Два разных атома являются изотопами друг друга. Средняя масса всех встречающихся в природе изотопов элемента называется 9-й массой элемента.0052 относительная атомная масса.
Это связано с тем, что они учитывают пропорции изотопов, естественно встречающихся в образцах элемента. Например, вы часто встречаете атомы хлора с разной массой. Некоторые из них имеют массовое число 35, а некоторые имеют массовое число 37. Два разных атома являются изотопами друг друга. Средняя масса всех встречающихся в природе изотопов элемента называется 9-й массой элемента.0052 относительная атомная масса.
Относительная атомная масса — это средняя масса атома в элементе по сравнению с 1/12 массы атома углерода-12.
Например, чтобы узнать относительную атомную массу хлора, мы умножаем массу каждого изотопа хлора на его процентное содержание и складываем все вместе. Если в пробе 75% хлора-35 и 25% хлора-37, относительная атомная масса будет (0,75*35) + (0,25*37) = 35,5.
Если вы хотите узнать больше о том, как мы определяем массу и содержание изотопов в образце, см. «Масс-спектрометрия».
Периодическая таблица. Железо показано как пример атомной массы. он имеет атомную массу 55,845. Обратите внимание, что это не целое число. commons.wikimedia.org
Железо показано как пример атомной массы. он имеет атомную массу 55,845. Обратите внимание, что это не целое число. commons.wikimedia.org
Как устроены электроны в атоме?
Электроны находятся в оболочках , вращающихся вокруг ядра, которые также известны как энергетических уровня . Оболочки содержат подоболочки и орбитали . Конфигурация электронов придает каждому элементу свои химические свойства . Электроны заполняют орбитали в соответствии с определенными правилами, такими как заполнение сначала оболочек самого низкого энергетического уровня, чтобы достичь минимально возможного энергетического состояния . Хотя правила заполнения могут показаться довольно сложными, это логическая система. Мы не будем сейчас вдаваться в подробности, но следующая таблица дает краткий обзор различных подоболочек и количества орбиталей и электронов, которые они могут удерживать:
| Подоболочка | Количество орбиталей | Maximum number of electrons |
| S | 1 | 2 |
| P | 3 | 6 |
| D | 5 | 10 |
For more information on electron filling и оболочки см. «Электронная конфигурация».
«Электронная конфигурация».
Как со временем менялись представления об атоме?
Древние греки были одними из первых, кто поверил в существование атомов, но, как мы теперь знаем, они лишь частично были правы относительно их природы. Представления об атоме менялись на протяжении всей истории благодаря новым научным открытиям, и некоторые особенно влиятельные ученые включают:0005
- Демокрит.
- Джон Далтон.
- Дж. Дж. Томпсон.
- Эрнест Резерфорд.
Демокрит
Как вы знаете, Демокрит считал, что атомы были наименьшими возможными частицами и поэтому были неделимыми . Он также считал, что атомы неразрушимы и постоянно находятся в движении.
Джон Дальтон
Дальтон, физик и химик, родившийся в 1766 году, также предположил, что атома не могут быть расщеплены . Далее он расширил идею, предполагая, что все атомы в элементе идентичны , а атомы разных элементов имеют разные массы.
JJ Thompson
Томпсон, родившийся в 1856 году, обнаружил, что атома содержат субатомные частицы , которые мы теперь знаем как электроны. Он предположил, что отрицательно заряженные электроны беспорядочно разбросаны по положительному атому, как сливы в сливовом пудинге.
Эрнест Резерфорд
Между 1908 и 1924 Резерфорд и его команда провели серию экспериментов. Они стреляли положительно заряженными частицами в чрезвычайно тонкий лист сусального золота. Благодаря своим наблюдениям они обнаружили множество вещей.
Во-первых, они обнаружили, что большая часть частиц проходит прямо через сусальное золото. Это означало, что атом в основном был пустым пространством.
Во-вторых, они увидели, что некоторые частицы отражались золотым листом . Так как одинаковые заряды отталкиваются друг от друга, это означало, что было крошечная, плотно заряженная положительная масса в центре атома. Резерфорд назвал это ядром. Он предположил, что положительные частицы в атоме ограничены его центром, а отрицательные электроны находятся в кольцах, вращающихся вокруг ядра.
Резерфорд назвал это ядром. Он предположил, что положительные частицы в атоме ограничены его центром, а отрицательные электроны находятся в кольцах, вращающихся вокруг ядра.
Структура атома – основные выводы
- Атомы состоят из протонов, нейтронов и электронов.
- Массовое число элемента указывает общее количество протонов и нейтронов, тогда как атомный номер указывает количество протонов.
- Протоны и нейтроны находятся в ядре атома, тогда как электроны находятся в оболочках, вращающихся вокруг ядра.
- Электроны заполняют оболочки в соответствии с правилами, чтобы достичь минимально возможного энергетического состояния.
- Представления об атоме со временем менялись в связи с новыми научными открытиями.
Управление атомами по одному с помощью электронного луча | MIT News
Высшей степенью контроля в инженерии будет способность создавать материалы и манипулировать ими на самом базовом уровне, создавая устройства атом за атомом с точным контролем.
Теперь ученые из Массачусетского технологического института, Венского университета и нескольких других институтов сделали шаг в этом направлении, разработав метод, который может перемещать атомы с помощью остро сфокусированного электронного луча и контролировать их точное местоположение и ориентацию связи. Открытие может в конечном итоге привести к новым способам создания квантовых вычислительных устройств или датчиков и открыть новую эру «атомной инженерии», говорят они.
Достижение описано сегодня в журнале Science Advances , в статье профессора ядерной науки и техники Массачусетского технологического института Джу Ли, аспиранта Конга Су, профессора Тома Суси из Венского университета и 13 других сотрудников Массачусетского технологического института, Венского университета, Окриджской национальной лаборатории и Китая, Эквадор и Дания.
«Мы используем множество инструментов нанотехнологий, — объясняет Ли, занимающий совместную должность в области материаловедения и инженерии. Но в новом исследовании эти инструменты используются для управления процессами, которые еще на порядок меньше. «Цель состоит в том, чтобы контролировать от одного до нескольких сотен атомов, контролировать их положение, контролировать их состояние заряда и контролировать их электронные и ядерные спиновые состояния», — говорит он.
Но в новом исследовании эти инструменты используются для управления процессами, которые еще на порядок меньше. «Цель состоит в том, чтобы контролировать от одного до нескольких сотен атомов, контролировать их положение, контролировать их состояние заряда и контролировать их электронные и ядерные спиновые состояния», — говорит он.
В то время как другие ранее манипулировали положением отдельных атомов, даже создавая аккуратный круг атомов на поверхности, этот процесс включал захват отдельных атомов на игольчатом наконечнике сканирующего туннельного микроскопа, а затем опускание их в нужное положение. относительно медленный механический процесс. Новый процесс манипулирует атомами с помощью релятивистского электронного луча в сканирующем просвечивающем электронном микроскопе (STEM), поэтому он может полностью контролироваться электронным способом с помощью магнитных линз и не требует механических движущихся частей. Это делает процесс потенциально намного быстрее и, следовательно, может привести к практическим применениям.
Используя электронное управление и искусственный интеллект, «мы думаем, что в конечном итоге сможем манипулировать атомами в микросекундном масштабе», — говорит Ли. «Это на много порядков быстрее, чем мы можем манипулировать ими сейчас с помощью механических зондов. Кроме того, должна быть возможность одновременного воздействия множества электронных лучей на один и тот же кусок материала».
«Это захватывающая новая парадигма манипулирования атомами, — говорит Сьюзи.
Компьютерные чипы обычно изготавливаются путем «легирования» кристалла кремния другими атомами, необходимыми для придания определенных электрических свойств, что приводит к созданию «дефектов» в материале — областей, которые не сохраняют идеально упорядоченную кристаллическую структуру кремния. Но этот процесс носит разрозненный характер, объясняет Ли, поэтому невозможно с атомарной точностью контролировать, куда попадают эти легирующие атомы. По его словам, новая система обеспечивает точное позиционирование.
Один и тот же электронный луч можно использовать для выбивания атома как из одного положения, так и в другое, а затем «считывать» новое положение, чтобы убедиться, что атом оказался там, где должен был, говорит Ли. Хотя позиционирование в основном определяется вероятностями и не является точным на 100%, способность определять фактическое положение позволяет выбирать только те, которые оказались в правильной конфигурации.
Атомный футбол
Мощность очень узко сфокусированного электронного луча, шириной примерно с атом, выбивает атом из его положения, и, выбирая точный угол луча, исследователи могут определить, где он находится. скорее всего закончится. «Мы хотим использовать луч, чтобы выбивать атомы и, по сути, играть в атомный футбол», — говорит он, направляя атомы по графеновому полю в их предполагаемую «целевую» позицию.
«Как и в футболе, это не детерминировано, но вы можете контролировать вероятности», — говорит он. «Как и в футболе, вы всегда пытаетесь двигаться к цели».
В экспериментах команда в основном использовала атомы фосфора, обычно используемую присадку, в листе графена, двумерном листе атомов углерода, расположенных в виде сот. Атомы фосфора в конечном итоге заменяют атомы углерода в частях этой структуры, тем самым изменяя электронные, оптические и другие свойства материала способами, которые можно предсказать, если известны положения этих атомов.
В конечном счете, цель состоит в том, чтобы перемещать несколько атомов сложным образом. «Мы надеемся использовать электронный луч для перемещения этих примесей, чтобы мы могли построить пирамиду или какой-то комплекс дефектов, где мы могли бы точно указать, где находится каждый атом», — говорит Ли.
Впервые в графене манипулировали электронно-различными атомами легирующей примеси. «Хотя мы и раньше работали с примесями кремния, фосфор потенциально более интересен своими электрическими и магнитными свойствами, но, как мы теперь обнаружили, также ведет себя совершенно по-другому. Каждый элемент может таить в себе новые сюрпризы и возможности», — добавляет Сьюзи.
Каждый элемент может таить в себе новые сюрпризы и возможности», — добавляет Сьюзи.
Система требует точного управления углом и энергией луча. «Иногда мы получаем нежелательные результаты, если не проявляем осторожности», — говорит он. Например, иногда атом углерода, который должен был оставаться на месте, «просто уходит», а иногда атом фосфора фиксируется на месте в решетке, и «тогда, как бы мы ни меняли угол луча, мы не можем повлиять на его положение. Мы должны найти другой мяч».
Теоретическая основа
В дополнение к подробному экспериментальному тестированию и наблюдению эффектов различных углов и положений лучей и графена, команда также разработала теоретическую основу для прогнозирования эффектов, называемую первичным формализмом пространства. который отслеживает импульс «футбольного мяча». «Мы провели эти эксперименты, а также предоставили теоретическую основу того, как контролировать этот процесс», — говорит Ли.
Каскад эффектов, возникающих в результате начального луча, происходит в течение нескольких временных масштабов, говорит Ли, что затрудняет проведение наблюдений и анализа. Фактическое начальное столкновение релятивистского электрона (движущегося со скоростью около 45 процентов скорости света) с атомом происходит в масштабе зептосекунд — триллионных долей миллиардной доли секунды, — но результирующее движение и столкновения атомов в решетке разворачивается во временных масштабах пикосекунд или дольше — в миллиарды раз дольше.
Фактическое начальное столкновение релятивистского электрона (движущегося со скоростью около 45 процентов скорости света) с атомом происходит в масштабе зептосекунд — триллионных долей миллиардной доли секунды, — но результирующее движение и столкновения атомов в решетке разворачивается во временных масштабах пикосекунд или дольше — в миллиарды раз дольше.
Атомы примеси, такие как фосфор, имеют ненулевой ядерный спин, что является ключевым свойством, необходимым для квантовых устройств, поскольку на это спиновое состояние легко влияют элементы окружающей среды, такие как магнитные поля. Таким образом, способность точно размещать эти атомы с точки зрения положения и связи может стать ключевым шагом на пути к разработке квантовых устройств обработки информации или датчиков, говорит Ли.
«Это важное достижение в этой области», — говорит Алекс Зеттл, профессор физики Калифорнийского университета в Беркли, не участвовавший в этом исследовании. «Примесные атомы и дефекты в кристаллической решетке лежат в основе электронной промышленности. По мере того, как твердотельные устройства становятся меньше, вплоть до нанометрового размера, становится все более важным точно знать, где находится отдельный примесный атом или дефект и каково его атомное окружение. Чрезвычайно сложной задачей является создание масштабируемого метода контролируемого манипулирования отдельными атомами или их размещения в нужных местах, а также точного прогнозирования того, какое влияние это размещение окажет на производительность устройства».
По мере того, как твердотельные устройства становятся меньше, вплоть до нанометрового размера, становится все более важным точно знать, где находится отдельный примесный атом или дефект и каково его атомное окружение. Чрезвычайно сложной задачей является создание масштабируемого метода контролируемого манипулирования отдельными атомами или их размещения в нужных местах, а также точного прогнозирования того, какое влияние это размещение окажет на производительность устройства».
Зеттл говорит, что эти исследователи «добились значительного прогресса в достижении этой цели. Они используют сфокусированный электронный пучок умеренной энергии, чтобы вызвать желаемую перегруппировку атомов, и наблюдают в реальном времени на атомном уровне за тем, что они делают. Элегантный теоретический трактат с впечатляющей предсказательной силой дополняет эксперименты».
Помимо ведущей команды Массачусетского технологического института, в международном сотрудничестве приняли участие исследователи из Венского университета, Университета Китайской академии наук, Орхусского университета в Дании, Национальной политехнической школы в Эквадоре, Национальной лаборатории Ок-Ридж и Сычуаньского университета в Китае. Работа была поддержана Национальным научным фондом, Исследовательским бюро армии США через Институт солдатских нанотехнологий Массачусетского технологического института, Австрийским научным фондом, Европейским исследовательским советом, Датским советом по независимым исследованиям, Китайской академией наук и Министерством науки и техники США. Энергия.
Работа была поддержана Национальным научным фондом, Исследовательским бюро армии США через Институт солдатских нанотехнологий Массачусетского технологического института, Австрийским научным фондом, Европейским исследовательским советом, Датским советом по независимым исследованиям, Китайской академией наук и Министерством науки и техники США. Энергия.
Рисование атомов – путаница Монтессори
В этом году я основывал свое введение в основы химии для своих учеников средней школы на периодической таблице элементов. Однако первый шаг — научить их рисовать базовые модели атомов.
Я начал с того, что во время зимних каникул учащиеся запомнили первые 20 элементов (от H до Ca) в правильном порядке — по атомному номеру.
Схема атома кислорода. Чтобы было немного контекста, я пробежался по основным частям атома (протоны, нейтроны и электроны) и дал понять, что название элемента определяется исключительно количеством протонов. Я даже попросил их нарисовать несколько атомов с протонами и нейтронами в центре и электронами в оболочках. Поскольку я вывалил на них все это за один урок, это, вероятно, было слишком, но, поскольку это было просто для того, чтобы дать им некоторый контекст, я не ожидал, что семиклассники, которые не видели этого раньше, запомнят. все это; для восьмиклассников это должен был быть просто обзор.
Поскольку я вывалил на них все это за один урок, это, вероятно, было слишком, но, поскольку это было просто для того, чтобы дать им некоторый контекст, я не ожидал, что семиклассники, которые не видели этого раньше, запомнят. все это; для восьмиклассников это должен был быть просто обзор.
Большинство учащихся хорошо справились с запоминанием. Некоторые нашли в Интернете песни, которые помогли, а другие просто пробились. Две недели зимних каникул, чтобы поработать над этим, вероятно, тоже помогли.
Когда мы вернулись в школу, я первым делом дал им схему верхней части периодической таблицы и попросил заполнить ее названиями элементов.
Шаблон для первых 20 элементов таблицы Менделеева. (pdf)После того, как они заполнили свой шаблон таблицы Менделеева, я более подробно изучил части атомов и попросил их попрактиковаться. Ключевые моменты, которые я хотел, чтобы они запомнили, были следующими:
- Атомный номер записывается в виде нижнего индекса слева от символа элемента.

Атомный номер — это число протонов. Поскольку они запомнили элементы по порядку, они должны быть в состоянии понять это самостоятельно, но они также могут быстро найти это в периодической таблице или посмотреть на символ элемента, где атомный номер иногда пишется в нижней части. оставил.
- Атомы имеют такое же количество электронов, как и протоны. Протоны заряжены положительно, а электроны отрицательно заряжены, поэтому атом должен иметь одинаковое количество и того, и другого, чтобы его заряд был сбалансирован. Мы не будем говорить об ионах, где больше или меньше электронов, пока позже.
- Атомная масса (4) записывается в виде надстрочного индекса слева от символа элемента. Атомная масса представляет собой сумму числа протонов (2) и числа нейтронов (2).
Маленькие атомы, которые мы рассматриваем под номером , как правило, имеют такое же количество нейтронов, как и протоны, но это не обязательно так. Так как же узнать, сколько нейтронов? Вы должны спросить, или посмотреть на число атомной массы, которое обычно пишется слева вверху от атома.
 С атомная масса это сумма количества протонов и нейтронов, если вы знаете атомную массу и количество протонов, вы можете легко вычислить количество нейтронов. (Обратите внимание, что электроны не вносят вклад в массу атома, потому что их массы намного меньше, чем массы нейтронов и протонов.
С атомная масса это сумма количества протонов и нейтронов, если вы знаете атомную массу и количество протонов, вы можете легко вычислить количество нейтронов. (Обратите внимание, что электроны не вносят вклад в массу атома, потому что их массы намного меньше, чем массы нейтронов и протонов. - Этот атом кислорода имеет 8 электронов на двух оболочках.
Электронные оболочки : Электроны вращаются вокруг ядра в виде ряда оболочек. Каждая оболочка может содержать определенное максимальное количество электронов (2 для первой оболочки, 8 для второй оболочки и 8 для третьей). И чтобы нарисовать атомы, вы сначала заполняете внутренние оболочки, а затем переходите к внешним оболочкам.
Итак, если я напишу на доске только символ элемента и его атомную массу, ученики смогут вычислить количество частиц.
Пример: Углерод-12
Например, наиболее распространенная форма (изотоп) углерода-12 записывается как:
- Протоны = 6 : Поскольку мы знаем атомный номер 6 (потому что мы запомнили его ), атом имеет 6 протонов.

- Нейтронов = 6 : Поскольку атомная масса равна 12 (вверху слева от символа элемента), чтобы найти количество нейтронов, мы вычитаем количество протонов (12 – 6 = 6).
- Электроны = 6 : Этот атом сбалансирован по заряду, поэтому ему нужно шесть электронов с их отрицательными зарядами, чтобы компенсировать шесть положительных зарядов шести протонов. (Примечание: мы еще не говорили о несбалансированных заряженных атомах, но заряд будет отображаться в виде надстрочного индекса справа от символа.)
- Электронные оболочки (2-4) : У нас есть шесть электронов, поэтому первые два идут на заполнение первой электронной оболочки, а остальные могут идти на вторую оболочку, которая может содержать до 8 электронов. Это дает электронную конфигурацию 2-4.
Пример: Углерод-14
Углерод-14 — это радиоактивный изотоп углерода, который часто используется для радиоуглеродного датирования исторических артефактов. Это записывается как:
Это записывается как:
- Протоны = 6 : Пока это углерод, у него шесть протонов.
- Электронов = 6 : Этот атом также сбалансирован по заряду, поэтому ему также нужно шесть электронов.
- Нейтронов = 8 : При атомной массе 14, когда мы вычитаем шесть протонов, число нейтронов должно быть 8 (14 – 6 = 8).
Единственная разница между углеродом-12 и углеродом-14 заключается в том, что у последнего на два нейтрона больше. Следовательно, это два изотопа углерода.
Схема атома углерода-14.Пример: гелий-4
Схема атома гелия-4.Пример: Натрий-23
Схема атома натрия-23.Примечание. Изображение атома водорода можно найти здесь.
Обновление: я создал интерактивное приложение, которое будет рисовать атомы (первых 20 элементов), чтобы использовать их вместе с рабочим листом для студенческой практики.
Автор Lensyl UrbanoОпубликовано Рубрики Химия, Мир природыМетки атомы, атомы и молекулы, изотопы, субатомные частицыконцепция диаграммы атома молибдена роялти бесплатно векторное изображение
концепция диаграммы атома молибдена роялти бесплатно векторное изображениеЛицензияПодробнее
Стандарт Вы можете использовать вектор в личных и коммерческих целях. Расширенный Вы можете использовать вектор на предметах для перепродажи и печати по требованию.Тип лицензии определяет, как вы можете использовать этот образ.
| Станд. | Расшир. | |
|---|---|---|
| Печатная / редакционная | ||
| Графический дизайн | ||
| Веб-дизайн | ||
| Социальные сети | ||
| Редактировать и изменять | ||
| Многопользовательский | ||
| Предметы перепродажи | ||
| Печать по требованию |
Способы покупкиСравнить
Плата за изображение € 14,99 Кредиты € 3,00 Подписка € 0,69 Оплатить стандартные лицензии можно тремя способами. Цены евро евро .
Цены евро евро .
| Оплата с помощью | Цена изображения |
|---|---|
| Плата за изображение € 14,99 Одноразовый платеж | |
| Предоплаченные кредиты € 3 Загружайте изображения по запросу (1 кредит = 1 евро). Минимальная покупка 30р. | |
| План подписки От 0,69 € Выберите месячный план. Неиспользованные загрузки автоматически переносятся на следующий месяц. | |
Способы покупкиСравнить
Плата за изображение € 39,99 Кредиты € 30,00Существует два способа оплаты расширенных лицензий. Цены евро евро .
| Оплата с помощью | Стоимость изображения |
|---|---|
Плата за изображение € 39,99 Оплата разовая, регистрация не требуется. | |

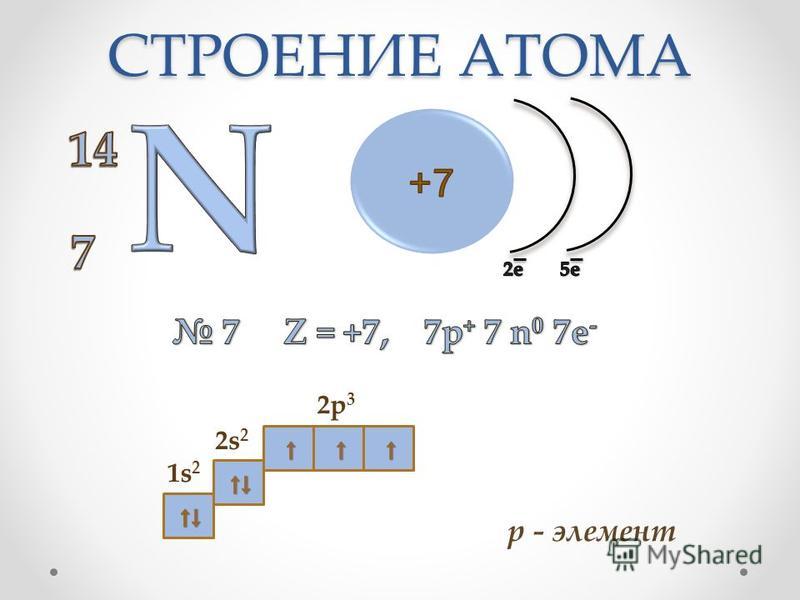 С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.

 – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37–38)
– М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37–38)