Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.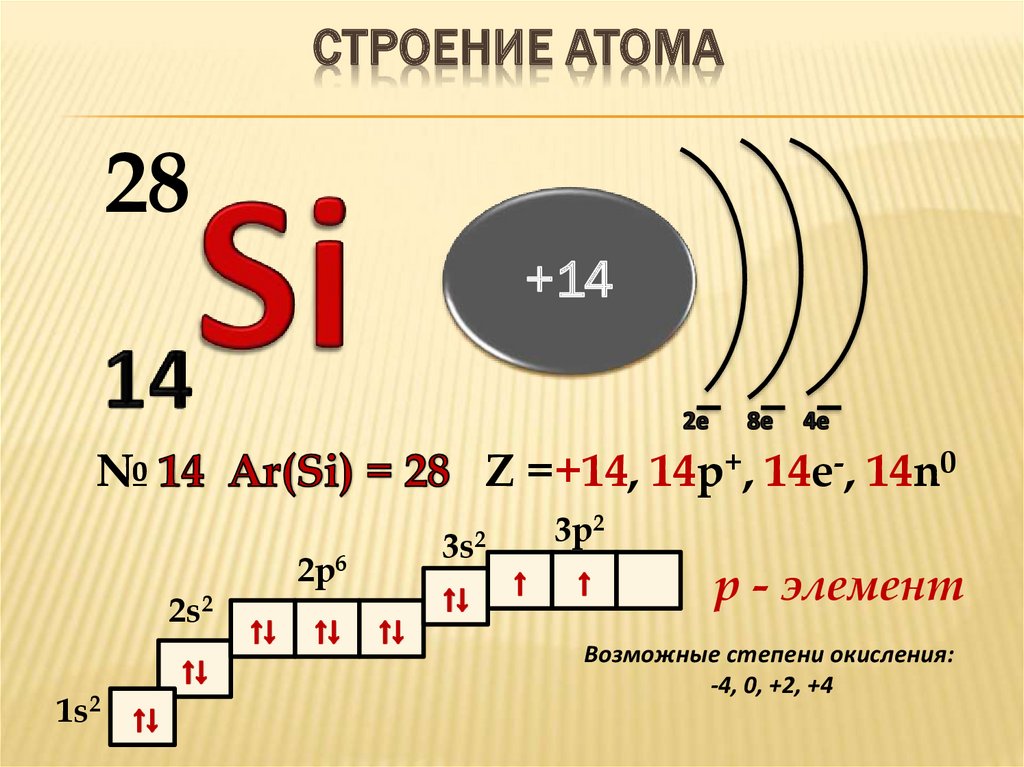
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10. 806
806
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87. 62
62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.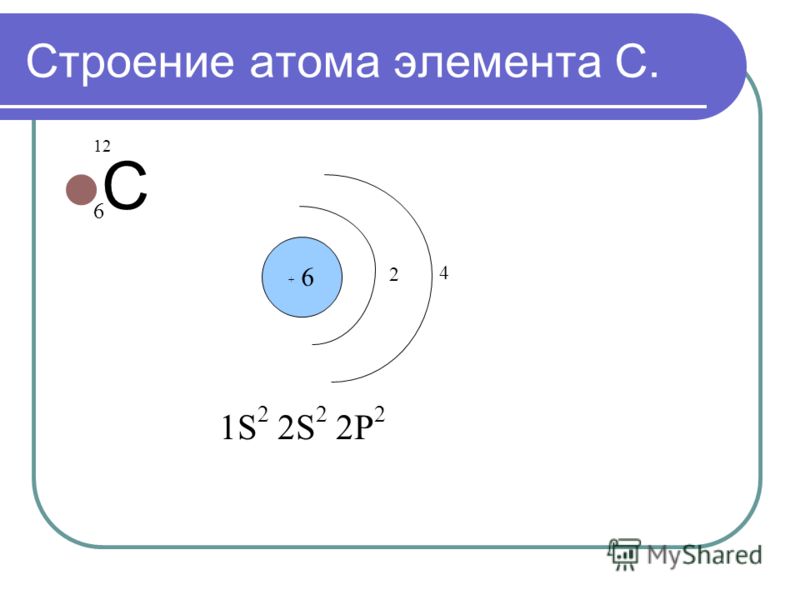 ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Бром, атомарная структура – Стоковая фотография – C018/3716
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3716
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Бром (Br). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома брома-80 (атомный номер: 35), изотопа этого элемента. Ядро состоит из 35 протонов (красный) и 45 нейтронов (оранжевый). 35 электронов (белые) последовательно занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Бром представляет собой галоген в группе 17, периоде 4 и р-блоке периодической таблицы. В элементарной форме это красно-коричневая коррозионно-токсичная жидкость (Br2), кипящая при 59градусов Цельсия. Его основное применение в огнезащитных смесях.
Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома брома-80 (атомный номер: 35), изотопа этого элемента. Ядро состоит из 35 протонов (красный) и 45 нейтронов (оранжевый). 35 электронов (белые) последовательно занимают доступные электронные оболочки (кольца). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Бром представляет собой галоген в группе 17, периоде 4 и р-блоке периодической таблицы. В элементарной форме это красно-коричневая коррозионно-токсичная жидкость (Br2), кипящая при 59градусов Цельсия. Его основное применение в огнезащитных смесях.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 4p
- 4п5
- 4с
- 4с2
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- черный фон
- бр
- бром
- бром-80
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 17
- галоген
- галогены
- иллюстрация
- изотоп
- уровень
- уровней
- жидкость
- жидкости
- нейтрон
- нейтрон номер
- нейтронов
- неметаллический
- неметаллический
- неметаллы
- неметалл
- неметаллический
- неметаллы
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбитали
- р блок
- р-блок
- период 4
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочки
- символ
- валентная орбиталь
- волновая функция
Чертеж, несколько соединений и подробное объяснение – Lambda Geeks
Бром Точечная структура Льюиса показывает, что бром представляет собой двухатомную молекулу с формулой Br 2 .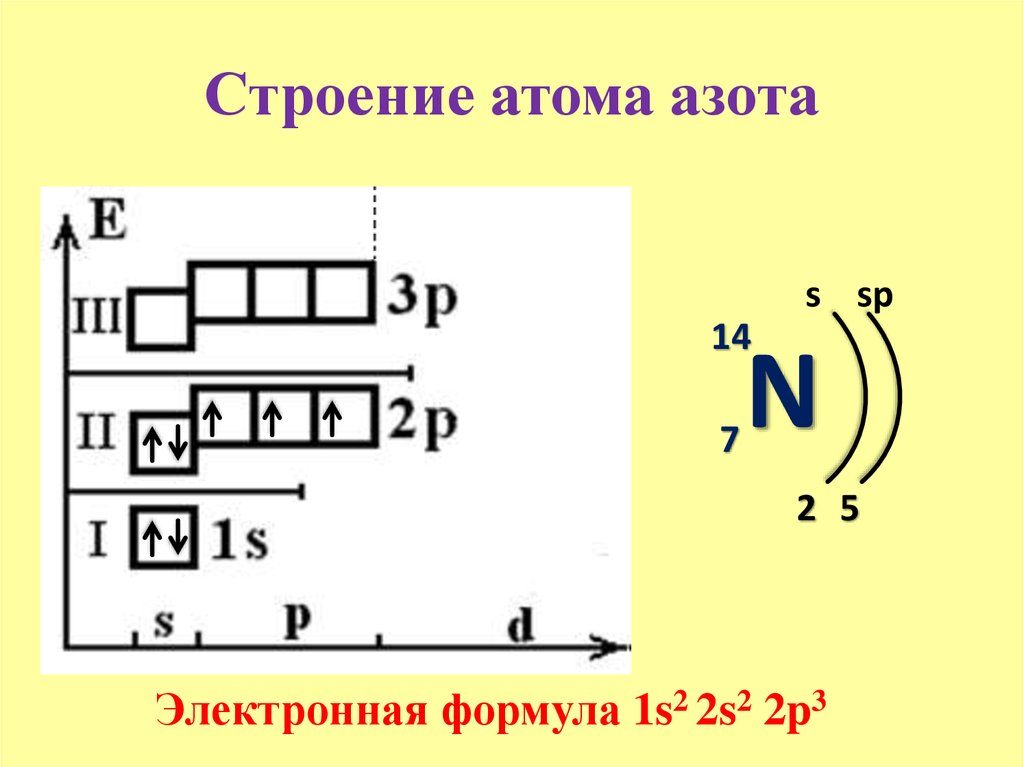 В этой статье объясняется структура точки Льюиса брома с самим собой и другими элементами, а также ее визуальное представление
В этой статье объясняется структура точки Льюиса брома с самим собой и другими элементами, а также ее визуальное представление
Бром принадлежит к группе 17 периодической таблицы. Таким образом, в его валентной оболочке всего 7 электронов. Чтобы достичь ближайшей конфигурации благородного газа, ему нужен всего 1 электрон. Таким образом, бром делит свой 1 электрон с 1 электроном другого атома брома, тем самым образуя одинарную ковалентную связь Br-Br. Поскольку между атомами брома существует одинарная связь, каждый бром будет иметь 3 неподеленные пары электронов вокруг себя.
Обсуждая свойства брома, он является неметаллом и относится к семейству галогенов. Это летучая красно-коричневая жидкость при комнатной температуре с резким и резким запахом. Его периодические свойства занимают промежуточное положение между хлором и йодом. Бром также имеет два стабильных изотопа 79 Br и 81 Br. Оба они являются единственными природными изотопами брома.
С точки зрения распространения и производства, в отличие от других галогенных аналогов, его изобилие наблюдается в океанах из-за длительного выщелачивания. В промышленных масштабах его производят путем реакции обмена галогенов и транспортируют в больших металлических бочках в нужные места. Лабораторное производство брома не требуется, поскольку он легко доступен в продаже, удобен в хранении и имеет длительный срок годности.
Бром широко используется в органическом синтезе и играет биологическую роль, но очень токсичен и должен использоваться химиком с осторожностью в лабораторных условиях. Он может вызвать химические ожоги, а его вдыхание поражает дыхательные пути. Хроническое воздействие также может привести к бронхиальной инфекции и смерти.
Для достижения стабильности октета бром может реагировать с другими элементами и может образовывать различные структуры точек Льюиса. Вот некоторые из них:
Бром Точечная структура Льюиса (бромид-ион) Бром (атомный номер = 35 и электронная конфигурация = 2,8,18,7) принадлежит к 17 группе периодической таблицы. Таким образом, у него есть 7 валентных электронов, которые участвуют в образовании химической связи. Таким образом, для достижения стабильности октета ему необходимо получить 1 электрон. Теперь с 8 электронами в валентной оболочке это уже не атом брома, а ион брома, который представлен отрицательным знаком. Знак минус означает присоединение 1 электрона и образование аниона.
Таким образом, у него есть 7 валентных электронов, которые участвуют в образовании химической связи. Таким образом, для достижения стабильности октета ему необходимо получить 1 электрон. Теперь с 8 электронами в валентной оболочке это уже не атом брома, а ион брома, который представлен отрицательным знаком. Знак минус означает присоединение 1 электрона и образование аниона.
Бром Точечная структура Льюиса с водородом приводит к образованию бромистого водорода (HBr). Водород (атомный номер = 1 и электронная конфигурация = 1) принадлежит к группе 1 st периодической таблицы и состоит из 1 электрона. Точно так же бром принадлежит к группе 17 и содержит 7 электронов на своей валентной оболочке. Им обоим нужен 1 электрон, чтобы достичь ближайшей конфигурации благородного газа. Таким образом, они поделятся своим 1 электроном, чтобы сформировать одинарную ковалентную связь, ведущую к молекуле H-Br. Кроме того, на атоме брома в молекуле HBr имеется 3 неподеленные пары электронов.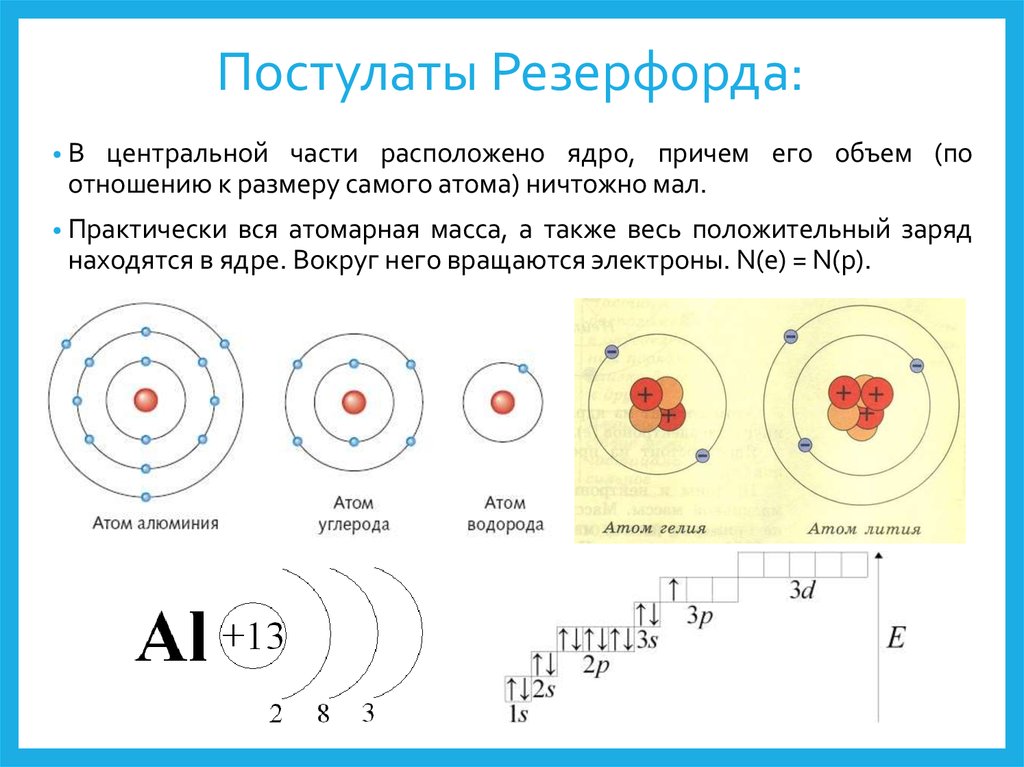
Литий (атомный номер = 3 и электронная конфигурация = 2,1) принадлежит к группе 1 st таблицы Менделеева с 1 электроном на валентной оболочке. Точно так же бром принадлежит к 17 -й -й группе периодической таблицы с 7 электронами в его валентной оболочке. Литий, будучи щелочным металлом, потеряет 1 электрон, чтобы достичь ближайшей конфигурации благородного газа гелия. Таким образом, он станет ионом Li + . С другой стороны, бром, будучи электроотрицательным элементом, получит этот 1 электрон, чтобы приобрести стабильность октета, и в результате получится Br _ ион. Это приведет к образованию ионного соединения бромида лития (LiBr). Связь между литием и бромом будет электровалентной.
Бром Точечная структура Льюиса с углеродом Углерод (атомный номер = 6 и электронная конфигурация = 2,4) принадлежит к группе 14 таблицы Менделеева и имеет 4 электрона на своей валентной оболочке.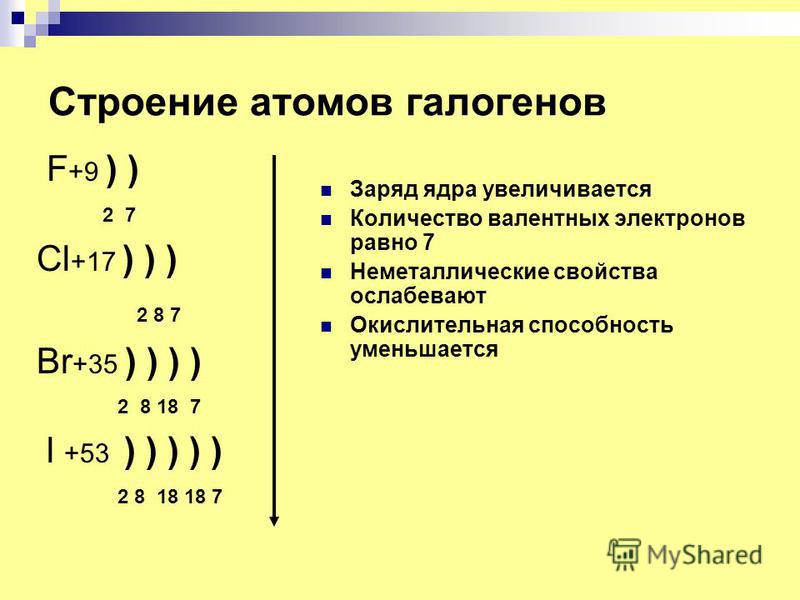 С другой стороны, бром принадлежит к группе 17 и состоит из 7 валентных электронов. Чтобы выполнить стабильность октета, углерод образует одинарную ковалентную связь с 4 атомами брома. Углерод, будучи менее электроотрицательным, будет центральным атомом, окруженным 4 атомами брома. Здесь углерод разделит свои 4 электрона с 1 электроном каждого атома брома, тем самым образуя тетрабромид углерода (CBr 4 ).
С другой стороны, бром принадлежит к группе 17 и состоит из 7 валентных электронов. Чтобы выполнить стабильность октета, углерод образует одинарную ковалентную связь с 4 атомами брома. Углерод, будучи менее электроотрицательным, будет центральным атомом, окруженным 4 атомами брома. Здесь углерод разделит свои 4 электрона с 1 электроном каждого атома брома, тем самым образуя тетрабромид углерода (CBr 4 ).
Алюминий (атомный номер = 13 и электронная конфигурация = 2,8,3) принадлежит к 13 группе периодической таблицы и имеет 3 электрона на валентной оболочке. Бром принадлежит к 17 группе и имеет 7 электронов на валентной оболочке. Алюминий, будучи наименее электроотрицательным, будет центральным атомом, окруженным 3 атомами брома.
Таким образом, 3 валентных электрона алюминия будут делиться с 1 электроном каждого атома брома, образуя между ними одинарную ковалентную связь. Это сформирует стабильную структуру Льюиса AlBr 3 . Еще одним примечательным моментом в этой структуре является то, что бром может достигать стабильности октета, но алюминий не образует никакого октета. У него 6 электронов на валентной оболочке, и он стабилен. Таким образом, AlBr 3 является исключением из критериев стабильности правил октетов.
Еще одним примечательным моментом в этой структуре является то, что бром может достигать стабильности октета, но алюминий не образует никакого октета. У него 6 электронов на валентной оболочке, и он стабилен. Таким образом, AlBr 3 является исключением из критериев стабильности правил октетов.
Сера (атомный номер = 16 и электронная конфигурация = 2,8,6) принадлежит к группе 16 таблицы Менделеева, и газ имеет 6 электронов на своей валентной оболочке. С другой стороны, бром принадлежит к группе 17 и имеет 7 электронов на своей валентной оболочке. Таким образом, для образования структуры Льюиса сера будет центральным атомом, окруженным двумя концевыми атомами брома. Для достижения критерия стабильности октета сера будет делиться своими 2 валентными электронами с 1 валентным электроном каждого атома брома. Между серой и бромом будет образовываться одинарная ковалентная связь, в результате чего образуется дибромид серы (SBr 2 ) молекула.
Калий (атомный номер = 19 и электронная конфигурация = 2,8,8,1) относится к группе 1 периодической таблицы с 1 валентным электроном. Бром, как упоминалось выше несколько раз, принадлежит к группе 17 с 7 электронами в его валентной оболочке. Калий, будучи щелочным металлом, отдаст свой 1 валентный электрон, который будет получен более электроотрицательным атомом брома. Это будет соответствовать критериям стабильности и приведет к образованию катиона калия и бромид-аниона. Кроме того, это приведет к образованию электровалентного или ионного соединения бромида калия (KBr).
Бром Точечная структура Льюиса с кальцием Кальций (атомный номер = 20 и электронная конфигурация = 2,8,8,2) принадлежат к группе 2 периодической таблицы и состоят из 2 валентных электронов. Аналогично бром принадлежит к группе 17 и имеет 7 валентных электронов. Для достижения стабильности кальций, являющийся щелочноземельным металлом, отдает по 1 валентному электрону 2 атомам брома.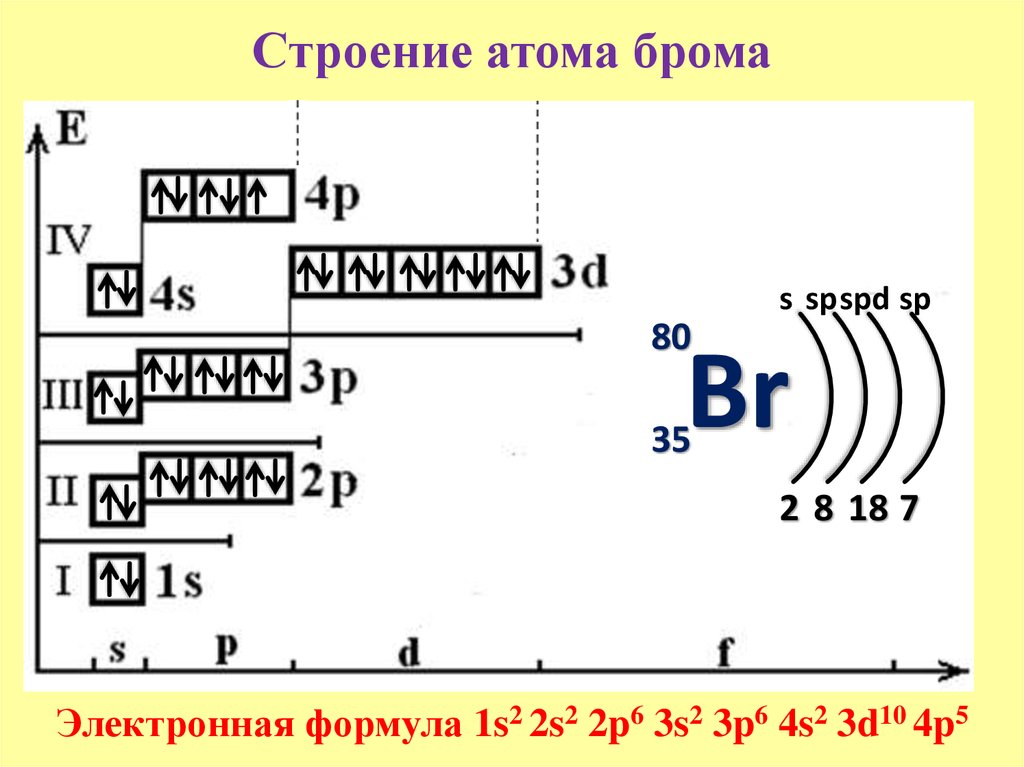 Таким образом, кальций, будучи металлом, получит +2 заряда, а электроотрицательные атомы брома и неметаллы получат -1 заряд каждый. Это приведет к образованию электровалентной связи между атомами кальция и брома и образованию ионного соединения CaBr 2 .
Таким образом, кальций, будучи металлом, получит +2 заряда, а электроотрицательные атомы брома и неметаллы получат -1 заряд каждый. Это приведет к образованию электровалентной связи между атомами кальция и брома и образованию ионного соединения CaBr 2 .
Молекулы с нечетным числом электронов являются исключением из правила октетов. Обычно это соединения, образованные из бора и алюминия. Обычно они образуют соединения с шестью валентными электронами. Помимо нечетного числа валентных электронов существует много других критериев, например, когда валентных электронов очень мало или когда валентных электронов слишком много
Какова официальная плата? Его можно определить как заряд конкретного атома в молекуле, когда все его электроны распределены поровну.
