Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Строение атома . 100 миллиардов солнц [Рождение, жизнь и смерть звезд]
Все, что нас окружает, горные породы и минералы, вещества в атмосфере и в морях, клетки растений и животных, газовые туманности и звезды во Вселенной во всем их многообразии все это состоит из 92 элементарных кирпичиков, химических элементов. Этот факт был установлен наукой девятнадцатого столетия, которая тем самым сильно упростила картину окружающего нас мира. Ученые нашего века в свою очередь показали, что существует всего три типа элементарных частиц, из которых построены атомы этих 92 элементов: протоны, нейтроны и электроны. Так, например, атомы гелия отличаются от атомов углерода только тем, что они состоят из разного количества этих элементарных частиц (рис. 3.1).
Ученые нашего века в свою очередь показали, что существует всего три типа элементарных частиц, из которых построены атомы этих 92 элементов: протоны, нейтроны и электроны. Так, например, атомы гелия отличаются от атомов углерода только тем, что они состоят из разного количества этих элементарных частиц (рис. 3.1).
Рис. 3.1. Схема строения атомов водорода, гелия и углерода. Протоны изображены красными шариками, нейтроны — серыми. Траектории электронов (показаны светло-серыми шариками), обращающихся вокруг ядер, изображены в другом масштабе. Шесть электронов, обращающихся вокруг ядра углерода, не показаны.
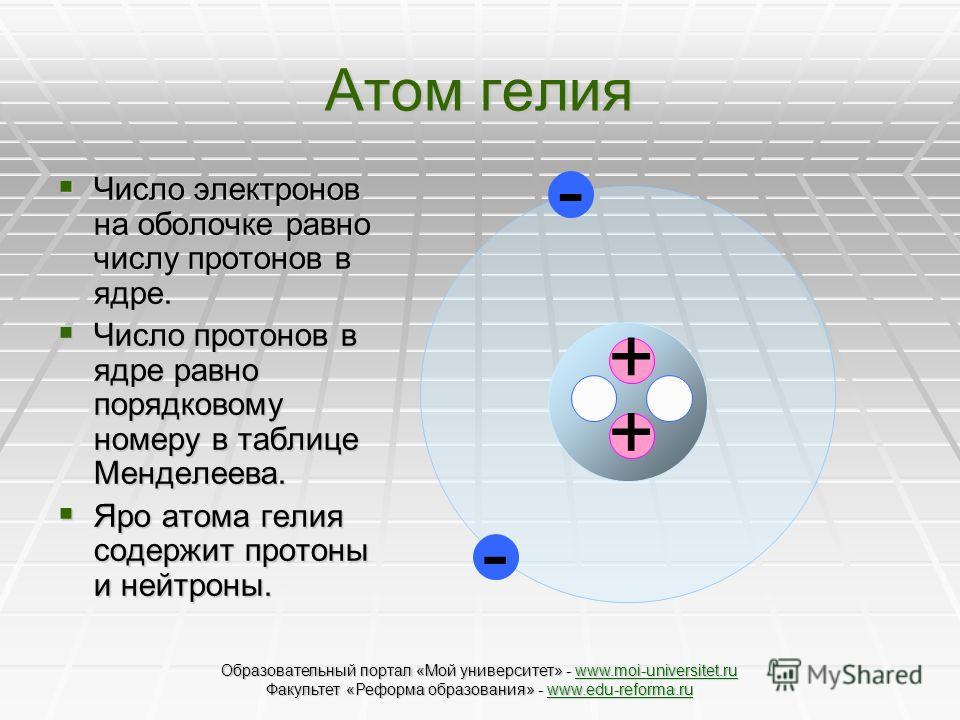
Атом гелия состоит из ядра, которое содержит два протона и два нейтрона. Протон-это положительно заряженная частица. Поэтому ядро атома гелия тоже заряжено положительно. Вокруг него стремительно вращаются две отрицательно заряженные легкие частицы, два электрона. Они образуют электронную оболочку атома гелия. Атомы углерода обладают более сложной структурой.
Протон и нейтрон имеют почти одинаковые массы. Их называют тяжелыми частицами, хотя по сравнению с обычными предметами, которые нас окружают, эти «тяжелые» частицы почти ничего не весят. Если бы мы могли положить на чашу весов триллион таких тяжелых частиц, то они весили бы всего одну триллионную долю грамма. Масса электрона еще в две тысячи раз меньше массы протона. Протон заряжен положительно, электрон — отрицательно. При этом заряды электронов и протонов в точности равны друг другу. Образованный из протона и электрона атом водорода электрически нейтрален. Нейтрон не имеет электрического заряда. Существует также элементарная частица с массой, равной массе электрона, и положительным электрическим зарядом: 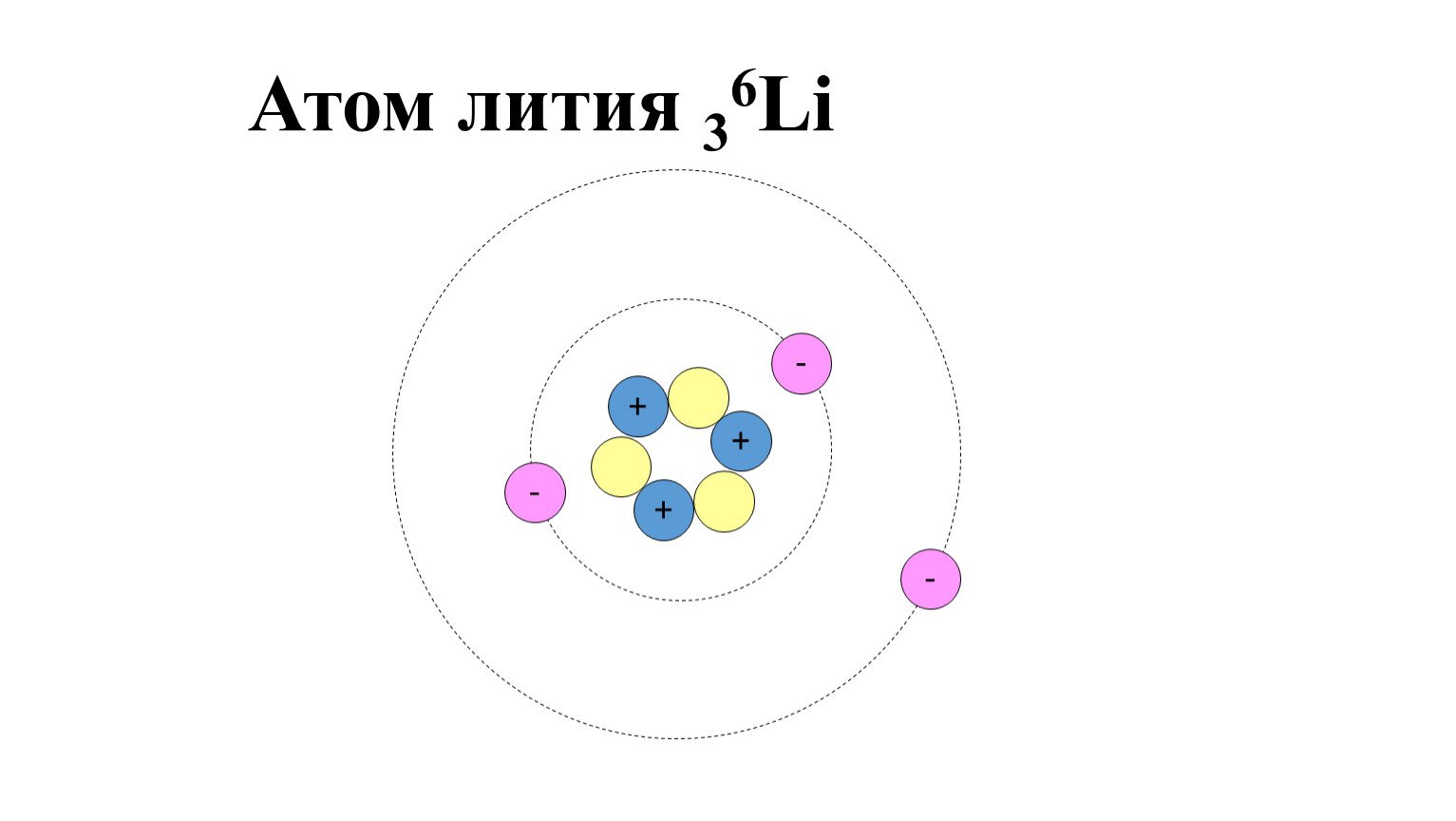
Все атомы и ядра состоят из определенного количества протонов и нейтронов. Сколько протонов находится в ядре, столько же электронов обращается вокруг ядра в электронных оболочках. Поэтому положительный заряд протонов ядра в точности компенсируется отрицательным зарядом электронов. Собственно говоря, дело обстоит еще проще. Если быть точным, то атомы состоят не из трех типов элементарных частиц: протонов, нейтронов и электронов, а всего из двух. В атомных ядрах протоны и электроны могут превращаться в нейтроны. За пределами атомного ядра нейтрон примерно через 17 минут распадается на протон и электрон. Поэтому можно считать, что окружающий нас мир во всем его многообразии построен только из протонов и электронов. Сумма количества протонов и нейтронов в атомном ядре называется  Таким образом, атом водорода имеет массовое число 1 и заряд ядра 1. У гелия массовое число равно 4, а заряд ядра 2. Наиболее распространенный тип атомов железа имеет массовое число 56, а заряд ядра 26. Заряд ядра показывает также, сколько электронов должно обращаться вокруг ядра, чтобы атом был полностью электрически нейтральным. Строение электронных оболочек определяет химические свойства веществ. Вещества с различными зарядами ядра различаются по химическим свойствам из-за того, что у атомов этих веществ разные электронные оболочки. Атомы с одинаковым зарядом ядра, но с различным числом нейтронов, не различаются по химическим свойствам. Они различаются только массовым числом. Такие атомы называются изотопами одного и того же элемента. Так, например, кроме обычного водорода существует так называемый тяжелый водород. В ядре этого изотопа кроме одного протона есть еще и один нейтрон. Такой изотоп водорода называется дейтерием. Он в небольших количествах встречается в природе.
Таким образом, атом водорода имеет массовое число 1 и заряд ядра 1. У гелия массовое число равно 4, а заряд ядра 2. Наиболее распространенный тип атомов железа имеет массовое число 56, а заряд ядра 26. Заряд ядра показывает также, сколько электронов должно обращаться вокруг ядра, чтобы атом был полностью электрически нейтральным. Строение электронных оболочек определяет химические свойства веществ. Вещества с различными зарядами ядра различаются по химическим свойствам из-за того, что у атомов этих веществ разные электронные оболочки. Атомы с одинаковым зарядом ядра, но с различным числом нейтронов, не различаются по химическим свойствам. Они различаются только массовым числом. Такие атомы называются изотопами одного и того же элемента. Так, например, кроме обычного водорода существует так называемый тяжелый водород. В ядре этого изотопа кроме одного протона есть еще и один нейтрон. Такой изотоп водорода называется дейтерием. Он в небольших количествах встречается в природе.
Хотя кусок железа и газообразный водород в воздушном шарике не имеют на первый взгляд между собой ничего общего, однако атомы и того и другого элемента построены из одних и тех же протонов и электронов.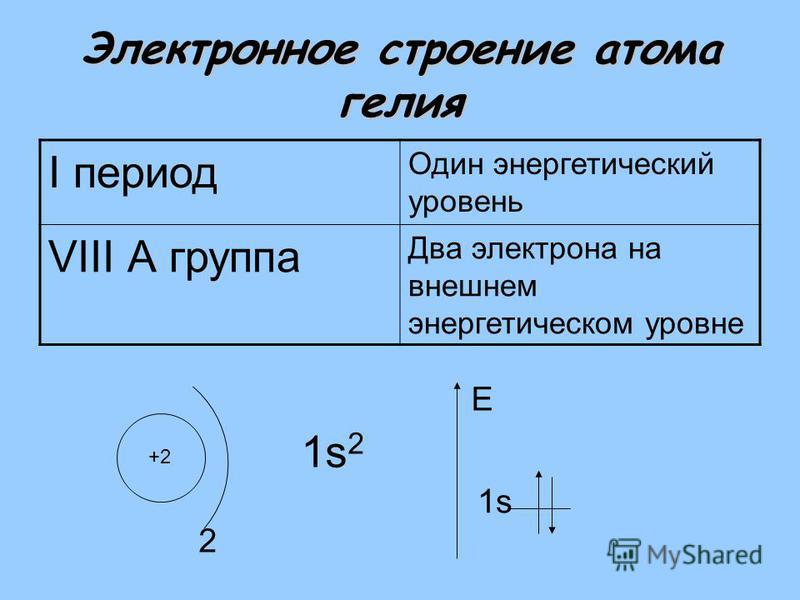 Если бы мы могли взять 56 атомов водорода и расположить 56 протонов и 56 электронов этих атомов в нужном порядке: из 30 электронов и 30 протонов сделать 30 нейтронов, объединить эти нейтроны с оставшимися 26 протонами в атомное ядро, и построить вокруг этого ядра электронную оболочку из остальных 26 электронов, то мы получили бы из водорода атом железа.
Если бы мы могли взять 56 атомов водорода и расположить 56 протонов и 56 электронов этих атомов в нужном порядке: из 30 электронов и 30 протонов сделать 30 нейтронов, объединить эти нейтроны с оставшимися 26 протонами в атомное ядро, и построить вокруг этого ядра электронную оболочку из остальных 26 электронов, то мы получили бы из водорода атом железа.
Если бы мы могли взять 4 атома водорода, образовать из двух электронов и двух протонов два нейтрона, объединить их с двумя оставшимися протонами в атомное ядро, то мы получили бы ядро с массовым числом 4 и зарядом 2, вокруг которого смогли бы обращаться два оставшихся электрона. При этом из четырех атомов водорода мы получили бы атом гелия. В результате такого процесса должна освобождаться энергия. Однако объединить ядра разных атомов друг с другом не так-то просто.
Гелий, атомарная структура – Стоковая фотография – C018/3683
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3683
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Обозначение
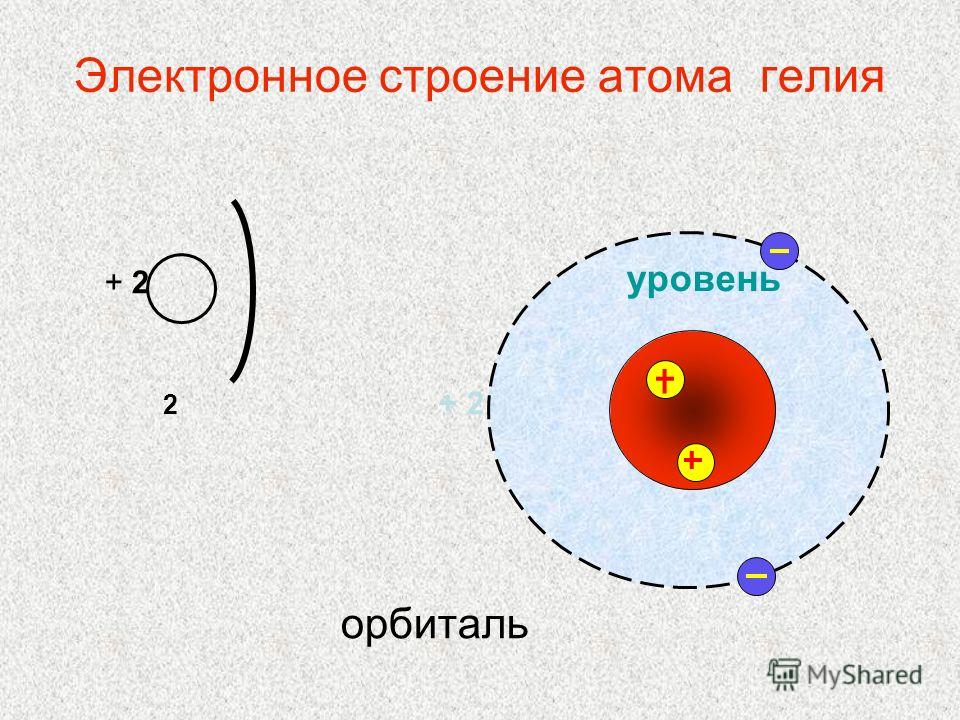
Гелий (He). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома гелия-4 (атомный номер: 2), наиболее распространенного изотопа элемента гелия. Ядро состоит из 2 протонов (красный) и 2 нейтронов (оранжевый). Два электрона (белые) заполняют первую электронную оболочку (кольцо), очень стабильная конфигурация. Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Гелий – благородный газ в группе 18, периоде 1 и s-блоке периодической таблицы. При комнатной температуре и давлении образует инертный газ, сжижающийся при минус 269градусов Цельсия.
Ядро состоит из 2 протонов (красный) и 2 нейтронов (оранжевый). Два электрона (белые) заполняют первую электронную оболочку (кольцо), очень стабильная конфигурация. Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Гелий – благородный газ в группе 18, периоде 1 и s-блоке периодической таблицы. При комнатной температуре и давлении образует инертный газ, сжижающийся при минус 269градусов Цельсия.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 1с
- 1с2
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- черный фон
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- газ
- газообразный
- газы
- группа 18
- он
- гелий
- гелий-4
- иллюстрация
- инертный
- изотоп
- уровень
- уровней
- нейтрон
- нейтрон номер
- нейтронов
- благородный газ
- благородные газы
- неметаллический
- неметаллический
- неметаллы
- нереактивный
- неметалл
- неметаллический
- неметаллы
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- период 1
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- с блоком
- S-блок
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочек
- символ
- нереактивный
- валентная орбиталь
- волновая функция
уровней энергии гелия
уровень энергии гелия Энергетические уровни электронов атома гелия демонстрируют ряд особенностей многоэлектронных атомов. Предполагается, что один электрон находится в основном состоянии, в состоянии 1s. Электрон в верхнем состоянии может иметь спин, антипараллельный электрону основного состояния (S=0, синглетное состояние, парагелий) или параллельный электрону основного состояния (S=1, триплетное состояние, ортогелий).
| Index Понятия атомной структуры | |||||||
| Назад |
На диаграмме энергетических уровней гелия предполагается, что один электрон находится в основном состоянии атома гелия, в состоянии 1s. Замечено, что состояния ортогелия имеют более низкую энергию, чем состояния парагелия. Объяснение этому:
Этот эффект иногда называют «взаимодействием спин-вращение» и рассматривается согласно правилу Хунда №1. Это часть понимания упорядочения энергетических уровней в многоэлектронных атомах.
| Index Reference | ||
| Назад |
Основное состояние гелия состоит из двух одинаковых 1s-электронов. Тот факт, что второй электрон менее прочно связан, можно интерпретировать как экранирующий эффект; другой электрон частично экранирует второй электрон от полного заряда ядра. Его энергию можно использовать для моделирования эффективной защиты следующим образом. Другой способ рассматривать энергию — сказать, что отталкивание электронов вносит вклад в положительную потенциальную энергию, которая частично компенсирует отрицательную потенциальную энергию, вносимую электрической силой притяжения ядерного заряда. |

 Электрон в верхнем состоянии может иметь спин, антипараллельный электрону основного состояния (S=0, синглетное состояние, парагелий) или параллельный электрону основного состояния (S=1, триплетное состояние, ортогелий).
Электрон в верхнем состоянии может иметь спин, антипараллельный электрону основного состояния (S=0, синглетное состояние, парагелий) или параллельный электрону основного состояния (S=1, триплетное состояние, ортогелий). Так что в целом вероятность небольшого расстояния между двумя электронами меньше, чем для симметричной пространственной волновой функции.
Так что в целом вероятность небольшого расстояния между двумя электронами меньше, чем для симметричной пространственной волновой функции.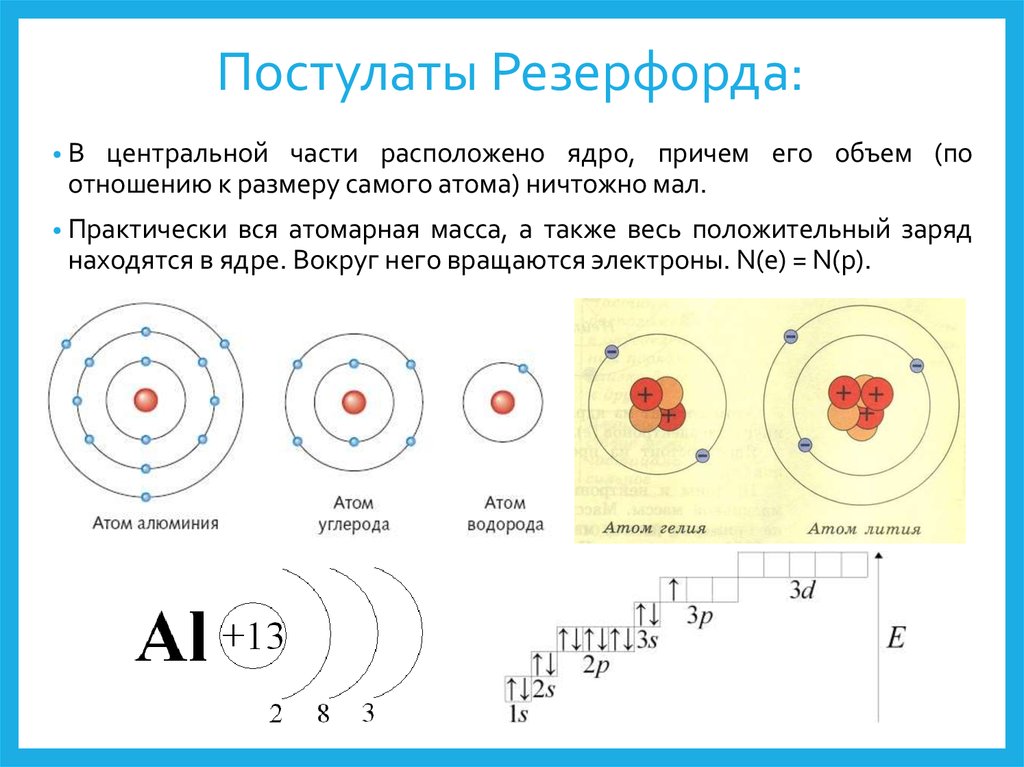 Энергия, необходимая для удаления одного из них, является самой высокой энергией ионизации любого атома в периодической таблице: 24,6 электрон-вольт. Энергия, необходимая для удаления второго электрона, составляет 54,4 эВ, как и следовало ожидать, моделируя ее после уровней энергии водорода. Ион He+ подобен атому водорода с двумя единицами заряда в ядре. Поскольку водородные энергетические уровни зависят от квадрата заряда ядра, энергия оставшегося электрона гелия должна быть как раз 4x (-13,6 эВ) = -54,4 эВ, как наблюдалось.
Энергия, необходимая для удаления одного из них, является самой высокой энергией ионизации любого атома в периодической таблице: 24,6 электрон-вольт. Энергия, необходимая для удаления второго электрона, составляет 54,4 эВ, как и следовало ожидать, моделируя ее после уровней энергии водорода. Ион He+ подобен атому водорода с двумя единицами заряда в ядре. Поскольку водородные энергетические уровни зависят от квадрата заряда ядра, энергия оставшегося электрона гелия должна быть как раз 4x (-13,6 эВ) = -54,4 эВ, как наблюдалось.