Ионная связь между калием и кислородом. Ионная химическая связь
Помощь уже в пути, держи.
а) Рассмотрим схему образования ионной связи между натрием и
кислородом.
1. Натрий – элемент главной подгруппы I группы, металл. Его атому легче отдать I внешний электрон, чем принять недостающие 7:
1. Кислород- элемент главной подгруппы VI группы, неметалл.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.
1. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы Naотдали 2 электрона, их надо взять 2(2:1), чтобы атомы кислорода смогли принять 2 электрона, их нужно взять 1.
2. Схематично образование ионной связи между атомами натрия и кислорода можно записать так:
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
I. Литий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
 Хлор- элемент главной подгруппы VII группы, неметалл. Его
Хлор- элемент главной подгруппы VII группы, неметалл. Егоатому легче принять 1 электрон, чем отдать 7 электронов:
2. Наименьшее общее кратное 1, т.е. чтобы 1 атом лития отдал, а атом хлора принял 1 электрон, надо взять их по одному.
3. Схематично образование ионной связи между атомами лития и хлора можно записать так:
в) Рассмотрим схему образования ионной связи между атомами
магния и фтора.
1. Магний- элемент II группы главной подгруппы, металл. Его
атому легче отдать 2 внешних электрона, чем принять недостающие 6:
2. Фтор – элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов:
2. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
3. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
Ответ на вопрос 5.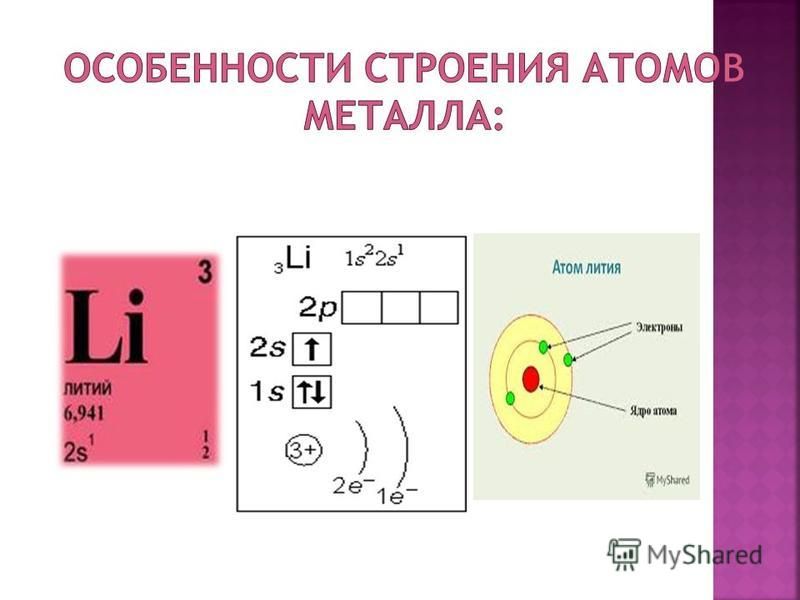
Элемент с порядковым номером 35 – это бром (Br). Заряд ядра его атома равен 35. Атом брома содержит 35 протонов, 35 электронов и 45 нейтронов.
§ 7 . Изменения в составе ядер атомов химических элементов. Изотопы
Ответ на вопрос 1.
Изотопы 40 19 K и40 18 Ar проявляют разные свойства, потому что имеют разный заряд ядра и разное количество электронов.
Ответ на вопрос 2.
Относительная атомная масса аргона близка к 40, т.к. в ядре его атома 18 протонов и 22 нейтрона, а в ядре атома калия 19 протонов и 20 нейтронов, поэтому его относительная атомная масса близка к 39. Так как число протонов в ядре атома калия больше, он стоит в таблице после аргона.
Ответ на вопрос 3.
Изотопы – это разновидности атомов одного элемента, имеющие одинаковое количество протонов и электронов и различное число нейтронов.
Ответ на вопрос 4.
Изотопы хлора схожи по свойствам, т.к. свойства определяются зарядом ядра, а не его относительной массой, даже при изменении относительной атомной массы изотопов хлора на 1 или 2 единицы масса изменяется незначительно, в отличие от изотопов водорода, где при добавлении одного или двух нейтронов масса ядра изменяется в 2 или 3 раза.
Ответ на вопрос 5.
Дейтериевая (тяжелая вода) – соединение, где 1 атом кислорода связан с двумя атомами изотопа водорода 2 1 D , формула D2 O. Сравнение свойств D2 O и Н2 О
Ответ на вопрос 6.
Вначале расположен элемент с большим значением относительной
атомной массы в парах:
Te-I (теллур-иод) 128 Te и127 I.
Th-Pa (торий-протактиний) 232 90 Th и231 91 Pa . U-Np (уран-нептуний) 238 92 U и237 93 Np .
§ 8 . Строение электронных оболочек атомов
Ответ на вопрос 1.
а) Al +13 | б) Р | в) О | |||||||
13 Al 2e– , 8e– , 3e– | 15 Р 2e– , 8e– , 5e– | 8 О 2e– , 6e– | |||||||
а) – схема строения атома алюминия; б) – схема строения атома фосфора; в) – схема строения атома кислорода.
Ответ на вопрос 2.
а) сравним строение атомов азота и фосфора.
7 N 2e– , 5e– | 15 Р 2e– , 8e– , 5e– | |||||
Cтроение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора их 3.
б) Сравним строение атомов фосфора и серы.
15 Р 2e– , 8e– , 5e– | 16 S 2e– , 8e– , 6e– | ||||||
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Ответ на вопрос 3.
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Ответ на вопрос 4.
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n2 , где n – номер периода.
Поэтому в первом периоде содержится только 2 элемента (2 12 ), а во втором периоде 8 элементов (2 22 ).
Ответ на вопрос 5.
В астрономии – Период вращения Земли вокруг своей оси 24 часа.
В географии – Смена сезонов с периодом 1 год.
В физике – Периодические колебания маятника.
В биологии – Каждая клетка дрожжей в оптимальных условиях раз в 20 мин. делится.
Ответ на вопрос 6.
Электроны и строение атома были открыты в начале XX века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также автор допускает возможность, что и электроны тоже сложные частицы, строение которых мы еще просто не изучили.
Ответ на вопрос 7.
Приведенные в учебнике 2 четверостишия говорят об огромном поэтическом таланте В. Брюсова и гибком уме его, раз он мог так легко понять и принять все достижения современной ему науки, а также, по всей видимости, просвещенности и образованности в данной области.
§ 9 . Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
Ответ на вопрос 1.
а) Сравним строение и свойства атомов углерода и кремния
6 С 2e– , 4e– | 14 Si 2e– , 8e– , 4e– | ||||
По строению электронной оболочки эти элементы схожи: оба на последнем энергетическом уровне имеют по 4 электрона, но у углерода 2 энергетических уровня, а у кремния 3. Т.к. число электронов на внешнем уровне одинаково, то и свойства этих элементов будут похожи, но радиус атома кремния больше, поэтому по сравнению с углеродом он будет проявлять больше металлических свойств.
б) Сравним строение и свойства атомов кремния и фосфора:
14 Si 2e– , 8e– , 4e– | 15 Р 2e– , 8e– , 5e– | |||||
Атомы кремния и фосфора имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у кремния на последнем энергетическом уровне 4 электрона, а у фосфора 5, поэтому радиус атома фосфора меньше и он в большей степени проявляет неметаллические свойства, чем кремний.
Ответ на вопрос 2.
а) Рассмотрим схему образования ионной связи между алюминием и кислородом.
1. Алюминий – элемент главной подгруппы III группы, металл. Его атому легче отдать 3 внешних электрона, чем принять недостающие
Al0 – 3e– → Al+ 3
2. Кислород – элемент главной подгруппы VI группы, неметалл.
O0 + 2e– → О− 2
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 6(3 2). Чтобы атомы Al отдали 6
электронов, их нужно взять 2(6:3), чтобы атомы кислорода смогли принять 6 электронов, их нужно взять 3(6:2).
4. Схематично образование ионной связи между атомами алюминия и кислорода можно записать так:
2Al0 + 3O0 → Al2 +3 O3 –2 → Al2 O3
6e–
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
1. Литий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
Li0 – 1e– → Li+ 1
2. Фосфор – элемент главной подгруппы V группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения вешнего уровня, чем отдать 5 электронов:
Р0 + 3e– → Р− 3
3.
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3 1). Чтобы атомы лития отдали
Чтобы атомы лития отдали
3 электронов, их нужно взять 3(3:1), чтобы атомы фосфора смогли принять 5 электронов, нужно взять только 1 атом (3:3).
4. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
3Li0 – + P0 → Li3 +1 P–3 → Li3 P
в) Рассмотрим схему образования ионной связи между атомами магния и фтора.
1. Магний – элемент II группы главной подгруппы, металл. Его атому легче отдать 2 внешних электрона, чем принять недостающие
Mg0 – 2e– → Mg+ 2
2. Фтор – элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов:
F0 + 1e– → F− 1
3. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2 1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
4. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
Mg0 +– 2F0 → Mg+2 F2 –1 → MgF2
Ответ на вопрос 3.
Самые типичные металлы расположены в периодической системе
в начале периодов и в конце групп, таким образом, самым типичным металлом является франций (Fr). Типичные неметаллы расположены
в конце периодов и в начале групп. Таким образом, самый типичный неметалл фтор (F). (Гелий не проявляет каких-либо химических свойств).
Ответ на вопрос 4.
Инертные газы стали называть благородными, так же как и металлы, потому что в природе они встречаются исключительно в свободном виде и с большим трудом образуют химические соединения.
Ответ на вопрос 5.
Выражение «Улицы ночного города были залиты неоном» химически неверно, т.к. неон – инертный, малораспространенный газ, в воздухе его содержится очень мало. Однако неоном заполняют неоновые лампы и лампы дневного света, которые часто используются для подсветки вывесок, афиш, реклам ночью.
§ 10 . Взаимодействие атомов элементов-неметаллов между собой
Ответ на вопрос 1.
Электронная схема образования двухатомной молекулы галогена будет выглядеть так:
а + а→ аа
А структурная формула
Ответ на вопрос 2.
а) Схема образования химической связи для AlCl3 :
Алюминий – элемент III группы. Его атому легче отдать 3 внешних электрона, чем принять недостающие 5.
Al° – 3 e→ Al+3
Хлор – элемент VII группы. Его атому легче принять 1 электрон, которого не хватает до завершения внешнего уровня, чем отдать 7 электронов.
Сl° + 1 e → Сl–1
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3:1). Чтобы атомы алюминия отдали 3 электрона надо взять только 1 атом (3:3), чтобы атомы хлора смогли принять 3 электрона, их нужно взять 3(3:1)
Al° + 3Сl° → Al+3 Cl–1 → AlСl3
3 e –
Связь между атомами металла и неметалла носит ионный характер. б) Схема образования химической связи для Cl2 :
Хлор – элемент главной подгруппы VII группы. Его атомы имеют 7 электронов на внешнем уровне. Число непарных электронов равно
Связь между атомами одного и того же элемента ковалентна.
Ответ на вопрос 3.
Сера – элемент главной подгруппы VI группы.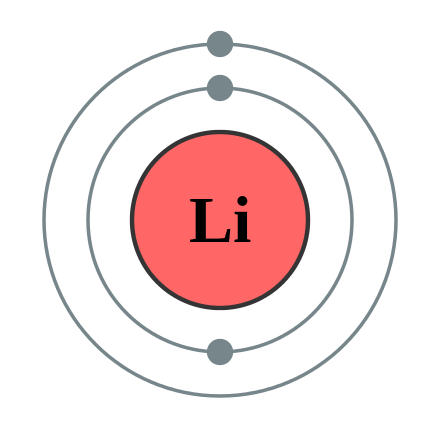 Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно (8–6)2. В молекулах S2
атомы связаны двумя общими электронными парами, поэтому связь двойная.
Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно (8–6)2. В молекулах S2
атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования молекулы S2 будет выглядеть следующим образом:
Ответ на вопрос 4.
В молекуле S2 связь двойная, в молекуле Cl связь одинарная, в молекуле N2 – тройная. Поэтому самой прочной молекулой будет N2 , менее прочной S2 , а еще слабее Cl2 .
Длина связи самая маленькая в молекуле N2 , больше в молекуле S2 , еще больше в молекуле Cl2 .
§ 11 . Ковалентная полярная химическая связь
Ответ на вопрос 1.
Так как значения ЭО водорода и фосфора одинаковы, то химическая связь в молекуле Ph4 будет ковалентной неполярной.
Ответ на вопрос 2.
1. а) в молекуле S2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи будет следующей:
Сера – элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке. Непарных электронов будет: 8 – 6 = 2.
Непарных электронов будет: 8 – 6 = 2.
Обозначим внешние электроны S
б) в молекуле K2 O связь ионная, т.к. она образована атомами элементов металла и неметалла.
Калий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
K0 – 1e– → K+ 1
Кислород – элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, которых не хватает до завершения уровня, чем отдать 6 электронов:
O0 + 2e– → O− 2
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2 1). Чтобы атомы калия отдали 2 электрона, их нужно взять 2, чтобы атомы кислорода смогли принять 2 электрона, необходим только 1 атом:
2K2e 0 – + O0 → K2 +1 O–2 → K2 O
в) в молекуле h3 S связь ковалентная полярная, т.к. она образована атомами элементов с различной ЭО. Схема образования связи будет следующей:
Сера – элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке.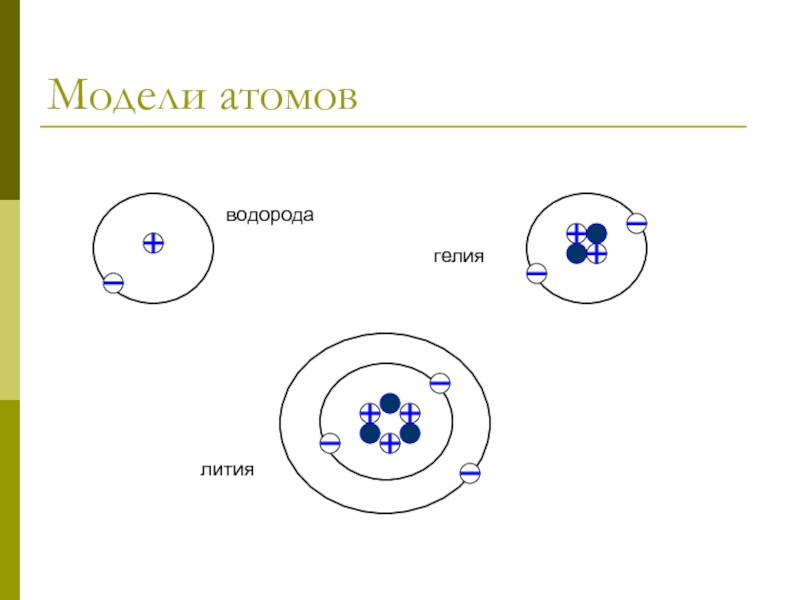 Непарных электронов будет: 8– 6=2.
Непарных электронов будет: 8– 6=2.
Водород – элемент главной подгруппы I группы. Его атомы содержат по 1 электрону на внешней оболочке. Непарным является 1 электрон (для атома водорода завершенным является двухэлектронный уровень). Обозначим внешние электроны:
Общие электронные пары смещены к атому серы, как более электроотрицательному
H δ+→ S 2 δ−← H δ+
1. а) в молекуле N2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи следующая:
Азот – элемент главной подгруппы V группы. Его атомы имеют 5 электронов на внешней оболочке. Непарных электронов: 8 – 5 = 3.
Обозначим внешние электроны: N
N ≡ N
б) в молекуле Li3 N связь ионная, т.к. она образована атомами элементов металла и неметалла.
Литий – элемент главной подгруппы I группы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
Li0 – 1e– → Li+ 1
Азот – элемент главной подгруппы V группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
N0 + 3e– → N− 3
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3 1). Чтобы атомы лития отдали 3 электрона, необходимо 3 атома, чтобы атомы азота смогли принять 3 электрона, необходим только один атом:
3Li0 + N0 → Li3 +1 N–3 → Li3 N
3e–
в) в молекуле NCl3 связь ковалентная полярная, т.к. она образована атомами элементов-неметаллов с различными значениями ЭО. Схема образования связи следующая:
Азот – элемент главной подгруппы V группы. Его атомы имеют по 5 электронов на внешней оболочке. Непарных электронов будет: 8– 5=3.
Хлор – элемент главной подгруппы VII группы. Его атомы содержат по 7 электронов на внешней оболочке. Непарным остается
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока :
- Сформировать понятие об химических связях на примере ионной связи. Добиться понимания образования ионной связи как крайнего случая полярной.
- Обеспечить в ходе урока усвоение следующих основных понятий: ионы (катион, анион), ионная связь.
- Развивать умственную деятельность учащихся через создание проблемной ситуации при изучении нового материала.
Задачи:
- научить распознавать виды химической связи;
- повторить строение атома;
- исследовать механизм образования ионной химической связи;
- научить составлять схемы образования и электронные формулы ионных соединений, уравнения реакций с обозначением перехода электронов.
Оборудование : компьютер, проектор, мультимедийный ресурс, периодическая система химических элементов Д.И. Менделеева, таблица «Ионная связь».
Тип урока: Формирование новых знаний.
Вид урока: Мультимедиа урок.
Х од урока I. Организационный момент . II. Проверка домашнего задания .Учитель: Как атомы могут принимать устойчивые электронные конфигурации? Каковы cпособы образования ковалентной связи?
Ученик: Полярная и неполярная ковалентные связи образованы по обменному механизму. К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Например, водород: (слайд 2)
Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов. У каждого атома есть по одному s-электрону. Атомы Н равноценны и пары одинаково принадлежат обоим атомам. Поэтому же принципу происходит образование общих электронных пар (перекрывание р-электронных облаков) при образовании молекулы F 2 . (слайд 3)
Запись H· означает, что у атома водорода на внешнем электронном слое находится 1 электрон. Запись показывает, что на внешнем электронном слое атома фтора находится 7 электронов.
Запись показывает, что на внешнем электронном слое атома фтора находится 7 электронов.
При образовании молекулы N 2 . Образуются 3 общие электронные пары. Перекрываются р-орбитали. (слайд 4)
Связь называется неполярная.
Учитель: Мы сейчас рассмотрели случаи, когда образуются молекулы простого вещества. Но вокруг нас множество веществ, сложного строения. Возьмем молекулу фтороводорода. Как в этом случае происходит образование связи?
Ученик: При образовании молекулы фтороводорода перекрывается орбиталь s-электрона водорода и орбиталь р-электрона фтора Н-F. (слайд 5)
Связывающая электронная пара смещена к атому фтора, в результате чего образуется диполь . Связь называется полярная .
III. Актуализация знаний .Учитель: Химическая связь возникает вследствие изменений, которые происходят с наружными электронными оболочками соединяющихся атомов. Это возможно потому, что наружные электронные слои не завершены у элементов, кроме инертных газов. Химическая связь объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную конфигурации «ближайшего» к ним инертного газа.
Химическая связь объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную конфигурации «ближайшего» к ним инертного газа.
Учитель: Записать схему электронного строения атома натрия (у доски). (слайд 6)
Ученик: Атому натрия для достижения устойчивости электронной оболочки необходимо либо отдать один электрон, либо принять семь. Натрий легко отдаст свой далекий от ядра и слабо связанный с ним электрон.
Учитель: Составить схему отдачи электрона.
Nа° – 1ē → Nа+ = Ne
Учитель: Записать схему электронного строения атома фтора (у доски).
Учитель: Как добиться завершения заполнения электронного слоя?
Ученик: Атому фтора для достижения устойчивости электронной оболочки необходимо либо отдать семь электронов, либо принять один. Энергетически выгоднее фтору принять электрон.
Учитель: Составить схему приема электрона.
F° + 1ē → F- = Ne
IV. Изучение нового материал.Учитель обращается с вопросом к классу, в котором ставится задача урока:
Возможны ли другие варианты, при которых атомы могут принимать устойчивые электронные конфигурации? Каковы пути образования таких связей?
Сегодня мы рассмотрим один из видов связей – ионную связь.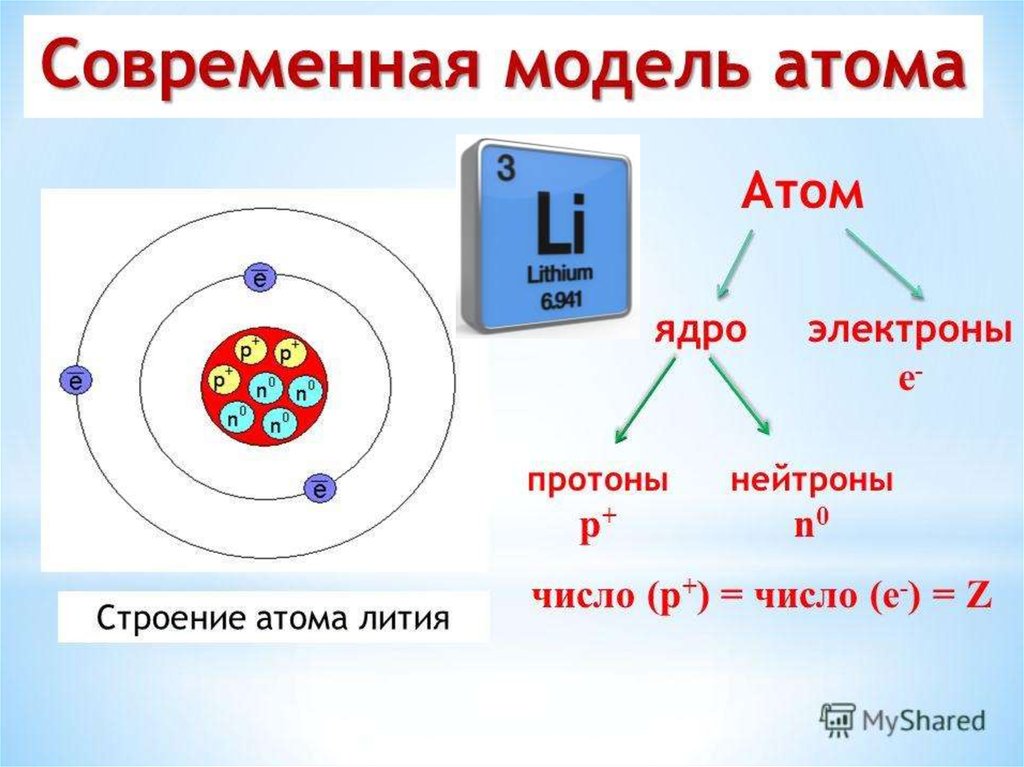 Сопоставим строение электронных оболочек уже названных атомов и инертных газов.
Сопоставим строение электронных оболочек уже названных атомов и инертных газов.
Беседа с классом.
Учитель: Какой заряд имели атомы натрия и фтора до реакции?
Ученик: Атомы натрия и фтора электронейтральны, т.к. заряды их ядер уравновешиваются электронами, вращающимися вокруг ядра.
Учитель: Что происходит между атомами при отдаче и принятии электронов?
Ученик: Атомы приобретают заряды.
Учитель дает пояснения: В формуле иона дополнительно записывают его заряд. Для этого используют верхний индекс. В нем цифрой указывают величину заряда (единицу не пишут), а потом – знак (плюс или минус). Например, ион Натрия с зарядом +1 имеет формулу Na + (читается «натрий-плюс»), ион Фтора с зарядом -1 – F – («фтор-минус»), гидроксид-ион с зарядом -1 – ОН – («о-аш-минус»), карбонат-ион с зарядом -2 – CO 3 2- («цэ-о-три-два-минус»).
В формулах ионных соединений сначала записывают, не указывая зарядов, положительно заряженные ионы, а потом – отрицательно заряженные.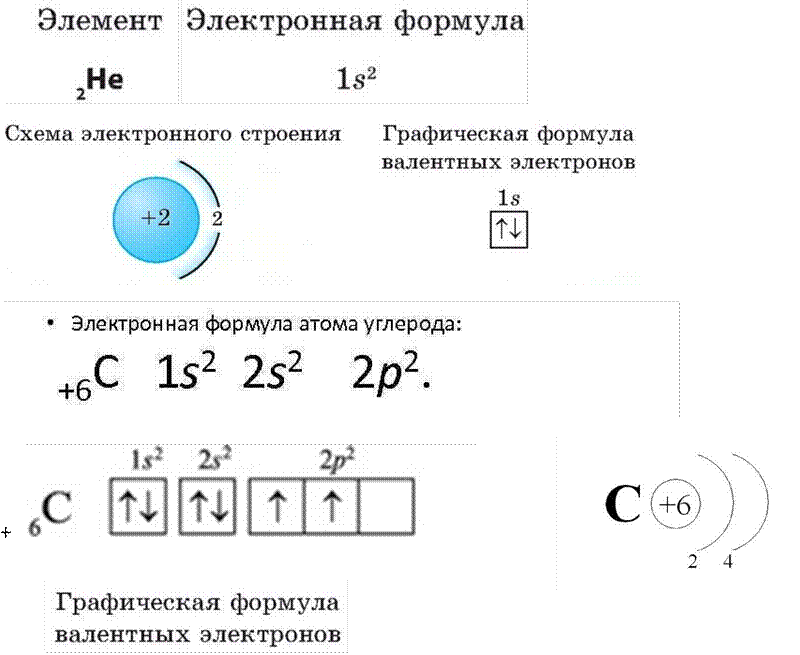 Если формула правильная, то сумма зарядов всех ионов в ней равна нулю.
Если формула правильная, то сумма зарядов всех ионов в ней равна нулю.
Положительно заряженный ионназывается катионом ,аотрицательно заряженный ион- анионом.
Учитель: Записываем определение в рабочие тетради:
Ион – это заряженная частица, в которую превращается атом в результате принятия или отдачи электронов.
Учитель: Как определить величину заряда иона кальция Ca 2+ ?
Ученик: Ио́н – электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов атомом. У кальция на последнем электронном уровне находятся два электрона, ионизация атома кальция происходит при отдаче двух электронов. Ca 2+ – двухзарядный катион.
Учитель: Что происходит с радиусами этих ионов?
При переходе электронейтрального атома в ионное состояние размер частицы сильно изменяется. Атом, отдавая свои валентные электроны, превращается при этом в более компактную частицу – катион. Например, при переходе атома натрия в катион Na+, имеющий, как указано выше, структуру неона, радиус частицы сильно уменьшается. Радиус аниона всегда больше радиуса соответствующего электронейтрального атома.
Радиус аниона всегда больше радиуса соответствующего электронейтрального атома.
Учитель: Что происходит с разноименно заряженными частицами?
Ученик: Разноименно заряженные ионы натрия и фтора, возникающие в результате перехода электрона от атома натрия к атому фтора, взаимно притягиваются и образуют фторид натрия. (слайд 7)
Nа + + F – = NаF
Рассмотренная нами схема образования ионов показывает, как между атомом натрия и атомом фтора образуется химическая связь, которую называют ионной.
Ионная связь – химическая связь, образованная электростатическим притяжением друг к другу разноименно заряженных ионов.
Соединения, которые при этом образуются, называют ионными соединениями.
V. Закрепление нового материала .Задания для закрепления знаний и умений
1. Сравните строение электронных оболочек атома кальция и катиона кальция, атома хлора и хлорид – аниона:
Прокомментируйте схему образования ионной связи в хлориде кальция:
2. Для выполнения данного задания необходимо разделиться на группы по 3–4 человека. Каждый участник группы рассматривает один пример и результаты представляет всей группе.
Для выполнения данного задания необходимо разделиться на группы по 3–4 человека. Каждый участник группы рассматривает один пример и результаты представляет всей группе.
Ответ учащихся:
1. Кальций – это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:
2. Хлор – это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2×1). Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, то есть надо взять один атом Са и два атома CI.
4. Схематично образование ионной связи между атомами кальция и хлора можно записать: (слайд 8)
Са 2+ + 2СI – → СаСI 2
Задания для самоконтроля
1. На основе схемы образования химического соединения составьте уравнение химической реакции: (слайд 9)
2. На основе схемы образования химического соединения составьте уравнение химической реакции: (слайд 10)
На основе схемы образования химического соединения составьте уравнение химической реакции: (слайд 10)
3. Дана схема образования химического соединения: (слайд 11)
Выберите пару химических элементов, атомы которых могут взаимодействовать в соответствии с этой схемой:
а) Na и O ;
б) Li и F ;
в) K и O ;
г) Na и F
Лови ответ.
а) Рассмотрим схему образования ионной связи между натрием и
кислородом.
1. Натрий – элемент главной подгруппы I группы, металл. Его атомму легче отдать I внешний электрон, чем принять недостающие 7:
2. Кислород- элемент главной подгруппы VI группы, неметалл.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы Naотдали 2 электрона, их надо взять 2(2:1), чтобы атомы кислорода смогли принять 2 электрона, их нужно взять 1.
Чтобы атомы Naотдали 2 электрона, их надо взять 2(2:1), чтобы атомы кислорода смогли принять 2 электрона, их нужно взять 1.
4. Схематично образование ионной связи между атомами натрия и кислорода можно записать так:
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
I. Литий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
2. Хлор- элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, чем отдать 7 электронов:
2. Наименьшее общее кратное 1, т.е. чтобы 1 атом лития отдал, а атом хлора принял 1 электрон, надо взять их по одому.
3. Схематично образование ионной связи между атомами лития и хлора можно записать так:
в) Рассмотрим схему образования ионной связи между атомами
магния и фтора.
1. Магний- элемент II группы главной подгруппы, металл. Его
атому легче отдать 2 внешних электрона, чем принять недостающие 6:
2. Фтор – элемент главной подгруппы VII группы, неметалл. Его
Фтор – элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов:
2. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
3. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
Схемы строения атомов – Справочник химика 21
Схему строения атомов можно изобразить следующим образом [c.376]
Составить электронные схемы строения атомов калия и цезия. Какой из этих элементов является более сильным восстановителем Почему [c.263]
Изобразите электронные схемы строения атомов элементов с порядковыми номерами 15, 20, 36, 40, 47. Укажите расположение этих элементов в периодической системе Д. И. Менделеева и их высшую валентность. [c.44]
Укажите расположение этих элементов в периодической системе Д. И. Менделеева и их высшую валентность. [c.44]Изобразите электронные схемы строения атомов натрия, хлора, хрома, кальция и железа. [c.44]
Составить электронные схемы строения атомов щелочных металлов. Какой из них является наиболее сильным восстановителем Почему [c.231]
Нарисуйте схемы строения атомов С и 81. Разъясните, чем сходны и чем отличаются свойства этих элементов [c.357]
Нарисуйте схемы строения атомов элементов с № I по [c.44]
Срисуйте себе в тетрадь эту схему строения атома лития. [c.82]
Изобразить в виде схем строение атомов элементов, имеющих порядковые номера а) 6 б) 11 в) 20. [c.40]
Представить с помощью схем строения атомов процессы образования молекул следующих простых веществ а) водорода б) кислорода в) азота г) фтора. [c. 42]
42]
Наиболее проста схема строения атома водорода (порядковый номер равен 1). Его ядро имеет один элементарный положительный заряд и в поле ядра вращается один электрон. [c.41]
В электронных схемах строения атомов следующих элементов подчеркнуть атомные остовы и указать число валентных электронов в атоме каждого элемента [c.36]
Подсчитать общее число электронов в каждом случае, указать положительный заряд ядра представ ить электронные схемы строения атомов подобно тому, как это сделано в задаче 17, Назвать элементы, схемы строения электронных оболочек которых даны выше. [c.37]
Представить схемы строения атомов и отвечающих им ионов следующих элементов с разбивкой электронов по квантовым уровням, атомные остовы подчеркнуть, как это выполнено в примере (а) [c.38]
Начертите электронные схемы строения атомов элементов, имеющих порядковые номера 14, 15, 16 и 17.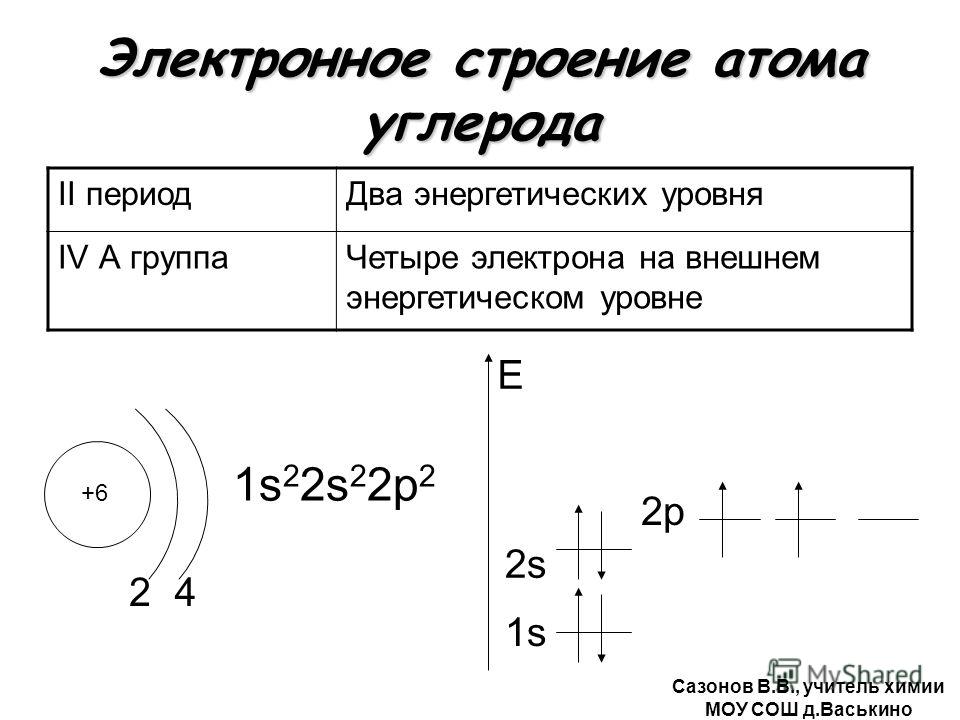 [c.176]
[c.176]
Изобразите схемы строения атома и иона натрия. [c.44]
Неправильно. Вы только что сами срисовывали схему строения атома водорода и записывали символы составляющих его частиц. [c.73]
Второй учащийся запишите в тетради схемы строения атомов кремния (порядковый № 14) и олова (№ 50). [c.130]
Составить электронные схемы строения атомов бериллия, магния и щелочноземельных металлов. [c.330]
Неправильно. Вы сами только что срисовывали схему строения атома водорода, поэтому должны знать, что он состоит всего из двух частиц. [c.88]
Наиболее проста схема строения атома водорода (порядковый номер равен 1). Его ядро имеет один элементарный положительный заряд, и вокруг ядра вращается один электрон. Ядро атома водорода — элементарная частица, которую называют протоном. [c.67]
Начертите электронные схемы строения атомов первых четырех элементов четвертого периода, укажите наибольшую валентность этих элементов и изобразите символами соответствующие ионы.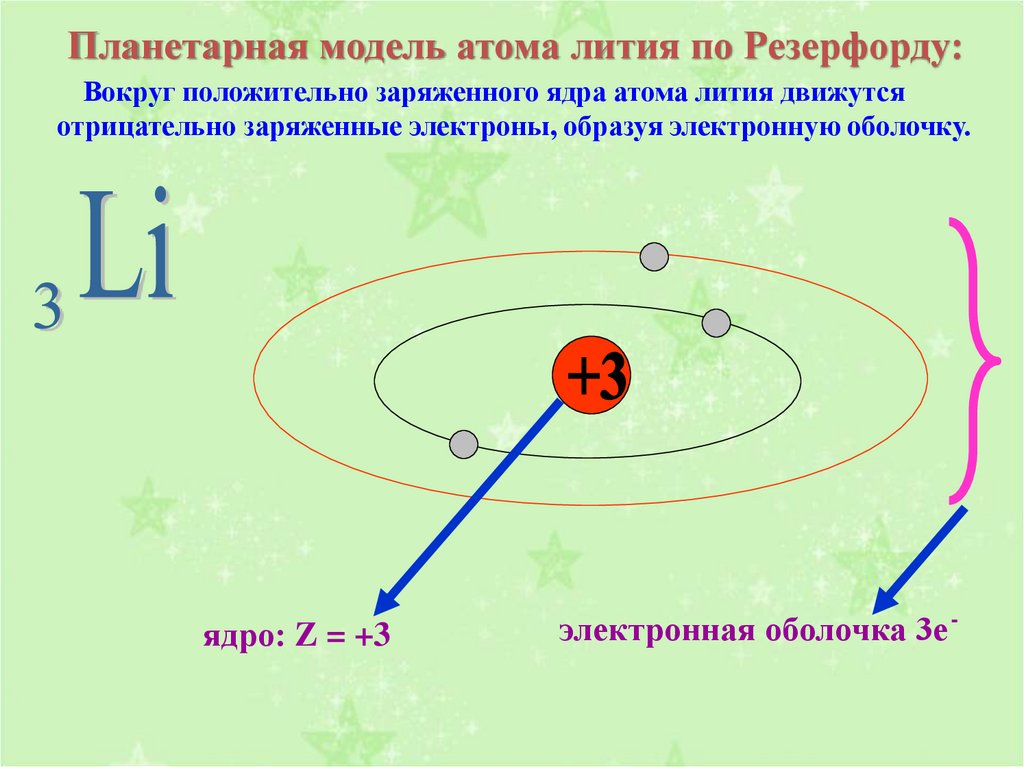 , [c.176]
, [c.176]
Цель на основе использования ранее приобретенных знаний о строении атомов составить схемы строения атомов элементов подгруппы углерода, сделать заключение о сходстве и различии строения этих атомов и предположение о свойствах данных элементов. [c.130]
Первый учащийся запишите в тетради схемы строения атомов углерода (порядковый № 6) и германия (№ 32). [c.130]
Изобразить схему строения атома серы. [c.97]
Содержание пособия используют для иллюстрации высказанной мысли, ее конкретизации с целью создания более ясного представления об изучаемом явлении. В этом отношении большое значение имеют экранные пособия, в которых последовательность видеоряда соответствует последовательности содержания изложения. Такие экранные средства особенно эффективны для закрепления и совершенствования знаний учащихся. В их отдельные кадры или графопособия включаются закономерности изменения физических констант веществ, схемы строения атомов и молекул, процессы разрыва и образования новых химических связей, энергетические эффекты химических взаимодействий. [c.120]
[c.120]
При составлении таблицы учащимся разрещается пользоваться учебником. Из него они могут извлечь данные о строении атома хрома. Затем по аналогии, а также с учетом числа электронных слоев и максимального количества электронов для каждого слоя записывают схемы строения атомов молибдена и вольфрама. [c.147]
А1. Еслн химическому элементу соответствует схема строения атома [c.5]
Ц м о л и п ычуг- “. Jтo важное-положение-тгостгг-нгтзва ние правила Хиноа. Из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают разные орбитали. [c.29]
Наряду с проблемным обучением, постоянно используется в процессе изучения периодического закона работа с карточками, на которых учащиеся записывают известные им сведения о каждом элементе. Работа с карточками не ограничивается только этапом выведения периодического закона.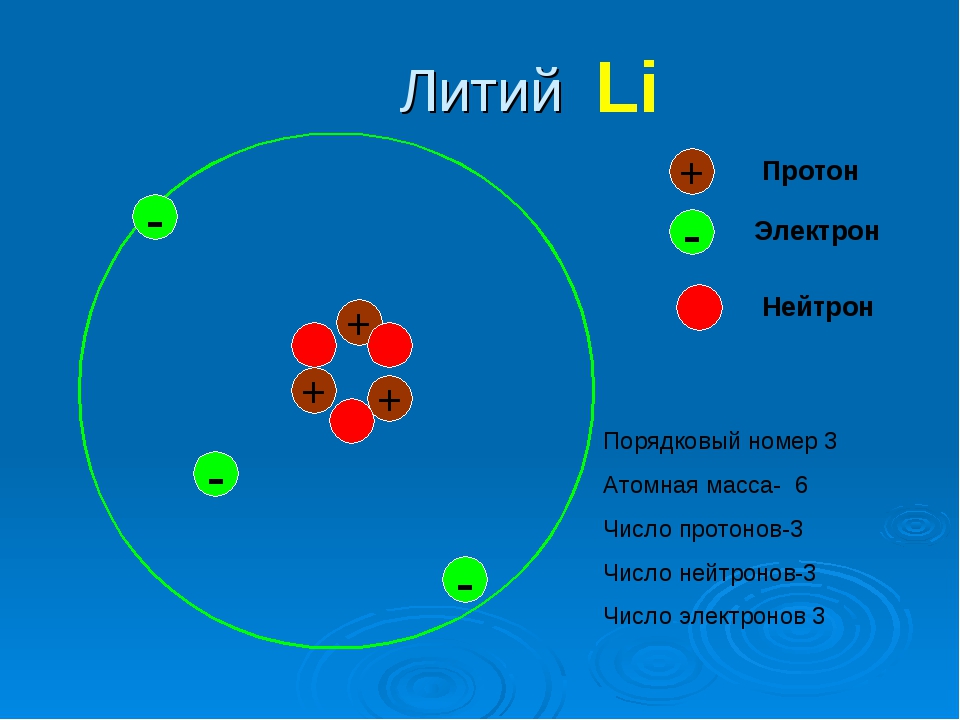 Учащиеся пользуются ими постоянно в ходе изучения темы на разных дидактических этапах. На карточке отмечают химический знак элемента, характер его свойств, высшую валентность в оксидах, формулы оксидов, валентность в летучих водородных соединениях и гидридах, схемы строения атомов, степень окисления элементов и т. д. Карточки позволяют эффективно организовать самостоятельную работу. Они используются как справочные материалы, способствуют выработке умений пользоваться периодической системой. [c.228]
Учащиеся пользуются ими постоянно в ходе изучения темы на разных дидактических этапах. На карточке отмечают химический знак элемента, характер его свойств, высшую валентность в оксидах, формулы оксидов, валентность в летучих водородных соединениях и гидридах, схемы строения атомов, степень окисления элементов и т. д. Карточки позволяют эффективно организовать самостоятельную работу. Они используются как справочные материалы, способствуют выработке умений пользоваться периодической системой. [c.228]
Привести схему строения атомов хрома, молибдена и вольфрама. Какой из этих элементов должен проявлять металлические свойства в меньшей степени Ответ мотивировать. [c.274]
На рис. 20 приведены схемы строения атомов элементов, имеющих заряд ядра от 1 до 18. [c.58]
Привести схемы строения атомов водорода (1), гелия (2), калия (19). В скобках указан заряд ядра атома. [c.59]
На рис. 29, 30 и 31 даны схемы строения атомов гелия, неона и натрия по Бору с орбитами, по которым движутся электроны.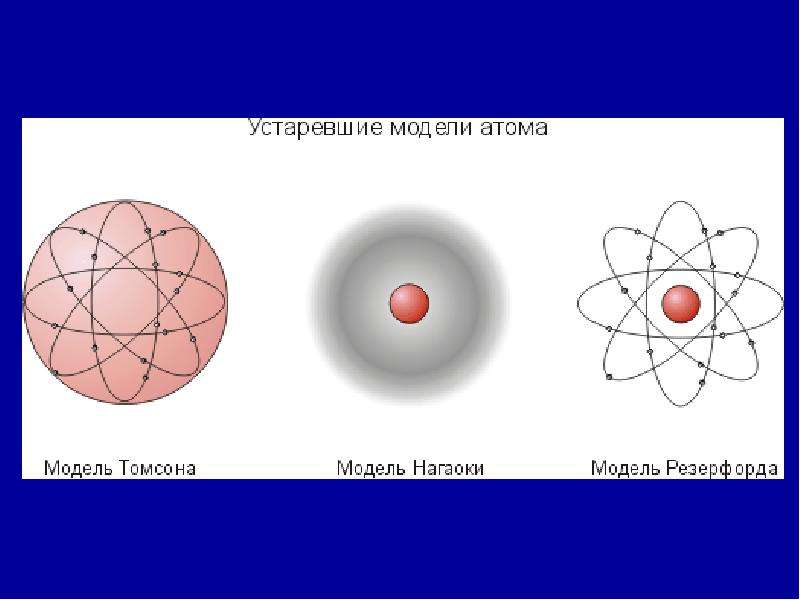 Ядро обозначено точкой внутри системы. [c.175]
Ядро обозначено точкой внутри системы. [c.175]
Изобразить с помош,ьго схем строения атомов образование молекул следующих ветцеств а) фтористого калия КР б) хлористого магиия Mg l2 в) сернистого алюминия А125з г) азотного ангидрида N265. [c.42]
Каждому квадрату (называемому каОнтовой ячейкой) соответствует определенная орбиталь. В первой схеме все р-электроны имеют разные значения /я во второй – у двух р-электронов они одинаковы. Квантовая механика и анализ атомных спектров показывают, что заполнение орбиталей, отвечающее низшему энергетическому состоянию атома, происходит следующим образом. При заполнении подуровня электроны сначала располагаются по орбиталям, отвечающим различным значениям магнитного квантового числа, и только после того как все орбитали подуровня однократно заполнены, в орбиталях появляется по два электрона с противоположно направленными спинами . Иными словами, заполнение энергетических подуровней происходит таким образом, чтобы суммарный спин был максимальным.
 Это важное положение носит название правила Хунда. Из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают разные орбитали. [c.32]
Это важное положение носит название правила Хунда. Из двух приведенных схем строения атома азота устойчивому состоянию (с наименьшей энергией) отвечает первая, где все р-электроны занимают разные орбитали. [c.32]Составить э.пектронные схемы строения атомов щелочноземельных металлов. Какая степень окисления характерна для этих элементов Чем объяснить их более низкую восстановительную способность по сравнению со щелочными металлами [c.241]
А1 Строение атома. Строение электронных оболочек атомов первых 20 элементов периодической системы химических элементов Д. И. Менделеева
Категория: Химия.
А1 Строение атома. Строение электронных оболочек атомов первых 20 элементов периодической системы химических элементов Д. И. Менделеева
Выберите один правильный ответ
1. Четыре электрона во внешнем электронном слое находятся у атома
1) бериллия 3) кремния
2) серы 4) магния
2. Атомы химических элементов магния и алюминия имеют одинаковое число
Атомы химических элементов магния и алюминия имеют одинаковое число
1) протонов
2) электронных слоев
3) электронов во внешнем электронном слое
4) нейтронов
3. Одинаковое число электронов во внешнем слое имеют атомы
1) бора и алюминия
2) магния и углерода
3) серы и хлора
4) лития и алюминия
4. Атомы азота и фосфора имеют
1) одинаковое число электронных слоев
2) одинаковые атомные радиусы
3) одинаковое число электронов во внешнем электронном слое
4) одинаковое число протонов в ядре
5. Строение внешнего энергетического уровня ns2npAимеют атомы химических элементов:
1) лития и натрия
2) углерода и кремния
3) фтора и хлора
4) серы и кислорода
6. Атомы химических элементов фтора и хлора имеют одинаковое число
1) протонов
2) нейтронов
3) электронных слоев
4) электронов во внешнем электронном уровне
7. Во внешнем слое атома магния содержится столько электронов, сколько их содержится во внешнем слое атома
Во внешнем слое атома магния содержится столько электронов, сколько их содержится во внешнем слое атома
1) углерода 3) алюминия
2) бериллия 4) фосфора
8. Атом какого химического элемента имеет приведенную ниже схему строения?
1) кислорода
2) неона
3) серы
4) углерода +8 ] ]
2 6
9. Атом какого химического элемента имеет приведенную ниже схему строения?
1) бора
2) фосфора
3) магния
4) алюминия
+12 2 8 2
10. Какая электронная схема соответствует атому углерода?
1) +8 2 6 2) +9 2 7 3) +6 2 4 4) +16 2 8 6
11. В электронной оболочке атома хлора число электронных слоев равно
1) 1 2) 2 3) 3 4) 4
12. Ряд чисел 2, 8, 5 соответствует распределению электронов по электронным слоям атома
1) фосфора 3) серы
2) азота 4) хлора
13. Распределению электронов по электронным слоям в атоме натрия соответствует ряд чисел:
1) 2, 8 3) 2, 8, 1
2) 2, 8, 3 4) 2, 8, 2
Т. М. Калитина, МБОУ СОШ №3, МБОУ СОШ №2 с. Александров-Гай Саратовской области
М. Калитина, МБОУ СОШ №3, МБОУ СОШ №2 с. Александров-Гай Саратовской области
Метки: Химия
Литий– Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: литий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе элемент, который возглавляет первую группу и дает нам более легкие самолеты и бронированную обшивку.Он также поддерживает смазку при арктических температурах, приводит в действие кардиостимуляторы и лежит в основе водородной бомбы.
Мэтт Уилкинсон
Литий редко встречается во Вселенной, хотя он был одним из трех элементов, наряду с водородом и гелием, которые были созданы в результате Большого взрыва. Этот элемент был открыт на Земле в 1817 году Йоханом Августом Арфведсоном (1792-1841) в Стокгольме, когда он исследовал петалит, один из первых обнаруженных минералов лития. (Было замечено, что при попадании в огонь дает интенсивное малиновое пламя.Он пришел к выводу, что петалит содержит неизвестный металл, который он назвал литием от греческого слова, обозначающего камень, lithos , хотя на самом деле он никогда его не производил. Он рассудил, что это новый щелочной металл, более легкий, чем натрий. Однако, в отличие от натрия, который Хамфри Дэви выделил в 1807 году электролизом гидроксида натрия, Арфведсон не смог получить литий тем же методом. Образец металлического лития был наконец извлечен в 1855 году, а затем путем электролиза расплавленного хлорида лития.
Этот элемент был открыт на Земле в 1817 году Йоханом Августом Арфведсоном (1792-1841) в Стокгольме, когда он исследовал петалит, один из первых обнаруженных минералов лития. (Было замечено, что при попадании в огонь дает интенсивное малиновое пламя.Он пришел к выводу, что петалит содержит неизвестный металл, который он назвал литием от греческого слова, обозначающего камень, lithos , хотя на самом деле он никогда его не производил. Он рассудил, что это новый щелочной металл, более легкий, чем натрий. Однако, в отличие от натрия, который Хамфри Дэви выделил в 1807 году электролизом гидроксида натрия, Арфведсон не смог получить литий тем же методом. Образец металлического лития был наконец извлечен в 1855 году, а затем путем электролиза расплавленного хлорида лития.
После того, как было объявлено об открытии лития, другие вскоре обнаружили, что он присутствует во всех видах вещей, таких как виноград, водоросли, табак, овощи, молоко и кровь.
Другой литиевой рудой является сподумен, который, как и петалит, является силикатом лития и алюминия, и в Южной Дакоте есть большое месторождение этой руды. Мировое производство соединений лития составляет около 40 000 тонн в год, а запасы оцениваются примерно в 7 миллионов тонн. Сообщается, что промышленное производство самого металла составляет около 7500 тонн в год, и его получают путем электролиза расплавленного хлорида лития и хлорида калия в стальных ячейках при температурах 450 o C.
Мировое производство соединений лития составляет около 40 000 тонн в год, а запасы оцениваются примерно в 7 миллионов тонн. Сообщается, что промышленное производство самого металла составляет около 7500 тонн в год, и его получают путем электролиза расплавленного хлорида лития и хлорида калия в стальных ячейках при температурах 450 o C.
Литий умеренно токсичен, как было обнаружено в 1940-х годах, когда пациентам давали хлорид лития в качестве заменителя соли. Однако в малых дозах его назначают для лечения маниакальной депрессии (теперь называемого биполярным расстройством). Его успокаивающее действие на мозг было впервые замечено в 1949 году австралийским врачом Джоном Кейдом из Департамента психической гигиены штата Виктория. Он вводил морским свинкам 0,5% раствор карбоната лития, и, к его удивлению, эти обычно очень нервные животные стали послушными и действительно были настолько спокойными, что сидели в одном и том же положении в течение нескольких часов.Затем Кейд сделал инъекцию того же раствора своему наиболее психически неуравновешенному пациенту. Мужчина так хорошо отреагировал, что через несколько дней его перевели в обычную больничную палату, и вскоре он вернулся на работу. Другие пациенты отреагировали аналогичным образом, и сейчас во всем мире для лечения этого психического состояния используют литиевую терапию. Как это работает, до сих пор доподлинно неизвестно, но похоже, что он предотвращает перепроизводство химического посредника в мозгу.
Мужчина так хорошо отреагировал, что через несколько дней его перевели в обычную больничную палату, и вскоре он вернулся на работу. Другие пациенты отреагировали аналогичным образом, и сейчас во всем мире для лечения этого психического состояния используют литиевую терапию. Как это работает, до сих пор доподлинно неизвестно, но похоже, что он предотвращает перепроизводство химического посредника в мозгу.
Литий используется в коммерческих целях по-разному.Оксид лития идет в стекло и стеклокерамику. Металлический литий переходит в сплавы с магнием и алюминием, что улучшает их прочность, делая их легче. Магниево-литиевый сплав используется в защитной броне, а алюминий-литий снижает вес самолета, тем самым экономя топливо. Стеарат лития, полученный в результате реакции стеариновой кислоты с гидроксидом лития, является универсальной высокотемпературной смазкой, и большинство пластичных смазок содержат ее. Он будет хорошо работать даже при температурах до -60 o C и использовался для транспортных средств в Антарктике.
Литиевые батареи, которые работают от 3 вольт и более, используются в устройствах, где компактность и легкость имеют решающее значение. Они имплантируются для обеспечения электрической энергией кардиостимуляторов. Они работают с литием в качестве анода, йодом в качестве твердого электролита и оксидом марганца в качестве катода – и их срок службы составляет десять лет. Эта долговечность была продлена до литиевых батарей более распространенного типа на 1,5 В (в которых катодом является дисульфид железа), которые используются в повседневных гаджетах, таких как часы, и теперь литий начинает использоваться для перезаряжаемых батарей
Литий – это мягкий серебристо-белый металл, возглавляющий группу 1, группу щелочных металлов, периодической таблицы элементов.Активно реагирует с водой. Хранить это проблема. Его нельзя держать под маслом, как натрий, потому что он менее плотный и плавает. Таким образом, он хранится, будучи покрытым вазелином. Несколько удивительно, что он не реагирует с кислородом, если не нагревается до 100 o C, но он будет реагировать с азотом из атмосферы с образованием красно-коричневого соединения нитрида лития, Li 3 N.
Водород водородных бомб равен фактически составной гидрид лития, в котором литий является изотопом лития-6, а водород – изотопом водорода-2 (дейтерий).Это соединение способно выделять огромное количество энергии из нейтронов, выпущенных атомной бомбой в ее ядре. Они поглощаются ядрами лития-6, который немедленно распадается с образованием гелия и водорода-3, которые затем переходят в другие элементы, и при этом бомба взрывается с силой в миллионы тонн тротила.
Крис Смит
Мэтт Уилкинсон о необычайных достоинствах элемента номер 3, лития. В следующий раз к одному из более редких химических веществ во Вселенной, каким бы ужасно токсичным оно ни было, без него мы были бы пресловутой частицей, а не ядром.
Ричард Ван Норден
Джеймс Чедвик в 1932 году открыл нейтрон, бомбардируя образец бериллия альфа-лучами, исходящими из радия. Он заметил, что бериллий испускает субатомную частицу нового типа, которая имеет массу, но не имеет заряда.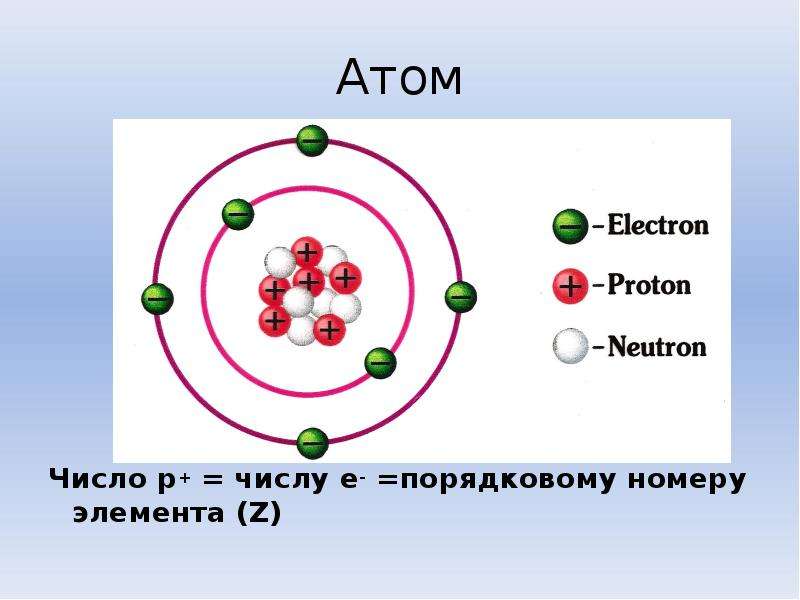 Нейтрон и комбинация радия и бериллия по-прежнему используются для получения нейтронов в исследовательских целях, хотя миллион альфа-частиц может произвести только 30 нейтронов.
Нейтрон и комбинация радия и бериллия по-прежнему используются для получения нейтронов в исследовательских целях, хотя миллион альфа-частиц может произвести только 30 нейтронов.
Крис Смит
Итак, это говорит о том, что иногда многое может пройти лишь незначительно.Ричард Ван Норден будет здесь с историей о бериллии на следующей неделе в программе «Химия в его элементе». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
Изобразите структуру Льюиса для Li2S. В структуре: A. каждый атом лития образует одну связь с серой. Б. Есть два иона лития, каждый с зарядом +1, и один сульфид-ион с четырьмя парами электронов и зарядом -2.C. есть два атома лития и на
Вопрос:
Изобразите структуру Льюиса для {eq} Li_2S. {/ экв}. В составе:
A. Каждый атом лития образует одну связь с серой.
B. есть два иона лития, каждый с зарядом +1, и один сульфид-ион с четырьмя парами электронов и зарядом -2.
C. Есть два атома лития и один атом серы с 6 электронами.
D. Есть два сульфид-иона и один ион лития.
Льюис Структура:
Структуры Льюиса – это точечные структуры, в которых точки используются для обозначения валентных электронов атома в молекуле. В структуре Льюиса связь показана с учетом распределения валентных электронов между атомами. Неподеленные пары (неспаренные электроны) также показаны в структуре и называются несвязывающими электронами.
Ответ и объяснение: 1
Структура Льюиса {eq} {\ text {L}} {{\ text {i}} _ {\ text {2}}} {\ text {S}} {/ eq} показан ниже:
Мы знаем, что атом лития имеет один валентный электрон, а атом серы имеет 6 валентных электронов.{{\ text {2 -}}}} {/ eq}) имеет четыре пары электронов (2 пары связей и 2 неподеленные пары)
Таким образом, здесь каждый атом лития (Li) образует одну связь с серой.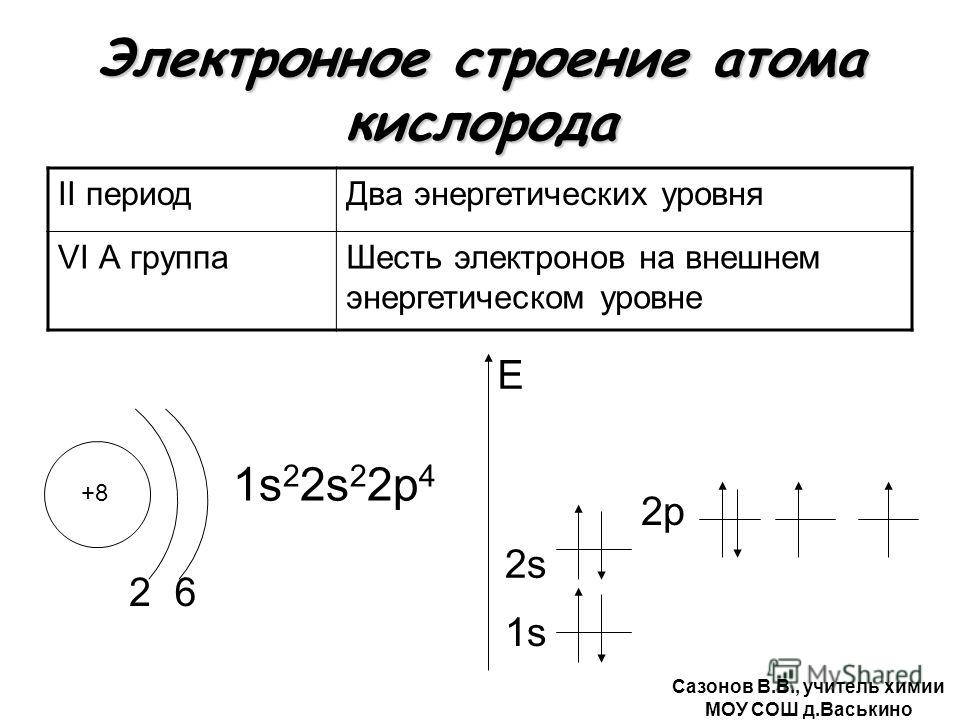
Есть два иона лития, каждый с зарядом +1, и один сульфид-ион с четырьмя парами электронов и зарядом -2.
Следовательно, ответ будет A и B .
% PDF-1.5
%
571 0 объект
>
эндобдж
xref
571 116
0000000016 00000 н.
0000003210 00000 н.
0000003821 00000 н.
0000003857 00000 н.
0000004013 00000 н.
0000004434 00000 н.
0000004624 00000 н.
0000004759 00000 н.
0000004893 00000 н.
0000005027 00000 н.
0000005161 00000 п.
0000005296 00000 н.
0000005430 00000 н.
0000005566 00000 н.
0000005701 00000 п.
0000005837 00000 н.
0000005973 00000 п.
0000006140 00000 н.
0000006302 00000 н.
0000006437 00000 н.
0000006573 00000 н.
0000006709 00000 н.
0000006843 00000 н.
0000006978 00000 п.
0000007112 00000 н.
0000007247 00000 н.
0000007383 00000 п.
0000007519 00000 п.
0000007655 00000 н.
0000007828 00000 н.
0000008075 00000 н.
0000008525 00000 н.
0000009253 00000 п.
0000009980 00000 н.
0000010367 00000 п. 0000012583 00000 п.
0000012883 00000 п.
0000016598 00000 п.
0000020370 00000 п.
0000020770 00000 п.
0000021818 00000 п.
0000022961 00000 п.
0000023995 00000 п.
0000032488 00000 н.
0000033014 00000 п.
0000034215 00000 п.
0000034663 00000 п.
0000035221 00000 п.
0000035949 00000 п.
0000036219 00000 п.
0000040488 00000 н.
0000040946 00000 п.
0000045974 00000 п.
0000046280 00000 п.
0000047081 00000 п.
0000048188 00000 п.
0000048461 00000 п.
0000048803 00000 п.
0000048935 00000 п.
0000049292 00000 п.
0000049503 00000 п.
0000050122 00000 п.
0000050353 00000 п.
0000051533 00000 п.
0000051757 00000 п.
0000052059 00000 п.
0000052753 00000 п.
0000053750 00000 п.
0000054789 00000 п.
0000055837 00000 п.
0000057447 00000 п.
0000057507 00000 п.
0000057535 00000 п.
0000060234 00000 п.
0000060271 00000 п.
0000060337 00000 п.
0000060382 00000 п.
0000060712 00000 п.
0000063383 00000 п.
0000063420 00000 п.
0000063478 00000 п.
0000064237 00000 п.
0000064546 00000 п.
0000012583 00000 п.
0000012883 00000 п.
0000016598 00000 п.
0000020370 00000 п.
0000020770 00000 п.
0000021818 00000 п.
0000022961 00000 п.
0000023995 00000 п.
0000032488 00000 н.
0000033014 00000 п.
0000034215 00000 п.
0000034663 00000 п.
0000035221 00000 п.
0000035949 00000 п.
0000036219 00000 п.
0000040488 00000 н.
0000040946 00000 п.
0000045974 00000 п.
0000046280 00000 п.
0000047081 00000 п.
0000048188 00000 п.
0000048461 00000 п.
0000048803 00000 п.
0000048935 00000 п.
0000049292 00000 п.
0000049503 00000 п.
0000050122 00000 п.
0000050353 00000 п.
0000051533 00000 п.
0000051757 00000 п.
0000052059 00000 п.
0000052753 00000 п.
0000053750 00000 п.
0000054789 00000 п.
0000055837 00000 п.
0000057447 00000 п.
0000057507 00000 п.
0000057535 00000 п.
0000060234 00000 п.
0000060271 00000 п.
0000060337 00000 п.
0000060382 00000 п.
0000060712 00000 п.
0000063383 00000 п.
0000063420 00000 п.
0000063478 00000 п.
0000064237 00000 п.
0000064546 00000 п.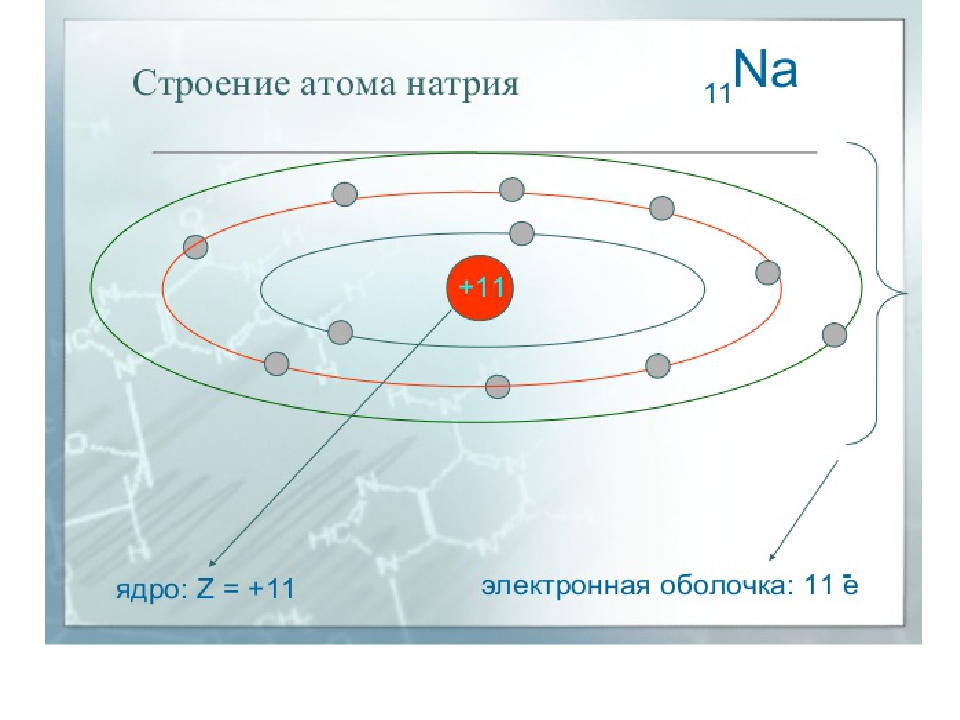 0000065607 00000 п.
0000073503 00000 п.
0000073690 00000 п.
0000073854 00000 п.
0000095115 00000 п.
0000095362 00000 п.
0000096545 00000 п.
0000097728 00000 п.
0000113265 00000 н.
0000113518 00000 н.
0000114705 00000 н.
0000114926 00000 н.
0000115004 00000 н.
0000115081 00000 н.
0000115155 00000 н.
0000123779 00000 п.
0000123998 00000 н.
0000124043 00000 н.
0000128533 00000 н.
0000128991 00000 н.
0000129378 00000 п.
0000168975 00000 н.
0000169118 00000 п.
0000195775 00000 н.
0000195965 00000 н.
0000196569 00000 н.
0000196624 00000 н.
0000196681 00000 н.
0000196839 00000 н.
0000196929 00000 н.
0000197025 00000 н.
0000197140 00000 н.
0000002616 00000 н.
трейлер
] / Назад 608815 >>
startxref
0
%% EOF
686 0 объект
> поток
hb“f`AX8
90DPF #
0000065607 00000 п.
0000073503 00000 п.
0000073690 00000 п.
0000073854 00000 п.
0000095115 00000 п.
0000095362 00000 п.
0000096545 00000 п.
0000097728 00000 п.
0000113265 00000 н.
0000113518 00000 н.
0000114705 00000 н.
0000114926 00000 н.
0000115004 00000 н.
0000115081 00000 н.
0000115155 00000 н.
0000123779 00000 п.
0000123998 00000 н.
0000124043 00000 н.
0000128533 00000 н.
0000128991 00000 н.
0000129378 00000 п.
0000168975 00000 н.
0000169118 00000 п.
0000195775 00000 н.
0000195965 00000 н.
0000196569 00000 н.
0000196624 00000 н.
0000196681 00000 н.
0000196839 00000 н.
0000196929 00000 н.
0000197025 00000 н.
0000197140 00000 н.
0000002616 00000 н.
трейлер
] / Назад 608815 >>
startxref
0
%% EOF
686 0 объект
> поток
hb“f`AX8
90DPF #
O {} mEn՜: 5 _z} sI% CʩF9 / J4.-ZέNW + {e [5 ۣ S ߈ s4ZzfU- + v + 8 ~ yqI6`i369 [t6J] @ aR2Ј $
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.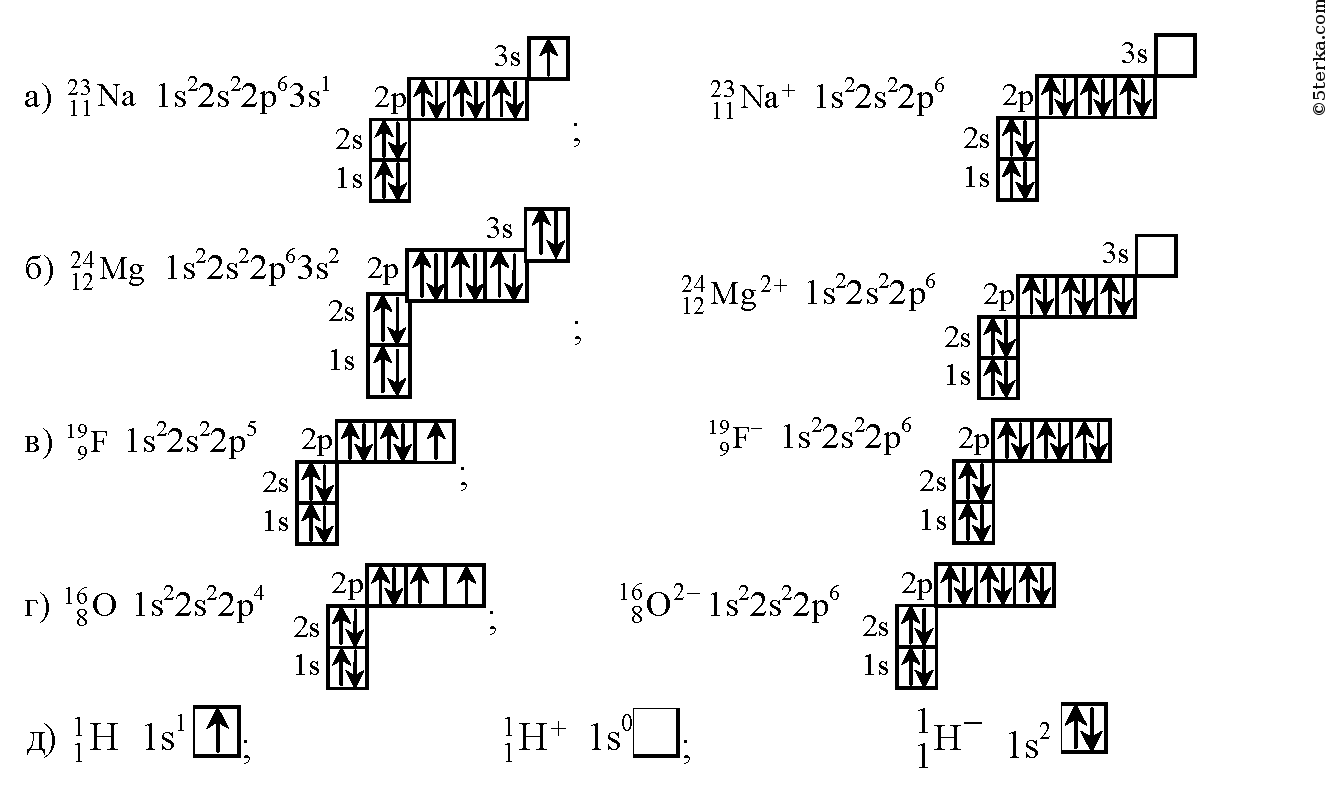 Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
% PDF-1.4
%
1 0 объект
> / ExtGState> / XObject> >>
/ Содержание 14 0 руб.
/ Группа>
/ Вкладки / S
/ StructParents 0
/ Родитель 15 0 R
/ Повернуть на 360
>>
эндобдж
2 0 obj
>
эндобдж
16 0 объект
>
эндобдж
17 0 объект
[250 0 0 0 0 0 0 0 0 0 0 0 0 0250 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 611 0 0 0 0 0 0 0 0 0 0 0 0 444 0 444 500
444 333 500 500 278 0 0 278 778 500 500 500 0 333 389 278 500]
эндобдж
3 0 obj
>
эндобдж
18 0 объект
>
эндобдж
19 0 объект
[278 0 0 0 0 889 0 0 333 333 0584 278 333 278 278 556 556 556 556 556 556
556 556 556 556 278 278 0584 0556 0 667 667 722 722 667 611 778 722 278
500 667 556 833 722 778 667 0 722 667 611 722 0 944 0 667 0 278 0 278 0 556
0 556 556 500 556 556 278 556 556 222 222 500 222 833 556 556 556 556 333
500 278 556 500 722 500 500 500 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0
0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 584]
эндобдж
4 0 obj
>
эндобдж
20 0 объект
>
эндобдж
21 0 объект
[278 0 0 0 0 0 0 0 333 333 0 0 278 0 278 0 556 556 556 556 556 556 556 556
556 556 0 0 0 0 0 0 0 722 722 722 722 667 611 778722 0 0 0 0 833 722 778
667778722 667 611 0 0 0 667 667 611 333 0 333 0 0 0 556 611 556 611 556
333 611 611 278 0 556 278 889 611 611 611 0 389 556 333 611 556 778 556 556
]
эндобдж
5 0 obj
>
эндобдж
22 0 объект
[24 0 R]
эндобдж
24 0 объект
>
эндобдж
25 0 объект
>
эндобдж
26 0 объект
>
эндобдж
28 0 объект
>
транслировать
x} | TE + 1 !! HnH` M (K # A7q! T: ĄE: 8y # n (oDǧA7 {} Ӝ: թ S FDaHd0arN ^ W}) C ڰ D ً O_B4 “kUMW_7FT> 2k \ el: ClƆ9
}}
. 1SL! A + DCh.? W. 搼 OHyMoǃ3×2> KʯLn
1SL! A + DCh.? W. 搼 OHyMoǃ3×2> KʯLn
| |
Периодическая таблица и модели уровней энергии | Глава 4: Периодическая таблица и связь
Познакомьте студентов с идеей о том, что электроны окружают ядро атома в областях, называемых энергетическими уровнями.
Повторите со студентами, что на втором уроке они сосредоточились на количестве протонов, нейтронов и электронов в атомах каждого элемента. В этом уроке они сосредоточатся на расположении электронов в каждом элементе.
Спроецировать изображение Поперечное сечение уровня энергии.
Объясните студентам, что электроны окружают ядро атома в трех измерениях, делая атомы сферическими. Они могут думать об электронах как о находящихся на разных энергетических уровнях, подобных концентрическим сферам вокруг ядра.Поскольку эти сферы очень сложно показать, уровни энергии обычно отображаются в двух измерениях.
Подробнее о моделях уровня энергии читайте в разделе «Информация о учителе».
Спроецировать изображение Атом кислорода.
Скажите студентам, что эта модель энергетического уровня представляет атом. Ядро представлено точкой в центре, которая содержит как протоны, так и нейтроны. Меньшие точки, окружающие ядро, представляют электроны на энергетических уровнях.Сообщите учащимся, что они узнают больше об электронах и уровнях энергии позже на этом уроке.
Попросите учащихся взглянуть на Периодическую таблицу элементов 1–20, которые они использовали в уроке 2, чтобы ответить на следующий вопрос:
- Можете ли вы определить, какой атом представляет эта модель?
- Если учащиеся не могут ответить на этот вопрос, укажите, что существует 8 электронов. Поскольку нейтральные атомы в периодической таблице имеют такое же количество электронов, что и протоны, у атома должно быть 8 протонов.Число протонов такое же, как и атомный номер, поэтому атом – это кислород.
Попросите группы работать вместе, чтобы разместить каждую карту с ее правильным атомом.
Покажите учащимся, что у вас есть 80 карточек (по 4 на каждый из первых 20 элементов). Прежде чем раздавать карточки, объясните, что каждая карточка содержит информацию об электронах и уровнях энергии первых 20 элементов таблицы Менделеева. Задача учеников – внимательно прочитать карточку, выяснить, какой элемент она описывает, и положить карточку в то место в комнате, где находится этот элемент.Напомните учащимся, что им нужно будет подсчитать электроны, чтобы идентифицировать каждый атом. Как только учащиеся поймут свое задание, раздайте карточки группам.
Обсудите размещение карт для двух или трех атомов.
После того, как все карты были размещены на 20 различных атомах, выберите два или три атома и проверьте, правильно ли были размещены карты. Этот обзор поможет укрепить представления о структуре атомов и поможет студентам определить количество протонов и электронов в каждом атоме.
Раздайте каждому ученику лист с заданием «Периодическая таблица уровней энергии». Эта таблица содержит модели уровней энергии для первых 20 элементов. Электроны включены только для атомов в начале и в конце каждого периода.
Спроецируйте Периодическую таблицу уровней энергии и обсудите расположение электронов по мере того, как учащиеся заполняют свой рабочий лист.
Спроецировать изображение Периодическая таблица уровней энергии.
Спроецированное изображение содержит все электроны для элементов 1–20. Однако периодическая таблица в таблице активности содержит электроны только для элементов в начале и в конце каждого периода. Обсудите расположение электронов на энергетических уровнях этих атомов и попросите студентов заполнить электроны для других атомов.
Примечание. На диаграммах уровней энергии электроны равномерно распределены по уровням. В некоторых книгах они показаны таким образом, а в других – парами.Спаривание электронов означает, что электроны находятся на отдельных орбиталях в пределах каждого энергетического уровня. На уровне средней школы учащимся не обязательно изучать электронные орбитали. Эта информация предлагается для того, чтобы вам было понятнее, почему электроны часто показаны парами на диаграммах уровней энергии и на точечных диаграммах, используемых в качестве дополнения в конце этой главы. Орбиталь определяет область на уровне энергии, где высока вероятность обнаружения пары электронов.На каждой орбитали может быть максимум два электрона. Вот почему электроны часто изображаются парами на уровне энергии.
Скажите студентам, что строки в периодической таблице называются периодами.
Период 1
- Водород
- Объясните, что водород имеет 1 протон и 1 электрон. 1 электрон находится на первом энергетическом уровне.
- Гелий
- Объясните, что гелий имеет 2 протона и 2 электрона.2 электрона находятся на первом энергетическом уровне.
Период 2
- Литий
- Объясните, что у лития 3 протона и 3 электрона. На первом энергетическом уровне 2 электрона, а на втором – 1 электрон. Объясните, что первый энергетический уровень может иметь только 2 электрона, поэтому следующий электрон в литии находится на следующем (втором) уровне.
- Неон
- Объясните, что у неона 10 протонов и 10 электронов.На первом уровне энергии 2 электрона, а на втором – 8 электронов.
- Бериллий-фтор
- Помогите учащимся указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 2.
Период 3
- Натрий
- Объясните, что у натрия 11 протонов и 11 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 1 электрон на третьем уровне энергии.Объясните, что второй энергетический уровень может иметь только 8 электронов, поэтому следующий электрон в натрия должен находиться на следующем (третьем) уровне.
- Аргон
- Объясните, что аргон имеет 18 протонов и 18 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне и 8 электронов на третьем уровне энергии. Попросите учащихся заполнить модель энергетического уровня аргона в своей периодической таблице.
- Магний-хлор
- Помогите учащимся указать правильное количество электронов на энергетических уровнях для остальных атомов в периоде 3.
Период 4
- Калий
- Объясните, что у калия 19 протонов и 19 электронов. Есть 2 электрона на первом уровне энергии, 8 электронов на втором уровне, 8 электронов на третьем уровне энергии и 1 на четвертом уровне энергии. Объясните: после того, как на третьем энергетическом уровне будет 8 электронов, следующий электрон перейдет на четвертый уровень.
- Кальций
- Помогите ученикам указать правильное количество электронов в энергетических уровнях кальция.
Примечание: учащиеся могут задаться вопросом, почему энергетический уровень может удерживать только определенное количество электронов. Ответ на этот вопрос выходит далеко за рамки химического подразделения средней школы. Он включает в себя представление об электронах как о трехмерных волнах и о том, как они будут взаимодействовать друг с другом и с ядром.
Попросите учащихся найти закономерности в строках и столбцах первых 20 элементов периодической таблицы.
Продолжайте проецировать изображение Периодическая таблица уровней энергии для элементов 1–20 и попросите учащихся просмотреть свои листы действий, чтобы найти закономерности в количестве электронов на каждом уровне энергии.
Попросите учащихся взглянуть на точки (пересекающиеся строки).
Количество уровней энергии за каждый период
- Атомы в первом периоде имеют электроны на одном энергетическом уровне.
- Атомы во втором периоде имеют электроны на двух уровнях энергии.
- Атомы в третьем периоде имеют электроны на трех уровнях энергии.
- Атомы в четвертом периоде имеют электроны на 4 уровнях энергии.
Как электроны заполняют энергетические уровни
- Первый энергетический уровень = 1, 2
- Второй энергетический уровень = 1, 2, 3,… 8
- Третий энергетический уровень = 1, 2, 3,… 8
- Четвертый энергетический уровень = 1, 2
Подробнее о таблице Менделеева читайте в разделе «Информация об учителе».
Определенное количество электронов переходит на уровень до того, как на следующем уровне могут быть электроны.После того, как первый энергетический уровень содержит 2 электрона (гелий), следующие электроны переходят на второй энергетический уровень. После того, как второй энергетический уровень имеет 8 электронов (неон), следующие электроны переходят на третий энергетический уровень. После того, как на третьем энергетическом уровне будет 8 электронов (аргон), следующие 2 электрона переходят на четвертый энергетический уровень.
Примечание. Третий энергетический уровень может фактически удерживать до 18 электронов, поэтому он не заполняется, когда на нем 8 электронов. Но когда третий уровень содержит 8 электронов, следующие 2 электрона переходят на четвертый уровень.Затем, хотите верьте, хотите нет, еще 10 электронов продолжают заполнять остаток третьего уровня. Студентам не обязательно это знать.
Попросите учащихся посмотреть на группы (столбцы вниз).
Скажите студентам, что вертикальные столбцы в периодической таблице называются группами или семьями.
Попросите учащихся сравнить количество электронов на внешнем энергетическом уровне атомов в группе. Студенты должны понимать, что каждый атом в группе имеет одинаковое количество электронов на внешнем энергетическом уровне.Например, водород, литий, натрий и калий имеют 1 электрон на внешнем энергетическом уровне. Сообщите учащимся, что эти электроны на внешнем энергетическом уровне называются валентными электронами. Это электроны, ответственные за связывание, которые студенты изучат на следующем уроке.
Сравните химическую реакцию различных элементов и соотнесите это с их расположением в таблице Менделеева.
Скажите студентам, что атомы в периодической таблице в одном столбце, называемом группой, обладают определенными характеристиками и могут реагировать аналогичным образом.
Спроецировать видео «Натрий в воде и калий в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_water
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potasium_in_water
Студенты увидят, что, хотя калий реагирует более энергично, чем натрий, реакции аналогичны. Попросите учащихся взглянуть на периодическую таблицу, чтобы увидеть, где находятся натрий и калий по отношению друг к другу.
Спроецировать видео «Кальций в воде».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#calcium_in_water
Студенты увидят, что эта реакция отличается от реакции натрия и калия. Попросите их найти кальций в периодической таблице и указать, что он находится в другой группе, чем натрий и калий.
Проецировать видео «Натрий в кислоте и калий в кислоте».
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#sodium_in_acid
www.middleschoolchemistry.com/multimedia/chapter4/lesson3#potassium_in_acid
Покажите, что натрий реагирует с кислотой, а затем калий реагирует с кислотой. HCl – это соляная кислота. HNO3 – это азотная кислота. Каждая кислота используется в двух разных концентрациях. Убедитесь, что учащиеся понимают, что натрий и калий реагируют аналогичным образом, хотя калий реагирует более энергично.
Спроецировать видео «Кальций в кислоте».
www.middleschoolchemistry.com//multimedia/chapter4/lesson3#calcium_in_acid
Укажите, что кальций реагирует иначе, чем натрий и калий.



 Внезапно возникший свет уносится прочь от электрона, атома и светодиода, чтобы раскрасить наш мир.
Внезапно возникший свет уносится прочь от электрона, атома и светодиода, чтобы раскрасить наш мир. Кроме того, электрон может перемещаться только по очень ограниченным орбиталям внутри атома; он должен оказаться на орбите, где длина волны, используемая сейчас, находится “в фазе” сама с собой.Эти два ограничения ограничивают качество квантов энергии, выделяемых электроном, и, следовательно, природу фотона света, который устремляется прочь от светодиода.
Кроме того, электрон может перемещаться только по очень ограниченным орбиталям внутри атома; он должен оказаться на орбите, где длина волны, используемая сейчас, находится “в фазе” сама с собой.Эти два ограничения ограничивают качество квантов энергии, выделяемых электроном, и, следовательно, природу фотона света, который устремляется прочь от светодиода.