Селен, свойства атома, химические и физические свойства
Селен, свойства атома, химические и физические свойства.
Поделиться в:
Se 34 Селен
78,96(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
Селен — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 34. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), четвертом периоде периодической системы.
Атом и молекула селена. Формула селена. Строение атома селена
Изотопы и модификации селена
Свойства селена (таблица): температура, плотность, давление и пр.
Физические свойства селена
Химические свойства селена. Взаимодействие селена. Химические реакции с селеном
Получение селена
Применение селена
Таблица химических элементов Д.И. Менделеева
Атом и молекула селена.
 Формула селена. Строение атома селена:
Формула селена. Строение атома селена:Селен (лат. Selenium, от греч. σελήνη – «Луна») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Se и атомным номером 34. Расположен в 16-й группе (по старой классификации – главной подгруппе шестой группы), четвертом периоде периодической системы.
Селен – неметалл. Относится к группе халькогенов. Редкий, рассеянный элемент.
Селен обозначается символом Se.
Как простое вещество селен при нормальных условиях представляет собой хрупкое, блестящее на изломе твердое вещество серого либо различных оттенков красного или черного цветов.
Молекула селена одноатомна.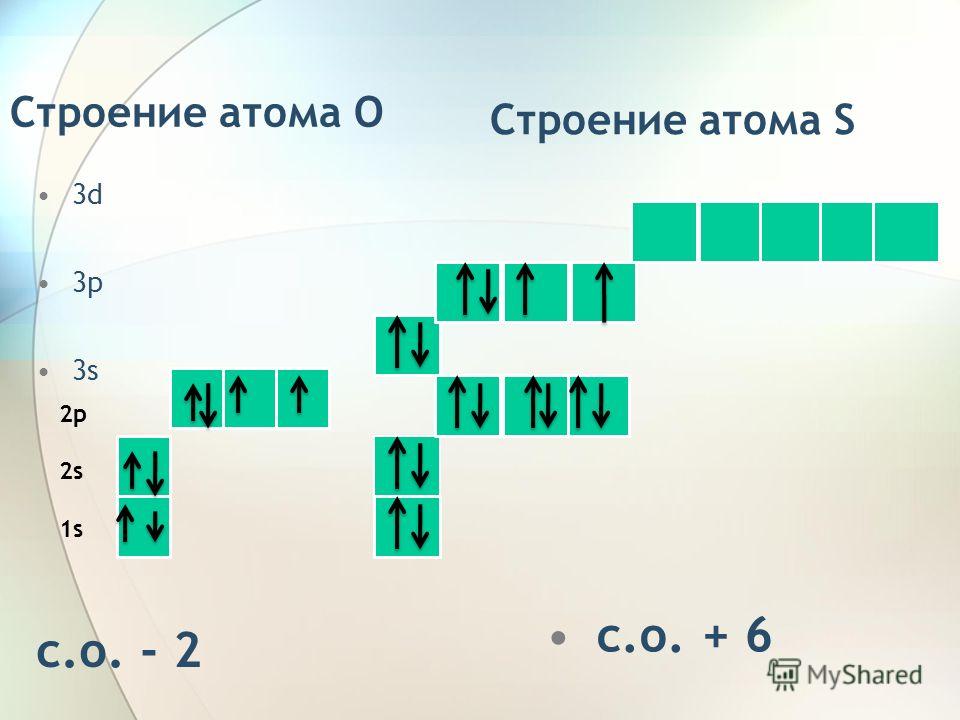
Химическая формула селена Se.
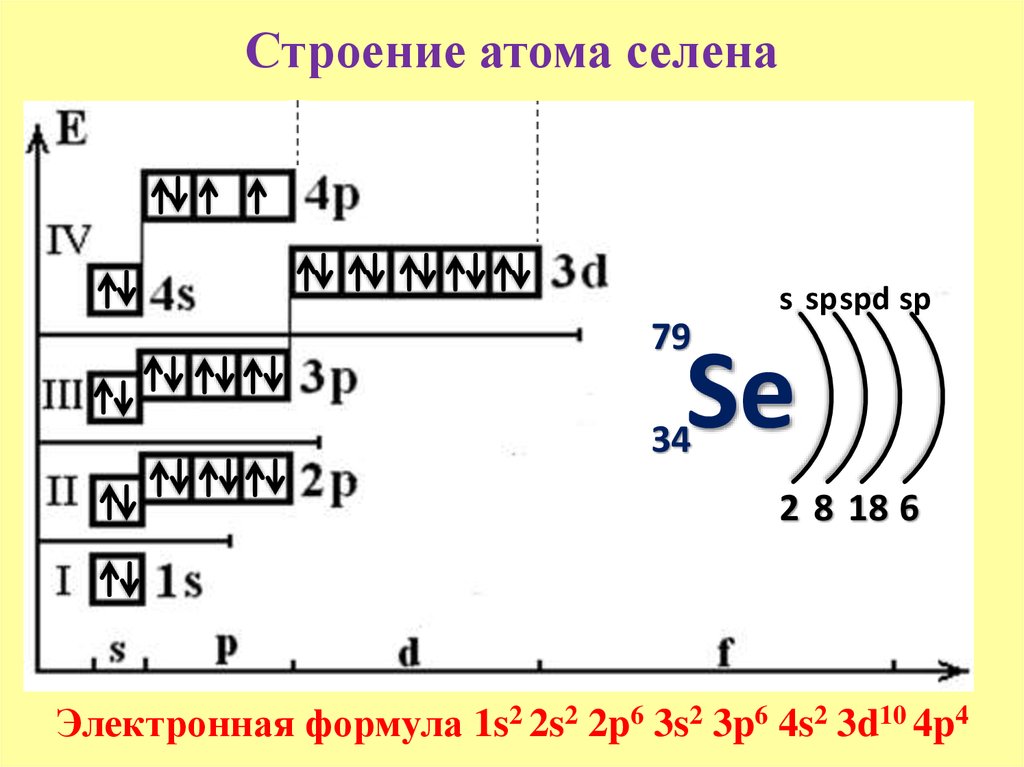
Электронная конфигурация атома селена 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4. Потенциал ионизации (первый электрон) атома селена равен 940,96 кДж/моль (9,752392(15) эВ).
Строение атома селена. Атом селена состоит из положительно заряженного ядра (+34), вокруг которого по четырем оболочкам движутся 34 электрона. При этом 28 электронов находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку селен расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома селена на 4s-орбитали находятся два спаренных электрона, на 4p-орбитали – два спаренных и два неспаренных электрона. В свою очередь ядро атома селена состоит из 34 протонов и 45 нейтронов. Селен относится к элементам p-семейства.
В свою очередь ядро атома селена состоит из 34 протонов и 45 нейтронов. Селен относится к элементам p-семейства.
Радиус атома селена (вычисленный) составляет 103 пм.
Атомная масса атома селена составляет 78,96(3) а. е. м.
Селен, свойства атома, химические и физические свойства
Изотопы и модификации селена:
Свойства селена (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения* | |
| 101 | Название | Селен |
| 102 | Прежнее название | |
| 103 | Латинское название | Selenium |
| 104 | Английское название | Selenium |
| 105 | Символ | Se |
| 106 | Атомный номер (номер в таблице) | 34 |
| 107 | Тип | Неметалл |
| 108 | Группа | Халькоген |
| 109 | Открыт | Йёнс Якоб Берцелиус, Иоганн Готлиб Ган, Швеция, 1817 г.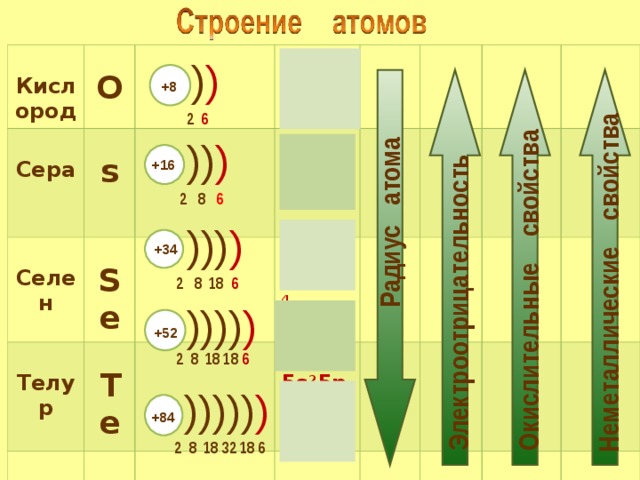 |
| 110 | Год открытия | 1817 г. |
| 111 | Внешний вид и пр. | Хрупкий, блестящий на изломе неметалл серого либо различных оттенков красного или черного цветов |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | Несколько аллотропных модификаций селена, в т.ч.: – γ-селен, серый кристаллический селен, металлический селен (наиболее устойчивая форма) |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 5,0·10-6 % |
| 120 | Содержание в морях и океанах (по массе) | 4,5·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 3,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,0013 % |
| Содержание в организме человека (по массе) | 5,0·10-6 % | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 78,96(3) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 |
| 203 | Электронная оболочка | K2 L8 M18 N6 O0 P0 Q0 R0
|
| 204 | 103 пм | |
| 205 | Эмпирический радиус атома* | 115 пм |
| 206 | Ковалентный радиус* | 120 пм |
| 207 | Радиус иона (кристаллический) | Se2- 184 (6) пм, Se4+ 64 (6) пм, Se6+ 56 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 190 пм |
| 209 | Электроны, Протоны, Нейтроны | 34 электрона, 34 протона, 45 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 16-ая группа (по старой классификации – главная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, IV, VI |
| 303 | Электроотрицательность | 2,55 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 940,96 кДж/моль (9,752392(15) эВ) |
| 305 | Электродный потенциал | Se + 2e– → Se2-, Eo = -0,92 В |
| 306 | Энергия сродства атома к электрону | 194,9587(2) кДж/моль (2,0206047(12) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 4,81 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 3,99 г/см3 (при температуре плавления 221 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 221 °C (494 K, 430 °F) |
| 403 | Температура кипения* | 685 °C (958 K, 1265 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 6,69 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 95,48 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 25,363 Дж/(K·моль) |
| 411 | Молярный объём | 16,3851 см³/моль |
| 412 | Теплопроводность | 0,52 Вт/(м·К) (при стандартных условиях), 0,52 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | γ-селен (серый кристаллический селен, металлический селен)
|
| 512 | Структура решётки | Гексагональная |
| 513 | Параметры решётки | a = 4,364 Å, c = 4,959 Å |
| Отношение c/a | 1,136 | |
| 515 | Температура Дебая | 90 K |
| 516 | Название пространственной группы симметрии | P121/c1 |
| 517 | Номер пространственной группы симметрии | 14 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7782-49-2 |
Примечание:
100* Данные в таблице приводятся применительно к серому селену, если не указано иное.
205* Эмпирический радиус атома селена согласно [1] и [3] составляет 120 пм и 140 пм соответственно.
206* Ковалентный радиус селена согласно [1] и [3] составляет 120±4 пм и 116 пм соответственно.
401* Плотность селена согласно [3] и [4] составляет 4,79 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления селена согласно [3] и [4] составляет 216,85 °С (490 K, 422,33 °F) и 217 °C (490,15 K, 422,6 °F) соответственно.
403* Температура кипения селена согласно [3] составляет 684,95 °С (958,1 K, 1264,91 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) селена согласно [3] и [4] составляет 5,23 кДж/моль и 6,7 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) селена согласно [3] и [4] составляет 59,7 кДж/моль и 29 кДж/моль соответственно.
410* Молярная теплоёмкость селена согласно [3] составляет 25,4 Дж/(K·моль).
Физические свойства селена:
Химические свойства селена. Взаимодействие селена. Химические реакции с селеном:
Получение селена:
Применение селена:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25.
 Марганец
Марганец - 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59.
 Празеодим
Празеодим - 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92.
 Уран
Уран - 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Selenium
- https://de.
 wikipedia.org/wiki/Selen
wikipedia.org/wiki/Selen - https://ru.wikipedia.org/wiki/Селен
- http://chemister.ru/Database/properties.php?dbid=1&id=244
- https://chemicalstudy.ru/selen-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
селен атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле селена
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 296
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов,
или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.996
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65. 38
38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178.49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195. 084
084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree. ru • Электронный учебник
ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Селен Информация об элементе: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура селена
Структура твердого состояния селена Простая моноклинная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки Константы решетки (a, b и c)
| A | B | C |
|---|---|---|
| 905,4 PM | 908,3 PM | 110. 1 PM 1 PM |
| alpha | beta | gamma |
|---|---|---|
| π/2 | 1.58493 | π/2 |
The positions of the atoms inside the unit cell are described by the set of atomic позиции ( х i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными).
Selenium Atomic and Orbital Properties
Selenium atoms have 34 electrons and the electronic shell structure is [2, 8, 18, 6] с символом атомного термина (квантовые числа) 3 P 2 .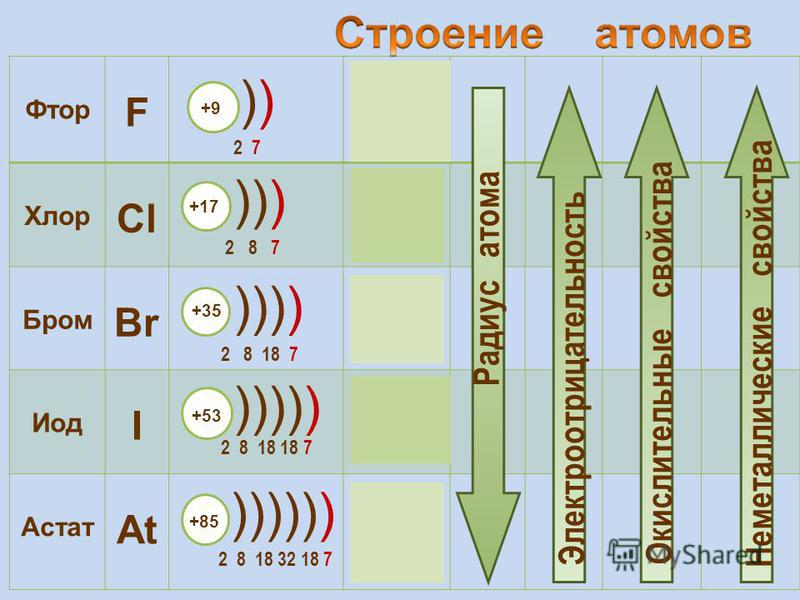
| Атомный номер | 34 | |
| Число электронов (бесплатно) | 34 | |
| Number of Protons | 34 | |
| Mass Number | 79 | |
| Number of Neutrons | 45 | |
| Shell structure (Electrons per energy level) | 2, 8, 18, 6 | |
| Electron Configuration | [Ar] 3d10 4s2 4p4 | |
| Valence Electrons | 4s2 4p4 | |
| Valence (Valency) | 6 | |
| Основные степени окисления | -2, 2, 4, 6 | |
| Степени окисления | -2, -1, 0, 1, 2, 3, 4, 5, 6 Atomic 90 | Symbol (Quantum numbers)3 P 2 |
Atomic Model of Selenium – Electrons на уровне энергии
Селен Сокращенная электронная конфигурация основного состояния нейтрального атома селена: [Ar] 3d10 4s2 4p4. Часть конфигурации селена, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4s2 4p4, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации селена, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4s2 4p4, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального селена
Полная электронная конфигурация основного состояния атома селена. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
Электроны заполняются атомными орбиталями в порядке, определяемом принципом Ауфбау, принципом запрета Паули и правилом Хунда.
 …
…Атомная структура селена
Атомный радиус селена составляет 103 пм, а его ковалентный радиус равен 116 пм.
| Расчетный атомный радиус | 103 пм (1,03 Å) |
| Атомный радиус Эмпирический | 115 вечера (1,15 Å) |
| Атом | 16,385 CM3/Мол |
| 16,385 CM3/Мол | |
| COVEL COVEL COVLE Waals Radius | 190 pm |
| Neutron Cross Section | 11.7 |
| Neutron Mass Absorption | 0.0056 |
Atomic Spectrum of Selenium
Селен Химические свойства: Энергия ионизации селена и сродство к электрону
Сродство к электрону селена составляет 195 кДж/моль.
| Valence | 6 |
| Electronegativity | 2.55 |
| ElectronAffinity | 195 kJ/mol |
Ionization Energy of Selenium
Refer to table below for Ionization energies of Selenium
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 941 |
| 2nd | 2045 |
| 3rd | 2973.7 |
| 4th | 4144 |
| 5th | 6590 |
| 6th | 7880 |
| 7th | 14990 |
Selenium.0004 Refer to below table for Selenium Physical Properties
| Density | 4.819 g/cm3(when liquid at m.p density is $3.99 g/cm3) |
| Molar Volume | 16. 385 cm3/mol 385 cm3/mol |
Elastic Properties
| Young Modulus | 10 |
| Shear Modulus | 3.7 GPa |
| Bulk Modulus | 8.3 GPa |
| Poisson Ratio | 0.33 |
Hardness of Selenium – Tests to Measure of Hardness of Element
| Mohs Hardness | 2 MPa |
| Vickers Hardness | – |
| Brinell Hardness | 736 МПа |
Электрические свойства селена
Селен является проводником электричества. Обратитесь к таблице ниже для получения информации об электрических свойствах Selenium 9.0007
| Electrical Conductivity | – |
| Resistivity | – |
| Superconducting Point | – |
Selenium Heat and Conduction Properties
| Thermal Conductivity | 0. 52 W/( м K) 52 W/( м K) |
| Тепловое расширение | – |
Магнитные свойства селена
| Магнитный тип | Diamagnetic |
| Curie Point | – |
| Магнитная восприимчивость | -4E -9 M3/KG |
| -4E -9 M3/KG | |
| Объемная магнитная восприимчивость | -0,0000193 |
Оптические свойства селена
| Показатель преломления | 9 85 1,00024 |
Акустические свойства Selenium
| Скорость звука | 3350 м/с |
Selenium Thermalies – энтри и термодийные
. Точка
Enthalpies of Selenium
| Heat of Fusion | 5.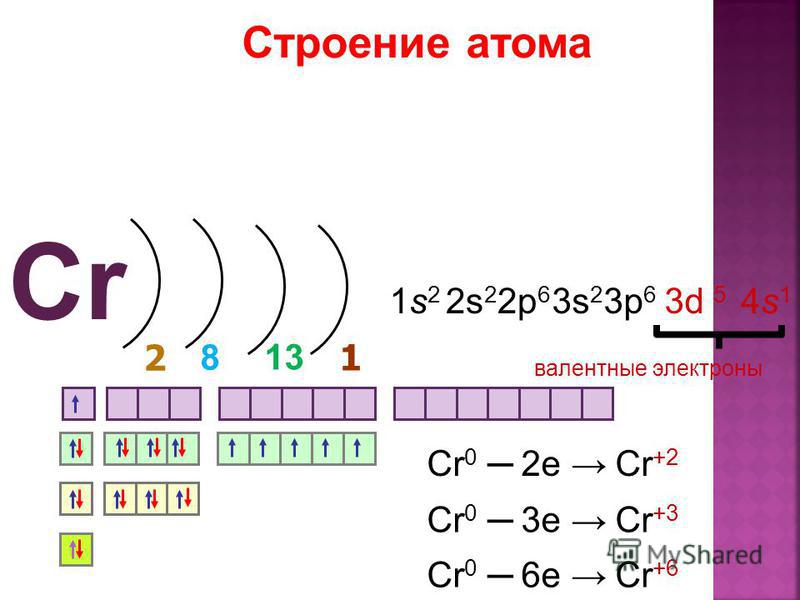 4 kJ/mol 4 kJ/mol |
| Heat of Vaporization | 26 kJ/mol |
| Теплота сгорания | – |
Изотопы селена – ядерные свойства селена
Селен состоит из 30 изотопов, содержащих от 65 до 94 нуклонов. Селен имеет 5 стабильных естественных изотопов.
Изотопы селена – Встречающиеся в природе стабильные изотопы: 74Se, 76Se, 77Se, 78Se, 80Se.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 65Se | 34 | 31 | 65 | Synthetic | |||||||||||||||||||||||
| 66Se | 34 | 32 | 66 | Synthetic | |||||||||||||||||||||||
| 67Se | 34 | 33 | 67 | Synthetic | |||||||||||||||||||||||
| 68Se | 34 | 34 | 68 | Synthetic | |||||||||||||||||||||||
| 69Se | 34 | 35 | 69 | Синтетический | |||||||||||||||||||||||
| 70SE | 34 | 36 | 70 | 70 | 70 | 70 | 70 | 70 | 70 | 70 | 0626|||||||||||||||||
| 71Se | 34 | 37 | 71 | Synthetic | |||||||||||||||||||||||
| 72Se | 34 | 38 | 72 | Synthetic | |||||||||||||||||||||||
| 73Se | 34 | 39 | 73 | Синтетический | |||||||||||||||||||||||
| 74SE | 34 | 40 | 74 | 0,89% | 7 | 0,89% | 77. | % | 777899% | 77. | % | 7789% | .0016 | 75Se | 34 | 41 | 75 | Synthetic | |||||||||
| 76Se | 34 | 42 | 76 | 9.37% | Stable | N/A | |||||||||||||||||||||
| 77Se | 34 | 43 | 77 | 7.63% | Stable | N/A | |||||||||||||||||||||
| 78Se | 34 | 44 | 78 | 23.77% | Stable | N/A | |||||||||||||||||||||
| 79Se | 34 | 45 | 79 | Synthetic | Stable | ||||||||||||||||||||||
| 80Se | 34 | 46 | 80 | 49.61% | Stable | N/ A | |||||||||||||||||||||
| 81Se | 34 | 47 | 81 | Synthetic | |||||||||||||||||||||||
| 82Se | 34 | 48 | 82 | 8. 73% 73% | Stable | N/A | |||||||||||||||||||||
| 83Se | 34 | 49 | 83 | Synthetic | |||||||||||||||||||||||
| 84Se | 34 | 50 | 84 | Synthetic | |||||||||||||||||||||||
| 85Se | 34 | 51 | 85 | Synthetic | |||||||||||||||||||||||
| 86Se | 34 | 52 | 86 | Synthetic | |||||||||||||||||||||||
| 87Se | 34 | 53 | 87 | Synthetic | |||||||||||||||||||||||
| 88Se | 34 | 54 | 88 | Synthetic | |||||||||||||||||||||||
| 89Se | 34 | 55 | 89 | Synthetic | |||||||||||||||||||||||
| 90Se | 34 | 56 | 90 | Synthetic | |||||||||||||||||||||||
| 91Se | 34 | 57 | 91 | Synthetic | |||||||||||||||||||||||
| 92Se | 34 | 58 | 92 | Synthetic | |||||||||||||||||||||||
| 93Se | 34 | 59 | 93 | Synthetic | |||||||||||||||||||||||
| 94Se | 34 | 60 | 94 | Синтетический |
Свойства, Использование Атомный номер и недостатки0001
Селен — тип химического элемента, имеющего атомный номер 34 в Периодической таблице элементов.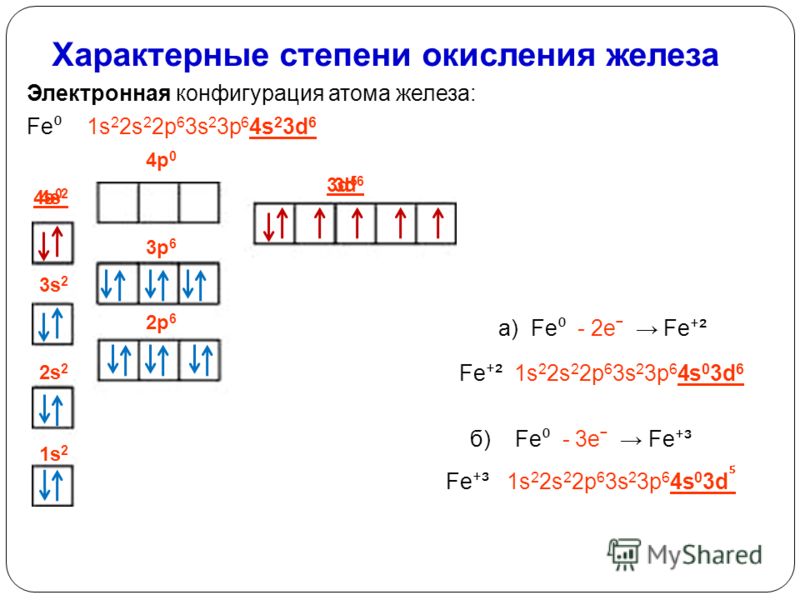 Селен находится в четвертом периоде шестой группы главной (А) подгруппы Периодической таблицы. Селен является одним из важных элементов для некоторых видов, в том числе человека. Человеческие тела содержат около 14 миллиграммов клеток, и каждая клетка человеческого тела состоит из более чем миллиона атомов селена. Недостаточное количество селена может вызвать проблемы со здоровьем у человека, но слишком большое количество также очень опасно. Избыточное количество селена нарушит развитие эмбриона или плода.
Селен находится в четвертом периоде шестой группы главной (А) подгруппы Периодической таблицы. Селен является одним из важных элементов для некоторых видов, в том числе человека. Человеческие тела содержат около 14 миллиграммов клеток, и каждая клетка человеческого тела состоит из более чем миллиона атомов селена. Недостаточное количество селена может вызвать проблемы со здоровьем у человека, но слишком большое количество также очень опасно. Избыточное количество селена нарушит развитие эмбриона или плода.
Селен — это химический элемент, который находится в 16 группе и 4 периоде в периодической таблице. Символ элемента селена — Se. Это неметаллический элемент с атомным номером 34. Он проявляет такие же свойства, как сера, теллур и мышьяк. Сера находится выше селена, а теллур ниже селена в 16 -й -й группе периодической таблицы. Мышьяк находится слева от селена в периоде 4 и 15 -й группа. Так как он находится в группе 16 th , то это p-блочный элемент. Из-за его различных свойств иногда его также считают металлоидом.
Из-за его различных свойств иногда его также считают металлоидом.
Селен был открыт и выделен шведскими химиками Йонсом Якобом Берцелиусом и Иоганном Готлибом Ганом в 1817 году. Слово селен происходит от греческого слова «селена», что означает луна. Он редко встречается в виде чистой руды или в чистом виде. Обычно встречается в сульфидных рудах металлов. Для коммерческого использования селен в основном производится как побочный продукт переработки сульфидных руд металлов.
Селен встречается в виде красных, серых и черных аллотропов. Его 7 изотопов доступны в природе. Помимо этого, у него также есть много синтетических изотопов, хотя все его синтетические изотопы нестабильны по своей природе. Из семи встречающихся в природе изотопов пять стабильны, а два нестабильны.
Электронная конфигурация селена
Атомы селена имеют положительно заряженное ядро, внутри которого находятся 34 протона и 45 нейтронов, и эти 34 электрона движутся по трем орбитам. Электронная конфигурация селена может быть определена как:
Электронная конфигурация селена может быть определена как:
SE – 12 2 S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 4
9103 ATTATION OT ELTATE Se – [Ar]3d 10 4s 2 4p 4Атомы селена и Br +1 , Kr +2 имеют одинаковую электронную конфигурацию.
Порядок заполнения оболочки атома селена электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Здесь на s-подуровне может находиться до 2 электронов, на s-уровне до 6 электронов, на d-уровне до 10 электронов и на f-уровне до 14 электронов.
Атомное количество селена составляет 34. его электронная конфигурация – 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 4 10 4S 2 4P 4 10 4S 2 4. 4 10 4S 2 4. 4 10 4S 2 4. 4 4S 2 4 0100 или может быть записано как:
4 10 4S 2 4. 4 10 4S 2 4. 4 4S 2 4 0100 или может быть записано как:
Ar 3d 10 4s 2 4p 4 . Он имеет 2 электрона в K-оболочке, 8 электронов в L-оболочке, 18 электронов в M-оболочке и 6 электронов в самой внешней оболочке.
Свойства селена
Это тип неметаллического элемента с атомным номером 34.
Атомная масса селена составляет 78,96.
Селен легко смешивается с различными металлами и неметаллами непосредственно или с помощью водного раствора.
Температура плавления селена 494К.
Температура кипения селена 958К.

Плотность селена 4,81 г/см3.
Физические и химические свойства селена
Ниже перечислены физические и химические свойства селена:
Он находится в твердом состоянии при температуре 20 ℃.
Относительный атомный вес селена составляет 78,96.
Температура плавления 221 ℃.
Температура кипения селена 685 ℃.
Имеет гексагональную кристаллическую структуру.
Плотность 4,809 г см -3 .
Образует сильнокислотный оксид.

По шкале Полинга его электроотрицательность равна 2,55
Его кристаллическая структура гексагональная.
Имеет много изотопов. Его 5 изотопов стабильны: 74 Se, 76 Se, 77 Se, 78 Se, 80 Se. хотя его ключевой изотоп – 80 Se.
Образует несколько изотопов.
Оптические свойства:
Селен проводит некоторое количество электричества. Таким образом, это полупроводник. Селен также является фотопроводником. Он может преобразовать энергию света в электрическую энергию. В исследованиях было обнаружено, что его проводимость увеличивается в присутствии света, что означает, что его фотопроводимость увеличивается с увеличением интенсивности света.
Использование селена
Селен используется в различных областях, в основном благодаря своим свойствам, таким как фотопроводимость, полупроводник электричества и т. д. Некоторые из его применений перечислены ниже –
Он широко используется в производстве стекла и пигментации. Это основные виды коммерческого использования селена в современном мире.
Используется в фотоэлементах, так как является фотопроводником.
В прошлом селен доминировал на рынке электроники, поскольку он является полупроводником, но в настоящее время кремний почти заменил селен.
Используется в флуоресцентных квантовых точках и устройствах защиты от перенапряжений.
Небольшое количество солей селена необходимо для правильного функционирования клеток многих организмов.

Входит в состав детских смесей.
Является компонентом многих ферментов, таких как ферменты тиоредоксинредуктазы, дейодиназы.
Диоксид селена используется в электролизе марганца.
Используется для изготовления сплавов. Например, в латуни селен используется вместо свинца, который более токсичен, чем селен. Он также используется в медных сплавах.
Используется в батареях Li-Se.
Используется в тонкопленочных солнечных элементах из селенида меди индия галлия.
Используется в плоскопанельных рентгеновских детекторах.

Селенорганические соединения используются при вулканизации каучука.
Используется в фотокопировальных машинах.
Селенид цинка используется в синих светодиодах.
Селен-75 используется в промышленной радиологии в качестве источника гамма-излучения.
В настоящее время соединение селена (сульфид селена) широко используется для лечения перхоти. Он работает как противогрибковое средство.
Элемент селена используется для изготовления копировальных аппаратов и лазерных принтеров.
Он также используется для улучшения качества меди и стали, которые дублятся за счет применения селенистой кислоты.

Из-за своих полупроводниковых свойств селен также используется в производстве солнечных батарей и квантовых точек.
Селен также используется для получения красного кадмия, красителя для стекла и пластмасс.
Недостатки селена
Селен является важным микроэлементом, но его высокие концентрации вредны для окружающей среды. Селен является токсичным элементом, и его высокие концентрации вредны не только для окружающей среды, но и для здоровья человека. Это влияет и на нашу экосистему. Высокая концентрация селена в рыбе может вызвать отек жабр и кровообращение в жабрах. Селен может вызвать катаракту, повреждение тканей печени, проблемы с дыханием и т. д.
Чрезмерное воздействие селена может вызвать бронхит, астму, рвоту, дисфункцию легких, диарею, боль в животе, одышку и в тяжелых случаях смерть.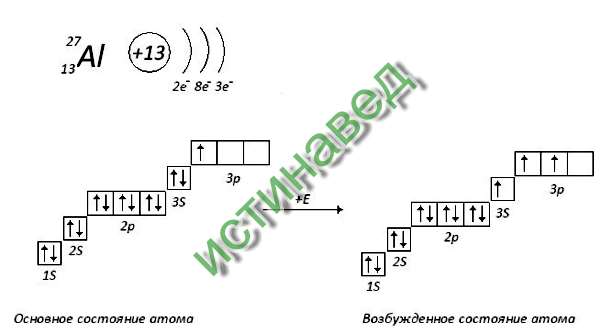
Обычно необходимое или необходимое количество селена потребляется животными и людьми с пищей, но большее количество селена потребляется ими за счет его накопления в окружающей среде. Селен попадает в окружающую среду в виде диоксида селена при сжигании угля и нефти.
Высокие концентрации селена могут вызывать нарушения репродуктивной функции, дефекты у младенцев. Хотя его дефицит также может вызвать множество неблагоприятных последствий для здоровья. Дефицит селена может вызвать болезнь Кашина-Бека, стресс, снижение функции головного мозга, поражение белых мышц у жвачных животных, дисфункцию щитовидной железы и т. д. Хотя после исследований было сказано, что все эти последствия дефицита селена, как правило, сопровождаются дефицитом других витамины или другие заболевания.
Селен в некоторой степени безопасен, если его принимаемые дозы составляют менее 400 мкг в день, но селен становится небезопасным, если принимать высокие дозы в течение длительного времени.

Дозы селена выше 400 мкг в день повышают риск развития токсичности селена.
Более низкие дозы селена в течение длительного времени могут увеличить риск развития диабета.
Селен также вызывает дискомфорт в желудке, головную боль и сыпь.
Высокие дозы селена могут даже вызвать выпадение волос, усталость, тошноту, рвоту и потерю веса.
Чрезвычайно высокие дозы селена могут привести к отказу органов и смерти.
Селена: Резюме в табличной форме
Selenium | |
SIMBOL 9288 | |
SIMBOL 9288 | |
Jons Jacob Berzelius and isolated by Johann Gottlieb Gahn | |
Atomic number | 34 |
Relative atomic weight | 78. |
Crystal Structure | Шестиугольный |
Состояние при 20℃ | Твердый |
| 3 Температура плавления0007 | 221℃ |
Boiling point | 685℃ |
Period | 4 th |
Group | 16 th |
Блок | p |
Электронная конфигурация | 9 9 1 0 2 9 0 9 0 1 0 2 9 5 30099 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 or|
Основные свойства | Полупроводник и фотопроводник |
Основное использование | . |

 Марганец
Марганец Празеодим
Празеодим Уран
Уран wikipedia.org/wiki/Selen
wikipedia.org/wiki/Selen



 96
96