Титан
| Титан | |
|---|---|
| Атомный номер | 22 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
47,88 а. е. м. (г/моль) |
| Радиус атома | 147 пм |
|
Энергия ионизации (первый электрон) |
657,8(6,82) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
|
Электроотрицательность (по Полингу) |
1,54 |
| Электродный потенциал | -1,63 |
| Степени окисления | 4, 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,54 г/см? |
| Молярная теплоёмкость | |
| Теплопроводность |
21. 9 Вт/(м·K) 9 Вт/(м·K) |
| Температура плавления | 1933 K |
| Теплота плавления | 18.8 кДж/моль |
| Температура кипения | 3560 K |
| Теплота испарения | 422,6 кДж/моль |
| Молярный объём | 10,6 см3/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
гексагональная плотноупакованная (?-Ti) |
| Параметры решётки | a=2,951 с=4,697 (?-Ti) A |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Ti | 22 |
|
47,88 |
|
| [Ar]3d24s2 | |
| Титан | |
Титан — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов, с атомным номером 22. Обозначается символом Ti (лат. Titanium). Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой, -Ti с кубической объёмно-центрированной упаковкой, температура перехода α↔β 883 °C
Обозначается символом Ti (лат. Titanium). Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой, -Ti с кубической объёмно-центрированной упаковкой, температура перехода α↔β 883 °C
История открытия элемента Титан
Схема атома титана
Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1789), выделил новую «землю» (окись) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — окислы одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз.
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 термическим разложением паров иодида титана TiI4.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот, в соответствии со своими взглядами на химическую номенклатуру в противоход французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Однако согласно другой версии, публиковавшейся в журнале «Техника-Молодежи» в конце 80-х, новооткрытый металл обязан своим именем не могучим титанам из древнегреческих мифов, а Титании — королеве фей в германской мифологии (жена Оберона в шекспировском «Сне в летнюю ночь»).
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. В свободном виде не встречается. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO4, танталит (Fe,Mn)2+Ta2O6 и манганотанталит MnT2O6
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т.[2]. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. При современных темпах добычи мировых разведанных запасов титана (без учёта России) х
в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т.[2]. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. При современных темпах добычи мировых разведанных запасов титана (без учёта России) х
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА».
Получение
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Образующиеся пары TiCl4 при 850 °C восстанавливают Mg: TiCl4
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой (a=2,951 A; с=4,697 A; z=2; пространственная группа C6mmc), ?-Ti с кубической объёмноцентрированной упаковкой (a=3,269 A; z=2; пространственная группа
 Точка плавления 1671 °C, точка кипения 3260 °C, плотность ?-Ti и ?-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см?, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Точка плавления 1671 °C, точка кипения 3260 °C, плотность ?-Ti и ?-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см?, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400°С.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок горит на воздухе.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF,H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2-.
При нагревании на воздухе до 1200°C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанат: TiO2+K2CO3=K2TiO3+CO2.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — желтоватая, сильно дымящая на воздухе жидкость, что объясняется сильным гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, Al, Si, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твердые вещества с сильно восстановительными свойствами. Ti взаимодействует с Br2 и I2.
Ti взаимодействует с Br2 и I2.
С N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с C образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,0). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Применение
Часы из титанового сплава
В виде сплавов
- Металл применяется в химической промышленности (реакторы, трубопроводы, насосы), лёгких сплавах, остеопротезах. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
- Используется в художественном литье[5]
- Титан является легирующей добавкой в некоторых марках стали.
-
Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.

- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171.
- Титанорганические соединения (напр. тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Диборид титана — важный компонент сверхтвердых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов.
-
Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —- сегнетоэлектрики.

Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
60 % — краска;
20 % — пластик;
13 % — бумага;
7 % — машиностроение.
Цены
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по степени её пластичности.
Физиологическое действие
Нитрид титана
Соединения титана
Строение атома кремния и схема электронной оболочки
4.6
Средняя оценка: 4.6
Всего получено оценок: 195.
4.6
Средняя оценка: 4.6
Всего получено оценок: 195.
Кремний (Si) – второй по распространённости в земной коре неметалл после кислорода. В природе находится в составе соединений, в чистом виде встречается редко. Строение атома кремния определяет свойства элемента.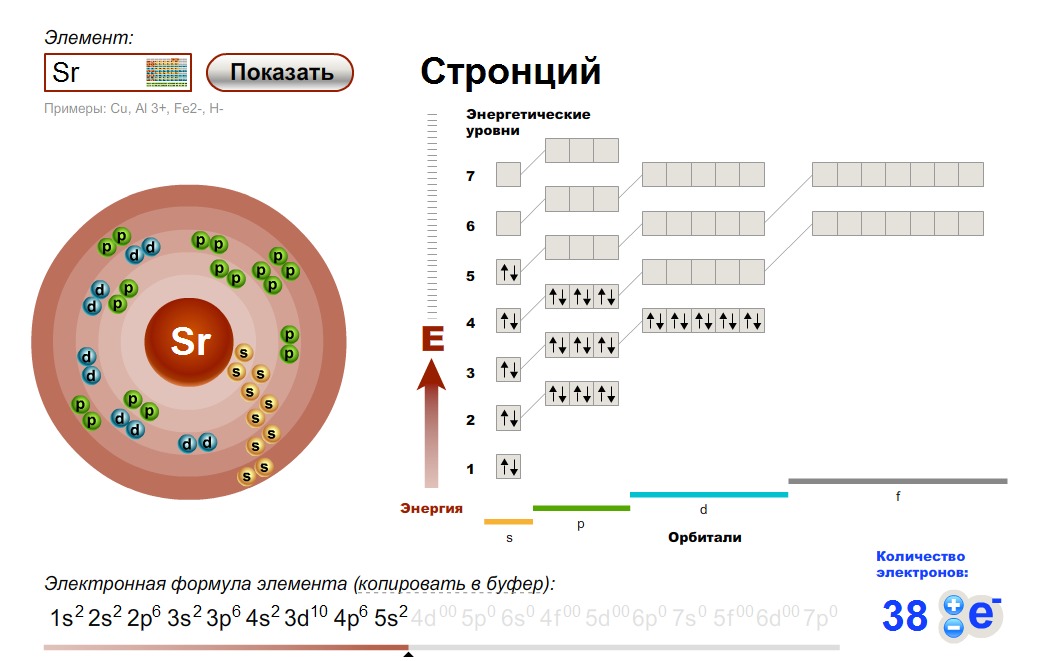
Строение
Кремний – 14 элемент периодической таблицы Менделеева, расположенный в третьем периоде, в IV группе. Относительная атомная масса – 28.
Рис. 1. Положение в таблице Менделеева.Ядро атома кремния содержит 14 протонов и 14 нейронов и имеет положительный заряд +14. Вокруг ядра располагается три электронные оболочки, на которых находится 14 электронов. Внешний энергетический уровень занимают четыре электрона, определяющие валентность элемента. Кремний проявляет степень окисления +2, потому что 3р-уровень имеет два неспаренных электрона. Элемент может переходить в возбуждённое состояние за счёт вакантной 3d-орбитали, проявляя степень окисления +4.
Рис. 2. Строение атома.Схема строения атома кремния – 1s22s22p63s23p2 или +14 Si)2)8)4.
Физические свойства
Кремний – твёрдый тёмно-серый элемент с металлическим блеском. Является полупроводником. Имеет одну модификацию, схожую по структуре с аллотропной модификацией углерода – алмазом. Однако связи между атомами кремния не такие прочные, как между атомами углерода.
Однако связи между атомами кремния не такие прочные, как между атомами углерода.
Кремний встречается в природе в составе песка, глины, кварца, силикатов. Диоксид кремния (SiO2) – песок. Получают кремний путём прокаливания песка с углеродом (углём) или металлами:
- 2C + SiO2 t˚→ Si + 2CO;
- 3SiO2 + 4Al → 3Si + 2Al2O3;
- 2Mg + SiO2 t˚→ Si + 2MgO.
Кремний используют для производства радиоэлементов, фотоэлементов, при производстве жароупорных материалов.
Химические свойства
Благодаря электронному строению кремний способен реагировать с другими элементами, принимая или отдавая электроны. В реакциях с металлами выступает в роли восстановителя, с неметаллами – окислителя. При оптимальных условиях кремний реагирует только с фтором:
Si + 2F2 → SiF4.
При нагревании реагирует:
- с кислородом (600°C) – Si + O2 → SiO2;
- с хлором (400°C) – Si + 2Cl2 → SiCl4;
- с углеродом (2000°C) – Si + C → SiC;
- с азотом (1000°C) – 3Si + 2N2 → Si3N4.

Является окислителем в реакциях с металлами:
Si + 2Mg → Mg2Si.
Может реагировать с концентрированными щелочами с выделением водорода:
Si + 2NaOH + H2O → Na2SiO3 + 2H2.
Кремний не реагирует непосредственно с водородом и кислотами, кроме плавиковой кислоты HF: Si + 6HF → H2[SiF6] + 2H2 или Si + 4HF → SiF4 + 2H2. Соединение с водородом – силан (SiH4) – получают разложением соли кислотой – Mg2Si + 2H2SO4 → SiH4 + 2MgSO4.
Что мы узнали?
Кремний – неметалл четвёртой группы периодической системы. На внешнем энергетическом уровне атома располагается четыре электрона. Имеет степень окисления +2. В природе находится в соединениях в виде глины, песка, кварца и других веществ. Существует только одна модификация кремния, схожая с алмазом. Получают кремний путём нагревания песка с углём или металлами. Реагирует элемент с неметаллами, металлами и щелочами. С водородом и кислотами (исключение – HF) не реагирует.
Реагирует элемент с неметаллами, металлами и щелочами. С водородом и кислотами (исключение – HF) не реагирует.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
5/5
Полина Шалаева
4/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 195.
А какая ваша оценка?
Фотография | Титан, атомная структура
{{ Элемент.Сообщение об ошибке }} Этот товар недоступен в вашем регионе. Товар не найден.ВЫБЕРИТЕ ВИДЕОЛИЦЕНЗИЮ
{{ item.PlusItemLicenseSmall }}
TIMESLICES
Создать квант времени
Просмотр временных интервалов (поставляется с 1-секундными дескрипторами)
Просмотр интервалов времени
БИРКИ
{{Ключевое слово}} {{Ключевое слово}}
ПОДЕЛИТЬСЯ ЭТОЙ СТРАНИЦЕЙ
Описание:
Описание:
Узнать больше
Кредит:
{{ item. ImgCredit }} Нет в наличии
ImgCredit }} Нет в наличии
Уникальный идентификатор:
{{ item.ItemID }}
Устаревший идентификатор:
{{ элемент.ItemSource }} Нет в наличии
Тип:
{{item.MediaType}}
Лицензия:
{{item.LicenseModel}}
ЦЕНЫ РФ
{{item.aText[i]}}
{{ item.aPrice[i] }}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
toLowerCase()” aria-label=”‘Add to ‘ + site.LabelPB.toLowerCase()”/>
Добавить на доску
Заказать печать
Заказать печать
Скачать в высоком разрешении
Размер без сжатия:
ЛИЦЕНЗИЯ ТОВАР НЕ ДОСТУПЕННазначение: {{item.ImgPurpose}}
{{ item.PlusItemLicenseSmall }}
Запрос товара
ПРОСТАЯ ЦЕНА RM
ПРОСТАЯ ЦЕНА RM
ТОВАР НЕ ДОСТУПЕН Запрос элемента
Назначение: {{ item.ImgPurpose }}
{{Имя}}
{{ FormatCurrency(item.aStandardPricingPrice[i]) }}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
LabelPB.toLowerCase()” :alt=”‘Add to ‘ + site.LabelPB.toLowerCase()” aria-label=”‘Add to ‘ + site.LabelPB.toLowerCase()”/>
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Заказать печать
Скачать в высоком разрешении
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ – $’ + item.PlusCodeAmount }} {{ item.PlusItemLicenseSmall }}
Перейти к оформлению заказа
Скопировать URL
Скачать Комп
LabelPB.toLowerCase()” :alt=”‘Add to ‘ + site.LabelPB.toLowerCase()” aria-label=”‘Add to ‘ + site.LabelPB.toLowerCase()”/>
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Скачать в высоком разрешении
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ – $’ + item.PlusCodeAmount }}
Перейти к оформлению заказаРазмер без сжатия:
ТОВАР НЕ ДОСТУПЕН
Запрос товара Назначение: {{item. ImgPurpose}}
ImgPurpose}}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Скачать в высоком разрешении
ТОВАР НЕ ДОСТУПЕН Запрос товара
Назначение: {{item. ImgPurpose}}
ImgPurpose}}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Скачать в высоком разрешении
Время начала:
{{ SecondsToTime(StartTime) }} Установить
Время окончания:
{{ SecondsToTime(EndTime) }} Установить
Продолжительность: {{ Продолжительность}}
Текущий: {{ Текущий }}
Продолжительность: {{DurationTime}}
Текущее: {{ ТекущееВремя}}
{{ SecondsToTime(Value.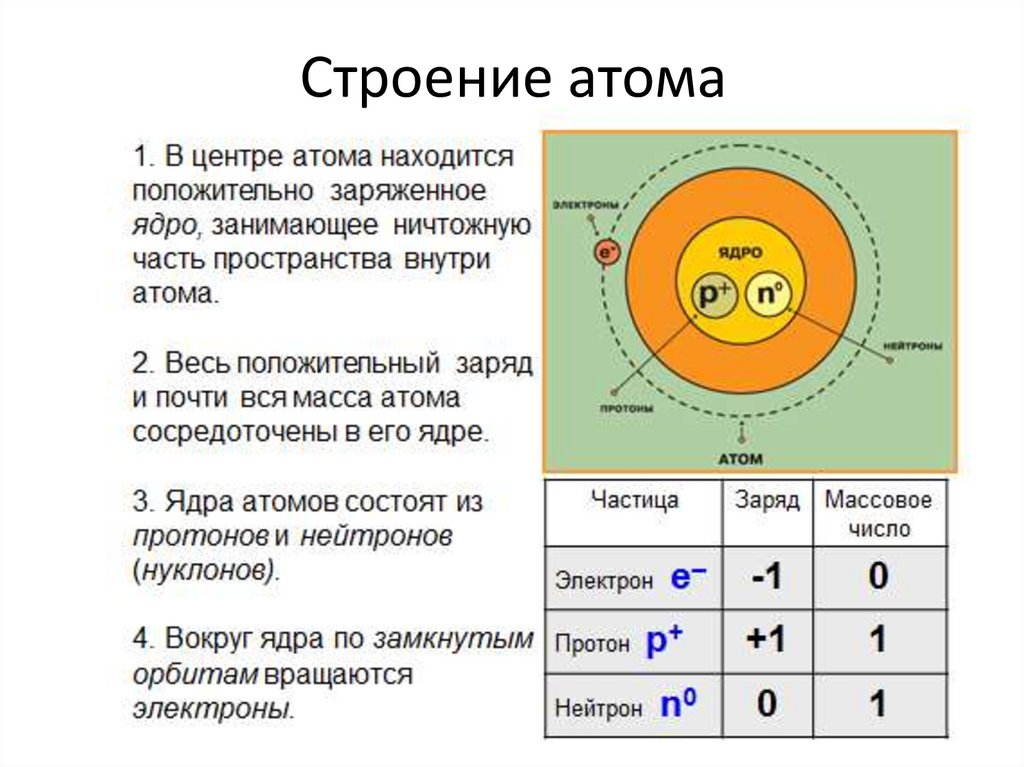 StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
Посмотреть
Удалить
Для этого элемента не заданы временные интервалы, поэтому по умолчанию это весь клип.
{{ SecondsToTime(0) }} до {{ SecondsToTime(videocontrols.Duration) }}
Общее время: {{ Math.round(TotalTime * 100) / 100 }}
Цена/сек: {{ FormatCurrency(item.PricePerSec) }}
Цена: {{ ItemPrice }}
{{ сайт.LabelPB }}
{{ сайт.LabelCT }}
{{ сайт.LabelPB }}
{{ сайт.LabelCT }}
{{ Lightbox.Name }} ({{ Lightbox.NumPix }})
Вид Управлять Новый
{{ site.LabelCT }}: {{ user.nCartItems }} {{ user.nCartItems == 1 ? “предмет” : “элемент” }}
{{ XXText }}
{{ XXSText }}
{{ XSText }}
{{ SMText }}
{{ MDText }}
{{ LGText }}
XLText 90 002} {{ LGText }} 90 002} { {{ XXLText }}{{ HDText }}
{{ QHDText }}
{{ K4Text }}
{{ K8Text }}
Мы используем файлы cookie, чтобы улучшить ваш опыт на нашем веб-сайте.
Прочтите нашу политику в отношении файлов cookie, чтобы узнать больше.
Мы используем файлы cookie, чтобы улучшить ваш опыт на нашем веб-сайте. Прочтите нашу политику в отношении файлов cookie, чтобы узнать больше.
Закрыть файлы cookie EULA
Ti Информация об элементе титана: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура титана
Твердотельная структура титана Простая гексагональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки. Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 295,08 pm | 468,55 pm |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
Положения атомов внутри элементарной ячейки описываются набором атомных позиций , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | P63/mmc | |
| Oxidation States | Space Group Number | 194 |
| Crystal Structure | Simple Hexagonal |
Titanium Atomic and Orbital Properties
Атомы титана имеют 22 электрона и структуру электронной оболочки [2, 8, 10, 2] с символом атомного термина (квантовые числа) 3 Ф 2 .
| Atomic Number | 22 |
| Number of Electrons (with no charge) | 22 |
| Number of Protons | 22 |
| Mass Number | 48 |
| Number нейтронов | 26 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 10, 2 |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Valence Electrons | 3d2 4s2 |
| Valence (Valency) | 4 |
| Main Oxidation States | 2, 3, 4 |
| Oxidation States | -2, -1, 0, 1, 2, 3, 4 |
| Символ атомного термина (квантовые числа) | 3 F 2 |
Электронная конфигурация основного состояния титана – нейтральный атом титана
Сокращенная электронная конфигурация титана
Сокращенная электронная конфигурация основного состояния нейтрального атома титана [Ar] 3d2 4s2. Часть конфигурации титана, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d2 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации титана, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d2 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального титана
Полная электронная конфигурация атома титана в основном состоянии, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d2 4s2 Принцип запрета Паули и правило Хунда.

Атомная структура титана
Атомный радиус титана составляет 176 пм, а его ковалентный радиус равен 136 пм.
| Вычисленный атомный радиус | 176 пм (1,76 Å) |
| Atomic Radius Empirical | 140 pm (1.4 Å) |
| Atomic Volume | 10.621 cm3/mol |
| Covalent Radius | 136 pm (1.36 Å) |
| Van der Waals Radius | – |
| Neutron Cross Section | 6.1 |
| Neutron Mass Absorption | 0.0044 |
Atomic Spectrum of Titanium
Титан Химические свойства: Энергия ионизации титана и сродство к электрону
Сродство титана к электрону составляет 7,6 кДж/моль.
| Valence | 4 |
| Electronegativity | 1.54 |
| ElectronAffinity | 7.6 kJ/mol |
Ionization Energy of Titanium
Refer to table below for Ionization energies of Titanium
| Ionization energy number | Enthalpy – kJ/mol | |
|---|---|---|
| 1st | 658.8 | |
| 2nd | 1309.8 | |
| 3rd | 2652.5 | |
| 4th | 4174.6 | |
| 5th | 9581 | |
| 6th | 11533 | |
| 7th | 13590 | |
| 8th | 16440 | |
| 9th | 18530 | |
| 10th | 20833 | |
| 11th | 25575 | |
| 12th | 28125 | |
| 13th | 76015 | |
| 14th | 83280 | |
| 15th | ||
| 16th | 100700 | |
| 17th | 109100 | |
| 18th | 117800 | |
| 19th | 129900 | |
| 20th | 137530 | |
| 21st | 602930 | |
| 22nd | 639294 |
Titanium Physical Properties
Refer to below table for Titanium Physical Properties
| Плотность | 4,507 г/см3 (для жидкости при т. пл. плотность 4,11 г/см3) пл. плотность 4,11 г/см3) |
| Молярный объем | 10,621 см3/моль |
Elastic Properties
| Young Modulus | 116 |
| Shear Modulus | 44 GPa |
| Bulk Modulus | 110 GPa |
| Poisson Ratio | 0.32 |
Твердость титана – испытания для измерения твердости элемента
| Твердость по Моосу | 6 МПа |
| Твердость по Виккерсу | 970 МПа |
| Твердость по Бринеллю | 716 МПа |
Электрические свойства титана
Титан является проводником электричества. Refer to table below for the Electrical properties ofTitanium
| Electrical Conductivity | 2500000 S/m |
| Resistivity | 4e-7 m Ω |
| Superconducting Point | 0. 4 4 |
Titanium Heat and Conduction Properties
| Thermal Conductivity | 22 W/(m K) |
| Thermal Expansion | 0.0000086 /K |
Titanium Magnetic Properties
| Magnetic Type | Парамагнитный |
| Точка Кюри | – |
| Массовая магнитная восприимчивость | 4.01e-8 м3/кг |
| Молярная магнитная восприимчивость | 1.919e-9 m3/mol |
| Volume Magnetic Susceptibility | 0.0001807 |
Optical Properties of Titanium
| Refractive Index | – |
Acoustic Properties of Titanium
| Скорость звука | 4140 м/с |
Тепловые свойства титана – энтальпии и термодинамика
Тепловые свойства титана 9 см.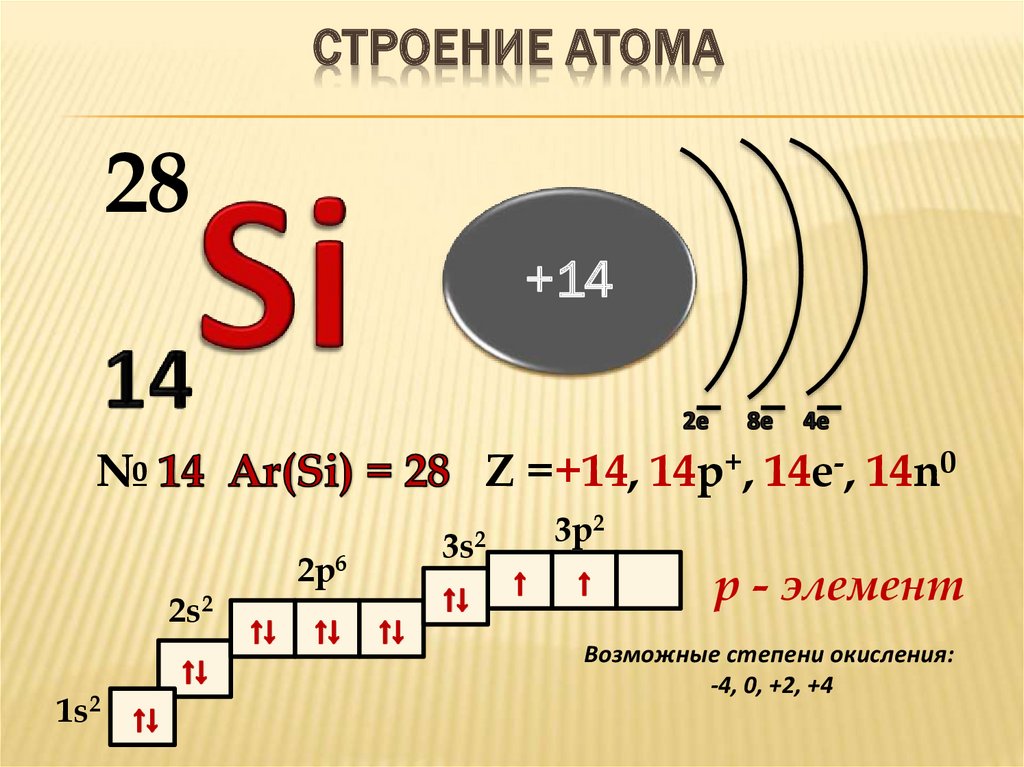 в таблице ниже.0003
в таблице ниже.0003
| Melting Point | 1941 K (1667.85°C, 3034.13 °F) |
| Boiling Point | 3560 K (3286.85°C, 5948.33 °F) |
| Critical Temperature | – |
| Superconducting Point | 0.4 |
Enthalpies of Titanium
| Heat of Fusion | 18.7 kJ/mol |
| Heat of Vaporization | 425 kJ/mol |
| Теплота сгорания | – |
Изотопы титана. Ядерные свойства титана
Титан состоит из 26 изотопов, содержащих от 38 до 63 нуклонов. Титан имеет 5 стабильных естественных изотопов.
Изотопы титана – Природные стабильные изотопы: 46Ti, 47Ti, 48Ti, 49Ti, 50Ti.
| Изотоп | Z | N | Изотоп Масса | % Содержание | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 38Ti | 22 | 16 | 38 | Synthetic | ||
| 39Ti | 22 | 17 | 39 | Synthetic | ||
| 40Ti | 22 | 18 | 40 | Synthetic | ||
| 41Ti | 22 | 19 | 41 | Synthetic | ||
| 42Ti | 22 | 20 | 42 | Synthetic | ||
| 43Ti | 22 | 21 | 43 | Synthetic | ||
| 44Ti | 22 | 22 | 44 | Synthetic | ||
| 45Ti | 22 | 23 | 45 | Synthetic | ||
| 46Ti | 22 | 24 | 46 | 8. |



