Вопрос 1 § 24-29 Химия 9 класс Рудзитис, Фельдман схемы строения атомов углерода и кремния. – Рамблер/класс
Вопрос 1 § 24-29 Химия 9 класс Рудзитис, Фельдман схемы строения атомов углерода и кремния. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания “Останкино”?
привет, помогите с ответом
Начертите схемы строения атомов углерода и кремния.
ответы
Углерод и кремний — это неметаллы, так как
на внешнем электронном слое 4 электрона. Поэто-
му проявляют валентность 4. В невозбужденном
состоянии их атомы имеют по 2 неспаренных элек-
трона. Но атомы этих элементов имеют на внешнем
уровне свободные орбитали, поэтому при переходе
в возбужденное состояние распаривают электроны
s-подуровней. Проявляют как положительную, так
и отрицательную степени окисления. Углерод и
кремний в соединениях проявляют степени окис-
ления -4; +2; +4. Например: СО2, SiО2, СО, SIO,
радиус атома, чем углерод, то для него более ха-
рактерна способность отдавать электроны, чем для
углерода.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 3
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н.
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1-го по 20-й…
1) Водород (H) – химический элемент номер 1 таблицы Менделеева. Схема строения электронной оболочки: 1s1;
2) Гелий (He) – химический элемент номер 2 таблицы Менделеева. Схема строения электронной оболочки: 1s2;
3) Литий (Li) – химический элемент номер 3 таблицы Менделеева. Схема строения электронной оболочки: 1s22s1;
4) Бериллий (Be) – химический элемент номер 4 таблицы Менделеева. Схема строения электронной оболочки: 1s22s2;
Схема строения электронной оболочки: 1s22s2;
5) Бор (B) – химический элемент номер 5 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p1;
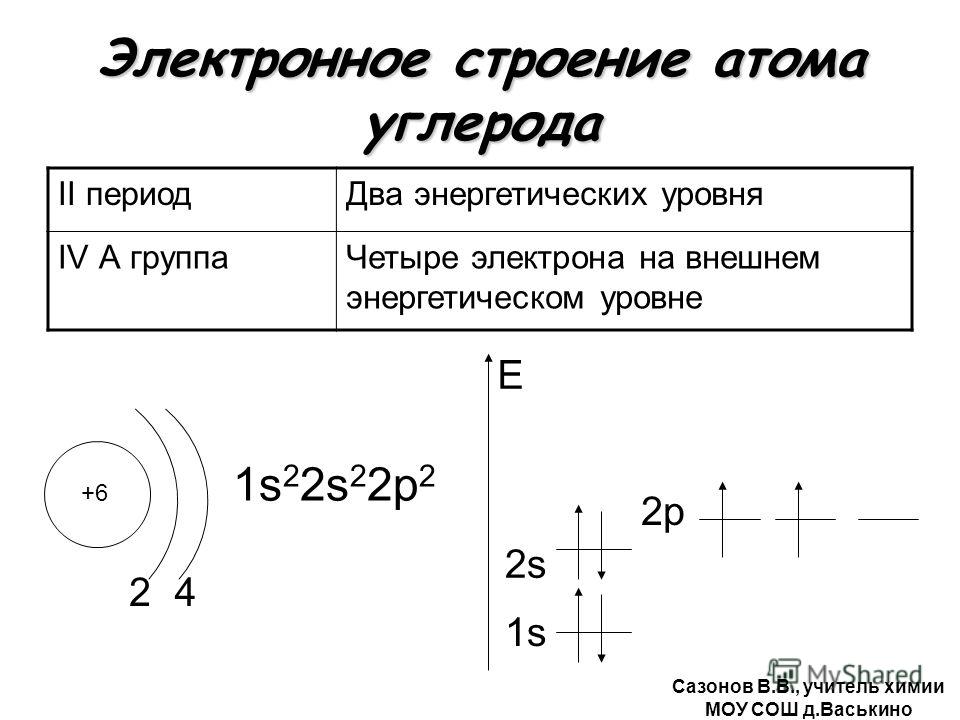
6) Углерод (C) – химический элемент номер 6 таблицы Д. И. Менделеева. Схема строения электронной оболочки: 1s22s22p2;
7) Азот (N) – химический элемент номер 7 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p3;
8) Кислород (O) – химический элемент номер 8 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p4;
9) Фтор (F) – химический элемент номер 9 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p5;
10) Неон (O) – химический элемент номер 10 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p6;
11) Натрий (Na) – химический элемент номер 11 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s1;
Схема строения электронной оболочки: 1s22s22p63s1;
12) Магний (Mg) – химический элемент номер 12 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s2;
13) Алюминий (Al) – химический элемент номер 13 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p1;
14) Кремний (Si) – химический элемент номер 14 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p2;
15) Фосфор (P) – химический элемент номер 15 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p3;
16) Сера (C) – химический элемент номер 16 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p4;
17) Хлор (Cl) – химический элемент номер 17 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p5;
Схема строения электронной оболочки: 1s22s22p63s23p5;
18) Аргон (Ar) – химический элемент номер 18 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p6;
19) Калий (K) – химический элемент номер 19 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p64s1;
20) Кальций (Ca) – химический элемент номер 20 таблицы Менделеева. Схема строения электронной оболочки: 1s22s22p63s23p64s2;
Атом углерода
 Кроме того, углерод представляет собой особую
элемент, потому что он играет доминирующую роль в химии жизни. Углерод, обнаруженный
в доисторические времена и был известен древним, которые производили его путем сжигания органических
материал для изготовления древесного угля. Известны четыре аллотопии кабона: аморфный,
графит, алмаз и фуллерен. Недавно был открыт новый (пятый) аллотроп углерода.
найденный. Это губчатое твердое вещество, чрезвычайно легкое и необычайно привлекательное.
к магнитам. Изобретатели этой новой формы углерода — магнитной углеродной нанопены —
говорят, что когда-нибудь он может найти применение в медицине (см. обзор
статья из Nature)
Кроме того, углерод представляет собой особую
элемент, потому что он играет доминирующую роль в химии жизни. Углерод, обнаруженный
в доисторические времена и был известен древним, которые производили его путем сжигания органических
материал для изготовления древесного угля. Известны четыре аллотопии кабона: аморфный,
графит, алмаз и фуллерен. Недавно был открыт новый (пятый) аллотроп углерода.
найденный. Это губчатое твердое вещество, чрезвычайно легкое и необычайно привлекательное.
к магнитам. Изобретатели этой новой формы углерода — магнитной углеродной нанопены —
говорят, что когда-нибудь он может найти применение в медицине (см. обзор
статья из Nature)Физические свойства атома углерода
Атомный
Номер 6
Средняя атомная масса: 12,011
Температура плавления: 3823 K (3550°C)
или 6422°F)
Плотность: 2,267 г/куб.
 см.
см. Скорость звука [/м·с-1]: 18350
Шкала твердости по шкале Мооса: 0,5
Стабильные изомеры (2)
Атомная структура
Атом углерода имеет шесть электронов, 4 из которых находятся на его валентной оболочке (внешней оболочке).
Круги на диаграмме показывают уровни энергии, представляющие увеличивающиеся расстояния.
от ядра.
Лучший способ взглянуть на атом углерода — использовать график уровня энергии. показано справа. Здесь мы видим, что углерод имеет шесть электронов, обозначенных стрелками.
(направление стрелки указывает на спин электрона) Обнаружены два электрона
на 1s-орбитали, близкой к ядру. Следующие два перейдут на орбиту 2s.
Остальные будут находиться на двух отдельных 2р-орбиталях. Это потому, что п
орбитали имеют одинаковую энергию, и электроны предпочли бы находиться на разных орбиталях. показано справа. Здесь мы видим, что углерод имеет шесть электронов, обозначенных стрелками.
(направление стрелки указывает на спин электрона) Обнаружены два электрона
на 1s-орбитали, близкой к ядру. Следующие два перейдут на орбиту 2s.
Остальные будут находиться на двух отдельных 2р-орбиталях. Это потому, что п
орбитали имеют одинаковую энергию, и электроны предпочли бы находиться на разных орбиталях. |
Фактическое расположение электронов в атоме углерода определить невозможно.
с уверенностью, и электроны кажутся «размазанными» по орбиталям, как показано
ниже. Эти изображения были созданы с помощью java-апплета –Atomic and Molecular.
Орбиты из Массачусетского технологического института. Этот java-апплет и другие апплеты Molecular Orbitals могут быть
можно найти на Java-странице химии.
2 с | 2 пикселя | 2 шт. |
Изотопы
Изотопы – это атомы, одинаковый атомный номер, но разные массовые числа. У них одинаковое количество протонов но разное количество нейтронов. Количество нейтронов в атоме может варьироваться в пределах малые пределы. Например, существует три вида атомов углерода 12С, 13С и 14С. Все они имеют одинаковое количество протонов, но количество нейтронов различается.
| протонов | массовый номер | ||
| углерод 12 | 6 | 6 | 12 |
| углерод 13 | 6 | 7 | 13 |
| углерод 14 | 6 | 8 | 14 |
Эти разные
типы атомов углерода называются изотопами. Дело в том, что они имеют разное количество
нейтронов не влияет на химические реакции атома углерода.
Дело в том, что они имеют разное количество
нейтронов не влияет на химические реакции атома углерода.
Использование углерода
Графит в сочетании с глинами образует «свинец»
используется в карандашах.
Алмаз используется в декоративных целях, а также как сверло
биты.
Добавление углерода в железо делает сталь.
Углерод используется для регулирующих стержней.
в ядерных реакторах.
Уголь графитовый в порошкообразном спекшемся виде используется в качестве
древесный уголь для приготовления пищи, художественных работ и других целей.
Таблетки древесного угля используются в
лекарство в виде таблеток или порошка для адсорбции токсинов или ядов из пищеварительного тракта.
система.
Определение, факты и примеры I StudySmarter
Что общего у обручальных колец с бриллиантами, карандашей для рисования, хлопковых футболок и энергетических напитков? Все они сделаны в основном из углерода. Углерод — один из самых фундаментальных элементов жизни. Например, по массе он составляет 18,5% человеческого тела — мы находим его в таких местах, как наши мышечные клетки, кровоток и проводящие оболочки, окружающие наши нейроны. Эти соединения обычно состоят из углерода, связанного с другими элементами, такими как водород, и вы изучите их подробнее в главе 9.0005 Органическая химия . Однако мы также можем найти конструкции, сделанные только из углерода. Примеры из них включают алмаз и графит.
Углерод — один из самых фундаментальных элементов жизни. Например, по массе он составляет 18,5% человеческого тела — мы находим его в таких местах, как наши мышечные клетки, кровоток и проводящие оболочки, окружающие наши нейроны. Эти соединения обычно состоят из углерода, связанного с другими элементами, такими как водород, и вы изучите их подробнее в главе 9.0005 Органическая химия . Однако мы также можем найти конструкции, сделанные только из углерода. Примеры из них включают алмаз и графит.
Углеродные конструкции представляют собой конструкции, состоящие из углерода.
Все эти структуры известны как аллотропы углерода .
Аллотроп является одной из двух или более различных форм одного и того же элемента.
Хотя аллотропы могут иметь одинаковый химический состав, они имеют очень разные структуры и свойства, которые мы рассмотрим через секунду. А пока давайте посмотрим, как углерод образует связи.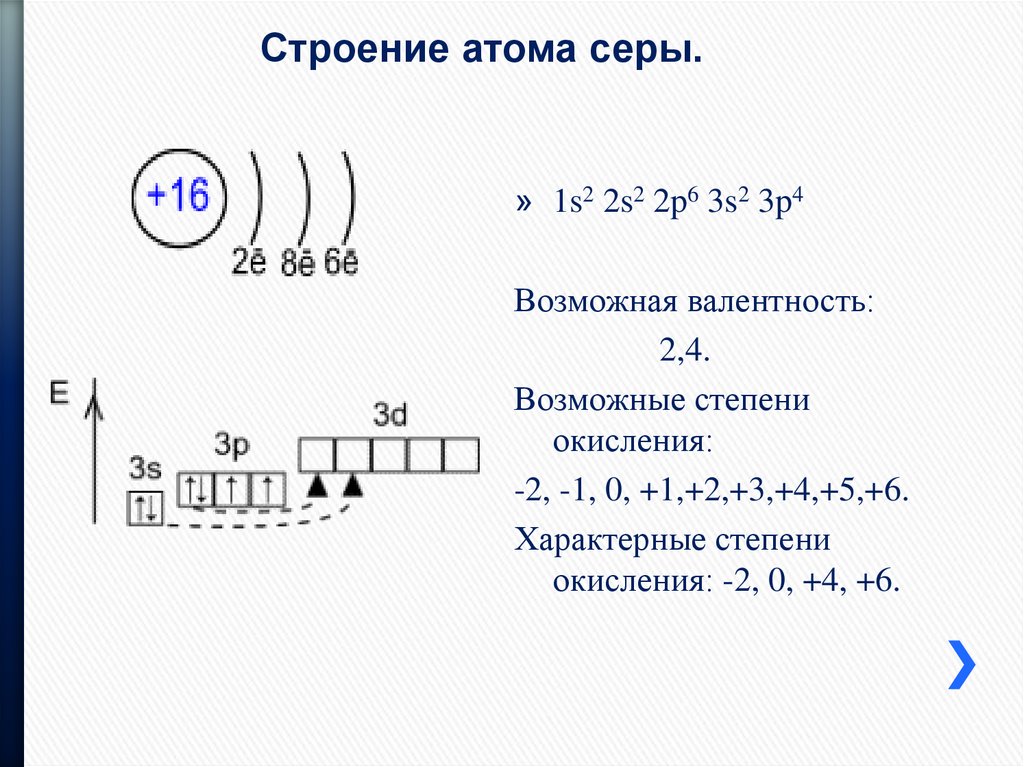 92\) . Если вы не уверены, что это значит, ознакомьтесь с дополнительной информацией по Electron Configuration и Electron Shells .
92\) . Если вы не уверены, что это значит, ознакомьтесь с дополнительной информацией по Electron Configuration и Electron Shells .
Рис. 1. Углерод имеет атомный номер 6 и массовое число 12 с точностью до десятых оболочка .
Рис. 2 – Электронные оболочки углерода. Он содержит четыре валентных электрона
Это означает, что углерод может образовывать до четырех ковалентных связей с другими атомами. Если вы помните с Ковалентная связь , ковалентная связь представляет собой общих пар электронов . Фактически, углерод редко встречается с чем-либо, кроме четырех связей, потому что образование четырех ковалентных связей означает, что он имеет восемь валентных электронов. Это дает ему -электронную конфигурацию благородного газа с полной внешней оболочкой, которая представляет собой -стабильную конфигурацию .
Рис. 3 – Электронные оболочки углерода. Здесь показано, что он связан с четырьмя атомами водорода с образованием метана. Каждая ковалентная связь содержит один электрон от атома углерода и один от атома водорода. Теперь он имеет полную валентную оболочку электронов
Здесь показано, что он связан с четырьмя атомами водорода с образованием метана. Каждая ковалентная связь содержит один электрон от атома углерода и один от атома водорода. Теперь он имеет полную валентную оболочку электронов
Эти четыре ковалентные связи могут быть между углеродом и почти любым другим элементом, будь то другой атом углерода, спиртовая группа (-ОН) или азот. Однако в этой статье мы рассматриваем различные структуры, которые он образует, когда связывается с другими атомами углерода, образуя различные аллотропы. Мы называем все эти различные аллотропы углеродными структурами . К ним относятся алмаз и графит. Давайте рассмотрим их обоих дальше.
Что такое алмаз?
Алмаз — это макромолекула , полностью состоящая из углерода.
Макромолекула — это очень большая молекула, состоящая из сотен атомов, ковалентно связанных друг с другом.
В алмазе каждый атом углерода образует четыре одинарные ковалентные связи с окружающими его атомами углерода, что приводит к гигантской решетке, вытянутой во всех направлениях.
Решетка представляет собой правильное повторяющееся расположение атомов, ионов или молекул. В этом контексте «гигантский» означает, что он содержит большое, но неопределенное количество атомов.
Рис. 4 – Изображение решетчатой структуры алмаза. В действительности решетка чрезвычайно велика и тянется во все стороны. Каждый атом углерода связан с четырьмя другими атомами углерода одинарными ковалентными связями
Свойства алмаза
Вы должны помнить, что ковалентные связи чрезвычайно прочны. Из-за этого алмаз обладает определенными свойствами.
- Высокие температуры плавления и кипения . Это связано с тем, что для преодоления ковалентных связей требуется много энергии, и в результате алмаз остается твердым при комнатной температуре.
- Твердый и прочный благодаря прочности ковалентных связей.
- Нерастворим в воде и органических растворителях.
- Не проводит электричество .
 Это связано с тем, что внутри структуры нет свободно движущихся заряженных частиц.
Это связано с тем, что внутри структуры нет свободно движущихся заряженных частиц.
Что такое графит?
Графит также является аллотропом углерода. Помните, что аллотропов — это разные формы одного и того же элемента, поэтому, как и алмаз, он состоит только из атомов углерода. Однако каждый атом углерода в графите образует всего три ковалентные связи с другими атомами углерода. Это создает тригонально-плоское расположение , предсказанное теорией отталкивания электронных пар, о которой вы узнаете больше в Формы молекул . Угол между каждой связью равен .
Атомы углерода образуют двухмерный гексагональный слой почти как лист бумаги. При укладке между слоями нет ковалентных связей, просто слабые межмолекулярные силы.
Однако у каждого атома углерода все еще есть один оставшийся электрон. Этот электрон перемещается в область выше и ниже атома углерода, сливаясь с электронами других атомов углерода в том же слое. Все эти электроны могут перемещаться в любом месте этой области, но не могут перемещаться между слоями. Мы говорим, что электронов делокализованный . Это очень похоже на море делокализации в металле (см. Металлическое соединение ).
Все эти электроны могут перемещаться в любом месте этой области, но не могут перемещаться между слоями. Мы говорим, что электронов делокализованный . Это очень похоже на море делокализации в металле (см. Металлическое соединение ).
Рис. 5 – Графит. Плоские слои укладываются друг на друга и удерживаются вместе слабыми межмолекулярными силами, представленными пунктирными линиями
Рис. 6. Угол между каждой из связей в графите составляет 120°
Свойства графита
Уникальная структура графита придает ему несколько отличных от алмаза физических характеристик. Его свойства включают в себя:
- Мягкий и слоеный . Хотя ковалентные связи между атомами углерода очень прочны, межмолекулярные силы между слоями слабы, и для их преодоления не требуется много энергии. Поэтому слои очень легко скользят друг относительно друга и стираются, поэтому графит используется в качестве грифеля в карандашах.

- Имеет высокие температуры плавления и кипения. Это связано с тем, что каждый атом углерода все еще связан с тремя другими атомами углерода сильными ковалентными связями, как в алмазе.
- Нерастворим в воде , как и алмаз.
- Является хорошим проводником электричества. Делокализованные электроны могут свободно перемещаться между слоями структуры и нести заряд.
Графен
Отдельный лист графита называется графеном . Это самый тонкий из когда-либо выделенных материалов — его толщина составляет всего один атом. Графен имеет схожие свойства с графитом. Например, это великий проводник электричества . Однако он также имеет низкую плотность, гибкий и чрезвычайно прочный для своей массы. В будущем вы можете найти носимую электронику, сделанную из графена, встроенную в вашу одежду. В настоящее время мы используем его для доставки лекарств и солнечных батарей.

 Это связано с тем, что внутри структуры нет свободно движущихся заряженных частиц.
Это связано с тем, что внутри структуры нет свободно движущихся заряженных частиц.