Особенности строения атома водорода :: SYL.ru
Самый распространенный элемент в космосе, состоящий из самых легких атомов, – это водород. Он открыт еще в 14 столетии великим алхимиком Парацельсом. Ученого по праву считают основоположником не только медицины, но и химии. Строение атома водорода было в дальнейшем детально рассмотрено Нильсом Бором. Элемент был затем обнаружен астрономами в составе Солнца и других планет, а также в газовых звездных туманностях. В них происходит процесс превращения атомов водорода в атомы гелия, иными словами, наблюдается ядерная реакция. В нашей статье мы изучим не только строение атома водорода, но и рассмотрим характерные особенности свойств этого химического элемента.
Место элемента в периодической системе Менделеева
Водород – единственный химический элемент, находящийся сразу в двух группах периодической системы: 1 и 7. Объяснить следующий факт можно так: он проявляет двойственные химические свойства. Особое строение атома водорода позволяет ему отдавать свой единственный электрон атомам, например, активных элементов – неметаллов. Это прежде всего галогены: агрессивные по своим свойствам фтор, хлор, бром и йод. Легко взаимодействует H2 и с халькогенами: серой, кислородом, селеном. В этом случае атомы водорода превращаются в катионы – положительно заряженные частицы.
Это прежде всего галогены: агрессивные по своим свойствам фтор, хлор, бром и йод. Легко взаимодействует H2 и с халькогенами: серой, кислородом, селеном. В этом случае атомы водорода превращаются в катионы – положительно заряженные частицы.
Благодаря этой особенности элемент занимает место в первой группе периодической системы. Иначе выглядит механизм реакции между металлами и водородом. Согласно теории строения атома водорода по Н. Бору, элемент имеет один неспаренный электрон. Атом H принимает электроны от атомов активных щелочных или щелочноземельных металлов. Таким образом, его электронная конфигурация становится похожей на частицу инертного газа гелия. Единственный энергетический слой теперь полностью завершен. В данных процессах строение атома водорода изменяется и он переходит в форму аниона. Именно по этой причине элемент одновременно располагается в периодической системе еще и в ее 7 группе.
Все в сравнении
Продолжая изучать особенности строения водородных частиц, давайте посмотрим, насколько их внутренняя структура влияет на поведение элемента в реакциях. Для этого обратим внимание на его ближайших соседей по периодической системе и определим, каково строение атомов водорода, гелия и лития. С частицами инертного газа водород объединяет одинаковое количество энергетических уровней, с литием – похожее строение внешнего энергетического слоя, на котором расположен один электрон. Однако свойства водорода сильно отличаются как от инертного газа, так и от щелочного металла. Этот факт доказывает, что все характеристики химического элемента полостью определяются строением атома и молекулы водорода, то есть количеством энергетических уровней и распределением электронов на них.
Для этого обратим внимание на его ближайших соседей по периодической системе и определим, каково строение атомов водорода, гелия и лития. С частицами инертного газа водород объединяет одинаковое количество энергетических уровней, с литием – похожее строение внешнего энергетического слоя, на котором расположен один электрон. Однако свойства водорода сильно отличаются как от инертного газа, так и от щелочного металла. Этот факт доказывает, что все характеристики химического элемента полостью определяются строением атома и молекулы водорода, то есть количеством энергетических уровней и распределением электронов на них.
Рождающий воду
Название элемента говорит о том, что соединение его атомов с частицами кислорода приводит к появлению такого уникального и важного для Земли вещества, как вода. В обычных условиях эта реакция не происходит, температура горения газовой смеси достигает 2800 °C. В лаборатории взаимодействие между H2 и O2 в соотношении 2:1 приводит к взрыву. Сама смесь получила название гремучего газа, а процесс, протекающий в ней, идет по свободно-радикальному механизму. Если его не контролировать, то реакция заканчивается серьезной проблемой – мощным взрывом. По этой причине, несмотря на его исключительную легкость, от водорода отказались как от наполнителя для воздушных летательных аппаратов. Печальным поводом послужило крушение в 1937 году дирижабля “Гинденбург”, направлявшегося в Америку. Посмотрим теперь, как строение атома водорода влияет на физические признаки газа.
Сама смесь получила название гремучего газа, а процесс, протекающий в ней, идет по свободно-радикальному механизму. Если его не контролировать, то реакция заканчивается серьезной проблемой – мощным взрывом. По этой причине, несмотря на его исключительную легкость, от водорода отказались как от наполнителя для воздушных летательных аппаратов. Печальным поводом послужило крушение в 1937 году дирижабля “Гинденбург”, направлявшегося в Америку. Посмотрим теперь, как строение атома водорода влияет на физические признаки газа.
Водород, дейтерий, тритий
Пусть вас не удивляет приведенный выше перечень терминов. Речь идет все об одном и том же химическом элементе водороде, заряд ядра атома которого равен +1. Второе и третье названия – это имена изотопов. Причина их различий заключается в количестве нейтронов в ядре, тогда как протонное число всех трех видов частиц одинаково. У дейтерия два нейтрона, у трития – 3, сам же водород имеет 1 нейтрон в составе своего ядра. Вода, содержащая в составе своих молекул дейтерий, называется тяжелой.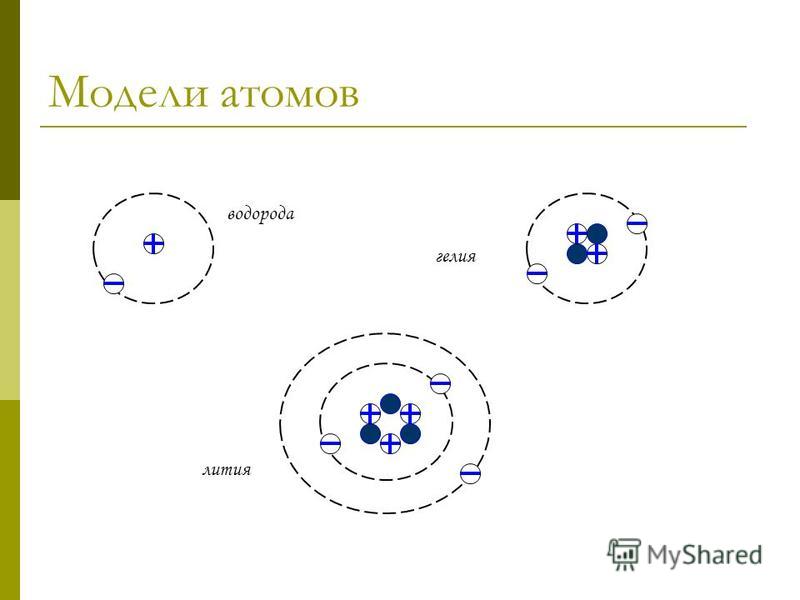 Ее можно обнаружить в прудах-охладителях атомных станций, а также в составе цитоплазмы клеток, имеющих нарушения нормального метаболизма.
Ее можно обнаружить в прудах-охладителях атомных станций, а также в составе цитоплазмы клеток, имеющих нарушения нормального метаболизма.
Электронное строение атома водорода
Схема, приведенная ниже, поможет нам понять специфику поведения простого вещества H2 в различных химических взаимодействиях.
Наличие единственного электрона, занявшего s-орбиталь первого энергетического уровня, обеспечивает постоянную валентность водорода, равную 1. В большинстве случаев этот электрон покидает пространство атома и переходит во владение более электроотрицательных элементов. Лишь реакции с металлами позволяют водороду притянуть в сферу влияния собственного ядра электрон от атомов активных щелочных или щелочноземельных элементов, образуя белые кристаллические соединения – их гидриды.
Активный и агрессивный
Атомарный водород, так сказать, легок на подъем. Его быстроте в восстановлении металлов из их оксидов могут позавидовать другие восстановители вроде углерода или его окислов. Так же активно атомы H соединяются с частицами серы, кислорода, фосфора. А пламя горелки с атомарным водородом дает разогрев выше 4000 °C. По этой причине такими приборами легко обрабатывать поверхности металлов: резать или сваривать их.
Так же активно атомы H соединяются с частицами серы, кислорода, фосфора. А пламя горелки с атомарным водородом дает разогрев выше 4000 °C. По этой причине такими приборами легко обрабатывать поверхности металлов: резать или сваривать их.
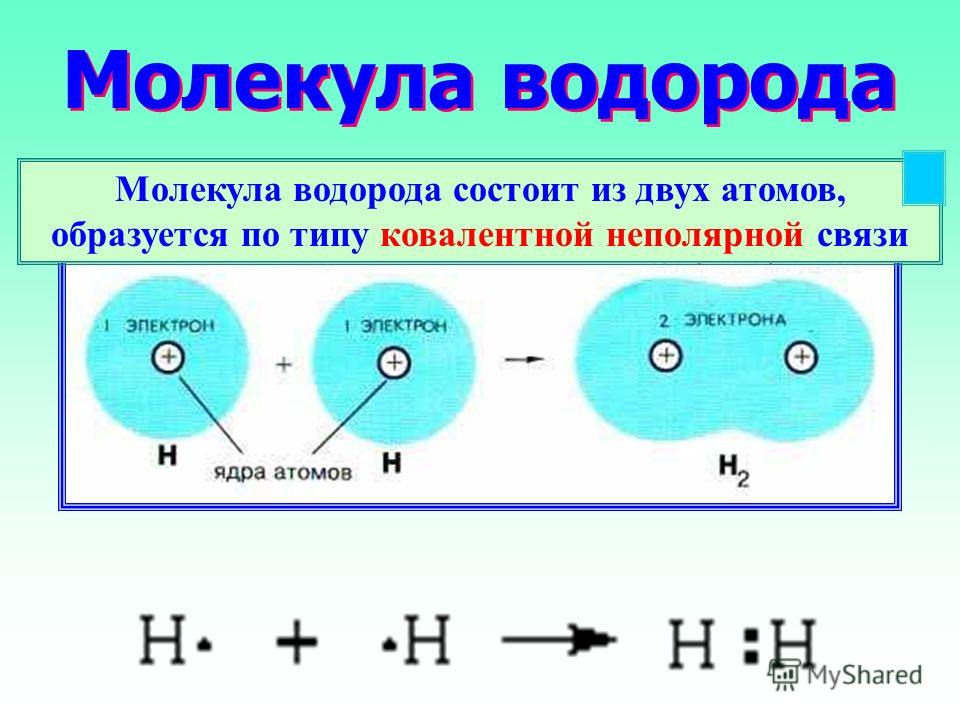
Атомарный водород хорошо зарекомендовал себя в качестве восстановителя чистых металлов – вольфрама, молибдена – из их руд, представленных в основном оксидами. Встречаясь с такими же атомами, как и он сам, водород образует устойчивую и пассивную структуру – молекулу. Оба атома H держатся друг за друга с помощью общей электронной пары, являясь образцом стабильной ковалентной неполярной связи. Она прочная и обеспечивает устойчивость молекул H2 как в условиях земного существования, так и на просторах космоса. Не обошлась без водорода и пищевая промышленность, в которой его применяют для гидрогенизации масел и получения модных в современной диетологии низкокалорийных спредов.
В нашей статье мы рассмотрели, каково строение атома водорода, и выяснили, как оно влияет на свойства простого вещества
Изотопы водорода.
 Водород. Задачи 781
Водород. Задачи 781
Изотопы водорода
Задача 781.
Описать атомы протия, дейтерия и трития. В чем различие этих атомов? Какие изотопы водорода стабильны?
Решение:
Водород имеет три изотопа: протий (или Н), дейтерий (или D) и тритий (или Т). Массовые доли их соответственно равны 1, 2 и 3. Протий и дейтерий – стабильные изотопы водорода, тритий – радиоактивен (период полураспада 12,5 лет).
Ядро атома протия содержит один протон, а ядро дейтерия и протия включает, кроме протона, соответственно один и два нейтрона. Таким образом, атомы протия, дейтерия и трития содержат на энергетическом уровне по одному электрону, различаются только ядра изотопов: протий содержит только протон, дейтерий – протон и нейтрон, а тритий – протон и два нейтрона.
Энергетическая схема образования молекулы
Задача 782.
Исходя из строения атома водорода: а) указать возможные валентные состояния и степени окисленности водорода;
б) описать строение молекулы Н2 с позиций методов ВС и МО; в) обосновать невозможность образования молекулы Н3.
Решение:
а) Свойства водорода определяются способностью его атомов отдавать единственный электрон и превращаться в положительно заряжённый ион . При этом проявляется особенность атома водорода, отличающая его от атомов других элементов, отсутствие промежуточных электронов между валентным электроном и ядром. Ион водорода, образующийся в результате потери атомом водорода электрона, представляет собой протон, размеры которого меньше размера катионов всех других элементов на несколько порядков.
б) Строение молекулы Н
H. + .H ↔ H (:) H
Или
Энергетическая схема образования молекулы (Н2) по методу МО:
в) Энергетическая схема образования молекулы (Н3) по методу МО:
Как видно из диаграммы число связывающих электронов здесь равно 3. Порядок связи ( ) равен:
= (3 – 0)/2 = 1,5. Следовательно, образование Н3 будет сопровождаться выделением энергии – молекула может существовать.
Водородная связь
Задача 783.
Почему между молекулами водорода и молекулами кислорода не образуются водородные связи?
Атом водорода, соединённый с атомом сильно электроотрицательного элемента (О, F, N, и др.
 ), способен к образованию ещё одной химической связи с другим подобным атомом. Эта связь намного слабее обычной ковалентной и называется водородной связью, обозначается тремя точками:
), способен к образованию ещё одной химической связи с другим подобным атомом. Эта связь намного слабее обычной ковалентной и называется водородной связью, обозначается тремя точками:HF…HF
Возникновение водородной связи можно объяснить действием электростатических сил. Так при образовании полярной ковалентной связи между атомом водорода и атомом фтора, который характеризуется высокой электроотрицательностью, электронное облако, первоначально принадлежащее атому водорода, сильно смещено в сторону атома фтора. В результате атом фтора приобретает значительный эффективный отрицательный заряд, а ядро водорода (протон) с внешней по отношению к атому фтора стороны почти лишается электронного облака. Между атомом водорода одной молекулы и отрицательно заряжённым атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Процесс образования водородной связи между двумя молекулами HF может быть представлен схемой:
Молекулы Н2 и О2 – нейтральные частицы, образованные неполярными ковалентными связями, не являются диполями, поэтому при приближении их друг к другу сил электро-статического взаимодействия не наблюдается, никаких дополнительных химических связей не образуется, наоборот, при приближении их будут наблюдаться силы отталкивания.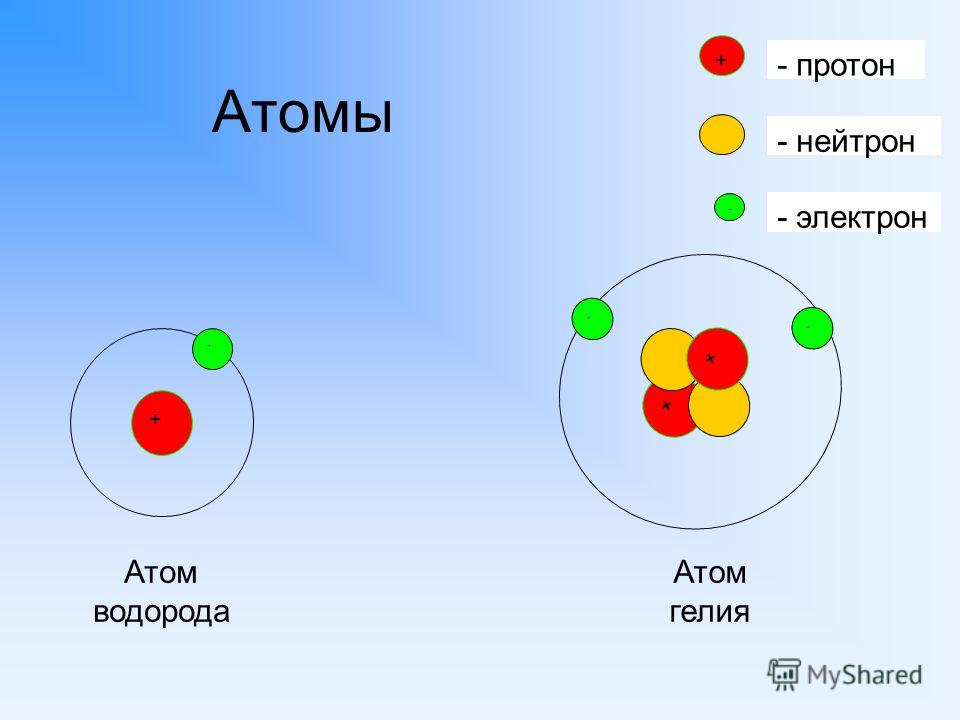
Задача 784.
В виде, каких ионов может входить водород в состав химических соединений?
Решение:
Атом водорода имеет один электрон, который он может отдать, превратившись при этом в положительный ион – катион водорода Н+. При этом проявляется особенность атома водорода, отличающая его от атомов других элементов, отсутствие промежуточных электронов между валентным электроном и ядром атома. Ион водорода, образующийся в результате потери атомом единственного электрона, представляет собой, по сути, протон, размеры которого на несколько порядков меньше, чем размеры катионов других элементов. Поэтому поляризующее действие протона очень велико, вследствие чего водород не способен образовывать ионных соединений даже с наиболее активными неметаллами. Например, с фтором, водород образует вещество с полярной ковалентной связью. Атом водорода также способен присоединять один, недостающий до полного завершения электронного уровня, электрон.
Атомная структура
Атомная структура Из чего состоит атом? Атом состоит из тяжелого ядра протонов
(положительно заряженные частицы, записываются как p
Что определяет элемент? Число протонов в ядре
каждый атом.
- Атомы водорода (H) имеют 1 протон.
- Атомы водорода с 1 протоном и 1 электроном нейтральны водород ( 1 H 1 ).
- Атомы водорода с 1 протоном, 1 электроном и 1 нейтроном являются
- Если к водороду добавить протон, мы получим другой элемент – гелий ( 4 He 2 ).
- Номенклатура: Для каждого элемента верхний индекс обозначает количество протоны и нейтроны, а нижний индекс число протонов.
- Сколько нейтронов содержится в нейтральном углероде ( 12 C 6 )?
- Сколько нейтронов содержится в радиоактивном изотопе называется углерод-14 ( 14 C 6 )?
[НМСУ, Н. Фогт]
Как строение атома или элемента говорит нам о том, как будет выглядеть его спектр?
- Электроны существуют в стационарных состояниях внутри атомов, каждое из которых определяется
дискретный, уникальный уровень энергии.
 Только определенные энергетические уровни, такие как орбиты
с определенными радиусами.
Только определенные энергетические уровни, такие как орбиты
с определенными радиусами. - Свет или излучение, испускаемое или поглощаемое атомами при движении электронов из
с одного энергетического уровня на другой можно представить как поток из квантов называются фотонами. Каждый фотон несет энергию E = h × против . Мы определяем
эти энергетические уровни следующим образом, говоря, что электрон находится в
[НМСУ, Н. Фогт] - Состояние заземления , самый низкий возможный уровень энергии
- Первое возбужденное состояние, следующий максимально допустимый уровень энергии
- Второе возбужденное состояние, следующий по величине разрешенный уровень энергии
- Третье возбужденное состояние, следующий по величине разрешенный уровень энергии
- .
 ..
.. - До точки, в которой электрон больше не связан с атомом
- Атом обычно имеет одинаковое количество протонов и электронов. Потому что протоны имеют положительный заряд, а электроны – отрицательный, он переносит в этом состоянии нет заряда. Когда атом теряет (или приобретает) электрон, мы говорим что это ионизированное , и тогда оно несет электрический заряд.
Энтропия говорит нам, что все вещи естественным образом тяготеют к минимально возможному энергетическое состояние:
- Бревна и вода катятся вниз по склону.
- Прыгающие мячи замедляются до полной остановки.
- Люди ложатся спать ночью и с трудом встают утром.
- Точно так же атомы водорода склонны находиться в основном состоянии.
- Большинство фотонов пролетают мимо, не взаимодействуя с атомом.
- Но фотоны только с правильной энергией поглощаются атомом.

- В данном случае справа означает, что энергия фотона соответствует
разница энергетических уровней между допускала орбит в водороде
атома, а поглотили означает, что энергия фотона будет
поглощается атомом (оставляя атом в более высоком энергетическом состоянии).
[НМСУ, Н. Фогт] - Фотон с частотой v будет поглощен атомом, если энергия фотона соответствует разнице уровней энергии между разрешенными состояний в атоме.
Что будет дальше?
- Помните, что энтропия ищет самый низкий доступный уровень энергии для всех вещи, так что электрон, поднятый на возбужденную орбиту, будет в конце концов вернуться в основное состояние.
- Сохранение энергии говорит нам, что разница в энергии
между возбужденным состоянием и основным состоянием должно появиться где-то, когда
электрон совершает переход.
 Он испускается атомом в виде фотона с
ту же энергию, что и исходная, которая была поглощена.
Он испускается атомом в виде фотона с
ту же энергию, что и исходная, которая была поглощена.[НМГУ, Н. Фогт]
Вот схематическая диаграмма разрешенных орбит в атоме водорода. Если вы можете ответить на вопросы, перечисленные ниже, у вас есть правильная идея!
- Какие переходы соответствуют поглощению фотона? А и Д
- Какой переход соответствует самая высокая энергия испущенных фотонов ? С
- Какой переход соответствует самой короткой длине волны испущенных фотонов? С
- Какой переход соответствует поглощенному фотону с наименьшей энергией ? А
- Какой переход соответствует самой высокой частоте испускаемого фотона? С
| [НМГУ, Н. Фогт] |
Благодаря Майку Болте (UC Santa Cruz) за основное содержание этого слайда.

Водород, атомная структура — Стоковая фотография — C018/3682
Похоже, вы используете устаревший веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3682
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Если у вас есть какие-либо вопросы, свяжитесь с вашим менеджером по работе с клиентами.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Водород (H). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома водорода-1 (атомный номер: 1), наиболее распространенного изотопа элемента водорода.

 Только определенные энергетические уровни, такие как орбиты
с определенными радиусами.
Только определенные энергетические уровни, такие как орбиты
с определенными радиусами. ..
..
 Он испускается атомом в виде фотона с
ту же энергию, что и исходная, которая была поглощена.
Он испускается атомом в виде фотона с
ту же энергию, что и исходная, которая была поглощена.