Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
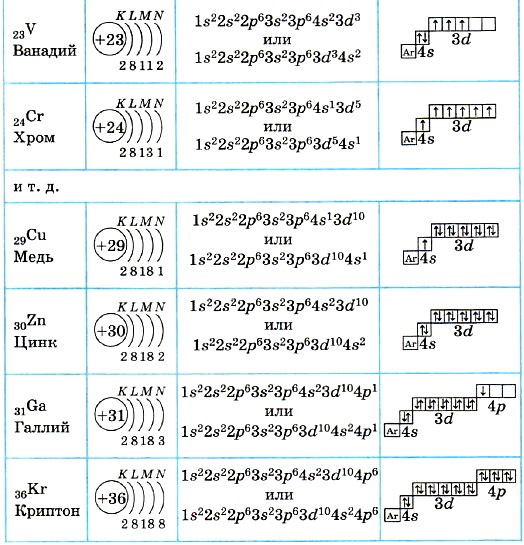
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Строение атома вольфрама (W), схема и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общие сведения о строении атома вольфрама
Относится к элементам d-семейства. Металл. Обозначение – W. Порядковый номер – 74. Относительная атомная масса – 183,84 а.е.м.
Металл. Обозначение – W. Порядковый номер – 74. Относительная атомная масса – 183,84 а.е.м.
Электронное строение атома вольфрама
Атом вольфрама состоит из положительно заряженного ядра (+74), внутри которого есть 74 протона и 109 нейтронов, а вокруг, по шести орбитам движутся 74 электрона.
Рис.1. Схематическое строение атома вольфрама.
Распределение электронов по орбиталям выглядит следующим образом:
+74W)2)8)18)32)12)2;
1s22s22p63s23p63d104s24p64f145s25p65d46s2.
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома вольфрама можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
|
6 |
0 |
0 |
+1/2 |
|
s |
6 |
0 |
0 |
-1/2 |
|
d |
5 |
2 |
-2 |
+1/2 |
|
d |
5 |
2 |
-1 |
+1/2 |
|
d |
5 |
2 |
0 |
+1/2 |
|
d |
5 |
2 |
+1 |
+1/2 |
Наличие четырех неспаренных электронов свидетельствует о том, что степень окисления вольфрама равна +4.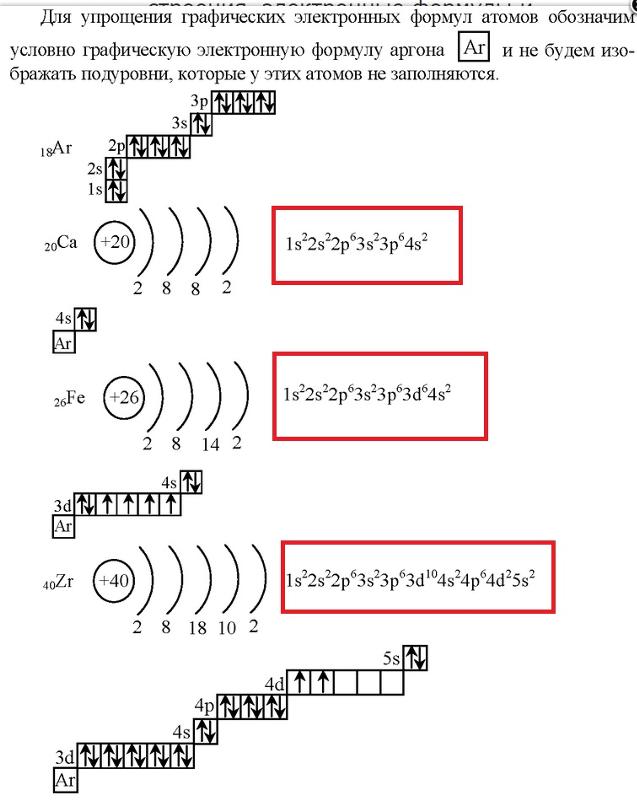
Для вольфрама характерно наличие возбужденного состояния за счет вакантных орбиталей 5p-подуровня (степень окисления +6):
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Вольфрам, атомарная структура – Стоковая фотография – C018/3755
Похоже, вы используете устаревший веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3755
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Надпись
Вольфрам (W). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома вольфрама-184 (атомный номер: 74), наиболее распространенного изотопа этого элемента. Ядро состоит из 74 протонов (красный) и 110 нейтронов (оранжевый). 74 электрона (белые) последовательно занимают доступные электронные оболочки (кольца). Вольфрам является переходным металлом в группе 6, периоде 6 и d-блоке периодической таблицы. Его температура плавления составляет 3422 градуса по Цельсию. Тенденции переходных металлов обусловлены электронами, заполняющими внутреннюю d-подоболочку (здесь, внутри 5-го кольца), экранируя внешние (валентные) электроны от увеличивающегося ядерного заряда.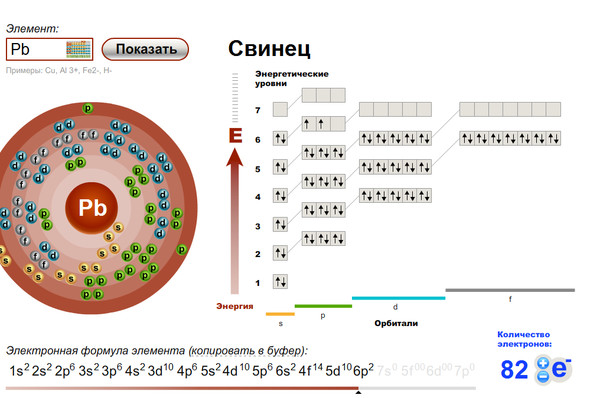
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 5d
- 5д4
- 6с
- 6с2
- а.е.м.
- атом
- атомный
- атомный номер
- атомных орбиталей
- атомный радиус
- атомный вес
- черный фон
- химические данные
- химические свойства
- химическое свойство
- химия
- д блок
- крестовина
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 6
- иллюстрация
- изотоп
- уровень
- уровней
- металл
- металлический
- металлы
- нейтрон
- нейтрон номер
- нейтронов
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- период 6
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- оболочка
- оболочковая конструкция
- снаряды
- простая электронная конфигурация
- твердый
- твердые вещества
- структурный
- структура
- субатомный
- субатомный
- подоболочка
- подоболочек
- символ
- переходный металл
- переходные металлы
- вольфрам
- вольфрам-184
- валентная орбиталь
- с
- волновая функция
Вольфрам(W) Электронная конфигурация и орбитальная диаграмма
Вольфрам — 74-й элемент в периодической таблице, его символ — «W». Вольфрам является классифицированным переходным металлом. В этой статье я подробно обсудил, как легко написать полную электронную конфигурацию вольфрама. Я также обсуждал, как нарисовать и написать орбитальную диаграмму вольфрама. Надеюсь, прочитав эту статью, вы узнаете больше об этой теме.
Вольфрам является классифицированным переходным металлом. В этой статье я подробно обсудил, как легко написать полную электронную конфигурацию вольфрама. Я также обсуждал, как нарисовать и написать орбитальную диаграмму вольфрама. Надеюсь, прочитав эту статью, вы узнаете больше об этой теме.
Какова электронная конфигурация вольфрама?
Общее число электронов в вольфраме равно семидесяти четырем. Эти электроны располагаются по определенным правилам на разных орбиталях. Расположение электронов в вольфраме по определенным правилам на разных орбитах и орбиталях называется электронной конфигурацией вольфрама.
The electron configuration of tungsten is 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 4 6s 2 , если электроны расположены через орбитали. Электронная конфигурация может быть выполнена двумя способами.
- Электронная конфигурация через орбиту (принцип Бора)
- Электронная конфигурация через орбиталь (принцип Ауфбау)
Конфигурация электронов через орбитали следует другим принципам. Например, принцип Ауфбау, принцип Хунда и принцип запрета Паули.
Электронная конфигурация атома вольфрама на орбите
Ученый Нильс Бор первым дал представление об орбите атома. Он представил модель атома в 1913 году. Там дается полное представление об орбите.
Электроны атома вращаются вокруг ядра по определенной круговой траектории. Эти круговые пути называются орбитами (оболочками). Эти орбиты выражаются через n. [n = 1,2,3,4 . . . Порядковый номер орбиты]
K — название первой орбиты, L — второй, M — третьей и N — название четвертой орбиты. Электронная удерживающая способность каждой орбиты составляет 2n 2 .
| Shell Number (n) | Shell Name | Electrons Holding Capacity (2n 2 ) |
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 18 |
| 4 | N | 32 |
.
Максимальная емкость для электронов на K-орбите составляет 2n 2 = 2 × 1 2 = 2,
Максимальная емкость для удержания электронов на L-орбите равна 2n 2 = 2 × 2 2 = 8,
Максимальная вместимость электронов на М-орбите составляет 2n 2 = 2 × 3 2 = 18,
Максимальная емкость электронов на N-орбите составляет 2n 2 = 2 × 4 2 = 32,
Таким образом, максимальная емкость удерживания электронов на первой оболочке равна двум, на второй оболочке — восьми, а на третьей оболочке может быть максимум восемнадцать электронов.
Электронная конфигурация атома вольфрама (модель Бора)Атомный номер — это число электронов в этом элементе. Атомный номер вольфрама равен 74. То есть число электронов в вольфраме равно семидесяти четырем.
Следовательно, атом вольфрама будет иметь два электрона на первой оболочке, восемь на 2-й орбите, восемнадцать электронов на 3-й оболочке и тридцать два электрона на 4-й оболочке.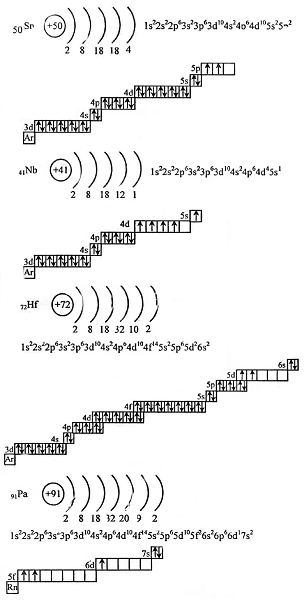
Согласно формуле Бора, пятая оболочка будет иметь четырнадцать электронов, но пятая оболочка вольфрама будет иметь двенадцать электронов, а оставшиеся два электрона будут в шестой оболочке.
Следовательно, порядок числа электронов в каждой оболочке атома вольфрама(W) равен 2, 8, 18, 32, 12, 2. Электроны можно правильно расположить по орбитам от элементов с 1 по 18.
Электронная конфигурация элемента с атомным номером больше 18 не может быть правильно определена в соответствии с атомной моделью Бора. Электронная конфигурация всех элементов может быть сделана через орбитальную диаграмму.
Электронная конфигурация вольфрама через орбиталь
Энергетические оболочки атома подразделяются на подэнергетические уровни. Эти подэнергетические уровни также называются орбитальными. Наиболее вероятная область вращения электрона вокруг ядра называется орбитальной.
Подэнергетические уровни зависят от азимутального квантового числа. Выражается буквой «л». Значение «l» от 0 до (n – 1). Подэнергетические уровни известны как s, p, d и f.
Значение «l» от 0 до (n – 1). Подэнергетические уровни известны как s, p, d и f.
| Orbit Number | Value of ‘l’ | Number of subshells | Number of orbital | Subshell name | Electrons holding capacity | Electron configuration |
| 1 | 0 | 1 | 1 | 1s | 2 | 1s 2 |
| 2 | 0 1 | 2 | 1 3 | 2s 2p | 2 6 | 2s 2 2p 6 |
| 3 | 0 1 2 | 3 | 1 3 5 | 3s 3p 3d | 2 6 10 | 3s 2 3p 6 3d 10 |
| 4 | 0 1 2 3 | 4 | 1 3 5 7 | 4s 4p 4d 4f | 2 6 10 14 | 4S 2 4P 6 4D 10 4F 14 |
- ...
- .
- .
- ............ п – 1) = (1–1) = 0 903:00 Следовательно, значение «l» равно 0. Таким образом, уровень подэнергии равен 1 с.
- Если n = 2,
(n – 1) = (2–1) = 1.
Следовательно, значение «l» равно 0, 1. Итак, подэнергетические уровни 2s и 2p. - Если n = 3,
(n – 1) = (3–1) = 2.
Следовательно, значение «l» равно 0, 1, 2. Таким образом, уровни подэнергии – это 3s, 3p и 3д. - Если n = 4,
(n – 1) = (4–1) = 3
Следовательно, значение ‘l’ равно 0, 1, 2, 3. Итак, подэнергетические уровни 4s, 4p, 4г и 4е. - Если n = 5,
(n – 1) = (n – 5) = 4. Какой символ обозначает вольфрам?
Ответ: Обозначение вольфрама — буква W.
Сколько электронов у вольфрама?
Ответ: 74 электрона.

- ....102929.10299. 9029.10299..
Следовательно, l = 0,1,2,3,4. Количество подоболочек будет 5, но 4s, 4p, 4d и 4f в этих четырех подоболочках можно расположить электроны всех элементов таблицы Менделеева.
Наименование подсшейло. ) ) | Electrons holding capacity 2(2l+1) | |||||||
| s | Sharp | 0 | 0 | 1 | 2 | |||
| p | Principal | 1 | −1, 0, +1 | 3 | 6 | |||
| D | Диффузный | 2 | −2, -1, 0, +1, +2 | 5 | 92502502502502502502502502502502502502502502502502502502502502502502502502н5н0н5н0н5ат.3 | −3, −2, −1, 0, +1, +2, +3 | 7 | 14 |
Орбитальное число s-подоболочки равно единице, трем в p-подоболочка, пять в d-подоболочке и семь в f-подоболочке. Каждая орбиталь может иметь максимум два электрона.
Каждая орбиталь может иметь максимум два электрона.
Подэнергетический уровень «s» может содержать максимум два электрона, «p» может содержать максимум шесть электронов, «d» может содержать максимум десять электронов, а «f» может содержать максимум четырнадцать электронов. электроны.
Электронная конфигурация через принцип AufbauAufbau — это немецкое слово, означающее наращивание. Основными сторонниками этого принципа являются ученые Нильс Бор и Паули. Метод Ауфбау заключается в том, чтобы выполнить конфигурацию электрона через подэнергетический уровень.
Принцип Ауфбау заключается в том, что электроны, присутствующие в атоме, сначала завершают орбиталь с самой низкой энергией, а затем постепенно продолжают завершать орбиталь с более высокой энергией.
Энергия орбитали рассчитывается по значению главного квантового числа «n» и азимутального квантового числа «l». Орбиталь, для которой значение (n + l) ниже, является орбиталью с низкой энергией, и электрон выйдет на эту орбиталь первым.
| Orbital | Orbit (n) | Azimuthal quantum number (l) | Orbital energy (n + l) |
| 3d | 3 | 2 | 5 |
| 4s | 4 | 0 | 4 |
Здесь энергия 4s-орбитали меньше энергии 3d. Таким образом, электрон сначала попадет на 4s-орбиталь, а затем перейдет на 3d-орбиталь, когда 4s-орбиталь будет заполнена. Метод ввода электронов на орбитали по принципу Ауфбау: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Первые два электрона вольфрама выходят на 1s-орбиталь. На s-орбитали может быть максимум два электрона. Следовательно, следующие два электрона переходят на 2s-орбиталь.
Следовательно, следующие два электрона переходят на 2s-орбиталь.
На p-орбитали может быть максимум шесть электронов. Итак, следующие шесть электронов переходят на 2р-орбиталь. Вторая орбита теперь заполнена. Итак, оставшиеся электроны выйдут на третью орбиту.
Затем два электрона выйдут на 3s-орбиталь, а следующие шесть электронов окажутся на 3p-орбитали третьей орбитали. Теперь орбиталь 3p заполнена. Итак, следующие два электрона перейдут на 4s-орбиталь, а десять электронов перейдут на 3d-орбиталь.
3-я орбиталь заполнена. Итак, следующие шесть электронов переходят на 4р-орбиталь. Затем следующие десять электронов перейдут на 4d-орбиталь. Теперь 4d-орбиталь заполнена. Итак, следующие восемь электронов переходят на 5p- и 6s-орбиталь, а следующие четырнадцать электронов переходят на 4f-орбиталь.
Орбиталь 4f теперь заполнена электронами. Итак, оставшиеся четыре электрона перейдут на 5d-орбиталь. Следовательно, полная электронная конфигурация вольфрама будет 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 4 6s 2 .
Примечание: Короткая электронная конфигурация вольфрама [Xe] 4f 14 5d 4 6s 2 . При записи электронной конфигурации вы должны писать последовательно.
Как написать орбитальную диаграмму вольфрама?
Чтобы построить орбитальную диаграмму атома, сначала нужно знать принцип Хунда и принцип запрета Паули.
Принцип Хунда заключается в том, что электроны на разных орбиталях с одинаковой энергией будут располагаться таким образом, чтобы они могли находиться в неспаренном состоянии максимального числа, а спин неспаренных электронов будет однонаправленным.
А принцип исключения Паули состоит в том, что значения четырех квантовых чисел двух электронов в атоме не могут быть одинаковыми. Чтобы написать орбитальную диаграмму вольфрама (W), вы должны сделать электронную конфигурацию вольфрама.
Подробно обсуждалось выше. 1s — ближайшая к ядру орбиталь с наименьшей энергией. Следовательно, электрон сначала выйдет на 1s-орбиталь.
Следовательно, электрон сначала выйдет на 1s-орбиталь.
Согласно принципу Хунда, первый электрон войдет по часовой стрелке, а следующий электрон войдет на 1s-орбиталь против часовой стрелки. Орбиталь 1s теперь заполнена двумя электронами.
Орбитальная диаграмма вольфрамаЗатем следующие два электрона перейдут на 2s-орбиталь точно так же, как и на 1s-орбиталь. Следующие три электрона войдут на 2p-орбиталь по часовой стрелке, а следующие три электрона войдут на 2p-орбиталь в направлении против часовой стрелки.
Затем следующие два электрона перейдут на 3s-орбиталь, как и на 1s-орбиталь, а следующие шесть электронов перейдут на 3p-орбиталь, как на 2p-орбиталь. Теперь орбиталь 3p заполнена. Итак, следующие два электрона попадут на 4s-орбиталь точно так же, как и на 1s-орбиталь.
Затем следующие пять электронов перейдут на 3d-орбиталь по часовой стрелке, а следующие пять электронов перейдут на 3d-орбиталь против часовой стрелки.
3-я орбиталь заполнена. Таким образом, следующие шесть электронов попадут на 4p-орбиталь так же, как и на 2p-орбиталь. Затем следующие два электрона перейдут на 5s-орбиталь, как и на 1s-орбиталь, а следующие десять электронов перейдут на 4d-орбиталь, как на 3d-орбиталь.
Таким образом, следующие шесть электронов попадут на 4p-орбиталь так же, как и на 2p-орбиталь. Затем следующие два электрона перейдут на 5s-орбиталь, как и на 1s-орбиталь, а следующие десять электронов перейдут на 4d-орбиталь, как на 3d-орбиталь.
4d-орбиталь теперь заполнена электронами. Затем следующие восемь электронов попадут на орбиталь 5p и 6s точно так же, как на орбиталь 2p и 1s. 6s-орбиталь теперь заполнена электронами.
Итак, следующие семь электронов выйдут на орбиталь 4f по часовой стрелке, а оставшиеся семь электронов войдут на орбиталь 4f против часовой стрелки.
Орбиталь 4f теперь заполнена электронами. Итак, оставшиеся четыре электрона выходят на 5d-орбиталь по часовой стрелке. Это хорошо видно на рисунке орбитальной диаграммы вольфрама.

 9.
9.