Урок «Строение электронных оболочек атомов»
Урок химии в 8 классе. «______»_______________ 20___ г.
Строение электронных оболочек атомов.
Цель. Способствовать формированию представлений о электронной оболочке атомов; создать условия для формирования умений составлять электронные формулы атомов химических элементов.
Задачи.
Образовательные: объяснить физический смысл номера группы и периода, составить схемы строения атомов первых 20 элементов ПСХЭ
Развивающие: формировать умения составлять электронные формулы атомов химических элементов и их графические конфигурации на основании правил и принципов заполнения электронных оболочек атомов; развивать умения сравнивать, анализировать, выделять главное.
Воспитательные: формировать мировоззрение к окружающему миру.
Ход урока.
1. Орг. момент.
2. Актуализация знаний.
1) Из чего состоит атом?
2) Определите число протонов, нейтронов, электронов у следующих элементов: мышьяк, цезий, криптон, бром, кальций, селен.
3) Определите число протонов, нейтронов, электронов у следующих у изотопов: 39К, 40К, 26 Мg, 29Al.
4) Домашнее упражнение. Упр. 2 стр.49
3. Изучение новой темы.
Электроны, двигаясь вокруг ядра атома, образуют в совокупности его электронную оболочку.
Число электронов в атоме равно заряду ядра атома и порядковому номеру.
Электроны в атоме различаются своей энергией, одни из них притягиваются к ядру сильнее, другие слабее. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки, чем дальше они от ядер, тем легче их оторвать.
Электроны образуют электронные слои, каждый слой состоит из электронов с близким значением энергии; поэтому электронные слои называют еще энергетическими уровнями.
Число энергетических уровней равно номеру периода.
Задание. Для первых 20 химических элементов укажите число энергетических уровней.
Например, +1 Н )
Максимальное число электронов находящихся на энергетическом уровне рассчитывается по формуле 2n2, гдеn – номер уровня.
1 эн. уровень максимально содержит 2 ē;
2 эн. уровень максимально содержит 8 ē;
3 эн. уровень максимально содержит 18 ē;
Число электронов на внешнем энергетическом уровне равно номеру группы (для главных подгрупп).
Задание. Распределите электроны по энергетическим уровням для первых20 химических элементов.
Движущийся в пространстве вокруг атомного ядра электрон образует электронные облака, их еще называют орбиталями. Электронные облака имеют разную форму. (s, p,d,f)
Таким образом электронная формула атомов имеет общий вид – 1s 2s2p 3s3p4s
Максимальное число электронов на s- подуровнях 2ē, на p – 6ē.
Задание. Составьте электронные формулы для первых20 химических элементов.
Домашнее задание.§8 упр. 3 стр. 52
Строение электронных оболочек атомов. ( 2 урок)
Цель. Способствовать формированию представлений о электронной оболочке атомов; создать условия для формирования умений составлять электронные формулы атомов химических элементов.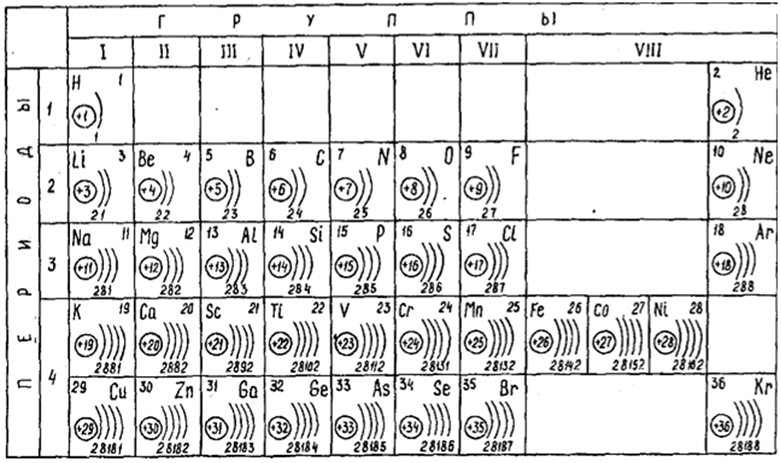
Задачи.
Образовательные: объяснить физический смысл номера группы и периода, составить схемы строения атомов первых 20 элементов ПСХЭ
Развивающие: формировать умения составлять электронные формулы атомов химических элементов и их графические конфигурации на основании правил и принципов заполнения электронных оболочек атомов; развивать умения сравнивать, анализировать, выделять главное.
Воспитательные: формировать мировоззрение к окружающему миру.
Ход урока.
1. Орг. момент.
2. Повторение изученного материала.
Дополните фразу.
Число электронных слоев в атоме, заполняемых электронами равно номеру …
Число электронов на внешнем слое у элементов главных подгрупп равно номеру …
Максимальное число электронов на третьем энергетическом уровне атома равно….
Максимальное число электронов на s- орбитали равно …
Число электронов на внешнем энергетическом уровне у фосфора равно …
Число энергетических уровней у атома хлора равно …
Упражнения.
1. Выпишите электронные схемы, соответствующие атомам химических элементов 2-го периода периодической таблицы Д.И. Менделеева:
а) 2ē,8ē,2ē
б) 2ē, 5ē
в) 2ē,2ē
г) 2ē,8ē, 8ē,2ē
д) 2ē,8ē
е) 2ē
ж) 2ē, 7ē
2. Выпишите электронные схемы, соответствующие атомам химических элементов 2-й группы главной подгруппы периодической таблицы Д.И. Менделеева:
а) 2ē,1ē
б) 2ē,8ē,2ē
в) 2ē
г) 2ē,8ē, 8ē,2ē
д) 2ē,6ē
е) 2ē,2ē
ж) 2ē,8ē,18ē,8ē,2ē
3. Поставьте правильное значение в схемах вместо Э, х, у. Составьте электронные формулы для данных схем атомов.
+11 Э)2)х)1
+Х Э)2)8)7
+13 Э)х)8)у
+5 Э)х)у
+Х Э)2)у)4
+6 Э)х)у
4. Определите химический элемент по электронной формуле, укажите его положение в ПСХЭ Д.И. Менделеева, укажите состав ядра атома.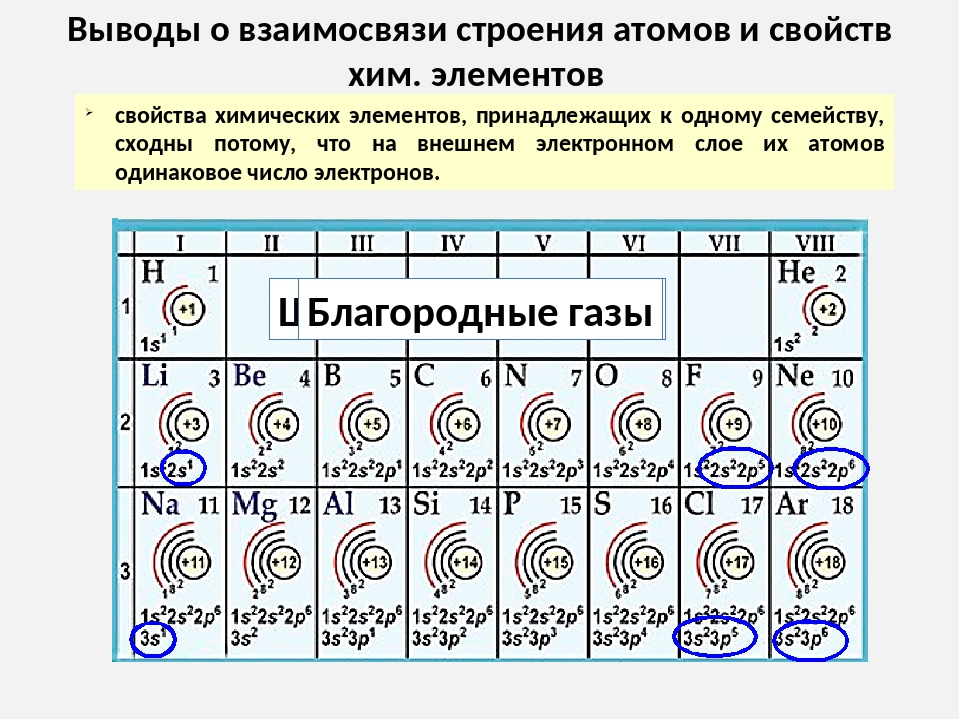
а) 1s2 2s2 2p6 3s2 3p4
б)1s2 2s2 2p4
в)1s2 2s2 2p6 3s2 3p6 4s1
Самостоятельная работа.
Дан ряд чисел: 3, 7, 9, 10, 15, 19, 22, 25, 30,32, которыми обозначены порядковые номера химических элементов в ПСХЭ Д.И. Менделеева.
1 вариант. Выпишите номер элемента 3- го периода
2 вариант. Выпишите номер элемента 7 группы главной подгруппы.
для данных элементов укажите:
Положение в ПС.
Определите число протонов и нейтронов
Составьте электронную формулу для данного элемента.
Домашнее задание.§ 8 упр.1 стр.52
Химический элемент, имеющий схему строения атома + 12 2, 8, 2 в Периодической системе занимает положение 1. 2- й период
Для того чтобы понять, какой химический элемент подразумевается в данном задании – проанализируем предложенное строение атома искомого химического элемента, воспользовавшись такими правилами:
- заряд атомного ядра элемента всегда соответствует его номеру в периодической системе Д.
 И. Менделеева;
И. Менделеева; - заряд ядра атома равен также общему количеству электронов в каждом атоме данного элемента;
- правильность расчетов можно проверить так: сумма положительных и отрицательных зарядов, в каждом атоме, равна нулю.
Решение задания
Исходя из всего вышеизложенного, можно сделать вывод о том, что, поскольку заряд атомного ядра заданного элемента равен (+12) – номер искомого элемента в периодической системе также двенадцатый. Вокруг атомного ядра этого элемента вращаются также 12 электронов, каждый с зарядом (-1).
Проверим расчеты: (+12) – 1*12= 0. Все верно. Остается только открыть периодическую систему Д.И. Менделеева и убедиться, что речь в задании идет об элементе Mg (магний).
Магний расположен в периодической системе на пересечении третьего периода и второй группы. Это элемент главной подгруппы. Следовательно, правильным является третье утверждение из задания: «3.3-й период главная подгруппа 2 группа».
Немного подробнее об электронном строении атома магния
Распределение электронов атома магния по энергетическим уровням таково:
- на первом уровне вращаются 2 спаренных s-электрона.
 Этот уровень заполнен полностью.
Этот уровень заполнен полностью. - На втором уровне имеются 2 s-электрона и 6 р-электронов. Все электроны спарены, уровень заполнен полностью.
- На третьем уровне атома Mg расположены два валентных s-электрона. Именно их атом магния может отдать атомам других химических элементов, при образовании химической связи.
Поскольку два валентных электрона отдать легко – магний всегда является восстановителем. В ходе химической реакции, атом магния превращается в положительно заряженный ион (катион), с зарядом (+2): Mg+2.
Например, реакция окисления магния:
2Mg0 + (O2)0 → 2Mg+2O-2.
Периодическая система и электронное строение атома
Элементы фтор F, хлор С1, бром Вг, иод I и астат At составляют V1IA группу Периодической системы Д. И. Менделеева. Групповое название этих элементов — галогены. Строение валентного электронного уровня атомов галогенов одинаково ns np атом фтора не имеет /г -подуровня, поэтому он образует только одну ковалентную связь.
Атом кислорода, располагаясь в главной подгруппе шестой группы периодической системы, имеет электронное строение ls 2s 2p, структура его внешнего электронного слоя выражается схемой [c.134]
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один электрон, который может быть отдан атомам других элементов. Поскольку это свойство проявляют атомы всех элементов, начинающих периоды,— Ыа, К, НЬ, s, Рг, то и водород должен стоять в главной подгруппе I группы. С другой стороны, поскольку атом водорода обладает способностью, подобно атомам галогенов, присоединять один электрон (Н+е =Н ), т. е. проявляет неметаллические свойства, он должен находиться в главной подгруппе VII группы. Такая двойственность в химическом поведении водорода является причиной того, что его помещают в двух подгруппах.
На рис. 2 схематически изображено строение атомов водорода, гелия и лития. Атом самого легкого элемента — водорода состоит из двух частиц. Вокруг ядра вращается один электрон. Вокруг ядра гелия вращаются уже два электрона, вокруг ядра лития — три. Чем тяжелее атом, тем сложнее его строение. Например, кислород, занимающий восьмое место в периодической системе элементов, имеет восемь электронов два из них вращаются на /С-оболочке, остальные шесть— на -оболочке. Конечно, приведенные модели атомов отражают их строение весьма схематично. На самом деле прост- [c.18]
Побочную группу VI группы периодической системы д. И. Менделеева образуют переходные металлы хром Сг, молибден Мо, вольфрам W. Электронное строение атомов этих элементов характеризуется наличием незаполненной -оболочки, причем атомы хрома и молибдена имеют неспарепные s-электроны, а атом вольфрама содержит пару (6s ) электронов  210]
210]
Строение комплекса меди [Си(ЫНз)4] + совершенно иное, чем у аналогичного комплекса цинка (хотя медь и цинк — элементы одного, четвертого периода Периодической системы). Результаты магнитных измерений указывают на наличие в этом ионе одного неспаренного электрона. Это можно объяснить следующим образом. Невозбужденный атом меди имеет один 45-электрон (рис. 3.27,а). При образовании иона Си + отрываются этот электрон и один электрон с З -подуровня таким образом, ион Си + имеет один неспаренный электрон на 3 -подуровне (рис. 3.27,6). Известно, что комплекс [Си(ЫНз)4] + квадратный. В квадратных комплексах других -элементов с координационным числом 4 электронные орбитали центрального атома находятся в состоянии бр -гибридизации. Поэтому можно предположить, что неспаренный электрон с З -подуровня
С позиций строения атома объяснимо положение водорода в периодической системе. Атом водорода имеет один внешний электрон, который может быть отдан атомам других элементов.

С развитием электронной теории строения атомов стало ясно, что химические свойства элементов являются функцией электронной стрз ктуры атомов. Отсюда следует, что в качестве объективного критерия, однозначно определяющего положение элемента в Периодической системе, целесообразно выбрать именно электронное строение атома. Поэтому в развитии Периодического закона выделяют три этапа. На первом этапе в качестве аргумента, определяющего свойства элементов, была выбрана атомная масса и закон был сформулирован Д.И.Менделеевым следующим образом “Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от их атомного веса”. На втором этапе было выяснено значение атомного номера, который, как оказалось, определяет заряд ядра атома. Открытие изотопов и изобаров показало, что истинным аргументом, определяющим природу элемента, является именно заряд ядра, а не атомная масса.
Используемое ныне в научной литературе выражение “превращение химических элементов” некорректно. Оно подменяет конкретный объект превращения (атом), неопределенным понятием (химический эле.мент). Недостатком формулировки закона радиоактивных смещений (правильнее превращений ) является то, что она не выделяет подвиды атомов как объект превращения. Она, по-прежнему, “вяжет” их к смещениям в Периодической системе. Возникает принципиальное несоответствие между законом и наглядной его иллюстрацией. Периодическая система химических элементов имеет в основе своей структуры устройство электронной оболочки атомов. Строение ядра имеет здесь лишь опосредованное значение через равенство Ерц. = 1 . Закон же радиоактивных превращений касается исключительно ядерных преобразований и индифферентен (в рамках данных рассмотрений ) к структуре электронной оболочки.
Атом элемента VII группы Периодической системы состоит из 28 элементарных частиц, а атом элемента V группы — из 21. Каков заряд ядер этих атомов Приведите схему строения их электронных оболочек. [c.67]
Атом первого элемента в Периодической системе — водорода — обладает наипростейшим строением. Он состоит всего из двух частиц протона и электрона, — между которыми существуют лишь силы притяжения. Не случайно именно для атома водорода оказалась успешно применимой первая квантовая теория — теория Бора, и только для этого атома волновое уравнение Шредингера имеет точное решение.
Заряд атомного ядра по величине совпадает с порядковым номером элемента в периодической системе число электронов равно заряду ядра. Атом в целом нейтрален, т. е. сумма отрицательных зарядов компенсирована положительным зарядом ядра.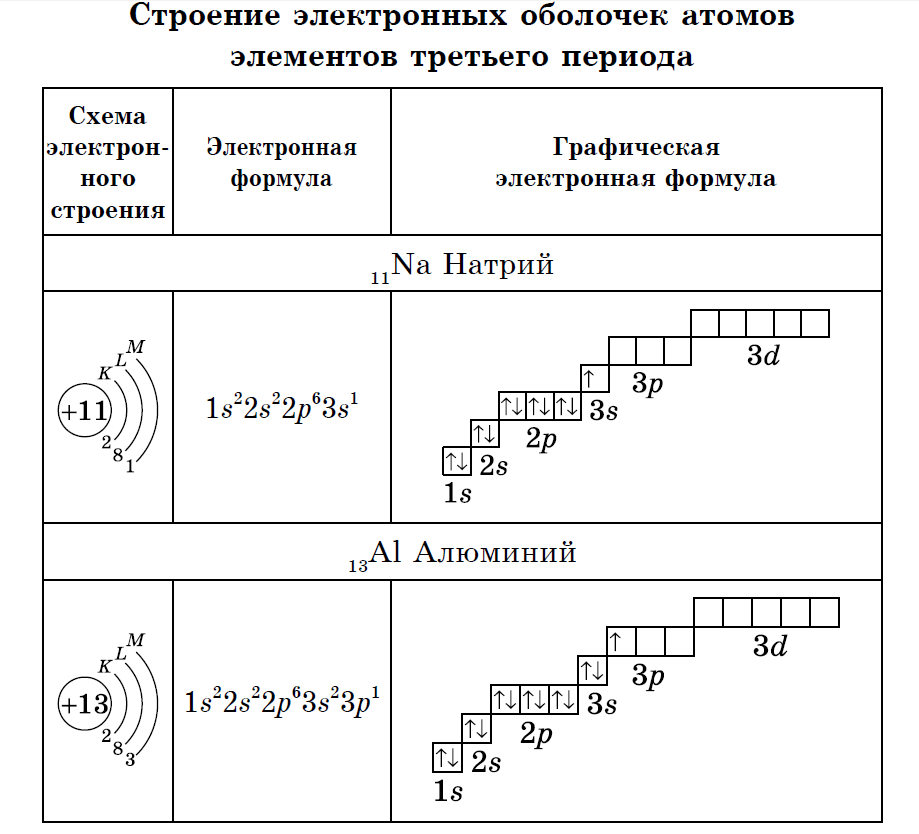 Размеры атомного ядра (диаметр 10 — 10 м) весьма малы по сравнению с размерами атома (диаметр 10 м), но почти вся его масса сосредоточена в ядре ( 99,97 %). А так как масса является мерой энергии, то в ядре сосредоточена почти вся энергия атома. Плотность ядерного вещества огромна ( 10 кг/м ). Заряд ядра определяет не только общее число электронов, но и электронное строение атомов, а следовательно, их физико-химические свойства.
Размеры атомного ядра (диаметр 10 — 10 м) весьма малы по сравнению с размерами атома (диаметр 10 м), но почти вся его масса сосредоточена в ядре ( 99,97 %). А так как масса является мерой энергии, то в ядре сосредоточена почти вся энергия атома. Плотность ядерного вещества огромна ( 10 кг/м ). Заряд ядра определяет не только общее число электронов, но и электронное строение атомов, а следовательно, их физико-химические свойства.
Рассмотрим строение атома какого-нибудь элемента, например натрия, с позиций протонно-нейтронной теории. Порядковый номер натрия в периодической системе 11, массовое число 23. В соответствии с порядковым номером заряд ядра натрия равен 11+. Следовательно, в атоме натрия имеется И электронов, сумма зарядов которых равна положительному заряду ядра. Если атом натрия потеряет один электрон, то положительный заряд ядра будет на единицу больше суммы отрицательных зарядов электронов (10), и атом натрия станет ионом с зарядом 1+. Заряд ядра атома равен сумме зарядов 11 протонов, находящихся в ядре, масса [c. 41]
41]
Строение атома. Атом состоит из положительно заряженного ядра, в котором сосредоточена практически вся его масса, и вращающихся вокруг ядра электронов. Атом в целом нейтрален, поэтому заряд ядра и общий заряд всех электронов равны между собой. Число электронов меняется у атомов разных элементов. Порядковый номер элемента в периодической системе Д. И. Менделеева показывает, каков заряд ядра и сколько электронов содержится в нейтральном атоме этс- [c.32]
Следует подчеркнуть, что периодическая система элементов Д. И. Менделеева явилась исходным пунктом для решения вопроса о строении атома и для создания его модели. Так, согласно ядерной модели наиболее просто устроен атом водорода ядро несет один элементарный положительный заряд, а в поле ядра по орбите движется один электрон. Порядковый номер железа 26. Значит, положительный заряд ядра равен 26, а в поле ядра нейтрального атома движется 26 электронов.
 У элемента курчатовия (2 = 104) положительный заряд ядра равен 104, а в поле ядра движется 104 электрона. Аналогично можно представить и строение атомов других элементов. [c.30]
У элемента курчатовия (2 = 104) положительный заряд ядра равен 104, а в поле ядра движется 104 электрона. Аналогично можно представить и строение атомов других элементов. [c.30] При заполнении электронных слоев и оболочек атомы подчиняются 1) принципу наименьшей энергии, согласно которому электроны сначала заполняют вакантные орбитали с минимальной энергией 2) принципу Паули 3) правилу Гунда — на вырожденных орбиталях суммарное спиновое число электронов должно быть максимальным. В квантовых ячейках с одинаковой энергией заселение электронами происходит так, чтобы атом имел наибольшее число неспаренных электронов. Это отвечает нормальному состоянию атома (минимум энергии). Рассмотрим связь между электронным строением атомов и положением элементов в короткой 8-клеточной Периодической сис ме (см. форзац). У каждого следующего элемента Периодической системы по сравнению с предыдущим на один электрон больше. Наиболее прост первый период системы, состоящий лишь из двух элементов. У водорода единственный электрон заселяет наинизшую по энергии орбиталь 1 , а у гелия на этой орбитали два электрона с антипарал-лельными спинами. Гелием заканчивается первый период системы и исчерпаны все вариации квантовых чисел при п = I. Таким образом, у атома гелия полностью формируется наиболее близкий к ядру А -слой. [c.40]
У водорода единственный электрон заселяет наинизшую по энергии орбиталь 1 , а у гелия на этой орбитали два электрона с антипарал-лельными спинами. Гелием заканчивается первый период системы и исчерпаны все вариации квантовых чисел при п = I. Таким образом, у атома гелия полностью формируется наиболее близкий к ядру А -слой. [c.40]
Общими физическими свойствами, характеризующими металлы, обладают в свободном состоянии 82 элемента из 105. Естественно предположить, что атомы этих элементов должны быть сходными и по строению. Атомы элементов главных подгрупп I—III групп периодической системы на внешнем энергетическом уровне имеют мало электронов (от одного до трех) и, стремясь принять более устойчивое состояние (структуру атомов благородных газов), сравнительно легко отдают эти электроны, превращаясь в положительно заряженные ионы. Эта особенность обусловливает своеобразное строение кристаллической решетки металлов, которая состоит из положительных ионов и атомов, находящихся в узлах решетки.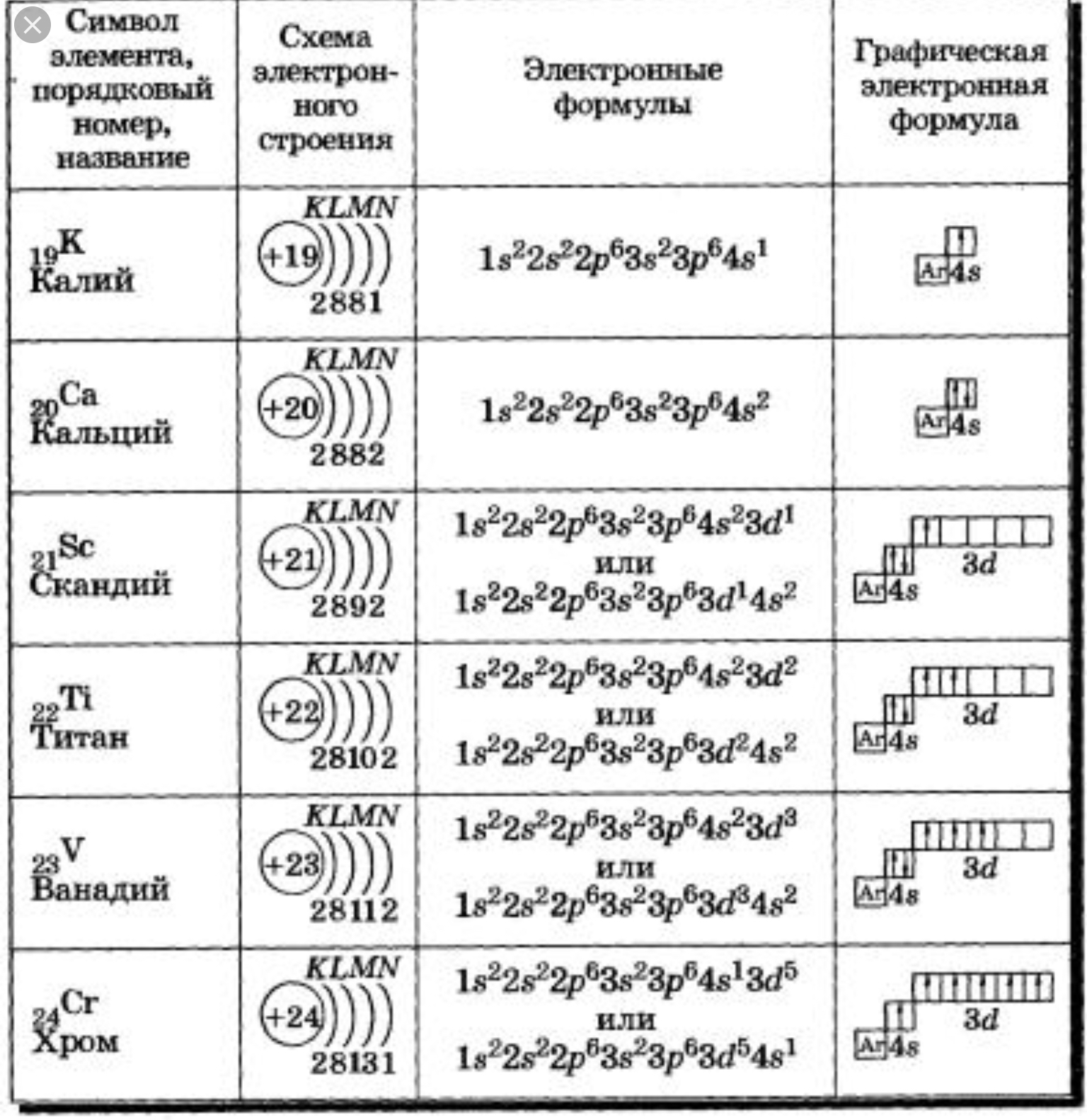 Между узлами находятся электроны, не принадлежащие каким-либо определенным атомам. Малые размеры электронов позволяют им более или менее свободно перемещаться по всему кристаллу металла, переходя от одного атома или иона к другому атому или иону. При достаточном сближении электронов с ионами образуются нейтральные атомы, которые снова распадаются на ионы и электроны. Следовательно, в кристалле металла существует своеобразное равновесие [c.390]
Между узлами находятся электроны, не принадлежащие каким-либо определенным атомам. Малые размеры электронов позволяют им более или менее свободно перемещаться по всему кристаллу металла, переходя от одного атома или иона к другому атому или иону. При достаточном сближении электронов с ионами образуются нейтральные атомы, которые снова распадаются на ионы и электроны. Следовательно, в кристалле металла существует своеобразное равновесие [c.390]
В настоящее время особенности атома углерода объясняются его строением и положением в периодической системе элементов Д. И. Менделеева. Атом углерода имеет четыре валентных электрона и обладает одинаковой способностью как к отдаче, так и к присоединению их. В органических соединениях химическая связь ковалентная. Атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. В этом случае каждый атом углерода на внешнем уровне будет иметь восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.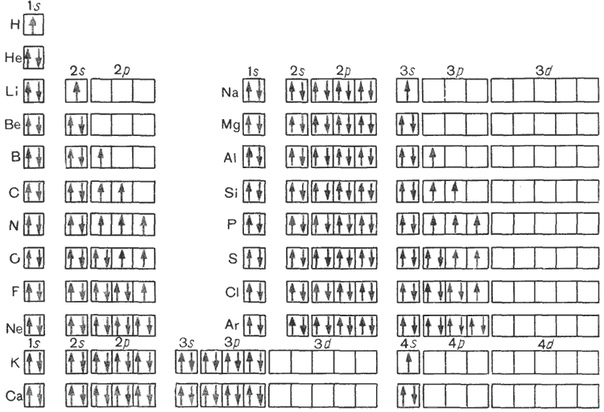 [c.307]
[c.307]
Схематически влияние р-металла III группы периодической системы на проводимость полупроводника (Ое) показано на рис. 204. Захватывая электроны из о-связи Ое—Ое, атом Оа обращается в отрицательный ион, создавая этим самым электронную вакансию, или дырку . Таким образом, создается примесная проводимость полупроводников, очень сильно изменяющая их электрические свойства. Подбор донорных и акцепторных примесей показан в табл. 127, где приведена часть периодической системы Д. И. Менделеева, из которой исключены – и /-металлы, электронное строение которых является особым (гл. XII). [c.448]
Бор — первый р-элемент в периодической системе элементов. Строение внешних электронных оболочек его атома в невозбужденном состоянии 25 Ввзбуждение переводит атом в состояние [c.327]
Магний расположен в главной подгруппе второй группы периодической системы элементов Д. И. Менделеева. Порядковый номер его 12, атомный вес 24,312.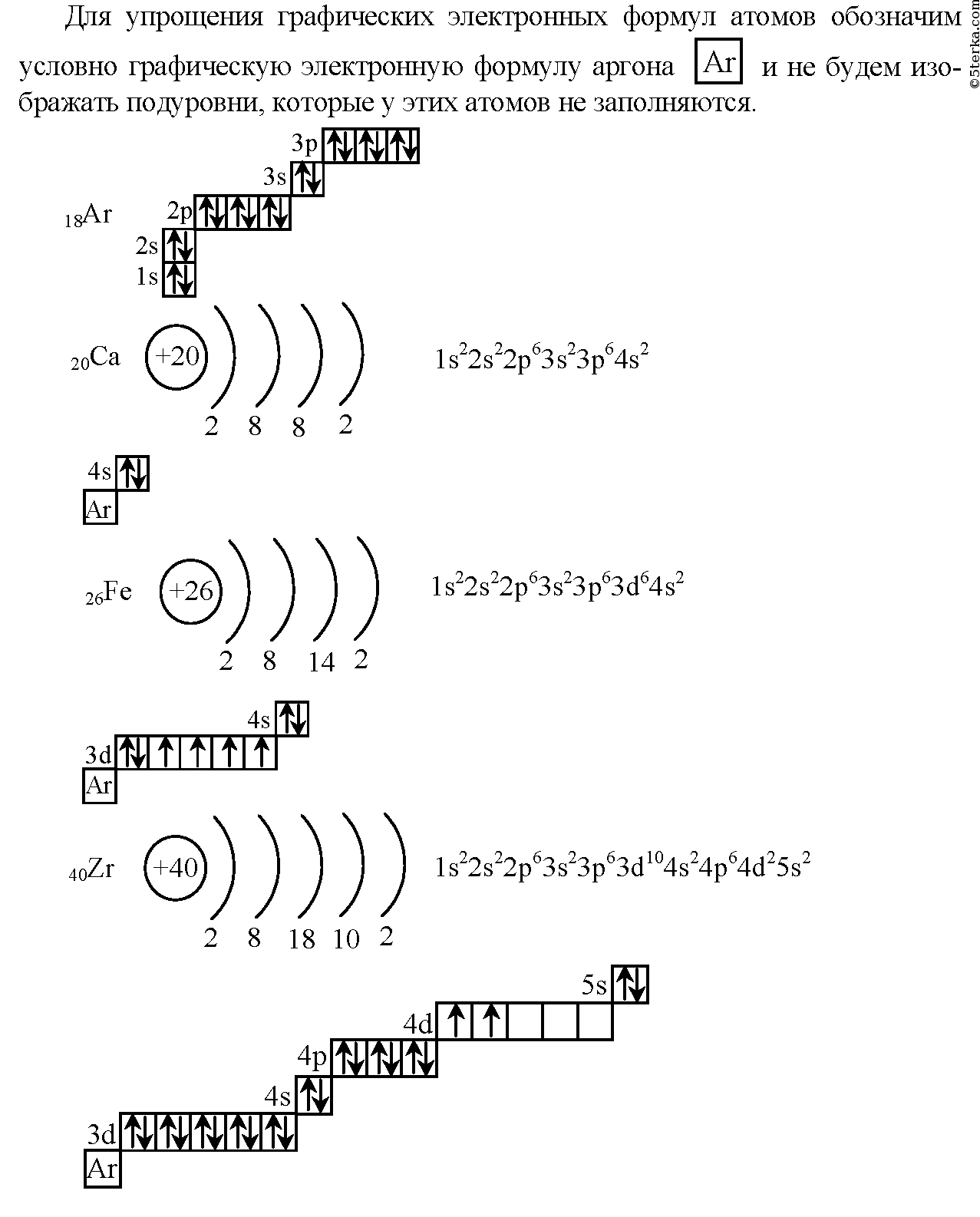 Электронная конфигурация атома-магния в невозбужденном состоянии 1х 25 /) 35 валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность 2- -. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации поэтому магний в химич ском отношении очень активен. На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
Электронная конфигурация атома-магния в невозбужденном состоянии 1х 25 /) 35 валентными являются электроны наружного слоя, в соответствии с этим магний проявляет валентность 2- -. В тесной связи со строением электронных оболочек атома магния находится его реакционная способность. Из-за наличия на внешней оболочке только двух электронов атом магния склонен легко отдавать их для получения устойчивой восьмиэлектронной конфигурации поэтому магний в химич ском отношении очень активен. На воздухе магний окисляется, но образующаяся при этом окисная пленка предохраняет металл от дальнейшего окисления. При нагревании до 600—650° С магний сгорает с образованием окиси магния МдО и частично нитрида [c.8]
Многие химические и физические процессы могут быть объяснены с помощью простых моделей строения атома, предложенных Резерфордом, Бором и другими учеными. Каждая из таких моделей, чем-то отличаясь, тем не менее предполагает, что каждый атом состоит из трех видов субатомных частиц протонов, нейтронов и электронов. Это далеко не полная картина, но для наших целей этого пока достаточно. Протоны и нейтроны образуют ядро атомов. Ядро намного тяжелее электронов. В ядре сосредоточена почти вся масса атома, но ядро занимает лишь ничтожную часть объема. Электроны движутся (часто говорят вращаются ) вблизи ядра по определенным законам. Ядро может быть описано всего лишь двумя числами — порядковым номером атома в периодической системе элементов (его называют атомным номером и обозначают символом ) и массовым числом символ А). [c.15]
Это далеко не полная картина, но для наших целей этого пока достаточно. Протоны и нейтроны образуют ядро атомов. Ядро намного тяжелее электронов. В ядре сосредоточена почти вся масса атома, но ядро занимает лишь ничтожную часть объема. Электроны движутся (часто говорят вращаются ) вблизи ядра по определенным законам. Ядро может быть описано всего лишь двумя числами — порядковым номером атома в периодической системе элементов (его называют атомным номером и обозначают символом ) и массовым числом символ А). [c.15]
Двойственность свойств водорода определяется оригинальностью строения его атома — один протон и один электрон. Потеряй водород электрон, и останется голый протон — частица, а не атом. Никакой другой элемент не имеет подобной структуры ато ма. Но где бы он ни находился — в I группе или в VII, нижняя граница периодической системы проходит по этому элементу. [c.183]
Строение атома углерода, находящегося в первом ряду IV группы периодической системы Менделеева, можно выразить схемой, изображенной на рис. 6, а. Атом углерода во внутреннем электронном слое, соответствующем атому инертного газа гелия, имеет 2 электрона, в следующем, внешнем электронном слое атом углерода имеет 4 электрона, являющихся валентными. Из курса неорганической химии известно, что наличие во внешнем электронном слое малого числа электронов (у элементов I, II и III групп) приводит к легкой потере этих электронов и превращению атомов в катионы (например, Na+, Са +, [c.27]
6, а. Атом углерода во внутреннем электронном слое, соответствующем атому инертного газа гелия, имеет 2 электрона, в следующем, внешнем электронном слое атом углерода имеет 4 электрона, являющихся валентными. Из курса неорганической химии известно, что наличие во внешнем электронном слое малого числа электронов (у элементов I, II и III групп) приводит к легкой потере этих электронов и превращению атомов в катионы (например, Na+, Са +, [c.27]
Схема, представленная на рис. 3, изображает строение атома углерода, который находится, как известно, в первом ряду IV группы периодической системы Менделеева. Схема показывает, что атом углерода имеет во внутреннем электронном слое 2 электрона, а в следующем — наружном слое — 4 электрона, которые являются валентными электронами. [c.31]
Строение ядер. Нейтральный атом состоит из плотного ядра диаметром около см, окруженного диффузным облаком электронов. Внешний диаметр этого облака равен примерно 10 см. Почти вся масса атома сосредоточена в положительно заряженном ядре. Величина заряда ядра равна целому числу зарядов электрона или 4,80223-Z эл. ст. ед. Это целое число 2 называется атомным номером. Оно совпадает с порядковым номером элемента в периодической системе элементов. Ядро состоит из 2 протонов и N нейтронов. [c.24]
Почти вся масса атома сосредоточена в положительно заряженном ядре. Величина заряда ядра равна целому числу зарядов электрона или 4,80223-Z эл. ст. ед. Это целое число 2 называется атомным номером. Оно совпадает с порядковым номером элемента в периодической системе элементов. Ядро состоит из 2 протонов и N нейтронов. [c.24]
Этими правилами определяется порядок заполнения орбиталей электронами и образование характерных электронных конфигураций атомов, что и отражено в приведенной периодической системе Д. И. Менделеева. Однако необходимо иметь в виду, что правила Клечковского не полностью охватывают все частные особенности электронной структуры атомов. Например, при переходе от атома никеля к атому меди число Зй-электронов увеличивается не на один, а сразу на два электрона за счет проскока одного 45-электрона на подуровень Зй. Таким образом, электронное строение атома меди выражается формулой 15 28 2р 35 3/7 3 г 45 . Аналогичный провал электрона с внешнего 5- на р-подуровень происходит и в атомах [c. 18]
18]
Сопоставляя полученные результаты с величинами потенцна-.лов иоиизатгии и констант основности, видим, что сравнительная протоноакцепторная способность вторичных и третичных ароматических аминов согласуется с характером изменения их основности и ионизационного потенциала третичные амины являются более сильными акцепторами протона и донорами электрона, чем вторичные. Энергии же водородной связи, образуемой атомом азота алифатических аминов с фиксированным донором протона, у третичных аминов ниже, чем у вторичных, хотя электронодо-норная способность RsN, мерой которой может служить ионизационный потенциал или прочность комплексов донориоакцептор-ного типа с переносом заряда, выше, чем у R9NH. Подобная закономерность ранее наблюдалась только для рядов соединений, функциональный атом которых меняется по столбцу Периодической системы. Результат данной работы показывает, что при большом сходстве в электронном строении атома азота вторичных и третичных аминов их способность выступать в качестве доноров электрона и акцепторов протона меняется в противоположном направлении.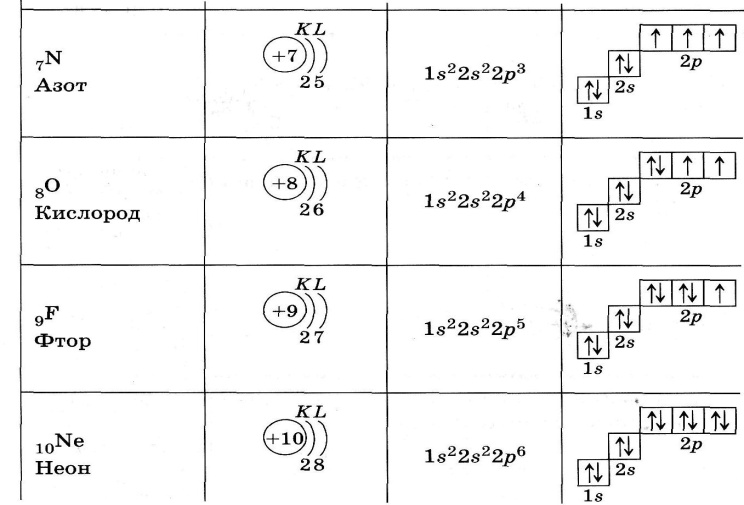 Это означает, что перенос заряда не вносит заметного вклада в энергетику рассматриваемых комплексов с водородной связью. [c.36]
Это означает, что перенос заряда не вносит заметного вклада в энергетику рассматриваемых комплексов с водородной связью. [c.36]
Бор – первый р-элемент в периодической системе элементов. Строение внешней электронной оболочки его атома в невозбужлениом состоянии 2х 2р . Возбуждение переводит атом в состояние 2f 2p p и далее в ip -тбридное валентное состояние, в котором орбитали расположены под углом 120. Этому состоянию отвечает структура соединений бора, в которых атом В связан с тремя другими атомами (три Образование донорно-акцепторной ж-связи (акцептор – атом бора) стабилизирует ip -гибридное состояние. Это приводит к уменьшению межатомных расстояний В-Г, В-О и др. Благодаря наличию в небольшом по размеру атоме бора свободной орбитали бор – один из сильнейших акцепторов неподеленных электронных пар. Многие соединения бора являются кислотами Льюиса, они энергично взаимодействуют с основаниями Льюиса, например [c.343]
Попять физический смысл валентности помогло учение о строении атомов и химической связл. Как уже отмечалось, электроны, которые участвуют в образовании химических связей между атомами, называются валентными. Зто электроны, наиболее слабо связанные с ядром. У химических элементов общее число валентных электронов в атоме, как правило, равно номеру группы периодической системы элементов Д. И. Менделеева. Так, атом серы (элемент VI группы) содержит всего 16 электронов, нз них валентных 6. К валентным относятся прежде всего электроны внешних незавершенных уровней. Однако валентными могут быть и электроны второго снаружи уровня (например, у -элементов), а также электроны третьего снаружи уровня (например, у /-элементов). [c.58]
Как уже отмечалось, электроны, которые участвуют в образовании химических связей между атомами, называются валентными. Зто электроны, наиболее слабо связанные с ядром. У химических элементов общее число валентных электронов в атоме, как правило, равно номеру группы периодической системы элементов Д. И. Менделеева. Так, атом серы (элемент VI группы) содержит всего 16 электронов, нз них валентных 6. К валентным относятся прежде всего электроны внешних незавершенных уровней. Однако валентными могут быть и электроны второго снаружи уровня (например, у -элементов), а также электроны третьего снаружи уровня (например, у /-элементов). [c.58]
В настоящее время наблюдается мощный интеллектуальный подъем в неорганической химии, который сильнее всего затронул те ее области, которые лежат на стыке с соседними дисциплинами химию металлоорганических и бионеорганических соединений, химию твердого тела, биогеохимию и др. Возрастает, в частности, уверенность ученых в том, что неорганические элементы играют важную роль в живых системах. Живые существа вовсе не являются чисто органическими. Они весьма чувствительны к ионам металлов почти всей Периодической системы Д.И. Менделеева. Некоторые ионы играют важнейшую роль в таких жизненно важных процессах, как связывание и транспорт кислорода (железо в гемоглобине), поглощение и конверсия солнечной энергии (магний в хлорофилле, марганец в фотосистеме II, железо в ферродоксине, медь во фта-лоцианине), передача электрических импульсов между клетками (кальций, калий в нервных клетках), мышечное сокращение (кальций), ферментативный катализ (кобальт в витамине В12). Это привело к взрыву творческой активности ученых в области неорганической химии биосистем. Мы начинаем изучать строение ближайшего и дальнего окружения атомов металлов в биосистемах и учимся понимать, как это окружение позволяет атому металла с такой высокой чувствительностью реагировать на изменение pH, давление кислорода, присутствие доноров или акцепторов электронов. [c.158]
Живые существа вовсе не являются чисто органическими. Они весьма чувствительны к ионам металлов почти всей Периодической системы Д.И. Менделеева. Некоторые ионы играют важнейшую роль в таких жизненно важных процессах, как связывание и транспорт кислорода (железо в гемоглобине), поглощение и конверсия солнечной энергии (магний в хлорофилле, марганец в фотосистеме II, железо в ферродоксине, медь во фта-лоцианине), передача электрических импульсов между клетками (кальций, калий в нервных клетках), мышечное сокращение (кальций), ферментативный катализ (кобальт в витамине В12). Это привело к взрыву творческой активности ученых в области неорганической химии биосистем. Мы начинаем изучать строение ближайшего и дальнего окружения атомов металлов в биосистемах и учимся понимать, как это окружение позволяет атому металла с такой высокой чувствительностью реагировать на изменение pH, давление кислорода, присутствие доноров или акцепторов электронов. [c.158]
Электронное строение и типы связей элементов периодической системы – ключ к пониманию Сфуктуры и свойств простых и сложных веществ, образованных эти. ми элементами Два или более атомов располагаются друг около друга так, как это энергетически выгодно. Это справедливо независимо от того, сильно или слабо связана фуппа атомов, содержит эта фуппа лишь несколько или 10 атомов, является расположение атомов упорядоченным (как в кристалле) или неупорядоченным (как в жидкости). Группа ато.мов устойчива тогда и только тогда, когда энергия атомов, расположенных вместе, ниже, чем у отдельных атомов. Единственной физической причиной конкретной кристаллической сфуктуры любого элемента и его модификаций является перекрытие валентных и подвалентных оболочек его атомов, приводящее к образованшо определенных межатомных связей. Число протяженность и симмефия орбиталей атомов данного конкретного элемента полностью определяют число, длину, ориентиров и энергию межатомных связей, образующихся в результате перекрытия этих орбита-лей, а следовательно, размещение атомов в пространстве, т е. кристаллическую структуру, основные физико-химические свойства элемента.
ми элементами Два или более атомов располагаются друг около друга так, как это энергетически выгодно. Это справедливо независимо от того, сильно или слабо связана фуппа атомов, содержит эта фуппа лишь несколько или 10 атомов, является расположение атомов упорядоченным (как в кристалле) или неупорядоченным (как в жидкости). Группа ато.мов устойчива тогда и только тогда, когда энергия атомов, расположенных вместе, ниже, чем у отдельных атомов. Единственной физической причиной конкретной кристаллической сфуктуры любого элемента и его модификаций является перекрытие валентных и подвалентных оболочек его атомов, приводящее к образованшо определенных межатомных связей. Число протяженность и симмефия орбиталей атомов данного конкретного элемента полностью определяют число, длину, ориентиров и энергию межатомных связей, образующихся в результате перекрытия этих орбита-лей, а следовательно, размещение атомов в пространстве, т е. кристаллическую структуру, основные физико-химические свойства элемента. [c.30]
[c.30]
Структура и принципы строения атома. Электронное строение атома
Так как при химических реакциях ядра реагирующих атомов остаются без изменений (за исключением радиоактивных превращений), то химические свойства атомов зависят от строения их электронных оболочек. Теория электронного строения атома построена на основе аппарата квантовой механики. Так, структура энергетических уровней атома может быть получена на основе квантовомеханических расчетов вероятностей нахождения электронов в пространстве вокруг атомного ядра (рис. 4.5 ).
Рис. 4.5 . Схема подразделения энергетических уровней на подуровни
Основы теории электронного строения
атома сводятся к следующим положениям:
состояние каждого электрона в атоме
характеризуется четырьмя квантовыми
числами: главным квантовым числом n
= 1, 2, 3, ;
орбитальным (азимутальным)l=0,1,2, n–1 ;
магнитнымm l = –l, –1,0,1, l ;
спиновымm s = -1/2, 1/2 .
Согласно принципу Паули , в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чиселn, l, m l , m s ; совокупности электронов с одинаковыми главными квантовыми числами n образуют электронные слои, или энергетические уровни атома, нумеруемые от ядра и обозначаемые какK, L, M, N, O, P, Q , причем в энергетическом слое с данным значениемn могут находиться не более, чем2n 2 электронов. Совокупности электронов с одинаковыми квантовыми числамиn иl , образуют подуровни, обозначаемые по мере удаления их от ядра какs, p, d, f .
Вероятностное нахождение положения
электрона в пространстве вокруг атомного
ядра соответствует принципу
неопределенностей Гейзенберга. По
квантовомеханическим представлениям,
электрон в атоме не имеет определенной
траектории движения и может находиться
в любой части пространства вокруг ядра,
а различные его положения рассматриваются
как электронное облако с определенной
плотностью отрицательного заряда. Пространство вокруг ядра, в котором
наиболее вероятно нахождение электрона,
называется орбиталью . В нем заключено
порядка 90% электронного облака. Каждому
подуровню1s,
2s, 2p и т.д. соответствует определенное
количество орбиталей определенной
формы. Например,1s –
и2s- орбитали
имеют сферическую форму, а2p -орбитали
(2p x ,
2p y ,
2p z -орбитали)
ориентированы во взаимно перпендикулярных
направлениях и имеют форму гантели
(рис. 4.6 ).
Пространство вокруг ядра, в котором
наиболее вероятно нахождение электрона,
называется орбиталью . В нем заключено
порядка 90% электронного облака. Каждому
подуровню1s,
2s, 2p и т.д. соответствует определенное
количество орбиталей определенной
формы. Например,1s –
и2s- орбитали
имеют сферическую форму, а2p -орбитали
(2p x ,
2p y ,
2p z -орбитали)
ориентированы во взаимно перпендикулярных
направлениях и имеют форму гантели
(рис. 4.6 ).
Рис. 4.6 . Форма и ориентация электронных орбиталей.
При химических реакциях атомное ядро не претерпевает изменений, изменяются лишь электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. На основе теории электронного строения атома был установлен глубокий физический смысл периодического закона химических элементов Менделеева и создана теория химической связи.
Теоретическое обоснование периодической
системы химических элементов включает
в себя данные о строении атома,
подтверждающие существование связи
между периодичностью изменения свойств
химических элементов и периодическим
повторением сходных типов электронных
конфигураций их атомов.
В свете учения о строении атома становится обоснованным разделение Менделеевым всех элементов на семь периодов: номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. В малых периодах с ростом положительных заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 2 в первом периоде, и от 1 до 8 во втором и третьем периодах), что объясняет изменение свойств элементов: в начале периода (кроме первого) находится щелочной металл, затем наблюдается постепенное ослабление металлических свойств и усиление неметаллических. Эта закономерность прослеживается для элементов второго периода в таблице 4.2.
Таблица 4.2.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что и объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов.
Одинаковый характер свойств химических
элементов в подгруппах объясняется
сходным строением внешнего энергетического
уровня, как это показано в табл.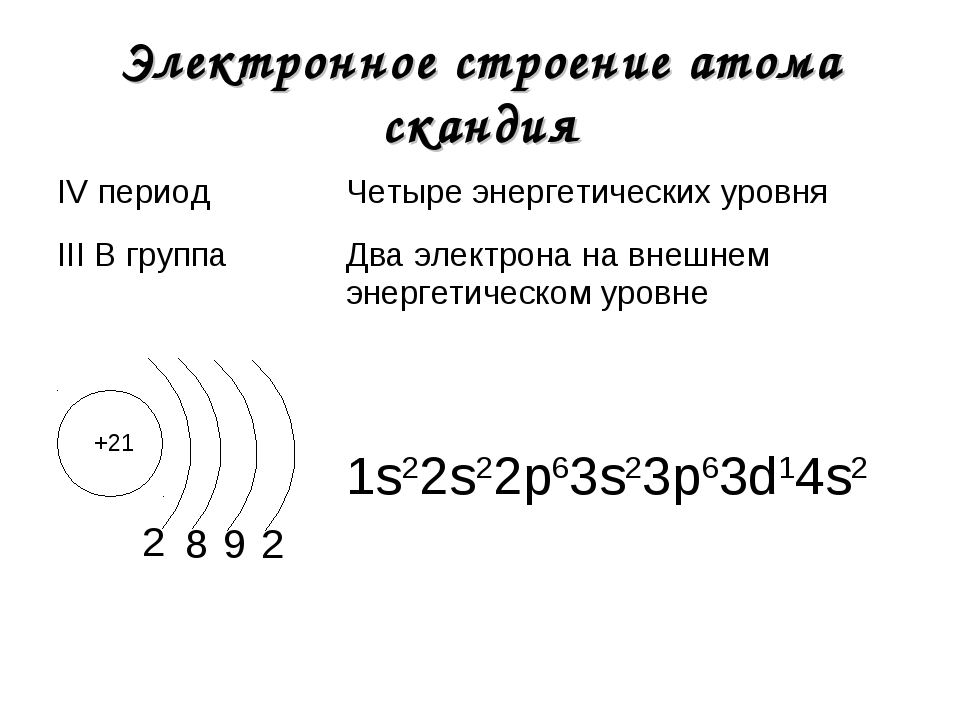 4.3 ,
иллюстрирующей последовательность
заполнения электронами энергетических
уровней для подгрупп щелочных металлов.
4.3 ,
иллюстрирующей последовательность
заполнения электронами энергетических
уровней для подгрупп щелочных металлов.
Таблица 4.3.
Номер группы, как правило, указывает на
число электронов в атоме, которые могут
участвовать в образовании химических
связей. В этом заключается физический
смысл номера группы. В четырех местах
периодической системы элементы
расположены не в порядке возрастания
атомных масс: Ar иK ,Co иNi ,T e иI ,Th иPa . Эти отступления считались
недостатками периодической системы
химических элементов. Учение о строении
атома объяснило указанные отступления.
Опытное определение зарядов ядер
показало, что расположение этих элементов
соответствует возрастанию зарядов их
ядер. Кроме того, опытное определение
зарядов ядер атомов дало возможность
определить число элементов между
водородом и ураном, а также число
лантаноидов. Ныне все места в периодической
системе заполнены в промежутке
отZ=1 доZ=114 ,
однако периодическая система не
закончена, возможно открытие новых
трансурановых элементов.
Урок посвящен формированию представлений о сложном строении атома. Рассматривается состояние электронов в атоме, вводятся понятия «атомная орбиталь и электронное облако», формы орбиталей (s–, p-, d-орбитали). Также рассматриваются такие аспекты, как максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням и подуровням в атомах элементов первых четырех периодов, валентные электроны s-, p- и d-элементов. Приводится графическая схема строения электронных слоев атомов (электронно-графическая формула).
Тема: Строение атома. Периодический закон Д.И. Менделеева
Урок: Строение атома
В переводе с греческого языка, слово «атом» означает «неделимый». Однако, были открыты явления, которые демонстрируют возможность его деления. Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются субатомными частицами.
Они называются субатомными частицами.
Табл. 1
Кроме протонов, в состав ядра большинства атомов входят нейтроны , не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами (nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А . Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре. Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Некоторые элементы существуют в виде нескольких изотопов . «Изотопы» означает «занимающий одно и тоже место». Изотопы имеют одинаковое число протонов, но отличаются массой, т. е. числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12 С или С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35 Cl и 37 Cl, содержание которых составляет соответственно 75% и 25%.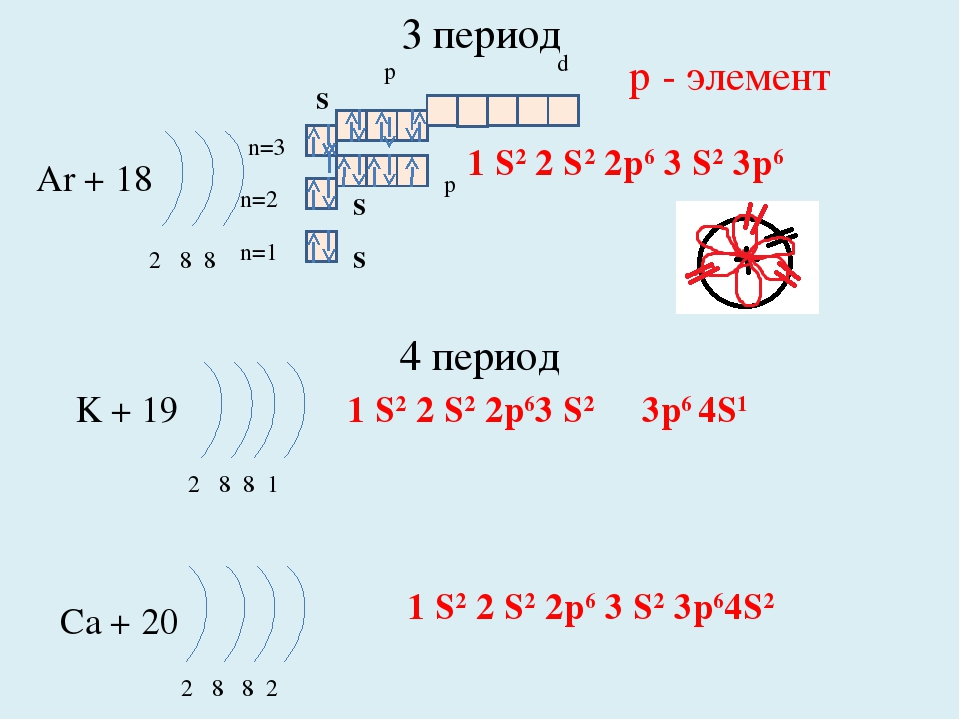 Таким образом, атомная масса хлора будет равна:
Таким образом, атомная масса хлора будет равна:
А r (Cl )=0,75 . 35+0,25 . 37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
Рис. 1. Модель строения атома Дж. Томсона
Английский физик Дж. Дж. Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны (рис. 1). Эту модель образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами. Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.
Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.
Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике, область пространства, в которой вероятность нахождения электрона наибольшая, называется орбиталью. Чем дальше электрон находится от ядра, тем меньше его энергия взаимодействия с ядром. Электроны с близкими энергиями образуют энергетический уровень. Число энергетических уровней равно номеру периода , в котором находится данный элемент в таблице Д.И. Менделеева. Существуют различные формы атомных орбиталей. (Рис. 4). d-орбиталь и f-орбиталь имеют более сложную форму.
Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален.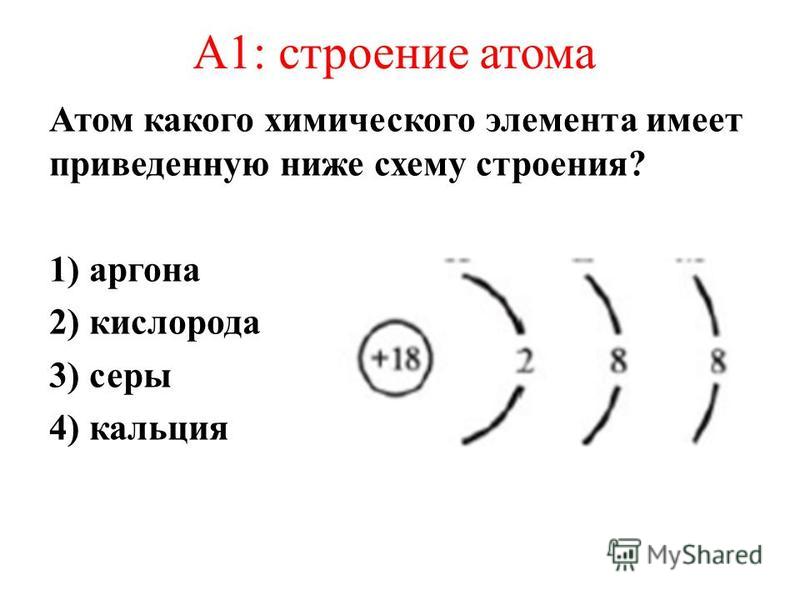 Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей .
Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей .
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1 s ). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали: 2 s 2 ppp . На третьем уровне: 3 s 3 ppp 3 ddddd .
Кроме движения вокруг ядра, электроны обладают еще движением, которое можно представить, как их движение вокруг собственной оси. Это вращение называется спином (в пер. с англ. «веретено»). На одной орбитали могут находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами.
Максимальное число электронов на энергетическом уровне определяется по формуле N =2 n 2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
Табл. 2
В зависимости от того, на какой орбитали находится последний электрон, различают s -, p -, d -элементы. Элементы главных подгрупп относятся к s -, p -элементам. В побочных подгруппах находятся d -элементы
Графическая схема строения электронных слоев атомов (электронно-графическая формула).
Для описания расположения электронов на атомных орбиталях используют электронную конфигурацию. Для её написания в строчку пишутся орбитали в условных обозначениях (s- -, p -, d-, f -орбитали), а перед ними – числа, обозначающие номер энергетического уровня. Чем больше число, тем дальше электрон находится от ядра. В верхнем регистре, над обозначением орбитали, пишется количество электронов, находящихся на данной орбитали (Рис. 5).
5).
Рис. 5
Графически распределение электронов на атомных орбиталях можно представить в виде ячеек. Каждая ячейка соответствует одной орбитали. Для р-орбитали таких ячеек будет три, для d-орбитали – пять, для f-орбитали – семь. В одной ячейке может находиться 1 или 2 электрона. Согласно правилу Гунда , электроны распределяются на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одному, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Такие электроны называют спаренными. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
См. рис. 6 для атома 7 N.
Рис. 6
Электронная конфигурация атома скандия
21 Sc : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 1
Электроны внешнего энергетического уровня называются валентными. 21 Sc относится к d -элементам.
21 Sc относится к d -элементам.
Подведение итога урока
На уроке было рассмотрено строение атома, состояние электронов в атоме, введено понятие «атомная орбиталь и электронное облако». Учащиеся узнали, что такое форма орбиталей (s -, p -, d -орбитали), каково максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням, что такое s -, p – и d -элементы. Приведена графическая схема строения электронных слоев атомов (электронно-графическая формула).
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. А.В. Мануйлов, В.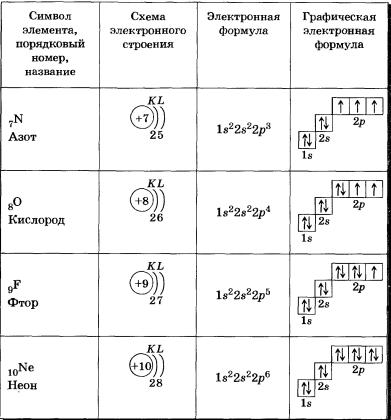 И. Родионов. Основы химии. Интернет-учебник.
И. Родионов. Основы химии. Интернет-учебник.
Домашнее задание
1. №№5-7 (с. 22) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Напишите электронные формулы для следующих элементов: 6 C, 12 Mg, 16 S, 21 Sc.
3. Элементы имеют следующие электронные формулы: а) 1s 2 2s 2 2p 4 .б) 1s 2 2s 2 2p 6 3s 2 3p 1 . в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Какие это элементы?
(Конспект лекций)
Строение атома. Введение.
Объектом
изучения в химии являются химические
элементы и их соединения. Химическим элементом называют
совокупность атомов с одинаковым
положительным зарядом. Атом –
это наименьшая частица химического
элемента, сохраняющая его химические
свойства .
Связываясь, друг с другом, атомы одного
или разных элементов образуют более
сложные частицы – молекулы .
Совокупность атомов или молекул образуют
химические вещества. Каждое индивидуальное
химическое вещество характеризуется
набором индивидуальных физических
свойств, такими как температуры кипения
и плавления, плотностью, электро- и
теплопроводностью и т.п.
Каждое индивидуальное
химическое вещество характеризуется
набором индивидуальных физических
свойств, такими как температуры кипения
и плавления, плотностью, электро- и
теплопроводностью и т.п.
1. Строение атома и Периодическая система элементов
Д.И. Менделеева .
Знание и понимание закономерностей порядка заполнения Периодической системы элементов Д.И. Менделеева позволяет понять следующее:
1.физическую суть существования в природе определенных элементов,
2.природу химической валентности элемента,
3.способность и “лёгкость” элемента отдавать или принимать электроны при взаимодействии с другим элементом,
4.природу химических связей, которые может образовать данный элемент при взаимодействии с другими элементами, пространственное строение простых и сложных молекул и пр., пр.
Строение атома.
Атом представляет собой сложную микросистему находящихся в движении и взаимодействующих друг с другом элементарных частиц.
В
конце 19 и начале 20 веков было установлено,
что атомы состоят из более мелких частиц:
нейтронов, протонов и электронов,
Последние две частицы являются заряженными
частицами, протон несет на себе
положительный заряд, электрон –
отрицательный. Поскольку атомы элемента
в основном состоянии электронейтральны,
то это означает, что число протонов в
атоме любого элемента равно числу
электронов. Масса атомов определяется
суммой массы протонов и нейтронов,
количество которых равна разности массы
атомов и его порядкового номера в
периодической системе Д.И. Менделеева.
Поскольку атомы элемента
в основном состоянии электронейтральны,
то это означает, что число протонов в
атоме любого элемента равно числу
электронов. Масса атомов определяется
суммой массы протонов и нейтронов,
количество которых равна разности массы
атомов и его порядкового номера в
периодической системе Д.И. Менделеева.
В
1926 г Шрёдингер предложил описывать
движение микрочастиц в атоме элемента
при помощи выведенного им волнового
уравнения. При решении волнового
уравнения Шрёдингера для атома водорода
появляются три целочисленных квантовых
числа: n ,
ℓ и m ℓ ,
которые характеризуют состояние
электрона в трёхмерном пространстве в
центральном поле ядра. Квантовые числа n ,
ℓ и m ℓ принимают целочисленные значения.
Волновая функция, определяемая тремя
квантовыми числами n ,
ℓ и m ℓ и получаемая в результате решения
уравнения Шрёдингера, называется
орбиталью. Орбиталь
– это область пространства, в котором
наиболее вероятно нахождение электрона ,
принадлежащего атому химического
элемента. Таким образом, решение
уравнения Шредингера для атома водорода
приводит к появлению трёх квантовых
чисел, физический смысл которых состоит
в том, что они характеризуют три разного
вида орбиталей, которые может иметь
атом. Рассмотрим более подробно каждое
квантовое число.
Таким образом, решение
уравнения Шредингера для атома водорода
приводит к появлению трёх квантовых
чисел, физический смысл которых состоит
в том, что они характеризуют три разного
вида орбиталей, которые может иметь
атом. Рассмотрим более подробно каждое
квантовое число.
Главное квантовое число n может принимать любые положительные целочисленные значения: n = 1,2,3,4,5,6,7…Оно характеризует энергию электронного уровня и размер электронного ″облака″. Характерно, что номер главного квантового числа совпадает с номером периода, в котором находится данный элемент.
Азимутальное
или орбитальное квантовое число ℓ может принимать целочисленные значения
от ℓ = 0….до n
– 1 и определяет момент движения
электронов, т.е. форму орбитали. Для
различных численных значений ℓ используют
следующие обозначения: ℓ = 0, 1, 2, 3, и обозначаются символами s , p , d , f ,
соответственно для ℓ = 0, 1, 2 и 3. В периодической системе
элементов нет элементов со спиновым
числом ℓ = 4.
Магнитное квантовое число m ℓ характеризует пространственное расположение электронных орбиталей и, следовательно, электромагнитные свойства электрона. Оно может принимать значения от – ℓ до + ℓ , включая нуль.
Форма или, точнее, свойства симметрии атомных орбиталей зависят от квантовых чисел ℓ и m ℓ . “Электронное облако”, соответствующее s – орбитали имеет, имеет форму шара (при этом ℓ = 0).
Рис.1. 1s-орбиталь
Орбитали,
определяемые квантовыми числами ℓ = 1
и m ℓ
= -1, 0 и +1, называются р-орбиталями.
Поскольку m ℓ
при этом имеет три разных значений, то
атом при этом имеет три энергетически
эквивалентные р-орбитали (главное
квантовое число для них одно и тоже и
может иметь значение n
=2,3,4,5,6 или 7). р-Орбитали обладают осевой
симметрией и имеют вид объёмных восьмёрок,
во внешнем поле ориентированных по осям
x,
y
и z
(рис.1.2). Отсюда и происхождение символики
p x ,
p y
и p z .
Рис.2. р x , p y и p z -орбитали
Кроме того, имеются d- и f- атомные орбитали, для первых ℓ = 2 и m ℓ = -2, -1, 0, +1 и +2, т.е. пять АО, для вторых ℓ = 3 и m ℓ = -3, -2, -1, 0, +1, +2 и +3, т.е. 7 АО.
Четвёртое
квантовое m s называется спиновым квантовым числом,
было введено для объяснения некоторых
тонких эффектов в спектре атома водорода
Гаудсмитом и Уленбеком в 1925г. Спин
электрона – это угловой момент заряженной
элементарной частицы электрона,
ориентация которого квантована, т.е.
строго ограничена определёнными углами.
Эта ориентация определяется значением
спинового магнитного квантового числа
(s),
которое для электрона равно ½ ,
поэтому для электрона согласно правилам
квантования m s = ± ½. В связи с этим к набору из трёх квантовых
чисел следует добавить квантовое числоm s . Подчеркнём еще раз, что четыре квантовых
числа определяют порядок построения
периодической таблицы элементов
Менделеева и объясняют, почему в первом
периоде только два элемента, во втором
и в третьём – по восемь, – в четвёртом
– 18 и т д. Однако, чтобы объяснить
строение многоэлектронных атомов,
порядок заполнения электронных уровней
по мере увеличения положительного
заряда атома недостаточно иметь
представления о четырёх квантовых
числах, “управляющих” поведением
электронов при заполнении электронных
орбиталей, но необходимо знать ещё
некоторые простые правила, а именно, принцип
Паули, правило Гунда и правила Клечковского.
Однако, чтобы объяснить
строение многоэлектронных атомов,
порядок заполнения электронных уровней
по мере увеличения положительного
заряда атома недостаточно иметь
представления о четырёх квантовых
числах, “управляющих” поведением
электронов при заполнении электронных
орбиталей, но необходимо знать ещё
некоторые простые правила, а именно, принцип
Паули, правило Гунда и правила Клечковского.
Согласно принципа Паули в одном и том же квантовом состоянии, характеризуемом определенными значениями четырёх квантовых чисел, не может находиться более одного электрона. Это означает, что один электрон можно в принципе поместить на любую атомную орбиталь. Два электрона могут находиться на одной атомной орбитали только в том случае, если они отличаются спиновыми квантовыми числами.
При
заполнении электронами трёх р-АО, пяти
d-AO
и семи f-AO
следует руководствоваться кроме принципа
Паули ещё и правилом Гунда: Заполнение
орбиталей одной подоболочки в основном
состоянии происходит электронами с
одинаковыми спинами.
При заполнении подоболочек (p , d , f )абсолютное значение суммы спинов должно быть максимальной .
Правило Клечковского . Согласно правилу Клечковского при заполнении d и f орбиталией электронами должен соблюдаться принцип минимальной энергии. Согласно этому принципу электроны в основном состоянии заполняют орбитали с минимальными уровнями энергии. Энергию подуровня определяют сумма квантовых чисел n + ℓ = Е .
Первое правило Клечковского : сначала заполняются те подуровни, для которых n + ℓ = Е минимальна.
Второе правило Клечковского : в случае равенства n + ℓ для нескольких подуровней идёт заполнение того подуровня, для которого n минимальна .
В
настоящее время известно 109 элементов.
2. Энергия ионизации, сродство к электрону и электроотрицательность .
Важнейшими характеристиками электронной конфигурации атома являются энергия ионизации (ЭИ) или потенциал ионизации (ПИ) и сродство атома к электрону (СЭ). Энергией ионизации называют изменение энергии в процессе отрыва электрона от свободного атома при 0 К: А = + + ē . Зависимость энергии ионизации от порядкового номера Z элемента, размера атомного радиуса имеет ярко выраженный периодический характер.
Сродство к электрону (СЭ), представляет собой изменение энергии, которым сопровождается присоединение электрона к изолированному атому с образованием отрицательного иона при 0 К: А + ē = А – (атом и ион находятся в своих основных состояниях). При этом электрон занимает низшую свободную атомную орбиталь (НСАО), если ВЗАО занята двумя электронами. СЭ сильно зависит от их орбитальной электронной конфигурации.
Изменения
ЭИ и СЭ коррелируют с изменением многих
свойств элементов и их соединений, что
используется для предсказания этих
свойств по значениям ЭИ и СЭ. Наиболее
высоким по абсолютной величине сродством
к электрону обладают галогены. В каждой
группе периодической таблице элементов
потенциал ионизации или ЭИ уменьшается
с увеличением номера элемента, что
связано с увеличением атомного радиуса
и с увеличением количества электронных
слоев и что хорошо коррелирует с
увеличением восстановительной способности
элемента.
Наиболее
высоким по абсолютной величине сродством
к электрону обладают галогены. В каждой
группе периодической таблице элементов
потенциал ионизации или ЭИ уменьшается
с увеличением номера элемента, что
связано с увеличением атомного радиуса
и с увеличением количества электронных
слоев и что хорошо коррелирует с
увеличением восстановительной способности
элемента.
В таблице 1 Периодической системы элементов приведены значения ЭИ и СЭ в эВ/на атом. Отметим, что точные значения СЭ известны лишь для немногих атомов, их величины подчёркнуты в таблице 1.
Таблица 1
Первая энергия ионизации (ЭИ), сродство к электрону (СЭ) и электроотрицательность χ) атомов в периодической системе.
χ | 0.747 2. 1 0 0, 3 7 | 1,2 2 | ||||||||||||||||
χ | 0. 1. 55 | -0.3 1. 1 3 | 0.2 0. 91 | 1.2 5 | -0. 1 0, 55 | 1.47 0. 59 | 3.45 0. 64 | 1 ,60 | ||||||||||
χ | 0. 7 4 1. 89 | -0.3 1 . 3 1 1 . 6 0 | 0. 6 | 1. | 0.7 | 2.07 | 3.61 | |||||||||||
χ | 2.3 6 | – 0 .6 | 1.26(α) | -0.9 1 . 39 | 0. 18 | 1.2 | 0. 6 | 2.07 | 3.36 | |||||||||
χ | 2.4 8 | -0.6 1 . 56 | 0. 2 | 2. | ||||||||||||||
χ | 2.6 7 | 2, 2 1 | О s |
χ – электроотрицательность по Полингу
r – атомный радиус, (из «Лабораторные и семинарские занятия по общей и неорганической химии» , Н.С. Ахметов, М.К. Азизова, Л.И. Бадыгина)
Атом – наименьшая частица вещества, неделимая химическим путем. В XX веке было выяснено сложное строение атома. Атомы состоят из положительно заряженного ядра и оболочки, образованной отрицательно заряженными электронами. Общий заряд свободного атома равен нулю, так как заряды ядра и электронной оболочки уравновешивают друг друга. При этом величина заряда ядра равна номеру элемента в периодической таблице (атомному номеру ) и равна общему числу электронов (заряд электрона равен −1).
Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц – нейтронов , не имеющих заряда. Обобщенные характеристики элементарных частиц в составе атома можно представить в виде таблицы:
Число протонов равно заряду ядра, следовательно, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы (складывающейся из масс протонов и нейтронов) отнять заряд ядра (число протонов).
Например, в атоме натрия 23 Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12
Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами .
Электронная оболочка атома также имеет сложное строение. Электроны располагаются на энергетических уровнях (электронных слоях).
Номер уровня характеризует энергию электрона. Связано это с тем, что элементарные частицы могут передавать и принимать энергию не сколь угодно малыми величинами, а определенными порциями – ква́нтами. Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие.
Чем выше уровень, тем большей энергией обладает электрон. Поскольку чем ниже энергия системы, тем она устойчивее (сравните низкую устойчивость камня на вершине горы, обладающего большой потенциальной энергией, и устойчивое положение того же камня внизу на равнине, когда его энергия значительно ниже), вначале заполняются уровни с низкой энергией электрона и только затем – высокие.
Максимальное число электронов, которое может вместить уровень, можно рассчитать по формуле:
N = 2n 2 , где N – максимальное число электронов на уровне,
n – номер уровня.
Тогда для первого уровня N = 2 · 1 2 = 2,
для второго N = 2 · 2 2 = 8 и т. д.
Число электронов на внешнем уровне для элементов главных (А) подгрупп равно номеру группы.
В большинстве современных периодических таблиц расположение электронов по уровням указано в клеточке с элементом. Очень
важно понимать, что уровни читаются снизу вверх , что соответствует их энергии. Поэтому столбик цифр в клеточке с натрием:
1
8
2
на 1-м уровне – 2 электрона,
на 2-м уровне – 8 электронов,
на 3-м уровне – 1 электрон
Будьте внимательны, очень распространенная ошибка!
Распределение электронов по уровням можно представить в виде схемы:
11 Na)))
2 8 1
Если в периодической таблице не указано распределение электронов по уровням, можно руководствоваться:
- максимальным количеством электронов: на 1-м уровне не больше 2 e − ,
на 2-м – 8 e − ,
на внешнем уровне – 8 e − ; - числом электронов на внешнем уровне (для первых 20 элементов совпадает с номером группы)
Тогда для натрия ход рассуждений будет следующий:
- Общее число электронов равно 11, следовательно, первый уровень заполнен и содержит 2 e − ;
- Третий, наружный уровень содержит 1 e − (I группа)
- Второй уровень содержит остальные электроны: 11 − (2 + 1) = 8 (заполнен полностью)
* Ряд авторов для более четкого разграничения свободного атома и атома в составе соединения предлагают использовать термин «атом» только для обозначения свободного (нейтрального) атома, а для обозначения всех атомов, в том числе и в составе соединений, предлагают термин «атомные частицы». Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
Время покажет, как сложится судьба этих терминов. С нашей точки зрения, атом по определению является частицей, следовательно, выражение «атомные частицы» можно рассматривать как тавтологию («масло масляное»).
2. Задача. Вычисление количества вещества одного из продуктов реакции, если известна масса исходного вещества.
Пример:
Какое количество вещества водорода выделится при взаимодействии цинка с соляной кислотой массой 146 г?
Решение:
- Записываем уравнение реакции: Zn + 2HCl = ZnCl 2 + H 2
- Находим молярную массу соляной кислоты: M (HCl) = 1 + 35,5 = 36,5 (г/моль)
(молярную массу каждого элемента, численно равную относительной атомной массе, смотрим в периодической таблице под знаком элемента и округляем до целых, кроме хлора, который берется 35,5) - Находим количество вещества соляной кислоты: n (HCl) = m / M = 146 г / 36,5 г/моль = 4 моль
- Записываем над уравнением реакции имеющиеся данные, а под уравнением – число моль согласно уравнению (равно коэффициенту перед веществом):
4 моль x моль
Zn + 2HCl = ZnCl 2 + H 2
2 моль 1 моль - Составляем пропорцию:
4 моль – x моль
2 моль – 1 моль
(или с пояснением:
из 4 моль соляной кислоты получится x моль водорода,
а из 2 моль – 1 моль) - Находим x:
x = 4 моль 1 моль / 2 моль = 2 моль
Ответ: 2 моль.
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В 1891 г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь». Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с. ) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится . Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра .
Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено приблизительно 90 % электронного облака , и это означает, что около 90 % времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей , которые обозначаются латинскими буквами s, p, d и f . Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром . Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, – 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n 2 ,
где N – максимальное число электронов; n – номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором – не более 8; на третьем – не более 18; на четвертом – не более 32.
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй – два; третий – три; четвертый – четыре подуровня . Подуровни в свою очередь образованы орбиталями.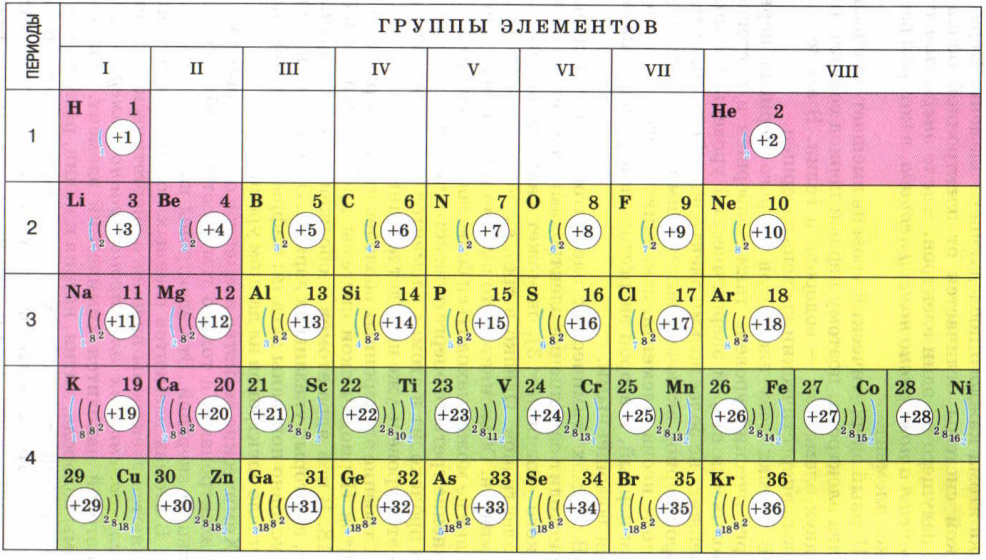 Каждому значению n соответствует число орбиталей, равное n.
Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, p, d, f.
Протоны и нейтроныАтом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной .
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов – протонов и нейтронов .
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus – ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом . Например, массовое число атома алюминия:
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e — .
Электроны обозначают e — .
Поскольку атом электронейтрален , то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
N = A — Z
Например, число нейтронов в атоме железа равно:
56 — 26 = 30
ИзотопыРазновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами . Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород – три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Схема электронного строения атома водорода:
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен – в нем 2 электрона. Водород и гелий – s-элементы; у этих атомов заполняется электронами s-орбиталь.
У всех элементов второго периода первый электронный слой заполнен , и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен – в нем 8 электронов.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s- электронная орбиталь. Na и Mg – s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar – р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са – s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10:
В атоме цинка третий электронный слой завершен – в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr – р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.У элементов пятого периода идет заполнение по-дуровней в следующем порядке: 5s — 4d — 5р. И так-же встречаются исключения, связанные с «провалом » электронов, у 41 Nb, 42 Мо, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55 Cs и 56 Ва – 6s-элементы; 57 La … 6s 2 5d x – 5d-элемент; 58 Се – 71 Lu – 4f-элементы; 72 Hf — 80 Hg – 5d-элементы; 81 Т1 — 86 Rn – 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т. е. nf 7 и nf 14 . В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
- s-элементы . Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
- p-элементы .
 Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
- d-элементы . Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I-VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
- f-элементы . Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского – «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки.
Этот принцип носит название принципа Паули . Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек – записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда , согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
Правило Хунда и принцип Паули
Правило Хунда – правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка : Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
- Мультиплетность максимальна
- При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p -элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками – электроны, причём направление стрелки обозначает ориентацию спина).
Правило Клечковского
Правило Клечковского — по мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречатреальной энергетической последовательности атомых орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слояна d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, аименно: после заполнения двумя электронами орбитали 6s
Рекомендуем также
Глава 3 – Атомная структура и свойства
Введение
Ядерный атом и квантовая теория являются общепринятыми теориями атома. В этой главе мы продемонстрируем их полезность, используя их для объяснения тенденций в атомарных свойствах.
3.1 Валентные электроны
Введение
Большинство свойств атома связаны с природой его электронного облака и с тем, насколько сильно электроны взаимодействуют с ядром.В этом разделе мы определяем электроны, которые наиболее важны для определения атомных свойств.Предпосылки
Цели
•
Различают остовные и валентные электроны.•
Определить количество валентных электронов в атоме.•
Напишите конфигурации валентных электронов атомов главной группы.
3.1-1. Видео валентных электронов
- Просмотр видео
•
Просмотрите видео в этом окне, выбрав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.
•
Перейти к упражнениям по этой теме.
3.1-2. Определение валентного электрона
Валентные электроны состоят из электронов самого внешнего s-подуровня и электронов любого незаполненного подуровня.
Электроны в атоме можно разделить на две группы:•
Электроны остова — это прочно связанные электроны, на которые не влияют химические реакции. Электроны ядра находятся на заполненных подуровнях и образуют сферическую оболочку с отрицательным зарядом вокруг ядра, которая влияет на количество ядерного заряда, испытываемого самыми внешними электронами.•
Валентные электроны — это самые внешние электроны, которые определяют свойства атома и участвуют в химической связи. Валентные электроны — это электроны самого внешнего s-подуровня и любых незаполненных подуровней.
Число валентных электронов в атоме равно номеру группы атома.
3.1-3. Валентные электронные конфигурации элементов основной группы
Все элементы в группе имеют одинаковое количество валентных электронов (номер группы), и их конфигурации валентных электронов одинаковы, за исключением значения квантового числа n (периода).Таким образом, периодичность химических свойств обусловлена периодичностью конфигураций валентных электронов. В таблице показаны общие конфигурации валентных электронов элементов в каждой группе элементов основной группы и конкретные конфигурации второго периода.| Группа | 1А | 2А | 3А | 4А | 5А | 6А | 7А |
| Конфигурация | н с 1 | н с 2 | н с 2 н р 1 | н с 2 н р 2 | н с 2 н р 3 | н с 2 н р 4 | н с 2 н р 5 |
| 2 -й Элемент периода | Ли | Быть | Б | С | Н | О | Ф |
| Конфигурация | 2 с 1 | 2 с 2 | 2с 2 2п 1 | 2с 2 2п 2 | 2с 2 2п 3 | 2с 2 2п 4 | 2с 2 2п 5 |
Таблица 3. 1: Конфигурации валентных электронов
1: Конфигурации валентных электронов
3.1-4. Валентные электронные конфигурации переходных элементов
Валентно-электронная конфигурация переходных элементов первого ряда имеет вид 4s 2 3d b , где b — положение элемента в d-блоке. Cr и Cu являются двумя исключениями, потому что каждый из них продвигает один из своих 4s-электронов на 3d-подуровень, чтобы получить наполовину заполненные и полностью заполненные 3d-подуровни. Цинк часто считают переходным элементом из-за его местоположения, но его d-подуровень заполнен, а его химический состав больше похож на металл группы 2А, чем на переходный металл.Таким образом, его конфигурация валентных электронов равна 4s 2 , что соответствует его групповому номеру 2B. Точно так же Cu представляет собой 4s 1 3d 10 , и тот факт, что это элемент 1B, наводит вас на мысль, что его конфигурация валентного электрона должна быть 4s 1 . Однако, в отличие от цинка, медь использует свои d-орбитали для связывания. Действительно, наиболее распространенным ионом, образованным медью, является ион Cu 2+ . Таким образом, химический состав меди определяется ее d-электронами, а ее конфигурация валентных электронов имеет вид 4s 1 3d 10 .
Действительно, наиболее распространенным ионом, образованным медью, является ион Cu 2+ . Таким образом, химический состав меди определяется ее d-электронами, а ее конфигурация валентных электронов имеет вид 4s 1 3d 10 .3.1-5. Практика с валентными электронами
Валентные электроны и конфигурации валентных электронов очень важны в химии. Потренируйтесь определять конфигурации валентных электронов для атомов, а затем проверьте свой ответ, нажав на элемент в таблице Менделеева ниже.3.1-6. Ядро против валентных электронов Упражнение
Упражнение 3.1:Используйте тот факт, что все электроны в атоме являются либо остовными, либо валентными электронами, а число валентностей равно номеру группы атома. элемент для определения количества валентных и остовных электронов в каждом из следующих атомов.2 для 2s 2 2p 2 .)
3.2 Экранирование и эффективный ядерный заряд
Введение
В этом разделе вы узнаете, как предсказать относительную силу, с которой валентные электроны взаимодействуют с ядром.
3.2-1. Видео с эффективным ядерным зарядом
- Просмотр видео
•
Просмотрите видео в этом окне, выбрав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.•
Перейти к упражнениям по этой теме.
3.2-2. Экранирование и эффективный ядерный заряд
Электроны ядра экранируют валентные электроны лучше, чем другие валентные электроны.
Ядерный заряд электрона влияет на размер и энергию его орбиталей, поэтому он является важным фактором, определяющим свойства валентных электронов и орбиталей. Однако валентный электрон не притягивается полным положительным зарядом ядра, потому что он экранирован другими электронами, в основном электронами остова. Заряд ядра, который фактически ощущается валентным электроном, называется эффективным зарядом ядра , Z эфф .Эффективный заряд ядра, испытываемый электроном, равен заряду ядра ( Z ) за вычетом той части заряда ядра, которая экранируется другими электронами ( σ ).
Заряд ядра, который фактически ощущается валентным электроном, называется эффективным зарядом ядра , Z эфф .Эффективный заряд ядра, испытываемый электроном, равен заряду ядра ( Z ) за вычетом той части заряда ядра, которая экранируется другими электронами ( σ ).( 3.1 )
Эффективный ядерный заряд
σ — это экранирование других электронов. Валентный электрон экранируется как остовными электронами, так и другими валентными электронами. Однако остовные электроны находятся ближе к ядру, поэтому остовные электроны экранируют валентные электроны лучше, чем другие валентные электроны .Этот важный факт будет использован для объяснения трендов атомных свойств в пределах периода.3.2-3. Тенденции в
Z eff Эффективный заряд ядра увеличивается слева направо в периоде.
1
Z = 3
для Li, что равно 1s 2 2s 1 . Z эфф ~ 1 согласно рисунку 3.2. Таким образом, два 1s-электрона экранируютσ ~ 3 − 1 = 2,
.2
Z = 9
для F, что равно 1s 2 2s 2 2p 5 , но Z eff ~ 5.Таким образом, экранирование σ ~ 9 – 5 = 4.
n = 2
электронов не экранируют так же хорошо, какn = 1
электронов. Этот эффект противоположен изменению квантового числа n , поскольку увеличение n увеличивает энергию валентных уровней, а увеличение эффективного заряда ядра снижает энергию валентных уровней. Эффект увеличения n тем более важен, что энергии валентных уровней действительно увеличиваются при движении вниз по группе.
Эффект увеличения n тем более важен, что энергии валентных уровней действительно увеличиваются при движении вниз по группе.3.2-4. Упражнение по эффективному ядерному заряду
Упражнение 3.5:Выберите электрон в каждой паре, который испытывает больший эффективный ядерный заряд.
3.3 Относительный размер атома
Введение
Атомы не являются твердыми сферами с четко определенными границами, поэтому термин «атомный радиус» несколько расплывчатый, и существует несколько определений того, что такое атомный радиус.Следовательно, атомные радиусы не измеряются напрямую. Скорее, они выводятся из расстояний между атомами в молекулах, которые можно легко определить с помощью нескольких методов. Однако обсуждение того, как определяются атомные радиусы, требует понимания химической связи и твердого состояния, поэтому подробное обсуждение различных типов радиусов и их значений отложено до главы 8. В этом разделе мы ограничимся обсуждением тенденций. в относительных размерах атомов.
в относительных размерах атомов.Предпосылки
Цели
•
Объясните периодичность размеров валентных орбиталей.•
Определите относительные размеры атомов на основе их положения в периодической таблице.
3.3-1. Модель Бора и размер атома
Размер атома определяется размером его облаков валентных электронов. Хотя орбиты фиксированных радиусов, предложенные в модели Бора, неверны, выводы модели все же можно использовать для получения качественного понимания тенденций атомных радиусов, заменив атомный номер в уравнении 2 эффективным зарядом ядра.4, чтобы получить следующее:•
Средний размер орбитали увеличивается по мере увеличения ее квантового числа n .•
Размер электронного облака уменьшается по мере увеличения эффективного ядерного заряда, который оно испытывает.
3.3-2. Атомный размер
Радиусы атомов увеличиваются по группе и уменьшаются по периоду.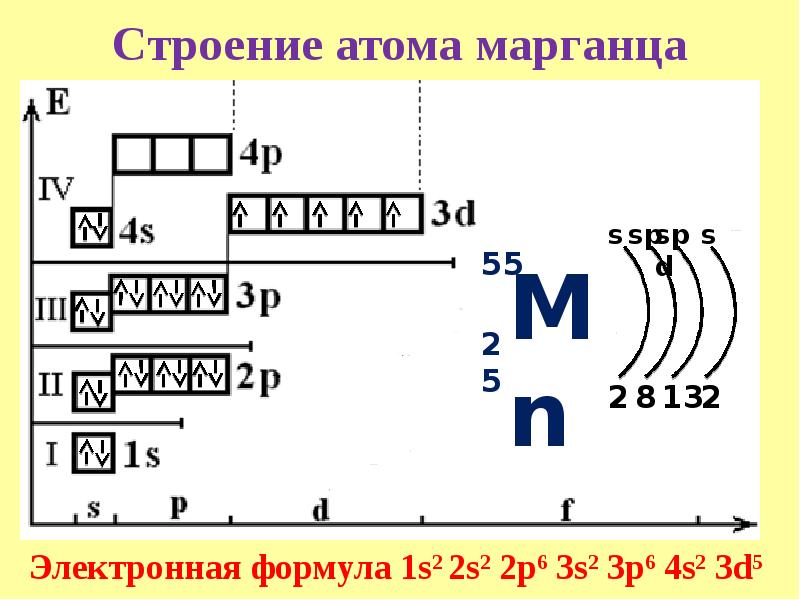
•
атомные радиусы увеличиваются вниз по группе, потому что квантовое число n самых удаленных орбиталей увеличивается, и•
атомные радиусы уменьшаются слева направо в периоде, потому что Z эфф увеличивается.
0,37 Å
и2,11 Å,
соответственно.3.3-3. Упражнение «Атомный размер»
3.4 Относительная орбитальная энергия
Введение
Относительная энергия валентных орбиталей в атоме является важной характеристикой атома, поскольку она определяет как свойства атома, так и способ и силу его взаимодействия с другими атомами. Действительно, мы будем использовать относительные орбитальные энергии при предсказании химических процессов на протяжении оставшейся части этого курса. В этом разделе мы используем модель Бора для предсказания относительных энергий валентных орбиталей в некоторых малых атомах.
В этом разделе мы используем модель Бора для предсказания относительных энергий валентных орбиталей в некоторых малых атомах.Предпосылки
Цели
•
Определите относительную энергию электронов на основе их квантового числа n и эффективного ядерного заряда, который они испытывают.
3.4-1. Видео об орбитальных энергиях
- Просмотр видео
•
Просмотрите видео в этом окне, выбрав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.•
Перейти к упражнениям по этой теме.
3.4-2. Модель Бора и орбитальная/электронная энергия
Легкость, с которой электрон теряется из атома, определяется тем, насколько сильно электрон связан с атомом, что, в свою очередь, определяется энергией электрона в атоме. Мы снова используем выводы модели Бора в качественном ключе, чтобы понять тенденций в энергиях валентных электронов, заменив атомный номер в уравнении 2.5 эффективным зарядом ядра, чтобы получить уравнение 3.2.
Мы снова используем выводы модели Бора в качественном ключе, чтобы понять тенденций в энергиях валентных электронов, заменив атомный номер в уравнении 2.5 эффективным зарядом ядра, чтобы получить уравнение 3.2.( 3.2 )
Приближение электронной/орбитальной энергии
E x — энергия валентной орбитали атома X, а n — главное квантовое число его валентной оболочки. В то время как уравнение 3.2 является лишь очень грубым приближением, оно полезно для демонстрации того, как соотносятся относительных орбитальных энергий валентных электронов в атомах первых трех периодов. Мы заключаем, что1
Энергия электрона увеличивается (становится менее отрицательной и менее жестко связана) по мере увеличения его квантового числа n .2
Энергия электрона уменьшается (становится более отрицательной и связана более прочно) по мере увеличения эффективного заряда ядра.
3.4-3. Относительные энергии, пример
Валентные орбитали неметаллов имеют относительно низкую энергию, а у металлов относительно высокую.
- Просмотр видео
•
Просмотрите видео в этом окне, выбрав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.•
Перейти к упражнениям по этой теме.
 4. Мы используем уравнение 3.2 и значения в таблице, чтобы сделать следующий вывод.
4. Мы используем уравнение 3.2 и значения в таблице, чтобы сделать следующий вывод.•
Пять валентных 2p-электронов фтора обладают очень положительным эффективным ядерным зарядом 5,2 и очень низким квантовым числом n , поэтому значение для довольно велико. Таким образом, энергия валентных орбиталей фтора очень мала. Действительно, они являются самыми низкоэнергетическими валентными орбиталями любого атома. Все неметаллы характеризуются низкоэнергетическими валентными орбиталями.•
Два 2p-электрона углерода имеют эффективный ядерный заряд +3,3 и то же квантовое число n , что и фтор, поэтому значение меньше, чем у фтора. Таким образом, валентные электроны углерода не связаны так прочно, как у фтора, а валентные орбитали углерода имеют более высокую энергию, чем у фтора. Однако углерод является неметаллом, и энергия его валентных орбиталей все еще относительно мала.•
Литий — это металл, и его 2s-валентный электрон имеет эффективный ядерный заряд всего +1. 3, который дает очень низкое значение для Z эфф в квадрате по сравнению с n в квадрате. Следовательно, валентный электрон на атоме лития связан слабо, и его энергия валентной орбиты достаточно высока. Действительно, все металлы характеризуются высокоэнергетическими валентными орбиталями.
3, который дает очень низкое значение для Z эфф в квадрате по сравнению с n в квадрате. Следовательно, валентный электрон на атоме лития связан слабо, и его энергия валентной орбиты достаточно высока. Действительно, все металлы характеризуются высокоэнергетическими валентными орбиталями.
3.4-4. Прогнозирование относительной энергии. Упражнение
.3.4-5. Относительная валентная орбитальная энергия для нескольких атомов
Прежде чем закончить обсуждение относительных орбитальных энергий, мы добавим H ( Z эфф = 1) и O ( Z эфф = 4).5) к нашей энергетической диаграмме, чтобы получить следующую диаграмму, содержащую восемь элементов первых трех периодов. На основании диаграммы делаем следующие два вывода:1
Орбитальные энергии уменьшаются (становятся более отрицательными) в течение периода, потому что Z эфф увеличивается. Таким образом,
Таким образом,Li > C > O > F.
2
Орбитальные энергии увеличиваются (становятся менее отрицательными) вниз по группе, потому что n увеличивается.Таким образом,Si > C;
S > O;
иCl > F.
3.4-6. Орбитальное энергетическое упражнение
Упражнение 3.8: Рассмотрим следующую энергетическую диаграмму валентных орбит, которую мы построили к этому моменту.| и |
| Ли (–0,4) |
| б |
| Н (–1,0) |
| с |
| Si (–2.0) |
| д |
| С (–2,5) |
| и |
| С (–3,3) |
| ф |
| Кл (–4,2) |
| г |
| О (–5,0) |
| ч |
| F (–6,5) |

3.4-7. Упражнение
«Ядро против валентной орбитальной энергии» Энергии валентных орбиталей всех атомов лежат в относительно узком диапазоне из-за периодичности в Z эфф и возрастающего квантового числа n . С другой стороны, энергия остовных электронов продолжает падать по мере увеличения числа протонов, потому что они не очень эффективно экранируются валентными электронами. Таким образом, валентные 2p-орбитали кислорода имеют более низкую энергию, чем валентные 3p-орбитали серы, потому что энергии валентных орбиталей увеличиваются при движении вниз по группе, но 2p-электроны в кислороде имеют гораздо более высокую энергию, чем 2p-электроны на сере, потому что сера 16 протонов, а у кислорода всего восемь. Упражнение 3.9:Выберите орбиталь с меньшей энергией в каждой паре.
3.5 Энергия ионизации
Введение
Одним из свойств атома, которое важно для определения химических свойств атома, является легкость, с которой атом теряет один или несколько своих валентных электронов.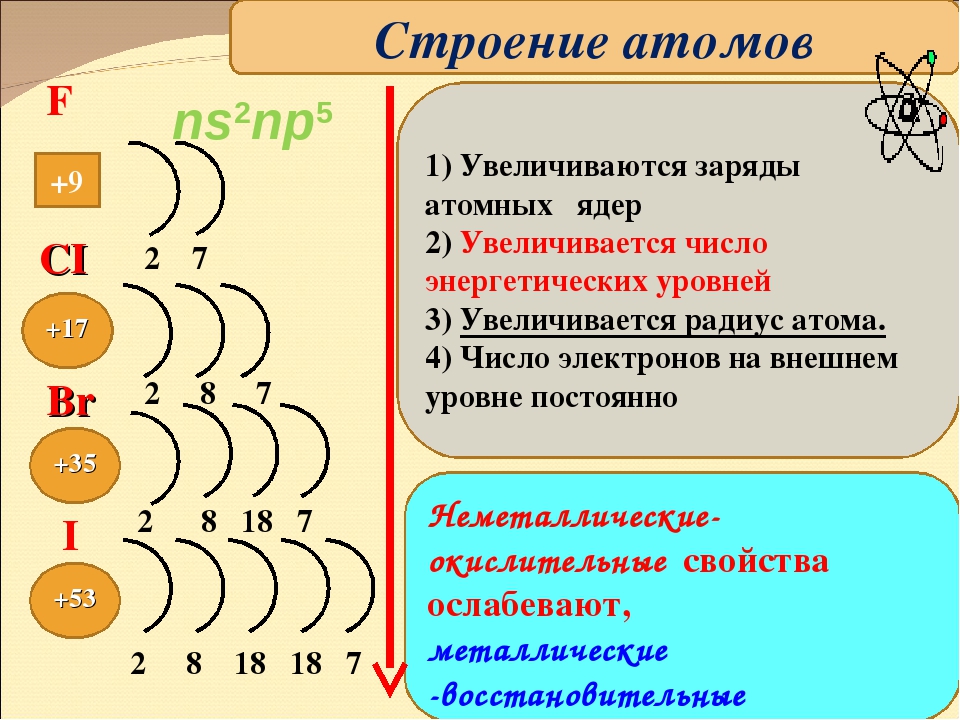 Это свойство атома задается энергией ионизации атома или потенциалом ионизации, темой этого раздела.
Это свойство атома задается энергией ионизации атома или потенциалом ионизации, темой этого раздела.Предпосылки
Цели
•
Предсказать относительные энергии ионизации атомов на основе их положения в периодической таблице или относительных энергий их занятых валентных орбиталей.
3.5-1. Видео по энергии ионизации
- Просмотр видео
•
Просмотрите видео в этом окне, выбрав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.•
Просмотрите видео в текстовом формате, прокрутив вниз.•
Перейти к упражнениям по этой теме.
3.5-2. Энергия ионизации и орбитальная энергия
Энергии ионизации измеряют энергию электрона с наивысшей энергией.
Li → Li 1+ + e 1− ΔE = +520 кДж
где Δ E = IE — энергия ионизации. Изменение энергии происходит потому, что энергия электрона в начальном состоянии отличается от энергии в конечном состоянии. В начальном состоянии электрон находится на орбите с энергией E n , но в конечном состоянии это свободный электрон без потенциальной энергии.Связь между энергией ионизации и орбитальной энергией получается следующим образом:| IE | = | = | E Final – E Начальный – E 3 |
| IE | = | Свободная энергия электронов – орбитальная энергия | |
| IE | = | 0 – E N |
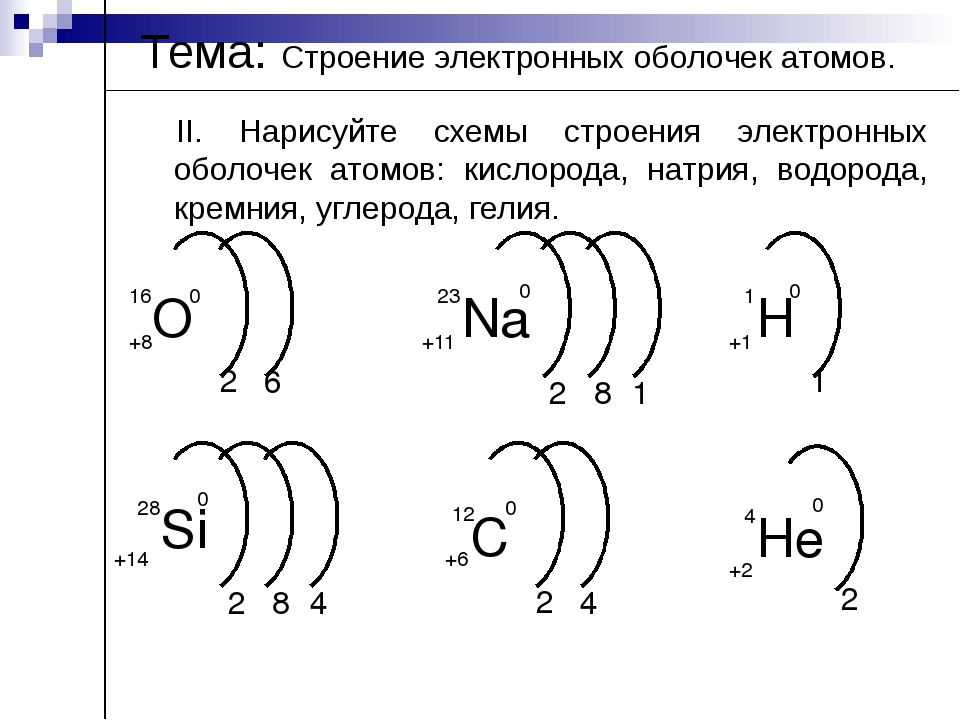 Орбитальная энергия электрона с самой высокой энергией может быть аппроксимирована как отрицательная энергия ионизации атома. В приведенном выше обсуждении мы рассмотрели удаление только электрона с самой высокой энергией, но, как показано ниже, другие электроны также могут быть удалены последовательными ионизациями. Таким образом, энергия, необходимая для удаления первого электрона, является первой энергией ионизации, а энергия, необходимая для удаления второго электрона, является второй энергией ионизации и так далее. Рассмотрим случай металла М.
Орбитальная энергия электрона с самой высокой энергией может быть аппроксимирована как отрицательная энергия ионизации атома. В приведенном выше обсуждении мы рассмотрели удаление только электрона с самой высокой энергией, но, как показано ниже, другие электроны также могут быть удалены последовательными ионизациями. Таким образом, энергия, необходимая для удаления первого электрона, является первой энергией ионизации, а энергия, необходимая для удаления второго электрона, является второй энергией ионизации и так далее. Рассмотрим случай металла М.| M | → | M 1+| + E 1- + E 1- | 2 M 1+ | → | M 2+ + E 1- | Вторая ионизация | 2 M 2+ | → | м 3+ + E 1- | третьей ионизации | M 3+2 | → | M 4+ + e 1− | Четвертая ионизация | |
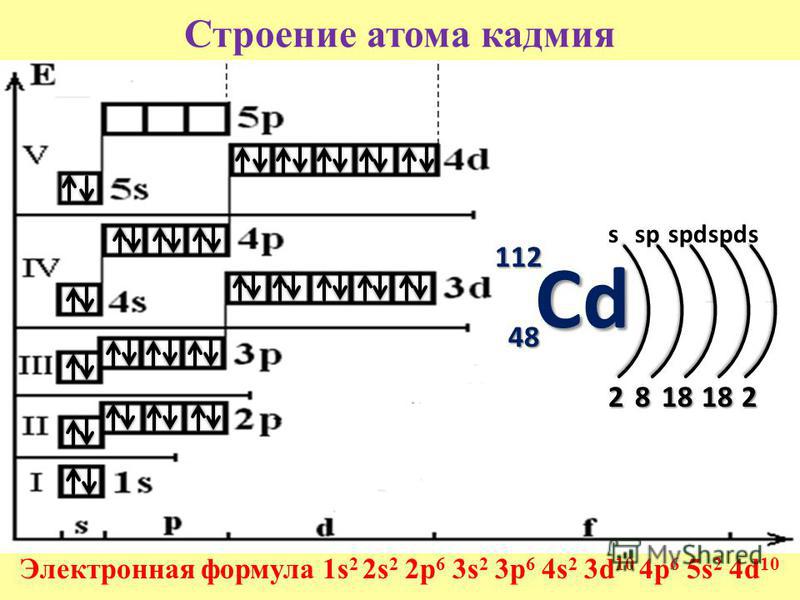 Таким образом, каждая последующая энергия ионизации больше предыдущей. Мы используем термин энергия ионизации для обозначения первой энергии ионизации в оставшейся части главы.
Таким образом, каждая последующая энергия ионизации больше предыдущей. Мы используем термин энергия ионизации для обозначения первой энергии ионизации в оставшейся части главы.3,5-3. Приведение чисел к орбитальной энергии
Энергия, необходимая для удаления одного 2p-электрона от каждого атома в моле атомов F с образованием моля ионов F 1+ , составляет 1681 кДж, поэтому энергия ионизации фтора составляет 1681 кДж/моль. Кроме того, в обратном процессе выделяется 1681 кДж/моль, поэтому мы заключаем, что энергия 2р-орбитала равна –1681 кДж/моль.Неметаллы характеризуются высокими энергиями ионизации и низкими энергиями валентных орбит, поскольку они имеют высокие эффективные ядерные заряды. Энергия ионизации углерода составляет 1086 кДж/моль, поэтому орбитальная энергия 2p-орбитали в углероде составляет –1086 кДж/моль. Энергия ионизации лития составляет всего 520 кДж/моль, поэтому орбитальная энергия его 2s-орбитали составляет –520 кДж/моль. Валентные орбитали металлов характеризуются низкими энергиями ионизации и высокими энергиями валентных орбиталей, поскольку они имеют низкие эффективные заряды ядер.
3,5-4. Тенденции энергии ионизации
Энергии ионизации увеличиваются при движении вверх по группе и слева направо в периоде.
Энергия ионизации – это энергия, необходимая для удаления из атома электрона с наибольшей энергией, которую можно оценить, исходя из предположения, что IE = – E n ; т. е. что энергия ионизации равна отрицательной величине орбитальной энергии электрона. E n можно оценить с помощью уравнения 3.2, поэтому мы заключаем, что энергии ионизации•
увеличиваться при переходе вверх по группе из-за уменьшения квантового числа n , и•
увеличение слева направо в периоде за счет увеличения Z эфф .
 Однако есть некоторые явные исключения, возникающие из-за того, что конфигурации из электронов, в которых подуровни заполнены (группы 2А и 8А) или заполнены наполовину (группа 5А), необычайно стабильны, поэтому удаление электрона из элемента в одной из этих групп является более устойчивым. затруднено и приводит к отклонениям от ожидаемой периодичности . Например, эффективный заряд ядра B больше, чем у Be, но энергия ионизации Be больше, чем у B, потому что электрон должен быть удален с заполненного 2s-подуровня в Be.Точно так же энергия ионизации N больше, чем у O, потому что 2p-подуровень N заполнен наполовину. Резюме
Однако есть некоторые явные исключения, возникающие из-за того, что конфигурации из электронов, в которых подуровни заполнены (группы 2А и 8А) или заполнены наполовину (группа 5А), необычайно стабильны, поэтому удаление электрона из элемента в одной из этих групп является более устойчивым. затруднено и приводит к отклонениям от ожидаемой периодичности . Например, эффективный заряд ядра B больше, чем у Be, но энергия ионизации Be больше, чем у B, потому что электрон должен быть удален с заполненного 2s-подуровня в Be.Точно так же энергия ионизации N больше, чем у O, потому что 2p-подуровень N заполнен наполовину. Резюме •
Металлы характеризуются низким эффективным зарядом ядра, поэтому все они имеют низкие энергии ионизации. Следовательно, металлов склонны терять электроны , и чем левее периодической таблицы, тем легче теряются электроны. Таким образом, элементы 1А очень легко теряют свой валентный электрон. Энергия ионизации также уменьшается вниз по семейству, поэтому Cs (высокий n и низкий Z эфф ) так легко теряет свой валентный электрон, что его приходится хранить в масле, потому что он отдает свой 6s-электрон воде или кислороду. при контакте с воздухом.
Энергия ионизации также уменьшается вниз по семейству, поэтому Cs (высокий n и низкий Z эфф ) так легко теряет свой валентный электрон, что его приходится хранить в масле, потому что он отдает свой 6s-электрон воде или кислороду. при контакте с воздухом.•
Неметаллы имеют высокие эффективные заряды ядер, поэтому они имеют относительно высокие энергии ионизации. Таким образом, неметаллы не очень легко теряют свои электроны. За исключением благородных газов, F (низкий n и высокий Z eff ) имеет самую высокую энергию ионизации любого атома, что означает, что валентные электроны фтора очень сильно связаны.
3,5-5. Энергетическое упражнение ионизации
3.6 Электроотрицательность
Введение
Электроны в связи могут понизить свою потенциальную энергию, находясь ближе к атому в связи, которая имеет валентную орбиталь с более низкой энергией. Способность атома притягивать к себе электроны связи называется его электроотрицательностью ( х ). Атомы наиболее электроотрицательны, когда их валентные орбитали имеют низкую энергию.Электроотрицательность является темой этого раздела.
Способность атома притягивать к себе электроны связи называется его электроотрицательностью ( х ). Атомы наиболее электроотрицательны, когда их валентные орбитали имеют низкую энергию.Электроотрицательность является темой этого раздела.Предпосылки
Цели
•
Предсказать относительную электроотрицательность атомов на основе их положения в периодической таблице или относительной энергии их незаполненных валентных орбиталей.•
Объясните различия между металлами и неметаллами, возникающие из-за различий в их энергиях ионизации и электроотрицательности.
3.6-1. Электроотрицательность Видео
- Просмотр видео
•
Просмотрите видео в этом окне, выбрав кнопку воспроизведения.•
Используйте элементы управления видео для просмотра видео в полноэкранном режиме.
•
Просмотрите видео в текстовом формате, прокрутив вниз.•
Перейти к упражнениям по этой теме.
3.6-2. Электроотрицательность и орбитальная энергия
Атомы с низкоэнергетическими валентными орбиталями сильно электроотрицательны.
Электроотрицательность ( х ) — это мера способности атома притягивать связывающие электроны, поэтому электронная плотность в связи накапливается вблизи атомов с более высокой электроотрицательностью. Связывающие электроны находятся на орбиталях, включающих валентные орбитали атомов, особенно те, которые незаполнены, и электроны стремятся минимизировать свою энергию, поэтому атом с высокой электроотрицательностью — это просто атом, чьи валентные орбитали, особенно незаполненные, имеют низкую энергия. Пример:поэтому валентные орбитали атомов с высокой электроотрицательностью имеют
1
большой Z eff (неметаллы) и2
низкие n квантовые числа (высокие в периодической таблице).
3.6-3. Значение электроотрицательности
Разница в электроотрицательности между двумя атомами диктует тип связи, которая образуется между ними. Обратитесь к Рисунку 3.9 для дальнейшего обсуждения.
Обратитесь к Рисунку 3.9 для дальнейшего обсуждения.1
Электроотрицательности двух атомов фтора одинаковы, поэтому связывающие электроны принадлежат обоим атомам поровну. Связи, в которых электроны связи распределены поровну, называются ковалентными.2
Фтор более электроотрицательный, чем углерод, поэтому связывающие электроны в связи CF находятся ближе к атому фтора.Избыток электронной плотности вблизи атома фтора придает ему частичный отрицательный заряд. Греческая дельта ( δ ) используется для обозначения того, что это только частичный заряд, поскольку углерод все еще испытывает часть отрицательного заряда связывающих электронов.3
Разница в электроотрицательности между Li и F настолько велика, что связывающие электроны находятся почти исключительно на фторе, придавая ему полный отрицательный заряд. Связи, в которых электроны связи не являются общими, а находятся на одном атоме, называются ионными связями.
3.6-4. Тенденции электроотрицательности
Электроотрицательности уменьшаются вниз по группе и увеличиваются по периоду.
Мы используем модель Бора для аппроксимации энергии пустой орбитали с самой низкой энергией – E n и заключаем, что•
электроотрицательность уменьшается вниз по группе, потому что n увеличивается, что приводит к увеличению орбитальной энергии, и•
электроотрицательность увеличивается слева направо в периоде, потому что Z эфф увеличивается, что приводит к уменьшению орбитальной энергии (становлению более отрицательной).
•
Неметаллы характеризуются высоким Z эфф , поэтому их валентные орбитали имеют низкую энергию. Следовательно, неметаллов являются сильно электроотрицательными (от 2,0 до 4,0).
Следовательно, неметаллов являются сильно электроотрицательными (от 2,0 до 4,0).•
Металлы главной группы имеют низкий эффективный ядерный заряд и характеризуются высокой энергией валентных орбиталей. Так, металлов основной группы имеют очень низкую электроотрицательность (0.с 7 до 1,5).
3.6-5. Поздние металлы
Исключением из приведенного выше общего положения об электроотрицательности металлов является тот факт, что d- и f-электроны не очень хорошо экранируют, поскольку они содержат соответственно две и три узловые плоскости. Следовательно, эффективный ядерный заряд, испытываемый валентными орбиталями в поздних металлах (металлы, лежащие в правой части периодической таблицы), может быть довольно большим. Например, у Pb на 27 протонов и электронов больше, чем у Cs, но 24 из этих электронов являются d- и f-электронами, которые не очень хорошо экранируют 27 дополнительных протонов. Так, 6p-электроны в Tl и Pb испытывают относительно высокие Z эфф (12,25 и 12,39 соответственно), что делает оба этих металла достаточно электроотрицательными. Действительно, электроотрицательность Pb намного больше, чем у Si, хотя они и принадлежат к одной группе, а валентные орбитали в Pb имеют гораздо более высокое квантовое число n . Мы заключаем, что из-за высокого эффективного заряда ядер поздние металлы обладают необычно высокой электроотрицательностью (см.2), что существенно влияет на их химические свойства.
Так, 6p-электроны в Tl и Pb испытывают относительно высокие Z эфф (12,25 и 12,39 соответственно), что делает оба этих металла достаточно электроотрицательными. Действительно, электроотрицательность Pb намного больше, чем у Si, хотя они и принадлежат к одной группе, а валентные орбитали в Pb имеют гораздо более высокое квантовое число n . Мы заключаем, что из-за высокого эффективного заряда ядер поздние металлы обладают необычно высокой электроотрицательностью (см.2), что существенно влияет на их химические свойства.| Металл | х |
|---|---|
| Аг | 1,9 |
| Сн | 2,0 |
| рт.ст. | 2,0 |
| Тл | 2,0 |
| Пб | 2,3 |
Таблица 3. 2: Электроотрицательность поздних металлов
2: Электроотрицательность поздних металлов
3.6-6. Металлы и неметаллы
Металлы имеют низкую энергию ионизации, а неметаллы имеют высокую электроотрицательность.
Металлы характеризуются более низкими эффективными ядерными зарядами, поэтому они имеют•
относительно большие атомные радиусы•
более низкие энергии ионизации•
более низкая электроотрицательность
•
относительно малые атомные радиусы•
более высокие энергии ионизации•
более высокие электроотрицательности

3.6-7. Электроотрицательность Упражнение
3.6-8. Орбитальная энергия и атомные свойства. Упражнение
. Упражнение 3.12: Используйте то, что вы узнали о взаимосвязях между орбитальной энергией и энергией ионизации, и электроотрицательность и заселенность валентных орбит атомов X и Y, приведенные ниже, чтобы ответить на следующие вопросы об атомах X и Y.Группа периодической таблицы, к которой принадлежит каждый атом:
3.7 Магнитные свойства
Введение
Все магнитные свойства обусловлены магнитными полями, вызванными спином электрона. Однако спаренные электроны не создают магнитного поля, поскольку спины двух разных электронов противоположны, и их магнитные поля компенсируются. Следовательно, магнитные свойства атома обусловлены исключительно его неспаренными электронами. В этом разделе мы даем краткое введение в магнитные свойства атомов и материалов.
Предпосылки
Цели
•
Объясните происхождение магнетизма.•
Различают парамагнитные и диамагнитные атомы.•
Объясните, почему магнитные атомы не всегда являются магнитными материалами.
3.7-1. Парамагнетизм и диамагнетизм
Парамагнетизм атома увеличивается с увеличением числа неспаренных электронов.
Атомы с неспаренными электронами парамагнитны .Парамагнитные атомы выравниваются в магнитных полях из-за наличия неспаренных электронов. Чем больше в атоме неспаренных электронов, тем более он парамагнетичен. И Li, и N имеют незаполненные валентные подоболочки, поэтому оба имеют неспаренные электроны и являются парамагнитными. У N три неспаренных электрона, а у Li только один, поэтому N более парамагнетичен, чем Li. Атомы без неспаренных электронов диамагнитны .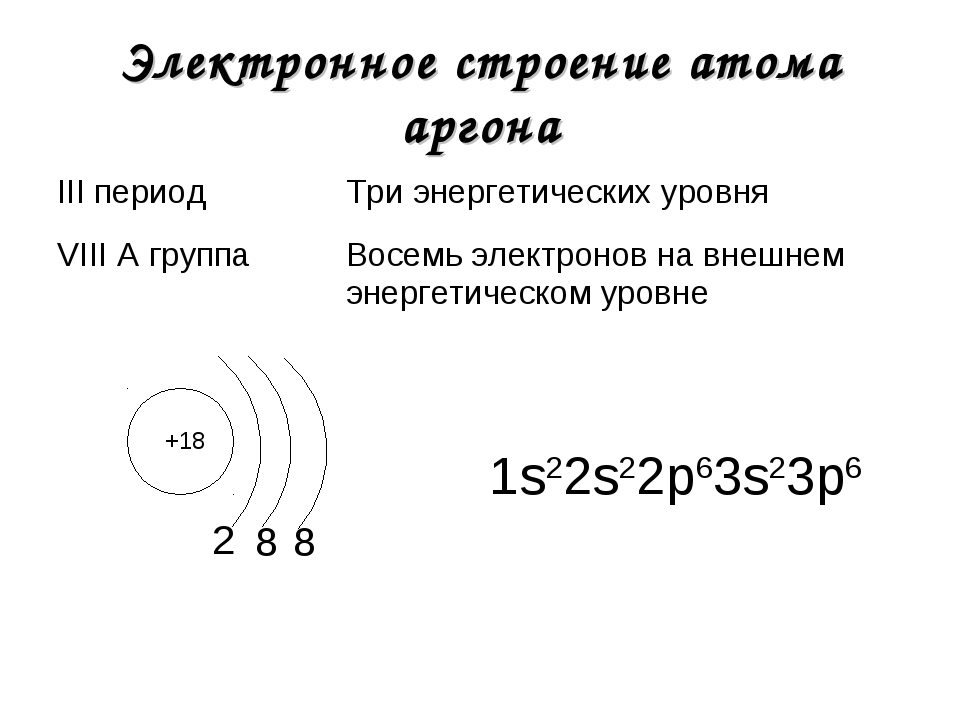 Диамагнитные атомы не выравниваются в магнитных полях, потому что у них нет неспаренных электронов.Ни Be, ни Ne не имеют незаполненных валентных оболочек, поэтому оба являются диамагнетиками.
Диамагнитные атомы не выравниваются в магнитных полях, потому что у них нет неспаренных электронов.Ни Be, ни Ne не имеют незаполненных валентных оболочек, поэтому оба являются диамагнетиками.3.7-2. Ферромагнетизм
Ферромагнетизм — это мера объемного магнетизма материала, а парамагнетизм — мера магнетизма отдельных атомов.
Парамагнетизм и диамагнетизм – это атомарные свойства, а не объемные свойства. Таким образом, N и Li являются парамагнитными атомами, но газообразный азот и металлический литий не являются магнитными, потому что неспаренные электроны на атомах соединяются друг с другом, образуя материалы, которые не являются магнитными.Знакомый вам магнетизм называется ферромагнетизм . Это объемное свойство , потому что оно требует неспаренных электронов в материале, а не только в изолированном атоме. Железо является наиболее известным примером.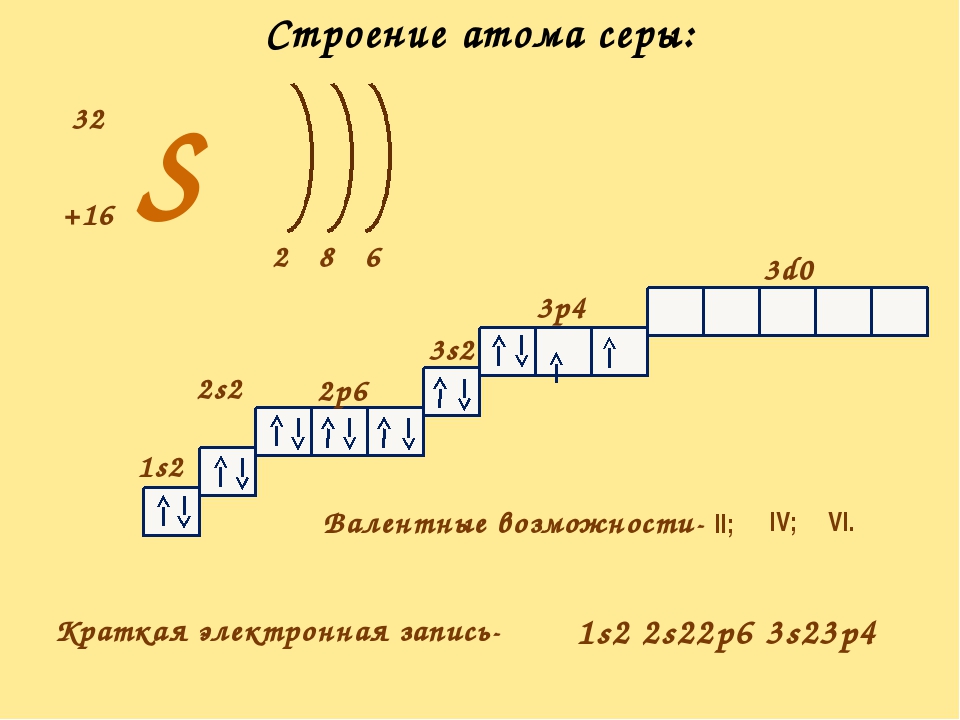 Атомы Fe имеют четыре неспаренных электрона, поэтому атомы Fe являются парамагнитными. Когда атомы Fe связываются с образованием металлического железа, в твердом теле возникает электронное спаривание, но не все четыре пары электронов. Следовательно, металлическое железо является магнитным, а железо — ферромагнетиком.
Атомы Fe имеют четыре неспаренных электрона, поэтому атомы Fe являются парамагнитными. Когда атомы Fe связываются с образованием металлического железа, в твердом теле возникает электронное спаривание, но не все четыре пары электронов. Следовательно, металлическое железо является магнитным, а железо — ферромагнетиком.3.7-3. Упражнение на парамагнетизм
3.8 Упражнения и решения
Выберите ссылки, чтобы просмотреть упражнения в конце главы или решения нечетных упражнений.Электронная структура — Периодическая таблица — AQA — GCSE Chemistry (Single Science) Revision — AQA
Электронная структура — это способ расположения электронов в атоме.
Электроны в оболочках
Электроны в атомах занимают энергетические уровни, также называемые электронными оболочками, вне ядра. Различные оболочки могут содержать разное максимальное количество электронов. Электроны в атоме сначала занимают самый низкий доступный энергетический уровень. Это ближайшая к ядру оболочка. Когда эта оболочка заполняется, электроны начинают занимать следующий энергетический уровень.
Различные оболочки могут содержать разное максимальное количество электронов. Электроны в атоме сначала занимают самый низкий доступный энергетический уровень. Это ближайшая к ядру оболочка. Когда эта оболочка заполняется, электроны начинают занимать следующий энергетический уровень.
Ниже приведена таблица, показывающая максимальное количество электронов, которое элемент может иметь для каждой оболочки своего энергетического уровня. Показанная информация для элементов с атомными номерами с 1 по 20:
| Shell | e3ha9d4mz4.0.0.0.1:0.1.0.$0.$2.$3.$1.$0.$1″> максимум |
|---|---|
| первые | 2 |
| второй | 8 |
| третий | 8 |
Электронную структуру атома можно предсказать по его атомному номеру.Например, атомный номер натрия равен 11. Атомы натрия имеют 11 протонов и, следовательно, 11 электронов:
- два электрона занимают первую оболочку
- восемь электронов занимают вторую оболочку
- один электрон занимает третью оболочку
Это электронная структура может быть записана как 2,8,1 (каждая запятая или точка отделяет одну оболочку от другой). Эту электронную структуру также можно изобразить в виде диаграммы. На этих диаграммах:
- e3ha9d4mz4.0.0.0.1:0.1.0.$0.$3.$4.$0″> каждая оболочка показана в виде кружка
- каждый электрон показан в виде точки или креста
Электронные структуры и периодическая таблица
Электронная структура элемент связан с его положением в периодической таблице.
| Электронная структура Характеристика | Ссылка на периодическую таблицу | |||||
|---|---|---|---|---|---|---|
| Количество оболочек | Количество оболочек | 1 номер | e3ha9d4mz4.0.0.0.1:0.1.0.$0.$4.$2.$2.$0.$1″> | Количество электронов в самом вершине Shell | Номер группы | |
| Номера добавлено вместе | Атомный номер |
Электронная структура натрия (2,8,1) показывает, что натрий, Na:
- $4.$0″> находится в периоде 3
- находится в группе 1
- имеет атомный номер (2 + 8 + 1) = 11
Натрий – Информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: натрий
(Промо)
Вы слушаете Химию в ее стихии, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Мира Сентилингам
На этой неделе важный элемент с раздвоением личности. Вот Дэвид Рид.
Дэвид Рид
Можно сказать, что натрий, как и большинство элементов в периодической таблице, обладает раздвоением личности. С одной стороны, это необходимое питательное вещество для большинства живых существ, и все же, благодаря своей реактивной природе, оно также способно нанести ущерб, если вы соедините его с чем-то, чего не следует делать.
Как таковой натрий встречается в природе только в виде соединений и никогда в виде свободного элемента. Несмотря на это, он очень распространен, составляя около 2,6% земной коры по весу. Его наиболее распространенные соединения включают растворенный хлорид натрия (или поваренную соль), его твердую форму, галит и катион, уравновешивающий заряд в цеолитах.
Помимо того, что это важное питательное вещество, история человека и натрия, как говорят, началась еще во времена фараонов в Древнем Египте, с первого письменного упоминания о соединении натрия в виде иероглифов.Трудно описать пиктограмму словами, но представьте себе волнистую линию поверх полого глаза, поверх полукруга, а рядом с ними — изображение стервятника, обращенного влево. Эта пиктограмма означала «божественный» или «чистый», и ее название является корнем слова «натрон», которое использовалось для обозначения стиральной соды или декагидрата карбоната натрия, как мы знаем его сегодня. Карбонат натрия использовался в мыле, а также в процессе мумификации благодаря его водопоглощающим и убивающим бактерии свойствам регулирования pH.
Однако в средневековой Европе карбонат натрия также использовался как лекарство от головной боли, поэтому он получил название sodanum от арабского suda, что означает головная боль. Именно эта терминология вдохновила сэра Хамфри Дэви назвать элемент натрием, когда он впервые выделил его, пропуская электрический ток через едкий натр или гидроксид натрия в 1807 году. Этот процесс известен как электролиз, и, используя его, Дэви продолжил выделение элементарного калий, кальций, магний и барий очень похожим методом.
Учителя химии часто путают детей, рассказывая им о химических символах. В то время как H, N, C и O кажутся совершенно логичными, сокращение натрия до Na поначалу кажется нелогичным. Однако если мы рассмотрим слово натрон, то увидим, откуда взялась сокращенная форма.
При выделении в металлической форме серебристо-белый натрий является агрессивным элементом, немедленно окисляющимся при контакте с воздухом и бурно выделяющим газообразный водород, который может воспламениться при контакте с водой. Это один из высокореакционноспособных элементов первой группы, которые называют щелочными металлами.
Это один из высокореакционноспособных элементов первой группы, которые называют щелочными металлами.
Как и другие щелочные металлы, он имеет очень характерный тест на пламя – ярко-оранжевый цвет по эмиссии D-линии. Это то, что вы видели во всех застроенных районах в виде уличных фонарей, в которых используется натрий для получения неестественного желтого света, омывающего наши улицы. Этот эффект был впервые отмечен в 1860 году Кирхгофом и Бунзеном, известными как Bunsen Burner.
Почти все молодые химики в какой-то момент проводят испытание пламенем, и хлорид натрия является популярным выбором.К сожалению, интенсивность цвета такова, что если какое-либо соединение прольется в горелку Бунзена, оно обречено гореть синим и оранжевым пятнистым пламенем, казалось бы, вечно. Реакция натрия с водой — любимая демонстрация, и в Интернете полно роликов с ней.
Применение натрия и его соединений настолько разнообразно, что перечислить их все здесь просто невозможно. Пара примеров включает в себя тот факт, что натрий используется для охлаждения ядерных реакторов, поскольку он не кипит, как вода, при высоких температурах. достигнуты.
достигнуты.
Гидроксид натрия можно использовать для удаления серы из бензина и дизельного топлива, хотя образующийся токсичный бульон из побочных продуктов привел к тому, что этот процесс объявлен вне закона в большинстве стран. Гидроксид натрия также используется в производстве биодизельного топлива и в качестве ключевого компонента продуктов, удаляющих засоры из канализации.
Пищевая сода на самом деле содержит натрий (это указано в названии!) и ее химическое название — бикарбонат натрия, где, я уверен, вы сталкивались с ней при выпечке или приготовлении пищи, где она подвергается термическому разложению при температуре выше 70°C с выделением углерода. диоксид – который затем заставляет ваше тесто подниматься.
Однако именно в виде иона натрий становится действительно важным. Среднестатистическому человеку необходимо потреблять около двух граммов натрия в день, и практически все это будет поступать в виде соли с пищей. Ионы натрия используются для создания электрических градиентов при возбуждении нейронов в головном мозге. При этом натрий (и его старший брат калий) диффундирует через клеточные мембраны. Натрий диффундирует внутрь и откачивается обратно, в то время как калий совершает обратное путешествие. На это может уйти огромное количество энергии тела — иногда до 40 процентов.
При этом натрий (и его старший брат калий) диффундирует через клеточные мембраны. Натрий диффундирует внутрь и откачивается обратно, в то время как калий совершает обратное путешествие. На это может уйти огромное количество энергии тела — иногда до 40 процентов.
Я хотел бы закончить краткой историей, в которой подчеркивается двойственность натрия. Один человек купил в Интернете три с половиной фунта металлического натрия и провел вечер, реагируя с водой различных форм и размеров, пока он и его друзья наблюдали за происходящим с безопасного расстояния. Вечеринка явно удалась, но он не предлагает устраивать собственную. На следующий день, когда хозяин вышел наружу, чтобы проверить чистоту места, где он взорвал натрий, он заметил, что оно было покрыто роями желтых бабочек.Проведя небольшое исследование, он обнаружил, что у этих бабочек есть интересная привычка. Самцы ищут натрий и постепенно собирают его, а позже преподносят своим самкам в качестве ритуала. Итак, это суммирует две стороны натрия.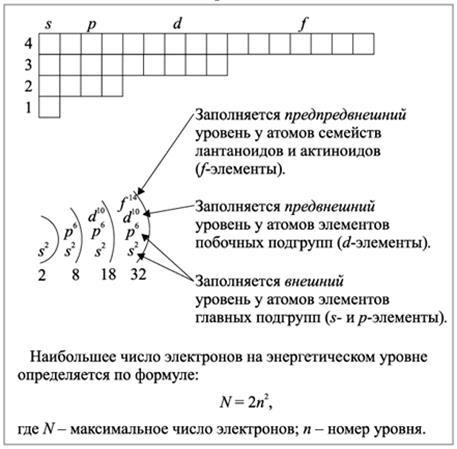 Его агрессивный реактивный характер контрастирует с его использованием влюбчивыми бабочками.
Его агрессивный реактивный характер контрастирует с его использованием влюбчивыми бабочками.
Мира Сентилингам
Это был Дэвид Рид из Саутгемптонского университета с двуличной химией натрия. На следующей неделе химический эквивалент обнаружения поезда.
Брайан Клегг
Легко обвинить ученых, производящих новые, очень тяжелые элементы, в том, что они следят за химическими поездами. Подобно тому, как наблюдатели поездов часами высматривают определенный локомотив, чтобы подчеркнуть его в своей книге, может показаться, что эти химики кропотливо производят атом или два сверхтяжелого элемента в качестве упражнения, чтобы поставить галочку. Но элемент 114 преподнес не один сюрприз, показав, почему такие элементы стоит исследовать.
Мира Сентилингам
И чтобы узнать, почему элемент 114 стоит затраченных усилий, присоединяйтесь к Брайану Клеггу в программе Химия в своей стихии на следующей неделе.
(Акция)
(Конец акции)
Атомная структура и электронная конфигурация
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному агенту, указанному ниже.Если университетские наставники примут меры в ответ на ан Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как
так как
ChillingEffects. org.
org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно искажать информацию о том, что продукт или деятельность нарушают ваши авторские права.Таким образом, если вы не уверены, что содержимое находится на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т.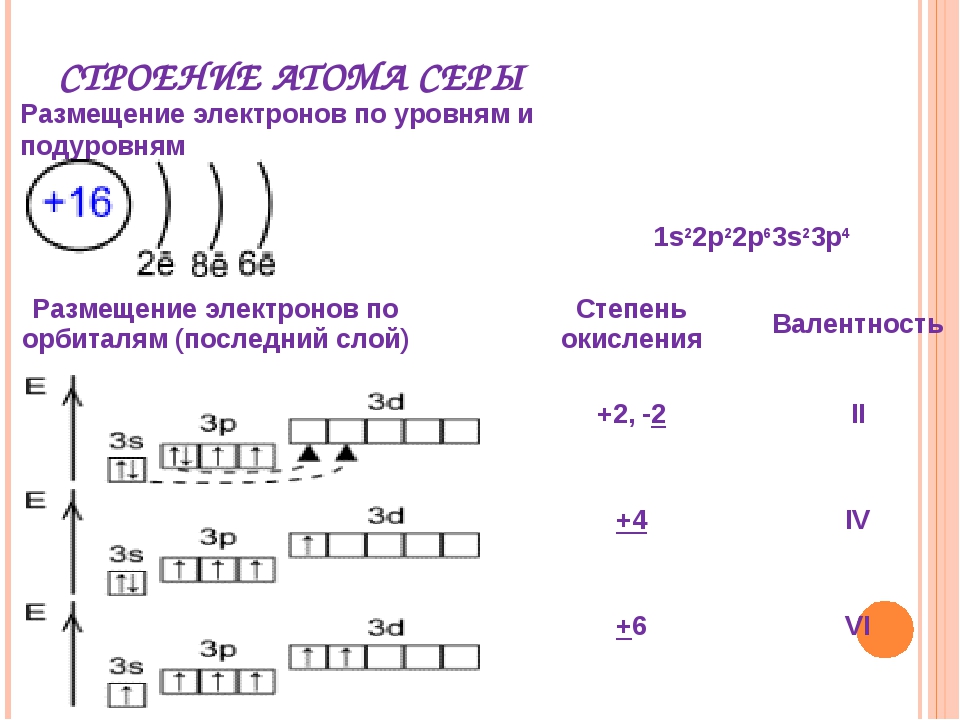 д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
Сент-Луис, Миссури 63105
Или заполните форму ниже:
Атомный радиус за период 3
Результаты обучения
Изучив эту страницу, вы сможете:
- описать и объяснить тенденцию изменения атомного радиуса в течение периода 3
Атомный радиус
В таблице приведены значения атомных радиусов для элементов от Na до Ar.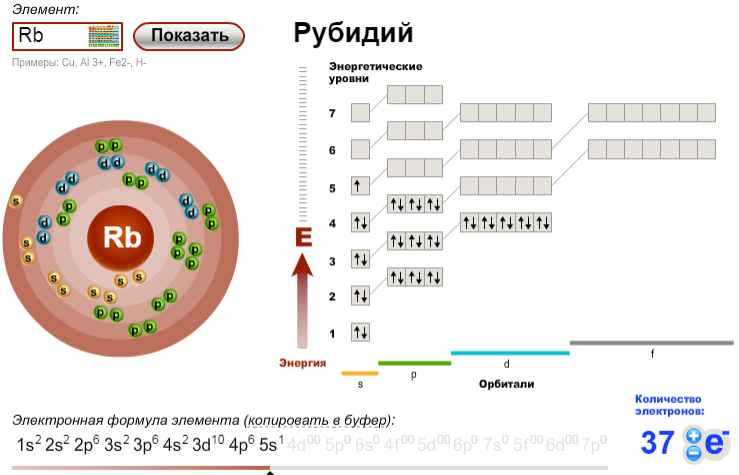
| Элемент | Символ | Атомный номер | Атомный радиус /нм |
|---|---|---|---|
| натрий | На | 11 | 0,191 |
| магний | мг | 12 | 0,160 |
| алюминий | Ал | 13 | 0.130 |
| кремний | Си | 14 | 0,118 |
| фосфор | Р | 15 | 0,110 |
| сера | С | 16 | 0,102 |
| хлор | Кл | 17 | 0,099 |
| аргон | Ар | 18 | 0.095 |
Атомный радиус — это расстояние от центра ядра до края окружающего электронного облака. Он измеряется или рассчитывается по-разному, поэтому значения варьируются от источника к источнику.
Описание тренда
На графике показано, как радиус атома меняется в течение периода 3:
- с увеличением атомного номера атомный радиус уменьшается.
×
Объяснение этой тенденции
Переход через период 3:
- количество протонов в ядре увеличивается так …
- ядерный заряд увеличивается…
- электронов больше, но увеличение экранирования незначительно, потому что каждый лишний электрон входит в ту же оболочку …
- поэтому сила притяжения между ядром и электронами увеличивается …
- и атомный радиус уменьшается.
Можно было бы ожидать, что атомный радиус увеличится, потому что число электронов в каждом атоме увеличивается в течение периода 3.
Однако этого не происходит: число протонов также увеличивается, а дополнительная защита от электронов в той же оболочке сравнительно невелика.
Ранняя атомная теория: Далтон, Томсон, Резерфорд и Милликен – Видео и стенограмма урока
Ранние греки
Во-первых, мы собираемся перенестись чуть более чем на 2000 лет назад, во времена Аристотеля и Демокрита. Греческий философ Аристотель считал, что материю можно бесконечно делить без изменения ее свойств. Демокрит не согласился. Он думал, что материя может быть разделена только до тех пор, пока вы не доберетесь до мельчайшей частицы (которую он назвал атомом, происходящим от греческого слова atomos , означающего неделимого ).Итак, кто был прав? Аристотель был очень убедителен и провел много экспериментов, используя научный метод, поэтому ему поверили все больше людей.
Джон Дальтон и атомы
Только примерно 2000 лет спустя, в начале 1800-х, появился Джон Дальтон и опроверг Аристотеля. Далее Дальтон сказал, что материя состоит из крошечных частиц, называемых атомами, которые не могут быть разделены на более мелкие части и не могут быть уничтожены. Он также заявил, что все атомы одного и того же элемента будут совершенно одинаковыми и что атомы разных элементов могут объединяться, образуя соединения.Самое потрясающее в модели атома Дальтона то, что он придумал ее, даже не видя атома! Он не имел представления о протонах, нейтронах или электронах. Его модель создавалась исключительно на макроскопических экспериментах или наблюдениях невооруженным глазом.
Томсон и открытие электронов
Теперь давайте перенесемся в конец 1800-х годов, когда Дж.Дж. Томсон открыл электрон. Томсон использовал так называемую электронно-лучевую трубку или электронную пушку. Вы, наверное, видели электронно-лучевую трубку, даже не подозревая об этом! Это громоздкая электронная часть старых телевизоров. Томсон использовал электронно-лучевую трубку с магнитом и обнаружил, что создаваемый ею зеленый луч состоит из отрицательно заряженного материала. Он провел множество экспериментов и обнаружил, что масса одной из таких частиц почти в 2000 раз легче атома водорода.Отсюда он решил, что эти частицы должны были появиться откуда-то внутри атома и что Дальтон был неправ, утверждая, что атомы нельзя разделить на более мелкие части. Томсон пошел еще дальше и определил, что этим отрицательно заряженным электронам нужно что-то положительное, чтобы уравновесить их. Итак, он определил, что они были окружены положительно заряженным материалом. Это стало известно как модель атома «сливовый пудинг». Отрицательно заряженные сливы были окружены положительно заряженным пудингом.
Томсон использовал так называемую электронно-лучевую трубку или электронную пушку. Вы, наверное, видели электронно-лучевую трубку, даже не подозревая об этом! Это громоздкая электронная часть старых телевизоров. Томсон использовал электронно-лучевую трубку с магнитом и обнаружил, что создаваемый ею зеленый луч состоит из отрицательно заряженного материала. Он провел множество экспериментов и обнаружил, что масса одной из таких частиц почти в 2000 раз легче атома водорода.Отсюда он решил, что эти частицы должны были появиться откуда-то внутри атома и что Дальтон был неправ, утверждая, что атомы нельзя разделить на более мелкие части. Томсон пошел еще дальше и определил, что этим отрицательно заряженным электронам нужно что-то положительное, чтобы уравновесить их. Итак, он определил, что они были окружены положительно заряженным материалом. Это стало известно как модель атома «сливовый пудинг». Отрицательно заряженные сливы были окружены положительно заряженным пудингом.
Резерфорд и ядро
Несколько лет спустя Эрнест Резерфорд , один из учеников Томсона, провел несколько испытаний на модели сливового пудинга Томсона. Сотрудники его лаборатории направили луч положительно заряженных частиц, называемых альфа-частицами, на очень тонкий лист золотой фольги. (Позже вы узнаете, что альфа-частицы на самом деле являются просто ядрами атомов гелия.) Поскольку эти альфа-частицы имели такую большую массу, он полностью ожидал, что все альфа-частицы пройдут сквозь золотую фольгу.Это потому, что, если бы Томсон был прав относительно модели атома сливового пудинга, альфа-частицы просто прошли бы через положительно заряженную материю и попали бы в детекторный экран с другой стороны.
Сотрудники его лаборатории направили луч положительно заряженных частиц, называемых альфа-частицами, на очень тонкий лист золотой фольги. (Позже вы узнаете, что альфа-частицы на самом деле являются просто ядрами атомов гелия.) Поскольку эти альфа-частицы имели такую большую массу, он полностью ожидал, что все альфа-частицы пройдут сквозь золотую фольгу.Это потому, что, если бы Томсон был прав относительно модели атома сливового пудинга, альфа-частицы просто прошли бы через положительно заряженную материю и попали бы в детекторный экран с другой стороны.
Но случилось что-то странное. Часть альфа-частиц прошла, а часть отклонилась от золотой фольги и попала в детектор в разных местах. Некоторые даже пошли прямо назад по тому же пути, по которому они пошли! Резерфорд сказал, что это было бы так, как если бы вы выстрелили 15-дюймовым снарядом в кусок папиросной бумаги, а он вернулся бы и попал в вас.После этого эксперимента Резерфорд пришел к выводу, что эти альфа-частицы должны были столкнуться с чем-то очень маленьким, плотным и положительно заряженным, чтобы вернуться обратно. Резерфорд утверждал, что это также показывает, что атом состоит в основном из пустого пространства и что весь положительный заряд не распределяется равномерно по всему атому, а вместо этого сжимается в крошечное ядро в центре атома.
Резерфорд утверждал, что это также показывает, что атом состоит в основном из пустого пространства и что весь положительный заряд не распределяется равномерно по всему атому, а вместо этого сжимается в крошечное ядро в центре атома.
Милликен и заряд электрона
Наконец, мы продвинемся еще на несколько лет вперед, когда Роберт Милликен обнаружит заряд электрона. Он сделал это, используя свой знаменитый «эксперимент с каплями масла», в котором он распылял заряженные капли масла между двумя металлическими пластинами. Он смог предотвратить падение масляного тумана, уравновешивая направленную вниз гравитационную силу электрической силой, равной заряду капли масла, что заставляло каплю масла отталкиваться вверх.Когда эти две противодействующие силы уравновешиваются, он может рассчитать заряд капли масла и с помощью графика определить, сколько заряженных частиц содержится в каждой капле; затем рассчитайте заряд каждой отдельной частицы.
Краткий обзор урока
Это были лишь некоторые из сотен ученых, которые усердно работали, чтобы углубить наши знания и понимание атома. Важно отметить, что наше понимание было развивающимся процессом, включая противоположные взгляды Аристотеля и Демокрита на атом: Аристотель считал, что материя может быть разделена навсегда, а Демокрит полагал, что мы в конечном итоге доберемся до мельчайшей частицы, называемой атомом.Две тысячи лет спустя Дальтон доказал, что Демокрит был прав. Вскоре после этого Томсон открыл электроны, Резерфорд открыл ядро, а Милликен измерил заряд электрона. Представление об атоме, которое у вас было в начале этого урока, все еще ошибочно по сравнению с текущим представлением об атоме, которое мы обсудим в следующем уроке. И по мере того, как ученые узнают больше об атоме, модель, которую мы используем для его описания, будет меняться и становиться все более и более точной.
Цели урока
После просмотра этого урока вы сможете:
- Объяснить взгляды Аристотеля и Демокрита на материю
- Идентифицировать Джон Далтон , Дж.
 Дж. Томсон , Эрнест Резерфорд и Роберт Милликен , и опишите, что каждый из них открыл об атомах
Дж. Томсон , Эрнест Резерфорд и Роберт Милликен , и опишите, что каждый из них открыл об атомах - Понять методы, которые каждый из этих ученых использовал для своих открытий
Периоды с 1 по 3 Электронная конфигурация подоболочки
Ключевые понятия
- Электроны в атоме могут располагаться в оболочках (или энергетических уровнях).
- Номер периода таблицы Менделеева говорит нам, какая оболочка (энергетический уровень) заполняется.
Период 1: К оболочка (1 st энергетический уровень) заполнение
Период 2: L оболочка (2 и энергетический уровень) заполнение
Период 3: M-оболочка (3 rd энергетический уровень) заполнение - Нижние энергетические уровни заполняются раньше, чем более высокие энергетические уровни.
- Каждая оболочка (уровень энергии) может быть подразделена на подоболочки (или подуровни):
s подоболочка: максимум 2 электрона
p подоболочка: максимум 6 электронов - Группа таблицы Менделеева, к которой принадлежит элемент, говорит нам, какая подоболочка заполняется:
подоболочка s: группа 1, группа 2, водород и гелий
p подоболочка: группы 13, 14, 15, 16, 17, 18 - Внутри определенного энергетического уровня (оболочки) подоболочка s заполнена электронами до подоболочки p.

- Электронная конфигурация (электронная конфигурация), указанная в обозначении подоболочки, указывает, сколько электронов находится в подоболочке каждой оболочки (на энергетических подуровнях каждого энергетического уровня)
Пример подметки электронной конфигурации: 1S 2 2S 1 2 2P 2P 1 4
2 электроны в 1S SUBShell , 2 электроны в 2S SUBSHELL , 4 электрона в подоболочке 2p . - Электронная конфигурация подоболочки атома также может быть представлена в сокращенной форме, известной как «конденсированная электронная конфигурация», в которой символ предшествующего элемента благородного газа помещен в квадратные скобки, за которым следует обозначение подоболочки для электронов в самом высоком уровни энергии:
Пример электронной конфигурации конденсированной подоболочки: [He] 2s 2 2p 4
Концепция электронной подоболочки
Электроны, окружающие ядро атома, можно представить как занимающие оболочки или энергетические уровни.
Каждая из этих электронных оболочек или энергетических уровней может быть далее разделена на подоболочки или энергетические подуровни.
Для периодов с 1 по 3 этим подоболочкам или энергетическим подуровням присваиваются символы s и p.
Подоболочка s может содержать максимум 2 электрона.
Подоболочка A p может содержать максимум 6 электронов.
Оболочка K (энергетический уровень 1 st ) содержит максимум 2 электрона.
Таким образом, оболочка K (энергетический уровень 1 st ) имеет ТОЛЬКО подоболочку s, для оболочки K нет подоболочки p.
Подоболочка s энергетического уровня 1 st (оболочка K) называется подоболочкой 1s.
L-оболочка (энергетический уровень 2 и ) может содержать максимум 8 электронов, 2 из этих электронов могут находиться на подоболочке s, а остальные электроны должны занимать подоболочку p:
Подоболочка s энергетического уровня 2 nd называется подоболочкой 2s.
Подоболочка p энергетического уровня 2 nd называется подоболочкой 2p.`
M-оболочка (энергетический уровень 3 rd ) может содержать 8 электронов, 2 из этих электронов могут находиться в s-подоболочке, а остальные 6 электронов должны занимать p-подоболочку:
Подоболочка s энергетического уровня 3 rd называется подоболочкой 3s.
Подоболочка p энергетического уровня 3 rd называется подоболочкой 3p. `
Для каждого энергетического уровня (оболочки) электроны в подоболочке s (энергетический подуровень) имеют несколько меньшую энергию, чем электроны в подоболочке p (энергетический подуровень p), как показано на диаграмме ниже:
| ↑ ↑ ↑ ↑ | 3 | 3 RD Уровень энергии (M Shell) | ____ | 3P ____ (максимум 6 электронов) 3S ____ (максимум 2 электронов) | ↑ ↑ | 91 854 | ↑ ↑ ↑ | 2 -й уровень энергии (л оболочки) | ____ | 2p ____ (максимум Из 6 электронов) 2S ____ (максимум 2 электронов) | |
| ↑ | |||||||||||
| ↑ | 1 ST2 Уровень энергии (K Shell) | ____ | 1s____ (максимум 2 электрона) | ||||||||
| ↑ энергия | уровни (оболочки) | 90 084 подуровни (подуровни) |
Чтобы атом находился в самом низком энергетическом состоянии, электроны сначала занимают самые низкие энергетические подуровни (подоболочки), поэтому электроны заполняют подоболочки в следующем порядке:
1s, затем 2s, затем 2p, затем 3s, затем 3p
Когда мы пишем электронную конфигурацию (электронную конфигурацию) атома, используя обозначение подоболочки, нам нужно сначала определить номер энергетического уровня, затем символ подоболочки, содержащей электроны, а затем мы указываем, что количество электронов в эту подоболочку номером в верхнем индексе.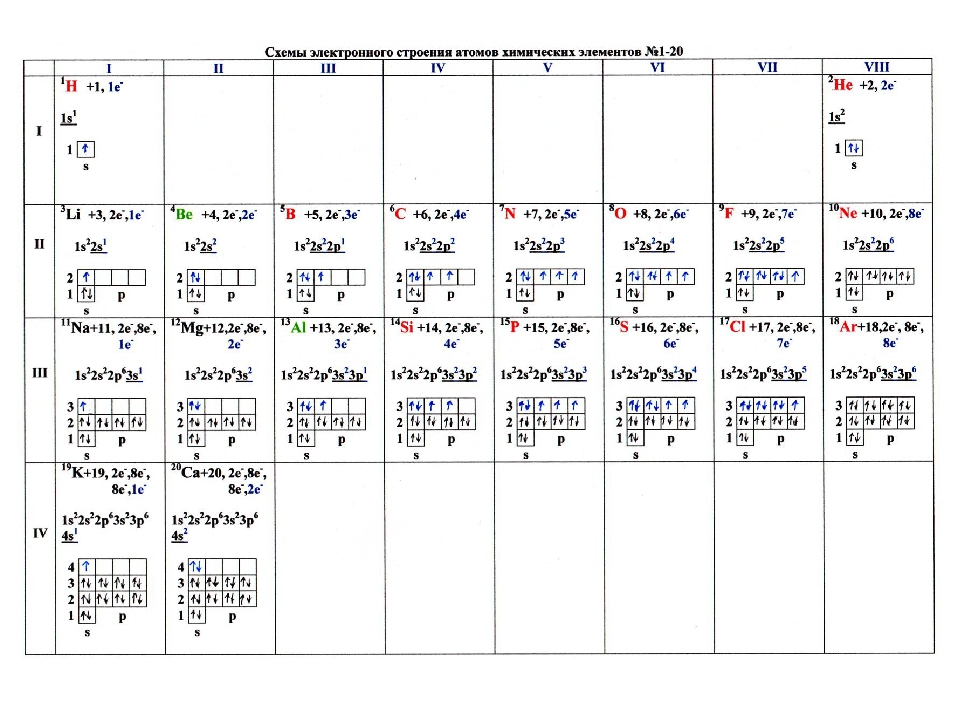
Пример. ( 1 с 2 )
На подоболочке s энергетического уровня 2 nd находится 2 электронов. ( 2 с 2 )
В подоболочке p энергетического уровня 2 nd находится 3 электронов.( 2 р 3 )
Число электронов на данной оболочке (энергетическом уровне) равно сумме числа электронов на подоболочках s и p для этого энергетического уровня.
Пример: Электронная (электронная) конфигурация конкретного атома 1s 2 2s 2 2p 3
На энергетическом уровне 1 st находится 2 электронов. ( 1 с 2 )
На 2 -м -м энергетическом уровне находится 5 электронов.
(2 электрона в подоболочке 2 s второго энергетического уровня ПЛЮС 3 электрона в подоболочке 2 p энергетического уровня 2 nd .)
Таким образом, общее число электронов в атоме равно сумме всех электронов во всех подоболочках всех энергетических уровней (оболочек):
Пример: Электронная (электронная) конфигурация конкретного атома 1s 2 2s 2 2p 3
Всего имеется 7 электронов:
2 электронов в s подоболочке 1 st энергетического уровня ПЛЮС 2 электронов в подоболочке s 2 й энергетический уровень ПЛЮС 3 электронов в подоболочке p энергетического уровня 2 й
А для нейтрального атома общее количество электронов равно количеству протонов в ядре, которое определяется атомным номером (Z) атома.
Пример: Электронная (электронная) конфигурация конкретного атома 1s 2 2s 2 2p 3
Всего 7 электронов.
Ядро атома должно содержать 7 протонов.
Атомный номер атома (Z) = 7
Это должен быть атом азота, потому что атомный номер азота равен 7.
Электронная конфигурация подоболочки периода 1
В периоде 1 Периодической таблицы есть только два элемента: водород (H) и гелий (He).Оба атома заполняют первый энергетический уровень (К-оболочку) электронами.
| Период 1 Заполнение оболочки K, 1 st уровень энергии | Z=1 H водород | Z=2 He гелий | ||||||||||||||||
Первый энергетический уровень (К-оболочка) имеет только одну подоболочку (подуровень), подоболочку 1s.
| Название атома (символ) | водород (H) | гелий (Он) |
|---|---|---|
| Атомный номер (Z) | 1 | 2 |
| Количество электронов (=Z) | 1 | 2 |
| Число электронов в K-оболочке (первый энергетический уровень) | 1 | 2 |
| корпус электронной конфигурации | 1 | 2 |
| подоболочечная электронная конфигурация | 1с 1 | 1с 2 |
Электронная конфигурация подоболочки периода 2
С гелием завершен первый энергетический уровень (K-оболочка), 1s 2 .
Атомы элементов периода 2 имеют первый энергетический уровень, 1s 2 , полный .
Каждый последующий электрон начинает заполнять второй энергетический уровень.
| Группа 1 | Группа 2 | Группа с 3 по 12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 | |||||
| блок с | р блок | ||||||||||||
| Период 2 Заполнение L оболочки, 2 nd уровень энергии | Z=3 Литий Литий | Z=4 Be бериллий | Z=5 B бор | Z=6 C углерод | Z=7 N азот | Z=8 O кислород | Z=9 F фтор | Z=10 Ne неон | |||||
Подоболочка 2s должна быть заполнена двумя электронами, прежде чем электроны будут добавлены к подоболочке 2p.
| Наименование (символ) | литий (литий) | бериллий (Be) | бор (Б) | углерод (С) | азот (Н) | кислород (О) | фтор (F) | неоновый (неоновый) |
|---|---|---|---|---|---|---|---|---|
| Атомарный Номер (Z) | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № электронов | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| № электронов 1 ст энергетический уровень | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| №электроны 2 й энергетический уровень | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| электронный корпус конфигурация | 2,1 | 2,2 | 2,3 | 2,4 | 2,5 | 2,6 | 2,7 | 2,8 |
| подоболочка электрон конфигурация | 1 с 2 2 с 1 | 1 с 2 2 с 2 | 1с 2 2с 2 2п 1 | 1с 2 2с 2 2п 2 | 1с 2 2с 2 2п 3 | 1с 2 2с 2 2п 4 | 1с 2 2с 2 2п 5 | 1с 2 2с 2 2п 6 |
Поскольку у всех элементов периода 2 первый энергетический уровень (оболочка K) заполнен, химики часто использовали для обозначения этого сокращенное обозначение, в котором электронная конфигурация заполненного энергетического уровня представлена символом его благородного газа в квадрате. кронштейны [].Это известно как конденсированная электронная конфигурация или конденсированная электронная конфигурация.
Все элементы периода 2 имеют электронную структуру, которая начинается со структуры благородного газа гелия, поэтому она представлена как [He]:
| имя (символ) | подоболочка электронная конфигурация | сжатый электронная конфигурация |
|---|---|---|
| литий (Li) | 1 с 2 2 с 1 | [Он] 2s 1 |
| бериллий (Be) | 1 с 2 2 с 2 | [Он] 2s 2 |
| бор (Б) | 1с 2 2с 2 2п 1 | [Не] 2s 2 2p 1 |
| углерод (С) | 1с 2 2с 2 2п 2 | [Не] 2s 2 2p 2 |
| азот (Н) | 1с 2 2с 2 2п 3 | [Не] 2s 2 2p 3 |
| кислород (О) | 1с 2 2с 2 2п 4 | [Не] 2s 2 2p 4 |
| фтор (F) | 1с 2 2с 2 2п 5 | [He] 2s 2 2p 5 |
| неон (Ne) | 1с 2 2с 2 2п 6 | [Не] 2s 2 2p 6 |
Период 3
С неоном (Ne) завершен второй энергетический уровень, 1s 2 2s 2 2p 6 .Атомы элементов периода 3 начинают заполнять 3-й -й -й энергетический уровень (М-оболочка).
| Группа 1 | Группа 2 | Группа с 3 по 12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 | |||||
| блок с | р блок | ||||||||||||
| Период 3 Заполнение оболочки M, 3 rd уровень энергии | Z=11 Na натрий | Z=12 магний магний | Z=13 Алюминий Алюминий | Z=14 Si кремний | Z=15 P фосфор | Z=16 S сера | Z=17 Cl хлор | Z=18 Ar аргон | |||||
Подоболочка 3s должна быть заполнена двумя электронами, прежде чем электроны могут быть добавлены к подоболочке 3p.
| атомный номер (Z) | имя (символ) | оболочка электронная конфигурация | подоболочка электронная конфигурация |
|---|---|---|---|
| 11 | натрий (Na) | 2,8,1 | 1s 2 2s 2 2p 6 3s 1 |
| 12 | магний (мг) | 2,8,2 | 1s 2 2s 2 2p 6 3s 2 |
| 13 | алюминий (алюминий) | 2,8,3 | 1s 2 2s 2 2p 6 3s 2 3p 1 |
| 14 | кремний (Si) | 2,8,4 | 1s 2 2s 2 2p 6 3s 2 3p 2 |
| 15 | фосфор (P) | 2,8,5 | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| 16 | сера (S) | 2,8,6 | 1s 2 2s 2 2p 6 3s 2 3p 4 |
| 17 | хлор (Cl) | 2,8,7 | 1s 2 2s 2 2p 6 3s 2 3p 5 |
| 18 | аргон (Ar) | 2,8,8 | 1s 2 2s 2 2p 6 3s 2 3p 6 |
Обратите внимание, что электронная конфигурация всех элементов периода 3 начинается одинаково, 1s 2 2s 2 2p 6 , что является электронной конфигурацией неона, поэтому мы используем это [Ne] для записи сокращенной версии электронной конфигурации, сжатой электронной конфигурации каждого элемента периода 3:
| имя (символ) | подоболочка электронная конфигурация | конденсированная электронная конфигурация |
|---|---|---|
| натрий (Na) | 1s 2 2s 2 2p 6 3s 1 | [Не] 3s 1 |
| магний (мг) | 1s 2 2s 2 2p 6 3s 2 | [Не] 3s 2 |
| алюминий (алюминий) | 1s 2 2s 2 2p 6 3s 2 3p 1 | [Ne] 3s 2 3p 1 |
| кремний (Si) | 1s 2 2s 2 2p 6 3s 2 3p 2 | [Ne] 3s 2 3p 2 |
| фосфор (P) | 1s 2 2s 2 2p 6 3s 2 3p 3 | [Ne] 3s 2 3p 3 |
| сера (S) | 1s 2 2s 2 2p 6 3s 2 3p 4 | [Ne] 3s 2 3p 4 |
| хлор (Cl) | 1s 2 2s 2 2p 6 3s 2 3p 5 | [Ne] 3s 2 3p 5 |
| аргон (Ar) | 1s 2 2s 2 2p 6 3s 2 3p 6 | [Ne] 3s 2 3p 6 |
Резюме
Номер периода периодической таблицы говорит нам, какой энергетический уровень заполняется электронами:период 1:1 ст энергетический уровень (оболочка К) заполняется
период 2: 2 й энергетический уровень (L оболочка) заполняется
период 3: 3 rd энергетический уровень (M оболочка) заполняется
Периодическую таблицу можно разделить на блоки s и p, показывающие, у каких атомов заполнены подоболочки s и p.
s блок: Группа 1, Группа 2, водород (H) и гелий (He) Блок
p: группы с 13 по 18
| Период 1 Заполнение оболочки K, 1 st уровень энергии | Z=1 H водород | Z=2 He гелий | ||||||||||||||||
| Группа 1 | Группа 2 | Группа с 3 по 12 | Группа 13 | Группа 14 | Группа 15 | Группа 16 | Группа 17 | Группа 18 | ||||||||||
| блок с | р блок | |||||||||||||||||
| Период 2 Заполнение L оболочки, 2 nd уровень энергии | Z=3 Литий Литий | Z=4 Be бериллий | Z=5 B бор | Z=6 C углерод | Z=7 N азот | Z=8 O кислород | Z=9 F фтор | Z=10 Ne неон | ||||||||||
| Период 3 Заполнение оболочки M, 3 rd уровень энергии | Z=11 Na натрий | Z=12 магний магний | Z=13 Алюминий Алюминий | Z=14 Si кремний | Z=15 P фосфор | Z=16 S сера | Z=17 Cl хлор | Z=18 Ar аргон | ||||||||||
| Период | имя (символ) | подоболочка электронная конфигурация | конденсированная электронная конфигурация |
|---|---|---|---|
| Период 1 | водород (Н) | 1с 1 | |
| гелий (Не) | 1с 2 | ||
| Период 2 | литий (литий) | 1 с 2 2 с 1 | [Он] 2s 1 |
| бериллий (Be) | 1 с 2 2 с 2 | [Он] 2s 2 | |
| бор (Б) | 1с 2 2с 2 2п 1 | [Не] 2s 2 2p 1 | |
| углерод (С) | 1с 2 2с 2 2п 2 | [Не] 2s 2 2p 2 | |
| азот (Н) | 1с 2 2с 2 2п 3 | [Не] 2s 2 2p 3 | |
| кислород (О) | 1с 2 2с 2 2п 4 | [Не] 2s 2 2p 4 | |
| фтор (F) | 1с 2 2с 2 2п 5 | [Не] 2s 2 2p 5 | |
| неон (Ne) | 1с 2 2с 2 2п 6 | [Не] 2s 2 2p 6 | |
| Период 3 | натрий (Na) | 1s 2 2s 2 2p 6 3s 1 | [Не] 3s 1 |
| магний (мг) | 1s 2 2s 2 2p 6 3s 2 | [Не] 3s 2 | |
| алюминий (алюминий) | 1s 2 2s 2 2p 6 3s 2 3p 1 | [Ne] 3s 2 3p 1 | |
| кремний (Si) | 1s 2 2s 2 2p 6 3s 2 3p 2 | [Ne] 3s 2 3p 2 | |
| фосфор (P) | 1s 2 2s 2 2p 6 3s 2 3p 3 | [Ne] 3s 2 3p 3 | |
| сера (S) | 1s 2 2s 2 2p 6 3s 2 3p 4 | [Ne] 3s 2 3p 4 | |
| хлор (Cl) | 1s 2 2s 2 2p 6 3s 2 3p 5 | [Ne] 3s 2 3p 5 | |
| аргон (Ar) | 1s 2 2s 2 2p 6 3s 2 3p 6 | [Ne] 3s 2 3p 6 |

 И. Менделеева;
И. Менделеева; Этот уровень заполнен полностью.
Этот уровень заполнен полностью. 54
54 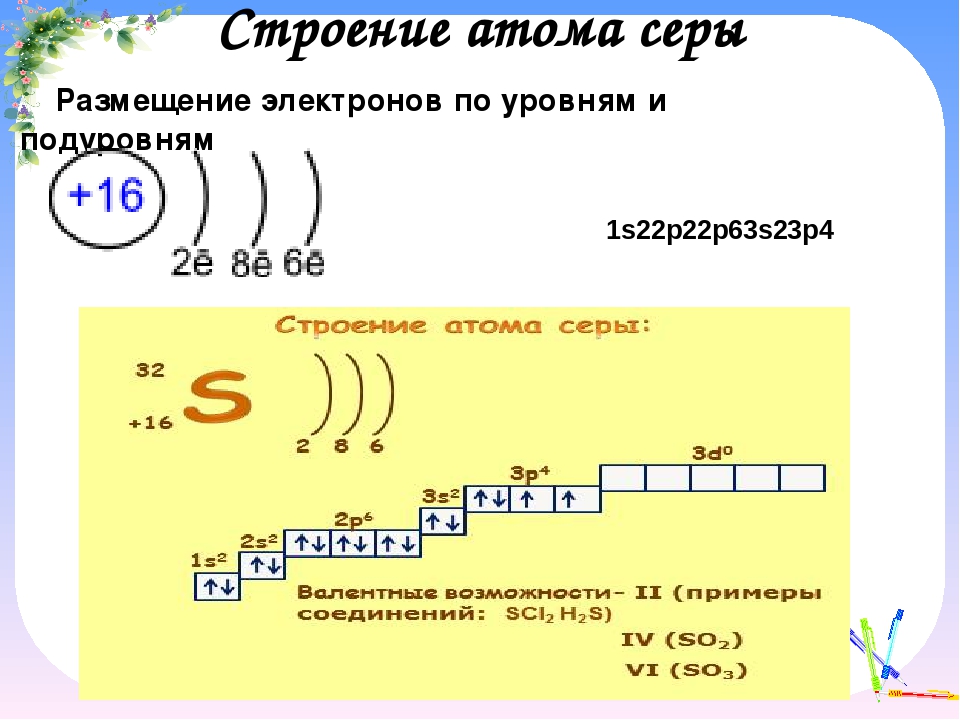 63
63  2
2  Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.


 3, который дает очень низкое значение для Z эфф в квадрате по сравнению с n в квадрате. Следовательно, валентный электрон на атоме лития связан слабо, и его энергия валентной орбиты достаточно высока. Действительно, все металлы характеризуются высокоэнергетическими валентными орбиталями.
3, который дает очень низкое значение для Z эфф в квадрате по сравнению с n в квадрате. Следовательно, валентный электрон на атоме лития связан слабо, и его энергия валентной орбиты достаточно высока. Действительно, все металлы характеризуются высокоэнергетическими валентными орбиталями. Таким образом,
Таким образом, Энергия ионизации также уменьшается вниз по семейству, поэтому Cs (высокий n и низкий Z эфф ) так легко теряет свой валентный электрон, что его приходится хранить в масле, потому что он отдает свой 6s-электрон воде или кислороду. при контакте с воздухом.
Энергия ионизации также уменьшается вниз по семейству, поэтому Cs (высокий n и низкий Z эфф ) так легко теряет свой валентный электрон, что его приходится хранить в масле, потому что он отдает свой 6s-электрон воде или кислороду. при контакте с воздухом.


 Следовательно, неметаллов являются сильно электроотрицательными (от 2,0 до 4,0).
Следовательно, неметаллов являются сильно электроотрицательными (от 2,0 до 4,0).
 Однако этого не происходит: число протонов также увеличивается, а дополнительная защита от электронов в той же оболочке сравнительно невелика.
Однако этого не происходит: число протонов также увеличивается, а дополнительная защита от электронов в той же оболочке сравнительно невелика. Дж. Томсон , Эрнест Резерфорд и Роберт Милликен , и опишите, что каждый из них открыл об атомах
Дж. Томсон , Эрнест Резерфорд и Роберт Милликен , и опишите, что каждый из них открыл об атомах

 )
)