Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
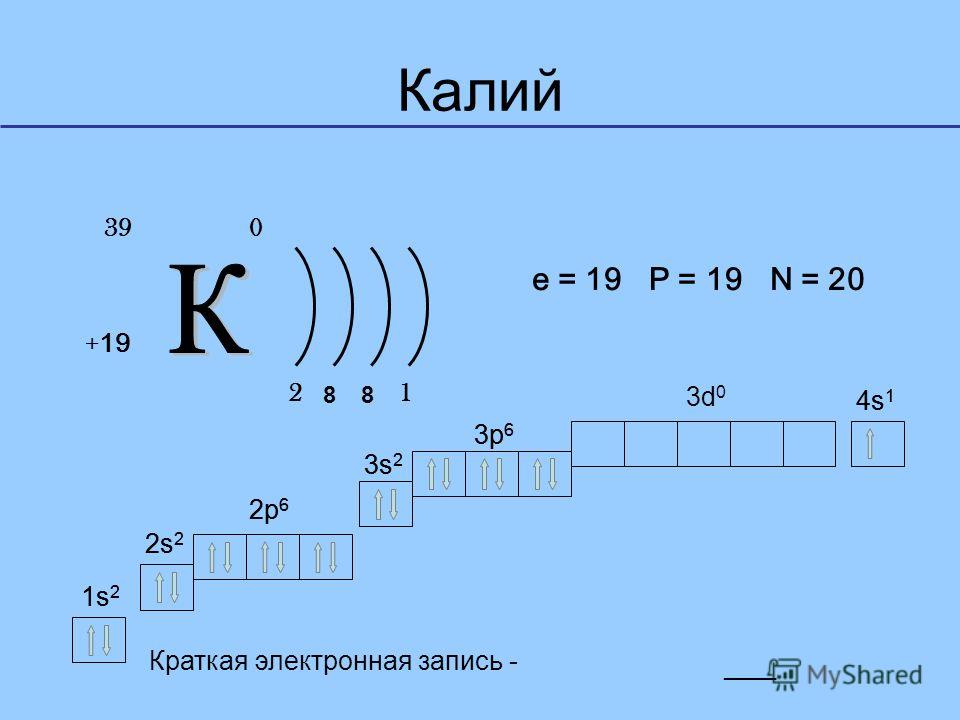
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Аргон, свойства атома, химические и физические свойства
Аргон, свойства атома, химические и физические свойства.
Ar 18 Аргон
39,948(1) 1s2 2s2 2p6 3s2 3p6
Аргон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 18. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), третьем периоде периодической системы.
Атом и молекула аргона. Формула аргона. Строение аргона
Изотопы и модификации аргона
Свойства аргона (таблица): температура, плотность, давление и пр.
Физические свойства аргона
Химические свойства аргона. Взаимодействие аргона. Реакции с аргоном
Получение аргона
Применение аргона: аргоновый лазер
Таблица химических элементов Д.И. Менделеева
Атом и молекула аргона. Формула аргона. Строение аргона:
Аргон (лат. Argon, от др.-греч. ἀργός – «ленивый, медленный, неактивный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ar и атомным номером 18. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), третьем периоде периодической системы.
Аргон самый лёгкий элемент периодической таблицы химических элементов Д.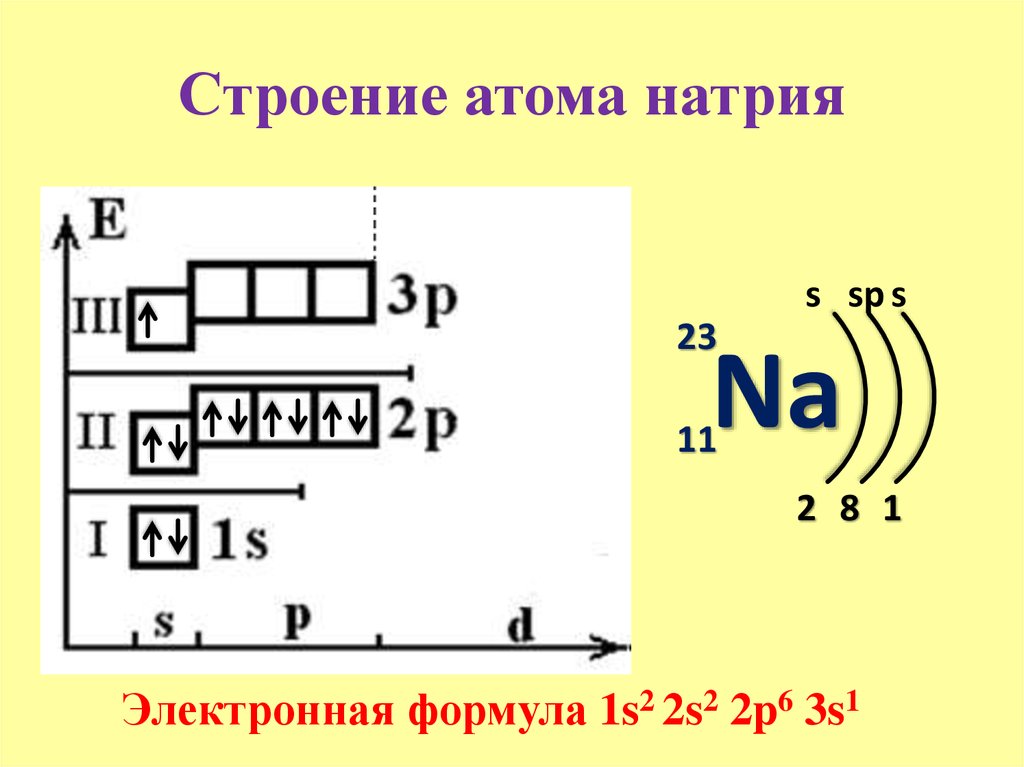 И. Менделеева из группы инертных (благородных) газов.
И. Менделеева из группы инертных (благородных) газов.
Аргон – химически инертный неметалл. Химически малоактивен.
Аргон обозначается символом Ar.
Как простое вещество аргон (химическая формула Ar) при нормальных условиях представляет собой одноатомный газ без цвета, вкуса и запаха.
Молекула аргона одноатомна.
Химическая формула аргона Ar.
Электронная конфигурация атома аргона 1s2 2s2 2p6 3s2 3p6. Потенциал ионизации (первый электрон) атома аргона равен 1520,57 кДж/моль (15,7596117(5) эВ).
Строение атома аргона. Атом аргона состоит из положительно заряженного ядра (+18), вокруг которого по трем атомным оболочкам движутся 18 электронов. При этом 10 электронов находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку аргон расположен в третьем периоде, оболочки всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. Внешний энергетический уровень атома аргона полностью завершен – 8 спаренных электронов. Поэтому аргон химически малоактивен. В свою очередь ядро атома аргона состоит из 18 протонов и 22 нейтронов. Аргон относится к элементам p-семейства.
Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. Внешний энергетический уровень атома аргона полностью завершен – 8 спаренных электронов. Поэтому аргон химически малоактивен. В свою очередь ядро атома аргона состоит из 18 протонов и 22 нейтронов. Аргон относится к элементам p-семейства.
Радиус атома аргона (вычисленный) составляет 71 пм.
Атомная масса атома аргона составляет 39,948(1) а. е. м.
Аргон – третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,292 % по массе. Аргон – самый распространённый инертный газ в земной атмосфере.
Аргон, свойства атома, химические и физические свойства
Изотопы и модификации аргона:
Свойства аргона (таблица): температура, плотность, давление и пр.
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Аргон |
| 102 | Прежнее название | |
| 103 | Латинское название | Argon |
| 104 | Английское название | Argon |
| 105 | Символ | Ar |
| 106 | Атомный номер (номер в таблице) | 18 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| 110 | Год открытия | 1894 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| 119 | Содержание в земной коре (по массе) | 0,00015 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000045 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,02 % |
| 122 | Содержание в Солнце (по массе) | 0,007 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| 203 | Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 71 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус* | 106 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 188 пм |
| 209 | Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 4,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| 305 | Электродный потенциал | 0 |
| 306 | Энергия сродства атома к электрону | -96(20) кДж/моль (-1,0(2) эВ) – предположительно |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001784 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,3954 г/см3 (при температуре кипения -185,848 °C и иных 1,65 г/см3 (при -233 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -189,34 °C (83,81 K, -308,81 °F) |
| 403 | Температура кипения* | -185,848 °C (87,302 K, -302,526 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,18 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,53 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 20,85 Дж/(K·моль) |
| 411 | Молярный объём | 22,392 см³/моль |
| 412 | Теплопроводность | 17,72·10-3 Вт/(м·К) (при стандартных условиях), 0,0164 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 5,260 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 85 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-37-1 |
Примечание:
206* Ковалентный радиус аргона согласно [1] составляет 106±10 пм.
401* Плотность аргона согласно [3] и [4] [Россия] составляет 0,0017839 г/см3 (при 0 °C /20 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления аргона согласно [3] и [4] составляет -189,35 °C (83,8 K, -308,83 °F) и -189,6 °C (83,55 K, -309,28 °F) соответственно.
403* Температура кипения аргона согласно [3] и [4] составляет -185,85 °C (87,3 K, -302,53 °F) и -185,9 °C (87,25 K, -302,62 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) аргона согласно [3] и [4] составляет 7,05 кДж/моль и 1,19 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) аргона согласно [3] и [4] составляет 6,45 кДж/моль и 6,51 кДж/моль соответственно.
410* Молярная теплоемкость аргона [3] составляет 20,79 Дж/(K·моль).
Физические свойства аргона:
Химические свойства аргона. Взаимодействие аргона. Реакции с аргоном:
Получение аргона:
Применение аргона:
- аргоновый лазер
Таблица химических элементов Д. И. Менделеева
И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34.
 Селен
Селен - 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67.
 Гольмий
Гольмий - 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100.
 Фермий
Фермий - 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Argon
- https://de.wikipedia.org/wiki/Argon
- https://ru.wikipedia.org/wiki/Аргон
- http://chemister.ru/Database/properties.php?dbid=1&id=228
- https://chemicalstudy.ru/argon/
Примечание: © Фото https://www.pexels. com, https://pixabay.com
com, https://pixabay.com
аргон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле аргона
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 711
Аргон Модель Бора — схема, этапы рисования
Аргон — элемент 18-й группы с атомным номером 18. Он обозначается символом Ar и является благородным газом. Это также третий по распространенности газ в атмосфере Земли. В воздухе содержится около 1,288% по массе аргона, который можно выделить с помощью фракционной перегонки.
В воздухе содержится около 1,288% по массе аргона, который можно выделить с помощью фракционной перегонки.
Служит основным источником аргона для промышленности. Аргон в основном используется в отраслях, где требуется инертная атмосфера, например, при получении титана.
В этой статье мы изучим диаграмму Бора аргона с пошаговым обсуждением.
Бор Модель аргона
Модель атома Резерфорда, предложенная в 1911 году, не могла объяснить стабильность электронов при движении вокруг ядра.
В соответствии с классической механикой и электромагнитной теорией такие частицы не могли бы оставаться стабильными и теряли бы энергию.
Ниль Бор модифицировал эту модель и представил импровизированную модель атома Бора-Резерфорда в 1913. В этой модели он постулировал, что каждый электрон движется по заранее определенной орбите, имеющей фиксированный размер и энергию.
Модель атома Бора определяет атомную структуру элементов посредством графического представления, иллюстрирующего все атомные частицы, а именно.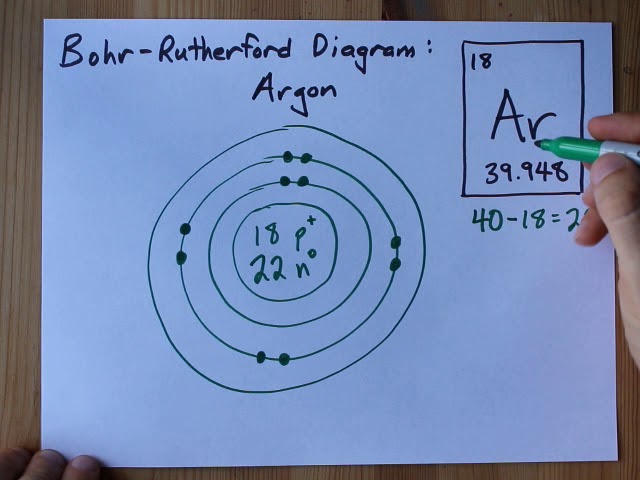 электроны, протоны и нейтроны.
электроны, протоны и нейтроны.
Прежде чем мы углубимся в модель атома Бора, мы должны сначала понять несколько важных терминов, связанных с этой моделью, используемых при описании структуры атома.
• Ядро: Центр или ядро атома, состоящее из нейтронов и протонов. Положительный заряд он получает благодаря положительно заряженным протонам.
• Протоны: Это положительно заряженные частицы, присутствующие в ядре атома и обозначаемые символом p + .
• Нейтроны: Это нейтральные сущности, присутствующие внутри ядра атома и ответственные за большинство физических свойств атомов. Они обозначаются символом n°.
• Электроны: Отрицательно заряженные объекты, движущиеся по фиксированным круговым траекториям вокруг ядра атома. Они обозначаются символом e – .
Положение электрона относительно ядра зависит от энергии электрона.
• Оболочки: Пути, пройденные электронами вокруг ядра, называются оболочками или орбитами. Только фиксированное количество электронов может следовать по определенной орбите из-за разницы в их энергии и способности оболочки вмещать электроны.
Только фиксированное количество электронов может следовать по определенной орбите из-за разницы в их энергии и способности оболочки вмещать электроны.
В модели атома Бора оболочки обозначаются как K, L, M, N и т. д. или 1, 2, 3, 4 и т. д. Это число увеличивается по мере удаления от ядра. Энергия электронов также увеличивается с увеличением числа оболочек. Вот почему оболочки также известны как энергетические уровни.
Поэтому говорят, что электроны, находящиеся в К-оболочке, т.е. ближайшей к ядру, находятся в основном состоянии и несут минимальную энергию.
Электроны, расположенные во внешней оболочке, несут максимальную энергию, их также называют валентными электронами. Эти электроны ответственны за образование связей.
Электронам также позволено прыгать с более низкого уровня на более высокий по мере того, как они приобретают энергию, или падать с более высокого на более низкий энергетический уровень по мере того, как они теряют свою энергию.
Атом аргона содержит 22 нейтрона, 18 протонов и 18 электронов. Электроны вращаются вокруг ядра в оболочках K, L и M.
| Атом аргона | Значение |
| № протона | 18 |
| № нейтрона | 22 |
| Номер Электрона | 18 |
| Количество снарядов | 3 |
| Количество электронов на первой (К) оболочке | 2 |
| Количество электронов во второй (L) оболочке | 8 |
| Количество электронов в третьей (М) оболочке | 8 |
| Количество валентных электронов | 8 |
Чертеж модели аргона Бора
Аргон – благородный газ, расположенный в 18-й группе периодической таблицы:
Информация, которую мы можем получить из вышеупомянутого ящика аргона, выглядит следующим образом:
• Атомный номер аргона 18.
• Электронная конфигурация хлора [Ne] 3s 2 3p 6 .
• Химический символ хлора — Ar.
• Атомная масса хлора 39.948.
Теперь, используя приведенную выше информацию, мы нарисуем атомную модель Бора для атома аргона.
Для этого нам сначала нужно подсчитать количество атомарных видов. Начнем с протонов.
Число протонов для любого атома всегда равно атомному номеру этого атома.
В случае атома аргона атомный номер равен 18.
Следовательно, для атома аргона число протонов = атомный номер = 18
Теперь мы посчитаем количество нейтронов в атоме аргона.
Формула для расчета количества нейтронов, присутствующих в атоме, приведена ниже:
Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Теперь, используя информации из ящика с аргоном мы знаем, что атомная масса аргона равна 39,948.
После округления до ближайшего целого числа получаем 40.
Кроме того, как подсчитано выше, количество протонов в атоме аргона равно 18.
Теперь, подставляя эти значения в вышеупомянутую формулу:
Число нейтронов = 40 – 18 = 22
количество нейтронов в атоме аргона = 22
Поскольку протоны и нейтроны составляют ядро атома, используя приведенные выше значения, мы теперь можем нарисовать ядро атома аргона. Это выглядит следующим образом:
На этой диаграмме p + представляет протоны, а n° представляет собой нейтроны.
Теперь, переходя к добавлению оболочек к ядру аргона, мы посчитаем количество электронов.
Для любого атома число электронов всегда равно атомному номеру этого атома.
Следовательно, в случае атомов аргона
Количество электронов = Атомный номер аргона = 18
размещается в каждой оболочке. Как обсуждалось ранее, только ограниченное число электронов может быть размещено в определенной оболочке.
Как обсуждалось ранее, только ограниченное число электронов может быть размещено в определенной оболочке.
Максимальное количество электронов, которое может быть размещено в конкретной оболочке, равно 2n 2 , где n означает количество оболочек.
Теперь, применяя эту формулу для атома аргона, посчитаем количество электронов для каждой оболочки отдельно.
Для К-оболочки атома аргона максимальное число электронов = 2 (1) 2 = 2
После добавления этих двух электронов к первой оболочке атом выглядит следующим образом:
После этого электроны должны быть добавлены к L-оболочке атома аргона.
Подсчитаем количество электронов, которое может разместиться на L-оболочке.
Максимальное количество электронов для L-оболочки атома аргона = 2 (2) 2 = 8
Следовательно, L-оболочка способна вместить 8 электронов.
Важным моментом, который следует отметить на этом этапе, является то, что для K-оболочки есть только два электрона, которые расположены близко друг к другу. Однако, начиная с L-оболочки и далее, по мере увеличения числа электронов схема расположения меняется.
Однако, начиная с L-оболочки и далее, по мере увеличения числа электронов схема расположения меняется.
Теперь электроны выстроены в группу по четыре по часовой стрелке. Первые четыре электрона расположены под углом 90° друг к другу. Этот угол продолжает уменьшаться по мере увеличения числа электронов.
Таким образом, первые четыре электрона в L-оболочке атома аргона расположены следующим образом:
Оставшиеся четыре электрона теперь добавляются к L-оболочке, опять же по часовой стрелке.
После этого атом аргона теперь представлен как:
Теперь у нас осталось еще 8 электронов, которые будут размещены в М-оболочке.
Поэтому рассчитаем количество электронов, которое может разместиться в М-оболочке.
Максимальное число электронов для М-оболочки атома аргона = 2 (3) 2 = 18
Таким образом, всего в М-оболочке может находиться 18 электронов.
Поскольку у атома аргона осталось всего 8 электронов, мы можем разместить их все в М-оболочке.
Первые четыре электрона снова будут добавляться по часовой стрелке.
Наконец, после добавления всех восьми электронов к М-оболочке мы получаем боровскую модель атома аргона, как показано ниже.
Следовательно, окончательная Боровская модель атома аргона состоит из 18 протонов и 22 нейтронов внутри ядра и 18 электронов, вращающихся вокруг ядра.
На K-оболочке имеется 2 электрона, на L-оболочке 8 электронов и на M-оболочке 8 электронов.
Получение структуры Льюиса аргона из модели Бора
Структура Льюиса или структура электронных точек представляет собой иллюстрацию атома элемента вместе с его валентными электронами. Ядро представлено атомным символом элемента, а электроны представлены точками.
Как обсуждалось выше, атом аргона состоит из 8 электронов на своей валентной оболочке, т.е. М-оболочке. Поэтому структура Льюиса аргона представляется следующим образом:
Свойства аргона
Ниже перечислены несколько важных свойств аргона:
• Он был открыт сэром Рамзи в 1894 году.
• Это бесцветный газ, который кажется фиолетовым под действием электрического поля. .
• Температуры плавления и кипения аргона составляют –185,848 °C и –189,34 °C соответственно.
• Плотность аргона составляет 1,78,10 -3 г.см -3 при 0 °C.
• Растворимость аргона в воде аналогична азоту и в 2,5 раза больше, чем у азота.
Ниже прикреплено видео для боровской модели Аргона.
Related Topics
Silicon Bohr Model
Boron Bohr Model
Sodium Bohr Model
Chlorine Bohr Model
Conclusion
As per the Bohr model of an atom, the argon atom consists of 18 protons and 22 нейтрона в ядре, а 18 электронов вращаются вокруг ядра.
Количество протонов, как и количество электронов в атоме, всегда равно атомному номеру этого атома.
Количество нейтронов определяется по формуле:
Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Дано максимальное количество электронов, которые могут быть размещены в оболочке по формуле 2n 2 , где n — количество оболочек.
Атом аргона состоит из трех оболочек, а именно. Оболочки K, L и M имеют 2, 8 и 8 электронов соответственно.
Удачи!!
Argon Bohr Model – Как нарисовать диаграмму Бора для атома аргона (Ar)
Главная > Аргон Модель Бора
Модель Бора Аргона (Ar) имеет ядро, содержащее 22 нейтрона и 18 протонов. Это ядро окружено трехэлектронными оболочками, называемыми K-оболочкой, L-оболочкой и М-оболочкой. Самая внешняя оболочка на диаграмме Бора аргона содержит 8 электронов, которые также называются валентными электронами.
| Наименование | Аргон Бор Модель |
| Номер of neutrons | 22 |
| Number of protons | 18 |
| Number of electrons | 18 |
| Total electron shells | 3 |
| Электрон на первой оболочке (К) | 2 |
| Электрон на второй оболочке (L) | 8 |
| Electrons in the Third shell(M) | 8 |
| Total valence electrons in Argon | 8 |
Bohr model describes the visual представление электронов, вращающихся вокруг малого ядра.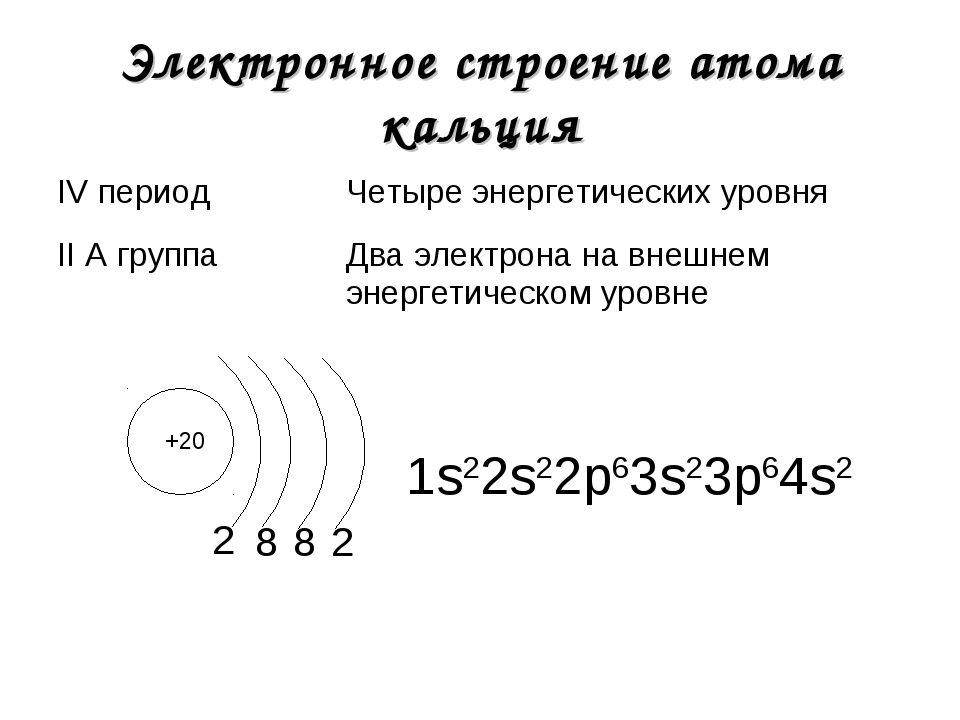 В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. Эти оболочки содержат определенное количество электронов, электронная оболочка, ближайшая к ядру, имеет меньшую энергию, а электронная оболочка, наиболее удаленная от ядра, имеет большую энергию.
В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. Эти оболочки содержат определенное количество электронов, электронная оболочка, ближайшая к ядру, имеет меньшую энергию, а электронная оболочка, наиболее удаленная от ядра, имеет большую энергию.
Диаграмма Бора очень интересна и легко рисуется. Здесь мы нарисуем диаграмму Бора атома аргона с помощью нескольких простых шагов.
Этапы рисования Боровской модели атома аргона 1. Найдите количество протонов, электронов и нейтронов в атоме аргона входят в состав ядер атомов. Электроны — это отрицательно заряженные частицы, вращающиеся вокруг ядра атома 9.0003 Чтобы узнать количество протонов, содержащихся в атоме, просто посмотрите на его атомный номер. Если атомный номер атома 31, то и протон будет 31, если атомный номер 33, то и протон будет 33. Итак, атомный номер аргона 18, следовательно протонов в атоме аргона тоже 18. Теперь, чтобы определить количество нейтронов в атоме, используйте эту формулу. ⇒ Количество нейтронов в атоме 9.0022 = Атомная масса атома (округленная до ближайшего целого числа) – Количество протонов в атоме Например, атом имеет 33,977 атомной массы и 20 протонов. Затем, чтобы найти число нейтронов, округлите атомную массу почти до целого числа, таким образом, атомная масса 33,977 округлите до 34. = (34 – 20 протонов) = 14 количество нейтронов в атоме Теперь . Чтобы получить число нейтронов в атоме аргона , посмотрите на его атомную массу, которая равна 39. ∴ Отсюда число нейтронов в атоме аргона = (40 – 18) = 22 Следует отметить, что «Количество электронов в нейтральном атоме равно числу протонов». Итак, атом аргона нейтрален, следовательно, число его электронов будет равно числу протонов, которое равно 18 , как мы уже обсуждали. ⇒ Количество электронов в атоме аргона = 18 ⇒ Количество протонов в атоме аргона = 18 ⇒ Количество нейтронов в атоме аргона = 22 Читаем подробно – Как найти количество протонов, электронов, нейтронов? 2. Нарисуйте ядро атома Ядро представляет собой плотную и маленькую область, содержащую количество протонов и нейтронов атома. На этом шаге мы должны нарисовать маленький кружок, состоящий из числа протонов и числа нейтронов атома аргона. 3. Нарисуйте первую электронную оболочку «Электронную оболочку можно представить как орбиту, по которой следуют электроны вокруг ядра атома». Первую электронную оболочку также называют К-оболочкой, это ближайшая к ядру атома оболочка, которая может содержать максимум два электрона. Как мы знаем, атом аргона имеет всего 18 электронов. Мы успешно нарисовали первую оболочку атома аргона, которая может содержать 2 электрона. Так как атом аргона имеет всего 18 электронов, то из 18 электронов мы использовали два электрона на первой оболочке. ∴ (18 – 2) = 16 электронов Следовательно, у нас осталось 16 электронов, поместим их в следующие оболочки атома аргона. 4. Нарисуйте вторую электронную оболочку Вторая оболочка, также называемая L-оболочкой, может содержать максимум 8 электронов. Эта оболочка рисуется после первой электронной оболочки. Во второй электронной оболочке электроны добавляются по одному, начиная с верхнего положения и затем двигаясь по часовой стрелке. Во второй оболочке электроны добавляются по одному по часовой стрелке в положении часов – 12 часов, 3 часа, 6 часов, 9 часов. После того, как вы разместите электроны по одному на каждой из четырех сторон (сверху – справа – снизу – слева), начните спаривать или удваивать их. Итак, у нас осталось 16 электронов атома аргона, а 2-я оболочка может удерживать максимум 8 электронов. Таким образом, поместите 8 электронов атома аргона во 2-ю электронную оболочку, начните с верхней позиции, размещайте электроны по одному и двигайтесь по часовой стрелке (сверху – справа – снизу – слева). И, наконец, соедините их. Поскольку у нас всего 18 электронов для атома аргона, и мы разместили 2 электрона на первой оболочке и 8 электронов на второй оболочке, следовательно, у нас осталось еще 8 электронов. Поместим его в следующую оболочку. 5. Нарисуйте третью электронную оболочку Третья оболочка также называется М-оболочкой и способна удерживать до 18 электронов, но для элементов первых нескольких периодов третья оболочка удерживает только до 8 электронов. «Можно считать, что третья оболочка содержит 8 или 18 электронов, но всего третья оболочка может содержать 18 электронов». Для первых нескольких элементов, скажем, до атомного номера 20 в периодической таблице, третья оболочка содержит до 8 электронов. ⇒ Для атомного номера 20 или меньше 20 третья оболочка может содержать максимум 8 электронов. ⇒ Для атомных номеров более 20, скажем, атомные номера 21, 22, 23, 24, 25, 26, 27 и т. д., третья оболочка заполнена более чем 8 электронами и до максимума 18 электронов. Для атома аргона третья оболочка заполняется так же, как и вторая оболочка. Итак, у нас осталось 8 электронов атома аргона, поэтому начнем с верхнего положения, ставим электроны по одному и идем по часовой стрелке (сверху – справа – снизу – слева). И, наконец, начать сопряжение. Вот и все, это наша Боровская модель атома аргона , которая содержит 18 протонов и 22 нейтрона в области ядра, и 18 электронов вращаются вокруг ядра, два электрона на первой оболочке, восемь электронов на второй оболочке и восемь электронов на третьей оболочке. Читайте также:- Также проверьте: Модель Бора для каждого элемента Периодической таблицы Валентные электроны находятся во внешней оболочке атома и могут принимать участие в образовании химической связи. Из диаграммы Бора атома мы можем легко найти количество валентных электронов в атоме, взглянув на его внешнюю оболочку. Итак, нам нужно найти валентный электрон в атоме аргона, для этого смотрим на его боровскую диаграмму. Диаграмма Бора Аргона имеет три электронных оболочки (K, L и M), внутренняя оболочка — это K-оболочка, а самая внешняя оболочка — это M-оболочка. Следовательно, электроны, обнаруженные в М-оболочке атома аргона, являются его валентными электронами, поскольку это самая внешняя оболочка, также называемая валентной оболочкой. М-оболочка или внешняя оболочка модели аргона Бора содержит 8 электронов, поэтому число валентных электронов в атоме аргона также равно 8. Электронная точечная диаграмма, также называемая структурой Льюиса, которая представляет валентные электроны атомов. Как мы узнали из диаграммы Бора аргона, у него 8 валентных электронов. Итак, просто представьте 8 валентных электронов вокруг атома аргона в виде точки. « Электронная конфигурация — это распределение электронов атома или молекулы по атомным или молекулярным орбиталям» Аргон имеет атомный номер 18 и содержит 18 электронов. Из боровской модели аргона мы знаем, что 2 электрона находятся на К-оболочке, 8 электронов — на L-оболочке и 8 электронов — на М-оболочке. Итак, исходя из оболочки, электронная конфигурация атома аргона [2, 8, 8]. Или электронная конфигурация Argon: 1s 2 2s 2 2p 6 3s 2 3p 6 , так как он содержит всего 18 электронов. Читайте также:- Электронные оболочки, также называемые энергетическими уровнями. Элементы или атомы первого периода таблицы Менделеева имеют один энергетический уровень или одну электронную оболочку, так же как элементы второго периода имеют два энергетических уровня или двухэлектронную оболочку и так далее… Итак, атом аргона относится к 3-му периоду периодической таблицы , следовательно, число электронных оболочек для боровской модели аргона будет равно 3 (К-оболочка, L-оболочка и М-оболочка). Самая внешняя оболочка, также называемая валентной оболочкой, содержит валентные электроны атома. Согласно диаграмме Бора Аргона, внешняя оболочка представляет собой М-оболочку, содержащую восемь валентных электронов.

 Итак, поместите два электрона из него, в первую оболочку, рядом друг с другом.
Итак, поместите два электрона из него, в первую оболочку, рядом друг с другом.

Найдите валентный электрон аргона по его диаграмме Бора 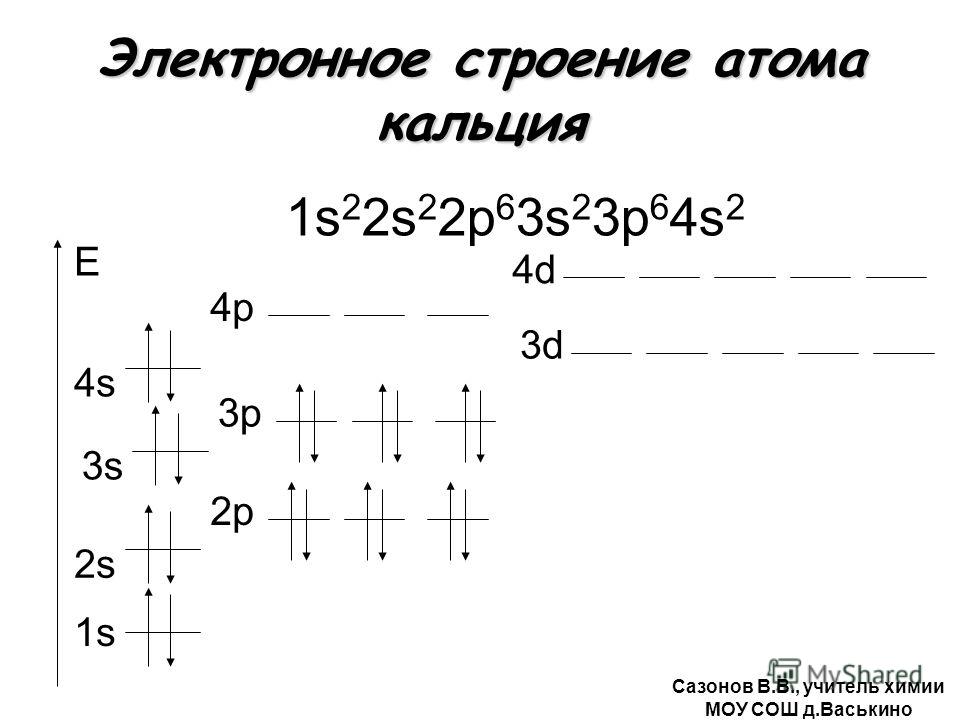 Эти электроны имеют большую энергию по сравнению с электронами внутренней оболочки.
Эти электроны имеют большую энергию по сравнению с электронами внутренней оболочки.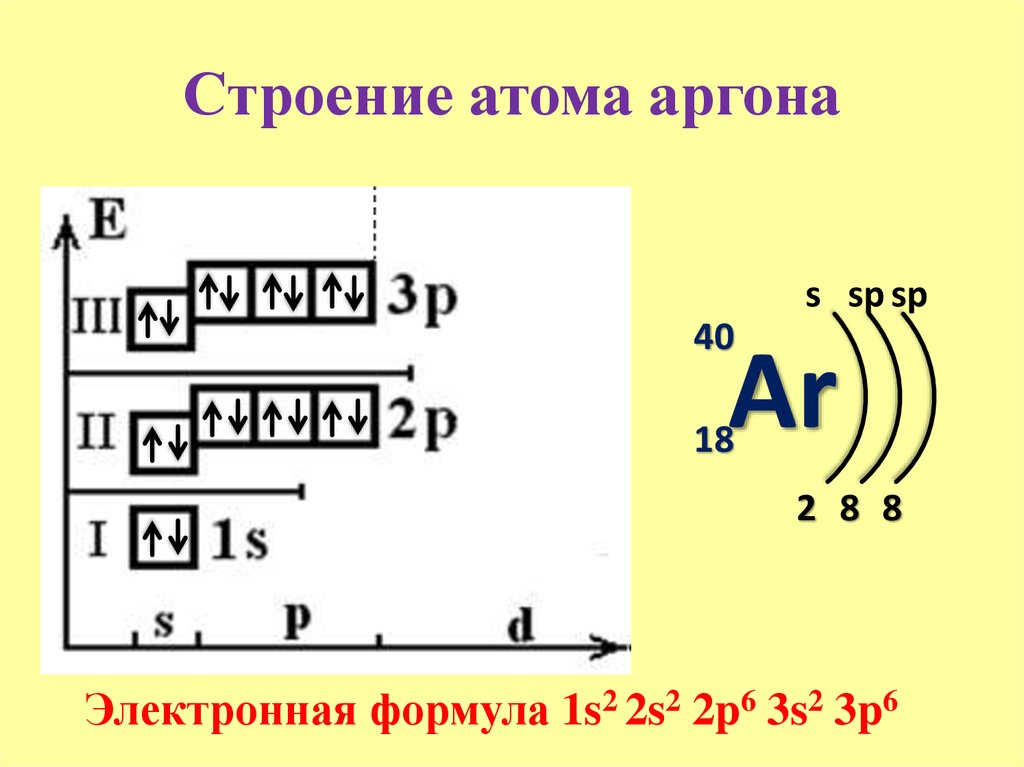
Часто задаваемые вопросы Сколько электронных оболочек содержит модель Argon Bohr?  Вы можете найти количество электронных оболочек элемента, зная его номер периода в периодической таблице.
Вы можете найти количество электронных оболочек элемента, зная его номер периода в периодической таблице.
Свойства аргона Какова внешняя оболочка диаграммы Бора атома аргона? 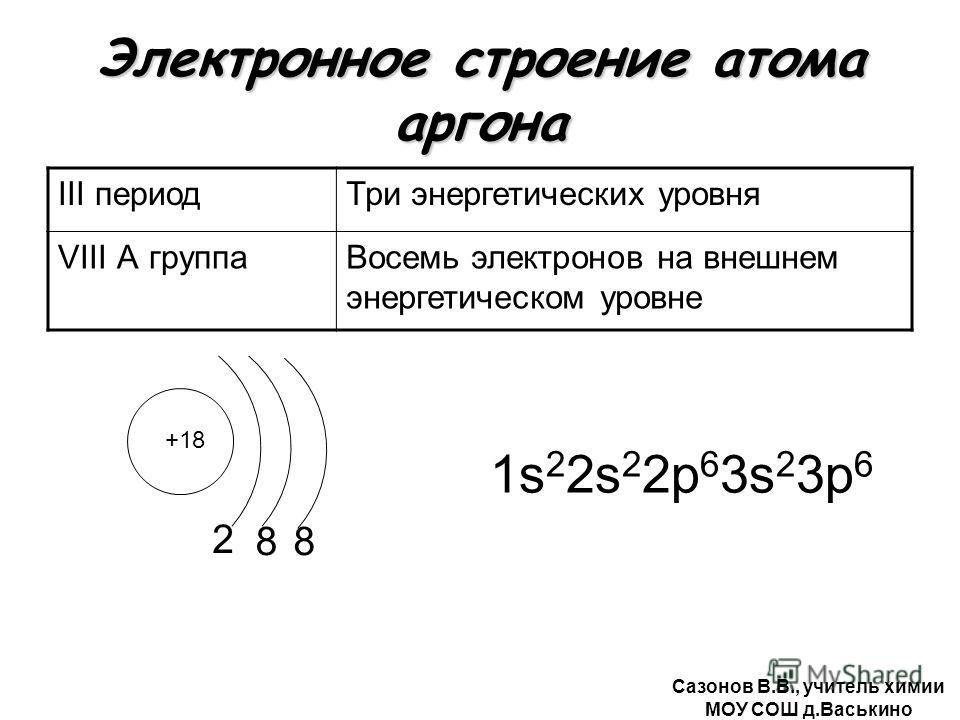

 Селен
Селен Гольмий
Гольмий Фермий
Фермий