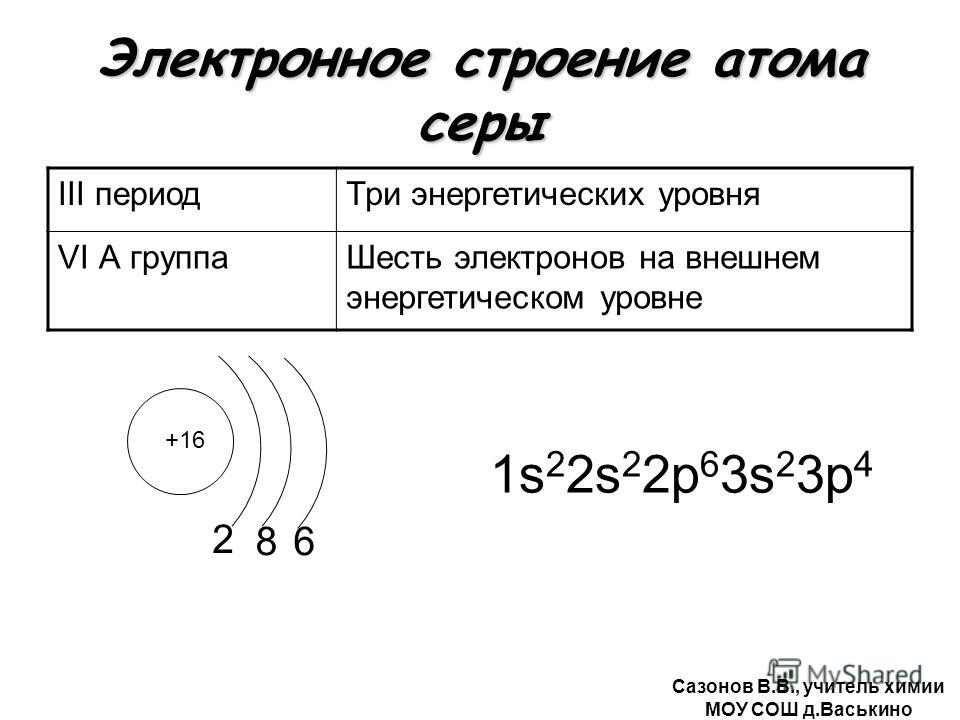
Строение атома циркония (Zr), схема и примеры
Общие сведения о строении атома циркония
Относится к элементам d-семейства. Металл. Обозначение – Zr. Порядковый номер – 40. Относительная атомная масса – 91,22 а.е.м.
Электронное строение атома циркония
Атом циркония состоит из положительно заряженного ядра (+40), внутри которого есть 40 протонов и 51 нейтрона, а вокруг, по пяти орбитам движутся 40 электронов.
Рис.1. Схематическое строение атома циркония.
Распределение электронов по орбиталям выглядит следующим образом:
+40Zr)2)8)18)10)2;
1s22s22p63s23p63d104s24p64d25s2.
Внешний энергетический уровень атома циркония содержит 4 электрона, которые являются валентными.
Валентные электроны атома циркония можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
d |
4 |
2 |
-2 |
+1/2 |
|
d |
4 |
2 |
-1 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома.
 Электронные формулы атомов элементов
Электронные формулы атомов элементов
Задание 27.
Какие орбитали атома заполняются электронами раньше 4d или 5s; 6s или 5р? Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2  1 + 1) = 6], на d-подуровне – [2 (2 . 2 + 1) = 10], на f-подуровне – [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов
1 + 1) = 6], на d-подуровне – [2 (2 . 2 + 1) = 10], на f-подуровне – [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов
→6d→7p.
Так как на 4d-подуровне сумма n + l равна 6 (4 + 2 = 6), на 5s-подуровне – 5 (5 + 0 = 5), то сначала будет заполняться 5s-подуровень, где сумма чисел n + l наименьшая. На 6s-подуровне сумма n + l равна 6 (6 + 0 = 6), на 5р-подуровне – 6 (5 + 1 = 6), то, согласно правилу Клечковского, сначала будет заполняться 5р-подуровень, где главное квантовое число имеет меньшее значение (второе правило Клечковского).
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элемента 43 (технеция) электронная формула будут иметь вид:
+43Тс 1s22s22p63s23p63d104s24p64d55s2.
Задание 30.
Напишите электронные формулы атомов элементов с порядковыми но-мерами 14 и 40. Сколько свободных 3d-орбиталей у атомов последнего элемента?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами  Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне – [2 (2
Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне – [2 (2
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→
→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 14 (кремния) и 40 (циркония) электронные формулы будут иметь вид:
+14Si 1s22s22p63s2
Цирконий на 4d-подуровне содержит два электрона каждый из которых занимает по одной АО (правило Хунда), то свободными остаются три 4d-орбитали:
Задание 32.
Напишите электронные формулы атомов элементов с порядковыми но-мерами 15 и 28. Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне – [2 (2 .
 2 + 1) = 10], на f-подуровне – [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
2 + 1) = 10], на f-подуровне – [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→
→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 15 (фосфора) и 28 (никеля) электронные формулы будут иметь вид:
+15Р 1s22s22p63s23p3; +28Ni 1s22s22p63s23p63d84s2
Спин электрона возникает за счёт вращения его вокруг собственной оси. У атома фосфора на внешнем энергетическом уровне на 3р-подуровне находятся три неспаренных электрона, на каждой р-орбитали по одному, поэтому максимальный спин р-электронов будет равен сумме спинов каждого из трёх электронов: (+1/2) + (+1/2) + (+1/2) = +1,5. Графическая схема 3р-подуровня:
Максимальный спин d-электронов у атома никеля равен +1, так как у атома никеля на 3d-подуровне имеется шесть спаренных и два неспаренных электрона, которые имеют спи-ны +1/2, что в сумме даёт +1 [(+1/2) + (+1/2) = +1] (принцип Паули).
Задание 33.
Напишите электронные формулы атомов элементов с порядковыми но-мерами 21 и 23. Сколько свободных 3d-орбиталей в атомах этих элементов?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 . 1 + 1) = 6], на d-подуровне – [2 (2 . 2 + 1) = 10], на f-подуровне – [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
2 + 1) = 10], на f-подуровне – [2 (2 . 3 + 1) = 14]. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), х – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→
→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 21 (скандий) и 23 (ванадий) электронные формулы будут иметь вид:
+21Sс 1s22s22p63s23p63d14s2; +23V 1s22s22p63s23p63d34s2
Скандий на 3d-подуровне содержит один электрон, который занимает одну АО (правило Хунда), то свободными остаются четыре 3d-орбитали:
Ванадий на 3d-подуровне содержит три электрона каждый из которых занимает по одной АО (правило Хунда), то свободными остаются две 3d-орбитали:
Наука: Наука и техника: Lenta.ru
Шведские ученые пришли к выводу, что во время аварии на Чернобыльской АЭС произошел слабый ядерный взрыв. Специалисты проанализировали самый вероятный ход ядерных реакций в реакторе и смоделировали метеорологические условия распространения продуктов распада. «Лента.ру» рассказывает о статье исследователей, опубликованной в журнале Nuclear Technology.
«Лента.ру» рассказывает о статье исследователей, опубликованной в журнале Nuclear Technology.
Авария на Чернобыльской АЭС произошла 26 апреля 1986 года. Катастрофа поставила под угрозу развитие ядерной энергетики во всем мире. Вокруг станции была создана 30-километровая зона отчуждения. Радиоактивные осадки выпадали даже в Ленинградской области, а изотопы цезия обнаруживали в повышенных концентрациях в лишайнике и мясе оленей в арктических областях России.
Материалы по теме
00:02 — 26 мая 2017
Существуют различные версии причин катастрофы. Чаще всего указывают на неправильные действия персонала ЧАЭС, повлекшие за собой возгорание водорода и разрушение реактора. Однако некоторые ученые полагают, что произошел настоящий ядерный взрыв.
В атомном реакторе поддерживается цепная ядерная реакция. Ядро тяжелого атома, например, урана, сталкивается с нейтроном, становится нестабильным и распадается на два более мелких ядра — продукты распада. В процессе деления выделяется энергия и два-три быстрых свободных нейтрона, которые в свою очередь вызывают распад других ядер урана в ядерном топливе. Количество распадов, таким образом, увеличивается в геометрической прогрессии, однако цепная реакция внутри реактора находится под контролем, что предотвращает ядерный взрыв.
Количество распадов, таким образом, увеличивается в геометрической прогрессии, однако цепная реакция внутри реактора находится под контролем, что предотвращает ядерный взрыв.
В тепловых ядерных реакторах быстрые нейтроны не годятся для возбуждения тяжелых атомов, поэтому их кинетическую энергию уменьшают с помощью замедлителя. Медленные нейтроны, именуемые тепловыми, с большей вероятностью вызывают распад атомов урана-235, используемого в качестве топлива. В таких случаях говорят о высоком сечении взаимодействия ядер урана с нейтронами. Сами тепловые нейтроны называются так, поскольку находятся в термодинамическом равновесии с окружающей средой.
Сердцем Чернобыльской АЭС был реактор РБМК-1000 (реактор большой мощности канальный мощностью 1000 мегаватт). По сути, это графитовый цилиндр с множеством отверстий (каналов). Графит выполняет роль замедлителя, а через технологические каналы загружается ядерное топливо в тепловыделяющих элементах (ТВЭЛах). ТВЭЛы сделаны из циркония, металла с очень маленьким сечением захвата нейтронов. Они пропускают нейтроны и тепло, которое нагревает теплоноситель, препятствуя утечке продуктов распада. ТВЭЛы могут объединяться в тепловыделяющие сборки (ТВС). Тепловыделяющие элементы характерны для гетерогенных ядерных реакторов, в которых замедлитель отделен от горючего.
Они пропускают нейтроны и тепло, которое нагревает теплоноситель, препятствуя утечке продуктов распада. ТВЭЛы могут объединяться в тепловыделяющие сборки (ТВС). Тепловыделяющие элементы характерны для гетерогенных ядерных реакторов, в которых замедлитель отделен от горючего.
РБМК — одноконтурный реактор. В качестве теплоносителя используется вода, которая частично превращается в пар. Пароводяная смесь поступает в сепараторы, где пар отделяется от воды и направляется на турбогенераторы. Отработанный пар конденсируется и вновь поступает в реактор.
Крышка реактора РБМК
В конструкции РБМК имелся недостаток, сыгравший роковую роль в катастрофе на Чернобыльской АЭС. Дело в том, что расстояние между каналами было слишком большим и слишком много быстрых нейтронов тормозилось графитом, превращаясь в тепловые нейтроны. Они хорошо поглощаются водой, но там постоянно образуются пузырьки пара, что снижает абсорбционные характеристики теплоносителя. В результате повышается реактивность, вода еще сильнее нагревается. То есть РБМК отличается достаточно высоким паровым коэффициентом реактивности, что осложняет контроль за протеканием ядерной реакции. Реактор должен оснащаться дополнительными системами безопасности, работать на нем должен только высококвалифицированный персонал.
То есть РБМК отличается достаточно высоким паровым коэффициентом реактивности, что осложняет контроль за протеканием ядерной реакции. Реактор должен оснащаться дополнительными системами безопасности, работать на нем должен только высококвалифицированный персонал.
25 апреля 1986 года на Чернобыльской АЭС была запланирована остановка четвертого энергоблока для планового ремонта и проведения эксперимента. Специалисты научно-исследовательского института «Гидропроект» предложили способ аварийного электроснабжения насосов станции за счет кинетической энергии вращающегося по инерции турбогенератора. Это позволило бы даже при отключении электричества поддерживать циркуляцию теплоносителя в контуре до тех пор, пока не включится резервное питание.
Согласно плану, эксперимент должен был начаться, когда тепловая мощность реактора снизится до 700 мегаватт. Мощность успели понизить на 50 процентов (1600 мегаватт), и процесс остановки реактора был отложен примерно на девять часов по запросу из Киева. Как только снижение мощности возобновилось, она неожиданно упала почти до нуля из-за ошибочных действий персонала АЭС и ксенонового отравления реактора — накопления изотопа ксенона-135, снижающего реактивность. Чтобы справиться с внезапной проблемой, из РБМК были извлечены аварийные стержни, поглощающие нейтроны, однако мощность не поднялась выше 200 мегаватт. Несмотря на нестабильную работу реактора, в 01:23:04 начался эксперимент.
Как только снижение мощности возобновилось, она неожиданно упала почти до нуля из-за ошибочных действий персонала АЭС и ксенонового отравления реактора — накопления изотопа ксенона-135, снижающего реактивность. Чтобы справиться с внезапной проблемой, из РБМК были извлечены аварийные стержни, поглощающие нейтроны, однако мощность не поднялась выше 200 мегаватт. Несмотря на нестабильную работу реактора, в 01:23:04 начался эксперимент.
Схема реактора ЧАЭС
Ввод дополнительных насосов усилил нагрузку на выбегающий турбогенератор, что снизило объемы воды, поступающей в активную зону реактора. Вместе с высоким паровым коэффициентом реактивности это быстро увеличило мощность реактора. Попытка внедрения поглощающих стержней из-за их неудачной конструкции лишь усугубила ситуацию. Всего лишь через 43 секунды после начала эксперимента реактор разрушился в результате одного-двух мощных взрывов.
Очевидцы утверждают, что четвертый энергоблок АЭС был разрушен двумя взрывами: второй, самый мощный, случился через несколько секунд после первого. Считается, что аварийная ситуация возникла из-за разрыва труб в системе охлаждения, вызванного быстрым испарением воды. Вода или пар вступили в реакцию с цирконием в тепловыделяющих элементах, что привело к образованию большого количества водорода и его взрыву.
Считается, что аварийная ситуация возникла из-за разрыва труб в системе охлаждения, вызванного быстрым испарением воды. Вода или пар вступили в реакцию с цирконием в тепловыделяющих элементах, что привело к образованию большого количества водорода и его взрыву.
Шведские ученые полагают, что к взрывам, один из которых был ядерным, привели два различных механизма. Во-первых, высокий паровой коэффициент реактивности способствовал увеличению объема перегретого пара внутри реактора. В результате реактор лопнул, и его 2000-тонная верхняя крышка взлетела на несколько десятков метров. Поскольку к ней были прикреплены тепловыделяющие элементы, возникла первичная утечка ядерного топлива.
Разрушенный 4-й энергоблок ЧАЭС
Во-вторых, аварийное опускание поглощающих стержней привело к так называемому «концевому эффекту». На чернобыльском РБМК-1000 стержни состояли из двух частей — поглотителя нейтронов и графитового вытеснителя воды. При введении стержня в активную зону реактора графит замещает поглощающую нейтроны воду в нижней части каналов, что только усиливает паровой коэффициент реактивности. Число тепловых нейтронов увеличивается, и цепная реакция становится неконтролируемой. Происходит небольшой ядерный взрыв. Потоки продуктов ядерного деления еще до разрушения реактора проникли в зал, а затем — через тонкую крышу энергоблока — попали в атмосферу.
Число тепловых нейтронов увеличивается, и цепная реакция становится неконтролируемой. Происходит небольшой ядерный взрыв. Потоки продуктов ядерного деления еще до разрушения реактора проникли в зал, а затем — через тонкую крышу энергоблока — попали в атмосферу.
Впервые о ядерной природе взрыва специалисты заговорили еще в 1986 году. Тогда ученые из Радиевого института Хлопина провели анализ фракций благородных газов, полученных на череповецкой фабрике, где производились жидкий азот и кислород. Череповец находится в тысяче километров к северу от Чернобыля, и радиоактивное облако прошло над городом 29 апреля. Советские исследователи выявили, что соотношение активностей изотопов 133Xe и 133mXe равнялось 44,5 ± 5,5. Эти изотопы — короткоживущие продукты ядерного распада, что указывает на слабый ядерный взрыв.
Шведские ученые рассчитали, сколько ксенона образовалось в реакторе до взрыва, во время взрыва, и как менялись соотношения радиоактивных изотопов вплоть до их выпадения в Череповце. Оказалось, что наблюдавшееся на заводе соотношение реактивностей могло возникнуть в случае ядерного взрыва мощностью 75 тонн в тротиловом эквиваленте. Согласно анализу метеорологических условий на период 25 апреля — 5 мая 1986 года, изотопы ксенона поднялись на высоту до трех километров, что предотвратило его смешение с тем ксеноном, который образовался в реакторе еще до аварии.
Оказалось, что наблюдавшееся на заводе соотношение реактивностей могло возникнуть в случае ядерного взрыва мощностью 75 тонн в тротиловом эквиваленте. Согласно анализу метеорологических условий на период 25 апреля — 5 мая 1986 года, изотопы ксенона поднялись на высоту до трех километров, что предотвратило его смешение с тем ксеноном, который образовался в реакторе еще до аварии.
(PDF) Comparison of the complexes structure of zirconium compounds in solutions with the structure of sulfated zirconia nanoparticles
56
Таблица 8. Ключевые расстояния, полученные расчетами методом молекулярной
механики, для различных моделей строения комплексов.
Структура
Расстоя-
ние
Zr-Zr, Å
Расстоя-
ние
Zr-O, Å
Расстоя-
ние
Zr-O
(мости-
ковый),
Å
Расстоя-
ние
Zr-C1, Å
Расстоя-
ние
Zr-C2, Å
Расстоя-
ние
Zr-C1 (от
мостико-
вого О),
Å
Расстоя-
ние
Zr-C2(от
мостико-
вого О),
Å
6-ти коорд. мономер – 2.12 – 2.96 3.56 – –
мономер – 2.12 – 2.96 3.56 – –
8-ти коорд. мономер – 2.14 – 3.12 4.54 – –
6-ти коорд. димер,
одинарные мостики 3.64 2.13 2.14 2.96 4.42 3.01 3.97
6-ти коорд. димер,
двойные мостики 3.38 2.13 2.13 2.97 4.38 2.96 3.94
8-ти коорд. димер,
одинарные мостики 4.09 2.16 2.28 3.15 4.48 3.11 4.13
8-ти коорд. димер,
двойные мостики 3.59 2.15 2.17 3.12 4.51 3.09 4.12
6-ти коорд. тример,
одинарные мостики,
замкнутый
3.58
3.66
3.71
2.13 2.14 3.03 4.42 3.05 4.06
6-ти коорд. тример,
двойные мостики,
замкнутый
3.35
3.36
3.37
2.12 2.12
(3.50-4.00) 2.96 4.37 3.02
(4.50-5.00)
3.62
4.44
(5.50-6.00)
6-ти коорд. тример,
одинарные мостики,
разомкнутый
3.62
3.65
3.71
2.13 2.15 3.03 4.41 3.02 4.03
6-ти коорд. тример,
двойные мостики,
разомкнутый
3. 38
38
3.40
5.18
2.13 2.13 2.99 4.38 2.95
3.46
3.76
4.35
5.38
8-ти коорд. тример,
одинарные мостики,
замкнутый
3.97
4.05
4.13
2.16 2.23 3.21 4.53 3.04, 3.18 3.60, 4.42
8-ти коорд. тример,
двойные мостики,
замкнутый
3.54
3.57
3.64
2.16 2.17
(3.50-4.00)
3.12
3.17
3.25
4.51 3.02, 3.13 4.15, 4.50
8-ти коорд. тример,
одинарные мостики,
разомкнутый
4.18
4.35
7.02
2.16 (2.26), 2.37 3.16 4.53 (3.07), 3.17
3.99
4.07
4.17
4.33
8-ти коорд. тример,
двойные мостики,
разомкнутый
3.76
3.77
5.67
2.16 2.20
4.60-5.40 3.17 4.50 3.04, (4.20)
6.20-7.70
3.60
4.26
4.60
5.18
6-ти коорд. тетрамер,
одинарные мостики,
параллелограм
3. 76
76
(4.92, 5.40)
2.14
(3.33)
2.16
(3.85-5.25)
3.04
(3.06-7.00)
4.04, 4.42
(~5.00)
3.02
(4.30-6.30)
3.35, 4.51
(5.50-6.30)
6-ти коорд. тетрамер,
двойные мостики
параллелограм
3.43
(4.50, 5.12)
2.12
(3.44-5.20)
2.13
(4.20-6.00)
3.02
(4.80-6.20)
4.38
(5.50-7.00)
3.02
(4.70-5.50)
3.82, 4.31
(5.00-7.00)
6-ти коорд.тетрамер,
одинарные мостики,
пирамида
3.48, 3.64
3.59, 3.69
3.74, 3.74
2.14
(3.40-6.00)
2.14
(3.00-4.30)
3.07
(4.80-6.00)
4.42
(5.30-8.00)
2.96, 3.02, 3.12
(4.20-5.70)
3.85-4.35
(4.4-6.60)
6-ти коорд. тетрамер,
двойные мостики,
пирамида
3.36, 3.37,
3.37, 3.38,
3.39, 3.40
– 2.17, (2.32)
(3.00-4.60 ) – –
3. 18, 3.30, 3.40,
18, 3.30, 3.40,
(3.50)
(3.00-7.00)
3.30-5.20
(4.30-7.70)
8-ти коорд. тетрамер,
одинарные мостики,
параллелограм
4.28, 4.30,
4.34, 4.36,
5.71, 6.47
2.17
(3.30-7.70)
(2.32), 2.39
(4.10-5.80) x x x x
8-ти коорд. тетрамер,
двойные мостики,
параллелограм
3.73, 3.74,
3.76, 3.76,
5.23, 5.36
2.18
(4.00-6.70)
2.20
(3.90-5.20) x x x x
8-ти коорд. тетрамер,
одинарные мостики,
пирамида
3.91, 4.01,
4.04, 4.12,
4.14, 4.19
2.16, 2.20
(3.70-6.20)
2.24, 2.33
(~3.40) x x x x
8-ти коорд. тетрамер,
двойные мостики,
пирамида
3.43, 3.43,
3.49, 3.50,
3.52, 3.54
2.14
(4.20-5.60)
2.15, 2.20, 2.30
(3.40-4.40) x x x x
“х.хх, у.уу” – расстояния, представленные равноценными координационными числами;
WebElements Периодическая таблица »Цирконий» Свойства свободных атомов
Атомы циркония имеют 40 электронов, а структура оболочки – 2. 8.18.10.2.
8.18.10.2.
Электронная конфигурация основного состояния газообразного нейтрального циркония в основном состоянии равна [ Kr ]. 4д 2 . 5s 2 , а символ термина – это 3 F 2 .
Схематическая электронная конфигурация циркония.Оболочечная структура Косселя из циркония.Атомный спектр
Представление атомного спектра циркония.
Энергии ионизации и сродство к электрону
Электронное сродство циркония 41,1 кДж / моль ‑1 . Энергии ионизации циркония приведены ниже.
Энергии ионизации циркония.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff .Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 39,16 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 29,37 | 2 пол. | 35,99 | ||||
| 3с | 24,36 | 3 пол. | 23,85 | 3d | 25,57 | ||
| 4с | 14,90 | 4p | 13.46 | 4д | 13,07 | 4f | (нет данных) |
| 5с | 6,45 | 5p | (нет данных) | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди, В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.

Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 17998 [1] |
| L I | 2s | 2532 [1] |
| L II | 2p 1/2 | 2307 [1] |
| L III | 2p 3/2 | 2223 [1] |
| M I | 3s | 430.3 [3] |
| M II | 3p 1/2 | 343,5 [3] |
| M III | 3p 3/2 | 329,8 [3] |
| M IV | 3d 3/2 | 181,1 [3] |
| M V | 3d 5/2 | 178,8 [3] |
| N I | 4s | 50,6 [3] |
| N II | 4p 1/2 | 28.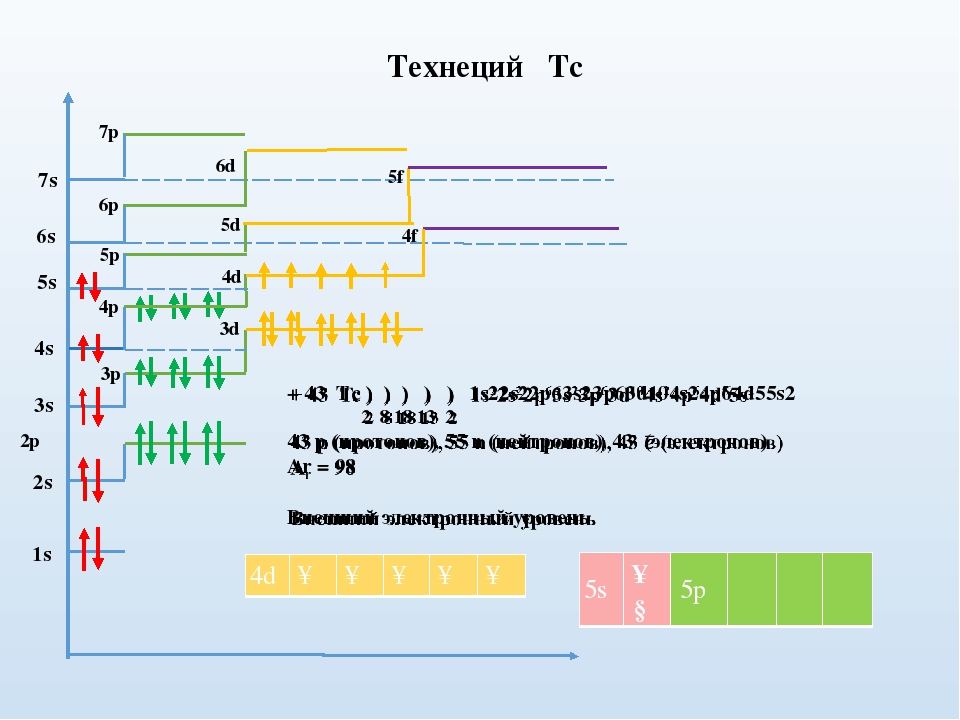 5 [3] 5 [3] |
| N III | 4p 3/2 | 27,1 [3] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev.Мод. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J.
 Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
| химический элемент | Britannica
Свойства, происхождение и использование
Цирконий, малоизвестный до конца 1940-х годов, стал важным инженерным материалом для ядерной энергетики, поскольку он очень прозрачен для нейтронов. Элемент был идентифицирован (1789) в цирконии ZrSiO 4 (ортосиликат циркония) из его оксида немецким химиком Мартином Генрихом Клапротом, а металл был выделен (1824) в нечистой форме шведским химиком Йенсом Якобом Берцелиусом.Нечистый металл, даже если он чист на 99 процентов, тверд и хрупок. Белый, мягкий, ковкий и пластичный металл повышенной чистоты впервые был произведен в больших количествах (1925 г.) голландскими химиками Антоном Э. ван Аркелем и Дж. де Бура термическим разложением тетраиодида циркония, ZrI 4 . В начале 1940-х Уильям Джастин Кролл из Люксембурга разработал свой более дешевый способ получения металла, основанный на восстановлении тетрахлорида циркония ZrCl 4 магнием. В начале 21 века ведущими производителями циркония были Австралия, Южная Африка, Китай и Индонезия; Мозамбик, Индия и Шри-Ланка были дополнительными производителями.
В начале 21 века ведущими производителями циркония были Австралия, Южная Африка, Китай и Индонезия; Мозамбик, Индия и Шри-Ланка были дополнительными производителями.
Британская викторина
Так много химии, так мало времени Quiz
Какой французский химик первым выделил кодеин? Кому приписывают открытие урана? Проверьте свои знания. Пройдите викторину.
Цирконий относительно широко присутствует в земной коре, но не в концентрированных отложениях, и обычно наблюдается у звезд S-типа.Минеральный циркон, который обычно находится в аллювиальных отложениях в руслах ручьев, океанских пляжах или старых озерах, является единственным коммерческим источником циркония. Бадделеит, который представляет собой по существу чистый диоксид циркония, ZrO 2 , является единственным другим важным минералом циркония, но коммерческий продукт дешевле извлекается из циркона. Цирконий производится тем же способом, что и титан. Эти минералы циркония обычно имеют содержание гафния, которое варьируется от нескольких десятых долей процента до нескольких процентов.Для некоторых целей разделение двух элементов не важно: цирконий, содержащий около 1 процента гафния, так же приемлем, как и чистый цирконий.
Цирконий производится тем же способом, что и титан. Эти минералы циркония обычно имеют содержание гафния, которое варьируется от нескольких десятых долей процента до нескольких процентов.Для некоторых целей разделение двух элементов не важно: цирконий, содержащий около 1 процента гафния, так же приемлем, как и чистый цирконий.
Цирконий наиболее часто используется в ядерных реакторах для покрытия топливных стержней, для легирования ураном и для конструкций активной зоны реактора из-за его уникального сочетания свойств. Цирконий обладает хорошей прочностью при повышенных температурах, устойчив к коррозии от быстро циркулирующих хладагентов, не образует высокорадиоактивных изотопов и выдерживает механические повреждения от бомбардировки нейтронами.Гафний, присутствующий во всех циркониевых рудах, должен быть тщательно удален из металла, предназначенного для использования в реакторах, поскольку гафний сильно поглощает тепловые нейтроны.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Подпишитесь сейчасРазделение гафния и циркония обычно осуществляется методом противоточной экстракции жидкость-жидкость. В этой методике неочищенный тетрахлорид циркония растворяют в водном растворе тиоцианата аммония, а метилизобутилкетон пропускают противотоком к водной смеси, в результате чего предпочтительно экстрагируется тетрахлорид гафния.
Атомные радиусы циркония и гафния составляют 1,45 и 1,44 Å соответственно, а радиусы ионов Zr 4+ 0,74 Å и Hf 4+ 0,75 Å. Фактическая идентичность атомных и ионных размеров, возникающая в результате сокращения лантаноидов, делает химическое поведение этих двух элементов более похожим, чем для любой другой пары известных элементов. Хотя химия гафния изучена меньше, чем циркония, они настолько похожи, что можно ожидать лишь очень небольших количественных различий – например, в растворимости и летучести соединений – в случаях, которые фактически не исследовались.
Цирконий поглощает кислород, азот и водород в удивительных количествах. При температуре около 800 ° C (1500 ° F) он химически соединяется с кислородом с образованием оксида ZrO 2 . Цирконий восстанавливает такие тугоплавкие материалы тигля, как оксиды магния, бериллия и тория. Это сильное сродство к кислороду и другим газам объясняет его использование в качестве геттера для удаления остаточных газов в электронных лампах. При нормальной температуре воздуха цирконий пассивен из-за образования защитной пленки из оксида или нитрида.Даже без этой пленки металл устойчив к действию слабых кислот и кислых солей. Лучше всего его растворять в плавиковой кислоте, при которой образование анионных фторокомплексов важно для стабилизации раствора. При нормальных температурах он не особенно реакционноспособен, но при повышенных температурах становится весьма реактивным с множеством неметаллов. Из-за своей высокой коррозионной стойкости цирконий нашел широкое применение в производстве насосов, клапанов и теплообменников.Цирконий также используется в качестве легирующего агента при производстве некоторых магниевых сплавов и в качестве добавки при производстве некоторых сталей.
При температуре около 800 ° C (1500 ° F) он химически соединяется с кислородом с образованием оксида ZrO 2 . Цирконий восстанавливает такие тугоплавкие материалы тигля, как оксиды магния, бериллия и тория. Это сильное сродство к кислороду и другим газам объясняет его использование в качестве геттера для удаления остаточных газов в электронных лампах. При нормальной температуре воздуха цирконий пассивен из-за образования защитной пленки из оксида или нитрида.Даже без этой пленки металл устойчив к действию слабых кислот и кислых солей. Лучше всего его растворять в плавиковой кислоте, при которой образование анионных фторокомплексов важно для стабилизации раствора. При нормальных температурах он не особенно реакционноспособен, но при повышенных температурах становится весьма реактивным с множеством неметаллов. Из-за своей высокой коррозионной стойкости цирконий нашел широкое применение в производстве насосов, клапанов и теплообменников.Цирконий также используется в качестве легирующего агента при производстве некоторых магниевых сплавов и в качестве добавки при производстве некоторых сталей.
Цирконий природный представляет собой смесь пяти стабильных изотопов: цирконий-90 (51,46 процента), цирконий-91 (11,23 процента), цирконий-92 (17,11 процента), цирконий-94 (17,40 процента), цирконий-96 (2,80 процента). . Существует два аллотропа: ниже 862 ° C (1584 ° F) гексагональная плотноупакованная структура, выше этой температуры объемно-центрированная кубическая.
Соединения
Цирконий преимущественно находится в степени окисления +4 в своих соединениях.Однако известны некоторые менее стабильные соединения со степенью окисления +3. (Наиболее важным аспектом, в котором цирконий отличается от титана, является то, что более низкие степени окисления имеют второстепенное значение.) Увеличенный размер атомов делает оксиды более основными, а химический состав воды несколько более обширным и позволяет достичь координационных чисел 7 и, довольно часто 8 в ряде соединений циркония.
Различные соединения циркония находят важное применение в промышленности.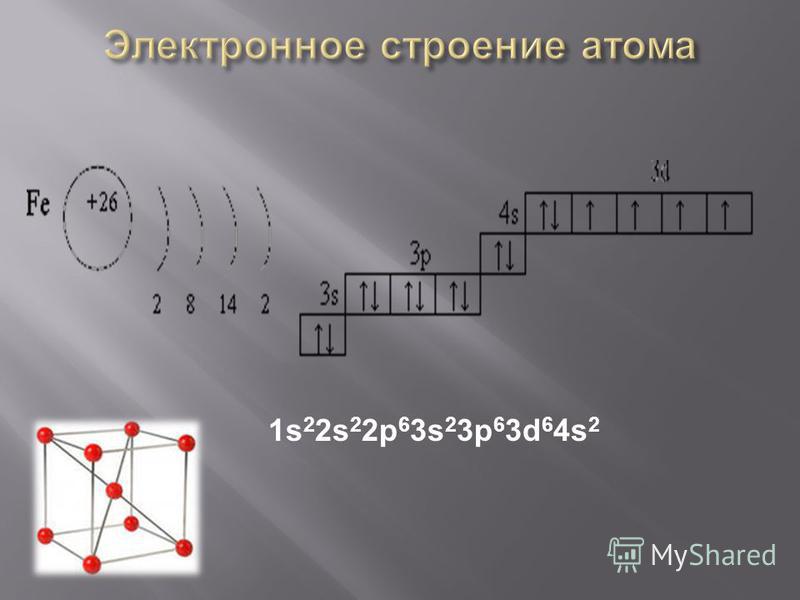 Среди них диоксид циркония (также называемый диоксидом циркония), ZrO 2 , твердое белое или желто-коричневое твердое вещество с высокой температурой плавления – около 2700 ° C (4892 ° F). Он обычно используется в качестве имитатора драгоценных камней, абразива, огнеупорного материала и компонента стойких к кислотам и щелочам стекол и керамики, используемых в топливных элементах.
Среди них диоксид циркония (также называемый диоксидом циркония), ZrO 2 , твердое белое или желто-коричневое твердое вещество с высокой температурой плавления – около 2700 ° C (4892 ° F). Он обычно используется в качестве имитатора драгоценных камней, абразива, огнеупорного материала и компонента стойких к кислотам и щелочам стекол и керамики, используемых в топливных элементах.
Другие важные промышленные соединения циркония включают тетрахлорид ZrCl 4 и сульфат Zr (SO 4 ) 2 ∙ 4H 2 O.Полученный хлорированием карбида или оксида циркония, тетрахлорид циркония используется для получения органических соединений циркония и в качестве катализатора в таких реакциях, как крекинг нефти и полимеризация этилена. Сульфат циркония, полученный действием серной кислоты на гидроксид циркония, Zr (OH) 4 , используется в качестве смазки, химического реагента и при дублении белой кожи.
Цирконий в электронной конфигурации (Zr) с орбитальной диаграммой
Изучите электронную конфигурацию циркония здесь, в статье, и сделайте следующий шаг, чтобы изучить еще один химический элемент.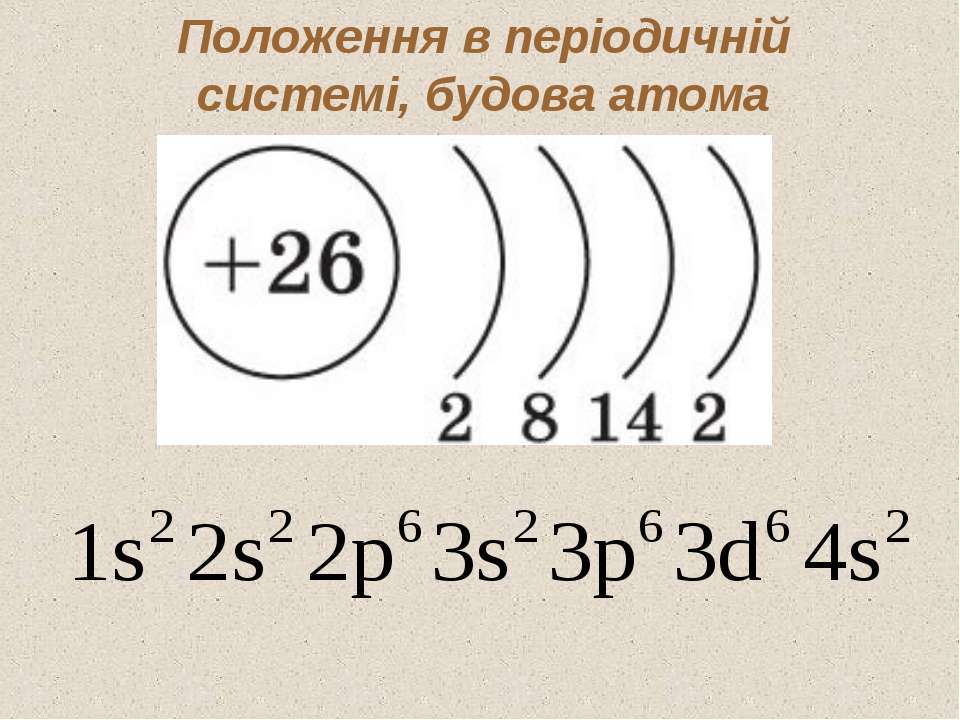 Статья в основном объясняет электронную конфигурацию и другие важные свойства циркония.
Статья в основном объясняет электронную конфигурацию и другие важные свойства циркония.
Цирконий – это химический элемент, который имеет символическую форму Zr и атомный номер 40. Химический элемент относится к категории металлических элементов. Он имеет физическую текстуру сероватых и белых элементов. Цирконий по своей физической структуре тесно связан с гафнием.
Циркониевая электронная конфигурация
Кроме того, цирконий обычно имеет либо твердую форму, либо форму порошка.Элемент в виде порошка легко воспламеняется, что делает его очень опасным для хранения. Кроме того, химический элемент обладает высокими антикоррозийными свойствами, что делает его очень полезным для использования вместе с другими химическими элементами.
Электронная конфигурация Zr очень полезна для полезного понимания элемента. С помощью электронной конфигурации циркония можно легко понять распределение электронов элемента по другим его орбиталям.Итак, длинная и описательная форма электронной конфигурации циркония может быть записана как 1s2 2s2p6 3s2p6d10 4s2p6d2 5s для полного понимания ученых. Однако стандартная форма электронной конфигурации циркония – [Kr] 4d² 5s².
Однако стандартная форма электронной конфигурации циркония – [Kr] 4d² 5s².
Сколько валентных электронов у циркония?
Электронная конфигурация Zr чрезвычайно полезна для понимания всех характеристик элемента. Это причина того, почему мы в основном разбиваем элемент, а затем выясняем его электронную конфигурацию.Весь этот процесс в конечном итоге помогает выяснить другие цели химического элемента. В химии обозначение электронной конфигурации элемента обязательно в периодической таблице. Итак, вы также можете изучить все другие свойства циркония, прочитав периодическую таблицу элементов.
Электронная конфигурация для циркония
Ну, как и другие химические элементы, цирконий также имеет ряд применений на своей территории. Это металлический химический элемент, поэтому вы можете найти его применение в сочетании других химических элементов.Например, высокие антикоррозионные свойства циркония позволяют лучше всего использовать его со сплавами. Впоследствии это добавляет дополнительный уровень защиты к различным вещам, в которых используются металлы.
Впоследствии это добавляет дополнительный уровень защиты к различным вещам, в которых используются металлы.
Другое применение циркония – высокотемпературные зоны. Это очень стойкий элемент, который может выдерживать химические воздействия при высоких температурах. Итак, это некоторые из важных применений циркония в разных местах. Мы считаем, что наша статья будет полезна нашим читателям в понимании его электронной конфигурации и других свойств.
Система Nb-Zr (ниобий-цирконий) | SpringerLink
34Bur: Бюргерс, У. Г., «О процессе перехода модификации с кубическим телом в гексагональную плотноупакованную модификацию циркония», Physica, 1 , 561 (1934).
ADS Статья Google ученый
55Rog: Роджерс, Б. А. и Аткинс, Д. Ф., «Диаграмма цирконий-колумбий», J.Мет., 7 , 1034 (1955).
Google ученый
59Com: Cometto, D. J. и Хехеманн, Р. Ф., «Характеристики превращения сплавов Zr-Nb», Промежуточный отчет № 2 Комиссии по атомной энергии США, TID-17006 (июль 1959 г.).
J. и Хехеманн, Р. Ф., «Характеристики превращения сплавов Zr-Nb», Промежуточный отчет № 2 Комиссии по атомной энергии США, TID-17006 (июль 1959 г.).
60Hat: Хатт, Б. А. и Робертс, Дж. А., «ω-фаза в сплавах на основе циркония», Acta Met., 8, , 575 (1960).
Артикул Google ученый
60Kna: Knapton, A.G., «Сплавы ниобия и тантала», J. Less-Common Met., 2, 113 (1960).
Артикул Google ученый
60Lun: Лундин, К. Э. и Кокс, Р. Х., «Определение равновесной фазовой диаграммы цирконий-ниобий», Комиссия по атомной энергии США, TID-11919 (август 1960 г.).
61Dwi: Дуайт, А. Э., «Поведение колумбия при легировании», в Columbium Metallurgy , AIME Metallurgical Soc.Конф., Т. 10, Interscience, 383 (1961).
62Ric: Richter, H., Wincierz, P., and Anderko, K. , «Состав цирконий-ниобиевых сплавов», J. Less-Common Met., 4 , 252 (1962) на немецком языке.
, «Состав цирконий-ниобиевых сплавов», J. Less-Common Met., 4 , 252 (1962) на немецком языке.
Артикул Google ученый
63Jam: Джеймисон, Дж. К., «Кристаллическая структура титана, циркония и гафния при высоких давлениях», Science, 140, , 72 (1963).
ADS Статья Google ученый
63 Джей: Джаяраман, А., Клемент, В. и Кеннеди, Г. С., “Переходы твердое тело-твердое тело в титане и цирконии при высоких давлениях”, Phys. Ред., 131 , 644 (1963).
ADS Статья Google ученый
65Com: Cometto, D. J., Houze, G. L. и Hehemann, R. F., «Превращение Омега в сплавах цирконий-ниобий (колумбий)», Trans. Встретились. Soc. AIME, 233 , 30 (1965).
Google ученый
65McM: МакМаллен, А. Г. и Гордон Парр Дж., «Превращение цирконий-ниобиевых сплавов», Canadian Metallurgical Quarterly, 4 (2), 117 (1965).
Г. и Гордон Парр Дж., «Превращение цирконий-ниобиевых сплавов», Canadian Metallurgical Quarterly, 4 (2), 117 (1965).
Артикул Google ученый
65Ste: Стюарт Д., Хатт Б. А. и Робертс Дж. А., «Высокоскоростной термический анализ сплавов Zr-Nb», Brit. J. Appl. Phys., 16, , 1081 (1965).
ADS Статья Google ученый
65 Уил: Уильямс, К.Д. и Гилберт, Р. В., «Закаленные структуры сплава Zr-2,5 мас.% Nb», J. Nuclear Mat., 18, , 161 (1966).
ADS Статья Google ученый
66Hig: Хиггинс, Г. Т. и Бэнкс, Э. Э., «Основные особенности изотермического превращения промонотектоидов в сплаве циркония 21/2 весовых процентов ниобия», Electrochemical Technology, 4 , 341 (1966).
Google ученый
66Sla: Слэттери, Г. Ф., «Некоторые аспекты превращения бета-альфа в сплаве цирконий-21/2 весовых процентов ниобия с переменной скоростью охлаждения и температурой выдержки», Electrochemical Technology, 4 , 336 (1966).
Ф., «Некоторые аспекты превращения бета-альфа в сплаве цирконий-21/2 весовых процентов ниобия с переменной скоростью охлаждения и температурой выдержки», Electrochemical Technology, 4 , 336 (1966).
Google ученый
67Eva: Evans, W., LeSurf, JE, и Thomas, WR, «Термообработанные Zr-2,5% Nb напорные трубы для энергетических реакторов с водяным охлаждением», Atomic Energy of Canada Ltd., AECL-2890 (1967) .
67вс: Сундарева, С.В., Буйнов С.В. Электронно-микроскопический анализ структуры сплава Zr-4% Nb // Физ. Встретились. Металл., 24 (1), 178 (1968).
Google ученый
68Fed: Федоров Г. Б., Смирнов Е. А., Махлин Н. А., Калинин П. И. Термодинамические свойства цирконий-ниобиевых сплавов. Физ. Хим., 42 , 663 (1968) на русском языке; TR: Русс. J. Phys. Chem., 42, , 349 (1968).
Google ученый
68Iva: Иванов О. С., Раевский И. И., Степанов Н. В., «Более точная фазовая диаграмма ниобий-циркониевой системы», Диаграммы состояния металлов. Сист. Матер. Всес. Совещ. . С. 52–57 (1968).
С., Раевский И. И., Степанов Н. В., «Более точная фазовая диаграмма ниобий-циркониевой системы», Диаграммы состояния металлов. Сист. Матер. Всес. Совещ. . С. 52–57 (1968).
69Bet: Бетюн, И. Т. и Уильямс, К. Д., «Граница α / (α + β) в системе Zr-Nb», J. Nuclear Mat., 29, , 129 (1969).
ADS Статья Google ученый
70Daw: Доусон, К. У. и Сасс, С. Л., «Закаленная форма омега-фазы в сплавах Zr-Nb», Met. Пер., 1 , 2225 (1970).
Артикул Google ученый
70Hun: Хант, К. Э. Л. и Ниссен, П., «Влияние кислорода на равновесную температуру превращения β / α + β в цирконий-ниобиевых сплавах», J.Nuclear Mat., 35, , 134 (1970).
ADS Статья Google ученый
70Kau: Кауфман Л. и Бернштейн Х., Компьютерный расчет фазовых диаграмм , Academic Press (1970).
70Kub: Кубит К. Дж. «Исследование фазовых превращений в сплавах Zr-Nb с высоким содержанием цинка, содержащих кислород», Ph.D. защитил диссертацию в Питтсбургском университете (1970 г.).
70 За: Перкинс, А.Дж., Йоффе, П. Э. и Хехеманн, Р. Ф., «Атермическое омега-превращение в сплавах Zr-Nb», Metall. Пер., 1 , 2785 (1970).
Google ученый
70Rab: Рабинкин А.Г., Клишанова Л.А., Пронина Л.Н. «Влияние обработки под высоким давлением на фазовый состав и сверхпроводящие свойства сплавов Zr-Nb», Проблемы сверхпроводящих материалов, 141 (1970) на русском языке. .
70Руд: Рудман П.С., «Термодинамический анализ и синтез фазовых диаграмм» в журнале Достижения в области исследований материалов , Херман, Ред., 4, , 147 (1970).
70Van: Vanderpuye, NA, Miodownik, AP, «Стабильность омега-фазы в сплавах титана и циркония», in The Science, Technology and Application of Titanium , Jaffee, RI and Promisel, NE, Ed. , Pergamon Пресс, 719 (1970).
, Pergamon Пресс, 719 (1970).
71 Бан: Банерджи, С.и Кришнан Р., «Мартенситное превращение в цирконий-ниобиевых сплавах», Acta Met., 19, , 1317 (1971).
Артикул Google ученый
71Dou: Дуглас Д. Л., «Металлургия циркония», Atomic Energy Review, Дополнение 1971, 164 (1971).
71Fed: Федоров, Г.Б., Смирнов, Е.А., Угасте, Ю.Е., Гусев, В.Н., Марчукова, И.Д., «Возможность определения термодинамической активности в бинарных сплавах по данным о взаимной диффузии и самодиффузии компонентов», Ж.Физ. Хим., 45, , 704 (1971). на русском; TR: Русс. J. Phys. Chem., 45, , 392 (1971). сплавов ниобия-циркония «в литом состоянии» и обработанных в растворе », Scripta Met., 5, , 579 (1971).
Google ученый
71Gue: Guerillon, J. P., «Структурные превращения в сплавах Zr-Nb», Metaux-Corrosion-Ind. , 47, , 21 (1972) на французском языке.
, 47, , 21 (1972) на французском языке.
Google ученый
71Hun: Hunt, C.Е. Л. и Ниссен П., «Поведение при непрерывном охлаждении и превращении сплавов цирконий-ниобий-кислород», J. Nuclear Mat., 38, , 17 (1971).
ADS Статья Google ученый
72Eff: Ван Эффентер, П., «Исследование диаграммы равновесия и структурных превращений, полученных закалкой с разной скоростью или отпуском сплавов Zr-Nb (0–55% Nb)», Отчет CEA-R-4330, Атомная энергия Комиссия, Сакле, Франция (1972) на французском языке.
Google ученый
72Fle: Flewitt, P.E.J., «Повторная оценка петли монотектоидов (β-Nb + β-Zr) в ниобий-циркониевой системе», J. Appl. Кристалл, 5, , 423 (1972).
Артикул Google ученый
72Heh: Hehemann, R. F., «Превращения в цирконий-ниобиевых сплавах», Canadian Metallurgical Quarterly, 11 , 201 (1972).
F., «Превращения в цирконий-ниобиевых сплавах», Canadian Metallurgical Quarterly, 11 , 201 (1972).
Артикул Google ученый
72Sas: Sass, S. L., «Структура и разложение твердых растворов с ОЦК Zr и Ti», J. Less-Common Met., 28, , 157 (1972).
Артикул Google ученый
73Bat: Баттерман, Б. В., Мараччи, Г., Мерлини, А. и Пейс, С., «Применение диффузного мессбауэровского рассеяния к динамике фазовых превращений», Phys.Rev. Lett., 31, , 227 (1973).
ADS Статья Google ученый
73Che: Чидл Б.А. и Олдридж С.А., «Поведение Zr-19 мас.% Nb при трансформации и старении», J. Nuclear Mat., 47, , 255 (1973).
ADS Статья Google ученый
73 Моос: Мосс, С. К., Китинг, Д. Т., и Акс, Дж.Д., «Нейтронное исследование нестабильности бета-омега в Zr 0,80 Nb 0,20 », в Phase Transitions , Elnsferd, Ed., Pergamon Press, 179 (1973).
Т., и Акс, Дж.Д., «Нейтронное исследование нестабильности бета-омега в Zr 0,80 Nb 0,20 », в Phase Transitions , Elnsferd, Ed., Pergamon Press, 179 (1973).
73Udo: Удовский А.Л., Иванов О.С., «Компьютерный расчет кривых фазового равновесия твердых растворов в бинарных системах урана», J. Nuclear Mat., 49 , 309 (1973)
ADS Статья Google ученый
74Che: Cheadle, B.A., «Физическая металлургия циркониевых сплавов», Atomic Energy of Canada Ltd., CRNL-1208 (1974).
74Fle: Flewitt, P. E. J., «Фазовые превращения в сплавах ниобия с содержанием циркония от 16 до 40% выше температуры монотектоида-I», Acta Met., 22 , 47 (1974).
Артикул Google ученый
74Kea: Китинг Д. Т. и Ла Плака С. Дж. «Определение числа и смещения атомов в диффузной ω-фазе Zr 0 методом дифракции нейтронов. 8 Nb 0,2 ”, J. Phys. Chem. Твердые тела, 35, , 879 (1974).
8 Nb 0,2 ”, J. Phys. Chem. Твердые тела, 35, , 879 (1974).
ADS Статья Google ученый
74Mil: Милн, И. и Финлейсон, Т. Р., «Исследование конституционного равновесия в сплавах ниобий-цирконий с использованием перехода температуры в сверхпроводящее состояние», Philos. Mag., 29, , 965 (1974).
ADS Статья Google ученый
75Axe: Axe, J.Д., Китинг Д. Т. и Мосс С. С., “Аномальное неупругое рассеяние нейтронов в сплавах Zr-Nb с ОЦК”, Phys. Rev. Lett., 35, , 530 (1975).
ADS Статья Google ученый
75Kau: Кауфман Л. и Несор Х. «Связь термохимии и фазовых диаграмм конденсированных систем», в Трактат по химии твердого тела Hannay, N. B., Ed., Vol. 5, глава 4, Plenum Press (1975).
76Alc: Алкок, К. Б., Джейкоб, К.Т., и Задор, С., «Термохимические свойства», в Цирконий: физико-химические свойства его соединений и сплавов » Кубащевский, О., Ред., Обзор атомной энергии, специальный выпуск № 6 , 7 (1976).
Б., Джейкоб, К.Т., и Задор, С., «Термохимические свойства», в Цирконий: физико-химические свойства его соединений и сплавов » Кубащевский, О., Ред., Обзор атомной энергии, специальный выпуск № 6 , 7 (1976).
76Ban: Банерджи, С., Виджаякар, С. Дж. И Кришнан, Р., «Осаждение в цирконий-ниобиевых мартенситах», J. Nuclear Mat., 62, , 229 (1976).
ADS Статья Google ученый
76Cha: Чанг, А.Л. Дж., Сасс, С. Л. и Краков, В., «Исследование омега-превращения в сплавах Zr-Nb с помощью электронного микроскопа высокого разрешения», Acta Met., 24, , 29 (1976).
Артикул Google ученый
76Kua: Куан Т.С. и Сасс С.Л., «Структура линейного омега-подобного вакансионного дефекта в Zr-Nb b.c.c. Твердые растворы », Acta Met., 24, , 1053 (1976).
Артикул Google ученый
76 Куб: Кубащевский фон Гольдбек, О. , «Фазовые диаграммы», в Цирконий: физико-химические свойства его соединений и сплавов » Кубащевский, О., Ред., Обзор атомной энергии, специальный выпуск № 6, 67 (1976).
, «Фазовые диаграммы», в Цирконий: физико-химические свойства его соединений и сплавов » Кубащевский, О., Ред., Обзор атомной энергии, специальный выпуск № 6, 67 (1976).
76Lin: Лин В., Спалт Х. и Баттерман Б. В., «Исследование ω-фазы в сплавах Zr-Nb методами мессбауэра и диффузного рассеяния рентгеновских лучей», Phys. Ред. В, 13 , 5158 (1976).
ADS Статья Google ученый
77Sin: Sinha, T.К. и Асунди, М. К., «Влияние скорости деформации и температуры на свойства растяжения термообработанных циркониевых сплавов с 2,5 мас.% Ниобия», J. Nuclear Mat., 67, , 311 (1977).
ADS Статья Google ученый
78And: Андерсен, С. К. и Баттерман, Б. В., «Энергетический анализ диффузных ω-отражений в Nb-Zr с помощью мессбауэровского рассеяния рентгеновских лучей», Solid State Comm., 26, , 195 (1978).
ADS Статья Google ученый
78 Мужчины: Menon, S.К., Банерджи, С., Кришнан, Р., «Применение диаграмм состава свободной энергии для прогнозирования последовательности фазовых превращений в сплавах Zr-Nb», Met. Пер., 9А, , 1213 (1978).
Артикул Google ученый
78Voh: Вохра, Ю. К., «Кинетика фазовых превращений в Ti, Zr и Hf при статическом и динамическом давлениях», J. Nuclear Mat., 75, , 288 (1978).
ADS Статья Google ученый
79Nor: Northwood, D.О. и Гиллис, Д. С., «Определение фазовых границ α / (α + β) и (α + β) / β в системе цирконий-ниобий», Microstructural Science, 7 , 123 (1979).
Google ученый
81Abr: Абриата, Дж. П. и Кардона, Ф., «Свободная энергия β-фазы в системе цирконий-ниобий», Отчет FAE-1-81. Комиссия по атомной энергии, Барилоче, Аргентина (1981) на испанском языке.
Комиссия по атомной энергии, Барилоче, Аргентина (1981) на испанском языке.
Google ученый
81BAP: «Точки плавления элементов (IPTS-68)», Bull.Фазовые диаграммы сплавов , 2 (1), 145 (1981).
81Kha: Халед, Т., Нараянан, Г.Х. и Копли, С.М., «Влияние промежуточных элементов на фазовое равновесие в сплавах P [Ti, Zr, Hf] – X [β-стабилизатор (ы)]» ”, Met. Пер., 12А, , 293 (1981).
Артикул Google ученый
81Nak: Накай, К., Киношита, С. и Китадзима, С., «Влияние кислорода и / или азота на фазовые превращения выше температуры монотектоида в сплавах Nb-Zr», J.Nuclear Mat., 98, , 131 (1981).
ADS Статья Google ученый
81Rab: Рабинкин А., Талианкер М. и Ботштейн О., «Кристаллография и модель фазового превращения α → ω в цирконии», Acta Met. , 29, , 691 (1981).
, 29, , 691 (1981).
Артикул Google ученый
82Bol: Больчич, Дж. К., «Бездиффузионные фазовые превращения в сплавах Zr-Nb и Zr-Nb-Al», Ph.Докторская диссертация, Instituto Balseiro, Барилоче, CNEA, Аргентина (1982) на испанском языке.
Google ученый
82Sik: Сикка, С. К., Вохра, Ю. К., и Чидамбарана, Р., «Омега-фаза в материалах», Progress in Materials Science , будет опубликовано.
Фазовая диаграмма палладий – цирконий – Скачать PDF бесплатно
Journal of Alloys and Compounds 290 (1999) 63–70L
Фазовая диаграмма палладий – цирконий a, a b R.M. Waterstrat *, A. Shapiro, A. Jeremie a
b
Лаборатория материаловедения и инженерии, NIST, Gaithersburg, MD 20899, США «Condensee», Женевский университет, CH 1211 Geneva 4, Switzerland Departement de Physique de la Matiere Получено 25 января 1999 г . ; получена в доработке 24 февраля 1999 г.
; получена в доработке 24 февраля 1999 г.
Резюме Фазовая диаграмма палладий – цирконий была повторно исследована во всем диапазоне его составов. Пересмотренная диаграмма включает две промежуточные фазы, Pd 4 Zr 3 и Pd 11 Zr 9, которых не было в предыдущих исследованиях.Кристаллическая структура новых фаз напоминает структуру типа B2, хотя атомы значительно смещены из узлов кубической решетки. Настоящие наблюдения обсуждаются и сравниваются с аналогичными результатами для родственных систем Ni – Ti и Rh – Zr. Опубликовано Elsevier Science S.A. Ключевые слова: палладиевые сплавы; Циркониевые сплавы; Фазовые диаграммы; Кристальная структура; Интерметаллические соединения; Структура мартенсита
1. Введение Система палладий-цирконий относится к классу бинарных систем сплавов, которые сочетают в себе так называемые «ранние» и «поздние» переходные элементы.Предыдущие исследования этого класса сплавов выявили множество интересных явлений, таких как волны зарядовой плотности [1–4].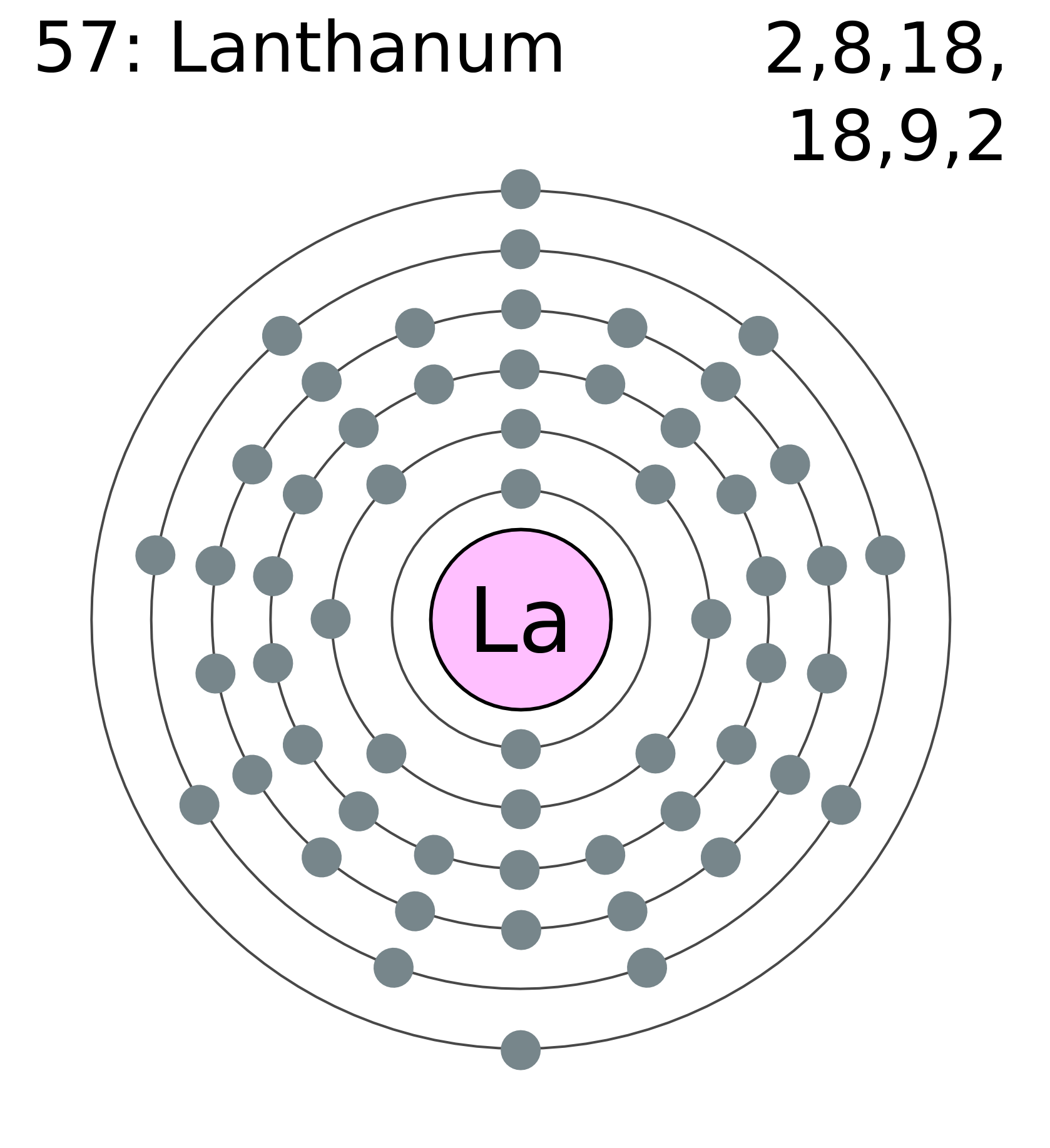 структуры смещения решетки [4–11]. мартенситные превращения и сверхпроводимость. Эти явления часто связаны с нестабильностью поверхности Ферми и могут давать некоторые уникальные и полезные свойства. Наиболее известным примером этого является коммерческий сплав «нитинол» (никель-титан), который сочетает в себе псевдоупругие свойства и свойства памяти формы [12] с превосходной стойкостью к распространению трещин, усталости и износу при скольжении [13,14].Систему сплава палладий – цирконий можно рассматривать как второй долгопериодный аналог системы никель – титан, но исследования сплавов Pd – Zr были гораздо менее обширными, чем исследования сплавов Ni – Ti, которые имеют много коммерческих применений. Предварительные исследования некоторых сплавов Pd – Zr – Ru показали, что они обладают необычной ударной вязкостью и устойчивостью к износу при скольжении [15], но необходимы дальнейшие исследования. На существующей фазовой диаграмме Pd – Zr, основанной в основном на ранних работах Андерко [16], не хватает информации о диапазонах составов промежуточных фаз, богатых Pd, и
структуры смещения решетки [4–11]. мартенситные превращения и сверхпроводимость. Эти явления часто связаны с нестабильностью поверхности Ферми и могут давать некоторые уникальные и полезные свойства. Наиболее известным примером этого является коммерческий сплав «нитинол» (никель-титан), который сочетает в себе псевдоупругие свойства и свойства памяти формы [12] с превосходной стойкостью к распространению трещин, усталости и износу при скольжении [13,14].Систему сплава палладий – цирконий можно рассматривать как второй долгопериодный аналог системы никель – титан, но исследования сплавов Pd – Zr были гораздо менее обширными, чем исследования сплавов Ni – Ti, которые имеют много коммерческих применений. Предварительные исследования некоторых сплавов Pd – Zr – Ru показали, что они обладают необычной ударной вязкостью и устойчивостью к износу при скольжении [15], но необходимы дальнейшие исследования. На существующей фазовой диаграмме Pd – Zr, основанной в основном на ранних работах Андерко [16], не хватает информации о диапазонах составов промежуточных фаз, богатых Pd, и
* Автор, отвечающий за переписку. 0925-8388 / 99 / $ – см. Титульный лист PII: S0925-8388 (99) 00127-9
0925-8388 / 99 / $ – см. Титульный лист PII: S0925-8388 (99) 00127-9
Опубликовано Elsevier Science S.A.
, похоже, упускает из виду другие важные особенности [7]. Таким образом, настоящее исследование было предпринято для получения более надежной фазовой диаграммы, которая облегчит дальнейшее развитие сплава и позволит проводить полезные сравнения с другими системами бинарных сплавов этого класса.
2. Экспериментальные процедуры Все образцы сплавов были плавлены дугой с использованием листов палладия и слитков циркония, обработанных йодидом.Атомная доля металлических примесей в этих металлах заявлена поставщиками менее 0,5%. Относительные потери массы при плавлении были менее 1%. Попытка приготовить сплав путем спекания сжатой порошковой смеси в высоком вакууме потерпела катастрофическую неудачу из-за бурной экзотермической реакции, которая произошла при нагревании образца. Образцы, полученные дуговой плавкой, отжигались для гомогенизации в высоковакуумной печи, резистивно нагреваемой танталовыми полосками. При самых высоких температурах часть палладия терялась из-за испарения тонкого слоя (прибл.0,5 мм) на поверхности образца, но внутренняя часть образца практически не пострадала. Температуры устанавливались путем калибровки тока печи по наблюдаемым температурам плавления стандартных проволок высокой чистоты из золота, никеля, платины и родия, а также по стандартизированной платино-родиевой термопаре. Эта процедура позволила установить и поддерживать все температуры с погрешностью менее 108 ° C. Во время визуального наблюдения-
При самых высоких температурах часть палладия терялась из-за испарения тонкого слоя (прибл.0,5 мм) на поверхности образца, но внутренняя часть образца практически не пострадала. Температуры устанавливались путем калибровки тока печи по наблюдаемым температурам плавления стандартных проволок высокой чистоты из золота, никеля, платины и родия, а также по стандартизированной платино-родиевой термопаре. Эта процедура позволила установить и поддерживать все температуры с погрешностью менее 108 ° C. Во время визуального наблюдения-
64
Р.М. Waterstrat et al./ Journal of Alloys and Compounds 290 (1999) 63 – 70
При точках плавления температуру можно было изменять с шагом в два или три градуса. За обработками отжигом следовало охлаждение в печи со скоростью 30–100 ° C / с. Отжиг при температурах ниже 1200 ° C проводился в вакуумированных кварцевых трубках с последующим закалкой в воде. Типичные графики отжига сплавов, богатых палладием и цирконием, показаны в таблице 1.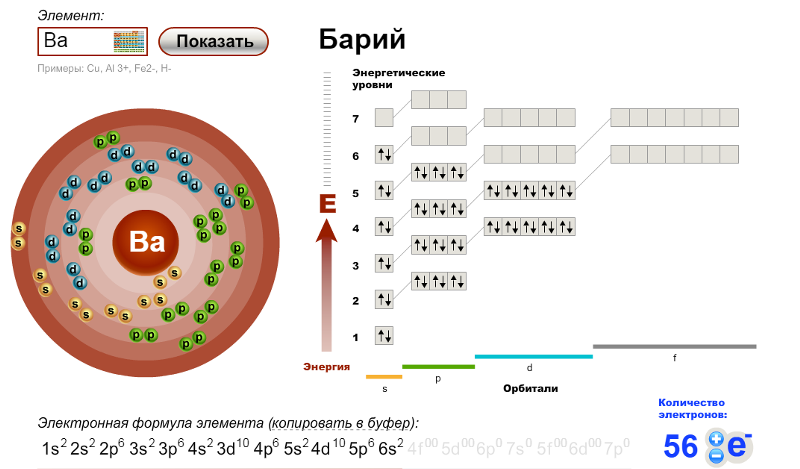 Тигли из оксида алюминия высокой чистоты оказались удовлетворительными для определения температуры плавления и дифференциального термического анализа (ДТА) при температурах ниже 1200 ° C, но они реагировали с образцами при температурах, превышающих эту температуру. .Однако измерения ДТА можно расширить до температуры более 1500 ° C, используя вольфрамовые хлопья в качестве футеровки тигля в атмосфере аргона высокой чистоты. Определение точки плавления может быть выполнено до 2000 ° C или выше в вакуумной печи путем подвешивания образцов на тонкой вольфрамовой проволоке. Вольфрамовые проволоки остаются неповрежденными даже при наличии некоторой локальной реакции с образцом. Похоже, что загрязнение образцов вольфрамом незначительно, учитывая небольшое количество вольфрамовой проволоки, потребляемой в реакции с образцом, по сравнению с гораздо большим весом образца.Фактически, нам часто удавалось удерживать каплю расплава в небольшой петле проволоки только за счет поверхностного натяжения без потери целостности проволоки.
Тигли из оксида алюминия высокой чистоты оказались удовлетворительными для определения температуры плавления и дифференциального термического анализа (ДТА) при температурах ниже 1200 ° C, но они реагировали с образцами при температурах, превышающих эту температуру. .Однако измерения ДТА можно расширить до температуры более 1500 ° C, используя вольфрамовые хлопья в качестве футеровки тигля в атмосфере аргона высокой чистоты. Определение точки плавления может быть выполнено до 2000 ° C или выше в вакуумной печи путем подвешивания образцов на тонкой вольфрамовой проволоке. Вольфрамовые проволоки остаются неповрежденными даже при наличии некоторой локальной реакции с образцом. Похоже, что загрязнение образцов вольфрамом незначительно, учитывая небольшое количество вольфрамовой проволоки, потребляемой в реакции с образцом, по сравнению с гораздо большим весом образца.Фактически, нам часто удавалось удерживать каплю расплава в небольшой петле проволоки только за счет поверхностного натяжения без потери целостности проволоки. Измерения методом ДТА проводились в токе аргона при скоростях нагрева и охлаждения 2–108 ° C / мин, и наблюдались резкие точки остановки как с вольфрамовыми вкладышами, так и без них. Данные, полученные с футеровкой, были предпочтительны при более высоких температурах, потому что химические реакции с тиглями из оксида алюминия без футеровки становятся чрезмерными при таких высоких температурах, в то время как реакции с вольфрамом более ограничены.Металлографические образцы были приготовлены обычной полировкой и травлением в водных растворах HF с добавлением, для некоторых богатых палладием сплавов, электролизом на переменном токе в несколько вольт. Количественный анализ отдельных фаз проводился методом энергодисперсионной спектроскопии (EDS) при сканировании.
Измерения методом ДТА проводились в токе аргона при скоростях нагрева и охлаждения 2–108 ° C / мин, и наблюдались резкие точки остановки как с вольфрамовыми вкладышами, так и без них. Данные, полученные с футеровкой, были предпочтительны при более высоких температурах, потому что химические реакции с тиглями из оксида алюминия без футеровки становятся чрезмерными при таких высоких температурах, в то время как реакции с вольфрамом более ограничены.Металлографические образцы были приготовлены обычной полировкой и травлением в водных растворах HF с добавлением, для некоторых богатых палладием сплавов, электролизом на переменном токе в несколько вольт. Количественный анализ отдельных фаз проводился методом энергодисперсионной спектроскопии (EDS) при сканировании.
Таблица 1 Температура и время, использованные для уравновешивания в различных диапазонах составов Диапазон составов,% Zr
Температура
Время
0–35
14008C 11008C 9008C
6 ч 1 неделя 4 недели
35–50
13008C 11008C 9008C
2] 12 ч 3 дня 2 недели
50–67
10008C 9008C 7008C
6 недель 67–100
9008C 7008C
1 день 2 недели
электронный микроскоп (SEM) с погрешностью 61% 1 в большинстве случаев. В некоторых случаях было трудно найти регионы, в которых анализируемая фаза имела необходимые размеры, и в таких случаях наши общие неопределенности были более низкого порядка. Картины дифракции рентгеновских лучей были получены с полированных поверхностей сплава с целью идентификации фаз, но точные параметры решетки не были определены в этом исследовании, поскольку значения параметров решетки для всех фаз доступны в других источниках [7,17–21]. Измерения микротвердости проводили с помощью системы микроиндентора Виккерса при нагрузке 30 г.
В некоторых случаях было трудно найти регионы, в которых анализируемая фаза имела необходимые размеры, и в таких случаях наши общие неопределенности были более низкого порядка. Картины дифракции рентгеновских лучей были получены с полированных поверхностей сплава с целью идентификации фаз, но точные параметры решетки не были определены в этом исследовании, поскольку значения параметров решетки для всех фаз доступны в других источниках [7,17–21]. Измерения микротвердости проводили с помощью системы микроиндентора Виккерса при нагрузке 30 г.
3. Экспериментальные результаты Фазовая диаграмма, полученная в этом исследовании, показана на рис. 1. Небольшие диапазоны составов наблюдались для каждой фазы, хотя для некоторых фаз диапазон был очень узким. Были обнаружены две новые фазы: Pd 4 Zr 3 и Pd 11 Zr 9. Ниже приводится обсуждение каждой фазовой области.
3.1. Твердый раствор палладия (г Pd) (г Pd) растворяет до 16% Zr при 1580 ° C, где происходит перитектическая реакция L1Pd 3 Zr↔ (г Pd). Растворимость медленно снижается при более низких температурах примерно до 14% Zr.Точность наших данных о температуре плавления недостаточна для определения того, отклоняется ли граница солидуса фазы (g Pd) от линейности, но мы чувствовали себя вынужденными построить эту границу слегка выпуклой к оси температуры в соответствии с термодинамическими аргументами, выдвинутыми Окамото. и Массальский [22,23]. Данные EDS не могли быть получены для образцов, содержащих обе фазы в узкой двухфазной области (g Pd) 1ZrPd 3, потому что вторая фаза образовывала глобулярные частицы, которые неизменно отрывались от поверхности образца во время полировки.
Растворимость медленно снижается при более низких температурах примерно до 14% Zr.Точность наших данных о температуре плавления недостаточна для определения того, отклоняется ли граница солидуса фазы (g Pd) от линейности, но мы чувствовали себя вынужденными построить эту границу слегка выпуклой к оси температуры в соответствии с термодинамическими аргументами, выдвинутыми Окамото. и Массальский [22,23]. Данные EDS не могли быть получены для образцов, содержащих обе фазы в узкой двухфазной области (g Pd) 1ZrPd 3, потому что вторая фаза образовывала глобулярные частицы, которые неизменно отрывались от поверхности образца во время полировки.
3.2. Твердые растворы циркония (a Zr) и (b Zr) b Zr растворяют до 11% Pd при 1070 ° C, где происходит эвтектическая реакция L↔ (b Zr) 1PdZr 2. При 7608 ° C происходит эвтектоидная реакция (b Zr) (a Zr) 1Pd Zr 2, и (a Zr) растворяет не более 1% Pd при этой температуре. Очень тонкие структуры, полученные во время эвтектических и эвтектоидных превращений, не могли быть разрешены во время измерений EDS, но для этих структур были получены средние составы для подтверждения эвтектического и эвтектоидного составов.
1
Проценты, указанные в этой статье, являются атомными долями.
Р.М. Waterstrat et al. / Журнал сплавов и соединений 290 (1999) 63 – 70
65
Рис. 1. Фазовая диаграмма палладий – цирконий. s однофазный, g двухфазный, h EDS анализ, m визуально наблюдаемое плавление 3DTA.
3.3. Данные ДТА PdZr2, полученные в этой работе, а также в работе Андерко [16], в пределах экспериментальных ошибок совместимы с существованием перитектической реакции L1PdZr↔PdZr 2 при 11208 ° C.Мы не смогли найти металлографических свидетельств эвтектической структуры в этой области. На рис. 1 мы показали диапазон составов PdZr 2 как приблизительно 1%, что соответствует погрешности наших измерений EDS. Однако возможно, что диапазон составов фазы PdZr 2 уже. Наши порошковые дифрактограммы PdZr 2 совместимы с ранее описанной тетрагональной структурой типа MoSi 2. Примечательно, что в этой области составов системы Pd – Zr аморфные фазы образуются закалкой в жидкости [24]. На рис. 2 показана структура, полученная при быстром охлаждении сплава с 60 ат.% Zr чуть выше температуры солидуса. На рис. 3 показан тот же сплав после отжига при 1000 ° C.
На рис. 2 показана структура, полученная при быстром охлаждении сплава с 60 ат.% Zr чуть выше температуры солидуса. На рис. 3 показан тот же сплав после отжига при 1000 ° C.
Диапазон составов фазы PdZr типа B2 простирается от примерно (46–51)% Zr при 14458 ° C, но он стабилен только примерно от (49 до 50)% Zr при температуре ниже 10008 ° C.
3.4. PdZr Эквиатомный сплав PdZr конгруэнтно плавился при 1600–6108 ° C. Предыдущее исследование установило, что кристаллическая структура фазы PdZr представляет собой кубический B2-тип выше 6208C [21].При охлаждении происходит мартенситное превращение в ромбическую структуру типа CrB [21]. Вопрос о том, связано ли это преобразование с эффектом памяти формы, требует дальнейшего изучения.
Рис. 2. Сплав 60% Zr быстро охлаждается после нагрева до температуры чуть выше температуры солидуса. Глобулярный мартенситный PdZr в матрице PdZr 2.
66
Р.М. Waterstrat et al. / Журнал сплавов и соединений 290 (1999) 63 – 70
Состав Zr 9 Pd 11 при n510. Следует отметить, что внутрислойное смешение атомов разного размера будет вносить деформации и, следовательно, атомы могут быть значительно смещены из идеальной квадратной сетки (и идеальной кубической решетки). Была приготовлена серия сплавов с шагом 1% состава от 40% до 47% Zr и отожжена при 900 ° C в течение 2 недель. Металлографические исследования этих закаленных образцов показали, что образцы с 43% Zr и 45% Zr были однофазными, тогда как все остальные образцы содержали две фазы. Двухфазный вид образца 44% Zr показан на рис.4. Картина дифракции рентгеновских лучей этого образца с 44% Zr показала сосуществующие сильные пики обеих фаз Pd 11 Zr 9 и Pd 4 Zr 3. Наши данные DTA в этой области показали термическую остановку при температуре около 980 ° C. Эти результаты предполагают перитектоидную трансформацию первого порядка; Pd 4 Zr 3 1PdZr↔Pd 11 Zr 9.
Следует отметить, что внутрислойное смешение атомов разного размера будет вносить деформации и, следовательно, атомы могут быть значительно смещены из идеальной квадратной сетки (и идеальной кубической решетки). Была приготовлена серия сплавов с шагом 1% состава от 40% до 47% Zr и отожжена при 900 ° C в течение 2 недель. Металлографические исследования этих закаленных образцов показали, что образцы с 43% Zr и 45% Zr были однофазными, тогда как все остальные образцы содержали две фазы. Двухфазный вид образца 44% Zr показан на рис.4. Картина дифракции рентгеновских лучей этого образца с 44% Zr показала сосуществующие сильные пики обеих фаз Pd 11 Zr 9 и Pd 4 Zr 3. Наши данные DTA в этой области показали термическую остановку при температуре около 980 ° C. Эти результаты предполагают перитектоидную трансформацию первого порядка; Pd 4 Zr 3 1PdZr↔Pd 11 Zr 9.
3.6. Pd4 Zr3 О существовании фазы Pd 4 Zr 3, имеющей структуру типа Pu 3 Pd 4, впервые сообщили Bendersky et al. [7]. Измерения теплового расширения и ДТА на этой фазе
Рис. 3. Сплав 60% Zr, отожженный при 1000 ° C. Мартенситные области PdZr в более крупнозернистой матрице PdZr 2.
3. Сплав 60% Zr, отожженный при 1000 ° C. Мартенситные области PdZr в более крупнозернистой матрице PdZr 2.
3.5. Pd11 Zr9 О существовании фазы Pd 11 Zr 9 ранее не сообщалось. Нейтронографическое исследование однофазного образца этого соединения показало дифракционную картину, резко отличающуюся от картин Pd 4 Zr 3 и PdZr [20]. Этот образец был проиндексирован на основе тетрагональной элементарной ячейки с a51,031 нм и c50,694 нм (a510.31A и c56.94A). Наблюдаемые относительные интенсивности хорошо согласуются с рассчитанными [20] для структуры, изоморфной Ni 11 Zr 9 [25] и Pt 11 Zr 9 [26].Эта структура может быть получена из чередующихся слоев квадратных ячеек атомов A и B в структуре типа B2. Чтобы приспособиться к отклонениям от идеальной стехиометрии AB, структура B2 не может сохранять 100% -ное заполнение слоев A и B. Если уровни A сохраняют 100% занятость, тогда уровни B должны иметь смешанную занятость, и наоборот. Cenzual et al. [5] показали, что если каждый смешанный слой A содержит 1 / n атомов B, то состав слоя A будет A n21 B, а состав несмешанного слоя будет иметь состав B. Общий состав этого типа конструкции – A 121 / n B 111 / n. Фаза Zr – Pd этого типа, следовательно, будет иметь
Общий состав этого типа конструкции – A 121 / n B 111 / n. Фаза Zr – Pd этого типа, следовательно, будет иметь
Рис. 4. Сплав с 44% Zr, отожженный при 900 ° C. Фаза Pd 11 Zr 9 (светлая) в бывших крупных зернах Pd 4 Zr 3 (темная).
Р.М. Waterstrat et al. / Journal of Alloys and Compounds 290 (1999) 63 – 70
67
указывают на то, что он стабилен от комнатной температуры до примерно 14508 ° C, где он, по-видимому, трансформируется посредством перитектической реакции L1PdZr↔Pd 4 Zr 3.Ромбоэдрическая структура типа Pu 3 Pd 4 также принадлежит к классу деформационных структур, производных от типа B2 путем введения чередующихся слоев со смешанным заполнением. В номенклатуре Cenzual et al. [5] эта структура имеет n57. Фазы Ni 4 Ti 3 [27] и Rh 4 Zr 3 [3], по-видимому, изоморфны, хотя последняя имеет наложенную несоразмерную волну. Pd 4 Zr 3 сосуществует с ZrPd (рис. 5) и вступает в эвтектическую реакцию L↔Pd 2 Zr1Pd 4 Zr 3 при температуре около 1400 ° C (рис. 6).
3. 7. Pd2 Zr Фаза Pd 2 Zr имеет тетрагональную структуру типа MoSi 2 и состав в диапазоне от 33 до 37% Zr при 1400 ° C. Диапазон составов сужается при более низких температурах, но все же остается шире, чем диапазон составов его изоморфного партнера PdZr 2. Несмотря на их изоморфные структуры, эти две фазы имеют существенно разные соотношения осей, что отражает хорошо известную способность этой структуры претерпевать большие изменения соотношения осей [28]. Pd 2 Zr образуется из сплава
7. Pd2 Zr Фаза Pd 2 Zr имеет тетрагональную структуру типа MoSi 2 и состав в диапазоне от 33 до 37% Zr при 1400 ° C. Диапазон составов сужается при более низких температурах, но все же остается шире, чем диапазон составов его изоморфного партнера PdZr 2. Несмотря на их изоморфные структуры, эти две фазы имеют существенно разные соотношения осей, что отражает хорошо известную способность этой структуры претерпевать большие изменения соотношения осей [28]. Pd 2 Zr образуется из сплава
Рис. 6. Сплав с 40% Zr в состоянии “дугового литья”.Эвтектическая структура Pd 2 Zr и Pd 4 Zr 3.
перитектическое превращение, L1Pd 3 Zr↔Pd 2 Zr, при 16108C. На рис. 7 показаны частицы Pd 2 Zr в матрице Pd 4 Zr 3.
3.8. Pd3 Zr В предыдущем исследовании [29] сообщалось о конгруэнтном плавлении Pd 3 Zr при 17806258 ° C, но мы наблюдали конгруэнтное плавление при (18
) 8C. Мы не можем объяснить это несоответствие, но загрязнение сплава во время плавления [29] может объяснить его. Диапазон составов этой фазы простирается примерно от (18 до 27)% Zr при 1600 ° C, но значительно сужается при более низких температурах.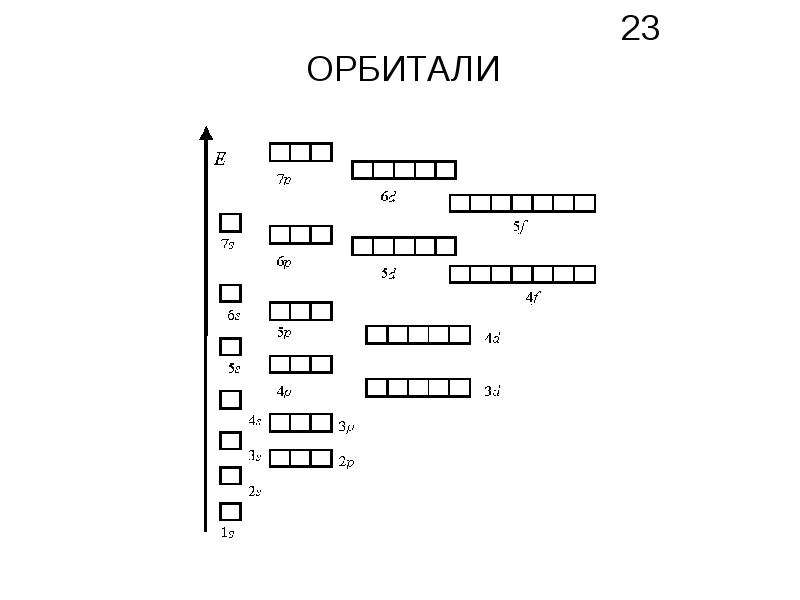 Он составляет от (20 до 25)% Zr ниже 1400 ° C, и это отражается в наблюдаемых изменениях параметров решетки. Кристаллическая структура этой фазы представляет собой гексагональную структуру типа Ni 3 Ti. На рис. 8 показаны частицы Pd 2 Zr в матрице Pd 3 Zr.
Он составляет от (20 до 25)% Zr ниже 1400 ° C, и это отражается в наблюдаемых изменениях параметров решетки. Кристаллическая структура этой фазы представляет собой гексагональную структуру типа Ni 3 Ti. На рис. 8 показаны частицы Pd 2 Zr в матрице Pd 3 Zr.4. Измерения твердости Твердость по Виккерсу фаз Pd – Zr суммирована на рис. 9.
5. Влияние загрязнения кислородом на фазу PdZr
Рис. 5. Сплав с 48% Zr, отожженный при 1100 ° C. Частицы Pd 4 Zr 3 (светлые) в матрице мартенситного PdZr (темные).
Во время отжига при 1100 ° C одна из откачанных кварцевых трубок разрушилась, не сломавшись, но, по-видимому, впустила ограниченное количество воздуха. Образцы были
68
Р.М. Waterstrat et al. / Журнал сплавов и соединений 290 (1999) 63 – 70
Рис. 8. Сплав 30% Zr, отожженный при 1300 ° C. Частицы Pd 2 Zr (светлые) в матрице более темного Pd 3 Zr.
Рис. 7. Сплав 41% Zr, отожженный при температуре 1100 ° C, частицы Pd 2 Zr в матрице Pd 4 Zr 3.
богат палладием и не показал никаких поверхностных признаков загрязнения, но последующий анализ EDS показал, что фаза PdZr в двухфазном образце (Pd 4 Zr 3 1PdZr) разложилась до ZrO 2 1Pd.Фаза Pd 4 Zr 3 не изменилась. О подобном эффекте недавно сообщалось в образцах AuZr, нагретых до 700 ° C в потоке кислорода и даже после длительного пребывания на воздухе при комнатной температуре [30]. Однако наши образцы ZrPd не разлагались при комнатной температуре.
расчет структуры сплавов Ni – Ti благодаря большому количеству экспериментальных данных, доступных для этих сплавов [32]. Существует некоторая полезная информация, которую можно получить, сравнивая настоящую фазовую диаграмму Pd – Zr с диаграммой Ni – Ti, которая является изоэлектронным аналогом системы Pd – Zr среди первых длиннопериодных элементов.Можно заметить поразительное сходство в областях, богатых Zr и Ti, этих двух систем (рис. 10), но области, богатые Ni и Pd, заметно различаются. Фазы Pd 3 Zr и Ni 3 Ti, например, изоморфны, но Ni 3 Ti по существу является линейным соединением [33], в то время как Pd 3 Zr имеет расширенный диапазон составов.
6. Обсуждение Одна из целей исследования фазовых диаграмм – найти систематические взаимосвязи, которые будут служить руководством для более точных расчетов. Существующей информации о фазовых равновесиях в системе Pd – Zr было недостаточно, чтобы дать много рекомендаций для расчетов электронной структуры, например, для тройных сплавов Pd – Zr – Ru [31].Поэтому при расчетах приходилось руководствоваться в основном электронными измерениями удельной теплоемкости. С другой стороны, большой прогресс был достигнут в полосе
Рис. 9. Твердость по Виккерсу промежуточных фаз Pd – Zr при комнатной температуре. М обозначает мартенсит.
Р.М. Waterstrat et al. / Journal of Alloys and Compounds 290 (1999) 63 – 70
69
Эффекты, вызываемые изменением концентрации электронов, можно увидеть, сравнив фазовую диаграмму Pd – Zr с диаграммой Rh – Zr системы [34].Снова можно увидеть поразительное сходство в областях, богатых Zr (рис. 10), в то время как области, богатые Rh и Pd, качественно различаются. Rh 3 Zr и Pd 3 Zr имеют расширенный диапазон составов. Rh 4 Zr 3 и Pd 4 Zr 3 представляют собой изоморфные структуры типа Pu 3 Pd 4, но следует отметить, что Rh 4 Zr 3 имеет наложенную несоразмерную волну смещения [3]. Фактически можно рассматривать структуру типа Pu 3 Pd 4 как кубическую решетку типа B2, в которой атомы случайным образом смещены из узлов кубической решетки [5].Структуры Rh 5 Zr 3 [5] и Pd 11 Zr 9 [20,26] можно рассматривать с той же точки зрения.
Рис. 10. Сравнение бинарных фазовых диаграмм для систем Ni – Ti, Pd – Zr и Rh – Zr [34].
Изоморфизм также существует для соединений Pd 4 Zr 3 [7] и Ni 4 Ti 3 [27], но неясно, является ли последний равновесной фазой, и он не проявляется на настоящей фазовой диаграмме Ni – Ti. Особо следует отметить, что эквиатомные соединения PdZr и NiTi имеют упорядоченные структуры типа B2 при высоких температурах, и оба они мартенситно трансформируются при понижении температуры.PdZr преобразуется в орторомбическую структуру типа CrB при температуре 620 ° C, в то время как NiTi преобразуется в слегка моноклинное искажение структуры типа AuCd при комнатной температуре или около нее.
Рис. 11. Соотношения атомных объемов для трех двойных систем на рис. 10. M обозначает мартенсит.
70
Р.М. Waterstrat et al. / Journal of Alloys and Compounds 290 (1999) 63 – 70
Очевидно, что источник этих искажений находится в электронных взаимодействиях, но они не совсем понятны.Сравнение атомных объемов в этих трех двойных системах показано на рис. 11. Интересная взаимосвязь существует между мартенситными структурами PdZr и RhZr. В этих двух структурах можно увидеть идентичные атомные слои. Последовательность укладки этих слоев – AABB в PdZr и ABBABAAB в RhZr [35]. Варианты наложения слоев также можно увидеть в эквиатомных мартенситных структурах, содержащих Ti. Мартенситы PdTi и PtTi представляют собой структуры типа AuCd, имеющие последовательность укладки AB, в то время как RhTi и IrTi образуют структуры CuAutype, имеющие последовательность укладки ABC.
Благодарности Выражаем благодарность Морин Уильямс и Тони Джузеппетти за их советы и помощь в технических процедурах, которые имели решающее значение для экспериментальных процедур, использованных в этом исследовании.
Ссылки [1] M. Hwang, M. Meichle, M.B. Саламон, К. Wayman, Philos. Mag. 47A (1983) 9–30. [2] G.L. Zhao, T.C. Люнг, Б. Harmon, M. Keil, M. Mullner, W. Weber, Phys. Ред. B40 (1989) 7999–8001. [3] Л.А. Бендерский, Р.М. Waterstrat, J. Alloys Comp. 252 (1997) L5 – L7. [4] Н.Ohnishi, T. Onozuka, M. Hirabayashi, J. Mater. Sci. 26 (1991) 2219–2228. [5] К. Чензуаль, Дж. Л. Джорда, Э. Парте, Acta Cryst. C44 (1988) 14–18. [6] К. Чензуаль, Э. Парте, Acta Cryst. C42 (1986) 1101–1105. [7] Л.А. Бендерский, Я.К. Сталик, Р. Waterstrat, J. Alloys Comp. 201 (1993) 121–126. [8] С.Ф. Дубинен, А. Лотков, С.Г.Теплоухов, В. Гришков, В. Скоробогатов. Встретились. Металлогр. 73 (1992) 401–405.
[9] B.H. Чен, Х.Ф. Франзен, J. Менее распространенный Met 153 (1989) L13– L19. [10] Б.H. Chen, H.F. Franzen, J. Less-Common Met. 158 (1990) L11. [11] Р.М. Waterstrat, R. Kuentzler, J. Muller, J. Less-Common Met. 167 (1990) 169–178. [12] Л.М. Щетки, Науки. Являюсь. 241 (1979) 74–82. [13] Х. Линь, Х. Ляо, J.L. He, K.C. Чен, К. Линь, Мет. Матер. Пер. 28A (1997) 1871–1877. [14] Д.Ю. Ли, Scripta Metall. 34 (1996) 195–200. [15] Р.М. Waterstrat, Platinum Met. Ред. 37 (1993) 194–196. [16] Андерко К., З. Мет. 50 (1959) 681–686. [17] П. Вилларс, Л.Д. Calvert, Pearsons Handbook of Crystallographic Data for Intermetallic Phases, Vol.4, ASM International, Metals Park, OH, 1991. [18] W.B. Пирсон, Справочник по промежуткам между решетками и структурам металлов, Vol. 2, Pergamon Press, 1967. [19] M. Norman, I.R. Харрис, J. Менее распространенный Met. 18 (1969) 333–345. [20] Дж. К. Сталик, Р. Waterstrat, будет опубликовано в 1998 г. [21] Л.А. Бендерский, Дж. Сталик, Р. Портье, Р. Waterstrat, J. Alloys Comp. 236 (1996) 19–25. [22] Х. Окамото, Т. Massalski, J. Phase Equilibr. 14 (3) (1993) 334–335. [23] Х. Окамото, Т. Massalski, J. Phase Equilibr.15 (5) (1994) 515. [24] P. Oelhafer, E. Hauser, H.J. Guntherodt, Phys. Rev. Lett. 43 (1979) 1134–1137. [25] J.L. Glinois, C. Becle, G. Develey, J.M. Moreau, J. Less-Common Met. 64 (1979) 87–90. [26] С.С. Панда, С. Бхан, J. Less-Common Met. 34 (1974) 344–347. [27] Т. Себури, С. Ненно, Т. Фукуда, J. Less-Common Met. 125 (1986) 157–166. [28] W.B. Пирсон, в: Кристаллохимия и физика металлов и сплавов, Джон Вили, 1972, стр. 589–592. [29] Савицкий Э. Полякова, Б. Кридин, А.А. Козлов, Э.Хорлин М. // Диагр. Сост. Встретились. Система, М .: Наук, 1971. С. 200–203. [30] M. Lomello-Tafin, P. Galez, J.C. Gachon, P. Feschotte, J.L. Jorda, J. Alloys Comp. 257 (1997) 215–223. [31] A.J.S. Трайбер, П.Е.А. Турчи, Р. Уотерстрат, С. Allen, J. Phys. Конденс. Дело 8 (1996) 6357–6379. [32] С.А.Шабаловская, Phys. Стат. Sol. (б) 132 (1985) 327–344. [33] Д. Пул, W. Hume-Rothery, J. Inst. Встретились. 83 (1955) 473–480. [34] J.L. Jorda, T. Graf, L. Schellenberg, J. Muller, K. Cenzual, J.C.Gachon, J. Hertz, J. Less-Common Met. 136 (1988) 313–328. [35] Р.М. Waterstrat, J.K. Stalick, X. Meng-Burany, A.E. Curzon, M.A. Estermann, Scripta Met. 33 (1995) 695–703.
Нарисуйте атомную орбитальную диаграмму нейтрального атома циркония и используйте Какие электроны должны быть ионизированы для образования этих катионов?
Стенограмма видео
Итак, теперь мы работаем над восьмой главой “Не ждать”. И этой задаче попросили написать электронную конфигурацию шести ионов Ket, которые образовались из серы в результате потери 16 электронов, а для чайника вместо неоплаченных электронов попросили написать орбитальную так, чтобы мы могли начать с серебра.Кроме того, у нас будет конфигурация благородного газа неона. Затем у нас есть три секунды до нейтрали. У серы было бы четыре p-электрона, но у серы плюс три PM-нейтрона. И поэтому мы можем продолжить чтение электронных конфигураций, последовательно удаляя электрон с P-орбитали. Таким образом, для нас от трех до трех с плюсом, у нас есть три с 2331 для четырех с плюсом. Мы после неона. У нас есть три с лишним на пять с плюсом. Мы собираемся начать удаление с южной орбиты. Итак, у вас есть три правильных.И за шесть с лишним мы потеряли все валентные электроны, и теперь у нас есть только конфигурация благородного газа Миа. Итак, теперь нам нужно написать орбитальные диаграммы для видов, у которых есть неоплаченные электроны, и поэтому мы можем видеть серу. Плюс у нас будут неоплаченные электроны и P-орбиталь, а также два и три плюс все на чистом металле, так как у CE четыре плюс нет неоплаченных электронов. И как пять с плюсом, у нас будет бесплатный электрон в эскорте, чтобы мы могли начать здесь. У нас есть плюс, у вас есть конфигурация благородного газа неона.Находился на трехлетней орбите. У нас было подготовлено два электрона и три р. У нас будет три параллельных спина. Согласно правилу Ханта в S два плюс, у нас нет газовой конфигурации неона. У нас есть три s-орбитали к спаренным электронам и три p-орбиты. Или нам понадобятся электроны, которые будут иметь опасные спины и будут в паре для S-3 плюс кошачий глаз. У меня есть газовая конфигурация. У нас есть три s с двумя электронами и три p с одним электроном, которые, конечно, сравниваются.И, наконец, последняя конфигурация ah с неоплаченным электроном – это пять плюс, где у нас есть неон. А затем на трех орбитали, у нас просто один электрон
Цирконий снимает напряжение с углеродных колец
Необычная молекула, которая когда-то считалась слишком напряженной, чтобы существовать, была преобразована в другое искаженное соединение химиками RIKEN, проверяющими пределы того, насколько сильно углеродные молекулы могут быть искажены путем объединения их с атомами металлов.
Сложность органической химии во многом обусловлена тенденцией атомов углерода объединяться в цепи и кольца. Тем не менее, тройные углерод-углеродные связи (–C≡C–, также известные как алкины) относительно редки в кольцевых системах, потому что они предпочитают соединяться с другими атомами прямыми линиями.
Почти возможно изогнуть эту алкиновую группу так, что она войдет в кольцо из семи атомов углерода. Но кольца меньшего размера чрезвычайно реактивны из-за нагрузки на тройную связь, объясняет Нориюки Судзуки из Института перспективных исследований RIKEN в Вако.«Считалось, что их невозможно изолировать в чистом виде», – говорит он.
Однако в 2002 году команда Сузуки сообщила, что они создали кольцо всего из пяти атомов, которое включает алкиновую группу, но при этом чрезвычайно стабильно и может быть выделено в виде кристаллов. Их секрет заключался в том, что одним из атомов в кольце был атом циркония 1 .
Исследователи сейчас изучают, как ведет себя эта молекула. Недавно они использовали его для создания другой кольцевой системы, содержащей две углерод-углеродные двойные связи, сидящие бок о бок (–C = C = C–), также известную как аллен.При нормальных обстоятельствах пятичленное кольцо, содержащее аллен, было бы слишком напряженным, чтобы существовать в течение длительного времени, но при наличии атома циркония команда обнаружила, что соединение циклоаллена может быть выделено (рис. 1).
Команда сделала это соединение, смешав литий или калий с раствором их цирконий-алкинового кольца, что дало ему отрицательный заряд и темно-синий цвет. Добавление реагента, такого как йодметан, затем привело к образованию циклоаллена – хотя команда была удивлена, что добавление источника атомов водорода привело к образованию смеси циклоаллена и циклоалкена, которая содержала только одну двойную связь углерод-углерод 2 .
Судзукиутверждает, что эти соединения вряд ли найдут какое-либо практическое применение. Вместо этого исследования раздвигают границы химии, которые когда-то считались невозможными.

 Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.