Электронная формула и схема строения атома. Строение электронной оболочки атома
Давайте рассмотрим, как построен атом. Учитывайте, что речь будет вестись исключительно о моделях. На практике атомы представляют собой гораздо более сложную структуру. Но благодаря современным разработкам мы имеем возможность объяснять и даже успешно предсказывать свойства (пускай даже и не все). Итак, какова схема строения атома? Из чего он «сделаны»?
Планетарная модель атома
Впервые была предложена датским физиком Н. Бором в 1913 году. Это первая теория строения атома, основанная на научных фактах. К тому же она положила основу современной тематической терминологии. В ней электроны-частицы производят вращательные движения вокруг атома по такому же принципу, как планеты вокруг Солнца. Бор высказал предположение, что они могут существовать исключительно на орбитах, находящихся на строго определённом расстоянии от ядра. Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Волновая модель атома
Но со временем планетарная модель подверглась пересмотру. Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример – в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%. На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Понятие вероятности в данном случае
Почему был использован этот термин? Гейзенбергом в 1927 г. был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры. И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Состав атома
Но давайте сконцентрируемся на всём объекте рассмотрения. Итак, кроме неплохо рассмотренной электронной оболочки, второй составляющей атома является ядро. Оно состоит из позитивно заряженных протонов и нейтральных нейтронов. Все мы знакомы с таблицей Менделеева. Номер каждого элемента соответствует количеству протонов, что в нём есть. Количество нейтронов равняется разнице между массой атома и его количеством протонов. Могут и быть отклонения от этого правила. Тогда говорят о том, что присутствует изотоп элемента. Схема строения атома такова, что его «окружает» электронная оболочка. обычно равняется количеству протонов. Масса последнего примерно в 1840 раз больше, чем у первого, и примерно равна весу нейтрона. Радиус ядра составляет около 1/200000 диаметра атома. Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Орбиты
Говоря о том, что такое схема строения атома, нельзя умолчать о них. Итак, есть такие виды:
- s. Имеют сферическую форму.
- p. Являются похожими на объемные восьмерки или веретено.
- d и f. Имеют сложную форму, которая с трудом описывается формальным языком.
Электрон каждого типа можно с вероятностью в 95% найти на территории соответствующей орбитали. К представленной информации необходимо относиться спокойно, поскольку это, скорее, абстрактная математическая модель, нежели физическое реальное положение дел. Но при всём этом она обладает хорошей предсказательной силой относительно химических свойств атомов и даже молекул. Чем дальше от ядра расположен уровень, тем больше электронов можно на нём разместить. Так, количество орбиталей можно подсчитать с помощью специальной формулы: х 2 .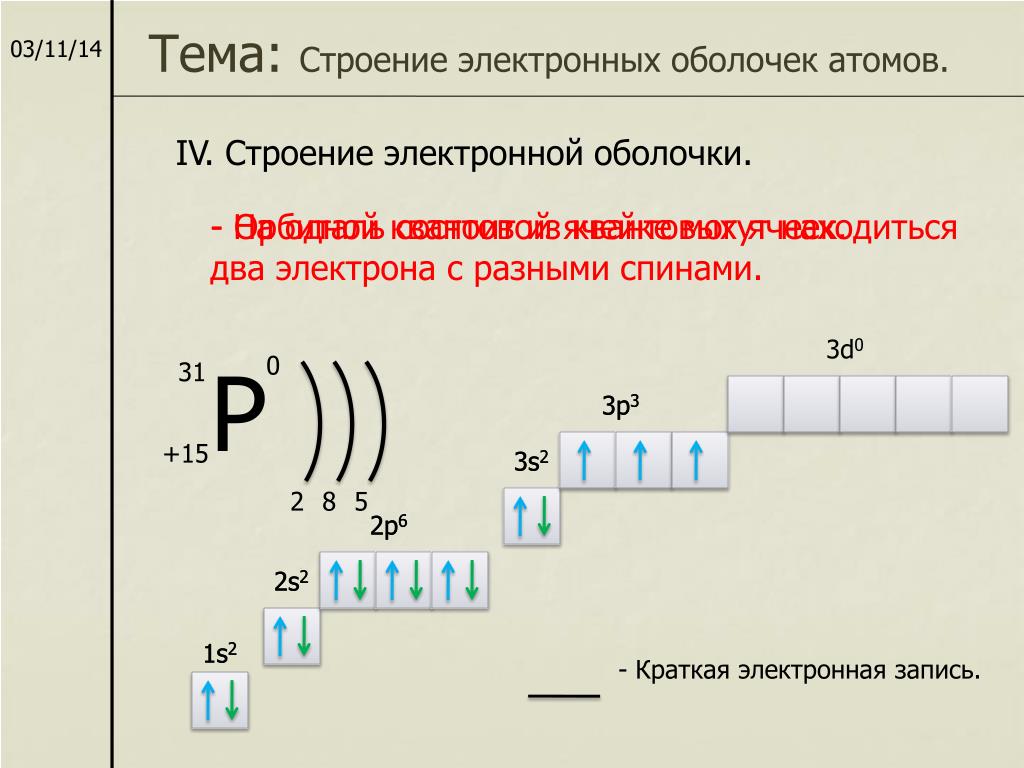
Орбиты: технические данные
Если говорить про строение атома фтора, то он будет иметь три орбитали. Все они будут заполнены. Энергия орбиталей в рамках одного подуровня одинакова. Чтобы их обозначить, добавляют номер слоя: 2s, 4p, 6d. Возвращаемся к разговору про строение атома фтора. У него будет два s- и один p-подуровень. У него девять протонов и столько же электронов. Сначала один s-уровень. Это два электрона. Потом второй s-уровень. Ещё два электрона. И 5 заполняют p-уровень. Вот такое у него строение. После прочтения следующего подзаголовка можно собственноручно проделать необходимые действия и убедиться в этом. Если говорить про к которым относится и фтор, то следует отметить, что они, хотя и в одной группе, полностью различаются по своим характеристикам. Так, их температура кипения колеблется от -188 до 309 градусов Цельсия. Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью. Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью. Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Как заполняются орбиты?
По каким правилам и принципам располагаются электроны? Предлагаем ознакомиться с тремя основными, формулировка которых была упрощена для лучшего понимания:
- Принцип наименьшей энергии. Электронам свойственно заполнять орбитали в порядке увеличения их энергии.
- Принцип Паули. На одной орбитали не может располагаться больше двух электронов.
- Правило Хунда. В пределах одного подуровня электроны заполняют сначала свободные орбитали, и только потом образуют пары.
В деле заполнения поможет и строение атома в таком случае станет более понятным в плане изображения. Поэтому при практической работе с построением схем элементов, необходимо держать её под рукой.
Пример
Для того, чтобы обобщить всё сказанное в рамках статьи, можно составить образец, как же распределяются электроны атома по своим уровням, подуровням и орбиталям (то есть, какой является конфигурация уровней). Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень.
Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Заключение
Как видите, строение атома – не такая сложная тема (если подходить к ней с позиции школьного курса химии, конечно). И понять данную тему не составляет труда. Напоследок хочется сообщить про некоторые особенности. К примеру, говоря про строение атома кислорода, мы знаем, что он имеет восемь протонов, и 8-10 нейтронов. И так как все в природе стремится к равновесию, два атома кислорода образуют молекулу, где два непарных электрона образуют ковалентную связь. Подобным же образом образуется другая стойкая молекула кислорода – озон (O 3). Зная строение атома кислорода, можно правильно составлять формулы окислительных реакций, в которых участвует самое распространенное на Земле вещество.
Так как при химических реакциях ядра
реагирующих атомов остаются без изменений
(за исключением радиоактивных превращений),
то химические свойства атомов зависят
от строения их электронных оболочек.
Рис. 4.5 . Схема подразделения энергетических уровней на подуровни
Основы теории электронного строения атома сводятся к следующим положениям: состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: главным квантовым числом n = 1, 2, 3, ; орбитальным (азимутальным)l=0,1,2, n–1 ; магнитнымm
Согласно принципу Паули , в одном и
том же атоме не может быть двух электронов,
обладающих одинаковой совокупностью
четырех квантовых чиселn,
l, m l ,
m s ; совокупности электронов с одинаковыми
главными квантовыми числами n образуют
электронные слои, или энергетические
уровни атома, нумеруемые от ядра и
обозначаемые какK,
L, M, N, O, P, Q , причем в энергетическом
слое с данным значениемn могут находиться не более, чем2n 2 электронов. Совокупности электронов с одинаковыми
квантовыми числами
Совокупности электронов с одинаковыми
квантовыми числами
Вероятностное нахождение положения электрона в пространстве вокруг атомного ядра соответствует принципу неопределенностей Гейзенберга. По квантовомеханическим представлениям, электрон в атоме не имеет определенной траектории движения и может находиться в любой части пространства вокруг ядра, а различные его положения рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью . В нем заключено порядка 90% электронного облака. Каждому подуровню1s, 2s, 2p и т.д. соответствует определенное количество орбиталей определенной формы. Например,
 4.6 ).
4.6 ).Рис. 4.6 . Форма и ориентация электронных орбиталей.
При химических реакциях атомное ядро не претерпевает изменений, изменяются лишь электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. На основе теории электронного строения атома был установлен глубокий физический смысл периодического закона химических элементов Менделеева и создана теория химической связи.
Теоретическое обоснование периодической системы химических элементов включает в себя данные о строении атома, подтверждающие существование связи между периодичностью изменения свойств химических элементов и периодическим повторением сходных типов электронных конфигураций их атомов.
В свете учения о строении атома становится
обоснованным разделение Менделеевым
всех элементов на семь периодов: номер
периода соответствует числу энергетических
уровней атомов, заполняемых электронами.
В малых периодах с ростом положительных
заряда ядер атомов возрастает число
электронов на внешнем уровне (от 1 до 2
в первом периоде, и от 1 до 8 во втором и
третьем периодах), что объясняет изменение
свойств элементов: в начале периода
(кроме первого) находится щелочной
металл, затем наблюдается постепенное
ослабление металлических свойств и
усиление неметаллических.
Таблица 4.2.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что и объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов.
Одинаковый характер свойств химических элементов в подгруппах объясняется сходным строением внешнего энергетического уровня, как это показано в табл. 4.3 , иллюстрирующей последовательность заполнения электронами энергетических уровней для подгрупп щелочных металлов.
Таблица 4.3.
Номер группы, как правило, указывает на
число электронов в атоме, которые могут
участвовать в образовании химических
связей. В этом заключается физический
смысл номера группы. В четырех местах
периодической системы элементы
расположены не в порядке возрастания
атомных масс: Ar иK ,Co иNi ,T e иI ,Th иPa .
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В 1891 г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь». Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с.) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с.) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится . Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра .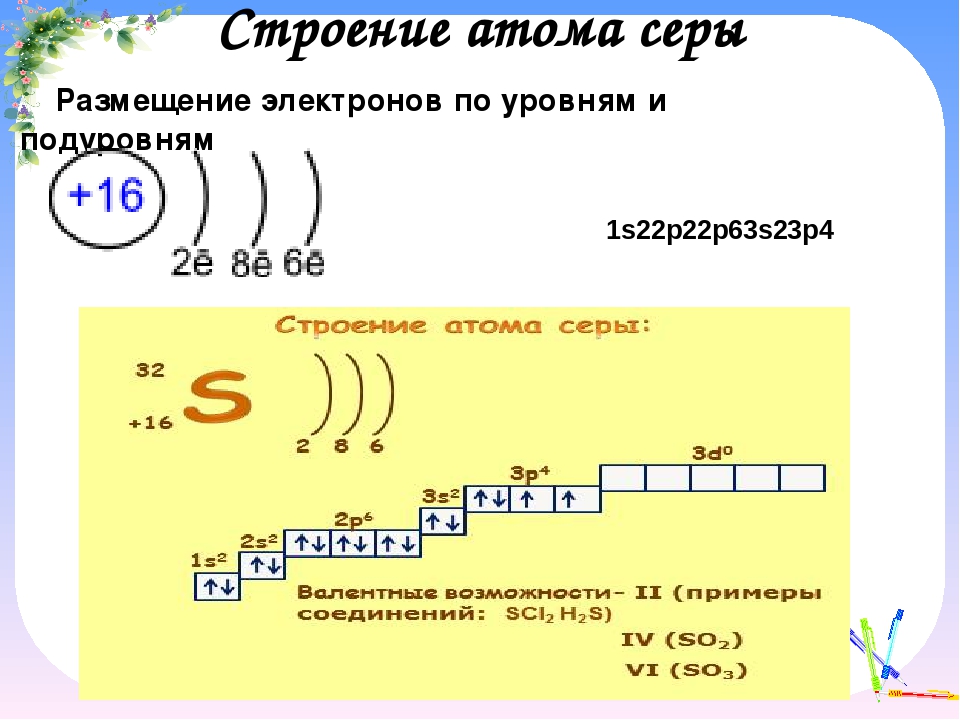
Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено приблизительно 90 % электронного облака , и это означает, что около 90 % времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей , которые обозначаются латинскими буквами s, p, d и f . Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром . Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, – 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n 2 ,
где N – максимальное число электронов; n – номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором – не более 8; на третьем – не более 18; на четвертом – не более 32.
Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором – не более 8; на третьем – не более 18; на четвертом – не более 32.
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй – два; третий – три; четвертый – четыре подуровня . Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, p, d, f.
Протоны и нейтроныАтом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной .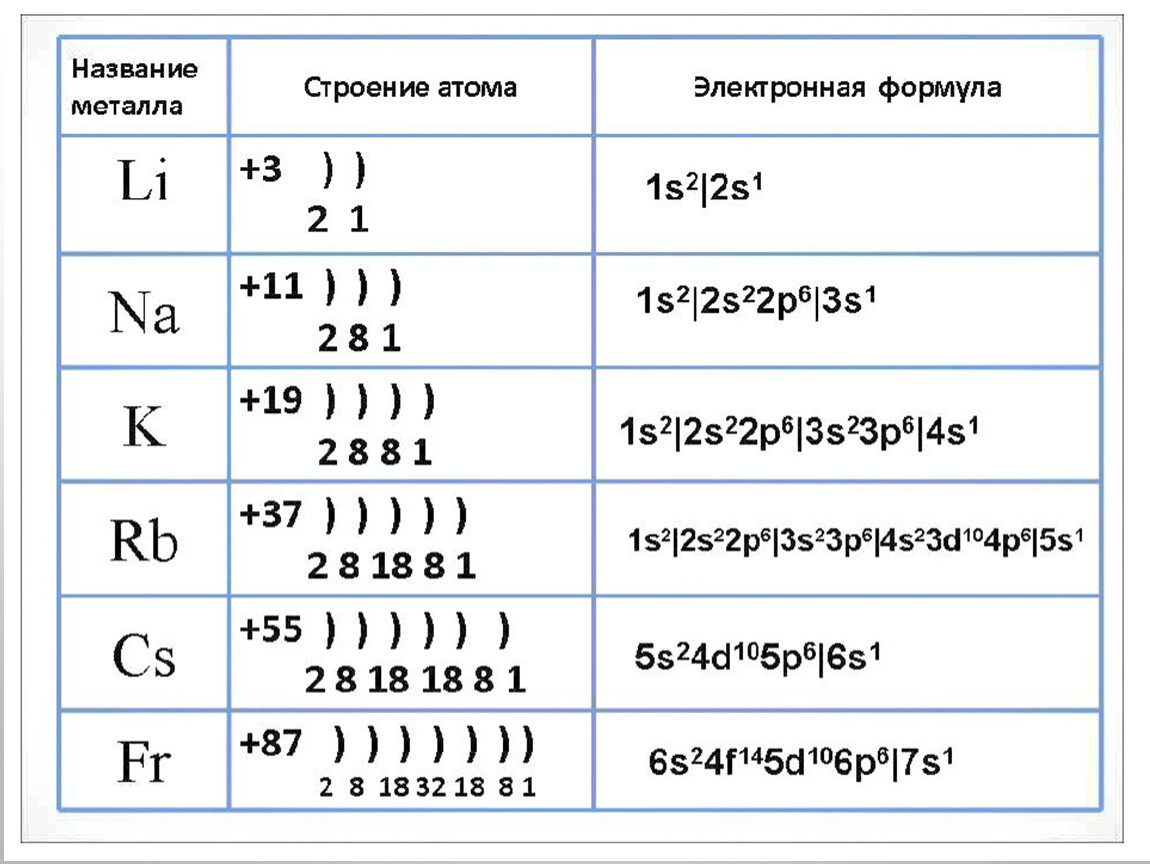
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов – протонов и нейтронов .
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus – ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом . Например, массовое число атома алюминия:
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e — .
Поскольку атом электронейтрален , то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе.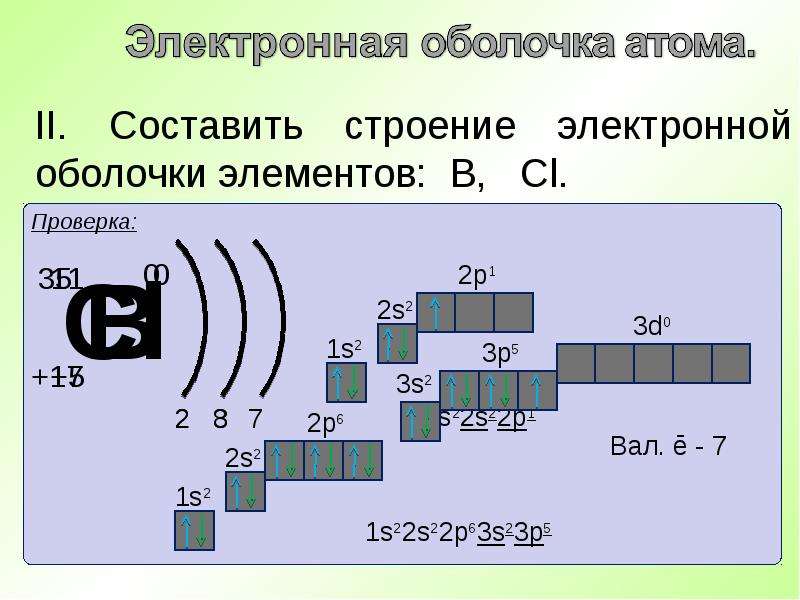 Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
N = A — Z
Например, число нейтронов в атоме железа равно:
56 — 26 = 30
ИзотопыРазновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами . Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород – три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.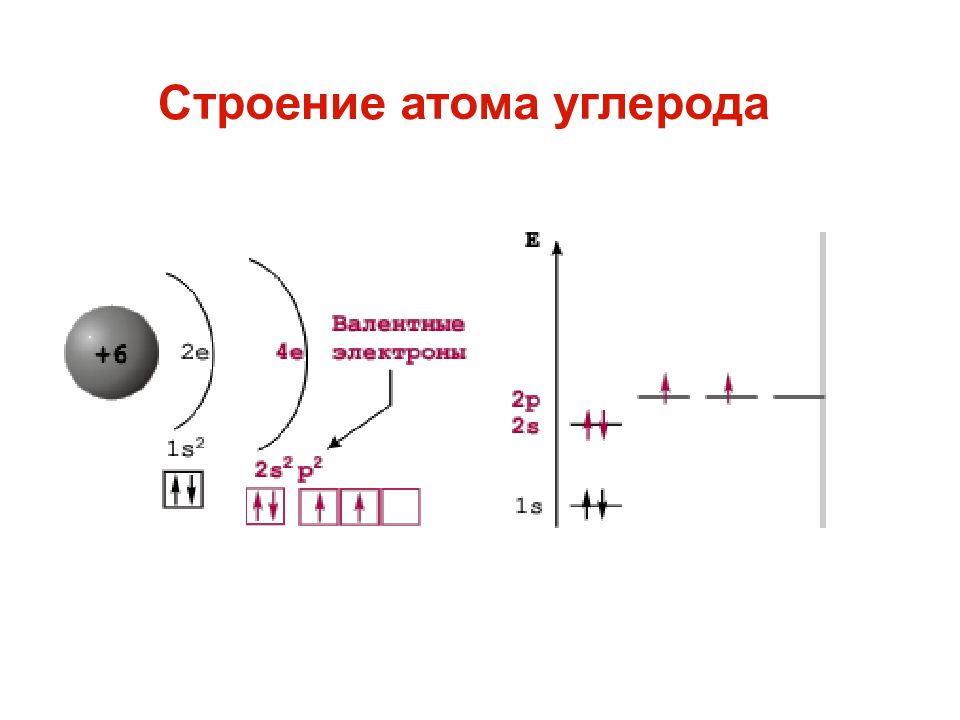
Схема электронного строения атома водорода:
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен – в нем 2 электрона. Водород и гелий – s-элементы; у этих атомов заполняется электронами s-орбиталь.
У всех элементов второго периода первый электронный слой заполнен , и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен – в нем 8 электронов.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s- электронная орбиталь. Na и Mg – s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar – р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са – s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.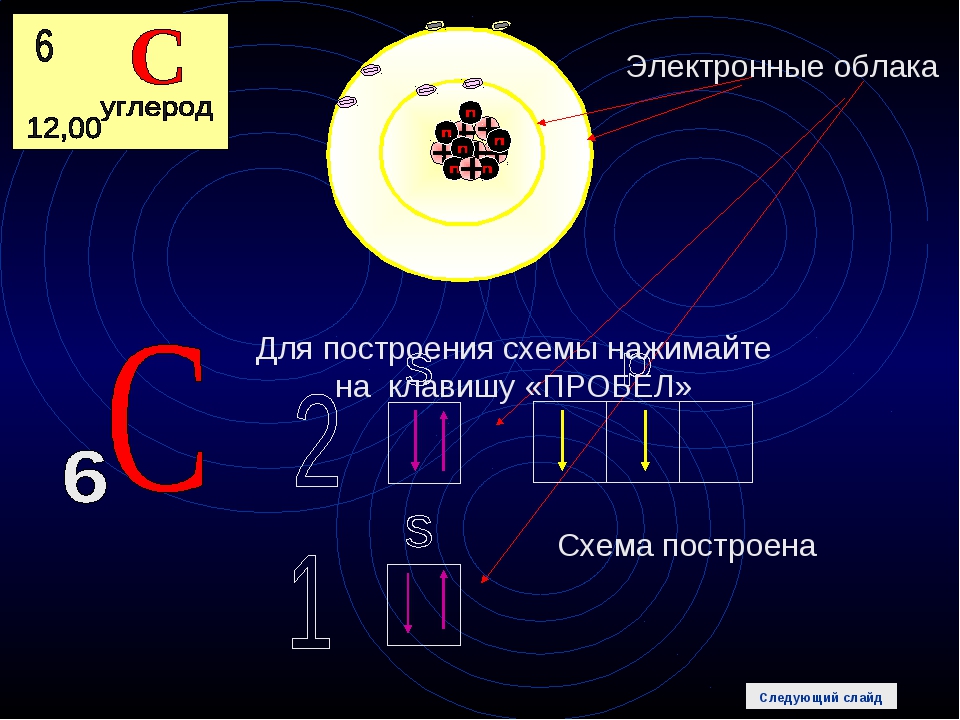
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10:
В атоме цинка третий электронный слой завершен – в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr – р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.У элементов пятого периода идет заполнение по-дуровней в следующем порядке: 5s — 4d — 5р. И так-же встречаются исключения, связанные с «провалом » электронов, у 41 Nb, 42 Мо, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55 Cs и 56 Ва – 6s-элементы; 57 La … 6s 2 5d x – 5d-элемент; 58 Се – 71 Lu – 4f-элементы; 72 Hf — 80 Hg – 5d-элементы; 81 Т1 — 86 Rn – 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т. е. nf 7 и nf 14 . В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
- s-элементы . Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
- p-элементы .
 Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
- d-элементы . Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I-VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
- f-элементы . Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского – «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки.
Этот принцип носит название принципа Паули . Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек – записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда , согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
Правило Хунда и принцип Паули
Правило Хунда – правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.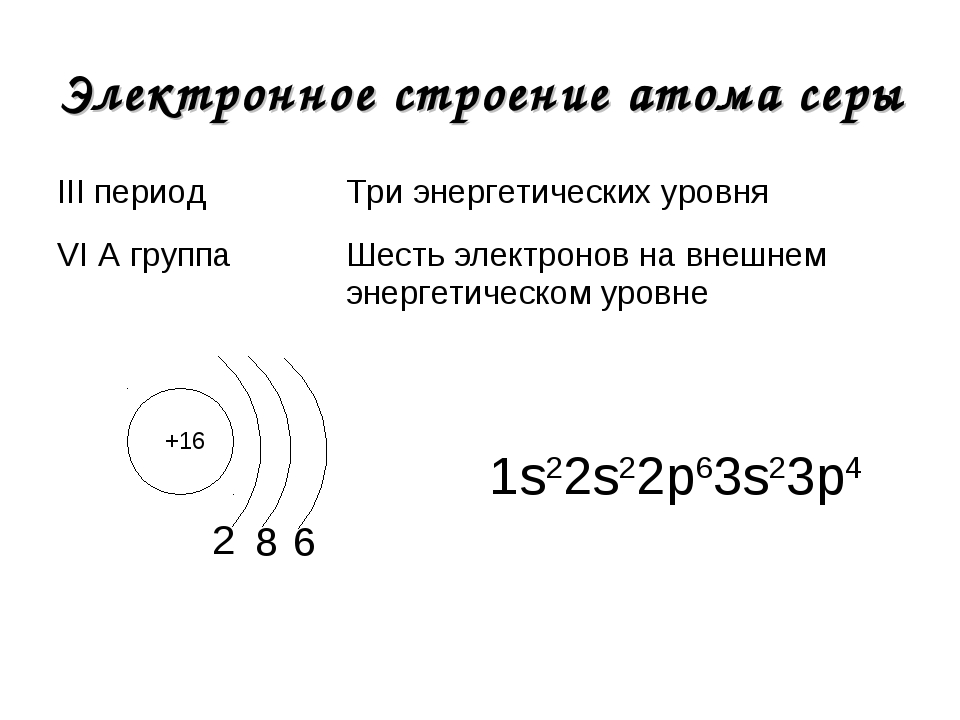 Сформулировано Фридрихом Хундом в 1925 году.
Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка : Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
- Мультиплетность максимальна
- При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p -элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками – электроны, причём направление стрелки обозначает ориентацию спина).
Правило Клечковского
Правило Клечковского — по мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l.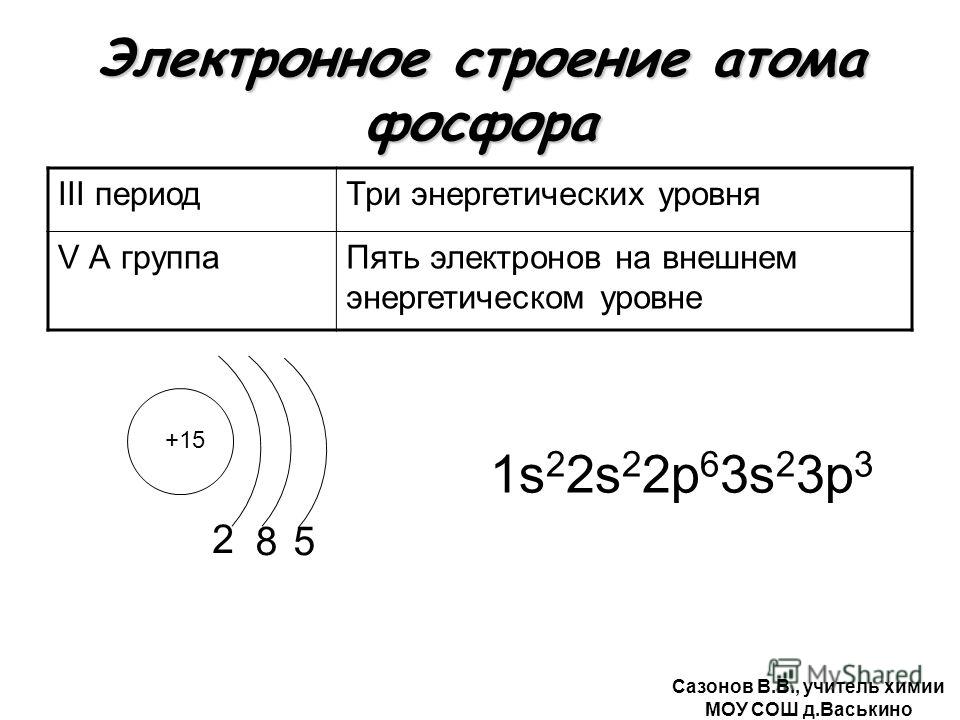 Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречатреальной энергетической последовательности атомых орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слояна d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, аименно: после заполнения двумя электронами орбитали 6s
Любое вещество состоит из очень маленьких частиц, называемых атомами . Атом-это наименьшая частица химического элемента, сохраняющая все его характерные свойства. Чтобы представить себе размеры атома, достаточно сказать что если бы их удалось уложить вплотную один к другому, то один миллион атомов занял бы расстояние всего в 0,1 мм.
Дальнейшее развитие науки о строении вещества показало, что атом также имеет сложное строение и состоит из электронов и протонов. Так возникла электронная теория строения вещества.
В глубокой древности было обнаружено, что существуют два рода электричества: положительное и отрицательное. Количество электричества, содержащееся в теле, стали называть зарядом. В зависимости от рода электричества, которым обладает тело, заряд может быть положительным или отрицательным.
Было также установлено опытным путем, что одноименные заряды отталкиваются, а разноименные притягиваются.
Рассмотрим электронное строение атома . Атомы состоят из еще более мелких частиц, чем они сами, называемых электронами .
ОПРЕДЕЛЕНИЕ: Электрон – это мельчайшая частица вещества, имеющая наименьший отрицательный электрический заряд.
Электроны вращаются вокруг центрального ядра, состоящего из одного или более протонов и нейтронов , по концентрическим орбитам. Электроны являются отрицательно заряженными частицами, протоны – положительными, а нейтроны – нейтральными (рисунок 1.1).
Электроны являются отрицательно заряженными частицами, протоны – положительными, а нейтроны – нейтральными (рисунок 1.1).
ОПРЕДЕЛЕНИЕ: Протон – мельчайшая частица вещества, имеющая наименьший положительный электрический заряд.
Существование электронов и протонов не вызывает никакого сомнения. Ученые не только определили массу, заряд и размеры электронов и протонов, но даже заставили их работать в различных электрических и радиотехнических приборах.
Было также установлено, что масса электрона зависит от скорости его движения и что электрон не только поступательно движется в пространстве, но и вращается вокруг своей оси.
Наиболее простым по своему строению является атом водорода (рис. 1.1). Он состоит из ядра-протона и вращающегося с огромной скоростью вокруг ядра электрона, образующего внешнюю оболочку (орбиту) атома. Более сложные атомы имеют несколько оболочек, по которым вращаются электроны.
Эти оболочки последовательно от ядра заполняются электронами (рисунок 1. 2).
2).
Теперь разберем . Самая внешняя оболочка называется валентной , а число электронов, содержащееся в ней, называется валентностью . Чем дальше находится от ядра валентная оболочка, следовательно, тем меньшую силу притяжения испытывает каждый валентный электрон со стороны ядра. Тем самым у атома увеличивается возможность присоединять к себе электроны в том случае, если валентная оболочка не заполнена и расположена далеко от ядра, либо терять их.
Электроны внешней оболочки могут получать энергию. Если электроны находящиеся в валентной оболочке получат необходимый уровень энергии от внешних сил, они могут оторваться от нее и покинуть атом, то есть стать свободными электронами. Свободные электроны способны произвольно перемещаться от одного атома к атому. Те материалы, в которых содержится большое число свободных электронов, называются проводниками .
Изоляторы , есть противоположность проводникам. Они препятствуют протеканию электрического тока. Изоляторы стабильны потому, что валентные электроны одних атомов заполняют валентные оболочки других атомов, присоединяясь к ним. Это препятствует образованию свободных электронов.
Изоляторы стабильны потому, что валентные электроны одних атомов заполняют валентные оболочки других атомов, присоединяясь к ним. Это препятствует образованию свободных электронов.
Промежуточное положение между изоляторами и проводниками занимают полупроводники , но о них мы поговорим позже
Рассмотрим свойства атома . Атом, который имеет одинаковое число электронов и протонов, электрически нейтрален. Атом, получающий один или более электронов, становится отрицательно заряженным и имеет название отрицательный ион. Если атом теряет один или более электронов, то он становится положительным ионом, то есть заряжается положительно.
Записывается в виде так называемых электронных формул. В электронных формулах буквами s, p, d, f обозначаются энергетические подуровни электронов; цифры впереди букв означают энергетический уровень, в котором находится данный электрон, а индекс вверху справа – число электронов на данном подуровне. Чтобы составить электронную формулу атома любого элемента, достаточно знать номер данного элемента в периодической системе и выполнить основные положения, которым подчиняется распределение электронов в атоме.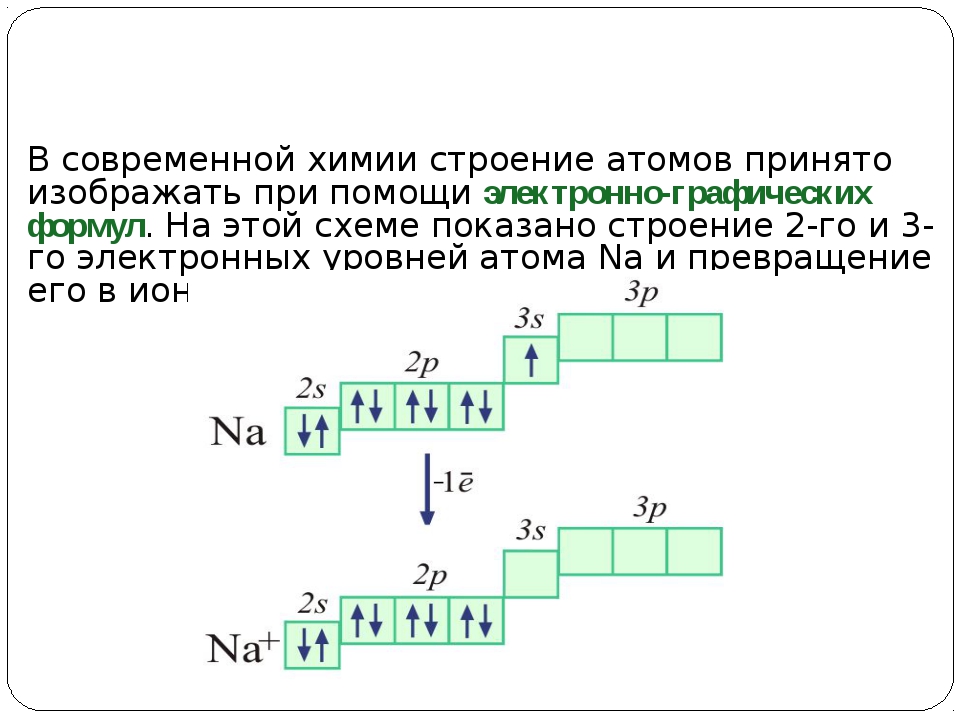
Структура электронной оболочки атома может быть изображена и в виде схемы размещения электронов по энергетическим ячейкам.
Для атомов железа такая схема имеет следующий вид:
На этой схеме наглядно видно выполнение правила Гунда . На Зd-подуровне максимальное количество, ячеек (четыре) заполнено неспаренными электронами. Изображение структуры электронной оболочки в атоме в виде электронных формул и в виде схем наглядно не отражает волновых свойств электрона.
Формулировка периодического закона в редакции Д.А. Менделеева : свойства простых тел, а так же формы и свойства соединений элементов находятся в периодической зависимости величины атомных весов элементов.
Современная формулировка Периодического закона : свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра их атомов.
Таким образом, положительный заряд ядра (а не атомная масса) оказался более точным аргументом, от которого зависят свойства элементов и их соединений
Валентность – это число химических связей, которым один атом связан с другим.
Валентные возможности атома определяются числом неспаренных электронов и наличием на внешнем уровне свободных атомных орбиталей. Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Стехиометрическая валентность химического элемента– это число эквивалентов, которое может к себе присоединить данный атом, или – число эквивалентов в атоме.
Эквиваленты определяются по числу присоединённых или замещённых атомов водорода , поэтому стехиометрическая валентность равна числу атомов водорода, с которыми взаимодействует данный атом. Но свободно взаимодействуют не все элементы, а с кислородом – практически все, поэтому стехиометрическую валентность можно определить как удвоенное число присоединённых атомов кислорода.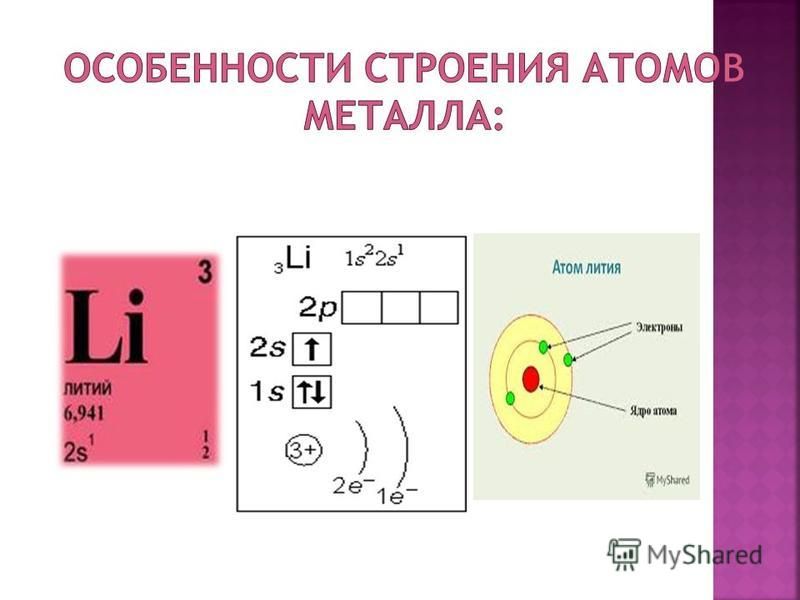
Например, стехиометрическая валентность серы в сероводороде H 2 S равна 2, в оксиде SO 2 – 4 , в оксиде SO 3 -6.
При определении стехиометрической валентности элемента по формуле бинарного соединения следует руководствоваться правилом: суммарная валентность всех атомов одного элемента должна быть равна суммарной валентности всех атомов другого элемента.
Степень окисления также характеризует состав вещества и равна стехиометрической валентности со знаком плюс (для металла или более электроположительного элемента в молекуле) или минус.
1. В простых веществах степень окисления элементов равна нулю.
2. Степень окисления фтора во всех соединениях равна -1. Остальные галогены (хлор, бром, иод) с металлами, водородом и другими более электроположительными элементами тоже имеют степень окисления -1, но в соединениях с более электроотрицательными элементами они имеют положительные значения степеней окисления.
3. Кислород в соединениях имеет степень окисления -2; исключением являются пероксид водорода Н 2 О 2 и его производные (Na 2 O 2 , BaO 2 и т.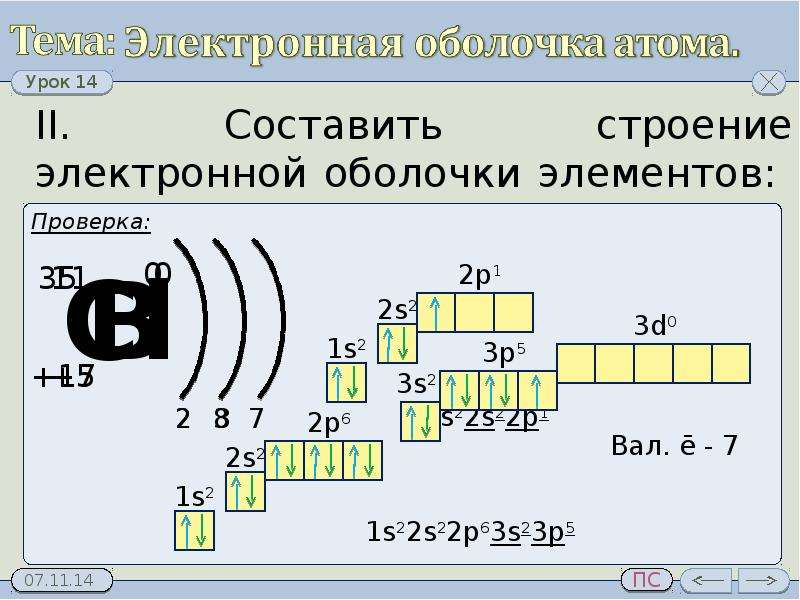 п., в которых кислород имеет степень окисления -1, а также фторид кислорода OF 2 , степень окисления кислорода в котором равна +2.
п., в которых кислород имеет степень окисления -1, а также фторид кислорода OF 2 , степень окисления кислорода в котором равна +2.
4. Щелочные элементы (Li, Na, K и др.) и элементы главной подгруппы второй группы Периодической системы (Be, Mg, Ca и др.) всегда имеют степень окисления, равную номеру группы, то есть +1 и +2, соответственно.
5. Все элементы третьей группы, кроме таллия имеют постоянную степень окисления, равную номеру группы, т.е. +3.
6. Высшая степень окисления элемента равна номеру группы Периодической системы, а низшая – разности: № группы – 8. Например, высшая степень окисления азота (он расположен в пятой группе) равна +5 (в азотной кислоте и её солях), а низшая равна -3 (в аммиаке и солях аммония).
7. Степени окисления элементов в соединении компенсируют друг друга так, что их сумма для всех атомов в молекуле или нейтральной формульной единице равна нулю, а для иона – его заряду.
Эти правила можно использовать для определения неизвестной степени окисления элемента в соединении, если известны степени окисления остальных, и составления формул многоэлементных соединений.
Сте?пень окисле?ния (окислительное число, ) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность . Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов).
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома:
Al 3+ + 3e − → Al
S 2− → S + 2e − (S 2− − 2e − → S)
Свойства элементов, зависящие от строения электронной оболочки атома, изменяются по периодам и группам периодической системы. Поскольку в ряду элементов-аналогов электронные структуры лишь сходны, но не тождественны, то при переходе от одного элемента в группе к другому для них наблюдается не простое повторение свойств, а их более или менее отчетливо выраженное закономерное изменение.
Поскольку в ряду элементов-аналогов электронные структуры лишь сходны, но не тождественны, то при переходе от одного элемента в группе к другому для них наблюдается не простое повторение свойств, а их более или менее отчетливо выраженное закономерное изменение.
Химическая природа элемента обусловлена способностью его атома терять или приобретать электроны. Эта способность количественно оценивается величинами энергий ионизации и сродства к электрону.
Энергией ионизации (Eи ) называется минимальное количество энергии, необходимое для отрыва и полного удаления электрона из атома в газовой фазе при T = 0
K без передачи освобожденному электрону кинетической энергии с превращением атома в положительно заряженный ион: Э + Eи = Э+ + e-. Энергия ионизации является положительной величиной и имеет наименьшие значения у атомов щелочных металлов и наибольшие у атомов благородных (инертных) газов.
Сродством к электрону (Ee ) называется энергия, выделяемая или поглощаемая при присоединении электрона атому в газовой фазе при T = 0
K с превращением атома в отрицательно заряженный ион без передачи частице кинетической энергии:
Э + e- = Э- + Ee.
Максимальным сродством к электрону обладают галогены, особенно фтор (Ee = -328 кДж/моль).
Величины Eи и Ee выражают в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ).
Способность связанного атома смещать к себе электроны химических связей, повышая около себя электронную плотность называется электроотрицательностью.
Это понятие в науку введено Л. Полингом . Электроотрицательность обозначается символом ÷ и характеризует стремление данного атома к присоединению электронов при образовании им химической связи.
По Р. Маликену электротрицательность атома оценивается полусуммой энергий ионизации и сродства к электрону свободных атом÷ = (Ee + Eи)/2
В периодах наблюдается общая тенденция роста энергии ионизации и электроотрицательности с ростом заряда ядра атома, в группах эти величины с увеличением порядкового номера элемента убывают.
Следует подчеркнуть, что элементу нельзя приписать постоянное значение электроотрицательности, так как оно зависит от многих факторов, в частности от валентного состояния элемента, типа соединения, в которое он входит, числа и вида атомов-соседей.
Атомные и ионные радиусы . Размеры атомов и ионов определяются размерами электронной оболочки. Согласно квантово-механическим представления электронная оболочка не имеет строго определенных границ. Поэтому за радиус свободного атома или иона можно принять теоретически рассчитанное расстояние от ядра до положения главного максимума плотности внешних электронных облаков. Это расстояние называется орбитальным радиусом. На практике обычно используют значения радиусов атомов и ионов, находящихся в соединениях, вычисленные исходя из экспериментальных данных. При этом различают ковалентные и металлические радиусы атомов.
Зависимость атомных и ионных радиусов от заряда ядра атома элемента и носит периодический характер . В периодах по мере увеличения атомного номера радиусы имеют тенденцию к уменьшению. Наибольшее уменьшение характерно для элементов малых периодов, поскольку у них заполняется внешний электронный уровень. В больших периодах в семействах d- и f- элементов это изменение менее резкое, так как у них заполнение электронов происходит в предпредвнешнем слое. В подгруппах радиусы атомов и однотипных ионов в общем увеличиваются.
В подгруппах радиусы атомов и однотипных ионов в общем увеличиваются.
Периодическая система элементов есть наглядный пример проявления различного рода периодичности в свойствах элементов, которая соблюдается по горизонтали (в периоде слева направо), по вертикали (в группе, например, сверху вниз), по диагонали, т.е. какое-то свойство атома усиливается или уменьшается, но периодичность сохраняется.
В периоде слева направо (→) увеличиваются окислительные и неметаллические свойства элементов, а восстановительные и металлические свойства уменьшаются. Так, из всех элементов 3 периода натрий будет самым активным металлом и самым сильным восстановителем, а хлор – самым сильным окислителем.
Химическая связь – это взаимное соединение атомов в молекуле, или кристаллической решетке, в результате действия между атомами электрических сил притяжения.
Это взаимодействие всех электронов и всех ядер, приводящих к образованию устойчивой, многоатомной системы (радикал, молекулярный ион, молекула, кристалл).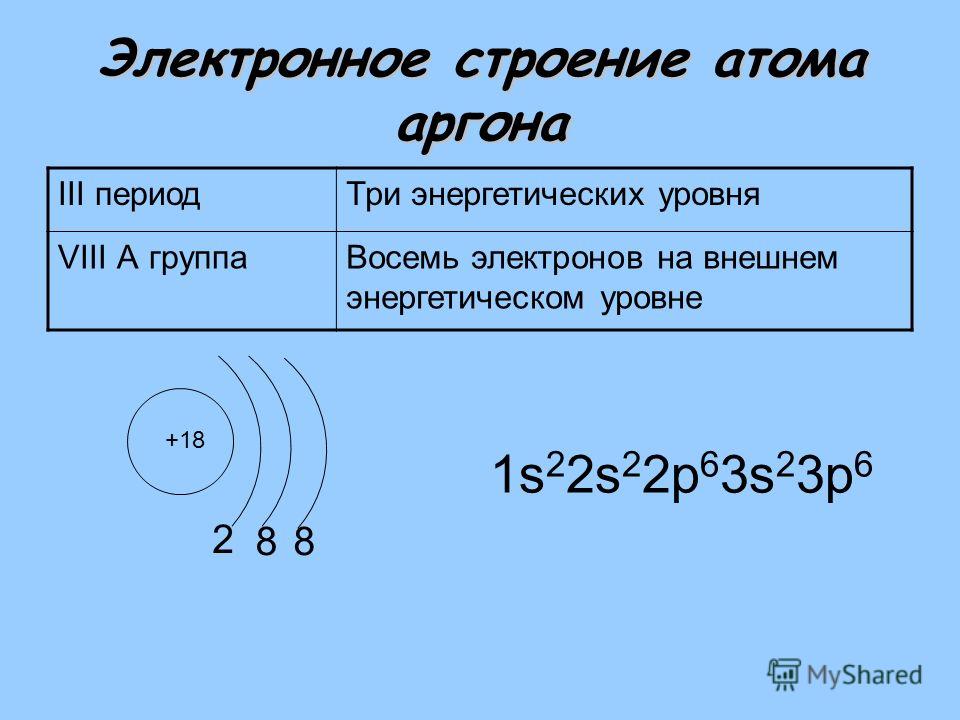
Химическая связь осуществляется валентными электронами. По современным представлениям химическая связь имеет электронную природу, но осуществляется она по-разному. Поэтому различают три основных типа химической связи: ковалентную, ионную, металлическую .Между молекулами возникает водородная связь, и происходят вандерваальсовые взаимодействия .
К основным характеристикам химической связи относятся:
– длина связи – это межъядерное расстояние между химически связанными атомами.
Она зависит от природы взаимодействующих атомов и от кратности связи. С увеличением кратности длина связи уменьшается, а, следовательно, увеличивается ее прочность;
– кратность связи – определяется числом электронных пар, связывающих два атома. С увеличением кратности энергия связи возрастает;
– угол связи – угол между воображаемыми прямыми проходящими через ядра двух химически взаимосвязанных соседних атомов;
Энергия связи Е СВ – это энергия, которая выделяется при образовании данной связи и затрачивается на ее разрыв, кДж/моль.
Ковалентная связь – Химическая связь, образованная путем обобществления пары электронов двумя атомами.
Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС) , открытый Льюисом в 1916 г. Для квантово-механического описания химической связи и строения молекул применяют ещё один метод – метод молекулярных орбиталей (ММО) .
Метод валентных связей
Основные принципы образования химической связи по МВС:
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается.
4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение.
5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Существует два механизма образования ковалентной связи:
Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
Рис. 7. Обменный механизм образования ковалентной связи: а – неполярной; б – полярной
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям
Рис. 8. Донорно-акцепторный механизм образования ковалентной связи
Ковалентная связь имеет определенные характеристики.
Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав.
Благодаря насыщаемости связей молекулы имеют определенный состав.
Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков . Относительно линии соединяющей центры атомов образующих связь различают: σ и π(рис. 9): σ-связь – образована перекрыванием АО по линии соединяющей центры взаимодействующих атомов; π-связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома. Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму. Гибридизация
– это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание. Различают следующие виды гибридизации (рис. 10, табл. |
sp 2 -гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp 2 -гибридизация, имеют плоскую геометрию (BF 3 , AlCl 3).
sp 3 –гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28″. Молекулы, в которых осуществляется sp 3 -гибридизация, имеют тетраэдрическую геометрию (CH 4 , NH 3).
Рис. 10. Виды гибридизаций валентных орбиталей: а – sp -гибридизация валентных орбиталей; б – sp 2 – гибридизация валентных орбиталей; в – sp 3 -гибридиза-ция валентных орбиталей
Используя графическую электронную схему атома.
 Схема строения атома: ядро, электронная оболочка
Схема строения атома: ядро, электронная оболочка2. Строение ядер и электронных оболочек атомов
2.7. Распределение электронов в атоме
Состояние электронов в атоме указывают, используя определенную форму записи. Например, для атома гелия имеем:
Распределение электронов в атоме указывают с помощью:
а) электронных схем , в которых отмечено только число электронов на каждом слое. Например: Mg 2e , 8e , 2e ; Cl 2e , 8e , 7e .
Часто употребляют графические электронные схемы, например, для атома хлора:
б) электронных конфигураций
; в этом случае показаны номер слоя (уровня), природа подуровней и число электронов на них. Например:
Mg 1s
2 2s
2 2p
6 3s
2 ;
в) электронно-графических схем , на которых орбитали изображают, например, в виде клетки, а электроны – стрелками (рис. 2.6).
Рис. 2.6. Электронно-графическая схема для атома магния
Кроме полных формул электронных конфигураций, широко используются сокращенные.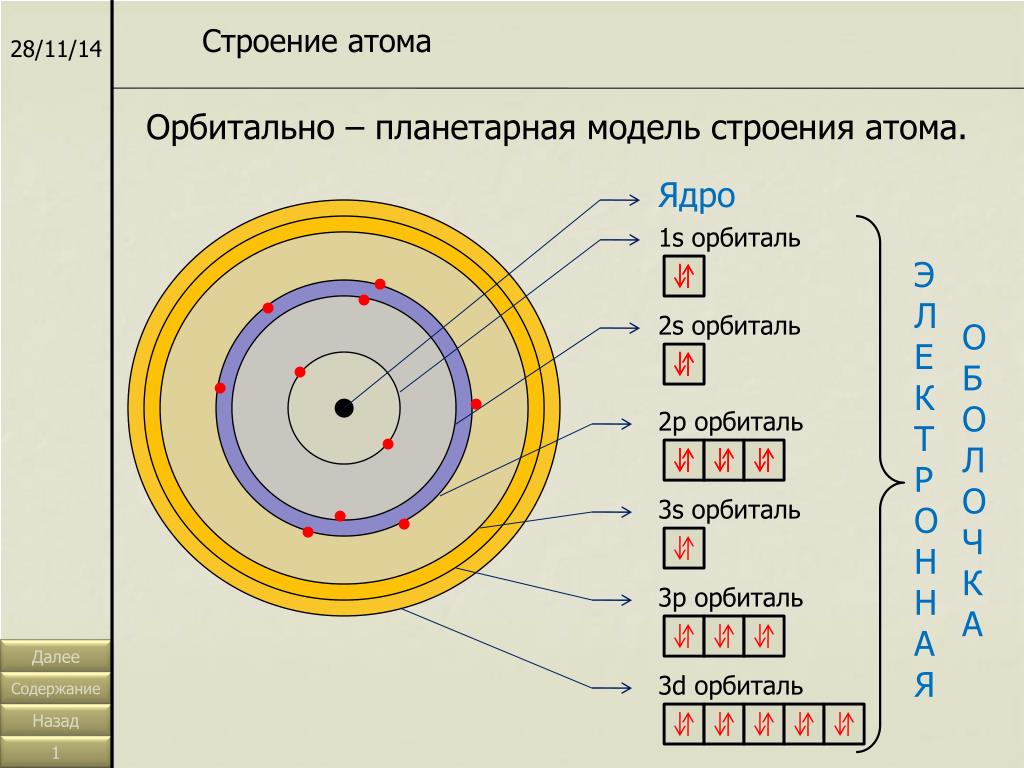 В этом случае часть электронной конфигурации, соответствующая благородному газу, указывается символом благородного газа в квадратных скобках. Например: 12 Mg3s 2 , 19 K4s 1 .
В этом случае часть электронной конфигурации, соответствующая благородному газу, указывается символом благородного газа в квадратных скобках. Например: 12 Mg3s 2 , 19 K4s 1 .
Существуют определенные принципы и правила заполнения электронами энергетических уровней и подуровней:
1. Принцип минимума полной энергии атома, согласно которому заселение электронами АО происходит так, чтобы полная энергия атома была минимальной. Экспериментально установлена следующая последовательность заполнения АО:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p … .
2. На одной АО может находиться не более двух электронов, причем их спины в этом случае должны быть антипараллельными.
3. В пределах данного энергетического подуровня электроны заполняют АО постепенно, вначале по одному (сначала все вакантные, а уже затем – по два), причем ориентация всех неспаренных электронов должна быть одинаковой, т.е. такой
но не такой
Практически в любом атоме внешними являются только s
– и p
-АО (рис. 2.7), поэтому на внешнем электронном слое любого атома не может находиться более восьми электронов
. Внешний электронный слой, содержащий восемь электронов (в случае гелия – два) называется завершенным
.
2.7), поэтому на внешнем электронном слое любого атома не может находиться более восьми электронов
. Внешний электронный слой, содержащий восемь электронов (в случае гелия – два) называется завершенным
.
Рис. 2.7. Электронно-графические схемы для атомов K (а ) и S (б )
Электронные конфигурации атомов элементов 4-го периода периодической системыЗначения энергий разных энергетических подуровней для различных атомов не являются постоянными, а зависят от заряда ядра Z атома элемента: для атомов элементов с Z = 1–20 Е 3 d > E 4 s и Е 3 d > E 4 p ; для атомов элементов с Z ≥ 21 наоборот: Е 3 d
Рис. 2.8. Диаграмма энергетических подуровней атомов элементов с Z = 1–20 (а ), Z ≥ 21 (б )
Электронные конфигурации атомов (основное состояние) K и Са следующие (см. рис. 2.8):
19 K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ,
20 Ca: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
Начиная со скандия (Z
= 21) заполняется 3d
-подуровень, а во внешнем слое остаются 4s
-электроны. Общая электронная формула атомов элементов от Sс до Zn – 3d 1−10 4s 1−2 . Например:
Общая электронная формула атомов элементов от Sс до Zn – 3d 1−10 4s 1−2 . Например:
21 Sс: 3d 1 4s 2 ,
25 Mn: 3d 5 4s 2 ,
28 Ni: 3d 8 4s 2 .
30 Zn: 3d 10 4s 2 .
Для хрома и меди наблюдается проскок (провал) 4s -электрона на 3d -подуровень: Cr – 3d 5 4s 1 , Cu – 3d 10 4s 1 . Такой проскок с ns – на (n − 1)d -подуровень наблюдается также у атомов других элементов (Mo, Ag, Au, Pt) и объясняется близостью энергий ns – и (n − 1)d -подуровней, а также стабильностью наполовину и полностью заполненных d -подуровней.
Дальше в 4-м периоде после 10 d -элементов следуют от Ga ( 3d 10 4s 2 4p 1) до Kr ( 3d 10 4s 2 4p 6) p -элементы.
Образование катионов d -элементов связано с потерей сначала внешних ns -, затем (n − 1)d -электронов, например:
Ti: 3d 2 4s 2 → − 2 e − Ti 2+ : 3d 2 → − 1 e − Ti 3+ : 3d 1
Mn: 3d 5 4s 2 → − 2 e − Mn 2+ : 3d 5 → − 2 e − Mn 4+ : 3d 3
Отметим, что в формулах электронных конфигураций принято записывать сначала все электроны с меньшим значением n
, а затем переходить к указанию электронов с более высоким значением главного квантового числа.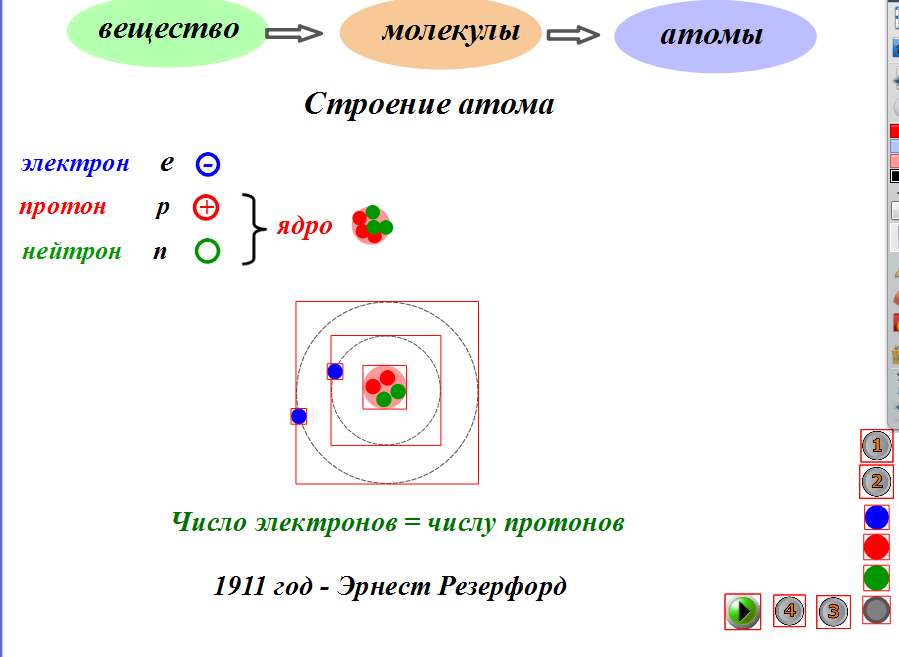 Поэтому порядок заполнения и порядок записи энергетических подуровней для 3d
-элементов не совпадают. Например, в электронной формуле атома скандия 3d
-орбиталь указана до 4s
-орбитали, хотя раньше заполняется 4s
-орбиталь.
Поэтому порядок заполнения и порядок записи энергетических подуровней для 3d
-элементов не совпадают. Например, в электронной формуле атома скандия 3d
-орбиталь указана до 4s
-орбитали, хотя раньше заполняется 4s
-орбиталь.
Возникает закономерный вопрос: почему в атомах 3d -элементов раньше заполняется 4s -подуровень, хотя его энергия больше энергии 3d -подуровня? Почему, например, атом Sc не имеет в основном состоянии электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 ?
Это происходит потому, что соотношение энергий различных электронных состояний атома не всегда совпадает с соотношением энергий отдельных энергетических подуровней. Энергия 4s
-подуровня для 3d
-элементов больше энергии 3d
-подуровня, но энергия состояния
3d
1 4s
2 меньше энергии состояния 3d 3 .
Объясняется это тем, что межэлектронное отталкивание, а соответственно и энергия всего состояния для конфигурации…3d 3 (с тремя электронами на одном и том же энергетическом подуровне) больше, чем для конфигурации. ..3d 1 4s 2 (с тремя электронами, находящимися на разных энергетических уровнях).
..3d 1 4s 2 (с тремя электронами, находящимися на разных энергетических уровнях).
Алгоритм составления электронной формулы элемента:
1. Определите число электронов в атоме используя Периодическую таблицу химических элементов Д.И. Менделеева .
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей :
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором – максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем – максимум 18 (два s , шесть p , и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s- подуровень, затем р-, d- b f- подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).

- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Примеры.
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
1s 2 2s 2 2p 6 3s 2 3p 6 .
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.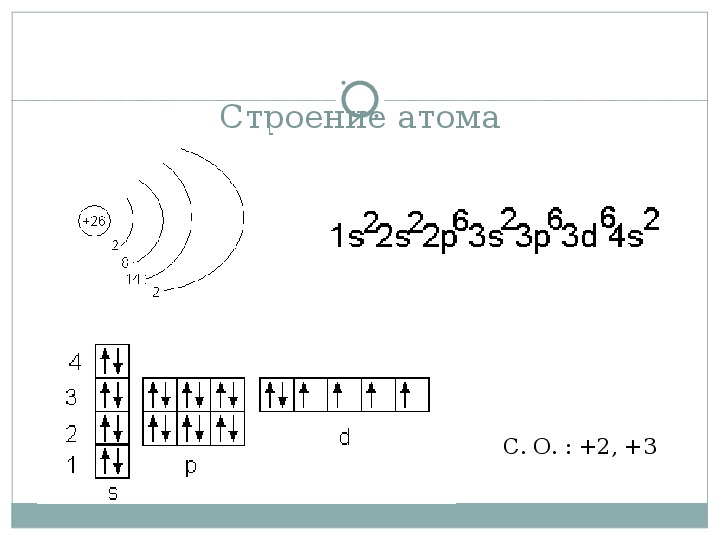
Электронную формулу цинка можно представить в виде.
Инструкция
Электроны в атоме занимают свободные орбитали в последовательности, называемой шкалой :1s / 2s, 2p / 3s, 3p / 4s, 3d, 4p / 5s, 4d, 5p / 6s, 4d, 5d, 6p / 7s, 5f, 6d, 7p. На орбитали могут располагаться два электрона с противоположными спинами – направлениями вращения.
Структуру электронных оболочек выражают с помощью графических электронных формул. Для записи формулы используйте матрицу. В одной ячейке могут располагаться один или два электрона с противоположными спинами. Электроны изображаются стрелками. Матрица наглядно показывает, что на s-орбитали могут располагаться два электрона, на p-орбитали – 6, на d – 10, на f -14.
Запишите порядковый номер и символ элемента рядом с матрицей. В соответствии со шкалой энергии заполоните последовательно 1s, 2s, 2p, 3s, 3p, 4s уровни, вписав по два электрона в ячейку. Получится 2+2+6+2+6+2=20 электронов. Эти уровни заполнены полностью.
У вас осталось еще пять электронов и незаполненный 3d-уровень. Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с одинаковыми спинами расположите в ячейках сначала по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в каждой ячейке.
Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с одинаковыми спинами расположите в ячейках сначала по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в каждой ячейке.
Электронно-графические формулы наглядно показывают количество неспаренных электронов, которые определяют валентность.
Обратите внимание
Помните, что химия – наука исключений. У атомов побочных подгрупп Периодической системы встречается «проскок» электрона. Например, у хрома с порядковым номером 24 один из электронов с 4s-уровня переходит в ячейку d-уровня. Похожий эффект есть у молибдена, ниобия и др. Кроме того, есть понятие возбужденного состояния атома, когда спаренные электроны распариваются и переходят на соседние орбитали. Поэтому при составлении электронно-графических формул элементов пятого и последующих периодов побочной подгруппы сверяйтесь со справочником.
Источники:
- как составить электронную формулу химического элемента
Электроны входят в состав атомов. А сложные вещества, в свою очередь, из этих атомов состоят (атомы образуют элементы) и электроны между собой делят. Степень окисления показывает, какой атом сколько электронов себе забрал, а какой сколько отдал. Этот показатель можно определить.
Вам понадобится
- Школьный учебник по химии 8-9 класс любого автора, таблица Менделеева, таблица электроотрицательности элементов (печатаются в школьных учебниках по химии).
Инструкция
Для начала необходимо обозначить, что степень – это понятие , принимающее связи за , то есть не углубляющиеся в строение. Если элемент находится в свободном состоянии, то это самый простой случай – образуется простое вещество, а значит степень окисления его равна нулю. Так например, водород, кислород, азот, фтор и т.д.
В сложных веществах все обстоит иначе: электроны между атомами распределены неравномерно, и именно степень окисления помогает определить количество отданных или принятых электронов. Степень окисления может положительной и отрицательной. При плюсе электроны отдаются, при минусе принимаются. Некоторые элементы свою степень окисления сохраняют в различных соединениях, но многие этой особенностью не отличаются. Нужно помнить немаловажное правило – сумма степеней окисления всегда равна нулю. Простейший пример, газ СО: зная, что степень окисления кислорода в преобладающем большинстве случаев равна -2 и используя вышеобозначенное правило, можно вычислить степень окисления для С. В сумме с -2 ноль дает только +2, а значит степень окисления углерода +2. Усложним задачу и возьмем для вычислений газ СО2: степень окисления кислорода по-прежнему остается -2, но молекул его в данном случае две. Следовательно, (-2) * 2 = (-4). Число, в сумме с -4 дающее ноль, +4, то есть в этом газе имеет степень окисления +4. Пример посложнее: Н2SO4 – у водорода степень окисления +1, у кислорода -2. Во взятом соединении 2 молекулы водорода и 4 кислорода, т.е. заряды будут, соответственно, +2 и -8.
Степень окисления может положительной и отрицательной. При плюсе электроны отдаются, при минусе принимаются. Некоторые элементы свою степень окисления сохраняют в различных соединениях, но многие этой особенностью не отличаются. Нужно помнить немаловажное правило – сумма степеней окисления всегда равна нулю. Простейший пример, газ СО: зная, что степень окисления кислорода в преобладающем большинстве случаев равна -2 и используя вышеобозначенное правило, можно вычислить степень окисления для С. В сумме с -2 ноль дает только +2, а значит степень окисления углерода +2. Усложним задачу и возьмем для вычислений газ СО2: степень окисления кислорода по-прежнему остается -2, но молекул его в данном случае две. Следовательно, (-2) * 2 = (-4). Число, в сумме с -4 дающее ноль, +4, то есть в этом газе имеет степень окисления +4. Пример посложнее: Н2SO4 – у водорода степень окисления +1, у кислорода -2. Во взятом соединении 2 молекулы водорода и 4 кислорода, т.е. заряды будут, соответственно, +2 и -8. Для того чтобы в сумме получить ноль, нужно добавить 6 плюсов. Значит, степень окисления серы +6.
Для того чтобы в сумме получить ноль, нужно добавить 6 плюсов. Значит, степень окисления серы +6.
Когда в соединении сложно определить, где плюс, где минус, необходима таблица электроотрицательности (ее несложно найти в учебнике по общей химии). Металлы часто имеют положительную степень окисления, а неметаллы отрицательную. Но например, PI3 – оба элемента неметаллы. В таблице указано, что электроотрицательность йода равна 2,6, а фосфора 2,2. При сравнении выясняется, что 2,6 больше, чем 2,2, то есть электроны стягиваются в сторону йода (йод имеет отрицательную степень окисления). Следуя приведенным несложным примерам, можно легко определить степень окисления любого элемента в соединениях.
Обратите внимание
Не нужно путать металлы и неметаллы, тогда степень окисления будет проще найти и не запутаться.
Атом химического элемента состоит из ядра и электронной оболочки. Ядро – это центральная часть атома, в котором сосредоточена почти вся его масса. В отличие от электронной оболочки, ядро имеет положительный заряд.
Вам понадобится
- Атомный номер химического элемента, закон Мозли
Инструкция
Таким образом, заряд ядра равен количеству протонов. В свою очередь, количество протонов в ядре равно атомному номеру . К примеру, атомный номер водорода – 1, то есть ядро водорода состоит из одного протона имеет заряд +1. Атомный номер натрия – 11, заряд его ядра равен +11.
При альфа-распаде ядра его его атомный номер уменьшается на два за счет испускания альфа-частицы (ядра атома ). Таким образом, количество протонов в ядре, испытавшем альфа-распад, также уменьшается на два.
Бета-распад может происходить в трех различных видах. В случае распада «бета-минус» нейтрон превращается в протон при испускании электрона и антинейтрино. Тогда заряд ядра увеличивается на единицу.
В случае распада «бета-плюс» протон превращается в нейтрон, позитрон и нйтрино, заряд ядра уменьшается на единицу.
В случае электронного захвата заряд ядра также уменьшается на единицу.
Заряд ядра можно также определить по частоте спектральных линий характеристического излучения атома. Согласно закону Мозли: sqrt(v/R) = (Z-S)/n, где v – спектральная частота характеристического излучения, R – постоянная Ридберга, S – постоянная экранирования, n – главное квантовое число.
Таким образом, Z = n*sqrt(v/r)+s.
Видео по теме
Источники:
- как изменяется заряд ядра
При создании теоретических и практических работ по математике, физике, химии студент или школьник сталкивается с необходимостью вставки специальных символов и сложных формул. Располагая приложением Word из офисного пакета Microsoft, можно набрать электронную формулу любой сложности.
Инструкция
Перейдите на вкладку «Вставка». Справа найдите π, а рядом надпись «Формула». Нажмите на стрелочку. Появится окно, в котором вы можете выбрать встроенную формулу, например, формулу квадратного уравнения.
Нажмите на стрелку и на верхней панели появятся самые разные символы, которые вам могут понадобиться при написании конкретно этой формулы. 2-4ac))/2a.
2-4ac))/2a.
Другой вариант написания электронной формулы в Word – через конструктор. Зажмите одновременно клавиши Alt и =. У вас сразу появится поле для написания формулы, а в верхней панели откроется конструктор. Здесь вы можете выбрать все знаки, которые могут понадобиться для записи уравнения и решения любой задачи.
Некоторые символы линейной записи могут быть непонятными читателю, незнакомому с компьютерной символикой. В этом случае самые сложные формулы или уравнения имеет смысл сохранить в графическом виде. Для этого откройте самый простой графический редактор Paint: «Пуск» – «Программы» – «Paint». Затем увеличьте масштаб документа с формулой так, чтобы она заняла весь экран. Это необходимо, чтобы сохраненное изображение имело наибольшее разрешение. Нажмите на клавиатуре PrtScr, перейдите в Paint и нажмите Ctrl+V.
Электронная конфигурация атома – это формула, показывающая расположение электронов в атоме по уровням и
подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и
сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему. Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину. Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном
состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество
протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов – 16й элемент периодической
системы. Золото имеет 79 протонов – 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном
состоянии 16 электронов, а в золоте 79 электронов.
Золото имеет 79 протонов – 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном
состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин “орбиталь”, орбиталь – это волновая функция электрона, грубо – это область, в которой электрон проводит 90% времени.
N – уровень
L – оболочка
M l – номер орбитали
M s – первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии,
облако принимает четыре основных формы: шар, гантели и другие две, более сложные. В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой.
На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f)
орбиталей. Орбитальное квантовое число – это оболочка, на которой находятся
орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно
принимает значения 0,1,2 или 3.
В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой.
На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f)
орбиталей. Орбитальное квантовое число – это оболочка, на которой находятся
орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно
принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) – два электрона
На p-оболочке три орбитали (L=1) – шесть электронов
На d-оболочке пять орбиталей (L=2) – десять электронов
На f-оболочке семь орбиталей (L=3) – четырнадцать электронов
Магнитное квантовое число m l
На p-оболочке находится три орбитали, они обозначаются цифрами от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали “-1”, “0” и “1”. Магнитное квантовое число обозначается буквой m l .
Внутри оболочки электронам легче
располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую
орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения M l =-2,M l =-1,M l =0, M l =1,M l =2.
Спиновое квантовое число m s
Спин – это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с противоположными спинами. Спиновое квантовое число обозначается m s
Главное квантовое число n
Главное квантовое число – это уровень энергии, на данный момент известны семь энергетических уровней, каждый обозначается арабской цифрой: 1,2,3,…7. Количество оболочек на каждом уровне равно номеру уровня: на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой
позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне
распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т. е. L=0,
магнитное квантовое число может принять только одно значение, M l =0 и спин будет равен +1/2.
Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут:
N=2, L=1, M=-1, спин 1/2.
е. L=0,
магнитное квантовое число может принять только одно значение, M l =0 и спин будет равен +1/2.
Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут:
N=2, L=1, M=-1, спин 1/2.
Давайте рассмотрим, как построен атом. Учитывайте, что речь будет вестись исключительно о моделях. На практике атомы представляют собой гораздо более сложную структуру. Но благодаря современным разработкам мы имеем возможность объяснять и даже успешно предсказывать свойства (пускай даже и не все). Итак, какова схема строения атома? Из чего он «сделаны»?
Планетарная модель атома
Впервые была предложена датским физиком Н. Бором в 1913 году. Это первая теория строения атома, основанная на научных фактах. К тому же она положила основу современной тематической терминологии. В ней электроны-частицы производят вращательные движения вокруг атома по такому же принципу, как планеты вокруг Солнца. Бор высказал предположение, что они могут существовать исключительно на орбитах, находящихся на строго определённом расстоянии от ядра. Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона.
Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Волновая модель атома
Но со временем планетарная модель подверглась пересмотру. Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример – в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%.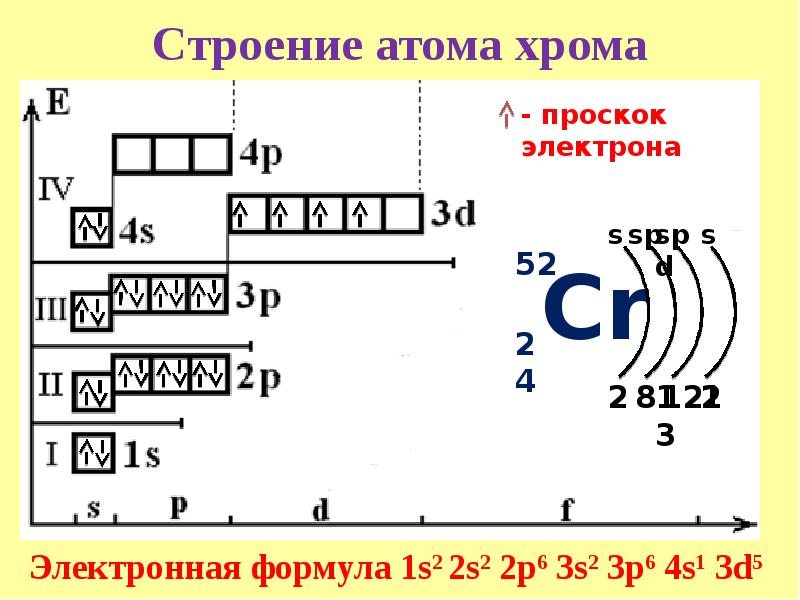 На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Понятие вероятности в данном случае
Почему был использован этот термин? Гейзенбергом в 1927 г. был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры.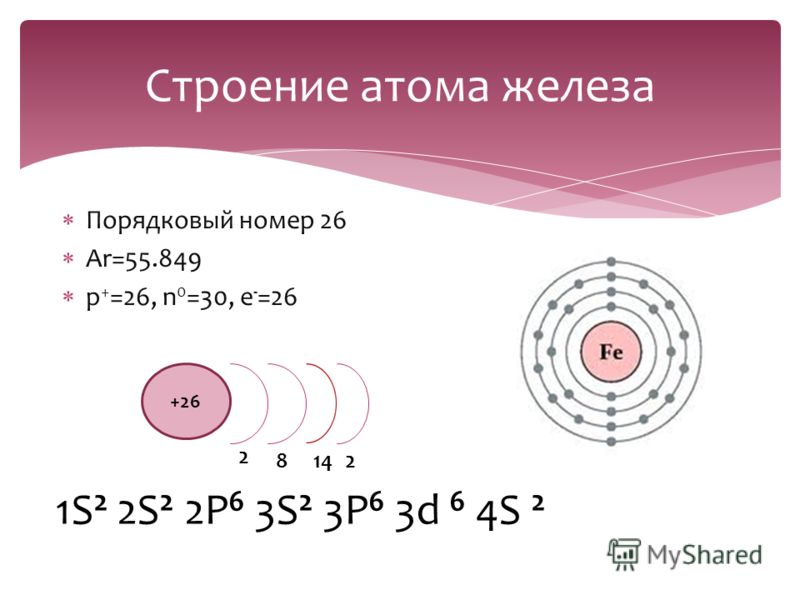 И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Состав атома
Но давайте сконцентрируемся на всём объекте рассмотрения. Итак, кроме неплохо рассмотренной электронной оболочки, второй составляющей атома является ядро. Оно состоит из позитивно заряженных протонов и нейтральных нейтронов. Все мы знакомы с таблицей Менделеева. Номер каждого элемента соответствует количеству протонов, что в нём есть. Количество нейтронов равняется разнице между массой атома и его количеством протонов. Могут и быть отклонения от этого правила. Тогда говорят о том, что присутствует изотоп элемента. Схема строения атома такова, что его «окружает» электронная оболочка. обычно равняется количеству протонов. Масса последнего примерно в 1840 раз больше, чем у первого, и примерно равна весу нейтрона. Радиус ядра составляет около 1/200000 диаметра атома. Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
обычно равняется количеству протонов. Масса последнего примерно в 1840 раз больше, чем у первого, и примерно равна весу нейтрона. Радиус ядра составляет около 1/200000 диаметра атома. Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Орбиты
Говоря о том, что такое схема строения атома, нельзя умолчать о них. Итак, есть такие виды:
- s. Имеют сферическую форму.
- p. Являются похожими на объемные восьмерки или веретено.
- d и f. Имеют сложную форму, которая с трудом описывается формальным языком.
Электрон каждого типа можно с вероятностью в 95% найти на территории соответствующей орбитали. К представленной информации необходимо относиться спокойно, поскольку это, скорее, абстрактная математическая модель, нежели физическое реальное положение дел. Но при всём этом она обладает хорошей предсказательной силой относительно химических свойств атомов и даже молекул.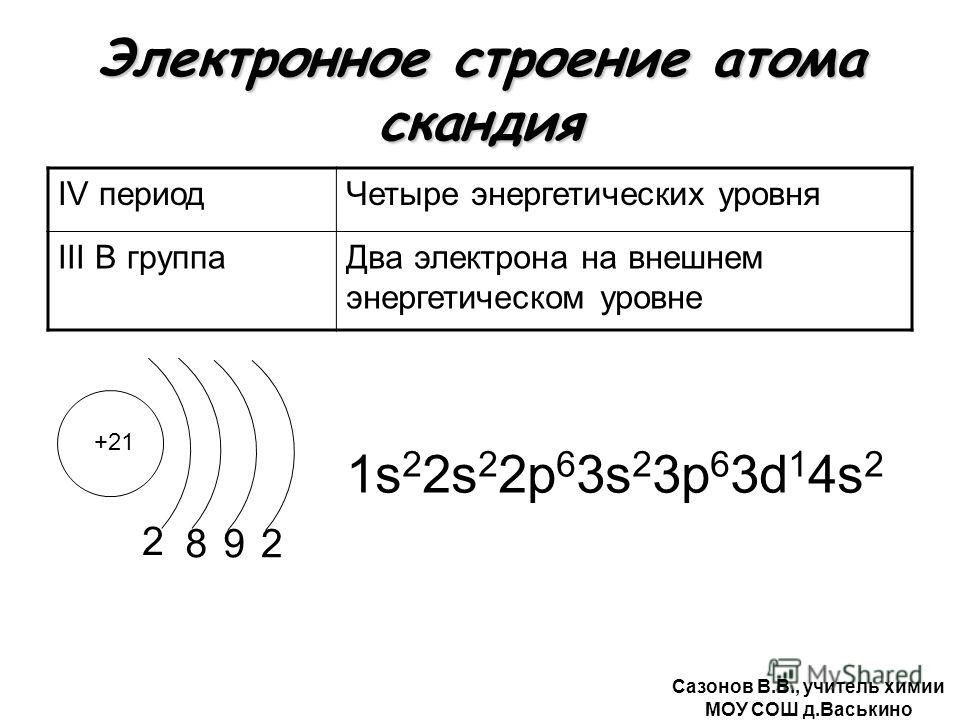 Чем дальше от ядра расположен уровень, тем больше электронов можно на нём разместить. Так, количество орбиталей можно подсчитать с помощью специальной формулы: х 2 . Здесь х равно количеству уровней. А поскольку на орбитали можно разместить до двух электронов, то в конечном итоге формула их численного поиска будет выглядеть следующим образом: 2х 2 .
Чем дальше от ядра расположен уровень, тем больше электронов можно на нём разместить. Так, количество орбиталей можно подсчитать с помощью специальной формулы: х 2 . Здесь х равно количеству уровней. А поскольку на орбитали можно разместить до двух электронов, то в конечном итоге формула их численного поиска будет выглядеть следующим образом: 2х 2 .
Орбиты: технические данные
Если говорить про строение атома фтора, то он будет иметь три орбитали. Все они будут заполнены. Энергия орбиталей в рамках одного подуровня одинакова. Чтобы их обозначить, добавляют номер слоя: 2s, 4p, 6d. Возвращаемся к разговору про строение атома фтора. У него будет два s- и один p-подуровень. У него девять протонов и столько же электронов. Сначала один s-уровень. Это два электрона. Потом второй s-уровень. Ещё два электрона. И 5 заполняют p-уровень. Вот такое у него строение. После прочтения следующего подзаголовка можно собственноручно проделать необходимые действия и убедиться в этом. Если говорить про к которым относится и фтор, то следует отметить, что они, хотя и в одной группе, полностью различаются по своим характеристикам. Так, их температура кипения колеблется от -188 до 309 градусов Цельсия. Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью. Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Так, их температура кипения колеблется от -188 до 309 градусов Цельсия. Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью. Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Как заполняются орбиты?
По каким правилам и принципам располагаются электроны? Предлагаем ознакомиться с тремя основными, формулировка которых была упрощена для лучшего понимания:
- Принцип наименьшей энергии. Электронам свойственно заполнять орбитали в порядке увеличения их энергии.
- Принцип Паули. На одной орбитали не может располагаться больше двух электронов.
- Правило Хунда. В пределах одного подуровня электроны заполняют сначала свободные орбитали, и только потом образуют пары.
В деле заполнения поможет и строение атома в таком случае станет более понятным в плане изображения. Поэтому при практической работе с построением схем элементов, необходимо держать её под рукой.
Пример
Для того, чтобы обобщить всё сказанное в рамках статьи, можно составить образец, как же распределяются электроны атома по своим уровням, подуровням и орбиталям (то есть, какой является конфигурация уровней). Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Заключение
Как видите, строение атома – не такая сложная тема (если подходить к ней с позиции школьного курса химии, конечно). И понять данную тему не составляет труда. Напоследок хочется сообщить про некоторые особенности. К примеру, говоря про строение атома кислорода, мы знаем, что он имеет восемь протонов, и 8-10 нейтронов. И так как все в природе стремится к равновесию, два атома кислорода образуют молекулу, где два непарных электрона образуют ковалентную связь. Подобным же образом образуется другая стойкая молекула кислорода – озон (O 3). Зная строение атома кислорода, можно правильно составлять формулы окислительных реакций, в которых участвует самое распространенное на Земле вещество.
Электронные формулы и графические схемы. Электронные формулы и графические схемы строения электронных слоев атомов. Магнитное квантовое число m l
Электронное строение атома можно показать электронной формулой и электронно-графической схемой. В электронных формулах последовательно записываются энергетические уровни и подуровни в порядке их заполнения и общее число электронов на подуровне. При этом состояние отдельного электрона, в частности его магнитное и спиновое квантовые числа, в электронной формуле не отражено. В электронно-графических схемах каждый электрон «виден» полностью, т.е. его можно охарактеризовать всеми четырьмя квантовыми числами. Электронно-графические схемы обычно приводятся для внешних электронов.
Пример 1. Напишите электронную формулу фтора, состояние внешних электронов выразите электронно-графической схемой. Сколько неспаренных электронов в атоме этого элемента?
Решение. Атомный номер фтора равен девяти, следовательно, в его атоме имеется девять электронов. В соответствии с принципом наименьшей энергии, пользуясь рис. 7 и учитывая следствия принципа Паули, записываем электронную формулу фтора: 1s 2 2s 2 2p 5 . Для внешних электронов (второй энергетический уровень) составляем электронно-графическую схему (рис. 8), из которой следует, что в атоме фтора имеется один неспаренный электрон.
В соответствии с принципом наименьшей энергии, пользуясь рис. 7 и учитывая следствия принципа Паули, записываем электронную формулу фтора: 1s 2 2s 2 2p 5 . Для внешних электронов (второй энергетический уровень) составляем электронно-графическую схему (рис. 8), из которой следует, что в атоме фтора имеется один неспаренный электрон.
Рис. 8. Электронно-графическая схема валентных электронов атома фтора
Пример 2. Составьте электронно-графические схемы возможных состояний атома азота. Какие из них отражают нормальное состояние, а какие – возбужденное?
Решение. Электронная формула азота 1s 2 s 2 2p 3 , формула внешних электронов: 2s 2 2p 3 . Подуровень 2p незавершен, т.к. число электронов на нем меньше шести. Возможные варианты распределения трех электронов на 2р-подуровне показаны на рис. 9.
Рис. 9. Электронно-графические схемы возможных состояний 2р-подуровня в атоме азота.
Максимальное (по абсолютной величине) значение спина (3 / 2) соответствует состояниям 1 и 2, следовательно, они являются основными, а остальные – возбужденные.
Пример 3. Определите квантовые числа, которыми определяется состояние последнего электрона в атоме ванадия?
Решение. Атомный номер ванадия Z = 23, следовательно, полная электронная формула элемента: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 . Электронно-графическая схема внешних электронов (4s 2 3d 3) такова (рис. 10),:
Рис. 10. Электронно-графическая схема валентных электронов атома ванадия
Главное квантовое число последнего электрона n = 3 (третий энергетический уровень), орбитальное l = 2 (подуровень d). Mагнитное квантовое число для каждого из трех d-электронов различно: для первого оно равно –2, для второго –1, для третьего – 0. Спиновое квантовое число у всех трех электронов одинаково: m s = + 1 / 2 . Таким образом, состояние последнего электрона в атоме ванадия характеризуется квантовыми числами: n = 3; l = 2; m = 0; m s = + 1 / 2 .
7. Спаренные и неспаренные электроны
Электроны, заполняющие орбитали попарно, называются спаренными, а одиночные электроны называются неспаренными . Неспаренные электроны обеспечивают химическую связь атома с другими атомами. Наличие неспаренных электронов устанавливается экспериментально изучением магнитных свойств. Вещества с неспаренными электронами парамагнитны (втягиваются в магнитное поле благодаря взаимодействию спинов электронов, как элементарных магнитов, с внешним магнитным полем). Вещества, имеющие только спаренные электроны, диамагнитны (внешнее магнитное поле на них не действует). Неспаренные электроны находятся только на внешнем энергетическом уровне атома и их число можно определить по его электронно-графической схеме.
Неспаренные электроны обеспечивают химическую связь атома с другими атомами. Наличие неспаренных электронов устанавливается экспериментально изучением магнитных свойств. Вещества с неспаренными электронами парамагнитны (втягиваются в магнитное поле благодаря взаимодействию спинов электронов, как элементарных магнитов, с внешним магнитным полем). Вещества, имеющие только спаренные электроны, диамагнитны (внешнее магнитное поле на них не действует). Неспаренные электроны находятся только на внешнем энергетическом уровне атома и их число можно определить по его электронно-графической схеме.
Пример 4. Определите число неспаренных электронов в атоме серы.
Решение. Атомный номер серы Z = 16, следовательно, полная электронная формула элемента: 1s 2 2s 2 2p 6 3s 2 3p 4 . Электронно-графическая схема внешних электронов такова (рис. 11).
Рис. 11. Электронно-графическая схема валентных электронов атома серы
Из электронно-графической схемы следует, что в атоме серы имеется два неспаренных электрона.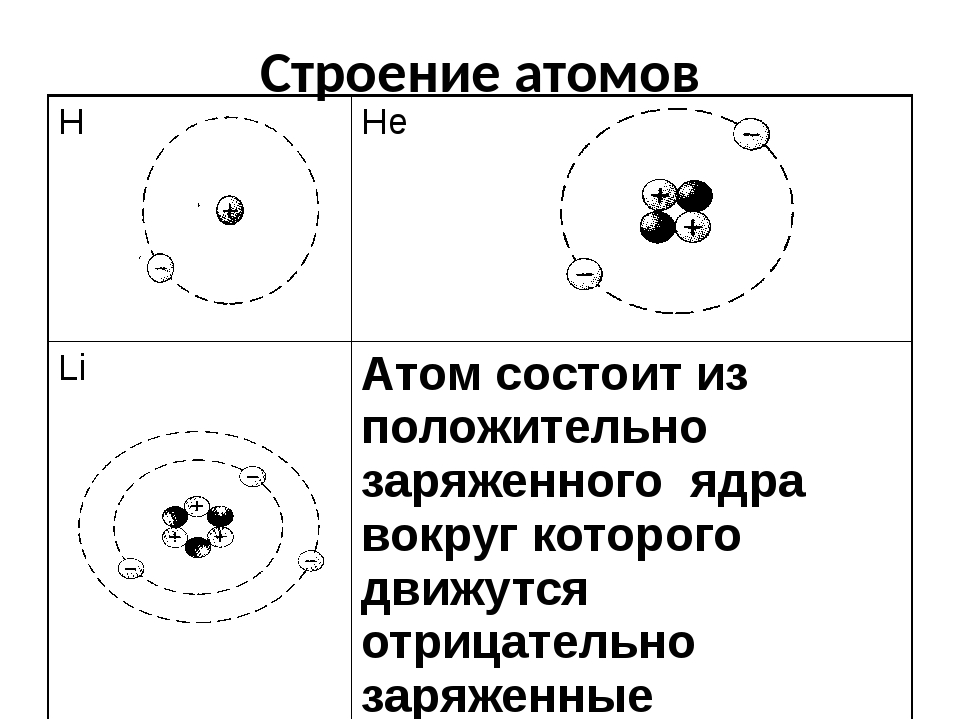
Записывается в виде так называемых электронных формул. В электронных формулах буквами s, p, d, f обозначаются энергетические подуровни электронов; цифры впереди букв означают энергетический уровень, в котором находится данный электрон, а индекс вверху справа – число электронов на данном подуровне. Чтобы составить электронную формулу атома любого элемента, достаточно знать номер данного элемента в периодической системе и выполнить основные положения, которым подчиняется распределение электронов в атоме.
Структура электронной оболочки атома может быть изображена и в виде схемы размещения электронов по энергетическим ячейкам.
Для атомов железа такая схема имеет следующий вид:
На этой схеме наглядно видно выполнение правила Гунда . На Зd-подуровне максимальное количество, ячеек (четыре) заполнено неспаренными электронами. Изображение структуры электронной оболочки в атоме в виде электронных формул и в виде схем наглядно не отражает волновых свойств электрона.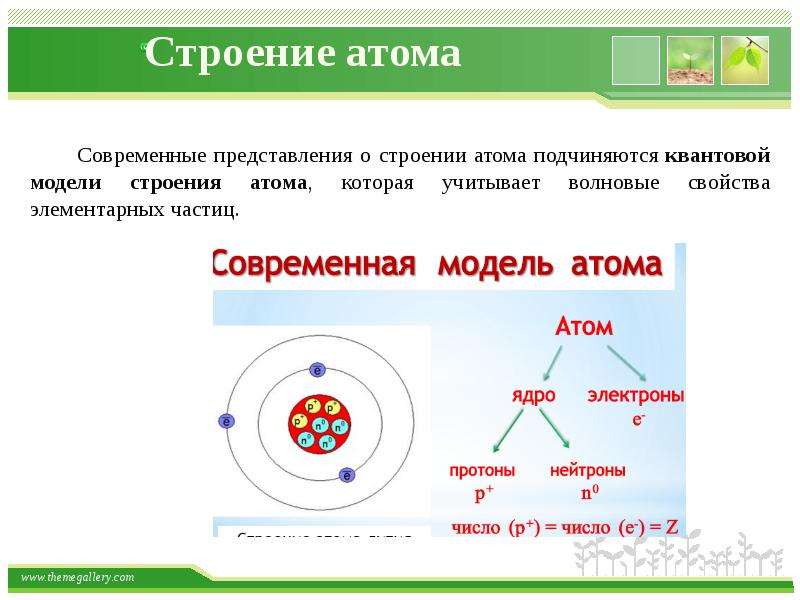
Формулировка периодического закона в редакции Д.А. Менделеева : свойства простых тел, а так же формы и свойства соединений элементов находятся в периодической зависимости величины атомных весов элементов.
Современная формулировка Периодического закона : свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра их атомов.
Таким образом, положительный заряд ядра (а не атомная масса) оказался более точным аргументом, от которого зависят свойства элементов и их соединений
Валентность – это число химических связей, которым один атом связан с другим.
Валентные возможности атома определяются числом неспаренных электронов и наличием на внешнем уровне свободных атомных орбиталей. Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.
Такие электроны также называют валентными.
Стехиометрическая валентность химического элемента– это число эквивалентов, которое может к себе присоединить данный атом, или – число эквивалентов в атоме.
Эквиваленты определяются по числу присоединённых или замещённых атомов водорода , поэтому стехиометрическая валентность равна числу атомов водорода, с которыми взаимодействует данный атом. Но свободно взаимодействуют не все элементы, а с кислородом – практически все, поэтому стехиометрическую валентность можно определить как удвоенное число присоединённых атомов кислорода.
Например, стехиометрическая валентность серы в сероводороде H 2 S равна 2, в оксиде SO 2 – 4 , в оксиде SO 3 -6.
При определении стехиометрической валентности элемента по формуле бинарного соединения следует руководствоваться правилом: суммарная валентность всех атомов одного элемента должна быть равна суммарной валентности всех атомов другого элемента.
Степень окисления также характеризует состав вещества и равна стехиометрической валентности со знаком плюс (для металла или более электроположительного элемента в молекуле) или минус.
1. В простых веществах степень окисления элементов равна нулю.
2. Степень окисления фтора во всех соединениях равна -1. Остальные галогены (хлор, бром, иод) с металлами, водородом и другими более электроположительными элементами тоже имеют степень окисления -1, но в соединениях с более электроотрицательными элементами они имеют положительные значения степеней окисления.
3. Кислород в соединениях имеет степень окисления -2; исключением являются пероксид водорода Н 2 О 2 и его производные (Na 2 O 2 , BaO 2 и т.п., в которых кислород имеет степень окисления -1, а также фторид кислорода OF 2 , степень окисления кислорода в котором равна +2.
4. Щелочные элементы (Li, Na, K и др.) и элементы главной подгруппы второй группы Периодической системы (Be, Mg, Ca и др.) всегда имеют степень окисления, равную номеру группы, то есть +1 и +2, соответственно.
5. Все элементы третьей группы, кроме таллия имеют постоянную степень окисления, равную номеру группы, т. е. +3.
е. +3.
6. Высшая степень окисления элемента равна номеру группы Периодической системы, а низшая – разности: № группы – 8. Например, высшая степень окисления азота (он расположен в пятой группе) равна +5 (в азотной кислоте и её солях), а низшая равна -3 (в аммиаке и солях аммония).
7. Степени окисления элементов в соединении компенсируют друг друга так, что их сумма для всех атомов в молекуле или нейтральной формульной единице равна нулю, а для иона – его заряду.
Эти правила можно использовать для определения неизвестной степени окисления элемента в соединении, если известны степени окисления остальных, и составления формул многоэлементных соединений.
Сте?пень окисле?ния (окислительное число, ) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность . Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов).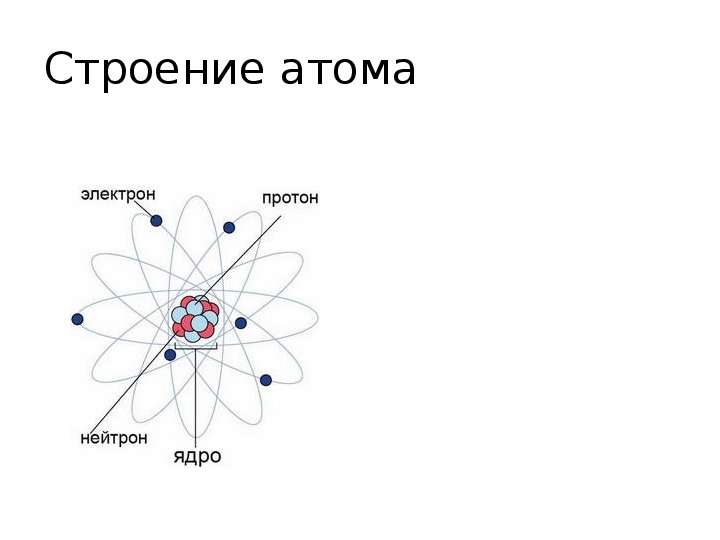
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома:
Al 3+ + 3e − → Al
S 2− → S + 2e − (S 2− − 2e − → S)
Свойства элементов, зависящие от строения электронной оболочки атома, изменяются по периодам и группам периодической системы. Поскольку в ряду элементов-аналогов электронные структуры лишь сходны, но не тождественны, то при переходе от одного элемента в группе к другому для них наблюдается не простое повторение свойств, а их более или менее отчетливо выраженное закономерное изменение.
Химическая природа элемента обусловлена способностью его атома терять или приобретать электроны. Эта способность количественно оценивается величинами энергий ионизации и сродства к электрону.
Энергией ионизации (Eи ) называется минимальное количество энергии, необходимое для отрыва и полного удаления электрона из атома в газовой фазе при T = 0
K без передачи освобожденному электрону кинетической энергии с превращением атома в положительно заряженный ион: Э + Eи = Э+ + e-.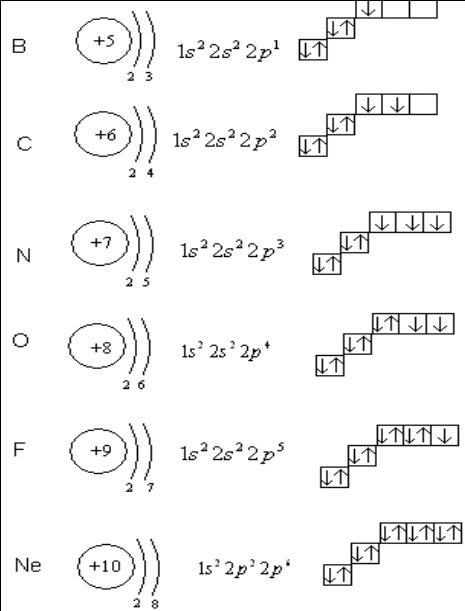 Энергия ионизации является положительной величиной и имеет наименьшие значения у атомов щелочных металлов и наибольшие у атомов благородных (инертных) газов.
Энергия ионизации является положительной величиной и имеет наименьшие значения у атомов щелочных металлов и наибольшие у атомов благородных (инертных) газов.
Сродством к электрону (Ee ) называется энергия, выделяемая или поглощаемая при присоединении электрона атому в газовой фазе при T = 0
K с превращением атома в отрицательно заряженный ион без передачи частице кинетической энергии:
Э + e- = Э- + Ee.
Максимальным сродством к электрону обладают галогены, особенно фтор (Ee = -328 кДж/моль).
Величины Eи и Ee выражают в килоджоулях на моль (кДж/моль) или в электрон-вольтах на атом (эВ).
Способность связанного атома смещать к себе электроны химических связей, повышая около себя электронную плотность называется электроотрицательностью.
Это понятие в науку введено Л. Полингом . Электроотрицательность обозначается символом ÷ и характеризует стремление данного атома к присоединению электронов при образовании им химической связи.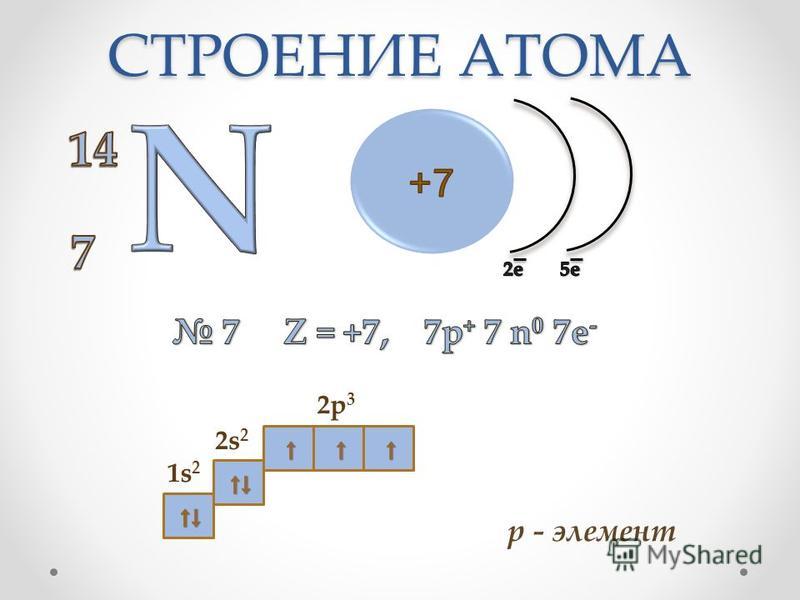
По Р. Маликену электротрицательность атома оценивается полусуммой энергий ионизации и сродства к электрону свободных атом÷ = (Ee + Eи)/2
В периодах наблюдается общая тенденция роста энергии ионизации и электроотрицательности с ростом заряда ядра атома, в группах эти величины с увеличением порядкового номера элемента убывают.
Следует подчеркнуть, что элементу нельзя приписать постоянное значение электроотрицательности, так как оно зависит от многих факторов, в частности от валентного состояния элемента, типа соединения, в которое он входит, числа и вида атомов-соседей.
Атомные и ионные радиусы . Размеры атомов и ионов определяются размерами электронной оболочки. Согласно квантово-механическим представления электронная оболочка не имеет строго определенных границ. Поэтому за радиус свободного атома или иона можно принять теоретически рассчитанное расстояние от ядра до положения главного максимума плотности внешних электронных облаков. Это расстояние называется орбитальным радиусом. На практике обычно используют значения радиусов атомов и ионов, находящихся в соединениях, вычисленные исходя из экспериментальных данных. При этом различают ковалентные и металлические радиусы атомов.
На практике обычно используют значения радиусов атомов и ионов, находящихся в соединениях, вычисленные исходя из экспериментальных данных. При этом различают ковалентные и металлические радиусы атомов.
Зависимость атомных и ионных радиусов от заряда ядра атома элемента и носит периодический характер . В периодах по мере увеличения атомного номера радиусы имеют тенденцию к уменьшению. Наибольшее уменьшение характерно для элементов малых периодов, поскольку у них заполняется внешний электронный уровень. В больших периодах в семействах d- и f- элементов это изменение менее резкое, так как у них заполнение электронов происходит в предпредвнешнем слое. В подгруппах радиусы атомов и однотипных ионов в общем увеличиваются.
Периодическая система элементов есть наглядный пример проявления различного рода периодичности в свойствах элементов, которая соблюдается по горизонтали (в периоде слева направо), по вертикали (в группе, например, сверху вниз), по диагонали, т.е. какое-то свойство атома усиливается или уменьшается, но периодичность сохраняется.
В периоде слева направо (→) увеличиваются окислительные и неметаллические свойства элементов, а восстановительные и металлические свойства уменьшаются. Так, из всех элементов 3 периода натрий будет самым активным металлом и самым сильным восстановителем, а хлор – самым сильным окислителем.
Химическая связь – это взаимное соединение атомов в молекуле, или кристаллической решетке, в результате действия между атомами электрических сил притяжения.
Это взаимодействие всех электронов и всех ядер, приводящих к образованию устойчивой, многоатомной системы (радикал, молекулярный ион, молекула, кристалл).
Химическая связь осуществляется валентными электронами. По современным представлениям химическая связь имеет электронную природу, но осуществляется она по-разному. Поэтому различают три основных типа химической связи: ковалентную, ионную, металлическую .Между молекулами возникает водородная связь, и происходят вандерваальсовые взаимодействия .
К основным характеристикам химической связи относятся:
– длина связи – это межъядерное расстояние между химически связанными атомами.
Она зависит от природы взаимодействующих атомов и от кратности связи. С увеличением кратности длина связи уменьшается, а, следовательно, увеличивается ее прочность;
– кратность связи – определяется числом электронных пар, связывающих два атома. С увеличением кратности энергия связи возрастает;
– угол связи – угол между воображаемыми прямыми проходящими через ядра двух химически взаимосвязанных соседних атомов;
Энергия связи Е СВ – это энергия, которая выделяется при образовании данной связи и затрачивается на ее разрыв, кДж/моль.
Ковалентная связь – Химическая связь, образованная путем обобществления пары электронов двумя атомами.
Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС) , открытый Льюисом в 1916 г. Для квантово-механического описания химической связи и строения молекул применяют ещё один метод – метод молекулярных орбиталей (ММО) .
Для квантово-механического описания химической связи и строения молекул применяют ещё один метод – метод молекулярных орбиталей (ММО) .
Метод валентных связей
Основные принципы образования химической связи по МВС:
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается.
4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение.
5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Существует два механизма образования ковалентной связи:
Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
Рис. 7. Обменный механизм образования ковалентной связи: а – неполярной; б – полярной
7. Обменный механизм образования ковалентной связи: а – неполярной; б – полярной
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям
Рис. 8. Донорно-акцепторный механизм образования ковалентной связи
Ковалентная связь имеет определенные характеристики.
Насыщаемость – свойство атомов образовывать строго определенное число ковалентных связей. Благодаря насыщаемости связей молекулы имеют определенный состав.
Направленность
– т. е. связь образуется в направлении максимального перекрытия электронных облаков . Относительно линии соединяющей центры атомов образующих связь различают: σ и π(рис. 9): σ-связь – образована перекрыванием АО по линии соединяющей центры взаимодействующих атомов; π-связь – это связь, возникающая в направлении оси перпендикулярной прямой, соединяющей ядра атома. Гибридизация – это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. Химическая связь, образуемая с участием электронов гибридных орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание. Различают следующие виды гибридизации (рис. 10, табл. 31): sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию (BeCl 2). |
sp 2 -гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp 2 -гибридизация, имеют плоскую геометрию (BF 3 , AlCl 3).
sp 3 –гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28″. Молекулы, в которых осуществляется sp 3 -гибридизация, имеют тетраэдрическую геометрию (CH 4 , NH 3).
Рис. 10. Виды гибридизаций валентных орбиталей: а – sp -гибридизация валентных орбиталей; б – sp 2 – гибридизация валентных орбиталей; в – sp 3 -гибридиза-ция валентных орбиталей
Чтобы правильно изображать электронные конфигурации атомов, нужно ответить на вопросы: 1. Как определить общее число электронов в атоме? 2. Каково максимальное число электронов на уровнях, подуровнях? 3. Какой порядок заполнения подуровней и орбиталей? 3
Электронные конфигурации (на примере атома водорода) 1. Схема электронного строения Схема электронного строения атомов показывают распределение электронов по энергетическим уровням 2. Электронная формула 1s 1, где s-обозначение подуровня; 1 – число электронов Электронные формулы атомов показывают распределение электронов по энергетическим подуровням 3. Электронно-графическая формула Электронно-графичесие формулы атомов показывают распределение электронов по орбиталям и спины электронов 4
Электронно-графическая формула Электронно-графичесие формулы атомов показывают распределение электронов по орбиталям и спины электронов 4
2. По образцу составь электронную формулу алюминия Порядок заполнения энергетических уровней в атоме. 1s 2, 2s 2, 2p 6, 3s 2, 3p 1 6 У алюминия 13 электронов Первым в атоме заполняется 1s подуровень На нем максимально может быть 2 электрона, отметим их и вычтем из общего числа электронов. Осталось разместить 11 электронов. Заполняется следующий 2s подуровень, на нем может быть 2 электрона. Осталось разместить 9 электронов. Заполняется следующий 2p подуровень, на нем может быть 6 электронов. Далее заполняем 3s подуровень Дошли до 3p подуровня, на нем максимально может быть 6 электронов, но осталось только 1, его и помещаем. 1s = Al s2s2s 2p2p 3p – 2 = – 6 = – 2 = 9 3 1
3. Определи: По порядку ли идут энергетические уровни. Если уровни идут по порядку, то так их и оставь. Если уровни идут не по порядку, то перепиши их, расставив по возрастанию.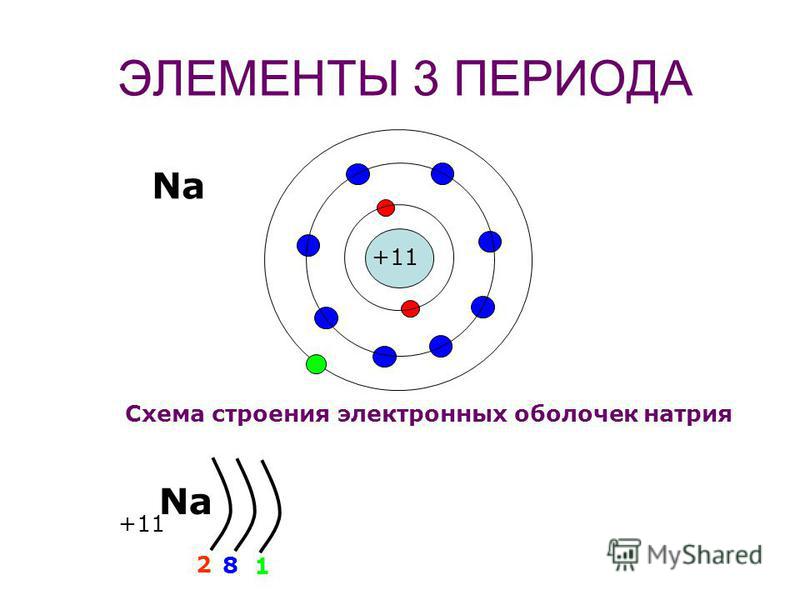 Нет. 4s и 3d подуровни идут не по порядку. Надо переписать и расставить их по мере возрастания. 7 Cr 24 1s 2 2p62p6 3s 2 4s 2 3p 6 3d 4 2s22s2 1s 2 2p62p6 3s 2 4s 2 3p 6 3d 4 2s22s2
Нет. 4s и 3d подуровни идут не по порядку. Надо переписать и расставить их по мере возрастания. 7 Cr 24 1s 2 2p62p6 3s 2 4s 2 3p 6 3d 4 2s22s2 1s 2 2p62p6 3s 2 4s 2 3p 6 3d 4 2s22s2
Правила для составления электронно-графической схемы Каждый подуровень имеет определенное число орбиталей На каждой орбитали могут находиться не более двух электронов Если на орбитале два электрона, то у них должен быть разный спин (стрелки смотрят в разные стороны). 8 s p d f Приступаем к составлению электронно-графической схемы
5. Географическое путешествие Определите, в каких группах периодической системы находятся химические элементы, электронные формулы атомов которых приведены в первом столбце таблицы. Буквы, соответствующие правильным ответам, дадут название стране. 10 ЯМАЙКА Электронные формулы Группы IIIIIIIVVVIVII 1s 2 2s 1 ЯГЛРКАО 1s 2 2s 2 2p 6 3s 2 3p 5 ВИСНПДМ 1s 2 2s 2 2p 6 3s 2 3p 4 ЕФТЗЯАО 1s 2 2s 2 2p 4 ГРИСЬЙК 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 КУЕРМИП 1s 2 2s 2 2p 6 3s 1 АНДЛОЖЛ
 Понятие электронной книги – ридера. Преимущества и недостатки. Технология ЖК-мониторов.
Понятие электронной книги – ридера. Преимущества и недостатки. Технология ЖК-мониторов.Строение электронных оболочек атомов имеют важную роль для химии, обуславливают химические свойства веществ. Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома. Электроны, обладающие близкими значениями энергии образуют единый электронный слой, илиэнергетический уровень. Энергия электронов в атоме и энергетический уровень определяется главным квантовым числом n и принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n, тем больше энергия электрона в атоме. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
Энергия электронов в атоме и энергетический уровень определяется главным квантовым числом n и принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n, тем больше энергия электрона в атоме. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
Где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Установлено, что на первой оболочке располагается не более двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Заполнение более далеких оболочек мы рассматривать не будем. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй – два (s,p), третий – три (s,p,d) и т.д. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и (f). Сферическую атомную орбиталь ученые договорились называть s -орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p -орбиталь:
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x , y и z . Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
Итак, p -орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве – разное.
Составить схему последовательного заполнения электронами энергетических уровней
Теперь мы можем составить схему строения электронных оболочек атомов:
1. Определяем общее число электронов на оболочке по порядковому номеру элемента.
2. Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
3. Определяем число электронов на каждом энергетическом уровне.
4. Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме:
Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме:
На s -подуровне может находиться одна атомная орбиталь
а на p -подуровне их может быть уже три –
(в соответствии с тремя осями координат):
Орбиталей d – и f -подуровня в атоме может быть уже пять и семь соответственно:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
Чтобы установить связь между строением атома химического элемента и его свойствами, рассмотрим еще несколько химических элементов.
Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:
Так как на первом энергетическом уровне может находиться не более двух электронов, то он считается завершенным.
Элемент № 3 – литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:
Анализ атомного спектра показывает, что правильна последняя схема. Пользуясь этим правилом, нетрудно составить схему электронного строения для атома азота:
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:
У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Если элементы имеют одинаково устроенные внешние энергетические уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, то есть почти не вступают в химические реакции. В свободном виде аргон и неон – газы, которые имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
III. Выводы.
1. Свойства химических элементов, расположенных в порядке возрастания заряда ядра, периодически повторяются, так как периодически повторяется строение внешних энергетических уровней атомов элементов.
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
Электронная конфигурация атома – это формула, показывающая расположение электронов в атоме по уровням и подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Для чего изучать электронную конфигурацию элементов?
Атомы как конструктор: есть определённое количество деталей, они отличаются друг от друга, но две детали
одного типа абсолютно одинаковы. Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Но этот конструктор куда интереснее, чем пластмассовый и вот почему.
Конфигурация меняется в зависимости от того, кто есть рядом. Например, кислород рядом с водородом может превратиться в воду, рядом с натрием в газ, а находясь рядом с железом вовсе превращает его в ржавчину.
Что бы ответить на вопрос почему так происходит и предугадать поведение атома рядом с другим необходимо
изучить электронную конфигурацию, о чём и пойдёт речь ниже.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов – 16й элемент периодической системы. Золото имеет 79 протонов – 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин “орбиталь”, орбиталь – это волновая функция электрона, грубо – это область, в которой электрон проводит 90% времени.
N – уровень
L – оболочка
M l – номер орбитали
M s – первый или второй электрон на орбитали
Орбитальное квантовое число l
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии, облако принимает четыре основных формы: шар, гантели и другие две, более сложные. В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой. На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f) орбиталей. Орбитальное квантовое число – это оболочка, на которой находятся орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно принимает значения 0,1,2 или 3.
На s-оболочке одна орбиталь (L=0) – два электрона
На p-оболочке три орбитали (L=1) – шесть электронов
На d-оболочке пять орбиталей (L=2) – десять электронов
На f-оболочке семь орбиталей (L=3) – четырнадцать электронов
Магнитное квантовое число m l
На p-оболочке находится три орбитали, они обозначаются цифрами
от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали “-1”, “0” и “1”.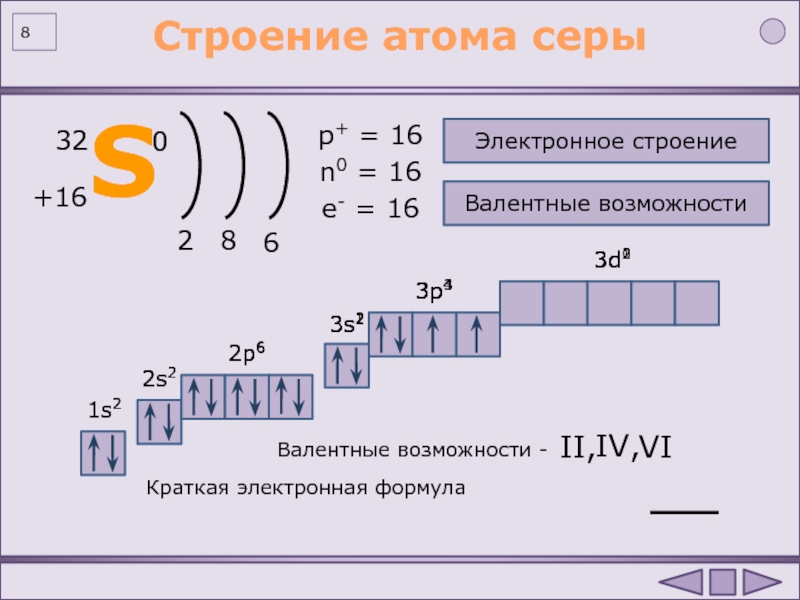 Магнитное квантовое число обозначается буквой m l .
Магнитное квантовое число обозначается буквой m l .
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку:
d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения M l =-2,M l =-1,M l =0, M l =1,M l =2.
Спиновое квантовое число m s
Спин – это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с противоположными спинами. Спиновое квантовое число обозначается m s
Главное квантовое число n
Главное квантовое число – это уровень энергии, на данный момент известны семь энергетических уровней,
каждый обозначается арабской цифрой: 1,2,3,. ..7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
..7. Количество оболочек на каждом уровне равно номеру уровня:
на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, M l =0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
Лекция № 17. Углеводы – коллекция курсовых, шпаргалок, лекций, дипломов
Лекция № 17
УГЛЕВОДЫ
План
Лекция № 17
УГЛЕВОДЫ
План
- Моносахариды.

- Дисахариды.
- Полисахариды.
Углеводы – это природные соединения, имеющие в
подавляющем большинстве состав
Cn(H2O)m.
Их подразделяют на низкомолекулярные углеводы и продукты их
поликонденсации.
Моносахариды – мономеры, из остатков
которых состоят углеводы более сложного строения.
Олигосахариды – олигомеры, содержащие от
2 до 10 моносахаридных остатков.
Полисахариды – полимеры, включающие до
нескольких тысяч моносахаридных звеньев.
1.
Моносахариды
1.1. Строение и
классификация
Моносахариды – это полигидроксикарбонильные соединения, в которых каждый атом
углерода (кроме карбонильного) связан с группой ОН. Общая формула моносахаридов
– Сn(H2O)n, где n
=3-9.
По химическому строению различают:
- альдозы – моносахариды, содержащие
альдегидную группу; - кетозы – моносахариды, содержащие
кетонную группу (как правило, в положении 2).
В зависимости от длины углеродной цепи моносахариды
делятся на триозы, тетрозы, пентозы, гексозы и т.д. Обычно моносахариды
классифицируют с учетом сразу двух этих признаков, например:
В природе встречаются производные моносахаридов,
содержащие аминогруппу (аминосахара), карбоксильную группу (сиаловые
кислоты, аскорбиновая кислота), а также атом Н вместо одной или нескольких
групп ОН (дезоксисахара).
Стереоизомерия
Все моносахариды (кроме дигидроксиацетона) содержат хиральные атомы углерода
и имеют стереоизомеры. Простейшая альдоза, глицериновый альдегид, содержит один хиральный атом С и существует в виде двух оптических изомеров
– D и L:
По мере увеличения длины цепи количество
стереоизомеров у альдогексоз растет. В соответствии с числом хиральных центров
существует 4 стереоизомерных альдотетрозы, 8 альдопентоз, 16 альдогексоз и т. д.
д.
В зависимости от конфигурации наиболее удаленного от карбонильной группы
хирального атома С все моносахариды делят на два стереохимических ряда –
D-моносахариды и L-моносахариды:
Подавляющее большинство природных моносахаридов
принадлежит к D-ряду.
Родоначальником ряда D-альдоз является
D-глицериновый альдегид. Остальные D-альдозы могут быть построены на основе
D-глицеральдегида путем последовательной вставки фрагмента СНОН сразу после
карбонильной группы. Стереоизомерные альдозы имеют тривиальные названия.
Уточним стереоизомерные отношения в ряду
D-альдоз. Между собой D-альдозы с одинаковым числом атомов углерода
(D-альдотетрозы, D-альдопентозы, D-альдогексозы и т.д.) являются
диастереомерами. Среди них выделяют особый тип диастереомеров, который называют эпимерами.
Эпимеры – это диастереомеры, которые
отличаются по конфигурации только одного хирального центра.
Например, D-рибоза и D-арабиноза являются эпимерами, так как отличаются
конфигурацией только хирального атома углерода в положении 2.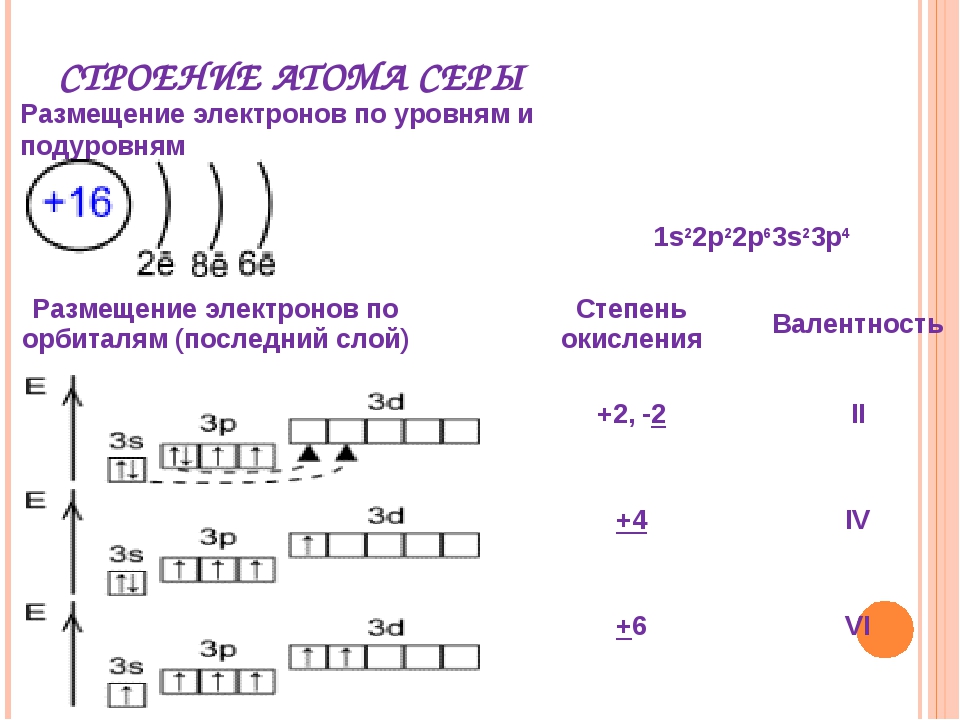 D-глюкоза имеет
D-глюкоза имеет
несколько эпимеров: D- маннозу по С-2, D-аллозу по С-3, D-галактозу по С-4,
L-иодозу по С-5.
Каждая из D-альдоз имеет энантиомер, относящийся к L-ряду, который может быть
построен аналогично D-ряду на основе L-глицеральдегида. Энантиомером D-глюкозы
является L-глюкоза, D-маннозы – L-манноза и т.д.
Ряд D-кетоз может быть построен на основе
простейшей кетозы – дигидроксиацетона. Названия кетоз образуются из названий
соответствующих альдоз путем введения суффикса “ул”. Для некоторых кетоз
утвердились тривиальные названия.
Дигидроксиацетон не содержит хирального атома С
и не имеет стереоизомеров. Остальные кетозы являются хиральными
соединениями.
В природе широко распространены гексозы
(D-глюкоза, D-галактоза, D-манноза, D-фруктоза) и пентозы (D-рибоза, D-ксилоза,
D-арабиноза). Среди производных моносахаридов наиболее распространенными
являются аминосахара D-глюкозамин и D-галактозамин и дезоксисахар
2-дезокси-D-рибоза.
Цикло-оксо-таутомерия
Известно, что альдегиды способны присоединять спирты с образованием
полуацеталей:
Карбонильная и гидроксильная группы
моносахаридов взаимодействуют внутримолекулярно с образованием циклического
полуацеталя:
При этом возникает новый хиральный центр –
бывший карбонильный, а теперь аномерный атом углерода. Наиболее устойчивы
циклические полуацетали, содержащие шестичленный (пиранозный) или
пятичленный (фуранозный) циклы. Они образуются при взаимодействии
альдегидной группы с гидроксильной группой в положении 5 или 4 моносахарида
соответственно. На рисунке представлена схема образования циклических форм
D-глюкозы:
Возникновение нового хирального центра приводит
к появлению 2-х стереоизомеров для каждой из циклической форм — a— и b—аномеров.
Аномеры – это эпимеры, которые различаются по
конфигурации аномерного атома углерода.
У a-аномера
конфигурация аномерного центра совпадает с конфигурацией концевого хирального
атома С, у b-аномера она противоположна.
Циклические формы моносахаридов изображают с
помощью формул Хеуорса. Молекулу представляют в виде плоского цикла,
перпендикулярного плоскости рисунка. Заместители, находившиеся в формуле Фишера
слева, располагают над плоскостью цикла, справа – под плоскостью. Для
определения положения группы СН2ОН в формуле Фишера предварительно делают две
перестановки.
В кристаллическом состоянии моносахариды
находятся в одной из циклических форм. При растворении образуется равновесная
смесь линейной и циклических форм. Их относительное содержание определяется
термодинамической стабильностью. Циклические, особенно пиранозные формы,
энергетически более выгодны для большинства моносахаридов. Например, в растворе
D-глюкозы преобладает b-D-глюкопираноза:
Существование равновесия между линейной и
циклическими формами моносахаридов получило название цикло-оксо-таутомерии.
Растворение кристаллического моносахарида
сопровождается постепенным таутомерным превращением, которое заканчивается
установлением таутомерного равновесия. Каждая таутомерная форма оптически
активна и имеет свою величину удельного вращения. Поэтому за таутомерным
превращением можно следить по изменению удельного вращения раствора, которое
заканчивается с установлением равновесия. Явление изменения удельного вращения
свежеприготовленного раствора моносахарида называют мутаротацией. Явление
мутаротации – одно из доказательств существования цикло-оксо-таутомерии у
моносахаридов.
Конформационное
строение
Формулы Фишера и Хеуорса являются условным
изображением пространственного строения моносахаридов. Близкое к действительному
расположение атомов в пространстве отражают конформационные
формулы.
Шестичленный цикл, в котором атомы находятся в
состоянии sp3-гибридизации, не
может иметь плоскую конформацию, так как это означало бы слишком сильное
искажение валентных углов (1200 вместо 1090) и заслоненное
положение заместителей. Наиболее выгодной конформацией для большинства
Наиболее выгодной конформацией для большинства
шестичленных циклов является конформация “кресла”, в которой все валентные углы
равны 1090 и нет заслоненных
положений заместителей. Так, у циклогексана есть две энергетически равноценные
конформации “кресла”, которые находятся в равновесии. Взаимопревращения между
ними называют инверсией цикла.
Заместители у каждого атома цикла могут
находиться в аксиальном (а) или экваториальном (е) положениях. Аксиальные связи расположены параллельно оси симметрии цикла и направлены
попеременно вверх и вниз. Экваториальные связи ориентированы под углом
1090 к оси симметрии цикла также
попеременно вверх и вниз. При инверсии цикла экваториальные связи становятся
аксиальными и наоборот.
При введении в циклогексан заместителей две
конформации кресла становятся энергетически неравноценными. Меньшей энергией,
как правило, обладает та конформация, в которой объемистые заместители занимают
экваториальное положение. Например, для циклогексанола наиболее выгодной
Например, для циклогексанола наиболее выгодной
является конформация с экваториальным положением ОН группы:
Основой строения пиранозных форм моносахаридов
является тетрагидропиран, для которого возможны две энергетически
неравноценные конформации кресла.
Более стабильной является конформация с
наименьшим числом объемистых заместителей в аксиальном положении. Для
большинства D-альдогексоз это конформация 4С1, в
которой группа CH2OH занимает
экваториальное положение.
Рассмотрим конформационное строение b-D-глюкопиранозы.
Более выгодной для этой формы D-глюкозы является конформация 4С1, в которой все заместители находятся в экваториальном
положении.
У a-аномера гликозидный гидроксил в этой конформации будет
занимать аксиальное положение. Поэтому в равновесной смеси таутомеров D-глюкозы
преобладает b-аномер.
b-D-глюкопираноза – единственная D-гексоза с
экваториальным положением всех заместителей.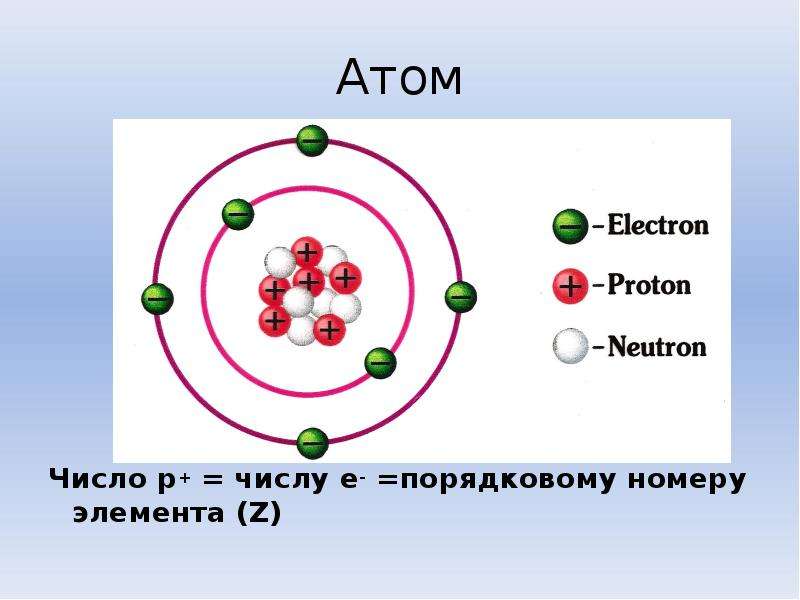 Как следствие этого, D-глюкоза —
Как следствие этого, D-глюкоза —
наиболее распространенный в природе моносахарид. Из всего семейства
D-альдогексоз в природе встречаются только эпимеры D-глюкозы – D-галактоза и
D-манноза, у которых число заместителей, занимающих аксиальное положение
минимально.
1.2. Химические
свойства
Химические свойства моносахаридов определяются
наличием карбонильной группы (в ациклической форме), полуацетального гидроксила
(в циклических формах) и спиртовых ОН групп.
Восстановление
При восстановлении карбонильной группы альдоз
образуются многоатомные спирты – глициты.
В лабораторных условиях для восcтановления
используют NaBH4. В
промышленности применяют каталитическое гидрирование. Таким образом получают
заменители сахара: из D-глюкозы — сорбит (D-глюцит), из D-ксилозы –
ксилит.
Восстановление альдоз приводит к “уравниванию”
функциональных групп на концах цепи. В результате из некоторых альдоз (эритрозы,
В результате из некоторых альдоз (эритрозы,
рибозы, ксилозы, аллозы, галактозы) образуются оптически неактивные
мезо-соединения, например:
Разные альдозы при восстановлении могут дать
один и тот же спирт.
Такая конфигурационная взаимосвязь между
глицитами использовалась для установления стереохимической конфигурации
моносахаридов.
При восстановлении кетоз из карбонильной группы
возникает новый хиральный центр и образуется смесь неравных количеств
диастереомерных спиртов (эпимеров по С-2).
Эта реакция доказывает, что D-фруктоза,
D-глюкоза и D-манноза имеют одинаковые конфигурации хиральных центров С-2, С-3,
и С-4.
Окисление
Вследствие своей полифункциональности альдозы
окисляются по-разному при действии различных окислителей. При этом может быть
окислена карбонильная группа, оба конца углеродной цепи или расщеплена связь
С-С.
Получение гликоновых кислот
При мягком окислении альдоз, например, под
действием бромной воды, затрагивается только карбонильная группа и образуются гликоновые кислоты, которые очень легко образуют пяти- и шестичленные
лактоны.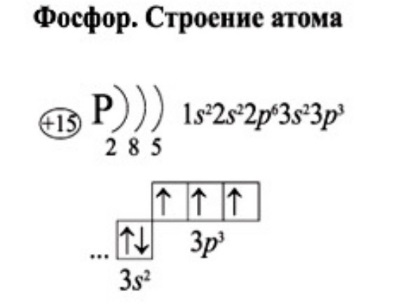
Кетозы в этих условиях не окисляются и могут
быть таким образом выделены из смесей с альдозами..
Альдозы и кетозы дают реакции, характерные
только для соединений, содержащих альдегидную группу: они восстанавливают в
щелочной среде катионы металлов Ag+ (Ag(NH3)2OH – реактив
Толенса) и Cu2+ (комплекс
Cu2+ с тартрат-ионом – реактив
Фелинга). При этом гликоновые кислоты образуются в незначительном
количестве, так как в щелочной среде протекает деградация углеродного скелета
моносахаридов.
Альдоза +
Ag(NH3)2+ —-> гликоновая кислота + Ag
+ продукты деструктивного окисления
Альдоза +
Cu2+ —-> гликоновая кислота +
Cu2O + продукты деструктивного окисления
Сахара, способные восстанавливать реактивы
Толенса и Фелинга, называют восстанавливающими.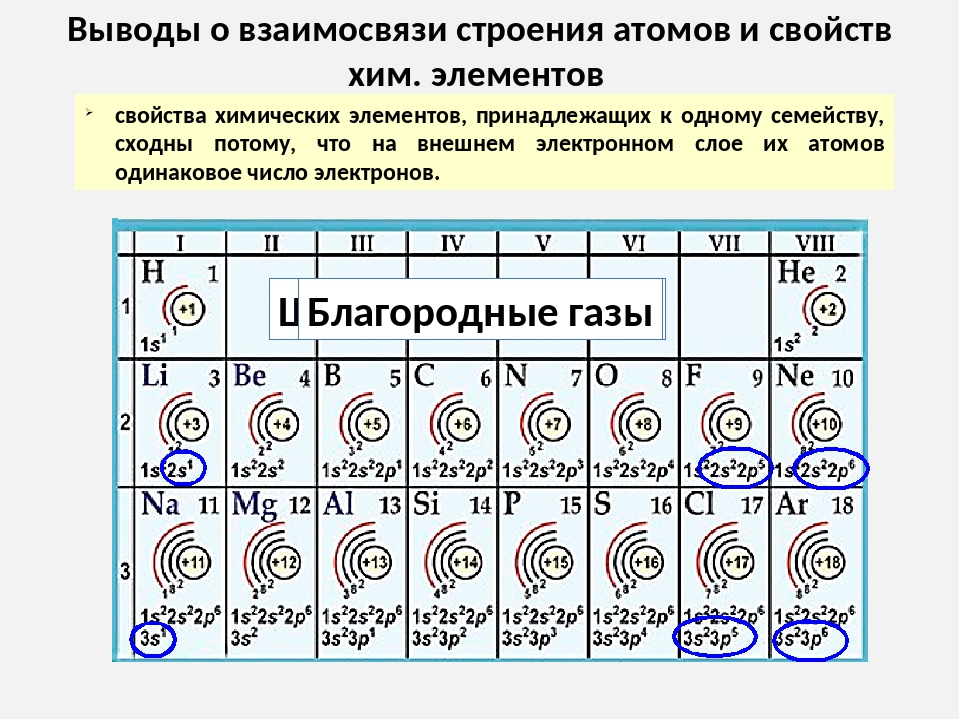 Кетозы проявляют
Кетозы проявляют
восстанавливающие свойства за счет изомеризации в щелочной среде в альдозы,
которые и взаимодействуют далее с окислителем. Процесс превращения кетозы в
альдозу происходит в результате енолизации. Образующийся из кетозы енол является
общим для нее и 2-х альдоз (эпимеров по С-2). Так, в слабощелочном растворе в
равновесии с D-фруктозой находятся ендиол, D-глюкоза и D-манноза.
Взаимопревращения в щелочном растворе между
альдозами, эпимерами по С-2, называют эпимеризацией.
Получение гликаровых кислот
При действии разбавленной азотной кислоты
окисляется оба конца углеродного скелета альдоз и образуются гликаровые
кислоты.
При образовании гликаровых кислот, как и в
случае глицитов, происходит “уравнивание” функциональных групп на концах цепи и
из некоторых альдоз образуются мезо-соединения.
Окисление кетоз азотной кислотой протекает с
расщеплением С-С связей.
В природе широко распространены гликуроновые
кислоты.
В лабораторных условиях они могут быть получены
только многостадийным синтезом, так как окисление спиртовой группы в присутствии
альдегидной требует предварительной защиты последней. Гликуроновые кислоты
входят в состав полисахаридов (пектиновые вещества, гепарин). Важная
биологическая роль D-глюкуроновой кислоты состоит в том, что многие токсичные
вещества выводятся из организма с мочой в виде растворимых глюкуронидов.
Получение гликозидов
Циклические формы моносахаридов содержат несколько групп ОН, одна из которых
– гликозидный (полуацетальный) гидроксил, отличается повышенной
склонностью к реакциям нуклеофильного замещения.
Известно, что в присутствии кислотных катализаторов полуацетали реагируют со
спиртами. При этом происходит нуклеофильное замещение полуацетального гидроксила
и образуются полные ацетали.
Аналогично реагирует гликозидный гидроксил в
альдозах и кетозах. Спиртовые ОН группы при этом не затрагиваются. Продукты
замещения гликозидного гидроксила называют гликозидами (гликопиранозидами или гликофуранозидами в
зависимости от размера цикла). Например, при пропускании через раствор D-глюкозы
в метаноле газообразного HCl образуется смесь метилглюкозидов, соответствующих
разным таутомерным формам D-глюкозы (двум пиранозным и двум фуранозным). В
условиях термодинамического контроля в реакционной смеси преобладают более
стабильные метилпиранозиды.
Метил-a-D-глюкопиранозид большей термодинамической
стабильностью, чем b-аномер и поэтому образуется в большем количестве.
Гликозиды существуют только в циклической форме, поэтому a— и b-аномеры гликозидов не могут
спонтанно переходить друг в друга в результате таутомерных превращений.
Гликозиды не имеют свободной альдегидной группы и являются невосстанавливающими сахарами.
Как полные ацетали гликозиды гидролизуются в
условиях кислотного катализа и устойчивы в разбавленных растворах щелочей.
Механизм кислотного гидролиза включает протонирование гликозидного кислорода,
расщепление гликозидной С-О связи с образованием гликозил-катиона, который затем
атакуется молекулой воды.
Расщепление гликозидной связи важно с
биологической точки зрения, поскольку многие природные соединения являются
гликозидами. Широко используется ферментативный гидролиз гликозидов,
преимущество которого заключается в его специфичности. Определенные ферменты
гидролизуют только a— или только b-гликозидные связи., что может быть использовано для
установления конфигурации гликозидной связи.
Молекулу гликозида рассматривают как состоящую
из двух частей – сахарной части и агликона:
В качестве агликона в природных гликозидах могут
выступать спирты, фенолы, стероиды, сами моносахариды. Перечисленные агликоны
связаны с сахарной частью через атом кислорода, поэтому такие гликозиды называют О-гликозидами. В природе широко распространены N-гликозиды, в
которых агликонами являются азотистые основания. К ним относятся нуклеозиды – структурные единицы нуклеиновых кислот.
Получение простых эфиров
Метиловые эфиры по спиртовым группам ОН получают
действием на моносахариды диметилсульфата в водном растворе щелочи или
метилиодида в присутствии оксида серебра. Эти методы являются модификациями
синтеза Вильямсона. При этом в реакцию вступает и гликозидный гидроксил. Простые
эфиры по спиртовым группа устойчивы к гидролизу, в то время как гликозидная
связь легко расщепляется в кислой среде.
Приведенная последовательность реакций
(метилирование, затем гидролиз) используется для определения размера цикла в
моносахаридах. Неметилированной остается группа ОН, которая участвовала в
образовании циклического полуацеталя.
Получение сложных эфиров
Гидроксильные группы моносахаридов легко
этерифицируются действием ангидриридов и хлорангидридов карбоновых кислот. Чаще
всего используют ацетилирование уксусным ангидридом в присутствии кислотного
(H2SO4, ZnCl2) или основного (пиридин, СH3COONa) катализатора.
Соотношение a— и b-аномеров зависит от условий
проведения реакции. В условиях термодинамического контроля (высокая температура,
кислотный катализатор) преобладает более стабильный a-аномер. В условиях
кинетического контроля (температура ниже 00С, основной катализатор) преимущественно образуется b-аномер, поскольку
экваториальная группа ОН ацилируется с большей скоростью, чем аксиальная.
Для удаления ацетильных групп используют
переэтерификацию действием метилата натрия в метаноле.
Получение производных по карбонильной
группе. Образование озазонов
Моносахариды вступают во многие реакции нуклеофильного присоединения по
карбонильной группе, характерные для альдегидов и кетонов: присоединяют HCN,
NH2OH, фенилгидразин. При действии
избытка фенилгидразина образуются озазоны.
Эпимеры по С-2, например, D-глюкоза и D-манноза,
дают один и тот же озазон, что используется для установления стереохимической
конфигурации моносахаридов. Кетозы также образуют озазоны. D-фруктоза дает такой
же озазон, что и D-глюкоза.
Озазоны – желтые кристаллические вещества,
используются для идентификации сахаров.
2. Дисахариды
2.1. Строение
Дисахариды состоят из двух моносахаридных остатков, связанных гликозидной
связью. Их можно рассматривать как О-гликозиды, в которых агликоном является
остаток моносахарида.
Возможно два варианта образования гликозидной связи:
1) за счет гликозидного гидроксила одного моносахарида и спиртового
гидроксила другого моносахарида;
2) за счет гликозидных гидроксилов обоих моносахаридов.
Дисахарид, образованный первым способом, содержит свободный гликозидный
гидроксил, сохраняет способность к цикло-оксо-таутомерии и обладает восстанавливающими свойствами.
В дисахариде, образованном вторым способом, нет
свободного гликозидного гидроксила. Такой дисахарид не способен к
цикло-оксо-таутомерии и является невосстанавливающим.
В природе в свободном виде встречается
незначительное число дисахаридов. Важнейшими из них являются мальтоза,
целлобиоза, лактоза и сахароза.
Мальтоза содержится в
солоде и образуется при неполном гидролизе крахмала. Молекула мальтозы состоит
из двух остатков D-глюкозы в пиранозной форме. Гликозидная связь между ними
образована за счет гликозидного гидроксила в a-конфигурации одного моносахарида и гидроксильной группы
в положении 4 другого моносахарида.
Мальтоза – это восстанавливающий дисахарид. Она способна к таутомерии и имеет a— и b-аномеры.
Целлобиоза – продукт
неполного гидролиза целлюлозы. Молекула целлобиозы состоит из двух остатков
D-глюкозы, связанных b-1,4-гликозидной связью. Целлобиоза – восстанавливающий
дисахарид.
Различие между мальтозой и целлобиозой состоит в
конфигурации гликозидной связи, что отражается на их конформационном строении.
Гликозидная связь в мальтозе имеет аксиальное, в целлобиозе – экваториальное
положение. Конформационное строение этих дисахаридов служит первопричиной
линейного строения макромолекул целлюлозы и спиралеобразного строения амилозы
(крахмал), структурными элементами которых они являются.
Лактоза содержится в молоке
(4-5%). Молекула лактозы состоит из остатков D-галактозы и D-глюкозы, связанных b-1,4-гликозидной связью.
Лактоза – восстанавливающий дисахарид.
Сахароза содержится в
сахарном тростнике, сахарной свекле, соках растений и плодах. Она состоит из
остатков D-глюкозы и D-фруктозы, которые связаны за счет гликозидных
гидроксилов. В составе сахарозы D-глюкоза находится в пиранозной, а D-фруктоза –
в фуранозной форме. Сахароза – невосстанавливающий дисахарид.
2.2. Химические
свойства
Дисахариды вступают в большинство реакций, характерных для моносахаридов:
образуют простые и сложные эфиры, гликозиды, производные по карбонильной группе.
Восстанавливающие дисахариды окисляются до гликобионовых кислот. Гликозидная
связь в дисахаридах расщепляется под действием водных растворов кислот и
ферментов. В разбавленных растворах щелочей дисахариды устойчивы. Ферменты
действуют селективно, расщепляя только a— или только b-гликозидную связь.
Последовательность реакций – окисление,
метилирование, гидролиз, позволяет установить строение дисахарида.
Окисление дает возможность определить, остаток
какого моносахарида находится на восстанавливающем конце. Метилирование и
гидролиз дают информацию о положении гликозидной связи и размерах цикла
моносахаридных звеньев. Конфигурация гликозидной связи ( a или b) может быть определена с
помощью ферментативного гидролиза.
3. Полисахариды
Полисахариды – полимеры, построенные из
моносахаридных остатков, связанных гликозидными связями. Полисахариды могут
иметь линейное или разветвленное строение. Полисахариды, состоящие
их одинаковых моносахаридных остатков, называют гомополисахаридами, из
остатков разных моносахаридов – гетерополисахаридами.
Крахмал – полисахарид
растительного происхождения. Его основная биологическая функция – запасное
вещество растений. Крахмал представляет собой смесь двух полисахаридов – амилозы (10-20%) и амилопектина (80-90%)
Амилоза – линейный гомополисахарид, состоящий из
остатков D-глюкопиранозы, связанных a-1,4-гликозидными связями. Структурным элементом амилозы
является дисахарид мальтоза.
Цепь амилозы включает от 200 до 1000
моносахаридных единиц. Вследствие аксиального положения гликозидной связи
макромолекула амилозы свернута в спираль.
Амилопектин – разветвленный гомополисахарид,
построенный из остатков D-глюкопиранозы, которые связаны в основной цепи a-1,4-гликозидными,
а в местах разветвлений — a-1,6-гликозидными связями. Разветвления расположены через
каждые 20-25 моносахаридных остатков.
Крахмал набухает и растворяется в воде, образуя
вязкие растворы (гели). Химические свойства крахмала аналогичны свойствам моно-
и дисахаридов. Крахмал гидролизуется под действием кислот (но не щелочей) и
фермента амилазы. Конечным продуктом гидролиза крахмала является
D-глюкоза.
(C6H10O5)n —>
(C6H10O5)m —>
C12H22O11 —>
C6H12O6
| крахмал | декстрины | мальтоза | D-глюкоза |
n>m
За счет спиралеобразной конформации амилоза
способна образовывать соединения включения с молекулярным иодом. Комплексы
крахмала с иодом имеют интенсивную синюю окраску. Реакция используется как
качественная на иод и крахмал.
Целлюлоза – самый распространенный
растительный полисахарид. Выполняет функцию опорного материала растений. Это
линейный гомополисахарид, построенный из остатков D-глюкопиранозы, связанных b-1,4-гликозидными
связями. Структурным элементом целлюлозы является целлобиоза.
Гликозидная связь в целлюлозе имеет
экваториальное положение. Это определяет линейную конформацию целлюлозы, которая
стабилизирована водородными связями.
Макромолекулы целлюлозы образуют волокна. В
отличие от крахмала целлюлоза в воде не набухает и не растворяется. Для перевода
целлюлозы в растворимую форму необходима её химическая модификация.
Среди других гомополисахаридов стоит отметить
следующие.
Декстраны – полисахариды бактериального
происхождения, построенные из остатков a-D-глюкопиранозы. Молекулы
декстранов сильно разветвлены. Основным типом связи является a -1,6-, а в местах
разветвлений a-1,4-, a-1,3-, реже a-1,2-гликозидные связи.
Декстраны используют как заменители плазмы крови.
Хитин – основной полисахарид роговых
оболочек насекомых и ракообразных, встречается в грибах. Хитин — неразветвленный
полисахарид, построенный их остатков N-ацетил-D-глюкозамина, связанных b-1,4-гликозидными
связями.
Пектиновые вещества содержатся в ягодах,
фруктах и овощах, способствуют желеобразованию Основной компонент пектиновых
веществ – пектовая кислота – линейный полисахарид, построенный их остатков
D-галактуроновой кислоты, связанных a-1,4-гликозидными связями.
Гетерополисахариды
Гетерополисахариды имеют в основном животное или
бактериальное происхождение. Важное значение имеют гетерополисахариды, входящие
в состав соединительной ткани. Полисахариды соединительной ткани находятся в
виде углевод-белковых комплексов — протеогликанов. Наиболее важные из
них: хондроитинсульфаты (кожа, хрящи, сухожилия), гиалуроновая
кислота (хрящи, стекловидное тело глаза, суставная жидкость), гепарин (печень, кровеносные сосуды). Для этих полисахаридов характерны общие черты в
строении. Они имеют неразветвленную структуру и содержат биозные фрагменты,
включающие гликуроновые кислоты и ацетилированные аминосахара. Например,
гиалуроновая кислота состоит из дисахаридных фрагментов, включающих D-глюкуроновую кислоту и
N-ацетил-D-глюкозамин, которые связан внутри биозного фрагмента b-1,3-гликозидной связью, между
биозными фрагментами — b-1,4-гликозидной связью.
Атомная структура
Атомная структура Атомные спектры – что мы видим из атомов?Что составляет атом? Атом состоит из тяжелого ядра протонов. (положительно заряженные частицы, записанные как p + ) и нейтроны (нейтральные частицы, записанные как n 0 ), вокруг которых вращается облако чрезвычайно легкие электроны (отрицательно заряженные частицы, обозначаемые как e – ).
Что определяет элемент? Число протонов в ядре каждый атом.
- Атомы водорода (H) имеют 1 протон.
- Атомы водорода с 1 протоном и 1 электроном нейтральны водород ( 1 H 1 ).
- Атомы водорода с 1 протоном, 1 электроном и 1 нейтроном – это тяжелые изотоп водорода называется дейтерий ( 2 H 1 ).
- Если к водороду добавить протон, мы получим другой элемент – гелий ( 4 He 2 ).
- Номенклатура: для каждого элемента верхний индекс обозначает количество протоны и нейтроны, а нижний индекс – число протонов.
- Сколько нейтронов содержится в нейтральном углероде ( 12 C 6 )?
- Сколько нейтронов содержится в радиоактивном изотопе называется углерод-14 ( 14 C 6 )?
[NMSU, N. Vogt]
Как состав атома или элемента говорит нам, как будет выглядеть его спектр?
- Электроны существуют в стационарных состояниях внутри атомов, каждое из которых определяется дискретный, уникальный уровень энергии.Только определенные уровни энергии, например, орбиты с определенными радиусами.
- Свет или излучение, испускаемое или поглощаемое атомами при движении электронов из
один энергетический уровень на другой можно представить как поток квантов называется фотонами. Каждый фотон несет энергию E = h × v . Мы определяем
эти уровни энергии выглядят следующим образом, говоря, что электрон находится в возбуждено состояние, когда у него есть дополнительная энергия (представьте ребенка, отскакивающего от
стены от волнения).
[NMSU, N. Vogt] - Основное состояние , минимально возможный уровень энергии
- Первое возбужденное состояние, следующий наивысший допустимый уровень энергии
- Второе возбужденное состояние, следующий наивысший допустимый уровень энергии
- Третье возбужденное состояние, следующий наивысший допустимый уровень энергии
- …
- До момента, когда электрон больше не связан с атомом
- Атом обычно имеет одинаковое количество протонов и электронов.Так как протоны имеют положительный заряд, а электроны – отрицательный, он несет бесплатно в этом состоянии. Когда атом теряет (или приобретает) электрон, мы говорим: что он ионизирован, , а затем несет электрический заряд.
Энтропия говорит нам, что все вещи естественным образом тянутся к минимуму из возможных. энергетическое состояние:
- Бревна и катятся под гору.
- Прыгающие шары медленно останавливаются.
- Люди падают спать по ночам, а утром им трудно встать.
- Таким же образом атомы водорода стремятся находиться в основном состоянии.
- Большинство фотонов проносятся мимо, не взаимодействуя с атомом.
- Но фотоны только с правой энергией поглощаются атомом.
- В данном случае справа означает, что энергия фотона соответствует
разница уровней энергии между разрешенными орбитами в водороде
атом, а поглощено означает, что энергия фотона будет
попадает в атом (оставляя атом в более высоком энергетическом состоянии).
[NMSU, N. Vogt] - Фотон с частотой v будет поглощен атомом, если энергия фотона соответствует разнице уровней энергии между разрешенными состояния в атоме.
Что будет дальше?
- Помните, что энтропия стремится к наименьшему доступному уровню энергии для всех. вещи, поэтому электрон, который был поднят на возбужденную орбиту, будет в конечном итоге вернуться в основное состояние.
- Сохранение энергии , говорит нам, что разница в энергии
между возбужденным состоянием и основным состоянием должно появиться где-то, когда
электрон совершает переход. Он испускается атомом в виде фотона с
та же энергия, что и исходная, которая была поглощена.
[NMSU, N. Vogt]
Вот схематическая диаграмма разрешенных орбит в атоме водорода. Если Вы можете ответить на вопросы, перечисленные ниже, вы поняли!
- Какой переход (ы) соответствует (ам) поглощению фотона? A&D
- Какой переход соответствует излучаемым фотонам с наивысшей энергией ? C
- Какой переход соответствует испускаемому фотону с самой короткой длиной волны ? C
- Какой переход соответствует фотону с наименьшей энергией и поглощенному фотону? А
- Какой переход соответствует самой высокой частоте испускаемого фотона? C
| [NMSU, N.Vogt] |
Спасибо Майку Болте (Калифорнийский университет в Санта-Круз) за основное содержание этого слайда.
Схема строения атома (принт № 6283851). Фото в рамке
Схема строения атома в рамке
Схема, представляющая строение атома. Атом состоит из одного или нескольких электронов (синий), которые вращаются вокруг крошечного центрального ядра. Ядро состоит из протонов (красный) и нейтронов (зеленый), удерживаемых вместе сильной ядерной силой. Количество электрически положительных протонов уравновешивает количество электрически отрицательных электронов, чтобы сделать атом в целом нейтральным.Показанный атом – это литий, который имеет 3 электрона, 3 протона и 4 нейтрона (показаны только 3 из них). Орбиты электронов представлены традиционно; в действительности орбиты электронов более эксцентричны и намного дальше от ядра атома
Мы рады предложить этот отпечаток из библиотеки Science Photo Library в сотрудничестве с Science Photo Library
Библиотека научных фотографий содержит изображения науки и медицины, включая фотографии и иллюстрации.
© ДЭВИД ПАРКЕР / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Идентификатор носителя 6283851
Атом Атомное ядро Атомная структура Химическая Химия Электрон Нейтрон Физика элементарных частиц Протон Представление Представляя Структура
14 дюймов x 12 дюймов (38 x 32 см) в современной раме
Наши современные репродукции в рамке профессионально сделаны и готовы повесить на вашу стену
проверить
Гарантия идеального качества пикселейчек
Изготовлен из высококачественных материаловпроверить
Изображение без кадра 24.4 x 17 см (прибл.)check
Профессиональное качество отделкиклетка
Размер продукта 37,6 x 32,5 см (прибл.)Наши водяные знаки не появляются на готовой продукции
Рамка под дерево, на карточке, печать фотографий архивного качества 10×8. Габаритные внешние размеры 14×12 дюймов (38×32 см). Экологически чистые и озонобезопасные молдинги Polycore® шириной 40 мм x 15 мм выглядят как натуральное дерево, они прочные, легкие и их легко повесить. Биоразлагаемый и сделанный с использованием нехлорированных газов (без токсичных паров), он эффективен; производя 100 тонн пенополистирола, можно спасти 300 тонн деревьев! Отпечатки глазируются легким небьющимся акрилом с оптической прозрачностью (обеспечивающим такую же общую защиту от окружающей среды, как и стекло).Спинка – прошитый ДВП с прикрепленной пилообразной подвеской. Примечание. Чтобы свести к минимуму обрезку оригинального изображения, обеспечить оптимальную компоновку и обеспечить безопасность печати, видимый отпечаток может быть немного меньше
Код товара dmcs_6283851_80876_736
Фотографическая печать Печать в рамке Плакат Печать Пазл Печать на холсте Поздравительные открытки Фото кружка Художественная печать Металлический принт Печать в рамке Установленное фото Подушка Коврик для мыши Премиум обрамление Стеклянная подставка Акриловый блок Стеклянная рамка Сумка Стеклянные коврики
Полный диапазон художественной печати
Наши стандартные фотоотпечатки (идеально подходят для кадрирования) отправляются в тот же или на следующий рабочий день, а большинство других товаров отправляется на несколько дней позже.
Фотопечать (6,07–60,80 долл.)
Наши фотопринты напечатаны на прочной бумаге архивного качества для яркого воспроизведения и идеально подходят для кадрирования.
Принт с рамкой (54,72 доллара – 279,73 доллара)
Наши современные репродукции в рамке профессионально сделаны и готовы повесить на вашу стену
Печать плакатов (13,37–72,97 долларов США)
Бумага для плакатов архивного качества, идеально подходит для печати больших изображений
Пазл (34 доллара.04 – 46,21 долл. США)
Пазлы – идеальный подарок на любой случай.
Печать на холсте (36,48–304,05 долл.)
Профессионально сделанные, готовые к развешиванию Отпечатки на холсте – отличный способ добавить цвет, глубину и текстуру в любое пространство.
Поздравительные открытки (7,26–14,58 долларов США)
Поздравительные открытки на дни рождения, свадьбы, юбилеи, выпускные, благодарности и многое другое
Фотокружка (12,15 $)
Наслаждайтесь любимым напитком из кружки, украшенной любимым изображением.Сентиментальные и практичные персонализированные фотокружки станут идеальным подарком для близких, друзей или коллег по работе
Fine Art Print (36,48 – 243,24 доллара)
Наши репродукции репродукций произведений искусства соответствуют стандартам самых критичных музейных хранителей, что делает их еще лучше, чем оригинальные произведения искусства с мягкой текстурированной естественной поверхностью.
Metal Print (71,76 – 363,66 долларов)
Сделанные из прочного металла и роскошной техники печати, металлические принты оживляют изображения и добавляют современный вид любому пространству.
Печать в рамке (54 долл.72 – 304,05 долл. США)
Наш оригинальный ассортимент британских принтов в рамке со скошенной кромкой
Фото (15,80 – 158,10 долларов)
Фотопринты поставляются в держателе для карт с индивидуальным вырезом, готовые к обрамлению
Подушка (30,39 $ – 54,72 $)
Украсьте свое пространство декоративными мягкими подушками
Коврик для мыши (17,02 доллара США)
Фотопечать архивного качества на прочном коврике для мыши с нескользящей подложкой. Работает со всеми компьютерными мышками.
Премиум обрамление (109,45–352,70 долл.)
Наши превосходные фоторамки премиум-класса профессионально изготовлены и готовы повесить на вашу стену
Glass Coaster (9,72 доллара)
Индивидуальная стеклянная подставка под столешницу. Элегантное полированное безопасное закаленное стекло и подходящие термостойкие коврики также доступны
Acrylic Blox (36,48–60,80 долларов США)
Обтекаемая, современная односторонняя привлекательная настольная печать
Стеклянная рамка (27 долл.96 – 83,93 доллара США)
Крепления из закаленного стекла
идеально подходят для настенного дисплея, а меньшие размеры также можно использовать отдельно с помощью встроенной подставки.
Большая сумка (36,43 доллара)
Наши сумки-тоут изготовлены из мягкой прочной ткани и оснащены ремнем для удобной переноски.
Стеклянные коврики (60,80 $)
Набор из 4 стеклянных ковриков. Элегантное полированное безопасное стекло и термостойкое. Также доступны подходящие подстаканники
Как нарисовать диаграммы электронной конфигурации | Feature
Схема электронной конфигурации – это модель, которая изображает положение электронов, когда они вращаются вокруг ядра атома.Электроны представлены точками или крестиками и расположены на энергетических уровнях или «оболочках» вокруг центрального ядра. Иногда это называют моделью Bohr или «солнечной системой».
Загрузите это
Эта инфографика предназначена для показа в качестве плаката в классе, хотя ее также можно отобразить на проекторе или распечатать в виде раздаточного материала.
Используйте прилагаемый информационный бюллетень и рабочий лист, чтобы научить учащихся рисовать схемы электронной конфигурации.
Скачать все
В модели Бора есть несколько правил, которые помогут вам построить точные диаграммы.
- Электроны должны занимать самую низкую доступную оболочку , ближайшую к ядру .
- Максимальное количество электронов, которое может заполнить каждую оболочку :
- два в первой оболочке,
- восемь во втором корпусе,
- восьмерка в третьем снаряде.
- Кальций , элемент 20 -й , имеет еще два электрона, которые входят в четвертую оболочку .
В сокращенном обозначении для электронной конфигурации количество электронов в каждой оболочке может быть записано, а не нарисовано. Каждая оболочка отделяется точкой или запятой. Для азота это будет 2,5 или 2,5, а для кальция – 2,8,8,2 или 2,8,8,2.
Знаете ли вы…?Расположение электронов элемента подскажет, где он находится в периодической таблице .Число оболочек показывает, в каком периоде или ряду он находится, а количество электронов во внешней оболочке показывает, в какой группе он находится.
Как нарисовать схему электронной конфигурации
Теперь нарисуйте первые 20 элементов
Все иллюстрации © Дэн Брайт
Атомная структура – обзор
1.09.6.2.2 Подвижность при конечной температуре
Релаксированная атомная структура из Раздел 1.09.6.2.1 при нулевом напряжении можно использовать для построения начальных условий для МД-моделирования для расчета подвижности дислокаций при конечной температуре. Дислокация в Раздел 1.09.6.2.1 периодична по своей длине ( z -ось) с относительно коротким повторяющимся расстоянием 21¯1¯2. В реальном кристалле флуктуация линии дислокации может быть важной для ее подвижности. Поэтому мы увеличиваем длину блока моделирования в пять раз по оси z , реплицируя атомную структуру перед запуском моделирования MD.Таким образом, ячейка МД-моделирования имеет размеры 30 [111], 401¯10, 101¯1¯2 по осям x , y , z соответственно и содержит 10 7070 атомов.
В следующем разделе мы вычисляем скорость дислокации при нескольких напряжениях сдвига при T = 300 K. Для простоты моделирование, в котором прикладывается напряжение сдвига, выполняется в ансамбле NVT. Однако объем ячейки моделирования необходимо отрегулировать от нулевого значения температуры, чтобы учесть эффект теплового расширения.Размеры ячеек корректируются с помощью серии симуляций NVT с использованием подхода, аналогичного тому, который использовался в , Раздел 1.09.6.1.2 , за исключением того, что ε xx , ε yy , ε zz разрешено настраивать самостоятельно. Как мы обнаружили в , Раздел 1.09.6.1.2 , для идеального кристалла тепловая деформация при 300 К составляет ε = 0,00191, ε xx , ε yy , ε zz инициализируются этим значением в начале уравновешивания.
После уравновешивания в течение 10 пс, мы выполняем моделирование MD при различных напряжениях сдвига σ xy до 100 МПа. Моделирование выполняется методом цепочки NVT с использованием алгоритма Velocity Verlet с Δ t = 1 фс. Напряжение сдвига прикладывается путем добавления внешних сил к поверхностным атомам таким же образом, как в , раздел 1.09.6.2.1 . Атомарные конфигурации сохраняются периодически каждые 1 пс. Для каждой сохраненной конфигурации вычисляется параметр CSD 45 каждого атома.Из-за тепловых флуктуаций некоторые атомы в объеме также могут иметь значения CSD, превышающие 0,6 Å 2 . Следовательно, только атомы, значение CSD которых составляет от 4,5 до 10,0 Å 2 , классифицируются как атомы ядра дислокации.
На рисунке 9 (а) показано среднее положение ( x ) атомов ядра дислокации как функция времени при различных приложенных напряжениях. Из-за PBC в направлении x – возможно иметь определенные атомы ядра на левом крае ячейки с другими атомами ядра на правом краю ячейки, когда ядро дислокации перемещается к границе ячейки.В этом случае нам нужно убедиться, что все атомы находятся в пределах ближайшего изображения друг друга, при вычислении их среднего положения в направлении x . Когда конфигурации сохраняются достаточно часто, дислокация не может переместиться более чем на длину коробки в направлении x с момента последнего сохранения конфигурации. Следовательно, среднее положение дислокации 〈 x 〉 на данном снимке принимается как ближайшее изображение среднего положения дислокации на предыдущем снимке, так что 〈 x 〉 〈 t 〉 отображается на рис. а) выглядят как плавные кривые.
Рис. 9. (a) Среднее положение атомов ядра дислокации как функция времени при различных напряжениях сдвига. (б) Скорость дислокации как функция σ xy при T = 300 K.
Рисунок 9 (a) показывает, что все кривые 〈 x 〉 〈 t 〉 при t = 0 имеют нулевой наклон и ненулевую кривизну, что указывает на ускорение дислокации. В конце концов, 〈 x 〉 становится линейной функцией от t , указывая на то, что дислокация перешла в установившееся движение.Скорость дислокации вычисляется из наклона 〈 x 〉 ( t ) во второй половине периода времени. Рисунок 9 (b) показывает скорость дислокации, полученную таким образом, как функцию приложенного напряжения сдвига. Скорость дислокации оказывается линейной функцией напряжения в пределе низких напряжений с подвижностью M = v / σxy · b = 2,6 · 104 Па-1 · с-1. Подвижность дислокаций – один из важных входных параметров материала для моделирования динамики дислокаций (DD). 46–48
Для точного прогнозирования скорости и подвижности дислокации необходимо проводить МД-моделирование в течение достаточно длительного времени, чтобы гарантировать наблюдение стационарного движения дислокации.Размер ячейки моделирования также необходимо варьировать, чтобы гарантировать, что результаты сходятся к пределу большой ячейки. Для больших ячеек моделирования обычно необходимы параллельные вычисления, чтобы ускорить моделирование. Программа LAMMPS 49 (http://lammps.sandia.gov), разработанная в Sandia National Labs, представляет собой программу параллельного моделирования, которая широко используется для моделирования твердых тел методом МД.
ЭЛЕКТРОННАЯ СТРУКТУРА И АТОМНЫЕ ОРБИТАЛЫ Простой вид В любом вводном курсе химии вы встретите электронные структуры водорода и углерода, изображенные как: | ||
Примечание: Есть много мест, где вы все еще можете использовать эту модель атома на уровне A ‘.Однако это упрощение и может ввести в заблуждение. Создается впечатление, что электроны вращаются вокруг ядра по орбитам, как планеты вокруг Солнца. Как вы вскоре увидите, невозможно точно знать, как они на самом деле движутся. | ||
Кружки показывают уровни энергии, представляющие увеличивающиеся расстояния от ядра. Вы можете выпрямить круги и нарисовать электронную структуру в виде простой энергетической диаграммы. Атомные орбитали Орбиты и орбитали кажутся похожими, но имеют совершенно разные значения. Важно, чтобы вы понимали разницу между ними. Невозможность рисования орбит для электронов Чтобы проложить путь к чему-либо, вам нужно точно знать, где находится объект, и уметь точно определить, где он будет через мгновение. Вы не можете сделать это с электронами. | ||
Примечание: Для построения курса самолета бесполезно знать его точное местоположение в средней части Атлантического океана, если вы не знаете его направление или скорость.В равной степени бесполезно знать, что он движется со скоростью 500 миль в час на запад, если вы не знаете, находится ли он в данный момент рядом с Исландией или Азорскими островами. | ||
Принцип неопределенности Гейзенберга (не требуется на A-уровне) говорит – в общих чертах – что вы не можете точно знать, где находится электрон и куда он пойдет дальше. Это делает невозможным построение орбиты электрона вокруг ядра. Это большая проблема? Нет.Если что-то невозможно, вы должны принять это и найти способ обойти это. Электрон водорода – орбиталь 1с | ||
Примечание: На этой диаграмме (и последующих орбитальных диаграммах) ядро показано намного больше, чем оно есть на самом деле. Это просто для ясности. | ||
Предположим, у вас есть единственный атом водорода, и в определенный момент вы построили график положения одного электрона.Вскоре после этого вы делаете то же самое и обнаруживаете, что это новое положение. Вы не представляете, как он переместился с первого места на второе. Вы продолжаете делать это снова и снова и постепенно создаете своего рода трехмерную карту мест, где может быть обнаружен электрон. В случае водорода электрон можно найти где угодно в сферическом пространстве, окружающем ядро. На схеме показано поперечное сечение этого сферического пространства. 95% времени (или любой другой процент, который вы выберете) электрон будет находиться в довольно легко определяемой области пространства, довольно близко к ядру.Такая область космоса называется орбиталью . Орбиталь можно представить как область пространства, в которой живет электрон. | ||
Примечание: Если вы хотите быть абсолютно уверены на 100% в том, где находится электрон, вам придется нарисовать орбиталь размером с Вселенную! | ||
Что делает электрон на орбите? Мы не знаем, мы не можем знать и поэтому просто игнорируем проблему! Все, что вы можете сказать, это то, что если электрон находится на определенной орбитали, он будет иметь определенную определяемую энергию. У каждой орбиты есть имя. Орбиталь, занятая водородным электроном, называется орбиталью 1s. “1” представляет тот факт, что орбиталь находится на уровне энергии, ближайшем к ядру. “s” расскажет вам о форме орбиты. s-орбитали сферически симметричны вокруг ядра – в каждом случае они похожи на полый шар из довольно массивного материала с ядром в центре. Орбиталь слева – это орбиталь 2s. Это похоже на орбиталь в 1 с, за исключением того, что область, где есть наибольшая вероятность обнаружения электрона, находится дальше от ядра – это орбиталь на втором уровне энергии. Если вы посмотрите внимательно, вы заметите, что есть еще одна область с немного большей электронной плотностью (где точки более толстые), ближе к ядру. («Электронная плотность» – это еще один способ сказать о том, насколько вероятно, что вы найдете электрон в определенном месте.) 2s (и 3s, 4s и т. Д.) Электронов проводят часть своего времени ближе к ядру, чем вы могли ожидать. Это приводит к небольшому снижению энергии электронов на s-орбиталях. Чем ближе к ядру электроны, тем меньше их энергия. 3s, 4s и т. Д. Орбиталей постепенно удаляются от ядра. p орбитали Не все электроны обитают на s-орбиталях (на самом деле очень мало электронов живет на s-орбиталях).На первом энергетическом уровне единственная доступная для электронов орбиталь – это 1s-орбиталь, но на втором уровне, помимо 2s-орбиталей, есть также орбитали, называемые 2p-орбиталями. Орбиталь p похожа на два идентичных шара, связанных вместе в ядре. На диаграмме справа показано сечение этой трехмерной области пространства. И снова орбиталь показывает, где есть 95% шанс найти конкретный электрон. | ||
Beyond A’level: Если вы представите горизонтальную плоскость, проходящую через ядро, с одной долей орбитали над плоскостью, а другой под ней, вероятность обнаружения электрона в этой плоскости равна нулю.Итак, как электрон попадает из одной доли в другую, если он никогда не может пройти через плоскость ядра? Для химии A’level вы просто должны признать, что это так! Если вы хотите узнать больше, прочтите о волновой природе электронов. | ||
В отличие от s-орбитали, p-орбиталь указывает в определенном направлении – нарисованная указывает вверх и вниз по странице. На любом уровне энергии возможно наличие трех абсолютно эквивалентных p-орбиталей, направленных взаимно под прямым углом друг к другу.Им произвольно присвоены символы p x , p y и p z . Это просто для удобства – то, что вы можете представить как направление x, y или z, постоянно меняется, когда атом падает в пространстве. P-орбитали на втором уровне энергии называются 2p x , 2p y и 2p z . Аналогичные орбитали есть на последующих уровнях – 3p x , 3p y , 3p z , 4p x , 4p y , 4p z и так далее. Все уровни, кроме первого, имеют p орбиталей. На более высоких уровнях доли становятся более вытянутыми, и наиболее вероятное место, где можно найти электрон, находится дальше от ядра. Размещение электронов на орбиталях Поскольку на данный момент нас интересуют только электронные структуры водорода и углерода, нам не нужно беспокоиться о том, что происходит за пределами второго энергетического уровня.
Каждая орбиталь может содержать 1 или 2 электрона, но не более. “Электроны в ящиках” Орбитали можно представить в виде прямоугольников, в которых электроны показаны стрелками. Часто стрелки вверх и вниз используются, чтобы показать, что электроны чем-то отличаются. | ||
Beyond A’level: Необходимость, чтобы все электроны в атоме были разными, исходит из квантовой теории.Если они живут на разных орбитах, это нормально, но если они оба находятся на одной орбите, между ними должно быть какое-то тонкое различие. Квантовая теория наделяет их свойством, известным как «вращение», – что и предполагают стрелки. | ||
Орбиталь в 1 с, содержащую 2 электрона, будет нарисована, как показано справа, но ее можно записать еще быстрее, как 1 с 2 . Это читается как «один на два», а не как «один на квадрат». Не путайте два числа в этом обозначении: Порядок заполнения орбиталей Электроны заполняют низкоэнергетические орбитали (ближе к ядру) до того, как заполняют более высокоэнергетические. Если есть выбор между орбиталями с одинаковой энергией, они заполняют орбитали по отдельности, насколько это возможно. Диаграмма (не в масштабе) суммирует энергии различных орбиталей на первом и втором уровнях. Обратите внимание, что орбиталь 2s имеет немного меньшую энергию, чем орбитали 2p.Это означает, что 2s-орбиталь заполнится электронами до 2p-орбиталей. Все 2p-орбитали имеют одинаковую энергию. Электронная структура водорода Водород имеет только один электрон, и он выйдет на орбиталь с наименьшей энергией – орбиталь 1с. Водород имеет электронную структуру 1s 1 . Мы уже описывали эту орбиталь ранее. Электронная структура углерода Углерод имеет шесть электронов.Два из них будут найдены на орбитали 1s рядом с ядром. Следующие два выйдут на орбиту 2s. Остальные будут на двух отдельных 2p-орбиталях. Это связано с тем, что все p-орбитали имеют одинаковую энергию, и в этом случае электроны предпочитают находиться самостоятельно. | ||
Примечание: Иногда люди задаются вопросом, почему электроны выбирают орбитали 2p x и 2p y , а не 2p z .Они этого не делают! Все 2p-орбитали в точности эквивалентны, и имена, которые мы им даем, совершенно произвольны. Это просто выглядит аккуратнее, если мы назовем орбитали, которые занимают электроны, 2p x и 2p y . | ||
Электронная структура углерода обычно записывается 1s 2 2s 2 2p x 1 2p y 1 .
© Джим Кларк 2000 (изменено в феврале 2013 г.) | ||
Точечные структуры Льюиса | Grandinetti Group
Во время химической связи валентные электроны перемещаются между различными атомами.Чтобы отслеживать валентные электроны для каждого атома и то, как они могут быть разделены при связывании, мы используем точечную структуру Льюиса для атомов и молекул. В этом подходе мы представляем валентные электроны в виде точек вокруг символа элемента. Например, кислород имеет 6 валентных электронов, поэтому мы пишем символ O для кислорода и окружаем его 6 точками:
Неспаренные электроны представлены в виде одиночных точек, а спаренные электроны – в виде двойных точек. Размещение одинарных или двойных точек вокруг символа не имеет решающего значения.В качестве альтернативы мы можем представить спаренные электроны в виде линии. То есть мы заменяем двойные точки, как показано ниже:
Рассмотрим другие примеры. У атома натрия 11 электронов, но только один является валентным электроном. Остальные 10 находятся внутри закрытой оболочки с электронной конфигурацией неона. Таким образом, мы рисуем структуру Льюиса для атома натрия в виде символа Na с единственной точкой:
У атома хлора 17 электронов, но только 7 из них валентные. Таким образом, мы рисуем структуру Льюиса как:
В ионных связях валентных электронов полностью переносятся (не разделяются).Таким образом, мы запишем структуру Льюиса для NaCl как:
Как вы можете видеть, теперь хлор окружен 8 электронами в оболочке с n = 3, а натрий потерял один валентный электрон в оболочке с n = 3. Конечно, натрий все еще окружен 8 электронами оболочки n = 2, но мы не показываем электроны во внутренних замкнутых оболочках.
Для элементов периода 2, где все валентные электроны атома находятся на s- и p-орбиталях, мы обнаруживаем, что точечная структура молекул Льюиса часто соответствует правилу Октета:
Правило октетов – Атомы имеют тенденцию приобретать, терять или делиться электронами, пока они не будут окружены восемью электронами (4 пары электронов).
Используя точечные структуры Льюиса и правило октетов, мы можем предсказать и представить электронную структуру ковалентно связанных молекул. Например, когда два атома хлора, каждый с 7 валентными электронами, объединяются, чтобы сформировать двухатомную молекулу хлора, структура Льюиса показывает, что будет разделение двух электронов между двумя атомами хлора, что позволяет окружить оба хлора 8 электроны.
Конечно, водород – это элемент с периодом 1, с орбиталью всего в 1 с, поэтому он имеет максимум два электрона, разрешенных в его валентной оболочке.Когда два атома водорода объединяются в двухатомную молекулу H 2 , структура Льюиса показывает, что два электрона разделяются между двумя атомами водорода, что позволяет окружить оба атома водорода замкнутой n = 1 оболочкой из 2 электронов:
Мы можем представить электронную структуру и реакцию атомов водорода и хлора с образованием HCl с помощью структур Льюиса:
Для двухатомного кислорода точечная структура Льюиса предсказывает двойную связь.
Хотя диаграмма Льюиса правильно предсказывает наличие двойной связи между атомами O, она неверно предсказывает, что все валентные электроны спарены ( i.е. , он предсказывает, что каждый валентный электрон находится на орбитали с другим электроном противоположного спина). Позже мы рассмотрим более продвинутый теоретический подход под названием «Теория молекулярных орбиталей», который правильно предсказывает как двойную связь O 2 , так и его неспаренные валентные электроны. Как правило, точечные структуры Льюиса имеют то преимущество, что с ними легко работать, и они часто дают хорошее представление об электронной структуре. Рассмотрим другой пример. Для двухатомного азота структура точек Льюиса правильно предсказывает наличие тройной связи между атомами азота:
Эта тройная связь очень сильна.Прочность тройной связи делает молекулу N 2 очень устойчивой к химическим изменениям, и, фактически, N 2 считается химически инертным газом . Существует связь между количеством общих электронных пар. и длина связи.
| Связка | Длина связки |
|---|---|
| Н-Н | 1,47 Å |
| N = N | 1,24 Å |
| N≡N | 1.10 Å |
Расстояние между связанными атомами уменьшается с увеличением числа общих электронных пар.
Демо:- Модели с шаром и рукоятью NH 2 -NH 2 , NH = NH, Конструкции N≡N
учебных материалов по атомной структуре | учитель естествознания
Рабочие листы и идеи уроков, чтобы побудить учащихся в возрасте от 11 до 16 лет хорошенько подумать об атомной структуре и изотопах (GCSE и Key Stage 3)
Краткое описание для учителя атомной структуры
Обзор: никогда не доверяйте атому, они составляют все! Атомы являются фундаментальными строительными блоками материи и состоят из протонов, нейтронов и электронов.Полезный способ подойти к изучению атомной структуры – рассмотреть изменяющиеся модели, предложенные учеными на протяжении всей истории. Изображение здесь может отображать прогресс в понимании учащимися теории атома, начиная с простой модели бильярдного шара на ключевом этапе 2/3 и заканчивая моделью электронного облака на уровне А. Помимо понимания того, что атомы состоят из разных субатомных частиц, учащиеся также должны понимать, что эти субатомные частицы различаются по размеру, расположению и заряду.Стоит потратить время на объяснение того, как атомы удерживаются вместе электростатическими силами притяжения между электронами и ядром (в обоих направлениях) и ядерными силами притяжения между нуклонами.
Ключевое понятие: материя состоит из дискретных единиц, называемых атомами. Атомы могут отличаться друг от друга количеством протонов, нейтронов и электронов, которые они содержат.
Из большой идеи: вся материя во Вселенной состоит из очень маленьких частиц
Связанные знания: Таблица Менделеева, частицы, связь
Заблуждение [научная идея]: электроны в атоме вращаются вокруг ядра, как планеты в нашей солнечной системе, вращаются вокруг Солнца [электронные оболочки представляют собой определенное количество энергии, которую имеют электроны, а не то, где они расположены]; ядро атома эквивалентно ядру в клетке [они не аналогичны].Подробное объяснение альтернативных представлений об атомной структуре см. В этой прекрасной публикации RSC о химических заблуждениях.
Учебные ресурсы
С чего начать?
Предложите учащимся разорвать лист бумаги на минимально возможный размер. Затем задайте вопрос: «Можно ли разбить этот лист бумаги дальше»? Изучите идеи на доске, а затем представьте идею атомов, основываясь на том, что учащиеся уже знают о частицах.Затем можно «построить атом вместе», используя ряд артефактов для представления различных частей. Нейтроны и протоны должны быть представлены объектами одинакового размера и одинаковой массы. Электроны могут быть представлены чем-то с крошечной массой, например, волоском, вырванным из вашей головы!
Учебные материалы по теории частиц (твердые тела, жидкости и газы)
Ресурсы, которые помогут студентам понять частицы, можно найти в других местах
Массовое число и атомный номер – что они означают?
GCSE деятельность по атомному и массовому числу.Учащиеся работают в парах, чтобы вывести как можно больше сведений об атомной структуре из диаграмм, показывающих три разных атома и один ион. Эта деятельность должна привести к пониманию того, что означают атомный номер и массовое число. (PDF)
Язык атомной структуры
Рабочий листGCSE по ключевым словам атомной структуры. На доске написаны ключевые слова, используемые для описания атомной структуры. Учащиеся составляют список вопросов, на которые их партнер должен ответить, используя ключевые слова, указанные на слайде.Это упражнение способствует хорошему обсуждению между студентами и поддерживает осмысление ключевых терминов. (PDF)
Электронная конфигурация атомов
При обучении атомной структуре жизненно важно учащимся понять масштаб и то, насколько пустыми являются атомы. Эта фантастическая модель помогает студентам оценить масштаб атома водорода
Рабочий листGCSE по электронной конфигурации и Периодической таблице. Учащиеся используют электронную конфигурацию первых 20 элементов.Они сами видят, как число группы равно числу валентных электронов. (PDF)
Перейдите по этой ссылке, чтобы перейти к заданию GCSE, где учащиеся должны решить, изображает ли модель атом или ион.
Изотопы
Студентам необходимо понять и объяснить, почему изотопы имеют одинаковые химические свойства, но разные физические свойства. Тяжелая вода может стать отличным контекстом для изучения изотопов. Кубики льда из тяжелой воды тонут в воде. Возможно, попросите студентов прогнозировать, наблюдать и объяснять, что происходит на видео ниже с 6:14.Затем переходите к тому, чтобы ученики вычисляли относительную атомную массу водорода. Почему это не просто среднее из трех встречающихся в природе изотопов 1 H, 2 H и 3 H, т.е. 2, а не 1,00794?
Разработка модели атома
Рабочий лист GCSE по разработке модели атома. Студенты читают о развитии модели атома на протяжении всей истории и рисуют то, как, по их мнению, атом мог бы выглядеть в разные моменты времени.

 Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп. 31): sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию (BeCl 2).
31): sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию (BeCl 2).
 Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму.
Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму.

