Натрий. Строение атома натрия
Разнообразен и интересен мир металлов. Их свойства издавна изучались человеком, и нашу жизнь просто невозможно представить без таких элементов, как железо, алюминий, хром. В нашей статье речь пойдет о натрии.
Строение атома натрия, расположение электронов по энергетическим уровням определяют его главные характеристики. К ним, например, относятся такие показатели, как высокая химическая активность, пластичность, способность проводить тепло и электрический ток.
Но особое внимание стоит уделить рассмотрению строения элементарной частицы химического элемента натрия – его атома.
Самые активные и агрессивные
Щелочные металлы, к которым относится натрий, в химии по праву считаются самыми реакционно-способными. Именно поэтому ни один из них, в том числе и натрий, не встречается в природе как самородок, а находится в ионном виде в составе горных пород и минералов.
К ним относится поваренная соль, сильвинит и карналлит. Чем же можно это объяснить?
Ответ лежит в особенностях строения атома натрия. Элемент, как и его собратья по подгруппе щелочных металлов, имеет большой радиус атома. Кроме того, его единственный электрон, расположенный на последнем энергетическом уровне, слабо связан с положительно заряженным ядром. Поэтому он легко отрывается от самого атома и захватывается частицами других химических элементов. Эта способность – легко отдавать собственные электроны – и определяет все главные свойства металлических элементов.
Элемент, как и его собратья по подгруппе щелочных металлов, имеет большой радиус атома. Кроме того, его единственный электрон, расположенный на последнем энергетическом уровне, слабо связан с положительно заряженным ядром. Поэтому он легко отрывается от самого атома и захватывается частицами других химических элементов. Эта способность – легко отдавать собственные электроны – и определяет все главные свойства металлических элементов.
Электронное строение атома натрия
Полная формула, показывающая распределение электронов по энергетическим уровням в атоме, имеет следующий вид: 1s22s22p63s1.
Последний неспаренный электрон, при вращении образующий облако в виде сферы, находится на значительном удалении от собственного ядра. Он участвует в возникновении такого типа связи, как ионное взаимодействие, и называется валентным.
Радиус самого атома составляет около 0,189 нм, а энергия его ионизации равна 5,14 эВ. Благодаря такому строению атома элемента натрия, его простое вещество проявляет хорошо выраженные восстановительные свойства, то есть в реакциях с атомами других элементов всегда отдает свой единственный электрон, расположенный на последнем энергетическом уровне (третий).
При этом электронейтральная частица натрия превращается в положительно заряженный ион – катион. Ярко выраженные восстановительные свойства металла и его химическая активность предъявляют особые требования к условиям его хранения. Чтобы металл не окислялся кислородом воздуха, его сберегают под слоем технического масла или керосина. Электронная схема атома натрия имеет следующий вид (см. фото ниже).
Физические свойства
Какова же зависимость между электронной формулой и физическими свойствами натрия? Строение атома натрия раскрывает эту взаимосвязь.
Природный Na состоит только из одного изотопа. Он представляет собой очень мягкий серебристо-белый металл, который можно резать ножом. Его плотность составляет всего 0,97 г/см.
Как и другие металлы, натрий хорошо проводит электрический ток и тепло. Поскольку в подгруппе щелочных металлов радиусы атомов и их свойства как восстановителей с увеличением заряда ядра увеличиваются, то температуры кипения и плавления будут уменьшаться.
Как строение атома влияет на химические свойства элемента?
Продолжим изучение строения атома натрия. Натрий содержит на третьем энергетическом уровне один электрон, электронное облако которого имеет форму сферы. Поэтому металл относят к s-элементам, а они, как известно, легко вступают в химическое взаимодействие с неметаллами, например с кислородом, водородом, серой, азотом и т. д. Реагируя с водой, натрий быстро растворяется в ней, образуя раствор щелочи.
Высокая активность щелочного металла натрия выражается в особенностях его взаимодействия с кислотами, которая сопровождается взрывом. Поэтому такую реакцию в лабораторных условиях проводить запрещено. Еще одна особенность металлического натрия заключается в том, что он не реагирует с растворами солей и щелочей, так как сам начинает активно взаимодействовать с растворителем – водой.
Так что, как можно видеть, строение атома натрия, а также его взаимосвязь с физическими и химическими свойствами элемента, действительно представляют собой научный интерес.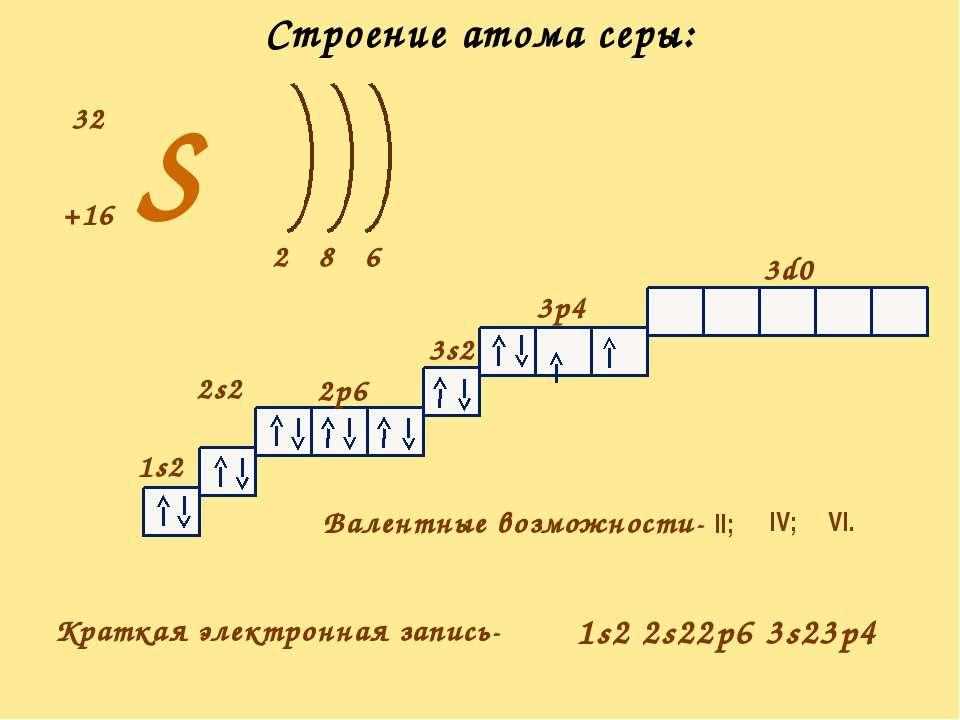
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51.
25
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Натрий, атомарная структура – Stock Image – C018/3692
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3692
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Натрий (Na). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома натрия-23 (атомный номер: 11), наиболее распространенного изотопа элемента натрия. Ядро состоит из 11 протонов (красный) и 12 нейтронов (оранжевый). 11 электронов (белые) включают относительно нестабильный электрон во внешней оболочке (кольце). Стабильность внешних (валентных) электронов элемента определяет его химические и физические свойства. Натрий является щелочным металлом в группе 1, периоде 3 и s-блоке периодической таблицы. В элементарной форме это мягкий химически активный металл, немного менее плотный, чем вода, плавящийся при 98 градусов Цельсия.
Сведения о выпуске
Разрешение модели не требуется. Разрешение собственности не требуется.
Ключевые слова
- 3s
- 3с1
- щелочной металл
- щелочные металлы
- а.е.м.
- атом
- атомный
- атомный номер
- атомный радиус
- атомный вес
- черный фон
- химические данные
- химические свойства
- химическое свойство
- химия
- схема
- электронная конфигурация
- номер электрона
- электронная оболочка
- электронный
- электронов
- элемент
- элементаль
- элементов
- уровней энергии
- группа 1
- иллюстрация
- изотоп
- уровень
- уровней
- металл
- металлический
- металлы
- на
- нейтрон
- нейтрон номер
- нейтронов
- ядерный
- ядерные данные
- нуклон
- нуклонов
- ядро
- орбитальный
- орбитальные типы
- орбиталей
- период 3
- физическая химия
- физические свойства
- физическое имущество
- вечера
- протон номер
- квантовая химия
- с блоком
- s-блок
- оболочка
- каркасная конструкция
- снаряды
- простая электронная конфигурация
- натрий
- натрий-23
- твердый
- твердые вещества
- структурный
- структура
- субатомный
- подоболочка
- подоболочек
- символ
- валентная орбиталь
- волновая функция
Нарисуйте атомную структуру атома натрия и иона натрия.

Ответить
Проверено
226,8 тыс.+ просмотров
Подсказка: Атомная структура состоит из протона, электрона и нейтрона. Протоны и нейтроны размещены в ядре, а электроны размещены на разных орбитах вокруг ядра. Ион представляет собой электронно-богатую или электронно-дефицитную разновидность соответствующего атома.
Полный пошаговый ответ:
Натрий – это атом периодической таблицы с атомным номером \[11\] и массовым числом\[23\]. Электронная конфигурация натрия: 91}$
Оболочки вокруг ядра атома обозначаются как \[K\], \[L\], \[M\], \[N\] и так далее. Первая оболочка \[K = 1\] имеет два электрона, вторая оболочка \[K = 2\] имеет восемь электронов и третья оболочка \[M = 3\] имеет один электрон.

