Неон, свойства атома, химические и физические свойства
Неон, свойства атома, химические и физические свойства.
Поделиться в:
Ne 10 Неон
20,1797(6) 1s2 2s2 2p6
Неон — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 10. Расположен в 18-й группе (по старой классификации — главной подгруппе восьмой группы), втором периоде периодической системы.
Атом и молекула неона. Формула неона. Строение атома неона
Изотопы и модификации неона
Свойства неона (таблица): температура, плотность, давление и пр.
Физические свойства неона
Химические свойства неона. Взаимодействие неона. Химические реакции с неоном
Получение неона
Применение неона
Таблица химических элементов Д.И. Менделеева
Атом и молекула неона. Формула неона. Строение атома неона:
Неон (лат. Neon, от греч. νέος – «новый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ne и атомным номером 10. Расположен в 18-й группе (по старой классификации – главной подгруппе восьмой группы), втором периоде периодической системы.
Neon, от греч. νέος – «новый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ne и атомным номером 10. Расположен в 18-й группе (по старой классификации – главной подгруппе восьмой группы), втором периоде периодической системы.
Неон – неметалл. Относится к группе инертных (благородных) газов.
Неон обозначается символом Ne.
Как простое вещество неон при нормальных условиях представляет собой инертный одноатомный газ без цвета, вкуса и запаха.
Молекула неона одноатомна.
Химическая формула неона Ne.
Электронная конфигурация атома неона 1s2 2s2 2p6. Потенциал ионизации (первый электрон) атома неона равен 2080,66 кДж/моль (21,564540(7) эВ).
Потенциал ионизации (первый электрон) атома неона равен 2080,66 кДж/моль (21,564540(7) эВ).
Строение атома неона. Атом неона состоит из положительно заряженного ядра (+10), вокруг которого по двум оболочкам движется 10 электронов. При этом 2 электрона находятся на внутреннем уровне, а 8 электронов – на внешнем. Поскольку неон расположен во втором периоде, оболочек всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлены s- и р-орбиталями. На внешнем энергетическом уровне атома неона на 2s-орбитали находятся два спаренных электрона, на 2p-орбитали находятся шесть спаренных электрона. В свою очередь ядро атома неона состоит из 10 протонов и 10 нейтронов. Неон относится к элементам p-семейства.
Радиус атома неона (вычисленный) составляет 38 пм.
Атомная масса атома неона составляет 20,1797(6) а. е. м.
Неон – пятый по распространённости элемент Вселенной после водорода, гелия, кислорода и углерода. Содержание неона в земной коре составляет 3,0×10-7 %, в морской воде и океане – 1,2×10-8 %.
Содержание неона в земной коре составляет 3,0×10-7 %, в морской воде и океане – 1,2×10-8 %.
Неон – химически инертный химический элемент.
Неон, свойства атома, химические и физические свойства
Изотопы и модификации неона:
Свойства неона (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Неон |
| 102 | Прежнее название | |
| 103 | Латинское название | Neon |
| 104 | Английское название | Neon |
| 105 | Символ | Ne |
| 106 | Атомный номер (номер в таблице) | 10 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай и Моррис Уильям Траверс, Великобритания, 1898 г. |
| 110 | Год открытия | 1898 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0,0014 % |
| 119 | Содержание в земной коре (по массе) | 3,0·10-7 |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,13 % |
| 122 | Содержание в Солнце (по массе) | 0,1 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 20,1797(6) а. |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 |
| 203 | Электронная оболочка | K2 L8 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 38 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус | 58 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 154 пм |
| 209 | Электроны, Протоны, Нейтроны | 10 электронов, 10 протонов, 10 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0 |
| 302 | Валентность | 0 |
| 303 | Электроотрицательность | 4,4 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 2080,66 кДж/моль (21,564540(7) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | -116(19) кДж/моль (-1,2(2) эВ) – предположительно |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,00090035 г/см3 (при 0 °C и 101,325 кПа, состояние вещества – газ), 0,00090035 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – газ), 1,204 г/см3 (при температуре кипения -246 °C и иных стандартных условиях, состояние вещества – жидкость), 1,444 г/см3 (при температуре плавления -248,49 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -248,59 °C (24,56 K, -415,46 °F) |
| 403 | Температура кипения* | -246,046 °C (27,104 K, -410,883 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,335 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔH | 1,71 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| 411 | Молярный объём | 22,42 см³/моль |
| 412 | Теплопроводность | 0,0491 Вт/(м·К) (при стандартных условиях), 0,0493 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 4,430 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 63 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS |
Примечание:
401* Плотность неона согласно [1] составляет 1,207 г/см3 (при -246,046 °C и иных стандартных условиях

402* Температура плавления неона согласно [3] составляет -248,6 °C (24,55 K, -415,48 °F).
403* Температура кипения неона согласно [3] составляет -246,05 °C (27,1 K, -410,89 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) неона согласно [4] составляет 0,33 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) кислорода согласно [3] и [4] составляет 1,74 кДж/моль и 1,79 кДж/моль соответственно.
Физические свойства неона:
Химические свойства неона. Взаимодействие неона. Химические реакции с неоном:
Получение неона:
Применение неона:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10.
 Неон
Неон - 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44.
 Рутений
Рутений - 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78.
 Платина
Платина - 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110.
 Дармштадтий
Дармштадтий - 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Neon
- https://de.wikipedia.org/wiki/Neon
- https://ru.wikipedia.org/wiki/Неон
- http://chemister.ru/Database/properties.php?dbid=1&id=220
- https://chemicalstudy.ru/neon-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
неон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле неона
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 3 166
Неон – презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Неон
Выполнилаученица 11 класса
Карпенко Екатерина
Неон — элемент главной подгруппы
восьмой группы, второго периода
периодической системы химических элементов
Д. И. Менделеева, с атомным номером 10.
Пятый по распространённости элемент во
Вселенной (после водорода, гелия, кислорода и
углерода). Простое вещество неон—
инертный одноатомный газ без цвета и
запаха.
Атом неона состоит из положительно заряженного ядра (+10), вокруг которого по
атомным оболочкам (орбиталям) движутся 10 электронов.
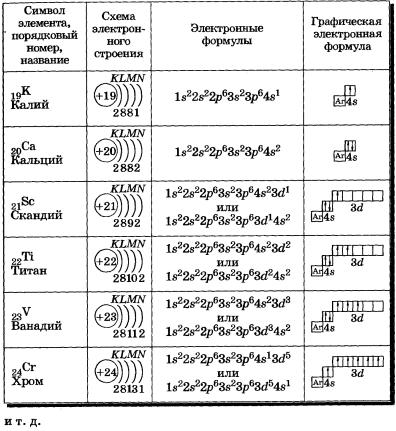 Поскольку неон расположен во
Поскольку неон расположен вовтором периоде, этих оболочек две. Схема строения атома неона представлена на рисунке:
Электронную конфигурацию атома неона можно записать так:
+10 Ne)2)8;
1s22s22p6.
Неон относится к семейству p-элементов. Энергетическая
диаграмма атома неона имеет вид:
Энергетический уровень атома неона завершенный, поскольку
на p-орбитали может располагаться всего шесть электронов.
Именно поэтому неон относят к инертным газам. Химически
он малоактивен.
4. История
Неон открыли в июне 1898 года шотландскийхимик Уильям Рамзай и английский химик Морис
Траверс. Они выделили этот инертный газ
«методом исключения», после того, как кислород,
азот, и все более тяжёлые компоненты воздуха
были превращены в жидкость. Элементу дали
незамысловатое название «неон», что в переводе с
греческого означает «новый».
В декабре 1910 года французский изобретатель
Жорж Клод сделал газоразрядную лампу,
заполненную неоном.

5. Распространённость
Во ВселеннойВ мировой материи неон распределен неравномерно, однако в
целом по распространенности во Вселенной он занимает пятое
место среди всех элементов — около 0,13 % по массе. Наибольшая
концентрация неона наблюдается на Солнце и других горячих
звездах, в газовых туманностях, в атмосфере внешних планет
Солнечной системы — Юпитера, Сатурна, Урана, Нептуна. В
атмосфере многих звезд неон занимает третье место после
водорода и гелия.
Земная кора
Из всех элементов второго периода неон — самый малочисленный на Земле. В рамках
восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и
гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его
находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере. В 1 м³ воздуха
содержится около 18,2 см³ неона. Среднее содержание неона в земной коре мало. Всего на
нашей планете около 6,6*1010 т неона.
 В изверженных породах находится около 109 т этого
В изверженных породах находится около 109 т этогоэлемента. По мере разрушения пород газ улетучивается в атмосферу.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда
Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу
инертных газов, которые не могли, как кислород и другие газы, химически связаться с
другими элементами в минералы и тем самым закрепиться на планете
7. Физические свойства
Неон в разрядной трубке:o Благородные газы — бесцветные одноатомные газы без вкуса и запаха.
o Инертные газы обладают более высокой электропроводностью по
сравнению с другими газами и при прохождении через них тока ярко
светятся, в частности неон огненно-красным светом, так как самые яркие
его линии лежат в красной части спектра.
Эмиссионный спектр неона (слева направо: от ультрафиолетовых до
инфракрасных линий):
o Насыщенный характер атомных молекул инертных газов сказывается и в
том, что инертные газы имеют более низкие точки сжижения и
замерзания, чем другие газы с тем же молекулярным весом.

8. Химические свойства
Все благородные газы имеют завершенную электронную оболочку,поэтому они химически инертны. Химическая инертность неона
исключительна, в этом с ним может конкурировать только гелий. Пока
не получено ни одного его валентного соединения. Даже так называемые
клатратные соединения неона с водой (Ne·6Н2О), гидрохиноном и
другими веществами получить и сохранить очень трудно.
Однако, с помощью методов оптической спектроскопии и массспектрометрии установлено существование следующих ионов:
Ne+, (NeAr)+, (NeH)+, и (HeNe)+.
9. Изотопы
Существует три стабильных изотопа неона: 20Ne, 21Ne и 22Ne. Повсеместнопреобладает легкий 20Ne.
Во многих альфаактивных минералах относительное содержание тяжелых 21Ne
и 22Ne в десятки и сотни раз больше содержания их в воздухе. Это вызвано тем, что
основными механизмами образования этих изотопов являются ядерные реакции,
происходящие при бомбардировке ядер алюминия, натрия, магния и кремния
продуктами распада ядер тяжёлых элементов.
 Кроме того, подобные реакции
Кроме того, подобные реакциипроисходят в земной коре и атмосфере под воздействием космического излучения.
Источник преобладающего на Земле лёгкого нуклида 20Ne до сих пор не
установлен.
Считается, что в космическом пространстве неон также преимущественно
представлен лёгким нуклидом 20Ne. В метеоритах обнаруживают немало 21Ne и 22Ne,
но эти нуклиды предположительно образуются в самих метеоритах под
воздействием космических лучей за время странствий во Вселенной.
Кроме трех стабильных нуклидов неона, существует еще шестнадцать
нестабильных.
10. Получение
Для промышленных целей неон выделяют из воздуха, как побочный продуктпри выделении из воздуха жидкого азота и кислорода, двумя способами:
адсорбционным или конденсационным.
Первый способ основан на адсорбции неона на активированном угле при
выделении из воздуха жидкого азота и кислорода и многократного повторения
этого процесса.
Второй основан на охлаждении воздуха до температуры жидкого водорода, при
которой неон, находящийся в воздухе кристаллизуется, а гелий остаётся в
газообразном состоянии и отсасывается специальными насосами.

11. Применение
o Неоновые вывескиo Жидкий неон используют в качестве охладителя в криогенных установках.
Ранее неон применялся в промышленности в качестве инертной среды, но
был вытеснен более дешёвым аргоном.
o Символ элемента, выполненный из неоновых трубок
o Неоном наполняют газоразрядные лампы, сигнальные лампы в
радиотехнической аппаратуре, фотоэлементы, выпрямители.
o Смесь неона и гелия используют как рабочую среду в газовых лазерах (гелийнеоновый лазер).
o Трубки, заполненные смесью неона и азота, при пропускании через них
электрического разряда дают красно-оранжевое свечение, в связи с чем они
широко используются в рекламе.
o Неоновые лампы используют для сигнальных целей на маяках и аэродромах,
так как их красный цвет очень слабо рассеивается туманом и мглой.
12. Биологическая роль Неон не играет никакой биологической роли.
Физиологическое действиеИнертные газы обладают физиологическим действием, которое проявляется в их наркотическом
воздействии на организм.
 Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытах
Наркотическое воздействие неона (как и гелия) при нормальном давлении в опытахне регистрируется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома
высокого давления» (НСВД)[12].
В связи с этим, наряду с гелием, неон в составе неоно-гелиевой смеси используется для дыхания океанавтов,
водолазов, людей, работающих при повышенных давлениях, чтобы избежать газовой эмболии и азотного
наркоза. Преимущество смеси в том, что она меньше охлаждает организм, так как теплопроводность неона
меньше, чем гелия.
Лёгкий неоно-гелиевый воздух облегчает также состояние больных, страдающих расстройствами дыхания.
Содержание неона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение,
тошноту, рвоту, потерю сознания и смерть от асфиксии.
13. Интересные факты
«Неоновые огни» оправдывают своё названиетолько в случае свечения красного цвета. Для
получения других цветов используют ртуть и
фосфор в определённых пропорциях или другие
благородные газы.
English Русский Правила
Неоновая модель Бора – Как нарисовать диаграмму Бора для атома неона (Ne)
Главная > Химия > Неоновая модель Бора
Модель Бора неона (Ne) имеет ядро, которое содержит 10 нейтронов и 10 протонов. Это ядро окружено двухэлектронными оболочками, называемыми K-оболочкой и L-оболочкой. Самая внешняя оболочка на диаграмме Бора неона содержит 8 электронов, которые также называются валентными электронами.
| Название | Неон Бор Модель |
| Number of neutrons | 10 |
| Number of protons | 10 |
| Number of electrons | 10 |
| Всего электронных оболочек | 2 |
| Электрон на первой оболочке (К) | 2 |
| Электроны во второй оболочке (L) | 8 |
| Общая валентная электроны в NEON | 8 |
Модель Бора описывает визуальное представление электронов, вращающихся вокруг малого ядра. В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. Эти оболочки содержат определенное количество электронов, электронная оболочка, ближайшая к ядру, имеет меньшую энергию, а электронная оболочка, наиболее удаленная от ядра, имеет большую энергию.
В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. Эти оболочки содержат определенное количество электронов, электронная оболочка, ближайшая к ядру, имеет меньшую энергию, а электронная оболочка, наиболее удаленная от ядра, имеет большую энергию.
Диаграмма Бора очень интересна и легко рисуется. Здесь мы нарисуем диаграмму Бора атома неона с помощью нескольких простых шагов.
Этапы рисования Боровской модели атома неона1. Найдите количество протонов, электронов и нейтронов в атоме неона
Протоны — это положительно заряженные частицы, а нейтроны — незаряженные частицы. входят в состав ядер атомов. Электроны — это отрицательно заряженные частицы, вращающиеся вокруг ядра атома 9.0005
Чтобы узнать количество протонов, содержащихся в атоме, просто посмотрите на его атомный номер.
Если атомный номер атома 14, то и протон будет 14, если атомный номер 17, то и протон будет 17.
Итак, атомный номер неона равен 10, следовательно, протонов в атоме неона также равно 10.
Теперь, чтобы определить количество нейтронов в атоме, используйте эту формулу.
⇒ Количество нейтронов в атоме 9.0004 = Атомная масса атома (округленная до ближайшего целого числа) – Количество протонов в атоме
Например, атом имеет 6,991 атомную массу и 3 протона.
Затем, чтобы найти число нейтронов, округлите атомную массу почти до целого числа, таким образом, атомная масса 6,991 округлите до 7.
= (7 – 3 протона) = 4 число нейтронов в атоме
Теперь . Чтобы получить число нейтронов в атоме неона , посмотрите на его атомную массу, которая равна 20,180, округленную до 20, и число протонов в неоне равно 10,9.0005
∴ Следовательно, количество нейтронов в атоме Неона = (20 – 10) = 10
Следует отметить, что «Количество электронов в нейтральном атоме равно количеству протонов».
Итак, атом неона нейтрален, следовательно, число его электронов будет равно числу протонов, которое составляет десять , как мы уже обсуждали.
⇒ Количество электронов в атоме неона = 10
⇒ Количество протонов в атоме неона = 10
⇒ Количество нейтронов в атоме Неона = 10
Читаем подробнее – Как найти количество протонов, электронов, нейтронов?
2. Нарисуйте ядро атома
Ядро представляет собой плотную и маленькую область, содержащую количество протонов и нейтронов атома.
На этом шаге мы должны нарисовать маленький кружок, состоящий из числа протонов и числа нейтронов атома неона.
3. Нарисуйте первую электронную оболочку
«Электронную оболочку можно представить как орбиту, по которой следуют электроны вокруг ядра атома».
Первую электронную оболочку также называют К-оболочкой, это ближайшая к ядру атома оболочка, которая может содержать максимум два электрона.
Как мы знаем, атомы неона имеют в общей сложности 10 электронов. Итак, поместите два электрона из него, в первую оболочку, рядом друг с другом.
Мы успешно нарисовали первую оболочку атома неона, которая может содержать 2 электрона. Так как атом неона имеет всего 10 электронов, а из 10 электронов мы использовали два электрона на первой оболочке.
∴ (10 – 2) = 8 электронов
Следовательно, у нас осталось 8 электронов, поместим их в следующие оболочки атома Неона.
4. Нарисуйте вторую электронную оболочку
Вторая оболочка, также называемая L-оболочкой, может содержать максимум 8 электронов. Эта оболочка рисуется после первой электронной оболочки.
Так как мы уже использовали два электрона на первой оболочке, теперь мы должны поместить оставшиеся 8 электронов на вторую оболочку.
Во второй электронной оболочке электроны добавляются по одному, начиная с верхнего положения, а затем двигаясь по часовой стрелке.
Во второй оболочке электроны добавляются по одному по часовой стрелке в положении часов – 12 часов, 3 часа, 6 часов, 9 часов.
После того, как вы разместите электроны по одному на каждой из четырех сторон (сверху – справа – снизу – слева), начните спаривать или удваивать их.0005
Итак, мы должны поместить 8 оставшихся электронов атома неона во вторую оболочку, следовательно, начнем с верхней позиции, поместим электроны по одному и двигаемся по часовой стрелке (сверху – справа – снизу – слева). ). И, наконец, соедините их.
Боровская модель атома неонаВот и все, это наша Боровская модель атома неона , которая содержит 10 протонов и 10 нейтронов в области ядра, и 10 электронов вращаются вокруг ядра, два электронов на первой оболочке и восьми электронов на второй оболочке.
Also Read:-
- Oxygen Bohr model
- Boron Bohr model
- Beryllium Bohr model
- Lithium Bohr model
- Helium Bohr model
- Nitrogen Bohr model
- Fluorine Bohr model
- Carbon Bohr model
- Натрий Бор модель
- Магний Бор модель
- Кремний Бор модель
- Фосфор Бор модель
- Сера Бор модель
- Хлор Бор модель
- Argon Bohr model
- Aluminum Bohr model
- Potassium Bohr model
- Calcium Bohr model
- Bromine Bohr model
- Silver Bohr model
- Arsenic Bohr model
- Gold Bohr model
- Krypton Bohr model
- Iodine Bohr model
- Медь Бор модель
- Железо Бор модель
- Уран Бор модель
- Никель Бор модель
- Скандий Бор модель
- Титан Бор модель
- Ванадий Модель Бора
Найдите валентный электрон неона по его диаграмме БораТакже проверьте: Модель Бора для каждого элемента Периодической таблицы
| Что такое диаграмма Бора? |
| Модель Бора описывает визуальное представление электронов, вращающихся вокруг малого ядра. В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. |
| Как нарисовать модель Бора для Неона? |
Модель Бора для неона рисуется с помощью следующих шагов –
|
Электронные оболочки, также называемые энергетическими уровнями. Вы можете найти количество электронных оболочек элемента, зная его номер периода в периодической таблице. Элементы или атомы в первом периоде таблицы Менделеева имеют один энергетический уровень или одну электронную оболочку, так же как элементы во втором периоде имеют два энергетических уровня или двухэлектронную оболочку и так далее… Итак, Атом неона принадлежит 2-му периоду периодической таблицы , следовательно, количество электронных оболочек для боровской модели неона будет равно 2 (K-оболочка и L-оболочка). |
| Какова внешняя оболочка диаграммы Бора атома неона? |
Самая внешняя оболочка, также называемая валентной оболочкой, содержит валентные электроны атома. Согласно диаграмме Бора неона, внешняя оболочка представляет собой L-оболочку, содержащую 8 валентных электронов. |
- Неон представляет собой бесцветный и благородный газ без запаха.
- При помещении в электрическое поле излучает оранжево-красное свечение.
- Имеет нулевую степень окисления.
- Имеет гранецентрированную кубическую кристаллическую структуру.
- Он химически инертен и принадлежит к семейству инертных газов в периодической таблице.
- Боровская модель Неона нарисована только с двумя электронными оболочками, первая оболочка содержит 2 электрона, а вторая оболочка содержит 8 электронов.
- Неон нейтрален, и его атомный номер равен 10, следовательно, количество протонов и электронов, доступных для его диаграммы Бора, также равно 10.
- Количество нейтронов для диаграммы Бора неона можно найти, вычитая количество протонов из атомной массы (округлив до ближайшего целого).
- Электронная конфигурация Неона с точки зрения оболочки [2, 8], или в нормальной форме это [He] 2s 2 2p 6 .

Неон Модель Бора — схема, этапы рисования
Неон — благородный газ, обозначаемый символом Ne. Это бесцветный одноатомный газ без запаха с атомным номером 10. Неон излучает красновато-оранжевое свечение внутри вакуумных разрядных трубок. Впервые он был выделен сэром Уильямом Рамзи из охлажденного образца воздуха.
Однако он редко встречается на поверхности земли. Он используется для изготовления рекламы или вывесок, которые светятся в темноте. Он также используется для изготовления молниеотводов, лазеров, водолазного снаряжения, высоковольтных индикаторов и т. д. Жидкий неон также используется в криогенной консервации.
Итак, вы рады узнать сегодня о модели Бора Неона???
Модель неона Бора
Модель атома Резерфорда была предложена в 1911 году. Эта модель хорошо описывала атомную структуру, правильно описывая расположение, а также количество атомных видов.
Однако с помощью этой модели нельзя было ответить на некоторые основные правила классической механики и электромагнитной теории.
В 1913 году модель Резерфорда снова была представлена Нилом Бором, но с некоторыми важными улучшениями. Это было названо моделью Бора-Резерфорда.
Эта модель давала объяснение стабильности электронов на их орбитах и пыталась преодолеть недостатки модели Резерфорда.
Эта модель Бора-Резерфорда объясняет структуру атома, размещение различных видов атомов внутри атома, а также заряд различных атомных частиц.
Это также объясняет, почему электроны остаются в своих оболочках, а не падают внутрь ядра. Вся аранжировка выставлена в графической форме для лучшего понимания.
Прежде чем мы начнем объяснять боровскую модель неона, мы должны сначала понять несколько терминов, связанных со структурой атома.
• Ядро: Оно расположено в центре атома и состоит из двух типов частиц, а именно. нейтроны и протоны. Ядро само по себе является положительно заряженным образованием.
• Протоны: Это положительно заряженные частицы, присутствующие в ядре. Они представлены символом p + .
Они представлены символом p + .
• Нейтроны: Это частицы с нейтральным зарядом, расположенные внутри ядра. Они представлены с помощью символа №.
• Электроны: Это отрицательно заряженные атомные частицы, вращающиеся вокруг ядра. Электроны следуют определенной траектории, вращаясь вокруг ядра. Они обозначаются символом e – .
• Оболочки: Определенный круговой путь, по которому следуют электроны внутри атома вокруг ядра. Они также известны как орбиты или энергетические уровни. Каждый электрон имеет свой определенный энергетический уровень, и каждый энергетический уровень имеет определенное количество электронов.
Модель Бора называет эти оболочки как K, L, M, N и т. д. или 1, 2, 3, 4 и т. д. Наименьшее значение присваивается оболочке, расположенной ближе всего к ядру, а оболочке, наиболее удаленной от ядра. ядро имеет наибольшую ценность.
Это также мера энергии электронов, которые, как говорят, находятся в основном состоянии, когда они находятся в наименьшей оболочке.
Электроны, расположенные в наиболее удаленной от ядра оболочке, обладают наибольшей энергией и называются валентными электронами, а оболочка называется валентной оболочкой. Электроны, находящиеся в этой оболочке, участвуют в образовании связей с другими атомами.
Модель Бора также утверждает, что электроны имеют возможность падать с более высокого уровня на более низкий, поскольку они выделяют энергию, или перескакивать с более низкого на более высокий энергетический уровень, поскольку они поглощают энергию.
Поскольку мы обсуждаем модель Неона Бора, она содержит 8 протонов и 8 нейтронов внутри ядра и 8 электронов, вращающихся вокруг ядра в 2 оболочках, а именно. Корпуса К и Л.
| Неоновый атом | Значение |
| № протона | 10 |
| № нейтрона | 10 |
| Номер Электрона | 10 |
| Количество корпусов | 2 |
| Количество электронов на первой (К) оболочке | 2 |
| Количество электронов во второй (L) оболочке | 8 |
| Количество валентных электронов | 8 |
Чертеж Бора Модель неона
Неон – благородный газ, относящийся к 18-й -й -й группе периодической таблицы:
следующим образом:
• Атомный номер неона 10.
• Электронная конфигурация неона [He] 2s 2 2p 6 .
• Химический символ неона — Ne.
• Атомная масса неона 20,1797.
Теперь, используя приведенную выше информацию, мы нарисуем атомную модель Бора для атома неона.
Чтобы нарисовать модель Бора, нам сначала нужно рассчитать различные виды атомов, присутствующие в атоме неона.
Начнем с расчета количества протонов.
Количество протонов для любого атома всегда равно атомному номеру этого атома.
Как упоминалось выше, атомный номер неона равен 10.
Следовательно, для атома неона количество протонов = атомный номер = 10
Теперь мы рассчитаем количество нейтронов для атома неона .
Формула для расчета числа нейтронов в атоме выглядит следующим образом:
Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Ссылаясь на неоновую рамку, нарисованную выше, мы видим, что атомная масса неона равна 20,1797. После округления до ближайшего целого числа получаем 20.
После округления до ближайшего целого числа получаем 20.
Также, как подсчитано выше, количество протонов в атоме неона равно 10.
Теперь подставим эти значения в приведенную выше формулу:
Число нейтронов = 20 – 10 = 10
Следовательно, число нейтронов в атоме Неона равно 10.
Выше мы уже обсуждали, что протоны и нейтроны вместе составляют ядро атома.
Следовательно, используя вычисленные выше значения, мы теперь можем нарисовать ядро атома неона. Это выглядит следующим образом:
На этой диаграмме p + представляет протоны, а n° представляет нейтроны.
Далее, теперь мы посчитаем количество электронов, присутствующих в атоме неона:
Для любого атома число электронов всегда равно атомному номеру этого атома.
Следовательно, в случае атомов неона
Количество электронов = Атомный номер неона = 10
Теперь, двигаясь дальше, мы добавим эти электроны к оболочкам вокруг ядра атома неона.
Для этого определим количество оболочек, присутствующих в атоме Неона, а также количество электронов, которые можно добавить к каждой оболочке.
Максимальное количество электронов, которое может быть размещено в конкретной оболочке, равно 2n 2 , где n означает количество оболочек.
Теперь мы рассчитаем количество электронов для каждой оболочки атома неона, применяя вышеупомянутую формулу.
Для K-оболочки атома неона максимальное число электронов = 2 (1) 2 = 2
После добавления этих двух электронов к первой оболочке атом неона выглядит следующим образом:
После этого у нас осталось еще восемь электронов.
Чтобы учесть их, мы рассчитаем количество электронов, которые могут быть размещены в L-оболочке атома неона.
Для L-оболочки атома неона максимальное число электронов = 2 (2) 2 = 8
Следовательно, все 8 электронов могут быть размещены в L-оболочке атома неона.
Здесь важно отметить, что, начиная с L-оболочки, электроны на любой оболочке располагаются группой из четырех электронов, расположенных по часовой стрелке под углом 90°.
По мере увеличения числа электронов в оболочке угол между электронами уменьшается. Однако всегда электроны будут добавляться в группу из четырех.
Следовательно, для L-оболочки атома неона первые четыре электрона будут добавляться под углом 90° по часовой стрелке. Атом неона теперь выглядит так:
Оставшиеся 4 электрона теперь размещены в L-оболочке атома неона по часовой стрелке. После этого окончательная боровская модель атома неона выглядит следующим образом:
Следовательно, окончательная боровская модель атома неона состоит из 10 протонов и 10 нейтронов внутри ядра и 10 электронов, вращающихся вокруг ядра.
На K-оболочке 2 электрона, а на L-оболочке 8 электронов.
Получение структуры Льюиса из модели Бора
Структура Льюиса элемента представляет собой представление его валентных электронов вокруг атома в графической форме.
Здесь точками обозначены электроны, а атом показан символом атома. Эту структуру также называют электронной точечной структурой.
Как обсуждалось выше, атом неона состоит из 8 электронов в своей валентной оболочке, т.е. L-оболочке. Таким образом, структура неона по Льюису представлена следующим образом:
Свойства неона
Несколько важных свойств неона перечислены ниже:
• Неон представляет собой бесцветный газ без запаха при комнатной температуре.
• Температура кипения и плавления неона составляет 27,07 К и 24,56 К соответственно.
• Плотность неона 0,00089г/см 3 .
• Атомы неона расположены в гранецентрированной кубической кристаллической структуре.
Связанные темы
BORN BOHR MODEL
ARGON BOHR MODEL
Силикон BOHR MODEL
MODEL -MODEL
BOHR модели
9007 КОНЦЕРА 2В целом
.

 Неон
Неон Рутений
Рутений Платина
Платина Дармштадтий
Дармштадтий
 Эти электроны имеют большую энергию по сравнению с электронами внутренней оболочки.
Эти электроны имеют большую энергию по сравнению с электронами внутренней оболочки.
 .
. Сколько электронных оболочек содержит модель Неона Бора?
Сколько электронных оболочек содержит модель Неона Бора? 
