Составить схему строения атома скандия – Telegraph
Составить схему строения атома скандия
====================================
>> Перейти к скачиванию
====================================
Проверено, вирусов нет!
====================================
Электронное строение атома скандия в химии, Sc. Внешний энергетический уровень атома скандия содержит 3 электрона, которые являются.
Электронные формулы атомов химических элементов (слои раположены в. 1s 22s 22p 63s 23p64s 2. 21, Sc, скандий, 1s 22s 22p 63s 23p64s 23d1.
Ска́ндий (химический символ Sc; лат. Scandium) элемент третьей группы (по старой. В этом веществе представлены связи между атомами скандия. Моногидрид скандия ScH известен в газовой фазе. Также низшие степени.
Нельзя так детям рассказывать о строении атома. Как составить схему строения атома, электронную формулу, энергетическую.
Рис. 6. Схемы строения атомов некоторых элементов второго периода.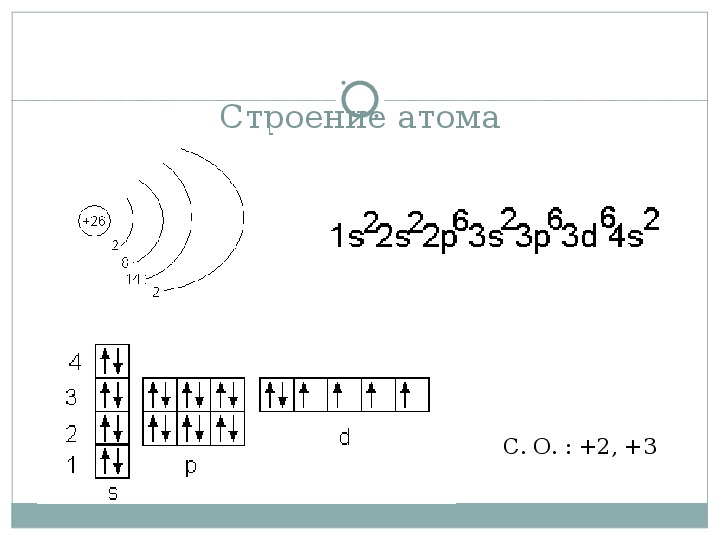 Так , для скандия можно представить следующую модель строения атома (Рис.
Так , для скандия можно представить следующую модель строения атома (Рис.
Строение атома – видеоурок на образовательном портале . Приводится графическая схема строения электронных слоев атомов ( электронно-графическая формула). Электронная конфигурация атома скандия.
Особенности электронного строения атомов хрома, меди и некоторых других элементов. Составьте валентные электронные формулы этих атомов. Как меняется электронная оболочка у атомов калия, кальция и скандия при.
Для атома можно составить электронно-графическую схему, которая показывает. Для атома скандия 21Sc электронно-графическую схему изображают так. имеют одинаковые электронные конфигурации, поэтому их строение.
Но атом водорода может и восстановиться – принять электрон. И правда: строение атомов, да и многие свойства элементов третьего периода так. например, элемента скандия Sc будут отвечать три электрона: 4s2и 3d1.
Следовательно, скандий относится к d-элементам, и его атом. и побочных подгрупп в ПСХЭ Д. И.Менделеева с точки зрения теории строения атомов.
Номер периода обозначает число энергетических уровней в атоме элемента. Строение атома (заряд ядра; состав ядра – количество протонов p11. Z = 21 обозначает: заряд ядра атома элемента (скандия): 65 21Sc – +21;.
Составьте электронные формулы невозбужденных атомов селена и скандия. Приведите графические схемы распределения электронов по квантовым ячейкам (орбиталям). К каким электронным семействам.
2.7 Понятие о квантовой теории строения атома. записать и полную электронную формулу для скандия: 1s2 2s2 2p6 3s2 3p6 4s2 3d1. а использовать для реконструкции этого ряда схему длинной формы Периодической.
Формулы веществ в простых случаях можно составлять по валентностям входящих в них. В то время, когда химики еще ничего не знали о строении атомов, они. б) напишите формулу Льюиса для соединения скандия с хлором;
Следовательно, элемент с зарядом ядра Z = 21 (скандий 21Sc) будет. Схема расположения s, p, d и f-элементов в длинной форме Периодической таблицы.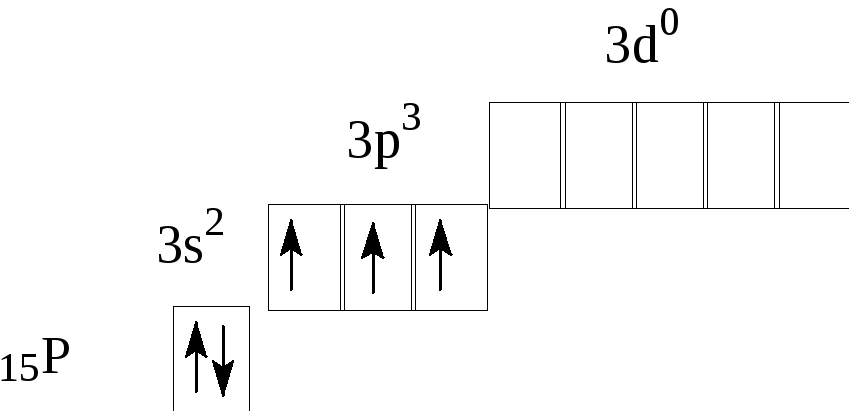 того, как выяснилось электронное строение атомов и стало понятно отличие. Составьте полную электронную формулу для 115-го элемента (Мс.
того, как выяснилось электронное строение атомов и стало понятно отличие. Составьте полную электронную формулу для 115-го элемента (Мс.
Конфигурация внеш. электронных оболочек атома 3d14s2; устойчивая степень. Гидроксиды скандия бесцветны, по составу и строению аналогичны.
Название: Скандий (scandium). Электронное строение: 3d1 4s2. Скандий (лат. scandium), sc, химический элемент iii группы. переходный элемент с одним 3d электроном; конфигурация внешних электронов атома 3d 1 4s 2.
Электронную структуру атома Н можно представить схемой. правилом Хунда, нетрудно составить схему электронного строения для атома азота (Z =7). Для атома скандия возникает вопрос: какой из подуровней должен.
Электронные формулы, обозначения и русские наименования атомов. 21, Sc, скандий, Sc – [Ar] 4s 2 3d 1, Sc – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1.
При описании электронного строения атома указывают, как его электроны. Далее у элементов со скандия (Sc) до цинка (Zn) заполняется третий.
Атомный номер | 21 |
Внешний вид простого вещества | умеренно мягкий, лёгкий металл серебристого цвета с жёлтым отливом |
Свойства атома | |
Атомная масса | 44,95591 а. е. м. (г/моль) |
Радиус атома | 162 пм |
Энергия ионизации | 630,8 (6,54) кДж/моль(эВ) |
Электронная конфигурация | [Ar] 3d1 4s2 |
Химические свойства | |
Ковалентный радиус | 144 пм |
Радиус иона | (+3e) 72,3 пм |
Электроотрицательность | 1,36 |
Электродный потенциал | 0 |
Степени окисления | 3 |
Термодинамические свойства простого вещества | |
Плотность | 2,99 г/см³ |
Молярная теплоёмкость | 25,51 Дж/(K·моль) |
Теплопроводность | 15,8 Вт/(м·K) |
Температура плавления | 1 814 K |
Теплота плавления | 15,8 кДж/моль |
Температура кипения | 3 110 K |
Теплота испарения | 332,7 кДж/моль |
Молярный объём | 15,0 см³/моль |
Кристаллическая решётка простого вещества | |
Структура решётки | гексагональная (α-Sc) |
Параметры решётки | a=3,309 c=5,268 (α-Sc) Å |
Отношение c/a | 1,592 |
Скандий, свойства атома, химические и физические свойства
Скандий, свойства атома, химические и физические свойства.

Sc 21 Скандий
44,955912(6) 1s2 2s2 2p6 3s2 3p6 3d1 4s2
Скандий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 21. Расположен в 3-й группе (по старой классификации — побочной подгруппе третьей группы), четвертом периоде периодической системы.
Атом и молекула скандия. Формула скандия. Строение скандия
Изотопы и модификации скандия
Свойства скандия (таблица): температура, плотность, давление и пр.
Физические свойства скандия
Химические свойства скандия. Взаимодействие скандия. Реакции с скандием
Получение скандия
Применение скандия
Таблица химических элементов Д.И. Менделеева
Атом и молекула скандия. Формула скандия. Строение скандия:
Скандий (лат. Scandium, назван в честь Скандинавии) – химический элемент периодической системы химических элементов Д.
Скандий – металл. Относится к редкоземельным элементам, а также к группе переходных металлов.
Как простое вещество скандий
Молекула скандия одноатомна.
Химическая формула скандия Sc.
Электронная конфигурация атома скандия 1s2 2s2 2p6 3s2 3p6 3d1 4s2.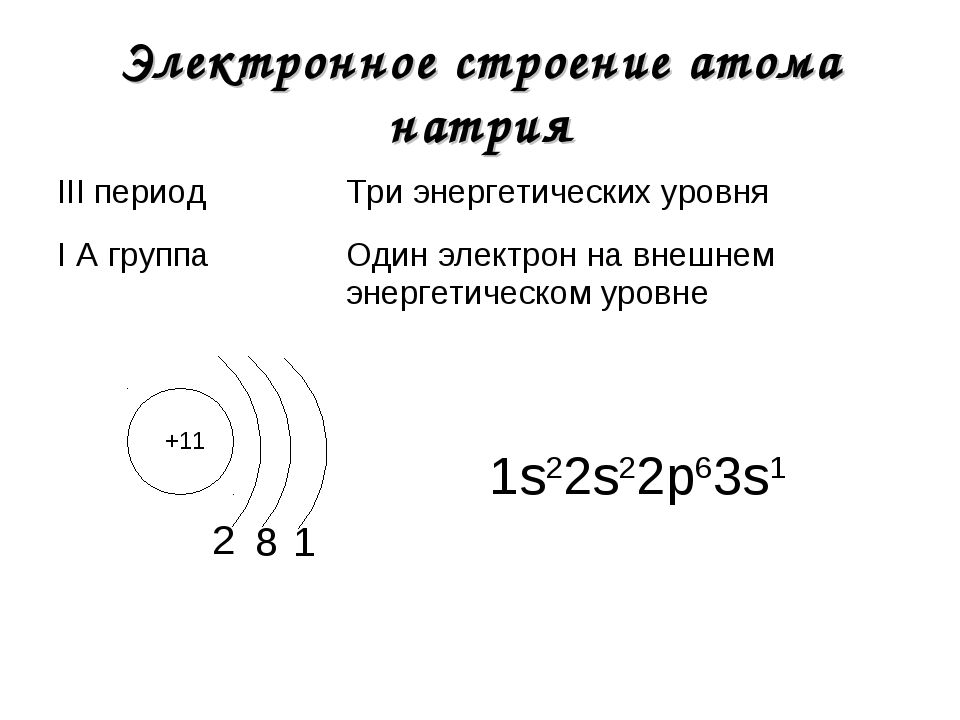 Потенциал ионизации (первый электрон) атома скандия равен 633,09 кДж/моль (6,56149(6) эВ).
Потенциал ионизации (первый электрон) атома скандия равен 633,09 кДж/моль (6,56149(6) эВ).
Строение атома скандия. Атом скандия состоит из положительно заряженного ядра (+21), вокруг которого по четырем оболочкам движутся 21 электрон. При этом 19 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку скандий расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома скандия на 3d-орбитали находится один неспаренный электрон. На внешнем энергетическом уровне атома скандия – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома скандия состоит из 21 протон и 24 нейтрона.
Радиус атома скандия (вычисленный) составляет 184 пм.
Атомная масса атома скандия составляет 44,955912(6) а. е. м.
е. м.
Изотопы и модификации скандия:
Свойства скандия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Скандий |
| 102 | Прежнее название | |
| 103 | Латинское название | Scandium |
| Английское название | Scandium | |
| 105 | Символ | Sc |
| 106 | Атомный номер (номер в таблице) | 21 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, редкоземельный металл |
| 109 | Открыт | Дмитрий Иванович Менделеев, Россия, 11 декабря 1870 г. (предсказан), Ларс Фредерик Нильсон, Швеция, 1879 г. |
| 110 | Год открытия | 1879 г. |
| 111 | Внешний вид и пр. | Лёгкий, умеренно мягкий, серебристо-белый металл с характерным жёлтым отливом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации скандия: – α-скандий с гексагональной плотноупакованной кристаллической решёткой, – β-скандий с кубической объёмно-центрированной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0026 % |
| 120 | Содержание в морях и океанах (по массе) | 1,5·10-10 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 3,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00064 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) |  е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d1 4s2 |
| 203 | Электронная оболочка | K2 L8 M9 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 184 пм |
| 205 | Эмпирический радиус атома* | 160 пм |
| 206 | Ковалентный радиус* | 170 пм |
| 207 | Радиус иона (кристаллический) | Sc3+ 88,5 (6) пм, 101 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 211 пм |
| 209 | Электроны, Протоны, Нейтроны | 21 электрон, 21 протон, 24 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 3-я группа (по старой классификации – побочная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1, +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,36 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 633,09 кДж/моль (6,56149(6) эВ) |
| 305 | Электродный потенциал | Sc3+ + 3e– → Sc, Eo = -2,077 В |
| 306 | Энергия сродства атома к электрону | 18,1 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 2,985 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 2,80 г/см3 (при температуре плавления 1541 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления | 1541 °C (1814 K, 2806 °F) |
| 403 | Температура кипения* | 2836 °C (3109 K, 5136 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 14,1 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 332,7 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 25,52 Дж/(K·моль) |
| 411 | Молярный объём | 15,0 см³/моль |
| 412 | Теплопроводность | 15,8 Вт/(м·К) (при стандартных условиях), 15,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-скандий |
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 3,309 Å, c = 5,268 Å |
| 514 | Отношение c/a | 1,592 |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 521 | Кристаллическая решётка #2 | β-скандий |
| 522 | Структура решётки | Кубическая объёмно-центрированная
|
| 523 | Параметры решётки | |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | Im_ 3m |
| 527 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-20-2 |
Примечание:
205* Эмпирический радиус атома скандия согласно [1] и [3] составляет 162 пм.
206* Ковалентный радиус скандия согласно [1] и [3] составляет 170±7 пм и 144 пм соответственно.
401* Плотность скандия согласно [3] и [4] составляет 2,99 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 3,02 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
403* Температура кипения скандия согласно [3] и [4] составляет 2836,85 °C (3110 К, 5138,33 °F) и 2850 °C (3123,15 К, 5162 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) скандия согласно [3] и [4] составляет 15,8 кДж/моль и 14,1 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) скандия согласно [4] составляет 315 кДж/моль.
410* Молярная теплоемкость скандия согласно [3] составляет 25,51 Дж/(K·моль).
Физические свойства скандия:
Химические свойства скандия.
 Взаимодействие скандия. Реакции с скандием:
Взаимодействие скандия. Реакции с скандием:
Получение скандия:
Применение скандия:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28.
 Никель
Никель - 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62.
 Самарий
Самарий - 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95.
 Америций
Америций - 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Scandium
- https://de.wikipedia.org/wiki/Scandium
- https://ru.wikipedia.org/wiki/Скандий
- http://chemister.
 ru/Database/properties.php?dbid=1&id=231
ru/Database/properties.php?dbid=1&id=231 - https://chemicalstudy.ru/skandiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
скандий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле скандия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 772
Строение атома
⇐ ПредыдущаяСтр 2 из 14Следующая ⇒
Каждая цифра в таблице Д. И. Менделеева имеет определенный физический смысл. Поэтому характеристики и схему строения атома любого элемента можно определить по положению его в таблице.
И. Менделеева имеет определенный физический смысл. Поэтому характеристики и схему строения атома любого элемента можно определить по положению его в таблице.
Пример 1. Составьте схему строения атома элемента №15.
Решение. Элемент №15 – фосфор, химический знак Р. Для элементов малых периодов главных подгрупп удобно пользоваться следующей схемой:
Таблица 2 Схема строения атома фосфора
| Положение элемента в таблице | Характеристики строения атома |
| Порядковый номер 15 | Число протонов в ядре 15 Заряд ядра +15 Общее число электронов 15 |
| Номер периода 3 | Число электронных слоев 3 |
| Номер группы 5 | Число электронов на внешнем слое 5 |
| Подгруппа главная | Высшая степень окисления +5 Низшая степень окисления -3 |
| Схема строения: ядро атома Р + 15 | Электронные оболочки атома Р I II III ) ) ) 2ē 8ē 5ē валентные электроны |
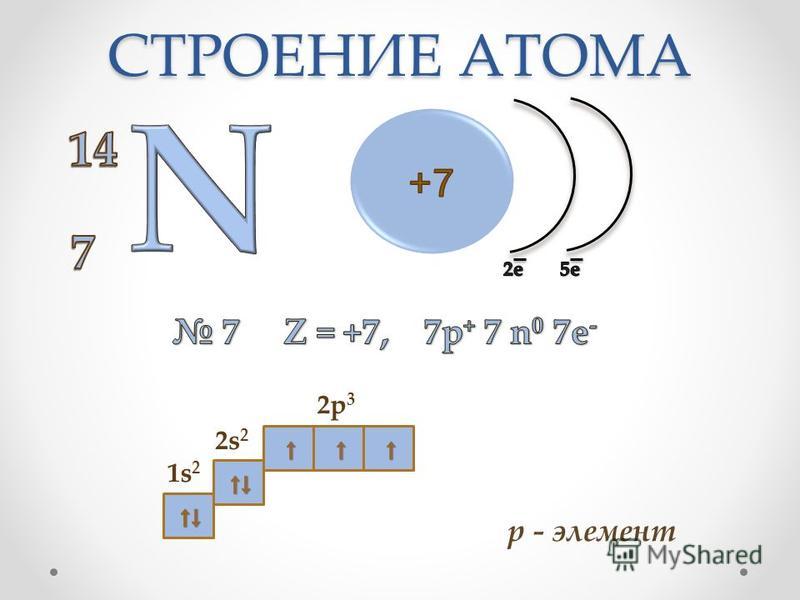
Пример 2. Скандий (Sc) расположен в 4 периоде третьей группы в побочной подгруппе. Его три валентных электрона распределены так: 2ē – на 4-м слое, а 1ē помещен вместе с восемью имеющимися на третьем слое.
Скандий (Sc) расположен в 4 периоде третьей группы в побочной подгруппе. Его три валентных электрона распределены так: 2ē – на 4-м слое, а 1ē помещен вместе с восемью имеющимися на третьем слое.
Схема строения:
ядро атома Sc электронные слои атома Sc
I II III IV
) ) ) )
2ē 8ē 8ē + 1ē 2ē
валентные электроны
1.2 Контрольные вопросы
1-20. Составьте электронные формулы и представьте графически размещение электронов по квантовым ячейкам для указанных в таблице 2 элементов, соответствующих вашему заданию. Проанализируйте возможности разъединения спаренных электронов при возбуждении атомов с образованием валентных электронов в соответствии с теорией спин-валентности.
Таблица 3 Задания к номерам 1-20
Поиск по сайту:
1.1.1. Строение электронных оболочек атомов химических элементов.
Химия — наука о веществах, их свойствах и превращениях.
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
— образование осадка при кипячении воды, называемого в быту накипью;
— выделение тепла и света при горении костра;
— изменение цвета среза свежего яблока на воздухе;
— образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p+, no и e−.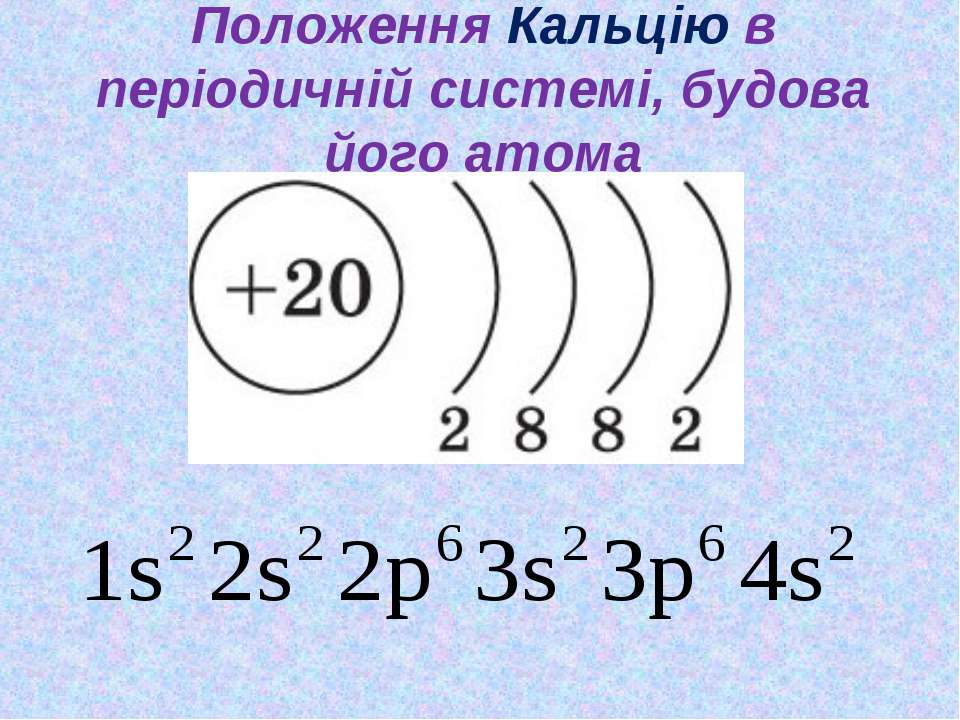 Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. mp ≈ mn , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. mp/me ≈ mn/me ≈ 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
| атом1 | атом2 | атом3 | атом4 | |
| ядро | 1p+ | 1p+, 1n0 | 4p+, 3n0 | 4p+, 4n0 |
| оболочка | 1e− | 1e− | 4e− | 4e− |
Вид атомов с одинаковым зарядом ядер, т. е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Каждый химический элемент имеет свое название и индивидуальный символ, который читается определенным образом. Так, например, самый простой химический элемент, атомы которого содержат в ядре только один протон, имеет название «водород» и обозначается символом «Н», что читается как «аш», а химический элемент с зарядом ядра +7 (т.е. содержащий 7 протонов) — «азот», имеет символ «N» , который читается как «эн».
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1Н, 2Н и 3Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1Н вообще нет нейтронов (1-1=0), в изотопе 2Н – 1 нейтрон (2-1=1) и в изотопе 3Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2Н практически в два раза тяжелее изотопа 1Н, а изотоп 3Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2Н и 3Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2Н дали название дейтерий и присвоили символ D, а изотопу 3Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.
Орбитали с l = 0 называют s-орбиталями. s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
Орбитали с l = 1 называются p-орбиталями. Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d-орбиталями, а с l = 3 – f-орбиталями. Их строение намного более сложное.
3) Магнитное квантовое число – ml – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число ml соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1). Так, например, при l = 0 ml = 0 (одно значение), при l = 1 ml = -1, 0, +1 (три значения), при l = 2 ml = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
4) Спиновое квантовое число (или просто спин) — ms — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения . Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ↓ и ↑.
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и ml.
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
- Принцип минимума энергии: электроны заполняют орбитали, начиная с подуровня с наименьшей энергией. Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Для того чтобы проще запомнить данную последовательность заполнения электронных подуровней, весьма удобна следующая графическая иллюстрация:
- Принцип Паули: на каждой орбитали может находиться не более двух электронов.
Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой.
- Правило Хунда: наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.
Фактически вышесказанное означает то, что, например, размещение 1-го, 2-х, 3-х и 4-х электронов на трех орбиталях p-подуровня будет осуществляться следующим образом:
Заполнение атомных орбиталей от водорода, имеющего зарядовое число равное 1, до криптона (Kr) с зарядовым числом 36 будет осуществляться следующим образом:
Подобное изображение порядка заполнения атомных орбиталей называется энергетической диаграммой. Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т.е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
При переводе в электронную формулу атома фосфора примет вид:
15P = 1s22s22p63s23p3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s1 |
| 2 | He | гелий | 1s2 | |
| II | 3 | Li | литий | 1s22s1 |
| 4 | Be | бериллий | 1s22s2 | |
| 5 | B | бор | 1s22s22p1 | |
| 6 | C | углерод | 1s22s22p2 | |
| 7 | N | азот | 1s22s22p3 | |
| 8 | O | кислород | 1s22s22p4 | |
| 9 | F | фтор | 1s22s22p5 | |
| 10 | Ne | неон | 1s22s22p6 | |
| III | 11 | Na | натрий | 1s22s22p63s1 |
| 12 | Mg | магний | 1s22s22p63s2 | |
| 13 | Al | алюминий | 1s22s22p63s23p1 | |
| 14 | Si | кремний | 1s22s22p63s23p2 | |
| 15 | P | фосфор | 1s22s22p63s23p3 | |
| 16 | S | сера | 1s22s22p63s23p4 | |
| 17 | Cl | хлор | 1s22s22p63s23p5 | |
| 18 | Ar | аргон | 1s22s22p63s23p6 | |
| IV | 19 | K | калий | 1s22s22p63s23p64s1 |
| 20 | Ca | кальций | 1s22s22p63s23p64s2 | |
| 21 | Sc | скандий | 1s22s22p63s23p64s23d1 | |
| 22 | Ti | титан | 1s22s22p63s23p64s23d2 | |
| 23 | V | ванадий | 1s22s22p63s23p64s23d3 | |
| 24 | Cr | хром | 1s22s22p63s23p64s13d5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s22s22p63s23p64s23d5 | |
| 26 | Fe | железо | 1s22s22p63s23p64s23d6 | |
| 27 | Co | кобальт | 1s22s22p63s23p64s23d7 | |
| 28 | Ni | никель | 1s22s22p63s23p64s23d8 | |
| 29 | Cu | медь | 1s22s22p63s23p64s13d10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s22s22p63s23p64s23d10 | |
| 31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 | |
| 32 | Ge | германий | 1s22s22p63s23p64s23d104p2 | |
| 33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 | |
| 34 | Se | селен | 1s22s22p63s23p64s23d104p4 | |
| 35 | Br | бром | 1s22s22p63s23p64s23d104p5 | |
| 36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5B = 1s22s22p1
А в возбужденном состоянии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5B* = 1s22s12p2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень. К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
- d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
Электронные конфигурации простых ионов
Ионами называют частицы, имеющие либо положительный, либо отрицательный заряд. Ионы бывают простые и сложные. Простые ионы образованы одним химическим элементом, сложные – двумя или более элементами.
Положительно заряженные ионы называют катионами, отрицательно заряженные ионы – анионами. Заряд иона обозначают надстрочным индексом, сначала указывая величину заряда, затем его знак. При этом в случае, если заряд иона по модулю равен единице, пишут только знак (+ или -).
Примеры простых ионов: Na+, Ca2+, Al3+, S2-, I— и т.д.
Примеры сложных ионов: SO42-, NO3—, [AlF6]3- и т.д.
Рассмотрим детальнее простые ионы. Откуда у них может возникнуть заряд? Вспомним тот факт, что любой атом является электронейтральной частицей вследствие того, что количество отрицательно заряженных электронов в его оболочках равно количеству положительно заряженных протонов в его ядре.
Если мы «удалим» у атома часть электронов, то получим часть некомпенсированных положительных зарядов. При удалении части электронов у атома получим катион, при присоединении одного или нескольких электронов к атому получим анион.
Например, катион натрия Na+, от атома натрия Na0 отличает то, что частица Na+ содержит в себе на один электрон меньше чем, атом натрия. Для того чтобы записать электронную конфигурацию катиона натрия Na+, сначала вспомним, сколько электронов имеет атом натрия. Сделать мы это можем, взглянув на порядковый номер химического элемента в таблице Д.И. Менделеева. Натрий имеет порядковый номер 11, следовательно, его атом содержит 11 электронов, тогда катион натрия будет иметь на один электрон меньше, то есть 10 электронов.
Далее распределим 10 электронов по энергетическим подуровням, исходя из всех тех же принципов, что использовались для записи электронных конфигураций атомов:
Аналогично попробуем записать электронно-графическую формулу сульфид-иона S2-. В таблице Д.И. Менделеева сера имеет порядковый номер, равный 16. Это значит, что атом серы S0 содержит 16 электронов. Отрицательный заряд иона серы равный 2- указывает на то, что у этого иона на два электрона больше, чем у атома серы, то есть 18 электронов. Тогда электронно-графическая формула и обычная электронная формула сульфид-иона S2- будут иметь вид:
Мы поняли, как записать электронно-графическую (или обычную электронную) формулу иона, зная точное его обозначение. Однако, для того чтобы успешно сдать ЕГЭ, нам нужно уметь самим определять заряды ионов, которые склонны образовывать те или иные химические элементы. Причем уметь определять заряд наиболее устойчивых ионов мы обязаны только для элементов главных подгрупп.
Все очень просто, если учитывать, что атомы элементов главных подгрупп «хотят» получить электронную конфигурацию, как у ближайшего к ним по номеру в таблице атома благородного газа.
Например, определим, какой наиболее устойчивый ион образует магний. Смотрим в таблицу Д.И. Менделеева и видим, что ближайший по значению порядкового номера к нему благородный газ – неон. Атом неона содержит 10 электронов, значит и катион магния будет содержать 10 электронов, в то время как у обычного атома магния 12 электронов. Значит наиболее устойчивый катион магния будет иметь заряд 2+ (от 12 отнимаем 10), то есть мы можем обозначить его как Mg2+.
Установим формулу наиболее устойчивого иона хлора. Для этого снова смотрим в таблицу Д.И. Менделеева и видим, что ближайший по порядковому номеру благородный химический элемент — аргон. Атом аргона имеет 18 электронов, а атом хлора – 17 электронов. То есть наиболее устойчивый ион хлора содержит один «избыточный» электрон по сравнению с нейтральным атомом хлора. Таким образом, формулу наиболее устойчивого иона хлора можно записать как Cl—.
Также есть еще один простой способ установления формул наиболее устойчивых ионов химических элементов, который заключается в том, чтобы попытаться найти их в ряду катионов и анионов таблицы растворимости. Если мы не находим анион соответствующего элемента, можно посмотреть на заряд его «родственника» по подгруппе. Например, в таблице растворимости мы не найдем ион кислорода, однако, в той же подгруппе, что и кислород, расположена сера, обозначение аниона которой мы легко находим в таблице растворимости – S2-. Следовательно, и наиболее устойчивый ион кислорода мы можем записать как O2-.
что такое нейтрон, протон и электрон
Основные положения атомно-молекулярной теории. Основные стехиометрические законы химии. Законы сохранения массы вещества, постоянства состава, объемных отношений, Авогадро, эквивалентов. Молярная масса эквивалента. Способы определения атомных и молекулярных масс.
Все веществ состоят из молекул.
Молекула – это наименьшая частица вещества, сохраняющая свойства тогo вещества. Молекулы разрушаются при химических реакциях.
Между молекулами имеются промежутки: у газов – самые большие, у твердых веществ – самые маленькие.
Молекулы двигаются беспорядочно и непрерывно.
Молекулы одного вещества имеют одинаковый состав и свойства, молекулы разных веществ отличаются друг от. друга по составу и свойствам.
Молекулы состоят из атомов.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и электронов.
Химический элемент – вид атомов с одинаковым положительным зарядом ядра.
Атомы одного элемента образуют молекулы простого вещества (02, Н2, О3, Fe…). Атомы разных элементов образуют молекулы сложного вещества (Н20, Na2S04, FeClg…).
Закон сохранения массы
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
ученым М.В. Ломоносовым.
Закон постоянства состава
Всякое химически чистое соединение независимо от способа его получения имеет вполне определенный состав.
На основании этого закона состав веществ выражается химической формулой с помощью химических знаков и индексов. Например, Н 2 О, СН 4 , С 2 Н 5 ОН и т.п.
Закон постоянства состава справедлив для веществ молекулярного строения.
Состав соединений молекулярного строения, то есть состоящих из молекул, является постоянным независимо от способа получения.
Закон эквивалентов
Химические элементы соединяются друг с другом в строго определенных количествах, соответствующих их эквивалентам.
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково.
Закон кратных отношений
Кратных отношений закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие.
Закон объемных отношений
Гей-Люссак, 1808 г.
“Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа”.
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V 1:V 2:V 3 = ν 1:ν 2:ν 3 .
Периодический закон и периодическая система элементов Д.И.Менделеева. Основные представления о строении атома и ядра. Периодически изменяющиеся и периодически неизменяющиеся свойства атомов и ионов. Варианты периодической таблицы.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период – горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns 2 np 6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические – присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n – 1) d- подуровне (или (n – 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на:
s- элементы (элементы главной подгруппы I и II групп),
p- элементы (элементы главных подгрупп III – VII групп),
d- элементы (элементы побочных подгрупп),
f- элементы (лантаноиды, актиноиды).
Состав атома.
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p + ) и нейтронов (n 0).
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze , где e – элементарный заряд. Число нейтронов обозначают символом N .
Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A :
Ядра химических элементов обозначают символом , где X – химический символ элемента. Например,
– водород, – гелий, – углерод, – кислород, – уран.
Изотоп – совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение отдельного атома или изотопа: (Э – символ элемента), например: .
Строение электронной оболочки атома
Атомная орбиталь – состояние электрона в атоме. Условное обозначение орбитали – . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s , p , d и f
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s -подуровень (состоит из одной s -орбитали), условное обозначение – .
p -подуровень (состоит из трех p
d -подуровень (состоит из пяти d -орбиталей), условное обозначение – .
f -подуровень (состоит из семи f -орбиталей), условное обозначение – .
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s , 3p , 5d означает s -подуровень второго уровня, p -подуровень третьего уровня, d -подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n . Общее число орбиталей на одном уровне равно n 2 . Соответственно этому, общее число облаков в одном слое равно также n 2 .
Обозначения: – свободная орбиталь (без электронов), – орбиталь с неспаренным электроном, – орбиталь с электронной парой (с двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии – электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули – на одной орбитали не может быть больше двух электронов.
3. Правило Хунда – в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n 2 .
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s , 2s , 2p , 3s , 3p , 4s , 3d , 4p , 5s , 4d , 5p , 6s , 4f , 5d , 6p , 7s , 5f , 6d , 7p …
Примеры электронного строения атомов:
Валентные электроны – электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних.
Например: у атома Ca внешние электроны – 4s 2 , они же и валентные; у атома Fe внешние электроны – 4s 2 , но у него есть 3d 6 , следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция – 4s 2 , а атома железа – 4s 2 3d 6 .
Возьмем мысленно атом любого химического элемента. В каких состояниях находятся в нем электроны? Из предыдущего параграфа ясно, что для каждого электрона необходимо знать значения четырех квантовых чисел, характеризующих его состояние. Но нам пока не известно, сколько электронов находятся в каждом состоянии. Какие состояния более, а какие менее вероятны? Ответ на эти вопросы дают два важнейших принципа (закона). Первый из них открыт в 1925 г. швейцарским физиком В. Паули (1900-1958) и назван его именем – принцип Паули.
Все электроны в атоме находятся в разных состояниях, т.е. характеризуются разными наборами четырех квантовых чисел.
В данном случае понятием «принцип» обозначен один из фундаментальных законов природы, который делает атом тем, что он есть, – микрочастицей вещества с индивидуальной электронной структурой для каждого химического элемента. Роль принципа Паули в природе становится яснее, если представить себе, что он не действует. Тогда электронное окружение ядра атома теряет структурную определенность. Все электроны скатываются в какое-то одно наиболее выгодное состояние.
Следует отметить, что этот закон справедлив для всех фермионов.
Из принципа Паули вытекает следствие, определяющее вместимость орбитали, т.е. число электронов, которые могут образовать единое электронное облако. Выбрав любую из орбиталей, мы фиксируем первые три квантовых числа. Например, для орбитали 2р 2: п = 2, /= 1, mj= 0. Но можно изменять еще спиновое квантовое число m s Получаются два набора квантовых чисел:
Следовательно, орбиталь вмещает не более двух электронов, и в атомах могут быть одно- и двухэлектронные облака.
Два электрона, находящиеся на одной орбитали, называют электронной парой.
Зная вместимость орбитали, легко понять, что вместимость энергетического подуровня равна удвоенному числу орбиталей (табл. 5.1).
Таблица 5.1
Структура подуровней в атомах
Совокупность электронов одного энергетического подуровня называют подоболочкой атома.
Вместимость энергетического уровня складывается из вместимости подуровней (табл. 5.2). В первой колонке таблицы кроме значений главного квантового числа приведены буквенные обозначения для электронных оболочек атома.
Таблица 5.2
Структура энергетических уровней в атомах
Совокупность электронов одного энергетического уровня называют оболочкой атома.
Реальное заполнение («заселение») орбиталей, подуровней и уровней электронами определяет второй принцип – принцип наименьшей энергии.
Основному (устойчивому) состоянию атома соответствует минимальная суммарная энергия электронов.
Состояния атома с повышенной энергией называются возбужденными. Атом в возбужденном состоянии неустойчив в том смысле, что за очень короткое время (~10 -8 с) переходит в основное состояние, излучая кванты энергии.
Любая физическая система тем устойчивее, чем меньше ее потенциальная энергия. Поэтому мы неизменно наблюдаем, что брошенное тело надает на землю или скатывается с горки вниз, согнутая пружина выпрямляется и т.д. Также и электронные оболочки атомов находятся в устойчивом состоянии, если общий запас энергии электронов минимален. Набор возможных энергетических состояний атома мы уже знаем (см. рис. 5.7). Рассмотрим, как соответствующие подуровни и уровни заселяются электронами. При этом строго выполняется принцип Паули, который имеет приоритетное значение по отношению к принципу наименьшей энергии и не нарушается. Будем изображать электронную структуру атомов с помощью энергетических диаграмм и электронных формул. Энергетическая диаграмма представляет собой часть общей последовательности подуровней (см. рис. 5.7), содержащую заселенные подуровни. В электронной формуле перечисляются заселенные подуровни в порядке возрастания энергии с указанием числа электронов верхними индексами. Первые два элемента периодической системы можно представить диаграммами I и II. Па диаграмме показано, что положение 1л*-уровня в атоме гелия ниже, чем в атоме водорода, так как у гелия заряд ядра больше и электроны сильнее притягиваются к ядру. Вместимость первого энергетического уровня в атоме гелия исчерпана.
У следующих за гелием элементов заселяется второй энергетический уровень. Рассмотрим энергетические диаграммы трех ближайших элементов – лития, бериллия и бора (диаграммы III, IV и V).
У лития и бериллия заселяется подуровень 2s. Пятый электрон атома бора начинает заселение подуровня 2р в соответствии с принципом Паули. У атомов углерода и азота заселение этого подуровня продолжается (диаграммы VI и VII).
В структуре этих элементов проявляется еще одна важная закономерность формирования электронных оболочек – правило Хунда (1927).
Основном} 7 состоянию атома соответствует заселение электронами максимального числа энергетически равноценных орбиталей. При этом электроны имеют одинаковые значения спиновых квантовых чисел (все +1/2 или все -1/2).
При рассмотрении энергетической диаграммы атома кажется, что перенесение электрона между одинаковыми орбиталями 2р не изменяет его энергию. В действительности при движении электронов по разным орбиталям уменьшается отталкивание между ними, за счет чего потенциальная энергия все-таки уменьшается. Электроны, занимающие орбитали поодиночке, называют неспаренными. Далее при изучении природы химических связей мы увидим, что валентность атомов определяется числом неспаренных электронов. Азот имеет три неспаренных электрона, и он действительно трехвалентен. Достаточно вспомнить формулу аммиака NH 3 . Углерод, согласно диаграмме, двухвалентен. Однако при поглощении сравнительно небольшой энергии один электрон переносится с подуровня 25 на подуровень 2р. Углерод переходит в возбужденное состояние с электронной формулой s 2 2s { 2p s . В этом состоянии он имеет четыре неспаренных электрона. Свободный атом может пребывать в возбужденном состоянии лишь очень короткое время. Но, оказываясь в составе молекулы, атом получает добавочные электроны для заселения орбиталей. После этого исключается возможность перехода в основное состояние, и атом углерода остается четырехвалентным. Фактически, энергия, затраченная на возбуждение электрона, компенсируется энергией образования дополнительных химических связей.
Заселение 2р-орби галей вторыми электронами происходит у кислорода, фтора и неона (диаграммы VIII, IX, X). При этом последовательно уменьшается число оставшихся неспаренных электронов и, соответственно, валентность атомов. Это соответствует элементарным знаниям о свойствах кислорода, фтора и неона: кислород двухвалентен, фтор одновалентен, а неон химических связей не образует, т.е. его валентность равна нулю.
Мы увидели, что у элементов от лития до неона заселяется электронами второй энергетический уровень, и именно поэтому они составляют
- 2- й период таблицы Менделеева. У следующего за неоном натрия начинается заселение третьего энергетического уровня, и далее формируется
- 3- й период по мере заселения подуровней 35 и 3р.-подуровней, составляющей восемь электронов. Таким образом, получает физическое объяснение наличие в таблице Менделеева именно восьми групп. Становится понятной и причина наблюдаемого сходства химических элементов в группах. Сравнивая энергетические диаграммы элементов одной и той же группы – лития и натрия, углерода и кремния и т.д., – мы замечаем, что они характеризуются одинаковой заселенностью внешнего энергетического уровня. Из этого вытекает, в первую очередь, одинаковая валентность атомов, чем и обусловлено сходство химических свойств. Но электронные структуры атомов, взятые в целом, различны. От периода к периоду увеличивается число электронных оболочек, что влечет за собой и увеличение радиусов атомов. Поэтому, как уже отмечалось, наряду со сходством наблюдается и определенная направленность в изменении свойств.
Из электронных формул и энергетических диаграмм атомов очевидно, что в группах IA и ПА электроны заполняют внешний 5-подуровень, а в группах I НА-V111А – внешний p-подуровень./-подуровней по мере увеличения заряда ядра атома (рис. 5.9).
Рис. 5.9.
Пример 5.1. Напишите сокращенные электронные формулы железа и криптона.
Решение. Как у железа, так и у криптона ближайший предшествующий благородный газ – аргон (Z = 18). У железа (Z = 26) на заполнение верхних 45- и Зб/-подуровней остается восемь электронов. Пишем формулу 45 2 3rf 6 . У криптона (Z = 36) добавляется еще 10 электронов, которые полностью заселяют подуровни 3d и Ар. Заполненный 3d -подуровень ставим в формуле до 45-подуровня: [Аг]3 10 45 2 4/? 6 .
Пятый период таблицы Менделеева по структуре аналогичен четвертому. Оба они содержат по 18 химических элементов. В 5-м периоде рубидий и стронций принадлежат к 5-блоку элементов, 10 элементов от иттрия до кадмия принадлежат к d-блоку и оставшиеся шесть элементов от индия до ксенона – к р- блоку.
Далее следуют самые длинные 6-й и 7-й периоды, содержащие но 32 элемента. В 6-м периоде добавляется семейство из 14 химических элементов – от лантана до иттербия, называемых лантаноидами , а в 7-м – аналогичное семейство актиноидов – от актиния до нобелия. В их атомах заполняются электронами 4/- и 5/-подуровни соответственно. Лантаноиды и актиноиды составляют блок /-элементов. Вследствие особых характеристик орбиталей /-подуровней, все лантаноиды и все актиноиды проявляют между собой большое сходство но химическим свойствам.
Пример 5.2. Чем объясняется, что семейства /-элементов содержат по 14 химических элементов?
Решение. В соответствии с формулой 2/+1 подуровень f (1 = 3) состоит из семи орбиталей. Поэтому его вместимость 14 электронов, и постепенное заполнение /-подуровня происходит у 14 химических элементов.
Таким образом, краткий обзор электронной структуры атомов в общих чертах раскрывает физическую основу периодичности изменения свойств химических элементов и, следовательно, периодического закона Д. И. Менделеева. Коротко можно сказать, что периодический закон является следствием принципа Паули и принципа наименьшей энергии.
8 класс
Тема урока
«Строение электронных оболочек атомов».
Цель урока:
Рассмотрение модели строения атома.
Введение понятия «электронное облако», «электронная орбиталь» , «движение без траектории».
Рассмотрение модели энергетических состояний атома.
Задачи урока :
Образовательные: формирование представления об электронной оболочке атома и энергетических уровнях, рассмотрение электронного строения некоторых элементов, развитие умений по составлению электронных формул атомов, определению элементов по их электронным формулам, определение состава атома.
Воспитательные : рассмотрение значимости работы русского химика Д.И.Менделеева ;
Развивающие: формирование умений работать с периодической системой, логически мыслить и оформлять результаты логических операций, проводить параллели между химическими понятиями, изучаемыми в теме.
Ход урока
Организационные моменты.
Доброе утро, ребята, уважаемые гости! Меня зовут Ирина Александровна Губская, я– учитель химии, представляю Раменский муниципальный район, Удельнинскую гимназию.
Нам сегодня вместе предстоит продолжить постигать тайны и загадки, которыми полна наука «химия».Вы только в этом году начали изучать этот удивительно интересный, но вместе с тем сложный предмет, но наверняка многое уже знаете.
Тема нашего урока «Строение электронных оболочек атомов» (запишем в тетрадях).
Ребята, вам хочется увидеть атомы, электроны?…Можно ли это сделать?…
Можно….в воображении. Умозрительно. Мы многое видим умозрительно, почему бы не увидеть атом или электрон? Давайте попробуем. Итак, в путь!
Наша общая задача на уроке – продолжить изучение темы «Атомы химических элементов», нам предстоит актуализировать знания о строении атома и познакомиться со строением электронных оболочек атомов.
2. Объяснение нового материала
Поэт В.Брюсов в 1922 году под впечатлением от удивительных открытий физиков написал:
Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще, быть может, каждый атом-
Вселенная, где сто планет;
Там – все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
? Как вы понимаете эти строки?
Может быть… Сходство электронов и атомов с астрономическими объектами пока не подтвердилось, но того, «чего здесь нет», оказалось более чем достаточно, и об этом вы будете узнавать на уроках химии и физики.
Науке потребовалось более 2000 лет, чтобы определить, на что он похож. И даже сейчас он все еще остается для нас загадкой.
Предлагаю вам заполнить анкету от имени атома.
Анкета.
1. Имя Атом
2. Место обитания любое тело в газообразном, жидком, твердом агрегатном состоянии
3. Поразительные
качества невероятная малость
4. Строение атома
? А из чего состоит атом? (схема)
Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов
? А из чего состоит ядро атома?
Из протонов и нейтронов
А движущиеся вокруг ядра электроны образуют электронную оболочку
В начале ХХ в. была принята планетарная модель строения атома , согласно которой вокруг ядра движутся электроны, как планеты вокруг солнца. Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь.
Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку .
Совокупность всех электронов, окружающих ядро, называется электронной оболочкой (записываем определение)
? Давайте выясним, как движутся электроны вокруг ядра?
? Беспорядочно или в определенном порядке? Оказывается, движение электронов происходит в определенном порядке.
Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Каждый электрон в зависимости от своей энергии будет находиться на определенном расстоянии от ядра. Так образуются электронные слои в электронной оболочке атома.
Каждый слой состоит из электронов с близкими значениями энергии, поэтому слои электронов называют энергетическими уровнями .
Электронный слой, состоящий из электронов с близкими значениями энергии, называется энергетическим уровнем . (записываем определение)
? А как же определить, сколько слоев (энергетических уровней) в атоме того или иного элемента?
– Число уровней определяется номером периода, в котором располагается элемент.
Например:
У Na -2 энергетических уровня, т.к. он находиться во 2 периоде
У N – 3, 3 период
У Fe – 4 , 4 период
? А сколько электронов может находиться на каждом энергетическом уровне?
Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле
N = 2n 2
Где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Например:
1 энергетический уровень, n =1, N =2
n =2, N=8
Каждый уровень вмещает не больше рассчитанного количества электронов.
Если электронный слой содержит максимально возможное число электронов, то его называют завершенным . Электронные слои, не содержащие максимального числа электронов, называют незавершенными .
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
(записываем определение)
Орбитали, или подуровни , как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s ), второй- два (s , p ), третий – три (s , p , d ) и т.д. Электроны, находящиеся на одном энергетическом уровне тоже отличаются друг от друга.
Электроны разных подуровней одного и того же уровня имеют разную форму
электронного облака: сферическую (s ), гантелеобразную (p ) и более сложную конфигурацию.
S – орбиталь – это просто шарик. Путь электрона по ней напоминает путь нитки, которую наматывают на клубок. С нее начинается каждый уровень.
P – орбиталь похожа на объемную восьмерку или перекрученную сосиску, и вместе перекрутки расположено ядро. Таких орбиталей на каждом энергетическом уровне -3, они располагаются под углом 90 – как оси координат.
D – орбиталь – это две p-орбитали, соединенные центрами – как объемная четырехлепестковая ромашка, их на подуровне может быть 5.
F – орбиталь имеет более сложную форму, ее трудно описать словами.
Представьте путь своей мысли при решении системы уравнений с 3 неизвестными – это примерно такой же сложности.
Каждая орбиталь вмещает максимум 2 электрона с противоположными спинами.
Спин – это условное направление движения электрона вокруг своей оси – оно может быть либо по часовой стрелке, либо против. Только электроны с разными спинами уживаются на одной орбитали, т.к. отталкивание их из-за одноименных зарядов частично гасится.
Составим схему последовательного заполнения электронами энергетических уровней.
2 ē 8 ē 18 ē
n=1 n=2 n=3
s s p s p d
2ē 2ē 6ē 2ē 6ē 8ē
Теперь мы можем составить схему строения электронных оболочек атомов:
Определяем общее число электронов на оболочке по порядковому номеру элемента.
Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
Определяем число электронов на каждом энергетическом уровне.
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p , а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами.
Пример:
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода
Элемент № 3- литий. Ядро лития имеет заряд +3,следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s -орбиталь первого уровня, потом s -орбиталь второго уровня.
Свойства элементов изменяются периодически. У всех атомов семейств элементов (щелочные металлы, галогены, благородные газы) на внешнем энергетическом уровне одинаковое число электронов.
У щелочных металлов – 1 электрон
У галогенов – 7 электронов
У благородных газов – внешний уровень их атомов завершен, 8 электронов
Вывод: свойства химических элементов периодически (через определенные промежутки – периоды) повторяются потому, что периодически повторяется одинаковое строение внешних энергетических уровней их атомов.
3. Закрепление
Вариант 1
Заряд ядра атома АЗОТА равен
а)7 б)13 в)4 г)26 д)11
Число протонов в ядре атома КРИПТОНА равно
а)36 б)17 в)4 г)31 д)6
3 .Число нейтронов в ядре атома ЦИНКА равно
а)8 б)35 в)11 г)30 д)4
4 .Число электронов в атоме ЖЕЛЕЗА равно
а)11 б)8 в)56 г)26 д)30
Вариант 2
Максимальное число электронов на 4 энергетическом уровне
а) 32 б)36 в)16 г)24
Число электронных уровней у атома кальция равно
а)1 б)2 в)3 г)4
3.Число электронов на внешнем уровне атома БРОМА равно
а) 7 б) 6 в)5 г)4
4.Общее число s -электронов у атома ЛИТИЯ равно
а) 1 б)2 в)3 г)4
Электронная формула внешнего уровня 2s2 2p 6 соответствует атому
а) кислорода б) серы
в) фтора г) неона
Подведение итогов. Рефлексия .
Домашнее задание : записи в тетради, 8, упр. по карточкам
Домашнее задание:
1. Изобразите строение атомов следующих элементов:
1 вариант
фосфора
2 вариант
Магния
2 . Сравните строение атомов
1 вариант
бора и фтора
2 вариант
кислорода и серы
3 . По данным о распределении валентных электронов найдите элемент :
а) 2s 1
б) 2s 2 2p 4
в) 3s 2 3p 6
г) 3d 10 4s 1
д) 4s 2 4p 3
е) 4s 2 4p 5
ж) 3s 2 3p 4
Давайте подведем итоги урока.
? Что мы сегодня узнали нового?
Электрон не имеет траектории и движение его происходит по орбитали.
По схеме последовательного заполнения электронами энергетических уровней научились составлять электронные формулы элементов.
Научились по электронным формулам определять химический элемент.
«Далеко лежит за пределами нашего чувства вся природа начал»
Тит Лукреций Кар
I в. до н.э.
В приведенных словах древнеримского поэта сконцентрирована вся трудность устройства атома.
Но мы его попытались описать,используя математические подходы и формулы.
У вас на столах находятся карточки для самооценки урока. Отметьте,пожалуйста, «+» или «-» свою самооценку. Я рада была с вами познакомиться. Молодцы, вы хорошо работали, хочется отметить, спасибо за сотрудничество. До свидания, урок окончен, успехов вам в изучении химии.
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na – элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br – 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 2).
Модель атома натрия: Модель атома брома:
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n 2 , где n – номер энергетического уровня.
Таким образом, максимальное число электронов на:
3 слое – 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия – 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома – 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1-3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 3).
Следующий за водородом элемент – гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
Элемент № 3 – это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое -1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 6).
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода – натрий. В атоме натрия – 3 электронных слоя, на которых расположены 11 электронов (Рис. 7).
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.
Четвертый период начинается с калия. Калий – щелочной металл, проявляющий в соединениях валентность I. Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент – скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп – это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (Рис. 9):
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т. к. на третьем слое максимально допустимое количество электронов – 18, т. е. восемь электронов на 3-м слое – это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое – два электрона, на предвнешнем – 18 (Рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т. д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности. Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Список литературы
- Оржековский П.А. Химия: 8-й класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§44)
- Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§37)
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37-38)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с. 38-41)
- Chem.msu.su ().
- Dic.academic.ru ().
- Krugosvet.ru ().
Домашнее задание
- с. 250 №№ 2-4 из учебника П.А. Оржековского «Химия: 8-й класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
- Запишите распределение электронов по слоям в атоме аргона и криптона. Объясните, почему атомы этих элементов с большим трудом вступают в химическое взаимодействие.
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов с близкими значениями энергии; поэтому электронные слои называют еще энергетическими уровнями.
Ядро находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями.
Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент.
Например, натрий Na – элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br – 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 2).
Модель атома натрия: Модель атома брома:
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n 2 , где n – номер энергетического уровня.
Таким образом, максимальное число электронов на:
3 слое – 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома.
Внешними называют электроны последнего электронного слоя.
Например, в атоме натрия – 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома – 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Строение электронных оболочек элементов 1-3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 3).
Следующий за водородом элемент – гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 4). Это максимально возможное число электронов для первого энергетического уровня.
Элемент № 3 – это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое -1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 5).
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 6).
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
После неона следует элемент 3-го периода – натрий. В атоме натрия – 3 электронных слоя, на которых расположены 11 электронов (Рис. 7).
Рис. 7. Схема строения атома натрия
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.
Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода.
Строение электронных оболочек элементов 4 периода
Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.
Четвертый период начинается с калия. Калий – щелочной металл, проявляющий в соединениях валентность I. Это вполне согласуется со следующим строением его атома. Как элемент 4-го периода, атом калия имеет 4 электронных слоя. На последнем (четвертом) электронном слое калия находится 1 электрон, общее количество электронов в атоме калия равно 19 (порядковому номеру этого элемента) (Рис. 8).
Рис. 8. Схема строения атома калия
За калием следует кальций. У атома кальция на внешнем электронном слое будут располагаться 2 электрона, как и у бериллия с магнием (они тоже являются элементами II А подгруппы).
Следующий за кальцием элемент – скандий. Это элемент побочной (В) подгруппы. Все элементы побочных подгрупп – это металлы. Особенностью строения их атомов является наличие не более 2-х электронов на последнем электронном слое, т. е. последовательно заполняться электронами будет предпоследний электронный слой.
Так, для скандия можно представить следующую модель строения атома (Рис. 9):
Рис. 9. Схема строения атома скандия
Такое распределение электронов возможно, т. к. на третьем слое максимально допустимое количество электронов – 18, т. е. восемь электронов на 3-м слое – это устойчивое, но не завершенное состояние слоя.
У десяти элементов побочных подгрупп 4-го периода от скандия до цинка последовательно заполняется третий электронный слой.
Схему строения атома цинка можно представить так: на внешнем электронном слое – два электрона, на предвнешнем – 18 (Рис. 10).
Рис. 10. Схема строения атома цинка
Следующие за цинком элементы относятся к элементам главной подгруппы: галлий, германий и т. д. до криптона. В атомах этих элементов последовательно заполняется 4-й (т. е. внешний) электронный слой. В атоме инертного газа криптона будет октет на внешней оболочке, т. е. устойчивое состояние.
Подведение итога урока
На этом уроке вы узнали, как устроена электронная оболочка атома и как объяснить явление периодичности. Познакомились с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
Список литературы
- Оржековский П.А. Химия: 8-й класс: учеб для общеобр. учрежд. / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013. (§44)
- Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§37)
- Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 37-38)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с. 38-41)
- Chem.msu.su ().
- Dic.academic.ru ().
- Krugosvet.ru ().
Домашнее задание
- с. 250 №№ 2-4 из учебника П.А. Оржековского «Химия: 8-й класс» / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. – М.: Астрель, 2013.
- Запишите распределение электронов по слоям в атоме аргона и криптона. Объясните, почему атомы этих элементов с большим трудом вступают в химическое взаимодействие.
Составьте электронные схемы, электронные и электронно-графические формулы атомов калия, хлора
напишить ривняння реакции что доводит Кислотный характер оксидов SO3, P2O5, CO2
Решить питання по хiмii
Какова массовая доля кислоты в растворе полученном растворением 0,1моля фосфорной кислоты в 40,2 г воды?
Определите объемную долю Гелия в смеси водорода и гелия где массовые отношения равны 3:1A)50 B)100/3 C)20 D)25
Определи вещества X1 и Х2 в следующей схеме превращений (см. рисунок): этанол и этилен пропин и ацетальдегид ацетилен и этанал этанол и хлорэтан
1.Верны ли следующие суждения о реакции, лежащей в основе промышленного синтеза метанола из синтез-газа? А. Эта реакция обратимая. Б. Для увеличения в … ыхода метанола процесс ведут при повышенном давлении. оба суждения неверны верно только А верно только Б верны оба суждения 2.По термохимическому уравнению реакции горения этанола С2Н5ОН + 3О2 = 2СО2 + 3Н2О + 1376 кДж Рассчитайте количество теплоты, которое выделится при полном сжигании 9,2 г этанола. 2752 кДж 137,6 кДж 275,2 кДж 27,52 кДж 3.В трёх пронумерованных пробирках находятся растворы глюкозы, крахмала и формальдегида. Для определения, в какой пробирке какое вещество находится нужно использовать следующие реактивы: раствор I2 и Cu(OH)2 при обычных условиях бромная вода и раствор FeCl3 раствор I2 и Cu(OH)2 при обычных условиях и при нагревании бромная вода и аммиачный раствор оксида серебра
1.Верны ли следующие суждения о свойствах сложных эфиров? А. Сложные эфиры подвергаются щелочному гидролизу с образованием спирта и соли. Б. При полно … м сгорании сложного эфира образуются углекислый газ и вода. верно только Б верны оба суждения верно только А оба суждения неверны 2.Выберите из перечня три элемента верного ответа. В отличие от сахарозы, глюкоза: образует сложный эфир с уксусной кислотой вступает в реакцию поликонденсации реагирует с концентрированной серной кислотой восстанавливается водородом окисляется аммиачным раствором оксида серебра гидролизуется водой 3.Для осуществления следующих превращений: ацетальдегид → этанол → этилацетат → ацетат натрия необходимо провести реакции: гидратации, этерификации, нейтрализации гидрирования, этерификации, нейтрализации гидратации, этерификации, щелочного гидролиза гидрирования, этерификации, щелочного гидролиза
Установите соответствие между формулой вещества и общей формулой его гомологического ряда: Делала давно и тут вроде только один неправильный, а какой … …?
1.Молекулярная формула углеводорода, массовая доля углерода в котором 80% и плотность по аргону 0,75 –C2H6C3H8C3H6C2h52.При полном сгорании углеводоро … да получили 6,72 л оксида углерода (IV) (н.у.) и 7,2 г воды. Относительная плотность вещества по водороду равна 22. Определите молекулярную формулу этого вещества.C3H6C3H8C4H8C4H6
соль+ кремниевая кислота идет ли реакция?
Скандий – Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: скандий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Мира Сентилингам
На этой неделе элемент, существование которого ожидалось, вот Дэвид Линсей.
Дэвид Линдсей
Скандий с атомным номером 21. Это первый из переходных металлов, и его открытие неразрывно связано с открытием вертикальных соседей иттрия и лантана. Шведский остров Ресарё недалеко от Стокгольма стал рассадником элементарных открытий в конце восемнадцатого и начале девятнадцатого веков. В карьере недалеко от деревни Иттерби были добыты две различные минеральные руды, из которых в конечном итоге были идентифицированы семнадцать так называемых «редкоземельных» элементов: скандий, иттрий и пятнадцать элементов лантаноидов.
В 1788 году лейтенант Аррениус нашел необычный черный камень недалеко от города Иттерби. Он передал это известному финскому ученому Йохану Гадолину, и началась история открытия редких земель.
В 1879 году Ларс Нильсон выделил оксид нового металлического элемента из минералов гадолинита и эвксенита. Нильсон был учеником легендарного Якоба Берцелиуса, который сам открыл многие элементы. Нильсон назвал этот оксид скандинавским в честь Скандинавии. Открытие этого элемента было особенно примечательно, поскольку семь лет назад Менделеев использовал свою периодическую таблицу, чтобы предсказать существование десяти еще неизвестных элементов, а для четырех из них он очень подробно предсказал свойства, которые они должны иметь.Один из этих четырех, предсказал Менделеев, должен обладать свойствами, очень похожими на бор, и назвал этот элемент «экаборон», что означает «подобный бору». Металл этого нового оксида, скандия, действительно был обнаружен по свойствам, подобным этому «экаборону», что демонстрирует мощь конструкции Менделеева. Например, Менделеев предсказал, что молекулярная масса элемента будет 44 и что он будет образовывать один оксид с формулой Eb 2 O 3 ; скандий имеет молекулярную массу 45 и образует оксид скандия, Sc 2 O 3 .Некоторые предсказания Менделеева были еще более подробными. Он предсказал, что карбонат экаборона не растворяется в воде, в отличие от карбоната скандия. Он даже сделал предсказание, связанное с открытием элемента – что он не будет обнаружен спектроскопически. Действительно, скандий не дает спектроскопических линий, поэтому его невозможно идентифицировать с помощью этого метода анализа. Однако другой шведский химик Пер Теодор Клев, который также работал с редкоземельными элементами, заметил сходство между новым элементом Нильсона и экабороном, предсказанным Менделеевым.Несмотря на открытие оксида этого нового элемента, потребовалось еще почти шестьдесят лет, прежде чем был получен чистый элементарный скандий путем электролиза хлорида скандия в присутствии лития и калия при высокой температуре.
Скандий – первый из переходных металлов. Многие переходные металлы обладают очень богатым и разнообразным химическим составом из-за того, что они могут существовать в самых разных степенях окисления. Скандий, однако, ограничен степенью окисления плюс три, что означает, что его химический состав не так разнообразен, как у некоторых его аналогов из переходных металлов.
Скандий начинает очень поздно по сравнению со многими другими элементами из-за его относительно низкой встречаемости и сложности получения его из руд. Например, только в 1960-х годах был получен первый фунт, или 450 граммов, скандия высокой чистоты. Соединения скандия находят применение в органической химии. Как и многие лантаноиды, трифторметансульфонат или трифлат скандия находит применение в качестве так называемой кислоты Льюиса, принимающей пару электронов от подходящей органической молекулы и активирующей органическую молекулу для участия в высокоэффективных и селективных химических реакциях. .Скандий также является источником искусственного естественного света. Это может звучать как противоречие, но когда йодид скандия добавляется в очень малых количествах к ртутным лампам, он дает свет, очень похожий на естественный солнечный свет, и эти лампы используются для различных применений, от прожекторов до кинопроекторов.
Скандий добавляют в алюминий в небольших количествах, чтобы получить очень легкий, но очень прочный сплав. Таким образом, он нашел применение в качестве материала для высокопроизводительных дорожных и горных велосипедов.Появление новых материалов для рамы, таких как углеродное волокно и титан, несколько снизило популярность велосипедных рам из сплава скандия, но многие такие рамы все еще производятся сегодня.
Итак, это скандий – элемент, впервые обнаруженный в конце восемнадцатого века, и не выделявшийся в чистом виде и в больших количествах до середины двадцатого века. Тот, который помог продемонстрировать силу периодической таблицы, который вы найдете освещающим футбольные поля и в рамах горных велосипедов.
Meera Senthilingam
И, открыв нам свет, был Дэвид Линдсей из Университета Рединга, обладающий ярким и сильным химическим составом скандия. Теперь, на следующей неделе, элемент, обеспечивающий еще один удар в борьбе за защиту окружающей среды.
Simon Cotton
Как всем известно, хлорфторуглероды, сокращенно CFC, широко использовались в прошлом в холодильниках и морозильниках в качестве хладагента. ХФУ способствуют разрушению озонового слоя и являются парниковыми газами.Из-за этого их использование в развитом мире в значительной степени прекратилось, а это означает, что необходима хорошая, экологически чистая замена. Гадолиний может оказаться полезным для холодильников будущего благодаря процессу, известному как магнитное охлаждение или адиабатическое размагничивание.
Meera Senthilingam
Присоединяйтесь к Саймону Коттону из Uppingham School, чтобы узнать, как магнитное охлаждение с использованием ионов гадолиния будет сохранять нашу пищу прохладной в будущем, в химии следующей недели в ее элементе.А пока я Мира Сентилингам, и спасибо за внимание.
(Промо)
(Окончание промо)
Скандий Информация об элементе: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История скандия
Элемент Скандий был открыт Ларсом Фредериком Нильсоном в год. 1879 г. в Швеции .Скандий получил свое название от Scandia, латинского названия Скандинавии.
Присутствие скандия: изобилие в природе и вокруг нас
В таблице ниже показано содержание Скандия во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура скандия
Скандий имеет твердую структуру , простую гексагональную.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
а б c 330.9 330,9 527,33 вечера и углы между ними Решетки Углы (альфа, бета и гамма).
альфа бета гамма π / 2 π / 2 2 π / 3 Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства скандия
Атомы скандия имеют 21 электрон и структура электронной оболочки [2, 8, 9, 2] с символом атомного члена (квантовые числа) 2 D 3/2 .
Оболочечная структура скандия – количество электронов на энергию уровень
n с с. д f 1 К 2 2 л 2 6 3 кв.м 2 6 1 4 N 2 Электронная конфигурация скандия в основном состоянии – нейтраль Атом скандия
Электронная конфигурация нейтрального атома скандия в основном состоянии [Ar] 3d1 4s2.Часть конфигурации скандия, эквивалентная благородному газу предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. валентные электроны 3d1 4s2, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального Скандия
Полная электронная конфигурация в основном состоянии для атома скандия, полная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d1 4с2
Атомная структура скандия
Атомный радиус скандия 184 пм, а его ковалентный радиус 144 пм.
Атомный спектр скандия
Скандий Химические свойства: Энергии ионизации скандия и сродство к электрону
Сродство скандия к электрону составляет 18,1 кДж / моль.
Энергия ионизации скандия
Энергии ионизации скандия
см. В таблице ниже.Число энергии ионизации Энтальпия – кДж / моль 1 633.1 2 1235 3 2388,6 4 7090,6 5 8843 6 10679 7 13310 8 15250 9 17370 10 21726 11 24102 12 66320 13 73010 14 80160 15 89490 16 9.74 × 104 17 1,056 × 105 18 1,17 × 105 19 124270 20 547530 21 582163 Физические свойства скандия
Физические свойства скандия см. В таблице ниже.
Плотность 2.985 г / см3 Молярный объем 15.0606063652 см3 Упругие свойства
Твердость скандия – Испытания для измерения твердости элемента
Электрические свойства скандия
Скандий – проводник электричества. Ссылаться на стол ниже электрические свойства скандия
Теплопроводность и теплопроводность скандия
Магнитные свойства скандия
Оптические свойства скандия
Акустические свойства скандия
Термические свойства скандия – энтальпии и термодинамика
Термические свойства скандия
см. В таблице ниже.Энтальпия скандия
Изотопы скандия – ядерные свойства скандия
Изотопы родия.Встречающийся в природе скандий имеет 1 стабильный изотоп – 45Sc.
Изотоп Масса изотопа % изобилие Т половина Режим распада 36Sc 37Sc 38Sc 39Sc 40Sc 41Sc 42Sc 43Sc 44Sc 45Sc 100% Стабильный N / A 46Sc 47Sc 48Sc 49Sc 50Sc 51Sc 52Sc 53Sc 54Sc 55Sc 56Sc 57Sc 58Sc 59Sc 60Sc Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Скандий | химический элемент | Britannica
Скандий (Sc) , химический элемент, редкоземельный металл группы 3 периодической таблицы.
Скандий – серебристо-белый умеренно мягкий металл. Он довольно стабилен на воздухе, но медленно меняет свой цвет с серебристо-белого на желтоватый из-за образования оксида Sc 2 O 3 на поверхности. Металл медленно растворяется в разбавленных кислотах, за исключением плавиковой кислоты (HF), в которой защитный слой трифторида предотвращает дальнейшую реакцию. Скандий является парамагнитным от 0 К (-273 ° C, или -460 ° F) до его точки плавления (1541 ° C, или 2806 ° F). Он становится сверхпроводящим при −273.1 ° C (-459,6 ° F) при давлении, превышающем 186 килобар.
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
После того, как русский химик Дмитрий Иванович Менделеев в 1871 году предсказал существование этого элемента, предварительно назвав его экабороном, шведский химик Ларс Фредрик Нильсон в 1879 году обнаружил его оксид, скандию, в редкоземельных минералах гадолините и эвксените, а шведский химик Пер Теодор Клив позже в 1879 г. идентифицировал скандий как гипотетический экаборон. Скандий содержится в небольших количествах, обычно менее 0,2 процента, во многих тяжелых лантаноидных рудах, а также во многих оловянных, урановых и вольфрамовых рудах.Торвейтит (силикат скандия) – единственный минерал, содержащий большое количество скандия, около 34 процентов, но, к сожалению, этот минерал довольно редок и не является важным источником скандия. Космическое содержание скандия относительно велико. Хотя это всего лишь 50-й элемент по распространенности на Земле (по содержанию он примерно такой же, как у бериллия), это примерно 23-й по содержанию элемент на Солнце.
В природе скандий существует в форме одного стабильного изотопа, скандия-45.Среди 25 (без ядерных изомеров) радиоактивных изотопов с массами от 36 до 61 наиболее стабильным является скандий-46 (период полураспада 83,79 дня), а наименее стабильным – скандий-39 (период полураспада менее 300 наносекунд). ).
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасСкандий отделяется от других редкоземельных элементов путем осаждения нерастворимого сульфата скандия калия или экстракцией тиоцианата скандия диэтиловым эфиром.Сам металл был впервые получен в 1938 году путем электролиза хлоридов калия, лития и скандия в эвтектической смеси (т.е. смеси, имеющей самую низкую возможную температуру плавления с этими компонентами). В настоящее время скандий производится в основном как побочный продукт при извлечении урана из минерального давидита, который содержит около 0,02% оксида скандия. Скандий существует в двух аллотропных (структурных) формах. Α-фаза является плотноупакованной гексагональной с a = 3,3088 Å и c = 5.2680 Å при комнатной температуре. Β-фаза является объемно-центрированной кубической с оценкой a = 3,73 Å при 1337 ° C (2439 ° F).
Было разработано лишь несколько вариантов использования этого необычного переходного металла, в основном из-за ограниченной доступности и высокой стоимости скандия. Его низкая плотность и высокая температура плавления позволяют использовать его в качестве легирующего агента для легких металлов для военных и высокопроизводительных приложений. В основном скандий используется в качестве добавки к сплавам на основе алюминия для спортивных товаров и в металлогалогенных лампах высокой интенсивности.При легировании алюминием и сплавами на его основе скандий ограничивает рост зерен при высоких температурах.
Химический состав скандия больше похож на химический состав других редкоземельных элементов со степенью окисления +3, чем на алюминий или титан. Однако некоторые его характеристики нетипичны для редкоземельных элементов из-за его значительно меньшего ионного радиуса (1,66 Å для координационного числа 12) по сравнению со средним значением для редкоземельных элементов (1,82 Å для координационного числа 12). По этой причине ион Sc 3+ является относительно сильной кислотой и имеет гораздо большую тенденцию к образованию сложных ионов.
Свойства элемента атомный номер 21 атомный вес 44.95591 точка плавления 1,541 ° C (2,806 ° F) точка кипения 2,806 ° F) (5,137 ° F) удельный вес 2,989 (24 ° C или 75 ° F) степень окисления +3 электронная конфигурация [Ar] 3 d 1 4 с 2 1.4. Электронная конфигурация и орбитальные диаграммы
Электронная конфигурация
Целью введения квантовых чисел было показать, что сходство в расположении электронов или электронной конфигурации приводит к сходствам и различиям в свойствах элементов. Но запись квантовых чисел электронов элемента в обозначениях типа {2,1, -1,1⁄2} отнимает много времени и их трудно сравнивать, поэтому была разработана сокращенная форма. Электронная конфигурация перечисляет только первые два квантовых числа, n и \ (\ ell \), а затем показывает, сколько электронов существует на каждой орбитали.Например, запишите электронную конфигурацию скандия: Sc: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 . Таким образом, для скандия 1 -й и 2 -й электрон должны быть на 1-й орбите, 3-й -й и 4 -й на 2-х, 5 -й -10 -й на 2-х орбиталях и т. Д.
Это запоминающее устройство для запоминания порядка орбиталей для первых двух квантовых чисел.Следуйте за стрелкой, начинающейся в верхнем правом углу, когда стрелка закончится, перейдите к следующей стрелке и начните снова.В скандии 4s имеет более низкую энергию и появляется перед 3d (сложность орбиталей d- приводит к его более высокой энергии), поэтому он записывается до добавления 3d к электронной конфигурации. Но принято хранить все основные квантовые числа вместе, чтобы вы могли видеть электронную конфигурацию, записанную как Sc: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 .Запись таких электронных конфигураций может вызвать трудности в определении элемента, который соответствует электронной конфигурации. Но если вы просто подсчитаете количество электронов, оно будет равно количеству протонов, которое равно атомному номеру, уникальному для каждого элемента. Например: «Какой элемент имеет электронную конфигурацию: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4s 2 4p 6 4d 5s 2 ? » Подсчет электронов дает 46 – атомный номер палладия.
Вот схема первых нескольких электронных конфигураций. Периодическая таблица свиста Дэвида – это визуальный способ взглянуть на изменяющуюся электронную конфигурацию элементов.
Обратите внимание, что 3-я орбиталь следует за 4 в нижнем ряду, но, начиная с Ga (# 31), она находится рядом с 3р-орбиталью. Чаще всего он указывается вместе с другими тремя орбиталями, но иногда он следует за 4-м орбиталью, чтобы указать, что 3-я орбиталь ниже по энергии, чем 4-е, когда она заполняется.Исключения из периодической таблицы, которые необходимо знать
Существует основное исключение из нормального порядка электронной конфигурации в Cr (# 24) и Cu (# 29). Оказывается, энергия электронной конфигурации, которая представляет собой наполовину заполненную , 4s 1 3d 5 и заполненную орбиталь, 4s 1 3d 10 , имеет меньшую энергию, чем типичный порядок заполнения, 4s 2 3d 4 и 4s 2 3d 9 .Этому шаблону следует 5 -й ряд с Mo (# 42) и Ag (# 47).
f блок ЭлементыДля полноты картины здесь перечислены несколько элементов блока f . Неодим, Nd, который используется в очень мощных магнитах, имеет атомный номер 60. Для 60 электронов электронная конфигурация:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4s 2 4p 6 4d 10 6177 5s 2 4f 4
Для калифорния Cf с 98 электронами конфигурация электронов:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4s 2 4p 6 4d 10 6177 5s 2 4f 14 5d 10 6p 6 7s 2 5f 10
Орбитальные диаграммы
Часто бывает необходимо увидеть все квантовые числа в электронной конфигурации, что и является целью орбитальной диаграммы.Помимо перечисления главного квантового числа n и подоболочки \ (\ ell \), орбитальная диаграмма показывает все различные ориентации и спин каждого электрона. На диаграмме показано количество подоболочек с использованием ящиков или линий для электронов (используйте три для p-орбиталей, пять для d-орбиталей и 7 для f-орбиталей). В каждом квадрате спин электрона отмечен стрелками, стрелки вверх означают 1/2 спина, а стрелки вниз означают –1⁄2 спина. Например, орбитальная диаграмма для первых 18 атомов показана ниже.
Правила заполнения орбиталей
- Принцип Ауфбау гласит, что орбиталь с самой низкой энергией заполняется первой. Таким образом, электроны обычно сначала заполняют самый низкий энергетический уровень и простейшую форму орбиты.
- Принцип исключения Паули гласит, что никакие два электрона не могут иметь одинаковые четыре квантовых числа. Вот почему каждая орбиталь имеет только два электрона, один спин вверх (1⁄2) и один спин вниз (–1⁄2).
- Правило Хунда гласит, что орбитали с одинаковой энергией, которые отличаются только своей ориентацией, заполняются электронами с одинаковым спином до того, как второй электрон будет добавлен к какой-либо из орбиталей.Вот почему электроны имеют восходящий спин ↑ на орбитальных диаграммах от B к N и от Al к P на диаграммах выше.
Дополнительные примеры орбитальных диаграмм
Вот несколько орбитальных диаграмм элементов с большим количеством электронов, которые помогут вам понять правила, электронную конфигурацию, орбитальные диаграммы и квантовые числа.
Аббревиатура благородных газов
Снова и снова записывать электронную конфигурацию может быть утомительно и отвлекает внимание от внешних электронов, которые являются наиболее важными электронами.Таким образом, сокращенная форма электронных конфигураций была разработана с использованием последнего столбца периодической таблицы, благородных газов. Любой элемент может быть сокращен, кроме H и He, с использованием благородного газа с меньшим количеством электронов, чем элемент. Например, вместо Sc: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 он будет сокращен как [Ar] 4s 2 3d 1 или [Ar] 3d 1 4s 2 . Для Ag сокращение будет: [Kr] 5s 1 4d 10 (см. Орбитальную диаграмму выше), а для Os: [Xe] 6s 2 4f 14 5d 6 или [Xe] 4f 14 5д 6 6с 2 .Просто помните, что сокращения требуют, чтобы вы использовали только благородные газы и что вы использовали благородный газ с меньшим количеством электронов. Также нельзя сокращать благородный газ, используя его символ в скобках; то есть Ar представляет собой [Ne] 3s 2 3p 6 , но не [Ar]. Наконец, вы все еще можете подсчитать количество электронов для определения элемента, вы просто начнете с количества электронов в благородном газе. Например, «Каков элемент с электронной конфигурацией: [Xe] 6s 2 4f 14 5d 6 ?» Подсчет электронов 54 + 2 + 14 + 6 = 76, что является атомным номером осмия, Os.
Сходства в электронной конфигурации
одинаковых аналогичных объектов недвижимости. Теперь мы можем собрать первую и вторую часть этого блока. Когда разрабатывалась таблица Менделеева, химики искали сходства в химических и физических свойствах. Любая теория, описывающая расположение электронов, должна быть способна объяснить эти сходства. Давайте снова посмотрим на электронные конфигурации в формате таблицы Менделеева.
Первый столбец этой периодической таблицы содержит единственный электрон на внешней s-орбитали: H 1s 1 , Li 2s 1 , Na 3s 1 , K 4s 1 .Таким образом, подобие электронов на внешнем энергетическом уровне должно быть причиной того, что все щелочные металлы действуют одинаково как по своему химическому составу, так и по своим физическим свойствам. Водород является исключением, потому что это единственный протон в ядре и один электрон, который придает ему совершенно уникальные свойства (хотя при высоком давлении и низкой температуре он может действовать как металл). На протяжении всей периодической таблицы мы видим один и тот же образец в каждом столбце, где наиболее удаленные электроны заполнили подоболочки аналогичным образом.Для переходных металлов крайними электронами являются 4s 2 электроны, которые окружают заполняющую 3d-орбиталь (4s находится на уровне энергии 4 th , а 3d – на нижнем уровне энергии 3 rd ). Поскольку переходные металлы добавляют больше электронов и больше протонов, их свойства меняются более тонко, чем у щелочных металлов и щелочноземельных металлов, потому что внешние электроны почти всегда одинаковы (помните, за исключением Cr и Cu). Внешние электроны настолько важны, что мы даем им имя: валентных электронов .Валентные электроны будут основной частью нашего обсуждения связывания и образования соединений.
WebElements Periodic Table »Скандий» Свойства свободных атомов
Атомы скандия имеют 21 электрон, а структура оболочки – 2.8.9.2.
Электронная конфигурация основного состояния газообразного нейтрального скандия в основном состоянии – это [ Ar ]. 3д 1 . 4s 2 , а символ термина – это 2 D 3/2 .
Схематическая электронная конфигурация скандия. Косселевская оболочка скандия.Атомный спектр
Представление атомного спектра скандия.
Энергии ионизации и сродство к электрону
Сродство скандия к электрону составляет 18,1 кДж моль ‑1 . Энергии ионизации скандия приведены ниже.
Энергии ионизации скандия.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff .Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
Эффективные ядерные заряды по скандию 1с 20,4566 2с 14,57 2п 17,05 3с 10,34 3 пол. 9,41 3д 7,12 4с 4,63 4п (нет данных) 4д (нет данных) 4f (нет данных) 5s (нет данных) 5п (нет данных) 5д (нет данных) 6s (нет данных) 6п (нет данных) 7с Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
Энергии связи электронов для скандия. Все значения энергий связи электронов приведены в эВ. Энергии связи указаны относительно уровня вакуума для инертных газов и молекул H 2 , N 2 , O 2 , F 2 и Cl 2 ; относительно уровня Ферми для металлов; и относительно верха валентной зоны для полупроводников. Этикетка Орбитальный эВ [ссылка на литературу] K 1s 4492 [1] L I 2s 498 [2] L II 1 2p 1/2 900 403,6 [2]
L III 2p 3/2 398,7 [2] M I 3s 51.1 [2] M II 3p 1/2 28,3 [2] M III 3p 3/2 28,3 [2] Банкноты
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электрона. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Электронные конфигурации элементов
Легче понять электронную конфигурацию и валентность, если вы действительно видите электроны, окружающие атомы. Для этого у нас есть диаграммы электронных оболочек.
Вот диаграммы атомов электронной оболочки для элементов, упорядоченных по возрастанию атомного номера.
Для каждой диаграммы атома электронной оболочки символ элемента указан в ядре. Показаны электронные оболочки, движущиеся наружу от ядра. Последнее кольцо или оболочка электронов содержит типичное количество валентных электронов для атома этого элемента. Атомный номер и имя элемента указаны в верхнем левом углу. В правом верхнем углу показано количество электронов в нейтральном атоме. Помните, что нейтральный атом содержит одинаковое количество протонов и электронов.
Изотоп определяется количеством нейтронов в атоме, которое может быть равно количеству протонов – или нет.
Ион атома – это ион, в котором количество протонов и электронов не одинаково. Если протонов больше, чем электронов, атомный ион имеет положительный заряд и называется катионом. Если электронов больше, чем протонов, ион имеет отрицательный заряд и называется анионом.
Показаны элементы от атомного номера 1 (водород) до 94 (плутоний). Однако легко определить конфигурацию электронов для более тяжелых элементов, составив диаграмму.
Водород
Грег Робсон / CC BY 2.0Гелий
Грег Робсон / CC BY 2.0Литий
Грег Робсон / CC BY 2.0Литий – первый элемент, в который добавлена дополнительная электронная оболочка. Помните, валентные электроны находятся во внешней оболочке. Заполнение электронных оболочек зависит от их орбитали. Первая орбиталь ( s орбиталь ) может содержать только два электрона.
Бериллий
Грег Робсон / CC BY 2.0Бор
Грег Робсон / CC BY 2.0Углерод
Грег Робсон / CC BY 2.0Азот
Грег Робсон / CC BY 2.0Кислород
Грег Робсон / CC BY 2.0фтор
Грег Робсон / CC BY 2.0Неон
Грег Робсон / CC BY 2.0Натрий
Грег Робсон / CC BY 2.0Магний
Грег Робсон / CC BY 2.0Алюминий
Грег Робсон / CC BY 2.0Кремний
Грег Робсон / CC BY 2.0фосфор
Грег Робсон / CC BY 2.0Сера
Грег Робсон / CC BY 2.0Хлор
Грег Робсон / CC BY 2.0Аргон
Грег Робсон / CC BY 2.0Калий
Грег Робсон / CC BY 2.0Кальций
Грег Робсон / CC BY 2.0Скандий
Грег Робсон / CC BY 2.0Титан
Грег Робсон / CC BY 2.0Ванадий
Грег Робсон / CC BY 2.0Хром
Грег Робсон / CC BY 2.0Марганец
Грег Робсон / CC BY 2.0Утюг
Грег Робсон / CC BY 2.0Кобальт
Грег Робсон CC BY 2.0Никель
Грег Робсон / CC BY 2.0Медь
Грег Робсон / CC BY 2.0Цинк
Грег Робсон / CC BY 2.0Галлий
Грег Робсон / CC BY 2.0Германий
Грег Робсон / CC BY 2.0Мышьяк
Грег Робсон / CC BY 2.0Селен
Грег Робсон / CC BY 2.0Бром
Грег Робсон / CC BY 2.0Криптон
Грег Робсон / CC BY 2.0Рубидий
Грег Робсон / CC BY 2.0Стронций
Грег Робсон / CC BY 2.0Иттрий
Грег Робсон / CC BY 2.0Цирконий
Грег Робсон / CC BY 2.0Ниобий
Грег Робсон / CC BY 2.0Молибден
Грег Робсон / CC BY 2.0Технеций
Грег Робсон / CC BY 2.0Рутений
Грег Робсон / CC BY 2.0Родий
Грег Робсон / CC BY 2.0Палладий
Грег Робсон / CC BY 2.0Серебро
Грег Робсон / CC BY 2.0Кадмий
Грег Робсон / CC BY 2.0Индий
Грег Робсон / CC BY 2.0Олово
Грег Робсон / CC BY 2.0Сурьма
Грег Робсон / CC BY 2.0Теллур
Грег Робсон / CC BY 2.0Йод
Грег Робсон / CC BY 2.0Ксенон
Грег Робсон / CC BY 2.0Цезий
Грег Робсон / CC BY 2.0Барий
Грег Робсон / CC BY 2.0Лантан
Грег Робсон / CC BY 2.0Церий
Грег Робсон / CC BY 2.0Празеодим
Грег Робсон / CC BY 2.0Неодим
Грег Робсон / CC BY 2.0Прометий
Грег Робсон / CC BY 2.0Самарий
Грег Робсон / CC BY 2.0Европий
Грег Робсон / CC BY 2.0Гадолиний
Грег Робсон / CC BY 2.0Тербий
Грег Робсон / CC BY 2.0Диспрозий
Грег Робсон / CC BY 2.0Гольмий
Грег Робсон / CC BY 2.0Эрбий
Грег Робсон / CC BY 2.0Тулий
Грег Робсон / CC BY 2.0Иттербий
Грег Робсон / CC BY 2.0Лютеций
Грег Робсон / CC BY 2.0Гафний
Грег Робсон / CC BY 2.0Тантал
Грег Робсон / CC BY 2.0Вольфрам
Грег Робсон / CC BY 2.0Рений
Грег Робсон / CC BY 2.0Осмий
Грег Робсон / CC BY 2.0Иридий
Грег Робсон / CC BY 2.0Платина
Грег Робсон / CC BY 2.0Золото
Грег Робсон / CC BY 2.0Меркурий
Грег Робсон / CC BY 2.0Таллий
Грег Робсон / CC BY 2.0Свинец
Грег Робсон / CC BY 2.0висмут
Грег Робсон / CC BY 2.0Полоний
Грег Робсон / CC BY 2.0Астатин
Грег Робсон / CC BY 2.0Радон
Грег Робсон / CC BY 2.0Франций
Грег Робсон / CC BY 2.0Радий
Грег Робсон / CC BY 2.0Актиний
Грег Робсон / CC BY 2.0Торий
Грег Робсон / CC BY 2.0Протактиний
Грег Робсон / CC BY 2.0Уран
Грег Робсон / CC BY 2.0Нептуний
Грег Робсон / CC BY 2.0Плутоний
Грег Робсон / CC BY 2.0Структура Sc3N @ C80 (синий: клеточные атомы C80; зеленый: атомы скандия …
Контекст 1
… кластерные ЭДС являются наиболее изученными кластерфуллеренами, о которых впервые сообщили в 1999 г. Дорн и соавторы. Sc 3 N @ C 80 (рис. 3), как первый член кластерфуллеренов из нитридов металлов, был получен с аномально высоким выходом и оказался самым распространенным членом среди всех эндоэдральных фуллеренов, о которых сообщалось. Дата (31). Общие методы синтеза нитридных кластерных ЭДС включают процесс «триметаллический нитридный темплат» (TNT) (31), метод «реактивная газовая атмосфера» (37), метод «неорганический твердый азот»…
Контекст 2
… [4þ2] циклоприсоединения, двойные связи 6: 6 фуллерена всегда действуют как диенофилы и имеют тенденцию реагировать с различными диенами с образованием продуктов типа Дильса-Альдера. Простые примеры включают реакции с антраценом, циклопентадиеном и бута-1,3-диеном с получением соединений, показанных на Фигуре 18 (230-234). Кроме того, некоторые диены, полученные in situ, также могут применяться для взаимодействия с фуллеренами. …
Контекст 3
… есть много примеров таких дополнений. Типичными примерами являются реакции 1,2-диаминов с образованием производных, таких как показанные на Фигуре 23 (246). …
Контекст 4
… способы связывания комплексов фуллерен-металл можно разделить на две категории, а именно, p-тип, такой как h 2 -фуллерен, mh 2: h 2 -фуллерен и m 3 -h 2: h 2: h 2 -фуллерен вместе с sp смешанного типа, например m 3 -h 1: h 1: h 2 -фуллерен и m 3 -h 1: h 2: h 1 -фуллерен. Комплексы [60] фуллерена p-типа и s-p смешанного типа показаны на рисунке 30….
Контекст 5
… Комплексы (h 2 -C 60) Ir (CO) Cl (PR 1 R 2 R 3) 2 являются одними из наиболее широко изученных и могут быть легко получены реакциями C 60 с различными комплексами васского типа Ir (CO) Cl (PR 1 R 2 R 3) 2 (335-337). Множественные добавки также наблюдаются во многих случаях, и типичный пример, включающий добавление Ir (CO) Cl (PMe 2 Ph) 2 к [70] фуллерену, показан на рисунке 31 (338). реакция первоначально наблюдается при нагревании продуктов циклоприсоединения C 60 с циклопентадиеном (339) или 9,10-диметилантраценом (340,341)….
Контекст 6
… близкое родство звездообразных полимеров – это дендритные полимеры или дендримеры (356), в которых ядра фуллерена не могут связываться друг с другом из-за стерических ограничений. На Фигуре 32 показаны общие структуры C 60-содержащих полимеров. …
Контекст 7
… Например, фторирование (C 59 N) 2 дает C 59 NF (358), а электрофильное замещение C 59 N ароматическими соединениями дает различные арилированные производные C 59 NAr (359).Структуры этих производных, включая C 59 NH, показаны на Фигуре 33a. Химия эндоэдральных фуллеренов. Экзоэдральные химические модификации эндоэдральных фуллеренов для получения новых гибридных молекул с различными органическими функциональными группами привлекли все большее внимание благодаря прорыву в монокристаллографических рентгеновских исследованиях их производных (44) (45) (46) (47) .
