Серебро, свойства атома, химические и физические свойства
Серебро, свойства атома, химические и физические свойства.
Поделиться в:
Ag 47 Серебро
107,8682(2) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1
Серебро — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 47. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), пятом периоде периодической системы.
Атом и молекула серебра. Формула серебра. Строение атома серебра
Цена на серебро
Изотопы и модификации серебра
Свойства серебра (таблица): температура, плотность, давление и пр.
Физические свойства серебра
Химические свойства серебра. Взаимодействие серебра. Химические реакции с серебром
Получение серебра
Применение серебра
Таблица химических элементов Д. И. Менделеева
И. Менделеева
Атом и молекула серебра. Формула серебра. Строение атома серебра:
Серебро (лат. Argentum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ag и атомным номером 47. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), пятом периоде периодической системы.
Серебро – металл. Относится к группе переходных металлов, а также к драгоценным и цветным металлам.
Серебро обозначается символом Ag.
Как простое вещество серебро при нормальных условиях представляет собой ковкий, пластичный металл серебристо-белого цвета.
Молекула серебра одноатомна.
Химическая формула серебра Ag.
Электронная конфигурация атома серебра 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1. Потенциал ионизации (первый электрон) атома серебра равен 731 кДж/моль (7,576234(25) эВ).
Строение атома серебра. Атом серебра состоит из положительно заряженного ядра (+47), вокруг которого по пяти оболочкам движутся 47 электронов. При этом 46 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку серебро расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома серебра на s-орбитали находится один неспаренный электрон.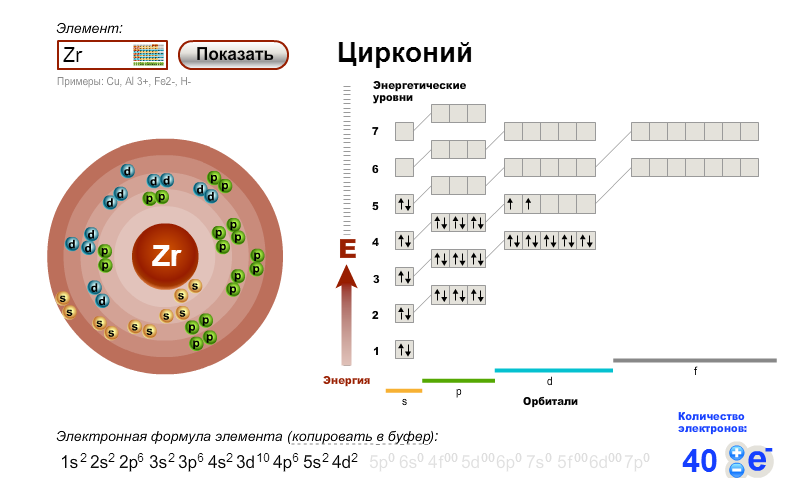 В свою очередь ядро атома серебра состоит из 47 протонов и 61 нейтрона. Серебро относится к элементам d-семейства.
В свою очередь ядро атома серебра состоит из 47 протонов и 61 нейтрона. Серебро относится к элементам d-семейства.
Радиус атома серебра (вычисленный) составляет 165 пм.
Атомная масса атома серебра составляет 107,8682(2) а. е. м.
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью.
Серебро, свойства атома, химические и физические свойства
Изотопы и модификации серебра:
Свойства серебра (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Серебро |
| 102 | Прежнее название | |
| 103 | Латинское название | Argentum |
| 104 | Английское название | Silver |
| 105 | Символ | Ag |
| 106 | Атомный номер (номер в таблице) | 47 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, драгоценный, цветной металл |
| 109 | Открыт | Известно с древних времен |
| 110 | Год открытия | до 5000 года до н. э. э. |
| 111 | Внешний вид и пр. | Ковкий, пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | ||
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 7,9·10-6 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000014 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 107,8682(2) а.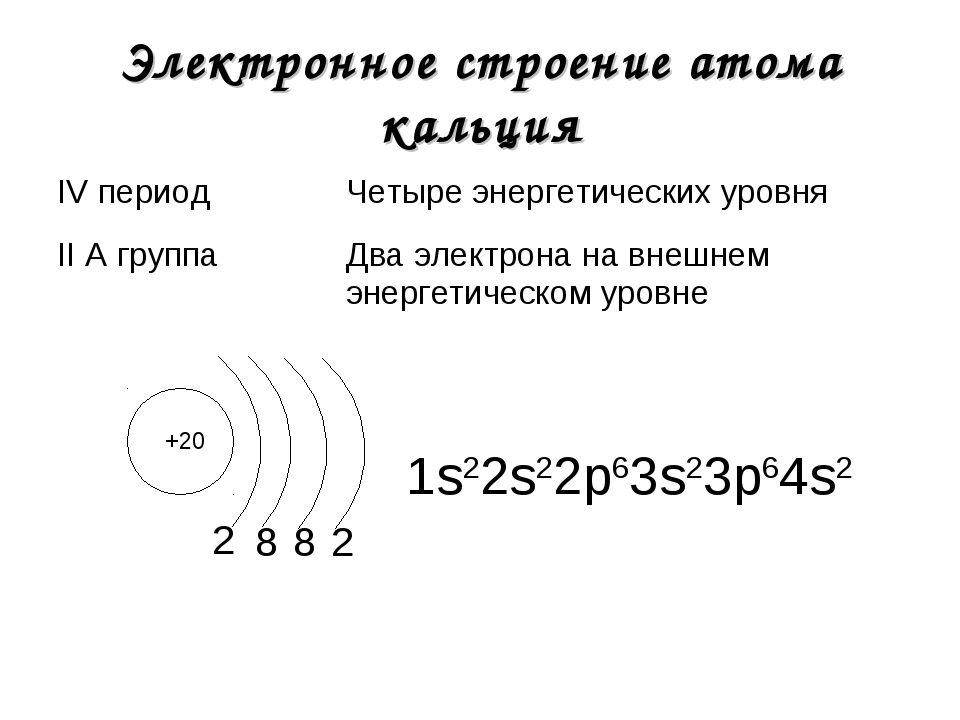 е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | |
| 205 | Эмпирический радиус атома* | 160 пм |
| 206 | Ковалентный радиус* | 145пм |
| 207 | Радиус иона (кристаллический) | Ag+ 81 (2) пм, 114 (4) пм, 129 (6) пм, 142 (8) пм, Ag2+ 108 (6) пм, Ag3+ 89 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 172 пм |
| 209 | Электроны, Протоны, Нейтроны | 47 электронов, 47 протонов, 61 нейтрон |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, -1, +1, +2, +3 |
| 302 | Валентность | I, II, III |
| 303 | Электроотрицательность | 1,93 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 731 кДж/моль (7,576234(25) эВ) |
| 305 | Электродный потенциал | Ag+ + e– → Ag, Eo = +0,799 В, Ag2+ + e– → Ag+, Eo = +2,00 В |
| 306 | Энергия сродства атома к электрону | 125,862(3) кДж/моль (1,30447(3) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 10,49 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 9,320 г/см3 (при температуре плавления 961,78 °C и иных стандартных условиях |
| 402 | Температура плавления* | 961,78 °C (1234,93 K, 1763,2 °F) |
| 403 | Температура кипения* | 2162 °C (2435 K, 3924 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 11,28 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 254 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,235 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 25,36 Дж/(K·моль) |
| 411 | Молярный объём | 10,282955 см³/моль |
| 412 | Теплопроводность | 429 Вт/(м·К) (при стандартных условиях), 429 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | a = 4,086 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 225 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-22-4 |
Примечание:
205* Эмпирический радиус атома серебра согласно [1] и [3] составляет 144 пм.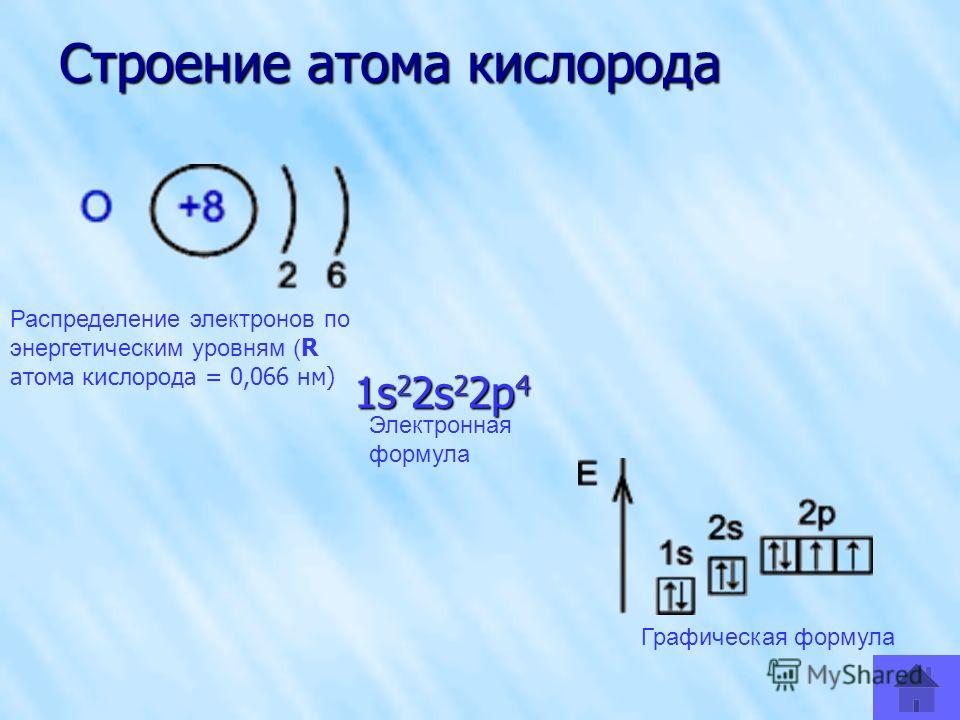
206* Ковалентный радиус серебра согласно [1] и [3] составляет 145±5 пм и 134 пм соответственно.
401* Плотность серебра согласно [3] и [4] составляет 10,5 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления серебра согласно [3] и [4] составляет 961,95 °С (1235,1 K, 1763,51 °F) и 960,5 °С (1233,65 K, 1760,9 °F) соответственно.
403* Температура кипения серебра согласно [3] и [4] составляет 2211,85 °C (2485 K, 4013,33 °F) и 2167 °С (2440,15 K, 3932,6 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) серебра согласно [3] и [4] составляет 11,95 кДж/моль и 11,3 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔH
410* Молярная теплоёмкость серебра согласно [3] составляет 25,36 Дж/(K·моль).
Физические свойства серебра:
Химические свойства серебра.
 Взаимодействие серебра. Химические реакции с серебром:
Взаимодействие серебра. Химические реакции с серебром:
Получение серебра:
Применение серебра:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28.
 Никель
Никель - 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62.
 Самарий
Самарий - 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95.
 Америций
Америций - 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Silver
- https://de.wikipedia.org/wiki/Silber
- https://ru.wikipedia.org/wiki/Серебро
- http://chemister.
 ru/Database/properties.php?dbid=1&id=257
ru/Database/properties.php?dbid=1&id=257 - https://chemicalstudy.ru/serebro-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
серебро атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле серебра серебро
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 101
3.
 Физические свойства
Физические свойстваСеребро — элемент, который был известен еще за 3000 лет до нашей эры в Египте, Персии, Китае. Основные физические свойства серебра:
Серебро имеет гранецентрированную кубическую кристаллическую решетку с параметром a= 4,0772А (при 20° С). По внешнему виду серебро — красивый металл белого цвета, очень пластичный и легко полируется. Из всех металлов серебро имеет наивысшую отражательную способность, равную в оранжево-красной части спектра 95%, наивысшую электропроводность и теплопроводность.
Ионный радиус серебра (Ag+) составляет, по Гольдшмидту и Полингу, 1,13 и 1,26 А соответственно.
Серебро марки
Ср999-999.9 должно иметь примесей не более
0.1%. Удельное электрическое сопротивление
ρ=0.015 мкОм•м. Механические характеристики
серебра невысоки: предел прочности при
разрыве не более 200МПа, относительное
удлинение при разрыве ~50%.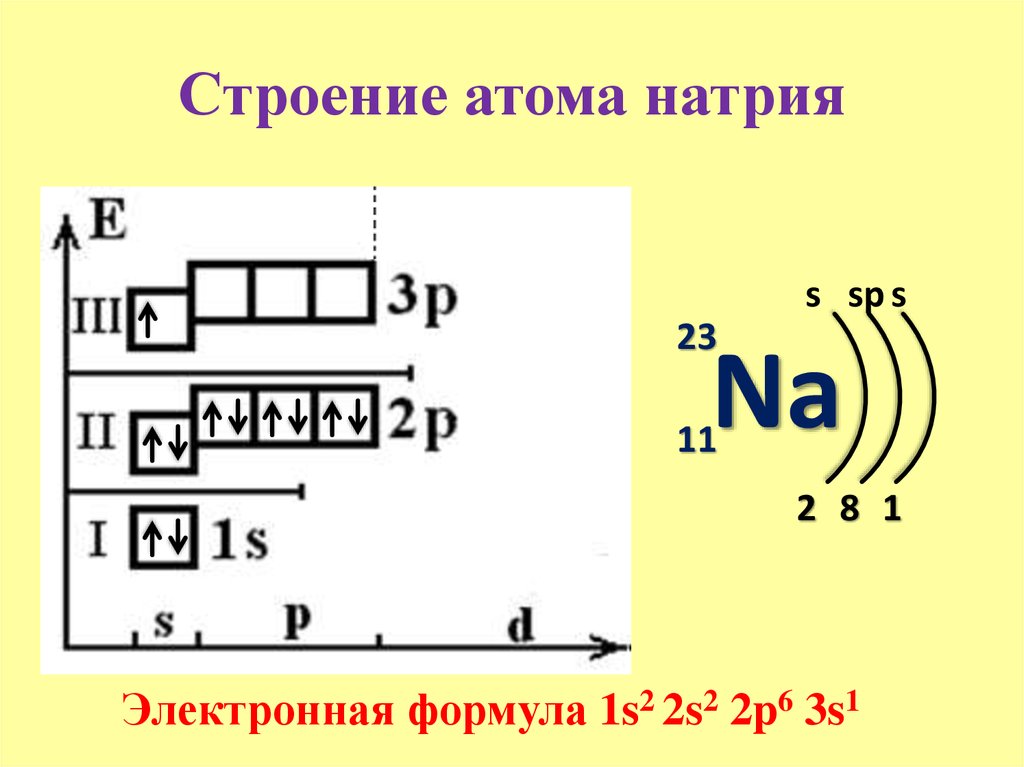 По сравнению
с золотом и платиной имеет пониженную
химическую стойкость. Часто применение
серебра ограничивается его способностью
диффундировать в материалы подложки.
По сравнению
с золотом и платиной имеет пониженную
химическую стойкость. Часто применение
серебра ограничивается его способностью
диффундировать в материалы подложки.
4.1 Электронная формула серебра: 1s22s22p63s23p63d104s24p64d105s1
4.2 Серебро принадлежит к главной подгруппе
первой группы периодической системы
элементов Д. И. Менделеева и располагается
в пятом периоде (большом) между палладием
и кадмием. Номер группы, как правило,
указывает число электронов, которые
могут участвовать в образовании
химических связей (валентных электронов).
У атома серебра это электроны внешнего
электронного уровня. Номер периода
равен общему числу энергетических
уровней, заполняемых электронами, у
атомов элемента – в нашем случае серебра.
Порядковый номер серебра 47. Порядковый
номер показывает заряд ядра атома, у
серебра, следовательно, он будет +47. По
своим химическим свойствам и условиям
нахождения в природе серебро является
благородным металлом. Серебро относится
к «Б» группе. У серебра возможен эффект
провала электрона, т.к. один электрон с
5s2 подуровня
переходит на 4d9 подуровень.
По
своим химическим свойствам и условиям
нахождения в природе серебро является
благородным металлом. Серебро относится
к «Б» группе. У серебра возможен эффект
провала электрона, т.к. один электрон с
5s2 подуровня
переходит на 4d9 подуровень.
Атомная масса серебра по углеродной шкале равна 107,868. Элемент представляет естественную смесь двух устойчивых изотопов с массовыми числами 107 и 109.
4.3 Валентным подуровнем у серебра будет являться 5s1 подуровень, так как только он в данном случае может участвовать в образовании химических связей (подуровень 5s1 является незаполненным ему не хватает одного электрона). Серебро относится к типу d – элементов, так как в его атомах происходит заполнение электронами d – подуровень второго снаружи уровня.
4.4 5S1
n
5
e
0
me
0
ms
1/2
4. 5 Степени
окисления серебра: 0, +1, +2, +3. Серебро в
своих соединениях проявляет преимущественно
степень окисления +1. Окисление до
двухвалентного состояния может быть
произведено действием озона или
персульфата на соли серебра (I).
Серебро (П) устойчиво преимущественно
в комплексных соединениях. Для серебра
известна также степень окисления
+3. Серебро в степени окисления +3 известно
в виде соединений Ag203 и KAgF4.
Первое получается при анодном окислении
фторида серебра, второе — фторированием
смеси КСl
и AgCl
при высоких температурах. Прямым
фторированием смеси 2CsCl
+ KCl
+ AgN03 получается соединение Cs2KagF6.
5 Степени
окисления серебра: 0, +1, +2, +3. Серебро в
своих соединениях проявляет преимущественно
степень окисления +1. Окисление до
двухвалентного состояния может быть
произведено действием озона или
персульфата на соли серебра (I).
Серебро (П) устойчиво преимущественно
в комплексных соединениях. Для серебра
известна также степень окисления
+3. Серебро в степени окисления +3 известно
в виде соединений Ag203 и KAgF4.
Первое получается при анодном окислении
фторида серебра, второе — фторированием
смеси КСl
и AgCl
при высоких температурах. Прямым
фторированием смеси 2CsCl
+ KCl
+ AgN03 получается соединение Cs2KagF6.
Синтезированы также периодаты серебра, например Na5H2Ag(JO6)2•16Н20. Серебро относится к металлам.
4.6
Валентный 5S1 подуровень серебра.
5. 1 С водородом:
1 С водородом:
Ag + H2 ≠ реакция не идет
Ag 2O+ H2 = H2O + 2Ag
5.2 С галогеном(Br2):
2Ag + Br2 = 2AgBr – бромид серебра
5.3 С серой:
2Ag + S = Ag2S – сульфид серебра
5.4 С азотом:
Ag + N2 ≠
5.5 С углеродом:
4Ag + C ≠
5.6 С кислородом
Ag + O2 = Ag2O – Оксид серебра
6.1 Оксиды серебра: Ag2O, AgO, Ag2O3, причем более или менее устойчивым является Ag2O. В комплексных соединениях оксид серебра более или менее устойчив:
AgNO3 + KOH + 2NH3h3OKNO3 + [Ag(NH3)2]OH
6. 2 Оксид серебра
является амфотерным оксидом, так как
серебро является металлом и проявляет
ярко выраженные металлические свойства
– следовательно, он не может быть
кислотным. Щелочным металлом серебро
тоже не является. Электроотрицательность
серебра по шкале равна 1,9.
2 Оксид серебра
является амфотерным оксидом, так как
серебро является металлом и проявляет
ярко выраженные металлические свойства
– следовательно, он не может быть
кислотным. Щелочным металлом серебро
тоже не является. Электроотрицательность
серебра по шкале равна 1,9.
6.3 Гидроксиды серебра: AgOH, Ag(OH)2, Ag(OH)3 . Гидроксиды серебра являются слабыми электролитами, так как они легко разлагаются водой.
6.4 AgOH – амфотерный
2AgOH → Ag2O + H2O
AgOH + NaOH → Na[Ag(OH)2]
AgOH + Na+ + OH– → Na+ + [Ag(OH)2]–
AgOH + OH– → [Ag(OH)2]–
AgOH + 2HNO3 → H[Ag(NO3)2] + H2O
AgOH + 2H+ + 2NO–3→ H+ + [Ag(NO3)2]– + H2O
AgOH + 2NO–3→ [Ag(NO3)2]– + H2O
2AgOH + H2SO4 → Ag2SO4 + 2H2O
2AgOH + 2H+ +SO–4 → 2Ag+ + SO–4 + 2H2O
2AgOH + 2H+ → 2Ag+ + 2H2O
6. 5
5
2AgOH → Ag2O∙H2O
7. Сеpебpо обладает склонностью к образованию комплексных соединений.
Многие
неpаствоpимые в воде соединения сеpебpа
(напpимеp: оксид
сеpебpа(I) —
Ag2O
и хлоpид
сеpебpа —
AgCl), легко pаствоpяются в водном pаствоpе
аммиака. Комплексные цианистые соединения
сеpебpа пpименяются для гальванического
сеpебpения, так как пpи электpолизе
pаствоpов этих солей на повеpхности
изделий осаждается плотный слой
мелкокpисталлического сеpебpа. Все
соединения сеpебpа легко восстанавливаются
с выделением металлического сеpебpа.
Если к аммиачному pаствоpу оксида
сеpебpа(I), находящемуся в стеклянной
посуде, пpибавить в качестве восстановителя
немного глюкозы или фоpмалина, то
металлическое сеpебpо выделяется в виде
плотного блестящего зеpкального слоя
на повеpхности стекла. Этим способом
готовят зеркала, а также серебрят
внутреннюю поверхность стекла в сосудах
для уменьшения потери тепла лучеиспусканием.
Примеры: Na3[Ag(S2O3)2]
[Ag(NH3)2]OH
[Ag(NH3)2]2SO4
K[Ag(CN)2]
Na[Аg(SCN)2]; Na2[Ag(SCN)3]; Na3[Аg(SСN)4]
(NН4)5[Аg(SСN)6]
Сs3Ba[Ag(NО2)6]·2Н2О
(NН4)9[Аg(S2O3)4Cl2]
8.
AgNO3 + H2O ↔ AgOH + HNO3
Ag+ + NO–3 + H2O ↔ AgOH↓ + H+ + NO–3
Ag+ + H2O ↔ AgOH↓ + H+
[H+] = 1∙10-14/[oh–]
[OH–] = c(AgNO3) = 0,01 моль/л = 10-2
pH
= 1/2∙lgKн2о∙Ссоли /Кдис.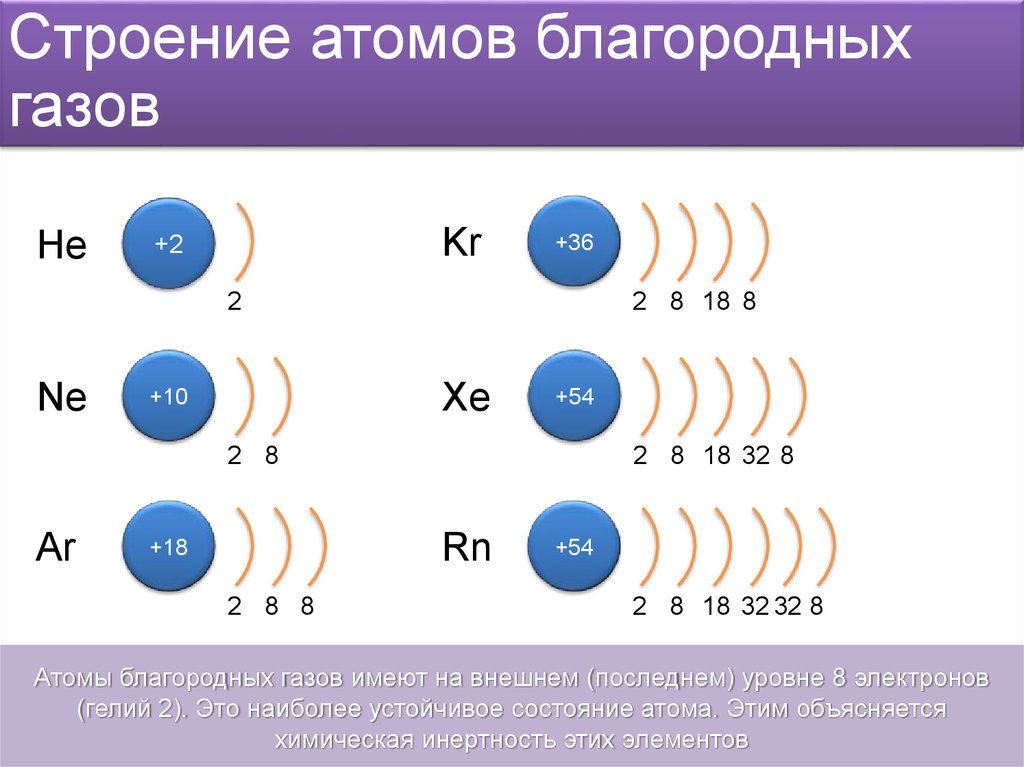 =12
=12
Повышение температуры и уменьшение концентрации соли увеличат полноту гидролиза.
9.1
При увеличении pH от кислой среды до щелочной увеличиваются окислительные свойства, а восстановительные уменьшаются, так как серебро в ряду напряжений находится правее водорода. Чем меньше алгебраическая величина электродного потенциала металла, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
φAg2+/Ag+ = 1,980B pH ≤ 7
φAg+/Ag= 0,799B
Так как φAg2+/Ag+ > φAg+/Agследовательно восстановительная способность ионов Ag+/Ag выше, чем у Ag2+/Ag+
φAgO/Ag2O= 0,607B pH ≥ 7
φAgO/Ag2O= 1,398B
pH
≤ 7 Ионы серебра в AgO/Ag2O
при pH
≥ 7 проявляют более сильные восстановительные
свойства, чем при pH
≤ 7.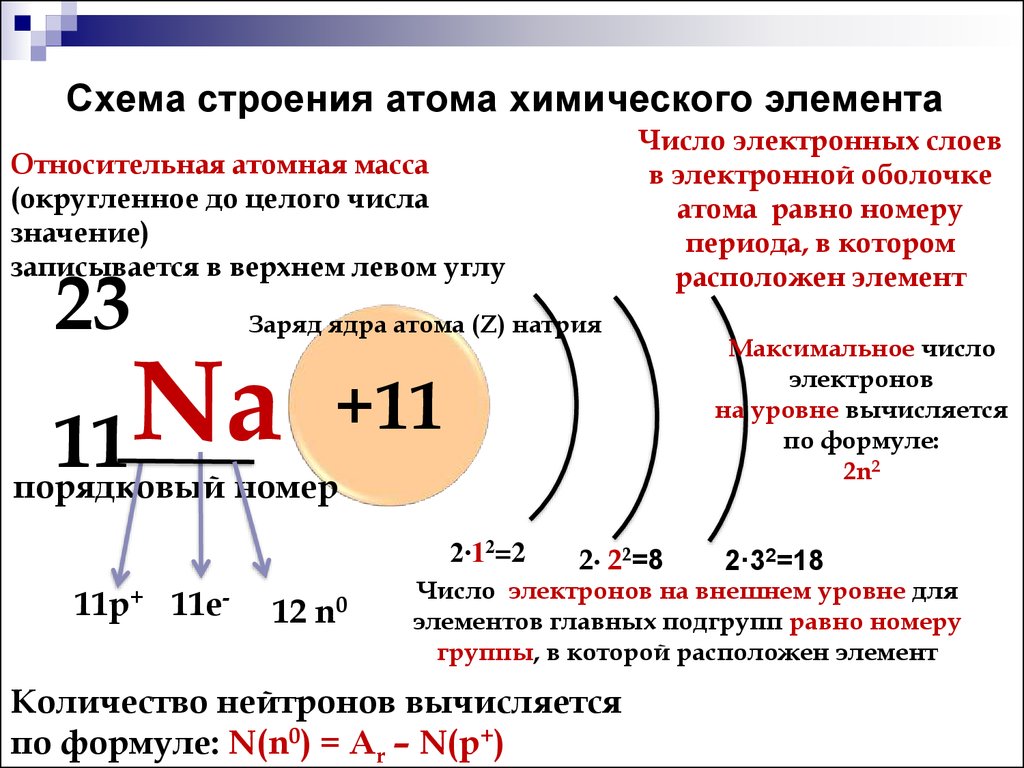
9.2
0 + +7 -2 + -2 + -2 + +5 -2 + -2
1) 2Ag + K(ClO4)– + H2O Ag2O + K(ClO3)– + H2O
red ox нейтр. pH=7
0 + -2 + -2
red 2Ag – 2e +H2O Ag2O + 2H+ 2 1 окисление
+7 -2 + -2 +5 -2
ox (ClO4)– + 2e + H2O (ClO3)– + 2OH– 2 1 восстановление
0 +7 -2 + -2 + -2 +5 -2
2Ag + (ClO4)– + 2H2O Ag2O + (ClO3)– +2H+ + 2OH–
0 +7 -2 + -2 +5 -2
2Ag + (ClO4)– Ag2O + (ClO3)–
+ | – |
K+ |
E0,B = φAg/Ag2O – φ(ClO4)–/(ClO3)–= 1,173 – 0,360 = 0,813B
+ -2 0 + -2 + 0 + +4 -2 + -2
2) 2Ag2O + Ti + 2NaOH 4Ag + Na2(TiO3)2- + H2O
ox
red щелочн. pH>7
pH>7
+ -2 + -2 0
ox Ag2O + 2e + H2O 2Ag + 2OH– 4 2 восстановление
0 +4 -2 + -2
red Ti – 4e + 6OH– (TiO3)2- + 3H2O 2 1 окисление
+ -2 0 + -2 0 +4 -2 + -2
2Ag2O + Ti + 2H2O + 6OH– 4Ag + (TiO3)2- + 4OH– + 3H2O
+ -2 0 0 +4 -2 + -2
2Ag2O + Ti + 2OH– 4Ag + (TiO3)2- + H2O
+ | – |
2Na+ |
E0,B = φTi/(TiO3)2- – φAg2O/Ag = -1,250 – 1,173 = -2,423B
0 + +6 -2 + +5 -2 + -2 +3 +5 -2 + -2
3) 6Ag +K2CrO7 + HNO3 3Ag2O + 2Cr(NO3)3 + 4H2O
red
ox кислотн. pH<7
pH<7
0 + -2 + -2
red 2Ag – 2e + H2O Ag2O + 2H+ 6 3 окисление
+6 -2 + -2
ox (Cr2O7)2- + 6e + 14H+ 2Cr3+ + 7H2O 2 1 восстановление
0 +6 -2 + -2 + -2
6Ag + (Cr2O7)2- + 8H+ 3Ag2O + 2Cr3+ + 4H2O
0 +6 -2 + -2 + -2
6Ag + (Cr2O7)2- + 8H+ 3Ag2O + 2Cr3+ + 4H2O
+ | – |
2K+ | 8NO–3 |
E0,B = φAg/Ag2O– φ(Cr2O7)2-/Cr3+ = 1,173 – 1,330 = -0,157B
10. 1
1
Серебро — малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение сеpебpяных предметов — результат образования на их поверхности черного сульфида сеpебpа – AgS2. Это происходит под влиянием содержащегося в воздухе сеpоводоpода, а также пpи соприкосновении
сеpебpяных предметов с пищевыми продуктами, содержащими соединения сеpы.
4Ag + 2H2S + O2 → 2Ag2S +2H2O
В
ряду напряжения серебро расположено
значительно дальше водорода. Поэтому
в растворах таких кислот, как НСl, Н2SO4 и т. п., при отсутствии окислителей не
растворяется. В кислотах, одновременно
являющихся окислителями (НNО3,
горячая концентрированная Н2SO4 и т. п.) серебро растворяется легко. С
водородом, азотом и углеродом Аg не
реагирует даже при высоких температурах. Под нормальным давлением кислорода
серебро не только с ним практически не
реагирует, но и крайне мало его растворяет.
Напротив, жидкое серебро растворяет
кислород довольно хорошо. Поэтому при
затвердевании Аg происходит выделение
из него газообразного кислорода, иногда
сопровождающееся разбрызгиванием
металла.
Под нормальным давлением кислорода
серебро не только с ним практически не
реагирует, но и крайне мало его растворяет.
Напротив, жидкое серебро растворяет
кислород довольно хорошо. Поэтому при
затвердевании Аg происходит выделение
из него газообразного кислорода, иногда
сопровождающееся разбрызгиванием
металла.
При нагревании металлического серебра в атмосфере и хлористого водорода имеет место обратимая реакция:
2 Аg + 2 НСl = 2 АgСl + Н2 + 71 кДж
Равновесие быстро устанавливается уже при 200 С. Если проводить процесс в замкнутом сосуде под атмосферным давлением, то при 600 С газовая смесь содержит по объему 92,8 % НСl и 7,2 % Н2, а при 700 С соответственно 95 % и 5 %.
Ag + HCl ≠
3Ag + 4HNO3 = 3AgNO3 + NO↑ + 2H2O
2Ag + NaOH + 2H2O = Na[Ag(OH)2] + H2↑
2Ag + 2NaOH → 2NaAgO + H2↑
10. 2
2
Непосредственно измерить потенциал отдельного электрода (в частности серебра) невозможно. Обычно применяют так называемый стандартный водородный электрод, значение потенциала которого условно принимают за 0. Пластину серебра погружают в раствор его соли (например: AgNO3), содержащей 1 моль ионов Ag в 1000г воды, соединяют с водородным электродом и измеряют ЭДС при 25°с. Эта ЭДС и есть стандартный электродный потенциал.
_ 0
Ag+ + 1e → Ag
ΔE = – ΔC1/nF = +0,799
F – постоянная Фарадея = 96493
n – число электронов
10.3
Ag+/Ag ; Zn2+/Zn
c| Ag+/Ag || Zn2+/Zn|c
ЭДС = Е0Ag+/Ag – Е0AgZn2+/Zn = 0,799 – (-0,763) = 1,562
Гальванические
элементы – устройства, применяемые для
непосредственного преобразования
энергии химической реакции в электрическую
энергию.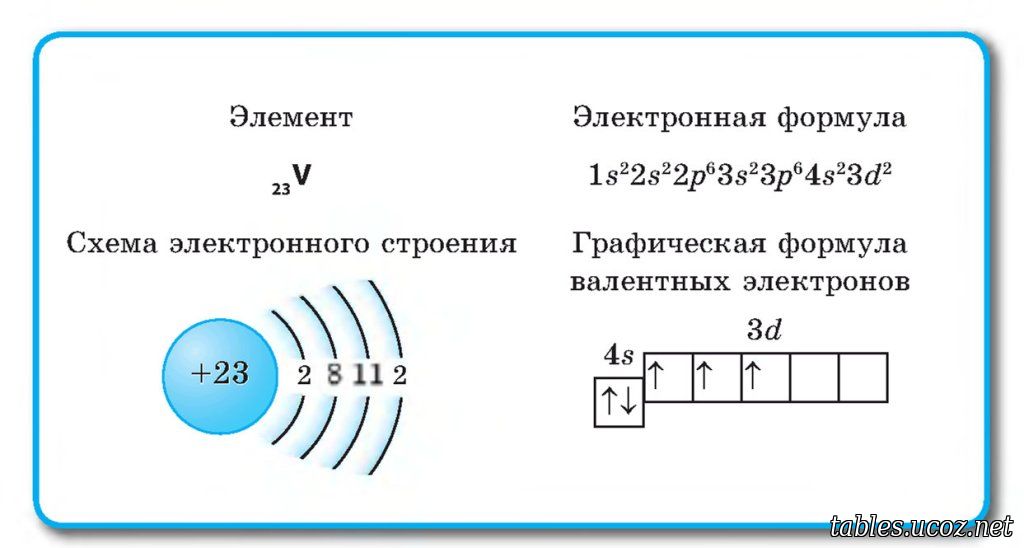 Действие гальванического
элемента основано на протекании в нём
окислительно – восстановительных
процессов. В простейшем случае
гальванический элемент состоит из двух
пластин или стержней (электродов),
изготовленных из различных металлов
(в данном случае Ag
и Zn)
и погружённых в раствор электролита.
Такая система позволяет пространственно
разделить окислительно – восстановительные
реакции: окисление происходит на одном
электроде, а восстановление на другом
(при этом электроны передаются от
окислителя к восстановителю по внешней
цепи).
Действие гальванического
элемента основано на протекании в нём
окислительно – восстановительных
процессов. В простейшем случае
гальванический элемент состоит из двух
пластин или стержней (электродов),
изготовленных из различных металлов
(в данном случае Ag
и Zn)
и погружённых в раствор электролита.
Такая система позволяет пространственно
разделить окислительно – восстановительные
реакции: окисление происходит на одном
электроде, а восстановление на другом
(при этом электроны передаются от
окислителя к восстановителю по внешней
цепи).
Эта гальваническая пара состоит из серебряной пластины, опущенной в раствор сульфата серебра (Ag2SO4) – серебряный электрод и сульфата цинка (ZnSO4) – цинковый электрод и. Растворы соприкасаются друг с другом, но для предупреждения смешивания разделены пористой перегородкой.
При замкнутой внешней цепи серебро окисляется и переходит в раствор Ag2SO4.
0
Ag – 1e → Ag+
Электрод на котором
происходит окисление называется анодом.
На цинковом катоде происходит восстановление ионов цинка и раствора ZnSO4 за счёт электронов, приходящих от серебряного электрода
0
Zn – 2e → Zn2+
Образующиеся атомы цинка выделяются в виде металла на цинковом электроде. Электрод на котором происходит восстановление называется катодом. При работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы в растворе происходит движение ионов.
Чем меньше алгебраическая величина электродного потенциала металла, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов.
E0Ag=+0,799 ; E0Zn=-0,763
Из этого следует, что Zn более сильный восстановитель, чем Ag.
10.4
Электрохимическая коррозия:
В
паре Ag/Sn
катодом будет серебро, а анодом олово,
так как потенциал серебра значительно
выше, чем у олова.
Анод:
0 2+
Sn – 2e → Sn 4 2
0 + –
O2 + 4e + 2H2O → 4OH– 2 1
0 0 + -2 +4 -2 +
2Sn + O2 + 2H2O → 2Sn(OH)2
Катод:0
Ag+ + 1e → Ag 2
0
2H+ +2e → H21
0 0
2Ag + 2H+ → 2Ag+ + H2
Eкор.= 1,23 – 0,059pH + ηO2/Ag– φ0Sn(OH)2 = 1,23 – 0,059∙7 + 0,97 + 0,900 = 2,687
При
электрохимической коррозии поток
электронов направлен от более активного
металла к менее активному и более
активный металл коррозирует. Металл с
более отрицательным потенциалом
разрушается – его ионы переходят в
раствор, а электроны переходят к менее
активному металлу, на котором происходит
восстановление водорода или восстановлённого
в воде кислорода. Электроны переходят
от олова к серебру. Будет происходить
разрушение олова, а на серебре, как на
менее активном металле выделятся
водород.
Металл с
более отрицательным потенциалом
разрушается – его ионы переходят в
раствор, а электроны переходят к менее
активному металлу, на котором происходит
восстановление водорода или восстановлённого
в воде кислорода. Электроны переходят
от олова к серебру. Будет происходить
разрушение олова, а на серебре, как на
менее активном металле выделятся
водород.
10.5 A-C ; K-C
AgF(р–в)= Ag+ + F– pH=7
K–0 А+0
2Ag+ + 2e → 2Ag 2F– – 2e → F2
восстановление окисление
ток 0 0
2AgF= 2Ag + F2
К– А+
AgF(р-р)
K– А+
Ag+ 0
2H2O ↔ 2H+ + 2OH– 2F– – 2e → F2
0
2H+ + 2e → 2H
0 0
2H → H2
2AgF + 2H2O = H2 + 2Ag(OH) + F2
K–А+
Фотография | Серебро, атомная структура
{{ Элемент.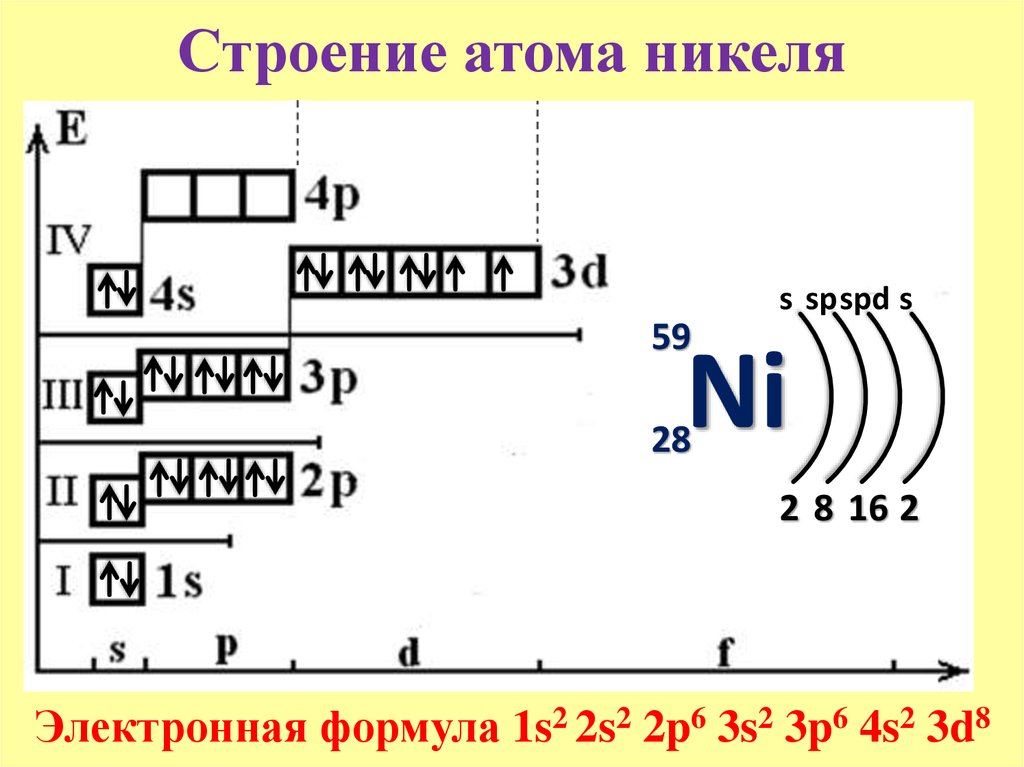 Сообщение об ошибке }} Этот предмет сейчас недоступен. Товар не найден.
Сообщение об ошибке }} Этот предмет сейчас недоступен. Товар не найден.ВЫБЕРИТЕ ВИДЕОЛИЦЕНЗИЮ
{{ item.PlusItemLicenseSmall }}
TIMESLICES
Создать квант времени
Просмотр временных интервалов (поставляется с 1-секундными дескрипторами)
Просмотр интервалов времени
БИРКИ
{{Ключевое слово}} {{Ключевое слово}}
ПОДЕЛИТЬСЯ ЭТОЙ СТРАНИЦЕЙ
Описание:
Описание:
Узнать больше
Кредит:
{{ item.ImgCredit }} Нет в наличии
Уникальный идентификатор:
{{ item.ItemID }}
Устаревший идентификатор:
{{ item.ItemDisplaySource }}
Тип:
{{item.MediaType}}
Лицензия:
{{item.LicenseModel}}
ЦЕНЫ РФ
{{item.aText[i]}}
{{ item.aPrice[i] }}
Скопировать URL
Скачать Комп
LabelPB.toLowerCase()” :alt=”‘Add to ‘ + site.LabelPB.toLowerCase()” aria-label=”‘Add to ‘ + site.LabelPB.toLowerCase()”/>
Добавить на доску
Удалить с доски
Добавить на доску
Заказать печать
Заказать печать
Скачать в высоком разрешении
Скачать в высоком разрешении
 com, и мы доставим его вам как можно скорее.
com, и мы доставим его вам как можно скорее.
Скачать в высоком разрешении
Скачать в высоком разрешении
Размер без сжатия:
ЛИЦЕНЗИЯ ТОВАР НЕ ДОСТУПЕННазначение: {{item.ImgPurpose}}
{{ item.PlusItemLicenseSmall }}
Запрос товара
ПРОСТАЯ ЦЕНА RM
ПРОСТАЯ ЦЕНА RM
ТОВАР НЕ ДОСТУПЕН Запрос элемента
Назначение: {{ item.ImgPurpose }}
{{Имя}}
{{ FormatCurrency(item. aStandardPricingPrice[i]) }}
aStandardPricingPrice[i]) }}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Заказать печать
Скачать в высоком разрешении
ТОВАР В КОРЗИНЕ
{{ item. PlusItemLicenseSmall + ‘ – $’ + item.PlusCodeAmount }} {{ item.PlusItemLicenseSmall }}
PlusItemLicenseSmall + ‘ – $’ + item.PlusCodeAmount }} {{ item.PlusItemLicenseSmall }}
Скопировать URL
Скачать Комп
Добавить на доску
Удалить с доски
Добавить на доску
Добавить в корзину
Скачать в высоком разрешении
Скачать в высоком разрешении
Это видео в высоком разрешении невозможно для мгновенной загрузки, так как размер файла превышает 2 ГБ. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Это видео в высоком разрешении сейчас недоступно. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его вам как можно скорее.
ТОВАР В КОРЗИНЕ
{{ item.PlusItemLicenseSmall + ‘ – $’ + item.PlusCodeAmount }}
Перейти к оформлению заказаРазмер без сжатия:
ТОВАР НЕ ДОСТУПЕН
Запрос товараНазначение: {{item.ImgPurpose}}
Узнать больше
Узнать больше
Скопировать URL
Скачать Комп
Скачать Комп
Добавить на доску
toLowerCase()” :alt=”‘Remove from ‘ + site.LabelPB.toLowerCase()” aria-label=”‘Remove from ‘ + site.LabelPB.toLowerCase()”/>
Удалить с доски
Добавить на доску
Добавить в корзину
Заказать печать
Скачать в высоком разрешении
ТОВАР НЕ ДОСТУПЕН Запрос товара
Назначение: {{item.ImgPurpose}}
Скопировать URL
Скачать Комп
Добавить на доску
LabelPB.toLowerCase()”/>
Удалить с доски
Добавить на доску
Скачать в высоком разрешении
Скачать в высоком разрешении
Это видео в высоком разрешении невозможно для мгновенной загрузки, так как размер файла превышает 2 ГБ. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его как можно скорее.
Это видео в высоком разрешении сейчас недоступно. Пожалуйста, свяжитесь с нами по адресу [email protected], и мы доставим его вам, как только возможный.
Время начала:
{{ SecondsToTime(StartTime) }} Установить
Время окончания:
{{ SecondsToTime(EndTime) }} Установить
Продолжительность: {{ Продолжительность}}
Текущий: {{ Текущий }}
Продолжительность: {{DurationTime}}
Текущее: {{ ТекущееВремя}}
{{ SecondsToTime(Value. StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
StartTime) }} to {{ SecondsToTime(Value.EndTime) }}
Посмотреть
Удалить
Для этого элемента не заданы временные интервалы, поэтому по умолчанию это весь клип.
{{ SecondsToTime(0) }} до {{ SecondsToTime(videocontrols.Duration) }}
Общее время: {{ Math.round(TotalTime * 100) / 100 }}
Цена/сек: {{ FormatCurrency(item.PricePerSec) }}
Цена: {{ ItemPrice }}
{{ сайт.LabelPB }}
{{ сайт.LabelCT }}
{{ сайт.LabelPB }}
{{ сайт.LabelCT }}
{{ Lightbox.Name }} ({{ Lightbox.NumPix }})
Вид Управлять Новый
{{ site.LabelCT }}: {{ user.nCartItems }} {{ user.nCartItems == 1 ? “предмет” : “элемент” }}
{{ XXText }}
{{ XXSText }}
{{ XSText }}
{{ SMText }}
{{ MDText }}
{{ LGText }}
XLText 90 002} {{ LGText }} 90 002} { {{ XXLText }}{{ HDText }}
{{ QHDText }}
{{ K4Text }}
{{ K8Text }}
Мы используем файлы cookie, чтобы улучшить ваш опыт на нашем веб-сайте.
Прочтите нашу политику в отношении файлов cookie, чтобы узнать больше.
Мы используем файлы cookie, чтобы улучшить ваш опыт на нашем веб-сайте. Прочтите нашу политику в отношении файлов cookie, чтобы узнать больше.
Закрыть файлы cookie EULA
Серебряная модель Бора – Как нарисовать диаграмму Бора для серебра (Ag)?
Главная > Химия > Серебро Модель Бора
Модель Бора Серебра (Ag) имеет ядро, содержащее 61 нейтрон и 47 протонов. Это ядро окружено пятью электронными оболочками, а именно K-оболочкой, L-оболочкой, M-оболочкой, N-оболочкой и O-оболочкой. Оболочка 1 st имеет 2 электрона, оболочка 2 nd имеет 8 электронов, оболочка 3 9Оболочка 0382 rd имеет 18 электронов, оболочка 4 th также содержит 18 электронов, а оболочка 5 th имеет только 1 электрон.
| Name | Silver Bohr Model |
| Number of neutrons | 61 |
| Number of protons | 47 |
| Количество электронов | 47 |
| Total electron shells | 5 |
| Electron in the First shell(K) | 2 |
| Electrons in the Second shell(L ) | 8 |
| Electrons in the Third shell(M) | 18 |
| Electrons in the Fourth shell(N) | 18 |
| Electrons in the Fifth shell(O) | 1 |
| Total valence electrons in Silver | 1 |
Модель Бора описывает визуальное представление электронов, вращающихся вокруг малого ядра. В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. Эти оболочки содержат определенное количество электронов, электронная оболочка, ближайшая к ядру, имеет меньшую энергию, а электронная оболочка, наиболее удаленная от ядра, имеет большую энергию.
В нем использовались разные электронные оболочки, такие как K, L, M, N… и так далее. Эти оболочки содержат определенное количество электронов, электронная оболочка, ближайшая к ядру, имеет меньшую энергию, а электронная оболочка, наиболее удаленная от ядра, имеет большую энергию.
Диаграмма Бора очень интересна и ее легко нарисовать. Здесь мы нарисуем боровскую модель атома серебра, выполнив несколько простых шагов.
Этапы построения модели атома серебра Бора1. Найдите количество протонов, электронов и нейтронов в серебре
Протоны — это положительно заряженные частицы, а нейтроны — незаряженные частицы, обе составляющие ядра атома. Электроны — это отрицательно заряженные частицы, вращающиеся вокруг ядра атома 9.0003
Чтобы узнать количество протонов, содержащихся в атоме, просто посмотрите на его атомный номер.
Если атомный номер атома равен 45, то протон также будет равен 45, если атомный номер равен 46, то протон также будет равен 46.
в нем также 47.
Теперь, чтобы определить количество нейтронов в атоме, используйте эту формулу.
⇒ Количество нейтронов в атоме 9.0377 = Атомная масса атома (округленная до ближайшего целого числа) – Количество протонов в атоме
Например, атом имеет 33,988 атомную массу и 16 протонов.
Затем, чтобы найти число нейтронов, округлите атомную массу почти до целого числа, таким образом, атомная масса 33,988 округлите до 34.
= (34 – 16 протонов) = 18 количество нейтронов в атоме
Теперь , чтобы получить количество нейтронов в атоме серебра , посмотрите на его атомную массу, которая равна 107,8682, округлив до ближайшего целого числа, это 108. Количество протонов, присутствующих в серебре, равно 47,9.0003
∴ Отсюда число нейтронов в атоме Серебра = (108 – 47) = 61.
Следует отметить, что «Число электронов в нейтральном атоме равно числу протонов».

Поскольку атом серебра (Ag) нейтрален, количество электронов, присутствующих в нем, будет равно количеству его протонов, то есть 47, как мы обсуждали ранее.
⇒ Количество электронов в атоме серебра = 47
⇒ Количество протонов в атоме серебра = 47,
⇒ Количество нейтронов в атоме Серебра = 61
Читаем подробнее – Как найти количество протонов, электронов, нейтронов?
2. Нарисуйте ядро атома
Ядро представляет собой плотную и маленькую область, содержащую количество протонов и нейтронов атома.
На этом шаге мы должны нарисовать маленький кружок, состоящий из числа протонов и числа нейтронов атома серебра.
3. Нарисуйте первую электронную оболочку
«Электронную оболочку можно представить как орбиту, по которой следуют электроны вокруг ядра атома».
Первую электронную оболочку также называют К-оболочкой, это ближайшая к ядру атома оболочка, которая может содержать максимум два электрона.
Как мы определили, атом серебра имеет в общей сложности 47 электронов. Итак, нам нужно поместить 2 электрона из 47, имеющихся в первой оболочке, рядом друг с другом, как показано ниже.
Теперь, когда мы успешно нарисовали первую оболочку атома серебра, которая может содержать 2 электрона, мы знаем, что мы использовали 2 электрона из 47 доступных в первой оболочке.
∴ (47-2) = 45 электронов.
Это показывает, что у нас осталось 45 электронов, которые нам нужно разместить в последующих оболочках атома серебра.
4. Нарисуйте вторую электронную оболочку
Вторая оболочка, также называемая L-оболочкой, может содержать максимум 8 электронов. Эта оболочка рисуется после первой электронной оболочки.
Во второй электронной оболочке электроны добавляются по одному, начиная с верхнего положения и затем двигаясь по часовой стрелке.
Во второй оболочке электроны добавляются по одному по часовой стрелке в положении часов – 12 часов, 3 часа, 6 часов, 9 часов.
После того, как вы разместите электроны по одному на каждой из четырех сторон (сверху – справа – снизу – слева), начните спаривать или удваивать их.
Поскольку у нас есть 45 оставшихся электронов атома серебра, из которых вторая оболочка может удерживать максимум 8 валентных электронов.
Таким образом, мы размещаем следующие 8 электронов атома Серебра на второй оболочке. Начните с верхнего положения и размещайте электроны по одному, двигаясь по часовой стрелке (сверху-справа-снизу-слева), и, наконец, соедините их в пары.
На этом этапе из 47 электронов атома серебра мы поместили 2 электрона на первую оболочку и 8 электронов на вторую оболочку.
∴ [47 – (2+8)] = 37 электронов.
Это означает, что теперь у нас осталось 37 электронов. Итак, давайте посмотрим, как мы можем назначить им соответствующие позиции в следующих оболочках атома Серебра.
5. Нарисуйте третью электронную оболочку
Третья электронная оболочка, также называемая М-оболочкой, может содержать до 18 электронов.
Для элементов первых нескольких периодов Периодической таблицы третья оболочка содержит только до 8 электронов. Но на самом деле в сумме он способен удерживать 18 электронов.
⇒ Третья подоболочка демонстрирует эту способность удерживать «до 18» электронов для атомных номеров больше 20, таких как 21, 22, 23, 24, 25, 26 и так далее.
⇒ Атомный номер серебра (Ag) равен 47. Поскольку 47 явно больше 20, это означает, что М-оболочка в модели Серебряного Бора будет заполнена до максимальной емкости, вмещая в общей сложности 18 электронов, как показано на рисунке. ниже.
Электроны размещаются по часовой стрелке, как мы обсуждали в шаге 4. Начиная с верхнего положения, размещайте электроны по одному, двигаясь по часовой стрелке (вверху справа — внизу слева), прежде чем спаривание электронов.
К тому времени, когда мы достигли этого шага, из 47 электронов атома серебра мы поместили 2 электрона на первую оболочку, 8 электронов на вторую оболочку и 18 электронов на третью электронную оболочку, что означает всего пока используется 2+8+18 = 28 электронов.
∴ 47 – [ 2+ 8+ 18] = 47 – 28 = 19 электронов.
Теперь давайте посмотрим, как эти оставшиеся 19 электронов размещаются в последующих оболочках модели Сильвера Бора.
6. Нарисуйте четвертую электронную оболочку
Четвертая электронная оболочка, т.е. N-оболочка, имеет максимальную емкость, вмещающую всего 32 электрона. Он состоит из подоболочек s, p, d и f.
Подоболочка s может содержать 2 электрона, 6 электронов могут быть размещены в p-подоболочке, 10 электронов могут быть размещены в d-подоболочке, а всего 14 электронов могут быть размещены в f-подоболочке оболочки номер 4. 2+6+10+14 дает в общей сложности 32 электрона.
⇒ Но электроны размещены в этих подоболочках в соответствии с принципом Ауфбау. Принцип Ауфбау гласит, что электроны заполняются по диагонали, как показано ниже. Следовательно, электроны заполняются в s-подоболочке оболочки номер 5 до заполнения электронами d-подоболочки оболочки номер 4.
⇒ Поскольку есть только 19 электронов, доступных для размещения в электронных оболочках 4 th и 5 th Серебряной (Ag) модели Бора. Таким образом, после помещения 8 электронов в Четвертую оболочку (2 электрона в 4s и 6 электронов в 4p), 2 электрона могут разместиться в 5s, а оставшиеся 9 электронов, следовательно, перейдут в 4d.
⇒ Но следует помнить, что частично заполненная подоболочка 4d с девятью электронами менее стабильна, чем полностью заполненная подоболочка 4d с десятью электронами. Таким образом, вместо распределения двух электронов в 5s и девяти электронов в 4d имеется десять электронов в 4d и только 1 электрон в подоболочке 5s атома серебра (Ag).
⇒ Короче говоря, четвертая электронная оболочка модели Серебряного Бора содержит в общей сложности 18 электронов, а пятая электронная оболочка содержит только один электрон.
Итак, на этом этапе рисования модели Сильвера Бора мы поместим в общей сложности 18 электронов на Четвертую электронную оболочку, как показано ниже.
На этом этапе также строго соблюдается схема заполнения, а затем спаривания электронов по часовой стрелке.
7. Нарисуйте пятую электронную оболочку
На последнем этапе оставшийся 1 электрон помещается на вершину пятой электронной оболочки, как показано ниже.
Теперь на 5-й оболочке всего 1 электрон.
Таким образом, мы имеем окончательное представление боровской модели атома серебра (Ag), который содержит 47 протонов и 61 нейтрон в области ядра, в то время как в общей сложности 47 электронов обращаются вокруг ядра по определенным орбитам, называемым снаряды.
Первая электронная оболочка серебра имеет два электрона, восемь электронов на второй оболочке, восемнадцать электронов на третьей и четвертой электронных оболочках и один электрон на пятой оболочке серебра (Ag).
Also Read:-
- Scandium Bohr model
- Titanium Bohr model
- Vanadium Bohr model
- Oxygen Bohr model
- Boron Bohr model
- Beryllium Bohr model
- Lithium Bohr model
- Helium Bohr model
- Азот Бор модель
- Фтор Бор модель
- Неон Бор модель
- Углерод Бор модель
- Натрий Бор модель
- Кремний Бор модель
- Magnesium Bohr model
- Sulfur Bohr model
- Chlorine Bohr model
- Phosphorus Bohr model
- Aluminum Bohr model
- Argon Bohr model
- Potassium Bohr model
- Bromine Bohr model
- Calcium Bohr model
- Arsenic Bohr model
- Золото Бор модель
- Криптон Бор модель
- Йод Бор модель
- Медь Бор модель
- Железо Бор модель
- Уран Бор модель
- Nickel Bohr model
FAQAlso check :- Bohr model for all elements of Periodic table
What is the Bohr diagram? Диаграмма Бора, формально называемая моделью Бора-Резерфорда, представляет собой визуальное представление вращения электронов вокруг маленького ядра атома. Например, диаграмма Бора серебра (Ag) представляет присутствующие в нем 47 электронов, вращающихся вокруг маленького ядра на определенных энергетических уровнях, называемых оболочками K, L, M, N и O.
Сколько электронных оболочек содержит модель Сильвера Бора? Электронные оболочки также называют энергетическими уровнями. Вы можете найти количество электронных оболочек для элемента, зная его номер периода в периодической таблице.
Элементы или атомы первого периода Периодической таблицы имеют один энергетический уровень или одну электронную оболочку, аналогично элементы второго периода имеют два энергетических уровня или две электронные оболочки и так далее.
Поскольку атом серебра (Ag) принадлежит к 5-му -му -му периоду в периодической таблице, следовательно, число электронных оболочек для модели Бора для серебра также равно 5. В модели Серебра Бора имеется 5 электронных оболочек, а именно K -оболочка, L-оболочка, М-оболочка, N-оболочка и О-оболочка.
Какова внешняя оболочка диаграммы Бора атома серебра? Самая внешняя оболочка, также называемая валентной оболочкой, представляет собой оболочку, содержащую валентные электроны атома.
Согласно диаграмме Бора серебра, его внешней оболочкой является оболочка номер 5, т. е. О-оболочка, содержащая только 1 валентный электрон.
Резюме
Сколько всего валентных электронов содержится в атоме серебра? Согласно диаграмме Бора атом серебра содержит только один валентный электрон. Однако следует помнить, что серебро (Ag) является элементом переходного металла, а элементы переходного металла обладают переменной валентностью.
Это означает, что в дополнение к электрону внешней оболочки атом Ag может также вовлекать в химическую связь электроны внутренней d-оболочки.
Следовательно, атом Ag также иногда образует ионы Ag 2+ и Ag 3+ , теряя 2 и 3 электрона, в дополнение к образованию своего наиболее распространенного иона Ag +1 , теряя свой наиболее жизнеспособный валентный электрон внешней оболочки. .
- Боровская модель серебра (Ag) нарисован с пятью электронными оболочками, первая оболочка содержит 2 электрона, вторая оболочка содержит 8 электронов, третья и четвертая электронные оболочки содержат по 18 электронов каждая, а пятая электронная оболочка имеет только 1 электрон.
- Атомный номер серебра равен 47. Поскольку серебро (Ag) является нейтральным атомом, следовательно, количество протонов и электронов, доступных для его диаграммы Бора, равно 47.
- Число нейтронов для диаграммы Бора серебра может можно найти, вычитая количество протонов из атомной массы (округляя до ближайшего целого числа).


 Никель
Никель Самарий
Самарий Америций
Америций ru/Database/properties.php?dbid=1&id=257
ru/Database/properties.php?dbid=1&id=257 в нем также 47.
в нем также 47. 

 Для элементов первых нескольких периодов Периодической таблицы третья оболочка содержит только до 8 электронов. Но на самом деле в сумме он способен удерживать 18 электронов.
Для элементов первых нескольких периодов Периодической таблицы третья оболочка содержит только до 8 электронов. Но на самом деле в сумме он способен удерживать 18 электронов.