Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
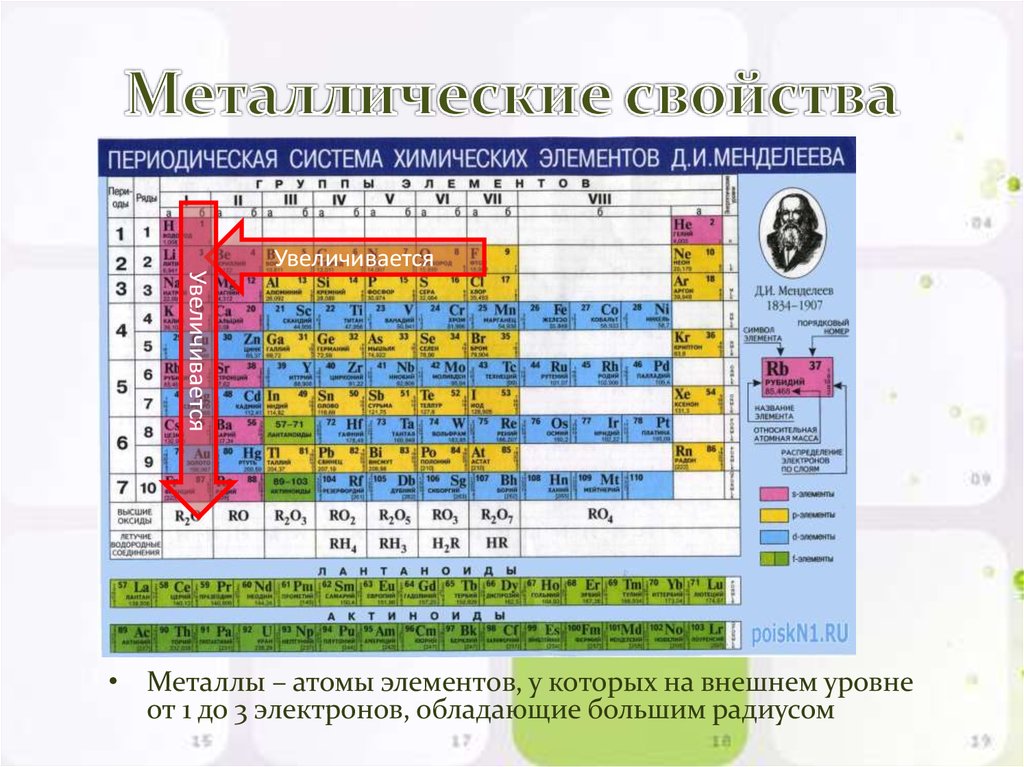
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
118 элементов. Глава 14: от компьютера до порно
Элемент: кремний (Aluminium, Aluminum)
Химический символ: Si
Порядковый номер: 14
Год открытия: 1824 (предсказан в 1782 А.Лавуазье)
Стандартная атомная масса: 28.084
Температура плавления: 1687 К
Температура кипения: 3265 К
Плотность при стандартных условиях: 2.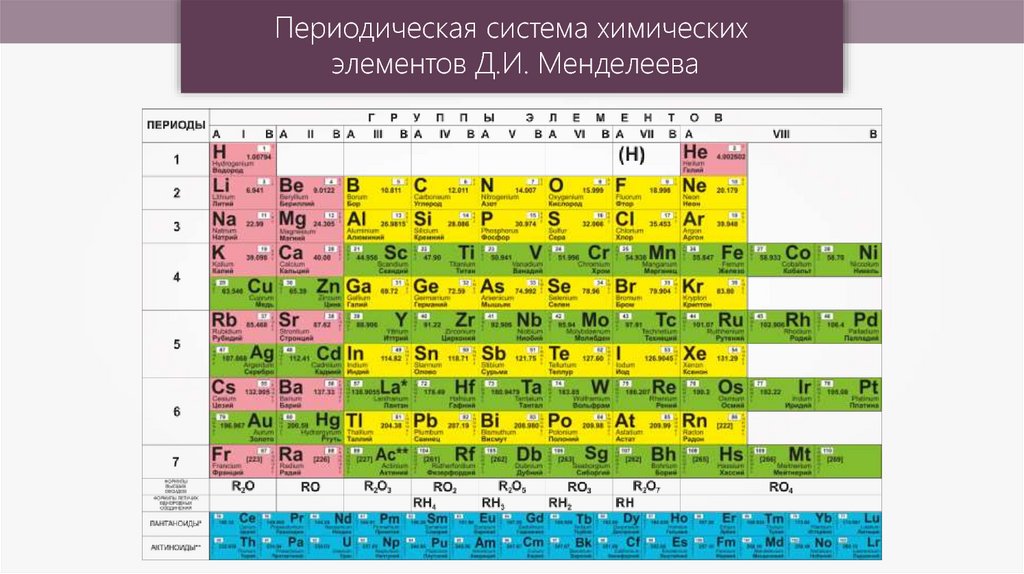 32г/cм3
32г/cм3
Скорость звука в кремнии: 8433 м/с
Число стабильных изотопов: 3
Кристаллическая решётка: кубическая, подобно алмазу
Кремний под ногами – и глубже
Как и о его «соседе сверху», углероде, о кремнии можно говорить и писать бесконечно. Достаточно того, что этот элемент – второй по распространенности в земной коре после кислорода, и первый – твердый в элементарном состоянии. 27,2% массы земной коры приходится на кремний. Впрочем, тут же нужно сказать, что очень часто приходится встречать утверждение, что земная кора состоит на 27,2% по массе из кремния. Но это совсем не так: ведь кора составляет всего… 0,4%от массы планеты – можно бы вообще не учитывать. Примерно треть массы занимает ядро, в котором кремния почти нет (его элементный состав – Fe25Ni2Co0.1S3), а две трети – мантия. И вот тут кремния тоже хватает: например, в самом типичном оливине ((Mg2+, Fe2+)2SiO4)…
Оливин
Но вернемся из мантии на поверхность. Соединения кремния нас окружали всегда, ну а сейчас он вообще стал символом технического прогресса. Песок – оксид кремния, стекло – то же самое, кварц – он же. Силикаты, алюмосиликаты – глина опять же (помним, что Al2Si2O5(OH)4)… Не забудем и то, что сам технический прогресс – всякие наконечники стрел и копий тоже делались из кремня, в котором кремнИя было предостаточно.
Соединения кремния нас окружали всегда, ну а сейчас он вообще стал символом технического прогресса. Песок – оксид кремния, стекло – то же самое, кварц – он же. Силикаты, алюмосиликаты – глина опять же (помним, что Al2Si2O5(OH)4)… Не забудем и то, что сам технический прогресс – всякие наконечники стрел и копий тоже делались из кремня, в котором кремнИя было предостаточно.
Дымчатый кварц
Нельзя не привести, вслед за сборником «Популярная библиотека химических элементов», на который мы равняемся (искусствоведы бы вычурно сказали «совершаем оммаж»), цитату из великого минералога Александра Ферсмана. «Показывают мне, – писал в одной из своих популярных книг академик А.Е. Ферсман, – самые разнообразные предметы: прозрачный шар, сверкающий на солнце чистотой холодной ключевой воды, красивый, пестрого рисунка агат, яркой игры многоцветный опал, чистый песок на берегу моря, тонкую, как шелковинка, нитку из плавленого кварца или жароупорную посуду из него, красиво ограненные груды горного хрусталя, таинственный рисунок фантастической яшмы, окаменелое дерево, превращенное в камень, грубо обработанный наконечник стрелы древнего человека… все это одно и то же химическое соединение элементов кремния и кислорода».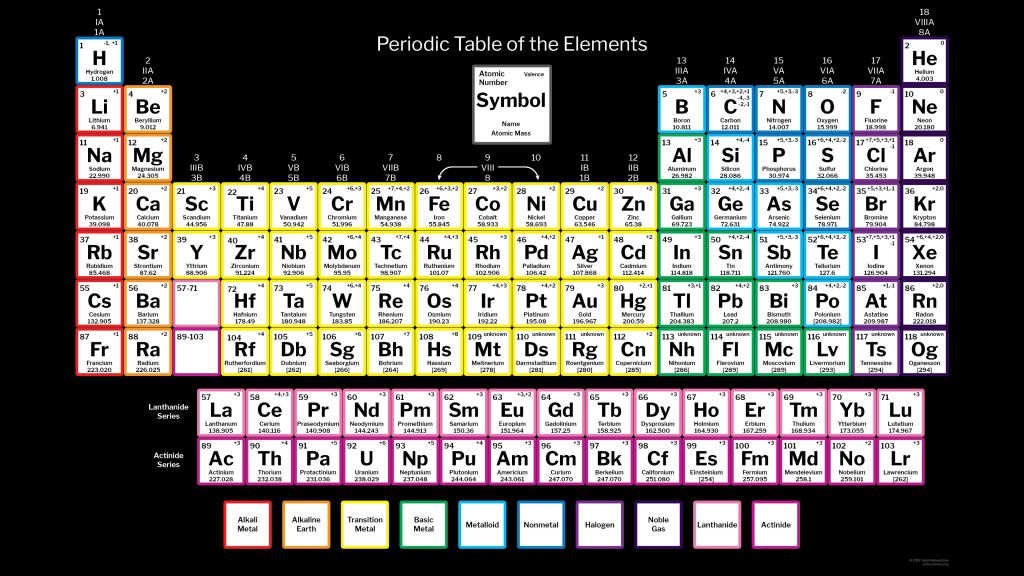
Еще один хорошо известный с древности минерал кремния, полезный и вредный одновременно – это горный лён. Он же асбест. Точнее, это, конечно, не минерал, а две группы минералов – хризотил-асбест (он же белый асбест, 3MgO•2SiO2•2H2O) и сложный гидросиликат амфиболовый асбест. Эта группа минералов образует прямые иглообразные волокна, которые крошатся и вдыхание которых может привести к онкологическим заболеваниям. Эти огнеупорные материалы удивительны, поскольку за счет полимерности оксида кремния образуют длинные и гибкие волокна (длина волокон в асбесте Ричмонда – до метра, в алтайских асбестах – до 20 сантиметров!). Представьте себе, каменные волокна – удивление, да и только!
Кристаллы амфиболового асбеста
Хризотил-асбест
Удивительно при всем при этом, что сам кремний человечество открыло сравнительно недавно. Впрочем, с другой стороны, в чистом виде-то он почти не встречается – разве что при отборе проб газов вулкана Кудрявый на острове Итуруп Курильской гряды удалось обнаружить кристаллики чистого кремния 0,3 миллиметра в поперечнике – но где Кудрявый и где европейские химики XVIII века…
Немного истории
Только в 1787 году все тот же Антуан Лоран де Лавуазье предположил, что кварц представляет собой оксид («землю») некоего химического элемента. Попытки выделить сам элемент долго не приводили к успеху. Так в 1808 году отступил великий Хэмфри Дэви, однако предложил новое имя для элемента: «силициум» – от латинского silex – кремень. В 1811 году французы Жозеф Гей-Люссак и Луи Жак Тенар вроде как выделили аморфный кремний реакцией недавно открытого калия и тетрафторида кремния (его получил еще в 1771 году Карл Вильгельм Шееле, растворив кварц в плавиковой кислоте), но… Во-первых, он был далеко не чистым, а во-вторых, химики не поняли, что сделали и не идентифицировали новый элемент.
Попытки выделить сам элемент долго не приводили к успеху. Так в 1808 году отступил великий Хэмфри Дэви, однако предложил новое имя для элемента: «силициум» – от латинского silex – кремень. В 1811 году французы Жозеф Гей-Люссак и Луи Жак Тенар вроде как выделили аморфный кремний реакцией недавно открытого калия и тетрафторида кремния (его получил еще в 1771 году Карл Вильгельм Шееле, растворив кварц в плавиковой кислоте), но… Во-первых, он был далеко не чистым, а во-вторых, химики не поняли, что сделали и не идентифицировали новый элемент.
Луи Жак Тенар
Так что пришлось ждать 1823 года и шведа Йенса Якоба Берцелиуса, который смог взаимодействием фторосиликата калия и металлического калия таки выделить кремний – он сделал еще один шаг за Тенаром и Гей-Люссаком и очистил продукты реакции до аморфного коричневого порошка.
Йенс Якоб Берцелиус
Кристаллического же кремния человечеству пришлось ждать еще 31 год: в 1854 году его смог получить француз Анри Этьен Сент-Клер Девиль, один из отцов физической химии, автор теории диссоциации – обратимого разложения веществ при нагреве, подтвердивший ее на практике, разложив воду на водород и кислород.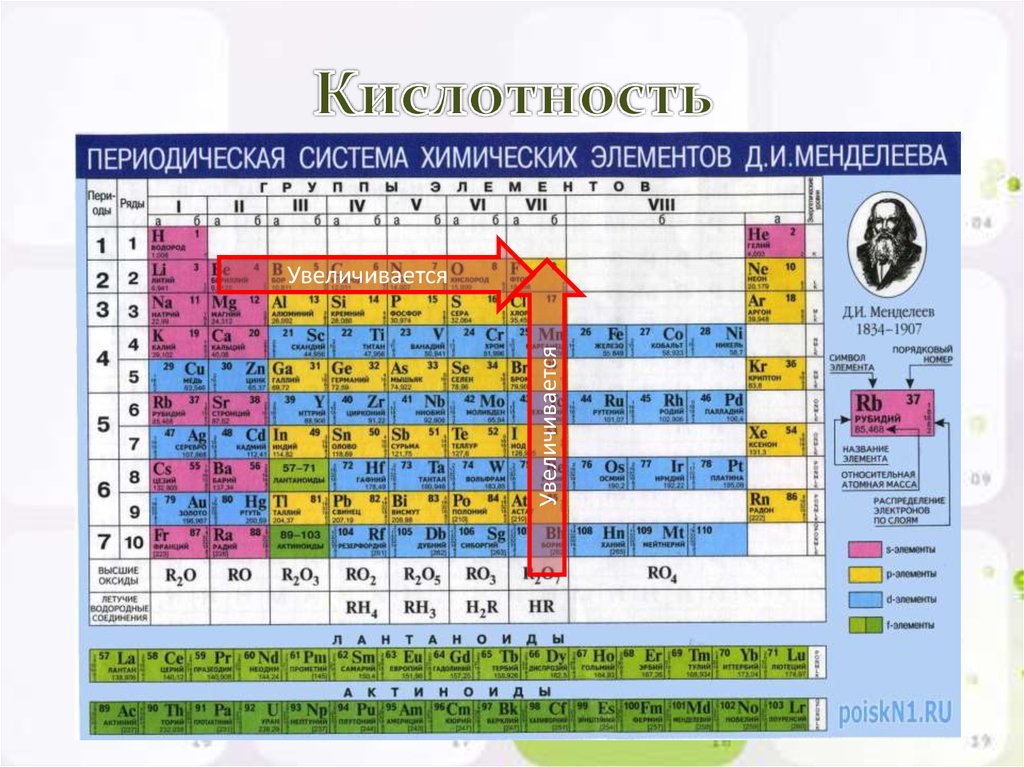
Анри Этьен Сент-Клер Девиль
А вот приоритет получения кремния в промышленных масштабах – российский. Замечательный химик Николай Николаевич Бекетов разработал способ получения кремния высокой чистоты реакцией четыреххлористого кремния и паров цинка (в скобках отметим, что технический кремний сейчас получают проще: восстановлением кремнезема в электрической дуге).
Николай Николаевич Бекетов
Удивительно, но еще тогда, в 1850-х годах, началась и химия кремнийорганики (надеюсь, читателям этого портала не нужно рассказывать о том, что кремний – это ближайший аналог углерода в таблице Менделеева, и точно так же образует четыре sp3-гибридизованные связи, да и кристаллическая решетка кремния повторяет кристаллическую решетку алмаза). В 1857 году был получен трихлорсилан SiHCl3, который, впрочем, нельзя еще считать кремнийорганическим соединением, однако шестью годами позже люди с милыми слуху любого органика фамилиями, Шарль Фридель и Джеймс Крафтс, еще не открывшие свою знаменитую реакцию, получили тетраэтилсилан, Si(C2H5)4.
Конечно же, революция в жизни кремния случилась, когда сначала люди открыли его полупроводниковые свойства, а затем, в 1947 году, Джон Бардин, Уолтер Браттейн и Уильям Шокли создали полупроводниковый транзистор. Что привело их к Нобелевской премии по физике (потом Бардин получит вторую). А нас в итоге – к Кремниевой долине, которую у нас сейчас часто по глупости называют Силиконовой, хотя это, кхм… две совсем разные долины.
Рождением термина «Кремниевая долина» мы обязаны технологическому журналисту Дону Хофлеру, который с 11 января 1971 года начал публиковать в еженедельнике Electronic News серию статей «Silicon Valley, USA». И тут, как это часть бывает, вмешался язык. Дело в том, что в английском языке есть слово silicon – «кремний»: поскольку в Долине находились производства микропроцессоров, которые делаются на кремниевой основе. А есть слово silicone– силикон, он же полиорганосилоксан, он же – материал для имплантов для увеличения груди. Еще до распространенности этого термина в России, в самих США часто путали эти термины, ну а уж в русском языке сам Бог велел «купиться» на эти ложные друзья переводчика.
Еще до распространенности этого термина в России, в самих США часто путали эти термины, ну а уж в русском языке сам Бог велел «купиться» на эти ложные друзья переводчика.
Уже в 1984 году Стив Гибсон, глава компании Gibson Laboratories, в сердцах возмущался: «…интегральные схемы создаются из тонких, круглых, плоских пластин сверхчистого кремния. Это отнюдь не то же самое, что силикон. Силиконовая долина — это то, что видят некоторые голливудские актрисы, когда смотрят себе под ноги. Кремниевая долина — это место в Северной Калифорнии, где делают микросхемы». И его легко понять – ведь Силиконовая долина тоже к тому времени уже существовала, не как выпуклости в вырезе голливудских актрис, а как Долина Сан-Фернандо, первое место в мире, где начали активно снимать порнофильмы.
Первые силиконовые импланты в клинической практике (1963)
Но кто сказал, что силиконовая грудь менее важна, чем компьютер? Тем более, что первые силиконовые импланты для груди были созданы Томасом Крониным и Фрэнком Джероу в 1961 году, как раз когда начался бурный рост всей электроники. Но вообще, полиорганосилоксанов очень много – и используются они далеко не только для улучшения внешнего вида прекрасных дам. Герметики, смазки, силиконовые перчатки, пеногасители, оттискные массы, амортизационные жидкости… Сотни, тысячи наименований окружающих нас предметов и субстанций сделаны из силиконов.
Но вообще, полиорганосилоксанов очень много – и используются они далеко не только для улучшения внешнего вида прекрасных дам. Герметики, смазки, силиконовые перчатки, пеногасители, оттискные массы, амортизационные жидкости… Сотни, тысячи наименований окружающих нас предметов и субстанций сделаны из силиконов.
Кстати, раз уж мы заговорили о кремнийорганике. Одной из самых обсуждаемых тем, связанных с кремнием стала, конечно же, «кремниевая жизнь». Когда исследователи начали обсуждать, какой могла бы быть альтернативная жизнь на других планетах, то самым очевидным решением было заменить углерод его старшим аналогом. Тем более, что кремний тоже достаточно распространен во Вселенной. Однако атом кремния более тяжелый и имеет больший диаметр по сравнению с атомом углерода. Поэтому «обычные» аналоги органики из кремния менее устойчивы, кроме того, у кремния есть некоторые проблемы с образованием двойной и тройной связей.
Тем не менее, кремниевая жизнь, вероятно, возможно – но на совсем других планетах. Ученые считают возможной существование кремниевой жизни в расплаве из оксида кремния.
Ученые считают возможной существование кремниевой жизни в расплаве из оксида кремния.
Сфера из кремния-28, эталон моля. В ней отражается эталон килограмма
Еще одно – неожиданное – применение кремния нашлось совсем недавно. Еще некоторое время назад единица количества вещества определялась как количество атомов, которое содержалась ровно в 12 граммах углерода-12. Однако потом решили переопределить моль напрямую через число Авогадро, а для иллюстрации сделать идеальный шар из кремния-28. В качестве эталона.
Текст: Алексей Паевский
Кремний | Элемент, атом, свойства, использование и факты
кремний
Посмотреть все носители
- Ключевые люди:
- Йонс Якоб Берцелиус Фредерик Марк Бекет
- Похожие темы:
- аморфный кремний кремниевый детектор кремний-28 кремний-29 реконструкция поверхности
Просмотреть весь связанный контент →
Сводка
Прочтите краткий обзор этой темы
кремний (Si) , неметаллический химический элемент из семейства углерода (группа 14 [IVa] периодической таблицы).
Название кремний происходит от латинского silex или silicis , что означает «кремень» или «твердый камень». Аморфный элементный кремний был впервые выделен и описан как элемент в 1824 году шведским химиком Йонсом Якобом Берцелиусом. Нечистый кремний был получен уже в 1811 г. Кристаллический элементарный кремний не был получен до 1854 г., когда он был получен в виде продукта электролиза. Однако в форме горного хрусталя кремний был знаком додинастическим египтянам, которые использовали его для изготовления бус и маленьких ваз; к ранним китайцам; и, вероятно, многим другим древним. Изготовлением стекла, содержащего кварц, занимались как египтяне — по крайней мере, уже в 1500 г. до н. э., так и финикийцы. Конечно, многие из встречающихся в природе соединений, называемых силикатами, использовались в различных видах строительных растворов для строительства жилищ самыми ранними людьми.
| atomic number | 14 |
|---|---|
| atomic weight | 28.086 |
| melting point | 1,410 °C (2,570 °F) |
| boiling point | 3,265 ° C (5909 °F) |
| плотность | 2,33 г/см 3 |
| степень окисления | −4, (+2), +4 | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 2 |
Occurrence and distribution
On a по массе содержание кремния в земной коре уступает только кислороду. Оценки космического содержания других элементов часто приводятся по числу их атомов, приходящихся на 10 6 атомов кремния. Только водород, гелий, кислород, неон, азот и углерод превосходят кремний по космическому изобилию. Кремний считается космическим продуктом поглощения альфа-частиц при температуре около 10 9 К, по ядрам углерода-12, кислорода-16 и неона-20. Энергия, связывающая частицы, образующие ядро кремния, составляет около 8,4 миллиона электрон-вольт (МэВ) на нуклон (протон или нейтрон). По сравнению с максимумом около 8,7 млн электрон-вольт для ядра железа, почти в два раза более массивного, чем у кремния, эта цифра указывает на относительную стабильность ядра кремния.
Только водород, гелий, кислород, неон, азот и углерод превосходят кремний по космическому изобилию. Кремний считается космическим продуктом поглощения альфа-частиц при температуре около 10 9 К, по ядрам углерода-12, кислорода-16 и неона-20. Энергия, связывающая частицы, образующие ядро кремния, составляет около 8,4 миллиона электрон-вольт (МэВ) на нуклон (протон или нейтрон). По сравнению с максимумом около 8,7 млн электрон-вольт для ядра железа, почти в два раза более массивного, чем у кремния, эта цифра указывает на относительную стабильность ядра кремния.
Чистый кремний слишком реакционноспособен, чтобы его можно было найти в природе, но он встречается практически во всех горных породах, а также в песке, глинах и почвах в сочетании с кислородом в виде кремнезема (SiO 2 , диоксид кремния) или с кислородом и другими элементами (например, алюминием, магнием, кальцием, натрием, калием или железом) в виде силикатов. Окисленная форма, такая как двуокись кремния и особенно силикаты, также распространена в земной коре и является важным компонентом мантии Земли. Его соединения встречаются также во всех природных водах, в атмосфере (в виде кремнеземистой пыли), во многих растениях, в скелетах, тканях и биологических жидкостях некоторых животных.
Его соединения встречаются также во всех природных водах, в атмосфере (в виде кремнеземистой пыли), во многих растениях, в скелетах, тканях и биологических жидкостях некоторых животных.
В соединениях диоксид кремния встречается как в кристаллических минералах (например, кварц, кристобалит, тридимит), так и в аморфных или кажущихся аморфными минералах (например, агат, опал, халцедон) во всех районах суши. Природные силикаты характеризуются обилием, широким распространением, сложностью строения и состава. В силикатных минералах содержится большинство элементов следующих групп периодической таблицы: группы 1–6, 13 и 17 (I–IIIa, IIIb–VIb, VIIa). Эти элементы считаются литофильными или камнелюбивыми. Важные силикатные минералы включают глины, полевой шпат, оливин, пироксен, амфиболы, слюды и цеолиты.
Свойства элемента
Элементарный кремний получают в промышленных масштабах путем восстановления кремнезема (SiO  В небольших масштабах кремний можно получить из оксида восстановлением алюминием. Почти чистый кремний получают восстановлением тетрахлорида кремния или трихлорсилана. Для использования в электронных устройствах монокристаллы выращивают путем медленного извлечения затравочных кристаллов из расплавленного кремния.
В небольших масштабах кремний можно получить из оксида восстановлением алюминием. Почти чистый кремний получают восстановлением тетрахлорида кремния или трихлорсилана. Для использования в электронных устройствах монокристаллы выращивают путем медленного извлечения затравочных кристаллов из расплавленного кремния.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Чистый кремний представляет собой твердое твердое вещество темно-серого цвета с металлическим блеском и октаэдрической кристаллической структурой, такой же, как у алмазной формы углерода, с которой кремний имеет много химических и физических сходств. Пониженная энергия связи в кристаллическом кремнии делает этот элемент менее плавящимся, более мягким и химически более активным, чем алмаз. Описана коричневая порошкообразная аморфная форма кремния, которая также имеет микрокристаллическую структуру.
Поскольку кремний образует цепочки, подобные тем, которые образованы углеродом, кремний изучался как возможный базовый элемент для кремниевых организмов. Однако ограниченное число атомов кремния, которые могут образовывать катеты, значительно уменьшает количество и разнообразие соединений кремния по сравнению с соединениями углерода. Окислительно-восстановительные реакции необратимы при обычных температурах. В водных системах стабильны только степени окисления 0 и +4 кремния.
Однако ограниченное число атомов кремния, которые могут образовывать катеты, значительно уменьшает количество и разнообразие соединений кремния по сравнению с соединениями углерода. Окислительно-восстановительные реакции необратимы при обычных температурах. В водных системах стабильны только степени окисления 0 и +4 кремния.
Кремний, как и углерод, относительно неактивен при обычных температурах; но при нагревании он энергично реагирует с галогенами (фтором, хлором, бромом и йодом) с образованием галогенидов и с некоторыми металлами с образованием силицидов. Как и в случае с углеродом, связи в элементарном кремнии достаточно прочны, чтобы требовать больших энергий для активации или стимулирования реакции в кислой среде, поэтому на него не действуют кислоты, кроме плавиковой. При красном калении кремний подвергается воздействию водяного пара или кислорода, образуя поверхностный слой диоксида кремния. Когда кремний и углерод объединяются при температуре электропечи (2000–2600 ° C [3600–4700 ° F]), они образуют карбид кремния (карборунд, SiC), который является важным абразивом.
Известны три стабильных изотопа кремния: кремний-28, составляющий 92,21% элемента в природе; кремний-29, 4,70%; и кремний-30, 3,09%. Известно пять радиоактивных изотопов.
Элементарный кремний и большинство кремнийсодержащих соединений нетоксичны. Действительно, ткани человека часто содержат от 6 до 90 миллиграммов кремнезема (SiO 2 ) на 100 граммов сухого веса, и многие растения и низшие формы жизни усваивают кремнезем и используют его в своих структурах. Вдыхание пыли, содержащей альфа-SiO 2 , однако, вызывает серьезное заболевание легких, называемое силикозом, распространенное среди шахтеров, каменотесов и керамистов, если не используются защитные устройства.
Si Информация о кремниевом элементе: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура кремния
Твердотельная структура кремния Тетраэдрическая упаковка .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 543,09 пм | 543,09 пм | 543,09 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | Gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
Положения атомов внутри единичной клетки описаны по наборам по атмосферу (x 9011. y i , z i ) измеряется от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | Fd_ 3m | |
| Oxidation States | Space Group Number | 227 |
| Crystal Structure | Tetrahedral Packing |
Silicon Atomic and Orbital Properties
Атомы кремния имеют 14 электронов и структуру электронной оболочки [2, 8, 4] с символом атомного термина (квантовые числа) 3 Р 0 .
| Atomic Number | 14 |
| Number of Electrons (with no charge) | 14 |
| Number of Protons | 14 |
| Mass Number | 28 |
| Number нейтронов | 14 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 4 |
| Электронная конфигурация | [Ne] 3s2 3p2 |
| Valence Electrons | 3s2 3p2 |
| Valence (Valency) | 4 |
| Main Oxidation States | -4, 4 |
| Oxidation States | – 4, -3, -2, -1, 0, 1, 2, 3, 4 |
| Символ атомного термина (квантовые номера) | 3 P 0 |
Bohr Model кремния – электронов на энергетический уровень
Электронная конфигурация основного состояния кремния – нейтральный атом кремния
Сокращенная электронная конфигурация кремния
Сокращенная электронная конфигурация основного состояния нейтрального атома кремния [Ne] 3s2 3p2. Часть конфигурации кремния, эквивалентная инертным газам предшествующего периода, обозначается аббревиатурой [Ne]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3s2 3p2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации кремния, эквивалентная инертным газам предшествующего периода, обозначается аббревиатурой [Ne]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3s2 3p2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального кремния
Полная электронная конфигурация атома кремния в основном состоянии. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p2 Принцип и правило Хунда.

Атомная структура кремния
Атомный радиус кремния составляет 111 пм, а его ковалентный радиус равен 111 пм.
| Вычисленный атомный радиус | 111 пм (1,11 Å) |
| Atomic Radius Empirical | 110 pm (1.1 Å) |
| Atomic Volume | 12.054 cm3/mol |
| Covalent Radius | 111 pm (1.11 Å) |
| Van der Waals Radius | 210 pm |
| Neutron Cross Section | 171 |
| Neutron Mass Absorption | 0.0002 |
Atomic Spectrum of Silicon
Химические свойства кремния: Энергия ионизации кремния и сродство к электрону
Сродство к электрону кремния составляет 133,6 кДж/моль.
| Valence | 4 |
| Electronegativity | 1.9 |
| ElectronAffinity | 133.6 kJ/mol |
Ionization Energy of Silicon
Refer to table below for Ionization energies of Silicon
| Ionization energy number | Enthalpy – kJ/mol | ||
|---|---|---|---|
| 1st | 786.5 | ||
| 2nd | 1577.1 | ||
| 3rd | 3231.6 | ||
| 4th | 4355.5 | ||
| 5th | 16091 | ||
| 6th | 19805 | ||
| 7th | 23780 | ||
| 8th | 928878787878787878787878787878787878787878787878787878787887878788787878878878787878887878888878887888887888788878887888888878788888888878888878888888788878788888888878887878787н.0041 | 9th | 33878 |
| 10th | 38726 | ||
| 11th | 45962 | ||
| 12th | 50502 | ||
| 13th | 235196 | ||
| 14th | 257923 |
Физические свойства кремния
Физические свойства кремния см. в таблице ниже.0045
в таблице ниже.0045
Elastic Properties
| Young Modulus | 47 |
| Shear Modulus | – |
| Bulk Modulus | 100 GPa |
| Коэффициент Пуассона | – |
Твердость кремния – тесты для измерения твердости элемента
| Твердость по шкале Мооса | 6,5 МПа |
| Твердость Vickers | – |
| Твердость Brinell | – |
Silicon Electrical Properties
. Электрические свойства кремния
| Электропроводность | 1000 См/м | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное сопротивление | 0,001 м Ом Сверхпроводимость |
| – |
Silicon Heat and Conduction Properties
| Thermal Conductivity | 150 W/(m K) |
| Thermal Expansion | 0. 0000026 /K 0000026 /K |
Silicon Magnetic Properties
| Магнитный тип | Диамагнитный |
| Точка Кюри | – |
| Массовая магнитная восприимчивость | -1.6e-9m3/kg |
| Molar Magnetic Susceptibility | -4.49e-11 m3/mol |
| Volume Magnetic Susceptibility | -0.00000373 |
Optical Properties of Silicon
| Refractive Index | – |
Акустические свойства кремния
| Скорость звука | 2200 м/с0109 См. Таблицу ниже для тепловых свойств кремния
Enthalpies of Silicon
Silicon isotopes – nuplepes – wuricon orlecon – inootopes – nuplepes – nuplepes – nuplepes – № |
. от 22 до 44 нуклонов. Кремний имеет 3 стабильных природных изотопа.
Изотопы кремния – Природные стабильные изотопы: 28Si, 29Si, 30Si.
| Изотоп | Z | N | Isotope Mass | % Abundance | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 22Si | 14 | 8 | 22 | Synthetic | ||
| 23Si | 14 | 9 | 23 | Synthetic | ||
| 24Si | 14 | 10 | 24 | Synthetic | ||
| 25Si | 14 | 11 | 25 | Synthetic | ||
| 26Si | 14 | 12 | 26 | Synthetic | ||
| 27Si | 14 | 13 | 27 | Synthetic | ||
| 28Si | 14 | 14 | 28 | 92. |

 2 kJ/mol
2 kJ/mol