Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Тема 1.2.1. Практическое занятие №1 Распределение электронов в атомах элементов | Методическая разработка:
Атомы и электроны
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома – порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
- Второй уровень
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых помещается 6 электронов
- Третий уровень
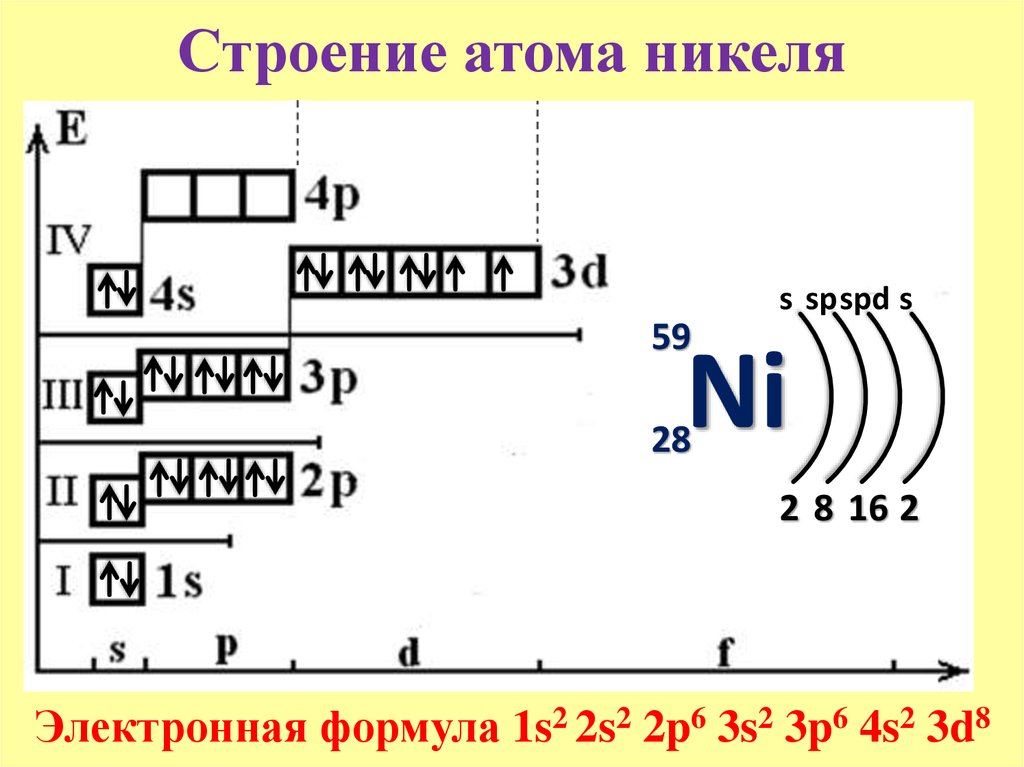
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня: пяти “d” ячеек (3d10), в которых помещается 10 электронов
- Четвертый уровень
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня: пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей.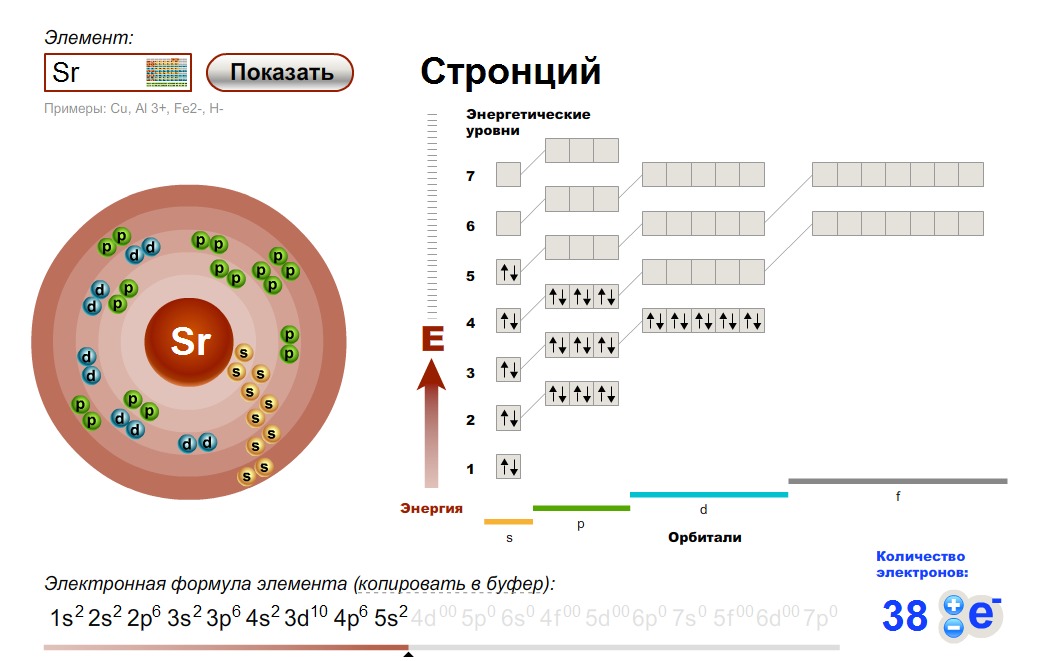 Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.
Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент.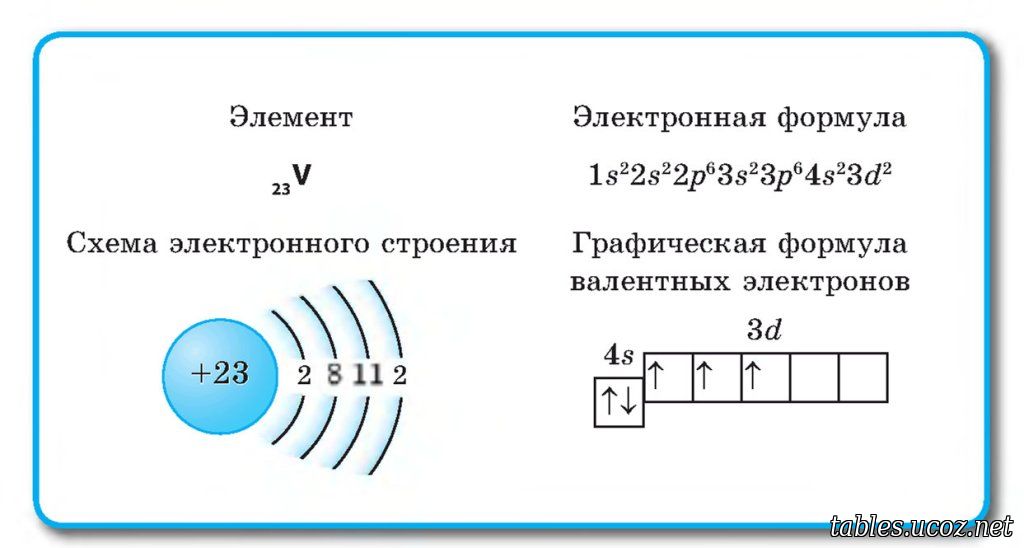 Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.
- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Запишем получившиеся электронные конфигурации магния и фтора:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную с учетом провала электрона.
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и сверьте с представленными ниже.
Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота, кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние связано с распаривание электронных пар.
Chem4Kids.com: Скандий: информация об орбитах и соединениях
Посмотрите на доску. В этом поле слева есть вся информация, которую вам нужно знать об одном элементе. Он сообщает вам массу одного атома, сколько частей внутри и где он должен быть помещен в периодической таблице.
Он сообщает вам массу одного атома, сколько частей внутри и где он должен быть помещен в периодической таблице.
Теперь мы работаем с четвертым периодом/строкой в таблице элементов. У вас может быть простой способ узнать количество электронов в нейтральных атомах , но размещение этих электронов становится немного сложнее. Давайте посмотрим на расположение электронов в основных элементах (левая и правая части таблицы) четвертого периода и более сложное расположение переходных элементов (в середине ряда). Если вы думаете, что это немного выше вашего понимания, вернитесь назад и посмотрите на элементы 1-18, которые имеют более простые организации.
Взгляните на картинку ниже. Каждый из этих цветных шаров является электроном. В атоме электроны вращаются вокруг центра, также называемого ядром. Электроны любят находиться в отдельных оболочках/орбиталях . Когда вы узнаете больше об атомной структуре, вы узнаете, что электроны не остаются в определенных областях вокруг ядра.
Этот элемент является одним из переходных элементов, которые размещают дополнительные электроны не во внешней оболочке, а в нижней. Для четвертого периода/ряда все эти электроны строят третью оболочку максимум до 18 электронов. Помните, что первые восемь были размещены во время нашего путешествия по третьему периоду/ряду. В четвертом ряду периодической таблицы находятся переходные металлы от скандия (21) до цинка (30).
Ах, переходные металлы. Скандий — первый элемент таблицы Менделеева, электронные конфигурации которого начинают становиться немного дикими. До сих пор вы использовали систему 2-8-8 для описания электронных оболочек. Каждый элемент добавляет еще один электрон на внешнюю оболочку. Вместо трех электронов на внешней оболочке скандий добавляет свой электрон на предпоследнюю оболочку. Электронная конфигурация 2-8-9-2.
Электронная конфигурация 2-8-9-2.
Скандий находится справа от кальция в четвертом периоде таблицы. Несмотря на то, что его электронная конфигурация немного отличается, скандий по-прежнему хочет связываться с этими тремя дополнительными электронами, независимо от того, в какой оболочке они находятся.
► Подробнее об истории и местах нахождения скандия.
► Следующий элемент периодической таблицы.
- Скажи/Найди
- Орбитали/связи
- Предыдущий элемент
- Следующий элемент
- Список элементов
- Периодическая таблица
- Дополнительные темы
Sc Информация об элементе скандия: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура скандия
Твердотельная структура скандия Простая гексагональная .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 330,9 пм | 330,9 пм | 527,33 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | Gamma |
|---|---|---|
| π/2 | π/2 | 2 π/3 |
. Положения атомов внутри единичной клетки описываются на подставки ATOMIC. , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | P63/mmc | |
| Oxidation States | Space Group Number | 194 |
| Crystal Structure | Simple Hexagonal |
Scandium Atomic and Orbital Properties
Атомы скандия имеют 21 электрон и структуру электронной оболочки [2, 8, 9, 2] с символом атомного термина (квантовые числа) 2 D 3/2 .
| Atomic Number | 21 |
| Number of Electrons (with no charge) | 21 |
| Number of Protons | 21 |
| Mass Number | 45 |
| Number нейтронов | 24 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 9, 2 |
| Электронная конфигурация | [Ar] 3d1 4s2 |
| Valence Electrons | 3d1 4s2 |
| Valence (Valency) | 3 |
| Main Oxidation States | 3 |
| Oxidation States | 0, 1, 2, 3 |
| Символ атомного термина (квантовые числа) | 2 D 3/2 |
Уровень атомной энергии бора0057
Электронная конфигурация основного состояния скандия – нейтральный атом скандия
Сокращенная электронная конфигурация скандия
Сокращенная электронная конфигурация основного состояния нейтрального атома скандия [Ar] 3d1 4s2. Часть конфигурации скандия, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d1 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть конфигурации скандия, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Ar]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 3d1 4s2, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального скандия
Полная электронная конфигурация атома скандия в основном состоянии. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d1 4s2
Принцип запрета Паули и правило Хунда.
Атомная структура скандия
Атомный радиус скандия составляет 184 пм, а его ковалентный радиус равен 144 пм.
| Вычисленный атомный радиус | 184 пм (1,84 Å) |
| Atomic Radius Empirical | 160 pm (1.6 Å) |
| Atomic Volume | 15.061 cm3/mol |
| Covalent Radius | 144 pm (1.44 Å) |
| Van der Waals Radius | 211 PM |
| Нейтронный сечение | 27,2 |
| Абсорбция нейронной массы | 0,025 |
Atomic.0062
Химические свойства скандия: Энергия ионизации скандия и сродство к электрону
Сродство к электрону скандия составляет 18,1 кДж/моль.
| Valence | 3 |
| Electronegativity | 1.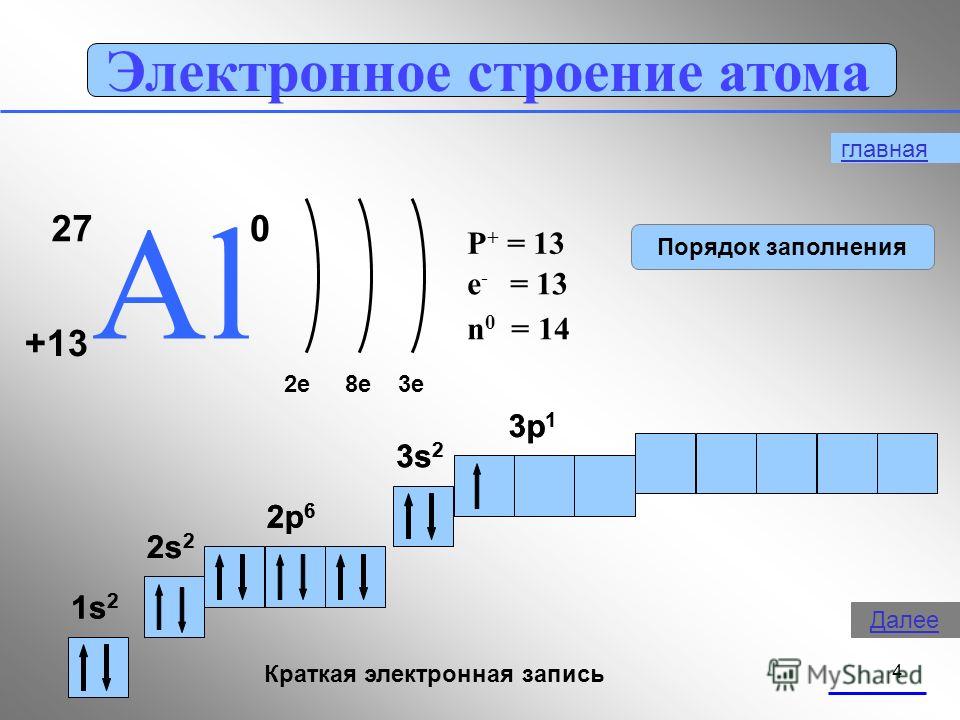 36 36 |
| ElectronAffinity | 18.1 kJ/mol |
Ionization Energy of Scandium
Refer to table below for Ionization energies of Scandium
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 633.1 |
| 2nd | 1235 |
| 3rd | 2388.6 |
| 4th | 7090.6 |
| 5th | 8843 |
| 6th | 10679 |
| 7th | 13310 |
| 8th | 15250 |
| 9th | 17370 |
| 10th | 21726 |
| 11th | 24102 |
| 12th | 66320 |
| 13th | 73010 |
| 14th | 80160 |
| 15th | 89490 |
| 16th | 97400 |
| 17th | 105600 |
| 18th | 117000 |
| 19th | 124270 |
| 20th | 547530 |
| 21st | 582163 |
Scandium Physical Properties
Refer to below table for Scandium Physical Properties
| Density | 2,985 г/см3 (при т. пл. плотности жидкости $2,8 г/см3) пл. плотности жидкости $2,8 г/см3) |
| Молярный объем | 15,061 см3/моль |
Упругие свойства
| Young Modulus | 74 |
| Shear Modulus | 29 GPa |
| Bulk Modulus | 57 GPa |
| Poisson Ratio | 0.28 |
Hardness of Scandium – Tests to Мера твердости элемента
| Твердость по Моосу | – |
| Твердость по Виккерсу | – |
| Твердость по Бринеллю | 750 МПа |
Скандий Электрические свойства
Скандий является проводником электричества. Refer to table below for the Electrical properties ofScandium
| Electrical Conductivity | 1800000 S/m |
| Resistivity | 5.5e-7 m Ω |
| Superconducting Point | 0. 05 05 |
Scandium Теплопроводность и теплопроводность
| Thermal Conductivity | 16 W/(m K) |
| Thermal Expansion | 0.0000102 /K |
Scandium Magnetic Properties
| Magnetic Type | Paramagnetic |
| Curie Point | – |
| Массовая магнитная восприимчивость | 8,8e-8 м3/кг |
| Молярная магнитная восприимчивость | 3,956e-9 м3/моль |
| Volume Magnetic Susceptibility | 0.0002627 |
Optical Properties of Scandium
| Refractive Index | – |
Acoustic Properties of Scandium
| Speed of Sound | – |
Тепловые свойства скандия – энтальпии и термодинамика
Тепловые свойства скандия 9 см.