|
1. Барфилд, М. Элементарно! : вся таблица Менделеева у тебя дома : [для старшего школьного возраста] / Майк Барфилд ; иллюстрации Лорен Хамфри ; перевод с английского Вадима Цилинского. – 2-е изд. – Москва : Манн, Иванов и Фербер, 2020. – 62, [1] с. : ил. – (Миф детство). – Алф. указ. в конце кн. – 3000 экз. – ISBN 978-5-00169-023-8 Ж2-20/68851 Аннотация Для читателей от 6 лет. |
|
|
2. Курамшин, А. И. Химические элементы для безнадежных гуманитариев [сильно влюбленных в них] / Аркадий Курамшин. – Москва : АСТ, 2020. – 414, [1] с. : ил. – (Безнадежный гуманитарий). – 2000 экз. – ISBN 978-5-17-123412-6 Д10-20/78268 Аннотация |
|
|
3. Руни, Э. Периодическая система. От философского камня к 118 элементам / Энн Руни ; [пер. с англ. Д10-20/79114 Аннотация |
|
|
4. Руни, Э. Химия. От таблицы Менделеева к нанотехнологиям / Э. Руни ; [перевод с английского А. Банкрашкова]. – Москва : Аванта : Изд-во АСТ, 2020. – 206, [1] с. : ил. – (Наука для всех). Д10-20/76453 Аннотация |
|
|
5. Иванов, А. Химические элементы : [для среднего школьного возраста] / А. Иванов, И. Гордий. – Москва : Аванта : АСТ, 2018. – 120, [11] с. : ил. – (Химия просто) (Хочу всё знать!). – 3000 экз. – ISBN 978-5-17-108044-0 Ж2-18/65481 Аннотация | |
|
6. Курамшин, А. Элементы: замечательный сон профессора Менделеева / А. Курамшин. – Москва : Изд-во АСТ : Времена, 2019. – 414, [1] с. : ил. – (Научпоп Рунета). – 5000 экз. – ISBN 978-5-17-113353-5 Д10-19/63246 Аннотация |
|
|
7. Иванов, А. Б. Химические элементы / А. Б. Иванов, И. В. Гордий. – Москва : Аванта, 2018. – 205 с. : ил. Д10-18/51625 Аннотация |
|
|
8. Олдерси-Уильямс, Х. Научные сказки периодической таблицы: занимательная история химических элементов от мышьяка до цинка : [перевод с английского] / Х. Олдерси-Уильямс. – Москва : АСТ, 2019. – 444, [1] с. : ил. – (Серия “Удивительная Вселенная”). – Пер. изд.: Periodic tales: the curious lives of the elements / H. Aldersey-Williams. Д10-19/64698 Аннотация |
|
9. Химические элементы : энциклопедический словарь : учебное пособие / В. В. Лунин [и др. ; научный редактор Н. В. Шелемина] ; Химический факультет Московского государственного университета. – Москва : Энциклопедия, 2019. – 382 с. – Авт. указ. на обороте тит. л. – 300 экз. – ISBN 978-5-94802-070-9 В. Шелемина] ; Химический факультет Московского государственного университета. – Москва : Энциклопедия, 2019. – 382 с. – Авт. указ. на обороте тит. л. – 300 экз. – ISBN 978-5-94802-070-9
Д10-19/63112 Аннотация |
|
|
10. Исчезающая ложка, или Удивительные истории из жизни периодической таблицы Менделеева / Сэм Кин ; [перевод с английского М. А. Райтман]. – Москва : БОМБОРА™ : Изд-во “Эксмо”, 2020. – 601, [4] с. : ил. – (Бомборий. Новый элемент знаний). – Библиогр. в конце кн. – Пер. изд.: disappearing spoon: and other true tales of madness, love, and the history of the world from the periodic table of the elements / Sam Kean. – 2010. – 2000 экз. – ISBN 978-5-04-111267-7 Д10-20/78887 Аннотация |
Периодическая система таблица Менделеева – Справочник химика 21
При построении периодической системы Менделеев руководствовался принципом расположения элементов по возрастающим атомным массам. Однако, как видно нз таблицы, в трех случаях этот принцип оказался нарушенным. Так, аргон (атомная масса 39,948 а. е. м.) стоит до калия (39,098 а. е. м.), кобальт (58,9332 а. е. м.) находится до никеля (58,70 а. е. м.) и теллур (127,60 а. е. м.) до иода (126,9045 а. е. м.). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств. Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в пе- [c.52]
Однако, как видно нз таблицы, в трех случаях этот принцип оказался нарушенным. Так, аргон (атомная масса 39,948 а. е. м.) стоит до калия (39,098 а. е. м.), кобальт (58,9332 а. е. м.) находится до никеля (58,70 а. е. м.) и теллур (127,60 а. е. м.) до иода (126,9045 а. е. м.). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств. Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в пе- [c.52]
Обоснуйте, почему аргон с относительной атомной массой 39,9 располагается в периодической системе перед калием, атомная масса которого меньше (К) = 39,1 (элементы расположил в таблице правильно еще Д. И. Менделеев ). [c.26]
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА — естественная система химических элементов, созданная гениальным русским химиком Д. И. Менделеевым. Расположив элементы в последовательности возрастания атомных масс и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, закономерности которой теоретически вытекают из сформулированного им периодического закона Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, находятся в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д.
И. МЕНДЕЛЕЕВА — естественная система химических элементов, созданная гениальным русским химиком Д. И. Менделеевым. Расположив элементы в последовательности возрастания атомных масс и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, закономерности которой теоретически вытекают из сформулированного им периодического закона Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, находятся в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д.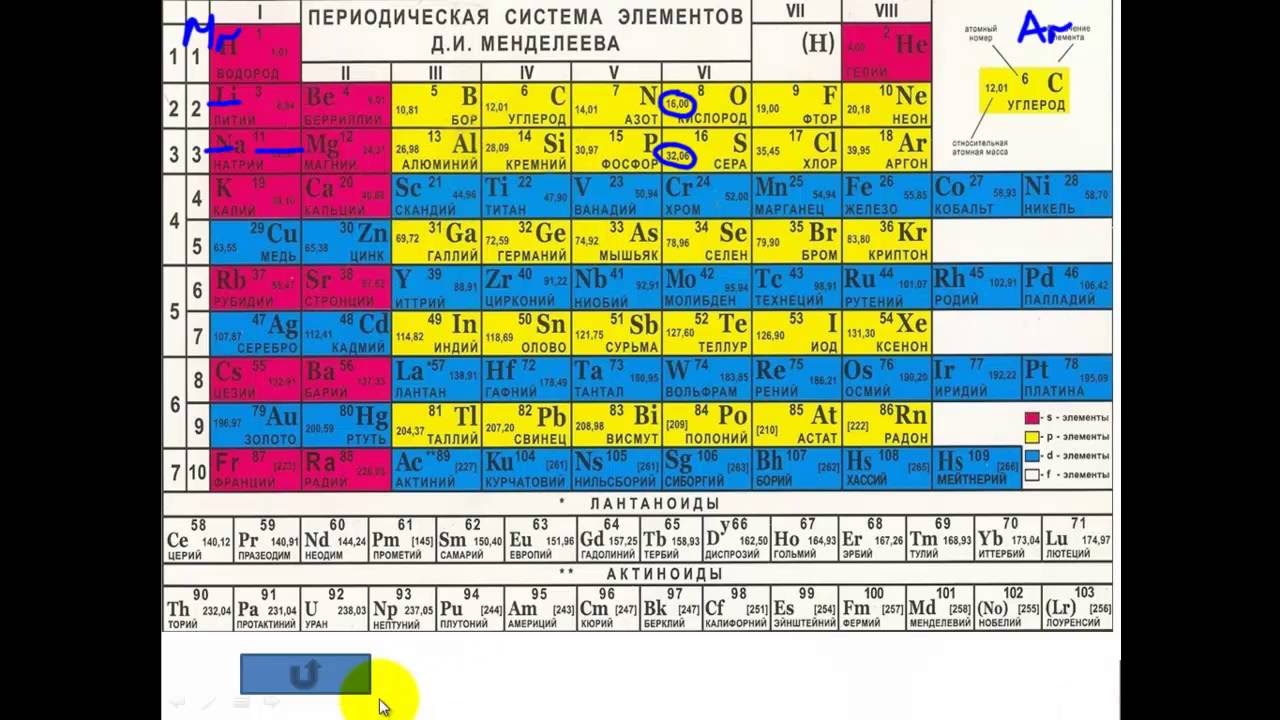 И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств. Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д. И. Менделеев. Периодический закон и периодическая система элементов [c.188]
И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств. Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д. И. Менделеев. Периодический закон и периодическая система элементов [c.188]
Вот как выглядела эта история. Иногда говорят, что Ньюлендсу задавали вопросы об аккордах и арпеджио , но на самом деле его спрашивали только об алфавитном порядке. Однако недоверие было совершенно очевидным, а незадачливая музыкальная аналогия сделала идеи Ньюлендса больше похожими на магию, чем на науку. Отсутствие места для новых элементов и помещение по два элемента в некоторые места таблицы были серьезными недостатками. По-видимому, главным достоинством схемы, предложенной Менделеевым, было введение больших периодов после двух первых, содержащих по восемь элементов. Менделеев подкреплял свою таблицу очень большим числом химических доказательств, а также прославившими его предсказаниями новых элементов и их химических свойств. Он несомненно заслужил репутацию создателя периодической системы элементов. [c.327]
Однако недоверие было совершенно очевидным, а незадачливая музыкальная аналогия сделала идеи Ньюлендса больше похожими на магию, чем на науку. Отсутствие места для новых элементов и помещение по два элемента в некоторые места таблицы были серьезными недостатками. По-видимому, главным достоинством схемы, предложенной Менделеевым, было введение больших периодов после двух первых, содержащих по восемь элементов. Менделеев подкреплял свою таблицу очень большим числом химических доказательств, а также прославившими его предсказаниями новых элементов и их химических свойств. Он несомненно заслужил репутацию создателя периодической системы элементов. [c.327]
Разделив все элементы иа периоды и располагая одн,н период под другим так, чтобы сходные ио свойствам и типу образуемых соединений элементы приходились друг под другом, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам.
 Эта таблица в современном виде, дополненная открытыми уже после Менделеева элементами, приведена в начале книги. Она состоит из десяти горизонтальных рядов и восьми вертикальных столбцов, или групп, [c.49]
Эта таблица в современном виде, дополненная открытыми уже после Менделеева элементами, приведена в начале книги. Она состоит из десяти горизонтальных рядов и восьми вертикальных столбцов, или групп, [c.49]Открытый закон периодичности Д. И. Менделеев использовал для создания периодической системы элементов. Днем рождения системы Д. И. Менделеева обычно считают 18 февраля 1869 г., когда был составлен первый вариант таблицы. В этой таблице 63 известных Д. И. Менделееву элемента были расположены в порядке возрастания атомных масс. Это расположение отражало также периодичность изменения свойств элементов. В таблице были оставлены пустые места для четырех еще не открытых элементов с атомными массами 45, 68, 70 и 180. Существование их было предсказано Д. И. Менделеевым. [c.20]
Свою таблицу Менделеев опубликовал в 1869 г., т. е. раньше, чем была издана основная работа Мейера (рис. 16). Однако честь открытия Периодической системы элементов принадлежит Менделееву не из-за приоритета публикации, действительная причина состоит в том, как Менделеев построил свою таблицу. [c.99]
[c.99]
Точно так же периодическая система дала толчок к исправлению атомных масс некоторых элементов. Например, цезию раньше приписывали атомную массу 123,4. Менделеев же, располагая элементы в таблицу, нашел, что по своим свойствам цезий должен стоять в главной подгруппе первой группы под рубидием и потому будет иметь атомную массу около 130. Современные определения показывают, что атомная масса цезия равна 132,9054. [c.77]
Несмотря на большое значение ранних работ различных ученых, главная заслуга в развитии периодической системы принадлежит русскому ученому Дмитрию Ивановичу Менделееву и немецкому ученому Юлиусу Лотару Мейеру. Независимо один от другого они открыли, что свойства элементов могут быть выражены как периодическая функция от. чх атомных весов, и сделали возможной периодическую классификацию, которая мало изменилась в течение последующих лет. Менделеев опубликовал свое первое сообщение о периодической системе в 1869 г. , на несколько месяцев раньше появления в печати таблицы Мейера. Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84]
, на несколько месяцев раньше появления в печати таблицы Мейера. Однако нет сомнения, что оба ученых достойны славы за открытие периодического закона, независимо от даты опубликования. Это было признано Королевским Обществом, присудившим в 1882 г, и Д. И. Менделееву, и Мейеру медаль Дэви. [c.84]
Период полураспада (Т. д)- время, за которое количество нестабильных частиц уменьшается наполовину. П. п.— одна из основных характеристик радиоактивных изотопов, неустойчивых элементарных (фундаментальных) частиц. Периодическая система элементов Д. И. Менделеева — естественная система химических элементов. Расположив элементы в порядке возрастания атомных масс (весов) и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, выражающую открытый им периодический закон Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, стоят в периодической зависимости от их атомного веса (1869—1871 гг. ). Периодический закон и периодическая таблица элементов Д. И. Менделеева позволяют установить взаимную связь между всеми известными химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. На основе закона и периодической системы Д. И. Менделеева найдены закономерности в свойствах химических соединений различных элементов, открыты новые элементы, получено много новых веществ. Периодичность в изменении свойств элементов обусловлена строением электронной оболочки атома, периодически изменяющейся по мере возрастания числа электронов, равного положительному заряду атомного ядра Z. Отсюда современная формулировка периодического закона свойства элементов, а также образованных ими простых и сложных соединений находятся в периодической зависимости от величин зарядов их атомных ядер (Z). Поэтому химические элементы в П. с. э. располагаются в порядке возрастания Z, что соответствует в целом их расположению по атомным массам, за исключением Аг—К, Со—N1, Те—I, Th—Ра, для которых эта закономерность нарушается, что связано с нх изотопным составом.
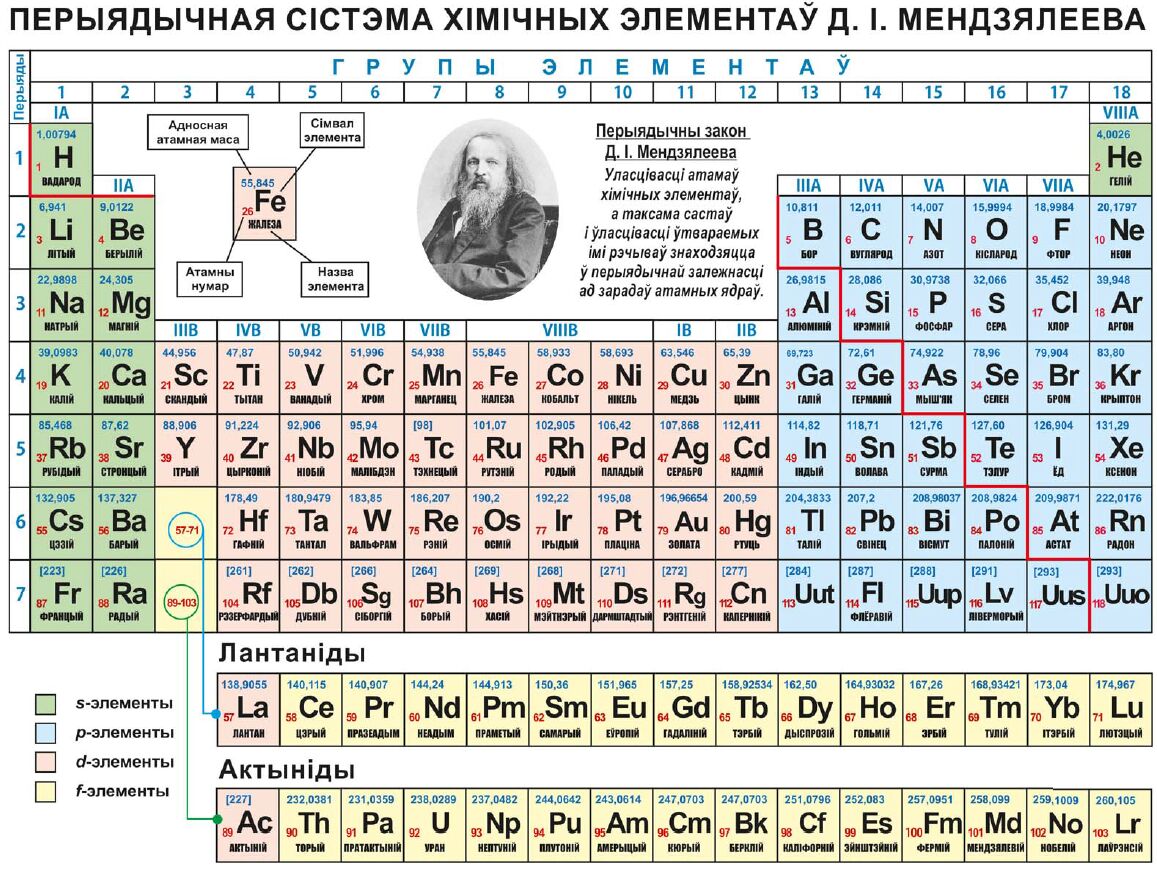
). Периодический закон и периодическая таблица элементов Д. И. Менделеева позволяют установить взаимную связь между всеми известными химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. На основе закона и периодической системы Д. И. Менделеева найдены закономерности в свойствах химических соединений различных элементов, открыты новые элементы, получено много новых веществ. Периодичность в изменении свойств элементов обусловлена строением электронной оболочки атома, периодически изменяющейся по мере возрастания числа электронов, равного положительному заряду атомного ядра Z. Отсюда современная формулировка периодического закона свойства элементов, а также образованных ими простых и сложных соединений находятся в периодической зависимости от величин зарядов их атомных ядер (Z). Поэтому химические элементы в П. с. э. располагаются в порядке возрастания Z, что соответствует в целом их расположению по атомным массам, за исключением Аг—К, Со—N1, Те—I, Th—Ра, для которых эта закономерность нарушается, что связано с нх изотопным составом. В периодической системе все химические элементы подразделяются на группы и периоды. Каждая группа в свою очередь подразделяется на главную и побочную подгруппы. В каждой подгруппе содержатся элементы, обладающие сходными химическими свойствами. Элементы главной и побочной подгрупп в каждой группе, как правило, обнаруживают между собой определенное химическое сходство главным образом в высших степенях окисления, которое, как правило, соответствует номеру группы. Периодом называют совокупность элементов, начинающуюся щелочным металлом и заканчивающуюся инертным газом (особый случай — первый период) каждый период содержит строго определенное число элементов. П. с. э. имеет 8 групп и 7 периодов (седьмой пока не завершен). [c.98]
В периодической системе все химические элементы подразделяются на группы и периоды. Каждая группа в свою очередь подразделяется на главную и побочную подгруппы. В каждой подгруппе содержатся элементы, обладающие сходными химическими свойствами. Элементы главной и побочной подгрупп в каждой группе, как правило, обнаруживают между собой определенное химическое сходство главным образом в высших степенях окисления, которое, как правило, соответствует номеру группы. Периодом называют совокупность элементов, начинающуюся щелочным металлом и заканчивающуюся инертным газом (особый случай — первый период) каждый период содержит строго определенное число элементов. П. с. э. имеет 8 групп и 7 периодов (седьмой пока не завершен). [c.98]
Во втором варианте таблицы Менделеев поместил только один элемент из лантаноидов — Се. Для остальных забронировал места. Впоследствии, когда их было известно уже 11 (1902 1903), он включает в таблицу только два — Се и УЬ, так как не мог окончательно определиться, куда их поместить.
 В 1903 г. он писал Тут мое мнение ни на чем не остановилось, и здесь я вижу одну из труднейших задач, представляемых периодической закономерностью . Возникает вопрос а в чем собственно заключается трудность задачи Ведь есть (как считает автор) естественная система химических элементов, сформулирован главный закон, лежащий в ее основе, — бери, пользуйся Но почему же они не срабатывают А дело в том, что в основе системы лежит не только периодическая законность (дифференциация), но и непрерывная законность (интеграция). Трудность размещения в Периодической [c.71]
В 1903 г. он писал Тут мое мнение ни на чем не остановилось, и здесь я вижу одну из труднейших задач, представляемых периодической закономерностью . Возникает вопрос а в чем собственно заключается трудность задачи Ведь есть (как считает автор) естественная система химических элементов, сформулирован главный закон, лежащий в ее основе, — бери, пользуйся Но почему же они не срабатывают А дело в том, что в основе системы лежит не только периодическая законность (дифференциация), но и непрерывная законность (интеграция). Трудность размещения в Периодической [c.71]На протяжении почти четырех десятилетий Д. И. Менделеев работал над усовершенствованием периодической системы элементов, разрабатываемой им в различных вариантах. Последний вариант короткой формы таблицы был опубликован им в 8-м издании Основ химии . [c.75]
В поисках периодической системы элемеитов Менделеев шел от представления об отдельных, разрозненных, не связанных между собой элементов и их групп к раскрытию их взаимной связи между собой.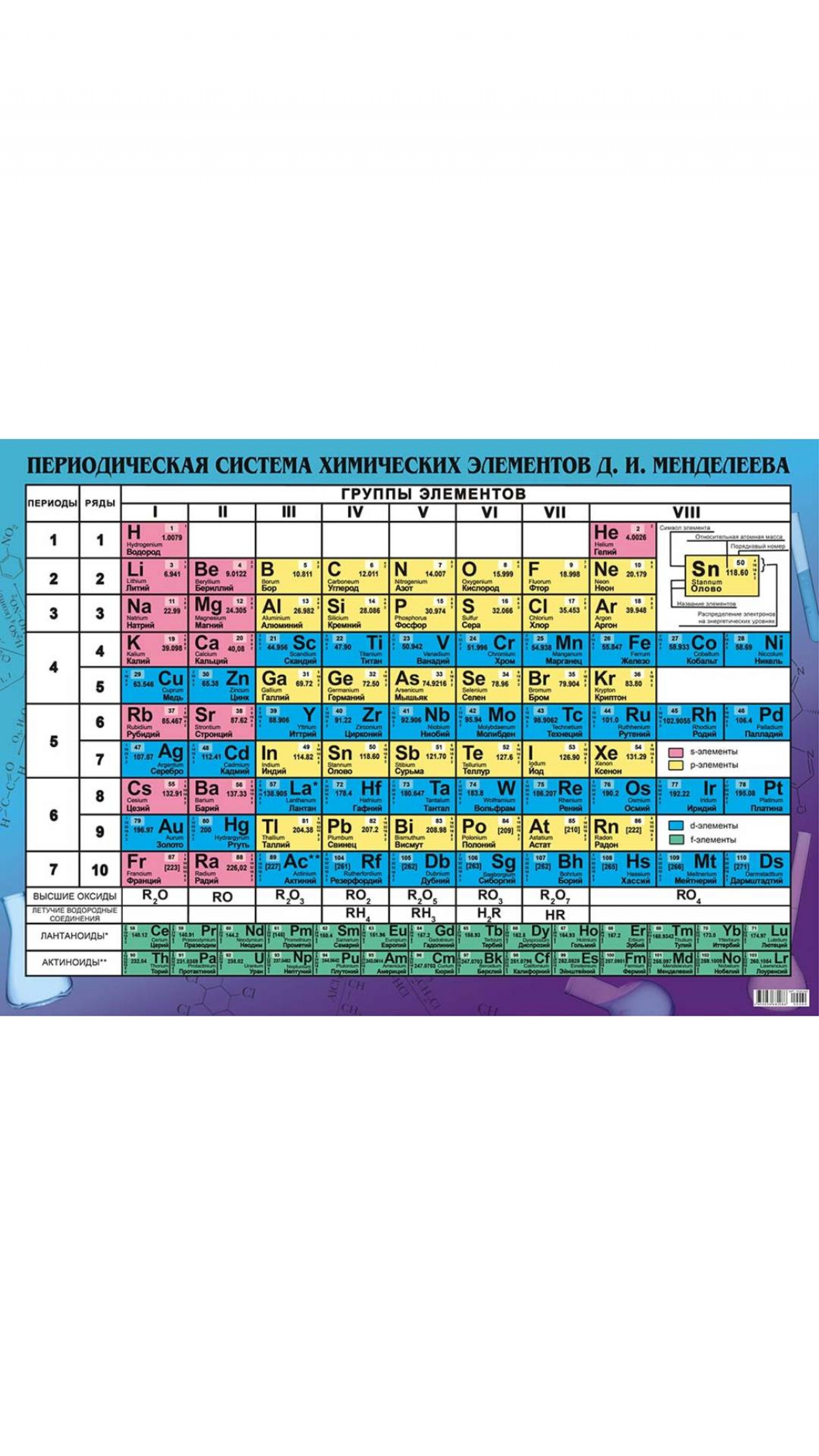 Общая связь, охватывающая все элементы, раскрывалась не сразу, не в виде пришедшего как бы по наитию решения, а последовательно, шаг за шагом. Когда речь шла о членах одного и того же семейства (например, семейства железа, платины или церитовых металлов), элементы оказывались близкими и по химическим свойствам, и по атомным весам. Поэтому связи элементов внутри таких семейств обнаруживались с особой ясностью, даже если в начале составления таблицы они не были еще выяснены в полном объеме. [c.45]
Общая связь, охватывающая все элементы, раскрывалась не сразу, не в виде пришедшего как бы по наитию решения, а последовательно, шаг за шагом. Когда речь шла о членах одного и того же семейства (например, семейства железа, платины или церитовых металлов), элементы оказывались близкими и по химическим свойствам, и по атомным весам. Поэтому связи элементов внутри таких семейств обнаруживались с особой ясностью, даже если в начале составления таблицы они не были еще выяснены в полном объеме. [c.45]
Решающий шаг в развитии периодической системы сделал Менделеев. Оп систематически изучал взаимосвязь между атомным весом и физическими и химическими свойствами элементов, обращая особое внимание на валентность. В 1869 г. Менделеев предложил таблицу элементов, содержащую семнадцать столбцов и в общем более похожую на новую форму периодической системы (см. стр, 56—57). В 1871 г. Менделеев видоизменил свою таблицу— сократил число столбцов до восьми, перегруппировал элементы длинных периодов в два ряда по семи элементов и ввел восьмой столбец, содержащий по три элемента в ряду (см. табл. 6, стр. 55). Аналогичная таблица была предложена в том же году [c.53]
табл. 6, стр. 55). Аналогичная таблица была предложена в том же году [c.53]
За основу классификации элементов Менделеев, как и Мейер, принял массу, но при этом Менделеев не рассматривал массу как единственную характеристику элемента. В современной формулировке Периодического закона отражается зависимость свойств элементов от порядкового номера элемента 2, т. е. от заряда ядра атомов, поскольку именно величина 2 однозначно характеризует химический элемент (см. 1.6). Не менее важным был учет Менделеевым химических свойств элементов именно эти свойства для некоторых элементов оказались решающими при выборе места данного элемента в таблице. В наши дни открытие Менделеева блестяще подтвердилось все новые элементы, как обнаруженные в природе, так и синтезированные искусственно, занимают свое естественное место в Периодической системе. [c.100]
В то время целый ряд ученых, работая независимо, пытались создать классификацию элементов, в которой бы рядом располагались элементы с близкими свойствами.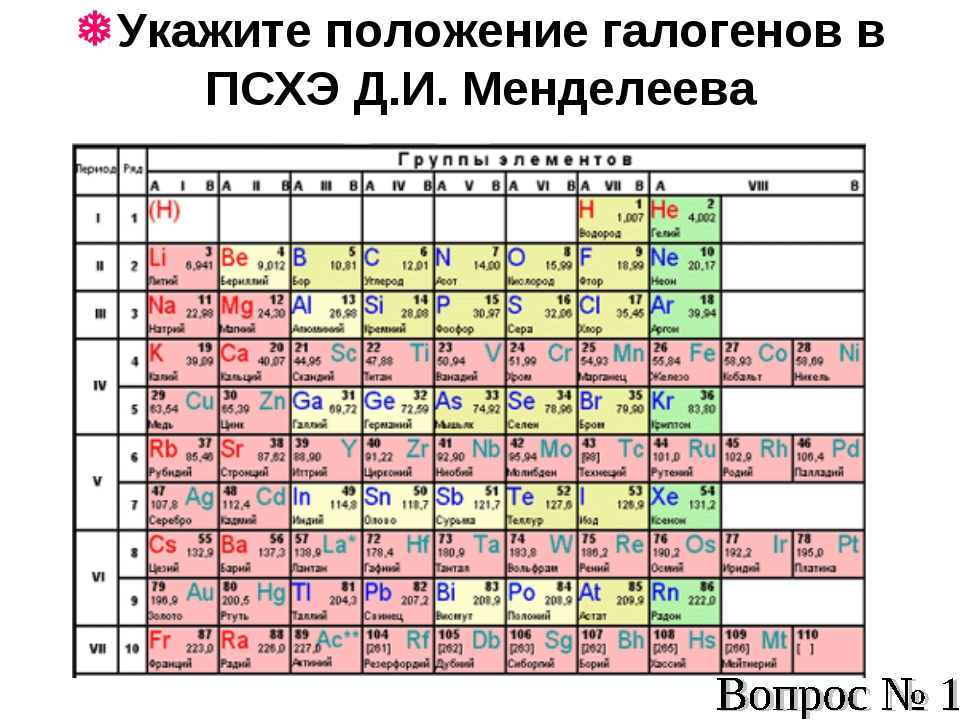 Такой тип расположения называется периодической системой. В 1869 году русский химик Дмитрий Иванович Менделеев опубликовал периодическую систему, очень похожую на ту, что используется в настоящее время. Это таблица, напоминающая табличный календарь, в котором все воскресения расположены в одной колонке, нее понедельники — в другой и т.д., а все дни одной недели располагаются в одном горизонтальном ряду. [c.124]
Такой тип расположения называется периодической системой. В 1869 году русский химик Дмитрий Иванович Менделеев опубликовал периодическую систему, очень похожую на ту, что используется в настоящее время. Это таблица, напоминающая табличный календарь, в котором все воскресения расположены в одной колонке, нее понедельники — в другой и т.д., а все дни одной недели располагаются в одном горизонтальном ряду. [c.124]
Эта убедительная логичность развития мысли о непрерывном ряде и рождает легенды. Рассудок бунтует против того иррационального пути, которым шел Д. И. Менделеев в создании Периодической системы. Его первая таблица содержала объективной информации не более чем таблица Д. Ньюлендса. И увидел он в ней то же, что и Ньюлендс — повторяемость. Однако Менделеев превзошел соперника в логичности и широте мышления. Чтобы найти, — писал он, — надо не только глядеть и глядеть внимательно, но и знать, и знать многое, чтобы знать, куда глядеть . Он даже в этой несовершенной системе увидел то, что скрыто от глаз рядового ученого, и решился на теоретические обобщения и прогнозы. Приведу их полностью [c.54]
Приведу их полностью [c.54]
Ученые, которые с недоверием относились к системе Д. И. Менделеева, пытались истолковать открытие инертных газов как удар по Периодической системе. В действительности же, эти элементы не только нашли свое место в системе, но и логически дополнили ее, заняв место между типическими металлами и типическими неметаллами (галогенами). Для них Менделеев вводит отдельную нулевую группу, которую помещает в левой части таблицы перед первой. Позже она была совмещена с 8-й группой и велся длительный спор об их альтернативности. (Как будет показано позже, спор этот был безосновательным). Компромиссно остановились на 8-й группе. В современных таблицах нулевая группа отсутствует. Считается, что проблема решена окончательно. Но это мнение ошибочно, и мы еще вернемся к данному вопросу. [c.71]
Периодический закон был создан на основе анализа макроскопических свойств элементов и их соединений. Менделеев полагал, что периодический закон является отражением глубоких закономерностей строения веш,ества. Выражением периодического закона служит таблица, наглядно отражающая эти закономерности и получившая название периодической системы элементов Д. И. Менделеева. [c.22]
Выражением периодического закона служит таблица, наглядно отражающая эти закономерности и получившая название периодической системы элементов Д. И. Менделеева. [c.22]
Развитие химии в период творческой деятельности Д. И. Менделеева привело ученого к выводу, что свойства химических элементов определяются их атомной массой, т. е. величиной, характеризующей относительную массу атома. Поэтому в основу систематики элементов он положил именно атомный вес, как фактор, от которого зависят физические и химические свойства элементов. Д. И. Менделеев сформулировал периодический закон так свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов . Вслед за открытием закона Д. И. Менделеев опубликовал периодическую систему элементов, в которой вертикальные ряды сходных элементов назвал группами, а горизонтальные ряды, в пределах которых закономерно изменяются свойства элементов от типичного металла до типичного неметалла,— периодами. Современная периодическая система химических элементов Д. И. Менделеева состоит из семи периодов и восьми групп и содержит 105 элементов. Порядковый номер элемента в периодической системе не только определяет его положение в таблице, но и отражает важнейшее свойство атомов — величину заряда их ядер. Поэтому периодический закон Д. И. Менделеева в настоящее время формулируется так свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов элементов. [c.43]
Современная периодическая система химических элементов Д. И. Менделеева состоит из семи периодов и восьми групп и содержит 105 элементов. Порядковый номер элемента в периодической системе не только определяет его положение в таблице, но и отражает важнейшее свойство атомов — величину заряда их ядер. Поэтому периодический закон Д. И. Менделеева в настоящее время формулируется так свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер атомов элементов. [c.43]
Для иллюстрации в табл. 1.8 сопоставлены современные данные и величины атомных весов, которые фигурировали в знаменитом менделеевском Опыте системы элементов, основанной на их атомном весе и химическом сродстве (отдельное издание от 1 марта 1869 г. [18, с. 9]. В таблицу включены все РЗЭ, которые Менделеев принимал во внимание при составлении первых вариантов периодической системы. [c.83]
В свое время периодическая система элементов сыграла выдающуюся роль в предсказании еще не открытых элементов и их свойств.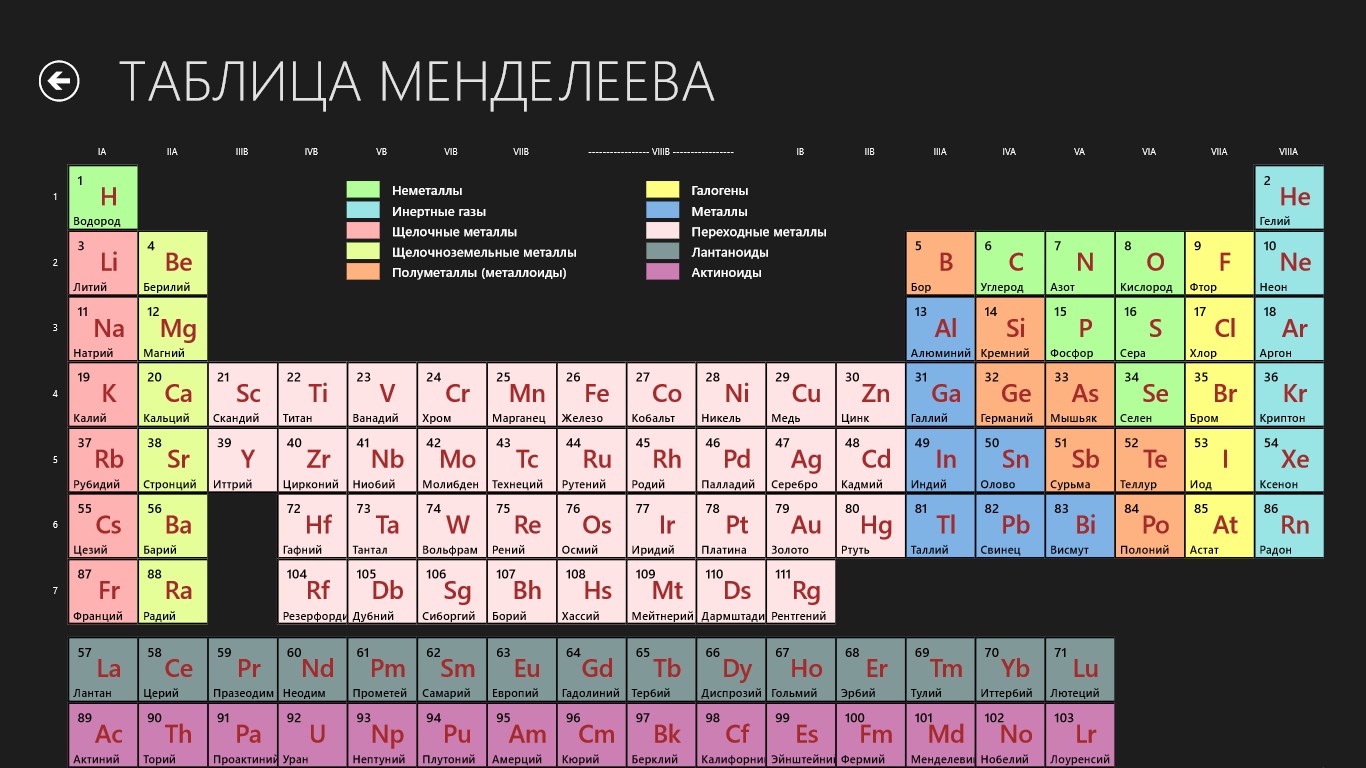 Например, сам Менделеев предсказал существование германия за 19 лет до открытия этого элемента, и его свойства действительно оказались в замечательном согласии с предсказанными. На сегодняшний день все пробелы в периодической таблице заполнены, так что порядковые номера элементов образуют непрерывный ряд, но она позволяет предсказывать свойства еще не- [c.105]
Например, сам Менделеев предсказал существование германия за 19 лет до открытия этого элемента, и его свойства действительно оказались в замечательном согласии с предсказанными. На сегодняшний день все пробелы в периодической таблице заполнены, так что порядковые номера элементов образуют непрерывный ряд, но она позволяет предсказывать свойства еще не- [c.105]
Д. И. Менделеев предвидел будущее открытие элемента с порядковым номером 72. Но описать его свойства с той же обстоятельностью, как свойства тоже еще не открытых скандия, германия и галлия, Менделеев не мог. Стройность периодической системы необъяснимо нарушали лантан и следующие за ним элементы. Позже Богуслав Браунер, выдающийся чешский химик, друг и сподвижник Менделеева, предложил выделить 14 лантаноидов в самостоятельный ряд, а в основном тексте таблицы поместить их все в клетку лантана. В 1907 г. был открыт самый тяжелый лантаноид — лютеций. Впрочем, уверенности в том, что [c.161]
В 1869 г. русский ученый Д. И. Менделеев составил таблицу, включающую большинство известных элементов, в которой элементы были сгруппированы в нескольких горизонтальных рядах так, что вертикальные столбцы включали элементы, сходные по химическим свойствам. Эта таблица, которую Менделеев назвал системой элементов, сегодня называется Периодической системой химических злементов (ее современный вид приведен на переднем форзаце). Кроме того, им был открыт и сформулирован фундаментальный закон природы — закон периодичности . Это основной химический закон, который называется Периодическим законом. [c.100]
русский ученый Д. И. Менделеев составил таблицу, включающую большинство известных элементов, в которой элементы были сгруппированы в нескольких горизонтальных рядах так, что вертикальные столбцы включали элементы, сходные по химическим свойствам. Эта таблица, которую Менделеев назвал системой элементов, сегодня называется Периодической системой химических злементов (ее современный вид приведен на переднем форзаце). Кроме того, им был открыт и сформулирован фундаментальный закон природы — закон периодичности . Это основной химический закон, который называется Периодическим законом. [c.100]
В пятом ряду таблицы после лантана следуют 14 элементов, называемых лантаноидами. Они сходны по свойствам с лантаном и редко встречаются в природе. Менделеев дал им название редкоземельных. В современной периодической системе эти элементы помещают внизу таблицы, отмечая звездочкой их положение в клетке лантана. [c.43]
При создании периодической таблицы Менделеев поставил теллур и соседний с ним йод (так же, как впоследствии аргон и калий) в VI и VII группы не в соответствии, а вопреки их атомным весам. Действительно, атомный вес теллура — 127,61, а йода — 126,91. Значит, йод должен был бы стоять не за теллуром, а впереди него. Менделеев, однако, не сомневался в правильности своих рассуждений, так как считал, что атомные веса этих элементов определены недостаточно точно. Близкий друг Менделеева чешский химик Богуслав Браунер тщательно проверил атомные веса теллура и йода, но его данные совпали с прежними. Правомерность исключений, подтверждающих правило, была установлена лишь тогда, когда в основу периодической системы легли не атомные веса, а заряды ядер, когда стал известен изотопный состав обоих элементов. У теллура, в отличие от йода, преобладают тяжелые изотопы. [c.23]
Действительно, атомный вес теллура — 127,61, а йода — 126,91. Значит, йод должен был бы стоять не за теллуром, а впереди него. Менделеев, однако, не сомневался в правильности своих рассуждений, так как считал, что атомные веса этих элементов определены недостаточно точно. Близкий друг Менделеева чешский химик Богуслав Браунер тщательно проверил атомные веса теллура и йода, но его данные совпали с прежними. Правомерность исключений, подтверждающих правило, была установлена лишь тогда, когда в основу периодической системы легли не атомные веса, а заряды ядер, когда стал известен изотопный состав обоих элементов. У теллура, в отличие от йода, преобладают тяжелые изотопы. [c.23]
Степень сходства между элементами имеет несколько градаций, которыми обусловлена специфичность каждого места в системе. Задача состоит в том, чтобы графически изобразить по возможности главные черты п оттенки в соотношении и переходах между элементами. С этой точки зрения первоначальная таблица оказалась слишком неопределённой и вместе с тем негибкой, одеревенелой, а потому огрубляющей реальные связи между элементахмп.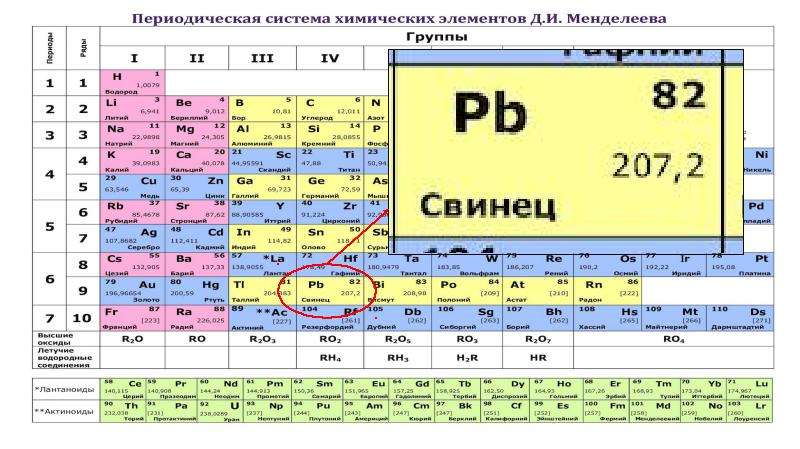 Расположение элемеитов ка кдого периода в один ряд не соответствовало реальному содержанию понятия место элемента в системе . В целом лестничная форма таблицы недостаточно полно и наглядно выража.ла многие существенные стороны периодической системы. Поэтому Менделеев, хотя и удерживал её, но придавал ей явно второстепенное значение. Главное же внимание у ке с первого издания Основ хилгаи он перенёс на короткую таблицу. Её можно назвать также восъмиклеточной, так как каждый ряд в ней разбпт на 8 клеток. [c.172]
Расположение элемеитов ка кдого периода в один ряд не соответствовало реальному содержанию понятия место элемента в системе . В целом лестничная форма таблицы недостаточно полно и наглядно выража.ла многие существенные стороны периодической системы. Поэтому Менделеев, хотя и удерживал её, но придавал ей явно второстепенное значение. Главное же внимание у ке с первого издания Основ хилгаи он перенёс на короткую таблицу. Её можно назвать также восъмиклеточной, так как каждый ряд в ней разбпт на 8 клеток. [c.172]
Таблицы периодической системы. На основании открытого им периодического закона Менделеев составил периодическую систему элементов. Он разбил весь ряд элементов на отдельные отрезки, внутри которых начинается и заканчивается периодическое изменение свойств, и расположил эти отрезки один под другим. Как известно, таблица Менделеева в ее так называемой коротко-пернодной форме (табл. 2 на первом форзаце книги) подразделяется на семь горизонтальных периодов и восемь вертикальных групи. [c.36]
В этом первоначальном варианте таблицы многое было неясно, требовало уточнений и изменений. На протяжении 37 лет.Менделеев продолжает дальнейшую творческую разработку периодической системы элементов. В V111 издании Основ химии был помещен следующий вариант системы, который следует рассматривать как итог работы Менделеева в развитии периодического закона (табл. 25). [c.79]
В то время, когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Так, был неизвестен элемент четвертого периода скандий. По атомной массе вслед за кальцием шел титан, но титан нельзя было поставить сразу после кальция, так как он попал бы в третью группу, тогда как титан образует высший оксид Т10г, да и по другим свойствам должен быть отнесен к четвертой группе. Поэтому Менделеев пропустил одну клетку, т. е. оставил свободное место между кальцием и титаном. На том же основании в четвертом периоде между цинком и мышьяком были оставлены две свободные клетки, занятые теперь элементами галлием и германием. Свободные места остались и в других рядах. Менделеев был не только убежден, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. Одному из них, которому в будущем предстояло занять место между кальцием и титаном, он дал название экабор (так как свойства его должны были напоминать бор) два других, для которых в таблице остались свободные места между цинком и мышьяком, были названы экаалюминием и экасилицием. [c.76]
Первоначальный вариант периодической системы Д. И. Менделеева имел длинную форму. (На втором форзаце книги этот вариант приведен в современном оформлении.) В декабре 1870 г. Д. И. Менделеев опубликовал короткую форму периодической системы. (На первом форзаце книги приведен вариант короткой формы таблицы.) Д. И. Менделеев отдавал преимущество короткому варианту. До настоящего времени продолжают поступать предложения о новых вариантах таблицы периодической системы элементов. Их известно уже несколько сотен. Но наилучшими из них, четко и глубоко передающими периодический закон, остаются вариагньг Д. И. Менделеева. [c.75]
Наиболее иоздиее по времени указание Менделеева по проблеме РЗЭ мы находим в примечании к периодической таблице в восьмом (последнем прижизненном) издании Основ химии , тщательно отредактированном самим автором. Менделеев дает следующую итоговую оценку проблемы РЗЭ Между Ge=140 и Та=183 недостает целого большого периода, ио ряд редких элементов (изучение их не полно) например, Рг=141, Nd=144, Sm=150, Eu = 152, Gd = 160, Но=165 Ег=166, Tu=I71 и Yb=173 представляет, по современным сведениям вес атома, как раз восполняющий этот промежуток, потому в указан ном месте периодическая система элементов представляет собой сво го рода разрыв, требующий новых изысканий [18, с. 367]. [c.90]
Одним из основных принципов, которым руководствавался Д. И. Менделеев при построении периодической системы, было предоставление каждому химическому элементу собственной клетки в таблице. Однако при размещении в периодической системе элементов середин больших приодов он отступил от этого правила и поместил в каждой клетке по три элемента. Основанием для такого объединения было большое сходство авойств элементов, имеющих близкие атомные массы. Возникло три триады — железа, палладия, платины. Расположение в одной клетке периодической системы нескольких элементов, сходных по свойствам, в дальнейшем нашло развитие ученик и последователь Менделеева Богуслав Браунер (долгое время был профессором Пражского университета) разместил все спутники церия (по Менделееву) в одной клетке периодической системы вместе с церием, подчеркнув тем самым близость химических свойств этих элементов [1]. Впоследствии все РЗЭ, следующие за церие.м (и сам церий) стали помещать в одной клетке периодической системы вместе с лантаном (лантаниды) то же относится и к актинидам (см. с. 86—230). [c.110]
Оболочечная структура электронных состояний атомов, следуюшая из законов движения электронов, объясненных квантовой механикой, была в некоторой степени предугадана замечательным русским химиком Менделеевым в 1868 г., т. е. задолго до появления квантовой механики, Менделеев открыл периодический закон химических элементов, который он выразил в виде таблицы апериодической системы элементов по группам и рядам . Периодическая система элементов Менделеева состоит из десяти горизонтальных рядов, которые составляют семь периодов, и девяти групп (вертикальных столбцов), в которых один под другим расположены сходные между собой элементы. Первоначальная таблица Менделеева содержала только восемь групп, так как инертные газы в то время не были еше известны. Произведенное Менделеевым размещение элементов в периодической системе оказалось полностью отражающим строение атомов, найденное современной квантовой механикой. Каждому периоду системы элементов Менделеева соответствует одна электронная оболочка в атоме. [c.361]
Когда Менделеев составлял свою таблицу на основании открытого им периодического закона, многие элементы не были известны. Руководствуясь рядом соображенТ1Й, Менделеев пришел к выводу, что в природе должны существовать еще неизвестные элементы, и оставил для них в периодической системе пустые места. Он предсказал свойства трех таких элементов на основании их положения среди других элементов в таблице. Одному из них Менделеев дал название экабор, так как этот элемент, по мнению Менделеева, должен был походить по свойствам на бор. Два другие были названы экаалюминием и экасилицием. Еще при жизни Менделеева эти три элемента были открыты. Первым был открыт галлий его свойства оказались такими, какие были предсказаны для экаалюминия. Затем был открыт скандий, обладающий свойствами экабора, и, наконец, германий, имеющий свойства, предсказанные для экаси-лиция. [c.46]
Приведенньщув табл. 2 приложения способ представления периодической системы, при котором элементы больших периодов подразделяются на два ряда и, следовательно, горизонтальное протяжение таблицы определяется длиной малых (коротких) периодов, называется короткопериодной формой в противоположность длиннопериодной форме, когда элементы больших (длинных) периодов располагаются в один непрерывный ряд. В этом случае приходится соответственно раздвигать малые периоды. Уже Менделеев наряду с короткопериодной применял также и длиннопериодную форму. В табл. 1 периодической системе придан тот вид (с добавлением открытых с тех пор элементов), который близок применявшемуся Менделеевым. [c.23]
Периодическая система элементов Менделеева. Д. И. Менделеев, основываясь на законе периодичности, расположил известные в то время элементы в таблицу по группам и рядам. Эта таблица получила название аериодической системы элементов Менделеева. Пополненная современными данными, таблица приведена на стр. 194—195. [c.193]
Таблица Менделеева пополнилась сразу четырьмя новыми сверхтяжелыми элементами
На прошлой неделе Международный союз теоретической и прикладной химии (IUPAC) добавил в периодическую таблицу Менделеева четыре новых химических элемента: 113, 115, 117 и 118. Это первые химические элементы, добавленные в периодическую систему с 2011 года. Они также завершают седьмой ряд таблицы Менделеева.
Все четыре полученных искусственным путем элемента пока имеют только порядковые номера, официальные названия им должны быть присвоены в ближайшие месяцы. Элементы с порядковыми номерами 115, 117 и 118 были открыты группой ученых из Объединенного института ядерных исследований (ОИЯИ) и Ливерморской национальной лаборатории им. Э. Лоуренса. Российско-американская группа ученых также пыталась присвоить себе приоритет открытия элемента под порядковым номером 113, который в настоящее время известен по именем унунтриум, но члены IUPAC были другого мнения и приписали эту заслугу команде японских ученых из Института физико-химических исследований (RIKEN). К слову, «стотринадцатый» станет первым элементом, право назвать который получат ученые из Азии.
Открытие сверхтяжелых элементов является задачей огромной сложности в первую очередь из-за их нестабильности (мгновенный распад). Однако последние исследования показали, что недавно обнаруженные сверхтяжелые элементы немного живучее своих предшественников, порождая тем самым огромные надежды ученых на открытие в будущем так называемого «островка стабильности» сверхтяжелых элементов – группы сверхтяжелых и стабильных химических элементов.
Профессор RIKEN Коскэ Морита, возглавляющий группу исследователей, которые открыли элемент 113, в своем заявлении отметил, что теперь его команда возьмется за открытие элемента 119 и остальных, которые идут после него.
«Для ученых это открытие несет гораздо большую ценность, чем золотая медаль для призера Олимпийских игр», – заявил японский ученый-химик Рёдзи Ноёри, лауреат Нобелевской премии по химии за 2001 год и бывший президент RIKEN.
Источник: The Verge
Периодическая таблица химических элементов и устойчивое развитие – Матлин – 2019 – Европейский журнал неорганической химии
Таблица напоминает нам, что на нашей планете менее 100 стабильных элементов (а также несколько десятков радиоактивных) из которого можно получить все материалы, необходимые для жизни, хорошего самочувствия и комфортной жизни. Нам необходимо гарантировать, что их ограниченные запасы не будут чрезмерно истощены или использованы экологически вредными способами.Объявление ООН 2019 года Международным годом Периодической таблицы химических элементов1 дает своевременную возможность осмыслить это предупреждение и подумать, как лучше всего решить проблему, которую оно представляет.
Международный год отмечает 150-летие публикации русским химиком Дмитрием Менделеевым (1834–1907) его Периодической таблицы2 и отмечает важность и влияние этой выдающейся успешной диаграммы атомных строительных блоков материи.Это было новаторское достижение в классификации, которое помогло направить понимание химии и стимулировало успехи в теоретическом понимании атомной структуры.3 Менделеев не был первым, кто опубликовал списки известных элементов в таблице, но, опираясь на В своих предыдущих усилиях он неукоснительно применял имеющиеся знания о периодических тенденциях в отношениях между примерно 60 известными на тот момент элементами для создания диаграммы, в которой в некоторых точках были пробелы.Из своей Периодической таблицы Менделеев предсказал свойства неизвестных тогда элементов, таких как галлий (элемент 31), германий (32), скандий (21) и технеций (43), представленные промежутками, которые были позже обнаружены, 4 и впоследствии другие, как Генри Мозли5 продолжал расширять Периодическую таблицу, делая прогнозы и заполняя пробелы.
Основное обоснование структуры Периодической таблицы появилось только много лет спустя, когда стала понятна атомная структура и атомный номер (т.е. количество ядерных протонов, эквивалентное номеру элемента), а не атомный вес, стало признанной основой для упорядочивания его членов. Открытие новых элементов и развивающееся теоретическое понимание атомной структуры в конечном итоге привело к добавлению новых блоков лантанидов и актинидов в таблицу, демонстрирующую гибкость системы классификации для адаптации.6
Неизменное доминирующее положение Периодической таблицы в отображении известных элементов (сейчас 118) отражает степень, в которой основные принципы, на которых она построена, составляют, по сути, «стандартную модель» для химии.Фундаментальное понимание, представленное рамкой классификации Менделеева 1869 года, остается неизменным, хотя появляются новые интерактивные7 и трехмерные8,9 презентации. Текущие исследования суператомов (кластеров атомов, обладающих свойствами одного атома другого элемента) 10 привели к предложениям о многомерных периодических таблицах для отображения взаимосвязей11.
Последние несколько десятков элементов, добавленных в Периодическую таблицу, были созданы синтетическим путем с помощью процессов с очень высокой энергией.Все они радиоактивны, распадаются путем деления на более легкие элементы с периодом полураспада от долей секунды (например, элемент 118, оганессон 294 Og, имеет период полураспада менее 1 миллисекунды) до миллионов лет (например, элемент 96, кюрий 247 см). Не ожидается, что на Земле будут обнаружены какие-либо новые стабильные элементы, 12 хотя небольшие количества новых радиоактивных элементов будут продолжать синтезироваться, а «сверхтяжелые» могут образовываться в астрономических событиях, таких как столкновения сверхновых звезд и нейтронных звезд.Однако для повседневного использования не будет новых стабильных строительных блоков, из которых можно было бы вылепить материалы нашего мира. Мы должны научиться наилучшим образом использовать те элементы, которые у нас есть, основываясь на понимании того, что геологические ресурсы конечны и не подлежат возобновлению.
Подавляющее большинство известных стабильных элементов имеют для нас центральное значение в биологическом, технологическом и / или экономическом отношении. По крайней мере, 60 элементов могут быть обнаружены в следовых количествах или более в организме человека, и около 28 из них – четверть Периодической таблицы – считаются играющими активную положительную роль в жизни и здоровье человека.13, 14 Хотя углерод, водород, кислород, азот, фосфор и кальций составляют почти 99% человеческого тела, молекулы и комплексы, содержащие небольшие количества оставшихся используемых элементов, участвуют в широком спектре метаболических функций, в том числе в качестве ферментов, катализаторы и переносчики (например, железо в гемоглобине, которое переносит кислород и углекислый газ). Помимо использования одних и тех же основных строительных блоков, другие организмы могут использовать некоторые другие элементы в своих биохимических процессах (например,грамм. магний в хлорофилле, который фиксирует кислород в растениях).
Существуют большие вариации в общем содержании содержания Периодической таблицы в земной коре (рис. 1) и, что очень важно, также большие вариации в распределении элементов. В то время как некоторые из наиболее распространенных видов очень широко распространены в атмосфере, суше и океанах Земли, другие сконцентрированы в относительно небольшом количестве мест.
Изобилие элементов в земной коре (взято из данных, доступных на веб-сайте Королевского химического общества: Periodic Table7).Разработка технологий разработки минеральных руд была постоянной чертой человеческой истории, и растущее использование различных элементов было основным двигателем экономического роста со времен промышленной революции – и, наряду с расширением добычи и переработки, произошло растущая технологическая способность использовать уникальные характеристики некоторых элементов, которые до сих пор были плохо доступны. Достижения в области использования различных элементов обеспечили такие преимущества, как более сильные магниты, которые используются во многих отраслях промышленности (например,грамм. с использованием редкоземельных металлов (неодима и диспрозия), микропроцессоров меньшего размера (например, галлия и германия), более эффективных солнечных элементов (например, галлия, индия и теллура) и сенсорных экранов (индий, ниобий). Многие современные устройства используют очень широкий спектр элементов и соединений, производных от них. General Electric, одна из крупнейших мировых компаний, использует 72 из первых 82 элементов Периодической таблицы в своих производственных линиях, и многие из этих элементов редки или труднодоступны.15 В другом примере, относящемся к одному типу продукции. В среднем смартфоне можно найти не менее 70 элементов в простой или сложной форме.16
Растущее осознание ограниченных запасов некоторых элементов, которые имеют специализированное и важное применение, отражается в увеличении количества терминов для их описания и руд, из которых они получены, в том числе «полезные ископаемые», «критические элементы» и «находящиеся под угрозой исчезновения элементы. ».17, 18 Некоторые страны приняли политику, учитывающую высокую стратегическую важность некоторых из них для их физической и экономической безопасности.19, 20
В то время как рискам нехватки материалов справедливо уделяется все большее внимание, параллельная проблема, имеющая значительную неотложность, касается воздействия массового расширения использования относительно обильных элементов.Важным подходом к постановке этой проблемы стала разработка концепции планетарных границ, впервые предложенной Рокстремом, Штеффеном и его коллегами в 2009 году и получившей дальнейшее развитие в 2015 году.21, 22 Границы, которые относятся к девяти процессам системы Земли, имеющим решающее значение для устойчивого развития, были было предложено, и в большинстве случаев работа уже определила количественное «безопасное рабочее пространство для человечества», пороговую область в «зоне неопределенности», где есть возрастающий риск, и за пределами этой «зоны высокого риска» серьезный и долгосрочный ущерб окружающей среде планеты (Таблица 1).
Таблица 1. Планетарные границы (данные по исх.)Три границы касаются биогеохимических потоков ключевых элементов, которые относительно многочисленны либо в земной коре (углерод: 0,18%; фосфор: 0,1%), либо в атмосфере (азот: 0,002% в коре и 78% в атмосфере). Ключевая проблема в каждом случае связана с тем, в какой степени промышленное использование способствует серьезным экологическим изменениям.Например:
● Образование парниковых газов в результате сжигания богатых углеродом материалов для производства энергии способствует изменению климата. Концентрация CO 2 в атмосфере уже находится в пороговой области, где возрастает риск глобального потепления. После промышленной революции уровень CO 2 в атмосфере увеличился примерно на 40% в мире, выровнявшись23 в 2014–2016 годах, а затем снова повысившись в 2017–2018 годах из-за увеличения использования нефти и газа.24
● Процесс Хабера-Боша для фиксации атмосферного азота в виде аммиака и производства нитрата аммония и других азотсодержащих удобрений был чрезвычайно важен для повышения урожайности сельскохозяйственных культур и прокормления растущего населения мира в 20 веке.25 Однако, загрязнение атмосферы и воды Земли оксидами и нитратами азота, по оценкам, превысило планетарные границы для активных форм азота примерно в два с половиной раза.
● Параллельно с увеличением использования азота произошло дополнительное увеличение использования фосфора, особенно в фосфорных удобрениях, с одновременным увеличением загрязнения воды из-за сельскохозяйственных стоков. При нынешнем масштабе использования прогнозируется дефицит фосфатов в следующие 50–150 лет, и подчеркивается необходимость «рационального использования фосфора »26.
Вывод из прогнозов Периодической таблицы о границах планет и науки об окружающей среде ясен.Требуются изменения в подходе, которые должны включать в себя лучшее использование критических элементов, сосредоточение внимания на сохранении и переработке имеющихся запасов редких и поиск новых заменителей для конкретных приложений, где это возможно27. Изменения также должны включать поиск способов сокращения использования количество элементов должно быть сведено к минимуму, в то время как гораздо больше внимания следует уделять всему циклу использования, ремонта, модернизации, перепрофилирования, побочных продуктов, отходов и утилизации, чтобы предотвратить нанесение ущерба окружающей среде планеты.Производители могут подумать о том, чтобы повторить обещание Apple в 2017 году делать свои смартфоны полностью из переработанных материалов28. Вдохновением может служить решение29 Токийского оргкомитета Олимпийских и Паралимпийских игр о производстве примерно 5000 золотых, серебряных и бронзовых медалей для использования в Токио. К 2020 году только из бытовой электроники, такой как бывшие в употреблении мобильные телефоны, после того, как переработанные металлы использовались для производства медалей к Играм в Лондоне в 2012 году и Играм в Рио-де-Жанейро в 2016 году.
Переработка и повторное использование имеющихся запасов элементов должны быть важным подходом, который следует учитывать – но хотя человеческий творческий потенциал и изобретательность, несомненно, улучшат возможности для достижения этой цели, это не всегда будет технически или экономически осуществимо, и, когда это возможно, потребуется капитальный пересмотр многих производственных процессов и производственных моделей.Следовательно, ограниченный планетарный запас некоторых элементов может в конечном итоге стать широко рассредоточенным в неизвлекаемых формах. Жизненно важен подход «системного мышления» 30, при котором соображения науки, техники, экономики и воздействия на окружающую среду интегрированы в целостное представление.
Обеспечение устойчивого развития планеты требует, чтобы мы срочно узнали, как лучше распоряжаться ограниченным запасом элементарных строительных блоков Земли, внесенных в список в Периодической таблице. внимание к сохранению запасов и материалов и повышение осведомленности о неблагоприятных последствиях того, как мы их эксплуатируем.Поскольку наука об атомах и молекулах и наследница периодической таблицы Менделеева, химия играет центральную роль в обеспечении такого лучшего управления.
Благодарности
Эта статья была написана на семинаре в Намюре в 2018 г., организованном Международной организацией по химическим наукам в разработке (IOCD) при поддержке Gesellschaft Deutscher Chemiker и Королевского химического общества. Мы благодарим Йохана Янса (Университет Намюра) за создание рисунка 1.
Новый химический элемент в Периодической таблице – ScienceDaily
Элемент 112, обнаруженный в GSI Helmholtzzentrum für Schwerionenforschung (Центр исследований тяжелых ионов) в Дармштадте, был официально признан новым элементом Международным союзом чистых и чистых веществ. Прикладная химия (ИЮПАК). ИЮПАК подтвердил признание элемента 112 в официальном письме главе исследовательской группы профессору Сигурду Хофманну. Письмо также просит первооткрывателей предложить имя для нового элемента.
Их предложение будет представлено в течение следующих недель. Примерно через 6 месяцев, после того как предложенное название будет тщательно оценено ИЮПАК, элемент получит свое официальное название. Новый элемент примерно в 277 раз тяжелее водорода, что делает его самым тяжелым элементом в периодической таблице.
«Мы рады, что теперь шестой элемент – а значит, и все элементы, открытые в GSI за последние 30 лет – был официально признан. В течение следующих нескольких недель ученые группы открытий будут обсуждать название нового элемента », – говорит Сигурд Хофманн.21 ученый из Германии, Финляндии, России и Словакии участвовал в экспериментах по открытию нового элемента 112.
Уже в 1996 году международная группа профессора Сигурда Хофманна создала первый атом элемента 112 с помощью ускорителя в GSI. В 2002 году они смогли произвести еще один атом. Последующие эксперименты на ускорителе японского ускорителя RIKEN дали больше атомов элемента 112, что недвусмысленно подтвердило открытие GSI.
Чтобы произвести атомы элемента 112, ученые ускоряют заряженные атомы цинка – для краткости ионы цинка – с помощью 120-метрового ускорителя частиц в GSI и «стреляют» ими по свинцовой мишени.Ядра цинка и свинца сливаются в ядерном синтезе, образуя ядро нового элемента. Его так называемый атомный номер 112, отсюда и предварительное название «элемент 112», представляет собой сумму атомных номеров двух исходных элементов: цинк имеет атомный номер 30 и ведущий атомный номер 82. Атомный номер элемента указывает номер протонов в его ядре. Нейтроны, которые также находятся в ядре, не влияют на классификацию элемента. 112 электронов, вращающихся вокруг ядра, определяют химические свойства нового элемента.
С 1981 года эксперименты на ускорителях GSI привели к открытию шести химических элементов с атомными номерами от 107 до 112. GSI уже назвала свои официально признанные элементы от 107 до 111: элемент 107 называется бориум, элемент 108 – калий, элемент 109 – мейтнерий. , элемент 110 Дармштадций, а элемент 111 называется Рентгением.
История Источник:
Материалы предоставлены GSI Helmholtzzentrum für Schwerionenforschung . Примечание. Содержимое можно редактировать по стилю и длине.
118 Элементы, их символы и атомные номера
[Изображение будет загружено в ближайшее время]
Современная периодическая таблица Менделеева сегодня состоит всего из 118 элементов. Поскольку имена элементов могут быть длинными и сложными в использовании, они обозначаются символом. Каждый элемент имеет уникальный символ.
Что означает символ?
Символ – это обозначение, которое обычно состоит из одной или двух букв, которое используется для обозначения химического элемента.Также есть символы, состоящие из 3 букв. Это недавно синтезированные элементы, и они временно так названы. Есть определенные правила, связанные с написанием символа. Первая буква символа всегда пишется с заглавной буквы, а вторая (или третья) буква всегда пишется в нижнем регистре. Например, Ca для кальция, He для гелия и т. Д. Если символ элемента состоит только из одной буквы, он всегда пишется в верхнем регистре.
Например, – N для азота, O для кислорода и т. Д.
Символы чаще всего используются для обозначения элементов в периодической таблице.Химические формулы и уравнения также представлены с использованием этих символов. Без символов было бы непросто представить все эти 118 элементов и бесчисленное количество соединений, которые они образуют. В следующей таблице приведен список из 118 элементов с их символами и атомными номерами.
118 Элемент, их символы и атомный номер (таблица)
Элемент | Атомный номер | Символ | |||||
75 1 Водород | H | ||||||
Гелий | 2 | He | |||||
Литий | 3 | 91035Be | |||||
Бор | 5 | B | |||||
Углерод | 6 | 5 C75 C | 75 7 | N | |||
Кислород | 8 | O | |||||
Фтор | 9 | F | |||||
| 5 Ne4 | |||||||
Натрий | 11 | Na | |||||
Магний | 12 | Mg 50505 Al | |||||
Кремний | 14 | Si | |||||
Фосфор | 15 | P04 | S | ||||
Хлор | 17 | Класс | |||||
Аргон | 18 | Ar | |||||
4 3 | |||||||
Кальций | 20 | Ca | |||||
Скандий | 21 | Sc | |||||
75 Титан | |||||||
Ванадий | 23 | V | |||||
Хром | 24 | Cr | |||||
Я ron | 26 | Fe | |||||
Кобальт | 27 | Co | |||||
Никель03 | 29 | Cu | |||||
Цинк | 30 | Zn | |||||
Галлий | 03Германий | 32 | Ge | ||||
Мышьяк | 33 | As | |||||
4 34103 | |||||||
4 349 Селен | |||||||
Бром | 9010 1Br | ||||||
Криптон | 36 | Kr | |||||
Рубидий | 37 | 0337 | 03 R90038 | Sr | |||
Иттрий | 39 | Y | |||||
Цирконий | 910141 | Nb | |||||
Молибден | 42 | Mo | |||||
Технеций | 03|||||||
| 9007 5 44 | Ru | ||||||
Родий | 45 | Rh | |||||
Палладий | 103 | 03104 | 03104 | 0347 | Ag | ||
Кадмий | 48 | Cd | |||||
Индий | 75 | Индий | 75 | 0375 | 0350 | Sn | |
Сурьма | 51 | Sb | |||||
Теллур 35 Teллур | 9103|||||||
53 | 90 101|||||||
Ксенон | 54 | Xe | |||||
Цезий | 55 | 4 | Cs | Cs | Ba | ||
Лантан | 57 | La | |||||
Церий | 58 | 910358 | 75 Ce | 75 Ce | Pr | ||
Неодим | 60 | Nd | |||||
Прометий | 0 61 | 033 | Самолет | P62 | ю. м | ||
Европий | 63 | Eu | |||||
Гадолиний | 64 | Gd | Gd | Gd | |||
Диспрозий | 66 | Dy | |||||
Гольмий | 67 | 104 3 | Er | ||||
Тулий | 69 | Tm | |||||
Иттербий | 70 | 9103Yb | Лю 9 0104 | ||||
Гафний | 72 | Hf | |||||
Тантал | 73 | Ta | Ta | ||||
Рений | 75 | Re | |||||
Осмий | 76 | Os | Os | ||||
Платина | 78 | Pt | |||||
Золото | 79 | Au | Au | ||||
81 | Tl | ||||||
Свинец | 82 | Pb | |||||
75 | |||||||
75 Bismuth4 | |||||||
Полоний | 84 | Po | |||||
Астатин | 85 | Ат | |||||
75 Радон | |||||||
75 Радон | |||||||
Франций | 87 | Fr | |||||
Радий | 88 | Ra | 0303 | 0 | |||
торий | 90 | Th | |||||
Протактиний | 91 | Па | |||||
Уран03 | Нептуний93 | Np | |||||
Плутоний | 94 | Pu | |||||
9103 | |||||||
Америций | 0396 | Cm | |||||
Berkelium | 97 | Bk | |||||
4 | |||||||
4 | Эйнштейний | 99 | Es | ||||
Фермий | 100 | Fm | |||||
Менделевий00104 55 Нобелий | 102 | № | |||||
Лоуренсий | 103 | Lr | |||||
Rutherford4 3 | |||||||
105 | Db | ||||||
Сиборгий | 106 | Sg | |||||
4 4 | га ssium | 108 | HS | ||||
Meitnerium | 109 | Mt | |||||
3 | Рентгениум | 111 | Rg | ||||
Коперниций | 112 | Cn | 3 | ||||
3 Nhonium 4 | Флеровий | 114 | Fl | ||||
Московий | 115 | Mc | |||||
3 | |||||||
3 Livermor 116 | |||||||
Tennessine | 117 | Ts | |||||
Oganesson | 118 | Og |
все элементы и теперь знаем свои элементы 9000Кто-то может спросить: «Как происходит символ элемента?» В таблице выше мы видим, что большинство символов являются производными от имен элементов, взяв первые или первые две буквы из английского названия элемента. Но мы также можем видеть, что многие символы не соответствуют этому шаблону. Это потому, что символы некоторых элементов происходят от их латинских или греческих названий. Например, латинское название золота – aurum. Следовательно, он обозначается Au. Иногда элементы также называют в честь ученых или географического места, где они были обнаружены.Новые элементы временно именуются в соответствии с их атомными номерами. Например, элемент с атомным номером 110 был назван un un nilium с символом «Uun», теперь его имя Ds. Что касается студентов, важно изучить все 118 элементов с их символом и валентностью.
Валентность элемента
Чтобы достичь наиболее стабильной конфигурации, то есть благородного газа, атом элемента пытается получить или потерять электроны. Эта способность атома приобретать или терять электроны для достижения стабильной конфигурации или конфигурации инертного газа называется валентностью элемента.Количество электронов во внешней оболочке называется валентными электронами, а самая внешняя оболочка называется валентной оболочкой. Валентность элемента определяется количеством электронов в валентной оболочке. Важно знать атомный номер и электронную конфигурацию элемента, чтобы определить его валентность.
Атомный номер
Понятие атомного номера и валентности можно понять, только если вы знаете, из чего именно состоят элементы. Элемент состоит из одного типа атомов.Атом – это мельчайшая неделимая единица материи. Он состоит из электронов, протонов и нейтронов. Центр атома, также называемый ядром, заряжен положительно и состоит из протонов и нейтронов. Протоны заряжены положительно. Нейтроны нейтральны, потому что на них нет заряда. Ядро окружено отрицательно заряженными электронами.
Сумма протонов и нейтронов дает атомную массу элемента. Атомный номер – это общее количество протонов, присутствующих в ядре атома.Обозначается буквой Z. Химические свойства элемента определяются количеством протонов в ядре. Вот почему знание атомных номеров важно для понимания химии элементов.
Часы ChemTime
Часы ChemTime Часы с химическими элементами
Если вы хотите, чтобы часы ChemTime повесили на стену, вы можете приобрести их в магазине Educational Innovations .
Химические элементы
Все материалы, твердые, жидкие или газовые, состоят из атомов. Атомы самые маленькие кусочки материи. Ученые обнаружили более 100 различных видов атомов. Многие различные материалы, с которыми мы сталкиваемся, состоят из комбинаций этих атомов. Материал в в котором все атомы одного вида, называется элементом. Таким образом, существует более 100 разные элементы.
Каждому элементу присвоен номер, называемый его атомным номером.Во время химии часы, цифры заменены символами соответствующего элемента.
| Атомный номер | Обозначение | Элемент | |
| 1 | H | водород | Водород – самый легкий и самый распространенный атом во Вселенной. |
| 2 | He | гелий | Гелий был впервые обнаружен на Солнце, и его название происходит от древнегреческое слово, обозначающее солнце. |
| 3 | Ли | литий | Литий – самый легкий металл, поэтому при свете он плавает в воде (и реагирует с водой тоже). |
| 4 | Be | бериллий | Бериллий входит в состав драгоценных камней: берилла, изумруда и аквамарина. |
| 5 | В | бор | Бор содержится в буре, которая обычно используется для смягчения воды в стиральные порошки. |
| 6 | С | углерод | И алмаз, и графит являются чистым углеродом, как и недавно обнаруженные бакиболлы. |
| 7 | N | азот | Азот – основной компонент воздуха. |
| 8 | O | кислород | Кислород – второй по распространенности элемент на Земле (после кремния). |
| 9 | F | фтор | Фтор используется для изготовления зубной пасты с фтором. |
| 10 | Ne | неон | Неон – это газ, который светится красно-оранжевым светом, когда через него проходит электричество. неоновые вывески. |
| 11 | Na | натрий | Натрий – один из двух элементов в поваренной соли (другой – хлор). |
| 12 | мг | магний | Магний – легкий металл, и его сплавы используются в “магические” колеса на спорткарах. |
| 13 | Al | алюминий | Металлический алюминий реагирует с кислородом, но образует оксид покрытие защищает его от дальнейшей реакции. |
| 14 | Si | кремний | Кремний – самый распространенный элемент в земных поверхность; он используется в производстве электронных полупроводников. |
| 15 | П | фосфор | Фосфор – неметалл и необходим во всех биологических организмы. |
| 16 | S | сера | Сера представляет собой твердое вещество желтого цвета, основным промышленным соединением которого является серная кислота. |
| 17 | Cl | хлор | Хлор – зеленый газ, но растворенный в воде эффективное дезинфицирующее средство. |
| 18 | Ar | аргон | Аргон – инертный газ, и он используется для наполнения света. лампочки, чтобы горячая нить не пригорела. |
| 19 | К | калий | Калий – это металл, который вступает в реакцию с водой, и его соединения необходимы живым организмам. |
| 20 | Ca | кальций | Кальций – это металл, и он является важным компонентом кости и зубы. |
| 21 | Sc | скандий | Скандий – очень редкий элемент, поэтому дорого и мало использует. |
| 22 | Ti | титан | Титан – это металл, а диоксид титана – белый пигмент, используемый в большинстве красок. |
| 23 | В | ванадий | Ванадий – это металл, который добавляют в сталь для получения более прочный и термостойкий. |
| 24 | Cr | хром | Хром – это металл, соединения которого бывают разных цветов, что является причиной для имени элемента. |
Часы ChemTime были представлены в путеводителе по праздничным подаркам 2011 года от Фонда химического наследия.
Ознакомьтесь с периодической таблицей Chemicool для получения дополнительной информации об элементах.
Статью профессора Шахашири о свинце элемента можно найти, нажав на свинец в этой периодической таблице. здесь.
Интересная Flash анимация про элементы
Страница с множеством вариаций таблицы Менделеева
Домашняя страница “Вернуться в науку – это весело”.
Четыре новых элемента завершают седьмую строку периодической таблицы | Наука
Страна: Страна * AfghanistanAland IslandsAlbaniaAlgeriaAndorraAngolaAnguillaAntarcticaAntigua и BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBolivia, многонациональное государство ofBonaire, Синт-Эстатиус и SabaBosnia и HerzegovinaBotswanaBouvet IslandBrazilBritish Индийский океан TerritoryBrunei DarussalamBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCape VerdeCayman IslandsCentral африканских RepublicChadChileChinaChristmas IslandCocos (Килинг) IslandsColombiaComorosCongoCongo, Демократическая Республика theCook IslandsCosta RicaCote D’IvoireCroatiaCubaCuraçaoCyprusCzech RepublicDenmarkDjiboutiDominicaDominican RepublicEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEthiopiaFalkland острова (Мальвинские ) Фарерские острова, Фиджи, Финляндия, Франция, Французская Гвиана, Французская Полинезия, Французские Южные территории, Габон, Гамбия, Грузия, Германия, Гана, Гибралтар, Греция, Гренландия, Гренада, Гваделупа, Гватемала, Гернси, Гвинея, Гвинея-Бисау, Гайана, Гаити, Остров Херд и МакДональда IslandsHoly Престол (Ватикан) HondurasHong KongHungaryIcelandIndiaIndonesiaIran, Исламская Республика ofIraqIrelandIsle из ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKorea, Корейская Народно-Демократическая Республика ofKorea, Республика ofKuwaitKyrgyzstanLao Народная Демократическая RepublicLatviaLebanonLesothoLiberiaLibyan Арабская JamahiriyaLiechtensteinLithuaniaLuxembourgMacaoMacedonia, бывшая югославская Республика ofMadagascarMalawiMalaysiaMaldivesMaliMaltaMartiniqueMauritaniaMauritiusMayotteMexicoMoldova, Республика ofMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmarNamibiaNauruNepalNetherlandsNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorwayOmanPakistanPalestinianPanamaPapua Новый GuineaParaguayPeruPhilippinesPitcairnPolandPortugalQatarReunionRomaniaRussian FederationRWANDASaint BarthélemySaint Елены, Вознесения и Тристан-да-КуньяСент-Китс и НевисСент-ЛюсияСент-Мартен (французская часть) Сен-Пьер и МикелонСент-Винсент и ГренадиныСам oaSan MarinoSao Том и PrincipeSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint Маартен (Голландская часть) SlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSouth Джорджия и Южные Сандвичевы IslandsSouth SudanSpainSri LankaSudanSurinameSvalbard и Ян MayenSwazilandSwedenSwitzerlandSyrian Arab RepublicTaiwanTajikistanTanzania, Объединенная Республика ofThailandTimor-LesteTogoTokelauTongaTrinidad и TobagoTunisiaTurkeyTurkmenistanTurks и Кайкос IslandsTuvaluUgandaUkraineUnited арабского EmiratesUnited KingdomUnited StatesUruguayUzbekistanVanuatuVenezuela, Боливарианская Республика ofVietnamVirgin остров, BritishWallis и Футуна Западная Сахара Йемен Замбия Зимбабве
Пожертвовать сейчасПоддержка некоммерческой научной журналистики
Если мы чему-то научились из пандемии COVID-19, так это тому, что мы не можем дождаться реакции кризиса. Science и AAAS неустанно работают над предоставлением достоверной, основанной на фактах информации о последних научных исследованиях и политике с широким бесплатным освещением пандемии. Ваш не подлежащий налогообложению вклад играет решающую роль в поддержании этих усилий.
Раскрытие благотворительной информации| 9 октября 2019 г. | |
| ( Nanowerk Spotlight ) Периодическая таблица химических элементов – одно из самых значительных достижений в науке, отражающее суть не только химии, но также физики, медицины, наук о Земле и биологии.1869 год считается годом открытия Периодической системы, и Дмитрий Менделеев был одним из ее первооткрывателей. | |
| Учитывая, что в 2019 году исполняется 150 лет Периодической таблице Менделеева, Генеральная Ассамблея Организации Объединенных Наций и ЮНЕСКО провозгласили Международным годом Периодической таблицы химических элементов (IYPT2019), отмечая его на собственном веб-сайте. | |
| Таблица Менделеева – уникальный инструмент, позволяющий ученым предсказывать внешний вид и свойства материи на Земле и во Вселенной. | |
| Элементы – это фундаментальные субстанции, из которых состоят все вещества. В настоящее время существует 118 элементов, причем первые 94 элемента встречаются в природе, а остальные 24 были синтезированы только в лабораториях или ядерных реакторах. | |
| Простая таблица Менделеева. Изображение показывает группу / период в обратном порядке; периоды – горизонтальные строки, группы – вертикальные столбцы. (щелкните изображение, чтобы увеличить) | |
| В периодической таблице периоды показаны в виде горизонтальных строк, а группы – в вертикальных столбцах.Элементы в один и тот же период имеют одинаковое количество орбиталей. Периоды характеризуются количеством энергетических уровней (оболочек) электронов, окружающих ядро. Элементы в одной группе имеют одинаковое количество электронов на орбите и обладают схожими свойствами. | |
| «Различные элементы играли решающую роль в разные периоды деятельности человека, при этом кремний (Si) в настоящее время является ключевым элементом», – сказал Евгений А. Гудилин, профессор M.МГУ им. В. Ломоносова, – рассказывает Нановерк. «Однако век нанотехнологий привлек внимание к различным элементам и изменил их роль в науке и технологиях». | |
| В статье «Перспектива» в ACS Nano («Нанотехнологические аспекты периодической таблицы»). of Elements »), Гудилин вместе с профессорами Полом С. Вайсом и Юрием Гогоци кратко обсуждают наиболее важные элементы с точки зрения нанотехнологий и их применения в наноматериалах. | |
| Авторы обнаружили, что наиболее востребованные и полезные нанотехнологические элементы сосредоточены в s- и p-блоках (см. Рисунок ниже), причем преобладающими наноэлементами являются неметаллы C, N, O и Si в p-блоке, а также H и Li. в s-блоке. | |
| Частота использования химических элементов таблицы Менделеева в нанотехнологиях. Сюжет построен с использованием экспертных заключений и анализа публикаций ACS Nano; более высокие неоновые светящиеся полосы коррелируют с вкладом элементов в область нанотехнологий; зеленые клетки обозначают радиоактивность; а семейства f-элементов не показаны, они отмечены буквами «La» и «Ac».(Печатается с разрешения Американского химического общества) (щелкните изображение, чтобы увеличить) | |
| «Рост атомного номера в периоды таблицы приводит к уплотнению атомных радиусов и увеличению потенциала ионизации», – объясняет Гудилин. «Кроме того, p-электроны вступают в игру во втором периоде таблицы элементов, что приводит к образованию прочных ориентированных ковалентных связей для большинства соединений B, C, N и O и анионных образований для электроотрицательных O и F. p-Электроны приводят к сопряженным π-связям в дополнение к σ-связям, и эта новая способность приводит к большому количеству неорганических полимеров.” | |
| Авторы отмечают, что «главный урок нанотехнологии состоит в том, что индивидуальность элемента важнее периодичности; известные« похожие »элементы на самом деле нанотехнологически непохожи и, в большинстве случаев, не подлежат замене, как мы привыкли представлять в традиционных науках. Таким образом, большинство элементов, за исключением обычных наноматериалов, имеют более узкие, но все же важные области использования в нанотехнологиях ». | |
| В результате около 30 из 118 первичных элементов пользуются большим спросом для различных одно-, двух- и трехмерных (1D, 2D, 3D) наноматериалов, которые формируются для B, C и N, включая графен. или аналоги, имитирующие BN, нанотрубки, фуллерены, MXenes, C3N4, наноалмазы и т. д. | |
| Эта группа является крупнейшим и наиболее быстрорастущим классом наноматериалов, возникшим в результате революции в нанотехнологиях и связанного с ней стремительного роста нанотехнологических архитектур, используемых при создании суперконденсаторов, батарей, молекулярной электроники, топливных элементов, датчиков и современных строительных материалов. | |
| «150-летняя периодическая таблица элементов помогает нам оценить химическое разнообразие элементов в поисках эффективных комбинаций элементов для производства новых наноматериалов», – заключают Гудилин, Вайс и Гогоци.«Разнообразие элементов в периодической таблице будет способствовать дальнейшему инновационному развитию нанонауки и нанотехнологий». | |
| Автор Майкл Бергер – Майкл является автором трех книг Королевского химического общества: Нано-общество: раздвигая границы технологий, Нанотехнологии: будущее крошечное и Наноинженерия: навыки и инструменты, которые делают технологии невидимыми Авторские права © Nanowerk | |
Информационный бюллетень NanowerkПолучайте наши новости о нанотехнологиях на свой почтовый ящик! Спасибо!Вы успешно присоединились к нашему списку подписчиков. | |


 Макояна А. С.]. – Москва : Аванта : Изд-во АСТ, 2020. – 204, [1] с. : ил. – (Наука для всех). – Авт. и пер. указ. в вып. дан. – 2000 экз. – ISBN 978-5-17-114752-5
Макояна А. С.]. – Москва : Аванта : Изд-во АСТ, 2020. – 204, [1] с. : ил. – (Наука для всех). – Авт. и пер. указ. в вып. дан. – 2000 экз. – ISBN 978-5-17-114752-5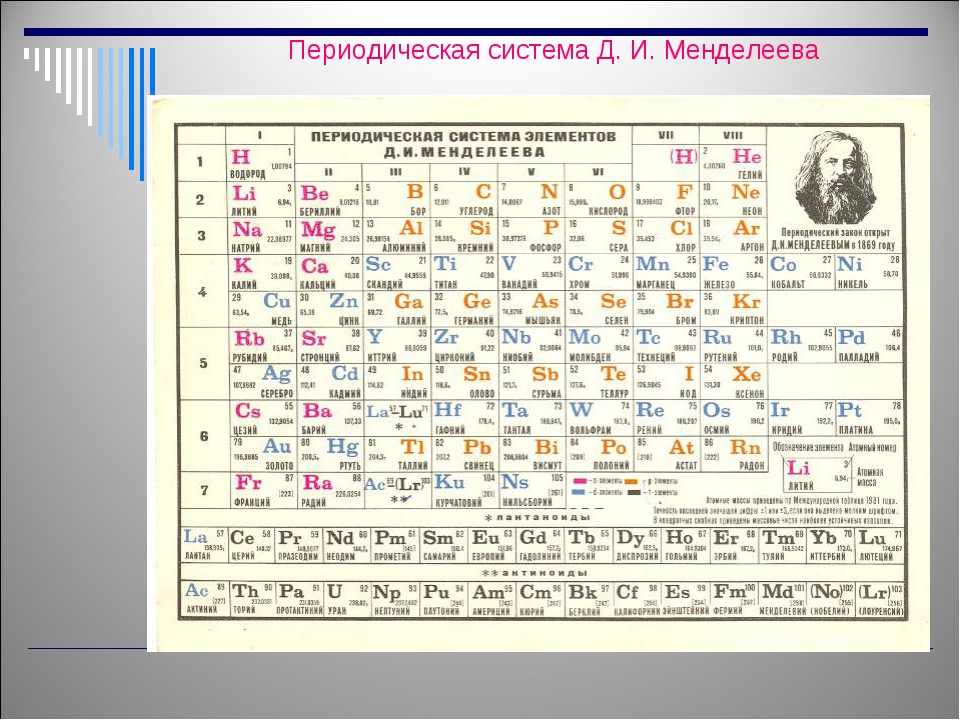
 – (Простая наука для детей). – Авт. указ. в вып. дан. – 4000 экз. – ISBN 978-5-17-105368-0
– (Простая наука для детей). – Авт. указ. в вып. дан. – 4000 экз. – ISBN 978-5-17-105368-0
