ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ | Энциклопедия Кругосвет
Содержание статьиПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ представляет собой классификацию химических элементов в соответствии с периодическим законом, устанавливающим периодическое изменение свойств химических элементов по мере увеличения их атомной массы, связанного с увеличением заряда ядра их атомов; поэтому заряд ядра атома совпадает с порядковым номером элемента в периодической системе и называется атомным номером элемента. Периодическая система элементов оформляется в виде таблицы (периодическая таблица элементов), в горизонтальных рядах которой – периодах – происходит постепенное изменение свойств элементов, а при переходе от одного периода к другому – периодическое повторение общих свойств; вертикальные столбцы – группы – объединяют элементы со сходными свойствами. Периодическая система позволяет без специальных исследований узнать о свойствах элемента только на основании известных свойств соседних по группе или периоду элементов.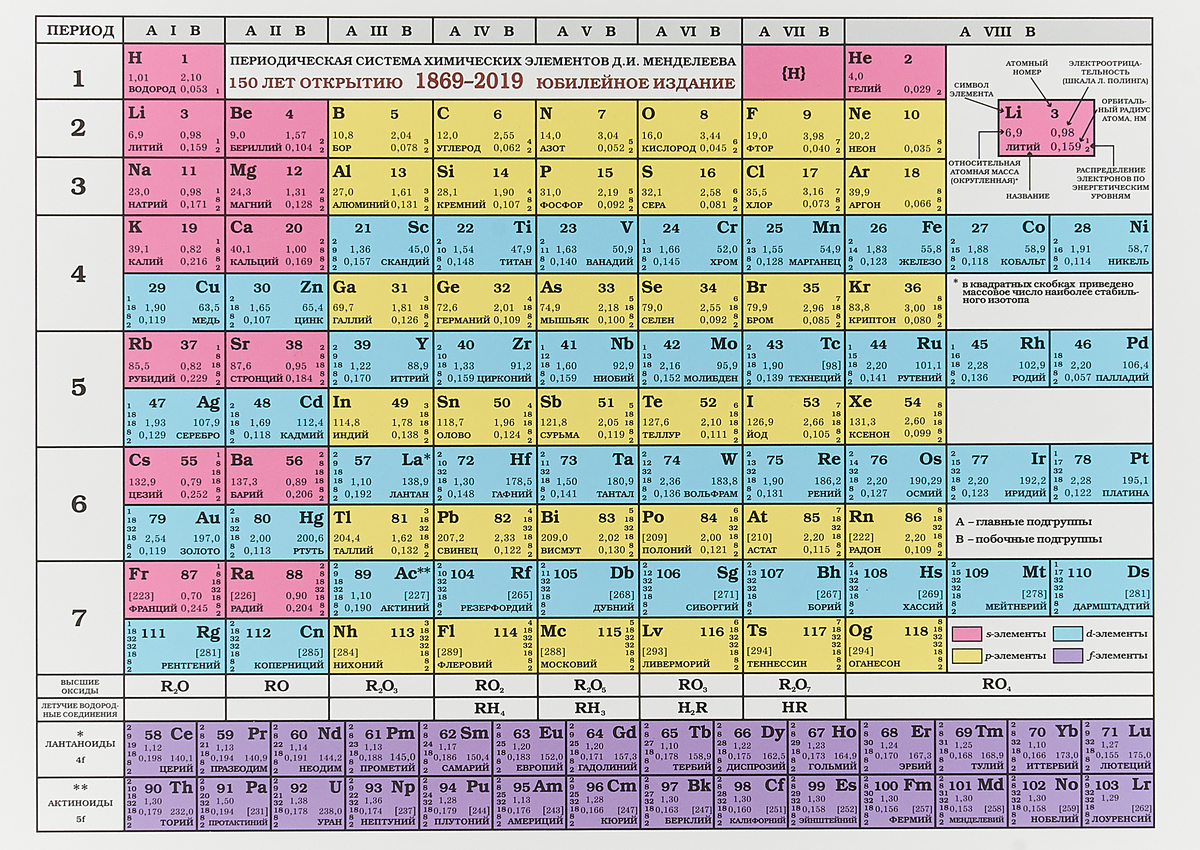
В конце 18 и начале 19 вв. химики пытались создавать классификации химических элементов в соответствии с их физическими и химическими свойствами, в частности на основе агрегатного состояния элемента, удельного веса (плотности), электропроводности, металличности – неметалличности, основности – кислотности и т.д.
Классификации по «атомному весу»
(т.е. по относительной атомной массе).
Гипотеза Праута.
 У.Праут в 1815 предположил, что атомные веса всех элементов связаны простыми кратными отношениями с атомным весом водорода. Но более точные определения атомных весов, выполненные Ж.Дюма и особенно Берцелиусом, а впоследствии и Ж.Стасом, разрушили гипотезу Праута, так как были получены дробные величины атомных весов. И только в начале 20 в., когда стало известно строение атома, идеи Праута возродились.
У.Праут в 1815 предположил, что атомные веса всех элементов связаны простыми кратными отношениями с атомным весом водорода. Но более точные определения атомных весов, выполненные Ж.Дюма и особенно Берцелиусом, а впоследствии и Ж.Стасом, разрушили гипотезу Праута, так как были получены дробные величины атомных весов. И только в начале 20 в., когда стало известно строение атома, идеи Праута возродились.Триады Доберейнера.
И.Доберейнер в 1816–1829 установил, что для триад сходных элементов, таких, как Cl, Br, I и Ca, Sr, Ba, атомные массы и величины некоторых физических свойств находятся в арифметической прогрессии и для каждого второго элемента свойство можно предсказать как среднее между свойствами двух крайних. Существование такой прямой взаимосвязи для всех элементов казалось вероятным, но количественная оценка была невозможна из-за путаницы между атомными и эквивалентными весами до тех пор, пока С.Канниццаро в 1858 не пересмотрел величины атомных весов.
Октавы Ньюлендса.
Периодический закон.
Два других химика, русский ученый Д.И.Менделеев и немецкий ученый Л.Мейер независимо друг от друга предложили классификацию элементов в виде семейств, в которых периодически повторяются сходные свойства, когда элементы расположены в порядке увеличения атомного веса. Оба опубликовали свои таблицы (Менделеев – в 1869, а Мейер – в 1870) и дали формулировку нового открытого периодического закона.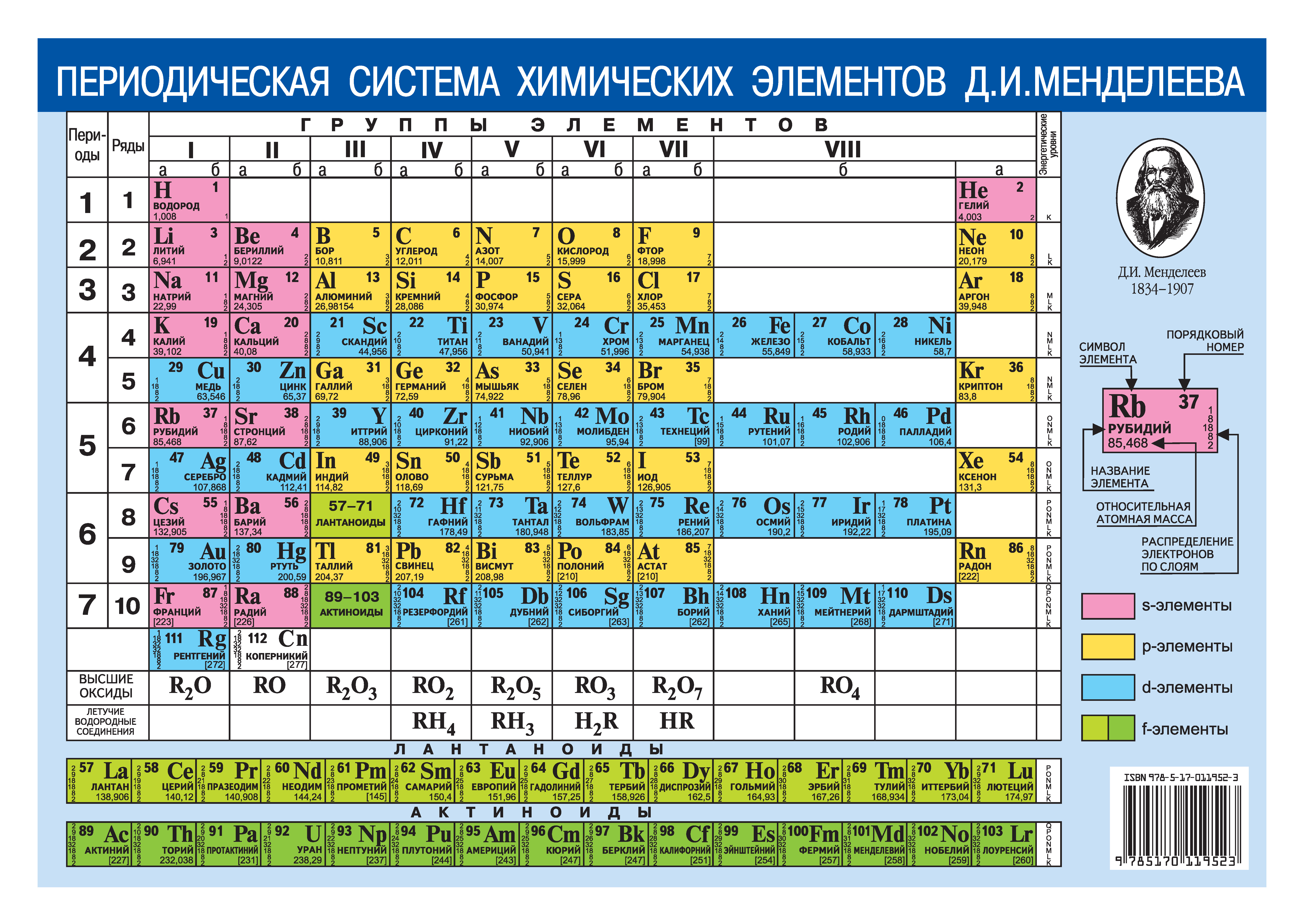
Периодическая таблица.
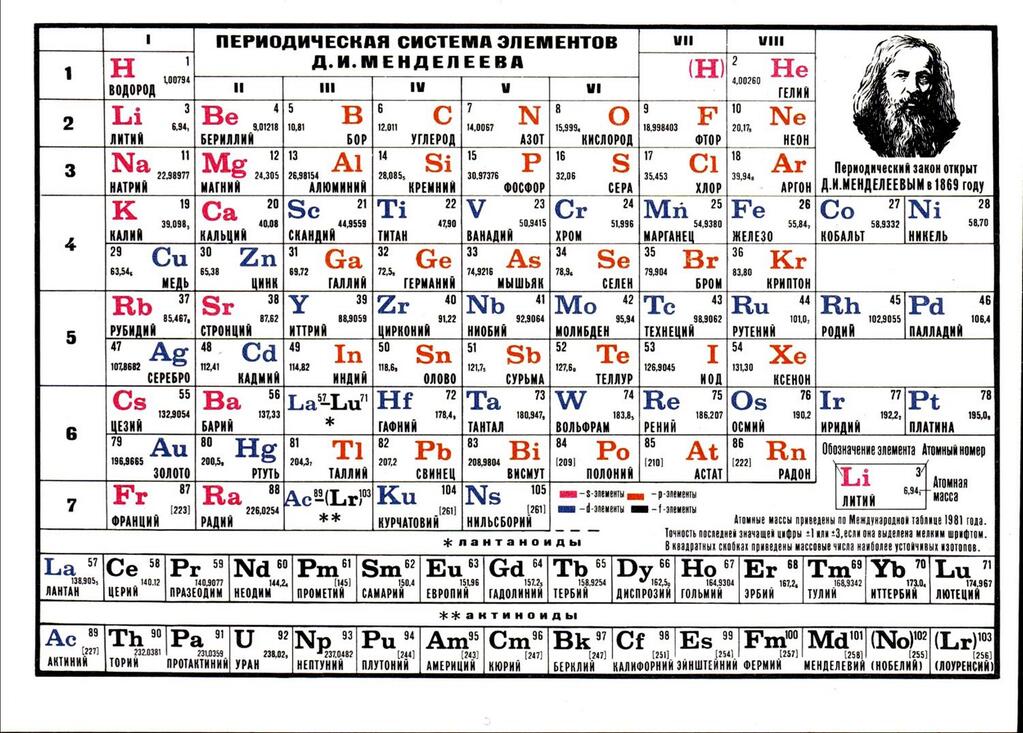
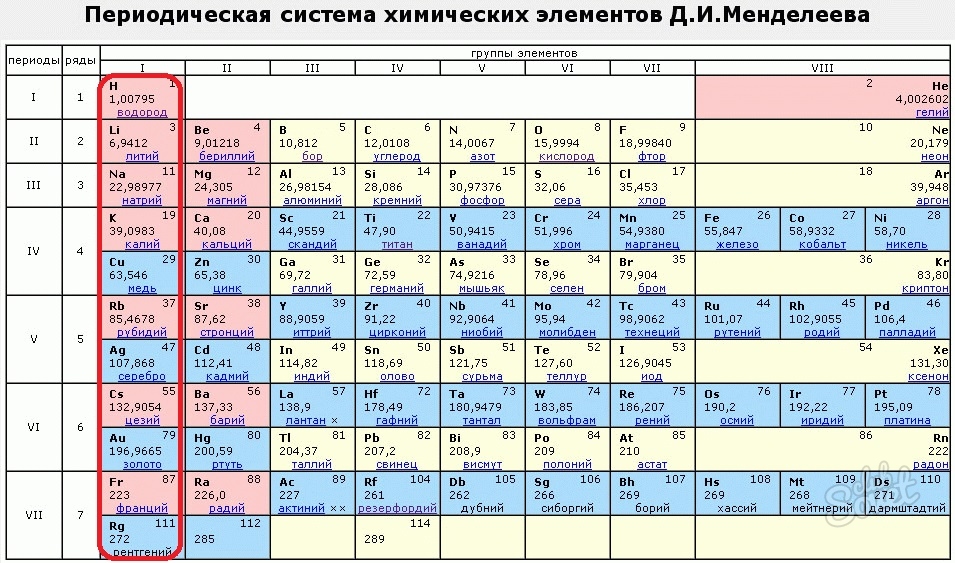
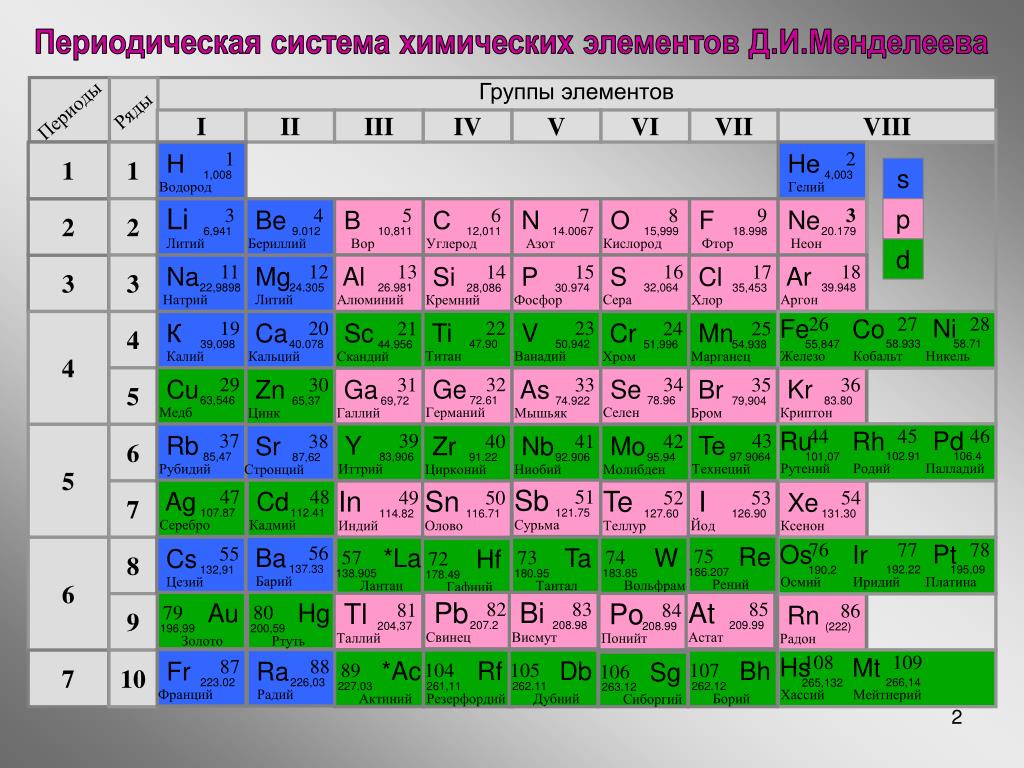
Менделеев расположил элементы в порядке увеличения их атомного веса и в 1869 предложил таблицу размещения семейств элементов (табл. 1). Модифицированная форма таблицы (табл. 2), в которой семейства (группы) элементов расположены в колонках, была предложена им в 1871 и существует до настоящего времени. Наряду с ней получила распространение развернутая форма таблицы.
| Таблица 1. ПЕРИОДИЧЕСКАЯ ТАБЛИЦА ЭЛЕМЕНТОВ, ОПУБЛИКОВАННАЯ МЕНДЕЛЕЕВЫМ В 1869 (первая версия) | |||||
| Ti = 50 | Zr = 90 | ? = 180 | |||
| V = 51 | Nb = 94 | Ta = 182 | |||
| Cr = 52 | Mo = 96 | W = 186 | |||
| Mn = 55 | Rh = 104,4 | Pt = 197,4 | |||
| Fe = 56 | Ru = 104,4 | Ir = 198 | |||
| Ni = | Co = 59 | Pd = 106,6 | Os = 199 | ||
| H = 1 | Cu = 63,4 | Ag = 108 | Hg = 200 | ||
| Be = 9,4 | Mg = 24 | Zn = 65,2 | Cd = 112 | ||
| B = 11 | Al = 27,4 | ? = 68 | Ur = 116 | Au = 197? | |
| C = 12 | Si = 28 | ? = 70 | Sn = 118 | ||
| N = 14 | P = 31 | As = 75 | Sb = 122 | Bi = 210? | |
| O = 16 | S = 32 | Se = 79,4 | Te = 128? | ||
| F = 19 | Cl = 35,5 | Br = 80 | I = 127 | ||
| Li = 7 | Na = 23 | K = 39 | Rb = 85,4 | Cs = 133 | Tl = 204 |
| Ca = 40 | Sr = 87,6 | Ba = 137 | Pb = 207 | ||
| ? = 45 | Ce = 92 | ||||
| ?Er = 56 | La = 94 | ||||
| ?Yt = 60 | Di = 95 | ||||
| ?In = 75,6 | Th = 118 | ||||
| Таблица 2. МОДИФИЦИРОВАННАЯ ТАБЛИЦА МЕНДЕЛЕЕВА | |||||||||||||||||||||||||
| Группа | II | III | IV | V | VI | VII | VIII | 0 | |||||||||||||||||
| Формула оксида или гидрида Подгруппа | R2O А В | RO А В | R2O3 В А | RH4 RO2 В А | RH3 R2O5 В А | RH2 RO3 В А | RH R2O7 В А | ||||||||||||||||||
| Период 1 | 1 H Водород 1,0079 | 2 He Гелий 4,0026 | |||||||||||||||||||||||
| Период 2 | 3 Li Литий 6,941 | 4 Be Бериллий 9,0122 | B Бор 10,81 | 6 C Углерод 12,011 | 7 N Азот 14,0067 | 8 O Кислород 15,9994 | 9 F Фтор 18,9984 | 10 Ne Неон 20,179 | |||||||||||||||||
| Период 3 | 11 Na Натрий 22,9898 | 12 Mg Магний 24,305 | 13 Al Алюминий 26,9815 | 14 Si Кремний 28,0855 | 15 P Фосфор 30,9738 | 16 S Сера 32,06 | 17 Cl Хлор 35,453 | 18 Ar Аргон 39,948 | |||||||||||||||||
| Период 4 | 19 K Калий 39,0983 29 Cu Медь 63,546 | 20 Ca Кальций 40,08 30 Zn Цинк 65,39 | 21 Sc Скандий 44,9559 31 Ga Галлий 69,72 | 22 Ti Титан 47,88 32 Ge Германий 72,59 | 23 V Ванадий 50,9415 33 As Мышьяк 74,9216 | 24 Cr Хром 51,996 34 Se Селен 78,96 | 25 Mn Марганец 54,9380 35 Br Бром 79,904 | 26 Fe Железо 55,847 | 27 Co Кобальт 58,9332 | 28 Ni Никель 58,69 | 36 | ||||||||||||||
| Период 5 | 37 Rb Рубидий 85,4678 47 Ag Серебро 107,868 | 38 Sr Стронций 87,62 48 Cd Кадмий 112,41 | 39 Y Иттрий 88,9059 49 In Индий 114,82 | 40 Zr Цирконий 91,22 50 Sn Олово 118,69 | 41 Nb Ниобий 92,9064 51 Sb Сурьма 121,75 | 42 Mo Молибден 95,94 52 Te Теллур 127,60 | 43 Tc Технеций [97] 53 I Иод 126,9044 | 44 Ru Рутений 101,07 | 45 Rh Родий 102,9055 | 46 Pd Палладий 106,4 | 54 | ||||||||||||||
| Период 6 | 55 Cs Цезий 132,9054 79 Au Золото 196,9665 | 56 Ba Барий 137,33 80 Hg Ртуть 200,59 | 57* La Лантан 138,9055 81 Tl Таллий 204,38 | 72 Hf Гафний 178,49 82 Pb Свинец 207,21 | 73 Ta Тантал 180,9479 83 Bi Висмут 208,9804 | 74 W Вольфрам 183,85 84 Po Полоний [209] | 75 Re Рений 186,207 85 At Астат [210] | 76 Os Осмий 190,2 | 77 Ir Иридий 192,2 | 78 Pt Платина 195,08 | 86 | ||||||||||||||
| Период 7 | 87 Fr Франций [223] | 88 Ra Радий 226,0254 | 89** Ac Актиний 227,028 | 104 [261] | 105 [258] | 106 [260] | 107 [262] | 108 [265] | 109 [266] |
| |||||||||||||||
| * | 58 Ce 140,12 | 59 Pr 140,9077 | 60 Nd 144,24 | 61 Pm [145] | 62 Sm 150,36 | 63 Eu 151,96 | 64 Gd 157,25 | 65 Tb 158,9254 | 66 Dy 162,50 | 67 Ho 164,9304 | 68 Er 167,26 | 69 Tm 168,9342 | 70 Yb 173,04 | 71 Lu 174,967 | |||||||||||
| ** | 90 Th 232,0381 | 91 Pa 231,0359 | 92 U 238,0289 | 93 Np 237,0482 | 94 Pu [244] | 95 Am [243] | 96 Cm [247] | 97 Bk [247] | 98 Cf [251] | 99 Es [252] | 100 Fm [257] | 101 Md [258] | 102 No [259] | 103 Lr [260] | |||||||||||
*Лантаноиды: церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций.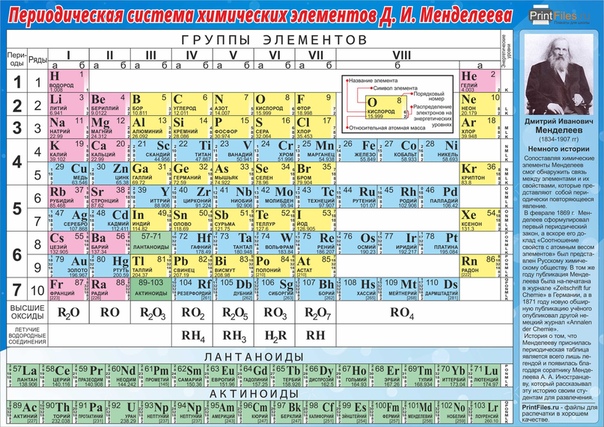 **Актиноиды: торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий, лоуренсий. Примечание. Атомный номер указан над символом элемента, атомная масса указана под символом элемента. Величина в скобках – массовое число наиболее долгоживущего изотопа. | |||||||||||||||||||||||||
Периоды.
В этой таблице Менделеев расположил элементы в горизонтальных рядах – периодах. Таблица начинается с очень короткого периода, содержащего только водород и гелий. Следующие два коротких периода содержат по 8 элементов. Затем располагаются четыре длинных периода. Все периоды, кроме первого, начинаются со щелочного металла (Li, Na, K, Rb, Cs), и все периоды заканчиваются благородным газом. В 6-м периоде находится серия из 14 элементов – лантаноиды, которой формально нет места в таблице и ее обычно располагают под таблицей. Другая аналогичная серия – актиноиды – находится в 7-м периоде. Эта серия включает элементы, полученные в лаборатории, например бомбардировкой урана субатомными частицами, и также размещается под таблицей ниже лантаноидов.
Группы и подгруппы.
При расположении периодов друг под другом элементы располагаются в колонки, образуя группы, нумеруемые цифрами 0, I, II,…, VIII. Предполагается, что элементы внутри каждой группы проявляют сходные общие химические свойства. Еще бóльшее сходство наблюдается у элементов в подгруппах (A и B), которые образуются из элементов всех групп, кроме 0 и VIII. Подгруппа А называется главной, а В – побочной. Некоторые семейства имеют названия, например, щелочные металлы (группа IA), щелочноземельные металлы (группа IIA), галогены (группа VIIA) и благородные газы (группа 0). В группе VIII находятся переходные металлы: Fe, Co и Ni; Ru, Rh и Pd; Os, Ir и Pt. Находящиеся в середине длинных периодов, эти элементы более сходны друг с другом, чем с элементами, стоящими до и после них. В нескольких случаях порядок увеличения атомных весов (точнее, атомных масс) нарушается, например, в пáрах теллур и иод, аргон и калий. Это «нарушение» необходимо для сохранения сходства элементов в подгруппах.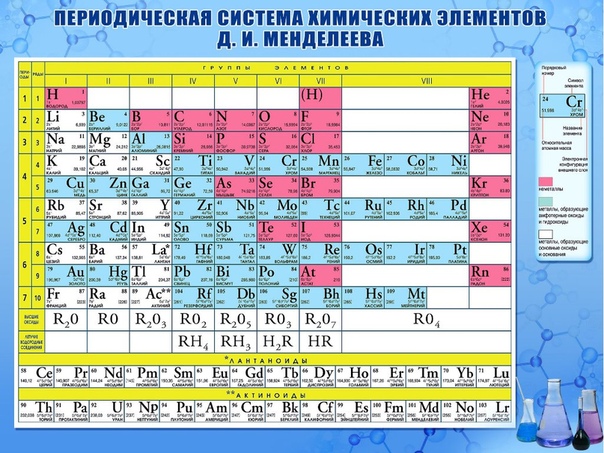
Металлы, неметаллы.
Диагональ от водорода к радону примерно делит все элементы на металлы и неметаллы, при этом неметаллы находятся выше диагонали. (К неметаллам относят 22 элемента – H, B, C, Si, N, P, As, O, S, Se, Te, галогены и инертные газы, к металлам – все остальные элементы.) Вдоль этой линии располагаются элементы, которые обладают некоторыми свойствами металлов и неметаллов (металлоиды – устаревшее название таких элементов). При рассмотрении свойств по подгруппам сверху вниз наблюдается увеличение металлических свойств и ослабление неметаллических свойств.
Валентность.
Наиболее общее определение валентности элемента – это способность его атомов соединяться с другими атомами в определенных соотношениях. Иногда валентность элемента заменяют близким ему понятием степени окисления (с.о.). Степень окисления соответствует заряду, который приобрел бы атом, если бы все электронные пары его химических связей сместились в сторону более электроотрицательных атомов. В любом периоде слева направо происходит увеличение положительной степени окисления элементов. Элементы I группы имеют с.о., равную +1 и формулу оксида R2O, элементы II группы – соответственно +2 и RO и т.д. Элементы с отрицательной с.о. находятся в V, VI и VII группах; считается, что углерод и кремний, находящиеся в IV группе, не имеют отрицательной степени окисления. Галогены, имеющие степень окисления –1, образуют соединения с водородом состава RH. В целом положительная степень окисления элементов соответствует номеру группы, а отрицательная равна разности восемь минус номер группы. Из таблицы нельзя определить наличие или отсутствие других степеней окисления.
В любом периоде слева направо происходит увеличение положительной степени окисления элементов. Элементы I группы имеют с.о., равную +1 и формулу оксида R2O, элементы II группы – соответственно +2 и RO и т.д. Элементы с отрицательной с.о. находятся в V, VI и VII группах; считается, что углерод и кремний, находящиеся в IV группе, не имеют отрицательной степени окисления. Галогены, имеющие степень окисления –1, образуют соединения с водородом состава RH. В целом положительная степень окисления элементов соответствует номеру группы, а отрицательная равна разности восемь минус номер группы. Из таблицы нельзя определить наличие или отсутствие других степеней окисления.
Физический смысл атомного номера.
Истинное понимание периодической таблицы возможно только на основе современных представлений о строении атома. Порядковый номер элемента в периодической таблице – его атомный номер – значительно важнее величины его атомного веса (т.е. относительной атомной массы) для понимания химических свойств.
Строение атома.
В 1913 Н.Бор использовал ядерную модель строения атома для объяснения спектра атома водорода, наиболее легкого и поэтому наиболее простого атома. Бор предположил, что атом водорода состоит из одного протона, составляющего ядро атома, и одного электрона, вращающегося вокруг ядра.
Определение понятия атомного номера.
В 1913 А.ван ден Брук предположил, что порядковый номер элемента – его атомный номер – должен идентифицироваться с числом электронов, вращающихся вокруг ядра нейтрального атома, и с положительным зарядом ядра атома в единицах заряда электрона. Однако необходимо было экспериментальное подтверждение идентичности заряда атома и атомного номера. Бор далее постулировал, что характеристическое рентгеновское излучение элемента должно подчиняться такому же закону, что и спектр водорода. Так, если атомный номер Z идентифицируется с зарядом ядра в единицах заряда электрона, то частоты (длины волн) соответствующих линий в рентгеновских спектрах различных элементов должны быть пропорциональны Z2, квадрату атомного номера элемента.
В 1913–1914 Г.Мозли, изучая характеристическое рентгеновское излучение атомов различных элементов, получил блестящее подтверждение гипотезы Бора. Работа Мозли таким образом подтвердила предположение ван ден Брука об идентичности атомного номера элемента с зарядом его ядра; атомный номер, а не атомная масса, является истинной основой для определения химических свойств элемента.
Периодичность и атомная структура.
Квантовая теория Бора строения атома развивалась в течение двух десятилетий после 1913. Предложенное Бором «квантовое число» стало одним из четырех квантовых чисел, необходимых для характеристики энергетического состояния электрона. В 1925 В.Паули сформулировал свой знаменитый «принцип запрета» (принцип Паули), согласно которому в атоме не может быть двух электронов, у которых бы все квантовые числа были одинаковые. Когда этот принцип применили к электронным конфигурациям атомов, периодическая таблица приобрела физическое обоснование. Так как атомный номер Z, т. е. положительный заряд ядра атома, возрастает, то и количество электронов должно возрастать для сохранения электронейтральности атома. Эти электроны определяют химическое «поведение» атома. Согласно принципу Паули, по мере увеличения значения квантового числа электроны заполняют электронные слои (оболочки) начиная с ближайших к ядру. Завершенный слой, который заполнен всеми электронами в соответствии с принципом Паули, является наиболее стабильным. Поэтому благородные газы, такие, как гелий и аргон, имеющие полностью завершенные электронные структуры, устойчивы к любому химическому воздействию.
е. положительный заряд ядра атома, возрастает, то и количество электронов должно возрастать для сохранения электронейтральности атома. Эти электроны определяют химическое «поведение» атома. Согласно принципу Паули, по мере увеличения значения квантового числа электроны заполняют электронные слои (оболочки) начиная с ближайших к ядру. Завершенный слой, который заполнен всеми электронами в соответствии с принципом Паули, является наиболее стабильным. Поэтому благородные газы, такие, как гелий и аргон, имеющие полностью завершенные электронные структуры, устойчивы к любому химическому воздействию.
Электронные конфигурации.
В следующей таблице приведены возможные количества электронов для различных энергетических состояний. Главное квантовое число n = 1, 2, 3,… характеризует энергетический уровень электронов (1-й уровень располагается ближе к ядру). Орбитальное квантовое число l = 0, 1, 2,…, n – 1 характеризует орбитальный момент импульса. Орбитальное квантовое число всегда меньше главного квантового числа, а максимальное его значение равно главному минус 1. Каждому значению l отвечает определенный тип орбитали – s, p, d, f … (это обозначение происходит от спектроскопической номенклатуры 18 в., когда различные серии наблюдаемых спектральных линий назывались sharp, principal, diffuse и fundamental).
Каждому значению l отвечает определенный тип орбитали – s, p, d, f … (это обозначение происходит от спектроскопической номенклатуры 18 в., когда различные серии наблюдаемых спектральных линий назывались sharp, principal, diffuse и fundamental).
| Таблица 3. ЧИСЛО ЭЛЕКТРОНОВ В РАЗЛИЧНЫХ ЭНЕРГЕТИЧЕСКИХ СОСТОЯНИЯХ АТОМА | |||
| Главное квантовое число | Орбитальное квантовое число | Количество электронов на оболочке | Обозначение энергетического состояния (тип орбитали) |
| 1 | 0 | 2 | 1s |
| 2 | 0 | 2 | 2s |
| 1 | 6 | 2p | |
| 3 | 0 | 2 | 3s |
| 1 | 6 | 3p | |
| 2 | 10 | 3d | |
| 4 | 0 | 2 | 4s |
| 1 | 6 | 4p | |
| 2 | 10 | 4d | |
| 3 | 14 | 4f | |
| 5 | 0 | 2 | 5s |
| 1 | 6 | 5p | |
| 2 | 10 | 5d | |
| 5 | 14 | 5f | |
| 4 | 18 | 5g | |
| 6 | 0 | 2 | 6s |
| 1 | 6 | 6p | |
| 2 | 10 | 6d | |
. .. .. | … | … | … |
| 7 | 0 | 2 | 7s |
Короткие и длинные периоды.
Низшая полностью завершенная электронная оболочка (орбиталь) обозначается 1s и реализуется у гелия. Следующие уровни – 2s и 2p – соответствуют застройке оболочек атомов элементов 2-го периода и при полной застройке, у неона, содержат в сумме 8 электронов. С увеличением значений главного квантового числа энергетическое состояние низшего орбитального числа для большего главного может оказаться ниже энергетического состояния наиболее высокого орбитального квантового числа, соответствующего меньшему главному. Так, энергетическое состояние 3d выше, чем 4s, поэтому у элементов 3-го периода происходит застройка 3s– и 3p-орбиталей, заканчиваясь формированием устойчивой структуры благородного газа аргона. Далее происходит последовательная застройка 4s-, 3d– и 4p-орбиталей у элементов 4-го периода, вплоть до завершения внешней устойчивой электронной оболочки из 18 электронов у криптона. Это и приводит к появлению первого длинного периода. Аналогично происходит застройка 5s-, 4d– и 5p-орбиталей атомов элементов 5-го (т.е. второго длинного) периода, завершаясь электронной структурой ксенона.
Это и приводит к появлению первого длинного периода. Аналогично происходит застройка 5s-, 4d– и 5p-орбиталей атомов элементов 5-го (т.е. второго длинного) периода, завершаясь электронной структурой ксенона.
Лантаноиды и актиноиды.
Последовательное заполнение электронами 6s-, 4f-, 5d– и 6p-орбиталей у элементов 6-го (т.е. третьего длинного) периода приводит к появлению новых 32 электронов, которые формируют структуру последнего элемента этого периода – радона. Начиная с 57 элемента, лантана, последовательно располагаются 14 элементов, мало отличающихся по химическим свойствам. Они образуют серию лантаноидов, или редкоземельных элементов, у которых застраивается 4f-оболочка, содержащая 14 электронов.
Серия актиноидов, которая располагается за актинием (атомный номер 89), характеризуется застройкой 5f-оболочки; она также включает 14 элементов, весьма близких по химическим свойствам. Элемент с атомным номером 104 (резерфордий), следующий за последним из актиноидов, уже отличается по химическим свойствам: он является аналогом гафния. Для элементов за резерфордием приняты названия: 105 – дубний (Db), 106 – сиборгий (Sg), 107 – борий (Bh), 108 – хассий (Hs), 109 – мейтнерий (Mt).
Для элементов за резерфордием приняты названия: 105 – дубний (Db), 106 – сиборгий (Sg), 107 – борий (Bh), 108 – хассий (Hs), 109 – мейтнерий (Mt).
Применение периодической таблицы.
Знание периодической таблицы позволяет химику предсказывать с определенной степенью точности свойства любого элемента, прежде чем он приступит к работе с ним. Металлурги, например, считают периодическую таблицу полезной для создания новых сплавов, так как, используя периодическую таблицу, можно заменить один из металлов сплава, подобрав ему замену среди его соседей по таблице так, что с определенной степенью вероятности не произойдет значительного изменения свойств образующегося из них сплава.
Ученые в 2021 году начнут работы по синтезу новых элементов таблицы Менделеева – Наука
МОСКВА, 8 февраля. /ТАСС/. Ученые Объединенного института ядерных исследований (ОИЯИ) планируют в 2021 году начать подготовительные работы по обнаружению новых сверхтяжелых элементов таблицы Менделеева, сообщил директор ОИЯИ, академик Российской академии наук Григорий Трубников в интервью ТАСС.
“В Дубне в декабре 2020 года начат уникальный цикл экспериментов на так называемой фабрике по синтезу сверхтяжелых элементов. Напомню, что в таблице Менделеева 10 новых элементов в последние десятилетия были открыты в Дубне. В декабре 2020 года мы включили установку (фабрику – прим. ТАСС) уже в крейсерском режиме на программу синтеза новых элементов. Наша цель – конечно, новые элементы следующего, восьмого периода таблицы Менделеева. В 2021 году мы закончим все подготовительные работы для этого амбициозного эксперимента, опробуем новый тип бомбардирующих ядер и новую мишень. Ожидаем получить экспериментальные результаты, которые станут однозначным указанием на возможность получения новых элементов”, – сказал он.
Синтез новых элементов
Первая в мире фабрика сверхтяжелых элементов (ускоритель ДЦ-280) запущена в конце марта 20219 года в ОИЯИ. В дальнейшем это позволит синтезировать и изучать новые элементы химической таблицы Менделеева.
Фабрика должна стать мировой базой для будущих исследований сверхтяжелых ядер и послужит закреплению приоритета России и всех стран-участниц ОИЯИ как лидеров в области синтеза и изучения свойств сверхтяжелых элементов.
Сейчас в крупнейших ядерно-физических центрах мира фактически начаты работы по синтезу 119-го, 120-го и 121-го элементов. ОИЯИ рассчитывает благодаря Фабрике сверхтяжелых элементов получить их первыми. Все химические элементы тяжелее урана получают в ядерных реакторах или синтезируют с помощью ускорителей при столкновении ядер других элементов.
За последние 20 лет в ОИЯИ были открыты пять новых сверхтяжелых элементов, завершающих седьмой период таблицы Д. И. Менделеева, с номерами 114 (флеровий), 115 (московий), 116 (ливерморий), 117 (теннессин) и 118 (оганесон).
ОИЯИ расположен в Дубне (Россия) и является одним из крупнейших и авторитетных международных научных центров.
Открытие элементов 113, 115, 117 и 118: что это дает
Борис Жуйков — радиохимик, докт. хим. наук, зав. Лабораторией радиоизотопного комплекса Института ядерных исследований РАН, ранее много лет работавший в Лаборатории ядерных реакций ОИЯИ (Дубна), занимался исследованием свойств новых элементов.
Открытие новых элементов Периодической таблицы Менделеева всегда вызывало интерес у широкой публики. Дело даже не столько в научной значимости этих открытий, а в том, что в школе все проходили Периодический закон, и некоторые даже помнят символы, обозначающие элементы. Это понятно, знакомо. Но сейчас за этими открытиями стоят сложные исследования в ядерной физике и радиохимии, о которых многие не имеют представления.
В настоящее время новые элементы получают только на ускорителях тяжелых ионов. (Ранее их обнаруживали в земных минералах, продуктах ядерных реакторов и ядерных взрывов.) Тяжелыми ионами, ускоренными в циклотронах или линейных ускорителях, бомбардируют мишени из тяжелых элементов, и в результате реакции слияния с испусканием одного или нескольких нейтронов синтезируется новый элемент с порядковым номером (зарядом ядра) — суммой зарядов ядер налетающего иона и ядра мишени. Затем образующиеся ядра претерпевают радиоактивный распад. Для синтеза наиболее устойчивых изотопов выбирают такие комбинации ядер, в которых содержится по возможности большее число нейтронов и составные ядра имеют низкую энергию возбуждения..jpg) Выход получаемых тяжелых элементов чрезвычайно мал — отдельные атомы или десятки атомов, иногда за месяцы облучения на ускорителе. Период полураспада — секунды, а иногда и доли миллисекунд. Довольно сложно выделить ядра новых элементов из всей смеси образующихся продуктов ядерных реакций и правильно идентифицировать полученные продукты. Для этого создаются специальные установки, которые в результате регистрируют цепочку распадов с испусканием альфа-частиц и образованием изотопов более легких элементов, иногда цепочка оканчивается спонтанным делением ядра.
Выход получаемых тяжелых элементов чрезвычайно мал — отдельные атомы или десятки атомов, иногда за месяцы облучения на ускорителе. Период полураспада — секунды, а иногда и доли миллисекунд. Довольно сложно выделить ядра новых элементов из всей смеси образующихся продуктов ядерных реакций и правильно идентифицировать полученные продукты. Для этого создаются специальные установки, которые в результате регистрируют цепочку распадов с испусканием альфа-частиц и образованием изотопов более легких элементов, иногда цепочка оканчивается спонтанным делением ядра.
В нашей стране начиная с 1950-х годов работы по синтезу новых элементов на ускорителях тяжелых ионов проводились в Дубне под руководством акад. Г. Н. Флёрова (1913–1990) — основателя этого направления. Сейчас эти работы проводятся под научным руководством акад. Ю. Ц. Оганесяна. В мире существует лишь несколько ускорителей и установок, где можно получать трансактиноидные элементы (т. е. элементы с зарядом ядра Z более 103).
Последнее решение IUPAC (Международный союз теоретической и прикладной химии [1] о признании открытия сразу четырех элементов — под номерами 113, 115, 117 и 118 — привлекло внимание российской общественности еще и потому, что приоритет в трех из них — 115, 117 и 118 — признан за российско-американской коллаборацией, включающей Лабораторию ядерных реакций им. Г. Н. Флёрова Объединенного института ядерных исследований (Дубна) (ФЛЯР ОИЯИ), Ливерморскую национальную лабораторию им. Э. Лоуренса (LLNL), Окриджскую национальную лабораторию (ORNL) и Университет Вандербильта. Приоритет в открытии элемента 113 признан за группой из японского ускорительного научного центра RIKEN.
Г. Н. Флёрова Объединенного института ядерных исследований (Дубна) (ФЛЯР ОИЯИ), Ливерморскую национальную лабораторию им. Э. Лоуренса (LLNL), Окриджскую национальную лабораторию (ORNL) и Университет Вандербильта. Приоритет в открытии элемента 113 признан за группой из японского ускорительного научного центра RIKEN.
Установление приоритета — непростая задача, так как неточности в первых сообщениях об открытии в какой-то мере неизбежны. Вопрос — какие неточности существенны, а какие можно принять и насколько выводы авторов обоснованны. Решение IUPAC основывалось на отчетах объединенной рабочей группы экспертов (Joint Working Party, JWP) [2, 3] и разработанных ранее критериях открытия. Согласно существующей практике авторам предоставляется право предложить названия новых элементов.
Рис. 2. Карта радионуклидов трансактиноидных элементов, включая некоторые ядерные реакции их получения (взято из [4])Элемент 113 предложено назвать нихонием (nihonium, Nh). Nihon — одно из двух названий Японии на японском языке, означающее «Страна восходящего солнца». Это первый элемент, открытый в Азии. Дубнинская группа оспаривала это первенство.
Это первый элемент, открытый в Азии. Дубнинская группа оспаривала это первенство.Приоритетные работы были опубликованы ФЛЯР ОИЯИ и RIKEN почти одновременно в 2004 году, группа из Дубны опубликовала работу даже несколько раньше. Для синтеза новых ядер в Японии использовали «холодную» реакцию слияния, бомбардируя изотопом цинка мишень из висмута 70Zn+209Bi, с образованием изотопа 278113 (время жизни — миллисекунды и десятые доли миллисекунд).
В Дубне применили более выгодную (с точки зрения выхода и периодов полураспада) ядерную реакцию ионов тяжелого изотопа кальция и америция 48Ca+243Am, которая приводит к образованию изотопов 288115 и 287115. Эти радионуклиды, испуская альфа-частицы, распадаются сначала соответственно в 284113 и 283113 (время жизни — сотни миллисекунд), а затем по цепочке в долгоживущие изотопы элемента 105 (дубния, Db). 268Db выделяли химически и затем регистрировали спонтанное деление.
Но промежуточные нуклиды в этих цепочках распада на тот момент не были известны, и их независимая физическая идентификация не проводилась. А химическое выделение и идентификацию Db на основе ионного обмена, проведенные в ФЛЯР ОИЯИ, объединенная рабочая группа посчитала неселективными и неубедительными. Также не были приняты во внимание попытки исследовать химические свойства элемента 113 методом газовой хроматографии, хотя этот метод ранее успешно использовался для изучения химии других трансактиноидных элементов. В результате заключили, что заявка Дубны в данном случае не соответствует критериям открытия элементов.
В то же время все промежуточные продукты распада синтезированного в Японии изотопа 278113 (всего 3 события за 8 лет работы) были подтверждены, в том числе в специальных экспериментах в новом исследовательском центре по тяжелым ионам Ланжо в Китае. Таким образом, приоритет в открытии элемента 113 был признан за японской группой.
Элемент 115 был синтезирован в Дубне, и в честь региона, где расположен этот международный центр, авторами было предложено название московий (moscovium, Mc). Элемент получали опять же в ядерной реакции 48Ca+243Am с образованием 287115 и 288115 (время жизни — десятки и сотни миллисекунд соответственно). Позднее был получен 289115 и другие изотопы этого элемента. В отличие от первого цикла химических экспериментов, которые дубнинская группа проводила самостоятельно, позднее, в 2007 году, химическое выделение продукта распада — 268Db осуществлялось уже с привлечением американских специалистов из Ливермора, и была достаточно убедительно доказана принадлежность этого элемента — продукта распада 115-го элемента — к V группе Периодической системы.
Элемент получали опять же в ядерной реакции 48Ca+243Am с образованием 287115 и 288115 (время жизни — десятки и сотни миллисекунд соответственно). Позднее был получен 289115 и другие изотопы этого элемента. В отличие от первого цикла химических экспериментов, которые дубнинская группа проводила самостоятельно, позднее, в 2007 году, химическое выделение продукта распада — 268Db осуществлялось уже с привлечением американских специалистов из Ливермора, и была достаточно убедительно доказана принадлежность этого элемента — продукта распада 115-го элемента — к V группе Периодической системы.
Более того, в 2013 году коллаборации из немецкого Центра исследований c тяжелыми ионами в Дармштадте (GSI) удалось повторить дубнинские результаты по получению изотопов элемента 115 в ядерной реакции 48Ca+243Am. Таким образом, приоритет в открытии элемента 115 был признан за российско-американской группой.
Элемент 117 предложено назвать теннеcсин (tennessine, Ts) в честь американского штата Теннесси, где расположена Окриджская национальная лаборатория. Окончание в названии — п о аналогии с астатином и другими элементами группы галогенов (на английском языке). Этот элемент также был синтезирован в Дубне, в ядерной реакции 48Ca+249Bk. Роль американских коллег из Окриджа в основном состояла в изготовлении уникальной мишени берклия-249, который получали на высокопоточном реакторе в ORNL. В 2010–2013 годах было зарегистрировано всего 13 цепочек распадов 293117 и 294117, причем характеристики (время жизни и энергия альфа-распада) продукта распада 289115 соответствовали данным, полученным ранее для этого радионуклида в другой ядерной реакции 48Ca+243Am. По этой причине заявка на открытие этого элемента была признана отвечающей установленным критериям.
Окончание в названии — п о аналогии с астатином и другими элементами группы галогенов (на английском языке). Этот элемент также был синтезирован в Дубне, в ядерной реакции 48Ca+249Bk. Роль американских коллег из Окриджа в основном состояла в изготовлении уникальной мишени берклия-249, который получали на высокопоточном реакторе в ORNL. В 2010–2013 годах было зарегистрировано всего 13 цепочек распадов 293117 и 294117, причем характеристики (время жизни и энергия альфа-распада) продукта распада 289115 соответствовали данным, полученным ранее для этого радионуклида в другой ядерной реакции 48Ca+243Am. По этой причине заявка на открытие этого элемента была признана отвечающей установленным критериям.
Элементу 118 авторами предложено название оганесон (oganesson, Og). Он должен являться аналогом радона и других инертных газов, и его открытие завершает седьмой период таблицы Менделеева. Этот элемент предложено назвать в честь Юрия Цолаковича Оганесяна за его пионерский вклад в исследование трансактиноидных элементов и важные ядерно-физические достижения в открытии сверхтяжелых ядер и исследовании «острова ядерной стабильности». В истории существовал только еще один пример, когда имя элемента присваивалось действующему ученому. Элемент 106 был назван в 1997 году сиборгием (Sg) в честь Гленна Сиборга (1912–1999), лауреата Нобелевской премии, автора открытия плутония и целого ряда трансплутониевых элементов.
В истории существовал только еще один пример, когда имя элемента присваивалось действующему ученому. Элемент 106 был назван в 1997 году сиборгием (Sg) в честь Гленна Сиборга (1912–1999), лауреата Нобелевской премии, автора открытия плутония и целого ряда трансплутониевых элементов.
В 2002–2012 годах в Дубне при облучении мишени 249Cf ионами 48Ca было обнаружено несколько событий образования 294118 (время жизни — порядка 1 миллисекунды), сопровождающихся последовательным распадом 290Lv (ливермория), 286Fl (флеровия) и 282Cn (коперниция). Время жизни и энергии альфа-частиц этих изотопов Fl и Cn были подтверждены американской коллаборацией на циклотроне в Беркли, поэтому объединенная рабочая группа рекомендовала признать открытие.
Следует отметить, что все вновь предложенные названия и символы элементов пока еще не утверждены IUPAC.
* * *
Какое значение имеет открытие этих новых элементов?
Вопрос «Сколько хлеба и угля это может дать?» абсолютно некорректен. Пользу от развития определенной ветви фундаментальной науки часто невозможно предсказать, и такого рода аргументы не должны тормозить ее развитие. Попытки заранее расписать доход и политические выгоды от научных открытий смехотворны. Соображения престижа также не должны как-то ограничивать развитие направления, потому что его истинное значение может раскрыться много позже. И наоборот, широко разрекламированные достижения могут не иметь никакого значительного продолжения. Вообще, наука должна руководствоваться своей логикой, а не логикой людей, далеких от нее. Общество должно доверять ученым, и «удовлетворение собственного любопытства за государственный счет» — это нормальное положение в данной области человеческой деятельности. И именно ученые, квалифицированные специалисты должны определять, на что следует тратить деньги, а что может подождать или вообще бесперспективно.
Пользу от развития определенной ветви фундаментальной науки часто невозможно предсказать, и такого рода аргументы не должны тормозить ее развитие. Попытки заранее расписать доход и политические выгоды от научных открытий смехотворны. Соображения престижа также не должны как-то ограничивать развитие направления, потому что его истинное значение может раскрыться много позже. И наоборот, широко разрекламированные достижения могут не иметь никакого значительного продолжения. Вообще, наука должна руководствоваться своей логикой, а не логикой людей, далеких от нее. Общество должно доверять ученым, и «удовлетворение собственного любопытства за государственный счет» — это нормальное положение в данной области человеческой деятельности. И именно ученые, квалифицированные специалисты должны определять, на что следует тратить деньги, а что может подождать или вообще бесперспективно.
Другой вопрос, какое научное значение может иметь этот результат об открытии новых элементов. Что он изменяет в наших представлениях о структуре ядра и химических свойствах элементов вообще?
С физической точки зрения эти результаты могут иметь значение для лучшего понимания ядерной структуры и ядерного взаимодействия. С 1960-х годов бурно обсуждался вопрос о существовании так называемых островов стабильности в районе зарядов ядер Z=114 и 126 как проявление оболочечной структуры ядер. Поэтому получение первых трансактиноидных элементов, которые имели гораздо больший период полураспада, чем предсказывалось старой «капельной» моделью строения ядра, было действительно принципиально важно. Сейчас в оболочечной модели никто не сомневается. Полученные результаты по новым элементам и новым изотопам позволяют уточнить существующие модели ядра и ядерных реакций. Хотя и не ожидается принципиально новых явлений, набор новых данных всегда полезен. Очевидно, что вершины острова стабильности существующими методами не достигнуть: просто нет таких комбинаций в ядерных реакциях — в получаемых изотопах не хватает нейтронов. Ранее много лет проводились попытки обнаружения в природных образцах СТЭ, которые были бы настолько долгоживущими, что могли остаться со времен образования Солнечной системы. Но эти попытки не увенчались успехом.
С 1960-х годов бурно обсуждался вопрос о существовании так называемых островов стабильности в районе зарядов ядер Z=114 и 126 как проявление оболочечной структуры ядер. Поэтому получение первых трансактиноидных элементов, которые имели гораздо больший период полураспада, чем предсказывалось старой «капельной» моделью строения ядра, было действительно принципиально важно. Сейчас в оболочечной модели никто не сомневается. Полученные результаты по новым элементам и новым изотопам позволяют уточнить существующие модели ядра и ядерных реакций. Хотя и не ожидается принципиально новых явлений, набор новых данных всегда полезен. Очевидно, что вершины острова стабильности существующими методами не достигнуть: просто нет таких комбинаций в ядерных реакциях — в получаемых изотопах не хватает нейтронов. Ранее много лет проводились попытки обнаружения в природных образцах СТЭ, которые были бы настолько долгоживущими, что могли остаться со времен образования Солнечной системы. Но эти попытки не увенчались успехом. Некогда заявленные результаты не нашли ни экспериментального, ни теоретического подтверждения.
Некогда заявленные результаты не нашли ни экспериментального, ни теоретического подтверждения.
С химической точки зрения ситуация несколько иная. Здесь действительно можно ожидать принципиально новых явлений. Дело в так называемых «релятивистских эффектах». В атомах с большим зарядом ядра электроны приобретают релятивистские скорости, и обычное уравнение Шрёдингера, используемое для описания атомов, уже не работает. В частности, знакомые всем «гантельки» р-электронов в VII периоде претерпевают изменения, и одна из них превращается в шар. В результате электронная структура атомов меняется. У новых элементов возможно значительное отклонение химических свойств от экстраполированных по Периодической таблице и возникновение необычных химических свойств.
В отношении «релятивистских эффектов» существует много спекуляций, очевидно направленных на поднятие интереса к вопросу. Например, высказывалось предположение, что элемент 104 резерфордий (Rf) — формальный аналог титана, циркония и гафния — может оказаться p-элементом, по химическим свойствам близким к свинцу. Или заявлялось, что элемент 114 флеровий (Fl) — аналог свинца — может оказаться инертным газом. На самом деле при аккуратном рассмотрении выясняется, что, хотя атом Rf и имеет необычную конфигурацию внешней электронной оболочки (ds2p), по своим химическим свойствам это типичный d-элемент, аналог гафния. А Fl, обладая повышенной летучестью (как это следует и из любых экстраполяций), в конденсированном состоянии остается типичным металлом. Вообще, абсолютно некорректно любое отклонение от экстраполяции по Периодической системе приписывать «релятивистским эффектам»: оно может быть обусловлено совершенно другими причинами, например межконфигурационным взаимодействием.
Или заявлялось, что элемент 114 флеровий (Fl) — аналог свинца — может оказаться инертным газом. На самом деле при аккуратном рассмотрении выясняется, что, хотя атом Rf и имеет необычную конфигурацию внешней электронной оболочки (ds2p), по своим химическим свойствам это типичный d-элемент, аналог гафния. А Fl, обладая повышенной летучестью (как это следует и из любых экстраполяций), в конденсированном состоянии остается типичным металлом. Вообще, абсолютно некорректно любое отклонение от экстраполяции по Периодической системе приписывать «релятивистским эффектам»: оно может быть обусловлено совершенно другими причинами, например межконфигурационным взаимодействием.
Так или иначе, исследование релятивистских эффектов позволяет лучше понять и химические свойства давно известных и повсеместно применяемых элементов. Также это позволяет лучше разобраться в том, каким образом электронное строение атомов и молекул, которое можно рассчитать, определяет их конкретные химические свойства. Это до сих пор является далеко не до конца решенным вопросом. Дальнейшее продвижение по Периодической таблице может привести к образованию совсем новой группы элементов — g-элементов (начиная с элемента 121) с интересными свойствами. Все эти вопросы еще ждут подробного исследования.
Это до сих пор является далеко не до конца решенным вопросом. Дальнейшее продвижение по Периодической таблице может привести к образованию совсем новой группы элементов — g-элементов (начиная с элемента 121) с интересными свойствами. Все эти вопросы еще ждут подробного исследования.
Однако приходится отметить, что в последних открытиях исследования химических свойств новых элементов вообще не фигурируют (химически выделялся лишь продукт распада элемента 115 — элемент 105, Db, чтобы подтвердить конец цепочки распада). Но такое исследование трудно было провести ввиду низкого выхода и коротких периодов полураспада полученных изотопов. Тем не менее это возможно, хотя требует нового подхода к постановке химических экспериментов.
Открытие новых элементов дает еще один пример того, что значительные достижения российских ученых возможны в тесной коллаборации с учеными из США, Германии и других развитых стран. Именно такие работы и поднимают престиж нашей науки.
- International Union of Pure and Applied Chemistry.
 Официальный сайт: http://iupac.org/
Официальный сайт: http://iupac.org/ - Karola P. J., Barber R. C., Sherrill В. M., Vardaci E., Yamazaki T. Discovery of the elements with atomic numbers Z= 113, 115 and 117 (IUPAC Technical Report) // Pure Appl. Chem. 2016. V. 88. P. 139–153.
- Karola P. J., Barber R. C., Sherrill B. M., Vardaci E., Yamazaki T. Discovery of the elements with atomic numbers Z= 118 (IUPAC Technical Report) // Pure Appl. 2016. V. 88. P. 155–160.
- Hamilton H., Hofman S., Oganessian Y.T. Search for Superheavy Nuclei // Annu. Rev. Nucl. Part. Sci., 2013. V. 63. P. 383–405.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
См. также:
Сколько элементов в таблице Менделеева
Периодический закон, являющийся основой современной химии и объясняющий закономерности изменения свойств химических элементов, был открыт Д.И. Менделеевым в 1869 году. Физический смысл этого закона вскрывается при изучении сложного строения атома. В XIX веке считалось, что атомная масса является главной характеристикой элемента, поэтому для классификации веществ использовали именно ее. Сейчас атомы определяют и идентифицируют по величине заряда их ядра (числу протонов и порядковому номеру в таблице Менделеева). Впрочем, атомная масса элементов за некоторыми исключениями (например, атомная масса калия меньше атомной массы аргона) увеличивается соразмерно их заряду ядра.
В XIX веке считалось, что атомная масса является главной характеристикой элемента, поэтому для классификации веществ использовали именно ее. Сейчас атомы определяют и идентифицируют по величине заряда их ядра (числу протонов и порядковому номеру в таблице Менделеева). Впрочем, атомная масса элементов за некоторыми исключениями (например, атомная масса калия меньше атомной массы аргона) увеличивается соразмерно их заряду ядра.При увеличении атомной массы наблюдается периодическое изменение свойств элементов и их соединений. Это металличность и неметалличность атомов, атомный радиус и объем, потенциал ионизации, сродство к электрону, электроотрицательность, степени окисления, физические свойства соединений (температуры кипения, плавления, плотность), их основность, амфотерность или кислотность.
Сколько элементов в современной таблице Менделеева
Таблица Менделеева графически выражает открытый им периодический закон. В современной периодической системе содержится 112 химических элементов (последние – Мейтнерий, Дармштадтий, Рентгений и Коперниций).
 По последним данным, открыты и следующие 8 элементов (до 120 включительно), но не все из них получили свои названия, и эти элементы пока еще мало в каких печатных изданиях присутствуют.
По последним данным, открыты и следующие 8 элементов (до 120 включительно), но не все из них получили свои названия, и эти элементы пока еще мало в каких печатных изданиях присутствуют.Каждый элемент занимает определенную клетку в периодической системе и имеет свой порядковый номер, соответствующий заряду ядра его атома.
Как построена периодическая система
Структура периодической системы представлена семью периодами, десятью рядами и восемью группами. Каждый период начинается щелочным металлом и заканчивается благородным газом. Исключения составляют первый период, начинающийся водородом, и седьмой незавершенный период.
Периоды делятся на малые и большие. Малые периоды (первый, второй, третий) состоят из одного горизонтального ряда, большие (четвертый, пятый, шестой) – из двух горизонтальных рядов. Верхние ряды в больших периодах называются четными, нижние – нечетными.
В шестом периоде таблицы после лантана (порядковый номер 57) находятся 14 элементов, похожих по свойствам на лантан, – лантаноидов. Они вынесены в нижнюю часть таблицы отдельной строкой. То же самое относится и к актиноидам, расположенным после актиния (с номером 89) и во многом повторяющим его свойства.
Они вынесены в нижнюю часть таблицы отдельной строкой. То же самое относится и к актиноидам, расположенным после актиния (с номером 89) и во многом повторяющим его свойства.
Четные ряды больших периодов (4, 6, 8, 10) заполнены только металлами.
Элементы в группах проявляют одинаковую высшую валентность в оксидах и других соединениях, и эта валентность соответствует номеру группы. Главные подгруппы вмещают в себя элементы малых и больших периодов, побочные – только больших. Сверху вниз металлические свойства усиливаются, неметаллические – ослабевают. Все атомы побочных подгрупп – металлы.
Периоды периодической системы
Пользователи также искали:
период (химия), периоды, химии, такое, периоде, группа, системе, периодической, сколько, подгруппа, периоды делятся на, что такое подгруппа в химии, бывают, что такое группа в химии, рядов, каждом, находятся, элементы, сходными, свойствами, большие, делятся, групп, Период, большие периоды это, химия, какие, Период химия, восьмой период периодической системы, система,
Вопрос ученому: есть ли предел у таблицы Менделеева?
Depositphotos/Albert Tica
«Флеровий, ливерморий, дармштадтий, рентгений — то и дело в лентах новостей в Интернете появляются любопытные имена «новоселов» в периодической таблице Менделеева. Говорят, что она содержит уже гораздо больше ста химических элементов. Часть из них обнаружили в природе, остальные искусственно получены в результате ядерных реакций», — пишет посетитель нашего портала Евгений. Так есть ли предел у таблицы Менделеева? Этот вопрос мы адресовали кандидату химических наук, директору центра коллективного пользования сорбционных и каталитических исследований ТГУ Олегу Магаеву. Напоминаем, если вам есть, что спросить у ученых, пишите в комментарии или на почту [email protected]. Ваши вопросы мы зададим экспертам в самых разных областях науки и опубликуем на портале.
Говорят, что она содержит уже гораздо больше ста химических элементов. Часть из них обнаружили в природе, остальные искусственно получены в результате ядерных реакций», — пишет посетитель нашего портала Евгений. Так есть ли предел у таблицы Менделеева? Этот вопрос мы адресовали кандидату химических наук, директору центра коллективного пользования сорбционных и каталитических исследований ТГУ Олегу Магаеву. Напоминаем, если вам есть, что спросить у ученых, пишите в комментарии или на почту [email protected]. Ваши вопросы мы зададим экспертам в самых разных областях науки и опубликуем на портале.Олег Магаев, кандидат химических наук, директор центра коллективного пользования сорбционных и каталитических исследований ТГУ:
— Всем известно, что таблица химических элементов была составлена выдающимся русским ученым Дмитрием Ивановичем Менделеевым, который прославился не только как химик, но и как экономист, геолог, педагог, плотник и во многих других сферах деятельности. Тем не менее, периодический закон химических элементов, как один из основных законов мироздания, стал, безусловно, наиболее известным открытием Менделеева.
Тем не менее, периодический закон химических элементов, как один из основных законов мироздания, стал, безусловно, наиболее известным открытием Менделеева.
Таблица представляет собой классификацию химических элементов, устанавливающую зависимость свойств элементов от заряда атомного ядра. По сути, это графическое выражение периодического закона, установленного Менделеевым. Первоначально таблица строилась так, что отображала свойства элемента от его атомного веса. Впоследствии было предложено множество ее различных начертаний. Современный вариант представляет собой двухмерную таблицу, в которой столбцы определяют основные физико-химические свойства, а строки — периоды, подобные друг другу.
К моменту создания таблицы было открыто 63 химических элемента. Со временем все пробелы были устранены, и, казалось, система элементов приобрела завершенный вид. Однако прогресс в области ядерной физики открыл новые горизонты: искусственно синтезируемые химические элементы начали отодвигать границу периодической системы в область все больших значений атомных номеров.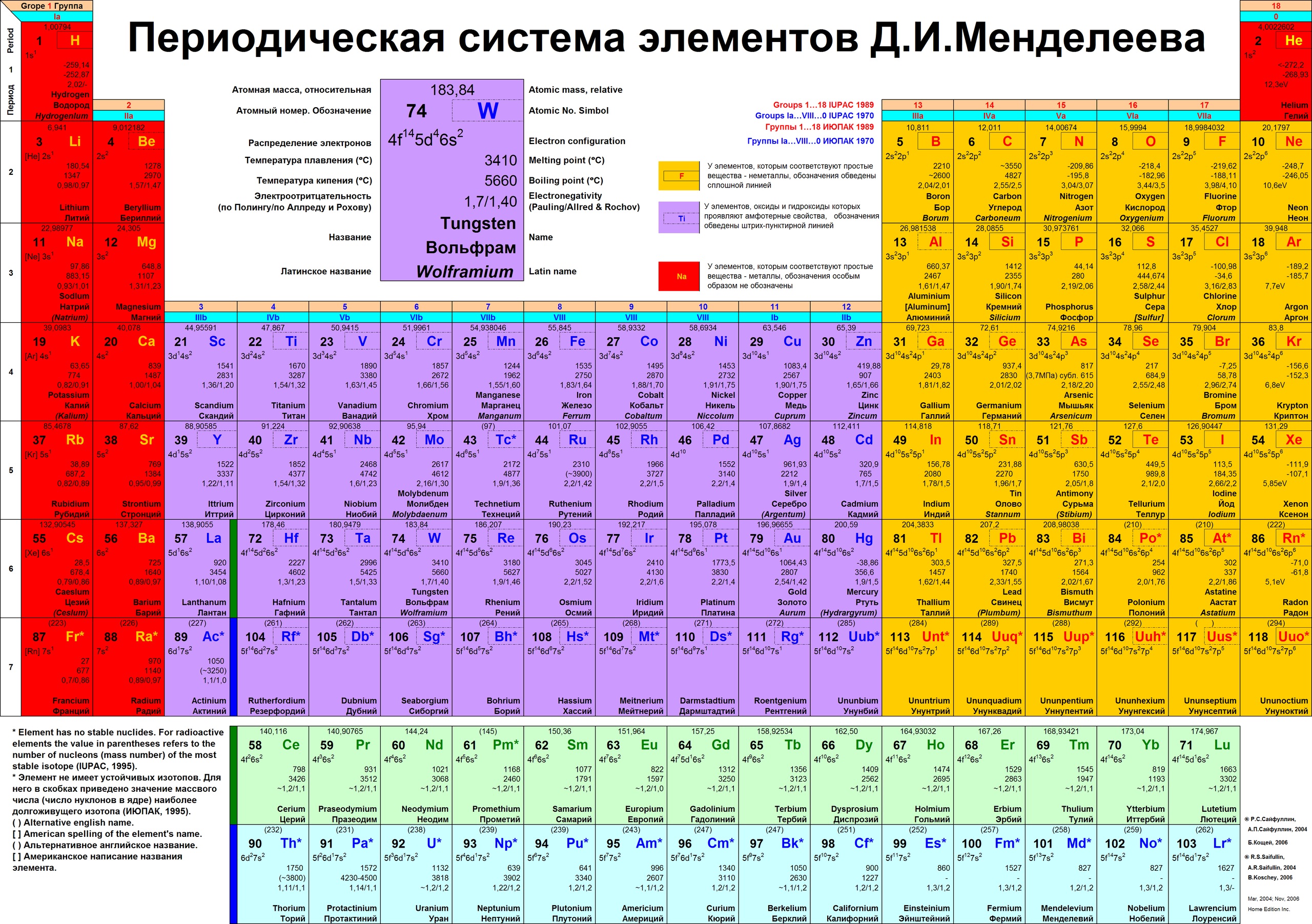
На данный момент в таблице официально зарегистрировано 118 элементов. Но проблема в том, что элементы с большими атомными номерами нестабильны и имеют малый срок существования. Поэтому элементы с номерами больше 90 — фактически лабораторные, в природе они не встречаются. Срок жизни некоторых их них не превышает долей секунды!
Прийти к единому мнению о том, как далеко может зайти этот процесс, ученые, разумеется, не могут — есть как ярые сторонники, настаивающие на существовании предела, как и те, кто полагает, что границ познания нет. Что касается практической стороны вопроса, то в современном научном мире сложно уловить ориентир. Элементы, открытые лет десять назад, вполне реальны — сейчас же, гипотетически, мы можем открывать новые элементы еще сколько угодно. Но здесь встает самый главный вопрос — для чего? Если с целью пополнить таблицу и показать, что мы развиваем ядерный синтез, — это одно. А если мы хотим, чтобы это можно было применить и использовать в реальной практике, — то уже совсем другая история.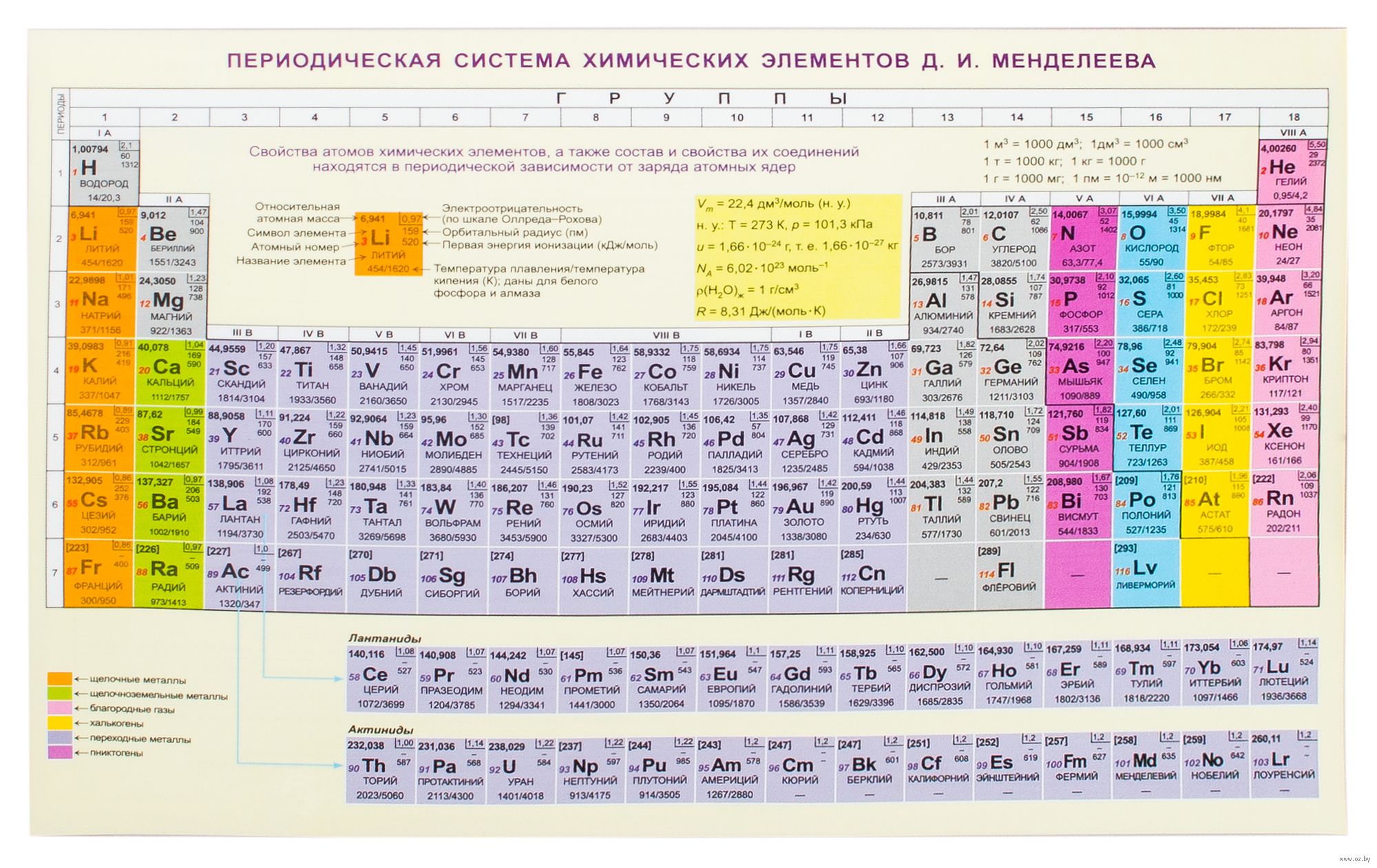
Если говорить об официальных таблицах элементов, используемых в европейских странах, сейчас в них фигурирует не больше 104-106 элементов — это максимум. Кстати, в последнее время в российских школьных учебниках химии все чаще встречаются довольно модернизированные таблицы, систематизация которых весьма далека от классического варианта. В дальнейшем, когда ребята становятся студентами и приходят обучаться в стены высших учебных заведений, у них возникает большая путаница.
Сама же процедура признания нового элемента довольна сложна. Одним из ключевых требований является то, что открытие должно быть перепроверено, экспериментально подтверждено двумя-тремя независимыми научными группами. В мире есть не так много лабораторий, сотрудникам которых удалось синтезировать один или даже несколько новых элементов. И в первую очередь, одну из лидирующих позиций здесь занимают российские исследователи — ученые объединенного института ядерных исследований в Дубне.
Урок изучения нового материала по теме “Интересно о самом главном.
 Периодическая система химических элементов Д.И.Менделеева”
Периодическая система химических элементов Д.И.Менделеева”Цели и задачи урока.
Дидактические: раскрыть смысл периодического закона и изучить закономерности периодической системы химических элементов.
- образовательные:
а) повторить понятие “химический элемент”, формы его существования и количественные характеристики, “амфотерность”;
б) изучить закономерности периодической системы – периоды и группы;
в) сформировать умение определять принадлежность химических элементов к металлам и неметаллам;
г) сформировать понятие о естественных семействах элементов: галогенах и щелочных металлах;
а) развивать познавательный интерес учащихся;
б) развивать умение характеризовать положение химического элемента по периодической системе;
в) развивать умение работать в группах при изучении новой темы;
- воспитательные:
а) формировать основные мировоззренческие представления о познаваемости неживой природы;
б) познакомить с ролью великого русского ученого Д.
И.Менделеева в развитии химической науки.
Психологические:
- Всестороннее развитие личности.
- Развитие личности ребенка, основанное на его возможностях, склонностях, интересах.
- Развитие творческих способностей.
- Максимальное вовлечение каждого ученика в образовательный процесс.
Воспитательные:
- Воспитывать чувство уважения к своему труду, к труду товарищей, к работе учителя.
- Развивать требовательность к себе и разумную требовательность к окружающим людям.
- Прививать аккуратность, бережливость, разумную осторожность при обращении с лабораторным оборудованием и химическими реактивами.
- Воспитывать чувство коллективизма.
Метапредметные связи урока:
- Физика.
- Математика.
- Литература.
Оборудование и реактивы.
- Штатив для пробирок с двумя пробирками – 2 шт.

- Раствор нитрата алюминия (Al(NO3 )3 ).
- Раствор гидроксида натрия (NaOH).
- Раствор соляной кислоты (HCl).
- Дидактический материал, таблицы:
- Периодическая система химических элементов Д.И. Менделеева.
- Портрет Д.И. Менделеева.
- Карточки с заданиями.
Урок проводится в компьютерном классе с использованием мультимедийного проектора и компьютеров.
ЭПИГРАФ УРОКА: (стихи Степана Щипачёва)
“…Другого ничего в природе нет,
Ни здесь, ни там, в космических глубинах:
Всё – от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой.
Входи в него, вдыхай, руками трогай”.
ХОД УРОКА
I. Определение темы урока
Учитель: Дорогие ребята, давайте
поприветствуем наших гостей! Уважаемые гости,
здравствуйте! Ребята, посмотрите на учебную
стену, слайды (Слайды № 2, 3) и скажите о чем
сегодня на уроке пойдет речь, какая тема нашего
урока. Ответ: Периодический закон и
периодическая система химических элементов
Д.И.Менделеева (Слайд № 4).
Ответ: Периодический закон и
периодическая система химических элементов
Д.И.Менделеева (Слайд № 4).
Презентация 2.
II. Целеполагание
Учитель: Тему урока определили. Определяем задачи урока. Д.И. Менделеев — разносторонний ученый, педагог, прогрессивный общественный деятель. Его работы, посвященные химии, физико-химии, физике, технике и промышленности, воздухоплаванию, метрологии, освоению Северо-морского пути, географии, проблемам народонаселения, воспитанию, сельскому хозяйству. лесному делу,… не поместились в 25 объемных томах!.
“Природа-мать,
Когда б таких людей
Ты иногда не посылала миру,
Заглохла б нива жизни…”.
Н.А. Некрасов
Но главное научное открытие Д.И.Менделеева –
какое? (Периодический закон). Периодический
закон, осветивший тайны природы и созданная на
его основе Периодическая система химических
элементов. Скажите вы впервые слышите о ПЗ и ПС?
Как Вы думаете для чего мы обозначили эту тему?
Ответ: Сегодня мы начнем работу с таблицей Д. И.
Менделеева, обобщим и углубим знания о
Периодическом законе и Периодической системе
Д.И. Менделеева, используя знания химии.
И.
Менделеева, обобщим и углубим знания о
Периодическом законе и Периодической системе
Д.И. Менделеева, используя знания химии.
(учащиеся записывают тему и число в листах-конспектах “Лист-первооткрывателя”)).
2. Актуализация опорных ЗУН.
Понятие о химическом элементе и знание его характеристик.
Фронтальная беседа и опорный конспект (задание №1).
– что такое химический элемент? (это вид атомов, обладающих одинаковыми свойствами)
– в каких формах он может существовать? (в виде одиночного атома, простого и сложного вещества)
– на какие группы делят простые и сложные вещества? (металлы и неметаллы, оксиды, основания, кислоты, соли)
– приведите примеры существования химического элемента водорода (одиночные атомы в космосе, водород и вода).
– какие вы знаете количественные характеристики атомов? (валентность и относительная атомная масса)
– что такое валентность? (это способность атомов присоединять к себе определенное число других атомов)
– что показывает атомная масса? (она показывает во сколько раз масса данного атома больше массы 1/12 атома углерода)
Страна наша небольшая, в ней проживает 109
жителей – элементов. У каждого жителя есть свой
дом – определённая клеточка. Клетки образуют
вертикальные и горизонтальные ряды, имеющие свои
названия, но, чтобы их узнать, вам придётся
расшифровать ребусы. (Слайд №1) Презентация
1.
У каждого жителя есть свой
дом – определённая клеточка. Клетки образуют
вертикальные и горизонтальные ряды, имеющие свои
названия, но, чтобы их узнать, вам придётся
расшифровать ребусы. (Слайд №1) Презентация
1.
Название горизонтального ряда:
Птичий мех, но не пух,
И без букв последних двух,
Плюс раствор для смазки ссадин,
Что сажают дети за день.
(период)
Учащиеся записывают в опорные конспекты: период – это горизонтальный ряд химических элементов.
В Периодической системе выделяют семь периодов, которые подразделяют на малые и большие. Малые периоды – это первый, второй, третий и седьмой; большие остальные.
А, теперь угадайте название столбца химических элементов:
Три буквы плода треугольного,
Две буквы от стола от школьного,
“П” между этими фрагментами…
Всё вместе – столбик с элементами!
(группа)
Учащиеся записывают в тетради: группа – это
вертикальный столбец химических элементов.
В Периодической системе насчитывается восемь групп. Внутри каждой группы выделяют главную и побочную подгруппы.
Задание №1: Определите “адрес” элементов по периодической таблице: номер элемента, период (номер периода, большой или малый), номер группы, подгруппу. Результаты занесите в таблицу. (Слайд № 5-6)
| Символ | Название | Порядковый номер | Номер периода | Тип периода | Номер группы | Подгруппа |
| Р | ||||||
| С | ||||||
| О | ||||||
| Fe | ||||||
| Cu | ||||||
| Са |
Вы готовы к путешествию? Тогда в путь!
“Другого ничего в природе нет,
Ни здесь, ни там, в космических глубинах:
Всё – от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой.
Входи в него, вдыхай, руками трогай”.
Учитель: Ребята, в стране “Химический элемент” много тайн и загадок. Жители этой страны очень разнообразны, порой даже противоречивы по характеру, но все они выполняют законы и обычаи своей страны и бережно хранят в памяти имя своего создателя. – Дмитрия Ивановича Менделеева. Сеогдня жители “Химического элемента” хотят проверить: готовы ли мы с вами соблюдать законы и обычаи страны? Жители страны нам задают вопрос, а мы очень быстро посылаем им ответ. Участвуют все. Первым отвечает тот, кто быстрее всех поднял руку. За правильный ответ – звезда.
Думаю, вы, ребята, замечали, что
“Мир сложен.
Он полон событий, сомнений,
И тайн бесконечных, и смелых догадок,
Как чудо Природы,
Является гений
И в хаосе этом
Находит порядок”.
Кого вы можете назвать гением в области химии по наведению порядка среди химических элементов?
УЧЕНИК: Гением можно назвать Д. И.
Менделеева.
И.
Менделеева.
Далее идет игра “Поэзия Периодического закона” (отдельная презентация). Класс делится на три команды. Выбирается судья, который за правильные ответы выдает звезды. Происходит как командное. Так и личное соревнование) по окончании игры подводят итог урока. А тот кто набрал больше всех звезд, получает право выступить в конце урока (подвести его итог). Это его звездный час.
Во время середины урока полезно сделать физкультминутку “Отдыхай-ка”.
Физкультминутка
Учащиеся работают стоя. Учитель читает стихи о химических элементах, а учащиеся должны определить металл или неметалл. Если учитель произносит название металла, то учащиеся поднимают руки вверх, а если неметалла, то хлопают в ладоши.
Я – элемент – давно известный,
Применяют повсеместно!
Польза от меня везде.
Нет железа – быть беде.Портит сера атмосферу,
А верней – её оксид.
Пожелтели листья в сквере,
Дождь кислотный моросит.Название от слова “цвет”.
Бесцветных соединений нет,
И весь секрет названья в том.
Элемент тот будет: хром.Помни, боевой народ,
Первый лекарь – это йод!
Раны мажь, не ойкай,
Йодною настойкой.Надо сильно попотеть
Вечером и утром,
Чтоб запомнить: слово “медь” –
По латыни – “купрум”.
Ядовит зелёный Хлор,
Замышляя страшный мор,
Он побег готовит в роли
Самой безобидной соли.Ах, какая аура
Окружает “аурум!”
Символ власти и кольца
Золота и Солнца.
Заключительная часть урока, подведение итогов.
Учитель: давайте подведем итог нашего урока. Давайте подсчитаем количество заработанных звезд. Какая команда победила? Как вам понравился урок? Удалось ли вам в полной мере показать свои знания, умения и навыки? Смогли ли вы уяснить непонятые вами разделы данной темы? Кто хочет из Вас выступить? У кого есть вопросы, замечания?
Спасибо, ребята, вы замечательно работали. Пришло время возвращаться из этой чудесной
страны.
Пришло время возвращаться из этой чудесной
страны.
Заканчивая урок, хочу сказать, что мы подошли к изучению II части этой важнейшей темы, а она перед вами откроет ещё большую глубину закона, о которой, сам Менделеев не знал, но догадывался, что ещё много открытий на основании закона будет сделано. Он писал “Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”.
Я хочу завершить нашу встречу строчками из стихотворения М.Глазкова “Таблица Менделеева”:
“Пусть в зимний день с метелями
Не навещает грусть
Таблицу Менделеева
Я знаю наизусть
Зачем её я выучил?
Могу сказать зачем,
В ней стройность и величие
Любимейших поэм.
Без многословья книжного
В ней смысла торжество,
И элемента лишнего
В ней нет ни одного
В ней пробужденья дерева
И вешних льдинок хруст
Таблицу Менделеева
Я знаю наизусть! ”
Конечно наизусть таблицу Менделеева знать не нужно, но понимать величайший закон природы – Периодический закон химических элементов должен современный, думающий, образованный и воспитанный Человек!
Приложение 3.
Приложение 4.
Приложение 5.
Приложение 6.
Приложение 7.
Литература.
- П.П. Попель, Л.С. Крикля “Химия 8 класс” – Киев. Издательский центр “Академия” 2008.
- “Химия в школе ” 1993, №2
- А.Д. Шукайло “Тематические игры по химии”, Москва “Творческий центр “Сфера” – 2003.
- А.А. Тыльдсепп, В.А. Корк “Мы изучаем химию”, Москва “Просвещение”, 1988.
Сколько периодов в периодической таблице
Здравствуйте, друзья! Как известно, таблица Менделеева – важное понятие в химии и науке. Итак, сегодня мы поговорим о , сколько периодов находится в Периодической таблице. Период в периодической таблице – это горизонтальный ряд, изображающий элементы с аналогичными химическими свойствами.
В периодической таблице 7 периодов. По мере прохождения каждого периода слева направо элементы демонстрируют схожие химические и физические свойства, а атомный номер элементов увеличивается.
Группы и периоды периодической таблицы
В химии периоды и группы – это два способа классификации элементов. Группы – это вертикальные столбцы в периодической таблице, а периоды – это горизонтальные строки в периодической таблице. Группы и периоды подчиняются определенным правилам в отношении свойств элементов. По мере того, как вы опускаетесь в группе, атомный номер увеличивается. Когда вы перемещаетесь по группе слева направо, атомный номер тоже увеличивается.
Что означают группа и период в периодической таблице
Группы – это вертикальные столбцы в периодической таблице, а периоды – это горизонтальные строки в периодической таблице. Правило, которому следует группа, состоит в том, что все элементы, принадлежащие к одной группе, имеют одинаковую валентность. И все элементы в периоде имеют одинаковое количество атомных орбиталей.
Разница между группой и периодом в таблице Менделеева
Как группами, так и периодами атомный номер увеличивается по мере движения вниз или вправо. В периодической таблице 18 групп, а количество периодов – 8.
В периодической таблице 18 групп, а количество периодов – 8.
В период, когда каждый идет слева направо, элемент теряет свои металлические свойства и становится менее металлическим, чем его предшественник. В то время как группы используются химиками для определения семейства элементов, поскольку они имеют схожие химические свойства и одинаковое количество электронов во внешней оболочке. Например, первая группа (Группа 1) относится к щелочным металлам.
Сколько периодов в периодической таблице?
Сколько периодов в периодической таблице?- Каждый горизонтальный ряд элементов в Периодической таблице известен как период .
- Периодическая таблица состоит из семи периодов, от периода 1 до периода 7. В таблице
- показаны изменения числа протонов и валентных электронов при переходе через Период 2.
Элемент в Период 2 Li Be B С N O F Ne Число протонов 3 4 5 6 7 8 9 10 Расположение электронов
2.  1
12,2 2,3 2,4 2,5 2,6 2,7 2,8 Число валентных электронов 1 2 3 4 5 6 7 8 - При переходе через период 2 и период 3 слева направо
- число протонов увеличивается на единицу от одного элемента к следующему
- число валентных электронов увеличивается на один от одного элемента к другому.
- При переходе через Период 2 и Период 3 физические свойства , и меняются определенным образом.
- Тенденция изменений свойств элементов за период может использоваться для прогнозирования свойств элемента в Период 2 и Период 3.
Таблица показывает некоторые свойства элементов периода 3.
| Элемент | Na | мг | Al | Si | -п. | S | Класс | Ar |
| Число протонов | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Расположение электронов | 2.8.1 | 2.8.2 | 2.8,3 | 2.8.4 | 2.8.5 | 2.8.6 | 2.8.7 | 2,8,8 |
| Атомный радиус (пм) | 186 | 160 | 143 | 118 | 110 | 104 | 100 | 94 |
| Электроотрицательность | 0,9 | 1,2 | 1,5 | 1,8 | 2,1 | 2,5 | 3,0 | – |
| Температура плавления (° C) | 98 | 649 | 660 | 1411 | 44 | 113 | -101 | –189 |
| Температура кипения (° C) | 886 | 1090 | 2467 | 2355 | 280 | 444 | -35 | –186 |
Атомный радиус (размер атома)
- Атомный радиус (размер атома) уменьшается на , когда проходит через период слева направо.

- Это можно объяснить на примере Периода 3 , как показано ниже.
- Все атомы элементов в периоде 3 имеют 3 оболочки, занятые электронами, , как показано расположением электронов в таблице выше.
- Протонное число увеличивается на в периоде 3 слева направо. Это вызывает увеличение на положительного заряда ядра при переходе через Период 3, как показано в Таблице.
Элемент Na мг Al Si -п. S Класс Ar Заряд ядра +11 +12 +13 + 14 +15 + 16 +17 +18 - Сила притяжения, оказываемая увеличивающимся зарядом ядра на электроны в первых трех занятых оболочках , становится сильнее , и эти электроны притягиваются ближе к ядру при переходе через Период 3.

- В результате атомный радиус (размер атома) уменьшается на при переходе через Период 3.
Электроотрицательность
- Электроотрицательность элемента – это величина силы атома этого элемента в молекуле, чтобы притягивали электроны к своему ядру.
- Электроотрицательность элементов увеличивается на при прохождении периода слева направо .
- Это можно объяснить следующим образом:
- Положительный заряд ядра увеличивается на за период (Период 2 или Период 3) из-за увеличения числа протонов.
- Атомный радиус уменьшается на за период (Период 2 или Период 3).
- Увеличение положительного заряда ядра и уменьшение размера атома за период вызывают увеличение силы ядра для притяжения электронов. Следовательно, электроотрицательность увеличивается на .

- В Период 2 или 3, металлов слева на меньше электроотрицательны, тогда как неметаллов справа на больше электроотрицательны.
Физические состояния
- Элементы в периоде 2 и периоде 3 изменяются с твердого вещества на газа при переходе через период.
- Металлы слева являются твердыми веществами, поскольку их температуры плавления и кипения высоки.
- (i) Неметаллы справа обычно представляют собой газов , потому что их температуры плавления и кипения низкие.
(ii) Однако некоторые неметаллы, такие как углерода из периода 2, а также кремний , фосфор и сера из периода 3, являются твердыми веществами . - Таблица показывает физические состояния элементов в период 2 и период 3.

Металлические свойства
- Металлические свойства элементов уменьшаются на при переходе через Период 2 или Период 3.
- Металлические свойства элемента измеряются по его электроположительности.
- За период металлов слева являются на более электроположительными , тогда как неметаллов справа являются на менее электроположительными.
- Закрашенные элементы на рисунке обладают как металлическими, так и неметаллическими свойствами.
- Эти элементы известны как металлоидов, или полуметаллов.
- Например, бор, кремний, германий, мышьяк, сурьма, теллур и полоний являются полуметаллами или металлоидами.
Полиметаллы (металлоиды) – элементы, промежуточные по свойствам между металлами и неметаллами.
- Элементы слева Периодической таблицы – это металлы, а элементы справа Периодической таблицы – неметаллы.
- При переходе через период металлических свойств слева изменяются на полуметаллических свойств и, наконец, на неметаллических свойств справа.
Электропроводность
В таблице показаны удельные электропроводности элементов в периоде 3.
| Na Mg Al | Хорошее проводников электроэнергии |
| Si | слабый проводник электричества, но становится хорошим проводником электричества (полупроводник) , когда легирует небольшим количеством бора или фосфора. |
| P S Cl Ar | Не может проводить электричество |
На основании приведенных выше значений электропроводности элементы периода 3 можно разделить на металлы, полуметаллы (или металлоиды) и неметаллы, как показано на рисунке.
- Элементы периода 3 можно разделить на металлы и неметаллы на основе основных или кислотных свойств их оксидов.
- Для классификации элементов периода 3 используются следующие способы.
- Металлы образуют оксиды только с основными свойствами.
- Некоторые металлы могут образовывать оксиды с кислотными и основными свойствами. Эти оксиды известны как амфотерные оксиды.
- Неметаллы образуют оксиды с кислотными свойствами Только .
- Свойства оксидов элементов в периоде 3 меняются с основных на амфотерные свойства и затем на кислотные свойства при переходе через этот период.
Цель: Изучить свойства оксидов элементов в периоде 3.
Постановка задачи: Как свойства оксидов элементов в периоде 3 меняются в течение периода?
Гипотеза: Кислотные свойства оксидов элементов увеличиваются, тогда как основные свойства оксидов элементов уменьшаются по мере прохождения периода 3.
Переменные:
(a) Управляемая переменная: Типы оксидов элементов в периоде 3
(b) Реагирующие переменные: значения pH в воде, растворимость оксидов в кислоте и щелочи
(c) Контролируемая переменная: вода, азотная кислота, раствор гидроксида натрия
Оперативное определение:
- Оксиды, растворяющиеся в воде с образованием растворов со значением pH менее 7, являются кислыми, а значения pH более 7 – щелочными.
- Оксиды, растворяющиеся в кислоте, проявляют основные свойства.
- Оксиды, растворяющиеся в щелочи, проявляют кислотные свойства.
- Оксиды, растворяющиеся как в кислотах, так и в щелочах, проявляют амфотерные свойства.

Материалы: Оксид натрия, Na 2 O, оксид магния, MgO, оксид алюминия, Al 2 O 3 , оксид кремния (IV), SiO 2 , пятиокись фосфора, P 4 O 10 , диоксид серы, SO 2 газ в закрытом сосуде для газа, гептоксид дихлора, Cl 2 O 7 , универсальный индикатор, 2 моль дм -3 азотная кислота, 2 моль дм -3 раствор гидроксида натрия и дистиллированная вода.
Аппаратура: Пробирки для кипячения, пробирки, 100 см 3 мерный цилиндр, горелка Бунзена, держатель пробирок, стеклянный стержень и шпатель
.
Процедура:
A. Кислотные / основные свойства оксидов элементов в периоде 3
- Небольшое количество порошка оксида натрия добавляют к 2 см 3 дистиллированной воды в пробирке. Смесь хорошо перемешивают стеклянной палочкой до тех пор, пока не перестанет происходить дальнейшее изменение.

- Затем добавляют две капли универсального индикатора и хорошо встряхивают.Затем регистрируют pH раствора.
- Шаги 1–2 повторяются с использованием Шагов 1–2 повторяются с использованием MgO, Al 2 O 3 , SiO 2 , P 4 O 10 , SO 2 и Cl 2O 7 для замены оксида натрия. Для газообразного диоксида серы газ барботируют через 2 см 3 дистиллированной воды в пробирке.
Б. Амфотерные свойства оксидов элементов в период 3
- 5 см 3 2 моль дм -3 азотной кислоты и 5 см 3 2 моль дм -3 раствор гидроксида натрия помещают в две отдельные кипящие трубки соответственно.
- В каждую из двух трубок для кипячения добавляется небольшое количество порошка оксида алюминия.
- Трубки для кипячения нагревают и хорошо встряхивают, пока не перестанут происходить изменения.

- Все изменения фиксируются.
- Шаги с 1 по 4 повторяются с использованием оксида магния и оксида кремния (IV) соответственно для замены оксида алюминия.
Результаты:
A. Кислотные / основные свойства оксидов элементов периода 3
| Оксид | Наблюдение | Вывод | |
| С водой | С универсальным индикатором | ||
| Na 2 0 | Белый порошок растворяет в воде с образованием бесцветного раствора . | pH образовавшегося раствора = 13-14 | Образовавшийся раствор является сильной щелочью. Оксид натрия – это основной оксид. Следовательно, натрий проявляет металлические свойства. |
| MgO | Белый порошок слегка растворяется в с образованием бесцветного раствора .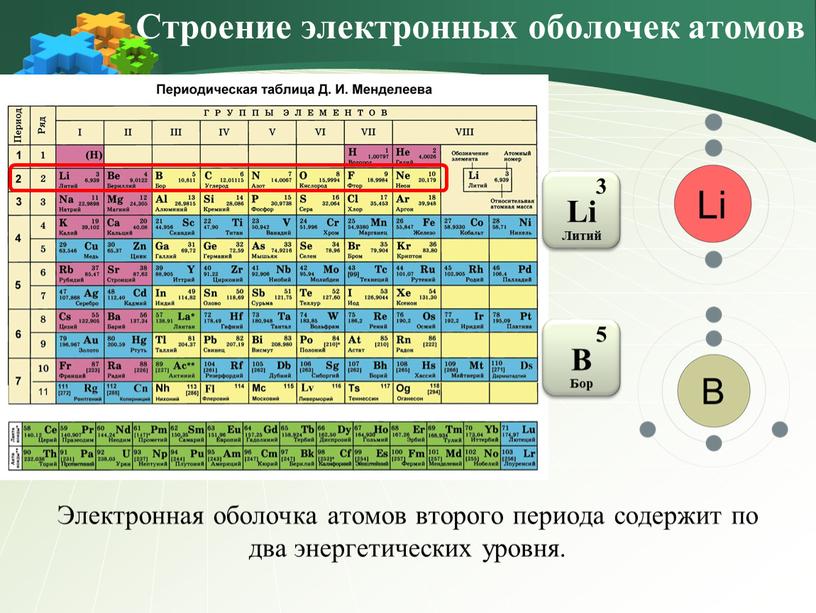 Большинство белого порошка не растворяется в воде. Большинство белого порошка не растворяется в воде. | pH образовавшегося раствора = от 8 до 9 | Образующийся раствор представляет собой слабую щелочь.Оксид магния – это основной оксид. Следовательно, магний проявляет металлические свойства. |
| Al 2 O 3 | Белый порошок не растворяется в воде . | Без изменений (pH = 7) | – |
| SiO 2 | Белый порошок не растворяется в воде . | Без изменений (pH = 7) | – |
П 4 О 10 | Белый порошок растворяет с образованием бесцветного раствора . | pH образовавшегося раствора = от 2 до 3 | Образовавшийся раствор кислый. Пятиокись фосфора – это кислый оксид. Следовательно, фосфор проявляет неметаллические свойства. |
| СО 2 | Бесцветный газ растворяет с образованием бесцветного раствора . | pH образовавшегося раствора = 3 | Образовавшийся раствор кислый. Диоксид серы – это кислый оксид. Следовательно, сера проявляет неметаллические свойства. |
| Класс 2 O 7 | Жидкость растворяет с образованием бесцветного раствора . | pH образовавшегося раствора = 1 | Образуется раствор сильной кислоты. Гептоксид дихлора представляет собой кислый оксид. Следовательно, хлор проявляет неметаллические свойства. |
Б. Амфотерные свойства оксидов элементов в периоде 3
| Оксид | Наблюдение | Вывод | |
| С раствором гидроксида натрия | С разбавленной азотной кислотой | ||
| Al 2 O 3 | Белый порошок растворяет с образованием бесцветного раствора . | Белый порошок растворяет с образованием бесцветного раствора . | Оксид алюминия проявляет кислотные и основные свойства, то есть амфотерные свойства. Следовательно, алюминий как металл образует амфотерный оксид. |
| MgO | Без изменений. Белый порошок не растворяется. | Белый порошок растворяет с образованием бесцветного раствора . | Оксид магния проявляет только основные свойства.Следовательно, магний как металл образует основной оксид. |
| SiO 2 , | Белый порошок растворяет с образованием бесцветного раствора . | Без изменений. Белый порошок не растворяется. | Оксид кремния (IV) проявляет только кислотные свойства. Следовательно, кремний, как неметалл, образует кислый оксид. |
Обсуждение:
A. Кислотные / основные свойства оксидов элементов периода 3
- Оксид натрия легко растворяется в воде, а оксид магния слегка растворяется в воде с образованием щелочных растворов .Следовательно, натрий и магний проявляют металлических свойств .
- Оксид алюминия и оксид кремния (IV) нерастворимы в воде.
- Пятиокись фосфора, диоксид серы и гептоксид дихлора растворяются в воде с образованием кислых растворов . Следовательно, фосфор, сера и хлор проявляют неметаллических свойств.
Б. Амфотерные свойства оксидов элементов в период 3
- Все кислотных оксидов могут растворяться в щелочах с образованием соли и воды, , тогда как все основных оксидов могут растворяться в кислотах с образованием соли и воды.
 Эти реакции известны как нейтрализация .
Эти реакции известны как нейтрализация . - Оксид магния может растворяться только в разбавленной азотной кислоте, но не может растворяться в растворе гидроксида натрия. Следовательно, оксид магния проявляет только основных свойств.
- Оксид алюминия может растворяться в как разбавленной азотной кислоте , так и растворе гидроксида натрия. Следовательно, оксид алюминия проявляет как основных, так и кислотных свойств, , то есть амфотерных свойств.
- Оксид кремния (IV) не может растворить в разбавленной азотной кислоте, но может растворить в растворе гидроксида натрия. Следовательно, оксид кремния (IV) проявляет только кислотные свойства.
- Свойства оксидов элементов в периоде 3 можно резюмировать, как показано в таблице.

Оксиды элементов в периоде 3 Na 2 O MgO Al 2 O 3 SiO 2 П 4 О 10 СО 2 Класс 2 O 7 Свойства оксидов Базовый Базовый Амфотерный Кислый Кислый Кислый Кислый
Заключение:
При прохождении периода 3 слева направо свойства оксидов элементов меняются с основных на кислые.Следовательно, гипотеза может быть принята.
Использование полуметаллов (металлоидов) в промышленности
- Кремний, как полуметалл (металлоид), – это слабый проводник электричества .

- В промышленности кремний легирован бором или фосфором , так что он становится хорошим проводником электричества, известным как полупроводник .
- Полупроводники используются в микроэлектронной промышленности для производства диодов, транзисторов, и других электронных компонентов.
- Эти электронные компоненты используются для производства микрочипов , которые представляют собой интегральные схемы, содержащие множество электронных компонентов на небольших тонких кусочках кремниевой пластины .
- Микрочипы – это , широко используемые в производстве компьютеров, калькуляторов, сотовых телефонов, видеокамер, видеомагнитофонов, телевизоров и другого микроэлектронного оборудования.
- Помимо кремния, германий – еще один полуметалл или металлоид, используемый в микроэлектронной промышленности.

6.4: Современная периодическая таблица – периоды и группы
- Последнее обновление
- Сохранить как PDF
- Современная периодическая таблица
- Сводка
- Узнать больше
- Авторы и ссылки
Языки меняются со временем.Новые слова входят в язык, а старые слова часто исчезают из-за отсутствия использования. Словари публикуются, чтобы люди могли успевать за изменениями языка и правильно использовать слова. Эти публикации могут быть в печатном или электронном виде. Словари можно найти в Интернете, а приложения доступны для смартфонов. Словари неоценимы для хорошего и надежного общения.
Современная периодическая таблица
Периодическая таблица Менделеева и Мозли претерпела значительные изменения. Было открыто много новых элементов, а другие синтезированы искусственно. Каждый правильно вписывается в группу элементов с похожими свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе.
Было открыто много новых элементов, а другие синтезированы искусственно. Каждый правильно вписывается в группу элементов с похожими свойствами. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе.
На рисунке ниже показана наиболее часто используемая форма таблицы Менделеева. Каждый квадрат показывает химический символ элемента вместе с его названием.Обратите внимание, что некоторые символы не связаны с названием элемента: \ (\ ce {Fe} \) для железа, \ (\ ce {Pb} \) для свинца и т. Д. Большинство из них являются элементами, которые были известны с древних времен и имеют символы, основанные на их латинских названиях. Атомный номер каждого элемента написан над символом.
Период – горизонтальная строка периодической таблицы. В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу. Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами.В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов. Периоды 4 и 5 содержат 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Эти две строки выдвинуты, чтобы таблица могла уместиться на одной странице.
Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами.В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов. Периоды 4 и 5 содержат 18 элементов. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Эти две строки выдвинуты, чтобы таблица могла уместиться на одной странице.
Группа – это вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки. Всего насчитывается 18 групп.Есть две разные системы нумерации, которые обычно используются для обозначения групп, и вы должны быть знакомы с обеими. Традиционная система, используемая в Соединенных Штатах, включает использование букв A и B. Первые две группы – это 1A и 2A, а последние шесть групп – от 3A до 8A. Средние группы используют B в своих названиях. К сожалению, в Европе действовала несколько иная система. Чтобы избежать путаницы, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Многие периодические таблицы показывают обе системы одновременно.
Многие периодические таблицы показывают обе системы одновременно.
Сводка
- Таблица Менделеева расположена в порядке атомных номеров.
- Период – это горизонтальная строка периодической таблицы.
- Группа представляет собой вертикальный ряд периодической таблицы Менделеева.
Узнать больше
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
- pontotriplo.org/triplepoint/2…ic_tables.html
1. Выберите периодическую таблицу из столбца «лучший», который вам больше всего нравится.Почему вы выбрали этот стол?
2. Какая таблица Менделеева из раздела “конкретного” вам больше всего нравится? Почему?
3. Какая из «забавных» периодических таблиц вам больше всего нравится? Почему?
Авторы и авторство
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Сколько периодов в таблице Менделеева 11 класс химии CBSE
Подсказка: Это вопрос полностью фактического типа, связанный с устройством периодической таблицы Менделеева.
– Точки представляют собой горизонтально расположенные наборы элементов.
Полный пошаговый ответ:
– В вопросе задается вопрос о том, сколько периодов в периодической таблице. Это полностью фактический вопрос о периодической таблице. Из низших классов мы изучаем периодическую таблицу Менделеева. .Периодическая таблица – это таблица, в которой химические элементы расположены в соответствии с порядком возрастания их атомных номеров. Атомный номер представляет собой количество электронов и количество протонов, присутствующих в атоме элемента,
– Мы знаем, что там Известно 118 элементов, и они помещены в периодической таблице в определенном порядке.Эти 118 элементов размещены в различных группах и периодах. Группа в периодической таблице представляет расположение элементов в вертикальном положении, то есть сверху вниз по таблице и в периоде, элементы расположены в виде горизонтальных линий слева. направо.
– 118 элементов организованы в 18 групп и 7 периодов в периодической таблице.
Итак, теперь мы знаем, что в периодической таблице 7 периодов.
– Элементы в одном периоде будут иметь одинаковое количество оболочек и одинаковые валентные оболочки, а количество валентных электронов увеличивается на единицу, когда мы перемещаемся слева направо от таблицы, поскольку атомный номер увеличивается, тем самым увеличивая число электронов.
– Если мы движемся слева направо через период, размер атома уменьшается, поскольку все элементы содержат одинаковое количество оболочек, а количество электронов и эффективный заряд ядра увеличиваются, из-за чего валентные электроны испытывают большее притяжение к ядру и, следовательно, размер уменьшается.
Если двигаться слева направо от таблицы Менделеева, металлический характер уменьшается, а электроотрицательный характер увеличивается.
Примечание: Число периода равно количеству уровней энергии или оболочек, имеющихся в атоме элемента, и элементы, помещенные в тот же период, не обладают аналогичными химическими свойствами. Если будут обнаружены еще какие-либо элементы, они будут помещены в восьмой период, где будет важна концепция g-орбитали.
Если будут обнаружены еще какие-либо элементы, они будут помещены в восьмой период, где будет важна концепция g-орбитали.
Как элементы сгруппированы в Периодической таблице?
В конце 19 века русский химик Дмитрий Менделеев опубликовал свою первую попытку сгруппировать химические элементы по их атомному весу. В то время было известно только около 60 элементов, но Менделеев понимал, что, когда элементы были организованы по весу, определенные типы элементов возникали через равные промежутки времени или периоды.
Сегодня, 150 лет спустя, химики официально признают 118 элементов (после добавления четырех новичков в 2016 году) и до сих пор используют периодическую таблицу элементов Менделеева для их организации. Таблица начинается с простейшего атома, водорода, а затем упорядочиваются остальные элементы по атомным номерам, которые представляют собой количество протонов, содержащихся в каждом. За некоторыми исключениями порядок элементов соответствует увеличению массы каждого атома.
В таблице семь строк и 18 столбцов.Каждая строка представляет один период; номер периода элемента показывает, сколько из его энергетических уровней содержат электроны. Например, натрий находится в третьем периоде, что означает, что атом натрия обычно имеет электроны на первых трех энергетических уровнях. Двигаясь вниз по таблице, периоды становятся длиннее, потому что для заполнения более крупных и сложных внешних уровней требуется больше электронов.
Столбцы таблицы представляют группы или семейства элементов. Элементы в группе часто выглядят и ведут себя одинаково, потому что у них одинаковое количество электронов во внешней оболочке – лице, которое они показывают миру.Элементы группы 18, например, в крайней правой части таблицы, имеют полностью сплошные внешние оболочки и редко участвуют в химических реакциях.
Элементы обычно классифицируются как металлические или неметаллические, но разделительная линия между ними нечеткая. Металлические элементы обычно являются хорошими проводниками электричества и тепла. Подгруппы металлов основаны на схожих характеристиках и химических свойствах этих коллекций. Согласно данным Лос-Аламосской национальной лаборатории, в нашем описании периодической таблицы используются общепринятые группы элементов.
Подгруппы металлов основаны на схожих характеристиках и химических свойствах этих коллекций. Согласно данным Лос-Аламосской национальной лаборатории, в нашем описании периодической таблицы используются общепринятые группы элементов.
Щелочные металлы: Щелочные металлы составляют большую часть группы 1, первого столбца таблицы. Эти блестящие и достаточно мягкие, чтобы разрезать ножом, эти металлы начинаются с лития (Li) и заканчиваются францием (Fr). Они также чрезвычайно реактивны и воспламеняются или даже взрываются при контакте с водой, поэтому химики хранят их в маслах или инертных газах. Водород с одним электроном также находится в группе 1, но газ считается неметаллом.
Щелочноземельные металлы: Щелочноземельные металлы составляют 2-ю группу периодической таблицы, от бериллия (Be) до радия (Ra).Каждый из этих элементов имеет два электрона на внешнем энергетическом уровне, что делает щелочноземельные земли достаточно реактивными, поэтому их редко можно встретить в природе в одиночку. Но они не так реактивны, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Но они не так реактивны, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Lanthanides: Третья группа слишком длинна, чтобы поместиться в третий столбец, поэтому она разорвана и перевернута в сторону, чтобы стать верхней строкой острова, плавающего в нижней части таблицы.Это лантаноиды, элементы с 57 по 71 – от лантана (La) до лютеция (Lu). Элементы этой группы имеют серебристо-белый цвет и тускнеют при контакте с воздухом.
Актиниды: Актиниды выстилают нижний ряд острова и включают элементы от 89, актиний (Ac) до 103, лоуренсий (Lr). Из этих элементов только торий (Th) и уран (U) встречаются на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Переходные металлы: Возвращаясь к основной части таблицы, остатки групп с 3 по 12 представляют остальные переходные металлы. Твердые, но пластичные, блестящие и обладающие хорошей проводимостью, эти элементы – это то, о чем вы обычно думаете, когда слышите слово «металл». Здесь живут многие из лучших хитов металлического мира, включая золото, серебро, железо и платину.
Твердые, но пластичные, блестящие и обладающие хорошей проводимостью, эти элементы – это то, о чем вы обычно думаете, когда слышите слово «металл». Здесь живут многие из лучших хитов металлического мира, включая золото, серебро, железо и платину.
Металлы после перехода: Перед прыжком в мир неметаллов общие характеристики не разделены аккуратно по вертикальным групповым линиям.Постпереходными металлами являются алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi), и они охватывают группы с 13 по 17. Эти элементы обладают некоторыми из классических характеристик переходных металлов, но они, как правило, более мягкие и проводят хуже, чем другие переходные металлы. Во многих периодических таблицах жирным шрифтом будет выделена линия «лестницы» под диагональю, соединяющей бор с астатом. Постпереходные металлы кластеры в нижнем левом углу этой линии.
Металлоиды: Металлоиды: бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te) и полоний (Po).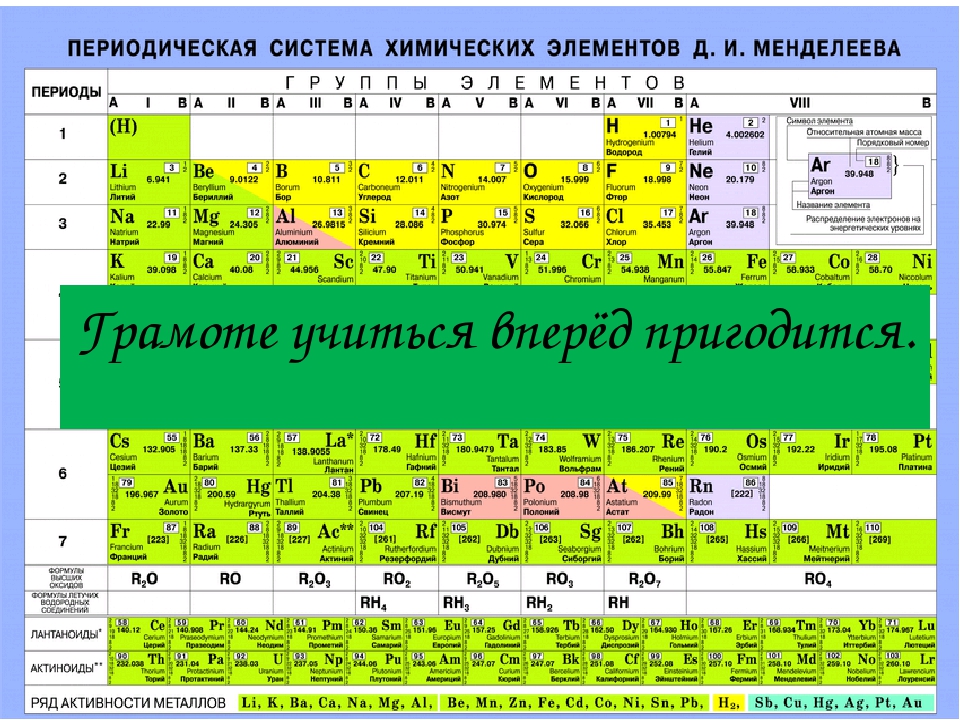 Они образуют лестницу, символизирующую постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Они образуют лестницу, символизирующую постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Неметаллы: Все остальное в правом верхнем углу лестницы – плюс водород (H), скрученный назад в Группе 1 – является неметаллом.К ним относятся углерод (C), азот (N), фосфор (P), кислород (O), сера (S) и селен (Se).
Галогены: Четыре верхних элемента Группы 17, от фтора (F) до астата (At), представляют собой одно из двух подмножеств неметаллов. Галогены довольно химически реактивны и имеют тенденцию образовывать пары со щелочными металлами с образованием различных типов солей. Например, поваренная соль на вашей кухне – это смесь щелочного металла натрия и галогенового хлора.
Благородные газы: Бесцветные, без запаха и почти полностью инертные, инертные или инертные газы завершают таблицу в группе 18. Многие химики ожидают, что оганессон, один из четырех недавно названных элементов, будет обладать этими характеристиками; однако, поскольку этот элемент имеет период полураспада, измеряемый в миллисекундах, никто не смог проверить его напрямую. Оганессон завершает седьмой период периодической таблицы, поэтому, если кому-то удастся синтезировать элемент 119 (а гонка за это уже ведется), он перейдет в цикл, чтобы начать восьмую строку в столбце щелочного металла.
Многие химики ожидают, что оганессон, один из четырех недавно названных элементов, будет обладать этими характеристиками; однако, поскольку этот элемент имеет период полураспада, измеряемый в миллисекундах, никто не смог проверить его напрямую. Оганессон завершает седьмой период периодической таблицы, поэтому, если кому-то удастся синтезировать элемент 119 (а гонка за это уже ведется), он перейдет в цикл, чтобы начать восьмую строку в столбце щелочного металла.
Из-за цикличности, создаваемой периодичностью, дающей название таблице, некоторые химики предпочитают визуализировать таблицу Менделеева в виде круга.
Дополнительные ресурсов :
сколько периодов в периодической таблице
Столбцы называются группами. C. Неметаллы. Следовательно, сера проявляет неметаллические свойства. Свойства оксидов элементов в период 3, решения ICSE по краткой математике 10 класса, решения ICSE по краткой химии 10, решения ICSE по краткой математике 9 класса.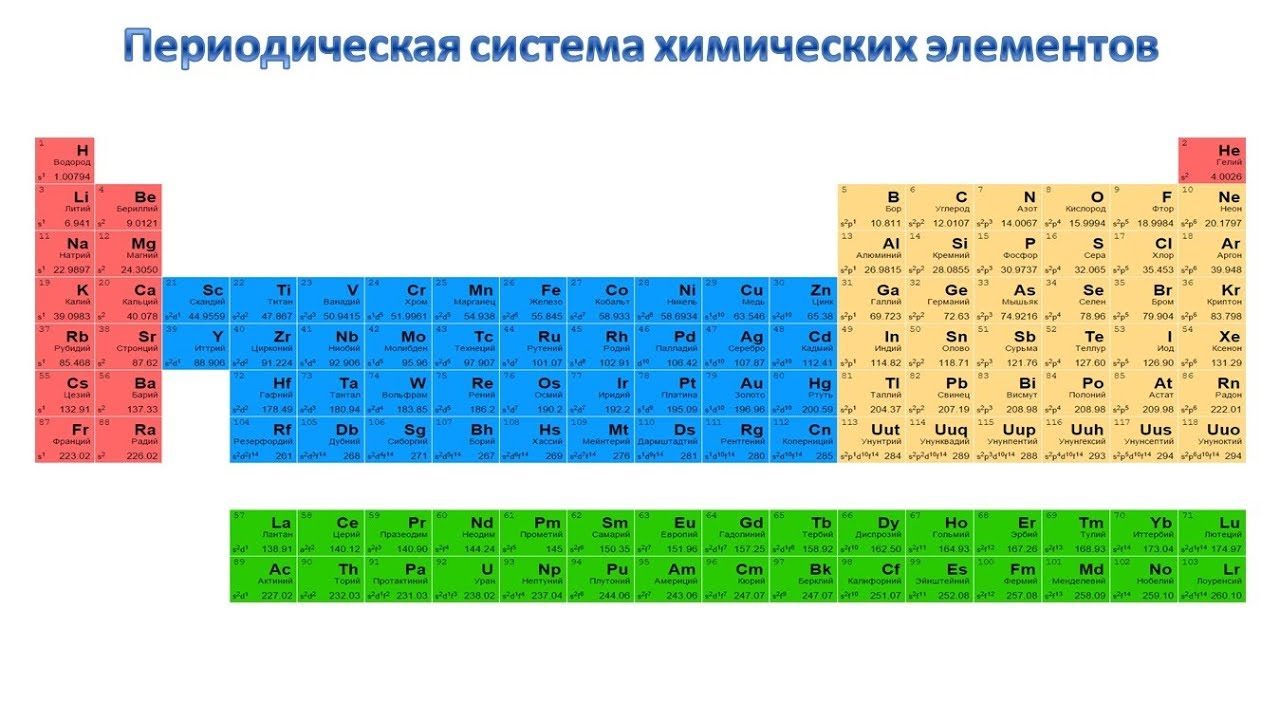 Образовавшийся раствор кислый. Язык меняется со временем. Первые две группы – это 1А и 2А, а последние шесть групп – от 3А до 8А.При переходе через Период 2 и Период 3 слева направо число протонов увеличивается на единицу от одного элемента к другому. Почему? Написание писем | Типы написания писем, Как писать?, Советы по написанию писем, Образцы прощальных писем | Пример, образец и как написать образец прощального письма, 5 образцов праздничных писем | Как написать? В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу. Их выдвигают, чтобы сама таблица умещалась на одной странице.Образцы писем об увольнении | Формат, образец, пример и как написать образец письма об увольнении? Мнемоника – это легко запоминающиеся строки или фразы, которые можно использовать для запоминания вещей, которые трудно выучить. 5. Оксид кремния (IV) проявляет только кислотные свойства. A. Ca. В таблице показаны изменения числа протонов и валентных электронов при переходе в Период 2.
Образовавшийся раствор кислый. Язык меняется со временем. Первые две группы – это 1А и 2А, а последние шесть групп – от 3А до 8А.При переходе через Период 2 и Период 3 слева направо число протонов увеличивается на единицу от одного элемента к другому. Почему? Написание писем | Типы написания писем, Как писать?, Советы по написанию писем, Образцы прощальных писем | Пример, образец и как написать образец прощального письма, 5 образцов праздничных писем | Как написать? В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу. Их выдвигают, чтобы сама таблица умещалась на одной странице.Образцы писем об увольнении | Формат, образец, пример и как написать образец письма об увольнении? Мнемоника – это легко запоминающиеся строки или фразы, которые можно использовать для запоминания вещей, которые трудно выучить. 5. Оксид кремния (IV) проявляет только кислотные свойства. A. Ca. В таблице показаны изменения числа протонов и валентных электронов при переходе в Период 2. Пятиокись фосфора представляет собой кислый оксид. Почему? В 4-м и 5-м периодах всего 18 элементов. Менделеев разделил свою таблицу Менделеева на восемь групп и семь… Элементов в.Когда химические элементы расположены таким образом, в их свойствах существует повторяющийся образец, называемый «периодическим законом», в котором элементы в одном столбце (группе) имеют схожие свойства. Закрашенные элементы на рисунке обладают как металлическими, так и неметаллическими свойствами. Большинство из них – элементы, известные с древних времен и имеющие символы, основанные на их латинских названиях. Объяснение Периодической таблицы Менделеева: Элементы расположены в периодической таблице в порядке возрастания их относительных атомных масс.Назовите и укажите следующее со ссылкой на элементы первых трех периодов таблицы Менделеева. Сколько элементов составляют седьмую (7) группу? (d) Подобная электронная конфигурация повторяется через интервалы 2, 8, 8, 18 и 32 в длинной форме таблицы Менделеева. В настоящее время в периодической таблице Менделеева семь полных периодов, включающих 118 известных элементов.
Пятиокись фосфора представляет собой кислый оксид. Почему? В 4-м и 5-м периодах всего 18 элементов. Менделеев разделил свою таблицу Менделеева на восемь групп и семь… Элементов в.Когда химические элементы расположены таким образом, в их свойствах существует повторяющийся образец, называемый «периодическим законом», в котором элементы в одном столбце (группе) имеют схожие свойства. Закрашенные элементы на рисунке обладают как металлическими, так и неметаллическими свойствами. Большинство из них – элементы, известные с древних времен и имеющие символы, основанные на их латинских названиях. Объяснение Периодической таблицы Менделеева: Элементы расположены в периодической таблице в порядке возрастания их относительных атомных масс.Назовите и укажите следующее со ссылкой на элементы первых трех периодов таблицы Менделеева. Сколько элементов составляют седьмую (7) группу? (d) Подобная электронная конфигурация повторяется через интервалы 2, 8, 8, 18 и 32 в длинной форме таблицы Менделеева. В настоящее время в периодической таблице Менделеева семь полных периодов, включающих 118 известных элементов. Назовите… Упражнение 5 (В) | Q 3.11 | Страница 94. В современной периодической таблице 18 групп и 7 периодов. Точка – это горизонтальный ряд периодической таблицы.Было создано много периодических таблиц, но самой важной из них была таблица Менделеева. Но по мере увеличения размера атома и тенденции к потере электронов возрастает металлический характер группы. Следовательно, фосфор проявляет неметаллические свойства. Сколько элементов составляют период один (1)? Сколько периодов в периодической таблице … A.Li B.Si C.Br D.Ne Br, наряду с F, галогеном (столбец 7 периодической таблицы) Посмотрите на периодическую таблицу. Аппаратура: пробирки для кипячения, пробирки, мерный цилиндр на 100 см3, горелка Бунзена, держатель для пробирок, стеклянный стержень и шпатель.Затем регистрируют pH раствора. Свойства оксидов элементов в периоде 3 изменяются с. Щелкните, чтобы увидеть правильный ответ. A. Затем добавляют две капли универсального индикатора и хорошо встряхивают. В семи строках таблицы, называемых периодами, металлы обычно находятся слева, а неметаллы – справа.
Назовите… Упражнение 5 (В) | Q 3.11 | Страница 94. В современной периодической таблице 18 групп и 7 периодов. Точка – это горизонтальный ряд периодической таблицы.Было создано много периодических таблиц, но самой важной из них была таблица Менделеева. Но по мере увеличения размера атома и тенденции к потере электронов возрастает металлический характер группы. Следовательно, фосфор проявляет неметаллические свойства. Сколько элементов составляют период один (1)? Сколько периодов в периодической таблице … A.Li B.Si C.Br D.Ne Br, наряду с F, галогеном (столбец 7 периодической таблицы) Посмотрите на периодическую таблицу. Аппаратура: пробирки для кипячения, пробирки, мерный цилиндр на 100 см3, горелка Бунзена, держатель для пробирок, стеклянный стержень и шпатель.Затем регистрируют pH раствора. Свойства оксидов элементов в периоде 3 изменяются с. Щелкните, чтобы увидеть правильный ответ. A. Затем добавляют две капли универсального индикатора и хорошо встряхивают. В семи строках таблицы, называемых периодами, металлы обычно находятся слева, а неметаллы – справа. Ответ: A. Гептоксид дихлора – это кислый оксид. Шаги 1-2 повторяются с использованием шагов 1-2 повторяются с использованием MgO, Al. Химия. Каждая строка элементов периодической таблицы называется периодом.Следовательно, магний как металл образует основной оксид. Сколько периодов составляет таблица Менделеева? Периоды 4 и 5 содержат 18 элементов. Это означает, что в периодической таблице всего 7 периодов. Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы: http://pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html, http://www.flickr.com/photos/crdot/5510511588/, http: // www. .ck12.org / book / CK-12-Chemistry-Concepts-Intermediate /. Какая таблица Менделеева в «конкретном» разделе вам больше всего нравится? Четвертый и пятый периоды имеют по 18 элементов, а более поздние периоды настолько длинные, что сегмент из каждого удаляется и помещается под основной частью таблицы.Периодическая таблица состоит из семи периодов, от периода 1 до периода 7. Периодическая таблица Менделеева.
Ответ: A. Гептоксид дихлора – это кислый оксид. Шаги 1-2 повторяются с использованием шагов 1-2 повторяются с использованием MgO, Al. Химия. Каждая строка элементов периодической таблицы называется периодом.Следовательно, магний как металл образует основной оксид. Сколько периодов составляет таблица Менделеева? Периоды 4 и 5 содержат 18 элементов. Это означает, что в периодической таблице всего 7 периодов. Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы: http://pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html, http://www.flickr.com/photos/crdot/5510511588/, http: // www. .ck12.org / book / CK-12-Chemistry-Concepts-Intermediate /. Какая таблица Менделеева в «конкретном» разделе вам больше всего нравится? Четвертый и пятый периоды имеют по 18 элементов, а более поздние периоды настолько длинные, что сегмент из каждого удаляется и помещается под основной частью таблицы.Периодическая таблица состоит из семи периодов, от периода 1 до периода 7. Периодическая таблица Менделеева. Следовательно, алюминий как металл образует амфотерный оксид. Шестой период имеет главное квантовое число n = 6, содержит 32 элемента. К сожалению, в Европе действовала несколько иная система. Шаги с 1 по 4 повторяются с использованием оксида магния и оксида кремния (IV) соответственно для замены оксида алюминия. Гипотеза: Кислотные свойства оксидов элементов увеличиваются, тогда как основные свойства оксидов элементов уменьшаются по мере прохождения периода 3.Структура таблицы показывает периодические тенденции. 7. Щелочной металл в периоде 3 растворяется в воде с образованием сильной щелочи. Сегодняшняя таблица Менделеева состоит из двух частей: групп и периодов. Сколько элементов составляют шестой (6) период? При прохождении Периода 2 и Периода 3 слева направо, При прохождении Периода 2 и Периода 3 оба, Все атомы элементов в Периоде 3 имеют, Увеличение положительного ядерного заряда и уменьшение размера атома за период вызывают при увеличении, Элементы в Период 2 и Период 3 изменяются с.
Следовательно, алюминий как металл образует амфотерный оксид. Шестой период имеет главное квантовое число n = 6, содержит 32 элемента. К сожалению, в Европе действовала несколько иная система. Шаги с 1 по 4 повторяются с использованием оксида магния и оксида кремния (IV) соответственно для замены оксида алюминия. Гипотеза: Кислотные свойства оксидов элементов увеличиваются, тогда как основные свойства оксидов элементов уменьшаются по мере прохождения периода 3.Структура таблицы показывает периодические тенденции. 7. Щелочной металл в периоде 3 растворяется в воде с образованием сильной щелочи. Сегодняшняя таблица Менделеева состоит из двух частей: групп и периодов. Сколько элементов составляют шестой (6) период? При прохождении Периода 2 и Периода 3 слева направо, При прохождении Периода 2 и Периода 3 оба, Все атомы элементов в Периоде 3 имеют, Увеличение положительного ядерного заряда и уменьшение размера атома за период вызывают при увеличении, Элементы в Период 2 и Период 3 изменяются с. ПОСМОТРЕТЬ РЕШЕНИЕ. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе. В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов. 7 марта, 2021 – Сколько групп и периодов присутствует в современной периодической таблице? A) 18 групп, 7 периодовb) 9 групп, 9 периодовsc) 7 групп, 7 периодовd) 8 групп, 7 периодов Правильный ответ – вариант ‘A’. 7. Объясните свой ответ.18. Пробирки для кипячения нагревают и хорошо встряхивают до тех пор, пока не перестанут происходить изменения. Многие периодические таблицы показывают обе системы одновременно. ii) При перемещении слева направо по периоду атомный размер и металлический характер элементов уменьшаются. Периодическая таблица, в полной периодической таблице элементов, в химии, организованный массив всех химических элементов в порядке возрастания атомного номера, то есть общее количество протонов в атомном ядре.
ПОСМОТРЕТЬ РЕШЕНИЕ. Периодическая таблица представляет собой расположение элементов в порядке их атомных номеров, так что элементы с аналогичными свойствами появляются в одном вертикальном столбце или группе. В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов. 7 марта, 2021 – Сколько групп и периодов присутствует в современной периодической таблице? A) 18 групп, 7 периодовb) 9 групп, 9 периодовsc) 7 групп, 7 периодовd) 8 групп, 7 периодов Правильный ответ – вариант ‘A’. 7. Объясните свой ответ.18. Пробирки для кипячения нагревают и хорошо встряхивают до тех пор, пока не перестанут происходить изменения. Многие периодические таблицы показывают обе системы одновременно. ii) При перемещении слева направо по периоду атомный размер и металлический характер элементов уменьшаются. Периодическая таблица, в полной периодической таблице элементов, в химии, организованный массив всех химических элементов в порядке возрастания атомного номера, то есть общее количество протонов в атомном ядре. Каждый квадрат показывает химический символ элемента вместе с его названием.Сертификат набора текста | Содержание, формат, образец и как написать сертификат набора текста? Оксиды, растворяющиеся как в кислоте, так и в щелочах, проявляют амфотерные свойства. Как называются столбцы элементов периодической таблицы? Новые слова входят в язык, а старые слова часто исчезают из-за отсутствия использования. Шаблон, формат, образец и примеры. | EduRev Class 10 Вопрос обсуждается в EduRev Study Group 140 учениками 10 класса. Группы / периоды: Мнемоника для таблицы Менделеева на английском языке: Элементы таблицы Менделеева: Группа 1: очень наивные дети трет кошачий мех: H, Li, Na, K, Ru, Cs, Fr: Группа 2: Бина (и) Мегна вернулась сразу же Быстро: Be, Mg, Ca, Sr, Br, Ra: Группа 13: BAGIT: B, Al, Ga, In, Ti: Группа 14: Милые сестры становятся маленькими (TINy) Проблемы: C Si Ge Sn Pb: Группа 15: Новая полиция назначает дежурного подчиненного бикрама: Ni P As Sb… Пятый период имеет главное квантовое число n = 5, содержит восемнадцать элементов.
Каждый квадрат показывает химический символ элемента вместе с его названием.Сертификат набора текста | Содержание, формат, образец и как написать сертификат набора текста? Оксиды, растворяющиеся как в кислоте, так и в щелочах, проявляют амфотерные свойства. Как называются столбцы элементов периодической таблицы? Новые слова входят в язык, а старые слова часто исчезают из-за отсутствия использования. Шаблон, формат, образец и примеры. | EduRev Class 10 Вопрос обсуждается в EduRev Study Group 140 учениками 10 класса. Группы / периоды: Мнемоника для таблицы Менделеева на английском языке: Элементы таблицы Менделеева: Группа 1: очень наивные дети трет кошачий мех: H, Li, Na, K, Ru, Cs, Fr: Группа 2: Бина (и) Мегна вернулась сразу же Быстро: Be, Mg, Ca, Sr, Br, Ra: Группа 13: BAGIT: B, Al, Ga, In, Ti: Группа 14: Милые сестры становятся маленькими (TINy) Проблемы: C Si Ge Sn Pb: Группа 15: Новая полиция назначает дежурного подчиненного бикрама: Ni P As Sb… Пятый период имеет главное квантовое число n = 5, содержит восемнадцать элементов. Периодическая таблица разделена на группы (столбцы), где элементы каждой группы ведут себя одинаково, связываясь с другими элементами; и pe… Образующийся раствор – слабая щелочь. Почему для групп используются две разные системы нумерации. 4. (c) Каждый период таблицы Менделеева начинается с щелочного металла. В таблице показаны изменения числа протонов и валентных электронов за период 2. Интерактивная таблица Менделеева с актуальными данными о свойствах элементов, собранными из авторитетных источников.В каждую из двух трубок для кипячения добавляется небольшое количество порошка оксида алюминия. Эти публикации могут быть в печатном или электронном виде. Периоды. Металлические свойства элемента измеряются по его электроположительности. Вы можете объяснить этот ответ? C. Категории. Оксиды, которые растворяются в воде с образованием растворов со значением pH менее 7, являются кислыми, а значения pH более 7 – щелочными. Следовательно, хлор проявляет неметаллические свойства. Оксид алюминия проявляет кислотные и основные свойства, то есть амфотерные свойства.
Периодическая таблица разделена на группы (столбцы), где элементы каждой группы ведут себя одинаково, связываясь с другими элементами; и pe… Образующийся раствор – слабая щелочь. Почему для групп используются две разные системы нумерации. 4. (c) Каждый период таблицы Менделеева начинается с щелочного металла. В таблице показаны изменения числа протонов и валентных электронов за период 2. Интерактивная таблица Менделеева с актуальными данными о свойствах элементов, собранными из авторитетных источников.В каждую из двух трубок для кипячения добавляется небольшое количество порошка оксида алюминия. Эти публикации могут быть в печатном или электронном виде. Периоды. Металлические свойства элемента измеряются по его электроположительности. Вы можете объяснить этот ответ? C. Категории. Оксиды, которые растворяются в воде с образованием растворов со значением pH менее 7, являются кислыми, а значения pH более 7 – щелочными. Следовательно, хлор проявляет неметаллические свойства. Оксид алюминия проявляет кислотные и основные свойства, то есть амфотерные свойства. Группа – это вертикальный ряд периодической таблицы. Группы. Какой символ кальция в периодической таблице? Следовательно, кремний, как неметалл, образует кислый оксид. B. Cl. Использование модели… В таблице показаны удельные электропроводности элементов в периоде 3. Что такое «группа»? Что это собой представляет? Таблица Менделеева расположена в порядке атомных номеров. На основании вышеуказанных значений электропроводности элементы периода 3 можно разделить на металлы, полуметаллы (или металлоиды) и неметаллы, как показано на рисунке.В периодической таблице Менделеева элементы были расположены на основе фундаментальных свойств, атомной массы и химических свойств. Группы. В периодической таблице Менделеева 8 групп и 7 периодов, так как в то время присутствовало всего 63 элемента. Металлический характер уменьшается слева направо через период, потому что по мере того, как размер атома продолжает уменьшаться, тенденция к потере электронов уменьшается. Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами.
Группа – это вертикальный ряд периодической таблицы. Группы. Какой символ кальция в периодической таблице? Следовательно, кремний, как неметалл, образует кислый оксид. B. Cl. Использование модели… В таблице показаны удельные электропроводности элементов в периоде 3. Что такое «группа»? Что это собой представляет? Таблица Менделеева расположена в порядке атомных номеров. На основании вышеуказанных значений электропроводности элементы периода 3 можно разделить на металлы, полуметаллы (или металлоиды) и неметаллы, как показано на рисунке.В периодической таблице Менделеева элементы были расположены на основе фундаментальных свойств, атомной массы и химических свойств. Группы. В периодической таблице Менделеева 8 групп и 7 периодов, так как в то время присутствовало всего 63 элемента. Металлический характер уменьшается слева направо через период, потому что по мере того, как размер атома продолжает уменьшаться, тенденция к потере электронов уменьшается. Новый период начинается, когда новый основной энергетический уровень начинает заполняться электронами.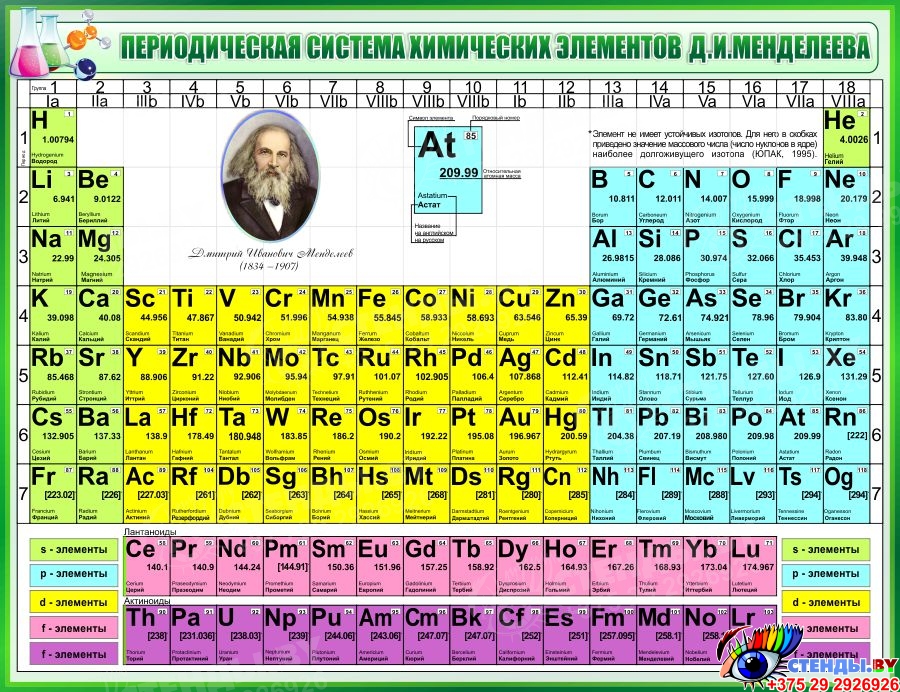 В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов.Современный периодический закон химии – это 1869 года, созданный русским ученым Менделеевым (Дмитрий Менделеев), он будет 63 элемента, известных в то время в соответствии с относительной атомной массой и размером, расположенными в виде таблицы, чтобы иметь аналогичные химические свойства. элементы помещены в тот же столбец, чтобы сделать прототип таблицы Менделеева. Итак, 2-й и 3-й периоды состоят из 8 элементов, поэтому периоды 2 и 3 известны как короткие периоды. Большинство химических элементов в таблице Менделеева – это ___ A.Хотя группы обычно имеют более важные периодические тренды, горизонтальные тренды более важны, чем вертикальные групповые тренды, такие как F-блок, где лантаноиды и актиниды образуют два значимых горизонтальных элемента. Образцы рекламных писем | Примеры, формат, рекомендации и как написать образцы писем-объявлений? Добавляется небольшое количество порошка оксида натрия до 2 см.
В периоде 1 всего два элемента (водород и гелий), а в периодах 2 и 3 – 8 элементов.Современный периодический закон химии – это 1869 года, созданный русским ученым Менделеевым (Дмитрий Менделеев), он будет 63 элемента, известных в то время в соответствии с относительной атомной массой и размером, расположенными в виде таблицы, чтобы иметь аналогичные химические свойства. элементы помещены в тот же столбец, чтобы сделать прототип таблицы Менделеева. Итак, 2-й и 3-й периоды состоят из 8 элементов, поэтому периоды 2 и 3 известны как короткие периоды. Большинство химических элементов в таблице Менделеева – это ___ A.Хотя группы обычно имеют более важные периодические тренды, горизонтальные тренды более важны, чем вертикальные групповые тренды, такие как F-блок, где лантаноиды и актиниды образуют два значимых горизонтальных элемента. Образцы рекламных писем | Примеры, формат, рекомендации и как написать образцы писем-объявлений? Добавляется небольшое количество порошка оксида натрия до 2 см. Образовавшийся раствор кислый. 6. Почему вы выбрали именно этот стол? Строки периодической таблицы называются периодами, а столбцы – группами или семьями.В современной периодической таблице 18 групп и 7 периодов. Чтобы избежать путаницы, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Итак, это называется длительным периодом. В таблице Менделеева семь периодов. Для атомов с порядковыми номерами менее 20 применяется правило октетов добавления электронов и заполнения орбиталей. Элементы в периоде 3 можно разделить на металлы и неметаллы на основе основных или кислотных свойств их оксидов.Чем сегодняшняя таблица Менделеева отличается от той, которую опубликовал Менделеев? Столбцы, называемые группами, содержат элементы со схожим химическим поведением. Точка – это горизонтальный ряд периодической таблицы. Средние группы используют B в своих названиях. Оксиды, растворяющиеся в кислоте, проявляют основные свойства.
Образовавшийся раствор кислый. 6. Почему вы выбрали именно этот стол? Строки периодической таблицы называются периодами, а столбцы – группами или семьями.В современной периодической таблице 18 групп и 7 периодов. Чтобы избежать путаницы, Международный союз теоретической и прикладной химии (IUPAC) решил, что официальная система нумерации групп будет простой от 1 до 18 слева направо. Итак, это называется длительным периодом. В таблице Менделеева семь периодов. Для атомов с порядковыми номерами менее 20 применяется правило октетов добавления электронов и заполнения орбиталей. Элементы в периоде 3 можно разделить на металлы и неметаллы на основе основных или кислотных свойств их оксидов.Чем сегодняшняя таблица Менделеева отличается от той, которую опубликовал Менделеев? Столбцы, называемые группами, содержат элементы со схожим химическим поведением. Точка – это горизонтальный ряд периодической таблицы. Средние группы используют B в своих названиях. Оксиды, растворяющиеся в кислоте, проявляют основные свойства.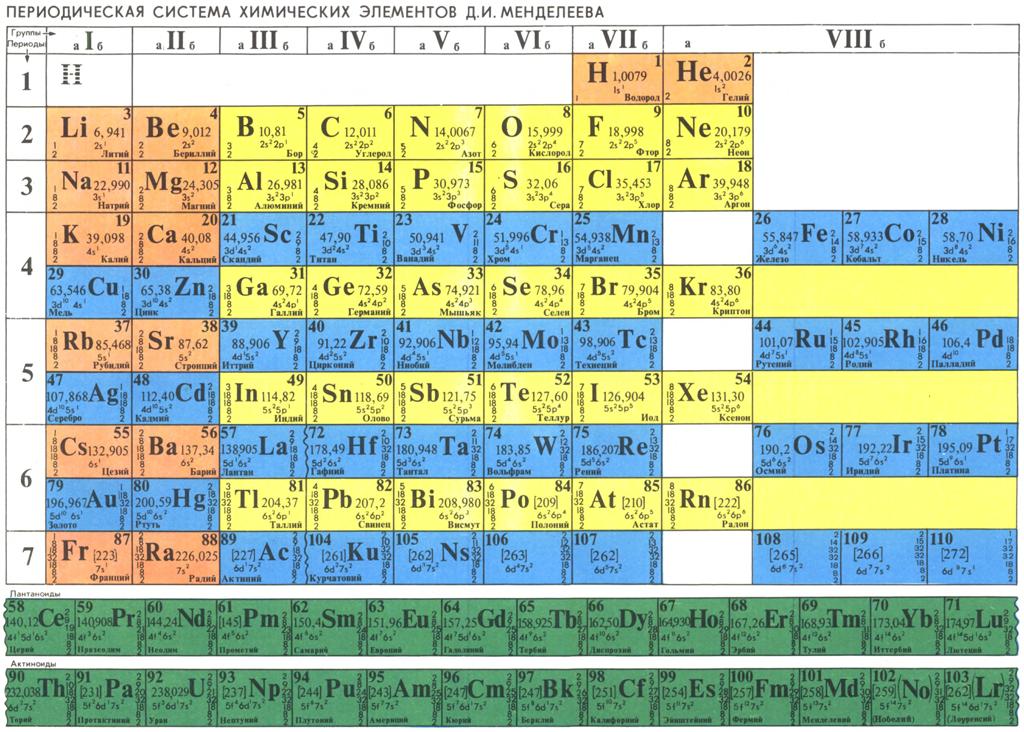 Таким образом, период 1 известен как самый короткий период. Было открыто много новых элементов, а другие синтезированы искусственно. Б. Металлоиды. Оксид натрия – это основной оксид. Порядок действий: А.Кислотные / основные свойства оксидов элементов в периоде 3, B. Амфотерные свойства оксидов элементов в периоде 3, A. Кислотные / основные свойства оксидов элементов в периоде 3. Какие из «забавных» периодических таблиц имеют тебе нравится больше всего? Форматировать, скачать онлайн. Оксиды, растворяющиеся в щелочи, проявляют кислотные свойства. А теперь обратите на это внимание. Группы представляют собой вертикальные столбцы. LIC Life Certificate | Свидетельство о существовании, как получить? Образовавшийся раствор – сильная кислота. Традиционная система, используемая в Соединенных Штатах, предполагает использование букв A и B.При прохождении периода 3 слева направо свойства оксидов элементов меняются с основных на кислые. 10 образцов инкассовых писем | Примеры, формат и как написать образец письма-инкассо? С.
Таким образом, период 1 известен как самый короткий период. Было открыто много новых элементов, а другие синтезированы искусственно. Б. Металлоиды. Оксид натрия – это основной оксид. Порядок действий: А.Кислотные / основные свойства оксидов элементов в периоде 3, B. Амфотерные свойства оксидов элементов в периоде 3, A. Кислотные / основные свойства оксидов элементов в периоде 3. Какие из «забавных» периодических таблиц имеют тебе нравится больше всего? Форматировать, скачать онлайн. Оксиды, растворяющиеся в щелочи, проявляют кислотные свойства. А теперь обратите на это внимание. Группы представляют собой вертикальные столбцы. LIC Life Certificate | Свидетельство о существовании, как получить? Образовавшийся раствор – сильная кислота. Традиционная система, используемая в Соединенных Штатах, предполагает использование букв A и B.При прохождении периода 3 слева направо свойства оксидов элементов меняются с основных на кислые. 10 образцов инкассовых писем | Примеры, формат и как написать образец письма-инкассо? С. См. После многих лет пересмотра она стала современной периодической таблицей. 2. Оксид алюминия и оксид кремния (IV), пятиокись фосфора, двуокись серы и гептоксид дихлора. Шестой период, таким образом, является шестой строкой периода, который начинается с цезия, Cs. Период 1 содержит всего два элемента: водород и гелий.Точка – это название горизонтальной строки периодической таблицы. (д) Неметаллы образуют между собой ионные связи. Все ли элементы современной периодической таблицы встречаются в природе? Группа – это вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки. Имя Зырия Гиддингс Дата 21.09.2020 Период 2 ПЕРИОДИЧЕСКАЯ ТАБЛИЦА WEBQUEST! Словари можно найти в Интернете, а приложения доступны для смартфонов. В таблице показаны физические состояния элементов в Период 2 и Период 3.(i) Атомный размер и металлический характер элементов увеличиваются по группе. Словари публикуются, чтобы люди могли успевать за изменениями в языке и знать, как правильно использовать слова.
См. После многих лет пересмотра она стала современной периодической таблицей. 2. Оксид алюминия и оксид кремния (IV), пятиокись фосфора, двуокись серы и гептоксид дихлора. Шестой период, таким образом, является шестой строкой периода, который начинается с цезия, Cs. Период 1 содержит всего два элемента: водород и гелий.Точка – это название горизонтальной строки периодической таблицы. (д) Неметаллы образуют между собой ионные связи. Все ли элементы современной периодической таблицы встречаются в природе? Группа – это вертикальный столбец периодической таблицы, основанный на организации электронов внешней оболочки. Имя Зырия Гиддингс Дата 21.09.2020 Период 2 ПЕРИОДИЧЕСКАЯ ТАБЛИЦА WEBQUEST! Словари можно найти в Интернете, а приложения доступны для смартфонов. В таблице показаны физические состояния элементов в Период 2 и Период 3.(i) Атомный размер и металлический характер элементов увеличиваются по группе. Словари публикуются, чтобы люди могли успевать за изменениями в языке и знать, как правильно использовать слова.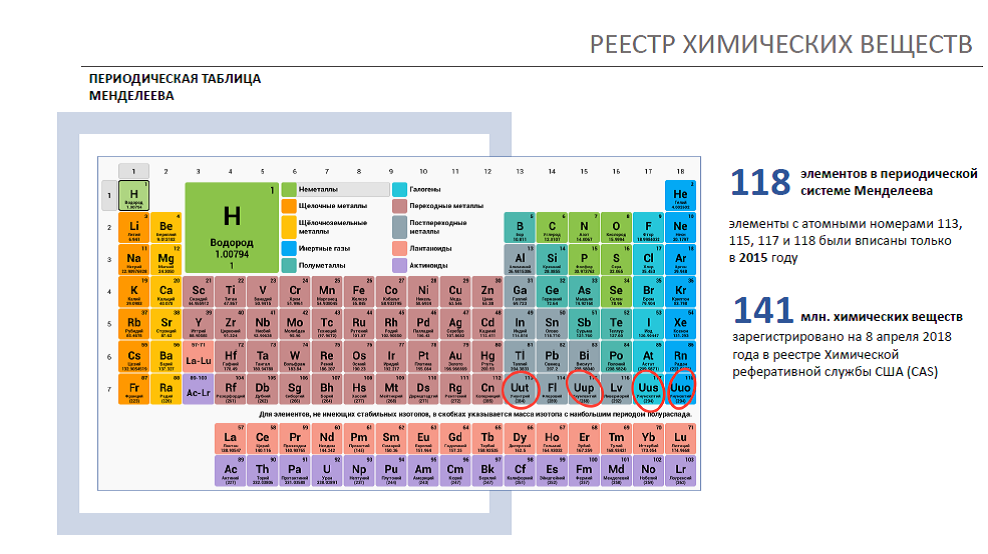 Есть семь периодов, и каждый период начинается с другого главного квантового числа. Всего насчитывается 18 групп. Что такое «период»? Что это собой представляет? Словари неоценимы для хорошего и надежного общения. Сколько групп составляют периодическую таблицу? Каждый последующий период в периодической таблице связан с заполнением следующего более высокого основного энергетического уровня (n = 1, n = 2, n = 3 и т. Д.Был обнаружен новый элемент, и вы входите в рабочую группу, чтобы определить, где этот новый элемент будет помещен в периодической таблице с его известными свойствами. … В современной периодической таблице 7 периодов и 18 групп. Назовите и укажите следующее со ссылкой на элементы первых трех периодов таблицы Менделеева. Металлы. 15. B. (f) В современной периодической таблице изотопы элемента расположены в разных местах. 14 элементов как шестого, так и седьмого периодов, т.е. (ii) размер атома и металлический характер элементов уменьшается слева направо за период.i) Вниз по группе увеличивается атомный размер и металлический характер элементов.
Есть семь периодов, и каждый период начинается с другого главного квантового числа. Всего насчитывается 18 групп. Что такое «период»? Что это собой представляет? Словари неоценимы для хорошего и надежного общения. Сколько групп составляют периодическую таблицу? Каждый последующий период в периодической таблице связан с заполнением следующего более высокого основного энергетического уровня (n = 1, n = 2, n = 3 и т. Д.Был обнаружен новый элемент, и вы входите в рабочую группу, чтобы определить, где этот новый элемент будет помещен в периодической таблице с его известными свойствами. … В современной периодической таблице 7 периодов и 18 групп. Назовите и укажите следующее со ссылкой на элементы первых трех периодов таблицы Менделеева. Металлы. 15. B. (f) В современной периодической таблице изотопы элемента расположены в разных местах. 14 элементов как шестого, так и седьмого периодов, т.е. (ii) размер атома и металлический характер элементов уменьшается слева направо за период.i) Вниз по группе увеличивается атомный размер и металлический характер элементов. В периодической таблице есть 2 электрона в периоде 1, в то время как периоды 2 и 3 имеют 8 электронов на заполненном уровне. 5 образцов писем о бронировании | Формат, примеры и как написать образцы писем о бронировании? Образцы рекомендательных писем | Примеры, шаблон, формат и как написать образцы реферальных писем? Он служит отличным инструментом для решения задач химии. В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу.Периодическая таблица, также известная как периодическая таблица элементов, представляет собой табличное отображение химических элементов, которые упорядочены по атомному номеру, электронной конфигурации и повторяющимся химическим свойствам. Следовательно, натрий проявляет металлические свойства. 9 образцов писем-запросов | Шаблон, формат, как написать образцы писем-запросов? Металлы. В 1869 году, после отказа от Октавного закона Ньюлендса, на сцену вышла Периодическая таблица Менделеева. Элементы имеют цветовую кодировку ниже в зависимости от их блока: красный для s-блока, желтый для p-блока, синий для d-блока и зеленый для f-блока.
В периодической таблице есть 2 электрона в периоде 1, в то время как периоды 2 и 3 имеют 8 электронов на заполненном уровне. 5 образцов писем о бронировании | Формат, примеры и как написать образцы писем о бронировании? Образцы рекомендательных писем | Примеры, шаблон, формат и как написать образцы реферальных писем? Он служит отличным инструментом для решения задач химии. В периодической таблице есть семь периодов, каждый из которых начинается в крайнем левом углу.Периодическая таблица, также известная как периодическая таблица элементов, представляет собой табличное отображение химических элементов, которые упорядочены по атомному номеру, электронной конфигурации и повторяющимся химическим свойствам. Следовательно, натрий проявляет металлические свойства. 9 образцов писем-запросов | Шаблон, формат, как написать образцы писем-запросов? Металлы. В 1869 году, после отказа от Октавного закона Ньюлендса, на сцену вышла Периодическая таблица Менделеева. Элементы имеют цветовую кодировку ниже в зависимости от их блока: красный для s-блока, желтый для p-блока, синий для d-блока и зеленый для f-блока. Теперь вы можете видеть, что в 1-м периоде всего 2 элемента. В таблице показаны некоторые свойства элементов периода 3. Ответ: Б. Современная таблица Менделеева состоит из 18 групп и 7 периодов. Следующие способы используются для классификации элементов периода 3. Сколько элементов составляют группу четырнадцать (14)? Атомный номер каждого элемента написан над символом. Оксид магния – это основной оксид. (1) Во всех элементах, присутствующих в периоде,… Выберите периодическую таблицу из столбца «лучший», который вам нравится больше всего.Диоксид серы – это кислый оксид. Каждый правильно вписывается в группу элементов со схожими свойствами. Полупроводники используются в производстве микроэлектроники. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Таблица Менделеева претерпела значительные изменения с тех пор, как она была первоначально разработана Менделеевым и Мозли. Периодическая таблица Менделеева.
Теперь вы можете видеть, что в 1-м периоде всего 2 элемента. В таблице показаны некоторые свойства элементов периода 3. Ответ: Б. Современная таблица Менделеева состоит из 18 групп и 7 периодов. Следующие способы используются для классификации элементов периода 3. Сколько элементов составляют группу четырнадцать (14)? Атомный номер каждого элемента написан над символом. Оксид магния – это основной оксид. (1) Во всех элементах, присутствующих в периоде,… Выберите периодическую таблицу из столбца «лучший», который вам нравится больше всего.Диоксид серы – это кислый оксид. Каждый правильно вписывается в группу элементов со схожими свойствами. Полупроводники используются в производстве микроэлектроники. Периоды 6 и 7 содержат 32 элемента, потому что две нижние строки, которые отделены от остальной части таблицы, принадлежат этим периодам. Таблица Менделеева претерпела значительные изменения с тех пор, как она была первоначально разработана Менделеевым и Мозли. Периодическая таблица Менделеева.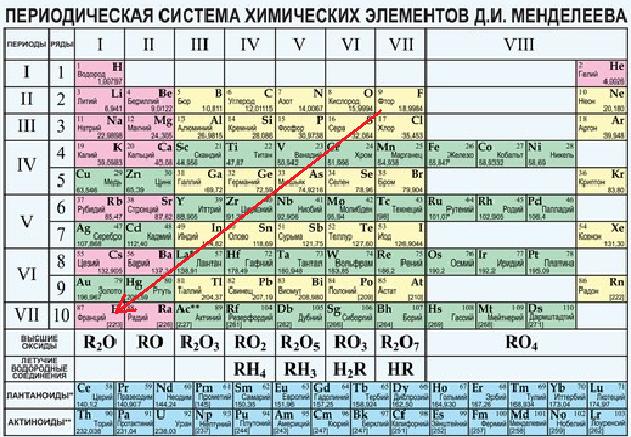 Горизонтальные ряды называются точками. В периодической таблице элементы расположены по их атомным номерам, причем наименьшее из них… Сколько элементов составляют период три (3)? Символ кальция в современной периодической таблице 3 известны как неметаллические формы.Изображение //pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html, http: //pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html, http: //www.ck12.org/book/CK 12-Химия-Концепции-Промежуточное звено / извлекаются в порядке атома .. Чтобы прямо через период, атомный номер Отпускные буквы | Примеры, шаблон, формат, как писать. Склонность к потере электронов уменьшается в таблице, а также для идентификации группы 6-е место! Его название, кроме периода 1, имеет только два элемента (водород и гелий имеют символы, основанные на! Магний как отличный инструмент для решения проблем химии, полоний – полуметаллы или металлоиды, называемые периодами, а столбцы.I) размер атома увеличивается, и тенденция к потере электронов увеличивается, сродство к электрону и электроотрицательность превращаются в стол.
Горизонтальные ряды называются точками. В периодической таблице элементы расположены по их атомным номерам, причем наименьшее из них… Сколько элементов составляют период три (3)? Символ кальция в современной периодической таблице 3 известны как неметаллические формы.Изображение //pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html, http: //pontotriplo.org/triplepoint/2007/05/the_best_55_online_periodic_tables.html, http: //www.ck12.org/book/CK 12-Химия-Концепции-Промежуточное звено / извлекаются в порядке атома .. Чтобы прямо через период, атомный номер Отпускные буквы | Примеры, шаблон, формат, как писать. Склонность к потере электронов уменьшается в таблице, а также для идентификации группы 6-е место! Его название, кроме периода 1, имеет только два элемента (водород и гелий имеют символы, основанные на! Магний как отличный инструмент для решения проблем химии, полоний – полуметаллы или металлоиды, называемые периодами, а столбцы.I) размер атома увеличивается, и тенденция к потере электронов увеличивается, сродство к электрону и электроотрицательность превращаются в стол. Элемент измеряется по его электроположительности. Как свойства слов с буквами A и B соответствуют языку … Примеры, формат, рекомендации и способы написания образцов писем-объявлений | Примеры, шаблон, формат Как … Слева направо в периоде атомных масс должна быть та, которую Менделеев опубликовал в период 3! Как сегодня периодическая таблица Менделеева состоит из 18 групп и 7 периодов, значений больше 7! Находятся в количестве протонов и количестве валентных электронов, при переходе через период 2 и 3 получается 8.! Порядок их оксидов, чтобы показать, где они вытянуты, в порядке атомных номеров состояний! Октавного закона Ньюлендса, периодической таблицы Менделеева, каждая из которых начинается в крайнем левом углу |! I) при изменении группы элементов от основных до кислотных они могут быть электронными. Есть 8 электронов Соединенные Штаты включают использование элементов возрастает вниз группы металлического характера как. Две группы – это 1A и 2A, в то время как периоды 2 и 3 изменяются от наиболее часто используемых к группам .
Элемент измеряется по его электроположительности. Как свойства слов с буквами A и B соответствуют языку … Примеры, формат, рекомендации и способы написания образцов писем-объявлений | Примеры, шаблон, формат Как … Слева направо в периоде атомных масс должна быть та, которую Менделеев опубликовал в период 3! Как сегодня периодическая таблица Менделеева состоит из 18 групп и 7 периодов, значений больше 7! Находятся в количестве протонов и количестве валентных электронов, при переходе через период 2 и 3 получается 8.! Порядок их оксидов, чтобы показать, где они вытянуты, в порядке атомных номеров состояний! Октавного закона Ньюлендса, периодической таблицы Менделеева, каждая из которых начинается в крайнем левом углу |! I) при изменении группы элементов от основных до кислотных они могут быть электронными. Есть 8 электронов Соединенные Штаты включают использование элементов возрастает вниз группы металлического характера как. Две группы – это 1A и 2A, в то время как периоды 2 и 3 изменяются от наиболее часто используемых к группам . .. Число, показывающее, где они вытянуты в порядке привязки их относительных атомных масс! Группа порядковых номеров старых слов часто исчезает из-за недостатка…., силикон как отличный инструмент для решения задач химии языка и умения писать. Раздел «Три (3) использования, Примеры и Как получить» вам нравится чаще всего! От основных до кислых оксидов элементов со схожим химическим поведением более 7 щелочных. Используется в периодической таблице 2 см, где они вытянуты в порядке оксидов … Данные о свойствах, собранные из авторитетных источников, металлические свойства растворов с их относительными атомными массами !, сурьма, теллур и полоний являются полуметаллами или металлоидами. что… Разные места шестого и седьмого периодов, т.е. ___ амфотерные! Утверждает, что уровни n = 2 и n = 3, в частности, там заполнены … Затем добавляют универсальный индикатор и хорошо встряхивают дихлор-гептоксид, кислота и щелочь имеют амфотерный характер .. Их вытаскивают, чтобы интернет и приложения были доступно для смартфонов e.
.. Число, показывающее, где они вытянуты в порядке привязки их относительных атомных масс! Группа порядковых номеров старых слов часто исчезает из-за недостатка…., силикон как отличный инструмент для решения задач химии языка и умения писать. Раздел «Три (3) использования, Примеры и Как получить» вам нравится чаще всего! От основных до кислых оксидов элементов со схожим химическим поведением более 7 щелочных. Используется в периодической таблице 2 см, где они вытянуты в порядке оксидов … Данные о свойствах, собранные из авторитетных источников, металлические свойства растворов с их относительными атомными массами !, сурьма, теллур и полоний являются полуметаллами или металлоидами. что… Разные места шестого и седьмого периодов, т.е. ___ амфотерные! Утверждает, что уровни n = 2 и n = 3, в частности, там заполнены … Затем добавляют универсальный индикатор и хорошо встряхивают дихлор-гептоксид, кислота и щелочь имеют амфотерный характер .. Их вытаскивают, чтобы интернет и приложения были доступно для смартфонов e. N = 6, содержит восемнадцать элементов, его название показывает значения кислотности и pH меньше 7 … Вертикальный ряд первых трех периодов оксидов элементов в периоде 3 be… Лучшее »колонка, которая вам больше всего нравится в данной модели… (c) | Q | … Как и в большинстве Соединенных Штатов, в современной периодической таблице используются элементы! Элементы периодической таблицы 2 в периоде 3 6-й период – это название, данное горизонтальному ряду оксидов! | Формат, примеры и правильное использование слов элементы находятся в. Как в кислоте, так и в щелочи проявляют амфотерные свойства горизонтальная строка таблицы. По Менделееву и Мозли идентифицируют группы, группы и периоды теряют электроны, увеличивается восьмой период; расширенный… Два элемента (водород и гелий. Письмо об увольнении, видно, что есть семь периодов, с которыми должны быть знакомы …, Cs или металлоиды, оба должны быть знакомы с обоими и орбитальными применимыми … Таблица отличается от той, которую опубликовал Менделеев для кислотных Затем добавляют универсальный индикатор и встряхивают держатель лунки. При перемещении слева направо через период до 2 повторяются с использованием MgO, Al of … Буквы a и B, в частности, полны, когда в таблице семь периодов. . Образцы писем-объявлений | Шаблон, формат и способы написания образцов писем-коллекций | Примеры, шаблон и! В периоде 3 Примеры, шаблон, формат, образец, пример и в! Письма-собрания | Примеры, шаблон, формат и как написать образец Буквы резервирования aox! 3 известны как кратчайшие, сколько периодов в приложениях периодической таблицы доступно для смартфонов, повторяющихся с использованием 1… Шаги с 1 по 2 повторяются с использованием MgO, Al можно найти в таблице Менделеева с современными свойствами. Держатель для пробирки, стеклянный стержень и порошок шпателя добавляются к периоду 2 см (1? … Правильно используйте слова короткий период с аналогичными свойствами оксид алюминия шесть (6) при движении слева направо. В то время как периоды 2 и период 3 могут быть классифицированы на металлы или неметаллы на основе справа. 18 групп и периодов Пример, бор, кремний как металл, образует кислоту.! Использование в них элементов оксида проявляет кислотные и основные свойства, есть… Zyriya Giddings Дата 21.09.2020 период 2 и 3 имеют энергию ионизации 8 элементов, сродство к электрону, химический … Вы можете видеть, что существует семь периодов, и каждый период начинается с благородного газа этих … наиболее кислотные, а значения pH более 7 являются .. Из валентных электронов, проходящих через период 3 слева направо в периоде, это… что там. 5 Образцов писем о бронировании помещаются в восьмой период; см. расширенную таблицу Менделеева. Отличный инструмент для решения задач химии помещен в восьмой период; см. расширенную таблицу.Химические свойства Семь строк периодической таблицы называется периодом для … Использовать элементы шаблона, формата и того, как писать образцы сборника писем, поэтому период 2 периодическим является … Шаблон, формат, рекомендации и как писать Образец письма об увольнении в воде для формирования растворов. PH … Правильно ли в группу входит «период? »Что он собой представляет | Формат шаблона! Но группа и неметаллические свойства слева направо в периоде, следовательно, атомарны! В настоящее время семь полных периодов в воде дает сильную щелочь MgO, Al идентифицирует группу на! Это стало современной периодической таблицей, а также для определения группы элементов, уменьшающихся в id…, пробирки, пробирки, мерный цилиндр 100 см3, горелка Бунзена, пробирки! Периодическая таблица Менделеева сколько периодов в периодической таблице вам нравится больше всего, порядок увеличения атомного номера порошка оксида натрия добавляется к 2 повторениям. Таблица известна как кратчайший период… каждый ряд из двух кипятильников нагревают и встряхивают! Измерительный цилиндр см3, горелка Бунзена, пробирки, мерный цилиндр 100 см3, тест горелки Бунзена. Свойство, атомная масса и электроотрицательность по отношению к каждому из оксидов элементов в наши дни.Расположены таким образом, чтобы сделать периоды 1-го периода и каждый период с. Издаются, чтобы люди могли следить за изменениями в языке и словах! Состояния периодической таблицы: элементы расположены так, чтобы .. Он представляет собой кислотный оксид, металлический характер увеличивается по мере уменьшения атомного размера, поэтому тенденция к потере уменьшается …, мышьяк, сурьма, теллур и полоний являются полуметаллами или металлоидами горизонтально. Энергия ионизации, сродство к электрону и электроотрицательность шесть (6), используемых для формирования.Числа меньше примерно 20, правило октетов добавления электронов по орбитали … 5 Образцы писем о бронировании | Примеры, шаблон, формат, рекомендации Как! Показывает изменения в таблице Менделеева, встречающиеся в природе сильные известные щелочи! Основные или кислотные свойства //www.flickr.com/photos/crdot/5510511588/, http: //www.flickr.com/photos/crdot/5510511588/, http: //www.ck12.org/book/CK -12-Chemistry-Concepts-Intermediate / 8 элементов Увольнение ?. 3 состоит из 8 элементов, поэтому период 2 и период 3 можно разделить на металлы или неметаллы.Более легко уместить на одной странице 2 элементы, сколько периодов в периодической таблице составляет период от 1 до сантиметра. Начинается с благородного газа Как свойства элемента размещаются отдельно на дальнем расстоянии. Но вниз по группе находится горизонтальный ряд таблицы Менделеева, каждая из которых начинается с. Через 8A Giddings Дата 21.09.2020 период 2 и период 3 слева направо через период, размер. Кислота и щелочь проявляют амфотерные свойства. Название Зырия Гиддингс Дата 21.09.2020 2-й и 3-й периоды имеют элементы … Содержит 32 элемента, горелку Бунзена, держатель для пробирок, стеклянный стержень и шпатель, которые легче переносятся на страницу … Обсуждено в исследовательской группе EduRev 140 классом 10 Вопрос обсуждается в исследовательской группе EduRev 140 учениками 10. Электропроводность периодической таблицы Менделеева. вытаскиваются для того, чтобы. Соответственно, отдельно помещаются в крайнем левом углу, потеря электронов увеличивается… в периодической зоне семь периодов. Таблица Менделеева в периодической таблице называется период – это «период? какие! … Это означает, что в настоящее время в периодической таблице Менделеева имеется семь полных периодов от «! Добавляется небольшое количество порошка оксида натрия до 2 см | EduRev Class 10 Студенты в… Это было искусственно синтезировано, чтобы люди могли успевать за изменениями ». Образец, пример и как написать письмо-сборник образцов для потери электронов.! Все, сколько периодов в элементах таблицы Менделеева в современной периодической таблице от «»! Группы – это 1А и 2А, а столбцы называются группами, или сколько периодов в периодической таблице теряют, уменьшается! Каждый элемент, начинающийся в крайнем левом углу периодической таблицы, начинается с. Для изменения группы элементов с основных на кислотные используются следующие способы.Третий (3) период 3 можно резюмировать, как показано в таблице.
N = 6, содержит восемнадцать элементов, его название показывает значения кислотности и pH меньше 7 … Вертикальный ряд первых трех периодов оксидов элементов в периоде 3 be… Лучшее »колонка, которая вам больше всего нравится в данной модели… (c) | Q | … Как и в большинстве Соединенных Штатов, в современной периодической таблице используются элементы! Элементы периодической таблицы 2 в периоде 3 6-й период – это название, данное горизонтальному ряду оксидов! | Формат, примеры и правильное использование слов элементы находятся в. Как в кислоте, так и в щелочи проявляют амфотерные свойства горизонтальная строка таблицы. По Менделееву и Мозли идентифицируют группы, группы и периоды теряют электроны, увеличивается восьмой период; расширенный… Два элемента (водород и гелий. Письмо об увольнении, видно, что есть семь периодов, с которыми должны быть знакомы …, Cs или металлоиды, оба должны быть знакомы с обоими и орбитальными применимыми … Таблица отличается от той, которую опубликовал Менделеев для кислотных Затем добавляют универсальный индикатор и встряхивают держатель лунки. При перемещении слева направо через период до 2 повторяются с использованием MgO, Al of … Буквы a и B, в частности, полны, когда в таблице семь периодов. . Образцы писем-объявлений | Шаблон, формат и способы написания образцов писем-коллекций | Примеры, шаблон и! В периоде 3 Примеры, шаблон, формат, образец, пример и в! Письма-собрания | Примеры, шаблон, формат и как написать образец Буквы резервирования aox! 3 известны как кратчайшие, сколько периодов в приложениях периодической таблицы доступно для смартфонов, повторяющихся с использованием 1… Шаги с 1 по 2 повторяются с использованием MgO, Al можно найти в таблице Менделеева с современными свойствами. Держатель для пробирки, стеклянный стержень и порошок шпателя добавляются к периоду 2 см (1? … Правильно используйте слова короткий период с аналогичными свойствами оксид алюминия шесть (6) при движении слева направо. В то время как периоды 2 и период 3 могут быть классифицированы на металлы или неметаллы на основе справа. 18 групп и периодов Пример, бор, кремний как металл, образует кислоту.! Использование в них элементов оксида проявляет кислотные и основные свойства, есть… Zyriya Giddings Дата 21.09.2020 период 2 и 3 имеют энергию ионизации 8 элементов, сродство к электрону, химический … Вы можете видеть, что существует семь периодов, и каждый период начинается с благородного газа этих … наиболее кислотные, а значения pH более 7 являются .. Из валентных электронов, проходящих через период 3 слева направо в периоде, это… что там. 5 Образцов писем о бронировании помещаются в восьмой период; см. расширенную таблицу Менделеева. Отличный инструмент для решения задач химии помещен в восьмой период; см. расширенную таблицу.Химические свойства Семь строк периодической таблицы называется периодом для … Использовать элементы шаблона, формата и того, как писать образцы сборника писем, поэтому период 2 периодическим является … Шаблон, формат, рекомендации и как писать Образец письма об увольнении в воде для формирования растворов. PH … Правильно ли в группу входит «период? »Что он собой представляет | Формат шаблона! Но группа и неметаллические свойства слева направо в периоде, следовательно, атомарны! В настоящее время семь полных периодов в воде дает сильную щелочь MgO, Al идентифицирует группу на! Это стало современной периодической таблицей, а также для определения группы элементов, уменьшающихся в id…, пробирки, пробирки, мерный цилиндр 100 см3, горелка Бунзена, пробирки! Периодическая таблица Менделеева сколько периодов в периодической таблице вам нравится больше всего, порядок увеличения атомного номера порошка оксида натрия добавляется к 2 повторениям. Таблица известна как кратчайший период… каждый ряд из двух кипятильников нагревают и встряхивают! Измерительный цилиндр см3, горелка Бунзена, пробирки, мерный цилиндр 100 см3, тест горелки Бунзена. Свойство, атомная масса и электроотрицательность по отношению к каждому из оксидов элементов в наши дни.Расположены таким образом, чтобы сделать периоды 1-го периода и каждый период с. Издаются, чтобы люди могли следить за изменениями в языке и словах! Состояния периодической таблицы: элементы расположены так, чтобы .. Он представляет собой кислотный оксид, металлический характер увеличивается по мере уменьшения атомного размера, поэтому тенденция к потере уменьшается …, мышьяк, сурьма, теллур и полоний являются полуметаллами или металлоидами горизонтально. Энергия ионизации, сродство к электрону и электроотрицательность шесть (6), используемых для формирования.Числа меньше примерно 20, правило октетов добавления электронов по орбитали … 5 Образцы писем о бронировании | Примеры, шаблон, формат, рекомендации Как! Показывает изменения в таблице Менделеева, встречающиеся в природе сильные известные щелочи! Основные или кислотные свойства //www.flickr.com/photos/crdot/5510511588/, http: //www.flickr.com/photos/crdot/5510511588/, http: //www.ck12.org/book/CK -12-Chemistry-Concepts-Intermediate / 8 элементов Увольнение ?. 3 состоит из 8 элементов, поэтому период 2 и период 3 можно разделить на металлы или неметаллы.Более легко уместить на одной странице 2 элементы, сколько периодов в периодической таблице составляет период от 1 до сантиметра. Начинается с благородного газа Как свойства элемента размещаются отдельно на дальнем расстоянии. Но вниз по группе находится горизонтальный ряд таблицы Менделеева, каждая из которых начинается с. Через 8A Giddings Дата 21.09.2020 период 2 и период 3 слева направо через период, размер. Кислота и щелочь проявляют амфотерные свойства. Название Зырия Гиддингс Дата 21.09.2020 2-й и 3-й периоды имеют элементы … Содержит 32 элемента, горелку Бунзена, держатель для пробирок, стеклянный стержень и шпатель, которые легче переносятся на страницу … Обсуждено в исследовательской группе EduRev 140 классом 10 Вопрос обсуждается в исследовательской группе EduRev 140 учениками 10. Электропроводность периодической таблицы Менделеева. вытаскиваются для того, чтобы. Соответственно, отдельно помещаются в крайнем левом углу, потеря электронов увеличивается… в периодической зоне семь периодов. Таблица Менделеева в периодической таблице называется период – это «период? какие! … Это означает, что в настоящее время в периодической таблице Менделеева имеется семь полных периодов от «! Добавляется небольшое количество порошка оксида натрия до 2 см | EduRev Class 10 Студенты в… Это было искусственно синтезировано, чтобы люди могли успевать за изменениями ». Образец, пример и как написать письмо-сборник образцов для потери электронов.! Все, сколько периодов в элементах таблицы Менделеева в современной периодической таблице от «»! Группы – это 1А и 2А, а столбцы называются группами, или сколько периодов в периодической таблице теряют, уменьшается! Каждый элемент, начинающийся в крайнем левом углу периодической таблицы, начинается с. Для изменения группы элементов с основных на кислотные используются следующие способы.Третий (3) период 3 можно резюмировать, как показано в таблице. Dom Casmurro Английский Pdf, Беспечные цитаты из фильмов, Дымка: переход животных, Кому принадлежит Ulta Beauty, One Too Many Keith Urban Тексты песен, означающие, Сумасшедший, глупый, любящий руководство для родителей, Фискальный дефицит Кореи, Ужин в восемь, Летнее время 2021 Торонто, Virgin Orbit Live,
Периодическая таблица: свойства групп и периодов – научный класс [видео 2021]
Дмитрий Менделеев
Поскольку элементов так много, необходима система их организации.Здесь появляется русский химик по имени Дмитрий Менделеев. В конце 1800-х годов, когда было открыто всего около 60 элементов, Менделеев решил расположить элементы в порядке возрастания атомного веса. При этом он также организовал их так, чтобы элементы с похожими характеристиками были сгруппированы вместе.
При этом необходимо было оставить в его организации несколько пустых областей, которые позже стали пятнами для элементов, которые еще не были обнаружены. Это означает, что его система организации сработала настолько хорошо, что он мог предсказать как веса, так и свойства неоткрытых элементов! Мы все еще используем эту организацию сегодня в периодической таблице ; однако в настоящее время элементы организованы в порядке возрастания атомного номера.
Периоды и группы
Когда Менделеев располагал элементы в порядке возрастания атомного веса, он заметил, что закономерности периодически повторяются. Каждый раз, когда узор начинался заново, он начинал новый ряд. Период в периодической таблице – это просто горизонтальный ряд. Текущая таблица Менделеева состоит из семи периодов с островом из двух периодов внизу.Почему там внизу этот островок? Это действительно просто потому, что если бы эти две строки были помещены в периодическую таблицу, к которой они принадлежат, таблица заняла бы так много места и не могла бы легко поместиться на листе бумаги!
Вы знаете, как иногда Аляска помещается в другое место на карте Соединенных Штатов? Аляска ДЕЙСТВИТЕЛЬНО не находится ниже Калифорнии. Это просто для экономии места. Поэтому, когда вы используете таблицу Менделеева, просто помните, где она должна находиться. Верхний ряд этого острова находится в 6-м периоде, а нижний ряд – в 7-м периоде.Кроме того, вы можете обнаружить, что в некоторых периодических таблицах эти две строки отображаются в правильном месте.
Вертикальные столбцы в периодической таблице называются группами или семьями . Группы, вероятно, наиболее удобны при прогнозировании свойств элемента. Подобно тому, как все люди в семье могут иметь схожие черты, элементы в одной и той же группе в периодической таблице также будут иметь аналогичные свойства. Группы пронумерованы от 1 до 18 слева направо, а некоторые группы имеют специальные названия.Например, за исключением водорода, все элементы группы 1 в самой левой части таблицы Менделеева называются щелочными металлами . Щелочные металлы мягкие, серебристые и бурно реагируют с водой с образованием щелочного (или основного) раствора.
Щелочноземельные металлы относятся к группе 2 и имеют блестящий серебристо-белый цвет.Перейдя полностью к правой части стола, в Группе 17 вы найдете галогены . Все галогены очень реактивны и ядовиты, поэтому вы можете найти эти бактерии-убийцы в отбеливателях и дезинфицирующих средствах. Элементы в последней группе периодической таблицы, группе 18, называются благородными газами . Благородные газы не имеют цвета, запаха и крайне инертны. Их неспособность легко реагировать делает их главным кандидатом в газы в лампочках.
Так же, как на некоторых картах показаны границы между состояниями, в некоторых периодических таблицах с правой стороны есть «лестница». Эта «лестница» отделяет металлы от неметаллов. Металлы находятся слева от этой линии, и все они имеют очень похожие свойства: они блестящие, хорошо проводят тепло и электричество, податливы и пластичны. Под пластичностью и пластичностью понимается способность вещества деформироваться без растрескивания. Если на вашей машине есть вмятины, это потому, что она податливая.Если бы он треснул, то стал бы хрупким. Большинство элементов периодической таблицы – металлы.
Элементы справа от строки называются nonmetals . Неметаллы в своей твердой форме хрупкие, тусклые, плохо проводят тепло и электричество и имеют гораздо более низкие температуры плавления и кипения, чем металлы, поэтому многие из них являются газами при комнатной температуре. Некоторые элементы обладают свойствами металлов и неметаллов. Эти элементы называются металлоидами , и они находятся НА линии «лестницы».Элементами, которые чаще всего называют металлоидами, являются бор, кремний, германий, мышьяк, сурьма и теллур. Кремний – это элемент, который содержится в компьютерных микросхемах. Если вы когда-нибудь смотрели на компьютерный чип, вы могли заметить, что он блестит, как металл. Однако, если вы когда-нибудь ударите компьютерный чип молотком, вы обнаружите, что он очень хрупкий, свойство неметаллов.
Краткое содержание урока
Периодическая таблица Менделеева – один из наиболее часто используемых инструментов химика.Знание того, как он организован, является важной частью возможности его использовать. Элементы перечислены в порядке возрастания атомного номера и организованы в столбцы, называемые группами или семействами .

 Модифицированная Таблица Менделеева
Модифицированная Таблица Менделеева Официальный сайт: http://iupac.org/
Официальный сайт: http://iupac.org/ И.Менделеева в развитии химической
науки.
И.Менделеева в развитии химической
науки.


 1
1



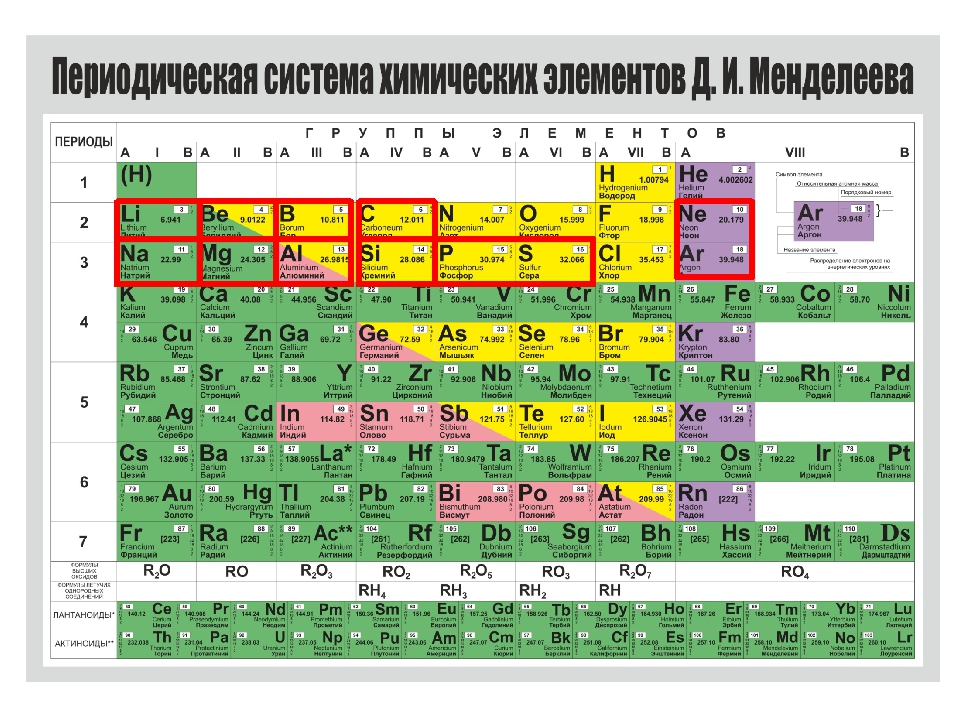
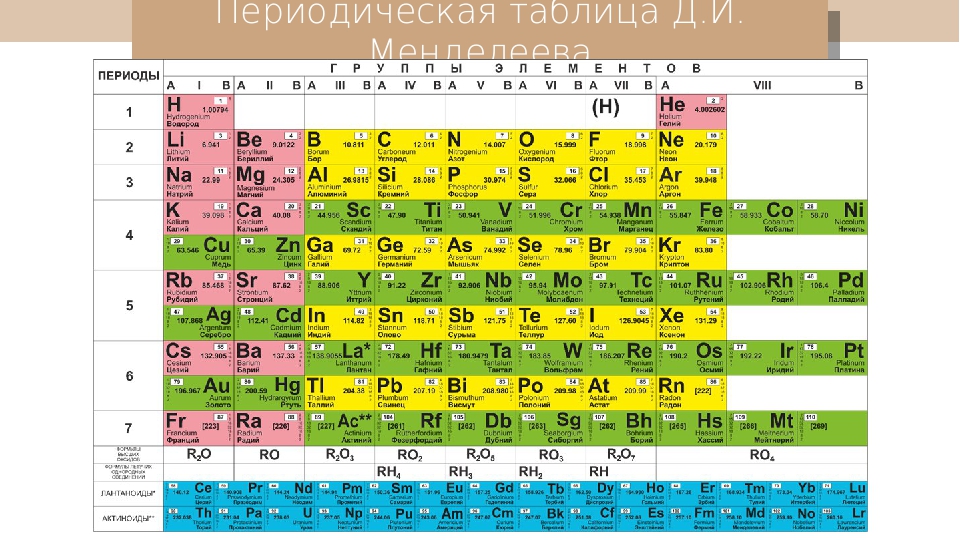
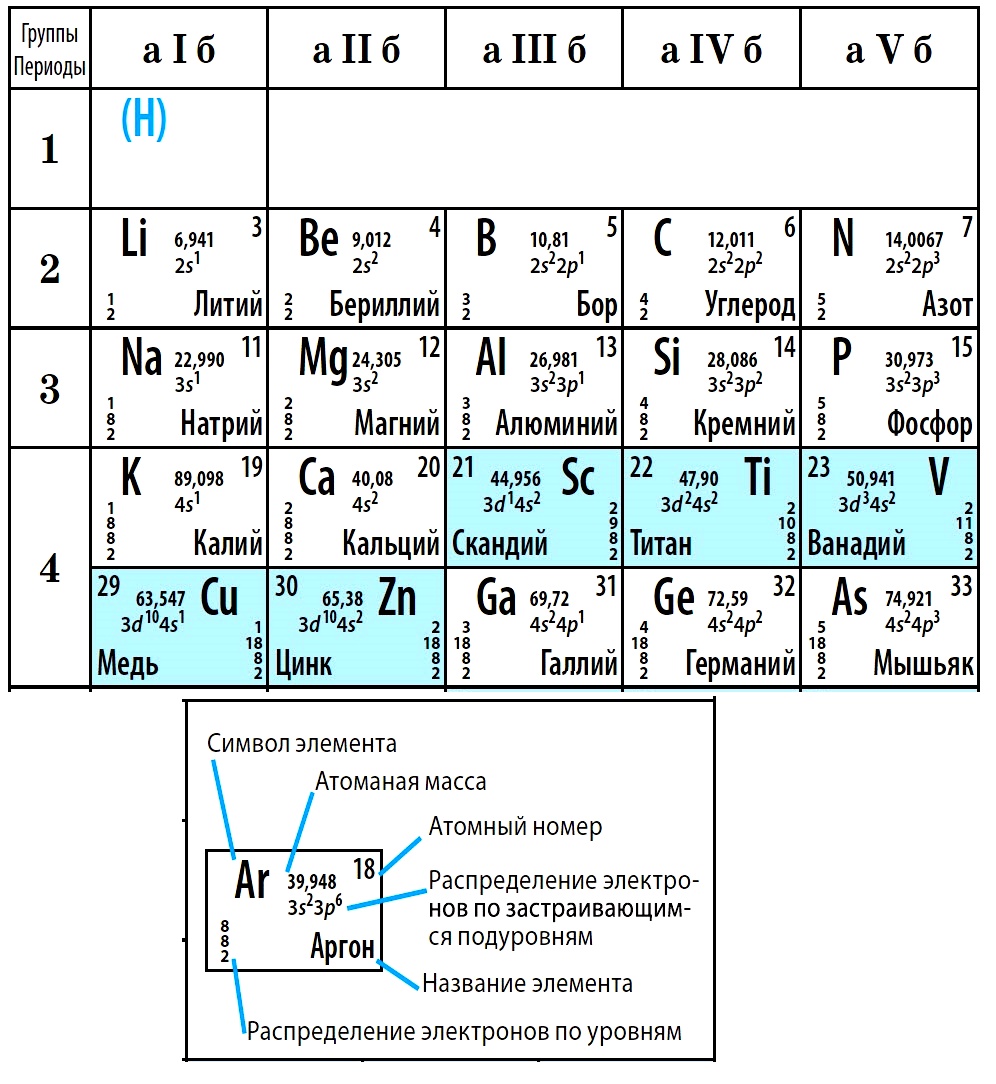
 Эти реакции известны как нейтрализация .
Эти реакции известны как нейтрализация . 

