|
Заглавная страница
КАТЕГОРИИ: Археология ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрации Техника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ? Влияние общества на человека Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Балочные системы. Определение реакций опор и моментов защемления |
⇐ ПредыдущаяСтр 4 из 7Следующая ⇒
Ответьте на вопросы: 1. Что Д.И.Менделеев считал главной характеристикой атома при построении периодической системы? _____________________________________________________________________________________________________________________________________________________________________________________________________________________ 2. Сколько вариантов имеет периодическая система элементов? _____________________________________________________________________________________________________________________________________________________________________________________________________________________ 3. Изучите длинный и короткий вариант таблицы Менделеева. Напишите, чем они отличаются? _____________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание № 2. Теоретическая часть Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Например: дана формула оксида меди Cu2O, необходимо определить валентность меди. Валентность кислорода постоянная и равна II, а на один атом кислорода приходится 2 атома меди. Следовательно, валентность меди равна I.
Определить валентности следующих элементов: Вариант 1. Вариант 2.CO, HCl, HBr, Cl2O5, SO Bариант 3. Al2O3, P2O5, NO2, Mn2O7,Cl2O7, Cr2O3 Вариант 4. SiO2, B2O3, SiH4, N2O5, MnO, N2O3
_____________________________________________________________________________
Задание № 3. Теоретическая часть Относительная молекулярная масса –сумма всех относительных атомных масс входящих в молекулу атомов химических элементов. Мr = Аr1 * n Где Мr – относительная молекулярная масса вещества Аr1 , Ar2, Аr3 … – относительные атомные массы элементов входящих в состав этого вещества n1, n2, n3 – индексы при химических знаках химических элементов. Пример: Вычислить относительную молекулярную массу молекулы серной кислоты (H2SO4)
Определить относительную молекулярную массу веществ: Вариант 1.Cu2O, KNO3, Na Вариант 2. A12(S04)3, H2SO4 , K2S, Mg(OH)2 Вариант 3. Вариант 4. P2O3, Zn(OH)2, H2SiO3, AlCl3
_____________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание № 4. Теоретическая часть «Атом» – греч «неделимый». Атомы, тем не менее, имеют сложное строение. В центре – атомное ядро, имеющее чрезвычайно малые размеры по сравнению с размерами атома. В состав ядра входят положительные частицы – протоны (р+) и нейтральные частицы – нейтроны (n0). Таким образом, ядро атома заряжено положительно. Атом— это электронейтральная частица, имеющая положительно заряженное ядро, вокруг которого движутся отрицательно заряженные электроны. Заряд ядра = Число протонов = Число электронов Протоны – частицы с положительным зарядом +1 и относительной массой 1. Нейтроны– электронейтральные частицы с относительной массой 1. Положительный заряд атома равен числу протонов. Число протонов в ядре соответствует порядковому номеру химического элемента в периодической системе Электронная оболочка атома окружает положительно заряженное ядро и состоит из отрицательных частиц – электронов е Электроны– частицы с отрицательнымзарядом -1 и относительной массой 1/1837 от массы протона. Так как в целом масса всех электронов ничтожно мала, ее можно пренебречь. Значит, практически вся масса атома сосредоточена в ядре и представляет собой сумму масс протонов и нейтронов. Массовое число – суммарное число протонов и нейтронов, округленно равно значению относительной атомной массе химического элемента (Ar). Число нейтронов в ядре равно разности между массовым числом и числом протонов. N = A – Z N – число нейтронов A – массовое число Z – число протонов. Атом в целом электронейтрален. ⇐ Предыдущая1234567Следующая ⇒ Читайте также: Формы дистанционного обучения Передача мяча двумя руками снизу Значение правильной осанки для жизнедеятельности человека Основные ошибки при выполнении передач мяча на месте |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 579; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia. |
Периодическая система химических элементов Д. И. Менделеева – Учебник по Химии. 7 класс. Григорович
Учебник по Химии. 7 класс. Григорович – Новая программа
Периодическая система — перечень известных элементов
Мы уже упоминали о Периодической системе химических элементов, а сейчас ознакомимся с ней подробнее. Периодическую систему можно представить как своеобразный перечень химических элементов. Однако это не просто перечень. Периодическая система отображает классификацию химических элементов, которая основана на особенностях строения их атомов. В ней существует множество закономерностей и зависимостей, с которыми вы ознакомитесь при изучении химии.
Дмитрий Иванович Менделеев (1834-1907)
Выдающийся российский ученый.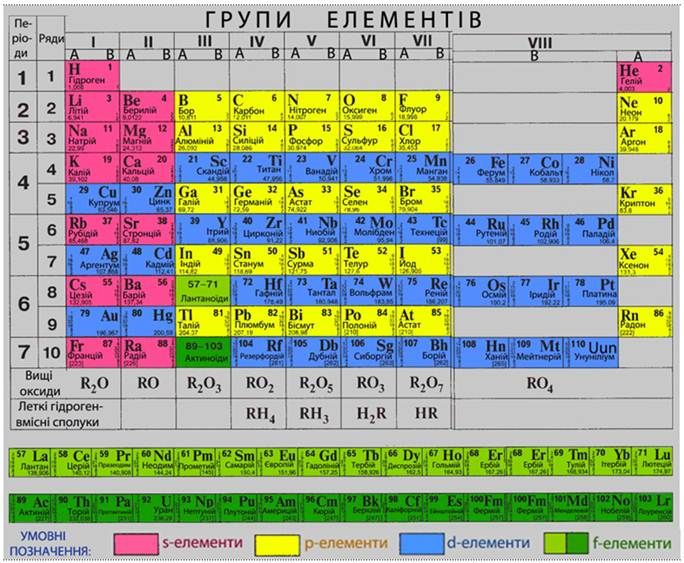 Родился в семье директора Тобольской гимназии. Закончил Петербургский педагогический институт, где позднее преподавал химию. Его труды посвящены не только химии, но и физике, технологии, экономике и географии. Самое значительное его достижение — открытие периодического закона. Создал в России первую палату мер и весов. В 1887 году сам осуществил полет на воздушном шаре для наблюдения солнечной короны во время затмения, пролетел 100 км на высоте около 4 км. Выдвигался на соискание Нобелевской премии, но так и не получил ее: Нобелевскую премию ввели лишь в 1901 году и давали только за открытия, совершенные в год присуждения.
Родился в семье директора Тобольской гимназии. Закончил Петербургский педагогический институт, где позднее преподавал химию. Его труды посвящены не только химии, но и физике, технологии, экономике и географии. Самое значительное его достижение — открытие периодического закона. Создал в России первую палату мер и весов. В 1887 году сам осуществил полет на воздушном шаре для наблюдения солнечной короны во время затмения, пролетел 100 км на высоте около 4 км. Выдвигался на соискание Нобелевской премии, но так и не получил ее: Нобелевскую премию ввели лишь в 1901 году и давали только за открытия, совершенные в год присуждения.
Периодическая система была составлена на основе периодического закона, открытого в 1869 г. Д. И. Менделеевым. Периодический закон мы рассмотрим чуть позже, а к Периодической системе будем обращаться в течение всего курса изучения химии. На момент своего создания Периодическая система содержала только 63 элемента — именно столько их было открыто к тому времени (рис. 56). По мере открытия новых элементов она дополнялась новыми данными. В честь Д. И. Менделеева химики называют Периодическую систему его именем. Гениальность Д. И. Менделеева заключалась в том, что он предусмотрел существование неоткрытых на тот момент элементов и оставил для них свободные места в таблице.
56). По мере открытия новых элементов она дополнялась новыми данными. В честь Д. И. Менделеева химики называют Периодическую систему его именем. Гениальность Д. И. Менделеева заключалась в том, что он предусмотрел существование неоткрытых на тот момент элементов и оставил для них свободные места в таблице.
На сегодняшний день в Периодическую систему внесены 118 элементов. Она пополняется новыми элементами, и пока ученые не могут однозначно утверждать, сколько всего элементов существует.
Рис. 56. Изображение первой Периодической системы, составленной Д. И. Менделеевым. В первой Периодической системе было только 63 элемента. По внешнему виду она отличалась от современной
Структура Периодической системы
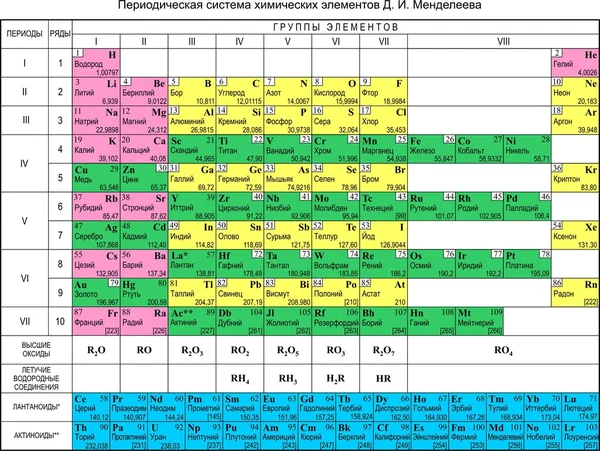
Периодическая система химических элементов имеет вид таблицы. Элементы в ней расположены в определенном порядке — по мере увеличения массы их атомов. Каждый элемент имеет свой порядковый номер, и этот номер равен заряду ядра атомов этого элемента.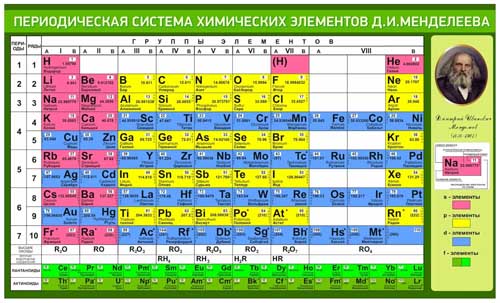
Существует множество вариантов изображения Периодической системы: круговые, спиральные, пирамидальные, с расположением элементов сверху вниз и слева направо. Общепринятым является изображение в виде таблицы с расположением элементов слева направо.
В Периодической системе все элементы объединены в периоды — горизонтальные ряды элементов, и группы — вертикальные столбцы элементов. В длинном варианте Периодической системы элементы объединены в 7 периодов и 18 групп, а в коротком — тоже в 7 периодов, но в 8 групп (см. форзацы).
В нашей стране традиционно пользуются короткопериодным вариантом. Международное сообщество IUPAC* рекомендует для использования длиннопериодный вариант Периодической системы.
Первые три периода называют малыми, так как в них содержится небольшое число элементов: первый период состоит из 2 элементов (Гидроген и Гелий), а второй и третий — из 8 элементов. Остальные периоды называют большими: четвертый и пятый периоды состоят из 18 элементов, а шестой и седьмой — из 32 элементов.
Группы объединяют элементы со схожими свойствами. Некоторые группы элементов имеют названия, например группа щелочных элементов или группа инертных элементов.
В нижней части таблицы расположены семейства элементов — лантаноиды и актиноиды. Эти элементы идут после Лантана (№ 57) и Актиния (№ 89) и формально относятся к третьей группе. Однако размещение этих элементов в таблице сделало бы ее громоздкой и неудобной, поэтому их обычно выносят за ее границы.
Каждый элемент имеет свой «адрес» в Периодической системе. Чтобы описать положение элемента в Периодической системе, нужно назвать его порядковый номер, а также номер группы и периода. Например: элемент Оксиген имеет порядковый номер 8, расположен во втором периоде, шестой группе.
* IUPAC (International Union of Pure and Applied Chemistry) — международное сообщество по фундаментальной и прикладной химии. Это сообщество принимает решения о присвоении названий новым элементам, а также о правилах составления названий веществ.
Рис. 57. Описание характеристик элементов в таблице Периодической системы
Элементы, так же как вещества или молекулы, имеют определенные свойства. Самые важные характеристики элементов приведены в Периодической системе — это порядковый номер, относительная атомная масса и т. п. (рис. 57).
Выводы:
1. Периодическая система содержит все известные на сегодня химические элементы. Она состоит из семи периодов — горизонтальных рядов, и восьми групп (короткий вариант) — вертикальных рядов.
2. Первые три периода называют малыми, они состоят из 2 или 8 элементов, а другие — большими, они состоят из 18 и более элементов. Некоторые группы элементов также имеют собственные названия.
Контрольные вопросы
1. Из скольких периодов и групп состоит современная Периодическая система?
2. Что называют периодом и группой Периодической системы?
3. Какие периоды Периодической системы называют малыми, а какие — большими?
4. Приведите примеры групповых названий химических элементов.
Приведите примеры групповых названий химических элементов.
5. Сколько элементов содержится в первых трех периодах Периодической системы? Выберите правильный ответ: а) 10; б) 18; в) 24; г) 63.
Задания для усвоения материала
1. Запишите символы и названия элементов, которые входят во второй период Периодической системы.
2. Сколько элементов содержится; а) в третьем периоде; б) пятом периоде?
3. Запишите символы приведенных элементов и опишите их положение в Периодической системе: Гидроген, Карбон, Фосфор, Феррум, Аргентум.
4. Как с помощью Периодической системы определить заряд ядра атома? Определите заряд ядер у атомов Карбона, Нитрогена, Хлора и Кальция.
5. Найдите в Периодической системе элемент с зарядом ядра +79. Запишите его символ, название. В каком периоде (большом или малом) он расположен? Сколько электронов содержится в атоме этого элемента?
6*. Найдите в дополнительной литературе примеры элементов, которые получены учеными искусственно и не существуют в природе. Укажите их порядковые номера и названия.
Укажите их порядковые номера и названия.
7*. Как вы считаете, почему из всех открытых химических элементов в природе встречается только 89? Как ученые открыли другие элементы?
ГДЗ к учебнику можно найти тут.
Попередня
СторінкаНаступна
СторінкаЗміст
Цей контент створено завдяки Міністерству освіти і науки України
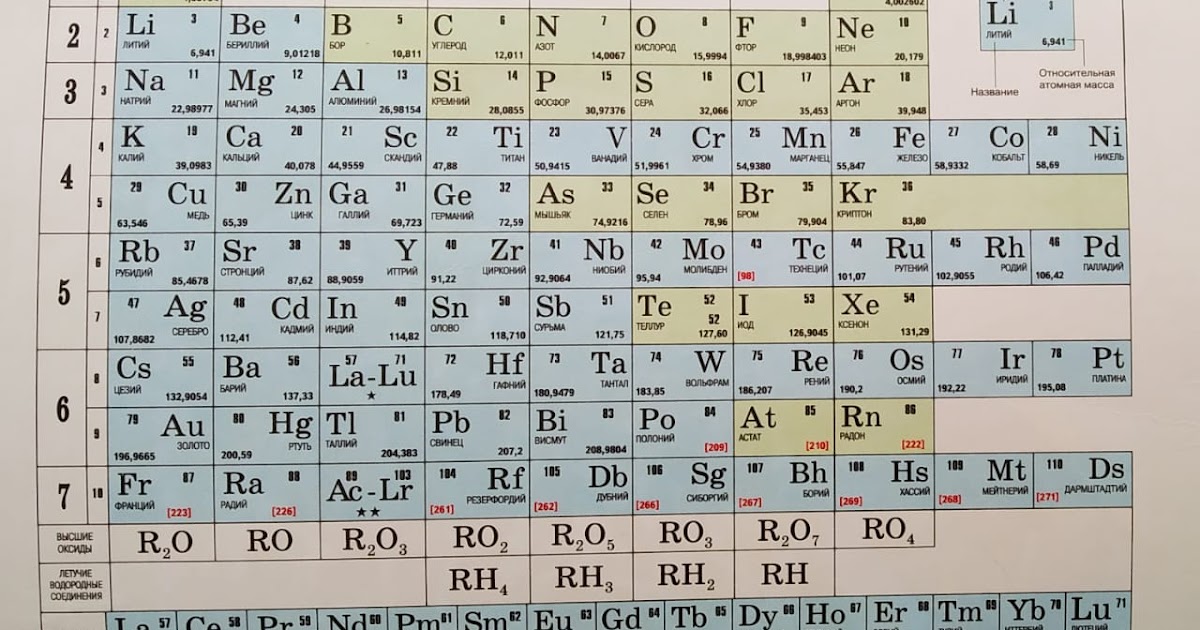
| Период 1 | 1 Х 1,008 Водород | 2 Он 4.0026 Гелий | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 3 Ли 6,94 Литий | 4 Быть 9.0122 Бериллий | 5 Б 10,81 Бор | 6 С 12.011 Углерод | 7 Н 14. Азот | 8 О 15,999 Кислород | 9 Ф 18,998 Фтор | 10 Не 20.180 Неон | |||||||||||
| 3 | 11 Нет 22.990 Натрий | 12 Мг 24.305 Магний | 13 Ал 26.982 Алюминий | 14 Си 28.085 Кремний | 15 Р 30,974 Фосфор | 16 С 32.06 Сера | 17 Кл 35,45 Хлор | 18 Ар 39,948 Аргон | |||||||||||
| 4 | 19 К 39.098 Калий | 20 Ca 40.078 Кальций | 21 СК 44,956 Скандий | 22 Ти 47. Титан | 23 В 50,942 Ванадий | 24 Кр 51,996 Хром | 25 Мн 54,938 Марганец | 26 Fe 55.845 Железо | 27 Ко 58.933 Кобальт | 28 Ni 58.693 Никель | 29 Медь 63,546 Медь | 30 Цинк 65,38 Цинк | 31 Га 69.723 Галлий | 32 Гэ 72.630 Германий | 33 Как 74,922 Мышьяк | 34 Se 78,971 Селен | 35 руб 79.904 Бром | 36 Кр 83,798 Криптон | |
| 5 | 37 руб. 85.468 Рубидий | 38 Старший 87,62 Стронций | 39 Д 88.906 Иттрий | 40 Зр 91.224 Цирконий | 41 № 92,906 Ниобий | 42 Мо 95,95 Молибден | 43 ТК ☢ 96.906 Технеций | 44 Ру 101.07 Рутений | 45 Рх 102,91 Родий | 46 Пд 106,42 Палладий | 47 Аг 107,87 Серебро | 48 CD 112,41 Кадмий | 49 В 114,82 Индий | 50 Сн 118,71 Олово | 51 Сб 121,76 Сурьма | 52 Те 127,60 Теллур | 53 я 126,90 Йод | 54 Хе 131,29 Ксенон | |
| 6 | 55 Cs 132,91 Цезий | 56 Ба 137,33 Барий | * | 71 Лу 174,97 Лютеций | 72 Хф 178,49 Гафний | 73 Та 180,95 Тантал | 74 Вт 183,84 Вольфрам | 75 Ре 186,21 Рений | 76 ОС 190,23 Осмий | 77 Ир 192,22 Иридий | 78 Пт 195,08 Платина | 79 Золото 196,97 Золото | 80 рт. 200,59 Меркурий | 81 Тл 204,38 Таллий | 82 Пб 207,2 Свинец | 83 Би 208,98 Висмут | 84 ПО ☢ 208,98 Полоний | 85 В ☢ 209,99 Астатин | 86 Р-н ☢ 222.02 Радон |
| 7 | 87 Пт ☢ 223.02 Франций | 88 Ра ☢ 226.03 Радий | ** | 103 Лр ☢ 262,11 Лоуренсиум | 104 Rf ☢ 267,12 Резерфордий | 105 Дб ☢ 270,13 Дубниум | 106 Сг ☢ 269,13 Сиборгиум | 107 Бх ☢ 270,13 Борий | 108 Hs ☢ 269,13 Хассиум | 109 Мт ☢ 278,16 Мейтнерий | 110 Дс ☢ 281,17 Дармштадтиум | 111 Rg ☢ 281,17 Рентгений | 112 Cn ☢ 285,18 Коперниций | 113 Nh ☢ 286,18 Нихоний | 114 Фл ☢ 289. Флеровиум | 115 Мк ☢ 289,20 Московиум | 116 ур. ☢ 293,20 Ливермориум | 117 Ц ☢ 293,21 Теннесси | 118 Ог ☢ 294,21 Оганесон |
| *Лантаноиды | * | 57 Ла 138,91 Лантан | 58 Се 140.12 Церий | 59 Пр 140,91 Празеодим | 60 Нд 144,24 Неодим | 61 ☢ 144,91 Прометий | 62 См 150,36 Самарий | 63 ЕС 151,96 Европий | 64 гд 157,25 Гадолиний | 65 Тб 158,93 Тербий | 66 Дай 162,50 Диспрозий | 67 Хо 164,93 Гольмий | 68 Er 167,26 Эрбий | 69 Тм 168,93 Тулий | 70 Ыб 173,05 Иттербий | ||||
| **Актиноиды | ** | 89 Ac ☢ 227. Актиний | 90 Чт ☢ 232.04 Торий | 91 Па ☢ 231.04 Протактиний | 92 У ☢ 238.03 Уран | 93 Нп ☢ 237,05 Нептуний | 94 Полиуретан ☢ 244,06 Плутоний | 95 Ам ☢ 243,06 Америций | 96 См ☢ 247,07 Кюриум | 97 Бк ☢ 247,07 Берклиум | 98 См. ☢ 251.08 Калифорния | 99 Эс ☢ 252,08 Эйнштейний | 100 FM ☢ 257,10 Фермиум | 101 Мд ☢ 258. Менделевий | 102 № ☢ 259,10 Нобелий | ||||
Министерство энергетики объясняет…Изотопы | Департамент энергетики
Управление Наука
Водород и два его природных изотопа, дейтерий и тритий. Все три имеют одинаковое количество протонов (обозначено p+), но разное количество нейтронов (обозначено n).
Изображение предоставлено Викискладом
Семья людей часто состоит из связанных, но не идентичных лиц. Элементы также имеют семейства, известные как изотопы. Изотопы являются членами семейства элементов, которые имеют одинаковое количество протонов, но разное количество нейтронов.
Количество протонов в ядре определяет атомный номер элемента в периодической таблице. Например, углерод имеет шесть протонов и атомный номер 6. Углерод встречается в природе в трех изотопах: углерод 12, который имеет 6 нейтронов (плюс 6 протонов равняется 12), углерод 13, который имеет 7 нейтронов, и углерод 14, который имеет 8 нейтронов. нейтроны. Каждый элемент имеет свое количество изотопов.
нейтроны. Каждый элемент имеет свое количество изотопов.
Добавление даже одного нейтрона может кардинально изменить свойства изотопа. Углерод-12 стабилен, то есть никогда не подвергается радиоактивному распаду. Углерод-14 нестабилен и подвергается радиоактивному распаду с периодом полураспада около 5730 лет (это означает, что половина материала исчезнет через 5730 лет). Этот распад означает, что количество углерода-14 в объекте служит часами, показывающими возраст объекта в процессе, называемом «углеродное датирование».
Изотопы обладают уникальными свойствами, и эти свойства делают их полезными в диагностике и лечении. Они важны в ядерной медицине, разведке нефти и газа, фундаментальных исследованиях и национальной безопасности.
Управление науки и изотопов Министерства энергетики США
Изотопы необходимы для исследований, торговли, медицинской диагностики и лечения, а также для обеспечения национальной безопасности. Однако изотопы не всегда доступны в достаточном количестве или по разумным ценам. Программа Министерства энергетики США по изотопам направлена на удовлетворение этой потребности. В рамках программы производятся и распределяются дефицитные радиоактивные и стабильные изотопы, включая побочные продукты, излишки материалов и сопутствующие изотопные услуги. Программа также поддерживает инфраструктуру, необходимую для производства и поставки приоритетных изотопных продуктов и сопутствующих услуг. Наконец, он проводит исследования и разработки в области новых и усовершенствованных методов производства и обработки изотопов.
Программа Министерства энергетики США по изотопам направлена на удовлетворение этой потребности. В рамках программы производятся и распределяются дефицитные радиоактивные и стабильные изотопы, включая побочные продукты, излишки материалов и сопутствующие изотопные услуги. Программа также поддерживает инфраструктуру, необходимую для производства и поставки приоритетных изотопных продуктов и сопутствующих услуг. Наконец, он проводит исследования и разработки в области новых и усовершенствованных методов производства и обработки изотопов.
Факты об изотопах
- У всех элементов есть изотопы.
- Существует два основных типа изотопов: стабильные и нестабильные (радиоактивные).
- Известно 254 стабильных изотопа.
- Все искусственные (лабораторные) изотопы нестабильны и поэтому радиоактивны; ученые называют их радиоизотопами.
- Некоторые элементы могут существовать только в нестабильной форме (например, уран).
- Водород — единственный элемент, изотопы которого имеют уникальные названия: дейтерий для водорода с одним нейтроном и тритий для водорода с двумя нейтронами.

 Все правила по сольфеджио
Все правила по сольфеджио

 SiH4, CrO3, H2S, CO2, SO3, Fe2O3
SiH4, CrO3, H2S, CO2, SO3, Fe2O3
 SO3, CaCO3, H2SO3, NH4OH
SO3, CaCO3, H2SO3, NH4OH

 su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь – 161.97.168.212 (0.003 с.)
su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь – 161.97.168.212 (0.003 с.) 007
007 867
867
 ст.
ст. 19
19 03
03 10
10