Элементы: Кричащий металл – олово
Олово известно человеку с самых древних времён. О нём есть упоминание в Библии. Так как олово и медь были открыты много раньше железа, их сплав – бронза, возможно, самый первый «искусственный» материал, сделанный человеком. Относительно чистое олово было получено в 12 веке.
Олово (Sn) в Таблице Менделеева
До этого оно всегда содержало какое-то количество свинца. Слово олово – славянского происхождения. Международное название этого элемента – stannum – из латинского языка и обозначается символом Sn. В Таблице Менделеева олово стоит под номером 50, c атомной массой 118, 710 а. е. м. При нормальных условиях это пластичный и легкоплавкий металл серебристо-белого цвета.
При нормальных условиях олово – мягкий, пластичный металл серебристо-белого цвета.
Несмотря на то, что олово известно с незапамятных времён, его аллотропные разновидности были открыты относительно недавно.
 При температуре −33 °C скорость превращений максимальна. Более того, соприкосновение серого и белого олова приводит к «заражению» последнего и его рассыпанию. В 1911 году совокупность этих явлений немецкий химик и минералог Эрнст Коген назвал «оловянной чумой». В 1912 году из-за «оловянной чумы» погибла экспедиция Роберта Скотта к Южному полюсу, которая осталась без горючего из-за того, что швы топливных баков были запаяны белым оловом, но в условиях низких температур оно перешло в серую разновидность и рассыпалось.
При температуре −33 °C скорость превращений максимальна. Более того, соприкосновение серого и белого олова приводит к «заражению» последнего и его рассыпанию. В 1911 году совокупность этих явлений немецкий химик и минералог Эрнст Коген назвал «оловянной чумой». В 1912 году из-за «оловянной чумы» погибла экспедиция Роберта Скотта к Южному полюсу, которая осталась без горючего из-за того, что швы топливных баков были запаяны белым оловом, но в условиях низких температур оно перешло в серую разновидность и рассыпалось.
Олово — редкий рассеянный элемент, по распространённости в земной коре занимает 47-е место со средним содержанием 8 г/т. Главный промышленный минерал олова — касситерит SnO2.
Кристаллы касситерита SnO2, разм. 5х4,5х4 см. Провинция Юньнань, Китай.
Второстепенное значение имеют: станнин Cu2FeSnS4, тиллит PbSnS2 и другие минералы. Основные мировые месторождения олова находятся в Китае, Индонезии, Бразилии, России, Боливии. В России запасы оловянных руд расположены на Дальнем Востоке.
Основные мировые месторождения олова находятся в Китае, Индонезии, Бразилии, России, Боливии. В России запасы оловянных руд расположены на Дальнем Востоке.
Главные промышленные применения олова – изготовления тары для пищевых продуктов, припои для электроники, подшипниковые сплавы.
| Относительная электроотрицательность (по Полингу): | 1,72 |
| Температура плавления: | 44,1°C |
| Температура кипения: | 277°C |
| Теплопроводность: | 0 |
| Плотность: | 1,82 г/см3 |
| Открыт: | было известно человеку уже в IV тысячелетии до н. э. |
| Цвет в твёрдом состоянии: | Бесцветный; Красный; Черный |
| Тип: | Неметалл |
| Орбитали: | 1s22s22p63s23p3 |
| Электронная формула: |
Sn – 1s2 2s2 Sn – [Kr] 5s2 4d10 5p2 |
| Валентность: | +2, +4 |
| Степени окисления: | 0, + II , IV |
| Сверхпроводящее состояние при температуре: | 0 К |
| Потенциалы ионизации: | 10,486 В 19,725 В 30,18 В |
Электропроводность в тв. фазе: фазе: |
10-15 при 293K |
| Ковалентный радиус: | 1,06 Å |
| Атомный объем: | 17 см3/моль |
| Атомный радиус: | 1,23 Å |
| Теплота распада: | 0,657 КДж/моль |
| Теплота парообразования: | 12,129 КДж/моль |
| Кристаллическая структура: | тетрагональная |
Общие сведенияХимический элемент таблицы Менделеева, металл. Степени окисления: +2 и +4. Валентности: II и IV. Электроотрицательность: 1,96. Электронная конфигурация: [Kr]5s25p2. Природное олово состоит из девяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96% по массе), 114 (0,66%), 115 (0,35%), 116 (14,30%), 117 (7,61%), 118 (24,03%), 119 (8,58%), 120 (32,85%), 122 (4,72%), и одного слабо радиоактивного олова-124 (5,94%).124 Sn — бета-излучатель, его период полураспада очень велик и составляет T
Строение атомаЧисло электронов: 50.
История открытияКогда человек впервые познакомился с оловом точно сказать нельзя. Олово и его сплавы известны человечеству с древнейших времен. Нахождение в природеОлово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Содержание олова в земной коре составляет, по разным данным, от 2·10 -4до 8·10 –3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO 2 , содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu ПолучениеДля добычи олова в настоящее время используют руды, в которых его содержание равно или немного выше 0,1%. На первом этапе руду обогащают (методом гравитационной флотации или магнитной сепарации). Физические и химические свойстваПростое вещество олово полиморфно. В обычных условиях оно существует в виде бета-модификации (белое олово), устойчивой выше 13,2°C. Белое олово — это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой, параметры a=0.5831, c=0.3181 нм. Координационное окружение каждого атома олова в нем — октаэдр. Плотность бета-Sn 7,29 г/см3 . Температура плавления 231,9°C, температура кипения 2270°C. Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, бета-Sn — металл, а альфа-Sn относится к числу полупроводников. Ниже 3,72 К альфа-Sn переходит в сверхпроводящее состояние. Стандартный электродный потенциал E°Sn 2+ /Sn равен –0.136 В, а E пары °Sn4+ /Sn2+ 0.151 В. При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды.  Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C: Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:Sn + O 2= SnO 2 . При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например: Sn + 2Cl 2= SnCl 4 С концентрированной соляной кислотой олово медленно реагирует: Sn + 4HCl = SnCl 4+ H 2 Возможно также образование хлороловянных кислот составов HSnCl 3 , H 2 SnCl 4 и других, например: Sn + 3HCl = HSnCl 3+ 2H 2 В разбавленной серной кислоте олово не растворяется, а с концентрированной реагирует очень медленно. Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b -SnO 2 ·nH 2 O (иногда ее формулу записывают как H 2 SnO 3 ). Sn + 4HNO 3 конц. =b -SnO 2 ·H 2 O + 4NO 2+ H 2 O При взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова(II): 3Sn + 8HNO 3 разб. = 3Sn(NO 3 ) 2 + 2NO + 4H 2 O. При нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn(II), например: Sn + 2KOH +2H 2 O = K2 [Sn(OH) 4 ] + H2 Гидрид олова — станнан SnH 4— можно получить по реакции: SnCl 4 + Li[AlH 4 ] = SnH4 + LiCl + AlCl 3 . Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C. Олову отвечают два оксида SnO 2(образующийся при обезвоживании оловянных кислот) и SnO.  Последний можно получить при слабом нагревании гидроксида олова(II) Sn(OH) 2 в вакууме: Последний можно получить при слабом нагревании гидроксида олова(II) Sn(OH) 2 в вакууме:Sn(OH) 2= SnO + H 2 O При сильном нагреве оксид олова(II) диспропорционирует: 2SnO = Sn + SnO 2 При хранении на воздухе монооксид SnO постепенно окисляется: 2SnO + O 2= 2SnO 2 . При гидролизе растворов солей олова(IV) образуется белый осадок — так называемая альфа-оловянная кислота: SnCl 4 + 4NH 3 + 6H2 O = H 2 [Sn(OH)6 ] + 4NH 4 Cl. H 2 [Sn(OH) 6 ] = -SnO2 ·nH 2 O (осадок) + 3H 2 O. Свежеполученная альфа-оловянная кислота растворяется в кислотах и щелочах: a -SnO 2 ·nH2 O + KOH = K 2 [Sn(OH) 6 ], a -SnO 2 ·nH2 O + HNO 3 = Sn(NO3 ) 4 + H2 O.  При хранении альфа-оловянная кислота стареет, теряет воду и переходит в бета-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO–Sn группировок при стоянии и замене их на более инертные мостиковые –Sn–O–Sn– связи. При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова(II): Sn 2++ S2– = SnS Этот сульфид может быть легко окислен до SnS 2 раствором полисульфида аммония: SnS + (NH 4 ) 2S 2 = SnS 2 + (NH4 ) 2 S Образующийся дисульфид SnS 2 растворяется в растворе сульфида аммония (NH 4 ) 2 S: SnS 2 + (NH 4 )2 S = (NH 4 )2 SnS 3 . Четырехвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и других.  ПрименениеВажное применение олова — лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. Олово способно прокатываться в тонкую фольгу — станиоль, такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS 2 применяют в составе красок, имитирующих позолоту («сусальное золото»). Искусственный радионуклид олова 119 Sn — источник гамма-излучения в мессбауэровской спектроскопии. Физиологическая рольО роли олова в живых организмах практически ничего не известно. |
ПромМетиз +7 (812) 385-76-07 Олово
Общие сведения.
Олово относится к категории лёгких металлов и имеет характерные для данной группы характеристики. В нормальных условиях он обладает пластичностью и переходит в жидкую форму при относительно невысокой температуре. В периодической таблице Менделеева олово занимает место под номером 50. Атомная масса элемента составляет 118,7 грамма на один моль. Металл располагается в главной подгруппе четвёртой группы веществ и относится к пятому периоду. Структура кристаллической решетки олова – тетрагональная.
Атомная масса элемента составляет 118,7 грамма на один моль. Металл располагается в главной подгруппе четвёртой группы веществ и относится к пятому периоду. Структура кристаллической решетки олова – тетрагональная.
История.
Олово относится к одним из первых металлов, которые были известны человечеству и использовались им для различных целей. Доподлинно известно о применение в четвёртом тысячелетии до нашей эры. Из-за своей редкости и дороговизны, он использовался, в основном, как ювелирное украшение. Главным толчком к активной добыче металла стало открытие его сплава с медью – бронзы. Стоит отметить, что исследованиями олова занималось большое количество химиков и металлургов, о чем свидетельствуют дошедшие до наших дней документы.
Нахождение в природе.
Олово относится к категории редких металлов, которые рассеяны по земной коре. Данный элемент занимает 47-е место по своей распространённости и составляет всего 2•10−4 до 8•10−3 % от массы Земли. В природе олово не встречается в чистом виде. Но его концентрация в основных минералах достаточно высока. Например, касситерит, представляющий собой оксид данного металла, содержит около 80 его процентов в своём составе.
В природе олово не встречается в чистом виде. Но его концентрация в основных минералах достаточно высока. Например, касситерит, представляющий собой оксид данного металла, содержит около 80 его процентов в своём составе.
Большинство мировых месторождений олова находятся на территории стран Юго-Восточной Азии. Именно там добывается значительная часть данного металла, поступающая на мировой рынок. В России, так же, присутствует несколько месторождений. Добыча производится разными методами, в зависимости от типа залегания минералов.
Получение.
Чтобы получить олово в чистом виде, руду с высоким показателем его концентрации размалывают до частиц не более сантиметра в диаметре. Вибрационно-гравитационный метод позволяет выделить метал с тяжёлыми примесями из общей массы. Когда обогащение обеспечивает содержание олова на уровне 40-70 процентов, производится обжиг концентрата в печах с последующим удалением примесей. Чтобы получить металл особой чистоты, который используется в некоторых сферах, применяется методика рафинирования.
Чтобы получить металл особой чистоты, который используется в некоторых сферах, применяется методика рафинирования.
Физические и химические свойства.
Олово является металлом со светло-серебряным цветом. Практически любая обработка или отсутствие таковой подразумевают наличие выраженного блеска. В твёрдом состоянии олово имеет плотность 7,3 тонны на один кубический метр вещества. При переходе в жидкую фазу, данный показатель уменьшается до 6980 килограмм. Температура плавления равняется 231 градус по Цельсию, а кипение начинается уже при 2200. Это простое вещество является полиморфным и при обычных условиях существует только его бета модификация.
В обычных условиях олово не склонно к окислению под воздействием окружающей среды. Причина заключается в том, что образуется тонкая плёнка на поверхности металла, которая препятствует подобным процессам. Окислительные процессы начинаются только после того, как температура превысит 150 градусов Цельсия.
Олово вступает в химические реакции с большинством элементов неметаллической категории. Сюда относится и значительное количество кислот, а также щелочей.
Применение.
Весьма широкое применение олово получило по той причине, что олово не представляет опасности для организма человека и может использоваться для создания надёжных и долговечных покрытий. Как показывает распределение данного металла по сферам, около трети добываемого элемента служат именно этим целям. Чистое олово может применяться в качестве материала для сверхпроводящих элементов.
Анодные электроды, зачастую, изготавливаются именно из этого типа металла. К перспективным областям можно отнести новые типы аккумуляторных батарей. Они обладают весьма высокими характеристиками и будут выпущены в течение ближайших нескольких лет.
Если требуется осуществить доводку стёкол в оптике, для этих целей применяется двуокись олова.
1.Химический элемент олово(Sn).
1.1. Электронная формула данного химического элемента:
1S22S22P63S23P63D104S24P64D104F05S25P2
Сокращенная электронная формула:4D105S25P2
В 5-м периоде
электроны заполняют сначала 5S-подуровень,
потом 4D-подуровень,
затем 5P-подуровень.
Начиная с 3-го периода, происходит
несоответствие между количеством
электронов на энергетическом уровне и
количеством электронов в данном периоде,
что можно объяснить принципом наименьшей
энергии. В соответствии с данным
принципом, при заполнении энергетических
уровней наблюдается эффект запаздывания.
Электроны в таком состоянии заполняют
орбитали в порядке повышения уровня
энергии орбиталей. В соответствии с
правилом Клечковского увеличение
энергии и соответственно заполнение
орбиталей происходит в порядке возрастания
суммы квантовых чисел (n+l),
а при равной сумме (n+l)
в порядке возрастания числа n.
В соответствии с
правилом Клечковского увеличение
энергии и соответственно заполнение
орбиталей происходит в порядке возрастания
суммы квантовых чисел (n+l),
а при равной сумме (n+l)
в порядке возрастания числа n.
4D(4+2)=6 5S(5+0)=5 5P(5+1)=6
4D- и 5P-подуровни имеют одинаковые значения (n+l), но энергетически более выгоден 4D-подуровень, т. к. у него меньшее значение n. Поэтому данные подуровни заполняются в следующем порядке: 5S, 4D, 5P. 5-й период заполняется аналогично 4-му.
1.2. I. Sn – олово. Порядковый номер 50, 5 период, IV группа, главная (А) подгруппа.
Порядковый номер олова – 50, а относительная атомная масса Аr=119 (округленное значение). Соответственно, заряд ядра его атома +50 (число протонов). Следовательно, число нейтронов в ядре равно N=Аr-Z=69. Так как атом электронейтрален, то число электронов, содержащихся в атоме олова, тоже равно 50.
Элемент олово находится в 5 периоде периодической таблицы Д. И. Менделеева, значит, все электроны атома располагаются на пяти энергетических уровнях. Так же по номеру периода устанавливается количество электронов, которые находятся в данном периоде. Их количество равно: Xe=2n2=2*52=50.
Номер группы (IV) показывает на то, что максимальная степень окисления металла равна +4.
Олово относится к IV группе главной (А) подгруппе, следовательно, олово – P-элемент.
I
5S 4D
I. Возможность “эффекта провала электронов”:50Sn
Так как 4D-подуровень заполнен электронами полностью, то “эффект провала электронов” не наблюдается.
1.3. Валентные
подуровни в электронной формуле данного
химического элемента – 5S
и 5P:
5S25P2. Олово относится к P-элементам,
т. к. у этого элемента в последнюю очередь
заполняется пятый электронный слой,
5P-подуровень.
Олово относится к P-элементам,
т. к. у этого элемента в последнюю очередь
заполняется пятый электронный слой,
5P-подуровень.
1.4. Наборы квантовых чисел для всех валентных электронов:
S
-1 0 1
1:n=5, l=0, ml=0, ms=+1/2;S2:n=5, l=0, ml=0, ms=-1/2;
P1:n=5, l=1, ml=-1, ms=+1/2; +50Sn
P2:n=5,
l=1,ml=0,ms=+1/2.
1.5. Олово – металл, т.к. его атомы отдают электроны, превращаясь в положительные ионы. Т. к. олово расположено вблизи диагонали бор – астат, он обладает двойственными свойствами: в одних соединениях ведет себя как металл, в других – как неметалл (амфотерные оксиды и гидроксиды).
Так как атомы олово содержат на внешнем слое 4 электрона, они могут отдавать их, приобретая при этом степень окисления +4 (проявлять восстановительные свойства). Также олово может принимать степень окисления +2.
5S 5P 5S 5P
с. о.=+2
с.о.=+4
о.=+2
с.о.=+4
1
1)
2)
.6.В соответствии с правилом Гунда суммарное спиновое число s должно быть максимальным. Расположим 2 электрона на P-атомной орбиталиТак как во втором варианте s=max, то два электрона располагаются наP-атомной орбитали в таком положении, как во втором варианте.
Согласно принципу
наименьшей энергии электроны в основном
состоянии заполняют орбитали в порядке
повышения уровня энергии орбиталей. В
одном и том же уровне энергия подуровней
возрастает:Es<Ep. Поэтому сначала заполняется
5S-подуровень(2 электрона),
а после этого заполняется 5P-подуровень
по одному электрону в каждой ячейке.
В
одном и том же уровне энергия подуровней
возрастает:Es<Ep. Поэтому сначала заполняется
5S-подуровень(2 электрона),
а после этого заполняется 5P-подуровень
по одному электрону в каждой ячейке.
1.7.
5S 5P 5S 5P
K=2K*=4SP3q4-гиб.-я
Атом олова в возбужденном состоянии имеет ковалентность, равную 4.
С водородом олово образует гидрид SnH4;с галогенами соединения типаSnX2иSnX4. Соединения типаSnX2обусловлены наличием у олова неподеленной пары электронов. Соединения типаSnX4иSnH4имеютSP3q4-гибридизацию и имеют форму тетраэдра.
температура плавления и кипения, добыча, месторождения, марки, масса
Раньше олово как чистый металл не был знаком человечеству. Оно использовалось в сплаве со свинцом, соединение которых образовывало оловянистую бронзу. Сейчас этот легкий металл применяется в разных сферах промышленности. Температура плавления олова позволяет эффективно использовать его для изготовления припоев.
Краткое описание
Олово — химический элемент, который в таблице Менделеева находится в группе легких металлов под номером 50. Это пластичный, ковкий материал, с естественным металлическим блеском.
Структура и характеристики
Аллотропные модификации:
- b-Sn — стандартное белое. Имеет объемноцентрированную тетрагональную кристаллическую решетку.
- a-Sn — серое олово. Имеет гранецентрированную кубическую кристаллическую решетку.
Чистый металл может рассыпаться в порошок при низких температурах, но этот процесс замедляется при наличии примесей в составе.
История открытия и изучения
По археологическим находкам ученые смогли установить, что с оловом человечество познакомилось еще в 4 тысячелетии до н. э. Письменные напоминания об этом металле можно встретить в Четвертой Книге Моисея, Библии.
Сначала олово было малодоступным. Его можно было встретить только у правителей, полководцев, богатых граждан, купцов. Он был главным компонентом оловянистой бронзы, которая появилась в середине 3 тысячелетия до н. э. Тогда бронза считалась самым прочным сплавом. Компоненты для его изготовления имели исключительную ценность в период «бронзового века».
Олово руда (Фото: Instagram / ferroprofi)Отдельно от примесей, чистый металл было получено в 12 веке. Его упоминания есть в работах Р. Бэкона.
Получение из руды и месторождения
Процесс получения сплава зависит от того, в какой форме его нашли. Олово в виде руды не имеет значительных отличий от производства других цветных металлов. Процесс состоит из трех этапов:
- Добыча, обработка расходного сырья (руды).
- Восстановительная плавка для получения чернового металла.
- Рафинирование подготовленного сырья допустимыми способами.
Разработка россыпных месторождений осуществляется с помощью промышленных песковых насосов.
Промышленное получение
Существует две технологии промышленного получения олова:
- Восстановительная плавка. Для проведения этой технологии применяется 2 типа аппаратов — отражательные печи, шахтное оборудование для плавки.
- Рафинирование. Бывает термическим, электролитическим.
Марки
Марки:
- О1, О1пч. Это обозначение указывает на то, что в сплаве содержится 99,9% Sn. Изготавливается в виде проволоки, прутков, чушек.
- ОВЧ-000. Сплав высокой чистоты. Содержание Sn в составе — 99,99%. Изготавливается в виде прутков, чушек.
- О2. Содержание Sn в составе — 99,565%. Производится в виде прутков, проволоки, чушек.
- О3. Сплав содержит 98,49% Sn. Изготавливается чушками.
- О4. Самое «грязное» соединение. Содержит большое количество сторонних примесей. Их примерное количество — 3,5% от общей массы.
Оловянные прутки (Фото: Instagram / ferroprofi)Маркировка указывается на готовых изделиях с помощью штампа.
Свойства
Чтобы понять, где лучше применять олово, нужно знать характеристики, свойства химического элемента.
Химические
Олово — химический элемент периодической таблицы Менделеева с атомным номером 50. Оно относится к группе легких металлов. Химические свойства:
- Электроотрицательность — 1,8.
- Температура плавления — 231°C.
- Температура кипения — 2630°C.
- Плотность — 7300 кг/м³.
- Атомная масса химического элемента — 118,71.
- Теплоемкость — 0,226 кДж/(кг·°С).
Олово инертно к воздействию воды, воздуха, если в помещении комнатная температура. На поверхности заготовки, которая находится на открытом воздухе, образуется оксидная пленка, защищающая металл от окисления, образования ржавчины.
Физические
Свойства:
- Плотность — 7,31 г/см3.
- Металлический блеск — есть.
- Прозрачность —нет.
- Цвет — серо-белый.
- Спайность — нет.
- Прочность — ковкий металл.
- Твердость — до 2 по шкале Мооса.
- Высокая электропроводность.
Белое олово является парамагнетиком, а серое диамагнетиком.
Сковорода из белого олова (Фото: Instagram / artprohome)Оптические
Свойства:
- Умеренная анизотропия.
- Не плеохроирует.
- Тип металла — изотропный.
- Олово не флуоресцентный материал.
Кристаллографические
Свойства:
- Тетрагональная сингония.
- Пространственная группа металла — I 41/amd.
- Точечная группа — 4/mmm.
Типы
Виды олова для пайки:
- ПОС-18. Содержит несколько основных компонентов — олово (18%), свинец (около 81), сурьму (2,5%). Применяется при лужении металлов. Подходит для создания швов при низких стандартах. Температура плавления — 270°C.
- ПОС-30. Содержит олово (28%), свинец (около 70%), сурьму (2%). Применяется для пайки меди, стали, латуни. Температура плавления — 270°C.
- ПОС-50. Содержит олово (50%), свинец (около 50%), сурьму (0,8%). Применяется для спаивания радиодеталей, получения высокого качества шва. Температура плавления — 230°С.
- ПОС-90. Содержит олово (90%), свинец (9–10%), сурьму (0,15%).
Отдельные виды оловянных припоев — ПОС-40, ПОС-60. Применяются для пайки радиодеталей.
Пайка радиодеталей (Фото: Instagram / remont_pc_gelendzhik)Сферы применения
Сферы применения:
- Защита металлических поверхностей. Применяется в виде специального покрытия. Оно не выделяет вредных веществ при эксплуатации, устойчиво к образованию ржавчины.
- Изготовление белой жести (второе название луженое железо). Используется для производства дымовых труб, тары для хранения пищевых продуктов, подшипников.
- Производство сантехники, запорной арматуры, фурнитуры.
- Изготовление сплавов.
- Производство припоев.
- Изготовление ограждений, лестничных перил.
- Производство скульптур, скамеек, вешалок, светильников для украшения интерьера.
Больше 50% добытого металла применяется для получения белой жести, предметов из стали с дополнительным защитным покрытием.
Преимущества и недостатки
Преимущества:
- Пластичность. Из олова изготавливают сложные изделия для украшения интерьера.
- Инертность. Металл применяется в пищевой промышленности для изготовления посуды, тар для хранения продуктов.
- Низкая температура плавления. Олово используется для нанесения на металлические детали в виде защитного покрытия.
Недостатки:
- Низкий показатель прочности. Сплав не подходит для изготовления деталей, которые будут подвергаться большим нагрузкам.
- Редкость. Из-за этого увеличивается цена на материал.
Сплавы
Сплавы:
- баббиты;
- пьютер;
- бронза.
Отдельная группа — припои с разными характеристиками.
Олово — редкий металл. Благодаря своим химическим, физическим особенностям оно применяется во многих сферах деятельности. Наиболее популярное направление — изготовление припоев для пайки других металлов, сплавов.
ПРЕЗЕНТАЦИЯ ПО ТЕМЕ ОЛОВО SN ХИМИЧЕСКИЙ ЭЛЕМЕНТ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
ПРЕЗЕНТАЦИЯ ПО ТЕМЕ ОЛОВО(SN) ХИМИЧЕСКИЙ ЭЛЕМЕНТ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ Д. И. МЕНДЕЛЕЕВА
Происхожде ние названия Месторо ждения Краткое содержа ние Нахожден ие в природе История
ОЛОВО (SN) О лово (лат. Stannum; обозначается символом Sn) — элемент главной подгруппы четвёртой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово — пластичный, ковкий и легкоплавкий блестящий металл серебристобелого цвета. Олово образует две аллотропические модификации: ниже 13, 2 °C устойчиво α-олово (серое олово) с кубической решёткой типа алмаза, выше 13, 2 °C устойчиво β-олово (белое олово) с тетрагональной кристаллической решеткой.
ИСТОРИЯ Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, так как изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисеевой. Олово является (наряду с медью) одним из компонентов бронзы (см. История меди и бронзы), изобретённой в конце или середине III тысячелетия до н. э. . Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века» , более 2000 лет (очень приблизительно: 35— 11 века до н. э. ).
ПРОИСХОЖДЕНИЕ НАЗВАНИЯ Латинское название stannum, связанное с санскритским словом, означающим «стойкий, прочный» , первоначально относилось к сплаву свинца и серебра, а позднее к другому, имитирующему его сплаву, содержащему около 67 % олова; к IV веку этим словом стали называть собственно олово. Слово олово — общеславянское, имеющее соответствия в балтийских языках (ср. лит. alavas, alvas — «олово» , прусск. alwis — «свинец» ). Оно является суффиксальным образованием от корня ol- (ср. древневерхненемецкое elo — «жёлтый» , лат. albus — «белый» и пр. ), так что металл назван по цвету. .
НАХОЖДЕНИЕ В ПРИРОДЕ Олово — редкий рассеянный элемент, по распространенности в земной коре олово занимает 47 -е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2× 10− 4 до 8× 10− 3 % по массе. Основной минерал олова — касситерит (оловянный камень) Sn. O 2, содержащий до 78, 8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu 2 Fe. Sn. S 4 (27, 5 % Sn).
МЕСТОРОЖДЕНИЯ Мировые месторождения олова находятся в Юго. Восточной Азии, в основном в Китае, Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии. В России запасы оловянных руд расположены в Чукотском автономном округе (рудник/посёлок Валькумей, разработка месторождения закрыта в начале 90 -х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
Tin – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее стихии: олово
(Promo)
Вы слушаете Химию в ее стихии, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе элемент, который изменил курс индустрии, а также породил бронзовый век.Мы узнаем, почему римляне пришли в Британию и почему ваш орган зимой может необратимо выйти из строя. Но любителям олова следует быть начеку, потому что многое из того, что мы называем оловом, – нет.
Кэтрин Холт
Жестяные банки, оловянная фольга, оловянные свистки, оловянные солдатики … это то, что приходит на ум, когда мы думаем о олове. И это прискорбно, поскольку жестяные банки на самом деле сделаны из стали; оловянная фольга сделана из алюминия и оловянных свистков …. ну вы поняли. Быть связанным со списком устаревших расходных материалов особенно прискорбно для олова, если учесть, что оно буквально изменило цивилизацию! Вы слышали о бронзовом веке? Что ж, некоторые предприимчивые рабочие-металлисты в конце каменного века обнаружили, что добавление небольшого количества олова в расплавленную медь привело к получению нового сплава.Она была тверже, чем медь, но ее было гораздо легче формировать, отливать и точить. Это открытие было настолько революционным, что родился бронзовый век – название, данное любой цивилизации, которая делала инструменты и оружие из этого сплава меди и олова.
Олово было настолько важным, что секреты его производства тщательно охранялись. Древние греки говорили о «Касситеридах» или «Оловянных островах», которые, как полагали, лежали у северо-западного побережья Европы. Эти загадочные острова никогда не были идентифицированы и, вероятно, никогда не существовали.Все, что знали греки, – это то, что олово попало к ним по морю и с северо-запада, и так возникла история о оловянных островах. Вероятно, олово пришло из Северной Испании и из Корнуолла. Фактически, стратегическое значение оловянных рудников Корнуолла считается одной из причин вторжения Римской империи в Британию.
Олово могло сыграть и другую историческую роль – на этот раз в разгроме армии Наполеона в русской кампании 1812 года. Утверждалось, что в сильный мороз оловянные пуговицы на солдатской форме рассыпались в порошок, что привело к серьезной потере жизнь от переохлаждения.Правильность этой истории спорна, но превращение олова из блестящего металла в серый порошок при низких температурах – химический факт.
Холодными зимами Северной Европы утрата оловянных органных трубок, когда они начали рассыпаться в пыль, на протяжении веков была известна как «оловянный вредитель», «оловянная болезнь» или «оловянная проказа». На самом деле этот процесс представляет собой очень простое химическое преобразование одной структурной формы олова – серебристого, металлического «белого олова» или «бета-олова» – в другую – хрупкое неметаллическое «серое олово» или «альфа-олово».Для чистого олова переход происходит при 13,2 ° C, но температура перехода ниже или не происходит вообще, если присутствует достаточно примесей, например, если олово легировано другим металлом.
Таким образом, возникла современная проблема с «оловянными вредителями», поскольку сплавы олово-свинец, используемые для покрытия выводов в электрическом оборудовании, иногда заменяются чистым оловом в связи с новым законодательством по охране окружающей среды. При низких температурах покрытие из металлического бета-олова превращается в непроводящее, хрупкое альфа-олово и падает с выводов.Затем рассыпчатый порошок альфа-олова перемещается внутри оборудования, но, поскольку он не проводит ток, это не вызывает проблем. Однако при более высоких температурах этот порошок альфа-олова снова превращается в проводящее бета-олово, что приводит к коротким замыканиям и всевозможным проблемам.
Чтобы победить «оловянных вредителей», нужно смешать олово с другими металлами, и в наши дни олово в основном используется для образования сплавов, например, бронзы, олова и припоев. Поскольку олово является наиболее тонально резонансным из всех металлов, оно используется в металлах колоколов и для изготовления органных труб, которые обычно представляют собой смесь олова и свинца в соотношении 50:50.От количества олова обычно зависит тон трубы.
Итак, мы возвращаемся к скромной консервной банке. Банки, хотя и не сделаны из жести, часто покрываются оловом изнутри для предотвращения коррозии. Итак, хотя сейчас может показаться, что олово играет небольшую роль в нашей повседневной жизни, помните, что когда-то оно участвовало в взлете и падении цивилизаций.
Крис Смит
Итак, это олово привлекло римлян в Британию – забавно, что я подумал, что это была чудесная погода.Историю Тина рассказала Кэтрин Холт из Калифорнийского университета в Лос-Анджелесе. На следующей неделе вещество, которое заставляет вас видеть красный цвет.
Брайан Клегг
Если вы слушаете этот подкаст на компьютере с традиционным цветным монитором, Европиум улучшит ваше представление о веб-сайте Chemistry World. Когда впервые были разработаны цветные телевизоры, красные пиксели были относительно слабыми, что означало, что весь цветовой спектр должен был оставаться приглушенным. Но люминофор, легированный европием, оказался гораздо лучшим и ярким источником красного цвета и до сих пор присутствует в большинстве сохранившихся мониторов и телевизоров, предшествовавших революции плоских экранов.
Крис Смит
И вы можете услышать от Брайана Клегга, как впервые была использована сила европия и как он был обнаружен на следующей неделе в «Химии в ее элементе». Надеюсь, вы присоединитесь к нам. А пока я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
фактов о олове | Живая наука
Олово – это элемент, который, возможно, наиболее известен тем, что он используется в жестяных банках, которые в наши дни почти всегда на самом деле являются алюминиевыми.Даже оригинальные консервные банки, впервые представленные в 1800-х годах, в основном были стальными, покрытыми оловом.
Так что олово может показаться непритязательным, но не маловажным. Этот металл используется для предотвращения коррозии и производства стекла. Чаще всего его находят в смеси или сплавах с другими металлами. Олово, например, в основном состоит из олова.
Источники олова
Олово относительно редко, по данным Геологической службы США, составляя лишь около 2 частей на миллион земной коры. Олово добывается из различных руд, в основном из касситерита (SnO 2 ).Металл получают путем восстановления оксидной руды углем в печи.
Очень мало олова было найдено в Соединенных Штатах, большая его часть – на Аляске и в Калифорнии. По данным Лос-Аламосской национальной лаборатории, металл в основном производится в Малайе, Боливии, Индонезии, Заире, Таиланде и Нигерии.
Использование олова
Возможно, исторически наиболее важным применением олова было изготовление бронзы – сплава меди и олова или других металлов, – которая изменила цивилизацию, открыв бронзовый век.Люди начали изготавливать или продавать бронзовые инструменты и оружие в разное время, в зависимости от географического положения, но принято считать, что бронзовый век начался около 3300 г. до н. Э. на Ближнем Востоке.
Только факты
Согласно данным лаборатории линейных ускорителей Джефферсона, олово имеет следующие свойства:
- Атомный номер (число протонов в ядре): 50
- Атомный символ (в Периодической таблице элементов): Sn
- Атомный вес (средняя масса атома): 118.710
- Плотность: 7,287 грамма на кубический сантиметр
- Фаза при комнатной температуре: твердое вещество
- Точка плавления: 449,47 градусов по Фаренгейту (231,93 градуса Цельсия)
- Точка кипения: 4,715 F (2602 C)
- Количество изотопов (атомов один и тот же элемент с другим числом нейтронов): 51, 8 стабильный
- Наиболее распространенные изотопы: Sn-112 (естественное содержание 0,97 процента), Sn-114 (0,66 процента), Sn-115 (0,34 процента), Sn-116 (14,54 процента), Sn-117 (7,68 процента), Sn-118 (24.22 процента), Sn-119 (8,59 процента), Sn-120 (32,58 процента), Sn-122 (4,63 процента) и Sn-124 (5,79 процента)
Старый металл
Олово используется в бронзе примерно 5000 лет назад. Он также иногда появлялся в археологических записях сам по себе. Например, исследователи, проводившие раскопки в еврейском храме в Иерусалиме в 2011 году, обнаружили кусок жести размером с пуговицу, на котором было написано арамейское слово «чистый для Бога».«Эта печать, возможно, использовалась для обозначения церемониально чистых предметов для ритуалов, согласно сообщению в газете Haaretz.
Помимо бронзы, величайшим вкладом олова в человечество, вероятно, была скромная консервная банка. о том, как прокормить армию в движении. По данным Института производителей банок (да, даже у консервных банок есть торговая организация), Наполеон Бонапарт в 1795 году предложил награду любому, кто сможет придумать способ сохранить еду для военных использовать.В 1810 году французский шеф-повар Николя Апперт выиграл приз в размере 12 000 франков, изобретя консервирование – процесс запечатывания еды или напитков в банке или бутылке с использованием кипящей воды.
Только год спустя это открытие расчистило путь для изобретения консервной банки. В 1810 году британский купец Питер Дюран получил патент на использование луженой стали в консервных банках. Олово устойчиво к коррозии, что делает его идеальным покрытием для относительно дешевой стали.
Жестяная банка прибыла на берега Америки в 1818 году, и компания-производитель Thomas Kensett & Co запатентовала жестяную банку в Америке в 1825 году.Гражданская война вызвала рост популярности консервных банок, поскольку генералы снова искали способ накормить своих солдат.
Расцвет олова закончился в середине 20-го, -го, века, однако, когда компания Coors Brewery представила первую алюминиевую банку. Более дешевый, легкий и пригодный для вторичной переработки алюминий быстро обогнал олово и сталь.
Но олово все еще находит применение. Олово плюс элемент ниобий делает сверхпроводящий металл, используемый для изготовления проволоки. Для изготовления припоя используется сплав олова / свинца. Медь и другие металлы смешивают с оловом, чтобы получить олово, которое когда-то было обычным металлом для изготовления посуды.А оконное стекло приобретает свою шелковистую гладкую поверхность из формы из расплавленного олова. Этот метод называется процессом Пилкингтона.
Кто знал?
- Эти золотые статуэтки Оскара не из чистого золота. На самом деле это металл Британии, покрытый золотом. Металл Британии примерно на 92 процента состоит из олова (остальное – это медь и сурьма).
- Sn? Разве атомным символом олова не должно быть Tn? На самом деле Sn – это сокращение от латинского слова олово, stannum .
- Когда олово сгибается при комнатной температуре, оно издает пронзительный скрипящий звук, известный как «крик олова», вызванный деформацией кристаллов олова.
- При температуре ниже 13 градусов по Цельсию олово превращается в форму, называемую «альфа-олово». Пудрово-серая олово – аллотроп, другая форма элемента. По словам химика Андреа Селла из Лондонского университетского колледжа, альфа-олово – это полупроводник, но его трудно получить.
Текущие исследования
Недавно технические исследователи заинтересовались графеном, одноатомным слоем углерода, который и тверже, чем алмазы, и поддается растяжению, как резина. Вполне возможно, что следующий прорыв в области высоких технологий, такой как графен, будет происходить из скромного олова.
Исследователи из Стэнфордского университета и Национальной ускорительной лаборатории SLAC Министерства энергетики изобрели слой олова толщиной в один атом, который они называют станеном.
Станен особенный, потому что это первый материал, способный проводить электричество со 100-процентной эффективностью при комнатной температуре. Добавление нескольких атомов фтора поддерживает эту эффективность до и за пределами температур, при которых работают компьютерные микросхемы – примерно до 212 F (100 C).
«Согласно закону Мура количество транзисторов в плотной интегральной схеме удваивается примерно каждые два года», – сказал Live Science исследователь Юн Сюй, ныне физик из Университета Цинхуа в Пекине.«Как следствие, удельная мощность интегральных схем увеличивается экспоненциально, что приводит к серьезным проблемам, связанным с потреблением энергии и рассеиванием тепла».
Сюй и его команда, в том числе физик Шоучэн Чжан из Стэнфорда, знали, что им нужен тяжелый элемент со свойствами так называемого «топологического изолятора». Топологический изолятор – это материал, который проводит электричество по своей поверхности, но не проводит электричество внутри.
«Многие топологические изоляторы были изготовлены из тяжелых элементов, включая ртуть, висмут, сурьму, теллур и селен», – сказал Сюй.«Ни один из них не был идеальным проводником электричества при комнатной температуре».
Олово ранее для этих целей не исследовалось. Но Сюй и его коллеги обнаружили, что, когда атомы олова расположены в одном сотовом слое, свойства элементов меняются. Исследователи сообщили в ноябре 2014 года, что он становится идеальным проводником электричества при комнатной температуре без потери ни одного паразитного электрона.
Электроника, сделанная из станена, должна, таким образом, выделять меньше тепла и потреблять меньше энергии, чем их кремниевые аналоги.
Сюй и его сотрудники создали однослойное олово с помощью процесса, называемого молекулярно-лучевой эпитаксией, при котором газообразные версии элемента конденсируются в тонком слое внутри вакуума. По словам Сюй, это сложный процесс, требующий точной температуры и скорости роста слоя, чтобы обеспечить правильную атомную структуру. Команда надеется разработать более дешевые и простые способы производства станена в будущем.
«Следующим шагом будет выращивание высококачественных образцов станена в больших масштабах с последующим использованием материала для фундаментальных исследований и практических применений», – сказал Сюй.
Следите за Live Science @livescience, Facebook и Google+.
Дополнительные ресурсы
Факты об олове (атомный номер 50 или Sn)
Олово – это серебристый или серый металл с атомным номером 50 и символом элемента Sn. Он известен тем, что его использовали для изготовления ранних консервов, а также при производстве бронзы и олова. Вот коллекция фактов об элементе олова.
Быстрые факты: олово
- Название элемента : Олово
- Обозначение элемента : Sn
- Атомный номер : 50
- Атомный вес : 118.71
- Внешний вид : Металлическое серебро (альфа, α) или серый металл (бета, β)
- Группа : Группа 14 (Углеродная группа)
- Период : Период 5
- Электронная конфигурация : [Kr] 5s2 4d10 5p2
- Discovery : Известен человечеству примерно с 3500 г. до н.э.
Основные факты об олове
Олово известно с давних времен. Первым сплавом олова, получившим широкое распространение, была бронза, сплав олова и меди.Люди знали, как делать бронзу еще в 3000 году до нашей эры.
Происхождение слова: Англосаксонское олово, латинское олово, оба названия элемента олова. Назван в честь этрусского бога Тинии; обозначается латинским символом олова.
Изотопы: Известно много изотопов олова. Обычное олово состоит из десяти стабильных изотопов. Было обнаружено 29 нестабильных изотопов и существует 30 метастабильных изомеров. Олово имеет наибольшее количество стабильных изотопов среди всех элементов из-за его атомного номера, который является «магическим числом» в ядерной физике.
Свойства: Олово имеет температуру плавления 231,9681 ° C, точку кипения 2270 ° C, удельный вес (серый) 5,75 или (белый) 7,31, валентность 2 или 4. Олово представляет собой ковкий серебристо-белый металл. который требует полировки. Он имеет высококристаллическую структуру и умеренно пластичен. Когда брусок олова сгибается, кристаллы ломаются, создавая характерный «оловянный крик». Существуют две или три аллотропные формы олова. Серый или жесть имеет кубическую структуру. При прогревании в 13.При 2 ° C серое олово меняется на белое или b олово, имеющее тетрагональную структуру. Этот переход от формы а к форме b называется оловянным вредителем. Форма g может существовать при температуре от 161 ° C до точки плавления. Когда олово охлаждается ниже 13,2 ° C, оно медленно переходит из белой формы в серую, хотя на переход влияют примеси, такие как цинк или алюминий, и его можно предотвратить, если присутствуют небольшие количества висмута или сурьмы. Олово устойчиво к воздействию морской, дистиллированной или мягкой водопроводной воды, но оно подвержено коррозии в сильных кислотах, щелочах и кислотных солях.Присутствие кислорода в растворе увеличивает скорость коррозии.
Применение: Олово используется для покрытия других металлов для предотвращения коррозии. Жестяная пластина поверх стали используется для изготовления коррозионно-стойких банок для пищевых продуктов. Некоторые из важных сплавов олова – это мягкий припой, легкоплавкий металл, металл типа, бронза, олово, баббитовый металл, металлический колокол, сплав для литья под давлением, белый металл и фосфорная бронза. Хлорид SnCl · H 2 O используется в качестве восстановителя и протравы при печати бязи.Соли олова можно распылять на стекло для получения электропроводящих покрытий. Расплавленное олово используется для плавления расплавленного стекла для производства оконного стекла. Кристаллические сплавы олова и ниобия обладают сверхпроводимостью при очень низких температурах.
Источники: Основным источником олова является касситерит (SnO 2 ). Олово получают восстановлением его руды углем в отражательной печи.
Токсичность : Металлическое олово, его соли и оксиды обладают низкой токсичностью.Луженые стальные банки по-прежнему широко используются для консервирования пищевых продуктов. Уровни воздействия 100 мг / м 3 считаются немедленно опасными. Законно допустимое воздействие при контакте или вдыхании обычно составляет около 2 мг / м 3 за 8-часовой рабочий день. Напротив, оловоорганические соединения очень токсичны наравне с цианидом. Оловоорганические соединения используются для стабилизации ПВХ, в органической химии, для изготовления литий-ионных батарей и в качестве биоцидных агентов.
Физические данные олова
Источники
- Эмсли, Джон (2001).”Банка”. Строительные блоки природы: руководство по элементам от А до Я . Оксфорд, Англия, Великобритания: Издательство Оксфордского университета. С. 445–450. ISBN 0-19-850340-7.
- Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- Вист, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4.
Информация об элементе олова Sn: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История олова
Элемент Олово был обнаружен неизвестными в году 3000 г. до н.э. в неизвестном месте . Банка получил свое название от английского слова (stannum на латыни)
Присутствие олова: изобилие в природе и вокруг нас
В таблице ниже показано содержание олова во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура олова
Твердотельная структура олова – центрированный тетрагональный.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| и | б | с |
|---|---|---|
| 583.18 | 583,18 | 318,19 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства олова
Атомы олова имеют 50 электронов и структура электронной оболочки [2, 8, 18, 18, 4] с символом атомного члена (квантовые числа) 3 P 0 .
Оболочечная структура олова – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | 10 | |
| 5 | O | 2 | 2 |
Основное состояние электронной конфигурации олова – нейтраль Атом олова
Электронная конфигурация нейтрального атома олова в основном состоянии [Кр] 4д10 5с2 5п2.Часть конфигурации олова, которая эквивалентна благородному газу предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. валентные электроны 4d10 5s2 5p2, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального олова
Полная электронная конфигурация основного состояния для атома олова, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 4д10 5с2 5п2
Атомная структура олова
Атомный радиус олова 145 пм, а его ковалентный радиус 141 пм.
Атомный спектр олова
Химические свойства олова: Энергии ионизации олова и сродство к электрону
Электронное сродство олова 107,3 кДж / моль.
Энергия ионизации олова
Энергия ионизации олова
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 708.6 |
| 2 | 1411,8 |
| 3 | 2943 |
| 4 | 3930,3 |
| 5 | 7456 |
Физические свойства олова
Физические свойства олова см. В таблице ниже
| Плотность | 7.31 г / см3 |
| Молярный объем | 16.2393980848 см3 |
Упругие свойства
Твердость олова – Испытания для измерения твердости элемента
Электрические свойства олова
Олово – проводник электричества. Ссылаться на стол ниже электрические свойства олова
Теплопроводность и теплопроводность олова
Магнитные свойства олова
Оптические свойства олова
Акустические свойства олова
Термические свойства олова – энтальпии и термодинамика
Термические свойства олова
см. В таблице ниже.Энтальпии олова
Изотопы олова – ядерные свойства олова
Изотопы родия.Олово естественного происхождения 10 стабильный изотоп – 112Sn, 114Sn, 115Sn, 116Sn, 117Sn, 118Sn, 119Sn, 120Sn, 122Sn, 124Sn.
| Изотоп | Масса изотопа | % изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 99Sn | ||||
| 100Sn | ||||
| 101Sn | ||||
| 102Sn | ||||
| 103Sn | ||||
| 104Sn | ||||
| 105Sn | ||||
| 106Sn | ||||
| 107Sn | ||||
| 108Sn | ||||
| 109Sn | ||||
| 110Sn | ||||
| 111Sn | ||||
| 112Sn | 0.97% | Стабильный | N / A | |
| 113Sn | ||||
| 114Sn | 0.66% | Стабильный | N / A | |
| 115Sn | 0.34% | Стабильный | N / A | |
| 116Sn | 14.54% | Стабильный | N / A | |
| 117Sn | 7.68% | Стабильный | N / A | |
| 118Sn | 24.22% | Стабильный | N / A | |
| 119Sn | 8.59% | Стабильный | N / A | |
| 120Sn | 32.58% | Стабильный | N / A | |
| 121Sn | ||||
| 122Sn | 4.63% | Стабильный | N / A | |
| 123Sn | ||||
| 124Sn | 5.79% | Стабильный | N / A | |
| 125Sn | ||||
| 126Sn | ||||
| 127Sn | ||||
| 128Sn | ||||
| 129Sn | ||||
| 130Sn | ||||
| 131Sn | ||||
| 132Sn | ||||
| 133Sn | ||||
| 134Sn | ||||
| 135Sn | ||||
| 136Sn | ||||
| 137Sn |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Олово Олово – мягкий, податливый серебристо-белый металл.Олово нелегко окисляется и устойчиво к коррозии, поскольку оно защищено оксидной пленкой. Олово устойчиво к коррозии от дистиллированной морской и мягкой водопроводной воды и может подвергаться воздействию сильных кислот, щелочей и кислотных солей. Области применения Олово используется для покрытия банок: луженые стальные контейнеры широко используются для консервирования пищевых продуктов. Сплавы олова используются по-разному: в качестве припоя для соединения труб или электрических цепей, олова, раструба, баббита и зубных амальгам.Сплав ниобия с оловом используется для изготовления сверхпроводящих магнитов, оксид олова используется для керамики и в датчиках газа (поскольку он поглощает газ, его электропроводность увеличивается, и это можно контролировать). Оловянная фольга когда-то была обычным упаковочным материалом для пищевых продуктов и лекарств, теперь ее заменила алюминиевая фольга. Олово в окружающей среде Оксид олова нерастворим, а руда сильно сопротивляется выветриванию, поэтому количество олова в почвах и природных водах невелико. Концентрация в почвах обычно находится в диапазоне 1-4 частей на миллион, но в некоторых почвах она меньше 0.1 ppm, в то время как торф может содержать до 300 ppm.
Источники таблицы Менделеева Новая страница: олово в воде Вернуться к периодической таблице элементов . | |
Химия олова (Z = 50) – Chemistry LibreTexts
Упоминается в еврейских писаниях, олово имеет древнее происхождение. Олово входит в группу 14 (семейство углерода) и имеет в основном металлические свойства.Олово имеет атомный номер 50 и атомную массу 118,710 атомных единиц массы.
Введение
Олово древнего происхождения упоминается в еврейских писаниях. Первые кузнецы по металлу быстро поняли, что смешивание меди с оловом позволяет получить более прочный металл (бронзу), и сегодня олово ценится в основном за его сплавы. Названный в честь этрусского бога Тинии, химический символ олова взят из латинского stannum . Металл серебристо-белого цвета и в чистом виде очень мягкий.Он выглядит как только что ограненный алюминий, но на ощупь напоминает свинец.
Олово полированное, слегка голубоватое. Он уже много лет используется для покрытия стальных банок для пищевых продуктов, поскольку он более устойчив к коррозии, чем железо. Он образует ряд полезных легкоплавких сплавов (припоев), которые используются для соединения электрических цепей. При сгибании бруска олова издается характерный визг, который называется «оловянный крик». Олово имеет химическое сходство с германием и свинцом. Добыча олова началась в Австралии в 1872 году, и сегодня олово широко используется в промышленности и торговле.
| цвет | белый с голубоватым оттенком |
| твердость | мягче золота, тверже свинца |
| атомный радиус | 140 вечера |
| плотность | 5,77 г / см 3 |
| точка плавления | 232 градуса Цельсия |
| точка кипения | 2623 градусов Цельсия |
| электропроводность | примерно на 1/7 от серебра |
| потенциал электрода | > 0.192 В |
| первая энергия ионизации | 709 кДж / моль |
| Ионный радиус | 93 вечера |
Реакции олова
| Водород | Олово не повреждено |
| Азот | Олово поглощает его вместо водорода при электрическом разряде |
| Аргон | Нет признаков сочетания олова с аргоном |
| Фтор | Не вступает в реакцию с оловом при низких температурах, но при 100 градусах Цельсия образует фторид олова.Возможно, одно из наиболее известных соединений олова, \ (SnF_2 \), фторид олова (II), имеет торговое название fluoristan и содержится в некоторых зубных пастах с фтором. |
| Хлор | Действует на олово при комнатной температуре |
| Бром | Действует на олово при комнатной температуре |
| сера | Соединяется непосредственно с оловом при нагревании |
| Селен | Активно реагирует с оловом |
| Теллур | Активно Реагирует с оловом |
| Азот | Формируется на компаунде прямым соединением с оловом |
| Мышьяк | Реагирует с оловом под действием тепла и света |
| Сурьма | Растворяется расплавленным оловом |
Реакция олова с кислородом
При нагревании в нем олово образует оксид олова
\ [Sn _ {(s)} + O_ {2 (g)} \ rightarrow SnO_ {2 (s)} \]
Реакция олова с водой (паром)
\ [Sn _ {(s)} + 2H_2O _ {(g)} \ rightarrow SnO_ {2 (s)} + 2H_ {2 (g)} \]
Изотопы
Существует 10 известных стабильных изотопов олова, большинства из элементов периодической таблицы.{50} Sn} \) – это «магическое число» в ядерной физике.
| Изотоп | % Естественное изобилие |
| 112 а.е.м. | 0,95% |
| 116 а.е.м. | 14,24% |
| 117 а.е.м. | 7,57% |
| 118 а.е.м. | 24,01% |
| 119 а.е.м. | 8.58% |
| 120 а.е.м. | 32,97% |
| 122 а.е.м. | 4,71% |
| 124 а.е.м. | 5,98% |
Аллотропы олова
Олово имеет 3 аллотропа: альфа, бета и гамма олово. Альфа-олово – самая нестабильная форма олова. Бета-олово является наиболее часто встречающимся аллотропом олова, а гамма-олово существует только при очень высоких температурах.
Степени окисления олова
Олово, хотя оно находится в группе 14 периодической таблицы, согласуется с тенденцией, обнаруженной в группе 13, где более низкая степень окисления предпочтительнее для более низких групп. Олово может существовать в двух степенях окисления, +2 и +4, но олово имеет тенденцию существовать в степени окисления +4.
Общие соединения олова
Олово образует два основных оксида, SnO и SnO 2 (амфотерный).
Электронная конфигурация олова
Олово имеет электронную конфигурацию в основном состоянии 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 10134 2 и может образовывать ковалентные соединения олова (II) с двумя его неспаренными p-электронами.На трехмерном рисунке ниже первая и самая внутренняя электронная оболочка представлена синими электронами, вторая электронная оболочка, состоящая из восьми электронов, представлена красными электронами, третья оболочка, содержащая восемнадцать электронов, представлена зелеными электронами, а следующая внешний электрон снова содержит восемнадцать электронов и представлен фиолетовым цветом.
Использование олова
Первые кузнецы по металлу быстро поняли, что при смешивании меди с оловом получается более прочный металл (бронза), и сегодня олово ценится в основном за его сплавы.2 ответ: 4
Напишите уравнение реакции олова с водой. В каких условиях протекает эта реакция?
ответ: Sn (s) + 2H 2 O (g) → SnO 2 (s) + 2H 2 (g) Реакция происходит, если вода нагревается до высокой температуры с образованием пара.
Какая из этих реакций имеет место.
а. олово с кислородом Ответ: ДА
г. олово с водородом Ответ: NO
г. олово с аргоном Ответ: NO
г.олово с хлором Ответ: ДА
Расположите следующие элементы в порядке увеличения атомного радиуса: Sn, K, Ag, C, Pb
Ответ: C Расположите в порядке убывания энергии ионизации: Sn, Si, Pb, I, In. Ответ: Si> I> Sn> In> Pb Цели обучения Оксиды и сульфиды олова и свинца легко восстанавливаются до металла при нагревании древесным углем – открытие, которое должно было произойти случайно, когда доисторические люди использовали камни, содержащие их руды, для разжигания огня.Однако, поскольку оловянные и медные руды часто встречаются в природе вместе, их сплав – бронза – вероятно, был обнаружен раньше любого из этих элементов, что привело к эпохе бронзы. Самый тяжелый элемент в группе 14, свинец, является настолько мягким и податливым металлом, что древние римляне использовали тонкую свинцовую фольгу в качестве письменных табличек, а также свинцовую посуду и свинцовые трубы для водопровода. (Напомним, что атомные символы олова и свинца произошли от их латинских названий: Sn для олова и Pb для свинца.) Хотя первые стекла были изготовлены из кремнезема (оксид кремния, SiO 2 ) около 1500 г. до н.э., элементарный кремний не получали до 1824 г. из-за его высокого сродства к кислороду.Йенс Якоб Берцелиус, наконец, смог получить аморфный кремний путем восстановления Na 2 SiF 6 расплавленным калием. Кристаллический элемент, имеющий блестящий серо-голубой блеск, был выделен только 30 лет спустя. Последним членом группы 14 элементов, которые были обнаружены, был германий, который был обнаружен в 1886 году в недавно обнаруженной серебряной руде немецким химиком Клеменсом Винклером, который назвал элемент в честь своей родины. Природное содержание элементов группы 14 сильно различается. Хотя кислород является самым распространенным элементом на Земле, следующим по распространенности является кремний, следующий член группы 14. Чистый кремний получают реакцией нечистого кремния с Cl 2 с образованием SiCl 4 с последующей фракционной перегонкой нечистый SiCl 4 и восстановление с помощью H 2 : \ [\ mathrm {SiCl_4 (l)} + \ mathrm {2H_2 (g)} \ xrightarrow {\ Delta} \ mathrm {Si (s)} + \ mathrm {4HCl (g)} \ label {3} \] Этим методом ежегодно производится несколько миллионов тонн кремния.Аморфный кремний, содержащий остаточное количество водорода, используется в фотоэлектрических устройствах, которые преобразуют свет в электричество, а солнечные элементы на основе кремния используются для питания карманных калькуляторов, лодок и дорожных знаков, где доступ к электричеству обычными методами затруднен или дорог. Сверхчистый кремний и германий составляют основу современной электронной промышленности (рис. \ (\ PageIndex {1} \)). В отличие от кремния, концентрации германия и олова в земной коре составляют всего 1-2 ppm.Концентрация свинца, который является конечным продуктом ядерного распада многих радионуклидов, составляет 13 частей на миллион, что делает свинец самым распространенным из элементов тяжелой группы 14. Концентрированные руды германия неизвестны; Подобно индию, германий обычно извлекают из дымовой пыли, полученной при переработке руд металлов, таких как цинк. Поскольку германий практически прозрачен для инфракрасного излучения, он используется в оптических устройствах. Олово и свинец – мягкие металлы, которые слишком слабы для структурных применений, но поскольку олово гибкое, устойчивое к коррозии и нетоксично, оно используется в качестве покрытия для упаковки пищевых продуктов.Например, «жестяная банка» на самом деле представляет собой стальную банку, внутренняя часть которой покрыта тонким слоем (1-2 мкм) металлического олова. Олово также используется в сверхпроводящих магнитах и сплавах с низкой температурой плавления, таких как припой и олово. Чистый свинец получают путем нагревания галенита (PbS) на воздухе и восстановления оксида (PbO) до металла углеродом с последующим электролитическим осаждением для повышения чистоты: \ [\ mathrm {PbS (s)} + \ frac {3} {2} \ mathrm {O_2 (g)} \ xrightarrow {\ Delta} \ mathrm {PbO (s)} + \ mathrm {SO_2 (g) } \ label {\ (\ PageIndex {4} \)} \] \ [\ mathrm {PbO (s)} + \ mathrm {C (s)} \ xrightarrow {\ Delta} \ mathrm {Pb (l)} + \ mathrm {CO (g)} \ label {\ (\ PageIndex) {5} \)} \] или \ [\ mathrm {PbO (s)} + \ mathrm {CO (g)} \ xrightarrow {\ Delta} \ mathrm {Pb (l)} + \ mathrm {CO_2 (g)} \ label {\ (\ PageIndex {6} \)} \] В наибольшей степени свинец используется в свинцовых аккумуляторных батареях.Все элементы группы 14 имеют ns 2 np 2 валентных электронных конфигурации. Все они образуют соединения, в которых они формально теряют либо два np- и два np-валентных электрона, либо только два np-валентных электрона, что дает степень окисления +4 или +2 соответственно. Поскольку ковалентные связи уменьшаются в силе с увеличением размера атома, а энергии ионизации для более тяжелых элементов группы выше, чем ожидалось, из-за более высокого Z eff , относительная стабильность степени окисления +2 плавно увеличивается от углерода к свинцу. Относительная стабильность степени окисления +2 увеличивается, а склонность к образованию катенированных соединений уменьшается, от углерода к свинцу в группе 14. Напомним, что многие углеродные соединения содержат кратные связи, образованные π-перекрытием однократно занятых 2p-орбиталей на соседних атомах. Однако соединения кремния, германия, олова и свинца с той же стехиометрией, что и соединения углерода, имеют разные структуры и свойства. Например, CO 2 – это газ, содержащий дискретные молекулы O = C = O, тогда как наиболее распространенной формой SiO 2 является тугоплавкое твердое вещество, известное как кварц, основной компонент песка.Вместо дискретных молекул SiO 2 кварц содержит трехмерную сеть атомов кремния, которая похожа на структуру алмаза, но с атомом кислорода, вставленным между каждой парой атомов кремния. Таким образом, каждый атом кремния связан с четырьмя другими атомами кремния мостиковыми атомами кислорода. Тенденция к катенату – формированию цепочек из одинаковых атомов – быстро уменьшается по мере того, как мы спускаемся вниз по группе 14, потому что энергии связи для обеих связей E – E и E – H уменьшаются с увеличением атомного номера (где E – любой элемент группы 14).Следовательно, введение группы CH 2 в линейный углеводород, такой как н-гексан, является экзергоническим (ΔG ° = -45 кДж / моль), тогда как введение группы SiH 2 в кремниевый аналог н-гексана (Si 6 H 14 ) фактически требует затрат энергии (ΔG ° ≈ +25 кДж / моль). В результате этой тенденции термическая стабильность катенированных соединений быстро снижается от углерода к свинцу. В таблице \ (\ PageIndex {1} \) мы снова видим, что существует большая разница между самым легким элементом (C) и другими по размеру, энергии ионизации и электроотрицательности.Как и в группе 13, второй и третий элементы (Si и Ge) похожи, и есть обратная тенденция для некоторых свойств, таких как энергия ионизации, между четвертым и пятым элементами (Sn и Pb). Что касается группы 13, эти эффекты можно объяснить наличием заполненных (n – 1) d и (n – 2) f подоболочек, электроны которых относительно плохо экранируют внешние электроны от более высокого заряда ядра. Элементы группы 14 следуют той же схеме, что и элементы группы 13 в своих периодических свойствах. Хотя кремний, германий, олово и свинец в их степенях окисления +4 часто образуют бинарные соединения с той же стехиометрией, что и углерод, структуры и свойства этих соединений обычно значительно отличаются от таковых углеродных аналогов. Кремний и германий являются полупроводниками со структурой, аналогичной алмазу. Олово имеет два общих аллотропа: белое (β) олово имеет металлическую решетку и металлические свойства, тогда как серое (α) олово имеет алмазоподобную структуру и является полупроводником.Металлическая β-форма стабильна при температуре выше 13,2 ° C, а неметаллическая α-форма стабильна при температуре ниже 13,2 ° C. Свинец – единственный элемент группы 14, который является металлическим как по структуре, так и по свойствам при любых условиях. Видео \ (\ PageIndex {1} \) : Замедленная реакция на оловянных вредителей. Основываясь на его положении в периодической таблице, мы ожидаем, что кремний является амфотерным. Фактически, он растворяется в сильной водной основе с образованием газообразного водорода и растворов силикатов, но единственной водной кислотой, с которой он реагирует, является фтористоводородная кислота, предположительно из-за образования стабильного иона SiF 6 2-.Германий по своим свойствам более металлический, чем кремний. Например, он растворяется в горячих окисляющих кислотах, таких как HNO 3 и H 2 SO 4 , но в отсутствие окислителя он не растворяется в водной основе. Хотя олово имеет даже более металлический характер, чем германий, свинец – единственный элемент в группе, который ведет себя исключительно как металл. Кислоты не легко атакуют его, потому что твердое вещество имеет тонкий защитный внешний слой соли Pb 2 + , такой как PbSO 4 . Все дихлориды группы 14 известны, и их стабильность резко возрастает с увеличением атомного номера центрального атома. Таким образом, CCl 2 представляет собой дихлоркарбен, высокореакционный, короткоживущий промежуточный продукт, который может быть получен в растворе, но не может быть выделен в чистой форме стандартными методами; SiCl 2 можно выделить при очень низких температурах, но он быстро разлагается выше -150 ° C, а GeCl 2 относительно стабилен при температурах ниже 20 ° C.Напротив, SnCl 2 представляет собой твердое полимерное вещество, которое неограниченно стабильно при комнатной температуре, тогда как PbCl 2 представляет собой нерастворимое кристаллическое твердое вещество со структурой, аналогичной структуре SnCl 2 . Стабильность дихлоридов группы 14 резко возрастает при переходе от углерода к свинцу. Хотя первые четыре элемента группы 14 образуют тетрагалогениды (MX 4 ) со всеми галогенами, только фтор способен окислять свинец до степени окисления +4, давая PbF 4 .Тетрагалогениды кремния и германия быстро реагируют с водой с образованием амфотерных оксидов (где M – Si или Ge): \ [MX_ {4 (s, l)} + 2H_2O _ {(l)} \ rightarrow MO_ {2 (s)} + 4HX _ {(aq)} \ label {1} \] Напротив, тетрагалогениды олова и свинца реагируют с водой с образованием гидратированных ионов металлов. Из-за стабильности степени окисления +2 свинец реагирует с кислородом или серой с образованием PbO или PbS, соответственно, тогда как нагревание других элементов группы 14 с избытком O 2 или S 8 дает соответствующие диоксиды или дисульфиды, соответственно.Диоксиды элементов группы 14 становятся все более основными по мере того, как мы спускаемся по группе. Диоксиды элементов группы 14 становятся все более основными в группе. Поскольку связь Si – O даже прочнее, чем связь C – O (~ 452 кДж / моль по сравнению с ~ 358 кДж / моль), кремний имеет сильное сродство к кислороду. Относительная прочность связей C – O и Si – O противоречит общему мнению о том, что прочность связи уменьшается по мере того, как связанные атомы становятся больше. Это потому, что мы до сих пор предполагали, что формальная одинарная связь между двумя атомами всегда может быть описана в терминах одной пары общих электронов.В случае связей Si – O, однако, наличие относительно низкоэнергетических пустых d-орбиталей на Si и несвязывающих электронных пар в гибридных орбиталях p или sp n O приводит к частичной π-связи (Рисунок \ ( \ PageIndex {3} \)). Из-за своего частичного характера двойной связи π связь Si – O значительно прочнее и короче, чем можно было бы ожидать в противном случае. Подобное взаимодействие с кислородом также является важной особенностью химии элементов, следующих за кремнием в третьем периоде (P, S и Cl).Поскольку связь Si – O необычайно прочна, соединения кремния с кислородом доминируют в химии кремния. Поскольку связи кремний – кислород необычайно прочны, соединения кремний – кислород доминируют в химии кремния. Соединения с анионами, которые содержат только кремний и кислород, называются силикатами, основным строительным блоком которых является SiO 4 4- единица: Количество атомов кислорода, общих между атомами кремния, и способ, которым эти звенья связаны, значительно различаются в разных силикатах. Преобразование одного из атомов кислорода из концевых в мостиковые образует цепочки силикатов, в то время как преобразование двух атомов кислорода из концевых в мостиковые образует двойные цепи.Напротив, преобразование трех или четырех атомов кислорода в мостик создает множество сложных слоистых и трехмерных структур соответственно. Кремний и германий реагируют с азотом при высокой температуре с образованием нитридов (M 3 N 4 ): \ [3Si _ {(l)} + 2N_ {2 (g)} \ rightarrow Si_3N_ {4 (s)} \ label {2} \] Нитрид кремния обладает свойствами, которые делают его пригодным для высокотемпературных технических применений: он прочный, очень твердый, химически инертный и сохраняет эти свойства до температур около 1000 ° C. Из-за диагонального соотношения между бором и кремнием силициды металлов и бориды металлов имеют много общего. Хотя силициды металлов имеют такую же сложную структуру, как бориды и карбиды металлов, немногие силициды структурно подобны соответствующим боридам из-за значительно большего размера Si (атомный радиус 111 мкм по сравнению с 87 мкм для B). Силициды активных металлов, такие как Mg 2 Si, представляют собой ионные соединения, содержащие ион Si 4-.{2 +} _ {(водный)} + SiH_ {4 (g)} \ label {3A} \] В отличие от углерода катенированные гидриды кремния становятся термодинамически менее стабильными по мере удлинения цепи. Таким образом, силаны с прямой и разветвленной цепью (аналогичные алканам) известны только до n = 10; аналоги германия (германы) известны до n = 9. Напротив, единственный известный гидрид олова – это SnH 4 , и он медленно разлагается до элементарного Sn и H 2 при комнатной температуре. Простейший гидрид свинца (PbH 4 ) настолько нестабилен, что химики даже не уверены в его существовании.Поскольку связи E = E и E≡E становятся слабее с увеличением атомного номера (где E – любой элемент группы 14), простые кремниевые, германиевые и оловянные аналоги алкенов, алкинов и ароматических углеводородов либо нестабильны (Si = Si и Ge = Ge) или неизвестно. Таким образом, формы жизни на основе кремния можно найти только в научной фантастике. Стабильность гидридов 14-й группы снижается вниз по группе, и связи E = E и E≡E ослабевают. Единственными важными органическими производными свинца являются такие соединения, как тетраэтилсвинец [(CH 3 CH 2 ) 4 Pb].Поскольку связь Pb – C слабая, эти соединения разлагаются при относительно низких температурах с образованием алкильных радикалов (R ·), которые можно использовать для регулирования скорости реакций горения. В течение 60 лет сотни тысяч тонн свинца ежегодно сжигались в автомобильных двигателях, создавая туман из частиц оксида свинца вдоль шоссе, что представляло потенциально серьезную проблему для здоровья населения. Использование каталитических нейтрализаторов уменьшило количество оксида углерода, оксидов азота и углеводородов, выбрасываемых в атмосферу через автомобильные выхлопные газы, но ничего не сделало для уменьшения выбросов свинца.Однако, поскольку свинец отравляет каталитические нейтрализаторы, его использование в качестве присадки к бензину запрещено в большинстве стран мира. Соединения, содержащие связи Si – C и Si – O, являются стабильными и важными. Полимеры с высокой молекулярной массой, называемые силиконами, содержат основную цепь (Si – O–) n с органическими группами, присоединенными к Si (рисунок \ (\ PageIndex {5} \)). Свойства силиконов определяются длиной цепи, типом органической группы и степенью сшивки между цепями.Без сшивки силиконы представляют собой воски или масла, но сшивание может привести к образованию гибких материалов, используемых в герметиках, прокладках, автомобильных полиролях, смазках и даже эластичных материалах, таких как пластичное вещество, известное как Silly Putty. Пример \ (\ PageIndex {2} \) Для каждой реакции объясните, почему образуются данные продукты. Дано: сбалансированные химические уравнения Спрашивали: почему данные продукты образуют Стратегия: Классифицируйте тип реакции.Используя периодические тенденции изменения атомных свойств, термодинамики и кинетики, объясните, почему образуются наблюдаемые продукты реакции. Решение Упражнение \ (\ PageIndex {2} \) Определите продукты реакций и напишите сбалансированное химическое уравнение для каждой реакции. Ответ Элементы группы 14 демонстрируют наибольшее разнообразие химического поведения из всех групп; прочность ковалентных связей уменьшается с увеличением размера атома, а энергии ионизации больше, чем ожидалось, увеличиваясь от C до Pb.Поскольку сила ковалентной связи уменьшается с увеличением размера атома и большей, чем ожидалось, энергии ионизации из-за увеличения Z eff , стабильность степени окисления +2 увеличивается от углерода к свинцу. Тенденция к образованию множественных связей и катенат уменьшается с увеличением атомного номера. В соответствии с периодическими тенденциями металлическое поведение увеличивается вниз по группе. Кремний обладает огромным сродством к кислороду из-за частичной π-связи Si – O. Диоксиды элементов группы 14 становятся все более основными в группе, и их металлический характер увеличивается.Силикаты содержат анионы, состоящие только из кремния и кислорода. Алюмосиликаты образуются путем замены некоторых атомов Si в силикатах атомами Al; алюмосиликаты с трехмерной каркасной структурой называются цеолитами. Нитриды, образующиеся при взаимодействии кремния или германия с азотом, прочны, тверды и химически инертны. Гидриды становятся термодинамически менее стабильными в группе. Список литературы
Авторы и авторство
22.10: Другие элементы группы 14: Si, Ge, Sn и Pb
Приготовление и общие свойства элементов группы 14
Имущество Углерод Кремний Германий Олово Свинец * Показанная конфигурация не включает заполненные подоболочки d и f. † Приведены значения для шестикоординатных +4 ионов в наиболее распространенной степени окисления, за исключением C 4 + и Si 4 + , для которых значения для четырехкоординатной ion. ‡ X представляет собой Cl, Br или I. Реакция с F 2 дает тетрафториды (EF 4 ) для всех элементов группы 14, где E представляет собой любой элемент группы 14. атомный символ С Si Ge Sn Пб атомный номер 6 14 32 50 82 атомная масса (а.е.м.) 12.01 28.09 72,64 118,71 207,2 валентная электронная конфигурация * 2с 2 2п 2 3с 2 3 пол 2 4s 2 4p 2 5s 2 5p 2 6s 2 6p 2 точка плавления / температура кипения (° C) 4489 (на 10.3 МПа) / 3825 1414/3265 939/2833 232/2602 327/1749 плотность (г / см 3 ) при 25 ° C 2,2 (графит), 3,51 (алмаз) 2,33 5,32 7,27 (белый) 11.30 атомный радиус (пм) 77 (ромб) 111 125 145 154 первая энергия ионизации (кДж / моль) 1087 787 762 709 716 наиболее частая степень окисления +4 +4 +4 +4 +4 ионный радиус (пм) † ≈29 ≈40 53 69 77.5 сродство к электрону (кДж / моль) −122 −134 −119 −107 −35 электроотрицательность 2,6 1,9 2,0 2,0 1,8 стандартный восстановительный потенциал (E °, V) (для EO 2 → E в кислотном растворе) 0.21 -0,86 -0,18 -0,12 0,79 продукт реакции с O 2 CO 2 , CO SiO 2 GeO 2 SnO 2 PbO тип оксида кислая (CO 2 ) кислая нейтральная (CO) амфотерный амфотерный амфотерный продукт реакции с N 2 нет Si 3 N 4 нет Sn 3 N 4 нет продукт реакции с X 2 ‡ CX 4 SiX 4 GeX 4 SnX 4 PbX 2 продукт реакции с H 2 CH 4 нет нет нет нет Реакции и соединения более тяжелой группы 14 элементов
Сводка

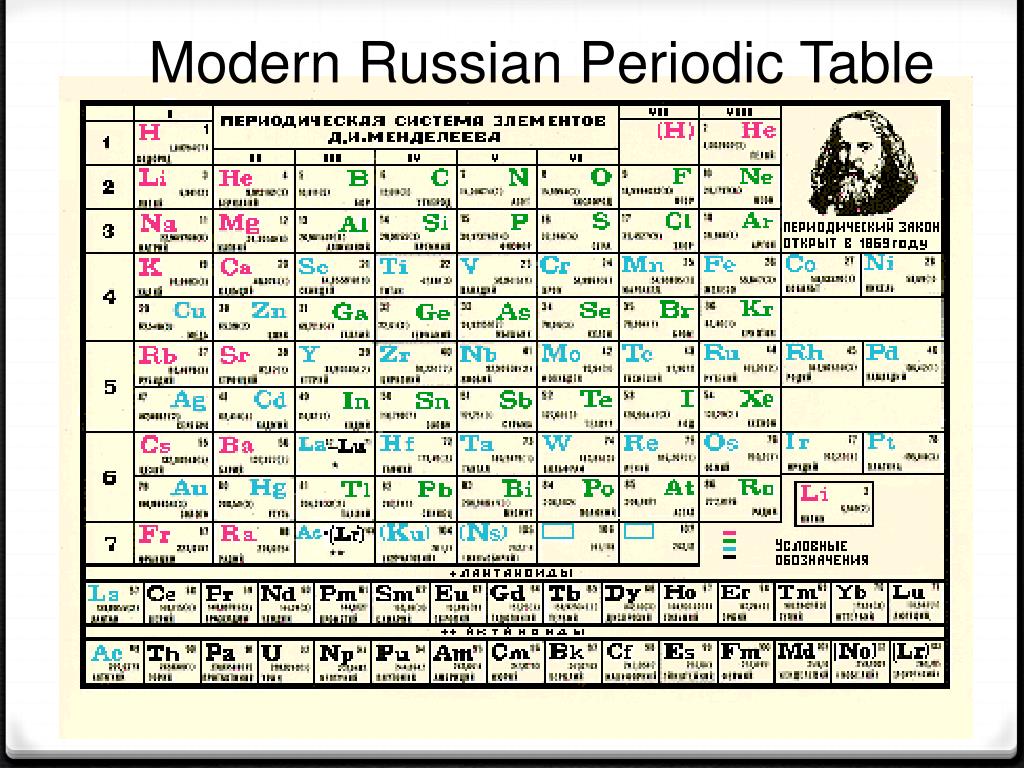 Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы, по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры. Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы.
Упоминание об олове есть в ранних книгах Ветхого Завета. Сплавы олова с медью, так называемые оловянные бронзы, по-видимому, стали использоваться более чем за 4000 лет до нашей эры. А с самим металлическим оловом человек познакомился значительно позже, примерно около 800 года до нашей эры. Из чистого олова в древности изготовляли посуду и украшения, очень широко применяли изделия из бронзы. Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO 2 восстанавливают углем или алюминием (цинком) в электропечах:
Таким образом удается повысить содержание олова в руде до 40-70%. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Затем полученный таким образом оксид SnO 2 восстанавливают углем или алюминием (цинком) в электропечах:
 В теле человека содержится примерно (1-2)· 10–4 % олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3 , ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.
В теле человека содержится примерно (1-2)· 10–4 % олова, а его ежедневное поступление с пищей составляет 0,2-3,5 мг. Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3 , ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.