Строение атома кислорода и схема электронной оболочки элемента
4.5
Средняя оценка: 4.5
Всего получено оценок: 330.
4.5
Средняя оценка: 4.5
Всего получено оценок: 330.
Кислород (O) – жизненно важный газ, необходимый для дыхания, поддержания горения, окисления. Относится к группе халькогенов. Самый распространённый на Земле элемент. Строение атома кислорода позволяет ему соединяться с металлами и неметаллами, образуя оксиды.
Строение
По положению в периодической таблице Менделеева можно определить строение атома элемента кислорода. Это восьмой элемент, расположенный в VI группе, втором периоде. Относительная атомная масса – 16. Существует три изотопа элемента:
- 16O;
- 17O;
- 18O.
Наиболее распространён 16O.
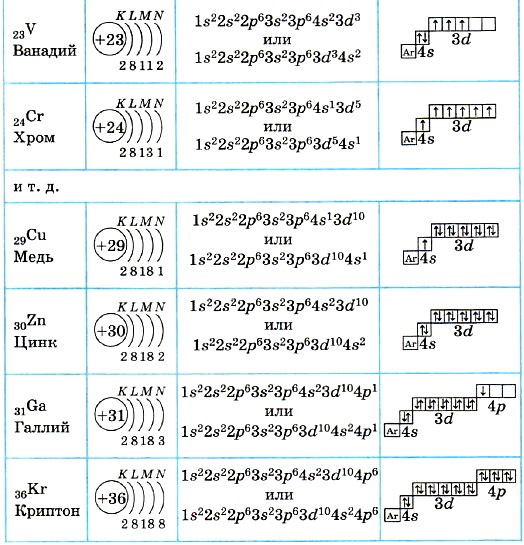
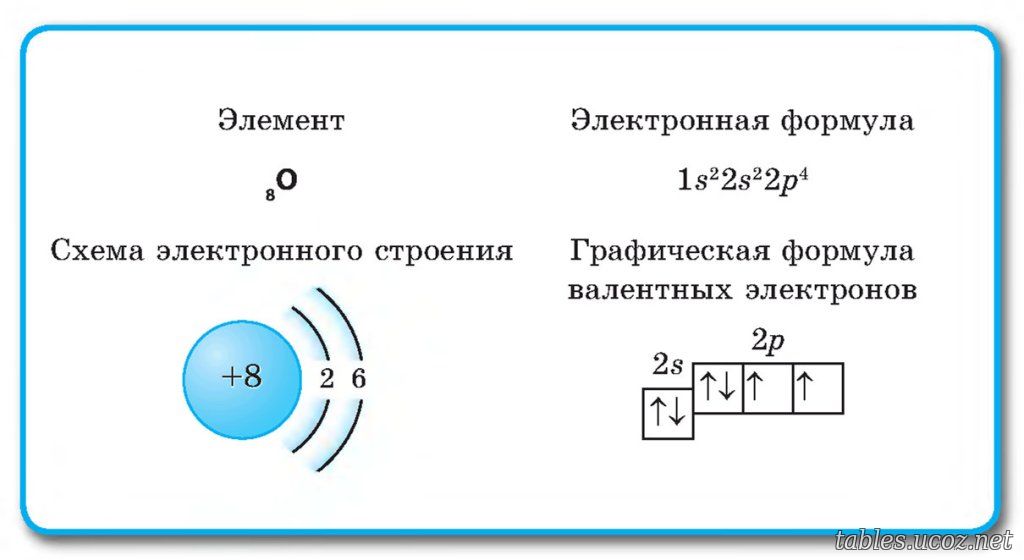
Рис. 1. Положение кислорода в периодической таблице.Электронная конфигурация атома кислорода – 1s22s22p4. Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Ядро атома кислорода имеет заряд +8. Кислород относится к элементам р-семейства. На внешнем энергетическом уровне находится шесть валентных электронов. Два спаренных электрона находится на 2s-орбитали. На 2р-уровне находится два спаренных и два неспаренных электрона, поэтому во всех соединениях кислород проявляет вторую валентность.
Молекула кислорода имеет два атома – О2. При присоединении ещё одного атома образуется озон – О3.
Физические свойства
Кислород – бесцветный и безвкусный газ, плохо растворимый в воде и спирте. Хорошо растворим в жидком серебре. В сжиженном виде приобретает светло-голубой цвет, в твёрдом – синий. Занимает 21 % атмосферного воздуха.
Рис. 3. Твёрдый кислород.Кислород поддерживает горение, поэтому его легко обнаружить с помощью тлеющей лучины (вспыхивает).
Химические свойства
Благодаря электронному строению обладает высокой степенью окисления. Однако большую активность проявляет при нагревании из-за прочных двойных связей между атомами.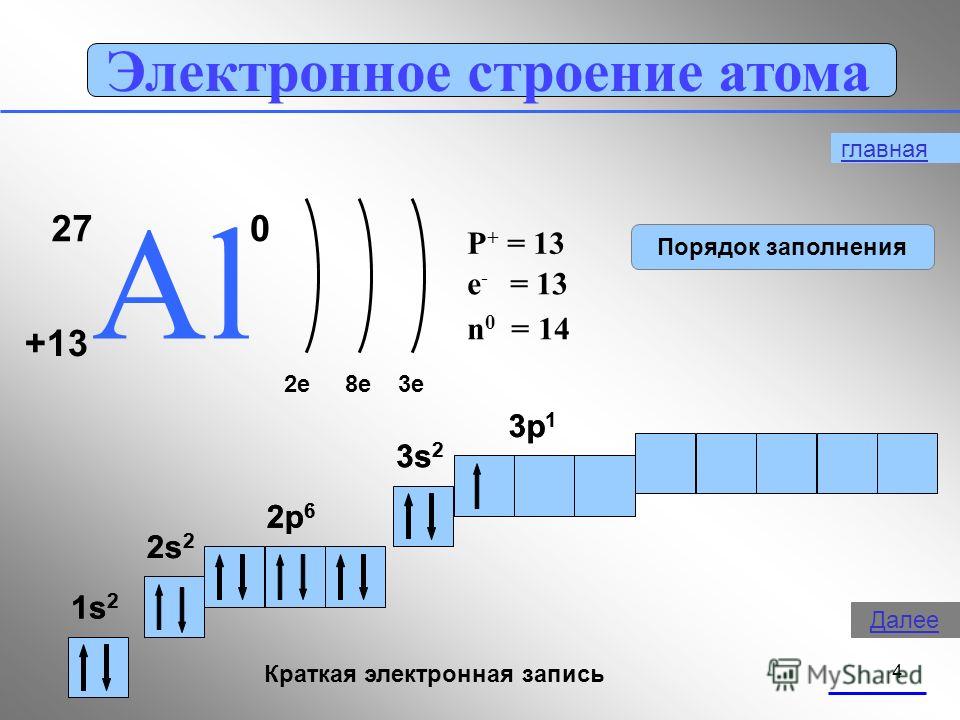 При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
При комнатной температуре быстро реагирует с наиболее активными элементами – щелочными и щелочноземельными металлами, некоторыми неметаллами.
Соединяясь с элементами, образует оксиды. Окисляет органические вещества. Примеры реакций с простыми веществами:
- K + O2 → KO2;
- 3Fe + 2O2 → Fe3
- S + O2 → SO2.
С фосфором, серой, углеродом (графитом), водородом кислород реагирует при нагревании:
- 4Р + 5О2 → 2Р2О5;
- S + O2 → SO2;
- С + О2 → СО2;
- 2Н2 + О2 → 2Н2О.
Быстро пропуская фтор через щёлочь, получают реакцию кислорода с фтором:
2F2 + 2NaOH → 2NaF + H2O + OF2.
Кислород с фтором непосредственно взаимодействует при электрическом разряде. В этом случае кислород играет роль восстановителя:
O2 + F
Кислород реагирует со сложными веществами, образуя оксиды:
- 2CuS + 3O2 → 2CuO + 2SO2;
- 2H2S + 3O2 → 2SO2 + 2H2O;
- 2C6H6 + 15O2 → 12CO2 + 6H2O;
- CH4 + 2O2 → CO2 + 2H2O.
Кислород не реагирует с золотом и инертными газами. Взаимодействие с галогенами происходит в условиях ультрафиолета или электрического тока.
Что мы узнали?
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Александр Котков
5/5
Мила Кондратьева
5/5
Семён Гольдфарб
5/5
Александр Котков
5/5
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 330.
А какая ваша оценка?
Особенности строения электронных оболочек атомов элементов
На этой странице вы узнаете:- Чем общежития электронов отличаются от студенческих?
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Строение электронной оболочки атомаПредставим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.
- Этажи общежития — энергетические уровни.
 Определенный этаж содержит определенное количество блоков.
Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
| Чем общежития электронов отличаются от студенческих? 1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4. 2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей). 3. Орбиталь (комната) специального обозначения не имеет. Может содержать максимум 2 электрона (студента). |
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева.
- Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум.
 Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
Исключениями являются медь, серебро, хром, золото и некоторые другие элементы. - Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
На приведенном рисунке изображена модель атома химического элемента.
Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атомаДля изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.
Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
| При наличии свободных орбиталей на подуровне электроны занимают именно их, а не «подсаживаются» к другим электронам: Ты приглядись, решив присесть, |
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
| Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона. |
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
| В атомах химических элементов есть свои уровни комфортности? Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов. Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … Согласитесь, если студентам заселиться в блок вдвоем, им будет проще найти друг с другом общий язык, чем если бы их было в блоке четырнадцать. |
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.
Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.
| Химические элементы делятся на семейства? Это что, биология какая-то? К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли? — s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня; |
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома.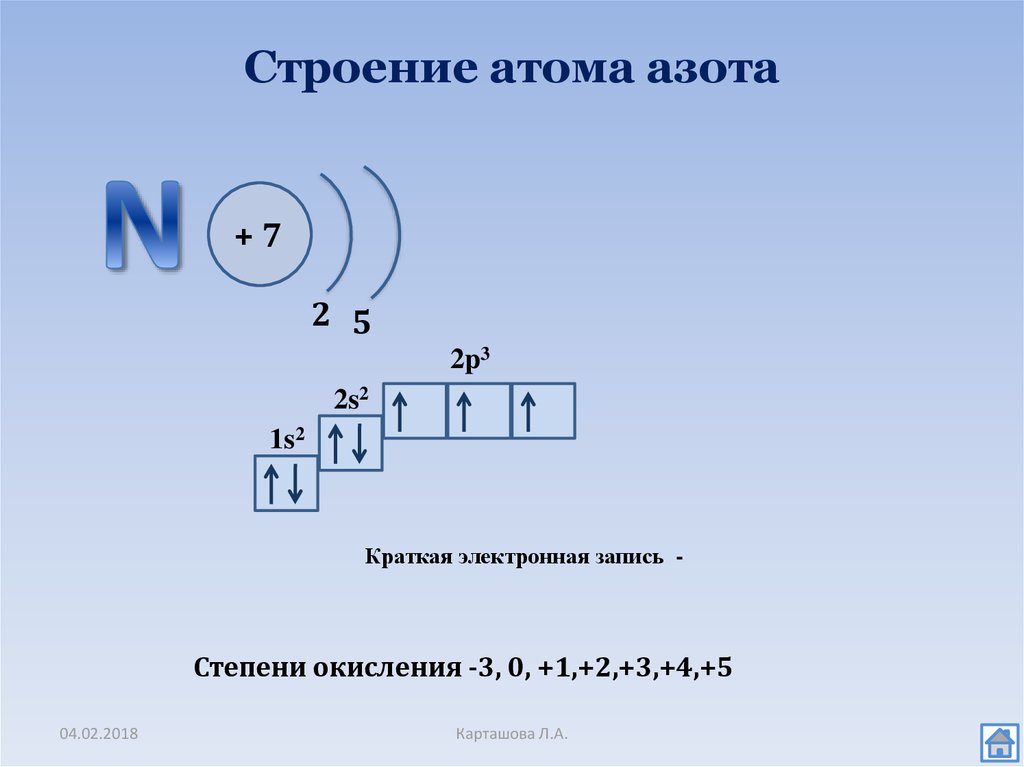 Теперь для нас не составит труда описать строение атома любого химического элемента.
Теперь для нас не составит труда описать строение атома любого химического элемента.
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Задание 1.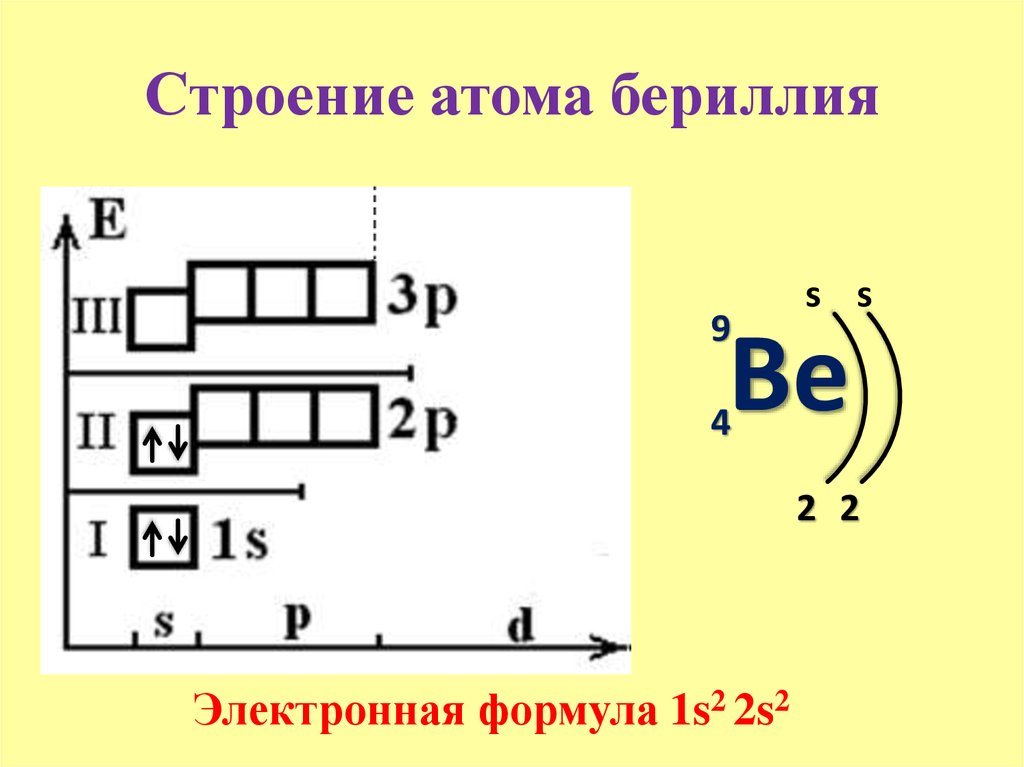
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
- 1
- 3
- 5
- 7
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.
Q5 Нарисуйте аккуратную диаграмму с надписями, изображающую атом. Назовите три субатомные частицы в атоме …
Перейти к
- Упражнение
- Вопросы объективного типа
- Иметь значение
- Элементы, соединения и смеси
- Атомная структура
- Язык химии
- Химические реакции
- Водород
- Вода
- Углерод и его соединения
Главная > Союзные решения Класс 8 Химия > Глава 4 – Атомная структура > Упражнение >
Вопрос 5 Упражнение 9{\ \ 1}p присутствует в ядре
Связанные вопросы
Q1) Сформулируйте основные постулаты теории атома Дальтона.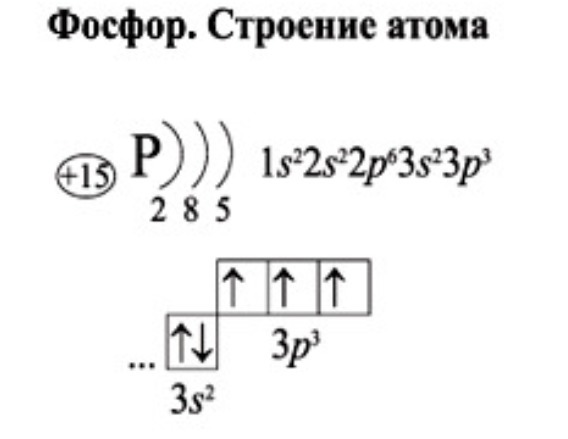 Объясните, как современная атомная теория противоречит…
Объясните, как современная атомная теория противоречит…
Q2) По поводу открытия строения атома поясните вкратце – Уильям Крукс…
Q3) Кратко объясните – эксперимент Гольдштейна, который привел к открытию протона и – Лод Резерф…
Q4) «Электроны вращаются вокруг ядра по фиксированным орбитам или оболочкам, называемым энергетическими уровнями». Подскажите как…
Q6) Дайте определение термину – «атомный номер» атома. Если атом «А» имеет атомный номер – одиннадцать, ст…
Q7) Дайте определение термину – «массовое число» атома. Если атом «В» имеет массовое число 35 и атомный номер 1…
Фейсбук WhatsApp
Копировать ссылку
Было ли это полезно?
Упражнения
Упражнения
Вопросы объективного типа
Главы
Материя
Физические и химические изменения
Элементы, соединения и смеси
Атомная структура
Язык химии
Химические реакции
Водород
Вода
Углерод и его соединения
Курсы
Быстрые ссылки
Условия и политика
Условия и политика
2022 © Quality Tutorials Pvt Ltd Все права защищены
Как рисовать схемы электронной конфигурации | Функция
Повысьте уверенность учащихся 14–16 лет в рисовании диаграмм электронной конфигурации с помощью этих простых шагов
Диаграмма электронной конфигурации — это модель, изображающая положение электронов, когда они вращаются вокруг ядра атома. Электроны представлены точками или крестами и расположены на энергетических уровнях или «оболочках» вокруг центрального ядра. Иногда ее называют моделью Бора или моделью «солнечной системы».
Электроны представлены точками или крестами и расположены на энергетических уровнях или «оболочках» вокруг центрального ядра. Иногда ее называют моделью Бора или моделью «солнечной системы».
Загрузить
Эта инфографика предназначена для использования в качестве плаката в классе, хотя ее также можно отображать на проекторе или распечатывать в качестве раздаточного материала.
Используйте прилагаемый информационный бюллетень и рабочий лист, чтобы ваши учащиеся рисовали диаграммы конфигурации электронов.
- Плакат с атомным номером вверху в формате pdf (одна страница формата A4 или одна страница формата A3)
- Плакат с атомным номером внизу в формате pdf (одна страница формата A4 или одна страница формата A3)
- Информационный бюллетень в формате MS Word или pdf
- Рабочий лист студента, путаница в конфигурации, в формате MS Word или pdf
- Ответы на ошибки в конфигурации в формате MS Word или pdf
Скачать все
В модели Бора есть несколько правил, которые помогут вам рисовать точные диаграммы.
- Электроны должны занимать самую нижнюю доступную оболочку , ближайшую к ядру .
- Максимальное количество электронов, которое может заполнить каждую оболочку , равно:
- два в первой оболочке,
- восемь во второй оболочке,
- восемь в третьем корпусе.
- Кальций , 20 -й элемент, имеет еще два электрона, которые находятся в четвертой оболочке .
В сокращенном обозначении для электронной конфигурации количество электронов в каждой оболочке может быть написано, а не нарисовано. Каждая оболочка отделяется точкой или запятой. Для азота это будет 2,5 или 2,5, а для кальция это будет 2,8,8,2 или 2,8,8,2.
Знаете ли вы…? Расположение электронов элемента говорит вам, где он находится в периодической таблице .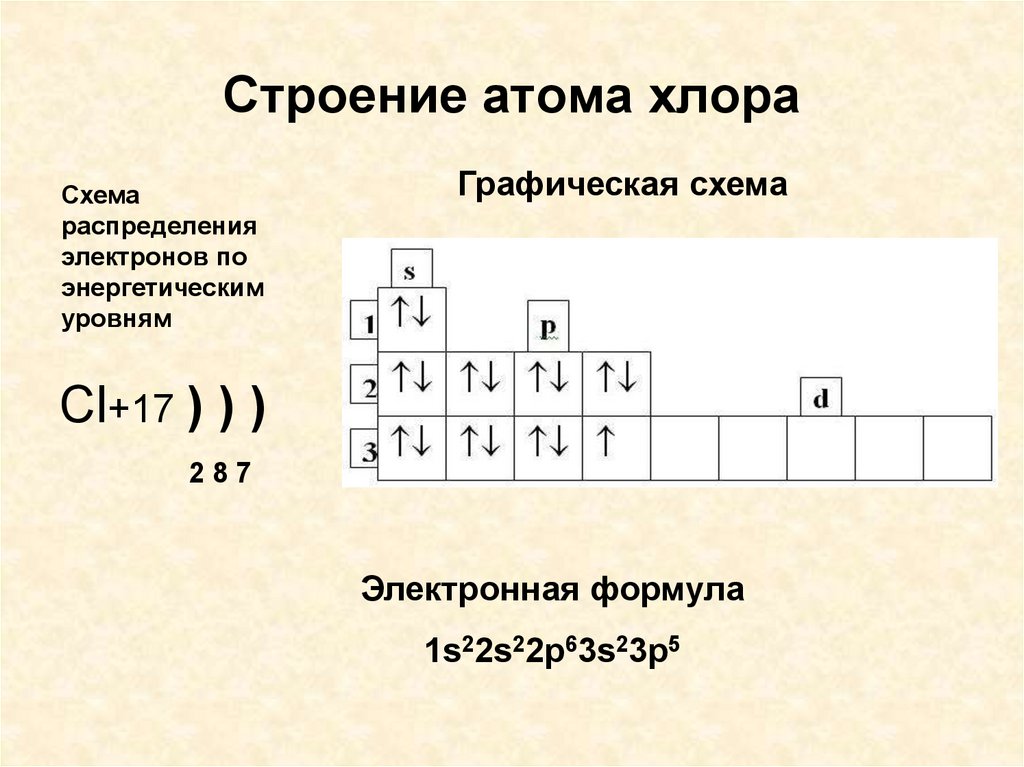

 Определенный этаж содержит определенное количество блоков.
Определенный этаж содержит определенное количество блоков. 
 Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.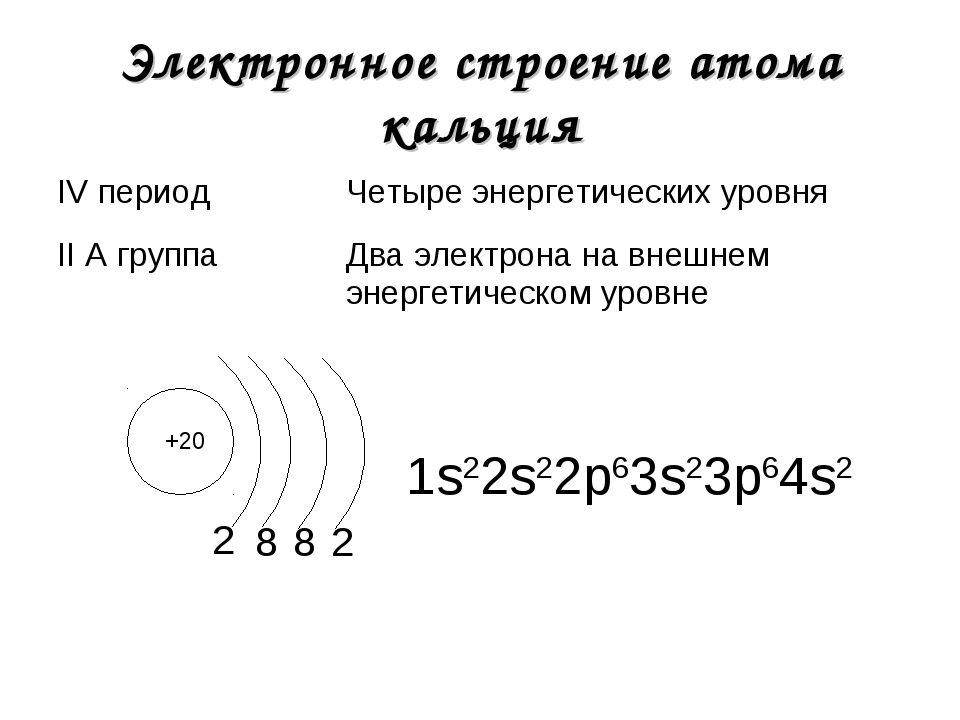

 Таких семейств выделяют четыре:
Таких семейств выделяют четыре: