Страница 404
Объявления
Свежие публикации
Случайный кадр
Министерство юстиции РФ
информирует
Главная / Страница 404
Извините! Страница не найдена!
Возможные причины:
- она была удалена,
- сменен адресс ссылки,
- вы не верно ввели ссылку.
Сегодня 35 просмотров этой страницы
Поиск по сайту
|
БЕСПЛАТНАЯ ЮРИДИЧЕСКАЯ ПОМОЩЬ Юрисконсульт Яркина Олеся Александровна
Подробнее > |
|
СТРАНИЧКА СОЦИАЛЬНОГО ПЕДАГОГА Телефон +7 (84593) 7-43-84
Подробнее > |
|
Телефон “Горячей линии” Общественной палаты Саратовской области +7 (8452) 277-567
Подробнее > |
Саратовская областная
организация Профсоюза
работников здравоохранения РФ
Пн
Вт
Ср
Чт
Пт
Сб
Вс
12345678910111213141516171819202122232425262728293031
Опрос
Довольны ли вы качеством услуг предоставляемых в нашем учебном заведении?
- Полностью доволен
- Скорее доволен
- Среднее
- Неудовлетворительно
Посмотреть результаты
ГДЗ (ответы) Химия 10 класс Попель П.
 П., Крикля Л.С. 2018 §12 Получение и применение углеводородов » Допомога учням
П., Крикля Л.С. 2018 §12 Получение и применение углеводородов » Допомога учнямДругие задания смотри здесь
Упражнение 81 Составьте уравнения реакций, которые протекают:
а) при последовательном гидрировании этина;
СН≡СН + Н2 -> СН2=СН2 этен
СН2=СН2 + Н2 -> СН3–СН3 этан
б) при последовательном дегидрировании этана.
СН3–СН3 -> СН2=СН2 + Н2 этен и водород
СН3–СН3 -> СН≡СН + 2Н2 этин и водород
Упражнение 82 Допишите химические уравнения:
а) C3H6 + Н2 -> C3H8 (t, k)
б) C3H8 -> C3H6 + H2 (t, k)
в) C4H10 -> CH4 + C3H6 (t, k)
г) 5CO + 11H2 -> C5H12 + 5H2O (t, р, k)
Упражнение 83 Составьте уравнения реакций, с помощью которых можно осуществить такие превращения, и укажите условия их протекания:
а) СаСО3 → CaO → СаС2 → С2H2 → C6H6;
CaCO3 -> CaO + CO2↑ (t0)
СаО + 3С -> СаС2 + СО↑ (t=19000C)
CaC2 + 2Н2О → С2Н2↑ + Са(ОН)2
3C2H2 -> C6H6 (t0, С вугілля)
б) бутан → этен → этин.
C4H10 -> C2H4 + C2H6
C2H4 -> C2H2 + H2↑
Упражнение 84 При дегидрировании этена разложилось 80% углеводорода. Вычислите:
а) объемные доли газов в образовавшейся смеси;
Дано: 80% С2Н4 разложилось
Найти: φ(С2Н2)-? φ(Н2)-?
Решение
Составляем уравнение реакции:
С2H4 -> C2H2 + H2
По условию задачи разложилось 80% этену, поэтому 20% этену не разложилось. Примем количество вещества за 1 моль, тогда 0,8 моль этена разложилось, то есть n(C2H4)=0,8 моль, а 0,2 моль – не разложилося, то есть nостаток(C2H4)=0,2 моль
По уравнению реакции n(C2H4)=n(C2H2)=n(H2), поэтому
n(C2H2)=n(H2)=n(C2H4)=0,8 моль
V=V(C2H2)=V(H2)=n•VM=0,8 моль•22,4 моль=17,92 л
n(смеси)=n(C2H2)+n(H2)+nостаток(C2H4)=0,8 моль+0,8 моль+0,2 моль=
=1,8 моль
V(смеси)=n(смеси)•VM=1,8 моль•22,4 моль=40,32 л
φ(С2Н2)=φ(Н2)=V:V(смеси)=17,92:40,32=0,444, или 44,4%
Ответ: 44,4 % этина и 44,4% водорода
б) среднюю молярную массу этой смеси.
Дано: n(C2H2)=n(H2)=0,8 моль, n(C2H4)=0,2 моль
Найти: среднюю M(смеси)-?
Решение:
М(С2Н4)=28 г/моль
М(С2Н2)=26 г/моль
М(Н2)=2 г/моль
Вычисляем массы всех составляющих смеси:
m(C2H2)=n(C2H2)•M(C2H2)=0,8 моль•26 г/моль=20,8 г
m(H2)=n(H2)•M(H2)=0,8 моль•2 г/моль=1,6 г
m(C2H4)=n(C2H4)•M(C2H4)=0,2 моль•28 г/моль=5,6 г
Вычисляем суммарное количество вещества всех составляющих смеси:
n(смеси)=n(C2H2)+n(H2)+n(C2H4)=0,8 моль+0,8 моль+0,2 моль=1,8 моль
Средняя молярная масса смеси – это масса всех ее составляющих, в суммарном количестве вещества смеси 1 моль, то есть M(смеси)=(m(С2H2)+m(H2)+m(C2H4)):n(смеси):
M(смеси)=(20,8 г+1,6 г+5,6 г):1,8 моль=15,6 г/моль
Ответ: 15,6 г/моль
Упражнение 85 Этин количеством вещества 0,2 моль пропустили над раскаленным углем, а полученную газообразную смесь — в избыток бромной воды. Прореагировало 16 г брома. Определите соотношение объемов углеводородов в полученной смеси.
Прореагировало 16 г брома. Определите соотношение объемов углеводородов в полученной смеси.
Дано: n(C2H2)=0,2 моль, m(Br2)=16 г
Найти: V(C2H2):V(С6Н6)-?
Решение
n(Br2)=m(Br2)/M(Br2)=16 г:160 г/моль=0,1 моль
Составляем уравнение реакции:
3С2H2 -> C6H6 (1)
C2H2 + 2Br2 -> C2H2Br4 (2)
По уравнению реакции (2) n(C2H2):n(Br2)=1:2, поэтому
n(C2H2)=n(Br2):2=0,1 моль : 2 = 0,05 моль
V(C2H2)=n(C2H2)•VM=0,05 моль•22,4 л/моль=1,12 л
С 0,2 моль этина 0,05 моль прореагировало с бромной водой, то есть, 0,2 моль – 0,05 моль=0,15 моль этина использовалось на образование бензена.
По уравнению реакции (2) n(C2H2):n(С6Н6)=1:3, поэтому
n(C6H6)=n(С2Н2):3=0,15 моль : 3 = 0,05 моль
V(C6H6)=n(C6H6)•VM=0,05 моль•22,4 л/моль=1,12 л
V(C2H2):V(С6Н6)=1,12 л : 1,12 л=1:1
Ответ: V(C2H2):V(С6Н6)=1:1
Другие задания смотри здесь
Уравнения реакций – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31353
Ключевые слова
- Энергия, экзотермическая реакция, эндотермическая реакция
- Физические реакции, химические реакции, фазовые переходы
- Реактивы, продукты
- Стехиометрия реакции
Развитие навыков
- Отличие химических изменений от физических.

- Написать химические уравнения для описания химической реакции.
- Чтобы сбалансировать химические уравнения.
- Для расчета требуемых количеств реагентов или количеств, образующихся в результате химической реакции.
Изменения в материале или системе называются реакциями и делятся на химические и физические реакции. Энергия является движущей силой всех изменений, как физических, так и химических реакций. В этих реакциях всегда участвует энергия. Если система более стабильна, теряя часть энергии, происходит реакция с выделением энергии. Такая реакция называется экзотермической . Подача энергии в систему также вызывает реакцию. Реакции поглощения энергии называются эндотермические реакции . Иногда количество энергии, участвующей в реакции, может быть настолько малым, что изменение энергии не сразу заметно.
Уравнение можно использовать для описания  Например, плавление, сублимация, испарение и конденсация могут быть представлены следующим образом. В этих уравнениях (s) обозначает твердое тело, (l) — жидкость (l) и (g) — газ.
Например, плавление, сублимация, испарение и конденсация могут быть представлены следующим образом. В этих уравнениях (s) обозначает твердое тело, (l) — жидкость (l) и (g) — газ.
- плавление: \(\mathrm{H_2O(s) \rightarrow H_2O(l)}\)
- сублимация: \(\mathrm{H_2O(s) \rightarrow H_2O(g)}\)
- испарение: \(\mathrm{C_2H_5OH(l) \rightarrow C_2H_5OH(g)}\)
- конденсация: \(\mathrm{NH_3(g) \rightarrow NH_3(l)}\)
При этих изменениях химические связи не разрываются и не образуются, а молекулярная идентичность веществ не меняется.
Является ли фазовый переход между графитом и алмазом химической или физической реакцией?
\(\ mathrm{C(графит) \rightarrow C(алмаз)}\).
Кристаллические структуры алмаза и графита сильно различаются, и связи между атомами углерода также различаются в двух твердых состояниях. Поскольку химические связи разрываются и образуются новые связи, фазовый переход алмаза и графита представляет собой химическую реакцию.
Химические вещества или вещества изменяются, превращаясь в одно или несколько других веществ, и эти изменения называются
\(\mathrm{C_3H_8 + 5 O_2 \rightarrow 3 CO_2 + 4 H_2O}\)
Сбалансированное уравнение также показывает макроскопическую количественную зависимость. Это сбалансированное уравнение реакции показывает, что пять молей кислорода реагируют с одним молем пропана, образуя три моля углекислого газа и четыре моля воды, всего 7 молей продуктов реакции горения.
На молекулярном уровне это уравнение показывает, что на каждую молекулу пропана требуется 5 молекул кислорода. Три атома углерода превращаются в три молекулы углекислого газа, тогда как 8 атомов водорода в пропане окисляются до 4 молекул воды. Количество атомов \(\ce{H}\), \(\ce{C}\) и \(\ce{O}\) одинаково в обеих частях уравнения.
Мы изучаем свойства веществ, чтобы знать, как их использовать. Склонность вещества реагировать как с самим собой, так и с другими веществами является важным химическим свойством. Под свойствами мы понимаем химические реакции, которые лучше всего изучаются путем экспериментов и наблюдений. Проведя множество экспериментов, вы можете обобщить некоторые правила и факты. Знание этих правил и фактов позволяет решать проблемы, с которыми вы еще не сталкивались.
Наиболее важным аспектом химической реакции является знание того, что является реагентами и что является продуктами. Для этого лучшим описанием реакции является написание уравнения реакции.
Например, при нагревании ракушек \(\ce{CaCO3}\) будет выделяться газ \(\ce{CO2}\), в результате чего останется белый порошок (твердый \(\ce{CaO}\) ) позади. Уравнение реакции записывается так:
\[\mathrm{CaCO_3 \rightarrow CaO + CO_2}\]
Уравнение показывает, что один моль \(\ce{CaCO3}\) дает по одному молю каждого из \(\ce{CaO}\) и \(\ce{CO2}\). Количества веществ, представленные химическими формулами, были введены на двух предыдущих страницах, и эти понятия должны помочь выяснить стехиометрию реакций, когда дано уравнение реакции.
Пример 1
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \(\ce{CaO}\), сколько оксида кальция должно быть получено? Если получается только 5,0 г \(\ce{CaO}\), каков фактический выход?
ПОДСКАЗКА
В идеальных условиях количество вещества в уравнении реакции указано ниже: \:100. 0 &&\:\:56 &&\:44\:\:\: \mathrm{г/моль\: (формула\: веса)}
0 &&\:\:56 &&\:44\:\:\: \mathrm{г/моль\: (формула\: веса)}
\end{alignat}\)
\[\mathrm{10.0 \: г\: CaCO_3\times\dfrac{1\: моль\: CaCO_3}{100\: г\: CaCO_3}\times\dfrac{1\: моль\: CaO}{1\: моль\: CaCO_3} \times\dfrac{56\: г\: CaO}{1\: моль\: CaO}= 5,6\: г\: CaO}\]
ОБСУЖДЕНИЕ
Здесь приведено неэффективное преобразование, но метод показывает детали рассмотрения. Если количество полученного \(\ce{CaO}\) не равно 5,6 г, можно сделать вывод, что образец может быть нечистым.
Пример 2
Когда 10,0 г чистого карбоната кальция нагревают и превращают в твердый оксид кальция \(\ce{CaO}\), сколько выделяется \(\ce{CO2}\) при стандартных условиях?
ПОДСКАЗКА
\[\mathrm{CaCO_3 \rightarrow CaO + CO_2}\]
\[\mathrm{10,0\: г\: CaCO_3\times\dfrac{1\: моль\: CO_2}{100\: г\: CaCO_3}\times\dfrac{22,4\: L\: CO_2}{ 1\:моль\:CO_2}= 2,24\:L\:CO_2}\]
ОБСУЖДЕНИЕ
В этой формулировке мы сделали более короткий путь по сравнению с примером 1. Примеры 1 и 2 иллюстрируют оценку величин в г и в л.
Примеры 1 и 2 иллюстрируют оценку величин в г и в л.
Написание уравнений химических реакций
Уравнения химических реакций действительно представляют изменения материалов. Для многих реакций мы можем написать уравнения только для общих реакций. Например, здравый смысл подсказывает нам, что при полном окислении сахара конечными продуктами являются углекислый газ и вода. Реакция окисления аналогична реакции горения. Таким образом, мы пишем
\[\ce{C12h32O11 + 12 O2 \rightarrow 12 CO2 + 11 h3O}\]
Это иллюстрирует методы, используемые для написания сбалансированных уравнений реакции:
- Определите реагенты и продукты : В этом случае продукты \(\ce{CO2}\) и \(\ce{h3O}\), определяемые здравым смыслом. Мы знаем это.
- Применить фундаментальный принцип сохранения атомов. Количество атомов каждого вида должно быть одинаковым до и после реакции.
- Сбалансируйте один тип атомов в времени : Для начала мы можем использовать \(\ce{H}\) или \(\ce{C}\).
 Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\).
Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\). - Баланс атомов кислорода с обеих сторон: Всего 35 атомов \(\ce{O}\) справа, и коэффициент для \(\ce{O2}\) должен быть 11.
Пример 3
Соединение \(\ce{N2O5}\) нестабильно при комнатной температуре. Он разлагается с образованием коричневого газа \(\ce{NO2}\) и кислорода. Напишите сбалансированное уравнение химической реакции его разложения.
ПОДСКАЗКА
Первый шаг – написать несбалансированное уравнение, указывающее только реагент и продукты:
\[\ce{N2O5 \rightarrow NO2 + O2}\]
A \(\ce{N2O5}\ ) распадается на две молекулы \(\ce{NO2}\) и половину молекулы \(\ce{O2}\).
\[\ce{N2O5 \rightarrow 2 NO2 + \dfrac{1}{2}O2}\]
Чтобы получить в уравнении целое число стехиометрических коэффициентов , умножим все стехиометрические коэффициенты на 2. Этот пример иллюстрирует шаги, используемые при написании сбалансированного уравнения для химической реакции. Это сбалансированное уравнение не говорит нам, как разлагается молекула \(\ce{N2O5}\), оно только иллюстрирует общую реакцию.
Этот пример иллюстрирует шаги, используемые при написании сбалансированного уравнения для химической реакции. Это сбалансированное уравнение не говорит нам, как разлагается молекула \(\ce{N2O5}\), оно только иллюстрирует общую реакцию.
Пример 4
При смешивании растворов \(\ce{CaCl2}\) и \(\ce{AgNO3}\) образуется белый осадок. Такой же осадок наблюдается и при смешивании раствора \(\ce{NaCl}\) с раствором \(\ce{AgCh4CO2}\). Напишите сбалансированное уравнение реакции между \(\ce{CaCl2}\) и \(\ce{AgNO3}\).
ПОДСКАЗКА
Общими ионами между \(\ce{NaCl}\) и \(\ce{CaCl2}\) являются ионы \(\ce{Cl-}\) и \(\ce{Ag+ }\) ионы являются общими для двух соединений, содержащих серебро. Вопрос иллюстрирует научную дедукцию, используемую при определении продуктов. Продукт \(\ce{AgCl}\), а сбалансированная реакция 92+}\) и \(\ce{NO3-}\) — иона-спектатора.
Химические реакции
Одной из самых важных тем в химии является химическая реакция . На этой странице мы сосредоточимся только на стехиометрии, выраженной уравнениями реакции. Другие темы, связанные с химическими реакциями:
На этой странице мы сосредоточимся только на стехиометрии, выраженной уравнениями реакции. Другие темы, связанные с химическими реакциями:
- Избыток и ограничение Реагенты или реагенты, оставшиеся или израсходованные
- Особенности химических реакций или классификация реакций
- Химическая кинетика или скорость реакции
- Механизм реакции или как на самом деле протекает реакция
Балансировка окислительно-восстановительных реакций
Балансировка уравнений реакций окисления и восстановления немного сложнее, чем то, что мы обсуждали здесь. Вы должны обладать навыками определения степеней окисления, объяснения окисления и восстановления с точки зрения изменения степени окисления и написания уравнений полуреакций. Тогда вы сможете сбалансировать окислительно-восстановительные реакции. Все это дано в следующем модуле по химическим реакциям.
Проблемы развития навыков
- Какой продукт(ы) содержит(ют) углерод при сжигании метана, \(\ce{Ch5}\) , на воздухе?
Подсказка: \(\ce{CO2}\)
Обобщение:
Сгорание соединений, содержащих \(\ce{C}\), превращает все \(\ce{C}\) в \(\ce{CO2}\).
- Используйте метод здравого смысла, чтобы найти молекулярную формулу сероводорода, молекулярная масса которого составляет 34,1. (атомный вес, \(\ce{H}\) , 1,008; \(\ce{S}\) , 32.066)
Подсказка: \(\ce{h3S}\)
Обобщение:
Сера и кислород являются элементами группы 6, и они образуют \(\ce{h3O}\) и \(\ce{h3S}\).
- При нагревании 30,0 г \(\ce{Al}\) (атомный вес 27,0) в кислороде (атомный вес 16,0) образуется оксид алюминия \(\ce{Al2O3}\) , сформировался. Сколько оксида должно быть получено?
Совет: 56,7 г
Вариант A:
Сколько (в г) требуется кислорода?
- При нагревании \(\ce{KClO3}\) он разлагается с образованием твердого вещества \(\ce{KCl}\) и газообразного кислорода. Если собрать 0,500 моль \(\ce{O2}\) , сколько граммов \(\ce{KCl}\) должно получиться? (Атомная масса: \(\ce{K}\) , 39,098; \(\ce{Cl}\) , 35,453)
Совет: 24,9 г
Рекомендуемый метод:
Для реакции: \(\ce{2 KClO3 \rightarrow 2 KCl + 3 O2}\)
предложенная формулировка:
\(\mathrm{0,50\: моль\: O_2 \times\dfrac{2\: моль\: KCl}{3\: моль\: O_2}\times\dfrac{74,6\: г\: KCl}{1 \: моль\: KCl}=\: ??. -}\). 9-}{1\:моль\:BaSO_4}= 0,113\:моль}\)
-}\). 9-}{1\:моль\:BaSO_4}= 0,113\:моль}\)
- Электростанция сжигает уголь, и этот процесс эквивалентен сжиганию 999 кг серы в день. Сколько килограммов \(\ce{SO2}\) выбрасывается в день, если на электростанции нет устройств для очистки от загрязнений для извлечения серы? Атомная масса: \(\ce{C}\) , 12,00; \(\ce{O}\) , 16.00; \(\ce{S}\) , 32.06.
Подсказка: 1998 кг
Дальнейшее рассмотрение:
Молекулярная масса \(\ce{SO2}\) примерно в два раза больше атомной массы \(\ce{S}\). Таким образом, вес \(\ce{SO2}\) вдвое больше веса \(\ce{S}\).
Варианты: Сколько (в молях и л) \(\ce{SO2}\) образуется в день?
Если весь \(\ce{SO2}\) превратить в \(\ce{h3SO4}\), сколько (в молях и кг) серной кислоты получится? (3055 кг)
- Сколько молей воды образуется при сжигании одного моля пропана \(\ce{C3H8}\) в избыточном количестве воздуха?
Подсказка: 4 моля; \(\ce{C3H8 + 5 O2 \rightarrow 3 CO2 + 4 h3O}\)
Навык:
Составьте сбалансированное уравнение реакции.
Варианты:
Сколько граммов воды будет произведено?
Сколько молей \(\ce{CO2}\) будет произведено?
- Смесь, содержащая \(\ce{Na2SO4}\) , но не содержащая других сульфатов, анализируется методом осаждения с \(\ce{BaCl2}\) . Образец смеси массой 2,37 г давал осадок \(\ce{BaSO4}\) массой 2,57 г. Каково процентное содержание \(\ce{Na2SO4}\) в смеси?
Подсказка: 66,0%
Навык:
Задача иллюстрирует стратегию химического анализа.
- Предположим, что смесь 2,33 г \(\ce{CaCl2}\) и \(\ce{Ca(NO3)2}\) дает 2,22 г \(\ce{AgCl}\) когда \(\ce{Ag(NO3)}\) используется в качестве реагента для осаждения ионов хлорида \(\ce{Cl-}\) . Каково процентное содержание \(\ce{CaCl2}\) в смеси?
Подсказка: 36,9%
Атомный вес: \(\ce{N}\) , 14. 0; \(\ce{O}\) , 16,0; \(\ce{Cl}\) , 35,5; \(\ce{Ca}\) , 40,1; \(\ce{Ag}\) , 107.9.
0; \(\ce{O}\) , 16,0; \(\ce{Cl}\) , 35,5; \(\ce{Ca}\) , 40,1; \(\ce{Ag}\) , 107.9.
Навык:
Эта задача также иллюстрирует стратегию химического анализа.
Авторы и авторство
Reaction Equations распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- сбалансированное уравнение химической реакции
- химические изменения
- Химические реакции
- конденсат
- эндотермический
- эндотермическая реакция
- энергия
- Энергия
- испарение
- экзотермический
- экзотермическая реакция
- плавка
- степени окисления
- степень окисления
- Фазовый переход
- фазовые переходы
- физические изменения
- Физические реакции
- Реагенты
- Уравнения реакций
- Стехиометрия реакции
- Реакции
- стехиометрия
- сублимация
Какие условия необходимы для химической реакции?
Химическое уравнение представляет собой представление химического процесса в виде символов для веществ, участвующих в реакции. Это способ изображения химической реакции с помощью символов и формул для компонентов.
Это способ изображения химической реакции с помощью символов и формул для компонентов.
Химическое уравнение может быть более информативным по следующим трем причинам.
- Характеризуя физические состояния реагентов и продуктов. Твердые вещества обозначаются буквой «s», жидкости — буквой «l», а газы — буквой «g». Водные растворы обозначаются символом (aq).
- Показывая изменения температуры, происходящие во время процесса. Например, экзотермический процесс – это процесс, при котором выделяется тепло. Реакция поглощения тепла известна как эндотермическая реакция.
- Путем описания обстоятельств, при которых происходит реакция. Символ или формула катализатора помещаются выше или ниже знака стрелки, если реакция происходит в присутствии катализатора. давление, при котором протекает реакция. Эти условия обсуждаются ниже.
Химическая реакция в присутствии тепла
Теплота реакции – это количество тепла, которое необходимо добавить или отвести во время химической реакции, чтобы все компоненты находились при одной и той же температуре.
Измеренная теплота реакции также представляет собой изменение термодинамической величины, известной как энтальпия или теплосодержание , которая представляет собой разницу между энтальпией веществ, присутствующих в конце реакции, и энтальпией веществ, присутствующих в конце реакции. начало реакции, если давление в сосуде с реагирующей системой поддерживается постоянным.
В результате теплота реакции, измеренная при постоянном давлении, также известна как энтальпия реакции, обозначаемая символом ΔH. Реакция называется эндотермической, если теплота, выделяемая при ней, положительна. Реакция считается экзотермической, если теплота реакции отрицательна. Если для протекания реакции требуется тепло, символ теплоты дельта (Δ) помещается над стрелкой уравнения.
Когда азот и кислород нагреваются до чрезвычайно высокой температуры, они объединяются с образованием монооксида азота, как показано в приведенной ниже реакции.
N 2 + O 2 + HEAT → 2NO
(азот) (кислород) (моноксид азота).
Химическая реакция, которая увеличивается без катализации
. потребляемый называется катализатором . Ферменты , являющиеся природными катализаторами, катализируют несколько важных метаболических реакций.
Металлы и их оксиды, сульфиды и галогениды, а также полуметаллические элементы бор, алюминий и кремний составляют большинство твердых катализаторов. Твердые катализаторы обычно диспергируют в других веществах, известных как носители катализаторов; газообразные и жидкие катализаторы обычно используются в чистом виде или в сочетании с подходящими носителями или растворителями.
Каталитическое действие , в общем, представляет собой химическую реакцию между катализатором и реагентом, в результате которой образуются химические промежуточные продукты, которые могут легче реагировать друг с другом или с другим реагентом с образованием желаемого конечного продукта. Катализатор регенерируется во время реакции между химическими промежуточными продуктами и реагентами.
Режимы реакции между катализаторами и реагентами сильно различаются и часто бывают сложными в твердых катализаторах.
Кислотно-основные реакции, окислительно-восстановительные процессы, образование координационных комплексов и образование свободных радикалов являются примерами этих реакций. Поверхностные свойства и электрическая или кристаллическая структура оказывают большое влияние на механизм реакции твердых катализаторов. Полифункциональные катализаторы представляют собой твердые катализаторы, которые могут взаимодействовать с реагентами более чем одним способом; бифункциональные катализаторы широко используются в нефтяной промышленности для реакций риформинга. Многие промышленные химические процессы основаны на катализируемых реакциях. Производство катализаторов само по себе является быстроразвивающимся промышленным процессом.
Символ или формула катализатора записывается над или под знаком стрелки в уравнении, если реакция протекает в присутствии катализатора. Следующий пример поможет прояснить это.
Хлорат калия (KClO 3 ) разлагается на хлорид калия и газообразный кислород при нагревании в присутствии катализатора на основе диоксида марганца. Ниже приведен пример того, как это можно выразить:
2KClO 3 0609 2 (в присутствии MNO 2 )
(Хлорат калия) (хлорид калия) (кислород)Катализатор является MNO 2 , а дельта (Δ) представляет для нагрева. В результате приведенное выше уравнение описывает условия, при которых протекает реакция.
Химическая реакция в присутствии температуры и давления
- Влияние температуры: Кинетико-молекулярная теория может быть использована для описания влияния температуры и давления на жидкость. Молекулярное поведение жидкости при низкой температуре вблизи точки замерзания и при более высокой температуре вблизи точки кипения различается. Рассмотрим, как подвижность атомов или молекул в жидкости зависит от температуры.
Частицы в твердом, жидком или газообразном состоянии движутся быстрее при повышении температуры. Частицы замедляются при понижении температуры.
- Когда жидкость достаточно охлаждена, она затвердевает.
- Когда жидкость достаточно нагрета, она превращается в газ.
- Влияние давления: На объем жидкости не влияют изменения давления. Поскольку любое увеличение давления может лишь немного уменьшить расстояние между плотно упакованными молекулами, жидкости, как правило, несжимаемы.
- Когда давление над жидкостью повышается достаточно высоко, жидкость затвердевает.
- Когда давление над жидкостью достаточно снижается, жидкость превращается в газ.
Условия температуры и давления, при которых протекает реакция, также можно выразить в уравнении, поместив их значения над или под знаком стрелки. Следующий пример продемонстрирует это.
Оксид углерода и водород используются для производства метанола или метилового спирта.
Смесь моноксида углерода и газообразного водорода сжимается до давления 300 атмосфер, а затем проходит через катализатор, состоящий из смеси оксида цинка и оксида хрома, нагретой до 300°С.0685 0 C. Для реакции требуется давление 300 атмосфер (записывается как 300 атм), температура 300 0 C и катализатор, состоящий из оксида цинка и оксида хрома (ZnO+CrO 3 ). Теперь мы можем записать химическое уравнение реакции образования метанола вместе с условиями следующим образом.
CO + 2H 2 → CH 3 OH + (при 300 атм.,0609 3 )
(угарный газ) (водород) (метанол)Состояние вещества вещества является внешним свойством, что означает, что на него можно влиять окружение. На состояние вещества влияют два физических фактора: температура и давление. Можно измерять как температуру и давление, так и изменения состояния.
Когда к веществу прикладывается тепловая энергия, температура повышается, изменяя состояние вещества из твердого в жидкое (плавление), из жидкого в газообразное (испарение) или из твердого в газообразное (сублимация).
Когда энергия теряется из вещества, температура падает, в результате чего оно превращается из жидкого в твердое (замерзание), из газа в твердое (осаждение) или из газа в жидкость (конденсация). Когда давление, приложенное к веществу, увеличивается, вещество может конденсироваться. Он может испариться, если давление уменьшится.
При каких условиях протекает реакция фотосинтеза?
Фотосинтез — это процесс, посредством которого зеленые растения производят пищу. Во время фотосинтеза углекислый газ реагирует с водой в присутствии «солнечного света», а зеленый пигмент «хлорофилл», содержащийся в листьях, производит пищу, такую как глюкоза, и выделяет газообразный кислород. Для протекания реакции фотосинтеза необходимо наличие солнечного света и хлорофилла. В результате мы можем написать следующее химическое уравнение фотосинтеза вместе с условиями.
6CO 2 + 6H 2 O → C 6 H 12 O 6 + 6O 2 (в присутствии солнечного света и Chlorophyl)
6 (2 (в присутствии солнечного света и Chlorophyl)
6 (2 (в присутствии солнечного света и Chlorophyl)
6 (2 (в присутствии Sunlight и Chlorophyl).) (Кислород)
Образец Вопросы
Вопрос 1: Как изменение температуры влияет на частицы дело?
Ответ:
Частицы в твердом теле, жидкости или газе движутся быстрее при повышении температуры, а когда температура падает, движение частиц замедляется.
Вопрос 2: Приведите пример химической реакции с изменением температуры.
Ответ:
Изменение температуры достигается при добавлении негашеной извести в воду с образованием гашеной извести, поскольку она бурно реагирует и выделяет тепло.
Вопрос 3: Плавление свечного воска при нагревании является химической реакцией или нет?
Ответ:
Нет, плавление свечного воска при нагревании не является химической реакцией, потому что при нагревании воск меняет свое физическое состояние, но не меняет своих свойств.


 00-15.00
00-15.00 
 Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\).
Поскольку слева 12 атомов \(\ce{C}\), коэффициент равен 12 для \(\ce{CO2}\). Точно так же 22 атома \(\ce{H}\) дают 11 молекул \(\ce{h3O}\). Измеренная теплота реакции также представляет собой изменение термодинамической величины, известной как энтальпия или теплосодержание , которая представляет собой разницу между энтальпией веществ, присутствующих в конце реакции, и энтальпией веществ, присутствующих в конце реакции. начало реакции, если давление в сосуде с реагирующей системой поддерживается постоянным.
Измеренная теплота реакции также представляет собой изменение термодинамической величины, известной как энтальпия или теплосодержание , которая представляет собой разницу между энтальпией веществ, присутствующих в конце реакции, и энтальпией веществ, присутствующих в конце реакции. начало реакции, если давление в сосуде с реагирующей системой поддерживается постоянным. Химическая реакция, которая увеличивается без катализации
Химическая реакция, которая увеличивается без катализации Режимы реакции между катализаторами и реагентами сильно различаются и часто бывают сложными в твердых катализаторах.
Режимы реакции между катализаторами и реагентами сильно различаются и часто бывают сложными в твердых катализаторах.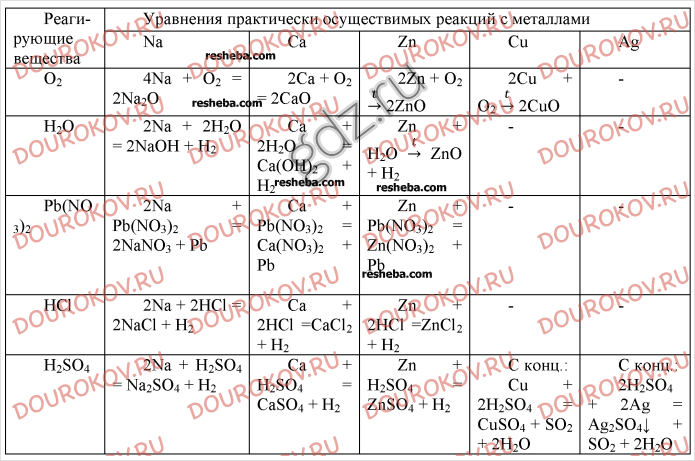
 Частицы в твердом, жидком или газообразном состоянии движутся быстрее при повышении температуры. Частицы замедляются при понижении температуры.
Частицы в твердом, жидком или газообразном состоянии движутся быстрее при повышении температуры. Частицы замедляются при понижении температуры. Смесь моноксида углерода и газообразного водорода сжимается до давления 300 атмосфер, а затем проходит через катализатор, состоящий из смеси оксида цинка и оксида хрома, нагретой до 300°С.0685 0 C. Для реакции требуется давление 300 атмосфер (записывается как 300 атм), температура 300 0 C и катализатор, состоящий из оксида цинка и оксида хрома (ZnO+CrO 3 ). Теперь мы можем записать химическое уравнение реакции образования метанола вместе с условиями следующим образом.
Смесь моноксида углерода и газообразного водорода сжимается до давления 300 атмосфер, а затем проходит через катализатор, состоящий из смеси оксида цинка и оксида хрома, нагретой до 300°С.0685 0 C. Для реакции требуется давление 300 атмосфер (записывается как 300 атм), температура 300 0 C и катализатор, состоящий из оксида цинка и оксида хрома (ZnO+CrO 3 ). Теперь мы можем записать химическое уравнение реакции образования метанола вместе с условиями следующим образом. Когда энергия теряется из вещества, температура падает, в результате чего оно превращается из жидкого в твердое (замерзание), из газа в твердое (осаждение) или из газа в жидкость (конденсация). Когда давление, приложенное к веществу, увеличивается, вещество может конденсироваться. Он может испариться, если давление уменьшится.
Когда энергия теряется из вещества, температура падает, в результате чего оно превращается из жидкого в твердое (замерзание), из газа в твердое (осаждение) или из газа в жидкость (конденсация). Когда давление, приложенное к веществу, увеличивается, вещество может конденсироваться. Он может испариться, если давление уменьшится. ) (Кислород)
) (Кислород)