2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
Согласно современным представлениям, атом – это наименьшая частица химического элемента, являющаяся носителем его химических свойств. Атом электрически нейтрален и состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые движутся определённым образом вокруг ядра. Ядро атома, не изменяющееся в ходе химических реакций, составляет его фундаментальную основу и определяет индивидуальность элемента. Поэтому значение заряда ядра выбрали за основной признак, по которому атомы относят к разным видам – химическим элементам.
Ядра атомов включают два вида элементарных частиц: протоны и нейтроны.
Основные характеристики электрона, протона и нейтрона приведены в табл. 2.1.
Таблица 2.1
Сведения о некоторых элементарных
частицах.
Частица | Символ | Масса | Заряд | |||
кг | а.е.м. | Кл. | Усл. | |||
протон | p | 1, 673 10-27 | 1, 007276 | 1, 602 10-19 | +1 | |
нейтрон | n | 1, 675 10-27 | 1, 008665 | 0 | 0 | |
электрон | e | 9, 109 10-31 | 0, 000547 | 1, 602 10-19 | ||
Каждый
протон несёт положительный заряд,
численно равный заряду электрона. Нейтрон же не несёт никакого электрического
заряда. Отсюда следует вывод: заряд
ядра определяется числом протонов.
Количество протонов в ядре атома
совпадает с порядковым номером элемента
(Z)
в периодической системе элементов Д.И.
Менделеева.
Нейтрон же не несёт никакого электрического
заряда. Отсюда следует вывод: заряд
ядра определяется числом протонов.
Количество протонов в ядре атома
совпадает с порядковым номером элемента
(Z)
в периодической системе элементов Д.И.
Менделеева.
Как видно из данных табл. 2.1, масса электрона почти в 1840 раз меньше массы протона и нейтрона. В ядре сосредоточено 99,9% массы атома, поэтому масса атома практически равна массе ядра – сумме масс протонов и нейтронов.
Общее число протонов (Z) и нейтронов (N) в ядре называется массовым числом A:
A=Z+N.
Поскольку массы протона и нейтрона практически равны 1а.е.м., то масса атома в а.е.м., как и относительная атомная масса, численно совпадает со значением массового числа А.
Силы, удерживающие протоны и нейтроны
в ядре, называют ядерными. Это чрезвычайно
большие силы, действующие на очень
коротких расстояниях (порядка 10-13 см) и превосходящие силы отталкивания. Природу этих сил изучает ядерная физика.
Природу этих сил изучает ядерная физика.
Исследования показали, что в природе атомы одного и того же элемента имеют различные атомные массы. Так, атомы хлора имеют массу 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов. Атомы с одинаковым числом протонов, но с различным числом нейтронов называются изотопами. Для обозначения изотопов пользуются обычными символами соответствующих элементов, добавив к ним слева вверху индекс, указывающий массовое число изотопа, внизу – индекс, указывающий количество протонов, равное порядковому номеру (Z) элемента (). Пример – изотопы водорода:
–протий (1р, 0n)
–дейтерий (1р, 1n)
–тритий (1р, 2n)
В периодической таблице элементов Д.И. Менделеева приводятся усреднённые значения относительных атомных масс с учётом распространённости различных изотопов в природе.
Атомы
с различным числом протонов Z и нейтронов
N, но с одинаковым числом нуклонов (Z+N)
называются изобарами, а с одинаковым
числом нейтронов (N) – изотонами.
Примеры изобаров и изотонов:
Изобары Изотоны
Поскольку атом в целом является электронейтральным, а заряд электрона численно равен заряду протона и противоположен ему по знаку, то общее число электронов в атоме равно числу протонов и, следовательно, равно порядковому номеру элемента в периодической системе элементов.
Современная теория – строение – атом
Cтраница 2
В основе современной теории строения атома лежит представление о двойственной природе м: икрочастиц, и в частности электронов. Оказывается, электроны могут вести себя и как частицы, и как волны – электроны обладают одновременно и корпускулярными и волновыми свойствами. [16]
| Волновые функции электрона. [17] |
Основой и началом современной теории строения атома явилось квантово-механическое описание атома, предложенное Шредингером. Сущность его заключается в том, что движение микрообъекта описывается волновым уравнением, а определение местоположения объектов производится по вероятностным принципам.
[18]
Сущность его заключается в том, что движение микрообъекта описывается волновым уравнением, а определение местоположения объектов производится по вероятностным принципам.
[18]
Бора, Шредингера и других создателей современной теории строения атома и химической связи описаны в гл. Здесь мы совершим путешествие в более далекое прошлое и сосредоточим внимание на двух ученых, революционизировавших химию: один из них, Антуан Лавуазье ( 1743 – 1794), продемонстрировал, что важнейшим свойством, сохраняющимся в любой химической реакции, является масса, а другой, Джон Дальтон ( 1766 – 1844), выдвинул предположение об атомах как об элементарных частицах, участвующих в химических реакциях. В принципе Дальтон не первым выдвинул предположение об атомах, но он первым убедительно показал, что атомы действительно существуют и что они создают удобную основу для понимания химических реакций. [19]
Как впервые показал Бор, работы которого лежат в основе современной теории строения атома, движение электрона вокруг ядра квантуется.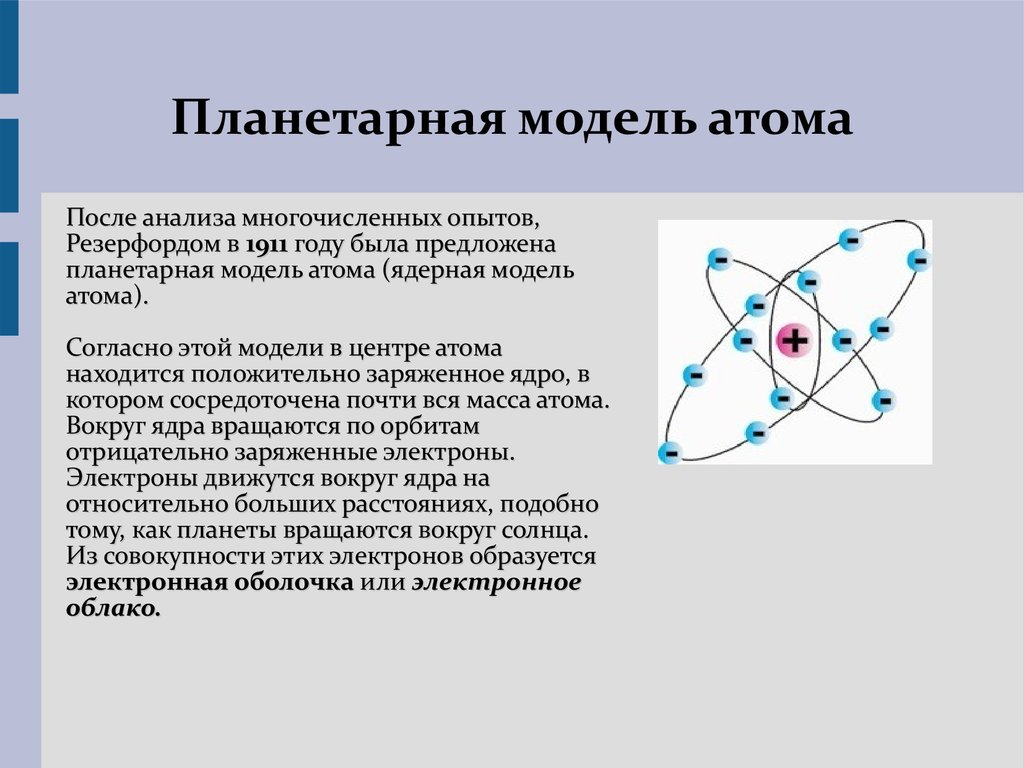
Истинная оценка споров была дана позже с позиций диалектического материализма и на основе современной теории строения атома. [21]
Представление об этих полях дает ясное объяснение характера межмолекулярных сил, первоначально возникшее на чисто физической основе за десятки лет до создания современных теорий строения атома и молекулы. [22]
[22]
Изучение внутреннего строения металлов и сплавов позволило утеным сделать вывод о том, что изменения свойств металлов и сплавов определяются особенностями их внутреннего строения. По
Прежде всего было обращено внимание на то обстоятельство, что при окислении всегда увеличивается положительная валентность того или иного атома окисляемого вещества, а при восстановлении эта валентность уменьшается. Но с точки зрения современной теории строения атома изменение валентности элемента зависит от изменения числа электронов во внешней электронной оболочке атомов. Стало быть, при окислении валентность окисляемого элемента повышается за счет отдачи электронов. [24]
Спектральный анализ был открыт более 100 лет тому назад ( I860 г.) Кирхгофом и Бунзеном. Теория спектров легла в основу современной теории строения атома. Методы и задачи спектрального анализа, с одной стороны, и анализа спектров – с другой, существенно различны. Однако при рассмотрении спектрального анализа необходимо знать основные положения теории спектров.
[25]
Теория спектров легла в основу современной теории строения атома. Методы и задачи спектрального анализа, с одной стороны, и анализа спектров – с другой, существенно различны. Однако при рассмотрении спектрального анализа необходимо знать основные положения теории спектров.
[25]
В этом ряду сделано исключение только для калия, который должен был бы стоять впереди аргона. Как увидим впоследствии, это исключение находит полное оправдание в современной теории строения атома. [26]
В этом ряду сделано исключение только для калия, который должен был бы стоять впереди аргона. Как увидим впоследствии, это исключение находит полное, оправдание в современной теории строения атома. [27]
Теория химического строения, созданная А. М. Бутлеровым ( I860 г), и развитая его учениками В. В. Марковниковым, А. М. Зайцевым и др., впервые дала руководящие идеи для оформления органической химии как науки. Эта теория основана на таких представлениях, как пространственное расположение атомов в составе молекулы, взаимное влияние атомов, входящих в состав одной молекулы, зависящее от их взаимного расположения, изомерия и элементы стереохимии. Это нашло подтверждение и уточнение в современной теории строения атома и теории химической связи, одинаково необходимой как в неорганической, так и в органической химии.
[28]
Это нашло подтверждение и уточнение в современной теории строения атома и теории химической связи, одинаково необходимой как в неорганической, так и в органической химии.
[28]
Теория химического строения, созданная А. М. Бутлеровым ( 1860) и развитая его учениками В. В. Марковниковым, А. М. Зайцевым и др., способствовала оформлению органической химии как науки. Эта теория основана на таких представлениях, как пространственное расположение атомов в молекуле, взаимное влияние атомов, зависящее от их расположения, изомерия и элементы стереохимии. Это нашло подтверждение и уточнение в современной теории строения атома и теории химической связи, одинаково необходимой как в неорганической, так и в органической химии. [29]
В 1925 – 1926 гг. Гейзенберг ( Германия) и Шредингер ( Австрия) предложили независимо друг от друга два варианта новой механики; впоследствии было показано, что оба варианта приводят к тождественным результатам. Метод Шредингера оказался более удобным для выполнения расчетов; современная теория строения атомов и молекул основывается на этом методе.
[30]
Метод Шредингера оказался более удобным для выполнения расчетов; современная теория строения атомов и молекул основывается на этом методе.
[30]
Страницы: 1 2 3
Объяснение урока: современная атомная теория
В этом объяснителе мы научимся описывать концепции современной атомной теории.
Каждая последующая модель атома разрабатывалась для теоретического объяснения практического результата.
- Модель твердых сфер Джона Дальтона объясняет, как атомы упаковываются вместе.
- Модель сливового пудинга Дж. Дж. Томсона учитывала присутствие в атоме отрицательно заряженных частиц, которые мы называем «электронами».
- Гейгер, Марсден и Эрнест Резерфорд продемонстрировали существование ядра, плотной, положительно заряженной части атома в самом его центре. Это ядро, которое содержит протоны.
- Нильс Бор и Эрнест Резерфорд предложили модель Резерфорда-Бора, которую часто называют просто моделью Бора, где
электроны занимают орбиты вокруг ядра, как планеты вокруг Солнца.
 Это объясняло особенности
спектр излучения водорода.
Это объясняло особенности
спектр излучения водорода. - Джеймс Чедвик позже продемонстрировал, что ядра также содержат незаряженные частицы. Это нейтроны.
Модель Бора предполагает следующее об атомах:
- Плотное положительно заряженное ядро находится в середине атома.
- Электроны вращаются вокруг ядра по плоским круговым орбитам.
- Радиус каждой орбиты определяется зарядом ядра.
- Электрон не может вращаться вокруг ядра между фиксированными орбитами.
Модель Бора объясняет тот факт, что когда мы возбуждаем атомы или ионы, они излучают повторяющиеся световые узоры, отдельные линий на определенных длинах волн.
Такое поведение объясняется строгой разницей в энергии между орбитами. Электрон может быть переведен на более высокую орбиту и, когда он снова падает вниз, излучают свет с определенной энергией.
Для каждого ядра модель Бора создала список разрешенных переходов и их энергий. Для атомарного водорода Бор
модель была очень точной. Однако для атомов с более чем одним электроном модель Бора не воспроизводила экспериментальных результатов.
Для атомарного водорода Бор
модель была очень точной. Однако для атомов с более чем одним электроном модель Бора не воспроизводила экспериментальных результатов.
Это спектры излучения некоторых из этих элементов.
Вот основные проблемы с моделью Бора, которые привели к ее пересмотру:
- Она не описывает энергии электронных переходов в системах с более чем одним электроном.
- Не учитывает тот факт, что некоторые эмиссионные линии в спектрах атомной эмиссии более интенсивны, чем другие.
- Не учитывает тот факт, что некоторые эмиссионные линии расположены слишком близко друг к другу, чтобы возникать в результате различных переходов.
- Не предоставляет модель склеивания.
- Нарушает принцип неопределенности Гейзенберга.
Модель Бора рассматривала электроны как частицы; теперь мы знаем, что электроны также обладают волновыми свойствами. Кроме того, в модели Бора
атом водорода был бы по существу двумерным, с электроном, движущимся в одной плоской плоскости.
Принцип неопределенности Гейзенберга — это принцип квантовой механики, появившийся позже. Это фундаментальная истина вселенная.
Определение: принцип неопределенности Гейзенберга
Чем точнее вы определяете положение частицы в пространстве, тем более неопределенно ваше измерение ее импульса становится (и наоборот).
Проще говоря, мы можем либо знать, где находится частица, либо с какой скоростью она движется (и в каком направлении). Этот принцип только имеет значение для субатомных частиц или более крупных объектов, движущихся с очень высокой скоростью.
Модель Бора рассматривает электроны исключительно как частицы, которые движутся по орбите предсказуемым образом. Эта модель нарушает принцип Гейзенберга. принцип неопределенности, поэтому модель Бора должна быть в чем-то неверна.
Работа Вернера Гейзенберга над принципом неопределенности была частью более крупной работы, которая расширила то, как мы описываем
Вселенная. Луи де Бройль сделал одно из самых важных открытий, которое изменило наше представление о поведении электронов. Де Бройль продемонстрировал, что электроны обладают как волнообразными, так и корпускулярными свойствами.
Луи де Бройль сделал одно из самых важных открытий, которое изменило наше представление о поведении электронов. Де Бройль продемонстрировал, что электроны обладают как волнообразными, так и корпускулярными свойствами.
Оказывается, все, что мы называем частицей, можно описать волновыми способами, а все, что мы называем волной, можно описывается частицеподобно. Однако в целом мы наблюдаем волнообразное поведение только частиц, движущихся со скоростями близкой к скорости света.
Название, которое мы даем этой концепции, — корпускулярно-волновой дуализм.
Определение: корпускулярно-волновой дуализм
Физические объекты могут проявлять волновые и корпускулярные свойства. Степень, в которой они проявляют это поведение зависит от того, кто они и как быстро они движутся.
Электрон может вести себя как частица, так как электроны имеют массу, и электроны могут отскакивать друг от друга. Тем не менее, электрон
также может вести себя как волна, создавая дифракционные картины так же, как свет в эксперименте с двумя щелями.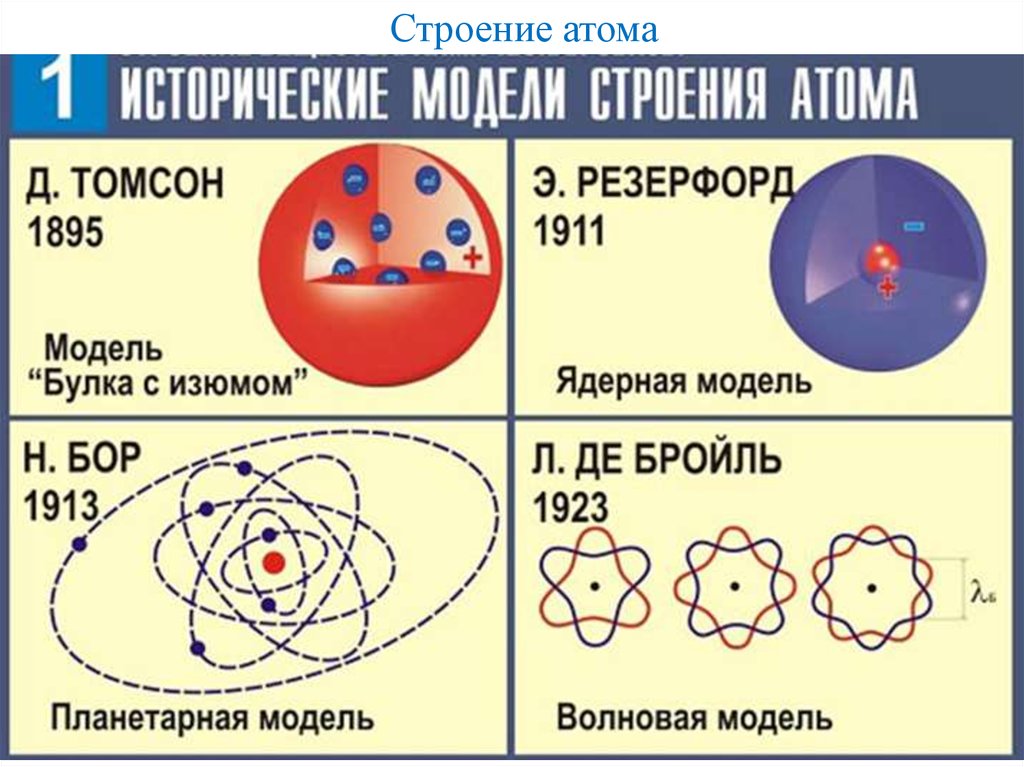 Электрон
демонстрирует корпускулярно-волновой дуализм. Он обладает корпускулярными свойствами и волновыми свойствами.
Электрон
демонстрирует корпускулярно-волновой дуализм. Он обладает корпускулярными свойствами и волновыми свойствами.
Понимание того, что частицы также ведут себя как волны, является фундаментальным для современной атомной теории, которая также опирается на квантовую теорию. теория. В начале 1900-х годов было сделано много теорий и открытий, которые произвели революцию в то, что мы называем классической физикой. В классической физике все виды энергии считаются непрерывными. Энергии могут быть любыми.
Однако квантовая теория представила идею о том, что определенные виды энергии приходят в виде дискретных пакетов, называемых квантами. Размер эти кванты зависят от системы. Детали этого сложны, но главное понять, что это знание позволило создать лучшую модель атома.
Квантовая теория оказала значительное влияние на наше понимание света. Свет приходит в виде квантов, называемых фотонами. Зеленый фотон
имеет примерно необходимое количество энергии, чтобы разорвать одинарную связь хлор-хлор. Фотон синего света обладает еще большей энергией,
в то время как фотон красного света имеет меньше. Вооружившись этим пониманием, мы можем понять, почему некоторые длины волн света имеют
эффект, а другие нет. Если энергия фотона меньше, чем энергетическая щель для перехода, переход
произойти не может.
Фотон синего света обладает еще большей энергией,
в то время как фотон красного света имеет меньше. Вооружившись этим пониманием, мы можем понять, почему некоторые длины волн света имеют
эффект, а другие нет. Если энергия фотона меньше, чем энергетическая щель для перехода, переход
произойти не может.
Понимание корпускулярно-волнового дуализма и квантовой теории привело к современной модели атома. В то время как это подверглись изменениям с 1900-х годов, простая версия модели осталась прежней.
Первая поправка к модели Бора заключается в том, что электроны могут вести себя волнообразно. Электроны не имеют четкой фиксированной позиции или импульса, но могут быть распределены таким образом, что это нелегко описать или понять.
Пример 1. Определение того, какое утверждение не является ограничением модели Бора атома
Что из следующего не является ограничением модели атома Бора?
- Электроны движутся вокруг ядра по круговым плоским орбитам.

- Электроны рассматриваются только как частицы, а не как волны.
- Можно точно определить положение и импульс электрона одновременно.
- Электроны внутри атомов могут занимать только квантованные энергетические уровни.
- Объясняет линейчатый спектр излучения только атома водорода.
Ответ
Модель атома Бора когда-то была лучшим описанием атома. Однако и эта модель не обошлась без ограничения. Открытия в физике и формулировка квантовой механики выявили недостатки модели Бора. атома. В этом вопросе нам дается пять утверждений о модели Бора, и нам нужно определить, какое из них верно. не ограничение.
В модели атома Бора электроны описываются как имеющие круговые плоские орбитали вокруг центрального ядра. Рассматривая электроны как частицы, модель Бора подразумевала, что атом водорода должен быть по существу двумерным, т.
с электроном, движущимся в одной плоской плоскости. Однако де Бройль продемонстрировал, что электроны обладают корпускулярно-волновым взаимодействием. двойственность, в то время как волновая механическая модель Шредингера описывает электроны как имеющие диапазон возможных положений. В любой момент времени электрон может оказаться ближе к ядру или дальше. Исходя из этих двух моментов, мы можем ясно
пометить утверждения A и B как ограничения модели Бора.
двойственность, в то время как волновая механическая модель Шредингера описывает электроны как имеющие диапазон возможных положений. В любой момент времени электрон может оказаться ближе к ядру или дальше. Исходя из этих двух моментов, мы можем ясно
пометить утверждения A и B как ограничения модели Бора.
Описывая частицы, которые движутся по орбите предсказуемым образом, модель Бора предполагает, что положение и импульс атом может быть точно определен одновременно. Однако принцип неопределенности Гейзенберга гласит, что чем больше чем точнее вы определяете положение частицы в пространстве, тем более неточным вы измеряете ее импульс становится. Другими словами, мы не можем одновременно точно определить положение и импульс частицы. Этот является еще одним ограничением модели Бора, поэтому утверждение C верно.
Модель атома Бора ввела представление об электронах, занимающих орбиты с фиксированными энергиями. В результате это
невозможно для электрона вращаться вокруг ядра между фиксированными орбитами. Это приводит к списку разрешенных
переходы между орбитами с определенным энергетическим значением. На основании этих переходов и характеристических энергий
линейчатый спектр излучения атома водорода может быть очень точно объяснен. Однако менее успешно
для атомов с более чем одним электроном. Это делает утверждение E ограничением модели атома Бора.
Это приводит к списку разрешенных
переходы между орбитами с определенным энергетическим значением. На основании этих переходов и характеристических энергий
линейчатый спектр излучения атома водорода может быть очень точно объяснен. Однако менее успешно
для атомов с более чем одним электроном. Это делает утверждение E ограничением модели атома Бора.
Однако представление об электронах, занимающих квантованные энергетические уровни, все еще является частью современной атомной теории, поэтому утверждение D не является ограничением модели Бора.
Таким образом, правильным ответом будет утверждение D.
о положении электрона, но где он может быть. Затем мы вычисляем средние значения, чтобы понять поведение
электрон. Таким образом, в то время как в старом описании расстояние электрона от ядра оставалось постоянным,
волновая механическая модель описывает электроны как имеющие диапазон возможных положений. В любой момент времени электрон
может быть ближе к ядру или дальше.
Что более важно с математической точки зрения, так это распределение и его среднее значение. Когда у нас есть позиции с разными вероятностями используем распределение. Мы можем думать, что электрон находится на заданном расстоянии от ядра. на определенную долю времени. Иногда электрон находится близко к ядру, а иногда дальше. Однако большую часть времени электрон находится посередине, хотя положение волнообразного электрона становится очень сложным. так что это просто упрощение.
Пример 2. Определение расстояния от ядра, на котором наиболее вероятно обнаружение электрона на 1s-орбитали
На графике показана вероятность нахождения электрона на расстоянии от ядра на 1s-орбитали атома водорода. На каком приблизительном расстоянии от ядра наиболее вероятно найти электрон?
Ответ
Современная атомная теория, или, точнее, квантовая теория, описывает электрон как не занимающий круговую орбиту в
фиксированное расстояние от ядра, в отличие от модели Бора. Вместо этого электрон может занимать ряд различных положений,
хотя и с разной вероятностью. Мы можем думать, что электрон находится на заданном расстоянии от ядра в течение определенного времени.
доля времени.
Вместо этого электрон может занимать ряд различных положений,
хотя и с разной вероятностью. Мы можем думать, что электрон находится на заданном расстоянии от ядра в течение определенного времени.
доля времени.
Приведенный в вопросе график показывает вероятность нахождения электрона на расстоянии от ядра на 1s-орбитали атома водорода. По оси 𝑥 отложено расстояние от ядра в единицах пикометры (pm), а ось 𝑦 дает нам вероятность найти электрон на этом расстоянии. Чем выше значение на 𝑦-ось, тем больше вероятность найти электрон.
Здесь электрон находится на 1s-орбитали. Орбитали s-типа являются сферическими, поэтому нам нужно учитывать только расстояние от ядро, а не угол.
Из графика видно, что самая высокая точка на кривой и, следовательно, самое высокое значение на оси 𝑦,
происходит на расстоянии около 50 пм от ядра. Как вопрос
запрашивает только приблизительное расстояние, нам не нужно давать наш ответ с большей точностью.
Правильный ответ: 50 часов вечера.
Когда мы рассматриваем это поведение, мы начинаем говорить о вероятностях и распределении вероятностей для положения электрон известен как его волновая функция. Распределение вероятностей электронов может иметь сложную форму; однако в этом простой пример, мы будем придерживаться расстояния от ядра.
Эрвин Шрёдингер вывел формулу, связывающую это распределение вероятностей с энергией электрона, которая
соответствует энергиям модели Бора атома водорода. Уравнение выглядит обманчиво простым, но детали, стоящие за ним
невероятно сложны. Важно то, что такой подход к вероятности и электронным волнам позволил предсказать
того, как ведут себя системы с несколькими электронами. Это также позволило нам понять, как ведут себя электроны, когда они собираются вместе.
химические связи. Современная модель, которую открыл Шредингер, известна как волновая механическая модель атома. Решив уравнение Шредингера, можно определить уровни энергии и наиболее вероятное местоположение из
ядра электрона на каждом энергетическом уровне. Работа Шредингера привела к концепции электронного облака, области
пространства вокруг ядра, где мог бы находиться электрон. Это привело к атомным орбиталям, которые были намного сложнее
формы, чем круговые, плоские орбиты модели Бора. Однако уравнение Шредингера может быть решено точно только для
атом водорода.
Работа Шредингера привела к концепции электронного облака, области
пространства вокруг ядра, где мог бы находиться электрон. Это привело к атомным орбиталям, которые были намного сложнее
формы, чем круговые, плоские орбиты модели Бора. Однако уравнение Шредингера может быть решено точно только для
атом водорода.
Определение: Электронное облако
Электронное облако описывает область пространства вокруг ядра атома, где существует вероятность обнаружения электрон.
Определение: атомные орбитали
Атомные орбитали представляют собой трехмерные математические выражения, которые описывают часть электронного облака и являются наиболее вероятное местонахождение электрона в атоме.
Пример 3. Определение карты плотности, которая наилучшим образом описывает возможное расположение электрона атома водорода в соответствии с Квантовая теория
Какая из карт плотности наиболее точно отражает возможное расположение электрона в атоме водорода согласно квантовой теории атома?
Ответ
Каждая диаграмма состоит из большой черной точки (ядро) и нескольких маленьких синих точек (электронная плотность). Чем ближе
синие точки расположены друг к другу, тем больше вероятность найти электрон в этом положении. Вся эта неопределенность приходит
из-за волнообразной природы электронов, когда они находятся вокруг ядра.
Чем ближе
синие точки расположены друг к другу, тем больше вероятность найти электрон в этом положении. Вся эта неопределенность приходит
из-за волнообразной природы электронов, когда они находятся вокруг ядра.
Атом водорода имеет 1 электрон на 1s-орбитали. Этот электрон будет сильно притягиваться к ядру водорода и вероятно, находится близко к ядру. Чем дальше мы удаляемся от ядра, тем меньше шанс найти электрон.
Ответ А неверен, потому что есть шанс, что электрон может быть найден на любом расстоянии от ядра, а не только на фиксированных расстояниях. Эта диаграмма ближе к боровской модели атома.
Ответ B вполне хорош. Чем ближе к ядру мы подходим, тем плотнее становятся синие точки, указывая на то, что вероятность нахождение электрона увеличивается по мере приближения к ядру.
В ответе C точки имеют необычный рисунок, с областями, которые являются точечными, и областями, которые не являются точками. Это может произойти для
в возбужденном состоянии, но в основном состоянии атома водорода карта электронной плотности будет сферической
симметричный — это конфигурация с наименьшей энергией.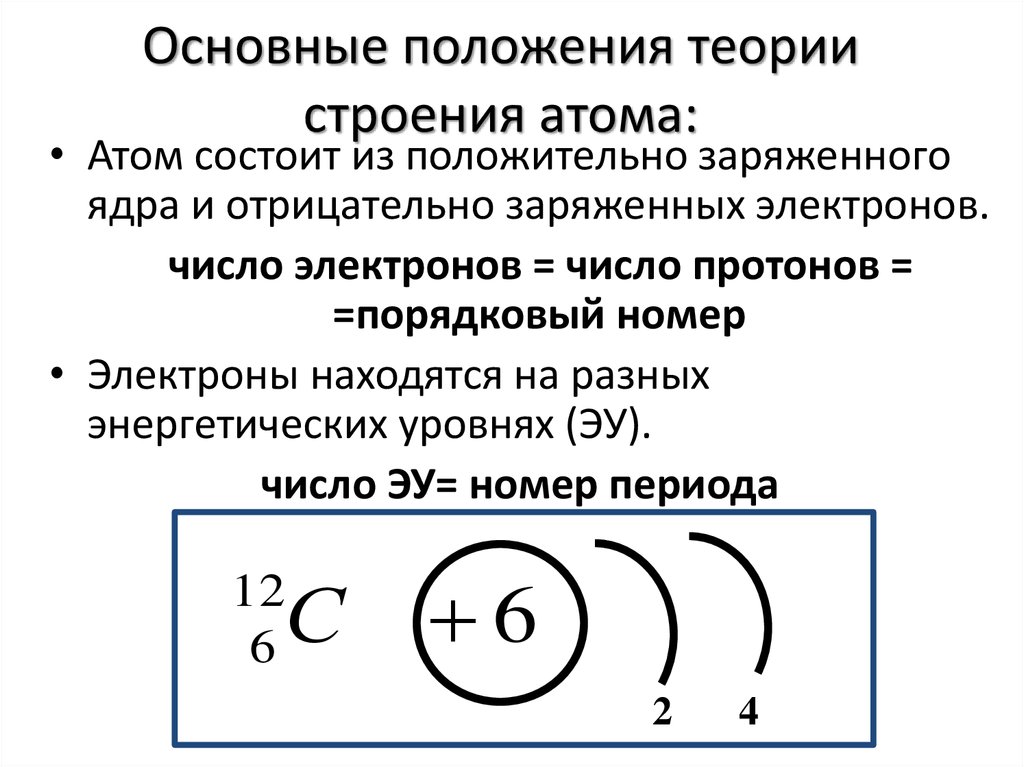 Следовательно, C неправдоподобен.
Следовательно, C неправдоподобен.
Ответ D имеет странные локальные пятна повышенной электронной плотности; нет причин для их формирования, поскольку нет ничего притягивать электрон помимо ядра.
Самая точная карта плотности та, которая показывает увеличение электронной плотности по мере приближения к ядру. Ответ: B.
Ключевые моменты
- Современная модель атома — это шаг вперед по сравнению с моделью Бора, в которой говорится, что электроны движутся по кругу. вращается вокруг ядра на фиксированных расстояниях.
- Модель Бора может учитывать только энергию атомов, таких как водород, с одним электроном.
- Модель Бора предполагала, что электроны обладают только корпускулярными свойствами, но электроны также обладают волновыми свойствами.
- В модели Бора электрон атома водорода будет вращаться вокруг ядра в двумерной плоскости, делая атом водорода по сути плоскостной.
- Модель Бора нарушает принцип неопределенности Гейзенберга, который является фундаментальной особенностью Вселенной.

- Принцип неопределенности Гейзенберга говорит нам, что чем точнее мы знаем положение частицы, тем меньше точно мы можем знать его импульс и наоборот.
- Волнообразная природа электрона является частью концепции, называемой корпускулярно-волновым дуализмом: частицы, подобные электроны также обладают волновыми свойствами.
- Современная теория атома, модель волновой механики, говорит нам, что электроны подобны стоячим волнам с распределения вероятностей их позиций. Эти распределения вероятностей известны как волновые функции.
- Решив уравнение Шредингера, можно определить допустимые уровни энергии системы и определить области пространства вокруг ядра, где может находиться электрон, известные как электронное облако.
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все СМИ
- Ключевые люди:
- Эрнест Резерфорд
Нильс Бор
Лев Давидович Ландау
Стивен Чу
Уильям Д.
 Филлипс
Филлипс
- Похожие темы:
- субатомная частица радиоактивность изотоп атомизм периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10 −10 метров.
Из чего состоит масса атома?
Масса атома состоит из массы ядра плюс массы электронов. Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статье Большая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц, см. субатомных частиц.
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобной единицей длины для измерения размеров атомов является ангстрем (Å), определяемый как 10 −10 метров. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метров пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метров. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метров пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метров. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе. Самое легкое ядро, атом водорода, в 1836 раз массивнее электрона, а тяжелые ядра почти в 500 000 раз массивнее.
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре.

 Это объясняло особенности
спектр излучения водорода.
Это объясняло особенности
спектр излучения водорода.

 Филлипс
Филлипс