Современная теория атома как – Справочник химика 21
Разрабатывая теорию химического строения, Бутлеров не ставил перед собой задачу выяснения природы химической связи, справедливо считая, что химия в то время еще не была готова к решению этой задачи. Действительно, необходимой предпосылкой создания теории химической связи было выяснение строения атома. Лишь после того, как стали известны основные черты электронной структуры атомов, появилась возможность для разработки такой теории. В 1916 г. Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам эта идея послужила исходным пунктом для разработки современной теории ковалентной связи. В том же 1916 г. В. Коссель предположил, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны при этом первый атом превращается в положительно заряженный, а второй [c.100]Для атома водорода уже в 1927 г.

Цветная реакция при взаимодействии борной кислоты с а-оксиантрахиноиами имеет место, главным образом, вследствие возникновения координационной связи за счет неподелен-ной пары электронов карбонильного атома кислорода, входящего в хромофорную систему сопряженных двойных связей, образование которой, в соответствии с современной теорией цветности органических соединений, всегда сопровождается резким углублением окраски [22].

Современная теория теплоемкости кристаллов выводит колебательный спектр, исходя из их структуры и конкретных характеристик межатомных взаимодействий. Объектом рассмотрения являются не только одноатомные, но и молекулярные многоатомные кристаллы (для описания межмолекулярных взаимодействий при этом обычно используются атом-атомные потенциалы). Учитывается ангармоничность колебаний, что особенно важно для описания теплоемкости в области высоких температур.
В первой главе, посвященной атому, сначала рассматриваются состав атома, затем его структура, коротко упоминаются основные модели, существовавшие до современной теории, базирующейся на квантовой механике. В конце главы приводятся некоторые из основных свойств атома. [c.7]
В экспериментальной практике исследования различных адсорбционных и коррозионных процессов в последние годы находят широкое применение тонкопленочные датчики из различных металлов [28].
Среди атомно-молекулярных систем, доступных наблюдению, особое место занимает атом водорода Причина этого заключается в следующем Фундаментальным положением, лежащим в основе всей современной теории микромира, является утверждение, что закон Кулона сохраняет свое действие и на расстояниях порядка 10 см Между тем, эТот закон получен изначально как результат обобщения макроскопических экспериментов (опыт с крутильными весами Кулона и с определением электрического поля внутри заряженной сферы Кавендиша) Более того, как будет показано в гл 2, вообще любые эксперименты с микрообъектами всегда являются только макроскопическими и косвенными Другими словами, залезть внутрь атома или молекулы с каким-нибудь измерительным прибором в принципе нельзя Проверить правильность того или иного утверждения можно только одним способом рассчитать макроскопический эффект на основе той или иной микроскопической модели объекта, а за-  27]
27]
Современная теория строения атома, основанная на квантовой (волновой) механике, представляет поведение электрона в атоме очень сложным. Электрон — частица определенной массы, движущаяся с большой скоростью. Вместе с тем электрон обладает и свойствами волны он движется по всему атомному объему и может находиться в любой части пространства вокруг ядра атом
Ради исторической точности следует отметить, что Уитмор определенно отрицал, что предполагаемое им промежуточное соединение является ионом карбония, и предпочитал выражение атом углерода с секстетом электронов в начале 30-х годов неодобрительно смотрели на ионы в качестве промежуточных продуктов реакций. Если иметь в виду, что в современных теориях важное место занимают ионные пары, то консерватизм Уитмора, возможно, имеет оправдание. [c.222]
В трех приведенных выше типах кристаллов связь рассматривалась на основе взаимодействия атом—атом. С тех же позиций обычно объясняют и возможность существования в природе твердых тел.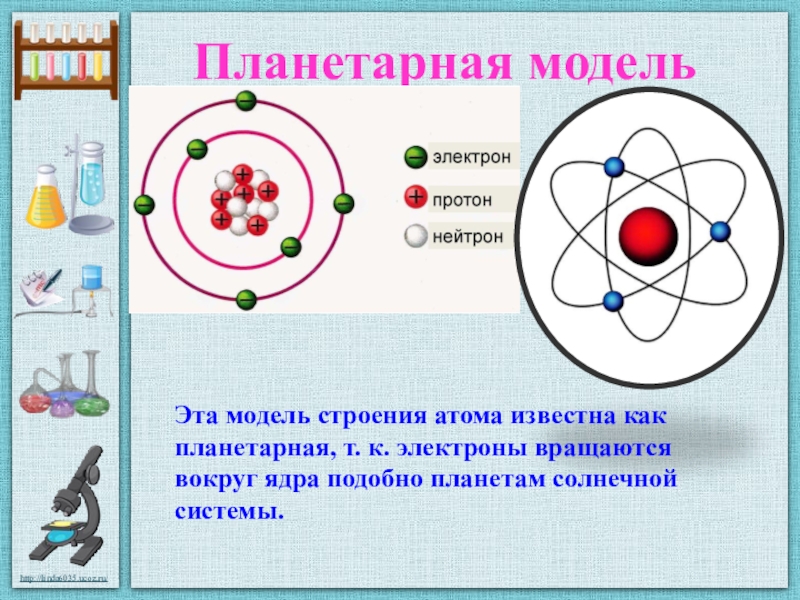
Разрабатывая теорию химического строения, Бутлеров не ста-вил перед собой задачу выяснения природы химической связи, справедливо считая, что химия в то время еще не была готова к решению этой задачи. Действительно, необходимой предпосылкой создания теории химической связи было выяснение строения атома. Лишь после того, как стали известны основные черты электронной структуры атомов, появилась возможность для разработки такой теории. В 1916 г. американский физико-химик Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам эта идея послужила исходным пунктом для разработки современной теории ковалентной связи.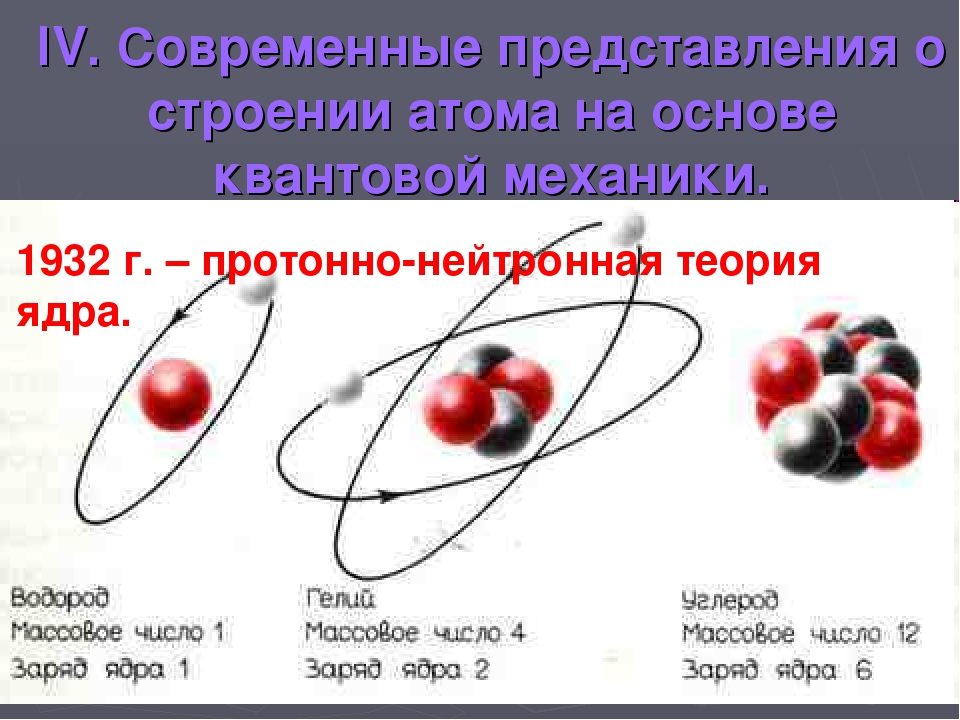
Усложнение атомов элементов есть результат развития, а не механического роста. Эту сушность периодического закона подтвердила и углубила современная теория строения атома. Усложнить атом элемента с точки зрения теории строения атома — значит ввести в ядро протон, а в электронную оболочку электрон. В результате такого количественного изменения появляется новый элемент с новыми свойствами. Такое развитие и наблюдается по периодам от элемента к элементу.
По современной теории строения вещества каждый атом состоит из положительно заряженного ядра, в котором сосредоточена ббльшая часть массы атома, и окружающих его электронов, число которых всегда достаточно для полной нейтрализации положительного заряда ядра. Химические свойства определяются поведением электронов и в значительной мере зависят от их числа. В свою очередь, число электронов определяется положительным зарядом [c.21]
Химические свойства определяются поведением электронов и в значительной мере зависят от их числа. В свою очередь, число электронов определяется положительным зарядом [c.21]
Современная теория строения карбоновых кислот подтверждает, что карбоксил сообщает этим органическим соединениям ярко выраженные кислотные свойства. Константа диссоциации монокарбоновых кислот примерно равна 10- —10- . Атом водо- [c.25]
Современная теория валентности не проводит резкой границы между ионной и ковалентной связью. Та и другая рассматриваются как результат образования общей электронной пары из электронов, принадлежащих атомам обоих элементов. Разница заключается лишь в том, что в случае ионной связи электронная пара переходит полностью к одному из атомов. Поэтому понятие о положительной и отрицательной валентности заменяется общим понятием об окислительном числе атома. Это число положительное, если при образовании молекулы электроны сместились от данного атома, й отрицательное, если они сместились к данному атому.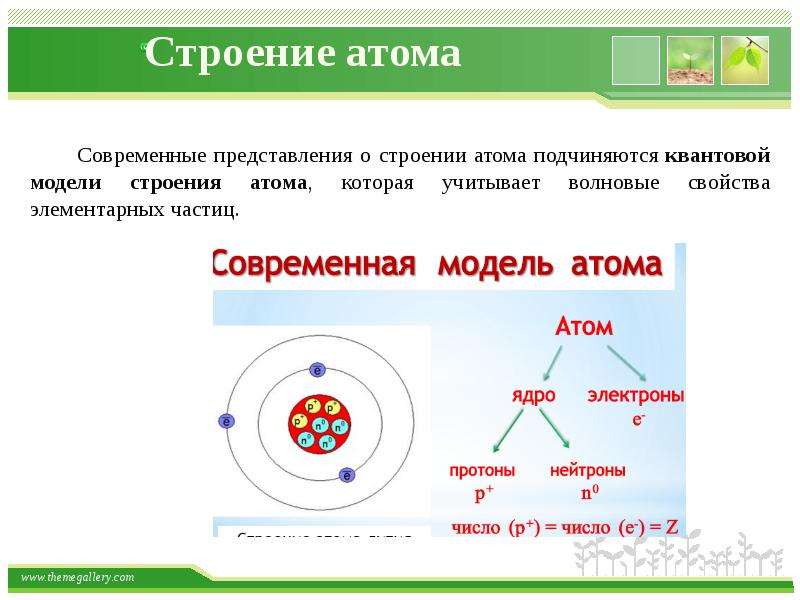 [c.59]
[c.59]
В старых теориях валентности стехиометрический состав химических соединений объяснялся тем, что каждый элемент имеет определенную валентность. Способ составления молекулярных формул (формул веществ) состоял в том, что символы атомов записывались в определенном порядке и соединялись штрихами так, что число штрихов, отходящих от каждого атома, отвечало валентности соответствующего элемента. В современной теории химической связи эти валентные штрихи получили особый смысл — во многих случаях, но никоим образом не во всех, они соответствуют локализованным атом- [c.44]
Кислород даже по отношению к электроотрицательным элементам всегда двухвалентен, в то время как S, Se и Те могут быть также четырех- и шестивалентными. Эти различия в поведении элементов VI группы объясняются современной теорией строения электронных оболочек атомов. Шесть валентных электронов кислорода находятся в L-слое (с главным квантовым числом п = 2). Для его заполнения необходимо всего два электрона, поэтому атом кислорода может иметь только две ковалентные связи — либо с двумя одновалентными атомами, либо с двухвалентным атомом или радикалом (двойная связь).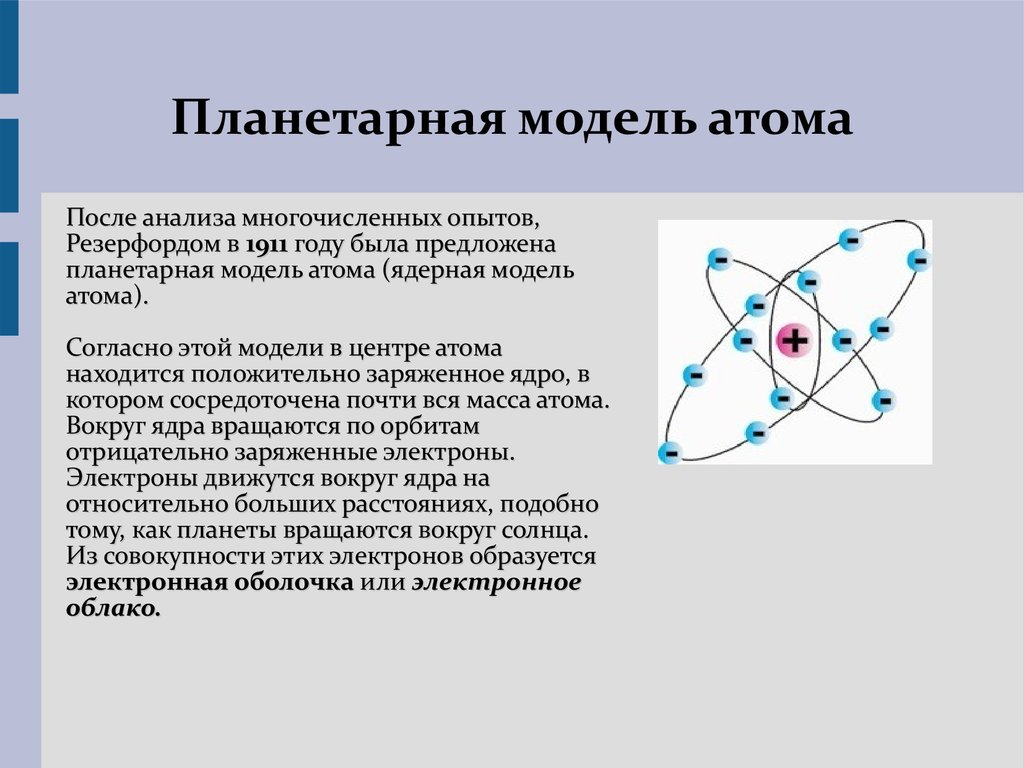 Для образования большего числа связей потребовались бы орбитали следующего М-слоя, что невозможно, так как их энергия значительно больше. Следовательно, во всех своих соединениях атом кислорода имеет в L-слое восемь электронов (полный октет). У атома S валентные электроны находятся [c.395]
Для образования большего числа связей потребовались бы орбитали следующего М-слоя, что невозможно, так как их энергия значительно больше. Следовательно, во всех своих соединениях атом кислорода имеет в L-слое восемь электронов (полный октет). У атома S валентные электроны находятся [c.395]
В 1913 г. Дж. Дж. Томсон в лекциях о физических и химических свойствах атома в свете современной теории и эксперимента, говорил Достиг. нутый прогресс почти всецело обусловливается тем обстоятельством, что мы электрифицировали атом . [c.330]
Гелий представляет собой вещество, интересное во многих отношениях. В нормальном состоянии гелий—одноатомный газ, и атом его настолько прост, что законы атомных взаимодействий могут быть достаточно хорошо описаны современной теорией, поэтому экспериментальное исследование уравнения состояния газообразного гелия, особенно при самых низких температурах, стало наиболее важным способом проверки далеко идущих теоретических выводов и послужило толчком к дальнейшим теоретическим исследованиям. [c.8]
[c.8]
Преобладание идей атомизма в общественном сознании, кроме очевидной пользы, имеет ряд отрицательных сторон. Атомизм привел к потере целостного восприятия мира, который был свойственен, например, в древних научных школах Платона, Аристотеля, Парацельса. Мир в работах большинства современных ученых предстал разорванным на отдельные куски, подобно телу и пространству в полотнах Пикассо (пример атомизма в живописи). Кроме того, идеализация лабораторных экспериментов, механическое перенесения их к масштабам природньЕх пространств и времен привели науку к оторванности от реальных процессов природы. Особенно ярко это выражается при изучении сложных технических, природных и социальных систем. Реальное понятие вещества и систем оказалось замененным графическими молекулярными символами, отдаленно схожими с реальными объектами. Это недопустимо при познании сложных по уровню организации экологических и ноосферных систем. Понятие атом и молекула, при переходе к таким системам, в ряде случаев теряет смысл. Например,, при исследовании нефти, почвы и аналогичных веществ из миллионов компонентов описать схему химической реакции принципиально невозможно. То же касается биопопуляций и социумов, с точки зрения современной теории систем, при расщеплении системы на части мы теряем свойства, отсутствующие у частей, [c.21]
Например,, при исследовании нефти, почвы и аналогичных веществ из миллионов компонентов описать схему химической реакции принципиально невозможно. То же касается биопопуляций и социумов, с точки зрения современной теории систем, при расщеплении системы на части мы теряем свойства, отсутствующие у частей, [c.21]
Связь параметра со стандартными мерами гибкости торможения вращения, не тождественна энергии /(ф) [формула (1.3)], введенной на основе других предположений. Некоторым парадоксом является то, что численное значение [ можно рассчитать с тем большей точностью, чем сложнее конфигурация првтомющегося звена. Например, различие свойств полиимидов ПФГ и ДФО (см. стр. 22) в значительной мере обус- [c.40]
Основы квантовомеханического рассмотрения атома водорода. Орбитали. Решения уравнения Шрёдингера даже для атома водорода весьма сложны. В то же время результаты, полученные при приложении квантовой механики к задаче атома водорода, имеют принципиальное значение для современной теории строения атомов вообще.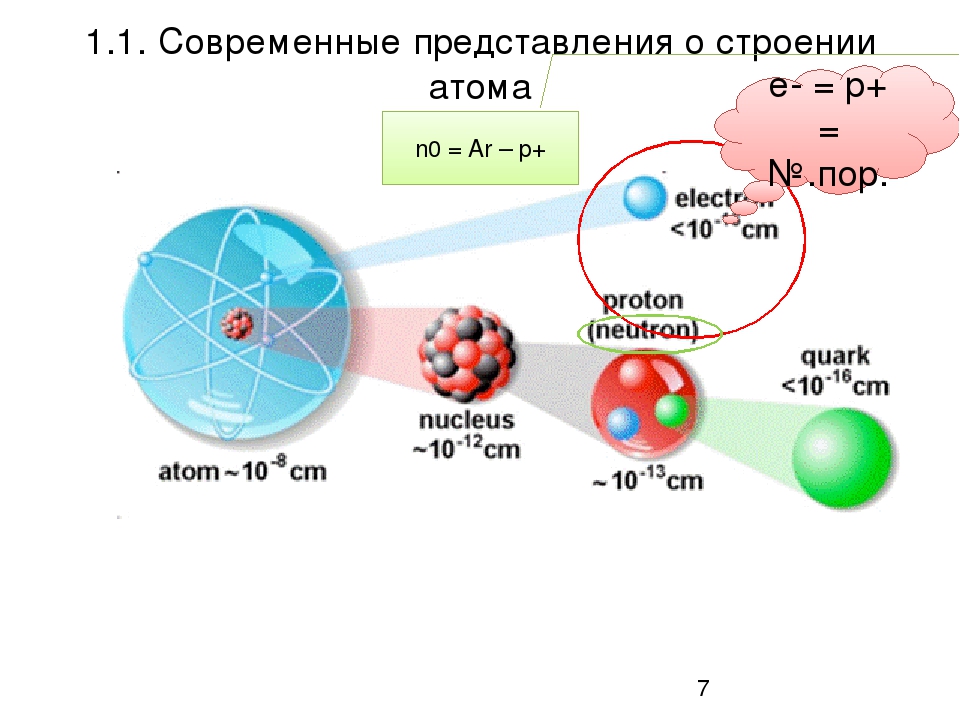 Поэтому рассмотрим лишь узловые вопросы квантовомеханического представления атома водорода, опуская математические частности. Уравнение Шрёдингера (П1.19) применительно к атому водорода запишется [c.40]
Поэтому рассмотрим лишь узловые вопросы квантовомеханического представления атома водорода, опуская математические частности. Уравнение Шрёдингера (П1.19) применительно к атому водорода запишется [c.40]
Опираясь на достижения всей этой весьма разветвленной школы советских исследов ате-лей, автор после краткого изложения основных положений современной теории горения в границах вопросов, интересующих нас в области поточных процессов, постарался заново пересмотреть основы технологии топочных процессов, которым посвящена наиболее развитая,, вторая часть книги. [c.3]
Вышеизложенная теория была развита на основе предположе ния о квазистационарном состоянии однако более строгий подход заключающийся в решении уравнения диффузии с зависящими от времени граничными условиями, приводит к тем же окончатечьным уравнениям Выражения, аналогичные уравнению (3 31), полу чаются и из других теоретических соображений, например при подходе к испарению капельки со стохастической точки зрения Мончик и Райс получили формулу для скорости испарения, ис пользуя функцию немаксвелловского распределения скоростей При дальнейшем развитии теории Фукса следует учитывать 1) разность между концентрацией пара Со у поверхности капли и величиной Ссс, соответствующей плоской поверхности 2) увели чение плотности электрического заряда капли в процессе испаре ния и 3) ван дер ваальсово взаимодействие между диффундирую щими молекулами и молекулами жидкой капли Можно показать однако, что рассматриваемые поправки для капелек радиусом более 0 01 мк в большинстве случаев незначительны впрочем как мы увидим ниже, первая из них имеет большое значение атя современной теории роста капелек в облаках [c. 101]
101]
Современная теория химической связи основана на квантовомеханическом рассмотрении системы из электронов и атомных ядер, причем предполагается, что решение соответствующих уравнений ведет к полному описанию этой системы. Как уже было указано в двух предшествующих главах, трудность состоит не в составлении уравнения Шрёдингера для конкретных задач, а в его решении. Поскольку даже для системы, состоящей всего из трех частиц, не существует точного решения, приходится вводить упрощающие предположения, т. е. по существу, рассматривать некоторые модельные системы. Уже то, что, как правило, изучаются изолированные системы (атом, молекула, твердое тело или системы, состоящие из нескольких подсистем), является определенным приближением, поскольку при этом влиянием окружающей среды, например влиянием растворителя, пренебрегают. [c.86]
Приведенное распределение электронов были бы очень трудно представить себе без привлечения гибридных орбиталей. Разумеетс. я, ранние попытки описания электронного строения СО с привлечением резонанса трех структур С+—О”, С = 0иС =0+ приблизительно одинакового веса были гораздо менее удовлетворительны, чем описания, основанные на современной теории, изложенной выше. Исходя из последней, можно понять также электронно-донорные свойства молекулы СО, проявляющиеся, например, в ее способности к образованию комплекса ВНз СО. Действительно, атом С имеет пару электронов (неподеленная пара, п. 5), облако которых сильно направлено в сторону от связи СО и которые могут легко заполнить первоначально незаполненный октет атома В. [c.241]
я, ранние попытки описания электронного строения СО с привлечением резонанса трех структур С+—О”, С = 0иС =0+ приблизительно одинакового веса были гораздо менее удовлетворительны, чем описания, основанные на современной теории, изложенной выше. Исходя из последней, можно понять также электронно-донорные свойства молекулы СО, проявляющиеся, например, в ее способности к образованию комплекса ВНз СО. Действительно, атом С имеет пару электронов (неподеленная пара, п. 5), облако которых сильно направлено в сторону от связи СО и которые могут легко заполнить первоначально незаполненный октет атома В. [c.241]
До 1930 г. было проведено значительное число исследований по присоединению различных аддендов к несимметричным олефинам с целью формулирования правил, которые привели бы в соответствие наблюдаемую ориентацию присоединения с современными теориями ионных реакций. Было найдено, что в большинстве случаев применимо правило Марковникова [3], согласно которому катионная часть адденда атакует углеродной атом с большим числом водородных атомов, т. е. реакция идет с образованием наиболее устойчивого промежуточного карбониевого иона. Для некоторых случаев, в том числе для присоединения бромистого водорода, были получены противоречивые результаты классическим примером этого является бромистый аллил. Теоретически реакция между бромистым водородом и бромистым аллилом может идти по одному из двух направлений [c.346]
е. реакция идет с образованием наиболее устойчивого промежуточного карбониевого иона. Для некоторых случаев, в том числе для присоединения бромистого водорода, были получены противоречивые результаты классическим примером этого является бромистый аллил. Теоретически реакция между бромистым водородом и бромистым аллилом может идти по одному из двух направлений [c.346]
Понятие правильная система точек весьма существенно для современной теории структуры кристаллов. В каждой точке системы располагается материальная частица (атом или ион). Таким образом, правильная система есть совокупность кр1исталлохимически тождественных материальных частиц (или, точнее, их центров тяжести) в кристаллической структуре. Понятие правильной системы точек вполне аналогично понятию простой формы кристалла. В самом деле, простой формой в кристаллографии называют такой многогранник, который получается из одной грани в результате повторения ее в пространстве всеми элементами симметрии, присущими виду симметрии, к которому принадлежит данный кристалл. Кристаллический многогранник может состоять из одной простой формы или из нескольких, т. е. представлять собой комбинацию простых форм. Различно ориентированная по отношению к элементам симметрии исходная грань будет образовывать для одного и того же вида симметрии различные по форме многогранники — различные простые формы. [c.35]
Кристаллический многогранник может состоять из одной простой формы или из нескольких, т. е. представлять собой комбинацию простых форм. Различно ориентированная по отношению к элементам симметрии исходная грань будет образовывать для одного и того же вида симметрии различные по форме многогранники — различные простые формы. [c.35]
Современная теория строения атома, принимающая, что атом состоит из ядерной массы и электронов, стремится свести силы химического сродства к электрическим силам. Эта теория предполагает, что электроны располагаются в определенном порядке вокруг ядра, образуя ряд с4 р, с определенным количеством электронов в каждой. Электроны, находящиеся в наружной сфере, наиболее легко подвергаются внешним воздействям, в результате чего может происходить отделение электрона от данного атома и присоединение его на внешнюю сферу другого атома. Вследствие того, что наиболее устойчивым состоянием считается такое, когда на внешней сфере будет 8 электронов, количество присоединяющихся электронов к данному атому будет равно количеству, недостающему до 8 электронов.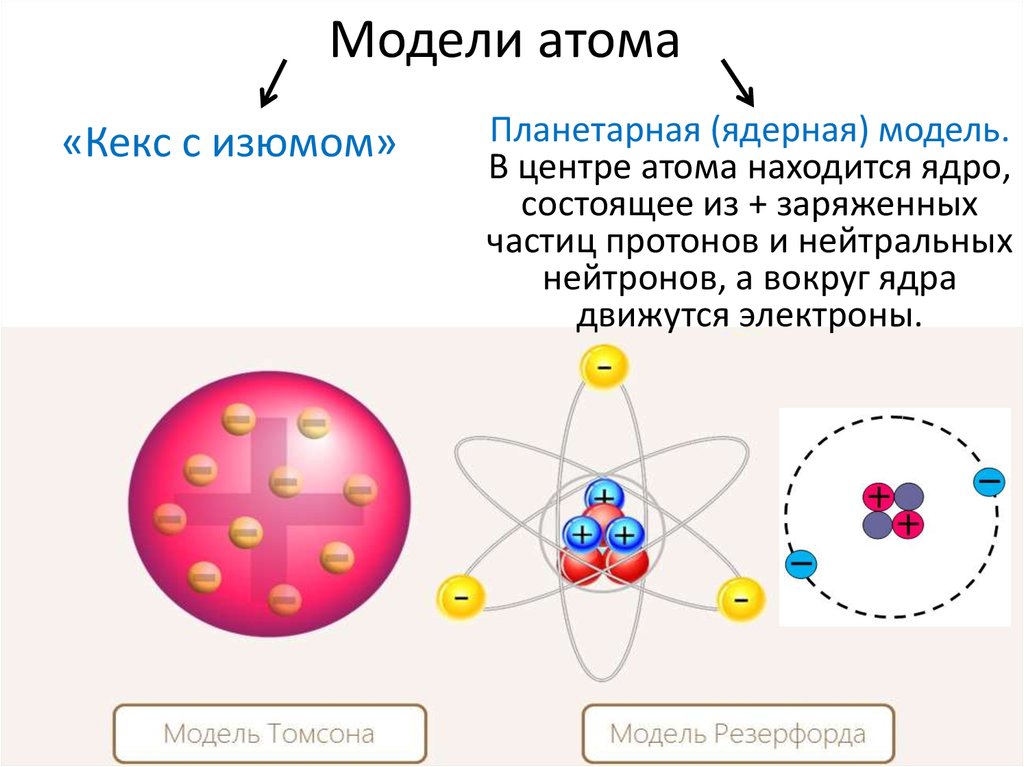 То же относится к числу отделяющихся электронов могут отделиться только электроны, находящиеся на внешней сфере, так как за ней внутри находится сфера, обычно, с полным набором электронов. [c.50]
То же относится к числу отделяющихся электронов могут отделиться только электроны, находящиеся на внешней сфере, так как за ней внутри находится сфера, обычно, с полным набором электронов. [c.50]
Согласно современной теории цветности в красителях трифенилметанового ряда двойные и простые связи не занимают строго фиксированного положения, и центральный углеродный атом находится в сопряжении со исеми тремя бензольными ядрами. Однако при написании формул трифе-нилметановых красителей авторы для упрощения обычно пользуются хи-1ЮИДНЫМИ структурами. [c.27]
Из изложенных представлений о путях попадания водорода в электролитический металл видно, что чем больще адсорбция водорода на данном металле или способность водорода образовывать гидриды с данным металлом, тем больше должен наводороживаться металл в процессе электроосаждения. Для подтверждения этого заключения можно сопоставить способность металла к наводороживанию в процессе электроосаждения с перенапряжением выделения водорода на металле, поскольку, согласно современным теориям перенапряжения водорода [25], высокая энергия адсорбции ато- [c. 269]
269]
Диссоциативный механизм (З ) для шестикоординированных комплексов предполагает образование пятикоординированного интермедиата. Стереохимические следствия образования тетрагонального пирамидального или тригонального бипирамидального интермедиата обсуждались в [2]. Эти две структуры, видимо, наиболее вероятны, так как 1) известны устойчивые соединения с такими структурами, 2) эти структуры могут быть получены из октаэдрической с небольшими перемещениями атомов и 3) такие структуры соответствуют современным теориям связи в комплексах металлов. Очевидно, что реакции как цис-, так и транс-ША ВХ через тетрагональный пирамидальный интермедиат могут идти без перегруппировки (рис. 4.3). Это предполагает, что вступающая группа V занимает место, освобождаемое группой X. По-видимому, это справедливо, потому что центральный атом наиболее доступен в этом направлении и потому что образование нового октаэдра не требует дополнительного перемещения атомов. Более того, 10 теории валентных связей пространственные свойства вакантной d sp -тll6-ридной орбитали соответствуют максимальному перекрыванию с орбитальными электронами вступающей группы.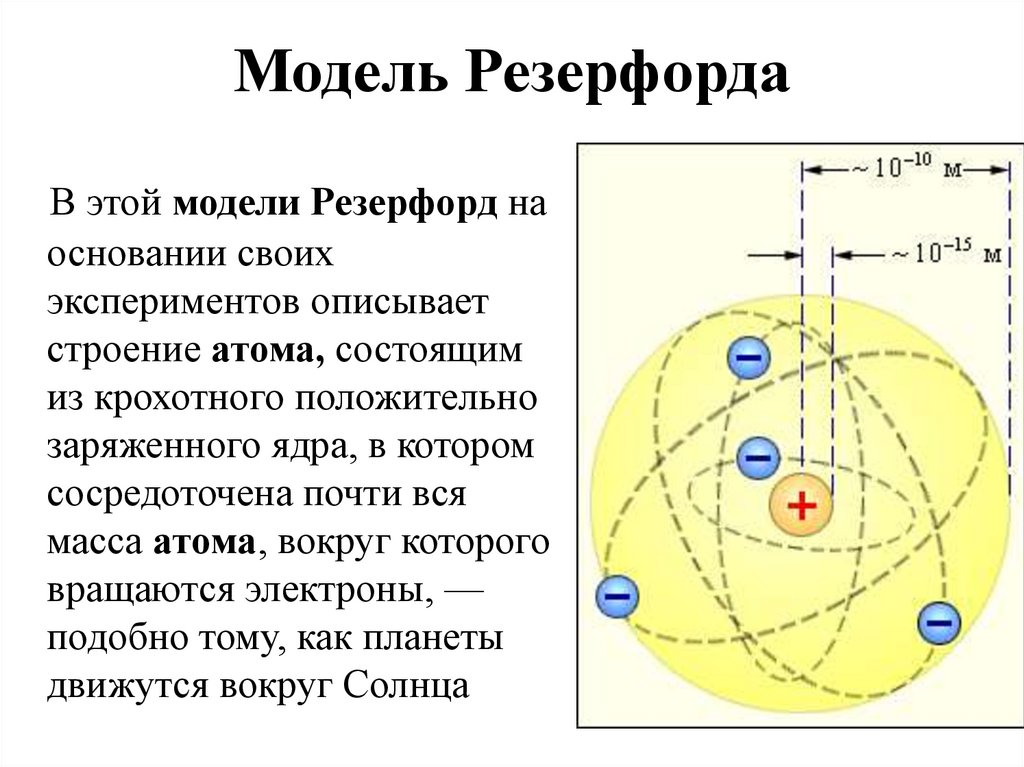 Альтернативно, согласно теории кристаллического поля, нуклеофильная атака по этому положению также предпочтительна вследствие низкой электронной плотности. [c.221]
Альтернативно, согласно теории кристаллического поля, нуклеофильная атака по этому положению также предпочтительна вследствие низкой электронной плотности. [c.221]
Теория валентности Лондона. Как было отмечено выше, Льюис обратил внимание на устойчивость электронного октета. Но существуют соединения и ионы, для которых требуется допустить, что центральный атом окружен больше чем восемью электронами, как, например РС1д, 8Рб, (СоС1б)—. Лондон [4] выдвинул более современную теорию, которая охватывает и эти случаи. Здесь эта теория изложена в несколько видоизмененной форме. [c.156]
Мезонные теории ядерных сил. Качественное подобие химических и ядерных сил некогда побудило ученых, а именно Юкаву [3], исследовать возможность объяснения ядерных сил обменом какой-то частицей между двумя нуклонами, аналогично химической Связи, зависящей от обмена электроном между двумя атомами. Это не означает, что нуклон при этом рассматривается как сложная частица (подобно атому), поскольку считается, что участвующая в обмене частица возникает лишь в момент излучения ее одним нуклоном и исчезает в момент поглощения другим. Процессы такого рода, в которых имеет место обмен виртуальными частицами, фигурируют во всех аспектах современной теории поля, выходящей за пределы классической концепции действия на расстоянии. Так, например, кулоновское взаимодействие двух заряженных частиц в настоящее время анализируется посредством обмена виртуальными фотонами между этими зарядами. Возникновение виртуальной частицы сразу ставит вопрос о сохранении энергии, поскольку для ее создания необходима энергия. Откуда же берется необходимая энергия Ответ ниоткуда как раз и означает, что частица является виртуальной сохранение энергии обеспечивается тем, что частица живет не слишком долго. Принцип неопределенности Гейзенберга утверждает, что [c.277]
Процессы такого рода, в которых имеет место обмен виртуальными частицами, фигурируют во всех аспектах современной теории поля, выходящей за пределы классической концепции действия на расстоянии. Так, например, кулоновское взаимодействие двух заряженных частиц в настоящее время анализируется посредством обмена виртуальными фотонами между этими зарядами. Возникновение виртуальной частицы сразу ставит вопрос о сохранении энергии, поскольку для ее создания необходима энергия. Откуда же берется необходимая энергия Ответ ниоткуда как раз и означает, что частица является виртуальной сохранение энергии обеспечивается тем, что частица живет не слишком долго. Принцип неопределенности Гейзенберга утверждает, что [c.277]
Атомная теория » HimEge.ru
Модель атома азота
Все тела окружающие нас, несмотря на их разнообразие, состоят из мельчайших частиц — атомов, состоящих, в свою очередь, из еще меньших частиц — протонов, нейтронов и электронов.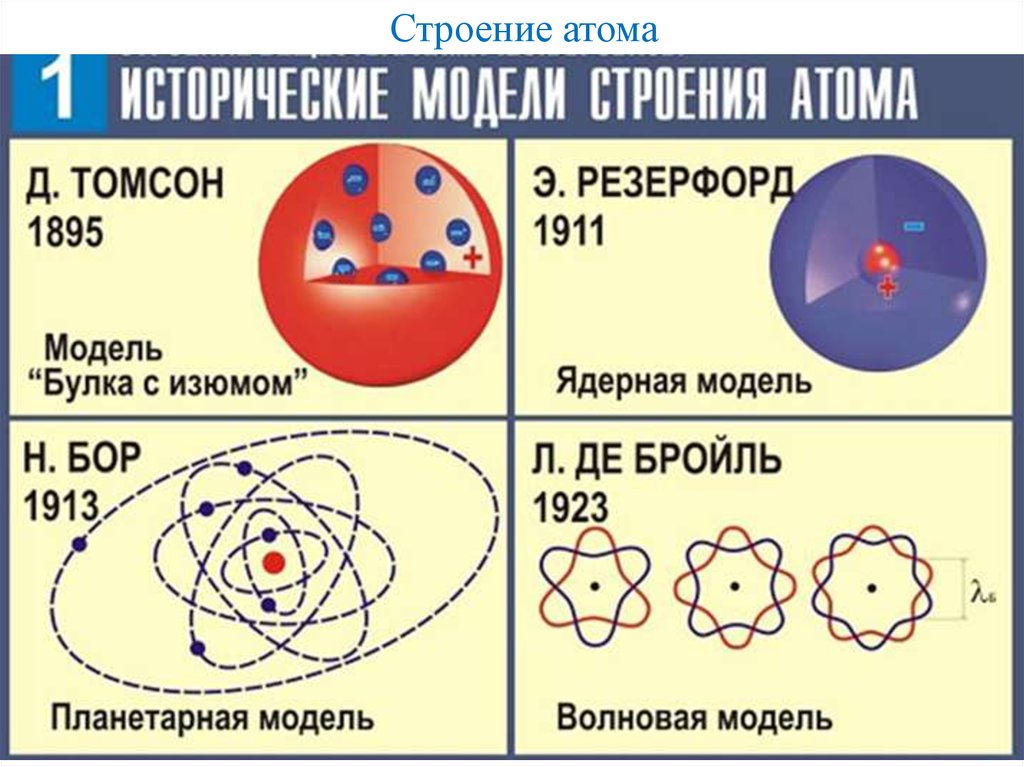 Это стало известно относительно недавно, атом долгое время считался неделимой частицей, т.е простейшей (см историю развития представлений об атоме).
Это стало известно относительно недавно, атом долгое время считался неделимой частицей, т.е простейшей (см историю развития представлений об атоме).
В основе современной теории строения атома лежат следующие основные положения:
- Атом состоит из ядра и электронной оболочки
- Электронная оболочка – совокупность движущихся вокруг ядра электронов
- Ядра атомов заряжены положительно, они состоят из протонов p и нейтронов n (вместе носят название нуклоны).Заряд ядра равен сумме протонов (обозначены красным цветом на рисунке).
- Атом в целом электронейтрален, число электронов е– равно числу протонов p+ , равно порядковому номеру элемента в таблице Менделеева. Именно заряд ядра является основной характеристикой атома и определяет его положение в таблице Менделеева. Хими́ческийэлеме́нт — совокупность атомов с одинаковым зарядом ядра.
Например, водород, первый элемент таблицы, имеет самое простое строение – его ядро представляет собой одни протон, а электронная оболочка состоит из одного электрона.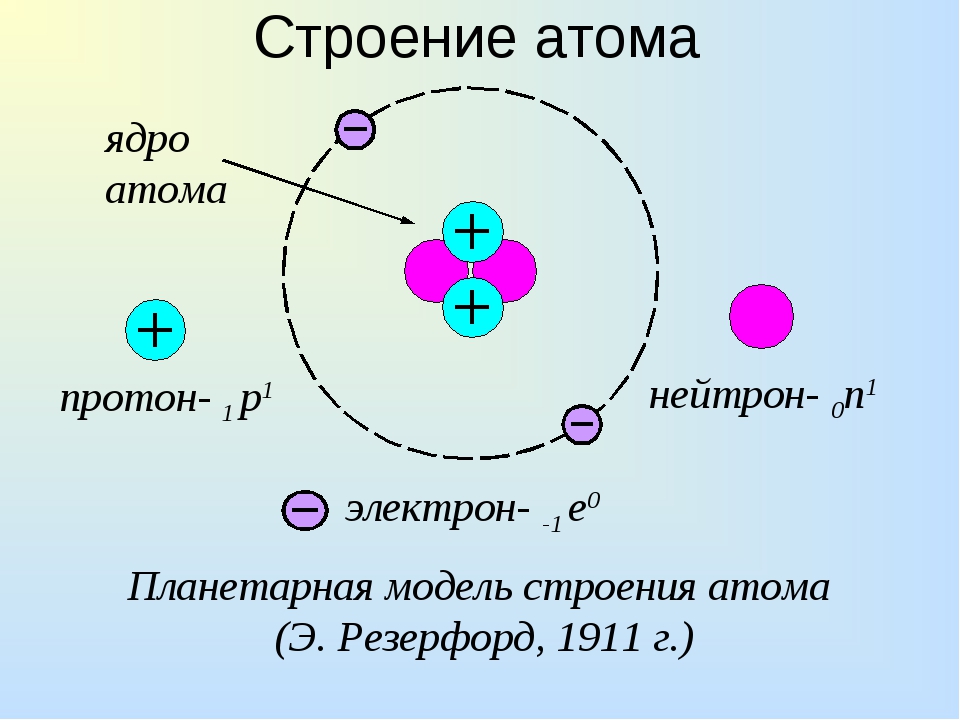 Атом бора имеет порядковый номер 5, это значит, что заряд ядра атома бора =+5, ядро содержит 5 протонов, электронная оболочка содержит 5 электронов.
Атом бора имеет порядковый номер 5, это значит, что заряд ядра атома бора =+5, ядро содержит 5 протонов, электронная оболочка содержит 5 электронов.
- Если атом присоединяет или отдает электроны (несущие отрицательный заряд) то его электронейтральность нарушается, он превращается в отрицательно или положительно заряженный ион соответственно.
При образовании положительно заряженного иона количество электронов уменьшается (на величину заряда данного иона), а при образовании отрицательно заряженного иона количество электронов увеличивается (на величину заряда данного иона).
Э0-ne—=Эn+
Э0+ne—=Эn-
В атомах имеются небольшие тяжелые ядра, в состав которых входят протоны и нейтроны и в которых сосредоточена почти вся масса атома. Большая часть атома заполнена электронами и представляет собой почти пустое пространство.
Большая часть атома заполнена электронами и представляет собой почти пустое пространство.
Помимо заряда ядра, ещё одной важной характеристикой атома является его масса или массовое число. Вся масса атома сосредоточена в маленьком ядре, массой электронов пренебрегают, тк масса электрона почти в 2000 раз меньше массы протона. Массовое число равно сумме числа протонов и нейтронов в ядре. Например, у кислорода, массовое число = 16, тк его ядро содержит 8 протонов (красные кружочки) и 8 нейтронов (белые кружочки).
В природе существуют атомы одного элемента, т.е имеющие одинаковый заряд ядра, но разные массовые числа — изотопы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место», занимают одно и то же «место» в таблице Менделеева). У них число протонов одинаково, но разное число нейтронов. У элемента водорода существует три изотопа: протий – с массовым числом 1, Дейтерий – с массовым числом 2 (D2O – тяжелая вода), и радиоактивный тритий с массовым числом 3.
В таблице Менделеева приведена относительная атомная масса — среднее арифметическое масс изотопов с учетом их % содержания в земной коре.
Количество нейтронов не указывается в таблице, поэтому чтобы рассчитать число нейтронов, нужно из массы атома (указывается в задании) вычесть порядковый номер (число протонов).
В химических реакциях состав ядер атомов не изменяется (искл. ядерные реакции – не рассматриваются в данном курсе, область изучения физики), изменяться может только состав электронной оболочки (количество электронов). Поэтому нам важно знать, каким образом располагаются электроны в атоме, т.е строение электронных оболочек атомов.
Электроны расположены в трехмерном пространстве вокруг ядра атома. Внутри этого пространства имеются области, в которых могут располагаться электроны. Эти области называются орбиталями. Каждая орбиталь характеризуется размером, формой и ориентацией внутри атома, и каждой присвоено буквенно-цифровое обозначение.
Хотя в атоме имеется большое число орбиталей, в обычных условиях только сравнительно малая их часть занята электронами. Ниже приводится список общепринятых обозначений первых (т. е. ближайших к ядру) восемнадцати орбиталей. Цифра (номер) характеризует размер или средний диаметр орбитали, а буква — форму орбитали. s-Орбиталь представляет собой сферу, центр которой совпадает с центром (ядром) атома, а три р-орбитали напоминают объемные восьмерки, оси которых перпендикулярны друг другу. Таким образом, 1s-орбиталь — сферическая и наименьшая по размерам; 2s-орбиталь — также сферическая, но большего размера; 2р-орбитали имеют форму восьмерок и по размеру сопоставимы с 2s-орбиталью. d-Орбитали имеют более сложную форму.
Орбитали группируются в соответствии с их размерами и эти группы называются слоями или оболочками или энергетическими уровнями. В первой электронной оболочке имеется лишь одна орбиталь — 1s. На второй оболочке их уже четыре, а на третьей — девять. Каждая орбиталь может быть свободной (пустой) или занятой одним или двумя электронами. Заметим, что в каждой оболочке (кроме первой) существует три р-орбитали и пять d-орбиталей (во всех оболочках, кроме двух первых). Поскольку на каждой орбитали может находиться по 2 электрона, группу р-орбиталей могут занимать не более 6 электронов, а группу d-oрбиталей — 10 электронов.
Каждая орбиталь может быть свободной (пустой) или занятой одним или двумя электронами. Заметим, что в каждой оболочке (кроме первой) существует три р-орбитали и пять d-орбиталей (во всех оболочках, кроме двух первых). Поскольку на каждой орбитали может находиться по 2 электрона, группу р-орбиталей могут занимать не более 6 электронов, а группу d-oрбиталей — 10 электронов.
Электроны сначала занимают орбитали низших слоев и только затем — орбитали более высоких уровней. Легкость заполнения орбиталей уменьшается от начала к концу списка. Иными словами, электроны, занимающие более высокие орбитали, имеют большую энергию.
Ниже приведены электронная конфигурация атомов кислорода и серы.
Подробнее про Строение электронных оболочек атомов
Основные положения теории четырёхмерного строения атома: zonasingularn — LiveJournal
В. С. Забирко
Основные положения теории четырёхмерного строения атома
Введение
В основу настоящей работы положены два простых, если не сказать “наивных”, вопроса.
Первый вопрос: Каким образом электромагнитные волны распространяются в вакууме?
Известно, что звуковые волны распространяются в материальной среде благодаря колебаниям самой среды. По аналогии с этим следовало ожидать и “колебаний вакуума”, в связи с чем появилась теория эфира – некоей материальной субстанции, чьи колебания якобы передают в вакууме электромагнитные волны. Существование эфира не подтвердилось (хотя в последнее время делаются попытки возродить теорию), и с тех пор вопрос передачи электромагнитных волн в вакууме повис, что называется, в пустоте. Точнее, в современной физике принято бездоказательное положение, что электромагнитное поле является самостоятельным физическим объектом, не нуждающимся в специальном носителе.
Но так ли это? Рассмотрим, какими физическими характеристиками обладает вакуум. Казалось бы, праздный вопрос: абсолютная пустота на то и пустота, чтобы не обладать физическими характеристиками. И всё же вакуум имеет одну неотъемлемую и неоспоримую характеристику – метрику. То есть вакуум можно охарактеризовать как абсолютно пустое пространство. Откуда на основе простого логического заключения можно выдвинуть предположение, что именно колебания метрики пространства и передают электромагнитные волны. То есть пространство является самостоятельным физическим объектом. Приняв это предположение за основу, следует допустить, что если пространство способно колебаться, то ему свойственны также и другие возмущения (искривление, завихрение и т.п.).
Второй “наивный” вопрос: Почему физические законы микромира столь разительно отличаются от физических законов макромира?
В средние века, когда небо представлялось двухмерной сферой, утверждалось, что механика движения планет по небесному своду иная, чем механика движения материальных тел на Земле. При этом были выведены формулы небесной механики, многие из которых до сих пор используются в астрономии и навигации. Однако затем оказалось, что никакой небесной сферы нет, Вселенная трёхмерна, и механика движения планет соответствует физическим законам земного мира.
По аналогии с этим можно предположить, что на самом деле Вселенная не трёхмерна, а многомерна, и физические законы микромира ничем не отличаются от законов макромира, поскольку физические процессы в многомерной Вселенной при их проекции в трёхмерный мир подвержены такой же аберрации, какой подвержено движение планет при его проекции из трёхмерной Вселенной на двухмерную небесную сферу.
Взяв эти два допущения за основу, было предположено, что атом является четырёхмерной структурой и его современная модель представляет собой трёхмерную проекцию. Рассмотрение этого предположения в основной части работы привело к тому, что многие постулированные представления о строении атома получили не только иную трактовку, но и объяснение, почему существует то или иное явление. В частности, показано: почему электроны в электронном облаке имеют противоположные спины; почему (в противовес постулированному эффекту электронного сжатия) происходит видимое уменьшение радиуса атомов в периоде; почему электронные облака s-подуровня имеют сферическую форму, а p-подуровня – форму гантели; что представляет собой “дефект массы”; каким образом происходит квантование энергии и пр.
Логичность и непротиворечивость полученных выводов косвенно подтверждает правильность допущений, заложенных в основу данной теории. Наконец, сама теория позволила выдвинуть предположение, что же собой представляет материя.
Основная часть
Любое материальное тело ограничено в пространстве своей поверхностью. Говоря языком математики, трёхмерное пространство материального тела ограничено замкнутым двухмерным пространством. Все возможные варианты поверхностей материальных тел располагаются между двумя крайними примерами: сферой (замкнутым двухмерным неевклидовым пространством) и многогранником (рядом смежных двухмерных евклидовых пространств). Если предположить, что атом имеет четырёхмерное строение, тогда следует допустить (по аналогии с вышесказанным), что четырёхмерное ядро ограничено замкнутым трёхмерным пространством. Приняв это допущение за основу, можно предположить, что таким замкнутым трёхмерным пространством, скорее всего, является электронная оболочка, и современная теория строения атома базируется на данных, регистрируемых с проекции четырёхмерного атома в трёхмерное пространство.
Представить четырёхмерное пространство невозможно, поэтому рассмотрим строение атома по принципу аналогий, для чего создадим упрощённую модель: четырёхмерное ядро представим трёхмерным шаром, электронную оболочку – поверхностью этого шара (двухмерным неевклидовым пространством), а трёхмерное пространство наблюдателя – евклидовой плоскостью. Иначе говоря, уменьшим порядок каждого пространства на единицу.
Если на электронную оболочку (сферу) этой модели помесить два электрона, то, как бы они ни перемещались, электроны всегда будут находиться в полярных друг другу точках сферы. Проекция такой электронной оболочки на плоскость наблюдателя будет представлять собой круг, по которому “бегают” два электрона, но при этом один из них ВСЕГДА будет вывернут (инвертирован) относительно другого. А что это, как не двухмерная аналогия s-подуровня, где все квантовые числа электронов равны и только спиновые квантовые числа противоположны? На основании этого можно предположить, что в действительности пространство s-подуровня представляет собой замкнутое трёхмерное пространство, а спины электронов не что иное, как регистрация наблюдателем их взаимной инверсии.
Каким образом тогда может выглядеть p-подуровень? Рассмотрим следующую модель в виде куба, в которой якобы трёхмерное пространство ядра замкнуто якобы двухмерными гранями электронной оболочки, где каждая грань представляется пространством отдельно взятого электрона. В проекции куба на плоскость наблюдателя рёбра куба пересекаются, а грани частично или полностью накладываются друг на друга. Одновременно с этим видно, что проекции противоположных параллельных граней куба ВСЕГДА инвертированы относительно друг друга. То есть, если проекция одной грани куба будет лицевой, то проекция противоположной параллельной грани ВСЕГДА изнаночной (инвертированной). Проведём через центры противоположных граней линии и назовём их ориентационными осями (ОО) параллельных пространств. В данной модели таких осей будет три, и углы между этими ОО и плоскостью наблюдателя будут одинаковыми (обоснование равенства углов будет рассмотрено позже).
Вообразив, что ОО куба являются осями электронных облаков p-подуровня, можно предположить, что в реальности вокруг четырёхмерного ядра атома на p-подуровне существует шесть трёхмерных пространств, каждое из которых занимает отдельный электрон. Проекция этих пространств в трёхмерное пространство наблюдателя в точности совпадает с пространством куба, однако каждое из пространств будет расположено под углом к пространству наблюдателя и ориентировано по соответствующей ОО. При этом пара совмещённых трёхмерных пространств, находящихся на одной ОО, полностью совпадет по своей ориентации к пространству наблюдателя, и эти пространства будут отличаться только центральной симметрией относительно друг друга (проще говоря, будут инвертированы друг в друге). Из чего следует, что такую пару пространств можно охарактеризовать как трёхмерное пространство, замкнутое на себя в четырёхмерном.
Представить замкнутое трёхмерное пространство невозможно, но составить представление о нём можно по аналогии с кольцом Мёбиуса, которое получается из полоски бумаги, имеющей две параллельные, инвертированные относительно друг друга плоскости – лицевую и изнаночную стороны. Искривляя эти две параллельные евклидовы плоскости в трёхмерном пространстве и замыкая полоску в кольцо так, что лицевая поверхность переходит в изнаночную, мы получаем замкнутое двухмерное пространство. Если мы разместим на кольце Мёбиуса два “плоских” (двухмерных) электрона с диаметром, равным ширине полоски, допустив при этом, что сила отталкивания действует только в двухмерном пространстве, то электроны разместятся на наибольшем друг от друга расстоянии по плоскости кольца. При этом в трёхмерном пространстве они окажутся точно друг под другом, причём в инвертированном положении. То есть аналогия кольца Мёбиуса с замкнутым трёхмерным пространством очевидна.
Чтобы понять дальнейшие рассуждения, рассмотрим простой пример, когда пузырёк воздуха (трёхмерный объект, ограниченный замкнутым двухмерным пространством), поднимаясь со дна водоёма, “протыкает” водную поверхность (евклидову плоскость). При этом молекулы воздуха внутри пузырька будут контактировать с поверхностью водоёма только в том случае, если они касаются сферы пузырька воздуха. Откуда следует, что в случае, когда трёхмерное образование (шар) контактирует с плоскостью наблюдателя, то любые трёхмерные объекты внутри шара, проецируясь на плоскость внутри круга (проекции шара), могут косвенным образом регистрироваться на евклидовой плоскости наблюдателя, но в то же время не иметь с ней контакта. По аналогии с этим следует допустить, что вокруг ядра атома существует шарообразная трёхмерная проекция “зоны четырёхмерного пространства” и любые объекты внутри этой зоны будут иметь контакт с нашим трёхмерным пространством только в том случае, если они соприкасаются с границей раздела между зоной четырёхмерного пространства и трёхмерным пространством, либо выходят за границу раздела.
В свете изложенного, рассмотрим упрощённую схему строения элементов в периодической системе на основе существующей в настоящее время теории строения атома, учитывая при этом, что регистрируемые электронные облака являются проекцией из четырёхмерного пространства.
Атом водорода имеет один электрон, который легко отрывается от ядра (протона), поскольку электронное облако практически всё находится вне зоны проекции четырёхмерного пространства вокруг ядра. Поскольку ядро атома гелия увеличивается по сравнению с ядром (протоном) атома водорода, увеличивается вокруг него и зона четырёхмерного пространства, в то время как электронное облако остаётся прежнего размера и оказывается полностью поглощённым четырёхмерным пространством вокруг ядра (что, кстати, и объясняет инертность гелия, электронное облако которого имеет исключительно пограничный контакт с трёхмерным пространством, из-за чего гелий вступает в химические реакции только в возбуждённом состоянии, когда электронное облако выходит за границы четырёхмерного пространства).
Такую электронную оболочку можно считать “плотно упакованной”, и строительство элементов второго периода фактически происходит уже не вокруг ядра, а вокруг атома гелия. И здесь оказывается, что пространство вокруг этой системы (в дальнейшем будем по-прежнему именовать её ядром) позволяет разместиться уже восьми электронам. С ростом ядра и увеличением количества электронов в элементах второго периода вокруг ядра разрастается зона четырёхмерного пространства, которая всё глубже поглощает электронные облака, что, естественно, уменьшает их зону контакта с трёхмерным пространством и приводит к тому, что электроны всё труднее отрываются от атома. И как только система оказывается “полностью упакованной” (иначе говоря, заполненной слоем электронных облаков) и погружённой в зону четырёхмерного пространства, аналогичным образом начинается строительство элементов третьего периода.
Когда же начинают строиться элементы четвёртого периода, то оказывается, что слой электронных облаков третьего периода не является “плотно упакованным” и в нём имеются пустоты, которые, заполняются электронными облаками 3d-подуровня. Когда эти облака оказываются полностью поглощены четырёхмерным пространством, идёт построение 4p-подуровня. Аналогичным образом идёт построение элементов и других периодов периодической системы элементов, при этом элементы пятого периода оказываются “неплотно упакованы” электронными облаками 4d-подуровня и в шестом периоде “пустоты” заполняются электронными облаками 4f-подуровня.
Такое строение атома позволяет объяснить изменение свойств элементов в периодах, поскольку, чем глубже электронные облака находятся в разрастающейся зоне четырёхмерного пространства, тем меньше у них контакта с трёхмерным пространством, а, значит, электрон труднее отрывается от атома, и когда электронные облака s-, p-, d-, f-подуровней оказываются полностью поглощены четырёхмерным пространством вокруг ядра, появляются такие элементы, как инертные газы и благородные металлы. Также становится понятным, почему электроны внутренних слоёв ни при каких условиях не отрываются от атома. Нынешняя теория строения атома объяснений по этому поводу не даёт и лишь констатирует факт.
По сложившемуся мнению, проекция четырёхмерного куба в трёхмерное пространство будет выглядеть в виде обычного трёхмерного куба, в который вложены восемь трёхмерных кубов, ориентированных по своим ОО. Соответственно, и в шарообразной проекции четырёхмерного пространства вокруг ядра электронные облака должны, по аналогии сложившемуся мнению, выглядеть шарами, как электронное облако s-подуровня. Однако такое представление о проекциях электронных облаков в корне неверно, и для того, чтобы это понять, рассмотрим обычную фотографию прозрачного трёхмерного куба. На фотографии видно, что квадраты граней превратились в неравносторонние четырёхугольники, а дальние грани по площади меньше ближних. Уменьшение площади дальних граней обусловлено третьей пространственной координатой, поскольку видимая поверхность объекта уменьшается обратно пропорционально квадрату расстояния до неё, равно как и регистрируемая энергия объекта, а также его масса. То же происходит и в шарообразной проекции четырёхмерного пространства вокруг ядра, где появляется четвёртая пространственная координата, величина которой растёт от поверхности четырёхмерной зоны к центру атома. Это объясняет уменьшение к центру атома регистрируемой энергии электронного облака (что сводит шарообразное электронное облако к форме “гантели”), уменьшение радиуса атомов элементов в периоде (за счёт увеличения зоны четырёхмерного пространства и, как следствие, удаления ядра и самого атома от пространства наблюдателя), а также приводит к пониманию, в чём, собственно, заключается смысл так называемого “дефекта массы” (поскольку ядро атома удалено от нашего пространства по четвёртой пространственной координате, то его масса и размер регистрируются обратно пропорционально квадрату расстояния). Подтверждением этих выводов является тот факт, что регистрируемая энергия, к примеру, электронов калия 1s-подуровня меньше, чем регистрируемая энергия электронов натрия того же 1s-подуровня, поскольку по четвёртой пространственной координате они в большей степени удалены от нашего пространства (кстати, это объясняет и уникальность спектра каждого элемента).
Теперь попробуем представить, каким образом располагаются электронные облака вокруг ядра по отношению к трёхмерному пространству. Но прежде, чем приступить к этому, рассмотрим, что представляет собой развёртка четырёхмерного куба в трёхмерном пространстве. У развёртки имеются три пары трёхмерных кубов, образованных на противоположных друг другу параллельных гранях и одна пара кубов (назовём эту пару внутренней структурой) инвертированных относительно друг друга в центре развёртки. Аналогичным образом выглядят развёртки всех правильных четырёхмерных многогранников (под “правильными” имеются в виду многогранники, чьи ориентационные оси пересекаются в центре в одной точке под одинаковыми углами, а грани находятся на одинаковом расстоянии от центра по своим ОО). То есть все они имеют пару трёхмерных многогранников, которые можно охарактеризовать как “внутренняя структура”, в то время как остальные пары трёхмерных многогранников образуются на параллельных гранях. При этом “внутренняя структура” служит основой в единственном виде для построения “вокруг” неё любых правильных четырёхмерных многогранников и фактически является пространством s-подуровня. Подтверждением этого необычного свойства четырёхмерных конструкций является тот факт, что в современной теории строения атома существуют только sp-, sd- и sf-гибридизации, а pd-, pf- и df-гибридизации не наблюдаются. На основании этого можно прийти к заключению, что ОО s2p6-, s2d10– и s2f14-электронных облаков пересекаются в центре атома под одинаковыми углами.
Для наглядности того, каким образом располагаются электронные облака вокруг ядра по отношению к трёхмерному пространству, рассмотрим их положение на примере второго периода. Одна пара электронов (s-подуровень) размещается в электронном облаке, чья ОО перпендикулярна пространству наблюдателя. Последующие три пары электронов (p-подуровень) располагаются в электронных облаках, чьи ОО имеют равные между собой углы по отношению к пространству наблюдателя, поскольку регистрируемые энергии этих облаков равны между собой. Вероятнее всего это обусловлено равновесным балансом электронных облаков по отношению к пространству наблюдателя (назовём это принципом уравновешенности). Как было предположено ранее, все ОО s2p6-электронных облаков пересекаются в центре под одинаковыми углами, почему же тогда электронные облака s-подуровня имеют в проекции шарообразную форму, а p-подуровня – форму гантели? На самом деле форма у них одна и та же: стоит только “развернуть” ОО гантелеобразного облака под прямым углом к пространству наблюдателя (то есть посмотреть на “гантель” с торца), как пред нами предстанет шарообразное электронное облако. Из этого следует очевидный вывод, что в действительности энергии электронных облаков s- и p-подуровней одинаковы, а на регистрируемую разницу накладывается эффект разницы углов наклона ОО к пространству наблюдателя. Также из этого следует, что при переходе атома из возбуждённого состояния в нормальное и наоборот не происходит никакого внепространственного и вневременного “перескока” электронов с орбитали на орбиталь, а наблюдается поворот проекций электронных облаков в положение, когда все четыре ОО s2p6-электронных облаков становятся под одинаковыми углами к пространству наблюдателя. При этом происходит резкое изменение угла наклона ОО электронных облаков, из-за чего их регистрируемая энергия меняется скачкообразно и создаётся иллюзия квантования энергии.
ОО s2d10-электронных облаков соответствуют ОО правильного двенадцатигранника. Но если в обычном состоянии атома возможно положение, когда одна ОО перпендикулярна пространству наблюдателя, а пять остальных находятся к этому пространству под одинаковыми углами, то в возбуждённом состоянии атома оказывается, что три ОО имеют один угол наклона, а ещё три – другой. Принцип уравновешенности, по всей видимости, здесь достигается тем, что s2d10-электронные облака имеют по две ориентировочные оси, и суммы углов ОО каждого электронного облака равны между собой. Что, в общем, и подтверждается регистрируемой формой электронных облаков d-подуровня, напоминающей две скрещенные гантели. Соответственно ОО s2f14-электронных облаков являются осями правильного шестнадцатигранника, но каждое из этих электронных облаков будет иметь по три ОО.
Чтобы иметь общее представление, что такое две или три ориентационные оси электронного облака, следует представить истинное шаровидное электронное облако, которое вращается для p-подуровня по одной оси, для d-подуровня – по двум осям, для f-подуровня – по трём, а затем “наложить” на вращающееся облако четвёртую пространственную координату, уменьшающую размеры облака к центру атома (разумеется, ориентационная ось и ось вращения не одно и то же, но для данного случая эффект аналогичен).
Остаётся неясным один вопрос: каким образом ОО электронных облаков могут находиться под постоянными неменяющимися углами по отношению к пространству наблюдателя, в то время как молекулярные связи, образованные теми же электронными облаками, при вращении молекулы могут принимать любой угол к пространству наблюдателя? Всё дело в том, что мы вращаем молекулу в трёхмерном пространстве, а для того чтобы изменить угол наклона ОО проекции из четырёхмерного пространства, необходимо повернуть атом в четырёхмерном. Для примера, по принципу аналогий, рассмотрим проекцию шара на плоскость под прямым углом (то есть проекцию трёхмерного объекта, чья ОО перпендикулярна двухмерной евклидовой плоскости). Проекция представляет собой круг, и как бы мы не вращали его в двухмерном пространстве (на плоскости), круг всегда будет оставаться кругом, а ОО шара всегда перпендикулярна плоскости. Но если мы повернём плоскость в третьем измерении, то угол наклона изменится и проекция шара на плоскость станет эллипсом. Для больше наглядности проведём простой эксперимент и сфотографируем указательный палец, направленный в объектив фотоаппарата. Иначе говоря, спроецируем трёхмерный объект (указательный палец) на двухмерное пространство таким образом, чтобы его ОО (направление пальца) была перпендикулярна пространству наблюдателя. Под каким бы углом не рассматривалась фотография, палец всегда будет показывать на смотрящего (то есть ОО проекции указательного пальца в двухмерное пространство всегда будет перпендикулярна пространству наблюдателя). Но если мы приклеим на кончик сфотографированного пальца небольшой напёрсток (такой, чтобы по диаметру не закрывал полностью палец), то при рассмотрении фотографии под разными углами палец по-прежнему будет всегда указывать на смотрящего, в то время как ОО напёрстка может принимать по отношению к пространству наблюдателя любые углы. Аналогичным образом происходит и с электронными облаками в атоме. Та их часть, которая находится в четырёхмерной зоне, является трёхмерной проекцией в наш мир, и поэтому будет всегда находиться под одним и тем же углом, а та часть электронного облака, которая вне четырёхмерной зоны, естественно, может принимать по отношению к наблюдателю какой угодно угол. Изменить угол наклона ОО электронных облаков, по всей видимости, можно воздействием внешнего магнитного или электрического поля, что и подтверждается эффектами Зеемана и Штарка соответственно, когда спектральные линии сдвигаются и расщепляются.
Таковы общие положения теории четырёхмерного строения атома, которые дают объяснения спину, дефекту массы, квантованию энергии, уменьшению размеров атомов в периоде, конфигурации электронных облаков, уникальности спектров каждого химического элемента, что, в свою очередь, даёт более чёткое понимание принципов построения элементов в периодической системе. Кроме того, теория позволяет выдвинуть предположение, что физические законы микромира ничем не отличаются от физических законов макромира, просто в микромире законы подвержены пространственной аберрации, аналогичной астрономической аберрации, когда движение планет Солнечной системы в трёхмерном космосе проецируется на двухмерную небесную сферу.
Следствие из теории четырёхмерного строения атома
Сферический поплавок, наполовину погружённый в воду, можно представить капсулой замкнутого двухмерного пространства, которая “протыкает” двухмерное евклидово пространство. Представим, что двухмерное евклидово пространство бесконечно, а капсула замкнутого двухмерного пространства бесконечно мала. Но как бы ни была мала капсула, она будет представлять собой этакую “занозу” непреодолимого препятствия в двухмерном пространстве. Иначе говоря, капсула свёрнутого двухмерного пространства, в которую заключено трёхмерное пространство, овеществляется (то есть МАТЕРИАЛИЗУЕТСЯ) в двухмерном евклидовом пространстве.
Из чего можно заключить, что аналогичным образом в нашем трёхмерном мире МАТЕРИАЛИЗУЕТСЯ четырёхмерное пространство атома, заключённое в капсулу замкнутого трёхмерного пространства. Откуда следует, что любые элементарные частицы можно представить свёртками, сгустками и т.п. многомерных пространств, которые под различными углами во всевозможных проекциях, с различными энергиями, вращаясь, перемещаясь, находясь в состоянии покоя, проявляются в нашем трёхмерном пространстве в капсулах замкнутого трёхмерного пространства и, ввиду “овеществления” этих капсул, являются основой материи.
🚀 Реферат на тему “Строение атома”
Содержание
1. Зарождение теории строения вещества
2. Атомистическая теория Дальтона
3. Катодные лучи и электроны
4. Ядерная модель строения атома
5. Состав атомных ядер
6. Изотопы
7. Электронные оболочки атомов. Теория Бора
8. Квантовая (волновая) механика. Характеристика поведения электронов в атомах.
Список использованных источников
1. Зарождение теории строения вещества
Атомистическая теория — современная теория строения вещества — зародилась еще в Древней Греции. Древнегреческие мыслители интересовались на первый взгляд отвлеченным вопросом: можно ли делить вещество бесконечно на все меньшие и меньшие части, или же оно состоит из некоторых неделимых частиц, не поддающихся дальнейшему делению?
Основное направление мысли древнегреческих философов, следовавших взглядам Платона и Аристотеля, основывалось на представлении о непрерывности материи. Однако некоторые древнегреческие философы, особенно Демокрит, не соглашались с такой точкой зрения и считали, что материя состоит из мельчайших неделимых частиц, которые Демокрит называл атомами, что и значит “неделимые”. Атомистические представления лежали также в основе естественной философии римского поэта и философа Лукреция, жившего в первом веке до нашей эры. Им была написана знаменитая поэма “О природе вещей”, в которой он подробно развивал атомистические взгляды на природу материи. Даже если было бы доказано, что материя имеет атомное строение, возник бы вопрос, чем отличаются друг от друга атомы различных веществ. Лукреций считал, что у атомов и веществ, имеющих горький вкус, на поверхности есть зазубринки, которые царапают язык, тогда как атомы веществ с приятным вкусом должны иметь гладкую поверхность.
Атомистические представления о природе веществ не намного продвинулись вперед за последующие 18 веков, прошедших со времен Лукреция. Научная мысль в Европе много веков находилась под влиянием философских идей Платона и Аристотеля, которые не разделяли атомистических воззрений на природу материи. И хотя об атомистических представлениях время от времени вспоминали, в прежние времена сторонники любой конкретной теории строения материи искали подтверждения своих взглядов главным образом в интуиции. Однако и на протяжении этого долгого периода медленно, с перерывами, шла экспериментальная работа. Часто ею двигали ошибочные взгляды: например, алхимики считали, что простые металлы, наподобие свинца, можно превратить в драгоценные металлы. Тем не менее накапливались сведения о том, как химические вещества реагируют друг с другом, и разрабатывались более количественные методы изучения химических реакций. Это подготовило почву для новых, более содержательных формулировок в рамках атомистической теории.
2. Атомистическая теория Дальтона
Джон Дальтон (1766 — 1844) большую часть своей жизни преподавал в школе и колледже в Манчестере. Возможно потому, что сам Дальтон не был химиком, он подошел к ее проблемам с иных позиций, чем химики его времени. Его атомистическая теория, опубликованная в период 1803-1807 гг., прочно основывалась на экспериментальных наблюдениях. Она оказалась столь успешной, что с этого времени заняла господствующее положение в науке и почти не потребовала дальнейшего пересмотра.
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Заказать реферат
Основные постулаты теории Дальтона заключались в следующем:
1.Каждый элемент состоит из чрезвычайно мелких частиц, называемых атомами.
2.Все атомы одного элемента одинаковы.
3.Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы.
4.Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях.
5.Соединения образуются в результате комбинации атомов двух или нескольких элементов.
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Заказать реферат
6.В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны.
Теория Дальтона позволяет мысленно нарисовать картину строения материи. Мы представляем себе элемент состоящим из мельчайших частиц, называемых атомами. Атомы являются основными структурными единицами материи, это мельчайшие частицы элемента, которые могут соединяться с другими элементами. Соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом.
3. Катодные лучи и электроны
До конца XIX века в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. Дальтон и его современники рассматривали атом как неделимый объект. Считалось, что при всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части. Но все эти предположения в то время еще не могли быть подтверждены какими-либо экспериментальными данными. Лишь в конце XIX века были сделаны открытия, показавшие сложность строения атома и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома.
Первые указания на сложную структуру атомов были получены при изучении катодных (исходящих от отрицательно заряженного электрода, или катода) лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения (порядка 1000 вольт). При таких условиях от катода трубки перпендикулярно к его поверхности распространяются «невидимые» катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение на их пути легко подвижные тела и отклоняются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, достигающей половины скорости света. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет самую сущность их природы. Эти частицы получили название электронов. По современным воззрениям, заряд электрона — это наименьший электрический заряд, наименьшее кол-во электричества, какое только может существовать. В катодных трубках электроны отделяются от катода под влиянием электрического заряда, но они могут возникать и вне всякой связи с электрическим зарядом. Так, например, все металлы испускают электроны при накаливании; в пламени горелки также присутствуют электроны; многие вещества выбрасывают электроны при освещении ультрафиолетовыми, рентгеновскими или лучами света (фотоэффект). Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов, следовательно, атомы являются сложными образованиями, построенными из более мелких структурных единиц.
В 1897 году английскому физику Дж. Дж. Томпсону (1856-1940) удалось измерить отношение электрического заряда электрона к его массе, которое оказалось равным 1,76*10 Кл/г.
В 1909 году Роберт Милликен из Чикагского университета определил заряд электрона: 1,60*10 Кл. Подставив это значение в найденное Томсоном отношение заряда электрона к его массе, можно было вычислить массу электрона: 1,60*10 Кл/1,76*10 Кл/г = 9,11*10 г.
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Заказать реферат
4. Ядерная модель строения атома
Изучение строения атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом в целом электрически нейтрален, следовательно, он должен содержать в себе еще другую составную часть, заряженную положительно, причем ее заряд должен уравновешивать сумму отрицательных зарядов электронов.
Эта положительно заряженная часть атома была открыта в 1911 г. Эрнестом Резерфордом (1871-1937). Резерфорд предложил следующую схему строения атома.
В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Суммарный отрицательный заряд электронов численно равен положительному заряду ядра, так что атом в целом электронейтрален. Так как масса электронов ничтожно мала, то почти вся масса атома сосредоточена в его ядре. Наоборот, размер ядер чрезвычайно мал даже по сравнению с размером самих атомов. Отсюда ясно, что на долю ядра и электронов, число которых, как увидим дальше, сравнительно невелико, приходится лишь ничтожная часть всего пространства, занятого атомной системой.
5. Состав атомных ядер
Таким образом, открытия Резерфорда положили начало ядерной теории атома. Со времен Резерфорда физики узнали еще очень многие подробности о строении атомного ядра.
Самым легким атомом является атом водорода (Н). Поскольку почти вся масса атома сосредоточена в ядре, естественно было бы предположить, что ядро атома водорода представляет собой элементарную частицу положительного электричества, которая была названа протоном от греческого слова “протос”, что означает “первый”. Таким образом, протон обладает массой, практически равной массе атома водорода (точно 1,00728 углеродных единиц) и электрическим зарядом, равным +1 (если за единицу отрицательного электричества принять заряд электрона, равный -1,602*10 Кл). Атомы других, более тяжелых элементов содержат ядра, обладающие большим зарядом и, очевидно, большей массой.
Измерения заряда ядер атомов показали, что заряд ядра атома в указанных условных единицах численно равен атомному, или порядковому, номеру элемента. Однако невозможно было допустить, так как последние, будучи одноименно заряженными, неизбежно отталкивались бы друг от друга и, следовательно, такие ядра оказались бы неустойчивыми. К тому же масса атомных ядер оказалась больше суммарной массы протонов, обуславливающих заряд ядер атомов соответствующих элементов, в два раза и более. Тогда было сделано предположение, что ядра атомов содержат протоны в числе, превышающем атомный номер элемента, а создающийся таким образом избыточный положительный заряд ядра компенсируется входящими в состав ядра электронами. Эти электроны, очевидно, должны удерживать в ядре взаимно отталкивающиеся протоны. Однако это предположение пришлось отвергнуть, так как невозможно было допустить совместное существование в компактном ядре тяжелых (протонов) и легких (электронов) частиц.
В 1932 г. Дж. Чедвик открыл элементарную частицу, не обладающую электрическим зарядом, в связи с чем она была названа нейтроном (от латинского слова neuter, что означает “ни тот, ни другой”). Нейтрон обладает массой, немного превышающей массу протона (точно 1,008665 углеродных единиц). Вслед за этим открытием Д. Д. Иваненко, Е. Н. Гапон и В. Гейзенберг, независимо друг от друга, предложили теорию состава атомных ядер, ставшую общепринятой. Согласно этой теории, ядра атомов всех элементов (за исключением водорода) состоят из протонов и нейтронов. Число протонов в ядре определяет значение его положительного заряда, а суммарное число протонов и нейтронов — значение его массы. Ядерные частицы — протоны и нейтроны — объединяются под общим названием нуклоны (от латинского слова nucleus, что означает “ядро”). Таким образом, число протонов в ядре соответствует атомному номеру элемента, а общее число нуклонов, поскольку масса атома в основном сосредоточена в ядре, — его массовому числу, т.е. округленной до целого числа его атомной массе А. Тогда число нейтронов а ядре N может быть найдено по разности между массовым числом и атомным номером:
N = A — Z
Таким образом, протонно-нейтронная теория позволила разрешить возникшие ранее противоречия в представлениях о составе атомных ядер и о его связи с порядковым номером и атомной массой.
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Заказать реферат
6. Изотопы
Протонно-нейтронная теория позволила разрешить и еще одно противоречие, возникшее при формировании теории атома. Если признать, что ядра атомов элементов состоят из определенного числа нуклонов, то атомные массы всех элементов должны выражаться целыми числами. Для многих элементов это действительно так, а незначительные отклонения от целых чисел можно объяснить недостаточной точностью измерения. Однако у некоторых элементов значения атомных масс так сильно отклонялись от целых чисел, что это уже нельзя объяснить неточностью измерения и другими случайными причинами. Например, атомная масса хлора (CL) равна 35,45. Установлено, что приблизительно три четверти существующих в природе атомов хлора имеют массу 35, а одна четверть — 37. Таким образом, существующие в природе элементы состоят из смеси атомов, имеющих разные массы, но, очевидно, одинаковые химические свойства, т. е. существуют разновидности атомов одного элемента с разными и притом целочисленными массами. Ф. Астону удалось разделить такие смеси на составные части, которые были названы изотопами (от греческих слов “изос” и “топос”, что означает “одинаковый” и “место” (здесь имеется в виду, что разные изотопы одного элемента занимают одно место в периодической системе)).
С точки зрения протонно-нейтронной теории, изотопами называются разновидности элементов, ядра атомов которых содержат различное число нейтронов, но одинаковое число протонов. Химическая природа элемента обусловлена числом протонов в атомном ядре, которому равно и число электронов в оболочке атома. Изменение же числа нейтронов (при неизменном числе протонов) не сказывается на химических свойствах атома.
Все это дает возможность сформулировать понятие химического элемента как вида атомов, характеризующихся определенным зарядом ядра. Среди изотопов различных элементов были найдены такие, которые содержат в ядре при разном числе протонов одинаковое общее число нуклонов, то есть атомы которых обладают одинаковой массой. Такие изотопы были названы изобарами (от греческого слова “барос”, что означает “вес”). Различная химическая природа изобаров убедительно подтверждает то, что природа элемента обуславливается не массой его атома.
Для различных изотопов применяются названия и символы самих элементов с указанием массового числа, которое следует за названием элемента или обозначается в виде индекса вверху слева от символа, например : хлор — 35 или Cl.
Различные изотопы отличаются друг от друга устойчивостью. 26 элементов имеют лишь по одному устойчивому изотопу — такие элементы называются моноизотопными (они характеризуются преимущественно нечетными атомными номерами), и атомные массы их приблизительно равны целым числам. У 55 элементов имеется по несколько устойчивых изотопов — они называются полиизотопными (большое число изотопов характерно преимущественно для элементов с четными номерами). У остальных элементов известны только неустойчивые, радиоактивные изотопы. Это все тяжелые элементы, начиная с элемента №84 (полоний), а из относительно легких — №43 (технеций) и №61 (прометий). Однако радиоактивные изотопы некоторых элементов относительно устойчивы (характеризуются большим периодом полураспада), и поэтому эти элементы, например торий, уран, встречаются в природе. В большинстве же радиоактивные изотопы получают искусственно, в том числе и многочисленные радиоактивные изотопы устойчивых элементов.
7. Электронные оболочки атомов. Теория Бора
По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, вследствие чего нарушается равновесие между ним и ядром. Для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен «упасть» на ядро, и излучение света прекратится.
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Заказать реферат
Если бы на самом деле происходило подобное непрерывное изменение движения электрона, его «падение» на ядро означало бы разрушение атома и прекращения его существования.
Таким образом, наглядная и простая ядерная модель атома, предложенная Резерфордом, явно противоречила классической электродинамике. Система вращающихся вокруг ядра электронов не может быть устойчивой, так как электрон при таком вращении должен непрерывно излучать энергию, что, в свою очередь, должно привести к его падению на ядро и к разрушению атома. Между тем атомы являются устойчивыми системами.
Эти существенные противоречия частично разрешил выдающийся датский физик Нильс Бор (1885 — 1962), разработавший в 1913 году теорию водородного атома, в основу которой он положил особые постулаты, связав их, с одной стороны, с законами классической механики и, с другой стороны, с квантовой теорией излучения энергии немецкого физика Макса Планка (1858 — 1947). Сущность теории квантов сводится к тому, что энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями — квантами энергии. Запас энергии излучающего тела изменяется скачками, квант за квантом; дробное число квантов тело не может ни испускать, ни поглощать. Величина кванта энергии зависит от частоты излучения: чем больше частота излучения, тем больше величина кванта.
Кванты лучистой энергии называются также фотонами. Применив квантовые представления к вращению электронов вокруг ядра, Бор положил в основу своей теории очень смелые предположения, или постулаты. Хотя эти постулаты и противоречат законам классической электродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в том полнейшем согласии, которое обнаруживается между теоретическим результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых, стационарных или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает электромагнитной энергии. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через Еí, а на более близкой через Еê и разделив потерянную атомом энергию Еí — Еê на постоянную Планка, получим искомую частоту:
= (Еí — Еê ) / h
Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода, вокруг ядра которого вращается только один электрон.
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Заказать реферат
Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1: 2 : 3 : …: n . Величина n получила название главного квантового числа.
В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связано с некоторыми трудностями из-за ее новизны. Она позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако надо иметь в виду, что все эти схемы — это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов.
Как было уже сказано раньше, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющее или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, имеющих возможность находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя:
N=2n
где n — номер слоя. Таким образом на 1-2, на 2-8, на 3-18 и т.д. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем — восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся положительно заряженными, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие электроны становятся отрицательно заряженными. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов, называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом.
8. Квантовая (волновая) механика. Характеристика поведения электронов в атомах.
Теория Бора оказала огромные услуги физике и химии. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах рисовалось Бору до известной степени как простое механическое перемещение, между тем как оно является весьма сложным и своеобразным.
Своеобразие движения электронов было раскрыто новой теорией — квантовой, или волновой, механикой. Квантовая механика показывает, что законы движения электронов имеют много общего с законами распространения волн. Для электрона с массой m и скоростью v можно записать:
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Цена реферата
= h / (m*v)
где — длина волны Деброиля, h— постоянная Планка.
Атомы различных элементов характеризуются определенным значением заряда ядра и равным ему числом электронов, которые распределяются по энергетическим уровням. Поведение электронов в атоме характеризуется четырьмя квантовыми числами:
1) Главное квантовое число n определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. Число может принимать значения ряда натуральных чисел (в реальных атомах от одного до семи). Эти числа соответствуют электронным слоям атома или его энергетическим уровням, которые обозначаются прописными буквами латинского алфавита:
1 2 3 4 5 6 7 К L M N O P Q
Помимо главного квантового числа, состояние электрона в атоме характеризуется еще тремя другими квантовыми числами: l, m, s.
2) Орбитальное, побочное или азимутальное квантовое число l характеризует момент количества движения электрона относительно центра орбиты. Оно определяет форму электронного облака (форму орбиты), его сплошность или разрывы и его вытянутость. Принимает целые значения от 0 до (n-1). Для данного значения n имеется n различных орбиталей, т.е. число значений l определяет количество атомных орбиталей. Энергетические подуровни обозначаются следующим образом:
3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, в соответствии с представлениями волновой механики, то направление, в котором вытянуто электронное облако. Может принимать целые значения от -l до l (включая 0), всего (2*l+1) значений. Число значений m определяет число орбиталей данного (s-, p-, d-, f- типа).
4) Спиновое квантовое число s определяет направление вращения электрона, может принимать только два значения: 1/2 и -1/2. Изучению распределения электронов в атомах уделяется большое внимание, так как поведение атомов в химических реакциях в значительной мере зависит от того, насколько прочно их электроны удерживаются на своих орбиталях.
Нужна помощь в написании реферата?
Мы – биржа профессиональных авторов (преподавателей и доцентов вузов). Наша система гарантирует сдачу работы к сроку без плагиата. Правки вносим бесплатно.
Цена реферата
Список использованных источников
1. Коровин Н.В., Курс общей химии – М: Высшая школа,1990. — 446с.
2. Кременчугская М., Васильева С., Химия – М: Слово, 1995. – 479с.
3. Кульман А. Г., Общая химия- М: Наука, 1982. – 578с.
4. Некрасов Б. В., Основы общей химии-М: Химия, 1973.- 688с.
5. Полинг Л., Полинг П. Химия –М: Мир, 1978. – 685с.
6. Савина О. М., Энциклопедия – М.: АСТ, 1994. – 448с.
7. Харин А.Н., Курс химии – М: Высшая школа, 1983. — 511с.
Строение атома
Цель урока:
- Образовательная:
- познакомить учащихся с историей развития взглядов о строении атома;
- дать знания о модели атома Резерфорда-Бора;
- сформулировать постулаты Бора;
- Развивающая:
- систематизировать и расширить знания учащихся по теме «Атомная физика»;
- развивать внимание и любознательность при объяснении нового материала;
- формировать умение объяснять явления, происходящие в природе.
- Воспитательная:
- вырабатывать устойчивое внимание при объяснении нового теоретического материала;
- развивать правильную речь, используя физические термины;
- показать значение работ ученых-физиков в вопросе о сложном строении атома.
Тип урока: урок-лекция (2 часа)
Оборудование: ПК, проектор, презентация
ХОД УРОКА
I. Изучение нового материала
Слайд 1 Вопрос о том, как устроен мир, является одним из тех, которые причисляются к разряду вечных. Открывая законы природы, спрятанные под покровом бесконечно многообразного мира явлений, человек научился применять их для своих целей, создавать то, чего никогда не было в самой природе. Было изобретено радио, построены громадные электрические машины, освобождена внутриядерная энергия; человек вышел в космическое пространство. Много веков длится процесс познания окружающего мира.
Слайд 2 Какими же путями добывается научная истина? Сегодня мы это и узнаем. Тема нашего урока: «Строение атома»
Слайд 3 В физике много разделов, и
каждый изучает свои явления. Раздел
физики, в котором изучают строение и состояние
атомов, называется атомная физика.
А. ф. возникла в конце 19 – начале 20 вв.
Предыстория атомной физики
Слайды 4-7 Мысль о существовании атомов как неделимых частиц материи возникла ещё в древности; идеи атомизма впервые были высказаны древнегреческими мыслителями Демокритом и Эпикуром.
Слайд 8 В XVII-XVII веках вопросом о
строении атома занимались Бойль, Ньютон,
Ломоносов.
Представления об атомах, господствовавшие в XVII-XVII
вв., были малоопределёнными. Атомы считались
абсолютно неделимыми и неизменными твёрдыми
частицами, различные виды которых отличаются
друг от друга по размеру и форме.
Возникновение атомной физики
Слайд 9 Важнейшими событиями в науке, от которых берёт начало А. ф., были открытия электрона и радиоактивности.
Слайд 10 При исследовании прохождения электрического тока через сильно разреженные газы были открыты лучи, испускаемые катодом разрядной трубки (катодные лучи) и обладающие свойством отклоняться в поперечном электрическом и магнитном полях. Выяснилось, что эти лучи состоят из быстро летящих отрицательно заряженных частиц, названных электронами. Из этого было сделано заключение, что электроны входят в состав любых атомов. Отсюда далее следовало, что нейтральные атомы должны также содержать и положительно заряженные частицы.
Слайд 11 30 апреля 1897 английский физик Джозеф Джон Томсон на заседании Королевского общества сделал доклад, где говорилось об открытии электрона.
Слайды 12-13 Результаты исследования свойств электрона и радиоактивности позволили строить конкретные модели атома. В модели, предложенной Томсоном в 1903 году, атом представлялся в виде положительно заряженной сферы, в которую вкраплены незначительные по размеру (по сравнению с атомом) отрицательные электроны.
Слайд 14 В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбиталям вращались электроны, объединённые в кольца.
Создание Резерфордом планетарной модели атома.
Слайды 15-18 Модель атома Томсона
оказалась неудовлетворительной. На её основе не
удалось объяснить совершенно неожиданный
результат опытов английского физика Э.
Резерфорда и его сотрудников Х. Гейгера и Э.
Марсдена по рассеянию a-частиц атомами. В этих
опытах быстрые a-частицы были применены для
прямого зондирования атомов. Проходя через
вещество, a-частицы сталкиваются с атомами. При
каждом столкновении a-частица, пролетая через
электрическое поле атома, изменяет направление
движения — испытывает рассеяние. В подавляющем
большинстве актов рассеяния отклонения a-частиц
(углы рассеяния) были очень малы. Поэтому при
прохождении пучка a-частиц через тонкий слой
вещества происходило лишь небольшое размытие
пучка. Однако очень малая доля a-частиц
отклонялась на углы более 90°(1 из 2 000). Этот
результат нельзя было объяснить на основе модели
Томсона, т.к. электрическое поле в
“сплошном” атоме недостаточно сильно, чтобы
отклонить быструю и массивную a-частицу на
большой угол. Чтобы объяснить результаты опытов
по рассеянию a-частиц, Резерфорд предложил
принципиально новую модель атома, напоминающую
по строению Солнечную систему и получившую
название планетарной. Она имеет следующий вид. В
центре атома находится положительно заряженное
ядро, размеры которого (~10–12см) очень
малы по сравнению с размерами атома (~10–8см),
а масса почти равна массе атома. Вокруг
ядра движутся электроны, подобно планетам вокруг
Солнца; число электронов в незаряженном
(нейтральном) атоме таково, что их суммарный
отрицательный заряд компенсирует (нейтрализует)
положительный заряд ядра. Электроны должны
двигаться вокруг ядра, в противном случае они
упали бы на него под действием сил притяжения.
Различие между атомом и планетной системой
состоит в том, что в последней действуют силы
тяготения, а в атоме — электрические
(кулоновские) силы. Вблизи ядра, которое можно
рассматривать как точечный положительный заряд,
существует очень сильное электрическое поле.
Поэтому, пролетая вблизи ядра, положительно
заряженные a-частицы (ядра гелия) испытывают
сильное отклонение.
Однако планетарная модель атома натолкнулась на
принципиальные трудности. Согласно классической
электродинамике, заряженная частица, движущаяся
с ускорением, непрерывно излучает
электромагнитную энергию. Поэтому электроны,
двигаясь вокруг ядра, т. е. ускоренно, должны были
бы непрерывно терять энергию на излучение. Но при
этом они за ничтожную долю секунды потеряли бы
всю свою кинетическую энергию и упали бы на ядро.
Слайд 19 Физкультминутка
Слайды 20-28 Противоречия модели Резерфорда оказалось возможным разрешить, лишь отказавшись от ряда привычных представлений классической физики. Важнейший шаг в построении теории атома был сделан датским физиком Н. Бором (1913).
Постулаты Бора и модель атома Бора
В основу квантовой теории атома Бор положил 2 постулата, характеризующих те свойства атома, которые не укладывались в рамки классической физики. Эти постулаты Бора могут быть сформулированы следующим образом:
1 постулат: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
2 постулат: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
hv = En – Em,
где h – постоянная Планка.
При испускании или поглощении света изменяется энергия атома, это изменение равно энергии испущенного или поглощённого фотона, т. е. имеет место закон сохранения энергии.
Дальнейшее развитие А. ф. показало справедливость постулатов Бора не только для атомов, но и для других микроскопических систем — для молекул и для атомных ядер. Эти постулаты следует рассматривать как твёрдо установленные опытные квантовые законы. Они составляют ту часть теории Бора, которая не только сохранилась при дальнейшем развитии квантовой теории, но и получила своё обоснование. Иначе обстоит дело с моделью атома Бора, основанной на рассмотрении движения электронов в атоме по законам классической механики при наложении дополнительных условий квантования. Такой подход позволил получить целый ряд важных результатов, но был непоследовательным: квантовые постулаты были присоединены к законам классической механики искусственно.
Последовательной теорией явилась созданная в 20-х гг. 20 в. квантовая механика. Её создание было подготовлено дальнейшим развитием модельных представлений теории Бора, в ходе которого выяснились её сильные и слабые стороны.
Развитие модельной теории атома Бора
Однако далеко не все вопросы теории атома удалось объяснить на основе модельных представлений теории Бора. При переходе к объяснению движений электронов в атомах, более сложных, чем атом водорода, модельная теория Бора оказалась в тупике. Уже атом гелия, в котором вокруг ядра движутся 2 электрона, не поддавался теоретической интерпретации на её основе. Трудности при этом не исчерпывались количественными расхождениями с опытом. Теория оказалась бессильной и в решении такой проблемы, как соединение атомов в молекулу.
Квантовомеханическая теория атома
Слайд 29 Ограниченность боровской модели атома коренилась в ограниченности классических представлений о движении микрочастиц. Стало ясно, что для дальнейшего развития теории атома необходимо критически пересмотреть основные представления о движении и взаимодействии микрочастиц. Неудовлетворительность модели, основанной на классической механике с добавлением условий квантования, отчётливо понимал и сам Бор, взгляды которого оказали большое влияние на дальнейшее развитие А. ф. Началом нового этапа развития А. ф. послужила идея, высказанная французским физиком Л. де Бройлем (1923) о двойственной природе движения микрообъектов, в частности электрона. Эта идея стала исходным пунктом квантовой механики, созданной в 1925-26 трудами В. Гейзенберга и М. Борна (Германия), Э. Шрёдингера (Австрия) и П. Дирака (Англия), и разработанной на её основе современной квантовомеханической теории атома.
Представления квантовой механики о движении электрона (вообще микрочастицы) коренным образом отличаются от классических. Согласно квантовой механике, электрон не движется по траектории (орбите), подобно твёрдому шарику; движению электрона присущи также и некоторые особенности, характерные для распространения волн. С одной стороны, электрон всегда действует (например, при столкновениях) как единое целое, как частица, обладающая неделимым зарядом и массой; в то же время электроны с определённой энергией и импульсом распространяются подобно плоской волне, обладающей определённой частотой (и определённой длиной волны). Энергия электрона Е как частицы связана с частотой v электронной волны соотношением: E = hv, а его импульс р — с длиной волны λ соотношением: р = h’λ.
На основе квантовой механики удалось путём решения уравнения Шрёдингера правильно рассчитать энергии электронов в сложных атомах.
Современная атомная физика
Важнейшая задача А. ф. — детальное определение всех характеристик состояний атома. Речь идёт об определении возможных значений энергии атома — его уровней энергии, значений моментов количества движения и других величин, характеризующих состояния атома. Исследуются тонкая и сверхтонкая структуры уровней энергии, изменения уровней энергии под действием электрических и магнитного полей — как внешних, макроскопических, так и внутренних, микроскопических. Большое значение имеет такая характеристика состояний атома, как время жизни электрона на уровне энергии. Наконец, большое внимание уделяется механизму возбуждения атомных спектров.
Двойственная природа электрона
Подтвержденная экспериментально в 1927 г.
двойственная природа электрона, обладающего
свойствами не только частицы, но и волны,
побудила ученых к созданию новой теории строения
атома, учитывающей оба этих свойства.
Современная теория строения атома опирается на
квантовую механику.
Двойственность свойств электрона проявляется в
том, что он, с одной стороны, обладает свойствами
частицы (имеет определенную массу покоя), а с
другой – его движение напоминает волну и может
быть описано определенной амплитудой, длиной
волны, частотой колебаний и др. Поэтому нельзя
говорить о какой-либо определенной траектории
движения электрона – можно лишь судить о той или
иной степени вероятности его нахождения в данной
точке пространства.
Следовательно, под электронной орбитой следует
понимать не определенную линию перемещения
электрона, а некоторую часть пространства вокруг
ядра, в пределах которого вероятность пребывания
электрона наибольшая. Иными словами, электронная
орбита не характеризует последовательность
перемещения электрона от точки к точке, а
определяется вероятностью нахождения электрона
на определенном расстоянии от ядра.
Слайд 30
II. Домашнее задание: записи в тетради.
Программа курса “Общая химия” (бакалавриат, 1 курс, 1 семестр)
Содержание курса «ОБЩАЯ ХИМИЯ»
БАКАЛАВРИАТ, 1 КУРС, 1 СЕМЕСТР
1. Разделы курса: основы атомно-молекулярного учения, строение вещества, Периодический закон, химическая связь, химический процесс, учение о растворах, обменные реакции в растворах электролитов, окислительно-восстановительные реакции, экспериментальные методы в химии.
2. Темы и их содержание
2.1. Основы атомно-молекулярного учения. Основные химические понятия и: законы атомно-молекулярного учения. Понятие о химической системе, фазе, компоненте. Гомогенные и гетерогенные системы. Газовые системы. Газовые законы. Идеальный газ. Уравнение Менделеева-Клапейрона. Парциальное давление газа в смеси. Жидкие системы. Растворы. Концентрация растворов и способы ее выражения. Твердые системы. Кристаллы, аморфные тела и стекла.
2.2. Строение вещества. Элементарные частицы и их основные свойства. Экспериментальные основы современной теории строения атома. Планетарная модель атома, постулаты Бора. Волновая природа элементарных частиц. Квантовомеханическая модель атома. Квантовые числа и их физический смысл. Атомные орбитали. Энергетические уровни электрона в одноэлектронном атоме. Многоэлектронный атом. Диаграмма одноэлектронных уровней энергии. Заполнение электронных оболочек атомов. Принцип Паули и правило Хунда. Валентные и остовные электроны.
2.3. Периодический закон. Попытки классификации химических элементов до открытия периодического закона. Экспериментальные основы периодического закона. Содержание периодического закона. Предсказание Д.И.Менделеевым свойств неизвестных элементов. Современная интерпретация периодического закона. Изменение свойств элементов по группам и периодам периодической системы. Периодичность в строении электронных оболочек атомов. Потенциалы ионизации, сродство к электрону, радиусы атомов и ионов в зависимости от положения элемента в периодической системе. Электроотрицательность элементов.
2.4. Химическая связь. Природа химической связи. Ковалентная, полярная и ионная связь. Молекула водорода и методы ее описания. Метод молекулярных орбиталей (МО) и метод валентных связей (ВС). Характеристики химической связи – энергия, длина, полярность, кратность. Химическая связь в гомоядерных и гетероядерных двухатомных молекулах элементов второго периода с позиций методов МО и ВС. Магнитные свойства веществ. Химическая связь в многоатомных молекулах. Локализованная и делокализованная связь. Трехцентровая связь. Электронодефицитные и электроноизбыточные молекулы. Направленность и насыщаемость ковалентной химической связи. Теория отталкивания электронных пар валентной оболочки и геометрия молекул. Донорно-акцепторная и водородная связь. Межмолекулярные взаимодействия. Строение веществ в конденсированном состоянии.
2.5. Химический процесс. Энергетические характеристики химических реакций. Термохимия. Понятие об энтальпии. Эндо- и экзотермические реакции. Стандартное состояние и стандартная энтальпия образования вещества. Законы термохимии: закон Лавуазье-Лапласа и закон Гесса. Расчеты тепловых эффектов реакций. Термохимический цикл. Энтальпия атомизации и энергия связей в молекулах. Движущие силы химической реакции – изменение энергии и изменение энтропии. Понятие энтропии. Энтропия газообразных, жидких и твердых веществ. Постулат Нернста. Стандартная энтропия. Изменение энтропии при фазовых и химических превращениях. Энергия Гиббса. Уменьшение энергии Гиббса как термодинамический критерий возможности самопроизвольного протекания процесса. Зависимость изменения энергии Гиббса от температуры, давления и концентрации реагирующих веществ.
Кинетика и механизмы химических реакций. Зависимость скорости реакции от концентрации реагентов. Кинетическое уравнение реакции. Порядок реакции. Константа скорости реакции и ее зависимость от температуры. Энергия активации. Уравнение Аррениуса. Понятие о механизме реакции. Молекулярность реакции. Катализ и катализаторы. Влияние катализатора на механизм реакции. Особенности кинетики газофазных, жидкофазных и твердофазных реакций.
Химическое равновесие. Обратимые и необратимые химические реакции с позиций термодинамики и кинетики. Кинетический и термодинамический подходы к описанию химического равновесия. Константа химического равновесия и различные способы ее выражения. Связь константы химического равновесия со стандартным изменением энергии Гиббса. Температурная зависимость константы равновесия. Смещение химического равновесия при изменении условий.
2.6. Учение о растворах. Гомогенные многокомпонентные системы – растворы. Жидкие растворы. Фазовые диаграммы. Область жидкого состояния. Диаграммы состав-свойство. Растворитель и растворяемое вещество. Растворимость. Насыщенные, ненасыщенные, пересыщенные, разбавленные и концентрированные растворы. Понятие идеального раствора. Общие свойства растворов.
Диаграмма состояния воды. Электронное строение и структура воды, водородные связи. Самоионизация жидкой воды. Ионное произведение воды, водородный показатель. Вода как ионизирующий растворитель. Растворы электролитов. Электролитическая диссоциация растворенных веществ. С.Аррениус, Д.И.Менделеев, И.А.Каблуков о природе растворов электролитов. Переход ионов в раствор. Гидратация соли и образующих ее ионов. Энергия гидратации ионов.
Сильные и слабые электролиты. Константа и степень диссоциации электролита. Закон разбавления. Понятие об активности ионов в растворах.
2.7. Обменные реакции в растворах электролитов. Гидролиз солей. Представления Аррениуса и Вернера о механизме гидролиза. Константа и степень гидролиза. Ступенчатый характер гидролиза. Буферные растворы.
Равновесие ионный кристалл – раствор. Произведение растворимости. Условия выпадения и растворимости осадка. Влияние наличия одноименных ионов и комплексообразования на растворимость осадков.
Реакции комплексообразования в водных растворах. Аквакомплексы. Комплексообразователь и лиганды. Внешняя и внутренняя сферы комплексов. Координационное число. Константа устойчивости комплекса.
Кислоты и основания. Теории кислот и оснований. Теории Аррениуса, Бренстеда-Лоури, Льюиса, Усановича. Роль растворителя в кислотно-основном взаимодействии. Дифференциирующие и нивелирующие растворители. Сила кислородсодержащих кислот и ее зависимость от их состава и строения. Реакция нейтрализации. Индикаторы кислотно–основного равновесия в водных растворах. Смещение равновесия нейтрализации в зависимости от силы реагирующих электролитов.
2.8. Окислительно – восстановительные реакции. Понятие об окислителях и восстановителях. Роль среды в окислительно-восстановительных реакциях. Составление уравнений окислительно-восстановительных реакций. Типы окислительно-восстановительных реакций.
Количественные характеристики окислительно-восстановительных переходов. Стандартные условия и стандартный потенциал полуреакции. Таблицы стандартных восстановительных потенциалов. Использование табличных данных для оценки возможности протекания окислительно-восстановительных процессов. Потенциалы окислительного и восстановительного разложения воды. Условия устойчивости веществ в водных растворах. Диспропорционирование веществ в водных растворах.
Окислительно-восстановительные равновесия в растворах. Уравнение Нернста. Влияние рН на величину восстановительного потенциала. Изменение восстановительного потенциала при изменении концентрации реагентов в результате их осаждения или комплексообразования.
Электролиз растворов и расплавов. Электролитическое получение металлов. Электрохимическая коррозия металлов.
2.9.Экспериментальные методы химии. Современные методы синтеза и анализа неорганических и органических веществ. Современные методы исследования структуры и строения вещества. Рентгенография. Спектроскопические методы. Термодинамические методы исследования. Калориметрия, тензиметрия, масс-спектрометрия.
3. Лабораторный практикум
Выполняется в специализированном практикуме общей и неорганической химии и включает следующие лабораторные работы:
- Классы неорганических соединений.
- Определение эквивалента металла.
- Кинетика химических реакций.
- Приготовление раствора кислоты заданной концентрации.
- Водородный показатель.
- Гидролиз.
- Определение рН растворов методом рН-метрии
- Примеры окислительно-восстановительных реакций.
Рекомендуемая литература (основная):
- А.В. Суворов, А.Б. Никольский. “Общая химия”. Учебник для ВУЗов. СПб: “Химия”, 1997, 624 с.
- А.Б.Никольский, А.В.Суворов, Химия. 2001. СПб: Химиздат.
- А.В.Суворов, А.Б.Никольский. Вопросы и задачи по общей химии. 2002. СПб: Химиздат. 304 с.
- Неорганическая химия в 3-х томах. Под ред. Ю.Д.Третьякова. М., Академия, 2004
- К. Хаускрофт, Э. Констебл. Современный курс общей химии (в 2х томах), М. Мир, 2002.
- Л.С. Лилич, М.К. Хрипун. “Растворы как химические системы”. Учебное пособие. С-Пб: “Изд. С-ПбГУ”, 2011, 216 с.
- Общая химия. для студентов 1 курса химического факультета. Домашние задания. Отв. ред. Суворов А.В. СПб. 2000 г. 51 с.
- Общая химия для студентов 1 курса химического факультета. Описание лабораторных работ. Отв. ред. Суворов А.В. СПб. 2000 г. 26 с.
Дополнительная литература:
- Н.Е. Кузьменко, В.В. Еремин, В.А. Попков. Начала химии. М.: Экзамен, 2001, 720 с.
- О.Х. Зайцев. Общая химия. Направление и скорость химических процессов. Строение вещества. М.: Высшая школа. 1983. 248 с.
- Фримантл М. Химия в действии. В 2-х частях. М.: Мир. 1991. 528 с.
- Я.А. Угай. Общая и неорганическая химия, М. «Высш. школа», 1997. 527 с.
- М.Х. Карапетьянц, С.И. Дракин. Общая и неорганическая химия, М. «Химия», 1992. 588 с.
- Р. Дикерсон, Г. Грей, Дж. Хейт. Основные законы химии. Т.1,2. М: “Мир”,1982, 652 с., 620 с.
| Атом (от др.-греч. ατομος – неделимый). Достижения экспериментальной физики к концу XIX в. доказали неправомерность представлений о неделимости атома. Французский физик Беккерель в 1896 г. обнаружил самопроизвольное испускание урановыми рудами ранее неизвестного вида излучения, проникающего через вещества. Позднее в 1898 г. то же явление было обнаружено и основательно изучено французскими учеными П. Кюри и М. Склодовсткой-Кюри, которые объяснили наблюдаемое излучение естественной радиоактивностью. Они открыли в урановых рудах два новых и более мощных источника излучения, чем сам уран. Ими оказались радиоактивные элементы полоний и радий. Было найдено, что радий претерпевает многоступенчатый спонтанный распад, который заканчивается образованием стабильного свинца. Поскольку атомы свинца качественно отличаются от атомов радия, такое превращение элементов можно объяснить только тем, что атомы обоих элементов построены из одинаковых, более мелких, чем сами атомы, частиц. Это послужило основанием для глубокого теоретического и экспериментального изучения строения атома. Первым основополагающим достижением в области изучения внутреннего строения вещества было создание модели атома английским физиком Резерфордом в 1911 г. По Резерфорду, атом состоит из ядра, окруженного электронной оболочкой. Датский физик теоретик Бор использовал представления Резерфорда и созданную немецким физиком Планком (1900 г.) квантовую теорию для разработки в 1913 г. теории водородоподобного атома и первой квантовой модели атома – модель атома Бора. Приняв, что электроны – это частицы, он описал атом как ядро, вокруг которого на разных расстояниях движутся по круговым орбитам электроны. В 1916 г. модель атома Бора была усовершенствована немецким физиком Зоммерфельдом, который объединил квантовую теорию Планка и теорию относительности Эйнштейна (1905 г.), создав квантовую теорию атомных орбит, которые по Зоммерфельду, могут быть не только круговыми но и эллиптическими. Следующий этап в становлении квантовой теории строения атома начался с теоретического обоснования французским ученым де Бройлем двойственной природы материальных частиц, в частности электрона. Распространив идею Эйнштейна о двойственной природе света на вещество, де Бройль постулировал (1924 г.), что поток электронов, наряду с корпускулярным характером обладает и волновыми свойствами. Исходя из учения о корпускулярно-волновой природе частиц вещества, австрийский физик Шрёдингер и ряд других ученых разработали теорию движения микрочастиц – волновую механику, которая привела к созданию квантово-механической модели атома Волновая механика Шрёдингера и матричная механика, созданная в то время немецким физиком Гейзенбергом (Хайзенбергом), явились двумя равноценными формами представления квантовой механики. Однако ни одна из созданных моделей полностью не воспроизводит реальную действительность, хотя и является полезной для решения определенных научных задач. Модель атома Бора более десяти лет служила инструментом для трактовки химической связи. Тем не менее представление о том, что электроны движутся по определенным орбитам вокруг ядра, недостаточно точно соответствует реальному их поведению в атоме. Такое представление о способе существования электронов в атоме следует признать упрощенным, заимствованным из теории механики движения твердых макротел, поэтому оно непригодно для объяснения возникновения химической связи между атомати. Современная квантово-механическая, орбитальная модель атома не только абстрактно-математически описывает движение электронов в атоме, но и обеспечивает достаточно наглядное представление о строении электронной оболочки атома. |
Современная атомная теория – будьте готовы! Все, что нужно знать для 1 курса химии
Стенограмма видеозаписи
У нейтрального атома такое же количество протонов, как и у электронов.
Единые атомные единицы массы (u):| масса атома углерода, содержащего шесть протонов и шесть нейтронов. | Используя это измерение, масса протона и нейтрона приблизительно равна. | Массы всех элементов определены в единых атомных единицах массы. |
масса атома углерода.
Z = количество протонов = атомный номер
A = количество протонов + количество нейтронов = массовое число
| Элемент | Химический символ (X) | Атомный номер (Z) | Массовое число (A) |
| Один или несколько атомов одного типа. | Аббревиатура из одной или двух букв, присвоенная каждому элементу. | Число протонов в ядре атома. Тип атома / элемента определяется количеством протонов. | Сумма количества нейтронов и протонов в ядре атома. |
Количество протонов определяет тип атома или элемента!
Изотопы – это атомы одного типа, которые имеют одинаковое количество протонов и различное количество нейтронов.
| Мы знаем: | Изотопы: |
Количество протонов определяет тип атома или элемента. Нейтроны и протоны составляют ядро атома и имеют примерно одинаковую массу. | Количество протонов определяет тип атома или элемента. Изотопы элементов различаются по массовому числу (А). |
Атомы элемента, у которых разное количество нейтронов.
Обозначение изотопов
Включение атомного номера является избыточным при представлении изотопов. Обычно используются следующие обозначения: X-A.
Например: Si-28, Si-29, Si-30
Мы знаем: | Атомная масса: |
Изотопы – это атомы одного типа, у которых разное количество нейтронов. Масса атома определяется массой протонов и нейтронов, потому что по сравнению с ними массой электрона можно пренебречь. | Средневзвешенное значение масс изотопов, основанное на естественном содержании каждого изотопа. Естественное содержание – это относительное количество каждого изотопа, обнаруженного в естественном образце любого элемента. Естественное изобилие относительно постоянное и уникальное для каждого элемента. |
Атомная масса элемента, как показано в периодической таблице, представляет собой средневзвешенное значение изотопных масс этого элемента.
Атомная масса Пример:Этот образец меди (Cu) будет содержать примерно 30,83% Cu-65 и 69,17% Cu-63.
Расчет атомной массы:Атомная масса элемента может быть рассчитана по следующей формуле:
Проще говоря, эта формула говорит нам, что атомную массу можно вычислить по формуле:
1) Умножение каждой изотопной массы элемента на его относительное содержание. | 2) Складываем полученные массы изотопов. |
Расчет атомной массы включен в раздел примеров!
Измерение, подобное паре, дюжине или баллу. Пара – это 2 предмета, дюжина – это 12 предметов, а оценка – 20 предметов.
объекта = число Авогадро
Определение родинки:Моль определяется с помощью изотопа C-12.
Один моль = количество атомов ровно в 12 г C-12.
12 г C-12 = 1 моль атомов C-12 = ровно C-12 атомов
Масса одного моля атомов C-12 12 г
1 моль углерода (C) =
атомов Молярная масса:Использование C-12 в качестве стандарта для моля дает соотношение между массой, числом атомов и унифицированными атомными единицами массы.
Крот можно использовать для подсчета атомов в зависимости от их массы.
Молярная масса элемента – это масса одного моля каждого элемента.
Молярная масса элемента:Молярная масса элемента – это масса одного моля каждого элемента.
Молярная масса – масса x атомов каждого элемента.
Молярная масса численно эквивалентна массе элемента в единых атомных единицах массы.
Молярная масса численно эквивалентна атомной массе
Периодические тенденции
| Металлы: | Неметаллы: | Металлоиды: |
В целом хорошие проводники тепла и электричества Имеет тенденцию терять электроны в химической реакции | Обычно плохие проводники тепла и электричества Склонны к получению электронов в химической реакции | Обладают свойствами как металлов, так и неметаллов. |
Периодические тенденции
| Основная группа: | Переходные металлы: | Лантаноиды и актиноиды: |
Элементы с предсказуемыми свойствами | Элементы с непредсказуемыми свойствами. | Элементы, расположенные отдельно для более компактной таблицы Менделеева.По своим свойствам они аналогичны элементам лантану и актинию. |
Периодические тенденции
Каждый столбец в периодической таблице называется группой и пронумерован 1-18 | Каждая строка в периодической таблице называется строкой и пронумерована 1-7 | Элементы в группе имеют похожие свойства. | Например: благородные газы в группе 18 относительно инертны. |
| Мы знаем: | Ионы: | Ионы и группы: |
Количество протонов определяет тип атома или элемента. Нейтроны и протоны составляют ядро атома и имеют примерно одинаковую массу. | Один или несколько атомов, которые получили или потеряли электрон (ы). Ионы – заряженные частицы. Периодическая таблица Менделеева может помочь предсказать, какие ионы будут образовываться. | Неметаллы основной группы обычно получают электроны. Металлы основной группы обычно теряют электроны. |
Ионы – это заряженные частицы, которые получили или потеряли электрон (ы).
| Катион (+): | Анион (-): | Ионное обозначение: |
Один или несколько атомов, потерявших электрон (ы). Основная группа МЕТАЛЛОВ будет ПОТЕРЯТЬ электроны с образованием КАТИОНА с тем же числом электронов, что и ближайший благородный газ. | Один или несколько атомов, получивших электрон (ы). Основная группа НЕМЕТАЛЛОВ будет НАБИРАТЬ электроны, чтобы сформировать АНИОН с тем же числом электронов, что и ближайший благородный газ. | Ионы представлены как химический символ иона с зарядом иона, отмеченным верхним индексом справа. Литий-ионный = |
Примеры
Следующие примеры помогут вам решить проблему.
Пример задачи 1Рассчитайте среднюю атомную массу кремния, используя информацию в таблице.
| Изотоп | Процент естественного изобилия (%) | Масса (ед.) |
| Si-28 | 92,2 | 27,9769 |
| Si-29 | 4,7 | 28,9764 |
| Si-30 | 3,1 | 29.9738 |
Эти золотые серьги имеют массу 1,00 г. Посчитайте количество молей золота в серьгах, сколько атомов золота содержат серьги? Предположим, что серьги из чистого золота. |
Ниже представлены два документа. Один – практические задачи, второй – те же проблемы с решениями.
Их можно загрузить и изменить в соответствии с вашими потребностями.
Викторина
Стенограмма видеозаписи
Модель атома Бора | Квантовая механическая модель атома | Шредингер – Квантово-механические модели |
| Положение электрона описывается как траектория. | Положение электрона, описанное как распределение вероятностей. | Квантовая механическая модель атома. Положение электрона описывается как распределение вероятностей. |
Вероятное положение электрона в атоме, описанное картой распределения вероятностей.
Квантовые числа = «Адрес» электрона
| Главное квантовое число (n) | Квантовое число углового момента (л) | Магнитное квантовое число |
Размер орбиты и уровень энергии электрона. Целое число 1,2,3,4… .. n увеличивается с энергией электрона и расстоянием от ядра. Каждый уровень называется оболочкой. | Форма орбиты. 0,1,2,3,…, п-1 Каждое значение l является подоболочкой Каждому числовому значению l присваивается буква s, p, d, f, g…. | Ориентация орбиты в трехмерном пространстве. Значение = целые числа от –l… l. Имеется 2 (l) +1 значений для каждого значения l. |
Орбитальные формы = Число углового момента (l)
| Значения (l) углового момента | |
| Номер | Письмо |
| 0 | с |
| 1 | п |
| 2 | г |
| 3 | f |
| 4 | г |
Буквенные значения продолжаются в соответствии с алфавитом после f, за исключением J.
s, p, d, f, g, h, i, k,… .. Трезвые физики не находят жирафов, прячущихся на кухнях
с Орбитальный:
Одно допустимое значение для = один тип орбиты s для каждого значения n.
p Орбитали:
Три разрешенных значения для = трех типов p-орбиталей для n значений, больших и равных двум.
d Орбитали:
Пять допустимых значений для = пяти типов d-орбиталей для n, большего и равного трем.
Спин присущ всем электронам, он квантован только с двумя ориентациями; вращать вверх или вниз.
Значение = ИЛИ
Никакие два электрона в атоме не могут иметь одинаковые четыре квантовых числа, однако любые три квантовых числа могут быть одинаковыми.
Это означает: одна орбиталь может содержать два электрона с противоположной ориентацией спинов!
В одноэлектронной системе подоболочки вырождены; означает s, p, d, f, …, все они имеют одинаковый уровень энергии в каждой оболочке.Однако в многоэлектронном атоме подоболочки имеют разные уровни энергии.
Одноэлектронный атом | Многоэлектронный атом |
Это означает, что мы хотим знать о системе, в которой орбитали с более низкой энергией заполняются раньше орбиталей с более высокой энергией. Эта идея называется принципом Ауфбау, и общий порядок, в котором электроны заполняют орбитали в атоме для достижения конфигурации основного состояния, следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
Электроны будут по отдельности занимать вырожденные орбитали, пока они не заполнятся наполовину, прежде чем объединиться с другими электронами.Электроны на половине полных орбиталей будут иметь одинаковый спин.
Обозначение, которое представляет орбитали, занятые электронами в атоме.
Запишите значение n, а затем количество электронов, разрешенных на каждой орбитали, до тех пор, пока все электроны в атоме не будут отнесены к орбитали.
Пример углерода: 6 электронов =
| Основные электроны | Валентные электроны | Кратковременная электронная конфигурация |
| Электроны в заполненной внутренней оболочке. | Электроны во внешней оболочке (максимальное значение n). Пример: Углерод 6 электронов = | Электронная конфигурация, использующая благородный газ для представления заполненных оболочек и записывающая только валентные электроны. |
Диаграмма, которая представляет заполненные орбитали в атоме, обозначая электрон стрелкой.
Каждая подоболочка представлена линией или кругом, электроны представлены стрелками, указывающими вверх или вниз в зависимости от спина электрона.
| Пример углерода: 6 электронов = |
Примеры
Следующее видео поможет вам понять конфигурацию электронов и орбитальные схемы
Стенограмма видеозаписи
Набор задач
Ниже представлены два документа. Один – практические задачи, второй – те же проблемы с решениями.
Их можно загрузить и изменить в соответствии с вашими потребностями.
Викторина
атомизм | философия | Британника
атомизм , любая доктрина, объясняющая сложные явления в терминах совокупностей фиксированных частиц или единиц.Эта философия нашла наиболее успешное применение в естествознании: согласно атомистической точке зрения, материальная вселенная состоит из мельчайших частиц, которые считаются относительно простыми, неизменными и слишком маленькими, чтобы их можно было увидеть. Таким образом, разнообразие видимых форм в природе основано на различиях в этих частицах и их конфигурациях; следовательно, любые наблюдаемые изменения должны сводиться к изменениям в этих конфигурациях.
Основная природа атомизма
Атомизм – это, по сути, аналитическая доктрина.Он рассматривает наблюдаемые формы в природе не как внутренние целостности, а как совокупности. В отличие от холистических теорий, которые объясняют части с точки зрения качеств, проявляемых целым, атомизм объясняет наблюдаемые свойства целого свойствами его компонентов и их конфигураций.
Чтобы понять историческое развитие атомизма и, особенно, его связь с современной атомистической теорией, необходимо проводить различие между атомизмом в строгом смысле слова и другими формами атомизма.Атомизм в строгом смысле слова характеризуется тремя пунктами: атомы абсолютно неделимы, качественно идентичны (т. Е. Различны только по форме, размеру и движению) и могут сочетаться друг с другом только путем наложения друг на друга. Другие формы атомизма менее строги в этом отношении.
Атомизм обычно ассоциируется с «реалистичным» и механистическим взглядом на мир. Это реалистично в том смысле, что атомы не рассматриваются как субъективные конструкции разума, используемые для того, чтобы лучше понять явления, подлежащие объяснению; вместо этого атомы существуют в реальной действительности.Точно так же механистический взгляд на вещи, который утверждает, что все наблюдаемые изменения могут быть сведены к изменениям конфигурации, не просто вопрос использования полезной объяснительной модели; механистический тезис, напротив, утверждает, что все наблюдаемые изменения вызываются движением атомов. Наконец, как аналитическая доктрина атомизм противопоставляется организменным доктринам, которые учат, что природу целого нельзя открыть, разделив его на составные части и изучив каждую часть отдельно.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасРазличные смыслы атомизма
Термин «атомизм» происходит от греческого слова atoma – «вещи, которые нельзя разрезать или разделить».
Два основных типа атомизма
Историю атомизма можно разделить на два более или менее различных периода: философский и научный, с переходным периодом между ними (с 17-го по 19-й век).Этот исторический факт оправдывает различие между философским и научным атомизмом.
Философский атомизм
В философском атомизме, столь же древнем, как и греческая философия, внимание было сосредоточено не на подробном объяснении всех видов конкретных явлений, а на некоторых основных общих аспектах этих явлений и на общих линиях, согласно которым рациональное объяснение этих аспектов было возможно. Эти основные аспекты заключались в существовании в природе множества различных форм и непрерывных изменений.Как можно объяснить эти особенности? Философский атомизм дал общий ответ на этот вопрос. Однако он не ограничивался строго общей проблемой объяснения возможности изменения и множественности – даже в древнегреческом атомизме, поскольку в греческой мысли философия и наука все еще составляли единство. Следовательно, атомисты также пытались дать более подробные объяснения конкретных явлений, таких как испарение, хотя эти объяснения предназначались больше для поддержки общей доктрины атомизма, чем для установления физической теории в современном смысле этого слова.Такая теория еще не была возможна, потому что физическая теория должна была основываться на косвенной или прямой информации о конкретных свойствах задействованных атомов, а такая информация тогда была недоступна.
Чем модель атома Бора отличается от современной теории?
Бор считал, что электроны вращаются вокруг ядра по круговым траекториям; тогда как с современной точки зрения атомная электронная структура больше похожа на трехмерные стоячие волны.
Бор построил модель атома Резерфорда.В нем большая часть массы атома сосредоточена в центре (то, что мы теперь называем ядром ), а электроны окружают положительную массу чем-то вроде облака. Наиболее значительным вкладом Бора было объяснение модели с использованием количественной энергии. Он считал, что электроны движутся вокруг ядра по круговым орбитам с квантованной потенциальной и кинетической энергиями.
В принципе, количественный аспект модели все еще считается правильным. Основная проблема заключается в идее электронов на круговых орбитах.Это не удовлетворяет принципу неопределенности Гейзенберга, заключающемуся в том, что невозможно узнать положение и импульс частицы одновременно. Кроме того, это не соответствует тому факту, что атомы имеют трехмерное образование. Если орбитали круговые, трехмерная структура атома маловероятна.
Применение уравнения Шредингера к спектрам излучения / поглощения водорода показало, что модель уровня энергии стоячей волны соответствует испускаемым / поглощенным фотонам.Ученые теперь используют идею облака вероятностей для описания распределения электронов вокруг ядра.
Облака вероятности удовлетворяют принципу неопределенности Гейзенберга, потому что облако только иллюстрирует вероятность нахождения электрона в этом пространстве, а не уверенность нахождения его там. Если вы посмотрите внимательно, вы также можете увидеть образование облаков по типу стоячей волны. Взгляните на это изображение облаков вероятности водорода.
Эффект Старка и Эффект Зеемана нельзя было объяснить, потому что не было введено понятие подуровней энергии.
(хронология теорий от 2500 лет назад до современной теории. Теория Бора начинается примерно через 4 минуты)
Хронология атомной структуры
Хронология атомной структуры
400 до н. Э. Атомная теория Демокрита утверждала, что вся материя состоит из небольших неразрушимых единиц, которые он назвал атомами.
1704 Исаак Ньютон теоретизировал механическую Вселенную с маленькими твердыми массами в движении.
1803 Джон Дальтон предположил, что элементы состоят из атомов, которые были идентичны и имели одинаковую массу, а соединения – это атомы разных элементов, объединенных вместе.
1832 Майкл Фарадей разработал два закона электрохимии.
1859 Дж. Плюккер построил одну из первых электронно-лучевых трубок.
1869 Дмитрий Менделеев создал таблицу Менделеева.
1873 Джеймс Клерк Максвелл предложил теорию электромагнетизма и установил связь между светом и электромагнитными волнами.
1874 Г.Дж. Стоуни предположил, что электричество состоит из отрицательных частиц, которые он назвал электронами.
1879 г. Эксперименты сэра Уильяма Крукса с электронно-лучевыми трубками привели его к подтверждению работ более ранних ученых, убедительно продемонстрировав, что катодные лучи имеют отрицательный заряд.
1886 г. Э. Гольдштейн открыл канальные лучи, которые имеют положительный заряд, равный электрону.
1895 Вильгельм Рентген открыл рентгеновские лучи.
1896 Анри Беккерель открыл излучение, изучая воздействие рентгеновских лучей на фотопленку.
1897 Дж. Дж. Томсон определил отношение заряда к массе электронов.
1898 Резерфорд открыл альфа, бета и гамма-лучи в радиации.
1898 Мария Склодовская Кюри открыла радий и полоний и ввела термин «радиоактивность» после изучения процесса распада урана и тория.
1900 Макс Планк предложил идею квантования, чтобы объяснить, как горячий светящийся объект излучает свет.
1900 Фредерик Содди придумал термин «изотоп» для объяснения непреднамеренного разрушения радиоактивных элементов.
1903 Хантаро Нагаока предложил атомную модель, называемую Сатурнианской моделью, для описания структуры атома.
1904 Ричард Абегг обнаружил, что инертные газы имеют «стабильную электронную конфигурацию».
1906 Ганс Гейгер изобрел устройство, способное обнаруживать альфа-частицы.
1914 Г. Дж. Дж. Мозли обнаружил, что количество протонов в элементе определяет его атомный номер.
1919 Фрэнсис Уильям Астон использовал масс-спектрограф для идентификации 212 изотопов.
1922 Нильс Бор предложил теорию строения атома, согласно которой внешняя орбита атома может содержать больше электронов, чем внутренняя.
1923 Луи де Бройль предположил, что электроны обладают дуализмом волна / частица.
1929 Кокрофт / Уолтон создали первую ядерную реакцию с образованием альфа-частиц
1930 Поль Дирак предположил существование античастиц.
1932 Джеймс Чедвик открыл нейтроны, частицы, масса которых была близка к массе протона.
1938 Лиз Мейтнер, Хан, Штрассман открыли ядерное деление.
1941-51 Гленн Сиборг открыл восемь трансурановых элементов.
1942 Энрико Ферми создал первый искусственный ядерный реактор.
Популярные товары
(PDF) Теории атома, которые сбивают с толку учителей естествознания, и основные причины
214
Концепция атома в химическом образовании
Химия – это область обучения, которая повышает уровень восприятия невидимого и
неприкосновенного концепции и позволяет понять информацию, которую мы не можем обнаружить напрямую через наши органы чувств.Атом и его структура, которые мы не можем видеть напрямую и поэтому должны визуализировать
, считались одним из ключевых предметов в процессе перехода от Демокрита к квантовой теории
(Демирчи, Йылмаз и Шахин, 2016). Понимание взаимоотношений атомов и молекул
лежит в основе химии (Whitten, Davis, Peck, & Stanley, 2009).
Атом объясняется с помощью атомных моделей с момента его открытия, и поэтому учителя пытаются объяснить
структуру атома, используя эти модели, чтобы помочь своим ученикам легче понять его структуру
(Podolefsky & Finkelstein, 2006; Jong, 2009) .Атом – ключевая концепция в преподавании и изучении естественных наук
(Erduran, 2014). Мнение о том, что материя на самом деле состоит из крошечных причастий, называемых атомом, восходит к
–годам V века до нашей эры. С тех пор было предложено большое количество атомных теорий, и каждая атомная теория
выявила и исправила недостатки предыдущих, что привело к возникновению и развитию современной современной атомной теории. Современная химия была разработана на основе современной атомной теории
, и поэтому понимание структуры атома и взаимодействия атомов
имеет решающее значение при преподавании естественных наук в школах (Mortimer, 2004).
Атом – это концепция, важность которой растет вместе с развитием науки и технологий, которые являются одним из строительных блоков
науки. По этой причине с каждым днем становится все более важным организовать преподавание концепции атома
в соответствии с требованиями студентов (ökelez & Yalçın, 2012). Строение атома
можно считать одним из основных предметов естественнонаучного образования. Трудно понять предметы
, такие как структура вещества, химические реакции и химические связи, не зная структуры атома
(Maloney, 2007).
Основа предметов определяется концепциями. Чтобы научить
определенному предмету, необходимо обучить ряду концепций. Поэтому большое количество исследований было проведено по концепциям в нашей стране
, а также в других странах мира (Kaya, 2010). Понятию атома были проведены многочисленные исследования
. Альбенезе и Вичентини (1997) провели исследование с участием 30 старшеклассников
в возрасте от 14 до 16 лет и исследовали идеи студентов о модели частиц материи и способе их объяснения с помощью основных понятий атома и молекулы. .Их результаты показали, что все студенты
сообщили, что понятия атома и молекулы связаны с мельчайшими частицами материи. Структура атома
– важная и центральная концепция, которой у студентов есть много альтернатив, и поэтому
испытывают трудности в понимании (Demirciolu, Altuntaş Aydın, & Demirciolu, 2012). Атомная теория – это научная теория
, оказавшая огромное влияние на физику и биологию, а также на химию (Ronan, 1983).
Квантовая теория особенно совершила прорыв в развитии науки и принесла около
революционных изменений в атомную теорию. Модель, принятая учеными и сегодня, – модель атома облака электронного
– основана на квантовой теории. В этой модели электроны изображаются как частицы
, движущиеся вокруг ядра в пределах определенной орбитали. Это относится к плотности электронов вокруг ядра
.Тем не менее открытие атома все еще продолжается. Точное понимание атомных моделей
от самой ранней до самой последней имеет большое значение в химии и для истории науки
. Атомная структура – это центральное понятие в химии и науке, и правильное понимание этого
затруднено из-за его абстрактной структуры. Многие атомные модели были разработаны учеными на протяжении всей истории
из-за его абстрактной структуры.Эти модели
визуально облегчают восприятие и понимание атомной структуры. Трудности, с которыми сталкиваются студенты, и ошибки, которые они делают при изучении структуры атома
, обсуждались во многих исследованиях в литературе (Gilbert and Watts,
1983; Griffiths and Preston, 1992).
Одним из фундаментальных недостатков школьной химии является то, что учебная программа не преподает учащимся
атомных теорий, использующих связанные модели в связи с соответствующими законами, и не показывает, что
они обладают объяснительной и предсказательной силой, позволяющей им понимать химия.Вместо этого ученикам
приходится иметь дело с отдельными частями знаний (Erduran, 2014).
Студенты обращаются к теории атома Резерфорда, пытаясь описать теорию, которую они называют современной атомной теорией
. Они приходят в класс с заранее подготовленными знаниями, и их идеи практически не меняются, даже если эти идеи ошибочны (Benson et al., 1993; цитируется по Oruncak, 2005). Было замечено, что
A History and Philosophy of Science Perspective на JSTOR
АбстрактныйНедавние исследования в области естественнонаучного образования признали важность истории и философии науки.Цель этого исследования – оценить представление моделей атома Томсона, Резерфорда и Бора в учебниках общей физики на основе критериев, взятых из истории и философии науки. Сорок один учебник общей физики (все изданные в Соединенных Штатах) был оценен по двум критериям, основанным на работе Томсона, три – по работе Резерфорда и три – по работе Бора. Полученные результаты показывают, что учебники общей физики систематически не включают историю и философию науки.Большинство учебников представляют собой индуктивистскую точку зрения, в которой экспериментальные детали считаются первостепенными. Напротив, историческая реконструкция экспериментальных деталей неизбежно включает: контекст, в котором проводится эксперимент, теоретические рамки, которыми руководствуется ученый, и альтернативные интерпретации данных, которые приводят к конфликтам и противоречиям. Приведены примеры, показывающие, как исторические реконструкции атомных моделей могут дать студентам возможность оценить, как работают ученые и прогресс науки.Правдоподобно предположить, что презентации учебников, основанные на истории и философии науки, могут, возможно, пробудить интерес студентов к предмету и, следовательно, привести к более глубокому концептуальному пониманию.
Информация о журналеThe Journal of Science Education and Technology – это международный междисциплинарный форум для приглашенных и написанных рецензируемых статей, которые способствуют развитию естественнонаучного образования на всех уровнях. Журнал публикует широкий спектр статей, охватывающих теорию и практику, чтобы облегчить будущие усилия отдельных лиц и групп, вовлеченных в эту область.Темы подпадают под категории дисциплинарных (например, биология, химия, физика, математика, информатика и инженерия), технологических (например, компьютер, видео, аудио и печать) или организационных (например, законодательство, администрирование, реализация, и повышение квалификации учителей). Признавая растущую роль технологий как в понимании и развитии науки, так и в предоставлении информации, журнал включает технологии как компонент естественнонаучного образования. В дополнение к работам в упомянутых выше областях и тематическим исследованиям образцовых реализаций, журнал публикует обзоры книг, видеокассет, программного обеспечения и соответствующих продуктов, которые помогают достичь нашей общей цели: совершенства в естественнонаучном образовании.
Информация об издателеSpringer – одна из ведущих международных научных издательских компаний, издающая более 1200 журналов и более 3000 новых книг ежегодно по широкому кругу вопросов, включая биомедицину и науки о жизни, клиническую медицину, физика, инженерия, математика, компьютерные науки и экономика.
Современная теория атома: электронные облака, Шредингер и Гейзенберг – Видео и стенограмма урока
Atomic Theory
Ученые узнали об атомах задолго до того, как смогли создать их изображения с помощью мощных увеличительных инструментов.Фактически, атомы получили свое название от древнегреческого слова atomos , что означает «что-то, что не может быть разделено».
Поскольку атомы нельзя было увидеть, ранние идеи об атомах были в основном основаны на философских и религиозных рассуждениях. Ближе к концу 18 века новые способы проведения экспериментов помогли исследователям научиться понимать атомы. Это привело к первой атомной теории , в которой говорилось, что вся материя состоит из атомов, элементы состоят только из одного типа атомов, и атомы могут объединяться с другими атомами, чтобы образовывать более сложные вещества.
Эта первая атомная теория многое объяснила, но по мере того, как наука продолжала развиваться, новая информация и новые открытия дали понять, что теорию необходимо обновлять. Одно из этих новых открытий произошло в конце 19 века, когда была открыта субатомная частица, названная электроном . Слово «субатомный» буквально означает «внутри атома». Благодаря этому открытию стало ясно, что атомы могли быть неправильно названы и что их можно разделить на более мелкие части.
Когда электроны были впервые обнаружены, ученые знали, что они являются частью атома, но не знали, где они находятся. Сначала думали, что электроны плавают по всему атому, как кусочки фруктов в пудинге, как если бы атомы были просто мягкими шариками материи. Но в результате дополнительных экспериментов было обнаружено, что большая часть вещества внутри атомов централизована. К началу 20 века эта централизованная материя была признана ядром атома.
Модель Бора
В 1913 году ученый по имени Нильс Бор расширил все предыдущие исследования атомов и пришел к идее, что отрицательно заряженные электроны вращаются вокруг положительно заряженного ядра определенными путями. Эта концепция стала известна как модель Bohr . Это был первый реальный взгляд на модель атома, подобную солнечной системе, о которой мы упоминали в начале этого урока.
Schrodinger & Heisenberg
Модель Бора была большим шагом вперед в нашем понимании атома, но все же она была относительно простой и не полностью объясняла природу сложных атомов, содержащих много электронов.Это более сложное понимание сформировалось благодаря работе двух ученых 20 века: Эрвина Шредингера и Вернера Гейзенберга .
Шредингер был заинтригован идеей о том, что электроны могут двигаться скорее как волны, чем частицы. Его идеи многое объясняли о природе электронов и о том, как они движутся; но это также создало проблему для ученых.
Гейзенберг и другие ученые поняли, что если электрон двигается как волна, невозможно одновременно измерить его положение и импульс.Это стало известно как принцип неопределенности Гейзенберга . Другими словами, точный путь электрона нельзя было предсказать, как предсказывал Нильс Бор с помощью модели Солнечной системы.
Современная теория атома
Работа Шредингера и Гейзенберга приводит к современной атомной теории , которая показывает нам, что внутри атома существуют области, где, вероятно, существуют электроны. Эти содержащие электроны области, которые существуют вокруг ядра, называются электронными облаками, или орбиталями.Электронные облака окружают ядро и существуют на разных уровнях энергии. Электрон может существовать на любом расстоянии от ядра; однако, в зависимости от уровня его энергии, существуют определенные облака, в которых он будет более или более вероятно находиться.
Резюме урока
Давайте еще раз рассмотрим. Модель Бора описывает атом, который выглядит как миниатюрная солнечная система с отрицательно заряженными электронами, вращающимися вокруг положительно заряженного ядра определенными путями.
Два ученых 20 века, Эрвин Шредингер и Вернер Гейзенберг , показали, что это не совсем правильно.Шредингер исследовал идею о том, что электроны движутся больше как волны, чем частицы.
