Как создавалсь таблица химических элементов — Хакасская Республиканская Детская Библиотека
Как создавалась таблица химических элементовВ 1668 г. Роберт Бойль – выдающийся учёный своей эпохи – опубликовал книгу, в которой развенчал немало мифов об алхимии. Главной идеей этого труда была мысль о необходимости поиска неразложимых химических элементов. С этого момента начался поиск не только этих элементов, но и принципов их упорядочения.
В своей работе Роберт Бойль привёл список неразложимых химических элементов. Было их на тот момент всего пятнадцать. При этом учёный не утверждал, что кроме перечисленных им элементов больше не существует, и вопрос об их количестве оставался открытым.
Через 100 лет французский химик Антуан Лавуазье составил новый список из известных науке элементов. В его реестр попали 35 химических веществ, из которых 23 были впоследствии признаны теми самыми неразложимыми элементами. Работа по поиску новых элементов велась химиками во всём мире и продвигалась вполне успешно.
Работа по поиску новых элементов велась химиками во всём мире и продвигалась вполне успешно.
Открытие Дмитрием Менделеевым периодической таблицы химических элементов в марте 1869 г. стало настоящим прорывом в химии. Российскому учёному удалось систематизировать знания о химических элементах и представить их в виде таблицы, которую и сейчас обязательно изучают школьники на уроках химии. Периодическая таблица стала фундаментом для бурного развития этой сложной и интересной науки, а история её открытия окутана легендами и мифами. Для всех увлекающихся наукой будет интересно узнать правду о том, как Менделеев открыл таблицу периодических элементов.
Попытки классифицировать и систематизировать известные химические элементы предпринимались задолго до Дмитрия Менделеева. Свои системы элементов предлагали такие известные учёные, как Иоганн Деберейнер, Джон Ньюлендс, Юлиус Мейер и другие. Однако, из-за нехватки данных о химических элементах и их правильных атомных массах, предложенные системы были не совсем достоверными.![]()
Работа над таблицей периодических элементов продолжается до сих пор, и современные учёные – химики добавляют новые химические элементы по мере их открытия.
Самым распространённым заблуждением в истории открытия таблицы Менделеева является то, что учёный увидел её во сне.
Миф о «вещем» сне учёного можно объяснить тем, что Менделеев работал над систематизацией химических элементов сутками напролёт, прерываясь на непродолжительный сон.
 Однако только упорный труд и природный талант учёного дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность. Многих учащихся в школе, а иногда и в университете, заставляют заучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего даётся тем людям, которые постоянно поддерживают мозг в тонусе.
Однако только упорный труд и природный талант учёного дал долгожданный результат и обеспечил Дмитрию Менделееву всемирную известность. Многих учащихся в школе, а иногда и в университете, заставляют заучивать или хотя бы примерно ориентироваться в таблице Менделеева. Для этого человек должен не только иметь хорошую память, но и логически мыслить, связывая элементы в отдельные группы и классы. Изучение таблицы легче всего даётся тем людям, которые постоянно поддерживают мозг в тонусе.Хочешь узнать больше? Читай книгу Сэма Кина «Исчезающая ложка, или Удивительные истории из жизни периодической таблицы Менделеева».
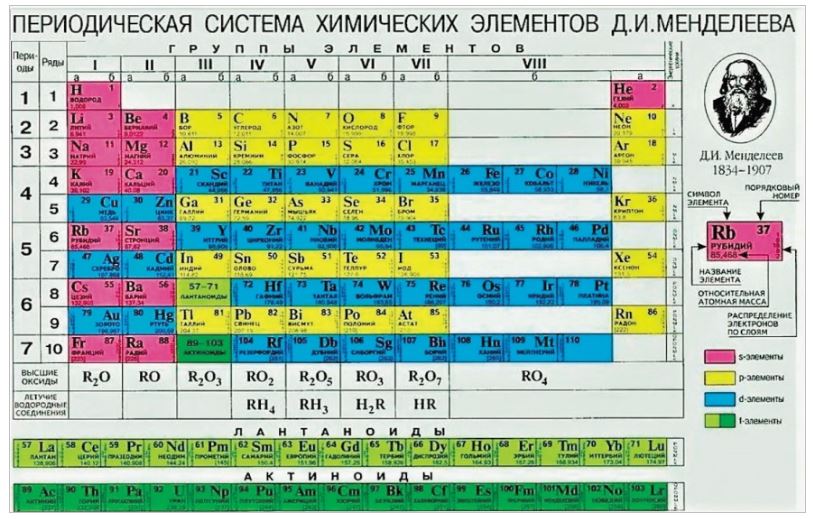
Элементы
Слово «элемент» (лат. elementum) использовалось уже в греко-римской цивилизации как часть чего-то. В те времена была популярной фраза: «Как слова состоят из букв, так и тела — из элементов». Возможно и происхождение этого термина от звучания букв l, m, n, t латинского алфавита, произнесённых подряд: «el» — «em» — «en» — «tum».
В 1789 году французский химик Антуан Лоран Лавуазье в книге «Элементарный курс химии» опубликовал первый в истории новой химии список химических элементов, разделённых на несколько классов. Он впервые отождествил с химическими элементами кислород, азот, водород, серу, фосфор. Ко времени открытия Д.И. Менделеевым Периодического закона в 1869 году было известно 63 элемента. По состоянию на 2018 год известно 118 химических элементов, 94 из них встречаются в природе, 24 искусственно синтезированы.
Наиболее распространенными элементами в земной коре являются кислород и кремний, среднее содержание которых (в массовых процентах) составляет соответственно – 50 и 25. Они вместе с алюминием, железом, кальцием, натрием, калием, магнием, водородом и титаном составляют более 99 % массы земной оболочки. Содержание элементов в коре Земли отличается от их концентраций в Земле, взятой как целое, так как химический состав мантии и ядра другой. Так, ядро состоит в основном из железа и никеля, а на его массу приходится 30% всей массы Земли.
Большинство химических элементов периодической таблицы Менделеева (94 из 118) были найдены в природе: 5 из 94 – технеций, прометий, астат, нептуний, плутоний – сначала были синтезированы, а потом обнаружены в природе в ничтожно малых концентрациях. Например, технеций на Земле встречается в следовых количествах только в урановых рудах, где его содержание составляет 5·10−10 г на 1 кг урана. Но в космосе технеций зафиксирован в спектрах некоторых звёзд в созвездиях Кита, Андромеды, Лебедя и Близнецов. Теперь такие звёзды называют технециевыми.
Большинство химических элементов (83 из 94), обнаруженых в земной коре, являются первичными. Они возникли в результате нуклеосинтеза в галактике до образования Солнечной системы. У них есть стабильные и долгоживущие изотопы, период полураспада которых достаточен, чтобы они не распались за 4,5 млрд лет с момента образования Солнечной системы. Остальные 11: технеций, прометий, полоний, астат, радон, франций, радий, актиний, протактиний, нептуний и плутоний являются радиогенными, то есть возникли в результате радиоактивного распада других элементов.
Остальные 11: технеций, прометий, полоний, астат, радон, франций, радий, актиний, протактиний, нептуний и плутоний являются радиогенными, то есть возникли в результате радиоактивного распада других элементов.
Периодическая таблица элементов динамическая. Алфавитный список химических элементов. Современная формулировка периодического закона такова
Вероятно, все вы видели периодическую таблицу элементов. Возможно, что она и по сей день преследует вас в ваших снах, а может быть, она пока для вас всего лишь визуальный фон, украшающий стенку школьного класса. Однако в этой, казалось бы, случайной коллекции клеток кроется значительно больше, чем это кажется на первый взгляд.
Периодическая таблица (или ПТ, как мы будем периодически называть её в этой статье), а также те элементы, которые входят в неё, обладают чертами, о которых вы, возможно, никогда не догадывались. Вот десять фактов, начиная от создания таблицы и до внесения в неё последних элементов, которые большинству людей не известны.
10. Менделееву помогали
Периодическая таблица стала использоваться, начиная с 1869 года, когда она была составлена заросшим густой бородой Димитрием Менделеевым. Большинство людей думает, что Менделеев был единственным, кто работал над этой таблицей, и благодаря этому он стал самым гениальным химиком столетия. Однако его усилиям помогали несколько европейских учёных, которые внесли важный вклад в завершение этого колоссального набора элементов.
Менделеев широко известен как отец периодической таблицы, но, когда он её составлял, ещё не все элементы таблицы были уже открыты. Как такое стало возможно? Учёные славятся своим безумием…
9. Последние добавленные элементы
Верьте или нет, периодическая таблица не сильно менялась с 1950-х годов. Однако 2 декабря 2016 года было добавлено сразу четыре новых элемента: нихоний (элемент №113), московий (элемент №115), тенессин (элемент №117) и оганесон (элемент №118). Эти новые элементы получили свои названия только в июне 2016 года, так как потребовалась пятимесячная экспертиза, прежде чем их официально добавили в ПТ.
Три элемента получили свои названия в честь городов или государств, в которых их удалось получить, а оганесон был назван в честь российского физика-ядерщика Юрия Оганесяна за его вклад в получение этого элемента.
8. Какой буквы нет в таблице?
В латинском алфавите есть 26 букв, и каждая из них важна. Однако Менделеев решил этого не замечать. Взгляните на таблицу и скажите, какой букве не повезло? Подсказка: ищите по порядку и загибайте при этом пальцы после каждой найденной буквы. В итоге вы найдёте «пропавшую» букву (если у вас на руках присутствуют все десять пальцев). Догадались? Это буква под номером 10, буква «J».
Говорят, что «единица» – это цифра одиноких. Так, может, стоило бы назвать букву «J» буквой одиноких? Но вот забавный факт: большинство мальчиков, родившихся в США в 2000 году, получили имена, начинавшиеся с этой буквы. Таким образом, эта буква не осталась без должного внимания.
7. Синтезированные элементы
Как вы, возможно, уже знаете, на сегодняшний день в периодической таблице присутствует 118 элементов.
 Можете ли вы догадаться, сколько элементов из этих 118 были получены лабораторным путём? Из всего общего списка в природных условиях можно найти лишь 90 элементов.
Можете ли вы догадаться, сколько элементов из этих 118 были получены лабораторным путём? Из всего общего списка в природных условиях можно найти лишь 90 элементов.Вам кажется, что 28 искусственно созданных элементов – это много? Ну, просто поверьте на слово. Их синтезируют, начиная с 1937 года, и учёные продолжают это делать и сейчас. Все эти элементы вы можете найти в таблице. Посмотрите на элементы с 95 по 118, все эти элементы отсутствуют на нашей планете и были синтезированы в лабораториях. То же касается и элементов под номерами 43, 61, 85 и 87.
6. 137-й элемент
В середине 20-го века известный учёный по имени Ричард Фейнман сделал довольно громкое заявление, которое повергло в изумление весь научный мир нашей планеты. По его словам, если мы когда-нибудь обнаружим 137-й элемент, то мы не сможем определить количество в нём протонов и нейтронов. Число 1/137 примечательно тем, что это значение константы тонкой структуры, которая описывает вероятность поглощения или излучения электроном фотона.
 Теоретически элемент №137 должен иметь 137 электронов и 100-процентную вероятность поглощения фотона. Его электроны будут вращаться со скоростью света. Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.
Теоретически элемент №137 должен иметь 137 электронов и 100-процентную вероятность поглощения фотона. Его электроны будут вращаться со скоростью света. Ещё более невероятно, что электроны элемента 139, чтобы существовать, должны вращаться быстрее, чем скорость света.Вы ещё не устали от физики? Возможно, вам будет интересно узнать, что число 137 объединяет три важнейших области физики: теорию о скорости света, квантовую механику и электромагнетизм. С начала 1900-х годов физики предполагают, что цифра 137 может быть основой Великой единой теории, в которую войдут все три вышеуказанных области. По общему признанию, это звучит так же невероятно, как легенды о НЛО и о Бермудском треугольнике.
5. Что можно сказать о названиях?
Почти все названия элементов имеют какой-то смысл, хотя он и не сразу понятен. Названия новым элементам даются не произвольно. Я бы назвал элемент просто первым пришедшим мне в голову словом. Например, «керфлумп». По-моему, неплохо.
Как правило, названия элементов относятся к одной из пяти основных категорий. Первая – это имена известных учёных, классический вариант – эйнштейний. Кроме того, элементы могут получить свои имена в зависимости от тех мест, где они были впервые зарегистрированы, например, германий, америций, галлий и т. д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
Первая – это имена известных учёных, классический вариант – эйнштейний. Кроме того, элементы могут получить свои имена в зависимости от тех мест, где они были впервые зарегистрированы, например, германий, америций, галлий и т. д. В качестве дополнительной опции используются названия планет. Элемент уран был впервые обнаружен вскоре после того, как была открыта планета Уран. Элементы могут носить имена, связанные с мифологией, например, существует титан, названный так в честь древнегреческих титанов, и торий, названный по имени скандинавского бога-громовержца (или звёздного «мстителя», в зависимости от того, что вы предпочитаете).
И, наконец, есть названия, описывающие свойства элементов. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «медленный». Из названия следует предположение, что этот газ не отличается активностью. Бром – это ещё один элемент, название которого происходит от греческого слова. «Бромос» означает «зловоние», и это довольно точно описывает запах брома.
4. Было ли создание таблицы «озарением»
Если вы любите карточные игры, то этот факт для вас. Менделееву требовалось каким-то образом упорядочить все элементы и найти систему для этого. Естественно, что для создания таблицы по категориям он обратился к пасьянсу (ну, а к чему же ещё?) Менделеев записал атомный вес каждого элемента на отдельной карточке, а затем приступил к раскладке своего передового пасьянса. Он укладывал элементы в соответствии с их специфическими свойствами, а затем упорядочивал их в каждом столбце в соответствии с их атомным весом.
Многие не могут сложить и обычный пасьянс, так что этот пасьянс впечатляет. Что будет дальше? Наверное, кто-нибудь с помощью шахмат сделает переворот в астрофизике или создаст ракету, способную долететь до окраин галактики. Представляется, что в этом не будет ничего необычного, если учесть, что Менделеев сумел получить такой гениальный результат всего лишь с помощью колоды обычных игральных карт.
3. Невезучие инертные газы
Помните, как мы классифицировали аргон как самый «ленивый» и «медленный» элемент в истории нашей вселенной? Похоже, что Менделеевым овладели такие же чувства.
 Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.
Когда в 1894 году впервые удалось получить чистый аргон, он не вписывался ни в один из столбцов таблицы, поэтому, вместо того чтобы заняться поисками решения, учёный решил просто отрицать его существование.Ещё более поразительно, что аргон был не единственным элементом, который изначально постигла эта судьба. Помимо аргона, без классификации остались ещё пять других элементов. Это коснулось радона, неона, криптона, гелия и ксенона – и все отрицали их существование просто потому, что Менделеев не смог найти для них места в таблице. После нескольких лет перегруппировки и переклассификации этим элементам (названных инертными газами) всё-таки посчастливилось присоединиться к достойному клубу признанных реально существующими.
2. Атомная любовь
Совет для всех тех, кто считает себя романтиком. Возьмите бумажную копию периодической таблицы и вырежьте из неё все сложные и относительно ненужные средние столбцы так, чтобы у вас осталось 8 колонок (вы получите «короткую» форму таблицы).
 Сложите её посредине IV группы – и вы узнаете, какие элементы могут образовывать соединения друг с другом.
Сложите её посредине IV группы – и вы узнаете, какие элементы могут образовывать соединения друг с другом.Элементы, которые «целуются» при складывании, способны образовывать стабильные соединения. Эти элементы имеют комплементарные электронные структуры, и они будут сочетаться друг с другом. И, если это не настоящая любовь, как у Ромео с Джульеттой или у Шрека с Фионой – тогда я не знаю, что такое любовь.
1. Углерод рулит
Углерод пытается быть в центре игры. Вы думаете, что всё знаете об углероде, но это не так, он занимает намного более важное место, чем вы это себе представляете. Знаете ли вы, что он присутствует более чем в половине всех известных соединений? И как насчёт того факта, что 20 процентов веса всех живых организмов приходится на углерод? Это действительно странно, но приготовьтесь: каждый атом углерода в вашем теле был когда-то частью фракции углекислого газа в атмосфере. Углерод является не только суперэлементом нашей планеты, он четвёртый по численности элемент во всей Вселенной.

Если периодическую таблицу сравнить с вечеринкой, то углерод – её главный ведущий. И кажется, что он единственный знает, как нужно всё правильно организовать. Ну и, помимо прочего, это основной элемент всех бриллиантов, так что при всей своей назойливости он ещё и блестит!
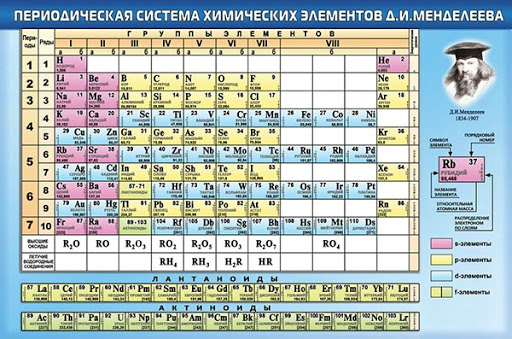
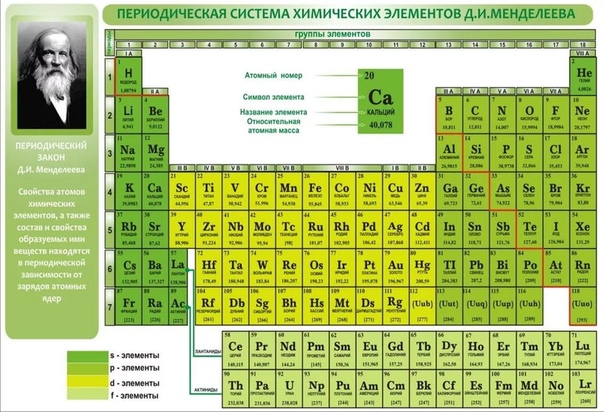
Девятнадцатый век в истории человечества – век, в который многие науки реформировались, в том числе и химия. Именно в это время появилась периодическая система Менделеева, а вместе с ней – и периодический закон. Именно он стал основой современной химии. Периодическая система Д. И. Менделеева представляет собой систематизацию элементов, которая устанавливает зависимость химических и физических свойств от строения и заряда атома вещества.
История
Начало периодической положила книга «Соотношение свойств с атомным весом элементов», написанная в третьей четверти XVII века. В ней были отображены основные понятия относительно известных химических элементов (на тот момент их насчитывалось всего 63). К тому же у многих из них атомные массы были определены неправильно. Это сильно мешало открытию Д. И. Менделеева.
Это сильно мешало открытию Д. И. Менделеева.
Дмитрий Иванович начал свою работу со сравнения свойств элементов. В первую очередь он занялся хлором и калием, а уж потом перешёл к работе со щелочными металлами. Вооружась специальными карточками, на которых были изображены химические элементы, он многократно пытался собрать эту «мозаику»: раскладывал на своем столе в поисках нужных комбинаций и совпадений.
После долгих стараний Дмитрий Иванович все же нашёл ту закономерность, которую искал, и выстроил элементы в периодические ряды. Получив в результате пустые ячейки между элементами, учёный понял, что русским исследователям известны не все химические элементы, и что именно он должен дать этому миру те знания в области химии, которые ещё не были даны его предшественниками.
Всем известен миф о том, что Менделееву периодическая таблица явилась во сне, и он по памяти собрал элементы в единую систему. Это, грубо говоря, ложь. Дело в том, что Дмитрий Иванович довольно долго и сосредоточенно работал над своим трудом, и его это сильно выматывало. Во время работы над системой элементов Менделеев однажды заснул. Проснувшись, он понял, что не закончил таблицу, и скорее продолжил заполнение пустых ячеек. Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Во время работы над системой элементов Менделеев однажды заснул. Проснувшись, он понял, что не закончил таблицу, и скорее продолжил заполнение пустых ячеек. Его знакомый, некий Иностранцев, университетский педагог, решил, что таблица Менделееву приснилась во сне и распространил данный слух среди своих студентов. Так и появилась данная гипотеза.
Известность
Химических элементов Менделеева является отображением созданного Дмитрием Ивановичем ещё в третьей четверти XIX века (1869 год) периодического закона. Именно в 1869 году на заседании русского химического сообщества было зачитано уведомление Менделеева о создании им определённой структуры. И в этом же году была выпущена книга «Основы химии», в которой впервые была опубликована периодическая система химических элементов Менделеева. А в книге «Естественная система элементов и использование её к указанию качеств неоткрытых элементов» Д. И. Менделеев впервые упомянул понятие «периодический закон».
Структура и правила размещения элементов
Первые шаги в создании периодического закона были сделаны Дмитрием Ивановичем еще в 1869-1871 годах, в то время он усиленно работал над установлением зависимости свойств данных элементов от массы их атома. Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Современный вариант представляет собой сведённые в двумерную таблицу элементы.
Положение элемента в таблице несёт определённый химический и физический смысл. По местонахождению элемента в таблице можно узнать, какая у него валентность, определить и другие химические особенности. Дмитрий Иванович пытался установить связь между элементами, как сходными между собой по свойствам, так и отличающимися.
В основу классификации известных на тот момент химических элементов он положил валентность и атомную массу. Сопоставляя относительные свойства элементов, Менделеев пытался найти закономерность, которая объединила бы все известные химические элементы в одну систему. Расположив их, основываясь на возрастании атомных масс, он всё-таки добился периодичности в каждом из рядов.
Дальнейшее развитие системы
Появившаяся в 1969 году таблица Менделеева ещё не раз дорабатывалась. С появлением благородных газов в 1930 годах получилось выявить новейшую зависимость элементов – не от массы, а от порядкового номера. Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Позднее удалось установить число протонов в атомных ядрах, и оказалось, что оно совпадает с порядковым номером элемента. Учёными XX века было изучено электронное Оказалось, что и оно влияет на периодичность. Это сильно меняло представления о свойствах элементов. Данный пункт был отражён в более поздних редакциях периодической системы Менделеева. Каждое новое открытие свойств и особенностей элементов органично вписывалось в таблицу.
Характеристики периодической системы Менделеева
Таблица Менделеева поделена на периоды (7 строк, расположенных горизонтально), которые, в свою очередь, подразделяются на большие и малые. Начинается период со щелочного металла, а заканчивается элементом с неметаллическими свойствами.
Вертикально таблица Дмитрия Ивановича поделена на группы (8 столбцов). Каждая из них в периодической системе состоит из двух подгрупп, а именно – главной и побочной. После долгих споров по предложению Д. И. Менделеева и его коллеги У. Рамзая было решено ввести так называемую нулевую группу. В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, – для них были выделены отдельные ячейки.
В неё входят инертные газы (неон, гелий, аргон, радон, ксенон, криптон). В 1911 году учёным Ф. Содди было предложено поместить в периодической системе и неразличимые элементы, так называемые изотопы, – для них были выделены отдельные ячейки.
Несмотря на верность и точность периодической системы, научное общество долго не хотело признавать данное открытие. Многие великие учёные высмеивали деятельность Д. И. Менделеева и считали, что невозможно предсказать свойства элемента, который ещё не был открыт. Но после того как предполагаемые химические элементы были открыты (а это были, например, скандий, галлий и германий), система Менделеева и его периодический закон стали науки химии.
Таблица в современности
Периодическая система элементов Менделеева – основа большинства химических и физических открытий, связанных с атомно-молекулярным учением. Современное понятие элемента сложилось как раз благодаря великому учёному. Появление периодической системы Менделеева внесло кардинальные изменения в представления о различных соединениях и простых веществах. Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
Создание ученым периодической системы оказало огромное влияние на развитие химии и всех наук, смежных с ней.
Химия – увлекательный, но сложный предмет. А если в школе еще и не было принадлежностей для проведения экспериментов, то можно сказать, что она и вовсе прошла мимо. Но есть то, в чём должен хотя бы минимально ориентироваться каждый человек. Это таблица Менделеева.
Для школьников выучить ее – настоящая пытка. Если они видят ее в снах, то только кошмарных. Так много элементов, у каждого свой номер… Но одна многодетная мать придумала занимательный способ, как выучить таблицу Менделеева . Он подойдет как для детей, так и для взрослых, и о нём тебе с радостью расскажет реакция «Так Просто!» .
Периодическая таблица химических элементов
Как показывает опыт матери четверых детей Карин Трипп, при правильном подходе возможно выучить всё. Чтобы приобщить к изучению химии даже маленьких детей, она решила превратить периодическую таблицу элементов в поле для морского боя.
Игра содержит четыре страницы с таблицей Менделеева – по две для каждого игрока. Каждому игроку на одной таблице необходимо нарисовать свои корабли, а на другой – обозначать точками свои выстрелы и подбитые корабли соперника.
Правила морского боя такие же, как в классической игре. Только для того, чтобы подстрелить кораблик соперника, нужно назвать не букву c цифрой, а соответствующий химический элемент.
Такая методика позволит детям не только усвоить названия химических элементов. Она способствует развитию памяти и логического мышления. Ведь дети будут анализировать порядковые номера и цвета.
Для того чтобы детям на первых порах было проще найти нужный элемент, ряды и столбцы следует пронумеровать цифрами. Но, по словам Карин, ее дети уже через несколько дней игры в «химический морской бой» стали прекрасно ориентироваться в таблице Менделеева. Они знали даже атомные массы и порядковые номера элементов.
Со временем правила игры можно усложнить. Например, размещать корабль только в пределах одного семейства химических элементов.
Например, размещать корабль только в пределах одного семейства химических элементов.
В эту игру с удовольствием играет даже восьмилетняя дочь изобретательной матери, которая еще не изучала химию в школе. Да и для взрослых это отличный способ занимательно провести время.
Все страницы таблицы Менделеева для игры в морской бой можно распечатать на обычном или цветном принтере и использовать неограниченное количество раз.
115 элемент таблицы Менделеева – московий (moscovium) – сверхтяжелый синтетический элемент с символом Mc и атомным номером 115. Он был впервые получен в 2003 году совместной командой российских и американских ученых в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Россия. В декабре 2015 года признан одним из четырех новых элементов Объединенной рабочей группой международных научных организаций IUPAC/IUPAP. 28 ноября 2016 года он был официально назван в честь Московского региона, в котором находится ОИЯИ.
Характеристика
115 элемент таблицы Менделеева является чрезвычайно радиоактивным веществом: его наиболее стабильный известный изотоп, moscovium-290 имеет период полураспада всего 0,8 секунды.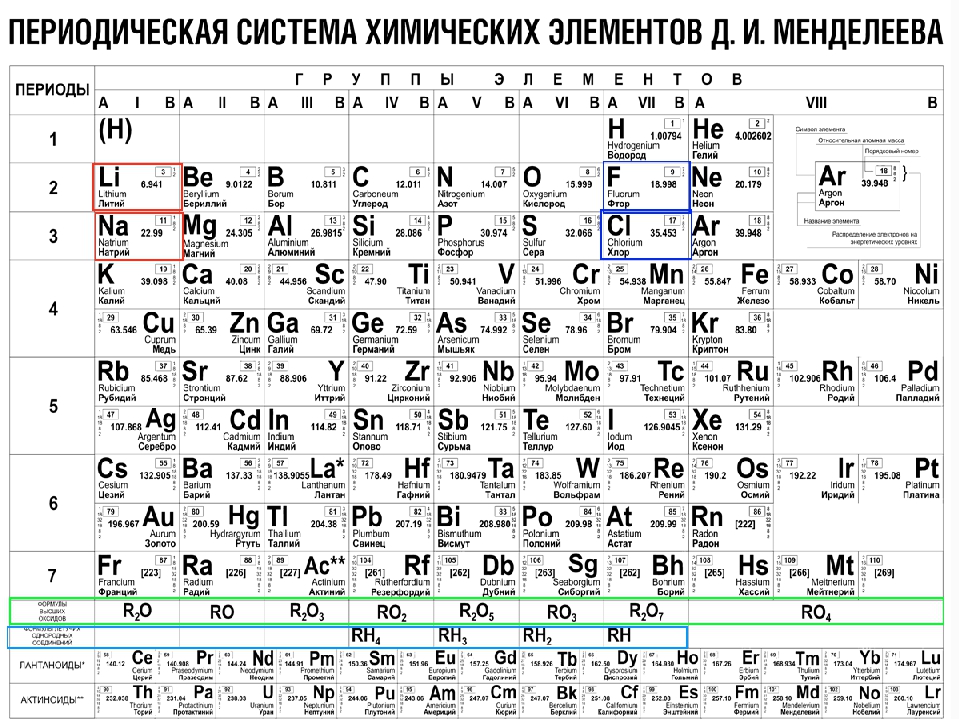 Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Согласно расчетам, элемент обладает некоторыми свойствами, схожими с более легкими гомологами: азотом, фосфором, мышьяком, сурьмой и висмутом. При этом демонстрирует несколько существенных отличий от них. На сегодня синтезировано около 100 атомов московия, которые имеют массовые числа от 287 до 290.
Физические свойства
Валентные электроны 115 элемента таблицы Менделеева московия делятся на три подоболочки: 7s (два электрона), 7p 1/2 (два электрона) и 7p 3/2 (один электрон). Первые два из них релятивистски стабилизируются и, следовательно, ведут себя, как инертные газы, а последние релятивистски дестабилизируются и могут легко участвовать в химических взаимодействиях. Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см 3 .
Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см 3 .
Предполагаемые расчетные характеристики:
- Фаза: твердая.
- Температура плавления: 400°С (670°К, 750°F).
- Точка кипения: 1100°С (1400°К, 2000°F).
- Удельная теплота плавления: 5,90-5,98 кДж/моль.
- Удельная теплота парообразования и конденсации: 138 кДж/моль.
Химические свойства
115-й элемент таблицы Менделеева стоит третьим в ряду химических элементов 7p и является самым тяжелым членом группы 15 в периодической таблице, располагаясь ниже висмута. Химическое взаимодействие московия в водном растворе обусловлено характеристиками ионов Mc + и Mc 3+ . Первые, предположительно, легко гидролизуются и образуют ионную связь с галогенами, цианидами и аммиаком. Гидроксид московия (I) (McOH), карбонат (Mc 2 CO 3), оксалат (Mc 2 C 2 O 4) и фторид (McF) должны растворяться в воде. Сульфид (Мс 2 S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Сульфид (Мс 2 S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) – слаборастворимые соединения.
Фторид московия (III) (McF 3) и тиозонид (McS 3), предположительно, нерастворимы в воде (аналогично соответствующим соединениям висмута). В то время, как хлорид (III) (McCl 3), бромид (McBr 3) и иодид (McI 3) должны быть легко растворимы и легко гидролизованы с образованием оксогалогенидов, таких как McOCl и McOBr (также аналогично висмуту). Оксиды московия (I) и (III) обладают схожими состояниями окисления, и их относительная стабильность в значительной степени зависит от того, с какими элементами они взаимодействуют.
Неопределенность
Вследствие того, что 115 элемент таблицы Менделеева синтезируется единичными экспериментально его точные характеристики проблематично. Ученым приходится ориентироваться на теоретические расчеты и сравнивать с более стабильными элементами, схожими по свойствам.
В 2011 году были проведены эксперименты по созданию изотопов нихония, флеровия и московия в реакциях между «ускорителями» (кальцием-48) и «мишенями» (америцием-243 и плутонием-244) для исследования их свойств. Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.
Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.
Открытие
Первым успешным синтезом 115 элемента таблицы Менделеева была совместная работа российских и американских ученых в августе 2003 года в ОИЯИ в Дубне. В команду во главе с физиком-ядерщиком Юрием Оганесяном, помимо отечественных специалистов, вошли коллеги из Ливерморской национальной лаборатории Лоуренса. Исследователи 2 февраля 2004 года опубликовали в издании Physical Review информацию, что они бомбардировали америций-243 ионами кальция-48 на циклотроне У-400 и получили четыре атома нового вещества (одно ядро 287 Mc и три ядра 288 Mc). Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах.
Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах.
Первоначально IUPAC не могла утвердить открытие нового элемента. Требовалось подтверждение из других источников. В течение следующих нескольких лет была проведена еще одна оценка более поздних экспериментов, и еще раз выдвинуто заявление дубненской команды об открытии 115-го элемента.
В августе 2013 года группа исследователей из Университета Лунда и Института тяжелых ионов в Дармштадте (Германия) объявили, что они повторили эксперимент 2004 года, подтвердив результаты, полученные в Дубне. Еще одно подтверждение было опубликовано командой ученых, работавших в Беркли в 2015 году. В декабре 2015 года совместная рабочая группа IUPAC/IUPAP признала обнаружение этого элемента и отдала приоритет в открытии российско-американской команде исследователей.
Название
115 элемент таблицы Менделеева в 1979 году согласно рекомендации IUPAC было решено назвать «унунпентий» и обозначать соответствующим символом UUP. Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли – элемент №115 или E115.
30 декабря 2015 года обнаружение нового элемента было признано Международным союзом чистой и прикладной химии. Согласно новым правилам, первооткрыватели имеют право предложить собственное название нового вещества. Сначала предполагалось назвать 115 элемент таблицы Менделеева «лангевиний» в честь физика Поля Ланжевена. Позднее команда ученых из Дубны, как вариант, предложила наименование «московий» в честь Московской области, где и было совершено открытие. В июне 2016 года IUPAC одобрил инициативу и 28 ноября 2016 официально утвердил название «moscovium».
Как всё начиналось?
Многие известные именитые химики на рубеже XIX-XX веков уже давно заметили, что физические и химические свойства многих химических элементов очень похожи друг на друга. Так например Калий, Литий и Натрий – все являются активными металлами, которые при взаимодействии с водой образают активные гидроксиды этих металлов; Хлор, Фтор, Бром в своих соединениях с водородом проявляли одинаковую валентность равную I и все эти соединения являются сильными кислотами. Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов – это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
Так например Калий, Литий и Натрий – все являются активными металлами, которые при взаимодействии с водой образают активные гидроксиды этих металлов; Хлор, Фтор, Бром в своих соединениях с водородом проявляли одинаковую валентность равную I и все эти соединения являются сильными кислотами. Из этой похожести давно напрашивался вывод, что все известные химические элементы можно объединить в группы, причём так чтобы у элементов каждой группы был определённый набор физико-химических характеристик. Однако часто такие группы были неверно составлены из разных элементов различными учёными и долгое время многими игнорировалась одна из главных характеристик элементов – это их атомная масса. Игнорировалась она потому, что была и есть разная у различных элементов, а значит её не могли использовать в качестве параметра для объединения в группы. Исключение составил лишь франзуский химик Александр Эмиль Шанкуртуа, он попытался расположить все элементы в трёхмерной модели по винтовой линии, но его работа не была признана научным сообществом, а модель получилась громоздкая и неудобная.
В отличие от многих учёных, Д.И. Менделеев взял атомную массу (в те времена ещё “Атомный вес”) как ключевой параметр при классификации элементов. В своём варианте Дмитрий Иванович расположил элементы по возрастанию их атомных весов и вот тут обозначилась закономерность, что через определённые промежутки элементов их свойства периодически повторяются. Правда пришлось сделать и исключения: некоторые элементы были поменяны местами и не соответствовали возрастанию атомных масс (например, теллур и йод), но зато соответствовали свойствам элементов. Дальнейшее развитие атомно-молекулярного учения оправдало такие подвижки и показало справедливость этой расстановки. Подробнее об этом вы можете прочесть в статье “В чём открытие Менделеева”
Как мы можем видеть, расположение элементов в этом варианте совсем не такое, какое мы видим в совремнном виде. Во первых, группы и периоды поменяны местами: группы по горизонтали, периоды по вертикали, а во-вторых, самих групп в нём как-то многовато – девятнадцать, вместо принятых на сегодня восемнадцати.
Однако, спустя всего год, в 1870-м Менделеев сформировал новый вариант таблицы, который уже более узнаваем нами: подобные элементы выстроены по вертикали, образуя группы, а 6 периодов расположены по горизонтали. Особенно примечательно то, что и в первом и во втором варианте таблицы виднеются существенные достижения, коих не было у его предшественников: в таблице заботливо оставлены места под элементы которые, по мнению Менделеева, ещё предстояло открыть. Соответствующие вакантные места обозначены им знаком вопроса и вы можете видеть их на рисунке выше. В дальнейшем были действительно открыты соответствующие элементы: Галий, Германий, Скандий. Таким образом Дмитрий Иванович не только систематезировал элементы в группы и периоды, но и предсказал открытие новых, ещё не известных, элементов.
В дальнейшем, после разрешения многих актуальных загадок химии того времени – открытие новых элементов, выделение группы благородных газов совместно с участием Уильяма Рамзая, установления того факта, что Дидимий вовсе не является самостоятельным элементом, а является смесью двух других, – были опубликованы всё новые и новые варианты таблицы, подчас имеющих даже вовсе и не табличный вид. Но не будем приводить здесь их все, а приведём лишь конечный вариант, сформировавшийся ещё при жизни великого учёного.
Но не будем приводить здесь их все, а приведём лишь конечный вариант, сформировавшийся ещё при жизни великого учёного.
Переход от атомных весов к заряду ядра.
К сожалению, Дмитрий Иванович не дожил до планетарной теории строения атома и не видел триумф опытов Резерфорда, хотя именно с его открытиями начинается новая эпоха в развитии периодического закона и всей периодической системы. Напомню что из опытов, проводимых Эрнестом Резерфордом, следовало, что атомы элементов состоят из положительно-заряженного атомного ядра и обращающихся вокруг ядра отрицательно-заряженных электронов. После определения зарядов атомных ядер всех, известных на тот момент, элементов, выяснилось, что в периодической системе они располагаются в соответствии с зарядом ядра. А периодический закон приобрёл новый смысл, теперь он стал звучать так:
“Свойства химических элементов, а также формы и свойства, образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов”
Теперь стало понятно, почему некоторые более лёгкие элементы были поставлены Менделеевым позади их более тяжёлых предшественников, – всё дело в том, что так они стоят по порядку зарядов их ядра. Например, теллур тяжелее йода, однако стоит в таблице раньше него, ибо заряд ядра его атома и количество электронов равняется 52, а у йода – 53. Можете посмотреть на таблицу и убедиться в этом сами.
Например, теллур тяжелее йода, однако стоит в таблице раньше него, ибо заряд ядра его атома и количество электронов равняется 52, а у йода – 53. Можете посмотреть на таблицу и убедиться в этом сами.
После открытия строения атома и атомного ядра, периодическая система претерпевала ещё несколько изменений, пока, наконец, не достигла вида, уже знакомого нам со школы, короткопериодного варианта таблицы Менделеева.
В этой таблице нам знакомо уже всё: 7 периодов, 10 рядов, побочные и главные подгруппы. Также со временем открытия новых элементов и наполнения ими таблицы, пришлось вынести в отдельные ряды элементы подобные Актинию и Лантану, все они соответственно были названы Актиноидами и Лантаноидами. Эта версия системы просуществовала очень долго – в мировом научном сообществе практически до конца 80х, начала 90х, а в нашей стране и того дольше – до 10х годов нынешнего столетия.
Современный вариант таблицы Менделеева.
Однако, тот вариант, которые многие из нас проходили в школе на деле оказывается весьма запутанным, а путаница выражается в разделении подгрупп на главные и побочные и запоминание логики отображения свойств элементов становится достаточно сложным. Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант – длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.
Конечно, несмотря на это, многие по нему учились, становились докторами химических наук, но всё же в современности ему на смену пришёл новый вариант – длиннопериодный. Отмечу, что именно этот вариант является одобренным IUPAC (международным союзом теоретической и прикладной химии). Давайте взглянем на него.
На смену восьми группам пришли восемнадцать, среди которых нет уже никакого разделения на главные и побочные, а все группы продиктованы расположением электронов в атомной оболочке. Заодно избавились и от двухрядных и однорядных периодов, теперь все периоды содержат только один ряд. Чем же удобен такой вариант? Теперь периодичность свойств элементов просматривается более наглядно. Номер группы, по сути, обозначает количество электронов во внешнем уровне, в связи с чем все главные подгруппы старого варианта расположились в первой, второй и с тринадцатой по восемнадцатую группу, а все “бывшие побочные” группы разместились в середине таблицы. Тем самым теперь из таблицы хорошо видно, что если это первая группа – то это щелочные металлы и никаких вам меди или серебра, и видно, что все транзитные металлы хорошо демонстрируют схожесть их свойств в связи с заполнением d-подуровня, в меньшей степени влияющим на внешние свойства, также как и лантаноиды и актиноиды проявляют подобные свойства по причине разного лишь f-подуровня. Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
Таким образом, вся таблица разбита на следующие блоки: s-блок, на котором заполняются s-электроны, d-блок, p-блок и f-блок, с заполнением d, p, и f-электронов соответственно.
К сожалению, в нашей стране этот вариант включился в школьные учебники лишь в последние 2-3 года, да и то не во все. И очень напрасно. С чем это связано? Ну во-первых, с застойными временами в лихие 90-е, когда в стране не было вообще никакого развития, не говоря уж о сфере образования, а именно в 90е годы мировое химическое сообщество перешло на этот вариант. Во-вторых, с лёгкой инертностью и тяжестью восприятия всего нового, ведь нашим преподавателям привычен именно старый, короткопериодный вариант таблицы, несмотря на то, что при изучении химии он гораздо сложнее и менее удобен.
Расширенный вариант периодической системы.
Но время не стоит на месте, наука и технологии тоже. Уже открыт 118 элемент периодической системы, а значит скоро придётся открывать следующий, восьмой, период таблицы. Кроме того, появится новый энергетический подуровень: g-подуровень. Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
Элементы его составляющие придётся вынести вниз таблицы, подобно лантаноидам или актиноидам, либо расширить эту таблицу ещё в два раза, так что она перестанет помещаться на лист формата A4. Здесь я приведу лишь ссылку на википедию (см. Расширенная периодическая система) и не буду лишний раз повторять описание этого варианта. Кому станет интересно – сможет пройти по ссылке и ознакомиться.
В этом варианте ни f-элементы (лантаноиды и актиноиды) ни g-элементы (“элементы будущего” с №№ 121-128) не вынесены отдельно, а делают таблицу шире на 32 клетки. Также элемент Гелий помещён во вторую группу, так как он входит в s-блок.
В целом, же вряд ли будущие химики будут пользоваться этим вариантом, скорее всего на смену таблице Менделеева придёт одна из альтернатив, которые уже выдвигаются смелыми учёными: система Бенфея, “Химическая галактика” Стьюарта или иной вариант. Но это будет уже только после достижения второго острова стабильности химических элементов и, скорее всего, нужно будет больше для наглядности в ядерной физике, чем в химии, ну а нам пока хватит старой доброй периодической системы Дмитрия Ивановича.
Непростые названия простых элементов, или История о том, почему химики «не любят» букву J
Графические обозначения химических элементов, предложенные Джоном Дальтоном. Справа от названий приведены их атомные веса (кратные атомному весу водорода, принятому за единицу), определённые Дальтоном с большими ошибками. 1808 год. Иллюстрация: Wikimedia Commons/PD.‹
›
Здравствуйте, многоуважаемый журнал «Наука и жизнь»!
В июльском номере 2020 года вашего журнала в разделе «Кунсткамера» на странице 61 я прочитал: «Среди символов химических элементов в таблице Менделеева использованы все латинские буквы, кроaме буквы J. Возможно, у неё всё ещё впереди».
Не являясь знатоком ни латыни, ни химии, обращаю ваше внимание на тот факт, что буква Q тоже не используется в таблице Менделеева. Даже в названиях таких элементов, как медь (Cuprum), цинк (Zincum), мышьяк (Arsenicum), кюрий (Curium) используется не буква Q, а сочетание букв «cu».
С уважением, Ельцов Владимир Вениаминович, Москва.
Изучение истории химических названий — чрезвычайно любопытное, а порой и забавное занятие. Давайте представим на минуту, что пару веков назад физики решили дать названия химическим элементам, а химики — придумать названия физическим законам. Что бы мы теперь учили в школе? Например, это мог быть закон злого духа гор, первое правило громовержца или даже эффект молодой зелёной ветви. Необычно, не правда ли? С химическими элементами получилась бы другая история. Школьникам пришлось бы изучать свойства первого, второго и третьего элемента Берцелиуса, запоминать, что у элемента Муассана самая большая электроотрицательность, а химики шутили бы о вредных свойствах дикавендишия монопристлишеелелавуазьита.
По поводу последнего названия. В 1983 году в одной еженедельной газете, издававшейся в городке Дарэнд, штат Мичиган (США), была опубликована заметка о том, что в городских водопроводных трубах обнаружено чрезвычайно опасное вещество «дигидрогена оксид» (dihydrogen oxide).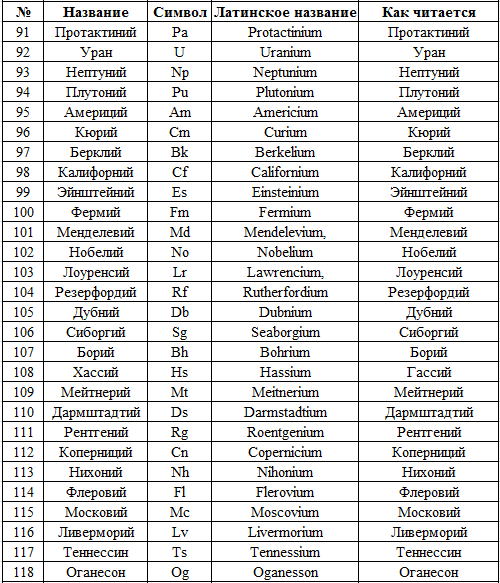 При попадании в лёгкие оно практически всегда приводило к смерти, а пары этого вещества могут вызывать на коже серьёзные ожоги. Заметка была первоапрельской шуткой, высмеивавшей хемофобов — людей, необоснованно боящихся всего, связанного с химией — даже воды, если её назвать «по-химически». Впоследствии шутку не раз повторяли в разное время и в разных странах. В России за водой закрепилось шуточное название «дигидрогена монооксид» — в молекуле воды (h3O) два атома водорода связаны с одним атомом кислорода. Что до «дикавендишия монопристлишеелелавуазьита», то так могло бы выглядеть «химическое» название воды, если бы элементы были названы в честь их первооткрывателей: Генри Кавендиша (выделил и описал свойства газообразного водорода как отдельного вещества), Джозефа Пристли, Карла Шееле и Антуана Лавуазье, причастных к открытию и изучению свойств кислорода.
При попадании в лёгкие оно практически всегда приводило к смерти, а пары этого вещества могут вызывать на коже серьёзные ожоги. Заметка была первоапрельской шуткой, высмеивавшей хемофобов — людей, необоснованно боящихся всего, связанного с химией — даже воды, если её назвать «по-химически». Впоследствии шутку не раз повторяли в разное время и в разных странах. В России за водой закрепилось шуточное название «дигидрогена монооксид» — в молекуле воды (h3O) два атома водорода связаны с одним атомом кислорода. Что до «дикавендишия монопристлишеелелавуазьита», то так могло бы выглядеть «химическое» название воды, если бы элементы были названы в честь их первооткрывателей: Генри Кавендиша (выделил и описал свойства газообразного водорода как отдельного вещества), Джозефа Пристли, Карла Шееле и Антуана Лавуазье, причастных к открытию и изучению свойств кислорода.
Так почему периодическая таблица не превратилась в список аббревиатур имён химиков, геологов и прочих деятелей науки, причастных к открытиям элементов? Есть ли этому логичное объяснение и так ли на самом деле отличаются физики, химики и другие учёные? Попробуем поразмышлять на эту тему, опираясь на известные нам факты из истории науки. А заодно поищем ответ на вопрос о «нелюбви» химиков к символам J и Q.
А заодно поищем ответ на вопрос о «нелюбви» химиков к символам J и Q.
Начнём с того, что на становление химии как науки в большой степени повлияла алхимия, насквозь пропитанная мистицизмом и эзотерикой. С одной стороны, алхимики подарили своим последователям ряд практических химических методик и накопили много полезной информации о свойствах разных соединений. С другой стороны, всё это знание было ими специально запрятано под густую пелену скрытых символов и потаённых смыслов, чтобы непосвящённые в таинства ненароком не синтезировали философский камень. Уже как наука, а не как философское течение, химия адаптировала под свои нужды часть алхимического знания. Впрочем, до сих пор она воспринимается многими как своего рода «магия».
По мере накопления знаний в любой науке возникает потребность в их систематизации. Одно дело, когда количество изучаемых объектов можно пересчитать на пальцах пусть даже всех четырёх конечностей, и совсем другое — когда их количество исчисляется сотнями, тысячами и растёт с каждым годом. Во второй половине XVIII века были открыты почти два десятка новых химических элементов, названных первооткрывателями в честь древних богов и мифических существ или по их характерным свойствам. Присваивали химическим элементам и названия соответствующих минералов, отдавая предпочтения греческому языку. Что характерно, ни один учёный, открывший новый элемент, не назвал его своим именем или именем другого химика и уж тем более монарха, который правил тогда почти в каждом государстве. Этому негласному правилу химики следовали и весь следующий XIX век. Несмотря на то, что в названиях, например, минералов фамилий химиков, геологов и даже государственных деятелей было хоть отбавляй, до поры до времени названия химических элементов эта «мода» обходила стороной.
Во второй половине XVIII века были открыты почти два десятка новых химических элементов, названных первооткрывателями в честь древних богов и мифических существ или по их характерным свойствам. Присваивали химическим элементам и названия соответствующих минералов, отдавая предпочтения греческому языку. Что характерно, ни один учёный, открывший новый элемент, не назвал его своим именем или именем другого химика и уж тем более монарха, который правил тогда почти в каждом государстве. Этому негласному правилу химики следовали и весь следующий XIX век. Несмотря на то, что в названиях, например, минералов фамилий химиков, геологов и даже государственных деятелей было хоть отбавляй, до поры до времени названия химических элементов эта «мода» обходила стороной.
К концу XVIII века химики задумались о том, что хорошо было бы им всем говорить на одном химическом языке, чтобы не перепутать ненароком колбы с похожими на вид жидкостями и не лезть в словарь каждый раз, когда коллега из соседнего государства пришлёт пробирку, подписанную как «волчья пена».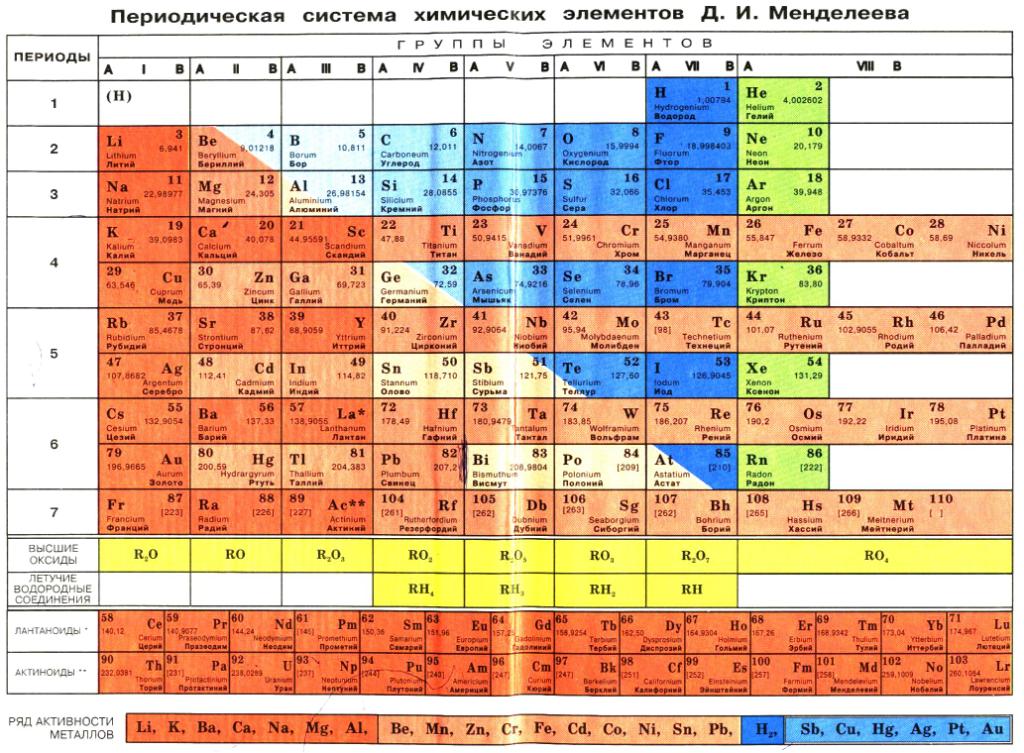 Идея не слишком революционная, если учесть, что шведский естествоиспытатель Карл Линней уже в 1735 году опубликовал «Систему природы», а французский химик и политик Гитон де Морво изложил свой первый вариант химической номенклатуры лишь в 1782-м. И тут мы практически вплотную подошли к ответу на вопрос об отсутствии некоторых букв среди символов химических элементов.
Идея не слишком революционная, если учесть, что шведский естествоиспытатель Карл Линней уже в 1735 году опубликовал «Систему природы», а французский химик и политик Гитон де Морво изложил свой первый вариант химической номенклатуры лишь в 1782-м. И тут мы практически вплотную подошли к ответу на вопрос об отсутствии некоторых букв среди символов химических элементов.
В 1801 году шотландский химик Томас Томсон, если верить Британской энциклопедии, впервые использовал буквы в качестве символов химических элементов. Практически в это же время английский физик, химик и естествоиспытатель Джон Дальтон начал развивать свою атомистическую теорию, утверждающую, что все вещества состоят из отдельных неделимых очень малых частиц — атомов химических элементов. Попутно в 1808 году Дальтон предложил научной общественности обозначать химические элементы в виде символов — кружочков с определённым рисунком внутри. Похожие символы использовались для обозначения химических веществ ещё алхимиками (в этом Дальтон остался верен традициям), другая их часть представляла собой кружочки с первой буквой английского названия элемента внутри.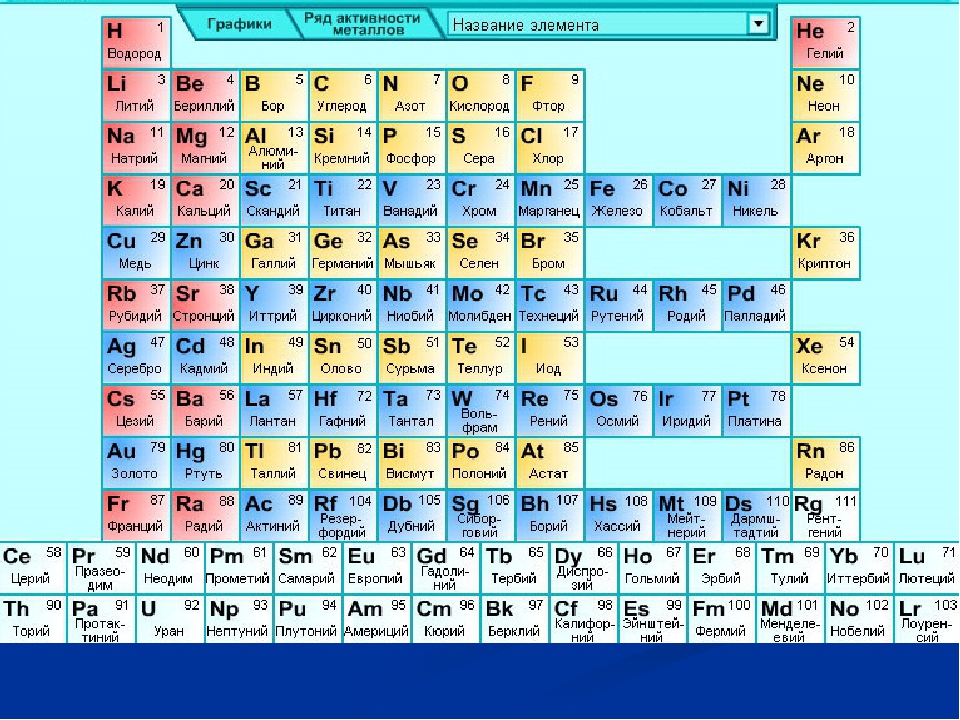 Например: Z — для цинка (zinc), I — для железа (iron), S — для серебра (silver). Эта система обозначений — самая настоящая переходная форма (как в эволюции живых существ), наследующая ещё архаические алхимические обозначения и одновременно уже имеющая прогрессивные черты в виде букв-символов. Заметим, что таблица символов, предложенная Дальтоном, это ни в коей мере не периодическая таблица — она преследовала лишь задачу удобного и понятного всем отображения химических веществ и их элементного состава. Правда, нашлись те, кому такая идея оказалась не по душе — книгопечатники. Им совсем не хотелось добавлять в уже имеющиеся шрифты уйму новых символов.
Например: Z — для цинка (zinc), I — для железа (iron), S — для серебра (silver). Эта система обозначений — самая настоящая переходная форма (как в эволюции живых существ), наследующая ещё архаические алхимические обозначения и одновременно уже имеющая прогрессивные черты в виде букв-символов. Заметим, что таблица символов, предложенная Дальтоном, это ни в коей мере не периодическая таблица — она преследовала лишь задачу удобного и понятного всем отображения химических веществ и их элементного состава. Правда, нашлись те, кому такая идея оказалась не по душе — книгопечатники. Им совсем не хотелось добавлять в уже имеющиеся шрифты уйму новых символов.
Окончательно задачу разработки удобного и понятного написания химических элементов решил великий шведский химик Йёнс Якоб Берцелиус в 1813 году. Он сделал простую, как сейчас кажется, вещь: все элементы сопоставил с их названиями на латыни, которые потом сократил до одного или двух первых символов. Первый символ всегда писался с большой, а второй, если он присутствовал, — с маленькой буквы. Латынь была в то время, что называется, международным научным стандартом, поэтому не вызывала неприятия у учёных разных стран. С небольшими изменениями символы, которые предложил Берцелиус, используются химиками и по сей день.
Отсутствие буквы J среди элементов объясняется просто. Во-первых, её нет в классическом латинском алфавите, а значит, какое-нибудь общеупотребимое слово на латыни просто не могло начинаться с несуществующей буквы. (Как отдельная буква, J стала оформляться в начале эпохи Возрождения в Европе.) Не стоит забывать, что для написания классических символов химических элементов используется именно латинский алфавит, а не современный английский или немецкий. Аналогично и с буквой Q — она хоть и присутствовала в латыни с древних времён, каких-либо слов или имён, начинавшихся с этой буквы и подходящих в качестве названий для элементов, видимо, не нашлось.
Во-вторых, и это тоже могло бы стать причиной негласной исторической «дискриминации» букв J и Q, на письме обе они очень похожи, соответственно, на I и O.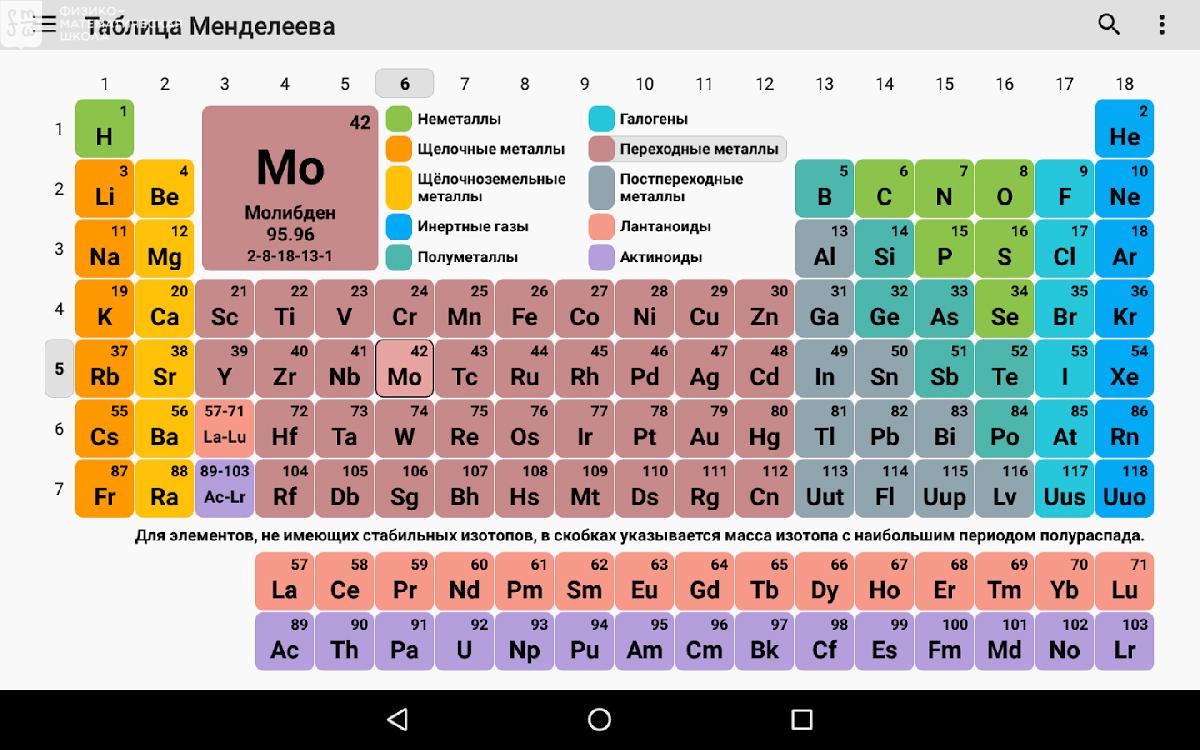 «Хвостик» слева или справа может не пропечататься, стереться. А если буквы написаны ещё и от руки?! Ошибиться в написании слова не так опасно, как перепутать два химических вещества. Забавно, что на раскладке клавиатуры буквы I и J располагаются почти одна под другой, поэтому очень хорошо, что в таблице Менделеева нет элемента J. А вот буква Q в неё всё-таки пробралась.
«Хвостик» слева или справа может не пропечататься, стереться. А если буквы написаны ещё и от руки?! Ошибиться в написании слова не так опасно, как перепутать два химических вещества. Забавно, что на раскладке клавиатуры буквы I и J располагаются почти одна под другой, поэтому очень хорошо, что в таблице Менделеева нет элемента J. А вот буква Q в неё всё-таки пробралась.
К началу ХХ века были открыты все химические элементы, которые можно найти в природе, однако в периодической таблице оставалось ещё много места для тяжёлых искусственных элементов. Пустые ячейки в таблице стали заполнять не химики с помощью колб и пробирок, а физики, вооружённые ускорителями. Тогда-то и закончилась «эпоха магических существ» в химических названиях, сдав позиции ядерным физикам и бюрократам из ИЮПАК.
ИЮПАК — это Международный союз теоретической и прикладной химии, образованный в 1911 году. Одна из его задач — стандартизировать номенклатуру химических соединений, в том числе и названия новых элементов. Говоря проще, союз определяет, как в итоге будет называться каждый новый элемент. Потребность в этом возникла, когда открытие элементов стало представлять собой процесс, растянутый на годы, если не на десятилетия, и проходящий одновременно в нескольких лабораториях в разных концах света. Понять, кто же первым получил новый элемент, бывает, действительно, непросто. Так же непросто договориться о том, как его назвать. Одни учёные предлагают одно название, другие — другое, а в итоге ИЮПАК утверждает третье. Дело в том, что, согласно современным правилам, даже первооткрыватели элемента официально не имеют права давать ему название, они могут лишь предложить его на рассмотрение международного комитета.
Говоря проще, союз определяет, как в итоге будет называться каждый новый элемент. Потребность в этом возникла, когда открытие элементов стало представлять собой процесс, растянутый на годы, если не на десятилетия, и проходящий одновременно в нескольких лабораториях в разных концах света. Понять, кто же первым получил новый элемент, бывает, действительно, непросто. Так же непросто договориться о том, как его назвать. Одни учёные предлагают одно название, другие — другое, а в итоге ИЮПАК утверждает третье. Дело в том, что, согласно современным правилам, даже первооткрыватели элемента официально не имеют права давать ему название, они могут лишь предложить его на рассмотрение международного комитета.
Для ещё неоткрытых химических элементов используются временные названия, состоящие из первых букв латинского или греческого названия цифр, соответствующих порядковому номеру элементов в таблице. Например, цифре 0 соответствует корень «ниль» и символ «n», цифре 1 — «ун» и символ «u», цифре 2 — корень «би» и символ «b» и т. д. Символ «q» соответствует цифре 4 и корню «квад». Поэтому элемент под порядковым номером 104 будет называться уннильквадий и иметь временный символ Unq; 114-й элемент будет называться унунквадий Uuq, а 124-й — унбиквадий и Ubq. Элементам под номерами 104 и 114 уже присвоили постоянные названия резерфордий и флеровий, а 124-й пока свободен. Поэтому если вас спросят, есть ли в периодической таблице элемент с буквой «q», то пока можете смело отвечать, что это унбиквадий Ubq.
д. Символ «q» соответствует цифре 4 и корню «квад». Поэтому элемент под порядковым номером 104 будет называться уннильквадий и иметь временный символ Unq; 114-й элемент будет называться унунквадий Uuq, а 124-й — унбиквадий и Ubq. Элементам под номерами 104 и 114 уже присвоили постоянные названия резерфордий и флеровий, а 124-й пока свободен. Поэтому если вас спросят, есть ли в периодической таблице элемент с буквой «q», то пока можете смело отвечать, что это унбиквадий Ubq.
Время от времени ИЮПАК публикует рекомендации к выбору названий. Например, в рекомендациях 2002 года новые химические элементы предлагалось называть в честь мифологического концепта или персонажа, минерала, места или географического региона, учёного или свойства элемента. Помимо этого название должно удовлетворять ещё ряду требований, чтобы максимально всех устроить и никого по возможности не оскорбить. В целом все эти требования строго выполняются, однако, взглянув на периодическую таблицу, можно с лёгкостью определить, какие элементы называли химики, а какие физики. За весь XVIII и XIX век ни Якоб Берцелиус, ни Хэмфри Дэви, ни Карл Мосандер, ни Анри Муассан не «подарили» свои фамилии ни одному открытому ими элементу, тогда как элементы с порядковыми номерами больше 100, открытые в XX и XXI веке, практически все «именные». Физики явно разучились шутить, как это они умели делать в прошлом.
За весь XVIII и XIX век ни Якоб Берцелиус, ни Хэмфри Дэви, ни Карл Мосандер, ни Анри Муассан не «подарили» свои фамилии ни одному открытому ими элементу, тогда как элементы с порядковыми номерами больше 100, открытые в XX и XXI веке, практически все «именные». Физики явно разучились шутить, как это они умели делать в прошлом.
В заключение отметим: у буквы «J» на самом деле был шанс прорваться в периодическую таблицу. Элемент под номером 113 мог получить символ Jp и именоваться японием, по предложению самих же японцев. Однако в ИЮПАК не согласились, и элемент в итоге стал нихонием по одному из названий Японии — Нихон. Как назовут ещё не открытые элементы в современную непростую эпоху, остаётся только гадать. И надеяться, что до переименования уже существующих элементов дело всё-таки не дойдёт.
Четыре химических элемента добавлены в таблицу Менделеева
Элементы 113, 115, 117 и 118 будут названы учеными из России, США и Японии.
TREND WATCH: Четыре новых элемента были официально добавлены в периодическую таблицу Менделеева, завершив ее седьмую строку.
Элементы 113, 115, 117 и 118 были нарисованы на столе в течение многих лет, и лаборатории в России, США и Японии неоднократно заявляли о том, что их обнаружили.Но официального признания пришлось ждать до конца 2015 года, когда группа независимых экспертов согласилась с тем, что доказательства действительны (см. Диаграмму). Международный союз чистой и прикладной химии (IUPAC) со штаб-квартирой в Research Triangle Park, Северная Каролина, объявил о выводах группы 30 декабря.
Все элементы были созданы в лаборатории путем столкновения более легких атомных ядер. Нестабильные скопления протонов и нейтронов длятся доли секунды, прежде чем они распадутся на более мелкие и более стабильные фрагменты.
Команды, получившие признание за открытия, теперь могут выдвигать предложения по названиям элементов и двухбуквенным символам. Элементы могут быть названы в честь одного из их химических или физических свойств, мифологической концепции, минерала, места или страны или ученого.
Приоритет в открытии 113-го элемента достался исследователям из Японии, которые особенно рады тому, что он станет первым искусственным элементом, названным в Восточной Азии. Когда этот элемент был впервые обнаружен 12 лет назад, в качестве названия было предложено название «Япониум».
Японский химик Косуке Морита является частью команды, которая открыла 113 элемент. Предоставлено: Kazuhiro Nogi / AFP / Getty
Команда из Центра науки на основе ускорителей RIKEN Nishina в Вако, недалеко от Токио, сделала свое первое заявление о том, что заметила элемент 113 в 2004 году, а затем продолжила более убедительное наблюдение в 2012. К тому времени было создано три атома элемента. «Для ученых это более ценно, чем олимпийская золотая медаль», – сказал Риодзи Нойори, получивший Нобелевскую премию по химии 2001 года, на пресс-конференции, посвященной решению ИЮПАК.(Нойори не был членом японской команды, но является бывшим президентом RIKEN).
Российские и американские исследователи сделали соперничающие заявления об открытии 113, но не получили приоритета со стороны экспертной группы, созданной из IUPAC и Международного союза чистой и прикладной физики (IUPAP).
Однако Россия и США все же получили права на присвоение и название другим новым элементам. По сообщению комитета IUPAC / IUPAP, элементы 115 и 117 были впервые созданы в результате сотрудничества Объединенного института ядерных исследований в Дубне, Россия, Ливерморской национальной лаборатории Лоуренса в Ливерморе, Калифорния, и Национальной лаборатории Ок-Ридж в Теннесси.Работа других команд, таких как шведская группа, использующая немецкий ускоритель, помогла подтвердить существование элемента 115.
Заслуга за открытие 118-го элемента – самого тяжелого из когда-либо созданных – принадлежит командам Дубны и Лоуренса Ливермора. У этого элемента неоднозначная история: заявление о его создании в 1999 году было отозвано два года спустя на фоне обвинений в фальсификации данных.
Физики теперь попытаются создать элементы 119 и 120, подвиг, который должен быть возможен с современными технологиями, говорит Рольф-Дитмар Герцберг, физик-ядерщик из Ливерпульского университета, Великобритания.Однако никто еще не заявил о наблюдении: исследователи из Центра исследований тяжелых ионов GSI им. Гельмгольца в Дармштадте, Германия, в течение пяти месяцев в 2012 году безуспешно пытались. Исследователи соглашаются, что за пределами 120-го элемента шансы на слияние двух ядер исчезающе малы.
Об этой статье
Цитируйте эту статью
Van Noorden, R. Четыре химических элемента добавлены в таблицу Менделеева. Природа (2016). https: // doi.org / 10.1038 / nature.2016.19112
Ссылка для скачивания
Поделиться статьей
Все, с кем вы поделитесь следующей ссылкой, смогут прочитать это содержание:
Получить ссылку для совместного использования Извините, ссылка для совместного использования в настоящее время недоступна для этой статьи .
Предоставлено инициативой по обмену контентом Springer Nature SharedIt
Дополнительная литература
Драматические релятивистские и магнитные эффекты Брейта для сверхтяжелой реакции Og + 3Ts2 → OgTs6: предсказание энергии атомизации и существования сверхтяжелого октаэдрического оганессона hexatennesside OgTs6
- Гульзари Л.Малли
- Джино А. ДиЛабио
- Мартин Зигерт
Счета по теоретической химии (2021)
| Химический символ | Название элемента | Атомный N o | Происхождение символа |
| Ас | Актиний | 89 | |
| Ag | Серебро | 47 | От латинского Argentum , что первоначально означало сияющий металл |
| Al | Алюминий | 13 | |
| Am | Америций | 95 | |
| Ар | Аргон | 18 | |
| Как | Мышьяк | 33 | |
| при | Астатин | 85 | |
| Au | Золото | 79 | От латинского Aurum , что первоначально означало желтый |
| Б | Бор | 5 | |
| Ba | Барий | 56 | |
| Be | Бериллий | 4 | |
| Bh | Борий | 107 | |
| Bi | Висмут | 83 | |
| Bk | Берклий | 97 | |
| Br | Бром | 35 | |
| С | Углерод | 6 | |
| Ca | Кальций | 20 | |
| КД | Кадмий | 48 | |
| CE | Церий | 58 | |
| Cf | Калифорний | 98 | |
| Класс | Хлор | 17 | |
| см | Кюрий | 96 | |
| Ко | Кобальт | 27 | |
| Cr | Хром | 24 | |
| CS | Цезий | 55 | |
| Cu | Медь | 29 | Из Cuprum , латинское название Кипра, римского источника меди |
| DS | Дармштадтиум | 110 | |
| Дб | Дубний | 105 | |
| Ду | Диспрозий | 66 | |
| Er | Эрбий | 68 | |
| Es | Эйнштейний | 99 | |
| ЕС | Европий | 63 | |
| Ф | Фтор | 9 | |
| Fe | Утюг | 26 | Из Ferrum , латинское название железа |
| FM | Фермий | 100 | |
| Fr | Франций | 87 | |
| Ga | Галлий | 31 | |
| Gd | Гадолиний | 64 | |
| Ge | Германий | 32 | |
| H | Водород | 1 | |
| He | Гелий | 2 | |
| Hf | Гафний | 72 | |
| Hg | Меркурий | 80 | От латинского Hydragyrum , что означает жидкое серебро |
| Ho | Гольмий | 67 | |
| HS | Калий | 108 | |
| Я | Йод | 53 | |
| В | Индий | 49 | |
| Ir | Иридий | 77 | |
| К | Калий | 19 | От латинского Kalium , что означает щелочь |
| Kr | Криптон | 36 | |
| Ла | Лантан | 57 | |
| Ли | Литий | 3 | |
Лр. | Лоуренсий | 103 | |
| Лю | Лютеций | 71 | |
| Md | Менделевий | 101 | |
| мг | Магний | 12 | |
| Мн | Марганец | 25 | |
| Пн | Молибден | 42 | |
| млн тонн | Мейтнерий | 109 | |
| № | Азот | 7 | |
| Na | Натрий | 11 | Из Natrium , латинское название карбоната натрия |
| Nb | Ниобий | 41 | |
| Nd | Неодим | 60 | |
| Ne | Неон | 10 | |
| Ni | Никель | 28 | |
| Нет | Нобелий | 102 | |
| НП | Нептуний | 93 | |
| О | Кислород | 8 | |
| Ос | Осмий | 76 | |
п. | Фосфор | 15 | |
| Па | Протактиний | 91 | |
| Пб | Свинец | 82 | От латинского Plumbum , что означает мягкий белый металл |
| Pd | Палладий | 46 | |
| пм | Прометий | 61 | |
| По | Полоний | 84 | |
| пр. | празеодим | 59 | |
| Pt | Платина | 78 | |
| Pu | Плутоний | 94 | |
| Ra | Радий | 88 | |
руб. | Рубидий | 37 | |
| Re | Рений | 75 | |
| Rf | Резерфордий | 104 | |
| Rg | Рентген | 111 | |
| правый | Родий | 45 | |
| Rn | Радон | 86 | |
| Ру | Рутений | 44 | |
| S | Сера | 16 | |
| Сб | Сурьма | 51 | От латинского Stibium , что означает косметическая пудра |
| SC | Скандий | 21 | |
| SE | Селен | 34 | |
| Sg | Сиборгий | 106 | |
| Si | Кремний | 14 | |
| См | Самарий | 62 | |
| Sn | Олово | 50 | Из Stannum , латинское слово для олова |
| Sr | Стронций | 38 | |
| Ta | Тантал | 73 | |
| Тб | Тербий | 65 | |
| TC | Технеций | 43 | |
| Te | Теллур | 52 | |
| Чт | торий | 90 | |
| Ti | Титан | 22 | |
| Тл | Таллий | 81 | |
| ТМ | Тулий | 69 | |
| U | Уран | 92 | |
| В | Ванадий | 23 | |
| Вт | Вольфрам | 74 | Из Wolfram , старое название элемента, полученного из его руды, Wolframite |
| Xe | Ксенон | 54 | |
| Y | Иттрий | 39 | |
| Yb | Иттербий | 70 | |
| Zn | Цинк | 30 | |
| Zr | Цирконий | 40 |
Таблица химических элементов
См. Интерактивную таблицу Менделеева .
Интерактивную таблицу Менделеева .
| Элемент | Sym- bol | Atomic no. | Атомарный мас. | Удельная плотность | Температура плавления C | Температура кипения C | Кол-во изотопов 1 | Discoverer | Год | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 89 Acinium | 210,07 3 | 1051 | 3198 | 11 | Debierne / Giesel | 1899/1902 | |||||||||||||||||||||||
| Алюминий | Al | 13 | 26. 981538 981538 | 2,6989 | 660,32 | 2519 | 8 | Whler | 1827 | ||||||||||||||||||||
| Америций | Am | 95 | 243 2 | 13,67 | 1176 13,67 | 1176 | Сиборг и др. | 1944 | |||||||||||||||||||||
| Сурьма | Sb | 51 | 121,76 | 6,61 | 630,63 | 1587 | 29 | Ранние исторические времена | ? | ||||||||||||||||||||
| Аргон | Ar | 18 | 39. 948 948 | 1,7837 5 | -189,35 | -185,85 | 8 | Рэлей и Рамзи | 1894 | ||||||||||||||||||||
| Мышьяк (серый) | As | 33 | 74, | As | 33 | 74,9216 | 603 | 14 | Альберт Великий | 1250 | |||||||||||||||||||
| Астатин | В | 85 | 210 2 | ? | 302 | ? | 21 | Corson et al. | 1940 | ||||||||||||||||||||
| Барий | Ba | 56 | 137,327 | 3,5 | 727 | 1897 | 25 | Дэви | 1808 | ||||||||||||||||||||
| Беркелий | Беркелий | Bk | Bk 2 | 14,00 6 | 1050 (? Форма) | ? | 8 4 | Seaborg et al. | 1949 | ||||||||||||||||||||
| Бериллий | Be | 4 | 9. 012182 012182 | 1,848 | 1287 | 2471 | 6 | Vauquelin | 1798 | ||||||||||||||||||||
| Висмут | Bi | 83 | 208.98038 | 9.747 | 9.747 | 277 9.747 | 1753 | ||||||||||||||||||||||
| Bohrium | Bh | 107 | 264 2 | ? | ? | ? | ? | Армбрустер и Мнценберг | 1981 | ||||||||||||||||||||
| Бор | B | 5 | 10.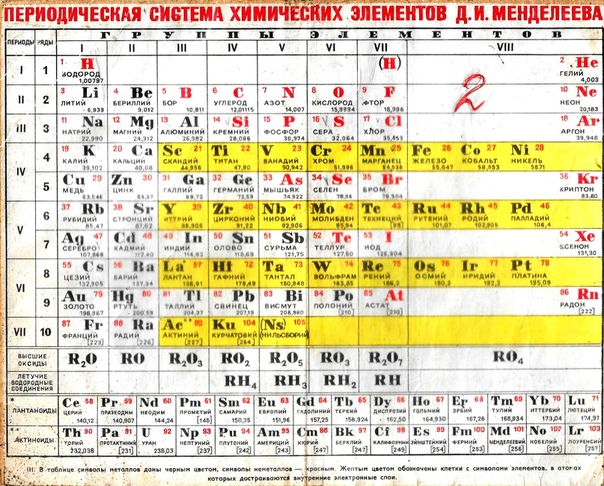 811 811 | 2,37 7 | 2075 | 4000 | 6 | Гей-Люссак и Thnard; Дэви | 1808 | ||||||||||||||||||||
| Бром | Br | 35 | 79,904 | 3,12 5 | -7,2 | 58,8 | 19 | Balard | 1826 | C | C 48 | 112,411 | 8,65 | 321.07 | 767 | 22 | Stromeyer | 1817 | |||||||||||
| Кальций | Ca | 20 | 40. 078 078 | 1,55 | 842 | 1484 | 14 | Cf | 98 | 251 2 | ? | 900 | ? | 12 4 | Seaborg et al. | 1950 | |||||||||||||
| Углерод | C | 6 | 12.0107 | 1,8? 3,5 8 | 4492 (графит) | 3825 | 7 | Доисторический | ? | ||||||||||||||||||||
| Церий | Ce | 58 | 140,116 | 6,771 | 798 | 3443 | 19 | Берцелиус и Хисингер; Клапрот | 1803 | ||||||||||||||||||||
| Цезий | Cs | 55 | 132, | 1,873 | 28. 5 5 | 671 | 22 | Бунзен и Кирхгоф | 1860 | ||||||||||||||||||||
| Хлор | Cl | 17 | 35,453 | 1,56 5 | -101,5 | -34e | -34e | 1774 | |||||||||||||||||||||
| Хром | Cr | 24 | 51,9961 | 7,18-7,20 | 1907 | 2671 | 9 | Vauquelin | 1797 | ||||||||||||||||||||
Кобальт . 9332 9332 | 8,9 | 1495 | 2927 | 14 | Brandt | c.1735 | |||||||||||||||||||||||
| Медь | Cu | 29 | 63,546 | 8,96 | 1084.62 | ? | |||||||||||||||||||||||
| Кюрий | Cm | 96 | 247 2 | 13,51 3 | 1345 | 3100 | 13 4 | Сиборг и др.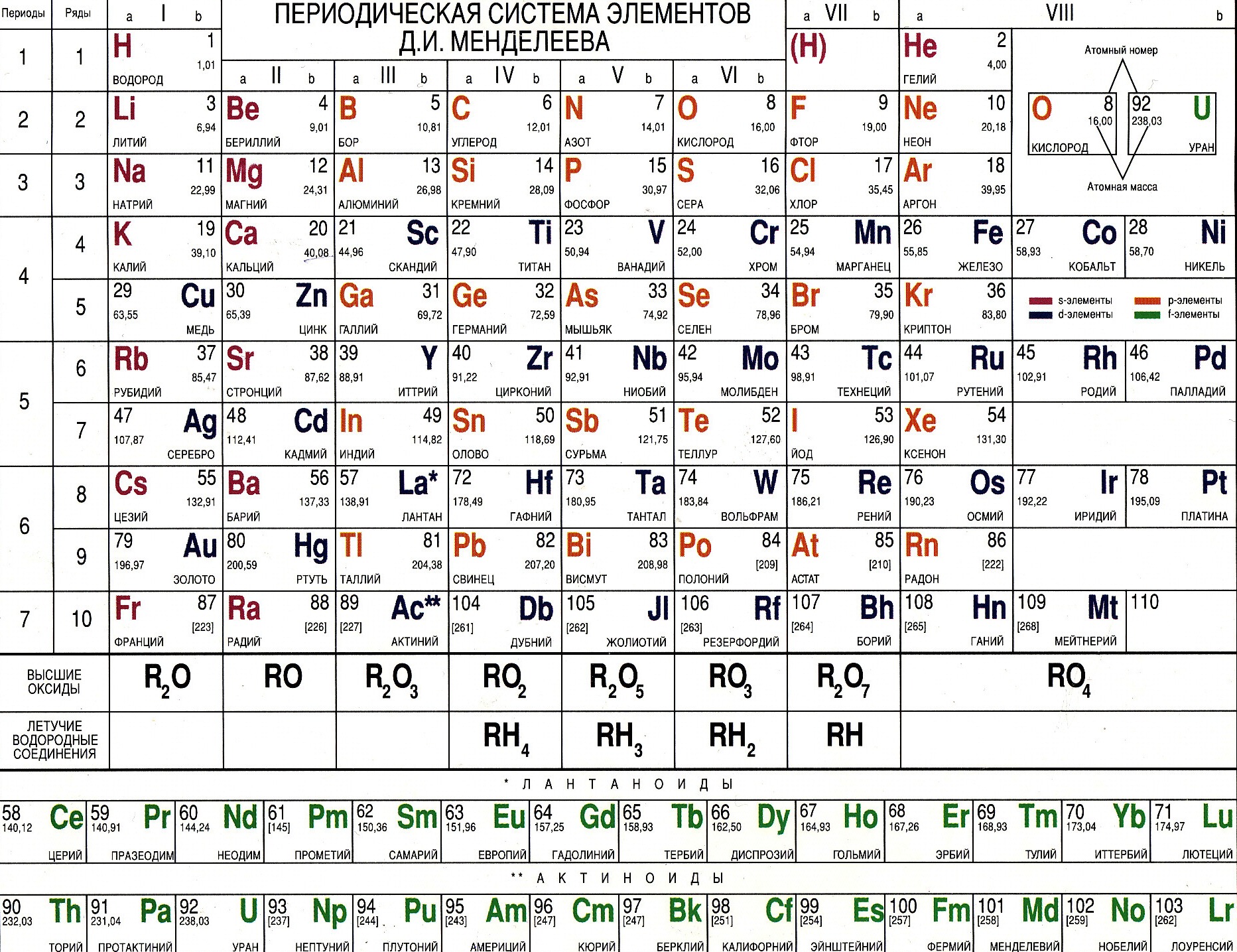 | 1944 | ||||||||||||||||||||
| Darmstadtium | Ds | 110 | 281 2 | ? | ? | ? | ? | S. Hofmann et al. | 1994 | ||||||||||||||||||||
| Дубний | Дб | 105 | 262 2 | ? | ? | ? | ? | Ghiorso et al. | 1970 | ||||||||||||||||||||
| Диспрозий | Dy | 66 | 162.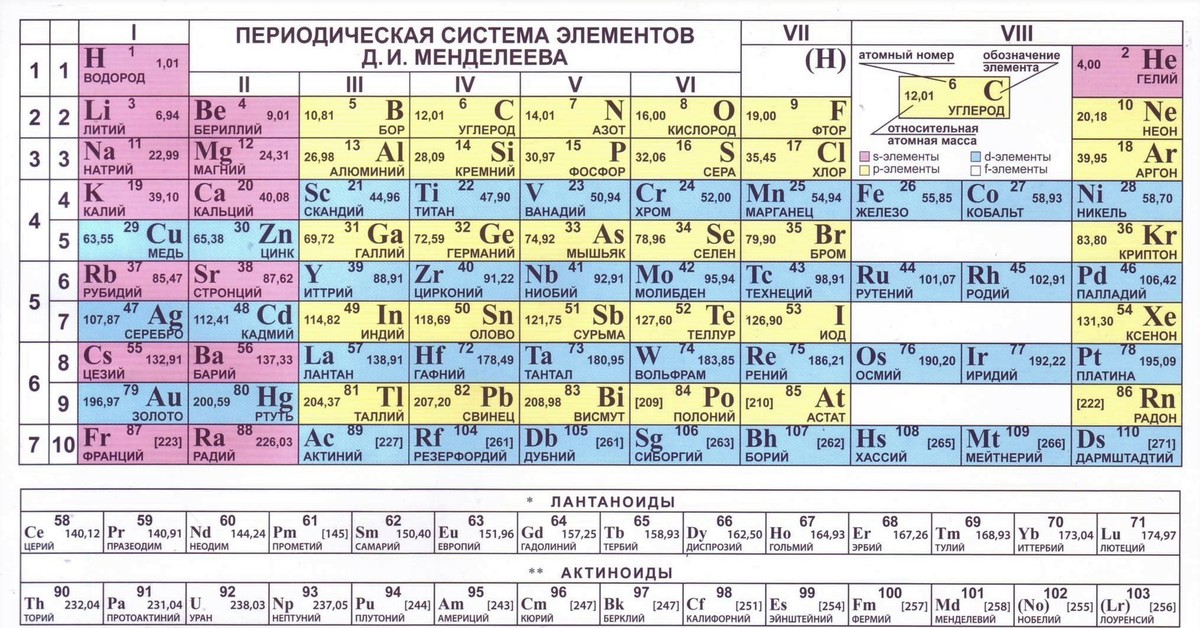 5 5 | 8,540 | 1412 | 2567 | 21 | де Буабодрана | 1886 | ||||||||||||||||||||
| Эйнштейний | Es | 99 | 252 2 | ? | 860 | ? | 12 4 | Ghiorso et al. | 1952 | ||||||||||||||||||||
| Эрбий | Er | 68 | 167,259 | 9,045 | 1529 | 2868 | 16 | Mosander | 1843 | ||||||||||||||||||||
| Europium | 964 5. 283 283 | 822 | 1529 | 21 | Demarcay | 1901 | |||||||||||||||||||||||
| Фермий | Fm | 100 | 257 2 | ? | 1527 | ? | 10 4 | Ghiorso et al. | 1953 | ||||||||||||||||||||
| Фтор | F | 9 | 18.9984032 | 1,108 5 | -219,67 | -188.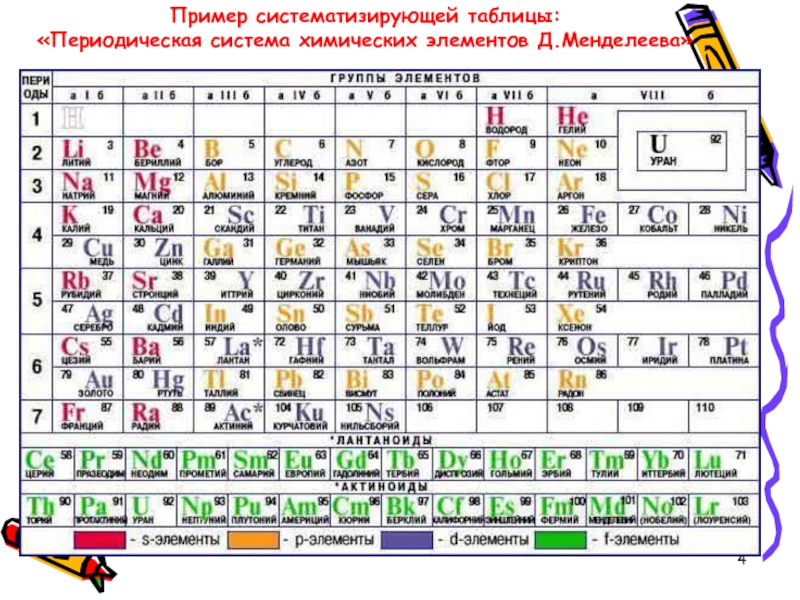 12 12 | 6 | Муассан | 1886 | ||||||||||||||||||||
| Франций | Fr | 87 | 223 2 | ? | 27 | ? | 21 | Перей | 1939 | ||||||||||||||||||||
| Гадолиний | Gd | 64 | 157,25 | 7,898 | 1313 | 3273 | 17 | де Мариньяк | |||||||||||||||||||||
| 31 | 69. 723 723 | 5,904 | 29,76 | 2204 | 14 | де Буабодран | 1875 | ||||||||||||||||||||||
| Германий | Ge | 32 | 72,64 | 938,25 | 938,25 | 1886 | |||||||||||||||||||||||
| Золото | Au | 79 | 196.96655 | 19.32 | 1064,18 | 2856 | 21 | Доисторический | ? | ||||||||||||||||||||
| Гафний | Hf | 72 | 178.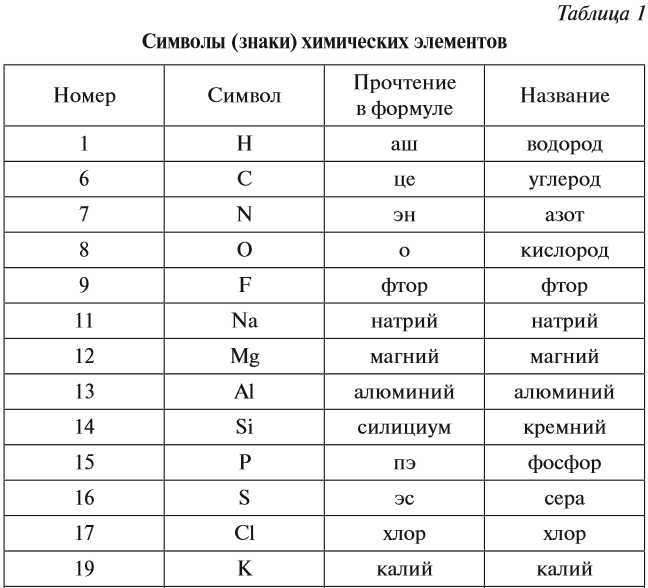 49 49 | 13,31 | 2233 | 4603 | 17 | Костер и фон Хевеши | 1923 | ||||||||||||||||||||
| Калий | HS | 108 | 277 2 | ? | ? | ? | ? | Армбрустер и Мнценберг | 1983 | ||||||||||||||||||||
| Гелий | He | 2 | 4,002602 | 0,1785 5 | -272,2 | -268. 934 934 | 5 | Janssen | 1868 | ||||||||||||||||||||
| Гольмий | Ho | 67 | 164. | 8.781 | 1474 | 2700 | 29 | Delafontaine и Soregen | |||||||||||||||||||||
| H | 1 | 1,00794 | 0,070 5 | -259,34 | -252,87 | 3 | Кавендиш | 1766 | |||||||||||||||||||||
| Индий | In | 49818 | 7,31 | 156. 60 60 | 2072 | 34 | Райх и Рихтер | 1863 | |||||||||||||||||||||
| Йод | I | 53 | 126, | 4,93 | 113,74 | ,41811 | |||||||||||||||||||||||
| Иридий | Ir | 77 | 192,217 | 22,42 | 2446 | 4428 | 25 | Tennant | 1804 | ||||||||||||||||||||
| Fe | 26003 | Fe | Fe | 845 | 7,894 | 1538 | 2861 | 10 | Доисторический | ? | |||||||||||||||||||
| Криптон | Kr | 36 | 83,8 | 3,733 5 | -157,38 | -153,22 | 23 | Рамсей и Трэверс | 1898 | ||||||||||||||||||||
138. 9055 9055 | 6,166 | 918 | 3464 | 19 | Мосандер | 1839 | |||||||||||||||||||||||
| Лоуренсий | Lr | 103 | 262 2 | ? | 1627 | ? | 20 4 | Ghiorso et al. | 1961 | ||||||||||||||||||||
| Свинец | Pb | 82 | 207,2 | 11,35 | 327,46 | 1749 | 29 | Доисторический | ? | ||||||||||||||||||||
| Литий | Li | 3 | 6,941 | 0,534 | 180,50 | 1342 | 5 | Арфведсон | 1817 | ||||||||||||||||||||
| Лютеций | 71 | Лютеций | 71 | 9679,835 | 1663 | 3402 | 22 | Урбейн / фон Вельсбах | 1907 | ||||||||||||||||||||
| Магний | Mg | 12 | 24,305 | 1,738 | Черный | 1755 | |||||||||||||||||||||||
| Марганец | Mn | 25 | 54. | 97,21? 7,44 9 | 1246 | 2061 | 11 | Gahn, Scheele, and 17 | |||||||||||||||||||||
| Мейтнерий | Мт | 109 | 268 2 | ? | ? | ? | ? | GSI, Дармштадт, Западная Германия | 1982 | ||||||||||||||||||||
| Mendelevium | Md | 101 | 258 2 | ? | 827 | ? | 3 4 | Ghiorso et al. | 1955 | ||||||||||||||||||||
| Меркурий | Hg | 80 | 200,59 | 13,546 | -38,83 | 356,73 | 26 | Доисторический | ? | ||||||||||||||||||||
| Молибден | Mo | 42 | 95,94 | 10,22 | 2623 | 4639 | 20 | Scheele | 1778 | ||||||||||||||||||||
| Неодим | 144 Nd24 | 6,80 и 7,004 10 | 1021 | 3074 | 16 | фон Вельсбаха | 1885 | ||||||||||||||||||||||
| Neon | Ne | 10 | 20,1797 | 0,89990 10,1797 | 0,89990 10 ) | -248,59 | -246,08 | 8 | Рамзи и Трэверс | 1898 | |||||||||||||||||||
| Нептуний | Np | 93 | 237 2 | 20. | 644 | 15 4 | Макмиллан и Абельсон | 1940 | |||||||||||||||||||||
| Никель | Ni | 28 | 58.6934 | 8.902 | 1455 | 29153 | 1751 | ||||||||||||||||||||||
| Ниобий (Columbium) | Nb | 41 | 92. | 8,57 | 2477 | 4744 | 24 | Hatchett | 1801 | 1801 | 9 Азот 69 14.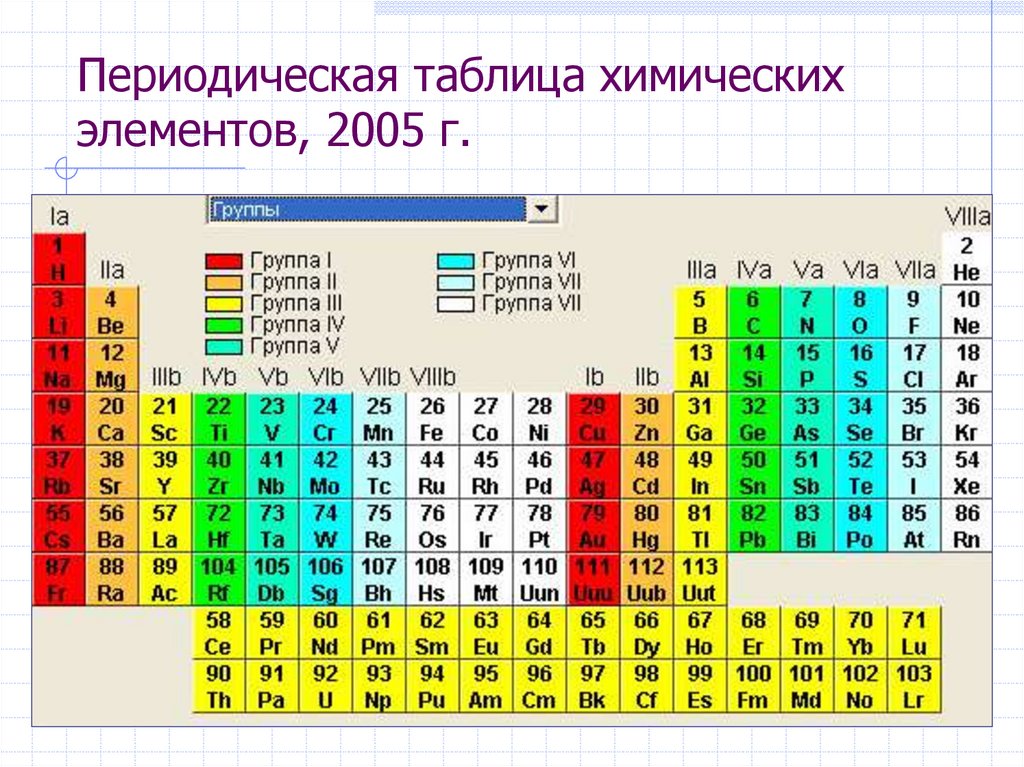 0067 0067 | 0,808 5 | -210,00 | -195,79 | 8 | Резерфорд | 1772 | ||||||||||||
| Нобелий | № | 102 | 259 2 | ? | 827 | ? | 7 4 | Ghiorso et al. | 1958 | ||||||||||||||||||||
| Осмий | Os | 76 | 190,23 | 22,57 | 3033 | 5012 | 19 | Теннант | 1803 | ||||||||||||||||||||
| Кислород | 9994 | 1,14 5 | -218,79 | -182,95 | 8 | Пристли / Шееле | 1774 | ||||||||||||||||||||||
| Палладий | Pd | 46 | 106,42 | 46 | 106,42 | 21 | Wollaston | 1803 | |||||||||||||||||||||
| Фосфор (белый) | P | 15 | 30. 973761 973761 | 1,82 | 44.15 | 280,5 | 7 | Торговая марка | 1669 | ||||||||||||||||||||
| Платина | Pt | 78 | 195.078 | 21,45 | 1768,4 | 3825 | 32 | Уллоа5 | Уллоа | ||||||||||||||||||||
| Плутоний | Pu | 94 | 244 2 | 19,84 | 640 | 3228 | 16 4 | Сиборг и др. | 1940 | ||||||||||||||||||||
| Полоний | Po | 84 | 209 2 | 9,32 | 254 | 962 | 34 | Кюри | 1898 | ||||||||||||||||||||
| Калий | 39,0983 | 0,862 | 63,5 | 759 | 10 | Дэви | 1807 | ||||||||||||||||||||||
| Празеодим | Pr | 59 | 140. | 6,772 | 931 | 3520 | 15 | фон Вельсбаха | 1885 | ||||||||||||||||||||
| Прометий | Pm | 61 | 145 2 | ? | 1042 | 3000 | 14 | Маринский и др. | 1945 | ||||||||||||||||||||
| Протактиний | Па | 91 | 231.03588 | 15,37 3 | 1572 | ? | 14 | Хан и Мейтнер | 1917 | ||||||||||||||||||||
| Радий | Ra | 88 | 226 2 | 5. 0? 0? | 700 | ? | 15 | Пьер и Мария Кюри | 1898 | ||||||||||||||||||||
| Радон | Rn | 86 | 222 2 | 4,4 5 | -71 | -61.7 | 2073 | Дорн | 1900 | ||||||||||||||||||||
| Рений | Re | 75 | 186.207 | 21,02 | 3186 | 5596 | 21 | Noddack, Berg и Tacke | 9215hod7 | 9215hod7 | |||||||||||||||||||
102. 9055 9055 | 12,41 | 1964 | 3695 | 20 | Волластон | 1803 | |||||||||||||||||||||||
| Рентгениум 10 | Rg | 111 | 272 2 | ? | ? | ? | ? | Hofmann et al. | 1994 | ||||||||||||||||||||
| Рубидий | Rb | 37 | 85,4678 | 1,532 | 39,30 | 688 | 20 | Бунзен и Кирхгоф | 1861 | 9003 9007||||||||||||||||||||
| Руссен | 101. 07 07 | 12,44 | 2334 | 4150 | 16 | Клаус | 1844 | ||||||||||||||||||||||
| Резерфордий | Rf | 104 | 261 2 | ? | ? | ? | ? | Ghiorso et al. | 1969 | ||||||||||||||||||||
| Самарий | Sm | 62 | 150,36 | 7,536 | 1074 | 1794 | 17 | Бойсбаудран | 1879 | 44 Скандий | 44 Скандий | 2. 989 989 | 1541 | 2836 | 15 | Nilson | 1878 | ||||||||||||
| Seaborgium | Sg | 106 | 266 2 | ? | ? | ? | ? | Ghiorso et al. | 1974 | ||||||||||||||||||||
| Селен (серый) | Se | 34 | 78,96 | 4,79 | 220,5 | 685 | 20 | 14 Берцелиус | SiC | ||||||||||||||||||||
| SiC | 28. 0855 0855 | 2,33 | 1414 | 3265 | 8 | Берцелиус | 1824 | ||||||||||||||||||||||
| Серебро | Ag | 47 | 107.8682 | 10,5 | 961.7862 | 961.7862 | ?|||||||||||||||||||||||
| Натрий | Na | 11 | 22.98977 | 0,971 | 97,80 | 883 | 7 | Дэви | 1807 | ||||||||||||||||||||
| Стронций | 87 Sr | 62 | 2,54 | 777 | 1382 | 18 | Дэви | 1808 | |||||||||||||||||||||
| Сера | S | 16 | 32,065 | 2,077 10 | 92. 6073 9007 9001 6073 9007 9001 | 95,3 (ромб. 10 | Доисторические | ? | |||||||||||||||||||||
| Тантал | Ta | 73 | 180.9479 | 16.654 | 3017 | 5458 | 19 | Ekeberg | 1801 | ||||||||||||||||||||
| Технеций | Tc | 11.50 3 | 2157 | 4265 | 23 | Perrier и Segr | 1937 | ||||||||||||||||||||||
| Теллур | Te | 52 | 127,60 | 6. 24 24 | 449.51 | 29153 449.51 | Райхенштейн | 1782 | |||||||||||||||||||||
| Тербий | Tb | 65 | 158. | 8,234 | 1356 | 3230 | 24 | Мосандер | 1843 | ||||||||||||||||||||
| Мосандер | 1843 | ||||||||||||||||||||||||||||
| Thallium | .383311,85 | 304 | 1473 | 28 | Крукс | 1861 | |||||||||||||||||||||||
| Торий | Th | 90 | 232,0381 | 11,72 | 232,0381 | 11,72 | 950 | 1828 | |||||||||||||||||||||
| Тулий | Tm | 69 | 168. | 9,314 | 1545 | 1950 | 18 | Cleve | 1879 | ||||||||||||||||||||
| олово (белый) | .71 | 7,31 | 231,93 | 2602 | 28 | Доисторический | ? | ||||||||||||||||||||||
| Титан | Ti | 22 | 47,867 | 4,55 | 1668 | 3287 | 9 | Gregor | 1791 | ||||||||||||||||||||
| Вольфрам | 74 | 9007 | 3422 | 5555 | 22 | Дж. и Ф. д’Эльхуяр и Ф. д’Эльхуяр | 1783 | ||||||||||||||||||||||
| Уран | U | 92 | 238.02891 | 19.05 | 1135 | 4131 | 15 | Peligot | 184199693 | 23 | 50.9415 | 6,11 | 1910 | 3407 | 9 | del Rio | 1801 | ||||||||||||
| Ксенон | Xe | 54 | 131.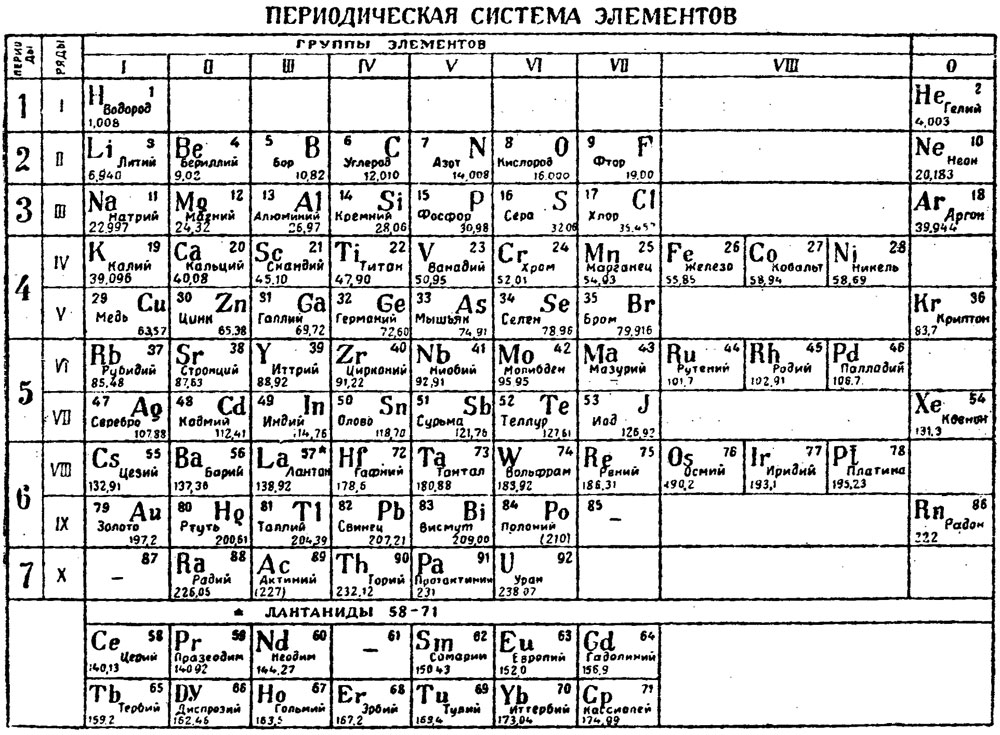 293 293 | 3,52 5 | -111,79 | -108,12 | 31 | Рамзи и Трэверс | 1898 | ||||||||||||||||||||
| Иттербий | Иб | 70 | 173,993 | 370 | 173 | 16 | Мариньяк | 1878 | |||||||||||||||||||||
| Иттрий | Y | 39 | 88. | 4,457 | 1522 | 3345 | 21 | Гадолин | 9003 | 994 | 30 65. 39 39 | 7,133 | 419,5 | 907 | 15 | Доисторический | ? | ||||||||||||
| Цирконий | Zr | 40 | 91,224 | 6,506 3 | 1855 | 4409 | 20 | Клапрот | 1789 |
Элементы 115 ПРИМЕЧАНИЯ и 116 находятся на рассмотрении и поэтому не включены. примерно значит? Примерно.? <означает? меньше, чем.?
1. Изотопы – это разные формы одного и того же элемента, имеющие одинаковый атомный номер, но разные атомные веса.
2. Известное массовое число наиболее долгоживущего изотопа.
3. Расчетная цифра.
4. Искусственно произведенные.
5. Жидкость.
6. Примерно.
7. Аморфный.
8. В зависимости от того, аморфный, графитовый или алмазный.
9. В зависимости от аллотропной формы.
10.В 2004 году Международный союз теоретической и прикладной химии назвал элемент 111 Roentgenium в честь первооткрывателя рентгеновских лучей Вильгельма Рентгена.
Периодическая таблица – важное открытие в физике элементарных частиц
| AT N o | Название элемента | æ | Происхождение названия |
89 | Актиний | Ac | От греческого слова aktinos (луч) |
13 | Алюминий | Al | От латинского слова alumen (квасцы) |
95 | Америций | Am | Из Америки, где был открыт |
51 | Сурьма | Сб | От греческих слов анти + монос, означающих не только |
18 | Аргон | Ar | От греческого слова argos, означающего бездействующий |
33 | Мышьяк | Как | От греческого слова «арсеникон», что означает «желтый арипимент» («арипимент» – трисульфид мышьяка). |
85 | Астатин | в | От греческого слова astatos, означающего нестабильный. |
56 | Барий | Ba | От греческого слова barus, означающего тяжелый |
97 | Берклий | Bk | Назван в честь Беркли, США, где был обнаружен |
4 | Бериллий | Be | От греческого слова бериллос, означающего берилл. |
83 | Висмут | Bi | От немецкого слова bisemutum |
107 | Бориум | Bh | Назван в честь датского физика Нильса Бора. |
5 | Бор | B | От арабского слова бурак или персидского слова бура |
35 | Бром | руб. | От греческого слова bromos, означающего зловоние |
48 | Кадмий | Кд | От латинского слова cadmia или греческого слова kadmeia, оба означающих каламин. |
55 | Цезий | CS | От латинского слова caesius, что означает небесно-голубой |
20 | Кальций | Ca | От латинского слова calx, означающего лайм |
96 | Калифорний | Cf | Назван в честь Калифорнийского университета, США, где он был обнаружен |
6 | Карбон | С | От латинского слова carb, означающего древесный уголь. |
58 | Церий | CE | Назван в честь астероида Церера, который был открыт в 1801 году, за два года до элемента | .
17 | Хлор | Класс | От греческого слова хлорос, означающего бледно-зеленый |
24 | Хром | Cr | От греческого слова хром, означающего цвет | .
27 | Кобальт | Co | От немецкого слова kobald, означающего гоблин или злой дух |
29 | Медь | Cu | От латинского названия острова Кипр из меди. |
96 | Кюрий | см | Названо в честь Пьера и Марии Кюри |
110 | Дармстадион | DS | Назван в честь Дармштадта, Германия, где был обнаружен |
105 | Дубний | Дб | Назван в честь Дубны, СССР, где был обнаружен |
66 | Диспрозий | Dy | От греческого слова «диспроситос», что означает «трудно получить». |
99 | Эйнштейний | Es | Назван в честь Альберта Эйнштейна |
68 | Эрбий | Er | Назван в честь деревни Иттерби в Швеции, где добывали минерал из |
63 | Европий | Eu | Назван в честь Европы |
100 | Фермий | Fm | Названо в честь Энрико Ферми, итальянского физика. |
9 | Фтор | F | От латинского слова fluere, что означает «течь» |
87 | Франций | Fr | Назван в честь Франции |
64 | Гадолиний | Gd | Назван в честь финского химика и минералога Йохана Гадолина |
31 | Галлий | Ga | От латинского слова Gallia, что означает Франция |
32 | Германий | Ge | От латинского слова Germania, что означает Германия |
79 | Золото | Au | От немецкого слова золото, которое произошло от более раннего слова, означающего желтый.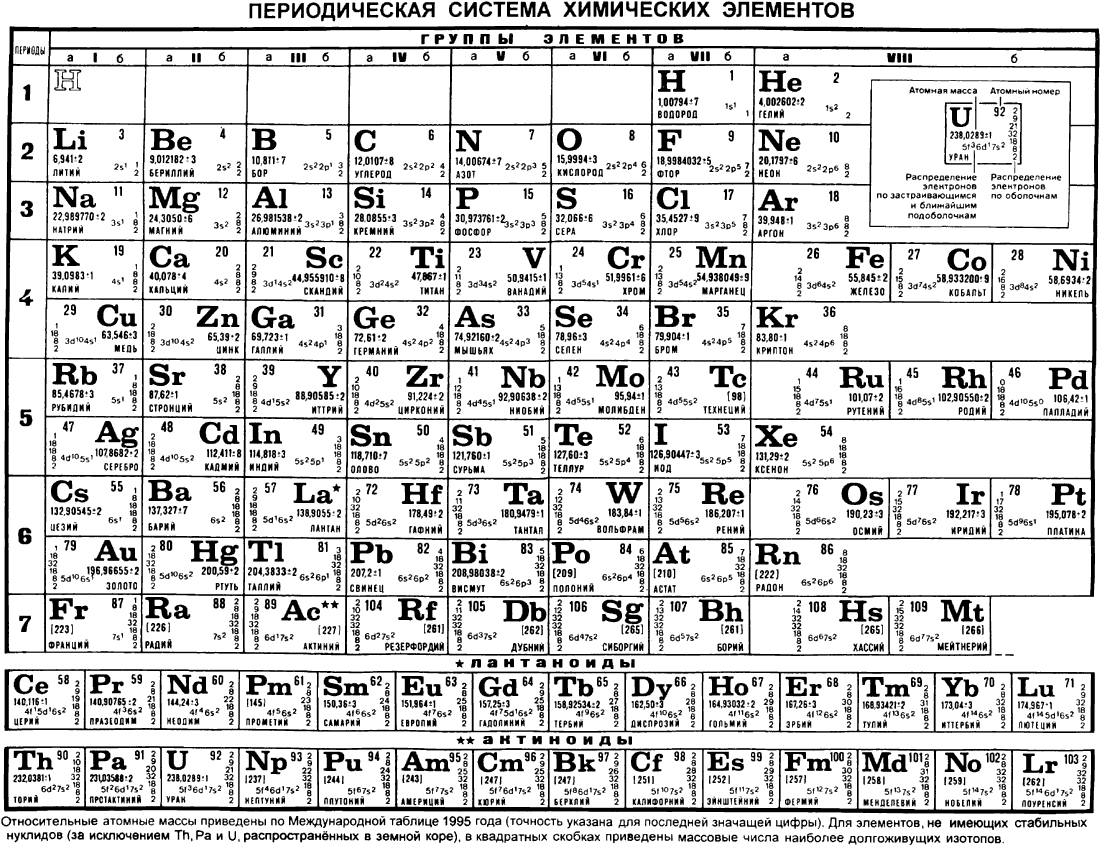 |
72 | Гафний | Hf | От латинского слова Hafnia, означающего Копенгаген. |
108 | Калий | HS | От латинского слова Халий, обозначающего немецкую землю Гесс | .
2 | Гелий | He | От греческого слова helios, означающего солнце |
67 | Гольмий | Ho | От греческого слова Holmia, что означает Швеция. |
1 | Водород | H | От греческих слов «гидрогены», что означает вода и генератор. |
49 | Индий | В | Назван в честь линии индиго в его атомном спектре |
53 | Йод | I | От греческого слова iodes, означающего фиолетовый. |
77 | Иридий | Ir | От греческого слова ирис, что означает радуга. |
26 | Утюг | Fe | От исарны старое саксонское слово для обозначения железа |
36 | Криптон | Кр | От греческого слова kryptos, что означает скрытый |
57 | Лантан мкм | La | От греческого слова lanthanein, что означает «скрывать» |
103 | Лоуренсий | Lr | Назван в честь Эрнеста О.Лоуренс, изобретатель циклотрона |
82 | Свинец | Пб | От англосаксонского слова свинец |
3 | Литий | Li | От греческого слова lithos, означающего камень. |
71 | Лютеций | Лю | От греческого слова Lutetia, означающего Париж. |
12 | Магний | мг | От греческого слова Магнезия, район Фессалии |
25 | Mangan ese | Мн | От латинского слова magnes, что означает магнит |
108 | Мейтнерий | млн тонн | Назван в честь австрийского физика Лизы Мейтнер. |
101 | Mendel Evium | Md | Именем российского химика Дмитрия Менделеева |
80 | Меркурий | рт. Ст. | Назван в честь планеты Меркурий |
42 | Молибден | Пн | От греческого слова «молибдос», что означает «свинец». |
60 | Неодим | Nd | От греческого слова neos didymos, означающего новый близнец |
10 | Неон | Ne | От греческого слова «неон», означающего «новый». |
93 | Нептуний | Np | Назван в честь планеты Нептун |
28 | Никель | Ni | От немецкого слова kupfernickel, что означает дьявольский лопаточка | .
41 | Ниобий | Nb | Назван в честь Ниобы, дочери Тантала в греческой мифологии |
7 | Азот | N | От греческих слов нитронные гены, означающие нитру и образующие |
102 | Нобелий | Нет | Назван в честь шведского химика Альфреда Нобеля |
76 | Осмий | Os | От греческого слова osme, что означает запах |
8 | Кислород | O | От греческих слов оксигены, означающих кислота и образующихся |
46 | Палладий | Pd | Назван в честь астероида Паллада, который был обнаружен примерно в то же время. |
15 | Фосфористая русская | -P | От греческого слова «фосферос», что означает «несущий свет». |
78 | Платина | Pt | От испанского слова «платина», что означает «серебро». |
94 | Плутоний | Pu | Назван в честь планеты Плутон |
84 | Полоний | Po | Назван в честь Польши, места рождения Марии Кюри |
19 | Калий | К | От английского слова поташ, зола, оставшаяся в горшке после сжигания листьев растений, из которой был получен карбонат калия. |
59 | Празеодим ium | Пр | От греческого слова prasios didymos, означающего гринтвин |
61 | Прометий | вечера | Назван в честь Прометея, который украл огонь с небес и дал его людям, согласно греческой мифологии. |
91 | Протактиний | Па | От греческого слова protos, означающего первый. |
86 | Радон | Rn | Назван в честь элемента радий, из которого он был получен |
88 | Радий | Ra | От латинского слова radius, означающего луч | .
75 | Рений | Re | От Ренуса, что на латыни означает река Рейн, где родился один из первооткрывателей. |
45 | Родий | Rh | От греческого слова родон, что означает роза. |
111 | Рентген | Rg | Назван в честь Вильгельма К.Рентген, немецкий физик |
37 | Рубидий | руб.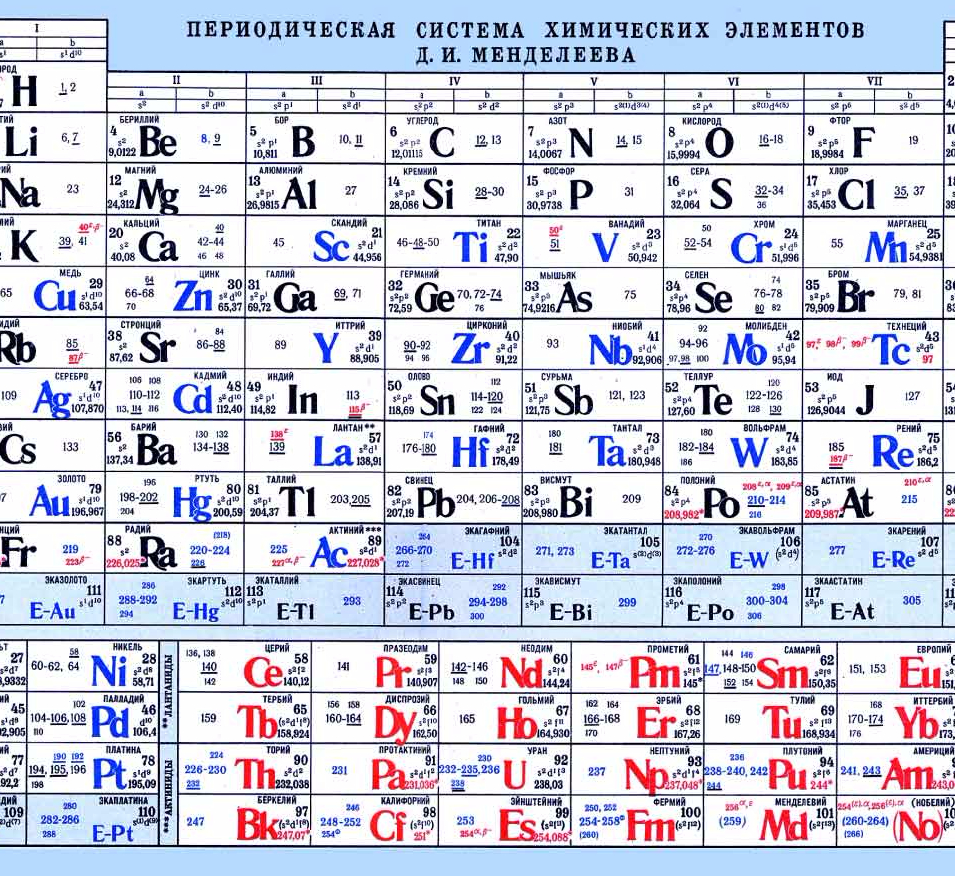 | От латинского слова rubidius, означающего темно-красный |
44 | Рутений | Ру | Из Малороссии, латинское слово для России |
104 | Резерфорд Иум | Rf | Назван в честь Эрнеста Р. Резерфорда, новозеландского физика и химика |
62 | Самарий | см | Назван в честь самарскита, минерала, из которого он был выделен |
21 | Скандий | SC | От латинского слова Scandia, что означает Скандинавия |
106 | Сиборгий | Sg | Назван в честь Глена Т.Сиборг, американский химик-ядерщик |
34 | Seleni um | SE | От греческого слова selene, означающего луна. |
14 | Кремний | Si | От латинского слова silicis, что означает кремень |
47 | Серебро | Ag | От слова siluvar, древнесаксонского слова, обозначающего серебро. |
11 | Натрий | Na | От английского слова «газировка», обозначающего карбонат натрия. | .
38 | Стронций | Sr | Назван в честь Стронтиана, Шотландия, где был обнаружен минерал, из которого он был выделен. |
16 | Сера | S | От латинского слова «сера», обозначающего серу. |
73 | Тантал | Ta | Назван в честь царя Тантала, отца Ниобы в греческой мифологии |
43 | Технеций | Tc | От греческого слова technikos, означающего искусственный. |
52 | Теллур | Te | От латинского слова tellus, что означает земля |
65 | Тербий | Тб | Назван в честь Иттерби, города в Швеции, где была обнаружена его руда. |
81 | Таллий | TL | От греческого слова thallos, что означает зеленая ветка |
90 | Торий | Чт | Назван в честь Тора, скандинавского бога войны |
69 | Тулий | ТМ | Назван в честь Туле, древнего названия Скандинавии |
50 | Олово | Sn | От англосаксонского слова олово |
22 | Титан | Ti | Назван в честь титанов, старших богов, правивших землей до олимпийских богов, в греческой мифологии |
74 | Вольфрам | Вт | От шведского слова вольфрам, что означает тяжелый камень |
92 | Уран | U | Назван в честь планеты Уран |
23 | Ванадий | В | Назван в честь Ванадиса, богини красоты в скандинавской мифологии |
54 | Ксенон | Xe | От греческого слова «ксенон», означающего «незнакомец». |
70 | Иттербий | Yb | Назван в честь деревни Иттерби в Швеции, где была найдена ее руда. |
39 | Иттрий | Y | Назван в честь деревни Иттерби в Швеции, где была найдена ее руда. |
30 | Цинк | Zn | От немецкого слова цинк |
40 | Цирконий | Zr | От арабского слова zargun, что означает золотой цвет |
Химические элементы в организме человека
«И в вас самих.Тогда ты не увидишь? » – Сурат ад-дхарийат (стих 21).
Наши тела удивляют нас своими секретами, которые постоянно раскрываются по мере проведения новых научных исследований. Это подтверждает, что независимо от того, насколько мы осведомлены, нам предстоит еще многое сделать. Раньше было трудно убедить людей в том, что их тела содержат химические элементы из Периодической таблицы, в том числе ценные, такие как золото и медь. Однако теперь, когда несколько исследований подтвердили, что эти элементы действительно существуют в наших телах, миссия стала намного проще.
Раньше было трудно убедить людей в том, что их тела содержат химические элементы из Периодической таблицы, в том числе ценные, такие как золото и медь. Однако теперь, когда несколько исследований подтвердили, что эти элементы действительно существуют в наших телах, миссия стала намного проще.
Почти 99% массы тела человека состоит из шести основных элементов; а именно: кислород, углерод, водород, азот, кальций и фосфор; 65–90% каждой клетки тела состоит из воды, поэтому кислород и водород являются одними из основных компонентов человеческого тела.
1. Кислород
Химический знак O 2 ; 65% массы тела человека.
В общем, выживание всех живых организмов зависит от кислорода.Кислород жизненно необходим для дыхания; он составляет 20% воздуха, который мы вдыхаем. Человеческий мозг нуждается в кислороде для выполнения своих биологических функций; если кислород не достигнет мозга, тело погибнет через несколько минут. Кислород существует в нашем организме в основном в форме воды; он составляет 89% от веса воды.
Кислород существует в нашем организме в основном в форме воды; он составляет 89% от веса воды.
2. Углерод
Химический знак C; 18% массы тела человека.
Углерод – четырехвалентный элемент; то есть он может связываться с четырьмя химическими элементами, что делает его фундаментальным атомом в органической химии.Углеродные цепи используются для создания углеводов, жиров и белков; разрыв этих цепей обеспечивает организм энергией.
3. Водород
Химический знак H 2 ; 10% от массы тела человека.
Водород является основным компонентом ДНК; как таковой, он присутствует в каждой молекуле всех живых клеток. Количество водорода, присутствующего в ДНК, зависит от количества воды в организме человека. Человеческому телу необходимо два с половиной литра воды в день или в зависимости от его веса, чтобы сохранить ДНК здоровой и избежать болезней.
4. Азот
Химический знак N 2 ; 3% от массы тела человека.
Азот – важнейший компонент протоплазмы клеток животных, а также аминокислоты, образующие белки, и кислоты, образующие ДНК.
5. Кальций
Химический знак Ca; 1,5% от массы тела человека.
Кальций – важный элемент в организме человека, большая часть которого сосредоточена в зубах и костях; кальций регулирует белок и мышечные сокращения.Он также сохраняет плотность и прочность костей, регулирует сердцебиение и свертываемость крови.
6. Фосфор
Химический символ P; 1% от массы тела человека.
Фосфор содержится в организме человека в форме фосфатов, атом фосфора, связанный с четырьмя атомами кислорода. Скелет и мозг человека являются резервуарами фосфатов, где они находятся в форме фосфата кальция. Фосфаты также присутствуют в форме энергетической молекулы аденозинтрифосфата (АТФ), которая выделяет 7. 3 ккал / моль энергии для выполнения различных биологических функций.
3 ккал / моль энергии для выполнения различных биологических функций.
7. Калий
Химический знак K; 0,35% от массы тела человека.
Красные кровяные тельца содержат большую часть калия, обнаруженного в организме, затем в мышцах, а затем в ткани мозга. Калий передает нервные сигналы, регулирует сердцебиение и снижает уровень сахара в крови. Он также поддерживает здоровье костей, увеличивает их плотность и предотвращает их хрупкость за счет поддержания баланса кислот, которые хранят кальций в организме.
8. Сера
Химический знак S; 0,25% от массы тела человека.
Сера играет роль в придании белкам формы, необходимой им для выполнения своих функций.
9. Натрий
Химическое обозначение Na; 0,15% от массы тела человека.
Функции натрия аналогичны калию в передаче нервных сигналов между клетками; он также способствует регулированию количества воды в организме.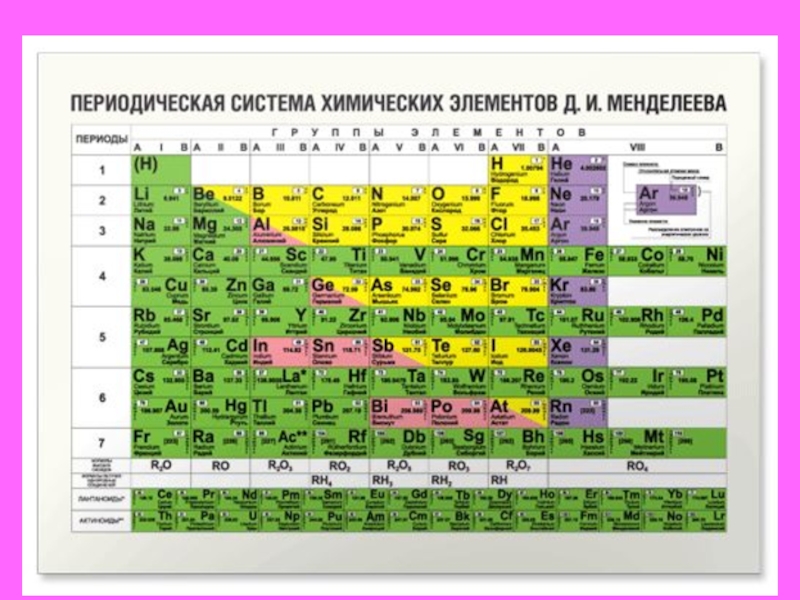
10. Золото
Химический знак Au; 0,2 мг массы тела человека.
Золото обнаружено в крови; он играет решающую роль в защите тела и сохранении суставов. Это также важный элемент передачи электрических сигналов по всему телу.
Ссылки
gold-traders.co.uk
livescience.com
Thinkco.com
Thinkco.com
знаков периодической таблицы
знаков периодической таблицы Принесено вам Кармен Джунтой и Джеймсом Маршаллом при поддержке Отдела истории химии ACS (HIST) в ознаменование Международного года Периодической таблицы элементов (IYPT). Мы благодарим Агнес Содербек (Мичиганский университет) за то, что она указала нам на Google Мои карты как на подходящую платформу для проекта.
Это интерактивная карта мест, связанных с разработчиками периодической таблицы Менделеева и химическими элементами, с возможностью поиска и ссылками на дополнительную информацию.Примеры включают места, где были обнаружены или синтезированы элементы, минеральные источники элементов, места, где работали первооткрыватели химической периодичности, и места, в честь которых были названы элементы. Каждая запись содержит ссылки на дополнительную информацию об описанном человеке, месте или событии. Указывается тип места (например, лаборатория, резиденция, минеральный источник и т. Д.), А также то, существует ли (насколько нам известно) историческое место на этом месте. Для получения дополнительной информации о типе сайта, пожалуйста, обратитесь к этому ключу к полям карты.Карта предназначена только для образовательных и информационных целей и не предназначена для использования в качестве путеводителя. Если вы хотите посетить сайт на этой карте, пожалуйста, обратитесь к другим ресурсам, чтобы подтвердить доступ, и руководствуйтесь здравым смыслом.
База данных, на которой построена карта, состоит в основном из локаций из проекта «Повторное открытие элементов», проекта Джеймса и Вирджинии Маршалл из Университета Северного Техаса. В течение более чем десятилетия Маршаллы посещали, фотографировали и писали о местах, связанных с открытиями химических элементов.Большинство сайтов на этой карте взяты из списка сайтов, предоставленного Джимом Маршаллом. (К сожалению, Вирджиния («Дженни») скончалась в 2014 году.) Сайты, перечисленные в проекте «Повторное открытие элементов», отмечены галочкой, ✓. Сайты «повторного открытия» были дополнены другими местами, выбранными во время путешествий Кармен Джунта в кресле, с использованием исторических документов, а также цифровых инструментов, таких как Google Maps и Google Earth. Собранная нами база данных доступна для скачивания здесь (формат .xlsx). Эта работа находится под лицензией Creative Commons Attribution-ShareAlike 4.0 Международная лицензия.
Мы заинтересованы в добавлении на карту еще большего количества мест, особенно за пределами Европы и Северной Америки. Комментарии и предложения по дополнительным местам приветствуются. Пожалуйста, отправьте их на [email protected]. Предлагая места для добавления на карту, пожалуйста, будьте как можно более конкретными: что это за место и как оно связано с периодической таблицей или конкретным элементом?
Комментарии и предложения по дополнительным местам приветствуются. Пожалуйста, отправьте их на [email protected]. Предлагая места для добавления на карту, пожалуйста, будьте как можно более конкретными: что это за место и как оно связано с периодической таблицей или конкретным элементом?
Комментарии по электронной почте о местах в таблице Менделеева.
Вернуться к элементам таблицы Менделеева Карта
Вернуться к началу классической химии
Какие химические элементы обнаружены в организме человека?
Химические элементы – кирпичики жизни. Они составляют ошеломляющее количество молекул, которые вместе образуют ДНК, клеточные органеллы, клетки, ткани и органы. В этой статье мы обсудим те элементы, которые присутствуют в организме человека, их соотношение и различные важные функции, которые они выполняют.
Изображение предоставлено: bestber / Shutterstock.com
Элементы, из которых состоит человеческое тело
Тело во всех смыслах представляет собой чрезвычайно сложную машину. Для этого требуется множество частей, работающих вместе в сложных отношениях от микро- до макромолекулярного уровня. Структура строительных блоков, составляющих сумму этих частей, таких как белки и нуклеиновые кислоты, определяется соотношением и взаимодействием химических элементов.
Для этого требуется множество частей, работающих вместе в сложных отношениях от микро- до макромолекулярного уровня. Структура строительных блоков, составляющих сумму этих частей, таких как белки и нуклеиновые кислоты, определяется соотношением и взаимодействием химических элементов.
Некоторые элементы встречаются гораздо чаще, чем другие. Человеческое тело примерно на 99% состоит всего из шести элементов: кислорода, водорода, азота, углерода, кальция и фосфора. Еще пять элементов составляют около 0,85% от оставшейся массы: сера, калий, натрий, хлор и магний. Все эти 11 элементов являются важными элементами.
Остальные 0,15% человеческого тела состоят из микроэлементов. Суммарная масса микроэлементов не соответствует массе магния, который является наименее распространенным из непроследованных элементов.Согласно лабораторным данным, некоторые из микроэлементов (около дюжины) могут быть необходимы для жизни.
Функции химических элементов в организме
Большинство химических элементов, содержащихся в организме человека, играют жизненно важную роль.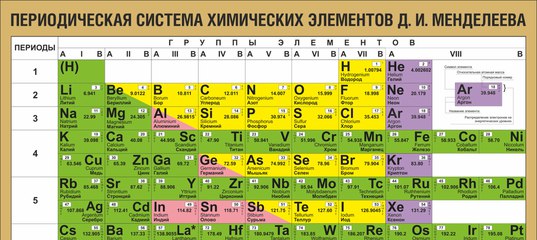 Некоторые микроэлементы, такие как титан и цезий, могут быть загрязнителями. Некоторые из них, такие как свинец, ртуть, мышьяк и кадмий, являются активными токсинами в зависимости от их количества.
Некоторые микроэлементы, такие как титан и цезий, могут быть загрязнителями. Некоторые из них, такие как свинец, ртуть, мышьяк и кадмий, являются активными токсинами в зависимости от их количества.
Функции основных элементов человеческого тела в процентном отношении к массе следующие:
КислородКислород – самый распространенный элемент в организме человека, его около 65.0% массы тела. Большая часть кислорода находится в форме воды. Кислород играет решающую роль в метаболизме и дыхании, и этот элемент содержится во всех основных органических молекулах в организме, включая белки, углеводы, жиры и нуклеиновые кислоты.
УглеродУглерод – следующий по частоте элемент в организме человека, составляющий 18% всего тела по массе. Его роль в основном структурная, составляющая «основу» многих органических молекул.
Водород Водород является самым распространенным элементом во Вселенной (около 75% общей массы) и составляет около 10% массы человеческого тела. Он присутствует в форме воды (наряду с кислородом), а также является важным элементом в органических молекулах.
Он присутствует в форме воды (наряду с кислородом), а также является важным элементом в органических молекулах.
Азот составляет 3% массы тела человека. Он содержится во всех организмах в таких молекулах, как аминокислоты (из которых состоят белки), нуклеиновые кислоты (ДНК и РНК) и аденозинтрифосфат (АТФ), важная молекула для передачи энергии.
КальцийКальций – самый распространенный металл в организме человека, его содержание составляет около 1.4% по массе. Возможно, его наиболее известная функция заключается в формировании костей и зубов, а недостаток кальция в рационе может привести к множеству дегенеративных состояний. Другие важные роли в организме человека включают синтез белка, поддержание разности потенциалов на клеточных мембранах и действие в качестве вторичных посредников в путях передачи сигналов.
Фосфор Фосфор обладает высокой реакционной способностью, и из-за этого свойства он никогда не встречается на Земле как свободный элемент. Фосфаты необходимы для жизни, и эта связанная форма фосфора является основным компонентом незаменимых органических молекул, таких как фосфолипиды, АТФ и нуклеиновые кислоты. Он составляет 1,1% от общей массы тела человека.
Фосфаты необходимы для жизни, и эта связанная форма фосфора является основным компонентом незаменимых органических молекул, таких как фосфолипиды, АТФ и нуклеиновые кислоты. Он составляет 1,1% от общей массы тела человека.
Калий составляет менее 1% массы тела. Он играет жизненно важную роль в нервной передаче через перенос ионов калия через мембраны нервных клеток.
СераСера, занимающая десятое место по распространенности во Вселенной и пятое по распространенности на Земле, играет важную роль в организме человека.Он находится в организме почти всегда в виде сульфидов металлов и сероорганических соединений. Сера также является основным структурным элементом протеина кератина, который содержится в коже и волосах.
Натрий Натрий, щелочной металл, обычно содержится в соли. Ионы натрия способствуют осмотическому давлению, поскольку они являются основными катионами во внеклеточной жидкости (ВКЖ). Натрий также играет ключевую роль в нервной передаче.
Натрий также играет ключевую роль в нервной передаче.
Хлор играет важную роль в поддержании кислотно-щелочного баланса крови, а также в формировании сухожилий, зубов и костей.Он обычно содержится в солях и в сочетании с калием и натрием в организме. Он также способствует работе печени и помогает удалять органические отходы.
МагнийМагний – наименее распространенный из незаменимых элементов в организме человека. Приблизительно 300 ферментам для правильного функционирования требуются ионы магния, а ионы магния взаимодействуют с такими соединениями, как ДНК, РНК и АТФ.
МикроэлементыМикроэлементы играют множество ролей, некоторые из которых важнее других, в то время как другие не вносят никаких заметных функций.Некоторые из них очень токсичны для человека.
Три самых распространенных незаменимых микроэлемента – это железо, фтор и цинк. Железо играет важную роль в здоровье человека как часть гемоглобина, который переносит кислород по телу в крови. Фтор важен для зубов. Цинк необходим более чем 300 ферментам и 1000 факторам транскрипции и жизненно важен для здоровья глаз и роста репродуктивных органов.
Фтор важен для зубов. Цинк необходим более чем 300 ферментам и 1000 факторам транскрипции и жизненно важен для здоровья глаз и роста репродуктивных органов.
Изображение предоставлено: Aldona Griskeviciene / Shutterstock.com
Заключение
Основным источником всех этих элементов является диета.Некоторые элементы более важны, чем другие, и они находятся в огромном количестве соединений и молекул в организме человека.
Некоторые из них могут даже нанести активный вред организму, и уровни их присутствия в организме могут определить, насколько вредны последствия. Пропорции химических элементов варьируются от человека к человеку в зависимости от множества факторов, но, как правило, они в основном одинаковы для всех видов.
Из каких элементов состоит человек? Играть
.