Экспресс-методы решения задач по химии
1. ЭКСПРЕСС-МЕТОДЫ РЕШЕНИЯ ЗАДАЧ ПО ХИМИИ
СТ. ПРЕПОДАВАТЕЛЬ КАФЕДРЫ НЕОРГАНИЧЕСКОЙ ХИМИИЦобкало Ж.А.
2. ТИПЫ ЗАДАЧ
Связьфизико-химических величин (ФХВ)
для 1 компонента − через количество
вещества; доли.
Расчеты
по стехиометрическим
соотношениям связь нескольких объектов
через количества веществ
3. ТИПЫ ЗАДАЧ
КомбинированныеНестандартные
задачи – зима
задачи – весна
4. МАТЕМАТИЧЕСКИЕ АСПЕКТЫ РЕШЕНИЯ ЗАДАЧ ПО ХИМИИ -проценты, – дроби, -степени -корни, -пропорции, -уравнения, -системы, -логарифмы
МАТЕМАТИЧЕСКИЕ АСПЕКТЫРЕШЕНИЯ ЗАДАЧ ПО ХИМИИ
-ПРОЦЕНТЫ,
– ДРОБИ,
-СТЕПЕНИ
-КОРНИ,
-ПРОПОРЦИИ,
-УРАВНЕНИЯ,
-СИСТЕМЫ,
-ЛОГАРИФМЫ
-УГЛЫ
-ОБЪЕМЫ
5. Связь физико-химических величин
СВЯЗЬ ФИЗИКО-ХИМИЧЕСКИХВЕЛИЧИН
P ∙ V = n ∙ R ∙ T (пора вставать на работу)
– уравнение Клапейрона-Менделеева
101,3 кПа = 1 атм = 760 мм.
 рт.ст
рт.ст00С = 273К
R= 8,31 кДж/моль∙К
7. НИ ДНЯ БЕЗ РЕШЁННОЙ ЗАДАЧИ!!!
?2 Какое число атомов содержится в 1 г алмаза??3Какая масса молекулы белого фосфора?
3,01·1021 молекул кислорода?
?5Какой объем воды (в см3) содержит столько же
атомов водорода, сколько и 4,48 дм3 аммиака (н.у.):
8. Расчеты по уравнениям, стехиометрическим схемам
РАСЧЕТЫ ПО УРАВНЕНИЯМ,СТЕХИОМЕТРИЧЕСКИМ СХЕМАМ
Стараемся уравнение
упростить до
стехиометрической
схемы
логические взаимосвязи
·w
·д/ a
:M
mсм → mчист → n (A)
Vcм→Vчист
·M
:w
n(Д) → mчист →mсм→mпракт
Vчист → Vcм
·α
Ncм→Nчист
Nчист → Ncм
Q
·η
Q
ПЗ 1.Какая масса осадка выпадет при взаимодействии
9,8 г фосфорной кислоты с гидроксидом стронция?
ПЗ 2. Какой объем аммиака (при н.у.) можно получить из
300 л, а практический выход – 43 %?
ПЗ 3.
 200 г известняка с массовой долей основного
200 г известняка с массовой долей основногокомпонента 54% и некарбонатными примесями
обработали иодоводородной кислотой, полученное
вещество осторожно выпарили. Потери в синтезе
составили 5%. Какова масса полученной соли.
ПЗ 4. Молярная теплота сгорания водорода -142,2
КДж/моль. Какой объем кислорода необходим, чтобы
при сжигании водорода получить 2844 кДж тепла,
если потери тепла в этом процессе составят 20%?
ПЗ 5. Мольная доля кислорода в воздухе – 0,208.
природного газа с 1% негорючих примесей? Какая
теплота при этом может быть получена, если при
сгорании 1,6 г основного компонента природного
газа выделяется 89,1 кДж?
ПЗ 6. Какова массовая доля серной кислоты, если в
процессе ее полного взаимодействия её с оксидом
алюминия массой 14,2 г было получено 524,2 г
раствора?
ПЗ 7 Какую массу (т) магнетита с массовой долей
основного компонента 87% необходимо взять для
получения 1 тонны стали, содержащей 0,5%
нежелезных примесей, если выход процесса
составляет 75%.

Суббота
Введение в химию 15 сентября в 12-00 (501 ауд)
Органическая химия 15 сентября в 10-00 (507 ауд)
Неорганическая химия 15 сентября в 12-00 (507 ауд)
Углубленный курс химии 15 сентября в 14-00 (507 ауд)
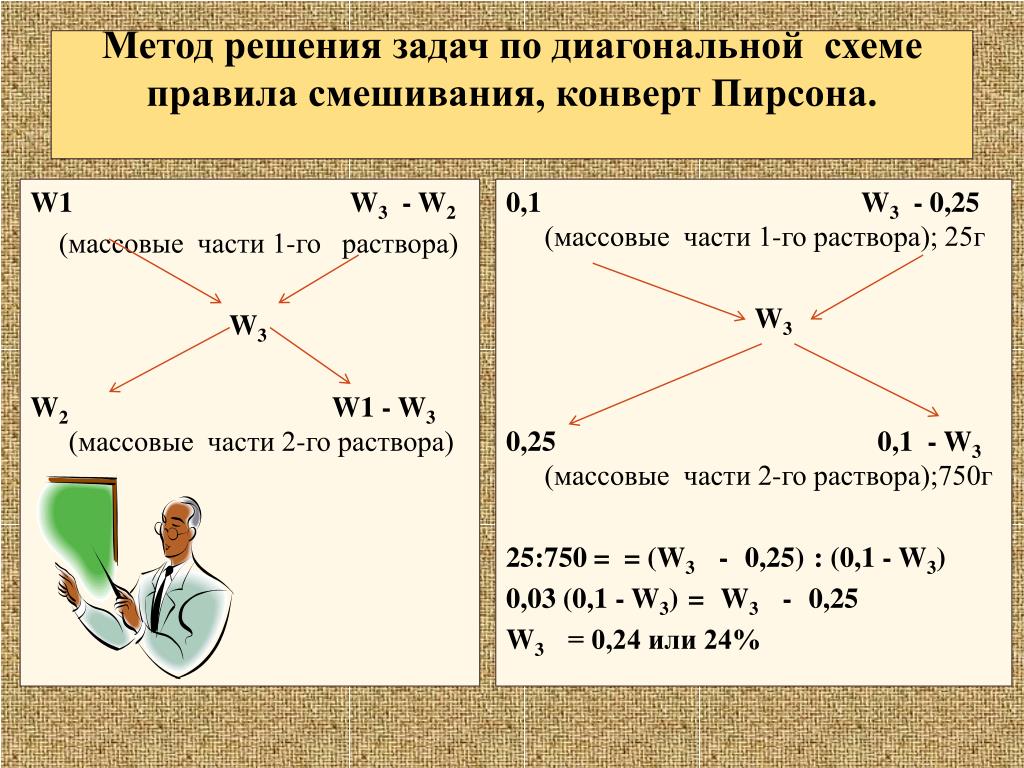
13. СОСТАВ РАСТВОРА
14. РАСТВОРЫ приготовление, смешение, выпадение осадка при охлаждении
РАСТВОРЫПРИГОТОВЛЕНИЕ, СМЕШЕНИЕ, ВЫПАДЕНИЕ
ОСАДКА ПРИ ОХЛАЖДЕНИИ
Сколько воды надо добавить к 50 г 15%ного раствора хлорида натрия, чтобы
получить 10% раствор.
Решение:0,1=(50·0,15)/(50+х) => х=25 г
Какую
массу кристаллической соды
необходимо растворить в 200 г воды, чтобы
при добавлении данного раствора в 50 г
раствора с массовой долей карбоната
натрия 10% получить 20% раствор?
x∙0,371+ 50 ∙0,1
=0,2
х+200+50
х=
Смешали
300 г 50%-ного раствора
гироксида натрия и 500 мл 20%-ного
раствора (плотность 1,1 г/см3) Какова
массовая доля полученного раствора?
Какие
объемы 20 %-ного (ρ=1,15) и
5 %-ного (ρ=1,05) растворов соли
необходимо смешать для получения
300 г 8%-ного раствора?
В
каком соотношении масс необходимо
взять 10%-ный раствор сульфата меди и
медного купороса, чтобы получить 30%ный раствор?
Решение.

Пусть m1= х, а m2=1, тогда
Определите концентрацию раствора
фосфорной кислоты, полученного сливанием
200 мл 0,3-молярного р-ра и 300 мл 0,6молярного р-ра. Какая массовая и мольная доля
фосфорной кислоты в полученном растворе?
ОХЛАЖДЕНИЕ РАСТВОРОВ
(нагревание р-ров газов, осушение,
упаривание растворов)
Какая масса осадка образуется при
охлаждении 250 г 30%-ного раствора
сульфата калия до 20 C0, если растворимость
при данной температуре соли составляет
21,4 г на 100 г растворителя?
Решение:
w20= 21,4/121,4=(250·0,30 – х)/(250–х) => х=
Приготовили 200 г насыщенного при 60 0С
раствора сульфата меди. Какая масса медного
охлаждении его до 0 0C? Растворимость сульфата
меди при 60 0С равна 39,5 г, а при 0 0C – 14,3 г на
100 г воды.
Какая масса КГ выпадет, если перед
охлаждением испарить 10% массы воды,
находящейся раствора?
Решение:
0,125=(200∙0,283– х∙0,64)/200-х =>х=
21.
 СПАСИБО ЗА ВНИМАНИЕ!!!
СПАСИБО ЗА ВНИМАНИЕ!!!Способы решения задач по химии » Информационный сайт города Гусева
Если вдаваться в подробности, сравнивая учебный период в университетах и колледжах несколько десятков лет назад, то можно смело заявить, что в наше время студентам стало гораздо проще в плане поиска нужной информации для саморазвития и решения поставленных перед ними целей.Варианты поиска доступной информации
Технологический прогресс шагнул очень решительным и широким шагом, поэтому развитие молодых людей, которым пришлось стать на эту нелегкую тропу студенчества очень упрощено, и теперь все меньше приходится проводить время в библиотеках для поиска нужной информации в тоннах макулатуры, а можно просто поставить правильно сформулированный вопрос в поисковике и найти интересующую вас информацию и исходя из неё дать ответы на все поставленные перед вами вопросы и задания. Тем не менее, при появлении таких возможностей, способствует и развитие людской лени, ведь большинство отдают предпочтение поиску готовой информации чем создания чего-то своего, по-настоящему уникального.
 Век технологий дал не только прогресс в доступности информации, но и способствует развитию хитрости.
Век технологий дал не только прогресс в доступности информации, но и способствует развитию хитрости.Одной из таких хитростей является использование сервиса «УниверSOS», который предоставляет студентам возможность с легкостью и без особых затрат написать и сдать работу любой сложности. Прогресс не стоит на месте и уже сегодня можно найти любое решение задачи онлайн https://universos.ru/reshenie-zadach-za-dengi-onlajn. Ну, а для того, чтобы избежать долгого поиска в недрах интернета, можно упростить себе жизнь и предоставить конкретную задачу специалисту на нашем сервисе.
Решение химических задач
В школьные годы не все учащиеся уделяют должное внимание изучению увлекательного и необычного предмета, такого как химия. И уже по истечению нескольких лет, когда ученик становится студентом, он неоднократно жалеет об упущенной возможности изучения столь сложного предмета. Даже самые лучшие отличники рано или поздно сталкиваются с трудностями понимания и запоминания химических формул.
 Что уж говорить о студентах, не обладающих достаточной дисциплинированностью и усидчивостью. Но выход есть из любой ситуации. Решение задач по химии онлайн поможет вам быстро справиться с заданиями, сдать материал на «отлично» и освободить себе время для того, чтобы провести его за более приятными занятиями.
Что уж говорить о студентах, не обладающих достаточной дисциплинированностью и усидчивостью. Но выход есть из любой ситуации. Решение задач по химии онлайн поможет вам быстро справиться с заданиями, сдать материал на «отлично» и освободить себе время для того, чтобы провести его за более приятными занятиями.Не важно к какому разделу химии относится задача, не важно, насколько она сложная. Наши специалисты примут вызов любого уровня сложности. Просто перейдите на сервис «УниверSOS», заполните форму, укажите в ней необходимую задачу для решения онлайн и ожидайте ответа. Ваш личный менеджер, который будет приставлен к вам в момент подачи задания, сам лично проконтролирует успешное, быстрое и главное качественное выполнение задания.
Никогда еще учеба не была настолько легкой и доступной, как сегодня. Убедитесь в этом сами, предоставьте работу профессионалам, а сами в это время проживайте насыщенную и полноценную студенческую жизнь, не беспокоясь о плохих отметках.
Методы решения задач по химии
Методы решения задач по химии
Расчётные задачи по химии решают несколькими методами:
1. пропорций;
2. готовых формул;
3. алгебраическим.
Метод пропорций вытекает из того, что существует прямо
пропорциональная зависимость между количеством элемента в соединении и
всей массой вещества, а также между количеством веществ, принимающих
участие в реакции или образующихся в результате её.
Пропорция составляется на основании условия задачи и теоретически
вычисленных величин. Она должна отражать и объяснять ход рассуждений по
формуле или уравнению, а не простой набор отношений чисел.
Процесс решения задач с помощью пропорции включает этапы:
установление зависимости между количествами вещества;
составление пропорции;
решение пропорции.
Метод готовых формул применяют при решении задач с
использованием понятий
«массовая доля» ω;
«молярная масса» М;
«молярный объём» Vm;
«относительная плотность газов» ρ.
Алгебраический метод следует использовать в тех случаях, когда
арифметическое решение химической задачи более трудоёмко.
С применением этого метода возможно решение следующих задач: смешивание нескольких растворов;
косвенное определение содержания двух веществ в смеси по
массе осадка или объёму газа, полученного в результате реакции;
косвенное определение содержания двух газообразных веществ в
смеси по массе их общего объёма и др.
пропорций;
2. готовых формул;
3. алгебраическим.
Метод пропорций вытекает из того, что существует прямо
пропорциональная зависимость между количеством элемента в соединении и
всей массой вещества, а также между количеством веществ, принимающих
участие в реакции или образующихся в результате её.
Пропорция составляется на основании условия задачи и теоретически
вычисленных величин. Она должна отражать и объяснять ход рассуждений по
формуле или уравнению, а не простой набор отношений чисел.
Процесс решения задач с помощью пропорции включает этапы:
установление зависимости между количествами вещества;
составление пропорции;
решение пропорции.
Метод готовых формул применяют при решении задач с
использованием понятий
«массовая доля» ω;
«молярная масса» М;
«молярный объём» Vm;
«относительная плотность газов» ρ.
Алгебраический метод следует использовать в тех случаях, когда
арифметическое решение химической задачи более трудоёмко.
С применением этого метода возможно решение следующих задач: смешивание нескольких растворов;
косвенное определение содержания двух веществ в смеси по
массе осадка или объёму газа, полученного в результате реакции;
косвенное определение содержания двух газообразных веществ в
смеси по массе их общего объёма и др.

Дополнительные главы химии. 8 класс: О курсе
Курс ориентирован на слушателей, владеющих школьной программой 8 класса по химии. Учащиеся познакомятся с основным понятиям и законам химии, начальным сведениям о химии элементов, систематизируют теоретические знания, научатся решать задачи повышенной сложности.
Курс поможет школьникам не только на уроках химии в школе, но и позволит успешнее выступать на олимпиадах, а учителям химии — лучше понять аспекты теории и задачные акценты, примыкающие к школьной программе и характерные для олимпиад по химии, использовать задачную базу курса на занятиях в школе.
Курс состоит из 13 обязательных модулей, 58 видеолекций с конспектами, 232 обязательных упражнений и факультативных задач для самостоятельного решения.
Учебные модули
|
– Химическая формула и способы ее определения |
– Смеси веществ |
Внутри каждого модуля есть:
– видео с кратким конспектом, где обсуждается теория и разбираются примеры решения задач,
– упражнения с автоматической проверкой, позволяющие понять, как усвоена теория,
– задачи для самостоятельного решения, которые не учитываются в прогрессе и не идут в зачет по модулю, но позволяют качественно повысить свой уровень.
В каждом разделе есть ответы на популярные вопросы, где можно уточнить свое понимание теории или условия задачи, но нельзя получить подсказки по решению.
По итогам обучения выдается электронный сертификат. Для его получения необходим зачет по всем учебным модулям, кроме лекционных. Условие получения зачета по модулю — успешное выполнение не менее 70% упражнений. Сертификаты могут учитываться при отборе на очные программы по направлению «Наука».
Если ученик не успеет получить зачет по отдельным модулям, то он не сможет получить сертификат, но сможет возобновить обучение, когда курс стартует в следующий раз. При этом выполнять пройденные модули заново не потребуется (но может быть предложено, если соответствующие учебные материалы обновятся).
В следующий раз курс будет открыт в августе 2021 года.
Рабочая программа по элективному курсу «Решение задач по химии»
Муниципальное бюджетное общеобразовательное учреждение
Кантемировская средняя общеобразовательная школа №2
Кантемировского муниципального района Воронежской области
“Утверждаю” Директор школы _______. Приказ № … от “… “……. 2017 г. | “Согласовано” Заместитель директора по УВР ___________ ………. | «Рассмотрено» на заседании ШМО учителей естественно-научных дисциплин Протокол № …. от “…” ……… 2017 г. |
РАБОЧАЯ ПРОГРАММА
ПО ЭЛЕКТИВНОМУ КУРСУ «РЕШЕНИЕ ЗАДАЧ ПО ХИМИИ»
11 класс
Учитель химии
Костина Наталья Васильевна
2017-2018 учебный год
1.Пояснительная записка
Программа элективного курса «Методы решения расчётных задач по химии» разработана на основе авторской программы в соответствии с Федеральным компонентом государственного стандарта среднего (полного) общего образования, утвержденного приказом Минобразования РФ № 1089 от 09. 03.2004.
03.2004.
Элективный курс «Методы решения расчётных задач по химии» носит предметно-ориентированный характер.
Профильное образование призвано более полно учитывать интересы, склонности и способности учащихся, создавать условия для обучения старшеклассников в соответствии с их профессиональными интересами и намерениями в отношении продолжения образования. Одним из условий естественнонаучного образования в профильных классах является формирование систематического подхода к рассмотрению химических процессов, осознанного применения теоретических знаний на практике. Для учащихся, выбравших естественнонаучный профиль обучения, уже недостаточно просто решать задачи по известным алгоритмам. Важно научиться методам анализа и синтеза в совокупности, так как именно эти мыслительные операции позволяют справиться учащимся со сложными задачами.
Цель курса:
– расширить знания учащихся по методам решения задач по химии;
– развивать познавательный интерес и творческую самореализацию учащихся;
– сформировать зрелость учащихся в выборе профиля обучения.
Задачи курса:
– помочь учащимся получить реальный опыт решения сложных задач различными способами, а также научить составлять свои по заданному алгоритму;
– познакомить учащихся с различными типами задач повышенного уровня сложности;
– дать ученику возможность реализовать свой интерес к выбранному предмету;
– создать условия для поступления учащихся в учебные заведения с химическим профилем.
2.Общая характеристика учебного предмета, курса
Решение задач требует от учащихся умения логически рассуждать, планировать, производить расчёты и обосновывать их теоретическими предпосылками, дифференцировать определённые проблемы на отдельные вопросы, после ответов на которые решаются исходные проблемы в целом. При решении задач происходит сознательное усвоение и лучшее понимание химических теорий, законов и явлений. Решение задач развивает интерес учащихся к химии, активизирует их деятельность, способствует профессиональной подготовке школьника.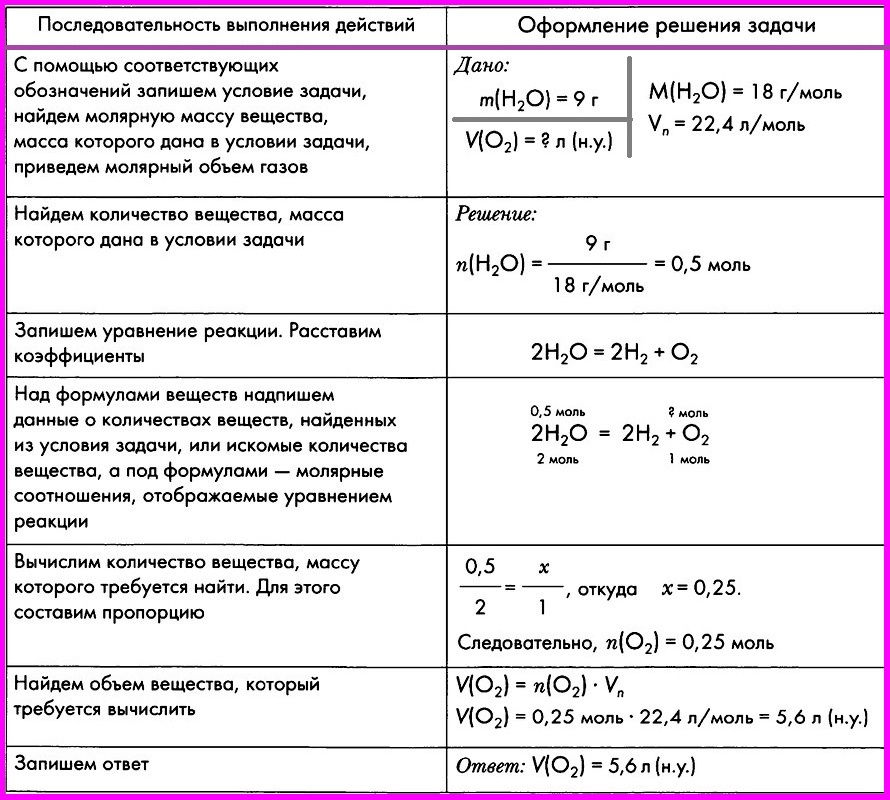
Решение традиционных задач различными способами и задач повышенного уровня сложности практически не изучается в школьном курсе химии. Однако при поступлении в ВУЗы и средние специальные учебные заведения учащиеся должны обладать определённым уровнем химических знаний в этой области.
Изучение данного курса способствует углублению знаний учащихся по химии, а именно – помогает получить реальный опыт решения сложных задач различными способами, а также углубить свои познания в физике и математике. При изучении данного курса большое внимание уделено вопросу методике решения расчётных химических задач с точки зрения рационального приложения идей математики и физики, показаны разные способы решения.
Для успешного усвоения старшеклассниками методов решения химических задач, практического применения теоретического материала, используются химические знания и химические действия: теории и законы, лежащие в основе предложенных задач. Предусмотрены также задачи для самостоятельной работы, при этом использованы задачи различных вариантов, что способствует более глубокому и осознанному овладению методикой их решения.
Предусмотрены также задачи для самостоятельной работы, при этом использованы задачи различных вариантов, что способствует более глубокому и осознанному овладению методикой их решения.
В качестве одной из форм организации учебных занятий предлагается проведение семинаров, на которых даётся краткое объяснение теоретического материала, а затем решаются задачи по данной теме. Для повышения интереса к теоретическим вопросам, закрепления изученного материала, а также совершенствования навыков экспериментальной работы предусмотрен лабораторный практикум. Кроме того, можно использовать такие формы работы, как дискуссии, моделирование проблемных ситуаций и ролевые игры.
Формами контроля за уровнем достижений учащихся служат текущие, рубежные и итоговые контрольные мероприятия; письменные творческие работы, итоговые учебные проекты (составление сборников авторских задач по различным темам).
Элективный курс предназначен для учащихся 10-11 классов.
3. Место учебного предмета, курса в учебном плане школы
Согласно учебному плану МКОУ Кантемировской СОШ №2 на 2017-2018 уч. год на изучение элективного курса «Методы решения расчётных задач по химии» в 11 классе из школьного компонента отводится 17 часов (из расчета 0,5 часа в неделю).
4. Содержание учебного предмета, курса
Тема 1. Межпредметные и курсовые связи при решении расчётных задач по химии
Международная система единиц как основа обозначения величин. Физические величины в химии, масса тела, плотность вещества, давление, количество теплоты, энергия топлива, уравнение состояния идеального газа, газовые законы. Основы математических расчётов: вычисления по пропорции, метод приведения к единице, вычисления с использованием процентов, графиков, системы алгебраических уравнений, округление чисел. Основные понятия химии и их обозначения, применяемые при решении расчётных задач: моль, молярная масса, молярный объём, молярная концентрация, относительная плотность, теплота химической реакции, тепловой эффект реакции, массовая доля, объёмная доля, мольная доля, растворимость, число структурных единиц, постоянная Авогадро, выход продукта.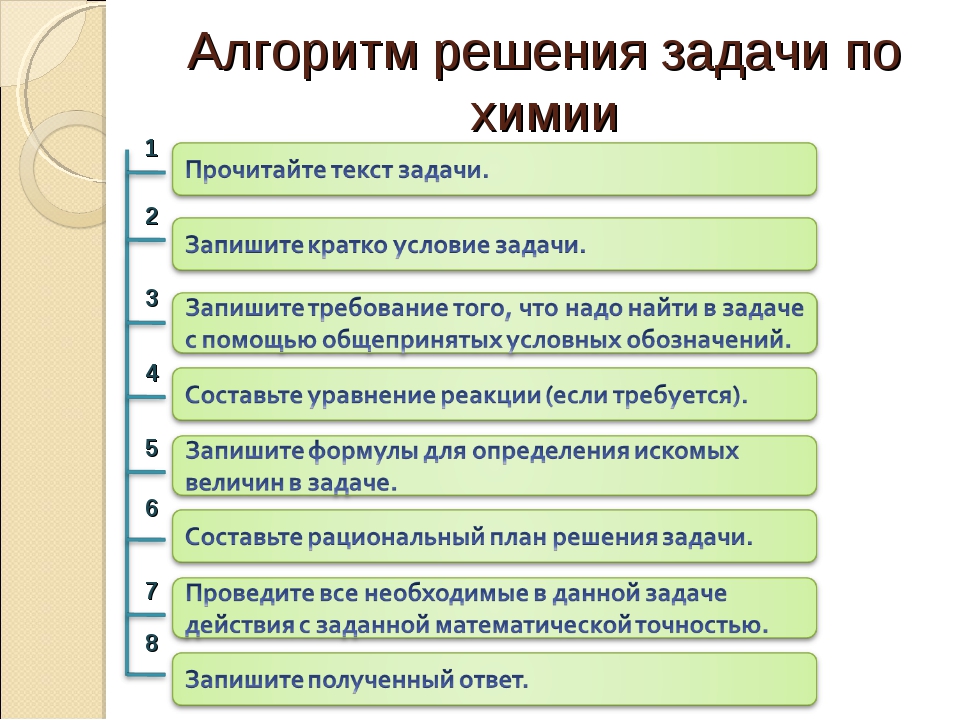
Тема 2. Вычисление состава смесей веществ и сплавов
Классификация смесей. Определение состава сплавов. Вычисление массовой доли вещества в растворе. Растворимость. Кристаллогидраты. Молярная концентрация растворов. Эквивалент Нормальная концентрация. Титр растворов. Разбавление растворов. Упаривание растворов. Сливание двух растворов. Расчёты по хим. уравнениям с участием растворенных веществ.
Практическая работа. Получение однородных и неоднородных смесей.
Тема3 . Определение количественных отношений в газах
Вычисление объёмов газов и числа частиц. Реакции с участием газов. Закон Авогадро и следствие из него. Объёмная доля газов. Мольная доля газов. Относительная плотность газов. Вычисление объёмов газов при ненормальных условиях
Тема 4. Определение скорости химических реакций
Скорость химических реакций. Природа реагирующих веществ. Площадь поверхности соприкосновения веществ. Закон действующих масс. Правило Вант-Гоффа. Влияние катализаторов и ингибиторов на скорость химических реакций.
Площадь поверхности соприкосновения веществ. Закон действующих масс. Правило Вант-Гоффа. Влияние катализаторов и ингибиторов на скорость химических реакций.
Тема 5. Вычисления по уравнениям химических реакций
Вычисление количества вещества продукта реакции, если известно количество вещества одного из исходных веществ. Вычисление массы вещества по исходному количеству вещества одного из исходных или получающихся в реакции веществ. Вычисление объёма газа, необходимого для реакции с определённым объёмом другого газа. Вычисление объёма продукта реакции по известному объёму исходного газа. Вычисление объёма полученного газа, если известна масса исходного вещества, и вычисление объёма исходного газа, если известна масса продукта реакции. Расчёты по химическим уравнениям, связанные с массовой (объёмной) долей выхода продукта реакции от теоретически возможного. Вычисление количества вещества продукта реакции по массе исходного вещества, содержащего примеси. Расчёты по уравнениям химических реакций с использованием растворов с определённой массовой долей растворённого вещества. Расчёты по химическим уравнениям, если одно из реагирующих веществ взято в избытке. Расчёты по термохимическим уравнениям. Вычисление при протекании последовательных реакций. Вычисления по уравнениям окислительно-восстановительных реакций.
Расчёты по уравнениям химических реакций с использованием растворов с определённой массовой долей растворённого вещества. Расчёты по химическим уравнениям, если одно из реагирующих веществ взято в избытке. Расчёты по термохимическим уравнениям. Вычисление при протекании последовательных реакций. Вычисления по уравнениям окислительно-восстановительных реакций.
Творческие задания. Составление задач с экологическим содержанием.
Тема 6. Комбинированные и нетрадиционные задачи
Решение комбинированных задач. Решение нетрадиционных задач. Решение задач повышенной сложности.
5. Тематическое планирование
№ п/п | Дата | Тема занятия | Содержание образования |
Тема 1 Межпредметные и курсовые связи при решении расчётных задач по химии (1 час) | |||
1 | Основные понятия и законы химии | Международная система единиц как основа обозначения величин. Основы математических расчётов. Правила решения задач. | |
Тема 2. Вычисление состава смесей веществ и сплавов (5 часов) | |||
2 | Практическая работа. Получение однородных и неоднородных смесей. | Классификация смесей. Определение состава сплавов. Вычисление массовой доли вещества в растворе. Растворимость. Молярная концентрация растворов. Разбавление растворов. Упаривание растворов. Сливание двух растворов. | |
3 | Вычисление массовой доли вещества в растворе. | Вычисление массовой доли вещества в растворе. | |
4 | Молярная концентрация растворов. | Молярная концентрация растворов. | |
5 | Нормальная концентрация. | Эквивалент Нормальная концентрация. | |
6 | Разбавление растворов. Упаривание растворов Сливание двух растворов | Разбавление растворов. Упаривание растворов Сливание двух растворов | |
Тема 3 Определение количественных отношений в газах (2 часа) | |||
7 | Вычисление объёмов газов и числа частиц. | Вычисление объёмов газов и числа частиц. Реакции с участием газов. Объёмная доля газов. Мольная доля газов. | |
8 | Вычисление объёмов газов при ненормальных условиях | Вычисление объёмов газов при ненормальных условиях | |
Тема 4. Определение скорости химических реакций (2 часа) | |||
9 | Скорость химических реакций. | Скорость химических реакций. | |
10 | Факторы, влияющие на скорость химических реакций Катализаторы и ингибиторы. | Природа реагирующих веществ. Площадь поверхности соприкосновения веществ. Закон действующих масс. Правило Вант-Гоффа. Влияние катализаторов и ингибиторов на скорость химических реакций. | |
Тема 5. Вычисления по уравнениям химических реакций (5 часов) | |||
11 | Выход продукта реакции от теоретически возможного. | Расчёты по химическим уравнениям, связанные с массовой (объёмной) долей выхода продукта реакции от теоретически возможного. | |
12 | Вычисление массы вещества, содержащего примеси. | Вычисление количества вещества продукта реакции по массе исходного вещества, содержащего примеси. | |
13 | Расчёты на избыток и недостаток. | Расчёты по химическим уравнениям, если одно из реагирующих веществ взято в избытке. | |
14 | Расчёты по термохимическим уравнениям Расчёты по уравнениям ОВР | Расчёты по термохимическим уравнениям. Вычисления по уравнениям окислительно-восстановительных реакций. | |
15 | Вычисление при протекании последовательных реакций | Вычисление при протекании последовательных реакций | |
Тема 6. Комбинированные и нетрадиционные задачи (2 часа) | |||
16 | Решение комбинированных и нетрадиционных задач | Решение комбинированных и нетрадиционных задач | |
17 | Решение задач повышенной сложности. | Решение задач повышенной сложности. | |
6. Требования к уровню подготовки
Учащиеся должны знать все предложенные типы задач, основные формулы и методики, по которым ведётся расчёт, а также способы их решения.
Учащиеся должны уметь самостоятельно определять способ решения, применять данные формулы при решении определённого типа задач, выбирать наиболее рациональный путь решения задачи
7.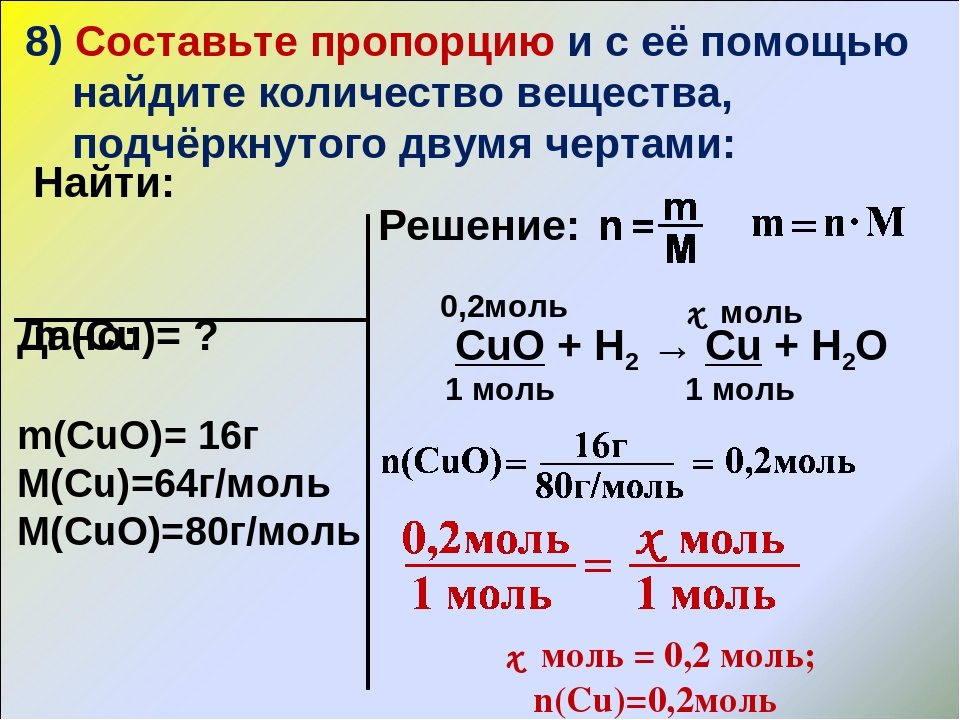 Учебно-методическое обеспечение курса
Учебно-методическое обеспечение курса
Литературы для учителя:
– Всероссийская химическая олимпиада школьников. М.: Просвещение, 2005.
– Новошинский И.И., Новошинская Н.С. Типы химических задач и способы их решения. М.: ОНИКС 21 век, 2004.
– Штремплер Г.И., Хохлова А.И. Методика решения расчётных задач по химии: 8-11 кл.: Пособие для учителя. М.: Просвещение, 2000.
– Материалы для подготовки и проведения итоговой аттестации выпускников средних общеобразовательных учреждений по химии/ Сост. С.В.Суматохин.- М.: Дрофа, 2001.
Литература для учащихся:
– Хомченко Г.П., Хомченко И.Г. Задачи по химии. М.: Высшая школа, 2007.
– Хомченко Г.П., Хомченко И.Г. Сборник задач по химии для поступающих в ВУЗы. М.: Новая волна, 2002.
– Кузьменко Н.Е., Ерёмин В.В. сборник задач и упражнений по химии для школьников и абитуриентов. – М.:ОНИКС 21 век, 2001.
– М.:ОНИКС 21 век, 2001.
Рабочая программа спецкурса по химии “Способы решения расчётных задач по химии”(9 класс)
«С О Г Л А С О В А Н О»
Рук.ШМО МОУ СОШ №1
————— /А.Н.Леоненко/
«___»____________201__г.
ПРИМЕРНАЯ РАБОЧАЯ ПРГРАММА
элективного курса химии для учащихся 9 классов
«СПОСОБЫ РЕШЕНИЯ РАССЧЁТНЫХ
ЗАДАЧ ПО ХИМИИ»
Наседкиной Людмилы Владимировны,
учителя химии МОУ СОШ №1, 1к/к
Североуральск,2012
Пояснительная записка
Данный курс по выбору предназначен для учащихся 9 классов. Его программа рассчитана на 17 часов, курс предпочтительнее проводить во втором полугодии, так как к этому времени учащиеся имеют больший объём знаний по химии элементов, на базе которого будут решаться задачи разных типов. В курсе по выбору представлены типы расчётных задач, которые не рассматриваются в базовом курсе химии. Курс разделён на три блока : расчёты по химическим формулам, количественные характеристики растворов, вычисления по химическим уравнениям. Каждый блок начинается с теоретического введения, учитель показывает учащимся разные способы решения задач.В дальнейшем учащиеся сами самостоятельно определяют способ решения — главное, чтобы он был рациональным и логически последовательным. Решение задач способствует развитию логического мышления, прививает навык самостоятельной работы. Решение сложных задач – интересный и творческий процесс, результат его часто бывает оригинальным и нестандартным —таким образом решение задач способствует самореализации ученика. Задачи обеспечивают закрепление теоретических знаний, учат творчески применять их в новой ситуации.
Каждый блок начинается с теоретического введения, учитель показывает учащимся разные способы решения задач.В дальнейшем учащиеся сами самостоятельно определяют способ решения — главное, чтобы он был рациональным и логически последовательным. Решение задач способствует развитию логического мышления, прививает навык самостоятельной работы. Решение сложных задач – интересный и творческий процесс, результат его часто бывает оригинальным и нестандартным —таким образом решение задач способствует самореализации ученика. Задачи обеспечивают закрепление теоретических знаний, учат творчески применять их в новой ситуации.
ЗАДАЧИ КУРСА:
1.Углубить знания учащихся по химии, научить их методически правильно и практически эффективно решать задачи.
2.Дать учащимся возможность реализовать и развить свой интерес к химии.
3.Предоставить учащимся возможность уточнить собственную готовность и способность осваивать в дальнейшем программу химии на повышенном уровне.
4.Создать учащимся условия для подготовки к ГИА по химии за курс основной школы.
МЕТОДЫ ОБУЧЕНИЯ:
1.фронтальный разбор способов решения новых типов задач;
2.групповое и индивидуальное самостоятельное решение задач;
3.коллективное обсуждение решения сложных и нестандартных задач;
4.решение расчётно-практических задач.
По окончании курса учащиеся должны уметь:
Производить расчёты по химическим формулам: определять среднюю молекулярную массу смеси, относительную плотность газовой смеси, состав газовой смеси;Производить вычисления состава раствора с использованием массовой доли растворённого вещества, молярной концентрации, растворимости;Производить расчёты по уравнениям: вычислять объёмные отношения газов, определять состав смеси, массы продуктов реакции, если одно из реагирующих веществ дано в избытке.Тематический план
Тема
Количество
часов
1,Расчёты по химическим формулам
2.Растворы
3.Вычисления по химическим уравнениям
Зачётное занятие
ИТОГО:
П Р О Г Р А М М А
1.Расчёты по химическим формулам. Основные понятия и законы химии. Количество вещества. Молярная масса. Постоянная Авогадро. Число структурных единиц. Молярный объём газа. Относительная плотность газа. Массовая доля вещества. Массовая доля элемента. Средняя молекулярная масса смеси газов. Массовая доля газов в газовой смеси. Вычисления с использованием физических величин(количество вещества, молярный объём газа, относительная плотность газа, массовая доля) и постоянной Авогадро. Определение средней молекулярной массы смеси. Определение относительной плотности газовой смеси. Определение состава газовой смеси.
Основные понятия и законы химии. Количество вещества. Молярная масса. Постоянная Авогадро. Число структурных единиц. Молярный объём газа. Относительная плотность газа. Массовая доля вещества. Массовая доля элемента. Средняя молекулярная масса смеси газов. Массовая доля газов в газовой смеси. Вычисления с использованием физических величин(количество вещества, молярный объём газа, относительная плотность газа, массовая доля) и постоянной Авогадро. Определение средней молекулярной массы смеси. Определение относительной плотности газовой смеси. Определение состава газовой смеси.
2.Растворы. Массовая доля растворённого вещества. Правило смешения. Расчёты с использованием массовой доли растворённого вещества. Молярная концентрация. Задачи на приготовление растворов заданной концентрации. Растворимость веществ. Насыщенные растворы. Решение задач на растворимость.
3.Вычисления по химическим уравнениям . Закон объёмных отношений газообразных веществ. Вычисление объёмных отношений газов. Задачи на вычисление массовой доли вещества в растворе. Вычисление массы (объёма, количества вещества ) продукта реакции ,если одно из реагирующих веществ дано в избытке. Определение состава смеси. Задачи на вычисление массы (объёма) продукта реакции, если одно из реагирующих веществ содержит примеси. Задачи на массовую долю выхода продукта реакции от теоретически возможного.
Задачи на вычисление массовой доли вещества в растворе. Вычисление массы (объёма, количества вещества ) продукта реакции ,если одно из реагирующих веществ дано в избытке. Определение состава смеси. Задачи на вычисление массы (объёма) продукта реакции, если одно из реагирующих веществ содержит примеси. Задачи на массовую долю выхода продукта реакции от теоретически возможного.
Календарно – поурочный план
занятия
Тема занятия
Кол-во
часов
10-11
Расчёты по химическим формулам
Основные понятия и законы химии.
Вычисления с использованием физических величин и постоянной Авогадро. Определение средней молекулярной массысмеси. Определение относительной плотности газовой смеси.
Определение состава газовой смеси.
Растворы
Массовая доля растворённого вещества. Расчёты с использованием массовой доли растворённого вещества. Правило смешения.
Задачи на приготовление растворов заданной массовой доли.
Молярная концентрация. Вычисления с использованием молярной концентрации.
Вычисления с использованием молярной концентрации.
Растворимость веществ. Решение задач на растворимость.
Вычисления по химическим уравнениям
Вычисление объёмных отношений газов.
Задачи, связанные с вычислением массовой доли веществ в образовавшемся растворе.
Вычисление массы (объёма, количества вещества) продукта реакции, если одно из реагирующих веществ взято в избытке.
Задачи на вычисление массы продукта реакции, если одно из реагирующих веществ содержит примеси.
Задачи на вычисление массовой (объёмной) доли выхода продукта реакции от теоретически возможного
ИТОГОВОЕ ЗАЧЁТНОЕ ЗАНЯТИЕ
Литература для учителя
Глинка Н.Л.Задачи и упражнения по общей химии.-Л.:Химия,1984Глинка Н.Л.Общая химия.-Л., «Химия»,1972г.Кузьменко Н.Е.,Ерёмин В.В. Сборник задач и упражнений по химии для школьников и абитуриентов. – М.:Оникс 21 век, 2001.Кузьменко Н.Е.,Ерёмин В.В.Химия.2400 задач для школьников и поступающих в ВУЗы.-М.,Дрофа, 1999г.Кузьменко Н. Е.,Магдесиева Н.Н.,Ерёмин В.В. Задачи по химии для абитуриентов (курс повышенной сложности).М.,Просвещение, 1992г.Чернобельская Г.М.,Ярославцева Т.С. Методические указания для обучения учащихся расчётам по химическим формулам и уравне- ниям.:М., МГПИ им.В.И.Ленина, 1980г.Хомченко Г.П.Химия для поступающих в ВУЗы.-М.,Высшая школа, 1993г.Хомченко Г.П.,Хомченко И.Г. Задачи по химии для поступающих в ВУЗы. М.,Высшая школа, 1993г.Шамова М.О.Учимся решать расчётные задачи по химии:Технология, алгоритмы решения.Библиотека журнала «Химия в школе».М., «Школа-Пресс», 2001, выпуск 6.Хомченко И.Г. Решение задач по химии.8-11кл.—М.,ООО «Новая волна», 2005г.Решения, методики, советы.Быкова В.В.Пособие для учащихся профильного спецкурса. Технология и алгоритмы решения расчётных задач по химии. Школа №8 г.Североуральска, 2006г.Аликберова Л.Ю.,Хабарова Е.И. Задачи по химии с экологическим содержанием.М.,Центрхимпресс, 2001. «Химия в школе»- абитуриенту, учителю : библиотека журнала.Цитович И.К., Протасов П.
Е.,Магдесиева Н.Н.,Ерёмин В.В. Задачи по химии для абитуриентов (курс повышенной сложности).М.,Просвещение, 1992г.Чернобельская Г.М.,Ярославцева Т.С. Методические указания для обучения учащихся расчётам по химическим формулам и уравне- ниям.:М., МГПИ им.В.И.Ленина, 1980г.Хомченко Г.П.Химия для поступающих в ВУЗы.-М.,Высшая школа, 1993г.Хомченко Г.П.,Хомченко И.Г. Задачи по химии для поступающих в ВУЗы. М.,Высшая школа, 1993г.Шамова М.О.Учимся решать расчётные задачи по химии:Технология, алгоритмы решения.Библиотека журнала «Химия в школе».М., «Школа-Пресс», 2001, выпуск 6.Хомченко И.Г. Решение задач по химии.8-11кл.—М.,ООО «Новая волна», 2005г.Решения, методики, советы.Быкова В.В.Пособие для учащихся профильного спецкурса. Технология и алгоритмы решения расчётных задач по химии. Школа №8 г.Североуральска, 2006г.Аликберова Л.Ю.,Хабарова Е.И. Задачи по химии с экологическим содержанием.М.,Центрхимпресс, 2001. «Химия в школе»- абитуриенту, учителю : библиотека журнала.Цитович И.К., Протасов П. Н. Методика решения расчётных задач по химии. Книга для учителя.М.,Просвещение,1983г.
Н. Методика решения расчётных задач по химии. Книга для учителя.М.,Просвещение,1983г.Если Вы являетесь автором этой работы и хотите отредактировать, либо удалить ее с сайта – свяжитесь, пожалуйста, с нами.
Задания Домашняя страница UVic | Решение проблем Решение проблем – это навык
у нас часто нет времени открыто учить
в лекциях.
Вы, вероятно, делаете что-то подобное, когда успешно отвечаете на сложные вопросы: этот метод просто формализует шаги и должен помочь предотвратить панику, когда вы столкнетесь с незнакомой проблемой.Во-первых, ПРОЧИТАЙТЕ вопрос внимательно и активно. Это означает, что вам следует искать ключевые термины и пытаться разобраться, какие части вопроса являются наиболее важными. Затем PLAN ваш ответ – запишите уравнения или концепции, которые, по вашему мнению, могут вам понадобиться, и / или быстро резюмируйте основную суть вопроса. Когда вы РЕШАЕТ проблему, вы непосредственно применяете то, что вы прошли на этапах ЧТЕНИЕ и ПЛАНИРОВАНИЕ, и записываете свою работу и ответ. Конечно, эта стратегия мало что значит, пока вы не увидите ее в действии! Так как же этому научиться? Что ж, вы, безусловно, можете спросить своих технических специалистов или инструкторов, и мы покажем вам, как решить проблему, используя этот подход. Однако вы также можете узнать об этом прямо здесь, на этом сайте. Мы сделали озвученные, анимированные Flash-презентации, которые применяют подход READ – PLAN – SOLVE – CHECK к широкому спектру проблем, которые возникали на прошлых экзаменах Chem101. Лучший способ использовать этот ресурс – это, вероятно, сначала попробовать решить проблему самостоятельно. Вы найдете их в конце каждой главы вашей лекционной книги. Если вы застряли, вот тут и появятся заданные наборы задач: Используйте панель навигации под каждым фильмом для паузы, воспроизведения, возврата и т. Если вы используете мобильное устройство, попробуйте версии Youtube. Получите доступ к правильному видео, отсканировав соответствующий QR-код, напечатанный в вашей лекционной книге.Большинство устройств Android изначально считывают эти коды, но на момент написания ipad / ipod / iphone требовалось приложение для этого. В основном они бесплатные, например «QR-сканер». Более 75% студентов в предыдущие годы сочли приведенные примеры работы «полезными» или «очень полезными». Мы надеемся, что вы тоже. Кредиты : Проблемы были получены доктором Коддингом на предыдущих промежуточных и выпускных экзаменах Chem101. Решения были разработаны и написаны Кристой Виксе и доктором МакИндо.Ведущая – Криста Виксе. Химический факультет Университета Виктории. Обновлено 27 июля 2011 г. |
Стратегии решения химических проблем – будьте готовы! Все, что нужно знать для 1 курса химии
youtube.com/embed/biqiUzaJcZc?feature=oembed&rel=0″ frameborder=”0″ allowfullscreen=”allowfullscreen”/>
Стенограмма видео
| Метод “бухгалтерского учета” единиц в расчетах | Общий метод «единичного анализа»: |
| Анализ единиц измерения помогает избежать ошибок в многоэтапных вычислениях и предоставляет единицы измерения для окончательного ответа. | 1) Запишите единицы с каждым числом, которое вы включаете в серию вычислений 2) Объедините свои вычисления в виде серии умножений или делений перед выполнением каких-либо математических операций. 3) Отмените свои отряды, чтобы увидеть эволюцию вычислений. |
Расчеты: преобразование одной единицы в другую | |
| Единичный анализ: | Коэффициент преобразования: |
Метод, использующий коэффициент преобразования для преобразования количества, выраженного в одной единице, в эквивалентное количество в другой единице. | Устанавливает отношения между двумя разными единицами. |
исходное количество x коэффициент преобразования = эквивалентное количество
Например, преобразование единиц длины
При условии, что 1 метр = 39,37 дюйма
Коэффициенты преобразования или
То же соотношение, просто инвертируйте, если необходимо, чтобы получить нужные вам единицы!
ФАКТ:
Чем больше вы используете «длинный метод» пересчета единиц, тем меньше ошибок вы сделаете!
Сколько молей атомов кислорода содержится в 10 мл воды?
| О чем спрашивают? | Какие данные предоставляются? | Что мне нужно знать? | Как мне сформулировать ответ? |
| Можете ли вы рассчитать количество атомов с учетом объема? | Данные: 10 мл воды | Необходимо знать: вода есть, плотность воды, молекулярная масса воды | Ответ в молях кислорода O |
Перевести объем воды в моль кислорода
Расчет есть: Объем массы молей
= Есть 0.
 55 моль атомов кислорода.
55 моль атомов кислорода. Всегда проверяйте единицы измерения!
Примеры
Набор задач
Ниже представлены два документа. Один – практические задачи, второй – те же проблемы с решениями.
Их можно загрузить и изменить в соответствии с вашими потребностями.
Викторина
Преподавание химии: решение задач в химии
Решение задач в химии
| Обзор темы по теме “Заголовок”: |
Решение проблем может быть очень сложной задачей.Но когда используется конкретная «атака», проблемы решаются гораздо проще. Общая методика решения проблем
Методика решения проблем со словами
Подготовка к тесту
Сдача экзамена
|
| Набор для быстрого изучения “Title”: | |||||||||
|
| “Заголовок” Краткое содержание учебного курса: |
На протяжении всего курса химии вы столкнетесь с проблемами. |
| Функции руководства: |
Специальные возможности учебного пособия:
Характеристики серии :
|
| «Заголовок» Список тем: |
|
Просмотрите все 24 урока химии в колледже, включая концептуальные руководства, упражнения и шпаргалки:
Научитесь преподавать химию визуально за 24 часа
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
5 советов по решению проблем, связанных с газом – Концепция
Вот пять небольших напоминаний, на которые вы должны обратить внимание перед модульным тестом по законам о газе.Вот пять вещей, в которых мои ученики склонны делать ошибки. Я уверен, что это вам тоже поможет.
Первый; температура всегда в Кельвинах, никогда по Цельсию. В вашей задаче он может быть указан в градусах Цельсия, но вам всегда нужно переводить его в градусы Кельвина. Не забывайте, что температура Кельвина 273+ по Цельсию. Если это не в Кельвинах, вы ошибаетесь.
Два; Заметьте, я хочу, чтобы вы заметили, если вам даны моли или дана масса газа, вы должны использовать закон идеального газа. Если вам не даны моль или масса определенного газа, вам не следует использовать закон идеального газа.Давайте это запишем. Обратите внимание, что единственный газовый закон с молями или массой в качестве переменной – это Закон идеального газа. Напомним, что закон идеального газа – это PV = nRT.
Если вам не даны моль или масса, или вас не просят вычислить моль или массу, не используйте закон идеального газа. Если вам даны моль или масса, или вас попросят вычислить моль или массу, единственное, что вы можете использовать, – это закон идеального газа. Убедитесь, что вы знаете об этом. Это поможет вам различать, когда и где его использовать.
Я также хочу, чтобы вы знали, что один моль газа всего 22.4л на СТП. Что такое STP? STP составляет 1 атмосферу при 273 Кельвина, это условие для STP. Так что, если ваши газы не находятся в этих условиях, это не 22,4 л, а только 22,4 л, если это на уровне STP. Если в вашей проблеме не указано, что условия являются стандартными, вы не можете предполагать, что ваш газ занимает 22,4 л места. В противном случае вы должны рассчитать его. Вы должны рассчитать, если это не так. Вы можете рассчитать, используя один из законов газа; Бойля, Чарльза и так далее.
Следующий. Говоря о газовых законах и законах об идеальном газе, здесь есть Р.Что это за фигня? Это газовая постоянная. Вы должны быть уверены, что используете правильную газовую постоянную, когда используете правильную единицу давления. Вы будете смотреть на свою единицу давления, и если она находится в атмосфере, вы собираетесь использовать 0,0821 в качестве постоянной газового закона. Единица измерения – атм л / моль К, и вы можете вычеркнуть это значение.
Если вам даны единицы измерения в миллиметрах в ртутном столбе (мм рт. Ст. / Торр – то же самое). Миллиметры и ртуть – это единица измерения ртути.Торр – человек, который изобрел этот метод. Единицы измерения – 62,4 мм рт. Ст. Л / моль К. Ваш учитель может быть очень внимателен к тому, чтобы убедиться, что вы знаете свои единицы, убедитесь, что они у вас есть.
Последнее, с чем вы, вероятно, столкнетесь, – это килопаскаль (кПа), а это 8,314 килопаскаль-литр на моль Кельвина. Если ваши единицы, узнайте, с какими единицами давления вы имеете дело, и выясните, какую единицу, какую R вы на самом деле собираетесь использовать. Вы всегда можете конвертировать, если хотите 1 вместо 1 и всегда использовать.0821, но вы должны заметить свои единицы, чтобы быть в курсе.
Последняя точка. Говоря о единицах измерения, убедитесь, что все единицы давления в задаче совпадают. Другими словами, проверьте свои единицы. Итак, если вам дано, если, например, если вы используете закон Бойля; PV = PV, вы хотите, чтобы единицы давления совпадали. Если вам нужно скрыть, вот преобразования; 1 атм = 760 мм рт. Мы также говорим, что это torr, если ваш учитель его использует. И все это равно 101,3 кПа, это три общие единицы измерения давления.
Убедитесь, что у вас одинаковые объемы. Объемы туров стабильны. Если вы используете миллилитры, убедитесь, что это миллилитры. Если вы используете литры, убедитесь, что это литры. Но я также хочу, чтобы вы знали, что 1 см³ = 1 мл, это одно и то же, они равны друг другу. Это поможет вам с вашими объемами.
Вот 5 вещей, на которые я хочу, чтобы вы обратили внимание, когда приходите на экзамен и просите решить некоторые проблемы. Это то, с чем ошибаются большинство студентов.Так что убедитесь, что вы хорошо знаете 5 этих вещей. Надеюсь, это помогло.
Методика решения задач по химии
стр. 401-405 | Номер статьи: ijese.2018.033
Опубликован онлайн: 10 июля 2018 г.
APA 6-е издание
В тексте: (Милькович, Милькович, Митрович и Ранчич, 2018)
Библиография: Милькович, М.Н., Милькович, В., Митрович, Дж. И Ранчич, С. (2018). Методология решения задач по химии. Международный журнал экологического и научного образования, 13 (4), 401-405.
Гарвард
В тексте: (Милькович, Милькович, Митрович и Ранчич, 2018)
Библиография: Милькович, М., Милькович, В., Митрович, Дж. И Ранчич, С. (2018) . Методология решения задач по химии. Международный журнал экологического и научного образования , 13 (4), стр.401-405.
Чикаго, 16-е издание
В тексте: (Милькович, Милькович, Митрович и Ранчич, 2018)
Библиография: Милькович, Милена Новица, Войкан Милькович, Елена Митрович и София Ранчич (2018). «Методика решения задач по химии». Международный журнал экологического и научного образования 13 (4): 401-405.
Осубель Д. П., Новак Дж. Д. и Ханезиан Х. (1978). Педагогическая психология: познавательный взгляд, 2-е изд. Нью-Йорк: Райнхарт и Уинстон.
Эйлкс, И., и Хофштейн, А. (2013). Преподавание химии – Учебное пособие: Практическое руководство и учебник для студентов-учителей, практикантов и учителей . Роттердам; Бостон, издательство Sense. https://doi.org/10.1007/978-94-6209-140-5
Fach, M. de Boer, T., & Parchmann, I. (2007). Результаты интервью как основа для разработки ступенчатых вспомогательных инструментов для стехиометрических задач. Исследования и практика химического образования, 8 (1), 13-31. https://doi.org/10.1039/B6RP
H
Фридман Р. С. и Дик Ф. П. (2002). Проблемно-ориентированное обучение и инструменты решения проблем: синтез и направление для распределенных образовательных сред. Journal of Interactive Learning Research, 13 (3), 239-257.
Габель, Д. (1999). Улучшение преподавания и обучения с помощью исследований в области химического образования: взгляд в будущее. Журнал химического образования, 76 (4), 548-553.https://doi.org/10.1021/ed076p548
Гринфилд, Л. Б. (1987) Обучение мышлению через решение проблем. Новые направления преподавания и обучения, 1987 (30), 5-22. https://doi.org/10.1002/tl.37219873003
Херрон, Дж. Д. (1996). Класс химии: формулы успешного обучения. Американское химическое общество, Вашингтон, округ Колумбия.
Хьюсон, П. У. и Хьюсон, М. Г. А. (1989). Анализ и использование задания для определения концепций педагогической науки. Журнал педагогического образования: международные исследования и педагогика, 15 (3), 191-209. https://doi.org/10.1080/02607478
302
Козма, Р. Б., и Рассел, Дж. У. (1997). Мультимедиа и понимание ответов экспертов и новичков на различные представления о химических явлениях. Journal of Research in Science Teaching, 34 (9), 949-968. https://doi.org/10.1002/(SICI)1098-2736(199711)34:9<949::AID-TEA7>3.0.CO;2-U
Поля, Г.(1985). Как решить . 2-е изд. Издательство Принстонского университета: Принстон, Нью-Джерси.
Russell, JW, Kozma, RB, Jones, T., Wykoff, J., Marx, N., & Davis, J. (1997) Использование синхронно-синхронизированных макроскопических, микроскопических и символических представлений для улучшения преподавания и изучения химические концепции. Журнал химического образования, 74 (3), 330-335. https://doi.org/10.1021/ed074p330
Сандлин, Б., Харшман, Дж., И Езерски, Э. (2015).Формирующее оценивание в преподавании химии в средней школе: исследование соответствия целей учителей их задачам. Журнал химического образования, 92 (10), 1619-1625. https://doi.org/10.1021/acs.jchemed.5b00163
Шенфельд, А. Х. (1992). Обучение математическому мышлению: решение проблем, метапознание и осмысление математики. Справочник по исследованиям в области преподавания и обучения математике , 334-370.
Спенсер, Дж. Н. (2006). Новые подходы к обучению химии.2005 Премия Джорджа К. Пиментеля. Journal of Chemical Education, 83 (4), 528. https://doi.org/10.1021/ed083p528
Штифф, М. (2011). Когда молекула трехмерна? Специальная роль для воображаемого мышления в продвинутой химии. Естественное образование, 95 (2), 310-336. https://doi.org/10.1002/sce.20427
Чжоу, К., Шен, Н., и Тиан, Х. (2010). Развитие критического мышления путем обучения на основе задач при обучении химическому эксперименту. Процедуры – Социальные и поведенческие науки, 2 (2), 4561-4570. https://doi.org/10.1016/j.sbspro.2010.03.731
Зушо А., Пинтрич П. Р. и Коппола Б. (2003). Навыки и воля: роль мотивации и познания в изучении химии в колледже. International Journal of Science Education, 25 (9), 1081-1094. https://doi.org/10.1080/095006
00052207% PDF-1.6 % 269 0 obj> эндобдж xref 269 159 0000000016 00000 н. 0000004408 00000 н. 0000004545 00000 н. 0000004665 00000 н. 0000005443 00000 н. 0000005572 00000 н. 0000005664 00000 н. 0000006501 00000 н. 0000007245 00000 н. 0000007540 00000 н. 0000007632 00000 н. 0000007744 00000 н. 0000007769 00000 н. 0000007794 00000 н. 0000007970 00000 п. 0000008061 00000 н. 0000008153 00000 н. 0000008208 00000 н. 0000008269 00000 н. 0000008337 00000 н. 0000008398 00000 п. 0000008490 00000 н. 0000008582 00000 н. 0000008693 00000 п. 0000008718 00000 н. 0000008743 00000 н. 0000008919 00000 н. 0000009010 00000 н. 0000009102 00000 п. 0000009194 00000 п. 0000009465 00000 н. 0000009575 00000 н. 0000010150 00000 п. 0000010175 00000 п. 0000010404 00000 п. 0000010429 00000 п. 0000010605 00000 п. 0000010716 00000 п. 0000010807 00000 п. 0000010899 00000 п. 0000010991 00000 п. 0000011083 00000 п. 0000011195 00000 п. 0000011220 00000 н. 0000011245 00000 п. 0000011270 00000 п. 0000011295 00000 п. 0000011471 00000 п. 0000011562 00000 п. 0000011654 00000 п. 0000011746 00000 п. 0000011838 00000 п. 0000011930 00000 п. 0000012022 00000 п. 0000012113 00000 п. 0000012289 00000 п. 0000012314 00000 п. 0000012339 00000 п. 0000012452 00000 п. 0000012544 00000 п. 0000012636 00000 п. 0000012728 00000 п. 0000012819 00000 п. 0000012995 00000 п. 0000022605 00000 п. 0000023291 00000 п. 0000023692 00000 п. 0000034052 00000 п. 0000034143 00000 п. 0000034168 00000 п. 0000034425 00000 п. 0000034450 00000 п. 0000034542 00000 п. 0000034774 00000 п. 0000034886 00000 п. 0000034978 00000 п. 0000035070 00000 п. 0000035162 00000 п. 0000035253 00000 п. 0000035429 00000 п. 0000035454 00000 п. 0000035479 00000 п. 0000035590 00000 н. 0000035682 00000 п. 0000035858 00000 п. 0000035950 00000 п. 0000036003 00000 п. 0000046332 00000 н. 0000048179 00000 н. 0000048539 00000 п. 0000053676 00000 п. 0000054311 00000 п. 0000054940 00000 п. 0000055425 00000 п. 0000055720 00000 п. 0000069447 00000 п. 0000079418 00000 п. 0000089466 00000 п. 0000089491 00000 п. 0000089582 00000 п. 0000089758 00000 п. 0000089850 00000 п. 0000089875 00000 п. 0000089985 00000 п. 00000

 ………..
……….. Физические величины в химии. Основные понятия и законы химии
Физические величины в химии. Основные понятия и законы химии Растворимость. Кристаллогидраты
Растворимость. Кристаллогидраты



 Мы используем четыре простых шага:
Мы используем четыре простых шага: Наконец, шаг, о котором многие забывают – ПРОВЕРИТЬ , что вы действительно ответили на ВСЕ части вопроса и что ваш ответ разумный.
Наконец, шаг, о котором многие забывают – ПРОВЕРИТЬ , что вы действительно ответили на ВСЕ части вопроса и что ваш ответ разумный. Д.
Д.
 Д.)
Д.)

 На обратной или верхней стороне теста напишите всю информацию, которую вы «сохранили» в памяти. Это позволяет вам обращаться к «банку» во время прохождения теста и предотвращает беспокойство по поводу забывания информации.
На обратной или верхней стороне теста напишите всю информацию, которую вы «сохранили» в памяти. Это позволяет вам обращаться к «банку» во время прохождения теста и предотвращает беспокойство по поводу забывания информации. «Проблема» – это когда вы не знаете, как перейти от известной информации к неизвестной. Наличие систематического метода «атаки» на проблемы может значительно облегчить их. В этом руководстве представлена общая техника решения проблем, а также особая техника для текстовых задач. Также даются советы по подготовке и сдаче тестов.
«Проблема» – это когда вы не знаете, как перейти от известной информации к неизвестной. Наличие систематического метода «атаки» на проблемы может значительно облегчить их. В этом руководстве представлена общая техника решения проблем, а также особая техника для текстовых задач. Также даются советы по подготовке и сдаче тестов.