ГДЗ (ответы) Химия 8 класс Григорович А.В., 2016 §15 Строение электронных оболочек и характер химических элементов » Допомога учням
Другие задания смотри здесь…
Контрольные вопросы
Вопрос 1 Чем обусловлены металлические и неметаллические свойства элементов? Строением электронных оболочек атомов. Металлические свойства проявляют преимущественно элементы, у атомов которых на внешних уровнях находится меньше четырех электронов, а неметаллические ― четыре и более.
Вопрос 2 Как определить число валентных электронов в электронных оболочках атомов химических элементов главных подгрупп? По номеру группы, в которой размещен элемент, поскольку валентные электроны ― это электроны внешнего энергетического уровня.
Вопрос 3 Почему атомы принимают (отдают) электроны в химических реакциях? Потому, что хотят иметь устойчивую электронную оболочку, которая есть в атоме ближайшего инертного элемента.
Вопрос 4 Почему инертные элементы не вступают в химические реакции?
Имеют чрезвычайно устойчивую электронную оболочку атома (энергетический уровень заверш, все электроны спаренные), что обуславливает их химическую инертность.
Вопрос 5 Какие частицы называют ионами? Заряженные частицы, которые образуются в результате присоединения или отдачи атомом электронов.
Вопрос 6 Как изменяется сила притяжения валентных электронов к ядру в периоде и в подгруппе?
В периоде с ростом заряда ядер и уменьшения радиуса, усиливается сила притяжения ядром электронов внешнего энергетического уровня, свойство отдавать электроны ослабляется, а присоединять ― усиливается.
В группе главной подгруппы растет радиус атома, а чем дальше от ядра расположены валентные электроны, тем меньше они притягиваются к ядру, ослабляется связь с внешним энергетическим уровнем, способность отдавать электроны усиливается, а способность присоединять электроны ослабевает.
Вопрос 7 Как изменяются металлические и неметаллические свойства элементов в группах и периодах Периодической системы с увеличением порядкового номера?
В группах с увеличением порядкового номера элементов металлические свойства усиливаются, а неметаллические ― ослабевают.
В периодах с увеличением порядкового номера элементов металлические свойства ослабевают, а неметаллические ― усиливаются.
Чем объясняются такие изменения? Строением электронных оболочек атомов.
Вопрос 8 Что определяет радиус атомов? Радиус атомов полностью обусловлен числом электронных слоев (энергетических уровней).
Как он изменяется в периодах и группах? В периодах слава направо радиус атома уменьшается, а в группах снизу вверх ― увеличивается.
Задания для усвоения материала
Упражнение 1 Выпишите из данного перечня Na, Na
а) атомов
Na, O, Fe
б) катионов
Na+, Mg2+, NH4+
в) анионов
O2-, SO42-, NO3–
г) молекул
O2, NO2, HNO3
Объяснение: атомы ― электронейтральные частицы. Молекулы состоят из атомов. Ионы ― это заряженные частицы, образованные из атома присоединением или потерей электронов. Катионы ― ионы с положительным зарядом, а анионы ― ионы с отрицательным зарядом.
Молекулы состоят из атомов. Ионы ― это заряженные частицы, образованные из атома присоединением или потерей электронов. Катионы ― ионы с положительным зарядом, а анионы ― ионы с отрицательным зарядом.
Упражнение 2 Запишите электронные конфигурации:
а) атома Хлора и иона Cl−
1s22s22p63s23p5 і 1s22s22p63s23p6
Атом Хлора, присоединяя один электрон, превращается в ион Хлора.
б) атома Магния и иона Mg+2
1s22s22p63s2 і 1s22s22p6
Атом Магния, теряя два электрона, превращается в ион Магния.
Упражнение 3 Сколько протонов и электронов содержит:
а) атом Алюминия
Протонов 13 и электронов 13
Объяснение: на число протонов в ядре атома указывает порядковый номер Алюминия (№13), а число протонов и электронов одинаковое (13).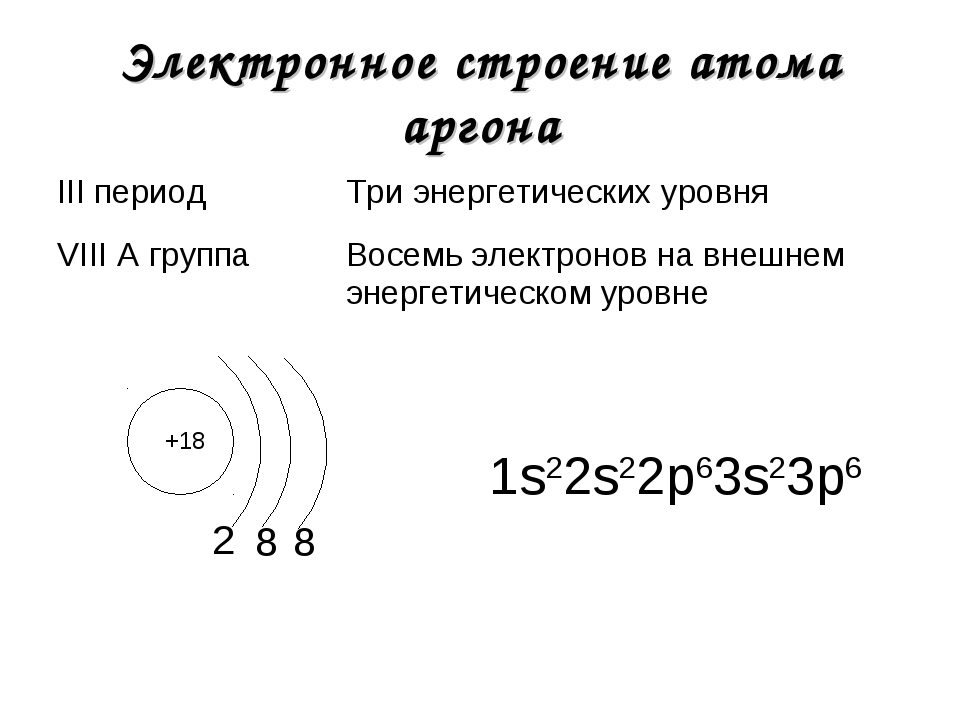
б) ион Al+3
Протонов 13 и электронов 10
Объяснение: на число протонов в ядре атома указывает порядковый номер Алюминия (№13), а ион образуется в результате потери атомом трех электронов, поэтому число электронов в ионе равно: 13-3=10
Упражнение 4 Атом какого элемента содержит столько же электронов, сколько их в ионе Na
Атом Неона Ne
Объяснение: ион Na+ содержит 11 протонов (порядковый №11) и 10 электронов (11-1=10), потому что образуется из атома вследствие потери им одного электрона. Столько же электронов содержит атом Неона (порядковый номер №10).
Упражнение 5 Сравните электронное строение ионов S–2, Cl–, K+, Ca+2 со строением атома Аргона. Одинаковое строение.
| S2- 1s22s22p63s23p6.
Сl– 1s22s22p6 
К+ 1s22s22p63s23p6. Са2+ 1s22s22p63s23p6. |
Упражнение 6 Сколько электронов не хватает до завершения внешнего энергетического уровня атомам:
а) Оксигена
Два электрона
б) Хлора
Один электрон
в) Фосфора
Пять электронов
Упражнение 7 У иона некоторого элемента E+2 такое же электронное строение, как и у атома Аргона. Определите этот элемент. Кальций Са
Определите этот элемент. Кальций Са
Объяснение: атом Аргона содержит 18 электронов (число электронов = протонное число = порядковый номер элемента). Ион Е2+ образуется в результате потери атомом двух электронов. По условию ион имеет такое же строение, что и атом Аргона, поэтому атом элемента Е содержит 18+2=20 электронов. Этим элементом является Кальций Са.
Упражнение 8 По Периодической системе определите число электронов, которое максимально может отдавать и присоединять атом Фосфора. Максимально может отдавать пять, а присоединять три электрона.
Объяснение: атом фосфора на последнем энергетическом уровне содержит пять электронов (для элементов главных подгрупп указывает номер группы), поэтому может максимально отдавать пять электронов или присоединять три, чтобы их электронная оболочка стала такой, как у атомов ближайшего инертного элемента.
Упражнение 9 Почему существенно отличаются свойства элементов главных подгрупп I и VII групп? Поясните ответ с точки зрения строения их электронных оболочек.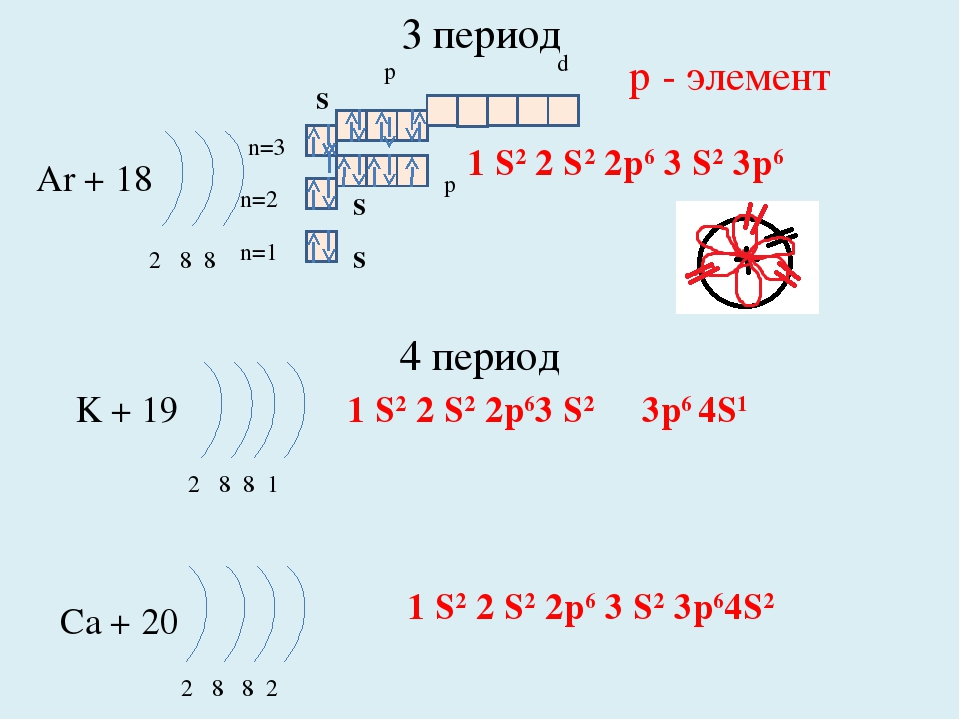 Существенно отличают числом электронов на внешнем энергетическом уровне. Щелочные элементы содержат один электрон, а галогены ― семь. Простые вещества щелочных элементов являются типичными металлами, а галогенов ― неметаллами.
Существенно отличают числом электронов на внешнем энергетическом уровне. Щелочные элементы содержат один электрон, а галогены ― семь. Простые вещества щелочных элементов являются типичными металлами, а галогенов ― неметаллами.
Упражнение 10. В чем заключается отличие электронной оболочки иона Натрия от электронных оболочек:
а) атома Натрия
Ион Натрия содержит на один электрон меньше, чем атом Натрия.
б) атома Неона
Разный заряд ядра атома (11 і 10)
в) иона K+
Разный заряд ядра атома (11 і 19), разное число энергетических уровней (2 і 3)
Упражнение 11 Почему элементы Флуор и Хлор обладают сходными свойствами? Находятся в одной (VII) группе главной подгруппы, то есть являются электронными аналогами.
Другие задания смотри здесь…
Строение атома, 11 класс – презентация онлайн
Строение атомаХимия, 11 класс
Домашнее задание: профильный
учебник, параграфы 1 и 2, вспомнить,
как записывать схему строения атома,
электронную и графическую формулу.
Атом –
Химический элемент –
Доказательства сложности строения атома:
– Открытие рентгеновских лучей
– Открытие радиоактивности
– Открытие «катодных лучей» (электронов)
– Изучение явления радиоактивности
Модели строения атома
• Пудинг с изюмом (1902-04 гг) Кельвин,
Томсон)
• Планетарная (1907-13 гг) Резерфорда-Бора
• Модель Бора-Зоммерфельда (1913 г)
• Квантово-механическая модель,
опирающаяся на протонно-нейтронную
теорию ядра (совр.) Шредингер,
Гейзенберг, Бор и др.
Модель Резерфорда
Схема строения атома
Современные представления о делимости нуклонов
Основные
характеристики протонов, нейтронов и электронов
Среднее значение относительной атомной
массы с учетом распространенности изотопов
Обратите внимание! При решении задач ЕГЭ среднее значение
относительной атомной массы всех атомов, кроме хлора, округляется до
целого по правилам математики. Среднее значение относительной
атомной массы атома хлора в ЕГЭ принято считать равным 35,5.
Порядковый номер химического элемента в
Периодической таблице –
Массовое число –
Номер периода –
Номер группы для элементов главных и побочных
подгрупп Для чего можно использовать эти данные?
Составим схему строения атома одного из элементов малых
периодов, например, серы.
Чего следует ожидать при изменении
числа элементарных частиц в атоме?
Изменение числа протонов- появление нового элемента.
Изменение числа нейтронов – появление изотопов одного и того
же элемента.
Изменение числа электронов – образование положительных или
отрицательных ионов из атомов этого элемента.
Нуклиды
Массовое число
одинаковое, заряд и
число нейтронов
различны
изобары
заряд одинаков,
массовое число и
число нейтронов
различны
изотопы
число нейтронов
одинаковое, заряд и
массовое число
различны
изотоны
Изотопы водорода
Попробуйте ответить на вопросы:
1.
 У изотопов одного элемента массовое число одинаковое
У изотопов одного элемента массовое число одинаковоеили разное?
2. У изотопов одного элемента число протонов одинаковое
или разное?
1. У изотопов одного химического элемента массовое
число всегда разное, т.к. массовое число складывается
из числа протонов и нейтронов. А у изотопов
различается число нейтронов.
2. У изотопов одного элемента число протонов всегда
одинаковое, т.к. число протонов характеризует
химический элемент.
3. Определите количество нейтронов, протонов и
электронов в изотопе брома-81.
4. Определите число нейтронов в изотопе хлора-37.
3. Массовое число изотопа брома-81 равно 81.
Атомный номер = заряд ядра брома = число протонов в
ядре = 35. Вычитаем из массового числа число
протонов, получаем 81-35=46 нейтронов.
4. Массовое число изотопа хлора равно 37. Атомный
номер, заряд ядра и число протонов в ядре равно 17.
Получаем число нейтронов = 37-17 =20.
Электронное облако –
Электронная орбиталь –
Формы электронных орбиталей –
Варианты расположения орбиталей в пространстве
Сводная таблица
Принцип минимума энергии.
 Электроны заполняют сначала
Электроны заполняют сначалаорбитали с наименьшей энергией. Энергия атомной орбитали
эквивалентна сумме главного и орбитального квантовых
чисел: n + l. Если сумма одинаковая, то заполняется первой та
орбиталь, у которой меньше главное квантовое число n.
Энергетическая диаграмма атома углерода
Электронная формула
С +6
1s22s22p2
Электронные формулы элементов первых четырех
периодов
H +1
1s1
1s
He +2
1s2
1s
Li +3
1s22s1
1s
2s
Be +4
1s22s2
1s
2s
B +5
1s22s22p1 1s
2s
C +6
1s22s22p2 1s
2s
2p
2p
Ne +10
1s22s22p6
1s
2s
Na+11 1s22s22p63s1 1s
2p
2s
2p
3s
У неона завершено заполнение второго
энергетического уровня.
У натрия начинается заполнение третьего
энергетического уровня.
От натрия до аргона заполнение 3-го уровня
происходит в том же порядке, что и заполнение
2-го энергетического уровня.

А вот начиная с 19-го элемента, калия,
заполняется не 3d-орбиталь, а 4s. Заполнение
энергетических
уровней
и
подуровней
электронами происходит по энергетическому
ряду орбиталей, а не по порядку.
Таким образом, формула калия:
K +19 1s22s22p63s23p64s1
1s
2s
2p
3s
3p
4s
У кальция 4s-подуровень заполнен:
Ca +20 1s22s22p63s23p64s2
1s
2s
2p
3s
3p
4s
У элемента 21, скандия, согласно энергетическому ряду
орбиталей, начинается заполнение 3d-подуровня:
Sc +21 1s22s22p63s23p63d14s2
3d
4s
Дальнейшее заполнение 3d-подуровня происходит согласно
квантовым правилам, от титана до ванадия.
Однако, у хрома порядок заполнения орбиталей нарушается.
Электронная конфигурация хрома такая:
Cr +24 [Ar]3d54s1
[Ar] 3d
4s
Этот эффект так и называется —провал или проскок
электрона. И наблюдается он, когда d-орбиталь
недозаполнена на 1 электрон (по одному электрону в ячейке
или по два).

Основное и возбужденное состояние атома бора
B +5 1s22s22p1
1s
2s
2p
B* +5 1s22s12p2
1s
2s
2p
Электронные формулы ионов
Если атом отдаёт электроны, то общий заряд образовавшейся
частицы будет положительный (вспомним, что число протонов в
атоме равно числу электронов, а при отдаче электронов число
протонов будет больше числа электронов). Положительно
заряженные ионы — это катионы. Например: катион натрия
образуется так:
Na +11 1s22s22p63s1 -1е = Na+ +11 1s22s22p63s0
Если атом принимает электроны, то
приобретает отрицательный заряд. Отрицательно заряженные
частицы — это анионы. Например, анион хлора образуется так:
Cl +17 1s22s22p63s23p5 +1e = Cl— +17 1s22s22p63s23p6
Таким образом, электронные формулы ионов можно
получить добавив или отняв электроны у атома. Обратите
внимание, при образовании катионов электроны уходят
с внешнего энергетического уровня. При образовании анионов
электроны приходят на внешний энергетический уровень.

В некоторых случаях совершенно разные атомы
образуют ионы с одинаковой электронной
конфигурацией. Частицы с одинаковой электронной
конфигурацией и одинаковым числом электронов
называют изоэлектронными частицами.
Например, ионы Na+ и F—.
Электронная формула катиона натрия:
Na+ 1s22s22p6, всего 10 электронов.
Электронная формула аниона фтора:
F— 1s22s22p6, всего 10 электронов.
Таким образом, ионы Na+ и F— — изоэлектронные.
Также они изоэлектронны атому аргона.
«Помогите пожалуйста.» — Яндекс.Кью
1 В атоме магния содержатся 12 протонов и 12 электронов. Укажите число электронов и протонов в ионе Mg2+:
Выберите один ответ:
12 протонов и 10 электронов
10 протонов и 12 электронов
12 протонов и 14 электронов
10 протонов и 10 электронов
2 Какова максимальная емкость р-подуровня?
Выберите один ответ:
4 электрона
2 электрона
3 электрона
6 электронов
3 Какая из электронных формул соответствует хлорид-иону?
Выберите один ответ:
ls22s22р6
ls22s22р53s23р5
ls22s22р5
ls22s22р63s23р6
4 Определите состав ядра атома углерода-12
Выберите один ответ:
6 протонов и 7 электронов
3 протона и 2 нейтрона
4 протона и 12 нейтронов
6 протонов и 6 нейтронов
5 В каком ряду основные свойства соединений усиливаются?
Выберите один ответ:
CО2,MgO,N2О5
MgO, Na2О, C02
SiО2, SО3, Cl2O7
Li2О, K2О, Rb2О
6 Номер периода в Периодической системе элементов Д. И. Менделеева указывает на:
И. Менделеева указывает на:
Выберите один ответ:
число электронов на внешнем энергетическом уровне
число валентных электронов
число энергетических уровней в атоме
общее число электронов в атоме
7 Что является основной причиной, обусловливающей периодическое изменение химических свойств элементов?
Выберите один ответ:
относительная атомная масса
строение внешних электронных уровней атомов элементов
число электронов в атоме
заряд атома
8 Какое число р-электронов находится в атоме аргона?
Выберите один ответ:
12
6
8
4
9 Укажите максимальную емкость энергетического уровня с заданным главным квантовым числом n:
Выберите один ответ:
n2
2n2
n-1
2n+1
10 В каком из рядов возрастают металлические свойства элементов?
Выберите один ответ:
Ca, Sr, Ba
В, О, F
Р, S, Cl
Al, Si, P
11 Внешний энергетический уровень атома элемента представлен формулой 3s2р6. Определите порядковый номер и название элемента.
Определите порядковый номер и название элемента.
Выберите один ответ:
10, неон
18, аргон
12, магний
15, фосфор
12 Какую из приведенных электронных формул может иметь ион Na+?
Выберите один ответ:
ls22sl
ls22s22p3
ls22s22p6
ls22s22p63sl
13 В каком из рядов орбитали представлены в порядке увеличения их энергии?
Выберите один ответ:
1s, 2s, 2p
1s, 2р, 2s
3s, 2р, 2s
2р, 1s, 2s
14 В каком из рядов находятся изоэлектронные (т. е. содержащие одинаковое число электронов) частицы?
Выберите один ответ:
Si4+, Na+, F
Mn2+, Fe2+, K+
Fe2+, Co3+, F-
Са2+, Аг, С1-
15 У какого из указанных ионов электронная формула совпадает с электронной формулой неона?
Выберите один ответ:
Be2+
F-
CI-
Li+
16 В каком из рядов приведенных элементов возрастает число электронов на внешнем слое?
Выберите один ответ:
Na,Al,Cl
Mg,Li,S
Be,N,C
Li,F,Be
17 Какая из электронных формул соответствует атому неона?
Выберите один ответ:
ls22s22p1
1s22s1
1s22s2
1s22s22p6
18 Атом какого из перечисленных элементов в основном состоянии содержит на внешнем уровне два неспаренных электрона?
Выберите один ответ:
алюминий
гелий
сера
магний
19 Что показывает порядковый номер химического элемента?
Выберите один ответ:
валентность атома в соединении
число протонов в ядре атома элемента
степень окисления элемента в соединении
заряд атома
20 Укажите пару атомов элементов четвертого периода периодической системы, которые образуют оксиды состава Э205, соответствующие их высшей степени окисления:
Выберите один ответ:
фтор и азот
германий и мышьяк
ванадий и мышьяк
мышьяк и фосфор
Аргон – информация об элементе, свойства и использование
Стенограмма:
Химия в ее стихии: аргон
(Промо)
Вы слушаете химию в ее стихии, представленную вам журнала Chemistry World, Королевского общества .
(Конец промо)
Крис Смит
Привет, на этой неделе элемент настолько ленивый, что ученые одно время думали, что он ни с чем не будет реагировать, но в химическом мире лень может иметь свою преимущества, особенно если вам нужны сверхтихие автомобильные шины или безопасный химикат, с помощью которого можно накачать гидрокостюм.
Это Джон Эмсли.
Джон Эмсли
Ленивый, трудолюбивый, бесцветный, красочный – это аргон!
Название аргона происходит от греческого слова argos , означающего ленивый, и более ста лет после его открытия химики не могли заставить его сочетаться с какими-либо другими элементами. Но в 2000 году химики Хельсинкского университета во главе с Маркку Рясаненом объявили о первом в истории соединении: фторгидриде аргона.Они сделали его путем конденсации смеси аргона и фтористого водорода на йодиде цезия при температуре -265 o C и воздействии на нее ультрафиолетовым светом. При нагревании чуть выше -246 o C он вновь превращается в аргон и фтористый водород. И ни один другой процесс никогда не вызывал реакцию аргона — [действительно ленивого элемента].
При нагревании чуть выше -246 o C он вновь превращается в аргон и фтористый водород. И ни один другой процесс никогда не вызывал реакцию аргона — [действительно ленивого элемента].
В атмосфере Земли циркулирует 50 триллионов тонн аргона, и он медленно накапливался в течение миллиардов лет, почти весь из-за распада радиоактивного изотопа калия-40, период полураспада которого составляет 12 .7 миллиардов лет. Хотя аргон составляет 0,93% атмосферы, он не был открыт до 1894 года, когда физик лорд Рэлей и химик Уильям Рамзи идентифицировали его. В 1904 году Рэлей получил Нобелевскую премию по физике, а Рамзи получил Нобелевскую премию по химии за свою работу.
История его открытия началась, когда Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем азот, полученный при разложении аммиака. Разница была небольшая, но реальная. Рамзи написал Рэлею, предлагая ему искать более тяжелый газ в азоте, полученном из воздуха, а Рэлею следует искать более легкий газ в азоте, полученном из аммиака. Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием, с которым азот реагирует с образованием нитрида магния. У него остался один процент, который не реагировал, и обнаружил, что он плотнее азота. Его атомный спектр показал новые красные и зеленые линии, подтверждающие, что это новый элемент. Хотя на самом деле в нем были следы и других благородных газов.
Рамзи удалил весь азот из своего образца, многократно пропуская его над нагретым магнием, с которым азот реагирует с образованием нитрида магния. У него остался один процент, который не реагировал, и обнаружил, что он плотнее азота. Его атомный спектр показал новые красные и зеленые линии, подтверждающие, что это новый элемент. Хотя на самом деле в нем были следы и других благородных газов.
Аргон был впервые выделен Генри Кавендишем в 1785 году в Клэпеме, Южный Лондон. Он пропускал через воздух электрические искры и поглощал образовавшиеся газы, но был озадачен тем, что остался нереакционноспособный 1%.Он не понял, что наткнулся на новый газообразный элемент.
Большая часть аргона идет на производство стали, где он продувается через расплавленное железо вместе с кислородом. Аргон перемешивает, а кислород удаляет углерод в виде углекислого газа. Он также используется, когда необходимо исключить доступ воздуха для предотвращения окисления горячих металлов, например, при сварке алюминия и производстве титана для исключения доступа воздуха.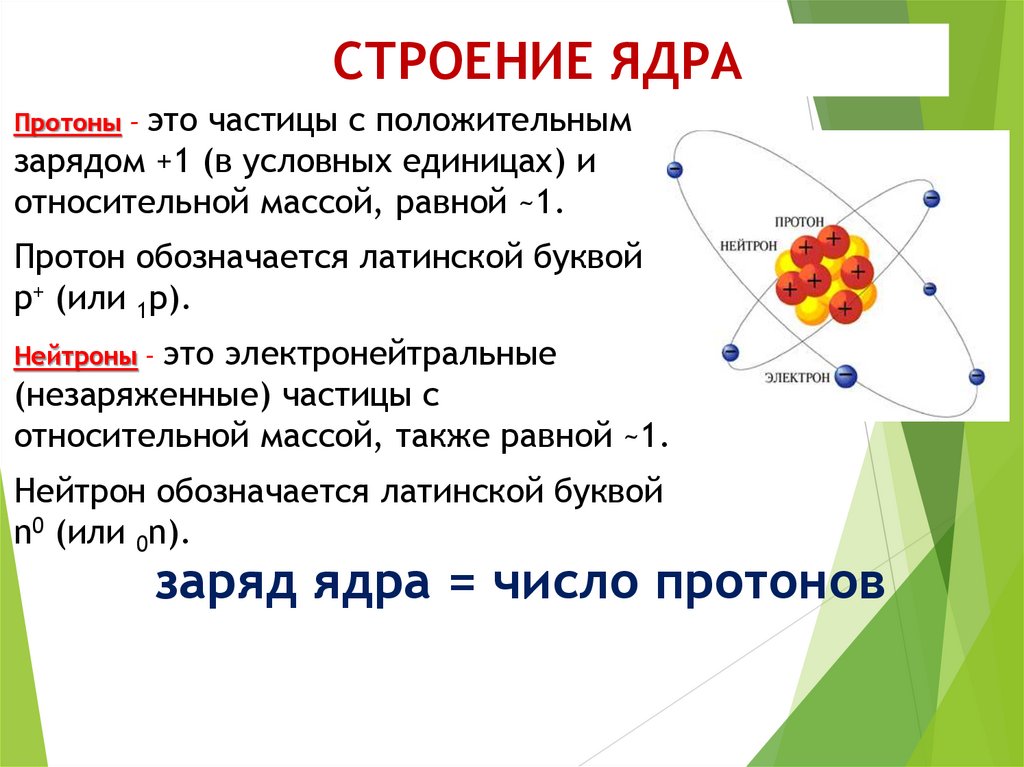 Сварка алюминия производится электрической дугой, для чего требуется поток аргона 10-20 литров в минуту.Топливные элементы атомной энергии защищаются аргоновой атмосферой при рафинировании и переработке.
Сварка алюминия производится электрической дугой, для чего требуется поток аргона 10-20 литров в минуту.Топливные элементы атомной энергии защищаются аргоновой атмосферой при рафинировании и переработке.
Сверхтонкие металлические порошки, необходимые для изготовления сплавов, получают путем направления струи жидкого аргона на струю расплавленного металла.
Некоторые металлургические заводы предотвращают попадание токсичной металлической пыли в окружающую среду, выпуская ее через аргоновую плазменную горелку. При этом атомы аргона электрически заряжаются до температуры 10 000 °C, а проходящие через них частицы токсичной пыли превращаются в каплю расплавленного лома.
Для химически ленивого газа аргон оказался чрезвычайно пригодным для использования. Знаки с подсветкой светятся синим, если они содержат аргон, и ярко-синим, если присутствует небольшое количество паров ртути. Двойное остекление еще более эффективно, если зазор между двумя стеклами заполнен аргоном, а не только воздухом, потому что аргон является худшим проводником тепла. Теплопроводность аргона при комнатной температуре (300 К) составляет 17,72 мВт м -1 К -1 (милливатт на метр на градус), тогда как для воздуха она составляет 26 мВт м -1 К -1 . По той же причине аргон используется для накачивания гидрокостюмов. Старые документы и другие вещи, подверженные окислению, можно защитить, храня их в атмосфере аргона. Синие аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и исправления дефектов глаз.
Теплопроводность аргона при комнатной температуре (300 К) составляет 17,72 мВт м -1 К -1 (милливатт на метр на градус), тогда как для воздуха она составляет 26 мВт м -1 К -1 . По той же причине аргон используется для накачивания гидрокостюмов. Старые документы и другие вещи, подверженные окислению, можно защитить, храня их в атмосфере аргона. Синие аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и исправления дефектов глаз.
Самое экзотическое применение аргона – в шинах роскошных автомобилей. Он не только защищает резину от воздействия кислорода, но и обеспечивает меньший шум шин при движении автомобиля на высокой скорости. В случае с этим элементом лень может оказаться полезной.Его высокотехнологичные применения варьируются от двойного остекления и лазерной хирургии глаза до нанесения вашего имени в свет.
Крис Смит
Джон Эмсли раскрывает секреты благородного газа аргона тяжелее воздуха. На следующей неделе ты выйдешь замуж за этого мужчину?
На следующей неделе ты выйдешь замуж за этого мужчину?
Steve Mylon
Почти никогда не бывает так, чтобы популярные элементы были такими из-за их полезности и интересного химического состава. Но для золота и серебра это все так поверхностно. Они более популярны, потому что они красивее.Моя жена, например, не химик, не мечтает носить медное обручальное кольцо. Возможно, это как-то связано с тем фактом, что оксид меди имеет раздражающую привычку окрашивать кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, чтобы узнать ее немного; возможно, тогда она отвернется от остальных и будет носить его с гордостью.
Крис Смит
Стив Майлон готов скрестить вашу ладонь с медью на следующей неделе Химия в ее элементах, я надеюсь, что вы можете присоединиться к нам.Я Крис Смит, спасибо за внимание и до свидания.
(Акция)
(Конец акции)
ПлакатAR, показывающий структуру атома и его орбитали
Visual Science Studio создала серию обучающих плакатов и приложений дополненной реальности для Научных лабораторий Политехнического музея в Москве. Проект призван мотивировать и привлечь внимание учащихся к темам школьной программы по естественным наукам, сочетая традиционную форму учебного плаката, знакомую большинству учителей, и удобный формат мобильного приложения.Для каждой из выбранных тем мы создали свою дополненную реальность (AR) и электронную версию постера, что дает возможность углубиться в изучение вопроса в интерактивном режиме.
Проект призван мотивировать и привлечь внимание учащихся к темам школьной программы по естественным наукам, сочетая традиционную форму учебного плаката, знакомую большинству учителей, и удобный формат мобильного приложения.Для каждой из выбранных тем мы создали свою дополненную реальность (AR) и электронную версию постера, что дает возможность углубиться в изучение вопроса в интерактивном режиме.
Первая серия постеров и разделов приложений посвящена четырем темам: Анатомия лягушки; ДНК, РНК и белок; атом; и таблица растворимости. В процессе разработки плаката использовались научные методы, такие как компьютерная микротомография, молекулярное моделирование и динамика, а также данные о форме различных атомных орбиталей.Плакаты доступны для преподавателей, посещавших учебные лаборатории Политехнического музея, бесплатное приложение с дополненной реальностью и электронные версии плакатов доступны в Google Play и App Store.
Атом
Структура атома показана на примере урана-238. Модель атома включает 45 электронных орбиталей со значительно большей детализацией и точностью, чем модели, опубликованные ранее. Также на плакате показана связь между зарядом ядра и символом элемента; общее количество протонов и нейтронов в ядре и атомный вес; формы, размеры, пространственная ориентация орбиталей и их символы; положения электронов на орбиталях и внешний вид диаграммы, часто используемой в учебных материалах для отображения электронной конфигурации.Центральная иллюстрация включает правила, по которым электроны занимают энергетические уровни и подуровни в атоме. Часть плаката посвящена радиоактивному распаду на примере атома урана. Дополненная реальность позволяет зрителю изменять количество протонов, нейтронов и электронов в модели атома, обеспечивая изображение атомов всех химических элементов от водорода до урана в одном масштабе. Также при нажатии на ячейку электронной схемы конфигурации отображается соответствующая орбиталь на экране.Все модели можно вращать в любом направлении в AR.
Модель атома включает 45 электронных орбиталей со значительно большей детализацией и точностью, чем модели, опубликованные ранее. Также на плакате показана связь между зарядом ядра и символом элемента; общее количество протонов и нейтронов в ядре и атомный вес; формы, размеры, пространственная ориентация орбиталей и их символы; положения электронов на орбиталях и внешний вид диаграммы, часто используемой в учебных материалах для отображения электронной конфигурации.Центральная иллюстрация включает правила, по которым электроны занимают энергетические уровни и подуровни в атоме. Часть плаката посвящена радиоактивному распаду на примере атома урана. Дополненная реальность позволяет зрителю изменять количество протонов, нейтронов и электронов в модели атома, обеспечивая изображение атомов всех химических элементов от водорода до урана в одном масштабе. Также при нажатии на ячейку электронной схемы конфигурации отображается соответствующая орбиталь на экране.Все модели можно вращать в любом направлении в AR. Электронные версии постера содержат все изображения и текст в высоком качестве.
Электронные версии постера содержат все изображения и текст в высоком качестве.
Argon Atom – обзор
Рассчитайте среднеквадратичную скорость (〈u2〉1/2) для атома аргона при температурах 100°C, 200°C и 500°C.
Используя результаты задачи 4.1, вычислите среднеквадратичную скорость атома водорода при этих температурах.
Используйте уравнения [4.18.2] и [4.18.3] для расчета разности теплоемкостей по уравнению [4.18.1] для модели Дитеричи для реального газа, заданного уравнением [4.26.2] . Чем этот результат отличается от результата для газа Ван-дер-Ваальса, уравнение [4.18.9]? При каких условиях эти два выражения равны?
Из неравенства, данного уравнением [4.16.5], показать, что теплоемкость при постоянном объеме C V должна быть положительной.
Рассмотрим кубический ящик с длиной одной стороны 1 см. Пусть среднеквадратичная скорость служит мерой средней скорости. (Эти две величины не являются строго равными, так что это приближение.) Далее предположим, что траектория частицы находится только в одном измерении, скажем, в x-измерении. Рассчитайте, сколько раз атом аргона сталкивается со стенкой за 1 с, если температура равна 100°C.
Пусть среднеквадратичная скорость служит мерой средней скорости. (Эти две величины не являются строго равными, так что это приближение.) Далее предположим, что траектория частицы находится только в одном измерении, скажем, в x-измерении. Рассчитайте, сколько раз атом аргона сталкивается со стенкой за 1 с, если температура равна 100°C.
Рассмотрим ту же ситуацию, что и в задаче 4.5. Пусть теперь атом аргона движется в двух измерениях в плоскости, параллельной одной стороне коробки. Предположим, что теперь атомы аргона сталкиваются точно в центре четырех удерживающих стенок. Сколько столкновений претерпит этот атом аргона за 1 с при температуре 100°С?
Рассмотрим геометрию моделей столкновений в задачах 4.5 и 4.6. Одинаково ли давление, оказываемое на каждую сторону двух путей, или разное? Подтвердите свой ответ с помощью геометрического доказательства.
Расширьте разложение газа Ван-дер-Ваальса по степеням за квадратичный член в числовой плотности (см. уравнение [4.11.4]), а именно,
уравнение [4.11.4]), а именно,
∑n=3∞Bn(T) ρn−1
Приведите выражение для этого суммирования в замкнутой форме.Разложите уравнение Дитеричи для реального газа (см. уравнение [4.26.2]) до первой степени плотности. Сравните это выражение с уравнениями Ван-дер-Ваальса (ср. уравнение [4.11.1]) и Бертело (ср.Уравнение [4.26.1]). Определите «эквивалентные» параметры Ван-дер-Ваальса для уравнений Дитеричи и Бертло. Обсудите «поправки» к модели Ван-дер-Ваальса, которые пытаются внести эти эквивалентности.
Следуя процедуре, ведущей к уравнению [4.14.5], получите выражение для температуры Бойля, используя модель Бертело, уравнение [4.26.1]).
Постройте приведенный потенциал Леннарда-Джонса U(r)/4ε LJ как функцию приведенного расстояния r/σ LJ .Получите аналитическое выражение для положения минимума в этом приведенном потенциале.
Одним из приближений к форме потенциала Леннарда-Джонса является потенциал прямоугольной ямы, определяемый областями: U(r) = ∞ для 0 ≤ r < σ; U(r) = −ε при σ ≤ r ≤ τ; и U(r) = 0 для τ < r ≤ ∞, где τ — диапазон взаимодействия притяжения, а σ — радиус твердой сферы, как в модели Ван-дер-Ваальса. Нарисуйте этот потенциал прямоугольной ямы в терминах приведенного расстояния r/σ и сравните с приведенным потенциалом Леннарда-Джонса в задаче 4.11. Рассчитайте второй вириальный коэффициент B 2 (T) для потенциала прямоугольной ямы и сравните с выражением Ван-дер-Ваальса (см. уравнение [4.14.5]).
Нарисуйте этот потенциал прямоугольной ямы в терминах приведенного расстояния r/σ и сравните с приведенным потенциалом Леннарда-Джонса в задаче 4.11. Рассчитайте второй вириальный коэффициент B 2 (T) для потенциала прямоугольной ямы и сравните с выражением Ван-дер-Ваальса (см. уравнение [4.14.5]).
Рассчитайте C P − C V для газа Бертело.
Выражение для коэффициента активности для газа Ван-дер-Ваальса дано в уравнении [4.15.6]. Нанесите на график значение ln(γ 2 ) в диапазоне 0,5 < V 2 /V c < 2.0 для газообразного аргона, где V c рассчитывается по уравнению [4.21.3] с b = 0,0372 л/моль.
Получите выражение для коэффициента активности γ 2 для газа Дитеричи. Сравните это выражение с выражением для газа Ван-дер-Ваальса (см. уравнение [4.15.6]).
Коэффициент активности является мерой неидеального поведения реального газа. При интерпретации этой величины для взаимодействующих частиц неявно предполагается, что частицы газа не димеризуются и не образуют агрегатов более высокого порядка.Альтернативная интерпретация значения γ 2 < 1 состоит в том, что частицы газа ведут себя как идеальные частицы, но часть частиц образует димеры. Используйте выражение Ван-дер-Ваальса, чтобы получить значение γ 2 для одного моля азота при T = 150K и V 2 = 1 л, используя константы Ван-дер-Ваальса a = 1,4 л 2 атм/ моль 2 и b = 0,039 л/моль в расчетах. Если это значение коэффициента активности обусловлено димеризацией, рассчитайте процентную долю частиц азота, находящихся в димерной форме.
При интерпретации этой величины для взаимодействующих частиц неявно предполагается, что частицы газа не димеризуются и не образуют агрегатов более высокого порядка.Альтернативная интерпретация значения γ 2 < 1 состоит в том, что частицы газа ведут себя как идеальные частицы, но часть частиц образует димеры. Используйте выражение Ван-дер-Ваальса, чтобы получить значение γ 2 для одного моля азота при T = 150K и V 2 = 1 л, используя константы Ван-дер-Ваальса a = 1,4 л 2 атм/ моль 2 и b = 0,039 л/моль в расчетах. Если это значение коэффициента активности обусловлено димеризацией, рассчитайте процентную долю частиц азота, находящихся в димерной форме.
В следующей таблице приведены температуры инверсии Джоуля-Томсона для азота при различных давлениях [из Glasstone, S., 1947. Термодинамика для химиков , van Nostrand Company, Inc. 173]
| P (ATM) | ||
|---|---|---|
| 1 | ||
| 9 | ||
| 20 | 330 | −167 |
| 60 | 299. | 6 -162,4 |
| 100 | 277,2 -156,5 | |
| 180 235 | ||
| 220 | 212,5 -117,2 | |
| 300 | 158,7 | −68,7 |
Нанесите эти данные на график и сравните с выражением Ван-дер-Ваальса для температуры инверсии Джоуля–Кельвина, используя значения .039 л/моль в расчетах. Определите области похолодания и потепления.
Критические параметры для криптона (Kr): T c = 209K, V c = 92,08 см3/моль, а P c X 8 = 45 ат. c = 289,9 К, V c = 118,8 см3/моль и P c = 58,2 атм. Используйте сокращенное уравнение состояния, чтобы показать, что кривые P – V совпадают в диапазоне давлений 1 атм < P < 100 атм для одного моля каждого газа при T = 298K.
В уравнении Ван-дер-Ваальса член давления имеет дополнительный член, a n 2 /V 2 , предположительно для поправки на парные взаимодействия.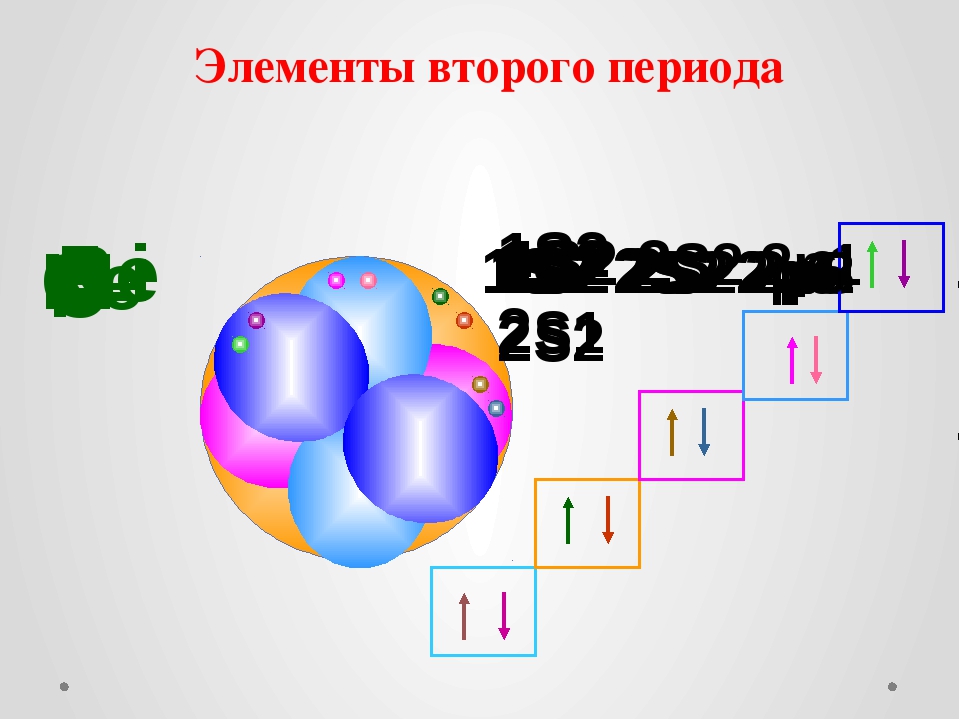 Однако V здесь – это общий объем контейнера. Напротив, «свободный объем» представляет собой общий объем с поправкой на исключенный объем частиц конечного размера, V − n b . Почему в поправке на давление используется n/V вместо термина n/(V − n b )?
Однако V здесь – это общий объем контейнера. Напротив, «свободный объем» представляет собой общий объем с поправкой на исключенный объем частиц конечного размера, V − n b . Почему в поправке на давление используется n/V вместо термина n/(V − n b )?
Предположим, что уравнение газа является модификацией выражения Ван-дер-Ваальса с поправкой, предложенной в задаче 4.19,
(p+an2(V−nb)2)(V−nb)=nRT
Как меняет ли эта модификация выражение произведения? Сравните с уравнением [4.13.1]. Получите выражение для второго вириального коэффициента, используя процедуру, ведущую к уравнению [4.11.5].
Следующие данные относятся к газообразному состоянию одного моля нормального пентана.
| Т (° С) | 47,76 | 91,41 | 124,71 | 163,16 | 193,16 | 195,36 | 197,11 |
| В (л) | 16,8 | 5,26 | 2,582 | 1,137 | 0,493 | 0,432 | 0,311 |
| Р (мм) | 1 110 | 3701 | 7402 | 14803 | 23685 | 24425 | 25100 |
критические параметры для нормальный пентан: P c = 33. 04 атм; T c = 470,3 К; и V c = 0,3102 л/моль. Сравните приведенные выше данные с предсказаниями давления, основанными на уравнении Ван-дер-Ваальса.
04 атм; T c = 470,3 К; и V c = 0,3102 л/моль. Сравните приведенные выше данные с предсказаниями давления, основанными на уравнении Ван-дер-Ваальса.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.

- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.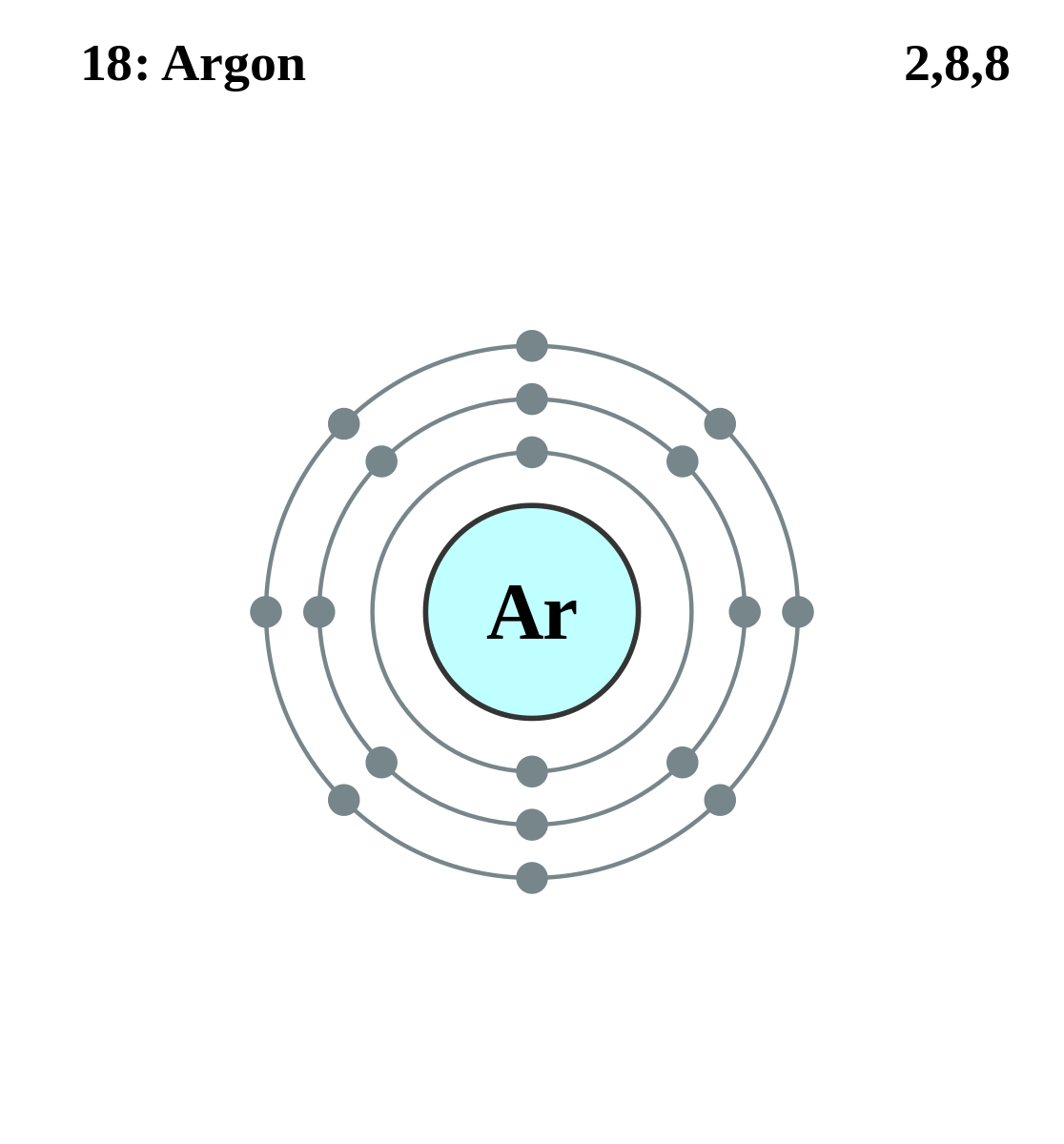
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Стабильные соединения лития и аргона под высоким давлением
Рясянен, М. Аргон из воздуха. Нац. Комм. 6, 82 (2014).
Google Scholar
Хьюи, Дж.Э., Кейтер, Э.А., Кейтер, Р.Л. и Медхи, О.К. Неорганическая химия: принципы строения и реакционной способности. Харпер и Роу: Нью-Йорк (1983).
Харпер и Роу: Нью-Йорк (1983).
Bartlett, N. Гексафторплатинат(V) ксенона Xe + [PtF6] − . проц. хим. соц. 218 (1962).
Graham, L., Graudejus, O., Jha, N.K. & Bartlett, N. О природе XePtF6. Координ. хим. Ред. 197, 321–334 (2000).
КАС Статья Google Scholar
Френкинг, Г.и Кремер, Д. Химия элементов благородных газов гелия, неона и аргона – экспериментальные факты и теоретические предсказания. Структура Склеивание 73, 17–95 (1990).
КАС Статья Google Scholar
Grochala, W. Типичные соединения газов, которые были названы «благородными». хим. соц. 36, 1632–1655 (2007).
КАС Статья Google Scholar
Хрящев Л., Петтерссон, М., Рунеберг, Н., Лунделл, Дж. и Расанен, М., Стабильное соединение аргона. Природа 406, 874–876 (2000).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Рунеберг Н., Петтерссон М., Хрящев Л., Лунделл Дж. и Расанен М. Теоретическое исследование HArF, недавно обнаруженного нейтрального соединения аргона. Дж. Хим. физ. 114, 836–841 (2001).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Петтерссон, М., Лунделл, Дж. и Расанен, М. Нейтральный инертный газ, содержащий молекулы с переносом заряда в твердых матрицах I: HXeCl, HXeBr, HXeI и HKrCl в Kr и Xe. Дж. Хим. физ. 102, 6423–6431 (1995).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Вонг, М. В. Прогноз метастабильного соединения гелия: HHeF. Варенье. хим. соц. 122, 6289–6290 (2000).
КАС Статья Google Scholar
Коэн, А., Лунделл, Дж. И Гербер, Р.Б. Первые соединения с химическими связями аргон-углерод и аргон-кремний. Дж. Хим. физ. 119, 6415–6417 (2003).
Дж. Хим. физ. 119, 6415–6417 (2003).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Wang, Q. & Wang, X. Инфракрасные спектры NgBeS (Ng=Ne, Ar, Kr, Xe) и BeS2 в матрицах благородных газов. Дж. Физ. хим. А 117, 1508–1513 (2013).
КАС Статья Google Scholar
Ван, Х., Эндрюс Л., Брози Ф. и Ридель С. Матричная инфракрасная спектроскопия и квантово-химические расчеты фторидов металлов для чеканки: сравнение ArAuF, NeAuF и молекул MF2 и MF3. хим. Евро. Журнал 19, 1397–1409 (2013).
КАС Статья Google Scholar
Бейтс Д. Р., Кук С. Дж. и Смит Ф. Дж. Классическая теория столкновений с перегруппировкой ионов и молекул при высоких энергиях удара. проц. физ. соц. 83, 49–57 (1964).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Giese, C. F. & Maier, W.B. Энергетическая зависимость поперечных сечений ионно-молекулярных реакций. Перенос атомов водорода и ионов водорода. Дж. Хим. физ. 39, 739–748 (1963).
F. & Maier, W.B. Энергетическая зависимость поперечных сечений ионно-молекулярных реакций. Перенос атомов водорода и ионов водорода. Дж. Хим. физ. 39, 739–748 (1963).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Антониотти П., Бороччи С., Бронзолино Н., Чекки П. и Грандинетти Ф.Анионы благородных газов: теоретическое исследование FNgBN – (Ng = He-Xe). Дж. Физ. хим. А, 111, 10144–10151 (2007).
КАС Статья Google Scholar
Шарек П. и Грочала В. Моноксиды благородных газов, стабилизированные в диполярной полости: теоретическое исследование. Дж. Физ. хим. А 119, 2483–2489 (2015).
КАС Статья Google Scholar
Грочала, В.Метастабильная связь He–O внутри сегнетоэлектрической молекулярной полости: (HeO)(LiF)2 . физ. хим. хим. физ. 14, 14860–14868 (2012).
КАС Статья Google Scholar
Ли, Т. Х., Моу, С. Х., Чен, Х. Р. и Ху, В. П. Теоретический прогноз содержания благородных газов, содержащих анионы FNgO – (Ng = He, Ar и Kr). Варенье. хим. соц. 127, 9241–9245 (2005).
Х., Моу, С. Х., Чен, Х. Р. и Ху, В. П. Теоретический прогноз содержания благородных газов, содержащих анионы FNgO – (Ng = He, Ar и Kr). Варенье. хим. соц. 127, 9241–9245 (2005).
Артикул Google Scholar
Ланделл, Дж., Räsänen, M. & Kunttu, H. Предсказанная структура, спектры и стабильность ArHX + , KrHX + и XeHX + (X = Cl, Br или I), J. Mol. Структура 358, 159–165 (1995).
КАС Статья Google Scholar
Fridgen, TD & Parnis, JM Теория функционала плотности Исследование димеров инертных газов, связанных с протоном, Rg2H + и (RgHRg’) + (Rg=Ar, Kr, Xe): интерпретация экспериментальной матрицы изоляция инфракрасных данных.Дж. Хим. физ. 109, 2162–2168 (1998).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Fridgen, TD & Parnis, JM Матричная изоляция смесей Rg/Rg’/метанол с помощью электронной бомбардировки (Rg=Ar,Kr,Xe): инфракрасная характеристика Фурье-преобразования протонно-связанных димеров Kr2H + , Xe2H + , (ArHKr) + и (ArHXe) + в матрицах Ar и (KrHXe) + и Xe2H + в матрицах Kr. Дж. Хим. физ. 109, 2155–2161 (1998).
Дж. Хим. физ. 109, 2155–2161 (1998).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Lockyear, J. F. et al. Генерация дикатиона ArCF2 2+ , J. Phys. хим. лат. 1, 358-362 (2010).
КАС Статья Google Scholar
Лунделл, Дж. и Кунтту, Х. Структура, спектры и стабильность Ar2H + , Kr2H + и Xe2H + : эффективный подход к потенциальному ядру.Дж. Физ. хим. 96, 9774–9781 (1992).
КАС Статья Google Scholar
Френкинг Г., Кох В., Гаусс Дж. и Кремер Д. Стабильность и характер взаимодействий притяжения в HeBeO, NeBeO и ArBeO и сравнение с аналогами NgLiF, NgBN и NgLiH (Ng = He , Ар). Теоретическое исследование. Варенье. хим. соц. 110, 8007-8016 (1988).
КАС Статья Google Scholar
Герман А. , МакСорли А., Эшкрофт Н.В. и Хоффманн Р. От Уэйда-Мингоса до Зинтла-Клемма при 100 ГПа: бинарные соединения бора и лития. Варенье. хим. соц. 134, 18606–18618 (2012).
, МакСорли А., Эшкрофт Н.В. и Хоффманн Р. От Уэйда-Мингоса до Зинтла-Клемма при 100 ГПа: бинарные соединения бора и лития. Варенье. хим. соц. 134, 18606–18618 (2012).
КАС Статья Google Scholar
Пэн, Ф., Мяо, М.С., Ван, Х., Ли, К. и Ма, Ю.М. Прогноз соединений лития и бора под высоким давлением. Варенье. хим. соц. 134, 18599−18605 (2012).
КАС Статья Google Scholar
Колмогоров А.Н. и Куртароло С. Теоретическое исследование стабильности боридов металлов. физ. Ред. B 74, 224507 (2006).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Лазицкий А., Хемли Р. Дж., Пикетт В. Е. и Ю К. С. Структурное исследование LiB до 70 ГПа, Phys. Ред. Б, 82, 180102 (2010).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Даффи, Т. С., Хемли, Р. Дж. и Мао, Х.K. Уравнение состояния и прочности на сдвиг при многомегабарном давлении: оксид магния до 227 ГПа. физ. Преподобный Летт. 74, 1371–1374 (1995).
и Мао, Х.K. Уравнение состояния и прочности на сдвиг при многомегабарном давлении: оксид магния до 227 ГПа. физ. Преподобный Летт. 74, 1371–1374 (1995).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Чжу К., Оганов А. Р., Ляхов А. О. Новые стабильные соединения в системе Mg–O при высоком давлении. физ. хим. хим. физ. 15, 7696–7700 (2013).
КАС Статья Google Scholar
Донг, X.и другие. Стабильное соединение гелия и натрия при высоком давлении. Препринт на http://arxiv.org/abs/1309.3827 (2013 г.).
Zhang, W. W. et al. Неожиданные стабильные стехиометрии хлоридов натрия. Наука 342, 1502–1505 (2013).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Зурек Э., Хоффманн Р., Эшкрофт Н. В., Оганов А. Р. и Ляхов А. О. Немного лития делает много для водорода. проц.Натл. акад. науч. США 106, 17640–17643 (2009).
науч. США 106, 17640–17643 (2009).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Ван Х., Це Дж. С., Танака К., Иитака Т. и Ма Ю. М. Сверхпроводящий содалитоподобный клатрат гидрида кальция при высоких давлениях. проц. Натл. акад. науч. США 109, 6463–6466 (2012).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Miao, M.S. Цезий в высоких степенях окисления и как элемент p-блока.Нац. хим. 5, 846–852 (2013).
КАС Статья Google Scholar
Zhu, L., Liu, H.Y., Pickard, C.J., Zou, G.T. & Ma, Y.M. Реакции ксенона с железом и никелем предсказаны во внутреннем ядре Земли. Нац. хим. 6, 644–648 (2014).
КАС Статья Google Scholar
Miao, M.S. Анионы Xe в стабильных соединениях Mg–Xe: механизм отсутствия Xe в атмосфере Земли. Препринт на http://arxiv.org/abs/1309.0696 (2013 г.).
Препринт на http://arxiv.org/abs/1309.0696 (2013 г.).
Мяо, М.С. и Хоффманн, Р. Электриды высокого давления: прогнозирующая химическая и физическая теория. Акк. хим. Рез. 47, 1311–1317 (2014).
КАС Статья Google Scholar
Хант, М. Б., Рейндерс, П. Х. П. и Спрингфорд, М. Исследование эффекта де Хааза-ван Альфена на поверхности Ферми лития. J. Phys: Condens. Мэтт. 1, 6589–6602 (1989).
КАС ОБЪЯВЛЕНИЯ Google Scholar
Родригес-Прието, А., Бергара А., Силкин В. М. и Эченик П. М. Сложность и деформация поверхности Ферми в сжатом литии. физ. Ред. Б, 74, 172104-1-4 (2006).
Руссо Б., Се Ю., Ма Ю. М. и Бергара А. Экзотическое поведение легких щелочных металлов, лития и натрия при высоком давлении, Eur. физ. JB 81, 1–14 (2011).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Lv, J. , Wang, Y.C., Zhu, L. & Ma, Y.М. Предсказал новые фазы высокого давления лития. физ. Rev. Lett., 106, 015503-1-4 (2011).
, Wang, Y.C., Zhu, L. & Ma, Y.М. Предсказал новые фазы высокого давления лития. физ. Rev. Lett., 106, 015503-1-4 (2011).
Ван, Ю. К., Лв, Дж., Чжу, Л. и Ма, Ю. М. Прогнозирование кристаллической структуры с помощью оптимизации роя частиц. физ. Ред. Б, 82, 094116–094123 (2010).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Wang, Y.C., Lv, J., Zhu, L. & Ma, Y.M. CALYPSO: метод предсказания кристаллической структуры. вычисл. физ. коммун.183, 2063–2070 (2012).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Wittlinger, J., Fischer, R., Werner, S., Schneider, J. & Schulz, H. Исследование высоконапорного аргона под высоким давлением, Acta. Crystallographica B 53, 745–749 (1997).
Артикул Google Scholar
Пикард, С. Дж., Мартинес-Каналес, М. и Нидс, Р. Дж. Исследование теории функционала плотности фазы IV твердого водорода. Phys Rev B 85, 214114 (2012).
Phys Rev B 85, 214114 (2012).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Герман А., Эшкрофт Н. В. и Хоффманн Р. Изотопическая дифференциация и таяние подрешеток в плотном динамическом льду. Phys Rev B 88, 214113 (2013).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Путилин С. Н., Антипов Е. В., Чмайссем О. и Марецио М. Сверхпроводимость при 94 K в HaBa2CuO4+δ.Природа. 362, 226–267 (1993).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Исса, Д. и Дай, Дж. Л. Синтез цезия 18-краун-6: первый монокристаллический электрид? Варенье. хим. соц. 104, 3781–3782 (1982).
КАС Статья Google Scholar
Дай, Дж. Л. Электриды: ранние примеры квантового ограничения. Акк. хим. Рез. 42, 1564-1572 (2009).
КАС Статья Google Scholar
Бадер, Р. Атомы в молекулах: квантовая теория, Oxford University Press (1990).
Атомы в молекулах: квантовая теория, Oxford University Press (1990).
Мяо, М.С. и Хоффманн, Р. Электриды высокого давления: прогнозирующая химическая и физическая теория. Акк. хим. Рез. 47, 1311–1317 (2014).
КАС Статья Google Scholar
Джанноцци, П. и др. QUANTUM ESPRESSO: модульный программный проект с открытым исходным кодом для квантового моделирования материалов.Дж. Физ. Конденс. Мэтт. 21, 395502-1-19 (2009).
Миякава, М. и др. Сверхпроводимость в неорганическом электроде 12CaO·7Al2O3: e − . Варенье. хим. соц. 129, 7270–7271 (2007).
КАС Статья Google Scholar
Кресс, Г. и Жубер, Дж. От ультрамягких псевдопотенциалов к проекторному методу дополненной волны. физ. Rev. B, 59, 1758–1774 (1999).
КАС ОБЪЯВЛЕНИЯ Статья Google Scholar
Монкхорст, Х. J. & Pack, JD Специальные точки для интеграции зоны Бриллюэна. физ. Rev. B, 13, 5188-5192 (1976).
J. & Pack, JD Специальные точки для интеграции зоны Бриллюэна. физ. Rev. B, 13, 5188-5192 (1976).
ОБЪЯВЛЕНИЕ MathSciNet Статья Google Scholar
Того, А., Оба, Ф. и Танака, И. Расчеты из первых принципов ферроэластичного перехода между SiO2 типа рутила и типа CaCl2 при высоких давлениях. физ. Ред. Б, 78, 134106 (2008).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Элемент Аргон — Атом Аргона
| Общие | |
|---|---|
| Имя, символ, номер | аргон, Ar, 18 |
| Химическая серия | инертные газы |
| Группа, период, блок | 18 (VIIIA), 3, с |
| Плотность, твердость | 1. 784 кг/м 3 (273 К) , NA 784 кг/м 3 (273 К) , NA |
| Внешний вид | Бесцветный |
| Атомные свойства | |
| Атомный вес | 39,948 а.е.м. |
| Атомный радиус (расч.) | нет данных (19:00) |
| Ковалентный радиус | 97 вечера |
| Радиус Ван-дер-Ваальса | 188 вечера |
| Электронная конфигурация | [Ne]3s 2 3p 6 |
| e – на уровень энергии | 2, 8, 8 |
| Степени окисления (оксид) | 0 (неизвестно) |
| Кристаллическая структура | кубический центрированный по граням |
| Физические свойства | |
| Состояние вещества | газовый (немагнитный) |
| Температура плавления | 83. 8 К (“308,7 F) 8 К (“308,7 F) |
| Точка кипения | 87,3 К (302,4 F) |
| Молярный объем | 22,56 10 -6 м 3 /моль |
| Теплота парообразования | 6,447 кДж/моль |
| Теплота плавления | 1.188 кДж/моль |
| Давление пара | нет данных |
| Скорость звука | 319 м/с при 293,15 К |
| Разное | |
| Электроотрицательность | нет данных (шкала Полинга) |
| Удельная теплоемкость | 520 Дж/(кг*К) |
| Электропроводность | нет данных |
| Теплопроводность | 0. 01772 Вт/(м*К) 01772 Вт/(м*К) |
| 1 st потенциал ионизации | 1520,6 кДж/моль |
| 2 nd потенциал ионизации | 2665,8 кДж/моль |
| 3 rd потенциал ионизации | 3931 кДж/моль |
| 4 -й потенциал ионизации | 5771 кДж/моль |
| 5 -й потенциал ионизации | 7238 кДж/моль |
| 6 -й потенциал ионизации | 8781 кДж/моль |
| 7 -й потенциал ионизации | 11995 кДж/моль |
| 8 -й потенциал ионизации | 13842 кДж/моль |
СИ
единицы и STP используются, если не указано иное. | |
Аргон — химический элемент в периодической таблице, который имеет символ Ar и атомный номер 18. Третий благородный газ в периоде 8, аргон составляет около 1% атмосферы Земли.
Примечательные характеристики
Аргон растворим в воде в 2,5 раза лучше, чем азот, что примерно равно растворимость в виде кислорода.Этот химически инертный элемент не имеет цвета и запаха. как в жидком, так и в газообразном виде. Нет известных истинных химические соединения, содержащие аргон. Создание аргона гидрофторида (HArF) сообщили исследователи из Университета Хельсинки в 2000 году. Сообщалось о крайне нестабильном соединении с фтором, но это еще не доказано. Несмотря на то что
химические соединения аргона в настоящее время не подтверждены, аргон
может образовывать клатраты с водой, когда ее атомы захвачены
в решетке молекул воды.
Несмотря на то что
химические соединения аргона в настоящее время не подтверждены, аргон
может образовывать клатраты с водой, когда ее атомы захвачены
в решетке молекул воды.Приложения
Используется в освещении, так как не вступает в реакцию с нить накаливания в лампочке даже при высоких температурах и другие случаи, когда двухатомный азот является непригодным (полу)инертным газ. Другое использование;
- Используется в качестве защиты от инертного газа во многих видах сварки, включая миг и тиг (где “ I ” означает инертный).
- в качестве нереакционноспособного мата при производстве титана и другие реактивные элементы.
- в качестве защитной атмосферы для выращивания кремния и германия
кристаллы.

- Аргон-39 использовался для ряда применений, прежде всего ледяной керн. Он также использовался для земли водные знакомства.
Аргон также используется в техническом подводном плавании с аквалангом для надувания сухой костюм из-за его нереактивного теплоизолирующего эффекта.
История
ПодозревалсяАргон (греч. argos , что означает «ленивый»). присутствовать в воздухе Генри Кавендиша в 1785 году, но был не обнаружен до 1894 года лордом Рэлеем и сэром Уильямом. Рамзи.
Возникновение
Этот газ выделяют с помощью жидкостного фракционирования воздуха, поскольку
атмосфера содержит только 0. 94% объема аргона (1,29%
масса). Марсианская атмосфера, напротив, содержит 1,6%
Ar-40 и 5 мд Ar-36.
94% объема аргона (1,29%
масса). Марсианская атмосфера, напротив, содержит 1,6%
Ar-40 и 5 мд Ar-36.
Изотопы
Основными изотопами аргона, встречающимися на Земле, являются Ar-40, Ar-36, и Ар-38. Встречающийся в природе К-40 с периодом полураспада 1,250 x 10 9 лет, распадается до стабильного Ar-40 (11,2%) захватом электронов и испусканием позитронов, а также распадом до стабильного Ca-40 (88.8%) за счет негатронного излучения. Эти свойства и коэффициенты используются для определения возраста горных пород.
В атмосфере Земли Ar-39 производится космическими лучами
активность, в первую очередь с Ар-40. В подземной среде,
он также производится путем захвата нейтронов К-39 или альфа
эмиссия кальцием. Аргон-37 создается из распада
кальция-40 в результате подземных ядерных взрывов.Период полувыведения составляет 35 дней.
Аргон-37 создается из распада
кальция-40 в результате подземных ядерных взрывов.Период полувыведения составляет 35 дней.
Артикул
Электронная конфигурация атомов
Электронная конфигурация атомов
Электронная конфигурация атома описывает распределение его электронов на атомных орбиталях, упорядоченных по энергетическим уровням орбиталей. Самая простая конфигурация для водорода: 1s 1 . Верхний индекс показывает, что на 1s-орбитали находится один электрон.
В периодической таблице после гелия (He) электронная конфигурация каждого элемента показана в сокращенной форме, которая начинается с предшествующего ему символа инертного газа. Например, сокращенная конфигурация для неона: [He] 2s 2 2p 6 . Конфигурация для гелия [He]: 1s 2 .
Таким образом, подстановка конфига He дает полный конфиг Neon: 1s 2 2s 2 2p 6
Например, для калия (K) (атомный номер 19) предшествующим инертным газом является аргон (Ar) (атомный номер 18). Таким образом, для калия показана конфигурация [Ar]4s 1 (см. таблицу ниже).
Таким образом, для калия показана конфигурация [Ar]4s 1 (см. таблицу ниже).
Атом калия (К) имеет 19 электронов. Полная электронная конфигурация калия (K): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 .
Сокращенная форма – [Ar]4s 1 – означает электронную конфигурацию аргона (Ar), плюс один электрон на 4s-орбитали. Аргон имеет 18 электронов. Одна дополнительная электронная конфигурация завершает картину для 19 электронов калия.
Обратите внимание, что в электронной конфигурации как K, так и Ca орбиталь 4s заполняется до орбитали 3d. Причина этого в том, что энергетический уровень орбитали 4s немного ниже, чем у орбитали 3d. Следовательно, орбиталь 4s заполнена электронами раньше, чем орбиталь 3d.
| Главный энергетический уровень Квантовое число: n | Доступные подуровни Квантовое число: l |
|---|---|
| 1 2 3 4 5 16 | 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5g 6s 6p 6d 6f 6g 6h |
Начиная со скандия (Sc, атомный номер 21), 3d-орбиталь имеет более низкую энергию, чем 4s. Таким образом, электронная конфигурация Sc имеет вид [Ar] 3d 1 4s 2 . Для объяснения этих аспектов см. ссылку Schwarz, указанную ниже.
Таким образом, электронная конфигурация Sc имеет вид [Ar] 3d 1 4s 2 . Для объяснения этих аспектов см. ссылку Schwarz, указанную ниже.
В таблице ниже показаны полные формы электронных конфигураций благородных газов.
| № | А. вес | Имя | Символ | Группа | Электронная конфигурация | |
|---|---|---|---|---|---|---|
| 2 | 4.003 | HELII | HE | 18 | 1S 2 | 9 | Neon | NE | 18 | 1S 2 2S 2 2P 6 1 0| 18 | 39,948 | Аргон | Ar | 18 | 1s 2 2s 2 2p 6 3s 2 3p 6 | 36 | 83. |  800 800 Криптон | Кр | 18 | 18 | 0 1S 2 2S 2 2P 6 3S 2 3P 2 3P 6 3D 10 4S 2 4P 6 4P 6 54 | 131.293 | XENON | XE | XE | 18 | 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 6 4D 10 5s 2 5P 6 | 86 | 222.000 | RADON | RN | 18 | 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4 2 4P 6 4D 10 5S 2 5S 2 5P 6 5F 14 5D 10 6S 2 6P 2 6P 6 | |
Собели и определения:
№- Атомный номер: Количество протонов в атоме. Каждый элемент однозначно определяется своим атомным номером.
Каждый элемент однозначно определяется своим атомным номером.
Атомная масса: Масса атома в первую очередь определяется количеством протонов и нейтронов в его ядре. Атомная масса измеряется в единицах атомной массы (а.е.м.), которые масштабируются по отношению к углероду, 12 C, который считается стандартным элементом с атомной массой 12. Этот изотоп углерода имеет 6 протонов и 6 нейтронов. Таким образом, каждый протон и каждый нейтрон имеют массу около 1 а.е.м.
Артикул
Шварц Э. В. Полная история электронных конфигураций переходных элементов. Журнал химического образования (2010) 87 (4) 444-448. https://doi.org/10.1021/ed8001286
См. также: Орбитрон: Галерея атомных орбиталей и несколько молекулярных орбиталей
.


