Строение атома и электронные конфигурации 2.0
На этой странице вы узнаете- Какой паспорт у атомов?
- Что общего у электронов и студентов?
Всё, что окружает нас в повседневной жизни имеет сложное строение: от чайника на плите до улиц города. Не менее сложным строением обладает и крохотный атом. В этой статье поговорим о его электронных конфигурациях.
Общее об атомеВспомним самую важную информацию об атоме.
Долгое время ученые не могли выяснить, из чего состоит атом. Впоследствии было установлено, что атом состоит из элементарных частиц: протонов, нейтронов и электронов.
Чтобы объяснить расположение элементарных частиц была предложена планетарная модель атома. Она гласит следующее: вокруг каждого ядра находятся электроны, которые располагаются вокруг него определенным образом, как и планеты вокруг Солнца. Подробнее о строении атома можно почитать в статье «Строение атома и электронные конфигурации 1. 0».
0».
В это статье мы сфокусируемся на электронах в атоме.
Валентные и неспаренные электроныПоследний энергетический уровень называют внешним. На нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
| Неспаренными называют электроны, которые находятся по одиночке в квантовых ячейках. При этом они тоже являются валентными электронами, то есть могут участвовать в образовании химических связей с другими элементами. Таким образом, можно сказать, что неспаренные и валентные электроны — близкие родственники: похожи, но не одинаковы. |
Сравним, какая же связь существует между валентными и неспаренными электронами. При образовании химической связи возможны два механизма: обменный и донорно-акцепторный. Более распространен обменный механизм, благодаря которому атомы выделяют по одному электрону на внешнем электронном уровне и образуют “коннекшн” (общую электронную пару).
Из этого следует правило:
| Все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными. |
У каждого атома или иона есть “паспорт” расположения электронов по энергетическим уровням. Такой паспорт называется электронной конфигурацией.
Электронная конфигурация — это формула, отражающая распределение электронов по электронным оболочкам атома.
| Что общего у электронов и студентов? Пусть электрон — это студент. А где обычно живут студенты? В общаге! Давайте нарисуем общежитие для электронов: — В нём есть отдельные комнаты — максимум 2 электрона. |
Более подробно про расположение электронов можно почитать в статье «Особенности строения электронных оболочек атомов элементов». .
Электронную конфигурацию ионов можно написать по тем же правилам, что и электронную конфигурацию атомов, только при этом нужно учитывать, какой заряд (положительный или отрицательный) у частицы.
Если атом принимает электроны, то он становится анионом, если отдаёт электроны – то катионом.
Атом может отдать или принять электроны таким образом, чтобы внешний энергетический уровень был максимально заполнен, так как это энергетически выгодно. Полностью заполненный подуровень является очень устойчивым — такую конфигурацию имеют все благородные газы, и к ней стремятся ионы.
Рассмотрим пример с образованием сульфид-аниона S2-.
- 3 энергетический уровень является внешним для атома серы, на нем располагается 6 электронов, 2 из которых являются неспаренными.

- К этим электронам могут добавиться два “соседа”, благодаря которым p-подуровень заполняется полностью и обретает стабильную конфигурацию.
- Так как каждый из электронов имеет заряд (-1), то суммарно после их присоединения к сере образуется сульфид-анион S2-
- Электроны заполняются определенным образом на энергетических уровнях вокруг атома.
- Электронная конфигурация помогает нам узнать, на каком уровне и подуровне располагается определенное число электронов.
- Если к нейтральному атому добавить электроны, то он превращается в анион, если же отобрать электроны — образуется катион.
- Атом стремится обладать наиболее устойчивой электронной конфигурацией, при которой энергетический уровень/подуровень является заполненным.
Задание 1.
Внешним энергетическим уровнем называется :
- Первый энергетический уровень
- Последний энергетический уровень
- Энергетический уровень с наименьшей энергией
Задание 2.
Максимальное число электронов на внешнем энергетическом уровне равно:
- 5
- 6
- 7
- 8
Задание 3.
Количество валентных электронов, в большинстве случаев, равно:
- Номеру группы
- Номеру периода
- Порядковому номеру элемента
- Массовому числу элемента
Задание 4.
Сколько электронов необходимо для заполнения энергетического уровня атома углерода?
- 2
- 3
- 4
- 5
Задание 5.
Электронной конфигурации какого благородного газа будет соответствовать электронная конфигурация хлорид-иона?
- Аргона
- Неона
- Криптона
- Ксенона
Ответы: 1. — 2; 2. — 4; 3. — 1; 4. — 3; 5. — 1.
Строение атома – материалы для подготовки к ЕГЭ по Химии
Автор статьи — профессиональный репетитор И. Давыдова (Юдина).
Давыдова (Юдина).
Атом – в переводе с древнегреческого – неделимый – это наименьшая частица химического элемента, являющаяся носителем его свойств. Современные представления о строении атома требуют для понимания знаний основ квантовой механики, поэтому мы ограничимся упрощенной моделью.
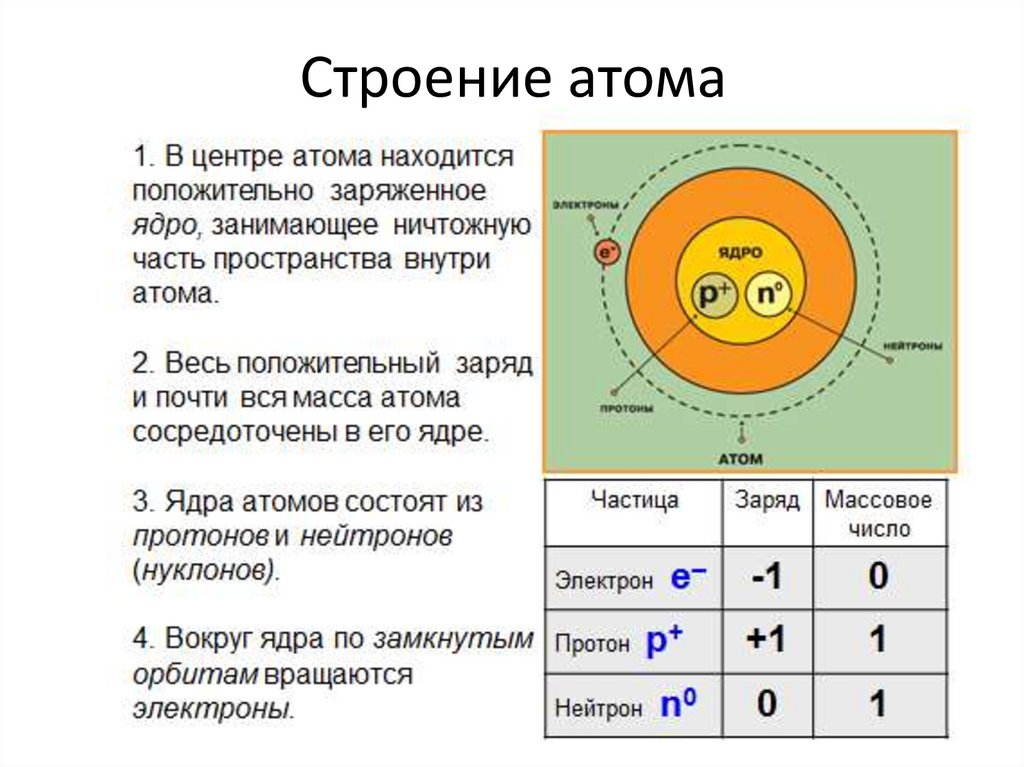
Атом состоит из ядра (в составе которого протоны и нейтроны) и электронов. Несмотря на то, что ядро составляет большую часть массы атома, оно очень мало.
| Заряд z | Масса m | |
| Протон p+ | +1 | 1 |
| Нейтрон n0 | 0 | 1 |
| Электрон e– | -1 | 0 |
Количество протонов равно количеству электронов и равно номеру атома в периодической таблице. Число нейтронов равно разности атомной массы и номера элемента.
Бор – пятый элемент периодической таблицы, в его атоме 5 протонов и 5 электронов.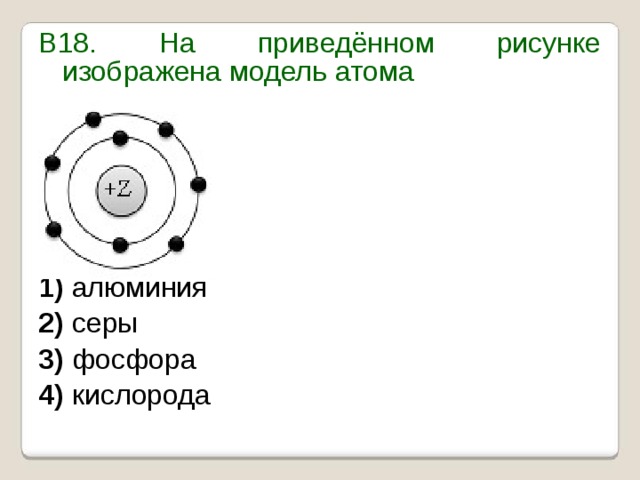 Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Атомная масса ≈ 11, количество нейтронов равно 11 – 5 = 6.
Элементы, имеющие одинаковое количество протонов в ядре, но различающиеся числом нейтронов, называются изотопами.
Например, 35Cl и 37Cl – изотопы, различающиеся атомной массой и количеством нейтронов.
| Число протонов | Число нейтронов | Число электронов | |
| 35Cl | 17 | 18 | 17 |
| 37Cl | 17 | 20 | 17 |
Вокруг ядра по различным траекториям – орбиталям движутся электроны. Каждой орбитали соответствует определенный уровень энергии, чем ближе орбиталь к ядру, тем меньшей энергией должен обладать электрон, чтобы находиться на ней.
Порядок заполнения орбиталей:
- Принцип наименьшей энергии: в первую очередь электроны заполняют наиболее низкие по энергии уровни (ближайшие к ядру).

Энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < Зs < Зр < 4s < 3d < 4р < 5s <4d < 5р < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈6d < 7p . (●)
| Число орбиталей на энергетическом уровне | Максимальное количество электронов на этих орбиталях | |
| s | 1 | 2 |
| p | 3 | 6 |
| d | 5 | 10 |
| f | 7 | 14 |
Перед оставшимися двумя принципами введем понятие спина электрона. Спин – характеристика самого электрона, представить его (это упрощенная модель, а ненастоящий физический смысл понятия спин!) можно как направление движения электрона вокруг своей оси: по или против часовой стрелки.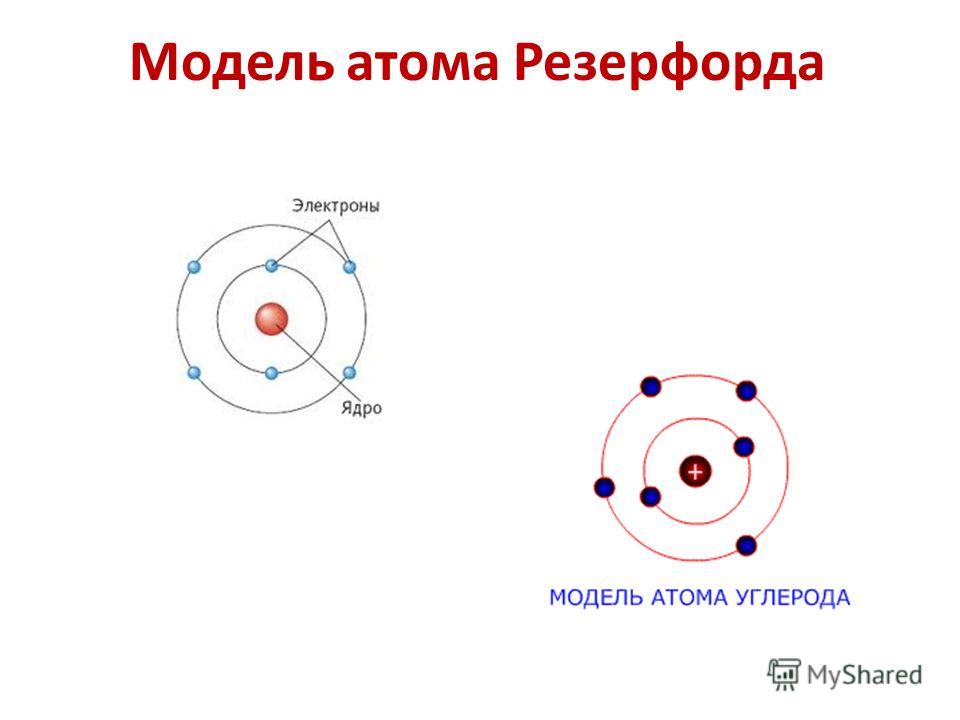
- Принцип Паули: на каждой орбитали может быть не более двух электронов, причем их спины должны быть различными.
- Правило Хунда: суммарный спин системы должен быть максимально возможным.
Рассмотрим заполнение орбиталей электронами на нескольких примерах. У каждого следующего элемента таблицы Менделеева на один протон и один электрон больше, чем у предыдущего. У элементов n-го периода заполнены предыдущие n-1 электронные уровни.
– магний – двенадцатый элемент, имеет по 12 протонов и электронов. Распределим эти электроны в соответствии с (●), не забывая, что на каждом подуровне может быть не более двух электронов.
Магний – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены – 1s22s22p6.Магний находится во второй группе, значит, на третьем уровне у него два электрона – 3s2. Итого получаем1s22s22p63s2.
Итого получаем1s22s22p63s2.
В атоме магния в основном состоянии нет неспаренных электронов.
Если атому сообщили дополнительную энергию (например, нагрели), то электронная пара может распарится и один из электронов переходит на свободную орбиталь того же энергетического уровня. В возбужденном состоянии атом магния имеет два неспаренных электрона и может образовать две связи (валентность II).
– фосфор – пятнадцатый элемент, распределяем 15 электронов: Фосфор – элемент третьего периода, следовательно, первый и второй энергетические уровни полностью заполнены – 1s22s22p6.Фосфор находится в пятой группе, значит, на третьем уровне у него пять электронов – 3s23p3. Итого получаем1s22s
В атоме фосфора в основном состоянии 3 неспаренных электрона. В возбужденном состоянии атом фосфора имеет пять неспаренных электронов и может образовать пять связей (валентность V).
– цирконий – сороковой элемент, распределяем 40 электронов. Цирконий – элемент пятого периода, следовательно, первые четыре энергетических уровня полностью заполнены – 1s22s22p63s23p64s23d104p6.Заполнение пятого уровня начинается с 5s
В атоме циркония в основном состоянии 2 неспаренных электрона.
В возбужденном состоянии цирконий имеет четыре неспаренных электрона.
Исключениями из общего порядка заполнения электронных подуровней являются хром, марганец, медь, серебро и золото – у них наблюдается «провал» электрона с внешного s – подуровня на предвнешний d. Например, электронные конфигурации хрома и меди вместо 4s
Задания для тренировки:
- Сколько протонов и электронов содержит ион NO2–
1) 46p, 46e
2) 23p, 24e
3) 23р, 23e
4) 46p, 47e - Чем отличаются изотопы одного и того же химического элемента?
1) Числом протонов
2) Числом электронов
3) Зарядом ядра
4) Массовым числом - Укажите атом, в котором больше всего электронов:
2) 40Аr
3) 41Ar
4) 39К - Изобразить электронно-графическую схему атома хлора в основном и всех возможных возбужденных состояниях. Какие валентности способен проявлять хлор?
- Объяснить, почему сера проявляет валентность VI, а кислород – не проявляет, хотя оба эти элемента содержат по 6 электронов на внешнем слое.
«Наивысшая музыкальность в области мысли». Теория Н. Бора о строении атомов и молекул
1547
Добавить в закладки
На становление квантовой теории повлияли многие ученые: Д. Максвелл, М. Планк, А. Эйнштейн и другие. По словам Луи де Бройля, «революцию в физике» произвел, в том числе Нильс Бор.
5 апреля 1913 года датский физик-теоретик Нильс Бор завершил научную статью «О строении атомов и молекул» и в июле опубликовал ее в «Философском журнале». Статья стала одной из самых известных работ в научном сообществе и определила дальнейшее развитие науки в XX веке. Спустя девять лет после публикации своей работы Нильс Бор получил Нобелевскую премию по физике.
Есть свидетельства, что Бор работал под руководством Эрнеста Резерфорда в лаборатории в Манчестере, где познакомился с теорией о планетарном строении атома. Бор понимал неточность и несовершенство версии Резерфорда, поэтому поставил перед собой задачу ответить на вопрос устойчивости планетарных атомов и найти законы, которые подтверждали бы это. Доказательства Бор нашел в спектральных формулах атома водорода, которые сформулировал Иоганн Бальмер.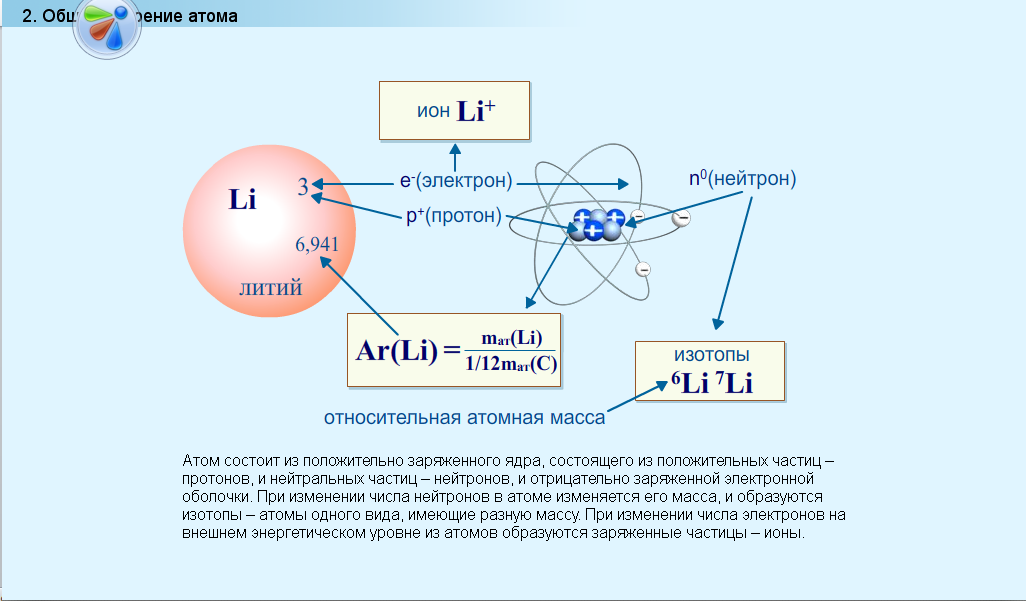
Планетарная модель атома Резерфорда
Источник: obrazovaka.ru
Боровская модель строения атома совместила в себе модель Эрнеста Резерфорда, который предполагал, что атом состоит из положительно заряженного ядра и электронов вокруг него, и гипотезу Макса Планка о квантовании энергии. Применение теории квантов Макса Планка считают главным достижением. Этим он впервые объяснил распределение спектральных линий в спектре водорода и в целом строение водородного атома.
Также в работе Бор утверждает, что атом может пребывать в стационарном состоянии и не излучать энергию.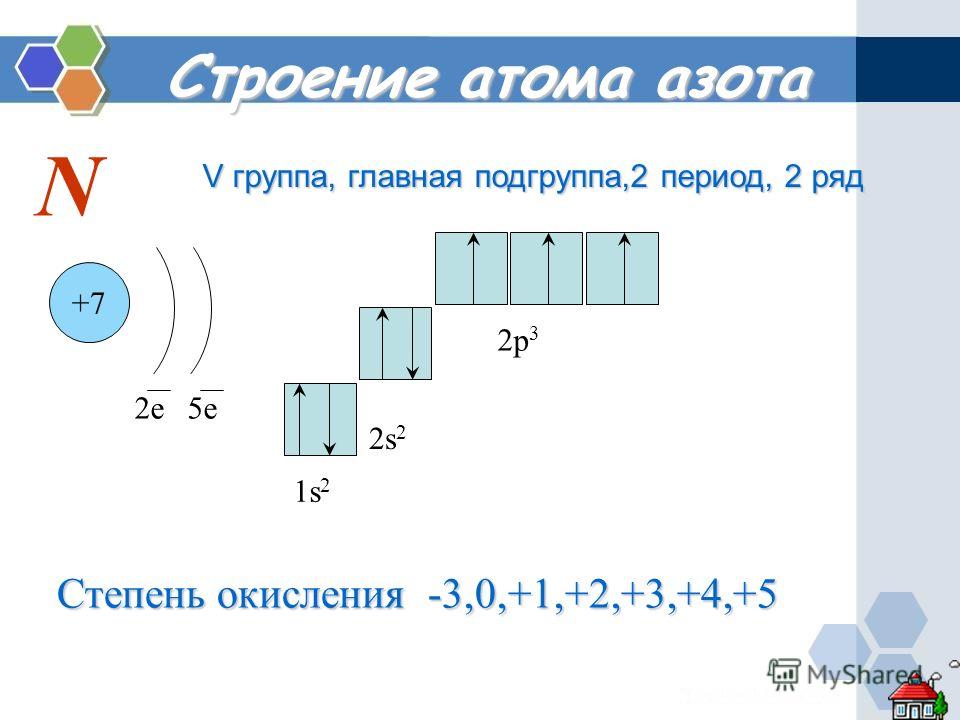 Однако при смене состояний происходит энергетическое излучение, равное разнице между энергиями состояний. Явление объясняется тем, что при равномерном движении тела по окружности механическая работа равна нулю. И это говорит о том, что частота излучаемого света никак не связана с частотой вращения электрона вокруг ядра.
Однако при смене состояний происходит энергетическое излучение, равное разнице между энергиями состояний. Явление объясняется тем, что при равномерном движении тела по окружности механическая работа равна нулю. И это говорит о том, что частота излучаемого света никак не связана с частотой вращения электрона вокруг ядра.
Несмотря на противоречия, которые Резерфорд увидел в этой теории, она успешно вошла в научный мир. Этому способствовали формулы, которые предложил Бор. По ним можно было теоретически вычислить диаметр атома водорода, частоту обращения электрона по основной орбите, значение постоянной Ридберга, от которой зависела частота в спектре атомов водорода, и среднее значение кинетической энергии электрона за одно полное обращение. Кроме того, Нильс Бор рассчитал спектр однократно ионизированного атома гелия. Это помогло подтвердить, что у атома есть стационарные энергетические состояния.
Нильс Бор
Источник: vokrugsveta.ru
Теория Бора легла в основу понимания переходов между энергетическими уровнями атомов и дала знания о наличии спектра у всех атомов и молекул. Высоко оценил теорию А. Эйнштейн: «Все мои попытки приспособить теоретические основы физики к этим результатам [то есть следствиям закона Планка для излучения черного тела] потерпели полную неудачу. Это было так, точно из-под ног ушла земля и нигде не было видно твердой почвы, на которой можно было бы строить. Мне всегда казалось чудом, что этой колеблющейся и полной противоречий основы оказалось достаточным, чтобы позволить Бору — человеку с гениальной интуицией и тонким чутьем — найти главные законы спектральных линий и электронных оболочек атомов, включая их значение для химии. Это мне кажется чудом и теперь. Это наивысшая музыкальность в области мысли».
Высоко оценил теорию А. Эйнштейн: «Все мои попытки приспособить теоретические основы физики к этим результатам [то есть следствиям закона Планка для излучения черного тела] потерпели полную неудачу. Это было так, точно из-под ног ушла земля и нигде не было видно твердой почвы, на которой можно было бы строить. Мне всегда казалось чудом, что этой колеблющейся и полной противоречий основы оказалось достаточным, чтобы позволить Бору — человеку с гениальной интуицией и тонким чутьем — найти главные законы спектральных линий и электронных оболочек атомов, включая их значение для химии. Это мне кажется чудом и теперь. Это наивысшая музыкальность в области мысли».
Материал подготовлен на основе открытых источников.
Фото на странице: vokrugsveta.ru
Фото на главной странице: indicator.ru
Автор Ольга Скибина
квантовая теория нильс бор строение атома
Информация предоставлена Информационным агентством “Научная Россия”. Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано
Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Экологи Пермского Политеха нашли способ снизить выбросы парниковых газов от цементных заводов
14:00 / Экология
Поздравляем академика Абела Гезевича Аганбегяна с юбилеем!
13:20 / История, Наука и общество, Экономика
Российская академия наук: три века в поисках знаний. «В мире науки» № 5-6
13:00 / История, Наука и общество
Томские студенты обнаружили большой средневековый могильник
12:00 / Археология
Согревающие волны СВЧ-печей изобретателя Перси Спенсера
10:00 / Наука и общество
Всероссийский фестиваль NAUKA 0+ стартовал в Москве
22:46 / Наглядный пример, Наука и общество, Экспертный разговор
Продолжительность светового дня влияет на уровень опиоидных рецепторов в бурой жировой ткани
19:48 / Биология
В Президентской академии обсудят научно-технологическое развитие России
19:00 / Наука и общество
Флагманские проекты телеканалов «Наука» и «Живая Планета» покажут на фестивале НАУКА 0+
18:30 / Наука и общество
Продолжается прием заявок в Акселератор Московского университета
18:00 / Наука и общество
Памяти великого ученого. Наука в глобальном мире. “Очевиднное – невероятное” эфир 10.05.2008
Наука в глобальном мире. “Очевиднное – невероятное” эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. “Очевидное – невероятное” эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
Смотреть все
2.1: Атомы, изотопы, ионы и молекулы – Обзор атомной структуры
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 12654
- Безграничный
- Безграничный
Цели обучения
- Обсудить электронные и структурные свойства атома
Атом — наименьшая единица вещества, сохраняющая все химические свойства элемента. Атомы объединяются, образуя молекулы, которые затем взаимодействуют, образуя твердые тела, газы или жидкости. Например, вода состоит из атомов водорода и кислорода, которые, объединившись, образуют молекулы воды. Многие биологические процессы посвящены расщеплению молекул на составные атомы, чтобы их можно было собрать в более полезную молекулу.
Атомы объединяются, образуя молекулы, которые затем взаимодействуют, образуя твердые тела, газы или жидкости. Например, вода состоит из атомов водорода и кислорода, которые, объединившись, образуют молекулы воды. Многие биологические процессы посвящены расщеплению молекул на составные атомы, чтобы их можно было собрать в более полезную молекулу.
Атомные частицы
Атомы состоят из трех основных частиц: протонов, электронов и нейтронов. Ядро (центр) атома содержит протоны (положительно заряженные) и нейтроны (без заряда). Самые внешние области атома называются электронными оболочками и содержат электроны (отрицательно заряженные). Атомы обладают различными свойствами в зависимости от расположения и количества их основных частиц.
Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Это можно определить, используя атомный номер и массовое число элемента (см. понятие об атомных числах и массовых числах).
Рисунок \(\PageIndex{1}\): Структура атома: Элементы, такие как гелий, изображенные здесь, состоят из атомов.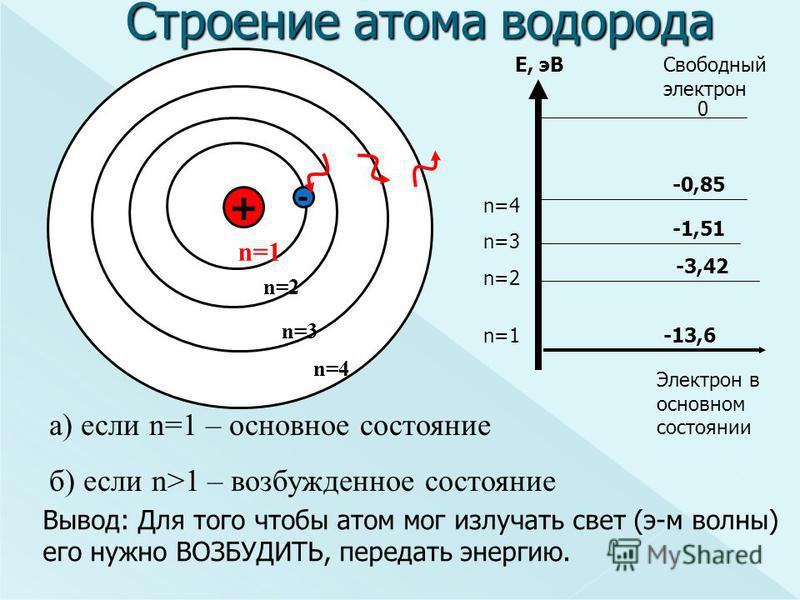 Атомы состоят из протонов и нейтронов, расположенных внутри ядра, с электронами на орбиталях, окружающих ядро.
Атомы состоят из протонов и нейтронов, расположенных внутри ядра, с электронами на орбиталях, окружающих ядро.Атомная масса
Протоны и нейтроны имеют примерно одинаковую массу, около 1,67 × 10 -24 граммов. Ученые определяют это количество массы как одну атомную единицу массы (аму) или один дальтон. Несмотря на то, что протоны имеют одинаковую массу, они заряжены положительно, а нейтроны заряда не имеют. Следовательно, количество нейтронов в атоме вносит значительный вклад в его массу, но не в его заряд.
Электроны намного меньше по массе, чем протоны, и весят всего 9,11 × 10 -28 граммов, или около 1/1800 атомной единицы массы. Следовательно, они не вносят большого вклада в общую атомную массу элемента. При рассмотрении атомной массы принято игнорировать массу любых электронов и вычислять массу атома, основываясь только на числе протонов и нейтронов.
Электроны вносят большой вклад в заряд атома, поскольку каждый электрон имеет отрицательный заряд, равный положительному заряду протона.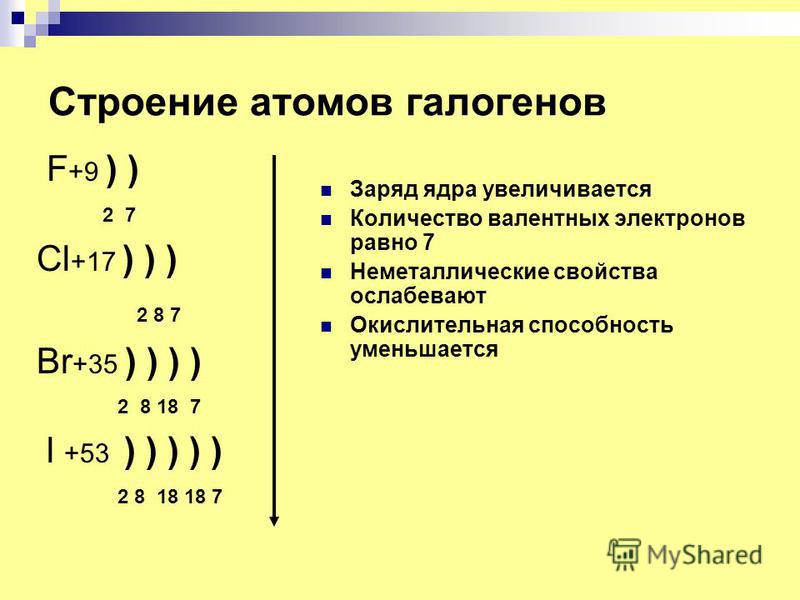 Ученые определяют эти заряды как «+1» и «-1». В незаряженном нейтральном атоме число электронов, вращающихся вокруг ядра, равно числу протонов внутри ядра. В этих атомах положительные и отрицательные заряды компенсируют друг друга, что приводит к атому без суммарного заряда.
Ученые определяют эти заряды как «+1» и «-1». В незаряженном нейтральном атоме число электронов, вращающихся вокруг ядра, равно числу протонов внутри ядра. В этих атомах положительные и отрицательные заряды компенсируют друг друга, что приводит к атому без суммарного заряда.
| Плата | Масса (а.е.м.) | Местоположение | |
|---|---|---|---|
| протон | +1 | 1 | ядро |
| нейтрон | 0 | 1 | ядер |
| электрон | -1 | 0 | орбиталей |
Изучение свойств электронов : Сравните поведение электронов с поведением других заряженных частиц, чтобы узнать свойства электронов, такие как заряд и масса.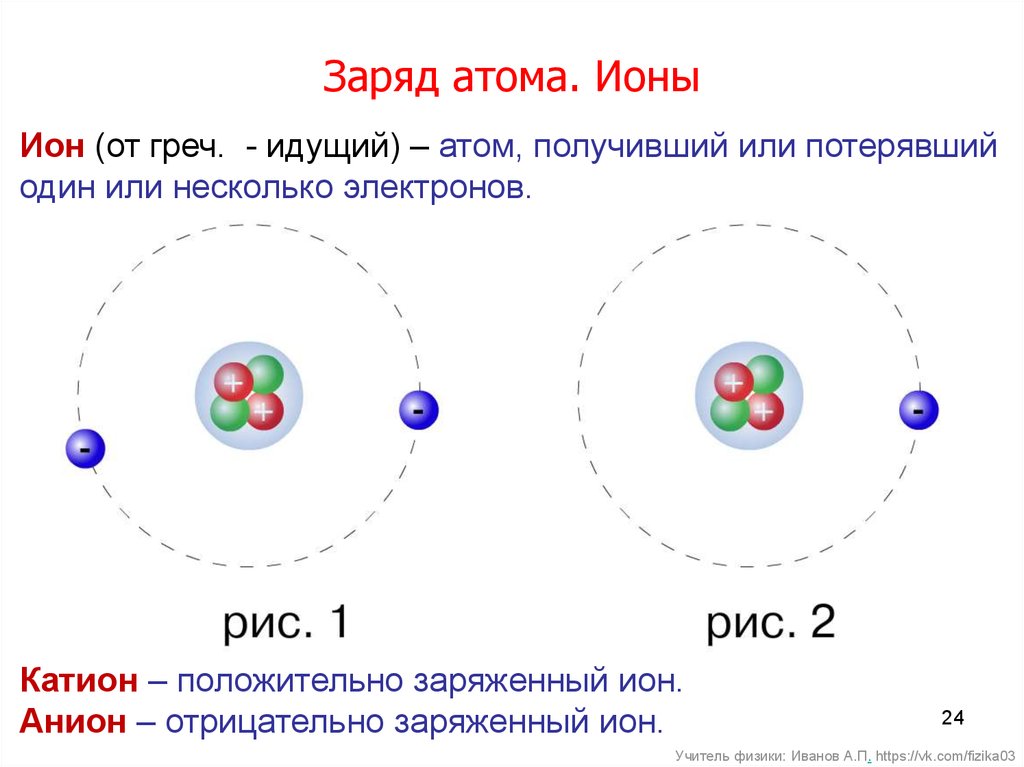
Объем атомов
Принимая во внимание размеры протонов, нейтронов и электронов, большая часть объема атома — более 99 процентов — фактически представляет собой пустое пространство. Несмотря на все это пустое пространство, твердые объекты не просто проходят друг через друга. Электроны, окружающие все атомы, заряжены отрицательно и заставляют атомы отталкиваться друг от друга, не позволяя атомам занимать одно и то же пространство. Эти межмолекулярные силы не позволяют вам провалиться сквозь такой объект, как ваш стул.
Интерактивный элемент
Интерактив: построй атом : построй атом из протонов, нейтронов и электронов и посмотри, как изменяются элементы, заряд и масса. Тогда сыграйте в игру, чтобы проверить свои идеи!
Ключевые моменты
- Атом состоит из двух областей: ядра, которое находится в центре атома и содержит протоны и нейтроны, и внешней области атома, которая удерживает электроны на орбите вокруг ядра.
- Протоны и нейтроны имеют примерно одинаковую массу, около 1,67 × 10-24 грамма, которую ученые определяют как одну атомную единицу массы (а.
 е.м.) или один дальтон.
е.м.) или один дальтон. - Каждый электрон имеет отрицательный заряд (-1), равный положительному заряду протона (+1).
- Нейтроны — это незаряженные частицы, находящиеся внутри ядра.
Ключевые термины
- атом : Наименьшее возможное количество вещества, которое все еще сохраняет свою идентичность как химический элемент, состоящий из ядра, окруженного электронами.
- протон : Положительно заряженная субатомная частица, входящая в состав ядра атома и определяющая атомный номер элемента. Он весит 1 а.е.м.
- нейтрон : Субатомная частица, входящая в состав ядра атома. У него нет заряда. По массе он равен протону или весит 1 а.е.м.
Эта страница под заголовком 2.1: Атомы, изотопы, ионы и молекулы — обзор атомной структуры распространяется по лицензии CC BY-SA 4.0 и была создана, изменена и/или курирована компанией Boundless.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Безграничный
- Количество столбцов печати
- Два
- Печать CSS
- Плотный
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать оглавление
- нет
- Теги

Атомная структура Определение и значение
- Основные определения
- Викторина
- Примеры
- Британский
Показывает уровень сложности слова.
Сохрани это слово!
Показывает уровень оценки в зависимости от сложности слова.
сущ. Физика.
структура атома, теоретически состоящая из положительно заряженного ядра, окруженного и нейтрализованного отрицательно заряженными электронами, вращающимися по орбитам на различных расстояниях от ядра, строение ядра и расположение электронов различаются у различных химических элементов.
ВИКТОРИНА
Сыграем ли мы «ДОЛЖЕН» ПРОТИВ. “ДОЛЖЕН” ВЫЗОВ?
Следует ли вам пройти этот тест на «должен» или «должен»? Это должно оказаться быстрым вызовом!
Вопрос 1 из 6
Какая форма обычно используется с другими глаголами для выражения намерения?
Происхождение атомной структуры
Впервые записано в 1895–1900 гг.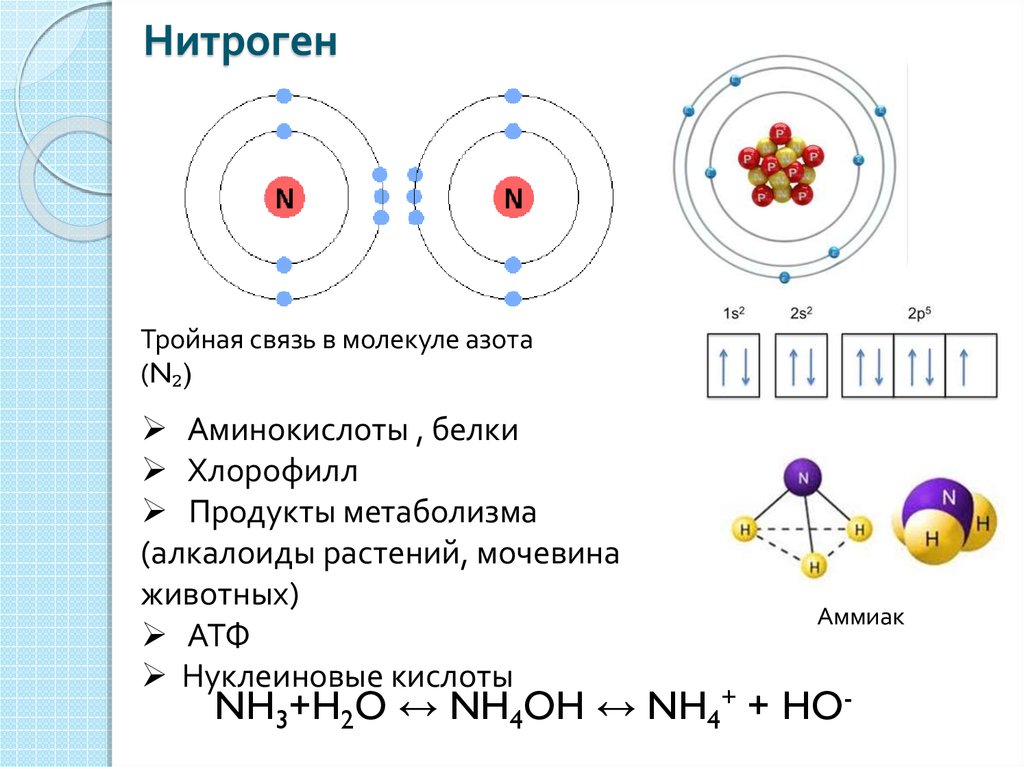
Слова рядом с атомной структурой
атомный номер, атомная куча, атомная сила, атомы, атомный спектр, атомная структура, атомная теория, атомный ветеран, атомный объем, атомный вес , атомизм
Dictionary.com Полный текст На основе Random House Unabridged Dictionary, © Random House, Inc. 2022
Как использовать атомарную структуру в предложении
«Он учится исключительно на атомной структуре, не используя никакой другой информации… и не делает предположений о том, какая структура особенности могут быть важны», — говорят авторы.
Глубокое обучение решает еще одну ключевую загадку биологии: структура РНК|Веер ракушек|31 августа 2021 г.|Центр Singularity
Итак, один из ключей к созданию материалов с худшими проводниками и лучшими изоляторами — изменение атомной структуры материала.
Худший проводник в мире может изменить правила игры в условиях климатического кризиса|Клэр Мальдарелли|23 июля 2021 г.|Popular-Science
Атомная структура графита не подходит для удержания жидкостей на месте, поэтому алмазы превращаются в графит, эти жидкости выделяются в виде газа.

Алмазы содержат остатки древней атмосферы Земли|Монро Хаммонд|20 июля 2021 г.|Popular-Science
И химические примеси, и атомная структура играют роль в цвете из-за того, как они изменяют спектр поглощения света минералом.
Как минералы и горные породы отражают радугу, светятся в темноте и поражают воображение|Лорен Леффер|28 июня 2021|Популярная наука
одетые модели, демонстрирующие последние достижения европейского минимализма.
Самый трагический призрак Нью-Йорка любит минималистскую шведскую моду|Нина Строхлич|8 января 2015 г.|DAILY BEAST
Черных американцев считают расой; другой — расизм как социальная структура.
Ни богов, ни копов, ни господ|Джеймс Пулос|1 января 2015|DAILY BEAST
Следуя этой цепочке рассуждений до ее логического завершения, путь к достижению мира во всем мире состоит в том, чтобы дать всем атомные бомбы.
Санта терпит неудачу еще раз|P. Дж.
 О’Рурк|27 декабря 2014 г.|DAILY BEAST
О’Рурк|27 декабря 2014 г.|DAILY BEASTЭто происходит не из-за плохих лидеров или поляризованной политики, а из-за того, что структура управления имеет фатальные недостатки.
Красная лента душит добрых самаритян|Филип К. Ховард|27 декабря 2014|DAILY BEAST
И структура аккордов для тех из вас, кто играет на музыкальных инструментах, неожиданна и заслуживает внимания.
Да, я люблю рождественскую музыку. Перестаньте смеяться.|Майкл Томаски|24 декабря 2014 г.|DAILY BEAST
Но жилище означает особый тип строения – здание, занимаемое человеком, – место, где он живет.
Ассимиляционная память|Маркус Дуайт Ларроу (он же профессор А. Луазетта)
Здание, похожее на мечеть значительных размеров, располагалось посреди манговой рощи.
Красный год|Луи Трейси
Не успел я наступить на хрупкую конструкцию, как она внезапно и необъяснимо рухнула посередине.
The Pit Town Coronet, Volume I (of 3)|Charles James Wills
Однако в обычной работе безопаснее основывать различие на размере, чем на структуре.

Руководство по клинической диагностике|Джеймс Кэмпбелл Тодд
Они сочетают фиксацию с процессом окрашивания и по-разному окрашивают каждую нормальную и аномальную структуру в крови.
Руководство по клинической диагностике|Джеймс Кэмпбелл Тодд
Определение атомной структуры из Британского словаря
атомная структура
сущ. количество электронов. Количество электронов равно количеству протонов: таким образом, вся сущность электрически нейтральна
Английский словарь Коллинза – полное и полное цифровое издание 2012 г. © William Collins Sons & Co. Ltd., 1979, 1986 © HarperCollins Издательства 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Структура атома
Структура атомаАтом и электромагнитное излучение
| Основные Субатомные частицы | Электромагнитный Радиация |
| Свет и другие формы электромагнитного излучения | |
Фундаментальный субатомный Частицы
| Частица | Символ | Платный | Масса | |
| электрон | е – | -1 | 0,0005486 а. е.м. е.м. | |
| протон | р + | +1 | 1.007276 а.е.м. | |
| нейтрон | нет или | 0 | 1.008665 аму | |
Число протонов, нейтронов и электронов в атоме можно определить из набора простых правила.
- Число протонов в ядре атома равно равно атомному номеру ( Z ).
- Число электронов в нейтральном атоме равно равно числу протонов.
- Массовое число атома ( M ) равно сумма числа протонов и нейтронов в ядро.
- Число нейтронов равно разности
между массовым числом атома ( M ) и
атомный номер ( Z ).

Примеры: Определим количество протонов, нейтронов, и электроны в следующих изотопах.
| 12 С | 13 С | 14 С | 14 Н |
Различные изотопы элемента идентифицируют, записывая массовое число атома в верхний левый угол символа элемента. 12 С, 13 C и 14 C изотопы углерода ( Z = 6) и, следовательно, содержат шесть протонов. Если атомы нейтральны, они также должны содержать шесть электронов. Единственный разница между этими изотопами в количестве нейтронов в ядре.
12 C: 6 электронов, 6 протонов и 6 нейтронов
13 C: 6 электронов, 6 протонов и 7 нейтронов
14 С: 6 электронов, 6 протонов и 8 нейтронов
Электромагнитный Радиация
Многое из того, что известно о строении электронов
в атоме было получено при изучении взаимодействия
между материей и различными формами электромагнитный
радиация .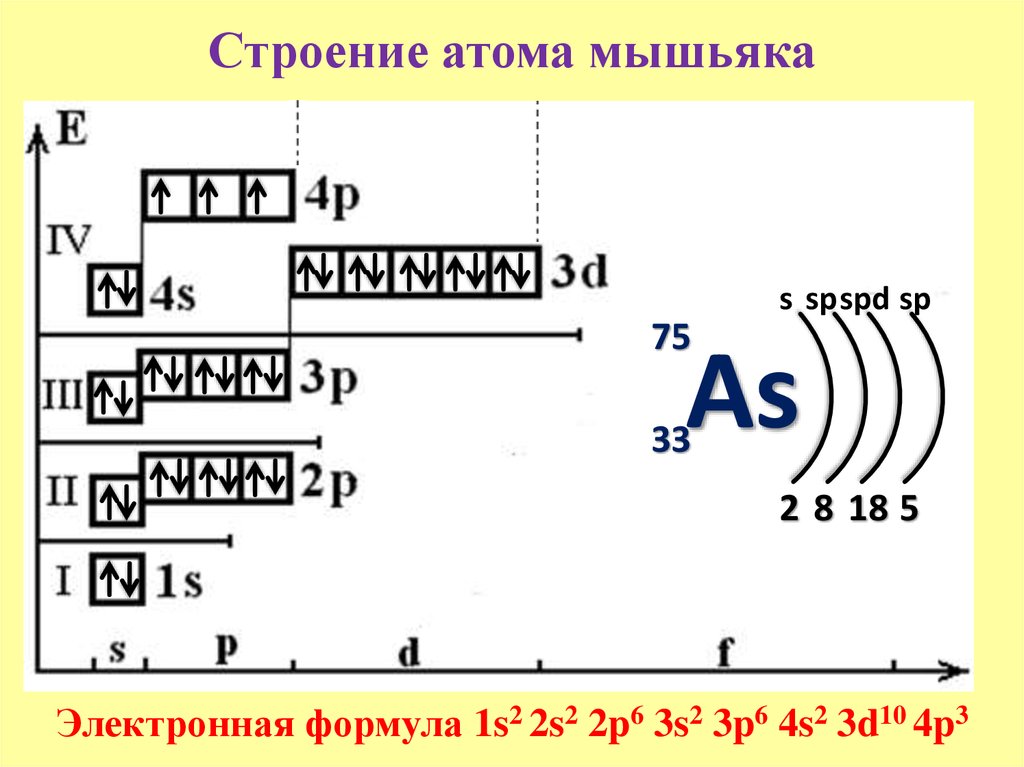 Электромагнитное излучение имеет некоторые
свойства частицы и волны.
Электромагнитное излучение имеет некоторые
свойства частицы и волны.
Частицы имеют определенную массу и занимают пространство. Волны не имеют массы, но несут энергию как они путешествуют по космосу. Помимо их способности несут энергию, волны имеют четыре другие характеристики свойства: скорость, частота, длина волны и амплитуда. частота ( v ) количество волн (или циклов) на единицу время. Частота волны указывается в единицах циклов. в секунду (с -1 ) или герц (Гц).
Идеализированный рисунок волны на рисунке ниже иллюстрирует определения амплитуды и длины волны. Длина волны ( l ) — наименьшее расстояние между повторяющимися точками на волне. Амплитуда волны это расстояние между самой высокой (или самой низкой) точкой волны и центр тяжести волны.
Если мы измерим частоту ( v ) волны в циклах
в секунду и длина волны ( l ) в метрах,
Произведение этих двух чисел выражается в метрах на
второй.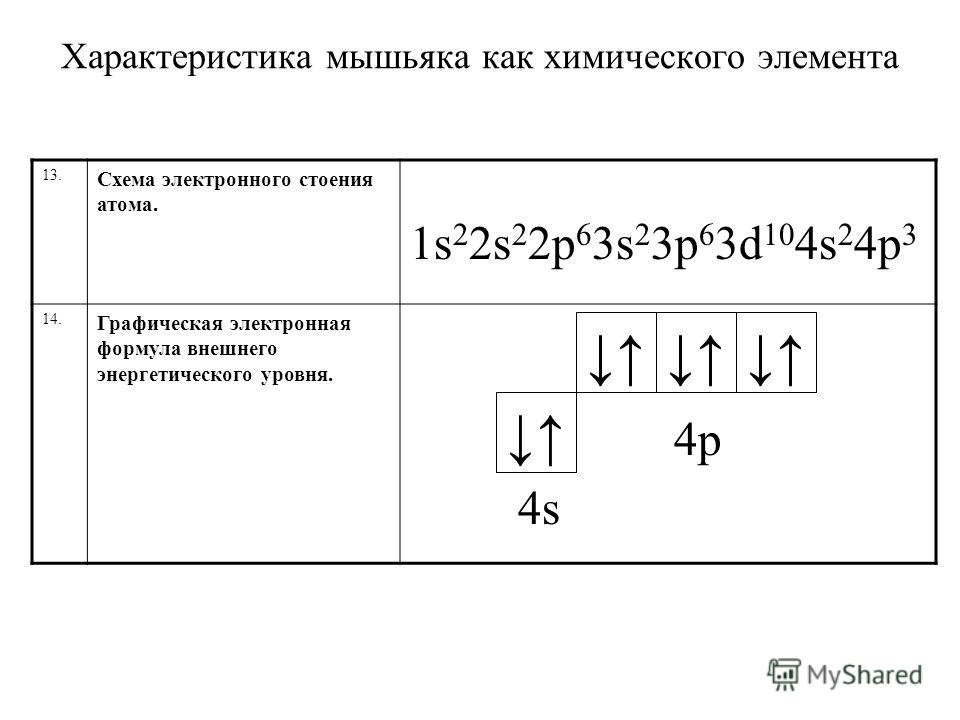 Произведение частоты ( v ), умноженной на
длина волны ( l ) волны, следовательно, скорость ( с )
при котором волна распространяется в пространстве.
Произведение частоты ( v ), умноженной на
длина волны ( l ) волны, следовательно, скорость ( с )
при котором волна распространяется в пространстве.
вл = с
Свет и прочее Формы электромагнитного излучения
Свет — это волна, состоящая как из электрических , так и из магнитных составные части. Таким образом, это форма электромагнитных полей. радиация .
Видимый свет содержит узкую полосу частот и
длины волн в части электромагнитного спектра
которые наши глаза могут обнаружить. Он включает в себя излучение с
длины волн от 400 нм (фиолетовый) до 700 нм (красный).
Поскольку это волна, свет преломляется, когда попадает в стекло.
призма. Когда белый свет фокусируется на призме, световые лучи
с разной длиной волны изгибаются на разную величину и
свет превращается в спектр цветов.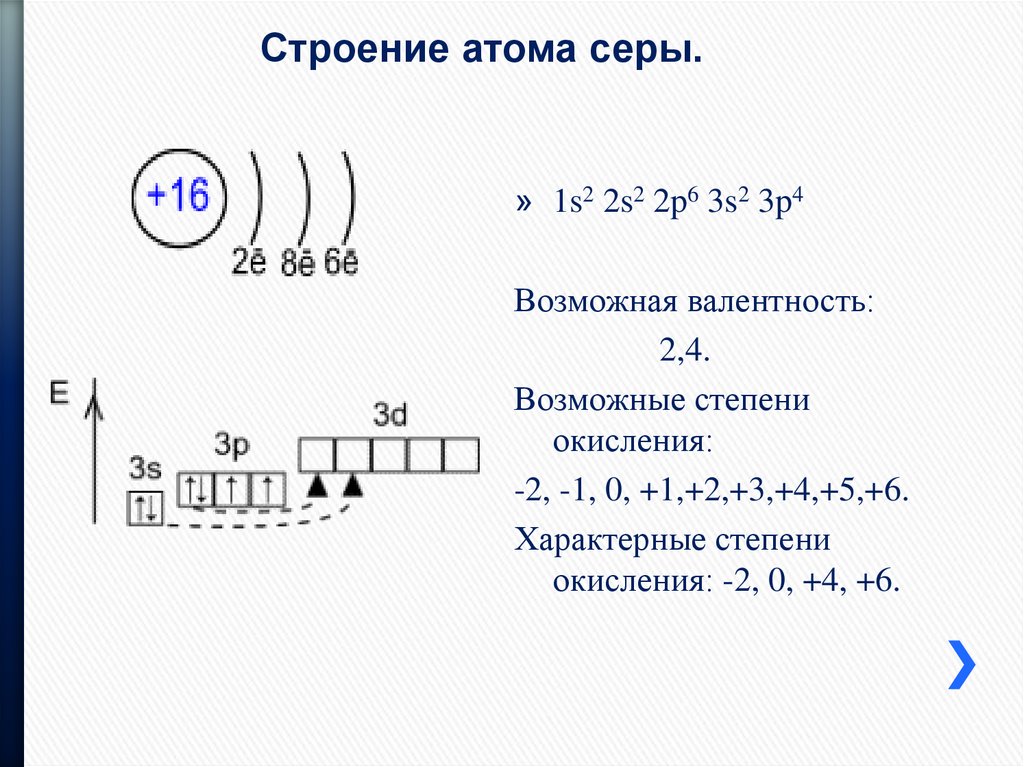 Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.
Начиная
со стороны спектра, где свет преломляется
наименьший угол, цвета красный, оранжевый, желтый, зеленый,
синий, и фиолетовый.
Как видно из следующей диаграммы, энергия переносимый светом, увеличивается по мере того, как мы переходим от красного к синему через видимый спектр.
Поскольку длина волны электромагнитного излучения может быть до 40 м или до 10 -5 нм, видимый спектр составляет лишь малую часть всего диапазона электромагнитного излучения.
Электромагнитный спектр включает радио- и телеволны,
микроволны, инфракрасное излучение, видимый свет, ультрафиолет, рентгеновские лучи,
g-лучи и космические лучи, как показано на рисунке выше. Эти
различные формы излучения движутся со скоростью света
( с ). Однако они различаются по своей частоте и
длины волн. Произведение частоты на
длина волны электромагнитного излучения всегда равна
скорость света.


 е.м.) или один дальтон.
е.м.) или один дальтон.

 О’Рурк|27 декабря 2014 г.|DAILY BEAST
О’Рурк|27 декабря 2014 г.|DAILY BEAST
