2. Строение атома
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом атом – система электронейтральная. Заряд ядра равен порядковому номеру элемента в таблице Д.И.Менделеева. Состояние электрона в атоме описывается при помощи набора четырех квантовых чисел: главного n, орбитального l, магнитного ml и спинового ms. Определенные значения трех квантовых чисел (n, l,ml) описывают состояние электрона, называемое атомной орбиталью (АО).
Главное квантовое число n определяет энергию АО и номер энергетического уровня, на котором находится электрон, и может принимать целочисленные значения от единицы до бесконечности.
Орбитальное квантовое число l определяет форму АО и энергетический подуровень, оно может принимать значения от нуля до n-1. Исторически атомным орбиталям со значениями l, равным 0, 1, 2, 3 присвоены буквенные обозначения
 В графических схемах электронного
строения атомов каждая орбиталь
обозначается символом .
В графических схемах электронного
строения атомов каждая орбиталь
обозначается символом .Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от –l до +l.
Спиновое квантовое число ms характеризует собственный момент импульса и связанный с ним магнитный момент и может принимать значения ±1/2.
Последовательность распределения электронов в атоме по мере увеличения значений l и n выражается электронными или электронно-графическими формулами.
При заполнении АО действует
Заполнение
энергетических подуровней подчиняется правилу
Хунда, согласно которому электроны
в основном состоянии в атоме располагаются
так, чтобы модуль суммарного спина всех
электронов подуровня был максимальным. Например, четыре валентных p-электрона
атома кислорода размещаются в квантовых
ячейках следующим образом:
Например, четыре валентных p-электрона
атома кислорода размещаются в квантовых
ячейках следующим образом:
Последовательность заполнения энергетических уровней и подуровней в атомах выражается правилом Клечковкого: порядок заполнения определяется возрастанием суммы n+l, а при одинаковом ее значении первым заполняется подуровень с меньшим значением n в этой сумме. Например,
1s2s2p3s3p4s3d4p5s4d5p6s5d1(La)4f
(лантаноиды)5d6p7s6d1(Ac)5f(актиноиды)6d…
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней:

Для d– и f-элементов возможны отклонения от описанного способа заполнения АО – так называемый провал электрона. Это явление связано с тем, что для атома устойчивым состоянием является полностью или наполовину заполненная АО, т.е. d10, d5, f
Если
на валентных энергетических уровнях
имеются вакантные АО, то при получении
электронами порции энергии (возбуждении
атома) становится возможным «разъединение»
валентных электронов, т.
Пример 1
Решение. 1. Порядковый номер
брома – 35, следовательно атом брома
имеет 35 электронов. Бром находится в IV
периоде периодической системы,
следовательно, АО с n,
равным 1; 2 и 3 заполнены полностью. Бром
относится к p-элементам,
следовательно, заполнен 4s-подуровень.
В ряду 4p-элементов
бром – пятый элемент, следовательно,
на 4p-подуровне – пять
электронов. Таким образом, электронная
формула брома имеет вид
1
Таким образом, электронная
формула брома имеет вид
1
2. Валентными орбиталями в этом атоме являются орбитали внешнего (четвертого) электронного слоя, т.е. 4s-, 4p– и незаполненные 4d-орбитали. Графически схема заполнения электронами этих орбиталей имеет вид
в таком состоянии бром имеет валентность 1, которой соответствуют степени окисления 1 и +1.
3. При затрате некоторой энергии спаренный p-электрон перейдет на свободную d-орбиталь. В этом первом возбужденном состоянии
бром имеет валентность 3, которой соответствует степень окисления +3.
4. При передаче атому брома еще некоторого количества энергии следующий p-электрон также перейдет на свободную d-орбиталь. Во втором возбужденном состоянии
бром имеет
валентность 5, которой соответствует
степень окисления +5.
5. При передаче атому брома еще некоторого количества энергии s-электрон также перейдет на свободную d-орбиталь. В третьем возбужденном состоянии
бром имеет валентность 7, которой соответствует степень окисления +7.
Пример 2. Составить электронные формулы атома селена в состояниях Se2 и Se+4 и графические схемы заполнения электронами валентных орбиталей.
Решение. 1. Cоставим электронную формулу атома селена (см. пример 1): 1s22s22p63s23p64s23d104p4. Графическая схема заполнения электронами валентных орбиталей имеет вид
2. Для получения Se2 необходимо к атому селена добавить два электрона на 4p-орбиталь (согласно правилу Клечковского). Тогда графическая схема примет вид
Электронная
формула Se2 – 1s22s22p63s23p64s23d104p6.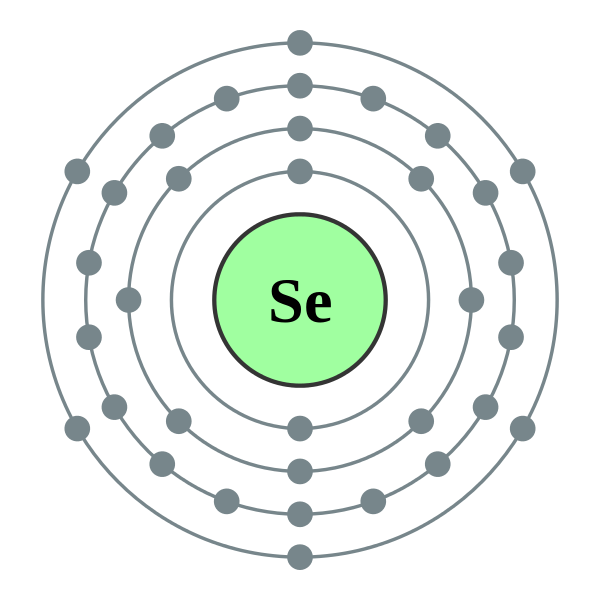
3. Для получения Se+4 необходимо убрать четыре электрона с 4p-орбитали, атома селена:
Электронная формула Se+4 – 1s22s22p63s23p64s
Пример 3. Составить полную электронную формулу элемента, валентные электроны которого имеют конфигурацию 3d6, определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
Решение. Согласно правилу Клечковского 3d-элементы
находятся в четвертом периоде таблицы
Д.И.Менделеева. На данной орбитали
находится шесть электронов, значит, это
шестой по счету среди 3d-элементов,
т.е. железо, полная электронная формула
которого 1s22s22p63s23p64s23d6.
Задание I. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
1. B, Al, Th. 2. Po, Ba, Lu. 3. Mg, Pm, Be. 4. Br, Co, Hf. 5. C, Tm, As. 6. Nd, Ca, V. 7. Ta, O, Ce. 8. Y, Rb, S. | 9. At, Xe, Lr. 10. Cs, U, H. 11. Cl, Cu, Bi. 12. Na, Ac, Fe. 13. Pb, Ra, Dy. 14. Ag, Re, In. 15. Cd, K, Pa. 16. P, Se, Li. | 17. Yb, Mn, Sn. 18. Mo, La, N. 19. Pu, Ni, Sb. 20. Au, Np, Rn. 21. Cr, Tl, Cm. 22. Si, I, Zr. 23. Tb, Sr, Bk. 24. | 25. He, Hg, Gd. 26. Pt, Ne, Sm. 27. Ga, Ru, Ho. 28. Sc, Pr, Os. 29. Ar, Ir, Eu. 30. Zn, Rh, Er. 31. Kr, Pd, Am. 32. Ge, Cf, F. |
Задание II. Составить электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей.
33. Li+, C+2. 34. O2, F. 35. Na+, N3. 36. Ca+2, C+4. 37. Al+3, B3. 38. C4, Ba+2. 39. S+6, P3. 40. P+5, Cl1. | 41. 42. Be+2, Co+3. 43. Cr+6, Cu+2. 44. I, P+3. 45. Cr+3, Br+3. 46. Ag+, Sn+4. 47. Zn+2, S2. 48. K+, Fe+2. | 49. Zr+4, Pb+2. 50. N+5, Br. 51. Ni+2, Cl+5. 52. Se2, Cs+. 53. Te2, Sr+2. 54. Bi+3, Si4. 55. B+3, Sc+2. 56. Mg+2, Mn+7. | 57. Cd+2, Sn+2. 58. Nb+3, Hg+. 59. Tl+,
V+3. 60. Ti+4, Mn+2. 61. Os+3, Au+3. 62. Rb+, Ce+3. 63. Fr+1, Y+3. 64. H+, Re+7. |
Задание III. Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления. Определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
65. 4d1. 66. 3d10. 67. 4s13d10. 68. 5d2. 69. 6p2. 70. 6s14f145d10. 71. 4s23d5. 72. 4s13d5. | 73. 74. 5d3. 75. 6s24f2. 76. 6p1. 77. 5s14d5. 78. 4f3. 79. 6d15f3. 80. 5s24d5. | 81. 5d8. 82. 5s14d10. 83. 5s24d10. 84. 5s2. 85. 5p3. 86. 6p4. 87. 4d6. 88. 5d6. | 89. 5f7. 90. 5d6. 91. 5f2. 92. 4d7. 93. 5d14f7. 94. 4f10. 95. 96. 5p6. |
РЕАКЦИИ ПОЛИФТОРАРЕНТИОЛОВ С БРОМОМ И ГАЛОИДАЛКАНАМИ. ПОЛУЧЕНИЕ ПОЛИФТОРАРЕНСУЛЬФОНИЛБРОМИДОВ И ИЗУЧЕНИЕ ИХ НЕКОТОРЫХ ПРЕВРАЩЕНИЙ
%PDF-1.6 % 1 0 obj > endobj 6 0 obj /CreationDate (D:20171120151023+03’00’) /Creator (Adobe Acrobat 11.0.2) /ModDate (D:20171120151756+03’00’) /Producer (Adobe Acrobat Pro 11.0.2 Paper Capture Plug-in) /Title >> endobj 2 0 obj > stream 2017-11-20T15:17:56+03:002017-11-20T15:10:23+03:002017-11-20T15:17:56+03:00Adobe Acrobat 11.0.2application/pdf
 0.2application/pdf uuid:240ae984-63a2-4b88-a1be-2ed61a152676uuid:52e522c5-3a22-42b3-ada1-6ad1472a401cAdobe Acrobat 11.0.2 Image Conversion Plug-in
endstream
endobj
44 0 obj
>
stream
HWn$7WhF-Rz3CA`Nf
0.2application/pdf uuid:240ae984-63a2-4b88-a1be-2ed61a152676uuid:52e522c5-3a22-42b3-ada1-6ad1472a401cAdobe Acrobat 11.0.2 Image Conversion Plug-in
endstream
endobj
44 0 obj
>
stream
HWn$7WhF-Rz3CA`NfБром — Key Stage Wiki
Содержимое
- 1 Ключевой этап 2
- 1.1 Значение
- 2 Ключевой этап 3
- 2.1 Значение
- 2.2 О броме
- 2.2.1 Молекулярная структура
- 2.2.2 Атомная структура
- 2.2.3 Свойства
- 3 Ключевой этап 4
- 3.1 Значение
- 3.2 О броме
- 3.2.1 Молекулярная структура
- 3.2.2 Атомная структура
- 3.2.3 Свойства
- 3.3 Ссылки
- 3.3.1 АКК
Ключевой этап 2
Значение
Бром представляет собой коричневую жидкость.
Ключевой этап 3
Значение
Химический символ брома.
Бром — элемент 7-й группы Периодической таблицы элементов с атомным номером 35.
О броме
Молекулярная структура
- Бром имеет химическую формулу Br 2 .
Атомная структура
- Бром состоит из 35 протонов и 45 нейтронов в ядре, что дает ему атомный номер 35 и атомную массу 80.
- У атома брома отсутствует один электрон из полной внешней оболочки.
Свойства
- Бром является неметаллическим элементом.
- Бром является более реакционноспособным галогеном, чем йод, но менее реакционноспособным, чем хлор.
- Бром сильно реагирует с водородом с образованием бромистого водорода, который растворяется в воде с образованием бромистоводородной кислоты.
- Бром — отбеливатель.
- Бром убивает бактерии.
- Бром представляет собой газ бледно-зеленого цвета при комнатной температуре.
Key Stage 4
Химический символ брома.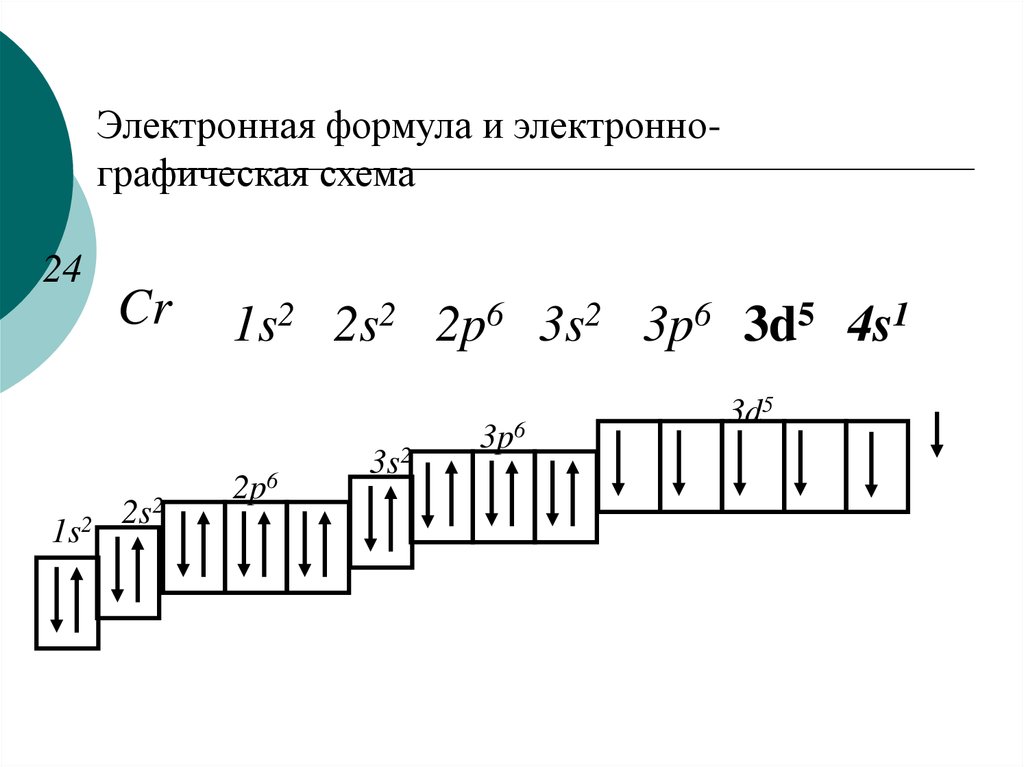
Значение
Бром — элемент 7-й группы Периодической таблицы элементов с 35 протонами в ядре.
О Броме
Молекулярная структура
- Бром имеет химическую формулу Br 2 .
- Атомы брома образуют ковалентную связь.
| Точечная и крестовая диаграмма молекулы брома. |
Атомная структура
- Самый стабильный изотоп брома имеет 45 нейтронов в ядре, что дает ему атомную массу 80.
- У атома брома отсутствует один электрон из полной внешней оболочки.
- Ионы брома получают 1 электрон, чтобы получить полную внешнюю оболочку и стать отрицательно заряженными.
Свойства
- Бром является неметаллическим элементом.
- Бром является более реакционноспособным галогеном, чем йод, но менее реакционноспособным, чем хлор.
- Бром сильно реагирует с водородом с образованием бромистого водорода, который растворяется в воде с образованием бромистоводородной кислоты.

- Бром — отбеливатель.
- Бром убивает бактерии.
- Бром представляет собой газ коричневого цвета при стандартной температуре и давлении.
Ссылки
AQA
- Бром, стр. 61, GCSE Chemistry, CGP, AQA
- Бром, стр. 61, Комбинированная научная трилогия GCSE; Химия, CGP, AQA
- Бром, реакция с алкенами, страницы 148, GCSE Combined Science Trilogy 2, Hodder, AQA
Электронная конфигурация брома (Br) и орбитальная диаграмма
Бром — 35-й элемент в периодической таблице, его символ — «Br». Бром является классифицированным галогенным элементом. Общее число электронов в броме равно тридцати пяти. Эти электроны расположены по определенным правилам разных орбит.
Расположение электронов на различных орбитах и орбиталях атома в определенном порядке называется электронной конфигурацией. Электронная конфигурация атома брома может быть выполнена двумя способами.
- Электронная конфигурация по орбите (принцип Бора)
- Электронная конфигурация через орбиталь (принцип Ауфбау)
Конфигурация электронов через орбитали следует другим принципам. Например, принцип Ауфбау, принцип Хунда и принцип запрета Паули. В этой статье подробно обсуждается, как легко написать полную электронную конфигурацию брома.
Например, принцип Ауфбау, принцип Хунда и принцип запрета Паули. В этой статье подробно обсуждается, как легко написать полную электронную конфигурацию брома.
Также обсуждалось, как нарисовать и написать орбитальную диаграмму брома. Надеюсь, после прочтения этой статьи вы узнаете подробности по этой теме.
Содержание
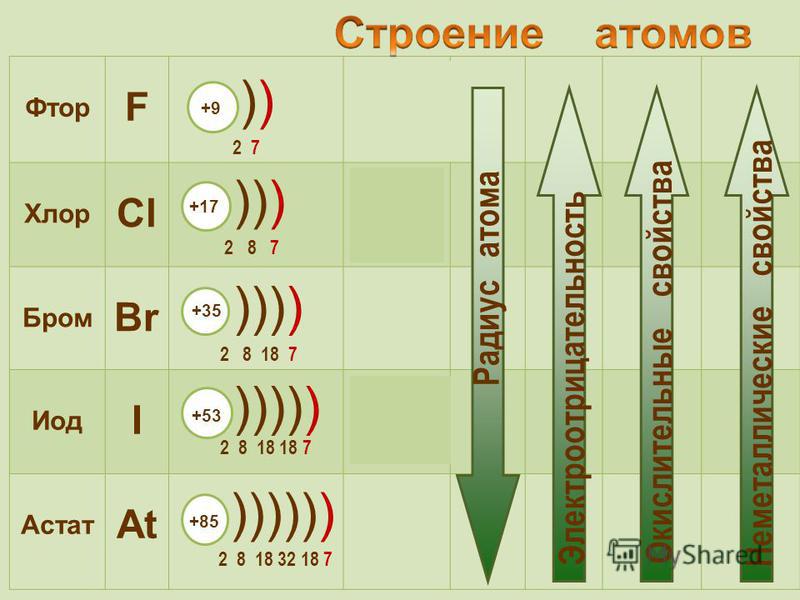
Электронная конфигурация атома брома на орбите
Ученый Нильс Бор первым дал представление об орбите атома. Он представил модель атома в 1913 году. Там дается полное представление об орбите.
Электроны атома вращаются вокруг ядра по определенной круговой траектории. Эти круговые пути называются орбитами (оболочками). Эти орбиты выражаются через n. [n = 1,2,3,4 . . . Порядковый номер орбиты]
K — название первой орбиты, L — второй, M — третьей, N — название четвертой орбиты. Электронная удерживающая способность каждой орбиты составляет 2n 2 .
| Shell Number (n) | Shell Name | Electrons Holding Capacity (2n 2 ) |
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 18 |
| 4 | N | 32 |
For example,
- n = 1 для K-орбиты.

Максимальная емкость для электронов на K-орбите составляет 2n 2 = 2 × 1 2 = 2, - Для L-орбиты n = 2.
Максимальная емкость для удержания электронов на L-орбите равна 2n 2 = 2 × 2 2 = 8, - n=3 для М-орбиты.
Максимальная вместимость электронов на М-орбите равна 2n 2 = 2 × 3 2 = 18, - n=4 для N-орбиты.
Максимальная вместимость электронов на N-орбите составляет 2n 2 = 2 × 4 2 = 32,
Таким образом, максимальная емкость удерживания электронов на первой оболочке равна двум, на второй оболочке — восьми, а на третьей оболочке может быть максимум восемнадцать электронов.
Атомный номер — это количество электронов в этом элементе. Атомный номер брома равен 35. То есть число электронов в броме равно тридцати пяти.
Электронная конфигурация атома брома (модель Бора) Следовательно, атом брома будет иметь два электрона на первой оболочке, восемь на 2-й орбите, восемнадцать электронов на 3-й оболочке, а остальные семь электронов будут на четвертой оболочке.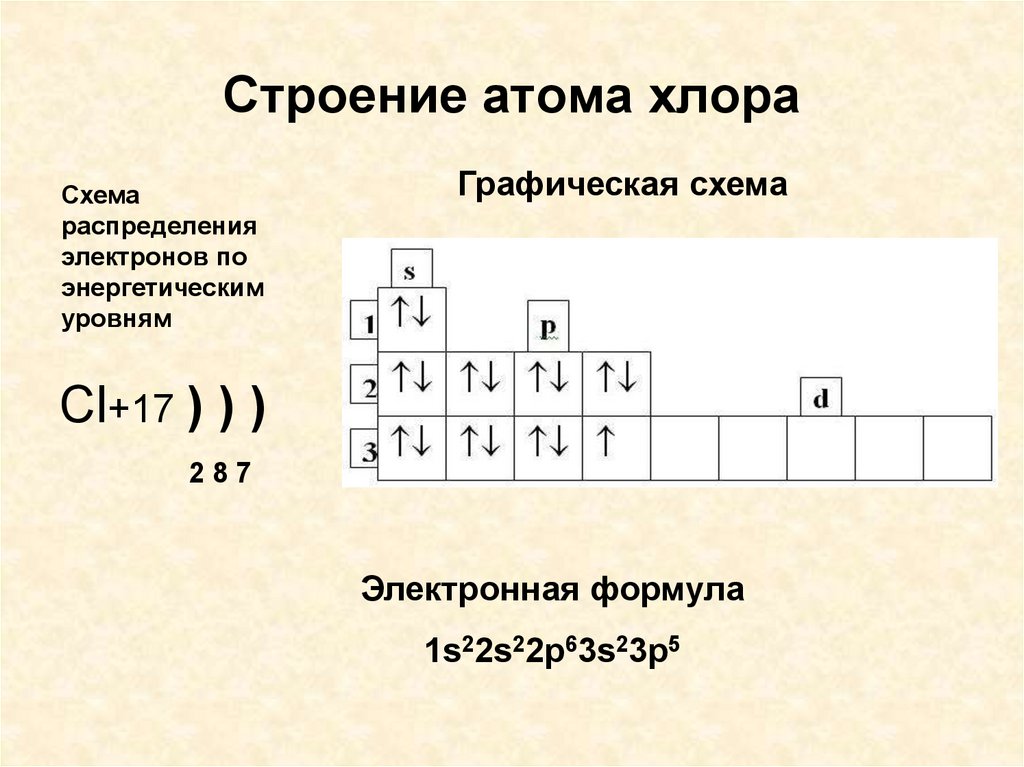
Следовательно, порядок числа электронов в каждой оболочке атома брома (Br) равен 2, 8, 18, 7. Электроны могут быть правильно расположены по орбитам от элементов с 1 по 18.
Электронная конфигурация элемент с атомным номером больше 18 не может быть правильно определен в соответствии с атомной моделью Бора. Электронная конфигурация всех элементов может быть сделана через орбитальную диаграмму.
Электронная конфигурация брома через орбиталь
Атомно-энергетические оболочки подразделяются на подэнергетические уровни. Эти подэнергетические уровни также называются орбитальными. Наиболее вероятная область вращения электрона вокруг ядра называется орбитальной.
Подэнергетические уровни зависят от азимутального квантового числа. Выражается буквой «л». Значение «l» от 0 до (n – 1). Подэнергетические уровни известны как s, p, d и f.
| Номер орбиты | Значение «l» | Number of subshells | Number of orbital | Subshell name | Electrons holding capacity | Electron configuration |
| 1 | 0 | 1 | 1 | 1s | 2 | 1s 2 |
| 2 | 0 1 | 2 | 1 3 | 2s 2p | 2 6 | 2s 2 2p 6 |
| 3 | 0 1 2 | 3 | 1 3 5 | 3s 3p 3d | 2 6 10 | 3s 2 3p 6 3d 10 |
| 4 | 0 1 2 3 | 4 | 1 3 5 7 | 4s 4p 4d 4f | 2 6 10 14 | 4S 2 4P 6 4D 10 4F 14 |
Например,
- , если n = 1,
(n – 1) = (1) = (1) = (1) = (1) = (1) = (1) = (1) = (1) = (1) = (1) = (1) = (1). = 0
= 0
Следовательно, значение ‘l’ равно 0. Таким образом, уровень подэнергии равен 1 с. - Если n = 2,
(n – 1) = (2–1) = 1.
Следовательно, значение «l» равно 0, 1. Таким образом, подэнергетические уровни равны 2s и 2p. - Если n = 3,
(n – 1) = (3–1) = 2.
Следовательно, значение «l» равно 0, 1, 2. Таким образом, уровни подэнергии 3s, 3p и 3д. - Если n = 4,
(n – 1) = (4–1) = 3
Следовательно, значение ‘l’ равно 0, 1, 2, 3. Итак, подэнергетические уровни 4s, 4p, 4г и 4е. - Если n = 5,
(n – 1) = (n – 5) = 4.
Следовательно, l = 0,1,2,3,4. Количество подоболочек будет 5, но 4s, 4p, 4d и 4f в этих четырех подоболочках можно расположить электроны всех элементов таблицы Менделеева.
| Имя субоболочки | Источник имени | Значение «l» | Значение «m» (от 0 до ± l) | Число орбиталей (2l+1) | 07 Электрон удерживающая способность 9 )|
| s | Sharp | 0 | 0 | 1 | 2 |
| p | Principal | 1 | −1, 0, +1 | 3 | 6 |
| d | Рассеянный | 2 | −2, −1, 0, +1, +2 | 5 | 10 |
| f | Основная | −3 −7 −7 −7 −207 3, 3 , +2, +3 | 7 | 14 |
Орбитальный номер s-подоболочки один, три в p-подоболочке, пять в d-подоболочке и семь в f-подоболочка.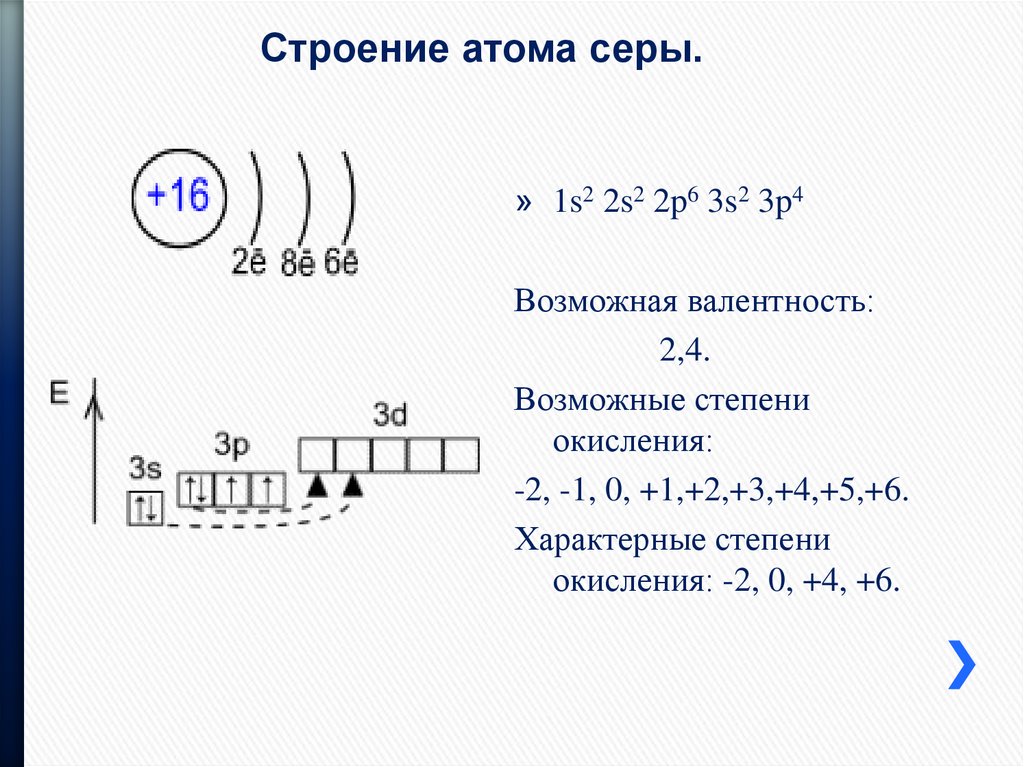 Каждая орбиталь может иметь максимум два электрона.
Каждая орбиталь может иметь максимум два электрона.
Подэнергетический уровень «s» может содержать максимум два электрона, «p» может содержать максимум шесть электронов, «d» может содержать максимум десять электронов, а «f» может содержать максимум четырнадцать электронов. электроны.
Электронная конфигурация через принцип AufbauAufbau — это немецкое слово, означающее наращивание. Основными сторонниками этого принципа являются ученые Нильс Бор и Паули. Метод Ауфбау заключается в том, чтобы выполнить конфигурацию электрона через подэнергетический уровень.
Принцип Ауфбау заключается в том, что электроны, присутствующие в атоме, сначала завершают орбиталь с самой низкой энергией, а затем постепенно продолжают завершать орбиталь с более высокой энергией.
Энергия орбитали рассчитывается по значению главного квантового числа «n» и азимутального квантового числа «l». Орбиталь, для которой значение (n + l) ниже, является орбиталью с низкой энергией, и электрон выйдет на эту орбиталь первым.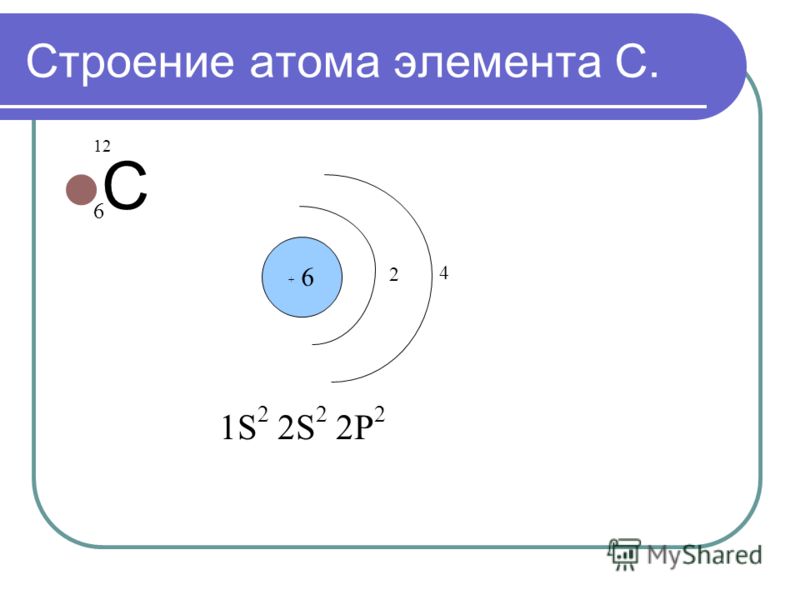
| Orbital | Orbit (n) | Azimuthal quantum number (l) | Orbital energy (n + l) |
| 3d | 3 | 2 | 5 |
| 4s | 4 | 0 | 4 |
Здесь энергия 4s-орбитали меньше энергии 3d. Таким образом, электрон сначала попадет на 4s-орбиталь, а затем перейдет на 3d-орбиталь, когда 4s-орбиталь будет заполнена. Метод ввода электронов на орбитали по принципу Ауфбау: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d.
Первые два электрона брома выходят на 1s-орбиталь. На s-орбитали может быть максимум два электрона.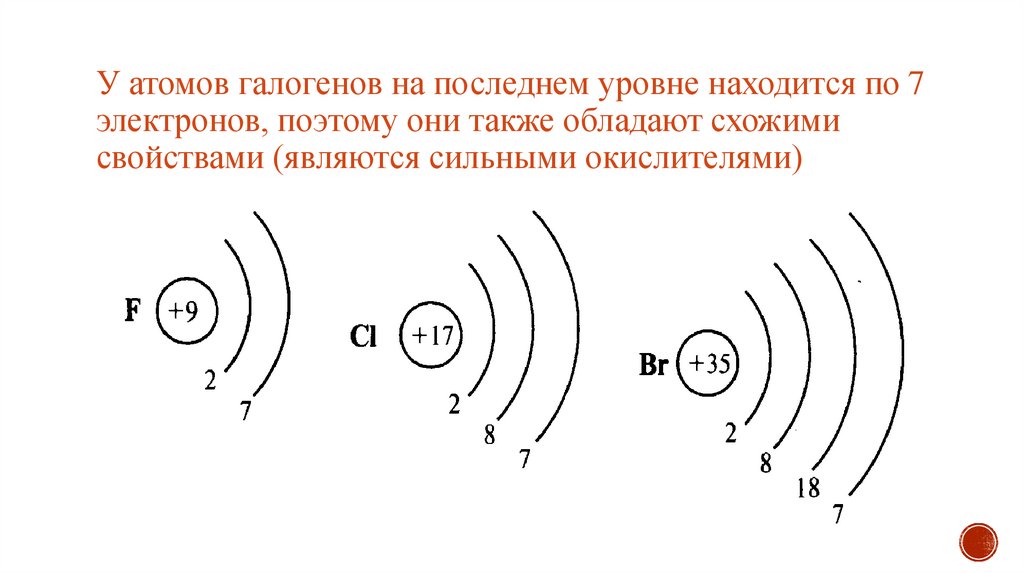 Следовательно, следующие два электрона переходят на 2s-орбиталь.
Следовательно, следующие два электрона переходят на 2s-орбиталь.
На p-орбитали может быть максимум шесть электронов. Итак, следующие шесть электронов переходят на 2р-орбиталь. Вторая орбита теперь заполнена. Итак, оставшиеся электроны выйдут на третью орбиту.
Тогда два электрона выйдут на 3s-орбиталь, а следующие шесть электронов окажутся на 3p-орбитали третьей орбитали. Теперь орбиталь 3p заполнена. Итак, следующие два электрона перейдут на 4s-орбиталь, а десять электронов перейдут на 3d-орбиталь.
Электронная конфигурация брома3d-орбиталь заполнена. Итак, оставшиеся пять электронов переходят на 4р-орбиталь. Таким образом, полная конфигурация брома будет 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 5 .
Примечание: Короткая электронная конфигурация брома: [Ar] 3d 10 4s 2 4p 5 . При записи электронной конфигурации вы должны писать последовательно.
Как написать орбитальную диаграмму брома?
Чтобы построить орбитальную диаграмму атома, сначала нужно знать принцип Хунда и принцип запрета Паули.
Принцип Хунда заключается в том, что электроны на разных орбиталях с одинаковой энергией будут располагаться таким образом, чтобы они могли находиться в неспаренном состоянии максимального числа, а спин неспаренных электронов будет однонаправленным.
Принцип исключения Паули состоит в том, что значения четырех квантовых чисел двух электронов в атоме не могут быть одинаковыми. Чтобы написать орбитальную диаграмму брома (Br), вы должны сделать электронную конфигурацию брома.
Подробно обсуждалось выше. 1s — ближайшая к ядру орбиталь с наименьшей энергией. Следовательно, электрон сначала выйдет на 1s-орбиталь.
Орбитальная диаграмма бромаВ соответствии с принципом Хунда, первый электрон войдет по часовой стрелке, а следующий электрон войдет на 1s-орбиталь против часовой стрелки. Орбиталь 1s теперь заполнена двумя электронами.
Затем следующие два электрона перейдут на 2s-орбиталь точно так же, как и на 1s-орбиталь. Следующие три электрона войдут на 2p-орбиталь по часовой стрелке, а следующие три электрона войдут на 2p-орбиталь в направлении против часовой стрелки.
Затем следующие два электрона перейдут на 3s-орбиталь, как и на 1s-орбиталь, а затем следующие шесть электронов перейдут на 3p-орбиталь, как на 2p-орбиталь. Теперь орбиталь 3p заполнена. Итак, следующие два электрона попадут на 4s-орбиталь точно так же, как и на 1s-орбиталь.
4s-орбиталь заполнена. Следовательно, следующие пять электронов войдут на 3d-орбиталь по часовой стрелке, а следующие пять электронов войдут на 3d-орбиталь в направлении против часовой стрелки.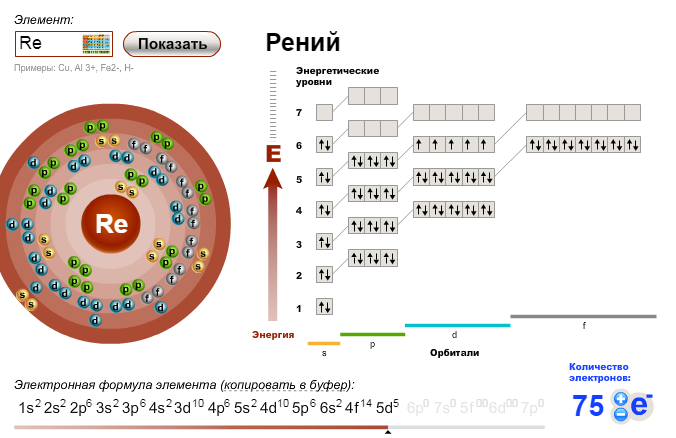
Трехмерная орбиталь заполнена. таким образом, следующие три электрона войдут на орбиталь 4p по часовой стрелке, а оставшиеся два электрона войдут в орбиталь 4p против часовой стрелки. Это хорошо видно на рисунке орбитальной диаграммы брома.
Схема атомных орбиталей бромаЭлектронная конфигурация брома в возбужденном состоянии
Атомы могут перескакивать с одной орбитали на другую в возбужденном состоянии. Это называется квантовым скачком. Конфигурация электронов из основного состояния брома составляет 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 5 .
В электронной конфигурации брома в основном состоянии последние пять электронов 4p-орбитали расположены в 4p x (2), 4p y (2) и 4p z орбитали. p-подоболочка имеет три орбитали.
p-подоболочка имеет три орбитали.
Орбитали p x , p y и p z и каждая орбиталь может иметь максимум два электрона. Then the correct electron configuration of bromine in the ground state will be 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p x 2 4p у 2 4p z 1 .
Эта электронная конфигурация показывает, что последняя оболочка атома брома имеет неспаренный электрон. Таким образом, в этом случае валентность брома равна 1.
Электронная конфигурация брома в возбужденном состоянииКогда атом брома возбужден, он поглощает энергию. В результате электрон с орбиты 4p y перескакивает на орбиталь 4d xy .
Мы уже знаем, что d-подоболочка имеет пять орбиталей. Орбитали d xy , d yz , d zx , d x 2 -y 2 и d z 22 и d z 2 и d z 2 и d z 2 Следовательно, конфигурация электронов брома (BR*) в возбужденном состоянии будет 1S 2 2S 2 2P 6 3S 2 3P 6 3D 10 4S 2 4P 9072 4072 10 4S 2 4P 10 4S 2 4P 10 4S 2 4 3D 10 4S 2 4 3D 10 4ST 2 4п y 1 4п z 1 4d ху 1 . Валентность элемента определяется электронной конфигурацией в возбужденном состоянии. Здесь бром имеет три неспаренных электрона. Таким образом, в этом случае валентность брома равна 3. Электронная конфигурация брома показывает, что последняя оболочка брома имеет семь электронов. Следовательно, валентных электронов брома семь. Элементы, имеющие 5, 6 или 7 электронов на последней оболочке, получают электроны последней оболочки при образовании связи. Элементы, принимающие электроны и образующие связи, называются анионами. При образовании связи последняя оболочка брома получает электрон и превращается в бромид-ион (Br – ). То есть бром является анионным элементом. Br + e – → Br – Электронная конфигурация бромид-иона (Br – ) 1s 2 2s 2 2s 9 2p 0202 3p 6 3d 10 4s 2 4p 6 . Электронная конфигурация бромид-иона (Br – ) показывает, что бромид-ион приобрел электронную конфигурацию криптона. Атом брома проявляет степени окисления -1, +1, +3, +5. Степень окисления элемента изменяется в зависимости от образования связи. Что означает бром? Сколько электронов у брома? 3 и d z 2 3 и d z 2 2 имеют максимум две орбиты электронов, каждая из которых может состоять из двух электронов. 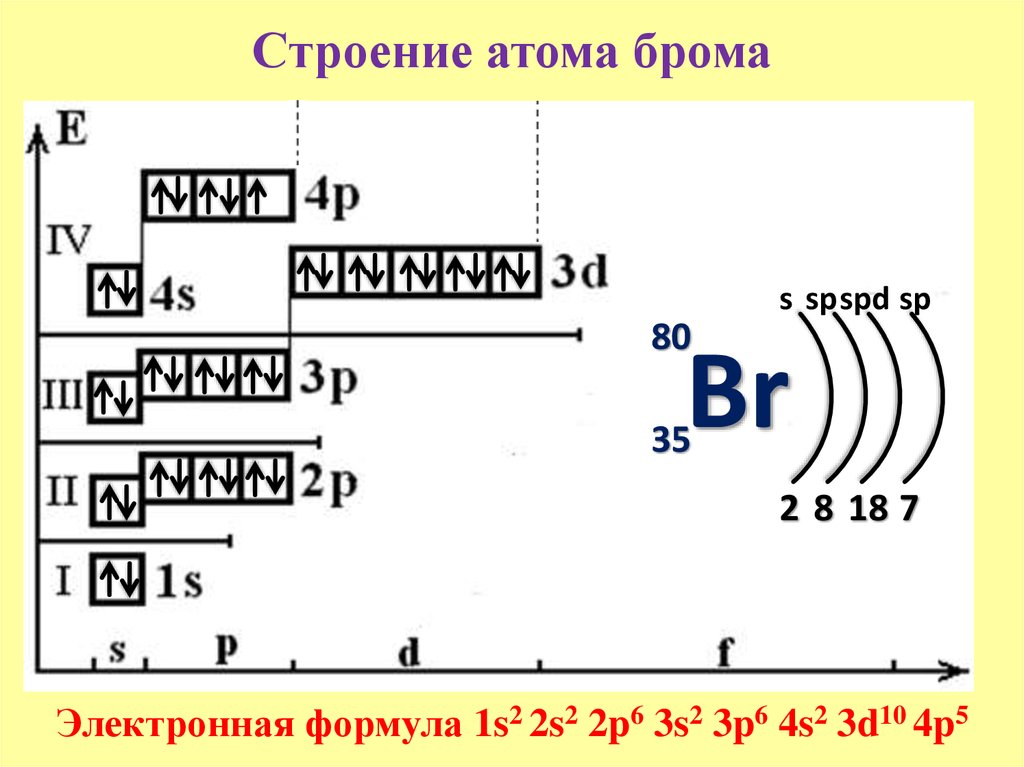
Ион брома (Br
– ) Электронная конфигурация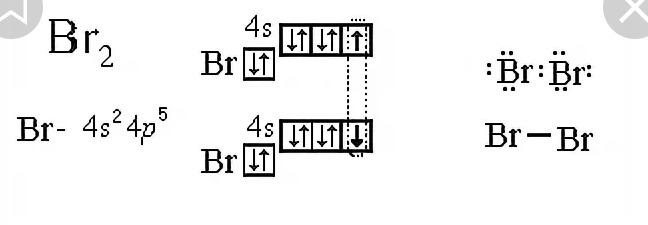
Часто задаваемые вопросы
Ответ: Бром обозначается символом «Br».
Ответ: 35 электронов.

 Fr,
Ti, W.
Fr,
Ti, W. I+5,
Fe+3.
I+5,
Fe+3.
 7s26d1.
7s26d1. 4d8.
4d8.
 = 0
= 0