Строение атома франция (Fr), схема и примеры
Общие сведения о строении атома франция
Относится к элементам s-семейства. Металл. Обозначение – Fr. Порядковый номер – 87. Относительная атомная масса – 223,02 а.е.м.
Электронное строение атома франция
Атом франция состоит из положительно заряженного ядра (+87), внутри которого есть 87 протонов и 136 нейтронов, а вокруг, по семи орбитам движутся 87 электронов.
Рис.1. Схематическое строение атома франция.
Распределение электронов по орбиталям выглядит следующим образом:
+87Fr)2)8)18)32)32)8)1;
1s22s22p63s23p63d104s24p64f145s25p65d106s26p67s1.
На внешнем электронном уровне атома франция находится 1 электрон, который является валентным (расположен на 7s- подуровне). Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие одного неспаренного электрона в атоме франция свидетельствует о его способности проявлять степень окисления +1.
Валентный электрон атома франция можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
7 |
0 |
0 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Периодичность изменения свойств атомов — урок.
 Химия, 8–9 класс.
Химия, 8–9 класс.Основные характеристики атомов химических элементов:
- заряд ядра;
- число электронных слоёв;
- число электронов на внешнем уровне;
- радиус атома;
- высшая валентность в соединениях с кислородом;
- валентность в летучих водородных соединениях;
- способность отдавать электроны;
- способность принимать электроны.
Заряд ядра атома химического элемента равен порядковому номеру. Он последовательно возрастает от одного элемента к другому.
Число электронных слоёв равно номеру периода, к которому относится химический элемент.
Другие свойства изменяются периодически.
Число внешних электронов одинаково у элементов одной \(A\) группы и совпадает с её номером. В периоде увеличивается от \(1\) до \(8\).
Высшие валентности химических элементов в соединениях с кислородом, как правило, совпадают с номером группы и в каждом периоде увеличиваются.
Валентности в соединениях с водородом (для неметаллов), наоборот, уменьшаются и равны разности \(8\) \(–\) № группы.
Радиусы атомов в каждом периоде уменьшаются, а в группе увеличиваются.
Химические свойства атомов обусловлены их способностью отдавать электроны или их принимать.
Способность атомов отдавать валентные электроны
Чем больше радиус атома, тем слабее удерживаются его внешние электроны. Поэтому способность отдавать электроны усиливается в группах сверху вниз.
В малых периодах с увеличением зарядов ядер радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается. Они всё сильнее притягиваются к ядру и труднее отрываются от атома.
Легче всего отрываются электроны от атомов щелочного металла франция.
Схематически усиление способности отдавать электроны можно изобразить так:
⇓Fr⇐
Способность атомов притягивать электроны
У элементов одной группы эта способность снижается с увеличением числа электронных слоёв.
В периоде с увеличением заряда ядра радиус атома уменьшается, число валентных электронов и их притяжение к ядру растёт, и атомам всё легче присоединять дополнительные электроны на внешний уровень.
Наиболее активно принимают электроны атомы галогена фтора.
Изменение способности принимать электроны показывает схема:
⇒F⇑
Отличаются от других элементов по свойствам инертные газы (элементы VIIIA группы). Их атомы имеют заполненные внешние энергетические уровни и поэтому не отдают и не принимают электроны.
Подведём итоги.
Закономерности изменения свойств атомов
Свойство | В периоде | В группе |
Заряд ядра
| увеличивается | увеличивается |
Радиус атома
| уменьшается | увеличивается |
Способность отдавать электроны | уменьшается | увеличивается |
Число валентных электронов | увеличивается | не изменяется |
Способность принимать электроны | увеличивается | уменьшается |
Высшая валентность в оксидах и гидроксидах | увеличивается | не изменяется |
Валентность в летучих водородных соединениях | уменьшается | не изменяется |
особенности строения и химические свойства Где используют франций
Франций – это элемент с атомным числом 87. Атомная масса наиболее долгоживущего изотопа – 223. Франций является радиоактивным щелочным металлом, обладает крайне выраженной химической реактивностью.
Атомная масса наиболее долгоживущего изотопа – 223. Франций является радиоактивным щелочным металлом, обладает крайне выраженной химической реактивностью.
История открытия франция
Металл был открыт еще в 1939 году сотрудницей парижского Института Радия по имени Маргарита Перей. Она же – видимо, из патриотических чувств – назвала элемент в честь своей Родины. Франций был открыт при изучении искусственно полученного элемента «актиния»: было замечено нехарактерное радиоактивное свечение. Следует ради справедливости отметить, что над созданием этого элемента могли одновременно с ней работать и другие исследователи, но, как говорится, победителей не судят.
Основные характеристики
На сегодняшний день франций является одним из самых редких металлов (да и вообще химических элементов), которые встречаются в природе.
Earth’s Crust
Согласно подсчетам ученых, содержание этого металла в земной коре составляет порядка 340 грамм (меньше содержится только aстата).
Как можно его получить?
Рассмотрим единственный способ получить самый стабильный изотоп франция. Это можно сделать за счет ядерной реакции золота с атомами кислорода. Все остальные способы (имеется в виду радиоактивный распад) нецелесообразны, так как получаются крайне нестабильные изотопы, которые «живут» не более нескольких минут. Получить в домашних условиях этот элемент, как и все его соединения, понятное дело, не получится (да и незачем, собственно). можно найти множество экспериментов с другими металлами.
Какие химические свойства проявляет франций?
По своим свойствам франций аналогичен цезию. Релятивистские эффекты 6p-оболочки обеспечивают связь франция с кислородом в супероксидах (например, состава FrO 2) более ковалентной, относительно супероксидов прочих элементов этой группы. С учетом максимально низкой электроотрицательности из всех ныне существующих франций характеризуется выраженной химической активностью. Все физические свойства этого элемента указаны только теоретически, так как проверить их на практике не представляется возможным по причине короткого периода «жизни» этого элемента (плотность=1,87 г/см³, t плавления=27 °C, t кипения=677 °C, удельная теплота плавления=9,385 кДж/кг). Все соединения этого элемента растворимы в воде (исключения: соли перхлорат, хлороплатинат, пикраткобальтинитрит франция). Франций всегда сокристаллизуется с веществами, в состав которых входит цезий. Наблюдается его соосаждение с нерастворимыми солями цезия (перхлоратом или кремневольфраматом цезия). Извлечение из растворов франция осуществляется:
Релятивистские эффекты 6p-оболочки обеспечивают связь франция с кислородом в супероксидах (например, состава FrO 2) более ковалентной, относительно супероксидов прочих элементов этой группы. С учетом максимально низкой электроотрицательности из всех ныне существующих франций характеризуется выраженной химической активностью. Все физические свойства этого элемента указаны только теоретически, так как проверить их на практике не представляется возможным по причине короткого периода «жизни» этого элемента (плотность=1,87 г/см³, t плавления=27 °C, t кипения=677 °C, удельная теплота плавления=9,385 кДж/кг). Все соединения этого элемента растворимы в воде (исключения: соли перхлорат, хлороплатинат, пикраткобальтинитрит франция). Франций всегда сокристаллизуется с веществами, в состав которых входит цезий. Наблюдается его соосаждение с нерастворимыми солями цезия (перхлоратом или кремневольфраматом цезия). Извлечение из растворов франция осуществляется:
- хлороплатинатами цезия и рубидия Cs 2 PtCl 6 и Rb 2 PtCl 6 ;
- хлоровисмутатом Cs 2 BiCl 5 , хлоростаннатом Cs 2 SnCl 6 и хлороантимонатом цезия Cs 2 SbCl 5 2,5H 2 O;
- cвободными гетерополикислотами: кремневольфрамовой и фосфорновольфрамовой.

Какое практическое значение имеет этот элемент?
Несмотря на всю свою уникальность, никакого применения на практике франций пока еще не имеет. Соответственно, в промышленности и каких-либо технологиях не используется. Причиной тому является его чрезвычайно короткий период полураспада. Есть данные, что хлорид франция может быть использован для диагностики онкологических новообразований, однако в виду значительной стоимости этого образования, подобного рода методика не может быть введена в систематическое использование. В принципе, теми же свойствами обладает цезий.
Caesium
Так что и это свойство франция оказалось невостребованным: его стоимость сравнивается со стоимостью тонны платины или золота. По прогнозам ведущих специалистов, рассматриваемый элемент будет всегда иметь чисто познавательную ценность, не более того.
– (Francium), Fr, радиоактивный химический элемент I группы периодической системы, атомный номер 87; щелочной металл. Открыла франций французская радиохимик М. Пере в 1939 … Современная энциклопедия
Пере в 1939 … Современная энциклопедия
ФРАНЦИЙ – (лат. Francium) Fr, химический элемент I группы периодической системы Менделеева, атомный номер 87, атомная масса 223,0197, относится к щелочным металлам. Радиоактивен, наиболее устойчив изотоп 223Fr (период полураспада 21,8 мин). Назван по имени … Большой Энциклопедический словарь
ФРАНЦИЙ – (символ Fr), радиоактивный, металлический элемент первой группы периодической таблицы, открыт в 1939 г. Самый тяжелый элемент ряда ЩЕЛОЧНЫХ МЕТАЛЛОВ. В натуральном виде присутствует в урановой руде, продукт разложения АКТИНИЯ. Элемент редкий,… … Научно-технический энциклопедический словарь
Франций – Fr (назв. в честь Франции, родины M. Пepe, открывшей элемент; лат. Francium * a. francium; н. Franzium; ф. francium; и. francio, francium), радиоактивный хим. элемент I группы системы Mенделеева; ат. н. 87. Cтабильных изотопов не имеет.… … Геологическая энциклопедия
ФРАНЦИЙ – (лат. Francium), Fr, радиоакт. хим. элемент 1 й группы периодич. системы элементов, ат. номер 87, относится к щелочным металлам. Наим. устойчив из всех радиоакт. элементов, встречающихся в природе. Природный Ф. состоит из b радиоактивного 223Fr… … Физическая энциклопедия
хим. элемент 1 й группы периодич. системы элементов, ат. номер 87, относится к щелочным металлам. Наим. устойчив из всех радиоакт. элементов, встречающихся в природе. Природный Ф. состоит из b радиоактивного 223Fr… … Физическая энциклопедия
франций – сущ., кол во синонимов: 2 металл (86) элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ФРАНЦИЙ – (лат. Francium), хим. элемент I гр. периодич. системы, относится к щелочным металлам. Радиоактивен, наиб. устойчив нуклид 223Fr (период полураспада 22 мин). Назв. от Франции родины М. Перей, открывшей элемент. Один из редчайших и наименее… … Естествознание. Энциклопедический словарь
Франций – Смотри Франций (Fr) … Энциклопедический словарь по металлургии
франций – francis statusas T sritis chemija apibrėžtis Cheminis elementas.
Книги
- Радиоактивные металлы франций и дубний. Методы прогнозирования физических параметров , Николаев О.С.. В книге приведены методы прогнозирования физических параметров франция и дубния. Это радиоактивные металлы седьмого периода таблицы Д. И. Менделеева. Малые периодыполураспада этих металлов… Купить за 538 грн (только Украина)
- Де Голль и голлисты. “Коннетабль” и его соратники , Владлен Максимов. Книга рассказывает о самом знаменитом французе XX века, основателе и первом президенте Пятой республики с необычной и неожиданной для российского читателя критической стороны. Автор подробно…
ОПРЕДЕЛЕНИЕ
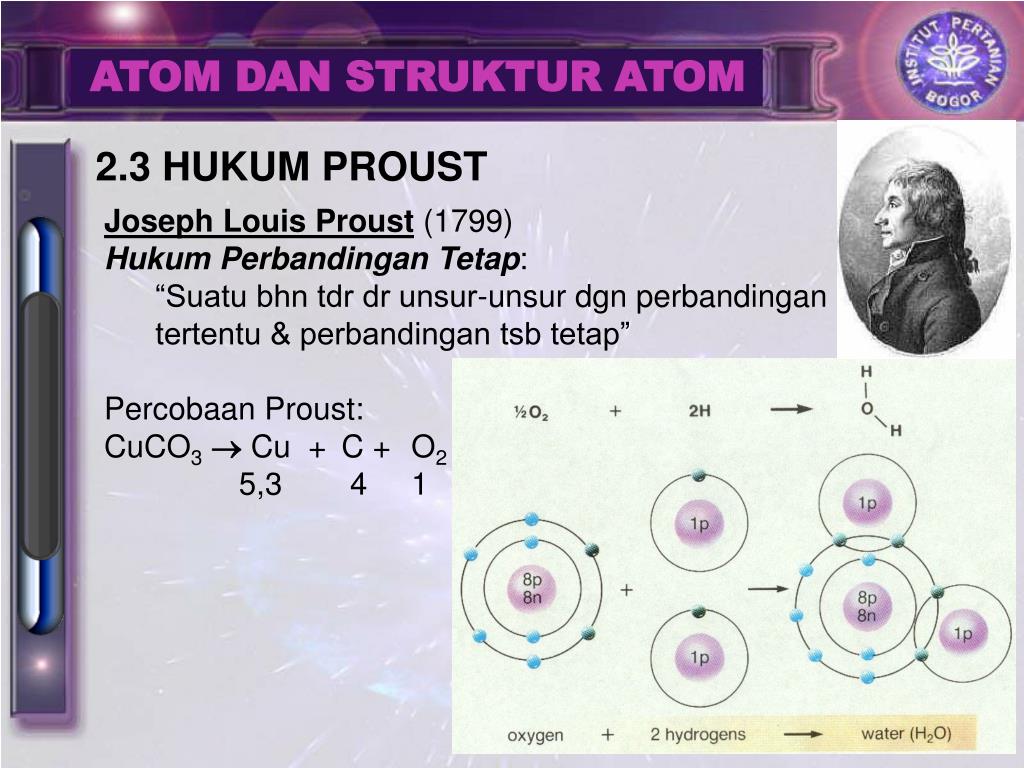
Франций расположен в седьмом периоде I группе главной (А) подгруппе Периодической таблицы.
Относится к элементам s -семейства. Металл. Обозначение – Fr. Порядковый номер – 87. Относительная атомная масса – 223,02 а. е.м.
е.м.
Электронное строение атома франция
Атом франция состоит из положительно заряженного ядра (+87), внутри которого есть 87 протонов и 136 нейтронов, а вокруг, по семи орбитам движутся 87 электронов.
Рис.1. Схематическое строение атома франция.
Распределение электронов по орбиталям выглядит следующим образом:
87Fr) 2) 8) 18) 32) 32) 8) 1 ;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4f 14 5s 2 5p 6 5d 10 6s 2 6p 6 7s 1 .
На внешнем электронном уровне атома франция находится 1 электрон, который является валентным (расположен на 7s- подуровне). Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие одного неспаренного электрона в атоме франция свидетельствует о его способности проявлять степень окисления +1.
Валентный электрон атома франция можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), m l (магнитное) и s (спиновое):
Примеры решения задач
ПРИМЕР 1
В 1939 г. Маргарита Перей из института Кюри в Париже, занимаясь очисткой препарата актиния (Ас-227) от разнообразных продуктов радиоактивного распада, обнаружила b-излучение, которое не могло принадлежать ни одному из известных в то время изотопов. Когда этот изотоп (период полураспада 21 мин) подвергли химическому исследованию, оказалось, что его свойства соответствуют свойствам эка-цезия. Окончательно это было подтверждено после второй мировой войны, и в 1946 г. Перей предложила назвать новый элемент францием (Francium) в честь ее родины.
Маргарита Перей из института Кюри в Париже, занимаясь очисткой препарата актиния (Ас-227) от разнообразных продуктов радиоактивного распада, обнаружила b-излучение, которое не могло принадлежать ни одному из известных в то время изотопов. Когда этот изотоп (период полураспада 21 мин) подвергли химическому исследованию, оказалось, что его свойства соответствуют свойствам эка-цезия. Окончательно это было подтверждено после второй мировой войны, и в 1946 г. Перей предложила назвать новый элемент францием (Francium) в честь ее родины.
Франций один из редчайших элементов. Среди элементов, постоянно существующих в земной коре, только астат имеет меньшее содержание. Весь природный франций является радиогенным, его радиоактивный распад компенсируется одновременным возникновением новых атомов франция в качестве промежуточных продуктов распада урана-235 и тория-232. Общее содержание франция в земной коре оценивается в 340 граммов.астат Нахождение в природе.
Физические и химические свойства. Франций похож по свойствам на цезий. Всегда со кристаллизуется с его соединениями. Практически все соединения франция растворимы в воде. Релятивистские эффекты 6p-оболочки делают связь франция с кислородом в супероксидах, например, состава FrO 2, более ковалентной, по сравнению с супероксидами других щелочных металлов. Франций имеет самую низкую электроотрицательность из всех элементов, известных в настоящее время. Соответственно, франций является и самым химически активным щелочным металлом.цезий Релятивистские эффекты 6p-оболочки делают связь франция с кислородом в супероксидах, например, состава FrO 2, более ковалентной, по сравнению с супероксидами других щелочных металлов. Франций имеет самую низкую электроотрицательность из всех элементов, известных в настоящее время. Соответственно, франций является и самым химически активным щелочным металлом.
Франций похож по свойствам на цезий. Всегда со кристаллизуется с его соединениями. Практически все соединения франция растворимы в воде. Релятивистские эффекты 6p-оболочки делают связь франция с кислородом в супероксидах, например, состава FrO 2, более ковалентной, по сравнению с супероксидами других щелочных металлов. Франций имеет самую низкую электроотрицательность из всех элементов, известных в настоящее время. Соответственно, франций является и самым химически активным щелочным металлом.цезий Релятивистские эффекты 6p-оболочки делают связь франция с кислородом в супероксидах, например, состава FrO 2, более ковалентной, по сравнению с супероксидами других щелочных металлов. Франций имеет самую низкую электроотрицательность из всех элементов, известных в настоящее время. Соответственно, франций является и самым химически активным щелочным металлом.
Применение: Хлорид франция FrCl использовался для обнаружения раковых опухолей, но по причине чрезвычайно высокой стоимости эту соль в масштабных разработках использовать невыгодно. В настоящее время франций и его соли применения пока что не имеют, в связи с малым периодом полураспада и высокой радиоактивностью.
В настоящее время франций и его соли применения пока что не имеют, в связи с малым периодом полураспада и высокой радиоактивностью.
| Франций | |
|---|---|
| Атомный номер | 87 |
| Внешний вид простого вещества | радиоактивный щелочной металл |
| Свойства атома | |
| Атомная масса (молярная масса) | 223,0197 а. е. м. ( /моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) | 380 кДж /моль (эВ) |
| Электронная конфигурация | 7s 1 |
| Химические свойства | |
| Ковалентный радиус | n/a пм |
| Радиус иона | (+1e) 180 пм |
| Электроотрицательность (по Полингу) | 0,7 |
| Электродный потенциал | Fr←Fr + −2,92 В |
| Степени окисления | +1 |
| Термодинамические свойства простого вещества | |
| Плотность | 1,87 /см³ |
| Молярная теплоёмкость | n/a Дж/( ·моль) |
| Теплопроводность | n/a Вт /(м·) |
| Температура плавления | 300 |
| Теплота плавления | ~ 2 кДж /моль |
| Температура кипения | 950 |
| Теплота испарения | ~ 65 кДж/моль |
| Молярный объём | n/a см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | n/a Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| Fr | 87 |
| 7s 1 | |
| Франций | |
Франций — элемент главной подгруппы первой группы седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 87. Обозначается символом Fr (Francium
). Простое вещество франций (CAS-номер: 7440-73-5) — радиоактивный щелочной металл, обладающий высокой химической активностью.
И. Менделеева, с атомным номером 87. Обозначается символом Fr (Francium
). Простое вещество франций (CAS-номер: 7440-73-5) — радиоактивный щелочной металл, обладающий высокой химической активностью.
История открытия Франция
Франций был предсказан Д. И. Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции.
Нахождение Франция в природе
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов. Образуется при альфа-распаде актиния-227:
227 Ac → 223 Fr (сопровождается α-излучением, вероятность распада приблизительно 1,4 %),
227 Ac → 227 Th (сопровождается β-излучением, вероятность распада около 98,6 %).
Его старое название — «актиний К» (AcK). По оценкам, его равновесное содержание в земной коре равно 340 г.
По оценкам, его равновесное содержание в земной коре равно 340 г.
Кроме того, в одной из побочных ветвей радиоактивного ряда тория содержится франций-224 с периодом полураспада 3,0 минуты. Его равновесное содержание в земной коре составляет лишь 0,5 г.
Получение Франция
Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций.
Физические, химические свойства Франция
Франций похож по свойствам на цезий . Всегда сокристаллизуется с его соединениями. Так как в распоряжении исследователей имеются лишь мельчайшие образцы, содержащие не более 10 −7 г франция, то сведения о его свойствах известны с достаточно большой погрешностью, однако они все время уточняются. Согласно последним данным, плотность франция при комнатной температуре составляет 1,87 г/см³, температура плавления 27°C, температура кипения 677°C, удельная теплота плавления 9,385 кДж/кг.
Применение Франция
Соль франция FrCl использовалась для обнаружения раковых опухолей, но по причине чрезвычайно высокой стоимости эту соль в масштабных разработках использовать не выгодно.
Куда еще точнее. Зачем Льюису Эссену потребовалось создавать атомные часы
В наше время не так-то просто отвечать на детские вопросы. Вот, к примеру, что такое секунда? Попробуйте рассказать ребенку про 60-ю часть минуты, потом про часы, сутки, обороты Земли вокруг своей оси. А он откроет Википедию и прочитает, что «секунда — время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133». И посмотрит на вас с недоверием.
Что ж, придется начинать все сначала: что это за цезий и что и почему он излучает. А виноват во всем один британский физик по имени Льюис Эссен.
В поисках колебаний
Представьте, что все часы в мире остановились, а вам надо договориться с приятелем о встрече.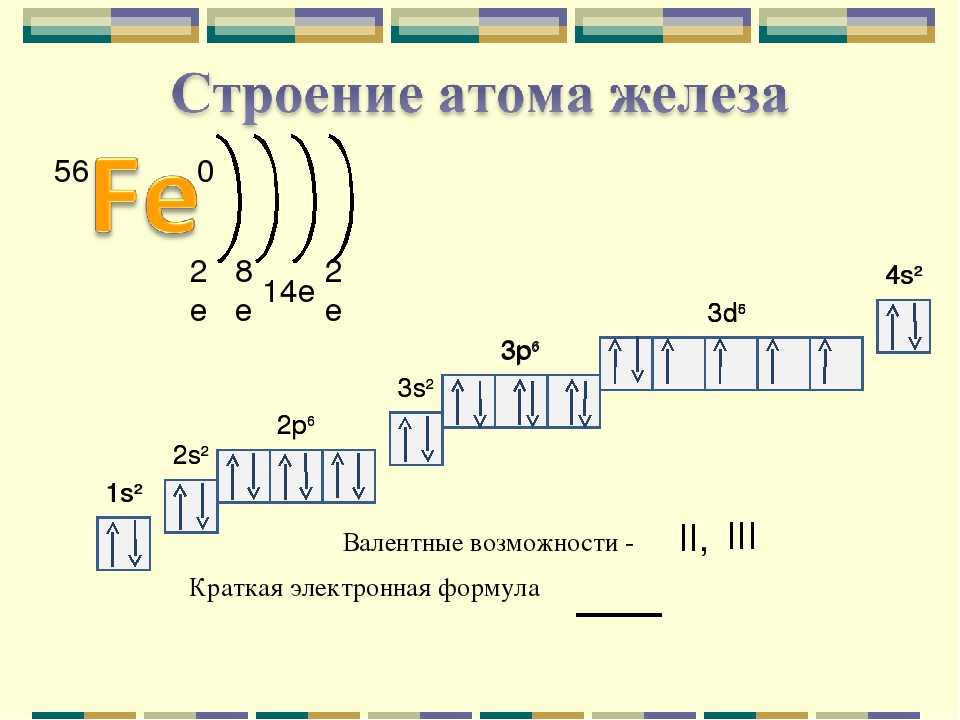 Придется выкручиваться, как в старину, полагаясь на Солнце. «Встречаемся на закате». Плюс-минус час — нестрашно. А можно соорудить солнечные часы — тогда можно назначить время посреди дня. Если, конечно, день выдастся ясным.
Придется выкручиваться, как в старину, полагаясь на Солнце. «Встречаемся на закате». Плюс-минус час — нестрашно. А можно соорудить солнечные часы — тогда можно назначить время посреди дня. Если, конечно, день выдастся ясным.
Чтобы измерить время, на протяжении всей истории люди искали периодические явления вроде вращения Земли вокруг Солнца. В основе механических часов лежат колебания маятника. На первый взгляд, эти колебания постоянны и зависят только от формы маятника, но это не так. Температура, сопротивление воздуха и другие внешние факторы незаметно сбивают маятник.
В кварцевых часах используется другая закономерность — периодические сжимания и разжимания кристалла под воздействием электричества. Проблема в том, что со временем кристалл теряет свои свойства и точность измерения падает.
В конце XIX века физики обнаружили, что материя состоит из атомов. В этом микромире тоже бывают периодические колебания, причем извне на них почти ничего не влияет. Но чтобы приспособить их для измерения времени, понадобилось более полувека.
Пульс частицы
В 1955 году в Национальном бюро стандартов США была представлена первая модель точнейших атомных часов. Ее главным создателем стал физик из Национальной физической лаборатории Великобритании Льюис Эссен.
Эссен (справа) с коллегой Джеком Пэрри рядом с первой моделью атомных часов. Фото: National Physical LaboratoryИзмерение времени волновало ученого с самого начала его карьеры. В 1938 году он создал самые точные для того времени кварцевые часы, которыми стали пользоваться обсерватории всего мира — астрономы, как и сегодня, были главными «заказчиками» идеальных часов. Но на этом Эссен не остановился и стал экспериментировать с атомами цезия-133, справедливо полагая, что внешнее влияние на то, что происходит внутри частиц, минимально. Безусловно, можно было использовать и другие атомы, цезий был просто самым удобным — этот мягкий щелочной металл широко распространен по всей планете.
В 1955 году в Национальном бюро стандартов США Эссен представил свое детище широкой публике. Ставка на атом оказалась верной, атомные часы стали настоящим прорывом в точности определения времени. Вклад Эссена во введение нового стандарта определения времени оценила даже Академия наук СССР, присвоив ученому золотую медаль имени А.С. Попова.
Ставка на атом оказалась верной, атомные часы стали настоящим прорывом в точности определения времени. Вклад Эссена во введение нового стандарта определения времени оценила даже Академия наук СССР, присвоив ученому золотую медаль имени А.С. Попова.
Тем не менее в 1960 году стандартом было выбрано астрономическое определение секунды как доли времени, за которое Земля делает оборот вокруг Солнца. Только семь лет спустя ее наконец заменили «атомной»: Эссен и его коллега, Уильям Марковиц, продемонстрировали, что астрономическая секунда это 9 192 631 770 периодов излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133. Именно это определение мы и находим сегодня во всех справочниках.
1975 г., СССР. Аппаратура, обеспечивающая энергией атомные часы во Всесоюзном научно-исследовательском институте физико-технических и радиотехнических измерений. Фото: Володин Александр / Фотохроника ТАСС«Мне повезло принять участие в трансформации одной из основных мер в науке — времени. От опоры на Солнечной систему и астрономию — к опоре на атомы и физику», — говорил Эссен.
От опоры на Солнечной систему и астрономию — к опоре на атомы и физику», — говорил Эссен.
Как они работают
Атомные часы внешне совсем не похожи на те, что висят у вас на стене. Первая модель была размером с книжный шкаф.
Конструкция атомных часов на самом деле по-прежнему использует кварцевый кристалл. Только теперь его сжимания и разжимания, запускающие ход часов, контролируются колебаниями внутри атома. Эти колебания — периодические переходы между возбужденным и основным энергетическими уровнями в атомах.
Чтобы разобраться с тем, что это за уровни и переходы, вспомним строение атома. В его центре находится положительно заряженное ядро, а вокруг него на собственных орбитах — электроны, заряженные отрицательно. При этом каждый из них находится на определенном энергетическом уровне, то есть имеет то или иное количество энергии за счет притяжения к ядру (подобно тому, как гиря на полке имеет энергию за счет притяжения к Земле).
Если же придать электрону больше энергии, например нагрев атом, то он будет стремиться перескочить на другой, более высокий уровень, с которого потом снова перейдет обратно, отдавая излишки в виде излучения. И вот это самое излучение имеет определенную частоту. И именно этим отдаленно напоминает тот самый маятник в механических часах.
И вот это самое излучение имеет определенную частоту. И именно этим отдаленно напоминает тот самый маятник в механических часах.
Современные атомные часы работают уже не только на атомах цезия, но и на атомах рубидия, стронция, водорода. Общий принцип в них все тот же: стрелки часов управляются периодическими процессами, происходящими внутри частиц.
Нужно больше точности
Физики продолжают совершенствовать и без того точные атомные часы до сих пор.
Национальный институт стандартов и технологий США (NIST) регулярно отчитывается о разработке все новых и новых моделей. Их лучшее на сегодняшний день достижение — часы, отстающие на одну секунду за несколько сотен миллиардов лет. В этом приборе используется уже не цезий, а стронций, причем несколько тысяч его атомов ученые выстроили в трехмерную решетку, охладили до температуры, близкой к абсолютному нулю, и измеряли колебания у всех атомов одновременно.
Схема: Анатолий Лапушко / ChrdkКому это нужно
На самом деле, без прорыва, совершенного в середине XX века Эссеном и его коллегами, было бы невозможным бурное развитие систем спутниковой навигации вроде ГЛОНАСС или GPS, ведь расстояние они определяют именно по времени, за которое сигнал проходит от точки на Земле до спутника и обратно. На современных навигационных спутниках установлено по несколько атомных часов — правда, теперь они работают чаще на атомах рубидия, поскольку такие приборы намного компактнее.
На современных навигационных спутниках установлено по несколько атомных часов — правда, теперь они работают чаще на атомах рубидия, поскольку такие приборы намного компактнее.
Главный же «заказчик» точных часов по-прежнему астрономы. Ведь огромные расстояния в космосе нельзя измерить линейкой. И чтобы определить, сколько нас отделяет от какой-то далекой планеты или астероида, мы можем лишь послать сигнал и зафиксировать время до его возвращения. И каждая секунда погрешности здесь — погрешность примерно в триста тысяч километров.
Впрочем, сегодня вы даже можете купить наручные атомные часы. Конечно, они будут чуть более громоздкими, чем обычные электронные, но зато вы точно ни на секунду не опоздаете.
Прогресс на этом наверняка не остановится. Для новых научных задач потребуется определять время еще точнее. К тому же человек не перестает пытаться взять под контроль время и пространство, которые сами по себе, конечно, вовсе не нуждаются ни в каких единицах измерения.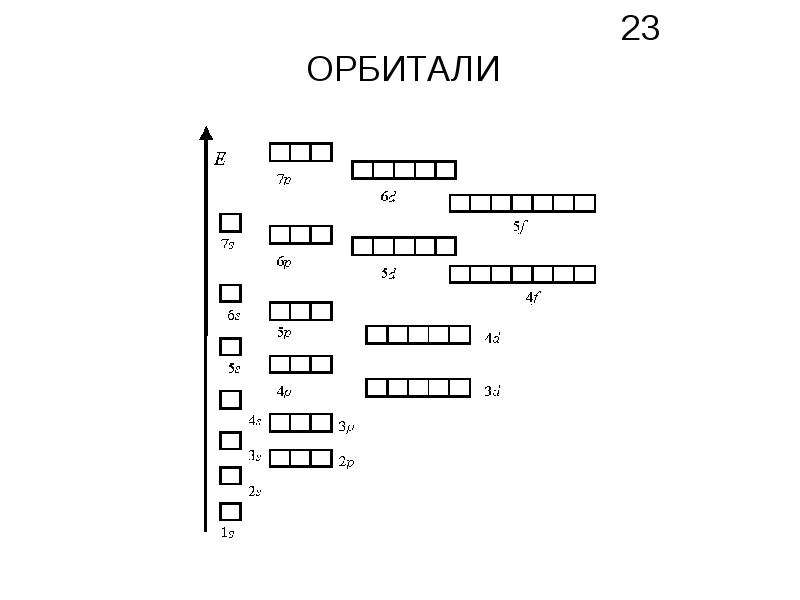
Евгения Береснева
В честь учителя. В таблице Менделеева мог бы появиться… клавдий
По инициативе Международного союза теоретической и прикладной химии (ИЮПАК), поддержанной ЮНЕСКО, Организация Объединенных Наций объявила 2011 год Международным годом химии. Предложенный ИЮПАК девиз «Химия – наша жизнь, наше будущее» подчеркивает важнейшую роль этой науки в обеспечении устойчивого развития нашей планеты. В течение всего года в разных странах мира будут проходить самые различные мероприятия, главная цель которых – повысить интерес общественности к химии и показать ключевую роль этой науки в решении глобальных и повседневных проблем человечества.
Попытаться бросить взгляд в отдаленное будущее – вполне естественное желание для каждого человека, для химика вдвойне актуальное сейчас, в Международный год химии, поскольку он владеет мощным орудием для прогнозирования – периодической системой Дмитрия Менделеева. Благодаря своей стройности система имеет некоторую предсказательную силу. Д.И.Менделеев сам считал, что периодический закон не только средство систематизации громадного экспериментального материала, но и орудие для предсказания новых химических элементов и их свойств. Он сам воспользовался периодическим законом для исправления атомных весов некоторых элементов и для предсказания новых элементов. В своих работах «Естественная система элементов и применение ее к указанию свойств неоткрытых элементов» и «Периодическая законность для химических элементов» Менделеев предсказал элементы экабором, экасилицием и экаалюминием. Правота научных предсказаний Д.И.Менделеева скоро была подтверждена. В 1875 году французский химик П.Лекок де Буабодран открыл элемент галлий, тождественный с экаалюминием. В 1879 году шведский химик Л.Нильсон нашел элемент скандий, полностью соответствующий описанному Менделеевым экабору. В 1886 году немецкий химик К.Винклер открыл германий, соответствующий экасилицию. Прекрасным подтверждением менделеевского закона явилась и открытая Рамзаем группа инертных газов, давшая возможность включить в систему «нулевую» группу – пограничную между щелочными металлами и металлоидами.
Благодаря своей стройности система имеет некоторую предсказательную силу. Д.И.Менделеев сам считал, что периодический закон не только средство систематизации громадного экспериментального материала, но и орудие для предсказания новых химических элементов и их свойств. Он сам воспользовался периодическим законом для исправления атомных весов некоторых элементов и для предсказания новых элементов. В своих работах «Естественная система элементов и применение ее к указанию свойств неоткрытых элементов» и «Периодическая законность для химических элементов» Менделеев предсказал элементы экабором, экасилицием и экаалюминием. Правота научных предсказаний Д.И.Менделеева скоро была подтверждена. В 1875 году французский химик П.Лекок де Буабодран открыл элемент галлий, тождественный с экаалюминием. В 1879 году шведский химик Л.Нильсон нашел элемент скандий, полностью соответствующий описанному Менделеевым экабору. В 1886 году немецкий химик К.Винклер открыл германий, соответствующий экасилицию. Прекрасным подтверждением менделеевского закона явилась и открытая Рамзаем группа инертных газов, давшая возможность включить в систему «нулевую» группу – пограничную между щелочными металлами и металлоидами. Сам Д.И.Менделеев заметил: «Писавши в 1871 году статью о приложении периодического закона к определению свойств еще неоткрытых элементов, я не думал, что доживу до оправдания этого следствия периодического закона, но действительность ответила иначе. Описаны были мною три элемента: экабор, экаалюминий и экасилиций, и не прошло 20 лет, как я имел уже величайшую радость видеть все три открытыми и получившими свои имена от тех трех стран, где найдены редкие минералы, их содержащие, и где сделано их открытие: галлия, скандия и германия. Л. де Буабодрана, Нильсона и Винклера, их открывших, я, со своей стороны, считаю истинными укрепителями периодического закона. Без них он не был бы признан в такой мере, как это случилось ныне. В такой же мере я считаю Рамзая утвердителем справедливости периодического закона…» В течение всего ХХ века человечество в основном заполняло седьмой период. У последнего полученного на сегодня элемента – №118 – целиком заполнены все семь электронных уровней. Поэтому вполне естественно, что он находится в группе инертных газов.
Сам Д.И.Менделеев заметил: «Писавши в 1871 году статью о приложении периодического закона к определению свойств еще неоткрытых элементов, я не думал, что доживу до оправдания этого следствия периодического закона, но действительность ответила иначе. Описаны были мною три элемента: экабор, экаалюминий и экасилиций, и не прошло 20 лет, как я имел уже величайшую радость видеть все три открытыми и получившими свои имена от тех трех стран, где найдены редкие минералы, их содержащие, и где сделано их открытие: галлия, скандия и германия. Л. де Буабодрана, Нильсона и Винклера, их открывших, я, со своей стороны, считаю истинными укрепителями периодического закона. Без них он не был бы признан в такой мере, как это случилось ныне. В такой же мере я считаю Рамзая утвердителем справедливости периодического закона…» В течение всего ХХ века человечество в основном заполняло седьмой период. У последнего полученного на сегодня элемента – №118 – целиком заполнены все семь электронных уровней. Поэтому вполне естественно, что он находится в группе инертных газов. Таким образом, седьмой период таблицы Менделеева завершен. Как будет заполняться периодическая система дальше?Студенты Тывинского государственного университета решили пополнить таблицу Д.И.Менделеева новыми элементами, участвуя в конкурсе творческих работ «Последователи Менделеева», посвященного Международному году химии. В конкурсе творческих работ участвовали студенты 1, 2, 3-го курсов естественно-географического факультета. Творческое задание заключалось в следующем: необходимо было представить себя первооткрывателем неоткрытого химического элемента и описать его исходя из строения атома по схеме: 1. Положение элемента в Периодической таблице химических элементов Д.И.Менделеева: порядковый номер, период, группа.2. Строение атома: заряд ядра, количество электронов и электронных слоев.3. Энергетическая схема строения внешнего слоя электронной оболочки атома химического элемента.4. Исходя из возможных степеней окисления химического элемента предположить, окислителем или восстановителем будет простое вещество.
Таким образом, седьмой период таблицы Менделеева завершен. Как будет заполняться периодическая система дальше?Студенты Тывинского государственного университета решили пополнить таблицу Д.И.Менделеева новыми элементами, участвуя в конкурсе творческих работ «Последователи Менделеева», посвященного Международному году химии. В конкурсе творческих работ участвовали студенты 1, 2, 3-го курсов естественно-географического факультета. Творческое задание заключалось в следующем: необходимо было представить себя первооткрывателем неоткрытого химического элемента и описать его исходя из строения атома по схеме: 1. Положение элемента в Периодической таблице химических элементов Д.И.Менделеева: порядковый номер, период, группа.2. Строение атома: заряд ядра, количество электронов и электронных слоев.3. Энергетическая схема строения внешнего слоя электронной оболочки атома химического элемента.4. Исходя из возможных степеней окисления химического элемента предположить, окислителем или восстановителем будет простое вещество. 5. Соединение химического элемента с кислородом (формула высшего оксида).6. Соединение химического элемента с водородом.7. История открытия элемента. В «открытии» 40 новых химических элементов участвовали около 50 студентов.Как распределялись открытия элементов по студенческим группам? На первом месте – 2-я группа 3-го курса. Ее «ученые» описали 15 химических элементов. «Ученые» 2-й группы 1-го курса занимают второе место (13 открытых элементов).3-я группа 3-го курса «подарила» миру девять элементов. Открытие и наименование нового элемента представляют собой события огромной важности в мире химии. В соответствии с правилами ИЮПАК после подтверждения открытия любого нового элемента ученые (первооткрыватели) имеют право предложить название для него. Первооткрыватели XIX века называли химические элементы в честь своих родных стран. В результате в таблице появились германий (назван в честь Германии), рутений (назван в честь России), франций (назван в честь Франции), полоний (назван в честь страны Польши), калифорний (назван в честь Калифорнии), галлий (название происходит от древнего названия Франции), скандий (от названия Скандинавии).
5. Соединение химического элемента с кислородом (формула высшего оксида).6. Соединение химического элемента с водородом.7. История открытия элемента. В «открытии» 40 новых химических элементов участвовали около 50 студентов.Как распределялись открытия элементов по студенческим группам? На первом месте – 2-я группа 3-го курса. Ее «ученые» описали 15 химических элементов. «Ученые» 2-й группы 1-го курса занимают второе место (13 открытых элементов).3-я группа 3-го курса «подарила» миру девять элементов. Открытие и наименование нового элемента представляют собой события огромной важности в мире химии. В соответствии с правилами ИЮПАК после подтверждения открытия любого нового элемента ученые (первооткрыватели) имеют право предложить название для него. Первооткрыватели XIX века называли химические элементы в честь своих родных стран. В результате в таблице появились германий (назван в честь Германии), рутений (назван в честь России), франций (назван в честь Франции), полоний (назван в честь страны Польши), калифорний (назван в честь Калифорнии), галлий (название происходит от древнего названия Франции), скандий (от названия Скандинавии).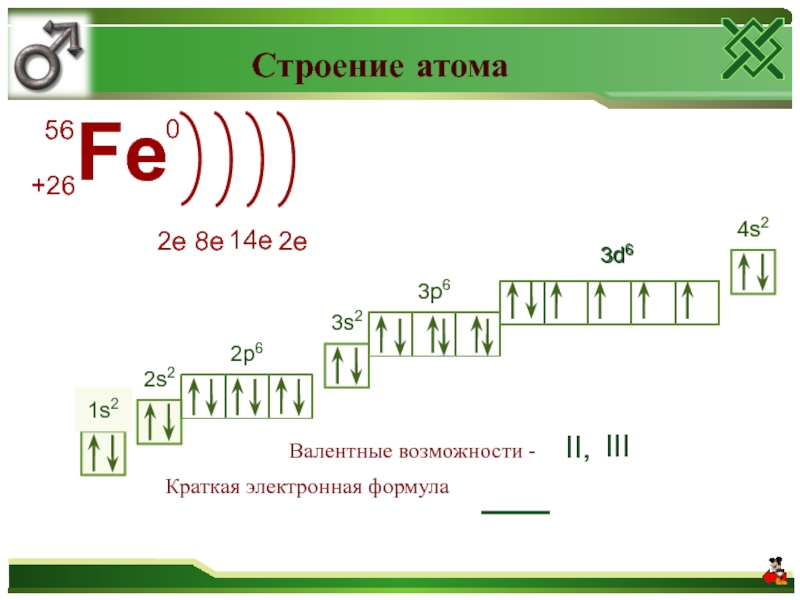 В XX веке новым элементам стали давать названия преимущественно в честь великих ученых. Так, в нижней строчке таблицы Менделеева появились фермий и эйнштейний, кюрий и резерфордий, нобелий и менделевий, рентгений и борий. Производить названия от фамилий политических деятелей, как действующих, так и уже не действующих, пусть и очень весомых, не принято. В честь кого и чего названы новые химические элементы, «открытые» студентами?В честь своей страны (России) назван 1 элемент;в честь родного региона (Тувы) – 4 элемента;в честь города (Туран, Республика Тыва) – 1 элемент;в честь великих ученых – 6 элементов; в честь учителя химии – 1 элемент;в честь преподавателя университета – 1 элемент; в честь первооткрывателя, то есть в честь себя, «новые» элементы назвали 9 студентов. Студенты 3-го курса Оюн Ч. и Очур Х. предложили назвать 120-й химический элемент ломоносовий – в честь Михаила Васильевича Ломоносова – первого русского ученого-естествоиспытателя мирового значения, основателя Московского университета.
В XX веке новым элементам стали давать названия преимущественно в честь великих ученых. Так, в нижней строчке таблицы Менделеева появились фермий и эйнштейний, кюрий и резерфордий, нобелий и менделевий, рентгений и борий. Производить названия от фамилий политических деятелей, как действующих, так и уже не действующих, пусть и очень весомых, не принято. В честь кого и чего названы новые химические элементы, «открытые» студентами?В честь своей страны (России) назван 1 элемент;в честь родного региона (Тувы) – 4 элемента;в честь города (Туран, Республика Тыва) – 1 элемент;в честь великих ученых – 6 элементов; в честь учителя химии – 1 элемент;в честь преподавателя университета – 1 элемент; в честь первооткрывателя, то есть в честь себя, «новые» элементы назвали 9 студентов. Студенты 3-го курса Оюн Ч. и Очур Х. предложили назвать 120-й химический элемент ломоносовий – в честь Михаила Васильевича Ломоносова – первого русского ученого-естествоиспытателя мирового значения, основателя Московского университета.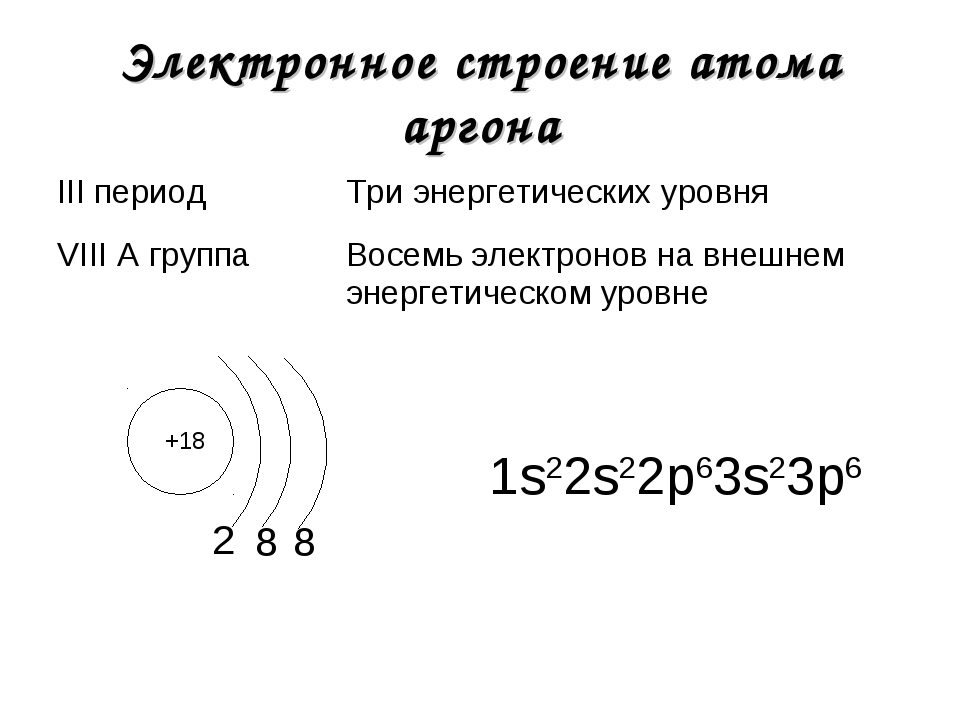 Студент 1-го курса 2-й группы Монгуш Ш. назвал 124-й химический элемент в честь своей страны – России – россиан, Rs. В честь своей родины (Тувы) решили назвать «новый» химический элемент студенты 3-го курса 2-й группы: Сундуй А. – тувий, Tv, Саая А. – тувван, Tu и студенты 1-го курса 2-й группы: Салчак С. – тувиний, Тu, Куулар А. – тувий, Tv. Традицию давать названия в честь великих ученых продолжили студенты 3-го курса: Зерницкая А. – зигмондий, в честь немецкого физика Р.Зигмонда, Атюнина Н. – ньютоний, в честь английского физика И.Ньютона и студентка 1-го курса Дамба О. – рентгений, в честь немецкого физика В.Рентгена. Студентка Салчак С. решила назвать «новый», «открытый» ею химический элемент в честь учителя химии своей школы – Давалай Клавдии Наксыл-ооловны (клавдий, Сv). Ольга КЕНДИВАН, кандидат химических наук, доцент кафедры химии Тывинского государственного университета, Кызыл, Республика Тыва
Студент 1-го курса 2-й группы Монгуш Ш. назвал 124-й химический элемент в честь своей страны – России – россиан, Rs. В честь своей родины (Тувы) решили назвать «новый» химический элемент студенты 3-го курса 2-й группы: Сундуй А. – тувий, Tv, Саая А. – тувван, Tu и студенты 1-го курса 2-й группы: Салчак С. – тувиний, Тu, Куулар А. – тувий, Tv. Традицию давать названия в честь великих ученых продолжили студенты 3-го курса: Зерницкая А. – зигмондий, в честь немецкого физика Р.Зигмонда, Атюнина Н. – ньютоний, в честь английского физика И.Ньютона и студентка 1-го курса Дамба О. – рентгений, в честь немецкого физика В.Рентгена. Студентка Салчак С. решила назвать «новый», «открытый» ею химический элемент в честь учителя химии своей школы – Давалай Клавдии Наксыл-ооловны (клавдий, Сv). Ольга КЕНДИВАН, кандидат химических наук, доцент кафедры химии Тывинского государственного университета, Кызыл, Республика Тыва
Электронное строение атома. Схема строения атома: ядро, электронная оболочка.
 Примеры
ПримерыТак как при химических реакциях ядра реагирующих атомов остаются без изменений (за исключением радиоактивных превращений), то химические свойства атомов зависят от строения их электронных оболочек. Теория электронного строения атома построена на основе аппарата квантовой механики. Так, структура энергетических уровней атома может быть получена на основе квантовомеханических расчетов вероятностей нахождения электронов в пространстве вокруг атомного ядра (рис. 4.5 ).
Рис. 4.5 . Схема подразделения энергетических уровней на подуровни
Основы теории электронного строения атома сводятся к следующим положениям: состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами: главным квантовым числом n = 1, 2, 3, ; орбитальным (азимутальным)l=0,1,2, n–1 ; магнитнымm l = –l, –1,0,1, l ; спиновымm s = -1/2, 1/2 .
Согласно принципу Паули , в одном и
том же атоме не может быть двух электронов,
обладающих одинаковой совокупностью
четырех квантовых чиселn,
l, m l ,
m s ; совокупности электронов с одинаковыми
главными квантовыми числами n образуют
электронные слои, или энергетические
уровни атома, нумеруемые от ядра и
обозначаемые какK,
L, M, N, O, P, Q , причем в энергетическом
слое с данным значениемn могут находиться не более, чем2n 2 электронов. Совокупности электронов с одинаковыми
квантовыми числамиn иl , образуют подуровни, обозначаемые
по мере удаления их от ядра какs,
p, d, f .
Совокупности электронов с одинаковыми
квантовыми числамиn иl , образуют подуровни, обозначаемые
по мере удаления их от ядра какs,
p, d, f .
Вероятностное нахождение положения
электрона в пространстве вокруг атомного
ядра соответствует принципу
неопределенностей Гейзенберга. По
квантовомеханическим представлениям,
электрон в атоме не имеет определенной
траектории движения и может находиться
в любой части пространства вокруг ядра,
а различные его положения рассматриваются
как электронное облако с определенной
плотностью отрицательного заряда.
Пространство вокруг ядра, в котором
наиболее вероятно нахождение электрона,
называется орбиталью . В нем заключено
порядка 90% электронного облака. Каждому
подуровню1s,
2s, 2p и т.д. соответствует определенное
количество орбиталей определенной
формы. Например,1s –
и2s- орбитали
имеют сферическую форму, а2p -орбитали
(2p x ,
2p y ,
2p z -орбитали)
ориентированы во взаимно перпендикулярных
направлениях и имеют форму гантели
(рис. 4.6 ).
4.6 ).
Рис. 4.6 . Форма и ориентация электронных орбиталей.
При химических реакциях атомное ядро не претерпевает изменений, изменяются лишь электронные оболочки атомов, строением которых объясняются многие свойства химических элементов. На основе теории электронного строения атома был установлен глубокий физический смысл периодического закона химических элементов Менделеева и создана теория химической связи.
Теоретическое обоснование периодической системы химических элементов включает в себя данные о строении атома, подтверждающие существование связи между периодичностью изменения свойств химических элементов и периодическим повторением сходных типов электронных конфигураций их атомов.
В свете учения о строении атома становится
обоснованным разделение Менделеевым
всех элементов на семь периодов: номер
периода соответствует числу энергетических
уровней атомов, заполняемых электронами.
В малых периодах с ростом положительных
заряда ядер атомов возрастает число
электронов на внешнем уровне (от 1 до 2
в первом периоде, и от 1 до 8 во втором и
третьем периодах), что объясняет изменение
свойств элементов: в начале периода
(кроме первого) находится щелочной
металл, затем наблюдается постепенное
ослабление металлических свойств и
усиление неметаллических. Эта
закономерность прослеживается для
элементов второго периода в таблице
4.2.
Эта
закономерность прослеживается для
элементов второго периода в таблице
4.2.
Таблица 4.2.
В больших периодах с ростом заряда ядер заполнение уровней электронами происходит сложнее, что и объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов.
Одинаковый характер свойств химических элементов в подгруппах объясняется сходным строением внешнего энергетического уровня, как это показано в табл. 4.3 , иллюстрирующей последовательность заполнения электронами энергетических уровней для подгрупп щелочных металлов.
Таблица 4.3.
Номер группы, как правило, указывает на
число электронов в атоме, которые могут
участвовать в образовании химических
связей. В этом заключается физический
смысл номера группы. В четырех местах
периодической системы элементы
расположены не в порядке возрастания
атомных масс: Ar иK ,Co иNi ,T e иI ,Th иPa . Эти отступления считались
недостатками периодической системы
химических элементов. Учение о строении
атома объяснило указанные отступления.
Опытное определение зарядов ядер
показало, что расположение этих элементов
соответствует возрастанию зарядов их
ядер. Кроме того, опытное определение
зарядов ядер атомов дало возможность
определить число элементов между
водородом и ураном, а также число
лантаноидов. Ныне все места в периодической
системе заполнены в промежутке
отZ=1 доZ=114 ,
однако периодическая система не
закончена, возможно открытие новых
трансурановых элементов.
Эти отступления считались
недостатками периодической системы
химических элементов. Учение о строении
атома объяснило указанные отступления.
Опытное определение зарядов ядер
показало, что расположение этих элементов
соответствует возрастанию зарядов их
ядер. Кроме того, опытное определение
зарядов ядер атомов дало возможность
определить число элементов между
водородом и ураном, а также число
лантаноидов. Ныне все места в периодической
системе заполнены в промежутке
отZ=1 доZ=114 ,
однако периодическая система не
закончена, возможно открытие новых
трансурановых элементов.
Состав атома.
Атом состоит из атомного ядра и электронной оболочки .
Ядро атома состоит из протонов (p + ) и нейтронов (n 0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N (p + ) равно заряду ядра (Z ) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов).
N (p +) = Z
Сумма числа нейтронов N (n 0), обозначаемого просто буквой N , и числа протонов Z называется массовым числом и обозначается буквой А .
A = Z + N
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е -).
Число электронов N (e -) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра.
Форма атома – сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент – вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп – совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение отдельного атома или изотопа: (Э – символ элемента), например: .
Строение электронной оболочки атома
Атомная орбиталь – состояние электрона в атоме. Условное обозначение орбитали – . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s , p , d и f .
Электронное облако – часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Примечание : иногда понятия “атомная орбиталь” и “электронное облако” не различают, называя и то, и другое “атомной орбиталью”.
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный (“энергетический”) уровень , их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s -подуровень (состоит из одной s -орбитали), условное обозначение – .
p -подуровень (состоит из трех p
d -подуровень (состоит из пяти d -орбиталей), условное обозначение – .
f -подуровень (состоит из семи f -орбиталей), условное обозначение – .
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s , 3p , 5d означает s -подуровень второго уровня, p -подуровень третьего уровня, d -подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n . Общее число орбиталей на одном уровне равно n 2 . Соответственно этому, общее число облаков в одном слое равно также n 2 .
Обозначения: – свободная орбиталь (без электронов), – орбиталь с неспаренным электроном, – орбиталь с электронной парой (с двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии – электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули – на одной орбитали не может быть больше двух электронов.
3. Правило Хунда – в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n 2 .
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s , 2s , 2p , 3s , 3p , 4s , 3d , 4p , 5s , 4d , 5p , 6s , 4f , 5d , 6p , 7s , 5f , 6d , 7p …
Наглядно эта последовательность выражается энергетической диаграммой:
Распределение электронов атома по уровням, подуровням и орбиталям (электронная конфигурация атома) может быть изображена в виде электронной формулы, энергетической диаграммы или, упрощенно, в виде схемы электронных слоев (“электронная схема”).
Примеры электронного строения атомов:
Валентные электроны – электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны – 4s 2 , они же и валентные; у атома Fe внешние электроны – 4s 2 , но у него есть 3d 6 , следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция – 4s 2 , а атома железа – 4s 2 3d 6 .
Периодическая система химических элементов Д. И. Менделеева
(естественная система химических элементов)
Периодический закон химических элементов (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.
Периодическая система – графическое выражение периодического закона.
Естественный ряд химических элементов – ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Таблица химических элементов строится путем “разрезания” естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов.
В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
Группы короткопериодной таблицы делятся на подгруппы (главные и побочные ), совпадающие с группами длиннопериодной таблицы.
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода.
Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
В короткопериодной таблице – восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице – шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB – побочной подгруппе седьмой группы: остальные – аналогично.
Характеристики химических элементов закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается число внешних электронов,
- уменьшается радиус атомов,
- увеличивается прочность связи электронов с ядром (энергия ионизации),
- увеличивается электроотрицательность,
- усиливаются окислительные свойства простых веществ (“неметалличность”),
- ослабевают восстановительные свойства простых веществ (“металличность”),
- ослабевает основный характер гидроксидов и соответствующих оксидов,
- возрастает кислотный характер гидроксидов и соответствующих оксидов.
В группах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается радиус атомов (только в А-группах),
- уменьшается прочность связи электронов с ядром (энергия ионизации; только в А-группах),
- уменьшается электроотрицательность (только в А-группах),
- ослабевают окислительные свойства простых веществ (“неметалличность”; только в А-группах),
- усиливаются восстановительные свойства простых веществ (“металличность”; только в А-группах),
- возрастает основный характер гидроксидов и соответствующих оксидов (только в А-группах),
- ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в А-группах),
- снижается устойчивость водородных соединений (повышается их восстановительная активность; только в А-группах).
Задачи и тесты по теме “Тема 9. “Строение атома. Периодический закон и периодическая система химических элементов Д. И. Менделеева (ПСХЭ)”.”
- Периодический закон – Периодический закон и строение атомов 8–9 класс
Вы должны знать: законы заполнения орбиталей электронами (принцип наименьшей энергии, принцип Паули, правило Хунда), структуру периодической системы элементов.Вы должны уметь: определять состав атома по положению элемента в периодической системе, и, наоборот, находить элемент в периодической системе, зная его состав; изображать схему строения, электронную конфигурацию атома, иона, и, наоборот, определять по схеме и электронной конфигурации положение химического элемента в ПСХЭ; давать характеристику элемента и образуемых им веществ по его положению в ПСХЭ; определять изменения радиуса атомов, свойств химических элементов и образуемых ими веществ в пределах одного периода и одной главной подгруппы периодической системы.
Пример 1. Определите количество орбиталей на третьем электронном уровне. Какие это орбитали?
Для определения количества орбиталей воспользуемся формулой N орбиталей = n 2 , где n – номер уровня. N орбиталей = 3 2 = 9. Одна 3s -, три 3p – и пять 3d -орбиталей.Пример 2. Определите, у атома какого элемента электронная формула 1s 2 2s 2 2p 6 3s 2 3p 1 .
Для того, чтобы определить, кокой это элемент, надо выяснить его порядковый номер, который равен суммарному числу электронов атома. В данном случае: 2 + 2 + 6 + 2 + 1 = 13. Это алюминий.Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:- О. С. Габриелян и др. Химия 11 кл. М., Дрофа, 2002;
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 11 кл. М., Просвещение, 2001.
Понятие атом возникло еще в античном мире для обозначения частиц вещества. В переводе с греческого атом означает «неделимый».
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, сущеетвующими в атомах всех химических элементов. В 1891 г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь». Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу (-1). Томсон даже сумел определить скорость движения электрона (скорость электрона на орбите обратно пропорциональна номеру орбиты n. Радиусы орбит растут пропорционально квадрату номера орбиты. На первой орбите атома водорода (n=1; Z=1) скорость равна ≈ 2,2·106 м/с, то есть примерно в сотню раз меньше скорости света с=3·108 м/с.) и массу электрона (она почти в 2000 раз меньше массы атома водорода).
Состояние электронов в атомеПод состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона и пространстве, в котором он находится . Электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра .
Он может находиться в любой части этого пространства, окружающего ядро, и совокупность его различных положений рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено приблизительно 90 % электронного облака , и это означает, что около 90 % времени электрон находится в этой части пространства. По форме различают 4 известных ныне типа орбиталей , которые обозначаются латинскими буквами s, p, d и f . Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром . Электроны, обладающие близкими значениями энергии, образуют единый электронный слои, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра, – 1, 2, 3, 4, 5, 6 и 7.
Целое число n, обозначающее номер энергетического уровня, называют главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней будут характеризоваться большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
N = 2n 2 ,
где N – максимальное число электронов; n – номер уровня, или главное квантовое число. Следовательно, на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором – не более 8; на третьем – не более 18; на четвертом – не более 32.
Начиная со второго энергетического уровня (n = 2) каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один подуровень; второй – два; третий – три; четвертый – четыре подуровня . Подуровни в свою очередь образованы орбиталями. Каждому значению n соответствует число орбиталей, равное n.
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: s, p, d, f.
Протоны и нейтроныАтом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Э. Резерфордом, называют планетарной .
Атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов – протонов и нейтронов .
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку (+1), и массу, равную массе атома водорода (она принята в химии за единицу). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона.
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus – ядро). Сумма числа протонов и нейтронов в атоме называется массовым числом . Например, массовое число атома алюминия:
13 + 14 = 27
число протонов 13, число нейтронов 14, массовое число 27
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают e — .
Поскольку атом электронейтрален , то также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента (Z), т. е. число протонов, и массовое число (А), равное сумме чисел протонов и нейтронов, можно найти число нейтронов (N) по формуле:
N = A — Z
Например, число нейтронов в атоме железа равно:
56 — 26 = 30
ИзотопыРазновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами . Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой 12, 13, 14; кислород – три изотопа с массой 16, 17, 18 и т. д. Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе. Химические свойства изотопов большинства химических элементов совершенно одинаковы. Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки.
Элементы первого периодаСхема электронного строения атома водорода:
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Графическая электронная формула атома водорода (показывает распределение электронов по энергетическим уровням и подуровням):
Графические электронные формулы атомов показывают распределение электронов не только по уровням и подуровням, но и по орбиталям.
В атоме гелия первый электронный слой завершен – в нем 2 электрона. Водород и гелий – s-элементы; у этих атомов заполняется электронами s-орбиталь.
У всех элементов второго периода первый электронный слой заполнен , и электроны заполняют s- и р-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала s, а затем р) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен – в нем 8 электронов.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d- подуровни.
У атома магния достраивается 3s- электронная орбиталь. Na и Mg – s-элементы.
У алюминия и последующих элементов заполняется электронами 3р-подуровень.
У элементов третьего периода остаются незаполненными 3d-орбитали.
Все элементы от Al до Ar – р-элементы. s- и р-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого — седьмого периодов
У атомов калия и кальция появляется четвертый электронный слой, заполняется 4s-подуровень, т. к. он имеет меньшую энергию, чем 3d-подуровень.
К, Са – s-элементы, входящие в главные подгруппы. У атомов от Sc до Zn заполняется электронами 3d-подуровень. Это 3d-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с 4s- на 3d-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d 5 и 3d 10:
В атоме цинка третий электронный слой завершен – в нем заполнены все подуровни 3s, 3р и 3d, всего на них 18 электронов. У следующих за цинком элементов продолжает заполняться четвертый электронный слой, 4р-подуровень.
Элементы от Ga до Кr – р-элементы.
У атома криптона внешний слой (четвертый) завершен, имеет 8 электронов. Но всего в четвертом электронном слое может быть 32 электрона; у атома криптона пока остаются незаполненными 4d- и 4f-подуровни.У элементов пятого периода идет заполнение по-дуровней в следующем порядке: 5s — 4d — 5р. И так-же встречаются исключения, связанные с «провалом » электронов, у 41 Nb, 42 Мо, 44 Ru, 45 Rh, 46 Pd, 47 Ag.
В шестом и седьмом периодах появляются f-элементы, т. е. элементы, у которых идет заполнение соответственно 4f- и 5f-подуровней третьего снаружи электронного слоя.
4f-элементы называют лантаноидами.
5f-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: 55 Cs и 56 Ва – 6s-элементы; 57 La … 6s 2 5d x – 5d-элемент; 58 Се – 71 Lu – 4f-элементы; 72 Hf — 80 Hg – 5d-элементы; 81 Т1 — 86 Rn – 6d-элементы. Но и здесь встречаются элементы, у которых «нарушается» порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных f-подуровней, т. е. nf 7 и nf 14 . В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы делят на четыре электронных семейства, или блока:
- s-элементы . Электронами заполняется s-подуровень внешнего уровня атома; к s-элементам относятся водород, гелий и элементы главных подгрупп I и II групп.
- p-элементы . Электронами заполняется р-подуровень внешнего уровня атома; к р-элементам относятся элементы главных подгрупп III- VIII групп.
- d-элементы . Электронами заполняется d-подуровень предвнешнего уровня атома; к d-элементам относятся элементы побочных подгрупп I-VIII групп, т. е. элементы вставных декад больших периодов, расположенных между s- и р-элементами. Их также называют переходными элементами.
- f-элементы . Электронами заполняется f-подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и антиноиды.
Швейцарский физик В. Паули в 1925 г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского – «веретено»), т. е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси: по часовой или против часовой стрелки.
Этот принцип носит название принципа Паули . Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т. е. электроны с противоположными спинами. На рисунке показана схема подразделения энергетических уровней на подуровни и очередность их заполнения.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических или квантовых ячеек – записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули и правило Ф. Хунда , согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, а лишь затем спариваются, но спины, при этом по принципу Паули будут уже противоположно направленными.
Правило Хунда и принцип Паули
Правило Хунда – правило квантовой химии, определяющее порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка : Ниже по энергии лежит тот атомный терм, для которого выполняются два условия.
- Мультиплетность максимальна
- При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p -элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками – электроны, причём направление стрелки обозначает ориентацию спина).
Правило Клечковского
Правило Клечковского — по мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра.
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречатреальной энергетической последовательности атомых орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место “провал” электрона с s-подуровня внешнего слояна d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, аименно: после заполнения двумя электронами орбитали 6s
Алгоритм составления электронной формулы элемента:
1. Определите число электронов в атоме используя Периодическую таблицу химических элементов Д.И. Менделеева .
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей :
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором – максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем – максимум 18 (два s , шесть p , и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s- подуровень, затем р-, d- b f- подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Примеры.
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.
1s 2 2s 2 2p 6 3s 2 3p 6 .
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.
Электронную формулу цинка можно представить в виде.
Давайте рассмотрим, как построен атом. Учитывайте, что речь будет вестись исключительно о моделях. На практике атомы представляют собой гораздо более сложную структуру. Но благодаря современным разработкам мы имеем возможность объяснять и даже успешно предсказывать свойства (пускай даже и не все). Итак, какова схема строения атома? Из чего он «сделаны»?
Планетарная модель атома
Впервые была предложена датским физиком Н. Бором в 1913 году. Это первая теория строения атома, основанная на научных фактах. К тому же она положила основу современной тематической терминологии. В ней электроны-частицы производят вращательные движения вокруг атома по такому же принципу, как планеты вокруг Солнца. Бор высказал предположение, что они могут существовать исключительно на орбитах, находящихся на строго определённом расстоянии от ядра. Почему именно так, учёный с позиции науки не смог объяснить, но такая модель потдтверждалась многими экспериментами. Для обозначения орбит использовались целые числа, начиная с единицы, которой нумеровалась, самая близкая к ядру. Все эти орбиты также называют уровнями. У атома водорода только один уровень, на котором вращается один электрон. Но сложные атомы имеют ещё уровни. Они делятся на составляющие, которые объединяют близкие по энергетическому потенциалу электроны. Так, второй уже имеет два подуровня – 2s и 2р. Третий имеет уже три – 3s, 3р и 3d. И так далее. Сначала «заселяются» более близкие к ядру подуровни, а потом дальние. На каждом из них может быть размещено только определённое количество электронов. Но это ещё не конец. Каждый подуровень делится на орбитали. Давайте проведём сравнение с обычной жизнью. Электронное облако атома сравнимо с городом. Уровни – это улицы. Подуровень – частный дом или квартира. Орбиталь – комната. В каждой из них «проживает» один или два электрона. Все они имеют конкретные адреса. Вот такой была первая схема строения атома. А напоследок про адреса электронов: они определяются наборами чисел, которые называют «квантовыми».
Волновая модель атома
Но со временем планетарная модель подверглась пересмотру. Была предложена вторая теория строения атома. Она более совершенна и позволяет объяснить результаты практических экспериментов. На смену первой пришла волновая модель атома, которую предложит Э. Шредингер. Тогда уже было установлено, что электрон может проявлять себя не только в качестве частицы, но и как волна. А что сделал Шредингер? Он применил уравнение, описывающее движение волны в Таким образом можно найти не траекторию движения электрона в атоме, а вероятность его обнаружения в определённой точке. Объединяет обе теории то, что элементарные частицы находятся на конкретных уровнях, подуровнях и орбиталях. На этом похожесть моделей заканчивается. Приведу один пример – в волновой теории орбиталью называется область, где можно будет найти электрон с вероятностью в 95%. На всё остальное пространство приходится 5%.Но в конечном итоге получилось, что особенности строения атомов изображаются с использование волновой модели, при том, что используется терминология используется общая.
Понятие вероятности в данном случае
Почему был использован этот термин? Гейзенбергом в 1927 г. был сформулирован принцип неопределенности, который сейчас используется, чтобы описывать движение микрочастиц. Он основан на их фундаментальном отличии от обычных физических тел. В чем оно заключается? Классическая механика предполагала, что человек может наблюдать явления, не влияя на них (наблюдение за небесными телами). На основе полученных данных можно рассчитать, где объект будет в определенный момент времени. Но в микромире дела необходимо обстоят по-другому. Так, к примеру, наблюдать за электроном, не влияя на него, сейчас не представляется возможным ввиду того, что энергии инструмента и частицы несопоставимы. Это приводит к тому, что меняется его местоположение элементарной частицы, состояние, направление, скорость движения и другие параметры. И бессмысленно говорить о точных характеристиках. Сам принцип неопределенности говорит нам о том, что невозможно вычислить точную траекторию полёта электрона вокруг ядра. Можно только указать вероятность нахождения частицы в определённом участке пространства. Вот такую особенность имеет строение атомов химических элементов. Но это следует учитывать исключительно ученым в практических экспериментах.
Состав атома
Но давайте сконцентрируемся на всём объекте рассмотрения. Итак, кроме неплохо рассмотренной электронной оболочки, второй составляющей атома является ядро. Оно состоит из позитивно заряженных протонов и нейтральных нейтронов. Все мы знакомы с таблицей Менделеева. Номер каждого элемента соответствует количеству протонов, что в нём есть. Количество нейтронов равняется разнице между массой атома и его количеством протонов. Могут и быть отклонения от этого правила. Тогда говорят о том, что присутствует изотоп элемента. Схема строения атома такова, что его «окружает» электронная оболочка. обычно равняется количеству протонов. Масса последнего примерно в 1840 раз больше, чем у первого, и примерно равна весу нейтрона. Радиус ядра составляет около 1/200000 диаметра атома. Сам он имеет сферическую форму. Таково, в общем, строение атомов химических элементов. Несмотря на различие в массе и свойствах, выглядят они примерно одинаково.
Орбиты
Говоря о том, что такое схема строения атома, нельзя умолчать о них. Итак, есть такие виды:
- s. Имеют сферическую форму.
- p. Являются похожими на объемные восьмерки или веретено.
- d и f. Имеют сложную форму, которая с трудом описывается формальным языком.
Электрон каждого типа можно с вероятностью в 95% найти на территории соответствующей орбитали. К представленной информации необходимо относиться спокойно, поскольку это, скорее, абстрактная математическая модель, нежели физическое реальное положение дел. Но при всём этом она обладает хорошей предсказательной силой относительно химических свойств атомов и даже молекул. Чем дальше от ядра расположен уровень, тем больше электронов можно на нём разместить. Так, количество орбиталей можно подсчитать с помощью специальной формулы: х 2 . Здесь х равно количеству уровней. А поскольку на орбитали можно разместить до двух электронов, то в конечном итоге формула их численного поиска будет выглядеть следующим образом: 2х 2 .
Орбиты: технические данные
Если говорить про строение атома фтора, то он будет иметь три орбитали. Все они будут заполнены. Энергия орбиталей в рамках одного подуровня одинакова. Чтобы их обозначить, добавляют номер слоя: 2s, 4p, 6d. Возвращаемся к разговору про строение атома фтора. У него будет два s- и один p-подуровень. У него девять протонов и столько же электронов. Сначала один s-уровень. Это два электрона. Потом второй s-уровень. Ещё два электрона. И 5 заполняют p-уровень. Вот такое у него строение. После прочтения следующего подзаголовка можно собственноручно проделать необходимые действия и убедиться в этом. Если говорить про к которым относится и фтор, то следует отметить, что они, хотя и в одной группе, полностью различаются по своим характеристикам. Так, их температура кипения колеблется от -188 до 309 градусов Цельсия. Так почему их объединили? Все благодаря химическим свойствам. Все галогены, а в наибольшей степени фтор обладают высочайшей окислительной способностью. Они реагируют с металлами и без проблем могут самостоятельно воспламеняться при комнатной температуре.
Как заполняются орбиты?
По каким правилам и принципам располагаются электроны? Предлагаем ознакомиться с тремя основными, формулировка которых была упрощена для лучшего понимания:
- Принцип наименьшей энергии. Электронам свойственно заполнять орбитали в порядке увеличения их энергии.
- Принцип Паули. На одной орбитали не может располагаться больше двух электронов.
- Правило Хунда. В пределах одного подуровня электроны заполняют сначала свободные орбитали, и только потом образуют пары.
В деле заполнения поможет и строение атома в таком случае станет более понятным в плане изображения. Поэтому при практической работе с построением схем элементов, необходимо держать её под рукой.
Пример
Для того, чтобы обобщить всё сказанное в рамках статьи, можно составить образец, как же распределяются электроны атома по своим уровням, подуровням и орбиталям (то есть, какой является конфигурация уровней). Он может быть изображен как формула, энергетическая диаграмма или как схема слоев. Здесь присутствуют очень хорошие иллюстрации, которые при внимательном рассмотрении помогают понять структуру атома. Так, сначала заполняется первый уровень. В нём имеется только один подуровень, в котором только одна орбиталь. Все уровни заполняются последовательно, начиная с меньшего. Сначала в рамках одного подуровня по одному электрону размещается на каждой орбитали. Потом создаются пары. И при наличии свободных происходит переключение на другой субъект заполнения. А теперь можно самостоятельно узнать, каково строение атома азота или фтора (который рассматривался раньше). Первоначально может быть немного сложно, но можно ориентироваться по картинкам. Давайте для ясности рассмотрим и строение атома азота. Он имеет 7 протонов (вместе с нейтронами составляющих ядро) и столько же электронов (которые составляют электронную оболочку). Сначала заполняется первый s-уровень. На нем 2 электрона. Потом идёт второй s-уровень. На ней тоже 2 электрона. И три остальных размещаются на p-уровне, где каждый из них занимает по одной орбитали.
Заключение
Как видите, строение атома – не такая сложная тема (если подходить к ней с позиции школьного курса химии, конечно). И понять данную тему не составляет труда. Напоследок хочется сообщить про некоторые особенности. К примеру, говоря про строение атома кислорода, мы знаем, что он имеет восемь протонов, и 8-10 нейтронов. И так как все в природе стремится к равновесию, два атома кислорода образуют молекулу, где два непарных электрона образуют ковалентную связь. Подобным же образом образуется другая стойкая молекула кислорода – озон (O 3). Зная строение атома кислорода, можно правильно составлять формулы окислительных реакций, в которых участвует самое распространенное на Земле вещество.
Франций химический элемент интересные факты. Химический элемент Франций (Fr). Общая Характеристика (Fr)
К числу вторых – их сосед по периодической системе элемент № 87 – франций.
Франций интересен по двум причинам: во-первых, это самый тяжелый и самый активный щелочной металл; во-вторых, франций можно считать самым неустойчивым из первых ста элементов периодической системы , У самого долгоживущего изотопа франция – 223 Fr – период полураспада составляет всего 22 минуты. Такое редкое сочетание в одном элементе высокой химической активности с низкой ядерной устойчивостью определило трудности в открытии и изучении этого элемента.
Как искали франций
На долю женщин-ученых не так уж часто выпадает счастье открытия новых элементов. Всем известно имя Марии Склодовской-Кюри, которая открыла радий и полоний . Менее известна Ида Ноддак (Такке), обнаружившая рений . Открытие элемента № 87 связано с именем еще одной женщины – француженки Маргариты Пере, кстати, ученицы Марии Склодовской-Кюри. 9 января 1939 г. она заявила об открытии элемента № 87. Вернемся, однако, назад почти на 70 лет и рассмотрим историю открытия этого элемента более подробно.
Возможность существования и основные свойства элемента № 87 были предсказаны Д.И. Менделеевым. В 1871 г. в статье «Естественная система элементов и применение ее к указанию свойств неоткрытых элементов», опубликованной в журнале Русского физико-химического общества, он писал: «Затем в десятом ряду можно ждать еще основных элементов, принадлежащих к I, II и III группам. Первый из них должен образовывать окисел R 2 O, второй – RO, а третий – R 2 O 3 ; первый будет сходен с цезием , второй – с барием , а все их окиси должны обладать, конечно, характером самых энергичных оснований».
Исходя из местоположения экацезия в периодической системе, следовало ожидать, что сам металл будет жидким при комнатной температуре, так как цезий плавится при 28°С. Из-за высокой реакционной способности весь земной экацезий должен бы встречаться только в виде солей, которые по своей растворимости должны превосходить соли остальных щелочных металлов, поскольку при переходе от лития к цезию растворимость солей возрастает.
Однако открыть этот интересный элемент ученым XIX столетия не удалось. После открытия радиоактивных соседей элемента № 87 стало очевидно, что он тоже должен быть радиоактивным. Но и это не прояснило ситуацию.
Ученых, занимавшихся поисками 87-го элемента, условно можно разделить на две большие группы. Первая предполагала существование в природе стабильных или долгоживущих изотопов этого элемента и потому вела поиски его в минералах и концентратах щелочных металлов, в воде морей и океанов, в золе сена и грибов, в патоке и пепле сигар. Вторая группа ученых, ориентируясь на радиоактивность элемента № 87, искала его среди продуктов распада соседних с ним элементов.
При поисках экацезия в воде морей и океанов особый интерес представляла вода Мертвого моря, омывающего земли Палестины. В результате экспедиций было установлено, что в воде этого моря в значительных количествах содержатся ионы щелочных металлов, галогенов и других элементов. «В воде Мертвого моря невозможно утонуть», – сообщали популярные журналы. Английского ученого И. Фриенда, который в июле 1925 г. отправился в эти края, интересовало нечто иное. «Уже несколько лет назад, – писал он, – мне пришло в голову, что если экацезий способен к постоянному существованию, то его можно будет найти в Мертвом море».
Из проб воды удаляли все элементы, кроме щелочных. Хлориды же щелочных металлов разделяли путем дробного осаждения. Хлорид экацезия должен был быть самым растворимым. Однако и проводимый на последнем этапе рентгеноспектральный анализ не позволил обнаружить экацезий.
Тем не менее в литературе вскоре появилось несколько сообщений об открытии 87-го элемента, но все они впоследствии не подтвердились. В 1926 г. английские химики Дж. Дрюс и Ф. Лоринг сообщили, что наблюдали линии экацезия на рентгенограммах сульфата марганца, и предложили для вновь открытого элемента название «алкалиний». В 1929 г. американский физик Ф. Аллисон с помощью в основе своей ошибочного метода магнитооптического анализа обнаружил следы 87-го элемента в редких минералах щелочных металлов – поллуците и лепидолите . Он назвал «свой» элемент виргинием. В 1931 г. американские ученые Дж. Пэпиш и Э. Вайнер вроде бы даже выделили экацезий из минерала самарскита, а в 1937 г. румынский химик Г. Хулубей обнаружил экацезий в минерале поллуците и назвал его молдавием. Но все эти открытия не удалось подтвердить, ибо открыватели алкалиния, Виргиния и Молдавия ни в малой степени не учитывали важнейшего свойства экацезия – его радиоактивности.
Однако неудачи преследовали и вторую группу ученых, занимавшихся поисками 87-го элемента среди продуктов распада радиоактивных семейств. Ни в одном из известных в то время радиоактивных семейств – урана 238 (4n+2), урана-235 (4n+3) и тория-232 (4n) – линии радиоактивных превращений не проходили через изотопы 87-го элемента. Это могло быть по двум причинам: либо элемент № 87 – член отсутствующего ряда (4n+1), либо недостаточно тщательно изучен процесс радиоактивного распада урана-238 или урана-235 на участке радий – полоний. Действительно, уже в самом начале более тщательного изучения ряда урана-238 было обнаружено, что изотоп 214 Bi может распадаться двумя путями: испытывать альфа-распад, превращаясь в 210Т1, или бета-распад, переходя в изотоп 214 Ро. Это явление получило название разветвленного распада, или радиоактивной вилки. Можно было ожидать подобных вилок и на участке радий – полоний.
Первое сообщение об открытии 87-го элемента как продукта радиоактивного распада появилось еще в 1913 г. и принадлежало английскому химику Дж. Крэнстону. Работая с препаратом 228 Ас, он обнаружил наличие у этого изотопа слабого альфа-излучения (помимо известного и ранее бета-излучения). В результате альфа-распада 228 Ас превращается в изотоп 87-го элемента – 224 87 . К сожалению, сообщение Крэнстона осталось незамеченным.
Через год сразу три австрийских радиохимика – Мейер, Гесс и Панет – наблюдали явление разветвленного распада изотопа 227 Ас, принадлежащего к ряду урана-235 (4n+3). Они обнаружили альфа-частицы с длиной пробега в воздухе 3,5 см. «Эти частицы образуются при альфа-распаде обычно бета-активного 227 Ас,- рассуждали они, – …продуктом распада должен быть изотоп элемента 87».
Однако к выводам этих ученых многие отнеслись с недоверием. Оно было вызвано в основном тем, что наблюдаемая альфа-активность была очень слабой, а это таило в себе возможность ошибки, тем более что препарат актиния-227 мог содержать примесь протактиния, а протактиний способен испускать подобные альфа-частицы.
Наряду с этими экспериментальными работами представляет интерес теоретическое исследование одесского химика Д. Добросердова. В 1925 г. в «Украинском химическом журнале» он опубликовал сообщение, в котором высказал интересные соображения о величине атомного веса, физических и химических свойствах 87-го элемента и о том, где и какими методами следует его искать. В частности, он подчеркнул, что экацезий «непременно должен быть весьма радиоактивным элементом». Однако Добросердов допустил досадную ошибку, предполагая, что известная радиоактивность калия и рубидия объясняется присутствием в них экацезия.
В случае открытия элемента со столь интересными свойствами русскими учеными Добросердов предлагал назвать его руссием.
В следующем году появились сразу две работы: выдающиеся радиохимики О. Ган (Германия) и Д. Хевеши (Венгрия) предприняли попытки доказать присутствие экацезия в радиоактивных рядах. Хевеши изучил альфа- распад 228 Ас и 227 Ас, а также бета-распад эманаций – изотопов радона и показал, что при бета-распаде эманаций изотопы 87-го элемента не образуются, а при распаде актиния-228 если и образуется изотоп 224 87 , то его количество должно составлять менее 1 / 200000 доли исходного количества ядер 228 Ас.
Прошло 12 лет, и в конце 1938 г. к поискам 87-го элемента приступила французский химик Маргарита Пере, сотрудница парижского Института радия. Повторив опыты Мейера, Гесса и Панета, она, естественно, также обнаружила альфа-частицы с пробегом 3,5 см. Чтобы доказать, что эти загадочные частицы испускаются актинием, а не протактинием, Пере очень тщательно очистила актиний от примесей и дочерних продуктов. Соосаждением с гидроокисью четырехвалентного церия она удалила из раствора радиоактиний – изотоп тория; с карбонатом бария были выведены изотопы радия, а с гидроокисью лантана – актиний.
Оставшийся после такой обработки маточный раствор мог содержать только щелочные и аммонийные соли и, как казалось, не должен был быть радиоактивным. Однако в остатке после выпаривания отчетливо регистрировалась бета-активность с периодом полураспада 22 минуты. Стало ясно, что эта активность связана с каким-то щелочным элементом. Можно было предположить, что она возникает в результате альфа-распада актиния и, согласно правилу смещения, принадлежит ядру элемента № 87. Чтобы доказать это, Пере перевела активность в осадок вместе с перхлоратом цезия. Активность полученных кристаллов перхлората цезия также убывала с периодом полураспада 22 минуты.
Таким образом, Пере обнаружила, что в 227 Ас существует радиоактивная вилка: в 1,2% случаев распада при вылете альфа-частиц образуется бета-излучатель со свойствами тяжелого щелочного металла и периодом полураспада 22 минуты:
Долгая и кропотливая работа завершилась успехом, и 9 сентября 1939 г. Пере заявила об открытии элемента № 87. В соответствии с номенклатурой, используемой для естественных радиоэлементов, она выбрала для него название «актиний-К». Позднее, в 1946 г., Пере назвала открытый ею элемент францием в честь своей родины, а в 1949 г. Международный союз теоретической и прикладной химии (ИЮПАК) утвердил это название и символ Fr.
Как исследовали франций
Помимо 283 Fr, сейчас известно несколько изотопов элемента № 87. Но только 223 Fr имеется в природе в сколько-нибудь заметных количествах. Пользуясь законом радиоактивного распада, можно подсчитать, что в грамме природного урана содержится 4*10 18 г 223 Fr. А это значит, что в радиоактивном равновесии со всей массой земного урана находится около 500 г франция-223. В исчезающе малых количествах на Земле есть еще два изотопа элемента № 87 – 224 Fr (член радиоактивного семейства тория) и 221 Fr. Естественно, что найти на Земле элемент, мировые запасы которого не достигают килограмма, практически невозможно. Поэтому все исследования франция и его немногих соединений были выполнены на искусственных продуктах.
Франций-223 долгое время был единственным изотопом, который применяли в опытах по изучению химических свойств элемента № 87. Поэтому, естественно, химики искали методы ускоренного выделения его из 227 Ас. В 1953 г. М. Пере и известный ныне французский радиохимик Ж. Адлов разработали экспресс-метод выделения этого изотопа с помощью бумажной хроматографии. По этому методу раствор 227 Ас, содержащий 223 Fr, наносится на конец бумажной ленты, которая погружается в элюирующий раствор. При движении раствора по бумажной ленте происходит распределение по ней радиоэлементов. 223 Fr, будучи щелочным металлом, движется с фронтом растворителя и откладывается позже других элементов. Позднее Адлов предложил использовать для выделения 223 Fr сложное органическое соединение а-теноилтрифторацетон (ТТА). Описанным методом за 10-40 минут удается выделить чистый препарат франция-223. Из-за малого периода полураспада работать с этим препаратом можно не более двух часов, после чего образуется уже заметное количество дочерних продуктов и нужно или очищать франций от них, или выделять его заново.
С развитием техники ускорения ионов были разработаны новые методы получения франция. При облучении торцевых или урановых мишеней протонами высоких энергий образуются и изотопы франция. Самым долгоживущим из них оказался франций-212 с периодом полураспада 19,3 минуты. За 15 минут облучения грамма урана пучком протонов с энергией 660 Мэв на синхроциклотроне Лаборатории ядерных проблем Объединенного института ядерных исследований в Дубне образуется 5*10 13 г франция-212 с активностью 2,5-107 распадов в минуту.
Выделение франция из облученных мишеней – процесс весьма сложный. За очень короткое время его нужно извлечь из смеси, содержащей почти все элементы периодической системы. Несколько методик выделения франция из облученного урана разработано советскими радиохимиками А.К. Лаврухиной, А.А. Поздняковым я С.С. Родиным, а из облученного тория – американским радиохимиком Э. Хайдом. Выделение франция основано на соосаждении его с нерастворимыми солями (перхлоратом или кремневольфраматом цезия) или со свободной кремневольфрамовой кислотой. Время выделения франция этими методами составляет 25-30 минут.
С помощью всех этих методов получено 27 изотопов франция с массовыми числами от 203 до 229.
Поскольку франций не может быть получен в весомых количествах , его физико-химические константы чаще всего рассчитываются с учетом свойств остальных членов группы щелочных металлов. Вычислили, что температура плавления франция около 8°С, а температура кипения примерно 620°С.
Все опыты по изучению химических свойств франция проводились, естественно, с ультрамалыми количествами этого элемента. В растворах было лишь 10 13 -10 9 г франция. При таких концентрациях могут стать важными процессы, о которых мы обычно забываем, имея дело с макроколичествами вещества. Например, в этих условиях радиоактивный изотоп может «потеряться» из раствора, адсорбировавшись на стенках сосудов, на поверхности осадков, на возможных примесях… Поэтому, казалось бы, изучая свойства франция, следует оперировать более концентрированными растворами. Но в этом случае возникают новые трудности из-за процессов радиолиза и ионизации.
И все же, несмотря на все трудности, получены некоторые достоверные данные о химических свойствах франция. Наиболее полно изучено соосаждение франция с различными нерастворимыми соединениями. Он увлекается из раствора хлороплатинатами цезия и рубидия Cs 2 PtCl 6 и Pb 2 PtCl 6 , хлоровисмутатом Cs 2 BiCl 5 , хлоростаннатом Cs 2 SnCl 6 и хлороантимонатом цезия Cs2SbCl 5 *2,5H 2 0, а также свободными гетерополикислотами – кремневольфрамовой и фосфорновольфрамовой.
Франций легко адсорбируется на ионообменных смолах (сульфокатионитах) из нейтральных и слабокислых растворов. С помощью этих смол легко отделить франций от большинства химических элементов. Вот, пожалуй, и все успехи.
Применение франция
Ожидать широкого использования элемента № 87 на практике, конечно, не приходится. И все же польза от франция есть. Во-первых, с его помощью (по его излучению) можно быстро определять присутствие в природных объектах актиния; во-вторых, франций надеются использовать для ранней диагностики сарком. Проведены предварительные опыты по изучению поведения франция в организме крыс. Было установлено, что франций избирательно накапливается в опухолях, причем и на ранних стадиях заболевания. Эти результаты очень интересны, однако удастся ли использовать их в онкологической практике, покажет лишь будущее.
ОПРЕДЕЛЕНИЕ
Франций расположен в седьмом периоде I группе главной (А) подгруппе Периодической таблицы.
Относится к элементам s -семейства. Металл. Обозначение – Fr. Порядковый номер – 87. Относительная атомная масса – 223,02 а.е.м.
Электронное строение атома франция
Атом франция состоит из положительно заряженного ядра (+87), внутри которого есть 87 протонов и 136 нейтронов, а вокруг, по семи орбитам движутся 87 электронов.
Рис.1. Схематическое строение атома франция.
Распределение электронов по орбиталям выглядит следующим образом:
87Fr) 2) 8) 18) 32) 32) 8) 1 ;
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4f 14 5s 2 5p 6 5d 10 6s 2 6p 6 7s 1 .
На внешнем электронном уровне атома франция находится 1 электрон, который является валентным (расположен на 7s- подуровне). Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие одного неспаренного электрона в атоме франция свидетельствует о его способности проявлять степень окисления +1.
Валентный электрон атома франция можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), m l (магнитное) и s (спиновое):
Примеры решения задач
ПРИМЕР 1
Элементов Менделеева. К 1925 году он был одним из четырех ненайденных элементов. Это самый тяжелый и наиболее активный существующий в природе, а также это самый быстрый для полураспада существующих химических элементов. Это, а еще невысокая ядерная устойчивость благоприятствовали тому, что продолжительное время было невозможным открытие франция, существование которого был предсказано Менделеевым почти за век до его получения.
История открытия химического элемента франция
Она отличительна тем, что выпала на участь женщины, имя которой Маргарита Пере. Поиски данного вещества основывались на На основе веществ, соседствующих с № 87, выдвигались различные гипотезы о свойствах данного металла:
- из-за того, что соседствующий цезий плавится при комнатной температуре, предполагалось, что 87-й элемент будет также плавиться при малых температурах;
- считалось, что он будет относиться к таким жидким металлам, как цезий или ртуть;
- выдвигались гипотезы о его радиоактивности.
К концу 1938 года к поиску этого вещества подключилась Маргарита Пере. Она акцентировала свое внимание на альфа-частицах, излучаемых актинием. Она хорошо очистила данное вещество от различных примесей, оставив лишь чистый элемент. После продолжительных химических обработок в руках ученой оставался содержащий щелочные соли. Она предполагала, что он не радиоактивен, но после выпаривания хорошо стала заметна бета-активность со временем полураспада 22 минуты. Женщине сразу стало понятно, что такая скорость зависит непосредственно от действия щелочного элемента.
Продолжительная работа Маргариты увенчалась успехом лишь осенью 1939 года. Отталкиваясь от существующей номенклатуры, женщина дала 87-му элементу наименование “Актиний-К”, который позже переименовала во франций в память о месте, в котором родилась. Международный союз теоретической и прикладной химии принял наименование, придуманное Маргаритой Пере. Так состоялось открытие франция.
Химический элемент Fr: характеристика
Это самый тяжелый и наиболее активный щелочной металл, существующий в природе, а также это один из самых быстрых для полураспада из существующих химических элементов. Самый долгоживущий из его изотопов можно обнаружить в урановых минералах. Поэтому химический элемент франций очень плохо изучен, так как распадается быстро. Тем более он обладает очень высокой радиоактивностью. Но все же малые количества этого элемента были исследованы, и обнаружены такие свойства:
Это последний химический элемент, открытый в природе. Он относится к самым редким, так как очень неустойчив и быстро распадается. По подсчетам ученых, химический элемент франций присутствует на Земле всего в количестве 30 граммов. Его можно отнести к жидким металлам, но жидкий он ненадолго. Через несколько секунд франций распадается на более устойчивые элементы, в частности получается радий.
Применение франция
Но, несмотря на высокую неустойчивость, этот химический элемент тоже приносит пользу. Он используется, хотя не широко. Прежде всего химический элемент франций полезен для обнаружения в природных объектах актиния. Кроме того, благодаря экспериментам с лабораторными крысами ученые выяснили, что он накапливается в злокачественных опухолях, которые находятся на первой стадии развития. Поэтому его можно использовать для ранней диагностики саркомы. Но исследование этого элемента продолжается. Франций раскрывает ученым все больше своих тайн.
| Франций | |
|---|---|
| Атомный номер | 87 |
| Внешний вид простого вещества | радиоактивный щелочной металл |
| Свойства атома | |
| Атомная масса (молярная масса) | 223,0197 а. е. м. ( /моль) |
| Радиус атома | n/a пм |
| Энергия ионизации (первый электрон) | 380 кДж /моль (эВ) |
| Электронная конфигурация | 7s 1 |
| Химические свойства | |
| Ковалентный радиус | n/a пм |
| Радиус иона | (+1e) 180 пм |
| Электроотрицательность (по Полингу) | 0,7 |
| Электродный потенциал | Fr←Fr + −2,92 В |
| Степени окисления | +1 |
| Термодинамические свойства простого вещества | |
| Плотность | 1,87 /см³ |
| Молярная теплоёмкость | n/a Дж/( ·моль) |
| Теплопроводность | n/a Вт /(м·) |
| Температура плавления | 300 |
| Теплота плавления | ~ 2 кДж /моль |
| Температура кипения | 950 |
| Теплота испарения | ~ 65 кДж/моль |
| Молярный объём | n/a см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | n/a Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| Fr | 87 |
| 7s 1 | |
| Франций | |
Франций — элемент главной подгруппы первой группы седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 87. Обозначается символом Fr (Francium ). Простое вещество франций (CAS-номер: 7440-73-5) — радиоактивный щелочной металл, обладающий высокой химической активностью.
История открытия Франция
Франций был предсказан Д. И. Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г. Маргаритой Пере, сотрудницей Института радия в Париже. Она же дала ему в 1964 г. название в честь своей родины — Франции.
Нахождение Франция в природе
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов. Образуется при альфа-распаде актиния-227:
227 Ac → 223 Fr (сопровождается α-излучением, вероятность распада приблизительно 1,4 %),
227 Ac → 227 Th (сопровождается β-излучением, вероятность распада около 98,6 %).
Его старое название — «актиний К» (AcK). По оценкам, его равновесное содержание в земной коре равно 340 г.
Кроме того, в одной из побочных ветвей радиоактивного ряда тория содержится франций-224 с периодом полураспада 3,0 минуты. Его равновесное содержание в земной коре составляет лишь 0,5 г.
Получение Франция
Микроскопические количества франция-223 и франция-224 могут быть химически выделены из минералов урана и тория. Другие изотопы франция получают искусственным путём с помощью ядерных реакций.
Физические, химические свойства Франция
Франций похож по свойствам на цезий . Всегда сокристаллизуется с его соединениями. Так как в распоряжении исследователей имеются лишь мельчайшие образцы, содержащие не более 10 −7 г франция, то сведения о его свойствах известны с достаточно большой погрешностью, однако они все время уточняются. Согласно последним данным, плотность франция при комнатной температуре составляет 1,87 г/см³, температура плавления 27°C, температура кипения 677°C, удельная теплота плавления 9,385 кДж/кг.
Применение Франция
Соль франция FrCl использовалась для обнаружения раковых опухолей, но по причине чрезвычайно высокой стоимости эту соль в масштабных разработках использовать не выгодно.
– (Francium), Fr, радиоактивный химический элемент I группы периодической системы, атомный номер 87; щелочной металл. Открыла франций французская радиохимик М. Пере в 1939 … Современная энциклопедия
ФРАНЦИЙ – (лат. Francium) Fr, химический элемент I группы периодической системы Менделеева, атомный номер 87, атомная масса 223,0197, относится к щелочным металлам. Радиоактивен, наиболее устойчив изотоп 223Fr (период полураспада 21,8 мин). Назван по имени … Большой Энциклопедический словарь
ФРАНЦИЙ – (символ Fr), радиоактивный, металлический элемент первой группы периодической таблицы, открыт в 1939 г. Самый тяжелый элемент ряда ЩЕЛОЧНЫХ МЕТАЛЛОВ. В натуральном виде присутствует в урановой руде, продукт разложения АКТИНИЯ. Элемент редкий,… … Научно-технический энциклопедический словарь
Франций – Fr (назв. в честь Франции, родины M. Пepe, открывшей элемент; лат. Francium * a. francium; н. Franzium; ф. francium; и. francio, francium), радиоактивный хим. элемент I группы системы Mенделеева; ат. н. 87. Cтабильных изотопов не имеет.… … Геологическая энциклопедия
ФРАНЦИЙ – (лат. Francium), Fr, радиоакт. хим. элемент 1 й группы периодич. системы элементов, ат. номер 87, относится к щелочным металлам. Наим. устойчив из всех радиоакт. элементов, встречающихся в природе. Природный Ф. состоит из b радиоактивного 223Fr… … Физическая энциклопедия
франций – сущ., кол во синонимов: 2 металл (86) элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
франций – я; ср. [лат. Francium] Химический элемент (Fr), радиоактивный щелочной металл. ◁ Франциевый, ая, ое. * * * франций (лат. Francium), химический элемент I группы периодической системы, относится к щелочным металлам. Радиоактивен, наиболее устойчив… … Энциклопедический словарь
ФРАНЦИЙ – (лат. Francium), хим. элемент I гр. периодич. системы, относится к щелочным металлам. Радиоактивен, наиб. устойчив нуклид 223Fr (период полураспада 22 мин). Назв. от Франции родины М. Перей, открывшей элемент. Один из редчайших и наименее… … Естествознание. Энциклопедический словарь
Франций – Смотри Франций (Fr) … Энциклопедический словарь по металлургии
франций – francis statusas T sritis chemija apibrėžtis Cheminis elementas. simbolis(iai) Fr atitikmenys: lot. francium angl. francium rus. франций … Chemijos terminų aiškinamasis žodynas
Книги
- Радиоактивные металлы франций и дубний. Методы прогнозирования физических параметров , Николаев О.С.. В книге приведены методы прогнозирования физических параметров франция и дубния. Это радиоактивные металлы седьмого периода таблицы Д. И. Менделеева. Малые периодыполураспада этих металлов… Купить за 538 грн (только Украина)
- Де Голль и голлисты. “Коннетабль” и его соратники , Владлен Максимов. Книга рассказывает о самом знаменитом французе XX века, основателе и первом президенте Пятой республики с необычной и неожиданной для российского читателя критической стороны. Автор подробно…
Крупнейший проект по ядерному синтезу переходит во Францию
Франция будет принимать крупнейший в мире ядерный термоядерный реактор, проект стоимостью 12 миллиардов долларов, предназначенный для использования энергии Солнца, было подтверждено во вторник.
«Согласно этому заявлению, Франция выбрана местом», – заявила пресс-секретарь Европейского Союза Антония Мочане на церемонии подписания в Москве, на которой присутствовали шесть партий & двоеточие; ЕС, США, Россия, Япония, Южная Корея и Китай.
Завершился долгий и иногда ожесточенный спор о месте размещения Международного термоядерного экспериментального реактора (ИТЭР). Как сообщалось на прошлой неделе, Япония отозвала свою заявку. 30-летний проект теперь будет построен в Кадараше на юге Франции.
Японский сайт поддержали США и Южная Корея, а Франция – ЕС, Россия и Китай. Президент Франции Жак Ширак сказал, что он «рад», и поблагодарил эти страны за «неизменную поддержку в переговорах».
Высшая работа
Александр Румянцев, глава российского агентства по атомной энергии, сообщил
деталей финансирования ИТЭР еще не решены. Но согласно более ранним обсуждениям ожидалось, что ЕС возьмет на себя 40% затрат, а Франция – 10%, а остальное разделит между собой другие партнеры.
Япония также заключила сделку по строительству основного исследовательского центра по материалам проекта в Японии и зарезервировала 20% рабочих мест в головном офисе, включая высший пост ИТЭР, для японских граждан.
Конечная цель проекта ИТЭР – найти способ использовать возможности ядерного синтеза, который обещает чистое, безопасное и почти бесконечное снабжение. Но проведенные на сегодняшний день десятилетия исследований не приблизили это существенно.
Ядерный синтез, который приводит в действие Солнце и водородные бомбы, обычно включает в себя синтез двух атомов водорода с образованием гелия. Современные атомные станции используют деление – расщепляющие атомы.
Горячая плазма
ИТЭР был задуман на международном саммите в 1985 году как экспериментальная установка для проверки того, можно ли вынести ядерный синтез за пределы лаборатории и помочь удовлетворить мировые потребности в энергии.
Проект представляет собой огромную технологическую задачу, поскольку для синтеза атомов потребуется плазма, нагретая до 100 миллионов градусов, чтобы удерживаться в сильном магнитном поле. Задача состоит в том, чтобы сделать это при одновременном производстве большего количества энергии, чем потребляемой.
После программы строительства эксперименты начнутся примерно в 2015 году и будут продолжаться примерно 20 лет, в ходе которых ИТЭР будет тестироваться на технологическую осуществимость, безопасность, здоровье и управление отходами. После этого реактор будет выведен из эксплуатации.
Если ИТЭР будет успешным, демонстрационная термоядерная электростанция будет построена в середине 2030-х годов, и – если все пойдет хорошо – первая коммерческая термоядерная электростанция будет создана в середине века для оценки экономической целесообразности.
Подробнее по этим темам:
Структурные тенденции в атомных ядрах по данным лазерной спектроскопии олова
Thoennessen, M. Открытие изотопов . (Springer: Cham, Швейцария, 2016).
MATH Книга Google ученый
Бор А. и Моттельсон Б. Р. Структура ядра , Vol. 2 (В. А. Бенджамин, Инк .: Сингапур, 1975 г.).
Рейнхард, П.-Г. & Оттен, Э. У. Переход к деформированным формам как ядерный эффект Яна – Теллера. Nucl. Phys. А 420 , 173 (1984).
ADS Статья Google ученый
Назаревич В. Микроскопическое происхождение ядерных деформаций. Nucl. Phys.А 574 , 27 (1994).
ADS Статья Google ученый
Кастен Р. Ф. Структура ядра с простой точки зрения . (Издательство Оксфордского университета: Нью-Йорк, 1990).
Google ученый
Талми И. Простые модели сложных ядер . (Harwood Academic Publishers: Швейцария, 1993).
Google ученый
Talmi, I. Модель оболочки – простота от сложности: некоторые из моих лучших ядер имеют сферическую форму. Phys. Scr. 92 , 083001 (2017).
ADS Статья Google ученый
Моралес И. О., Ван Исакер П. и Талми И. Обобщенный старшинство и переходы E2 в изотопах олова. Phys. Lett. В 703 , 606 (2011).
ADS Статья Google ученый
Стучбери, А. Э. Простые структуры в сложных ядрах по сравнению со сложными структурами в простых ядрах: перспектива ядерных моментов. J. Phys .: Conf. Сер. 366 , 012042 (2012).
Google ученый
Morris, T. D. et al. Структура легчайших изотопов олова. Phys. Rev. Lett. 120 , 152503 (2018).
ADS Статья Google ученый
Togashi, T., Tsunoda, Y., Otsuka, T., Shimizu, N. & Honma, M. Новая эволюция формы изотопов Sn от магических чисел от 50 до 82. Phys. Rev. Lett. 121 , 062501 (2018).
ADS Статья Google ученый
Siciliano, M. et al. Парно-квадрупольное взаимодействие в нейтронно-дефицитных ядрах олова: первые измерения времени жизни низколежащих состояний в 106,108 Sn. Препринт по адресу https: // arxiv.org / abs / 1905.10313 (2019).
Цукер А. П. Квадрупольное доминирование в легких изотопах Cd и Sn. Препринт на https://arxiv.org/abs/1905.11479 (2019).
Бербидж Э. М., Бербидж Г. Р., Фаулер У. А. и Хойл Ф. Синтез элементов в звездах. Ред. Мод. Phys. 29 , 547 (1957).
ADS Статья Google ученый
Neugart, R. et al. Коллинеарная лазерная спектроскопия в ISOLDE: новые методы и основные моменты. J. Phys. G 44 , 064002 (2017).
ADS Статья Google ученый
Köster, U. et al. Прогресс в системах источников ионов-мишеней ISOL. Nucl. Instrum. Методы Phys. Res., Sect. В 266 , 4229 (2008).
ADS Статья Google ученый
Mané, E. et al. Ионный охладитель-группировщик для высокочувствительной коллинеарной лазерной спектроскопии в Изольде. Eur. Phys. Дж. А 42 , 503 (2009).
ADS Статья Google ученый
Малкин, Э., Коморовский, С., Реписки, М., Демисси, Т. Б. и Рууд, К. Абсолютные константы экранирования тяжелых ядер: решение загадки абсолютного экранирования 119 Sn. J. Phys. Chem. Lett. 4 , 459 (2013).
Артикул Google ученый
Йонссон, П., Гайгалас, Г., Биерон, Дж., Фрозе Фишер, К. и Грант, И. П. Новая версия: пакет релятивистской атомной структуры Grasp2K. Comput. Phys. Commun. 184 , 2197 (2013).
ADS МАТЕМАТИКА Статья Google ученый
Froese Fischer, C., Gaigalas, G., Jönsson, P. & Bieroń, J. GRASP2018 – Версия пакета общей релятивистской атомной структуры для Fortran 95. Comput.Phys. Commun. 237 , 184 (2019).
ADS Статья Google ученый
Фрезе Фишер, К., Годфроид, М., Браге, Т., Йонссон, П. и Гайгалас, Г. Расширенные методы многоконфигурации для сложных атомов: I. Энергии и волновые функции. J. Phys. В 49 , 182004 (2016).
ADS Статья Google ученый
Грант И. П. Релятивистская квантовая теория атомов и молекул. Теория и вычисления . (Springer-Verlag: Нью-Йорк, США, 2007).
Книга Google ученый
Тупицын И.И., Логинов А.В. Использование разложений Штурма в расчетах сверхтонкой структуры атомных спектров. Опт. Spectrosc. 94 , 319 (2003).
ADS Статья Google ученый
Экман Дж., Ли Дж., Йонссон П., Годфроид М. и Гайгалас Г. Моделирование сверхтонких аномалий с помощью GRASP. Proc. Семинар EOS по электронным атомным факторам и сверхтонким аномалиям для ядерной физики (Брюссель, Бельгия, 2019).
Йорданов Д. Т. и др. Спины, электромагнитные моменты и изомеры 107–129 Cd. Phys. Rev. Lett. 110 , 192501 (2013).
ADS Статья Google ученый
Йорданов Д. Т. и др. Простая структура ядра в 111–129 Cd по изомерным сдвигам атомов. Phys. Rev. Lett. 116 , 032501 (2016).
ADS Статья Google ученый
Frömmgen, N. et al. Коллинеарная лазерная спектроскопия атомарного кадмия. Eur. Phys. J. D 69 , 164 (2015).
ADS Статья Google ученый
Хаас, Х. Переоценка данных. Частное общение (2019).
Бендер, М., Хинен, П.-Х. И Рейнхард, П.-Г. Самосогласованные модели среднего поля для структуры ядра. Ред. Мод. Phys. 75 , 121 (2003).
ADS Статья Google ученый
Klüpfel, P., Reinhard, P.-G., Bürvenich, T. J. & Maruhn, J. A. Вариации на тему Скирма: систематическое исследование корректировок параметров модели. Phys. Ред. C 79 , 034310 (2009).
ADS Статья Google ученый
Миллер А. Дж., Минамисоно К. и Клозе А. и др. Сверхтекучесть протонов и зарядовые радиусы в протонных изотопах кальция. Nat. Phys. 15 , 432 (2019).
Артикул Google ученый
Фаянс, С. А. К универсальному функционалу ядерной плотности. Письма в ЖЭТФ. 68 , 169 (1998).
ADS Статья Google ученый
Фаянс, С.А., Толоконников, С.В., Трыков, Э.Л., Завиша, Д. Ядерные изотопные сдвиги в рамках подхода с использованием локального функционала плотности энергии. Nucl. Phys. А 676 , 49 (2000).
ADS Статья Google ученый
Рейнхард П.-ГРАММ. И Назаревич, В. К глобальному описанию ядерных зарядовых радиусов: исследование функционала плотности энергии Фаянса. Phys. Ред. C 95 , 064328 (2017).
ADS Статья Google ученый
Ринг, П. и Шак, П. Ядерная проблема многих тел . (Springer-Verlag: Берлин, 1980).
Книга Google ученый
Hammen, M. & Nörtershäuser, W. et al. От кальция к кадмию: проверка функции сопряжения путем измерения радиуса заряда 100–130 Cd. Phys. Rev. Lett. 121 , 102501 (2018).
ADS Статья Google ученый
Gorges, C. et al. Лазерная спектроскопия нейтронно-богатых изотопов олова: неоднородность зарядовых радиусов через замыкание оболочки N = 82. Phys.Rev. Lett. 122 , 192502 (2019).
ADS Статья Google ученый
Zhao, P. W., Zhang, S. Q. & Meng, J. Объяснение простоты квадрупольных моментов, недавно обнаруженных в изотопах Cd, из ковариантной теории функционала плотности. Phys. Ред. C 89 , 011301 (R) (2014).
ADS Статья Google ученый
Йорданов Д. Т. и др. Спины и электромагнитные моменты 101–109 Cd. Phys. Ред. C 98 , 011303 (R) (2018).
ADS Статья Google ученый
Федерман П. и Питтель С. Унифицированное описание ядерной деформации на основе модели оболочки. Phys. Ред. C 20 , 820 (1979).
ADS Статья Google ученый
Добачевский Дж., Назаревич В., Скальски Дж. И Вернер Т. Деформация ядра: протон-нейтронный эффект? Phys. Rev. Lett. 60 , 2254 (1988).
ADS Статья Google ученый
Эсат, М. Т., Кин, Д. К., Спир, Р. Х. и Бакстер, А. М. Зависимость статических квадрупольных моментов первых 2 состояний + в изотопах кадмия от массы. Nucl. Phys. А 274 , 237 (1976).
ADS Статья Google ученый
Allmond, J. M. et al. Исследование полумагической природы изотопов олова через электромагнитные моменты. Phys. Ред. C 92 , 041303 (R) (2015).
ADS Статья Google ученый
Нейенс, Г. Ядерные магнитные и квадрупольные моменты для исследования структуры ядер на экзотических ядрах. Rep. Prog. Phys. 66 , 633 (2003).
ADS Статья Google ученый
Ferrer, R. et al. К лазерной ионизационной спектроскопии высокого разрешения наиболее тяжелых элементов при расширении сверхзвуковой газовой струи. Nat. Commun. 8 , 14520 (2017).
ADS Статья Google ученый
Sels, S. et al.Изменение формы изотопов ртути в средней части оболочки по результатам лазерной спектроскопии в источнике по сравнению с расчетами по теории функционала плотности и модели оболочек Монте-Карло. Phys. Ред. C 99 , 044306 (2019).
ADS Статья Google ученый
Magnante, P.C. & Stroke, H.H. Изотопный сдвиг между 209 Bi и 6,3-дневным 206 Bi. J. Opt. Soc. Являюсь. 59 , 836 (1969).
ADS Статья Google ученый
Brun, R. & Rademakers, F. ROOT – объектно-ориентированная среда анализа данных. Nucl. Instrum. Методы Phys. Res., Sect. А 389 , 81 (1997).
ADS Статья Google ученый
Ауди, Г., Кондев, Ф. Г., Ван, М., Хуанг, В. Дж. И Наими, С. Оценка ядерных свойств NUBASE2016. Подбородок. Phys. С 41 , 030001 (2017).
ADS Статья Google ученый
King W.H. Комментарии к статье: Особенности изотопического сдвига в спектре самария. J. Opt. Soc. Являюсь. 53 , 638 (1963).
Артикул Google ученый
Макульский, В. Исследование тетраметилолова методом ЯМР-спектроскопии в газовой и жидкой фазах. J. Mol. Struct. 1017 , 45 (2012).
ADS Статья Google ученый
Макульски В., Яковски К., Антушек А. и Яшунски М. Измерения ЯМР в газовой фазе, шкалы абсолютного экранирования и магнитные дипольные моменты ядер 29 Si и 73 Ge . J. Phys. Chem. А 110 , 11462 (2006).
Артикул Google ученый
Anselment, M. et al. Зарядовые радиусы и моменты ядер олова по данным лазерной спектроскопии. Phys. Ред. C 34 , 1052 (1986).
ADS Статья Google ученый
Le Blanc, F. et al. Изменение зарядового радиуса и ядерные моменты в тяжелых изотопах олова по данным лазерной спектроскопии: зарядовый радиус 132 Sn. Phys. Ред. C 72 , 034305 (2005).
ADS Статья Google ученый
Eberz, J. et al. Спины, моменты и зарядовые радиусы ядер 108–111 Sn. Z. Phys. А 326 , 121 (1987).
ADS Google ученый
Махешвари, Б., Абу Кассим, Х., Юсоф, Н. и Джайн, А. К. Эволюция ядерной структуры в закрытой оболочке и около Z = 50: обобщенное старшинство в изотопах Cd, Sn и Te. Nucl. Phys. А 992 , 121619 (2019).
Артикул Google ученый
Рагхаван П. Таблица ядерных моментов. At. Data Nucl. Таблицы данных 42 , 189 (1989).
ADS Статья Google ученый
Первые атомы антивещества, произведенные в ЦЕРН
Женева, 4 января 1996 года. В сентябре 1995 года профессору Вальтеру Олерт и международной группе специалистов из Юлихского IKP-KFA, Университета Эрланген-Нюрнберг, GSI Дармштадта и Университета Генуи впервые удалось синтезировать атомы антивещества из составляющих их античастиц.Девять из этих атомов образовались в результате столкновений антипротонов с атомами ксенона в течение трех недель. Каждый из них существовал около сорока миллиардных долей секунды, прошел путь в десять метров почти со скоростью света, а затем аннигилировал с обычной материей. Аннигиляция произвела сигнал, который показал, что антиатомы созданы.
Обычные атомы состоят из ряда электронов, вращающихся вокруг атомного ядра. Атом водорода – самый простой атом из всех; его ядро состоит из протона, вокруг которого циркулирует единственный электрон.Рецепт создания антиводорода очень прост – взять один антипротон, поднять один антиэлектрон и вывести последний на орбиту вокруг первого – но его очень сложно осуществить, поскольку античастиц на Земле в природе не существует. Их можно создать только в лаборатории. Экспериментаторы вращали ранее созданные антипротоны вокруг низкоэнергетического антипротонного кольца (LEAR) ЦЕРН 1 , пропуская их через струю ксенонового газа каждый раз, когда они вращались – примерно 3 миллиона раз в секунду.(см. схему эксперимента) Очень редко, проходя через атом ксенона, антипротон превращал небольшую часть своей энергии в электрон и антиэлектрон, обычно называемый позитроном. В еще более редких случаях скорость позитрона была достаточно близка к скорости антипротона, чтобы две частицы соединились, создав атом антиводорода (см. Схему принципа).
Три четверти нашей Вселенной состоит из водорода, и многое из того, что мы узнали о нем, было обнаружено путем изучения обычного водорода.Если бы поведение антиводорода отличалось даже в мельчайших деталях от поведения обычного водорода, физикам пришлось бы переосмыслить или отказаться от многих устоявшихся представлений о симметрии между материей и антивеществом. Предполагается, что историческая работа Ньютона по гравитации была вызвана наблюдением за падением яблока на землю, но будет ли «анти-яблоко» падать таким же образом? Считается, что антивещество «работает» под действием гравитации так же, как и материя, но если природа выбрала иное, мы должны выяснить, как и почему.
Следующий шаг – проверить, действительно ли антиводород «работает» так же хорошо, как и обычный водород. Сравнения можно проводить с огромной точностью, вплоть до одной части на миллион триллионов, и даже асимметрия в таком крошечном масштабе имела бы огромные последствия для нашего понимания Вселенной. Проверить наличие такой асимметрии означало бы удерживать антиатомы неподвижными в течение секунд, минут, дней или недель. Технологии, необходимые для хранения антивещества, интенсивно разрабатываются в ЦЕРНе.В настоящее время планируются новые эксперименты по улавливанию антивещества в электрических и магнитных емкостях или ловушках, что позволяет проводить высокоточный анализ.
Первое создание атомов антивещества в ЦЕРНе открыло дверь для систематических исследований антимира.
1. ЦЕРН, Европейская лаборатория физики элементарных частиц, находится в Женеве. В настоящее время его государствами-членами являются Австрия, Бельгия, Чешская Республика, Дания, Финляндия, Франция, Германия, Греция, Венгрия, Италия, Нидерланды, Норвегия, Польша, Португалия, Словацкая Республика, Испания, Швеция, Швейцария и Великобритания. .Статус наблюдателей имеют Израиль, Япония, Российская Федерация, Турция, Европейская комиссия и ЮНЕСКО.Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Geos 306, Лекция 5, Упаковка атомов
Geos 306, Лекция 5, Упаковка атомов Geos 306 Лекция 5Упаковка атомов
- В этой лекции мы исследуем, что происходит, когда группы атомов собраны вместе, чтобы сформировать кристаллы.
- Начнем с упаковки атомов в металлы , потому что они самые простые. Мы предполагаем, что все атомы в металле сферические и имеют того же размера , так как мы предполагаем, что металл изготовлен только из один тип атома, например Cu.Отзывать карта электронной плотности Cu и как появились сферические атомы.
- Существует 2 основные модели упаковки, которые вместе называются ближайший упаковка . Две модели – кубическая плотнейшая упаковка (ccp) и гексагональная. плотнейшая упаковка (ГПУ). Модели были формализованы Джоном Барлоу в 1800-х годах. Барлоу был Англичанин, которому французское правительство выделило средства для определения наиболее эффективного способа упаковки вещей. пушечные ядра на палубе военного корабля. ccp, с последовательностью упаковки abcabcabc например.Cu, Au, Ag, Al, Ni, Pt
- Положите слой сфер (шариков) на ровную поверхность и нажмите их вместе настолько плотно, насколько это возможно, тогда вы обнаружите, что каждая сфера вступил в контакт с 6 другими сферами, точно так же, как мы видели в электроне Cu карта плотности. Мы называем этот слой монослоем и обозначаем его “слой”. a “.
hcp, с последовательностью упаковки abababab например. Mg, Be, Ti, Zr
Изображение с https://www.seas.upenn.edu/~chem101/sschem/metallicsolids.html
- Затем мы можем добавить 2 слоя и поверх первого.Есть два места, где мы можем добавить этот слой. Эти места эквивалентны, с той лишь разницей, что ориентация. Мы называем этот слой b .
- HCP . Если слой 3 rd накладывается непосредственно на слой 1 st , тогда у нас есть последовательность aba . Слой 3 rd называется слоем a , потому что он эквивалентен в положении к первому слою. Последовательность может повторяться снова и снова, образуя узор: abababab… и результат схему упаковки, которую мы называем гексагональной плотнейшей упаковкой или ГПУ. Это называется ГПУ, потому что расположение имеет гексагональную симметрию. Например. магний.
- КПК. Если вместо этого на последний оставшийся набор отверстий, затем мы вызываем последовательность abc . Слой 3 rd называется слой c , потому что он находится в новом положении, отличном от положения слоя a или слоя b .Если этот шаблон повторяется снова и снова, то у нас есть последовательность abcabcabc … и в результате получается схема упаковки, которую мы называем кубической плотнейшей упаковкой, или ccp. Эта схема упаковки демонстрирует кубическую симметрию. Направление укладки наиболее плотно упакованных слоев соответствует диагонали тела куба. Например. медь.
- Изучение изображений должно заставить вас поверить в то, что каждая сфера с наиболее плотной упаковкой контактирует с 12 другими сферами.
- Такие схемы упаковки имеют пустот, или пустые места, где могут поместиться более мелкие сферы (атомы).В общем, мы предполагаем, что это анионы, которые образуют массивы с наиболее плотной упаковкой, с обнаруженными более мелкими катионами в пустотах. Это типичная упаковка, обнаруженная в ionic . или ковалентных минералов. Есть места для 2, 3, 4 и 6 согласованных сайтов, а также 12 скоординированных сайтов, если катион заменяет один наиболее плотно упакованных анионов. 2 (например, CO 2 ) и 3 (например, CO 3 группа найдена в кальцит, CaCO 3 ) согласованные сайты можно найти в монослое, четырехгранный а также восьмигранный сайты (например,грамм. SiO 4 или MgO 6 групп, которые встречаются в форстерит, Mg 2 SiO 4 ) требуется 2 слоя. Обратите внимание, что и +, и – существуют тетраэдрические узлы, направленные вверх или вниз соответственно. В На следующих изображениях скоординированные сайты 2 и 3 помечены как 2 и 3 соответственно, а 4 и 6 скоординированных сайтов обозначены T и O соответственно, (четырехгранный и октаэдрический). Показанный тетраэдрический узел указывает вниз.
- Две другие важные схемы упаковки: bcc, body-center кубическая, например Fe, V, Cr, Mo, W, и структура алмаза, C, Si, Ge.
- Пару лет назад после лекции один из студентов прислал мне это фото. Он понял, что принципы самой плотной упаковки можно экстраполировать от ядер к пивным банкам. На фото видно, как ему удалось добиться максимальной плотности упаковки пивных банок в ящик для свежих овощей в его холодильнике.
Размеры атомов
- Нет “истинного” радиуса атома. Есть только модели, и обычно мы выбираем ту модель, которая лучше всего иллюстрирует то, что мы хотим сделать.Однако никогда не следует смешивать радиусы разных моделей.
- Таблицы радиусов
- Для данного элемента ионный радиус уменьшается с увеличением положительного заряда и увеличивается с увеличением отрицательного заряда.
например r (Pb 4-) = 2,15 Å, r (Pb 0 ) = 1,74 Å, r (Pb 2+ ) = 1.18 Å, r (Pb 4+ ) = 0,78 Å. - Радиусы элементов в одном и том же вертикальном столбце Периодической таблицы с одинаковым ионным зарядом увеличиваются в размере с увеличением атомного номера.
например r (Li 1+ ) = 0,74 Å, r (Na 1+ ) = 1,02 Å, r (K 1+ ) = 1,38 Å, r (Rb 1+ ) = 1,49 Å, r ( Cs 1+ ) = 1,70 Å - Радиусы ионов с такой же электронной конфигурацией, но с увеличением положительного заряда, уменьшаются в размерах.
например1с 2 2с 2 2п 6 , r (O 2-) = 1,40 Å, r (F 1- ) = 1,33 Å, r (Na 1+ ) = 1,02 Å, r (Mg 2+ ) = 0,72 Å, r ( Al 3+ ) = 0,53 Å, r (Si 4+ ) = 0,40 Å. - Анионы обычно крупнее катионов
например r (O 2-) = 1,40 Å, r (Cl 1-) = 1,81 Å
Чтение :
Венк и Булах, Глава 2.
Кляйн, стр 64-75
Nesse, Глава 4.
Оптимальная атомная структура аморфного кремния, полученная из расчетов теории функционала плотности
Аморфный кремний ( a -Si) – это архетипический неупорядоченный материал с ковалентными связями. Он также широко используется в промышленных целях с многочисленными приложениями в электронике и фотовольтаике. Оба аспекта вызвали интенсивную исследовательскую деятельность в течение последних нескольких десятилетий. a -Si может быть получен с использованием нескольких методов подготовки, включая ионную имплантацию, лазерное плавление с последующей быстрой закалкой, различные методы выращивания и вдавливание [1–6].Характеристики образцов a -Si зависят от метода приготовления [7]. Например, осаждение из паровой фазы часто дает образцы, содержащие пустоты. Кроме того, a -Si, полученный ионной имплантацией, имеет тенденцию включать значительное количество координационных дефектов. Но отжиг различных типов образцов, кажется, приближает их к некоторой общей, идеальной структуре и -Si. Однако природа этого состояния является предметом давних споров. Помимо понимания основных характеристик ковалентно связанных неупорядоченных сетей, хорошие структурные модели являются важной предпосылкой для теоретических исследований электронных и механических свойств таких материалов [8].
Было предложено несколько различных процедур для создания реалистичных моделей a -Si в атомном масштабе. Один из подходов состоит в создании непрерывной случайной сети (CRN), которая может быть построена с использованием различных алгоритмов, чтобы дать структуру только с 4-кратно скоординированными атомами, то есть не содержащую координационных дефектов [9–11]. Другая структурная модель включает наноскопические кристаллические зерна, встроенные в неупорядоченную матрицу. Аргументы в пользу последнего были недавно представлены в связи с анализом образцов ионной имплантации [5, 12].Наконец, ограничения, полученные из экспериментальных данных, были использованы для построения моделей a -Si [13-15].
Большинство предложенных моделей смогли хорошо воспроизвести некоторые из измеренных структурных особенностей, таких как функция радиального распределения (RDF) и распределения валентных углов. RDF, однако, не может различать различные топологические сети [12], и детальную информацию об угловых распределениях трудно получить из экспериментов.Чтобы продвинуться дальше в поисках оптимальной модели a -Si, Драбольд недавно предложил сосредоточить внимание на избыточной энергии, запасенной в аморфной сетке относительно кристалла, c -Si, величине, которую можно извлечь из калориметрических экспериментов. [16]. Это до сих пор не считалось критическим свойством в исследованиях моделирования. Образцы, полученные ионной имплантацией, дали избыточную энтальпию 0,15 эВ атом -1 [1, 17], а недавно было обнаружено, что осаждение из паровой фазы дает более низкое значение, 0.07 эВ атом -1 [6]. Доступные модели a -Si часто соответствуют более высокой избыточной энергии [7, 14, 18–21], предполагая, что они не могут быть репрезентативными для экспериментальной структуры a -Si. Другим важным свойством является плотность ρ , которая, как было установлено экспериментально, на 1–2% ниже, чем плотность c -Si в нескольких измерениях [12, 22, 23]. Как показано ниже, плотность полезна для оценки качества структурной модели и сходимости моделирования отжига.
Создание структур a -Si без предвзятого представления об атомном упорядочении или данных экспериментальных наблюдений оказалось сложной задачей. Одна из возможностей – смоделировать быстрое охлаждение жидкости. Но из-за вычислительных ограничений для описания атомных взаимодействий часто используются эмпирические потенциальные функции. Их ограниченная точность привела к высокой плотности структурных дефектов [24, 25] и в целом плохому согласию с имеющейся экспериментальной информацией для a -Si.Чтобы улучшить этот подход, мы выполнили моделирование отжига с описанием электронных степеней свободы с помощью теории функционала плотности (DFT), поэтому окончательная структура определяется атомными взаимодействиями, определяемыми расчетами из первых принципов. Чтобы ускорить процесс отжига и оптимизировать плотность, а также энергию, была разработана систематическая процедура удаления слабосвязанных атомов. Это оказывается эффективной процедурой для создания структуры a -Si с расчетными свойствами, превосходно согласующимися с опубликованными экспериментальными измерениями образцов ионной имплантации, включая RDF, угловые распределения и колебательную плотность состояний, а также избыточную энергию и относительная плотность по отношению к c -Si.
Начальная конфигурация была создана путем быстрого охлаждения жидкого Si, представленного системой из 216 атомов, при соблюдении периодических граничных условий с объемом, выбранным в соответствии с объемом кристаллической фазы кремния. Температура снижалась со скоростью 2 × 10 12 K с −1 , типичной для лазерных экспериментов [24], до температуры 10 K. Использовалась эмпирическая потенциальная функция Терсоффа [26]. на этом начальном этапе моделирования, чтобы уменьшить вычислительные затраты.После охлаждения энергия была минимизирована по отношению к изотропному масштабированию объема симуляционного бокса и по координатам атомов перед выполнением любых расчетов методом DFT. Структурные характеристики полученной таким образом конфигурации в некотором смысле уже относительно хорошо согласуются с экспериментами, хотя есть и явные расхождения. ФРР близок к экспериментальному, но 1-й пик смещен на 2% по сравнению с экспериментом в сторону больших парных расстояний [23].Кроме того, хотя функция углового распределения имеет максимум при 108,1 °, что согласуется с измерениями, дающими 108,5 ° [2] и 107,8 ° [23], дисперсия слишком велика, 15,4 °, по сравнению с экспериментальными значениями в диапазоне от 9,0 ° до 11 ° [2, 6, 23].
Затем образец был отожжен путем моделирования, в котором энергия и атомные силы оценивались с помощью DFT. Обобщенное градиентное приближение PBE для обменного и корреляционного функционала [27] использовалось с валентными электронами, представленными в базисе плоских волн, расширенном до 18 Ry, и только Γ-точка в выборке с точками k , в то время как внутренние электроны были представлены с помощью проектора усиленная волна [28].Это дает для кристалла Si постоянную решетки 5,468 Å. Для расчетов использовалась программа VASP [29]. Моделирование классической динамики было выполнено при температуре 600 К, затем короткая динамика длительностью 1 пс при 300 К и, наконец, минимизация энергии сопряженного градиента по координатам атомов при фиксированном объеме. На рис. 1 показано, как избыточная энергия образца зависит от продолжительности временного интервала, смоделированного при 600 К. В то время как первые 10 пс имели большой эффект, расширение до 20 пс дало лишь незначительное дальнейшее снижение энергии.
Увеличить Уменьшить Сбросить размер изображения
Рис. 1. Энергия и плотность смоделированных образцов a -Si по сравнению с c -Si, оцененные на основе расчетов теории функционала электронной плотности. входная конфигурация, полученная путем быстрой закалки жидкости с использованием эмпирического потенциала (вертикальная пунктирная линия). : после моделирования динамики при 600 K с использованием DFT (для 1, 10 и 20 пс, соотв.) с последующей минимизацией энергии по координатам атома при фиксированном объеме. Затем выполняются два расчета отжига КПК. I (черный): энергия была минимизирована по отношению к объему прямоугольника (черная пунктирная линия) до обработки PDA, которая представляет собой итеративное удаление атомов с наименьшей энергией связи и оптимизацией объема. После первой итерации получается конфигурация f , g получается после удаления двух атомов и т. Д., И отжиг PDA приводит к оптимальной низкоэнергетической конфигурации, обозначенной i , содержащей 212 атомов.II (красный): объем увеличен, чтобы уменьшить плотность примерно на 2% ниже, чем у c -Si, и динамическое моделирование при 900, 600 и 300 K в течение 10 пс в каждом случае с последующей минимизацией энергии относительно к атомным координатам и объему (красная пунктирная линия), что приводит к образцу с более низкой плотностью, x . Из следующих расчетов КПК получена оптимальная низкоэнергетическая конфигурация, обозначенная y с 215 атомами. Оптимальные конфигурации, полученные в результате отжига I и II PDA, имеют почти одинаковую плотность, 99% от плотности c -Si.
Загрузить рисунок:
Стандартный образ Изображение высокого разрешенияПлотность в этой точке слишком высока по сравнению с плотностью кристалла Si на уровне теории DFT / PBE, поскольку объем был зафиксирован на уровне кристалла, описываемого эмпирическим потенциалом [26]. Затем была проведена минимизация энергии DFT / PBE по отношению к ящику объема путем изотропного масштабирования координат атома с последующей минимизацией энергии относительно координат атома.Избыточная энергия этой конфигурации, обозначенная e на рисунке 1, составляет 0,167 эВ атом -1 . Это значительно ниже опубликованных ранее теоретических значений [10, 14, 18, 20, 30], но выше экспериментальных оценок [1, 6, 17]. Плотность также слишком высока, близка к плотности кристалла DFT / PBE, а положение 1-го пика в RDF почти такое же, как в c -Si. Дисперсия 1-го пика RDF составляет 0,045 Å. Это аналогично экспериментальным значениям [23].Угловое распределение имеет пик 108,4 ° с разбросом 10,5 °. Это указывает на то, что описание атомных сил DFT / PBE значительно лучше, чем эмпирическая потенциальная функция [26], использованная для генерации начальной конфигурации. Фактически, мы обнаружили, что гораздо более длительные симуляции отжига с эмпирической потенциальной функцией не смогли снизить избыточную энергию до такой степени, как это было сделано на этом этапе расчетов DFT / PBE. Используя расстояние отсечки 2.8 Å конфигурация e включает 7 пятикратно и 1 трехкоординированный атом, что соответствует 4% координационным дефектам, а среднее координационное число составляет 4,03.
Для дальнейшей оптимизации атомной структуры и плотности была разработана схема отжига, которая более эффективна, чем прямое динамическое моделирование. Это важно, поскольку временной интервал, который можно смоделировать с разумными вычислительными затратами, очень ограничен. Были выполнены два различных расчета: один начался с конфигурации и , которая имеет высокую плотность, а другой – с конфигурации с низкой плотностью.В конце концов, аналогичная плотность была получена для оптимальных конфигураций с низким энергопотреблением, что подтверждает эффективность подхода. Наличие координационных дефектов предполагает, что дальнейшая оптимизация атомной структуры и плотности может быть достигнута путем удаления атомов с низкой энергией связи. Предыдущие исследования точечных дефектов в моделях a -Si показали, что в некоторых случаях энергия образования вакансии отрицательна, т.е. энергия системы может быть снижена путем удаления атома [31].Анализ структуры дефектов связи в наших образцах показал, что атомы с пятикратной координацией имеют тенденцию к кластеризации, как было отмечено в некоторых предыдущих исследованиях [24]. Мы провели систематический поиск таких “ атомов высокой энергии ”, используя процедуру, которая в дальнейшем будет называться аннигиляцией точечных дефектов (PDA): (1) атом удаляется с последующей минимизацией энергии относительно координат остальных атомов. Это повторяется для всех атомов в системе и окончательной конфигурации с наименьшей энергией, выбранной для дальнейшей обработки.(2) Затем выполняется отжиг выбранной конфигурации в течение 1 пс при 600 К и в течение 1 пс при 300 К с последующей минимизацией энергии по координатам и изменением масштаба объема. Этапы (1) и (2) повторялись до тех пор, пока процедура PDA не привела к увеличению конечной энергии. Отметим, что из-за отжига и релаксации по объему процедура PDA может приводить к увеличению плотности, несмотря на то, что атомы удаляются из системы.
Результаты расчетов КПК, начиная с конфигурации e , показаны на рисунке 1.Избыточная энергия упала с 0,167 до 0,156 эВ атом -1 после четырех итераций (удаление 4 атомов, конфигурация i на рисунке 1).
Поскольку описанная выше процедура PDA началась с конфигурации с высокой плотностью, близкой к кристаллу, возможно, что полученная конфигурация смещена в сторону высокой плотности. Таким образом, была создана другая начальная конфигурация для процедуры PDA путем увеличения объема блока моделирования примерно на 2% с последующим отжигом при 900, 600 и 300 K в течение 10 пс при каждой настройке температуры, а затем минимизацией энергии по сравнению с координаты атома и изотропное масштабирование окна моделирования (конфигурация x на рисунке 1).Плотность этой конфигурации на 1,8% ниже плотности кристалла, а избыточная энергия составляет 0,160 эВ атом -1 . Когда процедура PDA применяется к этой конфигурации, плотность увеличивается до аналогичного оптимального значения (образец y на рисунке 1), что и оптимальная конфигурация, полученная в предыдущем расчете PDA, приблизительно 99% плотности кристалла. Таким образом, эта оптимальная плотность была получена с помощью процедуры PDA, исходя как из значений выше, так и снизу.
Это второе моделирование отжига PDA создает, однако, конфигурацию с еще более низкой избыточной энергией, чем полученная ранее, 0,149 эВ атом -1 после удаления всего одного атома. Это значение избыточной энергии намного ниже, чем сообщалось ранее из модельных расчетов, и хорошо согласуется с экспериментальными оценками для образцов, созданных ионной имплантацией [1, 17]. Отметим, что общее время моделирования отжига, использованное для создания этой оптимальной конфигурации, довольно мало, 53 пс.
При оптимуме для отжига PDA энергия системы не снижается дополнительно за счет удаления атома, то есть ни один атом не вызывает отрицательную энергию образования вакансии, как показано на рисунке 2. Как и ожидалось, процедура PDA действительно приводит к уменьшение количества координационных дефектов. Конфигурация с наименьшей энергией на атом (образец и на рисунке 1) включает только один трехкратно и три пятикратно скоординированных атома. Образец и на рисунке 1, который имеет большую избыточную энергию, на самом деле содержит меньше координационных дефектов, только один пятикратно и один трехкоординированный атом.Следовательно, избыточная энергия не обязательно связана с количеством координационных дефектов, что согласуется с более ранним исследованием Bernstein и др. [20]. Это указывает на то, что введение дефектов координации в a -Si может быть энергетически выгодным. Обилие координационных дефектов в этих образцах соответствует 1–2% атомов, что близко к оценкам для образцов, полученных ионной имплантацией [23].
Увеличить Уменьшить Сбросить размер изображения
Рисунок 2. Распределение энергии образования вакансии, полученное в результате расчетов теории функционала плотности. Верхняя панель предназначена для конфигураций, обозначенных b и d на рисунке 1, и показывает эффект увеличения времени отжига при 600 K от 1 пс (пунктирная линия) до 20 пс (сплошная линия и заштрихованная область). Полная энергия образца уменьшается в течение продолжительного периода отжига, но некоторые из атомов становятся энергетически менее стабильными, на что указывают большие отрицательные значения энергии образования вакансий.На нижней панели показаны результаты для оптимальной конфигурации после процедуры PDA ( y на рисунке 1), где слабосвязанные атомы были удалены с последующим моделированием короткого отжига. Здесь все значения энергии образования вакансии положительны, наименьшее из которых составляет 0,13 эВ (кривая имеет хвост в область отрицательных значений из-за размытия по Гауссу).
Загрузить рисунок:
Стандартный образ Изображение высокого разрешенияОптимальная плотность, полученная в этих расчетах, 99% плотности кристалла, находится в диапазоне значений, определенных экспериментально для образцов a -Si, приготовленных ионной имплантацией [6, 22, 23].Некоторые измерения дали плотность всего 98%, но, как утверждают авторы, вполне вероятно, что эти образцы содержат небольшую концентрацию вакансий даже после отжига [23]. Это согласуется с низким значением координационного числа, определенным для этих образцов, 3,88. Во всех наших оптимизированных образцах координационное число больше 3,99–4,02. Другое объяснение может заключаться в том, что эксперименты проводятся при ненулевой температуре и, следовательно, содержат равновесную концентрацию точечных дефектов, таких как вакансии.Хотя концентрация тепловых дефектов обычно мала в c -Si из-за высокой энергии образования около 3,6 эВ, вакансии в a -Si могут быть созданы с гораздо меньшими затратами. Фактически, вычисленное распределение энергии образования вакансии в нашем оптимальном образце и -Si, показанном на рисунке 2, включает в себя такое низкое значение, как 0,13 эВ.
Другие структурные характеристики конфигурации с наименьшей энергией также хорошо согласуются с имеющимися экспериментальными данными, как показано на рисунке 3.Для сравнения с измерениями комнатной температуры RDF был рассчитан как среднее значение по большому количеству конфигураций, созданных классической динамикой DFT / PBE после нагрева самой низкоэнергетической конфигурации, образец и , до 300 К. Согласие отличное, как показано на рисунке 3. Положение 1-го пика в RDF аналогично расстоянию 1-го соседа в c -Si, как было обнаружено в экспериментах [23]. Распределение валентных углов также хорошо согласуется с экспериментом, как показано на рисунке 3.Максимум наблюдается при, что прекрасно согласуется с имеющимися измерениями [2] и [23]. Дисперсия в распределении валентных углов также отлично согласуется с экспериментальными оценками [2, 6, 23].
Увеличить Уменьшить Сбросить размер изображения
Рис. 3. Сравнение различных структурных свойств низкоэнергетической конфигурации, образец y , с экспериментальными измерениями.Верхняя панель: функция радиального распределения рассчитана (сплошная линия) и измерена [23], (заштрихованная серая область). На вставке показано распределение валентных углов (сплошная линия) вместе с экспериментально оцененной дисперсией (серые вертикальные полосы) [2, 6, 23]. На вставке также показано распределение двугранного угла (пунктирная линия) с наиболее частыми значениями в c -Si, отмеченными пунктирными линиями, что указывает на средний порядок, несмотря на тот факт, что никакие атомы не находятся локально в кристаллическом окружении. Нижняя панель: рассчитанная (сплошная линия) и измеренная [37] колебательная плотность состояний (серая заштрихованная область).
Загрузить рисунок:
Стандартный образ Изображение высокого разрешенияБыло высказано предположение, что средний порядок в a -Si обусловлен наличием кристаллических областей [12], и были предложены модели a -Si, которые включают кристаллические зерна [14]. Эти модели могут воспроизводить дисперсию измеренного дифракционного сигнала в экспериментах с флуктуационной электронной микроскопией, но характеризуются большим избытком энергии по сравнению с c -Si, превышающим экспериментальные оценки.Один из способов охарактеризовать средний порядок – это распределение двугранного угла. Образцы, полученные здесь, имеют распределения с четко определенными пиками при 60 ° и 180 °, четкое указание на средний порядок, см. Рисунок 3.
Более детальный анализ среднего порядка можно провести с помощью кольцевого анализа, т.е. подсчитать количество атомов в кратчайших кольцах, образованных связями Si – Si [32]. Результаты такого анализа представлены в таблице 1. В c -Si каждый атом образует 6 колец с 6 атомами.Такой анализ был использован для идентификации атомов локально в кристаллической среде в моделях и -Si [19]. Наша оптимальная конфигурация не содержит атома с кольцевыми характеристиками c -Si.
Таблица 1. Анализ колец и общих соседей локальной структуры в оптимальной конфигурации, y , и в конфигурации CRN.
| Образец y | CRN | |
|---|---|---|
| Кольца / атом | ||
| 3 | 0.005 | 0,000 |
| 4 | 0,042 | 0,025 |
| 5 | 0,391 | 0,495 |
| 6 | 0,772 | 0,630 |
| 7 | 0,023 | 0,035 |
| CNA пары% | ||
| (211) | 5,7 | 5,7 |
| (311) | 16.4 | 24,8 |
| (322) | 9,1 | 9,5 |
| (411) | 20,8 | 16,0 |
| (421) | 13,9 | 12,7 |
| (422) | 11,5 | 10,3 |
| (433) | 19,4 | 19,3 |
| (532) | 16,8 | 14,3 |
| (544) | 10.4 | 7,7 |
| (555) | 3,7 | 2,4 |
Другой метод структурного анализа, который использовался при исследовании аморфных упаковок атомов, основан на подсчете числа общих соседей и анализе количества и расположения связей между общими соседями [33–35]. Это называется анализом общего соседа (CNA). Недавно этот метод был распространен на системы, в которых атомы в идеале имеют четырехкратную координацию [36].Там анализ выполняется для вторых ближайших соседей, а не для первых ближайших соседей. Атом в c -Si образует 12 пар типа (421) со своими вторыми соседями, а атом в гексагональной решетке алмаза образует 6 пар типа (421) и 6 пар типа (422). Результаты CNA для нашей оптимальной конфигурации показаны в таблице 1. Ни один из атомов в нашей оптимальной конфигурации не образует набор пар, характерных для кристаллического упорядочения. Аналогично результатам кольцевого анализа, не обнаружено, что атом находится в локальном окружении, характерном для кристалла.Это показывает, что средний порядок может присутствовать в хорошо релаксированных моделях a -Si без наличия кристаллических зерен.
Колебательная плотность состояний, вычисленная в гармоническом приближении для нашей оптимальной конфигурации, также показана на рисунке 3 вместе с экспериментальными данными, полученными путем рассеяния нейтронов на напыленном образце a -Si [37]. Матрица силовых констант была рассчитана на основе расчетов DFT / PBE. Согласие между расчетом и измерением превосходное, что еще раз подтверждает высокое качество атомной конфигурации.
Наконец, мы провели подробное сравнение нашей оптимальной конфигурации с высококачественным образцом CRN [10], содержащим 200 атомов. Создание таких образцов основано не на энергии, а при условии, что все атомы имеют четырехкратную координацию, то есть отсутствие координационных дефектов. После минимизации энергии DFT / PBE относительно координат и объема атомов, начиная с координат CRN, избыточная энергия по отношению к кристаллу оказывается практически такой же, как у нашего образца с наименьшей энергией, 0.149 эВ атом -1 . Это довольно низкий уровень, сопоставимый с нашей оптимальной конфигурацией. Однако плотность расслабленной конфигурации CRN значительно ниже, всего 96,7% от плотности кристалла, что значительно ниже экспериментальных оценок. Конфигурация CRN также во многих отношениях сильно отличается от нашей оптимальной конфигурации. Он не содержит координационных дефектов даже после релаксации с помощью DFT / PBE, в то время как наш образец с наименьшей энергией имеет 2% координационных дефектов. Это снова вызывает вопрос, действительно ли небольшая плотность координационных дефектов является существенной характеристикой a -Si.Результаты для кольца и CNA конфигурации CRN приведены в таблице 1. Ни один атом не классифицируется как находящийся в кристаллической среде ни одним из методов анализа, аналогичных нашей оптимальной конфигурации. Но есть явная разница в изобилии колец, CRN имеет меньше шестикратных колец и больше пяти- и семикратных колец. Результаты CNA показывают большее количество пар, соответствующих 3 общим вторым соседям, в то время как количество пар, соответствующих 4 и 5, ниже. Количество пар (555) и (544), которые являются элементами (искаженного) икосаэдра, составляет лишь около 2/3 от количества в нашей оптимальной конфигурации.
Плотность электронных состояний, рассчитанная с помощью DFT / PBE для конфигурации с наименьшей энергией, дает ширину запрещенной зоны, которая в 1,48 раза больше, чем рассчитанная для кристалла на том же уровне теории. Хотя известно, что рассчитанные значения ширины запрещенной зоны слишком малы в DFT / PBE, это отношение прекрасно согласуется с отношением экспериментально определенных запрещенных зон, равным 1,55 (см. [38]). В щели обнаружены два пика дефектов, на 0,09 и 0,15 эВ выше края валентной зоны, предположительно соответствующие дефектам координации.Однако расчеты DFT / PBE для релаксированного образца CRN не показали наличия дефектных состояний в электронной запрещенной зоне, что согласуется с отсутствием координационных дефектов. О дальнейшем исследовании электронных свойств различных образцов a -Si будет сообщено в другом месте.
Таким образом, мы использовали процедуру отжига, основанную на электронном DFT, чтобы создать атомную конфигурацию для аморфного кремния, которая отлично согласуется с различными экспериментальными измерениями, включая избыточную энергию по отношению к кристаллу, плотности, плотности координационных дефектов, RDF, угловые функции распределения и колебательная плотность состояний.Наш подход частично основан на систематической процедуре удаления слабосвязанных атомов. Полученная оптимальная конфигурация не имеет атомов в локальном окружении, характерном для кристаллического порядка, как было установлено из кольцевого анализа и CNA.
Мы благодарим Дж. Баркему за плодотворные обсуждения и за предоставленный образец CRN. Благодарим регион Пуату-Шарант за поддержку трехмесячного пребывания А. Педерсена во Франции. Финансовую поддержку также оказал Исландский исследовательский фонд.Расчеты проводились с использованием центра Nordic High Performance Computing (NHPC) в Исландии.
Макрон продвигает атомную и водородную энергетику в плане на 30 миллиардов евро, чтобы обратить вспять промышленный спад
Дата выдачи:
Президент Эммануэль Макрон сказал, что Франция будет стремиться стать лидером в области экологически чистого водорода к 2030 году и построить новые ядерные реакторы меньшего размера, когда во вторник он обнародовал пятилетний инвестиционный план, направленный на содействие промышленным лидерам и инновациям.
«Мы должны вести битву за инновации и индустриализацию одновременно», – сказал президент Франции на собрании руководителей бизнеса и молодых предпринимателей, обнародовав планы инвестировать 30 миллиардов евро (35 миллиардов долларов) в «реиндустриализацию» страны.
Макрон выступал за шесть месяцев до президентских выборов во Франции, на которых он, как ожидается, будет баллотироваться на второй пятилетний срок в Елисейском дворце.
Излагая некоторые цели плана, Макрон сказал, что Франция построит низкоуглеродный самолет, небольшой модульный реактор, а также два мегазавода по производству зеленого водорода – все к концу десятилетия. Он также будет производить большое количество электромобилей.
Он сказал, что его долгосрочная дорожная карта, получившая название «Франция 2030», отводит ключевую роль небольшим, гибким стартапам в построении промышленного будущего Франции наряду с хорошо зарекомендовавшими себя гигантами.
Указывая на нехватку масок во время первой пандемии Covid-19, Макрон сказал, что пандемия выявила уязвимые места и подчеркнула необходимость инноваций и промышленных возможностей поблизости от дома.
«Мы должны перестроить основу для обеспечения производительной независимости Франции и Европы», – сказал он, подчеркнув, что инновации будут ключевыми в условиях глобальной конкуренции за лидерство и доступ к сырью. «Победитель получает все», – добавил он.
Другие цели включают в себя инвестиции в полупроводники и усиление инноваций во французском секторе здравоохранения, включая биомедицину.
30 миллиардов евро прибывают в дополнение к плану восстановления в 100 миллиардов евро, объявленному в прошлом году, чтобы помочь Франции справиться с пандемией коронавируса, большая часть которых пошла на продвижение более экологичной энергетической политики.
(ФРАНЦИЯ 24 с REUTERS)
.