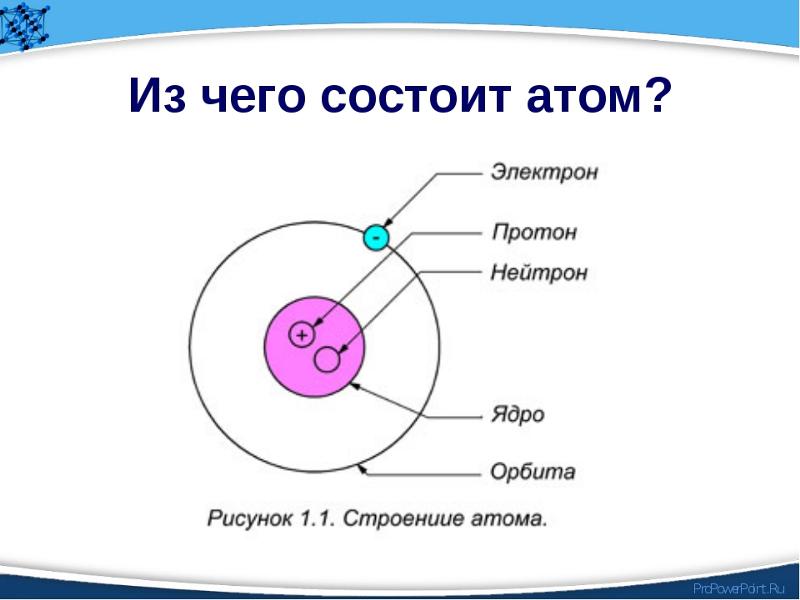
Строение атома. Строение вещества. – Химия
Причины образования химической связи.Энергия связи. ЭлектроотрицательностьВсе вещества образованы из атомов. Напомним: атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, располагающихся вокруг ядра на атомных орбиталях. Орбитали образуют подуровни (s, p, d, f), подуровни объединяются в энергетические уровни (первый, второй, третий и т. д.). На каждой орбитали может находиться не более двух электронов с противоположными спинами. На s-подуровне, состоящем из одной орбитали, может располагаться два электрона; на трех орбиталях p-подуровня – шесть электронов; на пяти орбиталях d-подуровня – десять. Соответственно в каждом периоде периодической системы имеются по два s-элемента, шесть p-элементов (начиная со второго периода) и десять d-элементов (четвертый и последующие периоды).
Казалось бы, этих знаний о строении атомов химических элементов вполне достаточно для понимания их свойств. А так как все вещества образованы из атомов, на этом можно завершить изучение теории строения вещества. Но, как это ни парадоксально, при обычных условиях атомы большинства химических элементов в свободном виде не существуют. Исключением являются лишь атомы благородных газов, существующие при обычных условиях в несвязанном виде. Во всех остальных случаях атомы входят в состав химических соединений, в которых они связаны посредством химических связей. Даже простые вещества всех химических элементов, кроме благородных газов, являются химическими соединениями. Например, простое вещество водород состоит из молекул Н2, в которых два атома водорода связаны одной ковалентной связью: Н–Н. В алмазе, одной из аллотропных модификаций углерода, каждый атом углерода связан с соседними атомами четырьмя ковалентными связями. Простые вещества металлов также являются химическими соединениями, в которых атомы связаны друг с другом металлическими связями (см. рисунки на стр. 83).
А так как все вещества образованы из атомов, на этом можно завершить изучение теории строения вещества. Но, как это ни парадоксально, при обычных условиях атомы большинства химических элементов в свободном виде не существуют. Исключением являются лишь атомы благородных газов, существующие при обычных условиях в несвязанном виде. Во всех остальных случаях атомы входят в состав химических соединений, в которых они связаны посредством химических связей. Даже простые вещества всех химических элементов, кроме благородных газов, являются химическими соединениями. Например, простое вещество водород состоит из молекул Н2, в которых два атома водорода связаны одной ковалентной связью: Н–Н. В алмазе, одной из аллотропных модификаций углерода, каждый атом углерода связан с соседними атомами четырьмя ковалентными связями. Простые вещества металлов также являются химическими соединениями, в которых атомы связаны друг с другом металлическими связями (см. рисунки на стр. 83).
Химическая связь – это взаимодействие, связывающее отдельные атомы в химические соединения.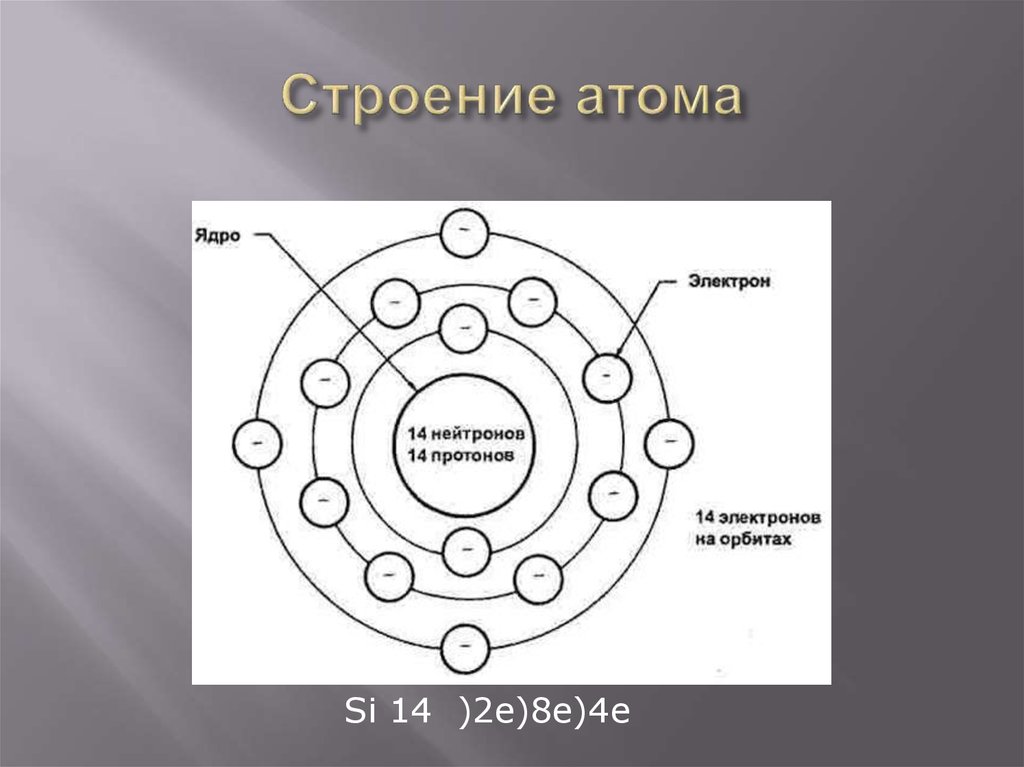
Таким образом, способность образовывать химические связи является важнейшим свойством атомов, без рассмотрения которого невозможно судить о строении и свойствах химических веществ.
Химические связи образуются за счет перераспределения электронов между электронными оболочками атомов. Участвовать в образовании химических связей могут только те электроны, которые слабее всего связаны с ядром, то есть электроны внешних электронных оболочек. Такие электроны называются валентными.
Валентные электроны принято обозначать точками, которые окружают химический символ элемента. Такие формулы называются электронными формулами:
Для атомов s- и p- элементов валентными являются s- и p-электроны внешнего энергетического уровня, причем для возбужденных состояний атомов s- и p-элементов третьего и последующих периодов валентными являются также электроны, перешедшие на d-подуровень (вспомните пятивалентный фосфор, шестивалентную серу, пяти- и семивалентный хлор).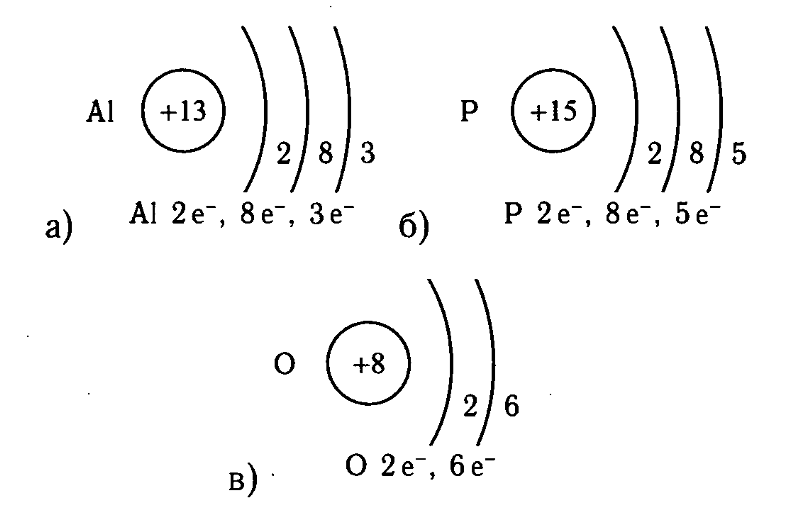
В случае атомов d-элементов валентными являются s-электроны внешнего уровня и d-электроны предвнешнего уровня, которые завершают формирование электронной оболочки атома.
Пример. Валентные электроны атомов скандия и марганца
Sc: …3s23p63d14s2
Mn: …3s23p63d54s2
В приведенных формулах электронных конфигураций валентные электроны подчеркнуты. Таким образом, валентность скандия равна трем, а у марганца высшая валентность равна семи. Это согласуется с существованием соответствующих соединений: Sc2O3; Sc(OH)3; Mn2O7; KMnO4 (“марганцовка”).
Как было сказано выше, при обычных условиях устойчивы только атомы благородных газов. Из этого реально наблюдаемого явления можно сделать два важных вывода.
Из этого реально наблюдаемого явления можно сделать два важных вывода.
Во-первых, внешние электронные оболочки атомов благородных газов являются весьма устойчивыми. Такие электронные оболочки называются завершенными. Завершенная электронная оболочка атома гелия включает два электрона (1s2). Атомы остальных благородных газов имеют восьмиэлектронные завершенные оболочки (…ns2np6).
Во-вторых, все остальные атомы будут стремиться сформировать подобные стабильные завершенные оболочки за счет отдачи либо присоединения электронов. В зависимости от того, какая тенденция преобладает, элементы делятся на две большие группы: металлы и неметаллы.
Атомы металлов, валентные оболочки которых далеки до завершения, легко отдают электроны, тогда как атомы неметаллов, у которых валентные электронные оболочки близки к завершению, стремятся присоединять электроны. В каждом случае структуры электронных оболочек будут приближаться к устойчивым электронным конфигурациям атомов благородных газов, то есть к завершению.
Например, при образовании хлорида натрия из простых веществ атомы натрия отдают по одному электрону, а атомы хлора – принимают. В результате образуются ионы Na+ и Cl–, из которых состоят кристаллы NaCl. Электронные конфигурации ионов Na+ и Cl– такие же, как у атомов неона и аргона соответственно:
Na+ …2s22p6
Cl– …3s23p6.
Хлорид натрия, в котором ионы Na+ и Cl– имеют завершенные электронные оболочки, является устойчивым соединением, в отличие от отдельных атомов натрия и хлора.
При образовании химической связи всегда выделяется энергия. Эта энергия называется энергией связи.
Энергии большинства химических связей имеют значения порядка нескольких сотен кДж/моль. На практике энергию, выделяющуюся при образовании химической связи, измерить сложно, проще измерить количество энергии, которое необходимо затратить для разрыва связи. В соответствии с законом сохранения энергии эти величины будут равны.
В соответствии с законом сохранения энергии эти величины будут равны.
Энергия связи – это энергия, которую необходимо затратить для разрыва химической связи.
При образовании химической связи валентные электроны перераспределяются между образующими ее атомами, то есть атомы в процессе взаимодействия могут отдавать либо принимать электроны. Обе эти тенденции – отдачи и присоединения электронов – характеризует электроотрицательность (ЭО).
Электроотрицательность – это величина, характеризующая способность атома в химическом соединении притягивать к себе электроны от других атомов.
Чаще всего на практике используется относительная шкала электроотрицательности, в которой максимальное значение электроотрицательности равно 4,10 у атома фтора. Наименьшие значения электроотрицательности, близкие к 1 – у атомов щелочных металлов.
Значения электроотрицательности атомов химических элементов приводятся во многих изданиях периодической таблицы Д. И. Менделеева.
Химическая связь образуется между атомами за счет перераспределения электронов между их валентными оболочками, поэтому тип образующейся связи будет определяться разностью значений электроотрицательности взаимодействующих атомов. Ее обозначают ЭО. Электроотрицательность является характеристикой атома, тогда как тип химической связи будет определяться значением ЭО.
Если химическая связь образована двумя одинаковыми атомами, ЭО равна нулю. Это значит, что валентные электроны будут в равной степени принадлежать каждому атому, связь будет ковалентной неполярной.
Примеры: ковалентные неполярные связи в молекулах N2, O2, Cl2, F2.
Таблица. Значения электроотрицательности некоторых химических
элементов
группа период | 1 (IA) | 2 (IIA) | 3 (IIIA) | 4 (IVA) | 5 (VA) | 6 (VIA) | 7 (VIIA) |
1 | H 2,20 | ||||||
2 | Li 0,97 | Be 1,47 | B 2,01 | C 2,50 | N 3,07 | O 3,50 | F 4,10 |
3 | Na 1,01 | Mg 1,23 | Al 1,47 | Si 1,74 | P 2,06 | S 2,44 | Cl 2,83 |
4 | K 0,91 | Ca 1,04 | Ga 1,82 | Ge 2,02 | As 2,20 | Se 2,48 | Br 2,74 |
5 | Rb 0,89 | Sr 0,99 | In 1,49 | Sn 1,72 | Sb 1,82 | Te 2,01 | I 2,21 |
6 | Cs 0,86 | Ba 0,97 | Тl 1,44 | Pb 1,55 | Bi 1,67 | Po 1,76 | At 1,90 |
7 | Fr 0,86 | Ra 0,97 |
В случае, если ЭО невелика и не превышает 0,5, между атомами образуются ковалентные малополярные связи.
Пример. Химическая связь в углеводородах
Каркасами органических соединений являются углеводороды. Молекулы их включают цепи из атомов углерода, связанных между собой неполярными связями. В углеводородах имеются связи С–Н, являющиеся малополярными (ЭО = 0,30).
Ковалентные малополярные связи могут образовываться также между атомами одного элемента. Например, в молекуле хлорэтана СН3–СН2Cl, связь С–С является ковалентной малополярной.
Ковалентные полярные связи образуются между атомами в случае не очень больших разностей электроотрицательностей.
Пример. Хлороводород HCl
Молекула H–Cl образована атомами водорода и хлора. Электроотрицательность водорода равна 2,20, хлора – 2,83. ЭО=0,63. Это значит, что электроны, образующие связь, будут смещены к более электроотрицательному атому хлора.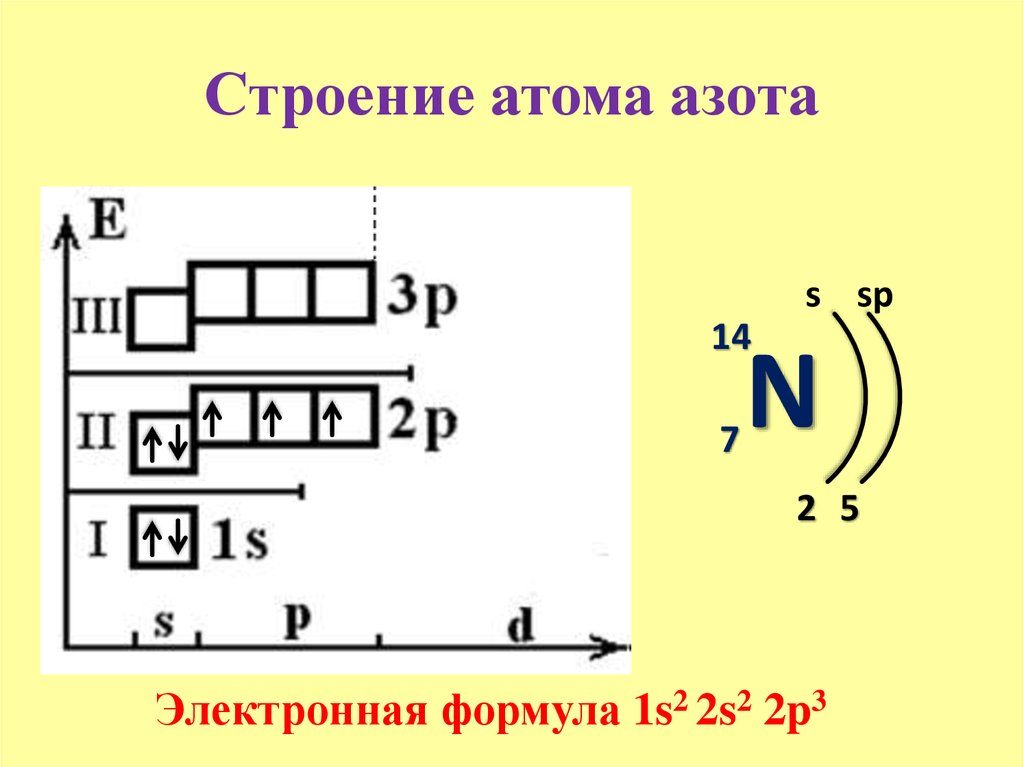 Молекула является полярной. На атоме хлора будет частичный отрицательный заряд, на атоме водорода – частичный положительный. Частичный заряд обозначается греческой буквой :
Молекула является полярной. На атоме хлора будет частичный отрицательный заряд, на атоме водорода – частичный положительный. Частичный заряд обозначается греческой буквой :
+ –
H–Cl
Образовавшаяся молекула является диполем. Связь между атомами водорода и хлора ковалентная полярная.
Если разность значений электроотрицательности атомов, образующих химическую связь, достаточно велика, атом с высокой электроотрицательностью захватывает электроны у атома с низкой электроотрицательностью. При этом образуется ионная связь. Понятно, что это случай взаимодействия между атомами с различными свойствами, то есть между атомами металлов и неметаллов. Для образования ионной связи электроотрицательности атомов должны различаться примерно на 2 и более.
Можно заключить, что тип химической связи определяется свойствами взаимодействующих атомов, в первую очередь, значениями их электроотрицательности, и разностью этих значений.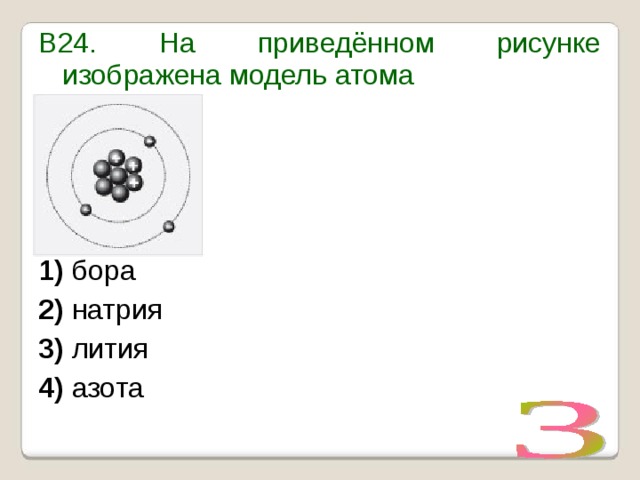 В следующих параграфах мы рассмотрим механизмы образования и основные характеристики химических связей различных типов.
В следующих параграфах мы рассмотрим механизмы образования и основные характеристики химических связей различных типов.
Строение атомов и ионов
Излагаемые в этом параграфе сведения вам придётся принять «на веру», так как в школе сложно проделать соответствующие эксперименты. Причина – многие из них объясняются «на стыке» пока не изученных разделов физики и химии. Строение атомов – пример таких сведений. Познакомимся с ними.
Атомы состоят из малых частиц трёх видов. В центре атома имеется ядро, образованное протонами и нейтронами. Вокруг ядра есть электроны, образующие электронные оболочки. Количество электронов, как правило, равно количеству протонов в ядре. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков.
Масса протона приблизительно равна массе нейтрона. По сравнению с их массами масса электрона пренебрежимо мала. Электроны относятся к так называемым отрицательно заряженным частицам, протоны – к положительно заряженным частицам. Нейтроны относятся к незаряженным или электронейтральным частицам (что такое электрический заряд и как определяются его знаки, мы узнаем в § 8-в).
Нейтроны относятся к незаряженным или электронейтральным частицам (что такое электрический заряд и как определяются его знаки, мы узнаем в § 8-в).
Частицы ядра прочно связаны друг с другом особыми ядерными силами. Притяжение электронов к ядру гораздо слабее взаимного притяжения протонов и нейтронов, поэтому электроны (в отличие от частиц ядра – протонов и нейтронов) могут отделяться от своих атомов и переходить к другим.
В результате переходов электронов образуются ионы – атомы или группы атомов, в которых число электронов не равно числу протонов. Если ион содержит отрицательно заряженных частиц больше, чем положительно заряженных, то такой ион называют отрицательным. В противоположном случае ион называют положительным. В верхней части рисунка показана потеря атомом электрона, то есть образование положительного иона. В нижней части рисунка – образование из атома отрицательного иона.
Ионы очень часто встречаются в веществах, например они есть во всех без исключения металлах. Причина заключается в том, что один или несколько электронов от каждого атома металла отделяются и движутся внутри металла, образуя так называемый электронный газ. Именно из-за потери электронов, то есть отрицательных частиц, атомы металла становятся положительными ионами. Это справедливо для металлов в любом состоянии – твёрдом, жидком или газообразном (например, для паров ртути).
Вы уже знаете, что в твёрдом состоянии все металлы являются кристаллами (см. § 7-е). Ионы всех металлов расположены упорядоченно, образуя кристаллическую решётку. В металлах в жидком или газообразном состоянии упорядоченное расположение ионов отсутствует, но электронный газ по-прежнему присутствует.
Некоторые ионы могут быть образованы несколькими атомами. Например, молекулы серной кислоты h3SO4 в водном растворе распадаются на положительные ионы водорода, в каждом из которых по одному атому, и отрицательные ионы кислотного остатка, в каждом из которых по пять атомов (см. рисунок).
рисунок).
| Символ «+» означает один недостающий электрон. Символ «2–» означает два дополнительных электрона. |
Образование ионов из нейтральных молекул (ионизация) может происходить по разным причинам. Одну из них, растворение, мы только что рассмотрели. Другая причина – повышение температуры. При этом увеличивается размах колебаний как молекул, так и атомов, входящих в их состав. Если температура превысит некоторое значение, то молекула распадётся, и образуются ионы. Ионизация может происходить и под действием трения, электричества, света, радиации.
Опубликовано в разделах: 8 класс, Электронно-ионная теорияКак нарисовать атомную структуру атомов
••• Kenishirotie/iStock/GettyImages
Обновлено 13 марта 2018 г.
Коллектив редакции
Для рисования атомной структуры требуется лишь простое понимание компонентов атомной структуры. Если вы понимаете, как протоны и электроны соотносятся друг с другом, а также как нейтроны помогают составлять атомную массу, остальное — пирог.
- Ручка или карандаш
- Бумага
- Периодическая таблица (дополнительно для справки)
Сначала используйте карандаш, если вы допустили ошибку.
Прежде чем рисовать, сделайте расчеты. Диаграмму легче нарисовать, если вы точно знаете, сколько всего у вас должно быть.
Дважды проверьте свою математику, особенно для элементов с большими атомными номерами. Один неуместный или забытый электрон и вся ваша схема ничего не стоит.
Нарисуйте круг на странице. Для целей этой статьи мы будем использовать углерод в качестве примера. Однако процесс одинаков для всего, что вы рисуете. Напишите букву «С» в середине круга, чтобы указать, что вы имеете дело с углеродом.
Определите, сколько протонов и электронов вам нужно нарисовать. Количество электронов в атоме связано с количеством протонов. Сколько бы у вас ни было протонов, столько электронов вам и понадобится. Чтобы определить количество протонов, достаточно посмотреть на атомный номер. Атомный номер углерода равен 6, поэтому вам понадобится 6 протонов и, в свою очередь, 6 электронов.
Нарисуйте электронные кольца. Кружок с буквой «С» представляет собой репрезентативное ядро, поэтому теперь вам нужно указать электронные орбитали. Количество колец, которое вам нужно, должно быть привязано к количеству электронов, которые у вас есть. У углерода 6 электронов. Поскольку каждое кольцо имеет максимальное количество электронов, которое можно изобразить, вам придется провести некоторые математические расчеты. В первом кольце может быть максимум 2 электрона, во втором кольце — максимум 8, в третьем кольце — максимум 18 и т. д. У углерода 6 электронов, поэтому вам нужно нарисовать два концентрических кольца.
В первом кольце может быть максимум 2 электрона, во втором кольце — максимум 8, в третьем кольце — максимум 18 и т. д. У углерода 6 электронов, поэтому вам нужно нарисовать два концентрических кольца.
Нарисуй свои электроны. Вы можете сделать это несколькими способами. Некоторые люди просто рисуют круги на кольцах и закрашивают их. В этом случае вы должны нарисовать 2 на первом кольце и 4 на втором кольце. Вы также можете указать электроны, нарисовав X. Лучший способ нарисовать электроны — нарисовать их в виде кругов со знаком минус внутри. Это указывает не только на то, что это электроны, но и помогает напомнить зрителю, что электроны содержат отрицательный заряд.
Нарисуй свои протоны и нейтроны. Сотрите букву «С» в центральном круге и нарисуйте свои протоны. Поскольку количество протонов равно количеству электронов, вы просто рисуете 6 протонов. Чтобы указать, что это протоны, нарисуйте их в виде кругов со знаками плюс внутри. Нейтроны просто равны атомной массе минус количество протонов.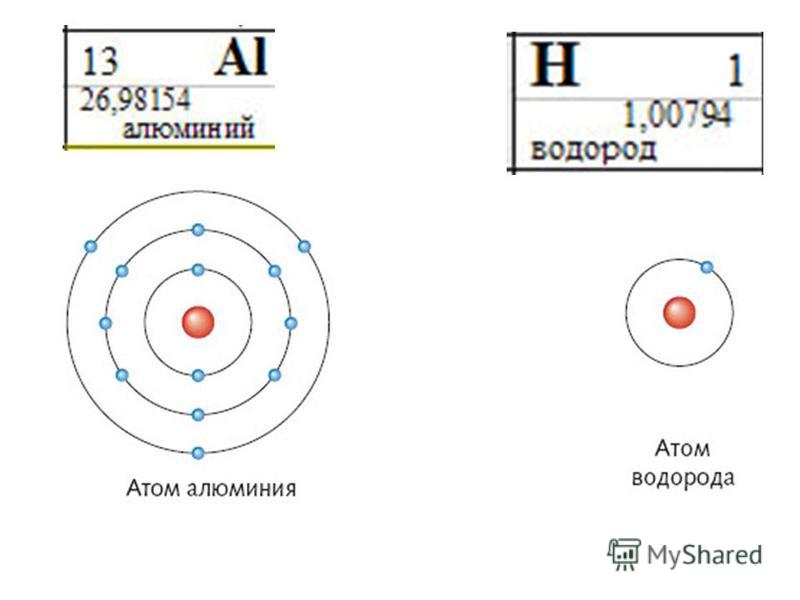 Опять же, вам нужно будет сделать некоторые быстрые математические расчеты. Атомная масса углерода равна 12, и у вас есть 6 протонов. Это означает, что вам нужно привлечь 6 нейтронов в ядро. Не указывайте им заряд, так как нейтроны имеют нейтральный заряд.
Опять же, вам нужно будет сделать некоторые быстрые математические расчеты. Атомная масса углерода равна 12, и у вас есть 6 протонов. Это означает, что вам нужно привлечь 6 нейтронов в ядро. Не указывайте им заряд, так как нейтроны имеют нейтральный заряд.
Подпишите свою диаграмму, если хотите. Из вашего рисунка должно быть ясно, какой элемент обозначается, но уточнить никогда не помешает.
Вещи, которые вам понадобятся
Предупреждения
Статьи по теме
Советы
- Сначала используйте карандаш, если вы допустили ошибку.

- Перед тем, как рисовать, сделайте расчеты. Диаграмму легче нарисовать, если вы точно знаете, сколько всего у вас должно быть.
Предупреждения
- Дважды проверьте свою математику, особенно для элементов с большими атомными номерами. Один неуместный или забытый электрон и вся ваша схема ничего не стоит.
Об авторе
Эта статья была написана командой CareerTrend, отредактирована и проверена с помощью многоточечной системы аудита, чтобы наши читатели получали только самую лучшую информацию. Чтобы задать свои вопросы или идеи или просто узнать больше о CareerTrend, свяжитесь с нами [здесь](http://careertrend.com/about-us).
Q2 Нарисуйте базовую структуру атома, представляя его a Субатомные частицы b Ядро c Орбиты или …
Перейти к
- Упражнение
- Вопросы объективного типа
- Материя и ее состав
- Физические и химические изменения
- Элементы, соединения и смеси
- Атомная структура
- Металлы и неметаллы
- Воздух и атмосфера
Главная > Союзные решения Класс 7 Химия > Глава 4 – Атомная структура > Упражнение > Вопрос 2
Вопрос 2 Упражнение
Q2) Изобразите основную структуру атома, представляющую его – (a) Субатомные частицы (b) Ядро (c) Орбиты или оболочки.
Ответ:
Решение:
Похожие вопросы
Q1) Укажите значение термина – (а) атом (б) молекула (в) радикал – с подходящим примером.
Q3) В современной периодической таблице – атомы всех элементов расположены по возрастанию…
Q4) Укажите основные пункты противоречия теории атома Дальтона современной теории атома…
Q5) «Атомы одного и того же элемента или разные из атомной теории Дальтона современной атомной теорией»….
Q6) Объясните термин «атомарность». Укажите причину, почему -1. Гелий считается одноатомным, но гидро…
Q7) Укажите атомарность следующего: 1. Неон2.