Электронное строение атомов – Справочник химика 21
На основе электронного строения атомов указать, могут ли быть окислителями атомы натрия, катионы натрия, кистород в степени окисленности —2, иод в степени окисленности О, фторид-ионы, катионы водорода, нитрит-ионы, гидрид-ионы.. [c.166]Дать краткую характеристику кремния, указав а) электронное строение атома и его валентные возможности б) химические свойства свободного кремния. [c.237]
Объясните исходя из электронного строения атомов, каков физический смысл номера периода и номера группы. [c.22]
Следует иметь в виду, что последняя схема (как и сами правила Клечковского) не отражает частных особенностей электронной структуры атомов некоторых элементоа. Например, при переходе от атома никеля (2 = 28) к атому меди (2 = 29) число Зй-электронов увеличивайся не иа один, а сразу на два за счет проскока одного из 45-электронов на подуровень З .
В предыдущих главах было показано, что энергии ионизации, сродство к электрону и электроотрицательности атомов всех элементов удается объяснить на основе рассмотрения орбитальной электронной структуры атомов. Теперь попытаемся связать электронное строение атомов с химическими свойствами элементов и их соединений. Начнем с обсуждения (и составления уравнений) реакций, в которых одни реагенты теряют, а другие приобретают электроны (окислительно-восстановительные реакции).
Согласно представлениям Гейтлера и Лондона, водород способен к образованию молекулы Нг потому, что в его атоме имеется один неспаренный электрон, а гелий не может образовать молекулу Нб2 ввиду того, что оба электрона в атоме Не являются спаренными. Аналогично рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) (рнс. 1.34) таково, что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания одиночных s-электронов можно ожидать образования молекулы LI2, аналогичной молекуле Нз. Действительно, молекула, LI2 существует. Энергия связи в молекуле Lis (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4,48 эВ). Это обусловлено наличием около ядра лития перв ого электронного слоя, поэтому связь Li —Li значительно более длин-” ная, чем связь Н—Н (267 пм вместо 74 пм в молекуле Нг) кроме того, две пары электронов первого слоя сильно экранируют заряд ядра и отталкипаются друг от друга.
Изучение электронного строения атомов начинается с описания в рамках одноэлектронного приближения оболочечной модели. Переходя от теории атома к теории молекул, естественно сохранить ту же последовательность изложения. Под атомными функциями далее понимают функции, точка центрирования которых совпадает с ядром. Явный вид волновой функции в общем случае отличен от вида функции свободного атома. Будем считать, что атомная задача решена известны численные характеристики различных атомных величин, включая и значения орбитальных энергий. Особый интерес представляют слабосвязанные атомные электроны, волновые функции которых наиболее существенным образом деформируются в ходе образования химической связи. Разделение электронов на более и менее существенные не всегда однозначно, приходится делать те или иные допущения, справедливость которых впоследствии проверяется на уровне точных расчетов. Примером тому может служить исследование роли -электронов атомов переходных металлов в энергии связи молекул.
В предыдущей главе мы познакомились с волновыми функциями и энергетическими уровнями атома водорода. При помощи этих сведений и так называемого принципа заполнения мы сможем перейти к выяснению электронного строения атомов всех элементов. Это позволит нам понять структуру периодической системы, таблица которой изображена на рис. 7-3
Знание электронного строения атомов позволяет подойти к интерпретации химических свойств элементов. Не следует пытаться запоминать все приводимые ниже факты, нужно лишь выделять из описательного материала те свойства, которые подчиняются регулярным периодическим закономерностям и могут быть объяснены электронным строением атомов. Не каждое химическое свойство становится абсолютно ясным, если известно электронное строение атома данного элемента, но многие наблюдаемые факты приобретают на этой основе ясный смысл, и именно этот смысл следует искать в массе химических данных.
Углерод. Электронное строение атома соответствует распределению электронов по ячейкам, в котором, согласно правилу Хунда, имеется два одиночных электрона. Однако валентность два для углерода не характерна , поскольку сравнительно легко осуществляется переход атома в возбужденное состояние, в котором его валентность равна четырем (см. рис. 1.34).
При обсуждении электронного строения атомов понадобится также важный интеграл от произведения трех сферических функций, который выражают через коэффициенты Клебша — Гордана по формуле [c.27]
Почему азоту трудно образовывать длинные цепи связей N—N—N—N—N—, аналогичные углеродным цепям Каким образом это зависит от электронного строения атомов [c.340]
Иерн. Электронное строение атома неона и распределение электронов по квантовым ячейкам (рис. 1.34) таковы, что в атоме неона нет неспаренных электронов. Неон, подобно гелию, не образует молекул с другими атомами его валентность равна нулю.
Современная периодическая таблица основана прежде всего на расположе- , НИИ элементов в порядке возрастания атомного номера. Она отражает также i и электронное строение атомов. [c.125]
Разделы, посвященные описательной химии элементов, могут не потребовать большого обсуждения с преподавателем студентам не следует стараться запоминать большое количество фактов, они должны лишь находить в них закономерности и связывать их с электронным строением атомов. При обсуждении сравнительной способности элементов находиться в определенных состояниях окисления в растворе удобно воспользоваться окислительными потенциалами, но студентам нужно указать, что этот способ будет подробно обсуждаться в гл. 19 и поэтому нет надобности долго останавливаться на нем в данном месте курса.
Олово 8п существует в виде двух аллотропных модификаций — неметаллическая форма а-8п (серое олово), устойчивая ниже 13,2 °С и металлическая форма Р-8п (белое олово), устойчивая выше 13,2 °С. Эти модификации отличаются структурой, что в свою очередь связано с электронным строением атома олова. Серое олово имеет алмазоподобную структуру и является изолятором, причем атомы олова находятся в состоянии зр -гибридизации (конфигурация 4с( 58 5р ). Белое олово имеет слоистую структуру и обладает металлической проводимостью, причем атомы олова находятся в состоянии sp -гибpидизaции (конфигурация 4с( 58 5р ). Такое различие в характере гибридизации и в типе структуры соответствует классическим валентностям IV в сером олове и II в белом. Действительно, если растворить серое олово в соляной кислоте и раствор выпарить, то образуется ВпСи-бНоО, если ту же операцию проделать с белым оловом, то в остатке получается 8пСЬ-2Н20, что экспериментально подтверждает приведенное выше объяснение.
Эти модификации отличаются структурой, что в свою очередь связано с электронным строением атома олова. Серое олово имеет алмазоподобную структуру и является изолятором, причем атомы олова находятся в состоянии зр -гибридизации (конфигурация 4с( 58 5р ). Белое олово имеет слоистую структуру и обладает металлической проводимостью, причем атомы олова находятся в состоянии sp -гибpидизaции (конфигурация 4с( 58 5р ). Такое различие в характере гибридизации и в типе структуры соответствует классическим валентностям IV в сером олове и II в белом. Действительно, если растворить серое олово в соляной кислоте и раствор выпарить, то образуется ВпСи-бНоО, если ту же операцию проделать с белым оловом, то в остатке получается 8пСЬ-2Н20, что экспериментально подтверждает приведенное выше объяснение.
Прн увеличении заряда ядра еще иа единицу, т. е. прн переходе к углероду (Z = 6), ЧИСЛО электронов на 2 -подуровне возрастает до 2 электронное строение атома углерода выражается формулой ls 2,s 2p . Однако этой формуле могла бы соогиетсгво-вать любая из трех схем [c.90]
Однако этой формуле могла бы соогиетсгво-вать любая из трех схем [c.90]
Обсуждаемые в данной главе атомные свойства-энергия ионизации, сродство к электрону и радиус атома – непосредственно связаны с электронным строением атома. Рекомендуется довольно подробно остановиться на обсуждении их закономерного изменения соответственно положению элемента в периодической системе.
Продолжим рассмотрение электронного строения атомо . Мы остановились на атоме аргона, у которого целиком заполнены 3s- и Зр-подуровнн, но остаются незанятыми все орбитали З -под-уровня. Однако у слсдуюилих за аргоном элементов — калия (Z = 19) и кальция (Z = 20) —заполиение третьего электронного слоя временно прекращается и начинает формироваться -подуровень четвертого слоя электронное строение атома калия выражается формулой ls 22s 2//3i 3p 4.s , атома кальция [c.92]
Исследование спектров дает возможность определить электронное строение атомов элементов — найти значения квантовых чисел и энергии электронов в атомах (обычно под термином электронное строение атома понимают его строение в нормальном состоянии). [c.30]
[c.30]
Электронное строение атома Не может быть выражено схемой, представленной на рис. 1.34, которая показывает, что два электрона находятся в одной квантовой ячейке. Два электрона с противоположными спинами, запимаюи [ие одну квантовую ячейку, называют спаренными. [c.81]
Учитывая особенности электронного строения атомов (наличие или отсутствие заряда, неспаренных электронов и т. д.), целесообразно ввести более широкое понятие — молеку.п.ярные частицы, при классификации которых необходимо выделять молекулы (отсутствуют заряд и неспаренные электроны), молекулярные радикалы (отсутствует заряд, имеются неспаренные электроны), молеку.чярные ионы (имеется заряд, отсутствуют неспаренные электроны), молекулярные ион-радикалы (имеются заряд и неспаренные электроны) (табл. 1). [c.8]
Выяснение электронного строения атомов всех элементов периодической системы облегчается мысленным процессом последовательного заселения электронами водородоподобных орбиталей в порядке повышения их энергии и одновременного увеличения заряда ядра на единицу с каждым добавляемым электроном.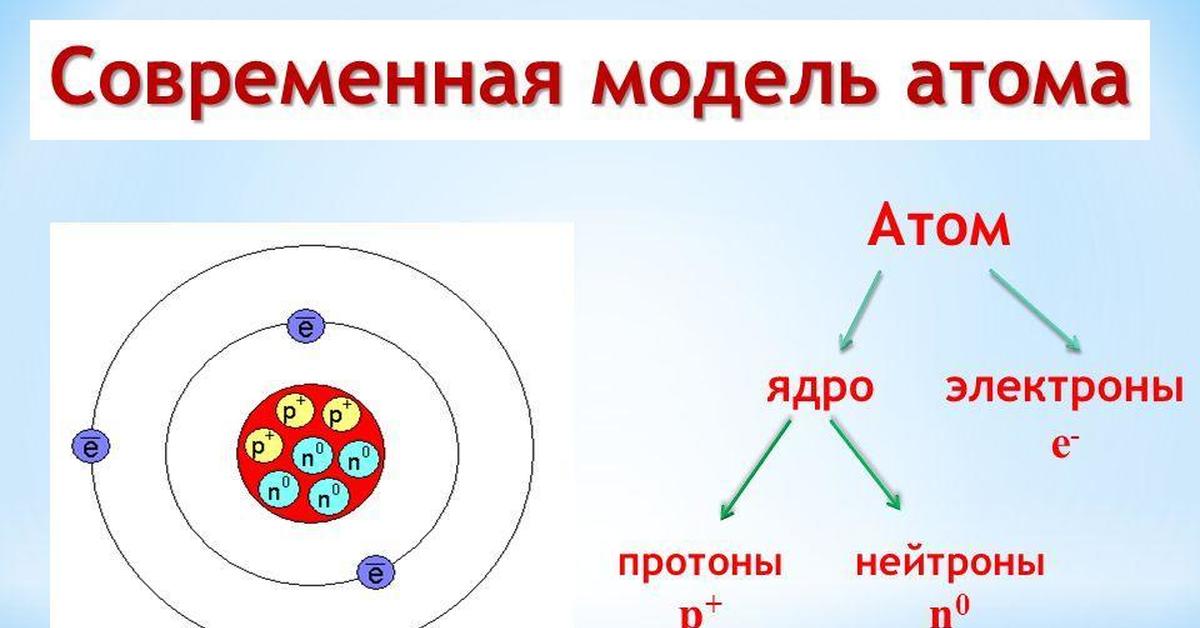 При этом особое внимание следует обращать на связь между орбитальной электронной конфигурацией атомов и их первой энергией ионизации. Первой энергией ионизации (ЭИ атома называется энергия, необходимая для удаления из атома одного электрона, т. е. для осуществленР я процесса [c.391]
При этом особое внимание следует обращать на связь между орбитальной электронной конфигурацией атомов и их первой энергией ионизации. Первой энергией ионизации (ЭИ атома называется энергия, необходимая для удаления из атома одного электрона, т. е. для осуществленР я процесса [c.391]
Эти пособия позволяют учащимся в диалоге с компьютером обсуждать первоначальные химические понятия, важнейшие классы неорганических соединений, периодическую систему химических элементов и строение атома, общие закономерности химических реакций и пр. При изучении периодической системы химических элементов и строения атомов можно рекомендовать компьютерную программу Ядро атома , Электронное строение атомов химических элементов , Энергия ионизации атомов . [c.4]
Во втором зданни (1-е издание вышло в 1983 г ) расснот рены вопросы электронного строения атомов и молекул. В до ступной форме описаны достижения, проблемы и перспективы развития квантовохимических представлений. Читатель знаке- мится с кругом современных проблем в области квантовой хи- мии( изучение нежестких молекул, возможность планирования синтеза соединений е определенными свойствами путем исследо- вания химических связей и др.). [c.2]
Читатель знаке- мится с кругом современных проблем в области квантовой хи- мии( изучение нежестких молекул, возможность планирования синтеза соединений е определенными свойствами путем исследо- вания химических связей и др.). [c.2]
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ [c.26]
Смирнов Г. 3. Электронное строение атомов и Периодическая система элементов // Вестник высшей школы.— 969.— № 10, -С, 82, [c.206]
Атомы — самые простые много электронные системы, доступные как экспериментальному, так и теоретическому изучению. Теория объясняет все основные особенности электронного строения атомов и находится не только в качественном, но и в количественном соответствии с экспериментом. С другой стороны, в более сложных образованиях атомы в значительной мере сохраняют свою индивидуальность. Поэтому многие результаты теории атомов представляют прикладной интерес. [c.116]
Свойства и получение. Атом углерода в валентном состоя-ВИИ s 2spxPgPz имеет четыре, неспаренных электрона и во внешнем электронном слое отсутствуют как свободные квантовые ячейки, так и неподеленные электронные пары (только для одного элемента, кроме углерода,— водорода характерно состояние атома, имеющее з ти особенности). Такое электронное строение атома и расположение углерода посередине шкалы электроотрицательностей обусловливают уникальные свойства данного элемента, благодаря которым существует огромное многообразие органических соединений. [c.352]
Такое электронное строение атома и расположение углерода посередине шкалы электроотрицательностей обусловливают уникальные свойства данного элемента, благодаря которым существует огромное многообразие органических соединений. [c.352]
При изучении органической химии особый интерес представляет электронное строение атома углерода, так как с этим связаны его особые свойства, определяющие во многом различия между органическими и неорганическими соединениями. [c.14]
Соответствие между обоими видами спектров определяется законом обращения Кирхгофа светлые линии в эмиссионном спектре совмещаются с темными в абсорбционном. Эмиссионными спектрами обычно пользуются для изучения электронного строения атомов, а абсорбционными — для изучения свойств молекул. Эмиссионный метод непригоден для изучения молекул, так как при высоких температурах они могут разрушиться. [c.338]
Хотя уравнение Шрёдингера для многоэлектронных атомов не имеет точного решения, можно показать, что при возрастании порядкового номера элементов не следует ожидать радикального изменения электронного строения атомов по сравнению с атомом водорода. Атомы всех элементов тоже могут быть охарактеризованы квантовыми состояниями, причем для этого используются те же четыре квантовых числа (п, /, ш и х) и по существу такие же электронные функции вероятности, или облака электронной плотности. Конечно, квантовые уровни энергии для разных элементов не совпадают, однако при переходе от одного элемента к другому они изменяются закономерным образом. [c.386]
Атомы всех элементов тоже могут быть охарактеризованы квантовыми состояниями, причем для этого используются те же четыре квантовых числа (п, /, ш и х) и по существу такие же электронные функции вероятности, или облака электронной плотности. Конечно, квантовые уровни энергии для разных элементов не совпадают, однако при переходе от одного элемента к другому они изменяются закономерным образом. [c.386]
На основании электронного строения атомов обоснуйте возможность осуществления р — d -связывания в SOj и ТеОа. [c.529]
Окислительно-восстановительные реакции связаны с электронным строением атомов, с видами валентной связи между ними, а также с энергией ионизации и электроотрицательностью элементов. [c.104]
При увеличении заряда ядра еще на единицу, т. е. при переходе к углероду 2 = 6), число электронов на 2р-подуровне возрастает до 2 электронное строение атома углерода выражается формулой 1з 2з 2р . Однако этой формуле могла бы соответствовать любая из трех схем [c.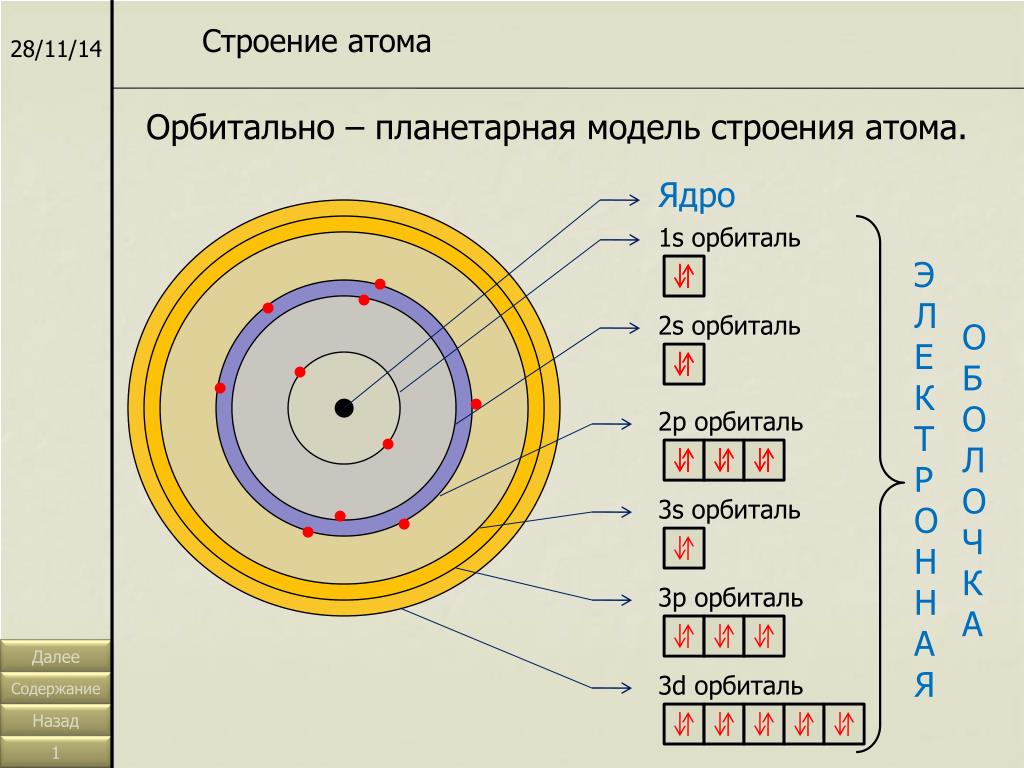 65]
65]
Каждая аюмная орбиталь (АО) характеризуется определенным распределением в пространстве волновой функции 1), квадрат которой определяет вероятность обнаружения электрона в соответствующей области пространства. Атомные орбитали, которым отвечают значения I, равные О, I, 2 и 3, называются соответственно 3-, р-, ё- и /-орбиталями. В графических схемах электронного строения атомов каждая орбиталь обозначается символом [c.40]
При формировании качественных представлений об электронном строении атомов важная роль принадлежит приближению центральносимметричного потенциала, на основе которого атомную орбиталь записывают в виде произведений радиальной и сферической функций. Принцип Паули и приближение центрально-симметричного поля позволяют понять оболочечное строение атома и установить конфигурацию основного состояния. В тех случаях, когда можно ожидать несколько конкурирующих конфигураций, вопрос их выбора рещается либо экспериментально, либо численными расчетами в приближении Хартри — Фока. Лишь в исключительных случаях для установления терма основного состояния (см. гл. 3, 7) требуется построение более сложной, по сравнению с методом Хартри — Фока, волновой функции в форме наложения конфигураций. Эту логику рассуждений переносят и на теорию злектрон-ного строения молекул, однако здесь возникают новые вопросы. [c.187]
Лишь в исключительных случаях для установления терма основного состояния (см. гл. 3, 7) требуется построение более сложной, по сравнению с методом Хартри — Фока, волновой функции в форме наложения конфигураций. Эту логику рассуждений переносят и на теорию злектрон-ного строения молекул, однако здесь возникают новые вопросы. [c.187]
Электронное строение атомов калпя и кальция соответствует этому правилу. Действительно, для Зй(-орбнталей (л — 3, / = 2) сумма (п + 1) равна 5, а для 45-орбиталн (п = 4, / = 0)— равна [c.93]
Электронное строение атома фтора ls 2s p В соединениях степень окисления фтора, равна —1, т.е. все соединения фтора, в том числе кислородные, являются фторидами. Существование F+ в соединениях исключено значение первой энергии ионизации If (1735 кДж/моль) меньше лншь /ие и /n – Это означает, что если получить катион F+ (химическим путем это неосуществимо, так как фтор наиболее электроотрицательный элемент), то при столкновении с любой частицей, кроме атомов Не или Ne, он превратится в атом F. [c.468]
[c.468]
Металлы подгруппы 1А периодической системы элементов И. Менделеева 1.1, Ыа, К, КЬ, Сз п Рг называются щелочными. Щелочноземельными металлами называются эле.менты подгруппы ПА Са, 5г, Ва, Ра на.ходящиеся в этой же подгруппе Ве и Мй к щелочноземельным металлам не относятся. В соответствии с электронным строением атомов щелочных металлов оии всегда одновалентны. Щелочноземельные металлы, Ве и в невозбужденном состоянии проявляют нулевую валентность. При возбуждении их атомы приобретают электронную ко)1фиг рацию наружного слоя пз пр и становятся двухвалентны.ми. За счиг образования дони )но-акцепторных связей валентность элементов может увеличиться, что особенно характерно для Ве. [c.127]
Заполнение электронных слоев и оболочек. Рассмотрим связь между электронным строением атомов в нормальном состоянии и положением элементов в пернодической системе. Электронное строение атомов представлено в таблице, напечатанной на форзаце. Приведенные данные об электронном строении атомов получены в результате исследования атомных спектров.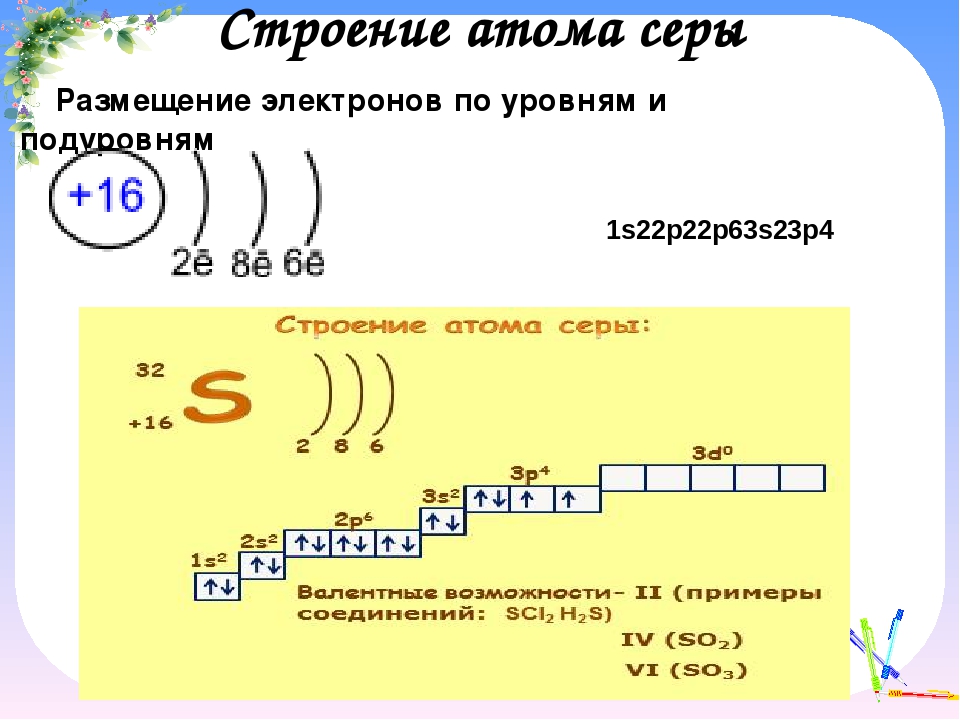 [c.39]
[c.39]
Полученная нами информация о физическом смысле номера группы и номера периода значительно облегчит в дальнейшем рассмотрение электронного строения атома. Применим, например, наши знания к атому брома (№ 35). Он расположен в четвертом периоде, значит последний заполняемый энергетический уровень -четвертый. Номер группы 7, главная подгруппа. Значит, на внешнем уровне расположено 7 электронов. Уровни 1-2 заполнены полностью – 2 и 8 электронов соответственно. Третий уровень заполнен либо полностью (18 эле1стронов), либо только s- и р-подуровни (8 электронов). [c.46]
Строение атома, химическая связь, валентность и строение молекул. Строение атомов химических элементов
Документальные учебные фильмы. Серия «Физика».
Атом (от греческого atomos – неделимый) – одноядерная, неделимая химическим путем частица химического элемента, носитель свойства вещества. Вещества состоят из атомов. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.).
В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом, заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.).
Масса атома определяется массой его ядра, поскольку масса электрона примерно в 1850 раз меньше массы протона и нейтрона и в расчетах редко учитывается. Количество нейтронов можно узнать по разности между массой атома и количеством протонов (N=A-Z).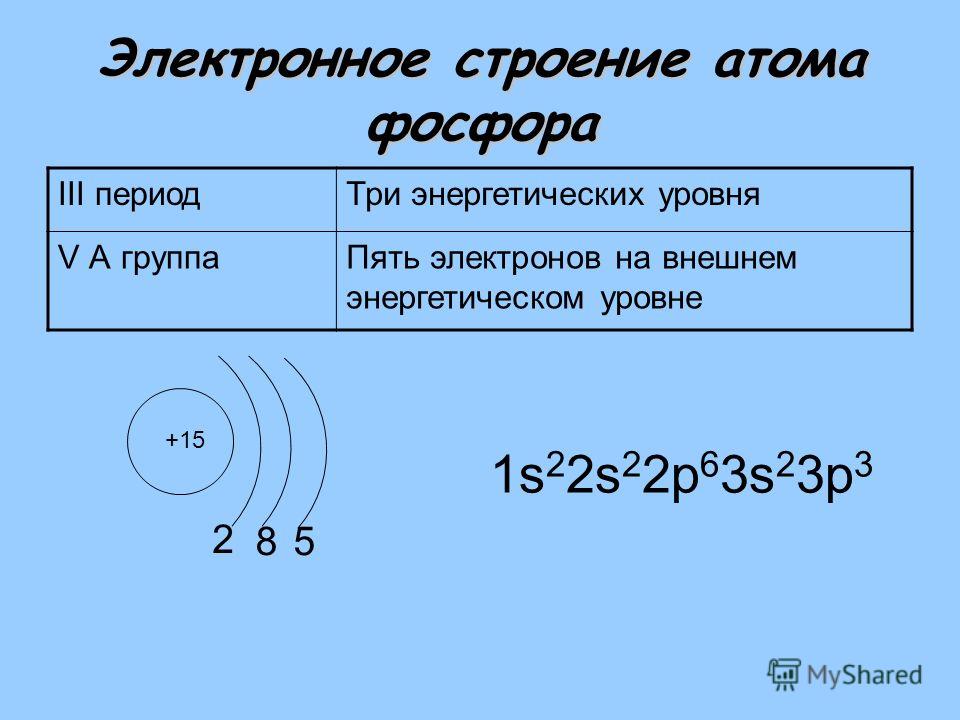 Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N) называется нуклидом.
Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N) называется нуклидом.
Перед изучением свойств электрона и правил формирования электронных уровней, необходимо затронуть историю формирования представлений о строении атома. Мы не будем рассматривать полную историю становления атомарного строения, а остановимся лишь на самых актуальных и наиболее “верных” представлениях, способных наиболее наглядно показать как располагаются электроны в атоме. Первыми наличие атомов как элементарных составляющих вещества, предположили еще древнегреческие философы. После чего история строения атома прошла сложный путь и разные представления, такие как неделимость атома, Томсоновская модель атома и другие. Наиболее близкой оказалась модель атома, предложенная Эрнестом Резерфордом в 1911 году. Он сравнил атом с солнечной системой, где в роли солнца выступало ядро атома, а электроны двигались вокруг него подобно планетам. Размещение электронов на стационарных орбитах было очень важным шагом в понимании строения атома.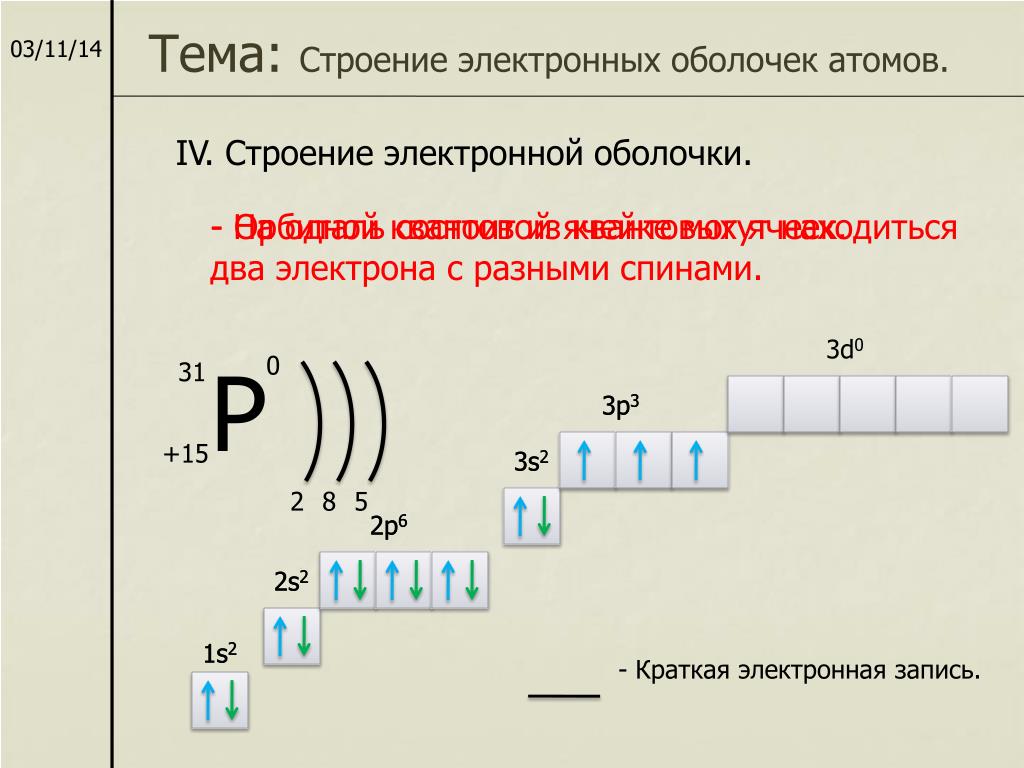 Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов “упасть” на ядро и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов Нильсом Бором. Согласно этим постулатам электрон двигался по стационарным орбитам вокруг ядра и при нормальных условиях не поглощал и не испускал энергию. Постулаты показывают, что для описания атома законы классической механики не подходят. Такая модель атома называется моделью Бора-Резерфорда. Продолжением планетарного строения атома является квантово-механическая модель атома, согласно которой мы и будем рассматривать электрон.
Однако такая планетарная модель строения атома шла в противоречие с классической механикой. Дело в том, что при движении электрона по орбите он должен был терять потенциальную энергию и в конце концов “упасть” на ядро и атом должен был прекратить свое существование. Такой парадокс был устранен введением постулатов Нильсом Бором. Согласно этим постулатам электрон двигался по стационарным орбитам вокруг ядра и при нормальных условиях не поглощал и не испускал энергию. Постулаты показывают, что для описания атома законы классической механики не подходят. Такая модель атома называется моделью Бора-Резерфорда. Продолжением планетарного строения атома является квантово-механическая модель атома, согласно которой мы и будем рассматривать электрон.
Электрон является квазичастицей проявляя корпускулярно-волновой дуализм. Он одновременно является и частицей (корпускула) и волной. К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам – способность к дифракции и интерференции. Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля.
Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля.
(Конспект лекций)
Строение атома. Введение.
Объектом изучения в химии являются химические элементы и их соединения. Химическим элементом называют совокупность атомов с одинаковым положительным зарядом. Атом – это наименьшая частица химического элемента, сохраняющая его химические свойства . Связываясь, друг с другом, атомы одного или разных элементов образуют более сложные частицы – молекулы . Совокупность атомов или молекул образуют химические вещества. Каждое индивидуальное химическое вещество характеризуется набором индивидуальных физических свойств, такими как температуры кипения и плавления, плотностью, электро- и теплопроводностью и т.п.
1. Строение атома и Периодическая система элементов
Д.И. Менделеева .
Знание и понимание закономерностей порядка заполнения Периодической системы элементов Д.И. Менделеева позволяет понять следующее:
1. физическую
суть существования в природе определенных
элементов,
физическую
суть существования в природе определенных
элементов,
2.природу химической валентности элемента,
3.способность и “лёгкость” элемента отдавать или принимать электроны при взаимодействии с другим элементом,
4.природу химических связей, которые может образовать данный элемент при взаимодействии с другими элементами, пространственное строение простых и сложных молекул и пр., пр.
Строение атома.
Атом представляет собой сложную микросистему находящихся в движении и взаимодействующих друг с другом элементарных частиц.
В
конце 19 и начале 20 веков было установлено,
что атомы состоят из более мелких частиц:
нейтронов, протонов и электронов,
Последние две частицы являются заряженными
частицами, протон несет на себе
положительный заряд, электрон –
отрицательный. Поскольку атомы элемента
в основном состоянии электронейтральны,
то это означает, что число протонов в
атоме любого элемента равно числу
электронов. Масса атомов определяется
суммой массы протонов и нейтронов,
количество которых равна разности массы
атомов и его порядкового номера в
периодической системе Д.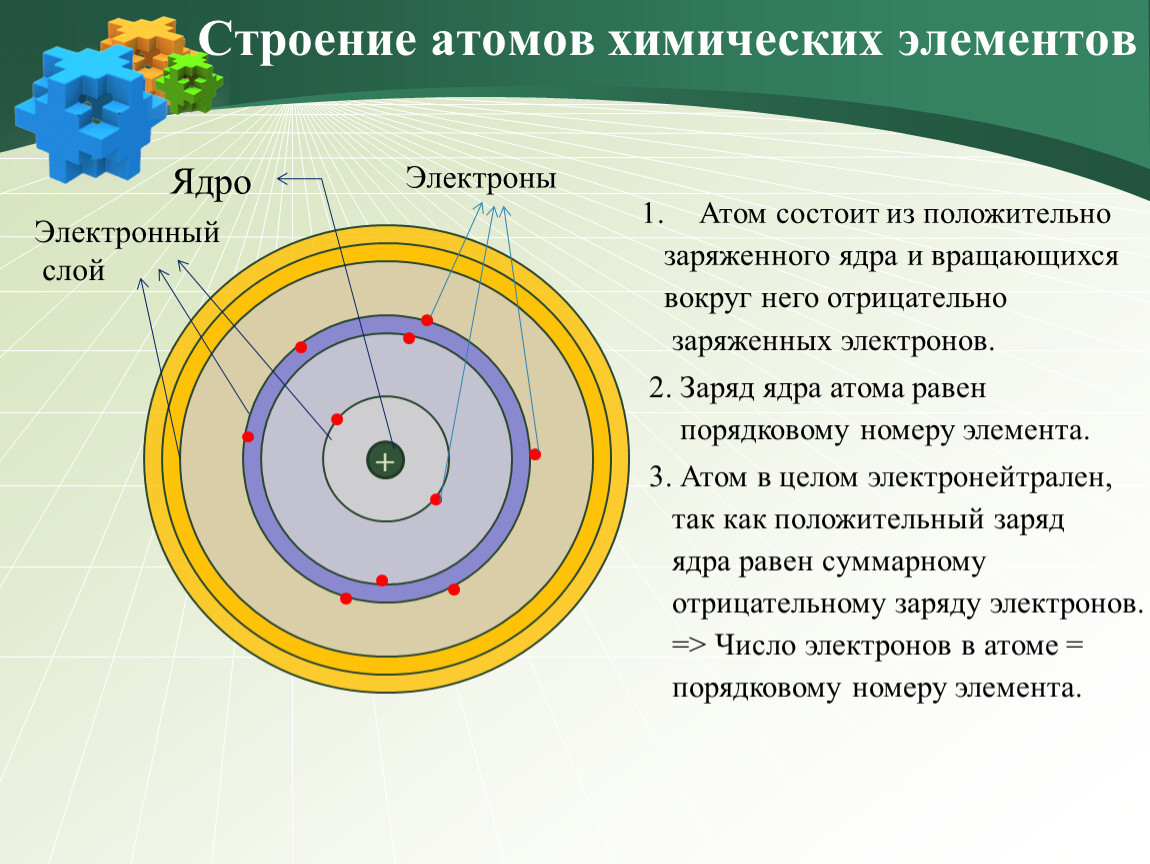 И. Менделеева.
И. Менделеева.
В
1926 г Шрёдингер предложил описывать
движение микрочастиц в атоме элемента
при помощи выведенного им волнового
уравнения. При решении волнового
уравнения Шрёдингера для атома водорода
появляются три целочисленных квантовых
числа: n ,
ℓ и m ℓ ,
которые характеризуют состояние
электрона в трёхмерном пространстве в
центральном поле ядра. Квантовые числа n ,
ℓ и m ℓ принимают целочисленные значения.
Волновая функция, определяемая тремя
квантовыми числами n ,
ℓ и m ℓ и получаемая в результате решения
уравнения Шрёдингера, называется
орбиталью. Орбиталь
– это область пространства, в котором
наиболее вероятно нахождение электрона ,
принадлежащего атому химического
элемента. Таким образом, решение
уравнения Шредингера для атома водорода
приводит к появлению трёх квантовых
чисел, физический смысл которых состоит
в том, что они характеризуют три разного
вида орбиталей, которые может иметь
атом. Рассмотрим более подробно каждое
квантовое число.
Рассмотрим более подробно каждое
квантовое число.
Главное квантовое число n может принимать любые положительные целочисленные значения: n = 1,2,3,4,5,6,7…Оно характеризует энергию электронного уровня и размер электронного ″облака″. Характерно, что номер главного квантового числа совпадает с номером периода, в котором находится данный элемент.
Азимутальное или орбитальное квантовое число ℓ может принимать целочисленные значения от ℓ = 0….до n – 1 и определяет момент движения электронов, т.е. форму орбитали. Для различных численных значений ℓ используют следующие обозначения: ℓ = 0, 1, 2, 3, и обозначаются символами s , p , d , f , соответственно для ℓ = 0, 1, 2 и 3. В периодической системе элементов нет элементов со спиновым числом ℓ = 4.
Магнитное
квантовое число m ℓ характеризует
пространственное расположение электронных
орбиталей и, следовательно, электромагнитные
свойства электрона. Оно может принимать
значения от – ℓ до + ℓ ,
включая нуль.
Оно может принимать
значения от – ℓ до + ℓ ,
включая нуль.
Форма или, точнее, свойства симметрии атомных орбиталей зависят от квантовых чисел ℓ и m ℓ . “Электронное облако”, соответствующее s – орбитали имеет, имеет форму шара (при этом ℓ = 0).
Рис.1. 1s-орбиталь
Орбитали, определяемые квантовыми числами ℓ = 1 и m ℓ = -1, 0 и +1, называются р-орбиталями. Поскольку m ℓ при этом имеет три разных значений, то атом при этом имеет три энергетически эквивалентные р-орбитали (главное квантовое число для них одно и тоже и может иметь значение n =2,3,4,5,6 или 7). р-Орбитали обладают осевой симметрией и имеют вид объёмных восьмёрок, во внешнем поле ориентированных по осям x, y и z (рис.1.2). Отсюда и происхождение символики p x , p y и p z .
Рис.2. р x , p y и p z -орбитали
Кроме
того, имеются d-
и f-
атомные орбитали, для первых ℓ = 2 и m ℓ
= -2, -1, 0, +1 и +2, т.е. пять АО, для вторых
ℓ = 3 и m ℓ
= -3, -2, -1, 0, +1, +2 и +3, т. е. 7 АО.
е. 7 АО.
Четвёртое
квантовое m s называется спиновым квантовым числом,
было введено для объяснения некоторых
тонких эффектов в спектре атома водорода
Гаудсмитом и Уленбеком в 1925г. Спин
электрона – это угловой момент заряженной
элементарной частицы электрона,
ориентация которого квантована, т.е.
строго ограничена определёнными углами.
Эта ориентация определяется значением
спинового магнитного квантового числа
(s),
которое для электрона равно ½ ,
поэтому для электрона согласно правилам
квантования m s = ± ½. В связи с этим к набору из трёх квантовых
чисел следует добавить квантовое числоm s . Подчеркнём еще раз, что четыре квантовых
числа определяют порядок построения
периодической таблицы элементов
Менделеева и объясняют, почему в первом
периоде только два элемента, во втором
и в третьём – по восемь, – в четвёртом
– 18 и т д. Однако, чтобы объяснить
строение многоэлектронных атомов,
порядок заполнения электронных уровней
по мере увеличения положительного
заряда атома недостаточно иметь
представления о четырёх квантовых
числах, “управляющих” поведением
электронов при заполнении электронных
орбиталей, но необходимо знать ещё
некоторые простые правила, а именно, принцип
Паули, правило Гунда и правила Клечковского.
Согласно принципа Паули в одном и том же квантовом состоянии, характеризуемом определенными значениями четырёх квантовых чисел, не может находиться более одного электрона. Это означает, что один электрон можно в принципе поместить на любую атомную орбиталь. Два электрона могут находиться на одной атомной орбитали только в том случае, если они отличаются спиновыми квантовыми числами.
При заполнении электронами трёх р-АО, пяти d-AO и семи f-AO следует руководствоваться кроме принципа Паули ещё и правилом Гунда: Заполнение орбиталей одной подоболочки в основном состоянии происходит электронами с одинаковыми спинами.
При заполнении подоболочек (p , d , f )абсолютное значение суммы спинов должно быть максимальной .
Правило
Клечковского . Согласно
правилу Клечковского при заполнении d и f орбиталией электронами должен соблюдаться принцип
минимальной энергии. Согласно этому принципу электроны в
основном состоянии заполняют орбитали
с минимальными уровнями энергии. Энергию
подуровня определяют сумма квантовых
чисел n + ℓ = Е .
Согласно этому принципу электроны в
основном состоянии заполняют орбитали
с минимальными уровнями энергии. Энергию
подуровня определяют сумма квантовых
чисел n + ℓ = Е .
Первое правило Клечковского : сначала заполняются те подуровни, для которых n + ℓ = Е минимальна.
Второе правило Клечковского : в случае равенства n + ℓ для нескольких подуровней идёт заполнение того подуровня, для которого n минимальна .
В настоящее время известно 109 элементов.
2. Энергия ионизации, сродство к электрону и электроотрицательность .
Важнейшими
характеристиками электронной конфигурации
атома являются энергия ионизации (ЭИ)
или потенциал ионизации (ПИ) и сродство
атома к электрону (СЭ). Энергией
ионизации называют изменение энергии
в процессе отрыва электрона от свободного
атома при 0 К: А = + +
ē .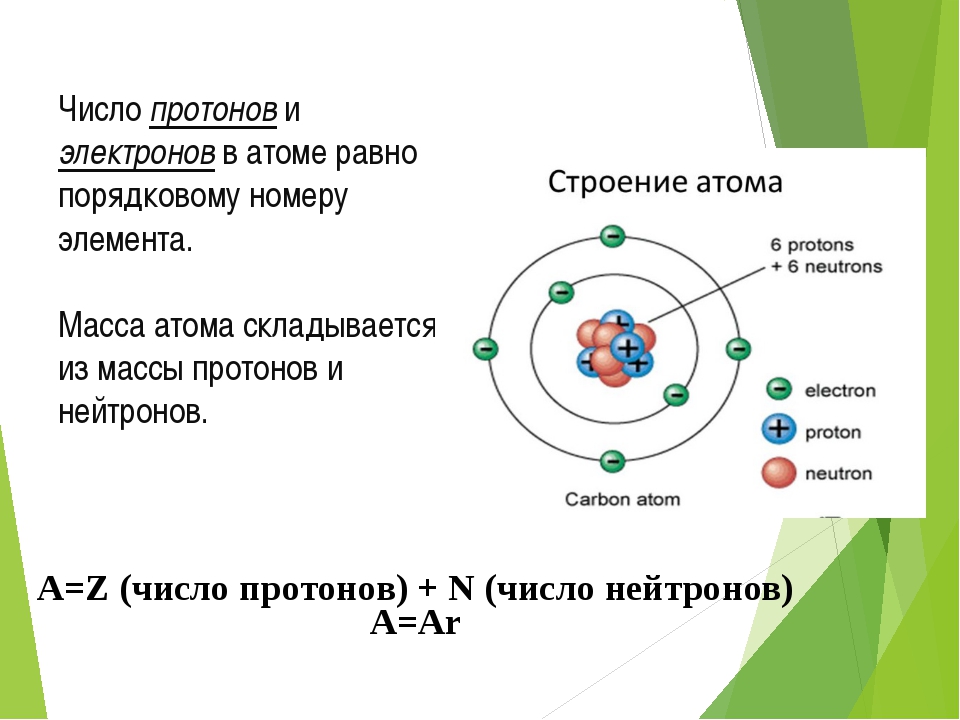 Зависимость
энергии ионизации от порядкового номера
Z
элемента, размера атомного радиуса
имеет ярко выраженный периодический
характер.
Зависимость
энергии ионизации от порядкового номера
Z
элемента, размера атомного радиуса
имеет ярко выраженный периодический
характер.
Сродство к электрону (СЭ), представляет собой изменение энергии, которым сопровождается присоединение электрона к изолированному атому с образованием отрицательного иона при 0 К: А + ē = А – (атом и ион находятся в своих основных состояниях). При этом электрон занимает низшую свободную атомную орбиталь (НСАО), если ВЗАО занята двумя электронами. СЭ сильно зависит от их орбитальной электронной конфигурации.
Изменения
ЭИ и СЭ коррелируют с изменением многих
свойств элементов и их соединений, что
используется для предсказания этих
свойств по значениям ЭИ и СЭ. Наиболее
высоким по абсолютной величине сродством
к электрону обладают галогены. В каждой
группе периодической таблице элементов
потенциал ионизации или ЭИ уменьшается
с увеличением номера элемента, что
связано с увеличением атомного радиуса
и с увеличением количества электронных
слоев и что хорошо коррелирует с
увеличением восстановительной способности
элемента.
В таблице 1 Периодической системы элементов приведены значения ЭИ и СЭ в эВ/на атом. Отметим, что точные значения СЭ известны лишь для немногих атомов, их величины подчёркнуты в таблице 1.
Таблица 1
Первая энергия ионизации (ЭИ), сродство к электрону (СЭ) и электроотрицательность χ) атомов в периодической системе.
χ | 0.747 2. 1 0 0, 3 7 | 1,2 2 | ||||||||||||||||
χ | 0.54 1. 55 | -0.3 1. 1 3 | 0. 0. 91 | 1.2 5 | -0. 1 0, 55 | 1.47 0. 59 | 3.45 0. 64 | 1 ,60 | ||||||||||
χ | 0. 7 4 1. 89 | -0.3 1 . 3 1 1 . 6 0 | 0. 6 | 1.63 | 0.7 | 2.07 | 3.61 | |||||||||||
χ | 2. | – 0 .6 | 1.26(α) | -0.9 1 . 39 | 0. 18 | 1.2 | 0. 6 | 2.07 | 3.36 | |||||||||
χ | 2.4 8 | -0.6 1 . 56 | 0. 2 | 2.2 | ||||||||||||||
χ | 2.6 7 | 2, 2 1 | О s |
χ – электроотрицательность по Полингу
r –
атомный радиус, (из «Лабораторные и
семинарские занятия по общей и
неорганической химии» , Н.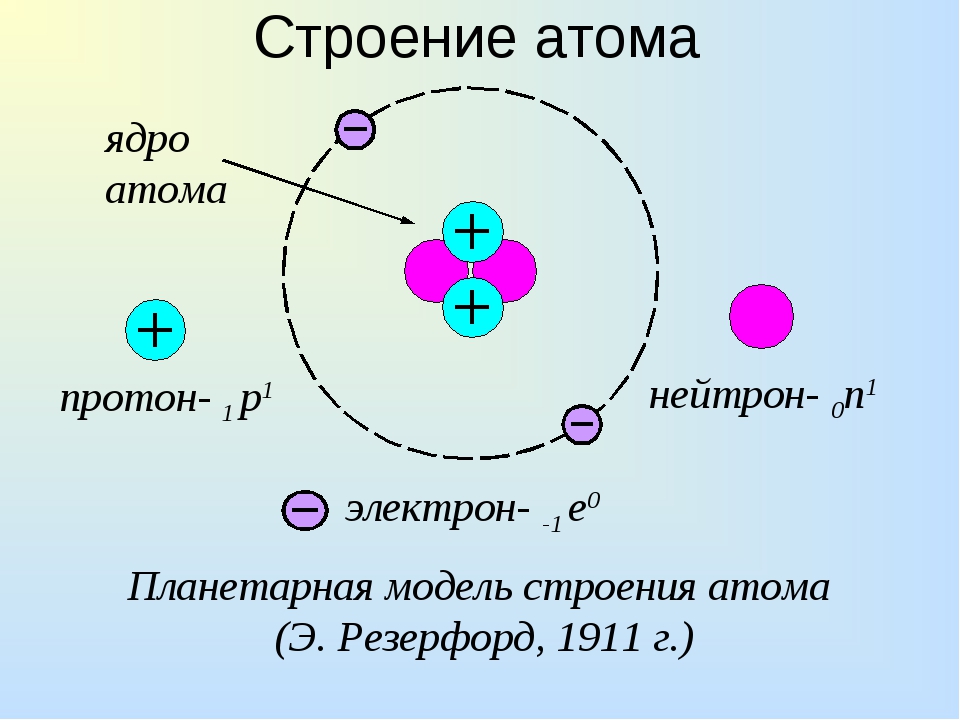 С. Ахметов,
М.К. Азизова, Л.И. Бадыгина)
С. Ахметов,
М.К. Азизова, Л.И. Бадыгина)
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.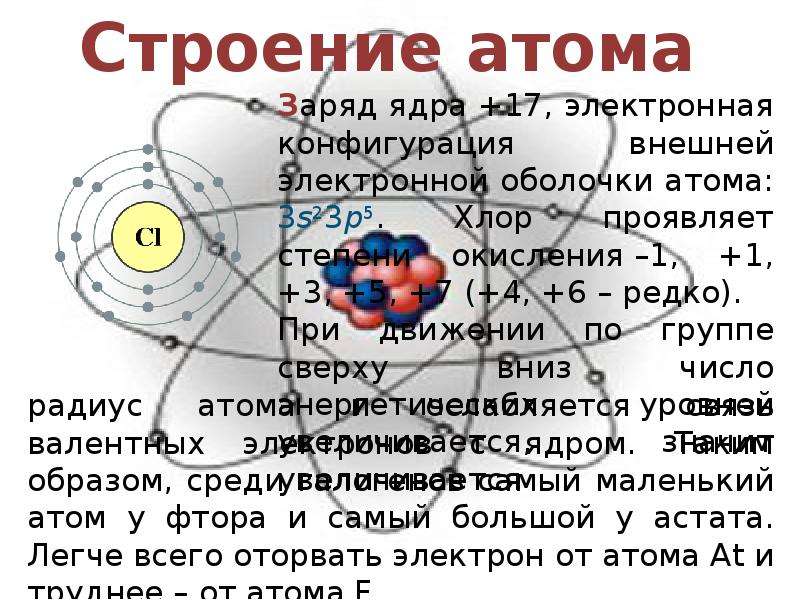
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
Образование осадка при кипячении воды, называемого в быту накипью;
Выделение тепла и света при горении костра;
Изменение цвета среза свежего яблока на воздухе;
Образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p + , n o и e − . Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. m p ≈ m n , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. m p /m e ≈ m n /m e ≈ 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
Вид атомов с одинаковым зарядом ядер, т.е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Каждый химический элемент имеет свое название и индивидуальный символ, который читается определенным образом. Так, например, самый простой химический элемент, атомы которого содержат в ядре только один протон, имеет название «водород» и обозначается символом «Н», что читается как «аш», а химический элемент с зарядом ядра +7 (т.е. содержащий 7 протонов) — «азот», имеет символ «N» , который читается как «эн».
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1 Н, 2 Н и 3 Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1 Н вообще нет нейтронов (1-1=0), в изотопе 2 Н – 1 нейтрон (2-1=1) и в изотопе 3 Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2 Н практически в два раза тяжелее изотопа 1 Н, а изотоп 3 Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2 Н и 3 Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2 Н дали название дейтерий и присвоили символ D, а изотопу 3 Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.

Орбитали с l = 0 называют s -орбиталями . s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
Орбитали с l = 1 называются p -орбиталями . Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d -орбиталями , а с l = 3 – f -орбиталями . Их строение намного более сложное.
3) Магнитное квантовое число – m l – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число m l соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1). Так, например, при l = 0 m l = 0 (одно значение), при l = 1 m l = -1, 0, +1 (три значения), при l = 2 m l = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т. д.
д.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
4) Спиновое квантовое число (или просто спин) — m s — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения. Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ↓ и .
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n 2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и m l .
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
- Принцип минимума энергии : электроны заполняют орбитали, начиная с подуровня с наименьшей энергией. Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s
Для того чтобы проще запомнить данную последовательность заполнения электронных подуровней, весьма удобна следующая графическая иллюстрация:
- Принцип Паули : на каждой орбитали может находиться не более двух электронов.

Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой.
- Правило Хунда : наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.
Фактически вышесказанное означает то, что, например, размещение 1-го, 2-х, 3-х и 4-х электронов на трех орбиталях p-подуровня будет осуществляться следующим образом:
Заполнение атомных орбиталей от водорода, имеющего зарядовое число равное 1, до криптона (Kr) с зарядовым числом 36 будет осуществляться следующим образом:
Подобное изображение порядка заполнения атомных орбиталей называется энергетической диаграммой. Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т. е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
При переводе в электронную формулу атома фосфора примет вид:
15 P = 1s 2 2s 2 2p 6 3s 2 3p 3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 | |
| II | 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 | |
| 5 | B | бор | 1s 2 2s 2 2p 1 | |
| 6 | C | углерод | 1s 2 2s 2 2p 2 | |
| 7 | N | азот | 1s 2 2s 2 2p 3 | |
| 8 | O | кислород | 1s 2 2s 2 2p 4 | |
| 9 | F | фтор | 1s 2 2s 2 2p 5 | |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 | |
| III | 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5 B = 1s 2 2s 2 2p 1
А в возбужденном состояниии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5 B* = 1s 2 2s 1 2p 2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень. К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.

- d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
Урок посвящен формированию представлений о сложном строении атома. Рассматривается состояние электронов в атоме, вводятся понятия «атомная орбиталь и электронное облако», формы орбиталей (s–, p-, d-орбитали). Также рассматриваются такие аспекты, как максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням и подуровням в атомах элементов первых четырех периодов, валентные электроны s-, p- и d-элементов. Приводится графическая схема строения электронных слоев атомов (электронно-графическая формула).
Тема: Строение атома. Периодический закон Д.И. Менделеева
Урок: Строение атома
В переводе с греческого языка, слово «атом» означает «неделимый». Однако, были открыты явления, которые демонстрируют возможность его деления. Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются субатомными частицами.
Это испускание рентгеновских лучей, испускание катодных лучей, явление фотоэффекта, явление радиоактивности. Электроны, протоны и нейтроны – это частицы, из которых состоит атом. Они называются субатомными частицами.
Табл. 1
Кроме протонов, в состав ядра большинства атомов входят нейтроны , не несущие никакого заряда. Как видно из табл. 1, масса нейтрона практически не отличается от массы протона. Протоны и нейтроны составляют ядро атома и называются нуклонами (nucleus – ядро). Их заряды и массы в атомных единицах массы (а.е.м.) показаны в таблице 1. При расчете массы атома массой электрона можно пренебречь.
Масса атома (массовое число) равна сумме масс, составляющих его ядро протонов и нейтронов. Массовое число обозначается буквой А . Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента. A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре. Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Согласно учению об изотопах, понятию «химический элемент» можно дать такое определение:
Химическим элементом называется совокупность атомов с одинаковым зарядом ядра.
Некоторые элементы существуют в виде нескольких изотопов . «Изотопы» означает «занимающий одно и тоже место». Изотопы имеют одинаковое число протонов, но отличаются массой, т. е. числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым зарядом ядра (то есть с одинаковым числом протонов), но с разным числом нейтронов в ядре.
Изотопы отличаются друг от друга только массовым числом. Это обозначается либо верхним индексом в правом углу, либо в строчку: 12 С или С-12. Если элемент содержит несколько природных изотопов, то в периодической таблице Д.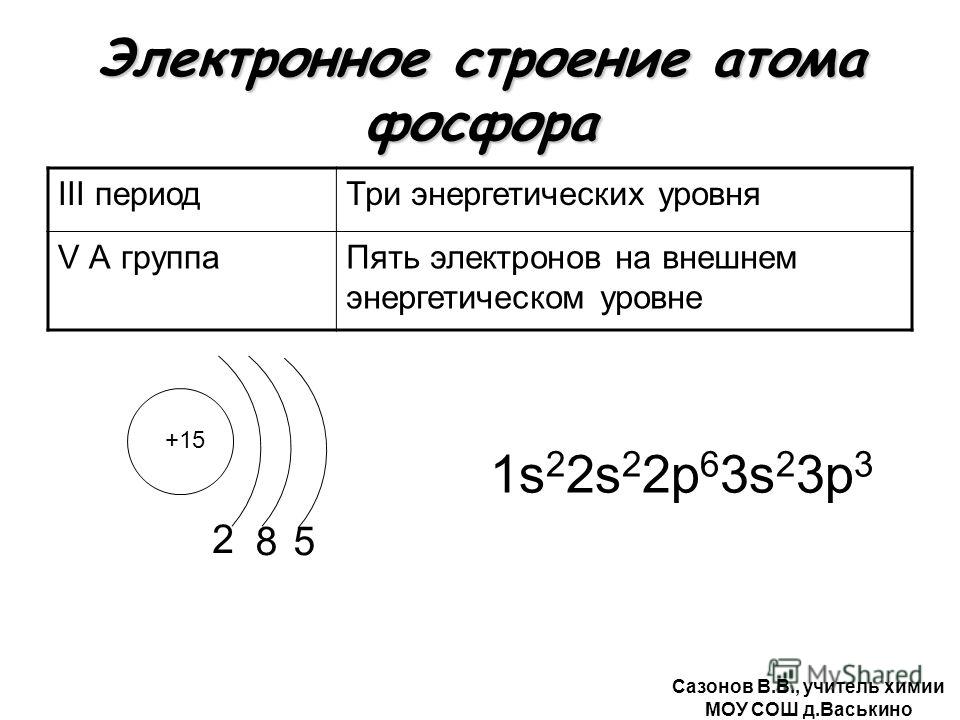 И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35 Cl и 37 Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
И. Менделеева указывается, его средняя атомная масса с учетом распространённости. Например, хлор содержит 2 природных изотопа 35 Cl и 37 Cl, содержание которых составляет соответственно 75% и 25%. Таким образом, атомная масса хлора будет равна:
А r (Cl )=0,75 . 35+0,25 . 37=35,5
Для тяжёлых искусственно-синтезированных атомов приводится одно значение атомной массы в квадратных скобках. Это атомная масса наиболее устойчивого изотопа данного элемента.
Основные модели строения атома
Исторически первой в 1897 году была модель атома Томсона.
Рис. 1. Модель строения атома Дж. Томсона
Английский физик Дж. Дж. Томсон предположил, что атомы состоят из положительно заряженной сферы, в которую вкраплены электроны (рис. 1). Эту модель образно называют «сливовый пудинг», булочка с изюмом (где «изюминки» – это электроны), или «арбуз» с «семечками» – электронами. Однако от этой модели отказались, т. к. были получены экспериментальные данные, противоречащие ей.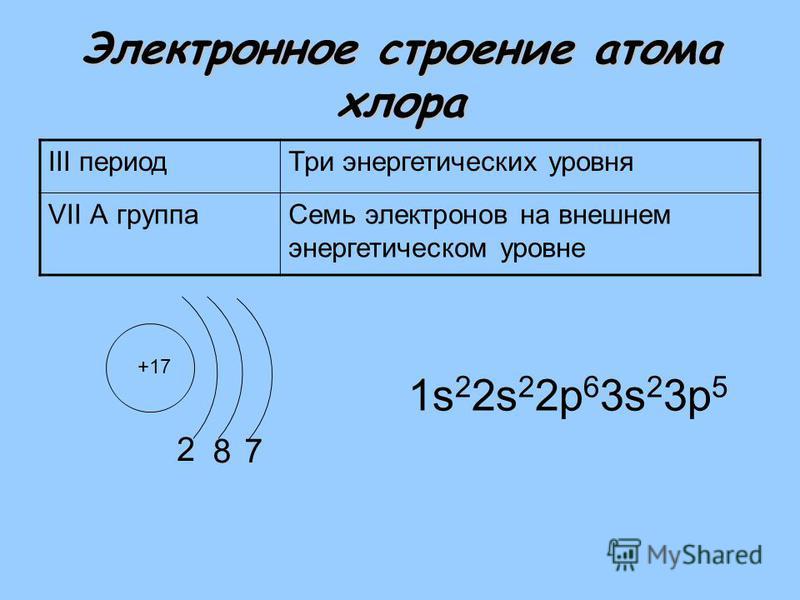
Рис. 2. Модель строения атома Э. Резерфорда
В 1910 году английский физик Эрнст Резерфорд со своими учениками Гейгером и Марсденом провели эксперимент, который дал поразительные результаты, необъяснимые с точки зрения модели Томсона. Эрнст Резерфорд доказал на опыте, что в центре атома имеется положительно заряженное ядро (рис. 2), вокруг которого, подобно планетам вокруг Солнца, вращаются электроны. Атом в целом электронейтрален, а электроны удерживаются в атоме за счет сил электростатического притяжения (кулоновских сил). Эта модель имела много противоречий и главное, не объясняла, почему электроны не падают на ядро, а также возможность поглощения и излучения им энергии.
Датский физик Н. Бор в 1913 году, взяв за основу модель атома Резерфорда, предложил модель атома, в которой электроны-частицы вращаются вокруг ядра атома примерно так же, как планеты обращаются вокруг Солнца.
Рис. 3. Планетарная модель Н. Бора
Бор предположил, что электроны в атоме могут устойчиво существовать только на орбитах, удаленных от ядра на строго определенные расстояния. Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
Эти орбиты он назвал стационарными. Вне стационарных орбит электрон существовать не может. Почему это так, Бор в то время объяснить не мог. Но он показал, что такая модель (рис. 3) позволяет объяснить многие экспериментальные факты.
В настоящее время для описания строения атома используется квантовая механика. Это наука, главным аспектом в которой является то, что электрон обладает свойствами частицы и волны одновременно, т. е. корпускулярно-волновым дуализмом. Согласно квантовой механике, область пространства, в которой вероятность нахождения электрона наибольшая, называется орбиталью. Чем дальше электрон находится от ядра, тем меньше его энергия взаимодействия с ядром. Электроны с близкими энергиями образуют энергетический уровень. Число энергетических уровней равно номеру периода , в котором находится данный элемент в таблице Д.И. Менделеева. Существуют различные формы атомных орбиталей. (Рис. 4). d-орбиталь и f-орбиталь имеют более сложную форму.
Рис. 4. Формы атомных орбиталей
В электронной оболочке любого атома ровно столько электронов, сколько протонов в его ядре, поэтому атом в целом электронейтрален. Электроны в атоме размещаются так, чтобы их энергия была минимальной. Чем дальше электрон находится от ядра, тем больше орбиталей и тем сложнее они по форме. На каждом уровне и подуровне может помещаться только определенное количество электронов. Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей .
На первом энергетическом уровне, наиболее близком к ядру, может существовать одна сферическая орбиталь (1 s ). На втором энергетическом уровне – сферическая орбиталь, большая по размеру и три р-орбитали: 2 s 2 ppp . На третьем уровне: 3 s 3 ppp 3 ddddd .
Кроме движения вокруг ядра, электроны обладают еще движением, которое можно представить, как их движение вокруг собственной оси. Это вращение называется спином (в пер. с англ. «веретено»). На одной орбитали могут находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами.
Это вращение называется спином (в пер. с англ. «веретено»). На одной орбитали могут находиться лишь два электрона, обладающих противоположными (антипараллельными) спинами.
Максимальное число электронов на энергетическом уровне определяется по формуле N =2 n 2.
Где n – главное квантовое число (номер энергетического уровня). См. табл. 2
Табл. 2
В зависимости от того, на какой орбитали находится последний электрон, различают s -, p -, d -элементы. Элементы главных подгрупп относятся к s -, p -элементам. В побочных подгруппах находятся d -элементы
Графическая схема строения электронных слоев атомов (электронно-графическая формула).
Для описания расположения электронов на атомных орбиталях используют электронную конфигурацию. Для её написания в строчку пишутся орбитали в условных обозначениях (s- -, p -, d-, f -орбитали), а перед ними – числа, обозначающие номер энергетического уровня.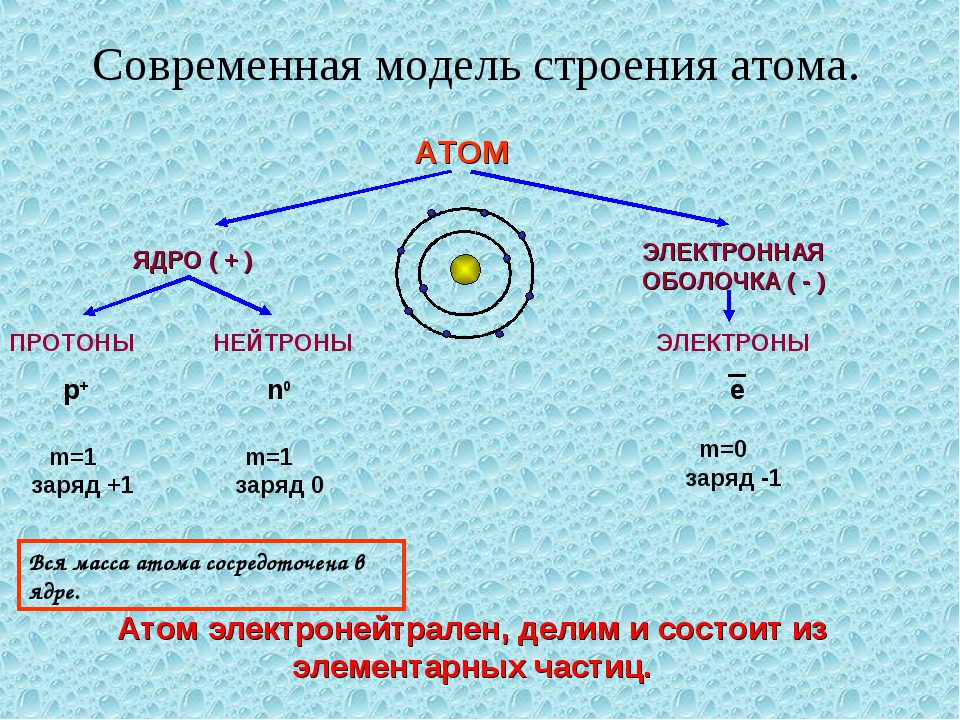 Чем больше число, тем дальше электрон находится от ядра. В верхнем регистре, над обозначением орбитали, пишется количество электронов, находящихся на данной орбитали (Рис. 5).
Чем больше число, тем дальше электрон находится от ядра. В верхнем регистре, над обозначением орбитали, пишется количество электронов, находящихся на данной орбитали (Рис. 5).
Рис. 5
Графически распределение электронов на атомных орбиталях можно представить в виде ячеек. Каждая ячейка соответствует одной орбитали. Для р-орбитали таких ячеек будет три, для d-орбитали – пять, для f-орбитали – семь. В одной ячейке может находиться 1 или 2 электрона. Согласно правилу Гунда , электроны распределяются на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одному, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Такие электроны называют спаренными. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
См. рис. 6 для атома 7 N.
Рис. 6
Электронная конфигурация атома скандия
21 Sc : 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 1
Электроны внешнего энергетического уровня называются валентными. 21 Sc относится к d -элементам.
21 Sc относится к d -элементам.
Подведение итога урока
На уроке было рассмотрено строение атома, состояние электронов в атоме, введено понятие «атомная орбиталь и электронное облако». Учащиеся узнали, что такое форма орбиталей (s -, p -, d -орбитали), каково максимальное число электронов на энергетических уровнях и подуровнях, распределение электронов по энергетическим уровням, что такое s -, p – и d -элементы. Приведена графическая схема строения электронных слоев атомов (электронно-графическая формула).
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. А.В. Мануйлов, В. И. Родионов. Основы химии. Интернет-учебник.
И. Родионов. Основы химии. Интернет-учебник.
Домашнее задание
1. №№5-7 (с. 22) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Напишите электронные формулы для следующих элементов: 6 C, 12 Mg, 16 S, 21 Sc.
3. Элементы имеют следующие электронные формулы: а) 1s 2 2s 2 2p 4 .б) 1s 2 2s 2 2p 6 3s 2 3p 1 . в) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Какие это элементы?
Состав атома.
Атом состоит из атомного ядра и электронной оболочки .
Ядро атома состоит из протонов (p + ) и нейтронов (n 0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N (p + ) равно заряду ядра (Z ) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов).
N (p +) = Z
Сумма числа нейтронов N (n 0), обозначаемого просто буквой N , и числа протонов Z называется массовым числом и обозначается буквой А .
A = Z + N
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е -).
Число электронов N (e -) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Масса протона примерно равна массе нейтрона и в 1840 раз больше массы электрона, поэтому масса атома практически равна массе ядра.
Форма атома – сферическая. Радиус ядра примерно в 100000 раз меньше радиуса атома.
Химический элемент – вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп – совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение отдельного атома или изотопа: (Э – символ элемента), например: .
Строение электронной оболочки атома
Атомная орбиталь – состояние электрона в атоме. Условное обозначение орбитали – . Каждой орбитали соответствует электронное облако.
Условное обозначение орбитали – . Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s , p , d и f .
Электронное облако – часть пространства, в которой электрон можно обнаружить с вероятностью 90 (или более) процентов.
Примечание : иногда понятия “атомная орбиталь” и “электронное облако” не различают, называя и то, и другое “атомной орбиталью”.
Электронная оболочка атома слоистая. Электронный слой образован электронными облаками одинакового размера. Орбитали одного слоя образуют электронный (“энергетический”) уровень , их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s -подуровень (состоит из одной s -орбитали), условное обозначение – .
p -подуровень (состоит из трех p
d -подуровень (состоит из пяти d -орбиталей), условное обозначение – .
f -подуровень (состоит из семи f -орбиталей), условное обозначение – .
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s , 3p , 5d означает s -подуровень второго уровня, p -подуровень третьего уровня, d -подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n . Общее число орбиталей на одном уровне равно n 2 . Соответственно этому, общее число облаков в одном слое равно также n 2 .
Обозначения: – свободная орбиталь (без электронов), – орбиталь с неспаренным электроном, – орбиталь с электронной парой (с двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны упрощенно):
1. Принцип наименьшей энергии – электроны заполняют орбитали в порядке возрастания энергии орбиталей.
2. Принцип Паули – на одной орбитали не может быть больше двух электронов.
Принцип Паули – на одной орбитали не может быть больше двух электронов.
3. Правило Хунда – в пределах подуровня электроны сначала заполняют свободные орбитали (по одному), и лишь после этого образуют электронные пары.
Общее число электронов на электронном уровне (или в электронном слое) равно 2n 2 .
Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии):
1s , 2s , 2p , 3s , 3p , 4s , 3d , 4p , 5s , 4d , 5p , 6s , 4f , 5d , 6p , 7s , 5f , 6d , 7p …
Наглядно эта последовательность выражается энергетической диаграммой:
Распределение электронов атома по уровням, подуровням и орбиталям (электронная конфигурация атома) может быть изображена в виде электронной формулы, энергетической диаграммы или, упрощенно, в виде схемы электронных слоев (“электронная схема”).
Примеры электронного строения атомов:
Валентные электроны – электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны – 4s 2 , они же и валентные; у атома Fe внешние электроны – 4s 2 , но у него есть 3d 6 , следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция – 4s 2 , а атома железа – 4s 2 3d 6 .
У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны – 4s 2 , они же и валентные; у атома Fe внешние электроны – 4s 2 , но у него есть 3d 6 , следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция – 4s 2 , а атома железа – 4s 2 3d 6 .
Периодическая система химических элементов Д. И. Менделеева
(естественная система химических элементов)
Периодический закон химических элементов (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.
Периодическая система – графическое выражение периодического закона.
Естественный ряд химических элементов – ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Таблица химических элементов строится путем “разрезания” естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов.
В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
Группы короткопериодной таблицы делятся на подгруппы (главные и побочные ), совпадающие с группами длиннопериодной таблицы.
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода.
Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
В короткопериодной таблице – восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице – шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB – побочной подгруппе седьмой группы: остальные – аналогично.
Характеристики химических элементов закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается число внешних электронов,
- уменьшается радиус атомов,
- увеличивается прочность связи электронов с ядром (энергия ионизации),
- увеличивается электроотрицательность,
- усиливаются окислительные свойства простых веществ (“неметалличность”),
- ослабевают восстановительные свойства простых веществ (“металличность”),
- ослабевает основный характер гидроксидов и соответствующих оксидов,
- возрастает кислотный характер гидроксидов и соответствующих оксидов.

В группах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается радиус атомов (только в А-группах),
- уменьшается прочность связи электронов с ядром (энергия ионизации; только в А-группах),
- уменьшается электроотрицательность (только в А-группах),
- ослабевают окислительные свойства простых веществ (“неметалличность”; только в А-группах),
- усиливаются восстановительные свойства простых веществ (“металличность”; только в А-группах),
- возрастает основный характер гидроксидов и соответствующих оксидов (только в А-группах),
- ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в А-группах),
- снижается устойчивость водородных соединений (повышается их восстановительная активность; только в А-группах).
Задачи и тесты по теме “Тема 9. “Строение атома. Периодический закон и периодическая система химических элементов Д. И. Менделеева (ПСХЭ)”.”
- Периодический закон – Периодический закон и строение атомов 8–9 класс
Вы должны знать: законы заполнения орбиталей электронами (принцип наименьшей энергии, принцип Паули, правило Хунда), структуру периодической системы элементов.
Вы должны уметь: определять состав атома по положению элемента в периодической системе, и, наоборот, находить элемент в периодической системе, зная его состав; изображать схему строения, электронную конфигурацию атома, иона, и, наоборот, определять по схеме и электронной конфигурации положение химического элемента в ПСХЭ; давать характеристику элемента и образуемых им веществ по его положению в ПСХЭ; определять изменения радиуса атомов, свойств химических элементов и образуемых ими веществ в пределах одного периода и одной главной подгруппы периодической системы.
Пример 1. Определите количество орбиталей на третьем электронном уровне. Какие это орбитали?
Для определения количества орбиталей воспользуемся формулой N орбиталей = n 2 , где n – номер уровня. N орбиталей = 3 2 = 9. Одна 3s -, три 3p – и пять 3d -орбиталей.Пример 2. Определите, у атома какого элемента электронная формула 1s 2 2s 2 2p 6 3s 2 3p 1 .

Для того, чтобы определить, кокой это элемент, надо выяснить его порядковый номер, который равен суммарному числу электронов атома. В данном случае: 2 + 2 + 6 + 2 + 1 = 13. Это алюминий.Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:- О. С. Габриелян и др. Химия 11 кл. М., Дрофа, 2002;
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 11 кл. М., Просвещение, 2001.
Рекомендуем также
Строение атома
Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе, наталкивает на мысль о том, что в основе всех атомов лежит нечто общее, что все они находятся в близком родстве друг с другом. Однако до конца 19 в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части. Но все эти предположения в то время еще не могли быть подтверждены какими либо экспериментальными данными. Лишь в конце 19в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома. Первые указания на сложную структуру атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются “невидимые” катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают.
При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части. Но все эти предположения в то время еще не могли быть подтверждены какими либо экспериментальными данными. Лишь в конце 19в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при известных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома. Первые указания на сложную структуру атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается по возможности весь воздух и затем пропускается сквозь нее ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются “невидимые” катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение на их пути легко подвижные тела и откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, достигающей половины скорости света. Особыми приемами удалось определить массу катодный частицы и величину их заряда. Оказалось, что масса каждой частицы равняется 0,00055 углеродной единицы, что составляет всего 1.1840 часть массы водорода, самого легкого из всех атомов. Заряд катодной частицы равняется 1,602 10 кулона, или 4,803 10 электростатических единиц. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта.
Катодные лучи обладают способностью приводить в движение на их пути легко подвижные тела и откланяются от своего первоначального пути в магнитном и электрическом поле (в последнем в сторону положительно заряженной пластины). Действие катодных лучей обнаруживается только внутри трубки, так как стекло для них непроницаемо. Изучение свойств катодных лучей привело к заключению, что они представляют собой поток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, достигающей половины скорости света. Особыми приемами удалось определить массу катодный частицы и величину их заряда. Оказалось, что масса каждой частицы равняется 0,00055 углеродной единицы, что составляет всего 1.1840 часть массы водорода, самого легкого из всех атомов. Заряд катодной частицы равняется 1,602 10 кулона, или 4,803 10 электростатических единиц. Особенно замечательно, что масса частиц и величина их заряда не зависит ни от природы газа, остающегося в трубке, ни от вещества из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. По современным воззрениям, заряд электрона есть наименьший электрический заряд, наименьшее кол-во электричества, какое только может существовать. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. однако они могут возникать и вне всякой связи с электрическим зарядом. Так, например, все металлы испускают электроны при накаливании; в пламени горелки также присутствуют электроны; многие вещества выбрасывают электроны при освещении ультрафиолетовыми, рентгеновскими или лучами света (фотоэффект). Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно атомы являются сложными образованиями, построенными из более мелких структурных единиц.
Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет, самую сущность их природы. Эти частицы получили название электронов. По современным воззрениям, заряд электрона есть наименьший электрический заряд, наименьшее кол-во электричества, какое только может существовать. В катодных трубках электроны отделяются от катода под влиянием электрического заряда. однако они могут возникать и вне всякой связи с электрическим зарядом. Так, например, все металлы испускают электроны при накаливании; в пламени горелки также присутствуют электроны; многие вещества выбрасывают электроны при освещении ультрафиолетовыми, рентгеновскими или лучами света (фотоэффект). Выделение электронов самыми разнообразными веществами указывает на то, что эти частицы входят в состав всех атомов; следовательно атомы являются сложными образованиями, построенными из более мелких структурных единиц. Изучение строение атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом в целом электрически нейтрален; следовательно, он должен содержать в себе еще другую составную часть, заряженную положительно, причем ее заряд должен уравновешивать сумму отрицательных зарядов электронов, Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движения -частиц в газах и других веществах. -частицы выбрасываемые атомами радиоактивных элементов, представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости -частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженные положительно, выбитые же электроны тотчас присоединяются к другим молекулам , заряжая их отрицательно.
Изучение строение атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Факт выделения электронов самыми разнообразными веществами приводил к выводу, что электроны входят в состав всех атомов. Но атом в целом электрически нейтрален; следовательно, он должен содержать в себе еще другую составную часть, заряженную положительно, причем ее заряд должен уравновешивать сумму отрицательных зарядов электронов, Эта положительно заряженная часть атома была открыта в 1911 г. Резерфордом при исследовании движения -частиц в газах и других веществах. -частицы выбрасываемые атомами радиоактивных элементов, представляют собой положительно заряженные ионы гелия, скорость движения которых достигает 20000 км/сек. Благодаря такой огромной скорости -частицы, пролетая через воздух и сталкиваясь с молекулами газов, выбивают из них электроны. Молекулы, потерявшие электроны, становятся заряженные положительно, выбитые же электроны тотчас присоединяются к другим молекулам , заряжая их отрицательно. Таким образом, в воздухе на пути -частиц образуются положительно и отрицательно заряженные ионы газа. Способность -частиц ионизировать воздух была использована английским физиком Вильсоном для того, чтобы сделать видимыми пути движения отдельных частиц и сфотографировать их.В последствии аппарат для фотографирования -частиц был назван камерой Вильсона. Рассматривая пути движения -частиц в камере Вильсона, мы видим, что они прямолинейны.В то же время, как показывает теория, каждая частица на протяжении своего пути. а он достигает в воздухе 11см, должна встретить сотни тысяч атомов. Если тем не менее путь ее остается прямолинейным, то это можно объяснить только тем, что -частица пролетает сквозь атомы. Более тщательное исследование этого явления показало, что при прохождении пучка параллельных лучей сквозь слой газа или тонкую металлическую пластинку выходят уже не параллельны, а несколько расходятся: происходит рассеяние -частиц, т.е. отклонение от их первоначального пути.Углы отклонения невелики, но всегда имеется небольшое число частиц (1/8000), которые отклоняются очень сильно, некоторые частицы отбрасываются назад, как если бы на пути встретилось что-то твердое непроницаемое.
Таким образом, в воздухе на пути -частиц образуются положительно и отрицательно заряженные ионы газа. Способность -частиц ионизировать воздух была использована английским физиком Вильсоном для того, чтобы сделать видимыми пути движения отдельных частиц и сфотографировать их.В последствии аппарат для фотографирования -частиц был назван камерой Вильсона. Рассматривая пути движения -частиц в камере Вильсона, мы видим, что они прямолинейны.В то же время, как показывает теория, каждая частица на протяжении своего пути. а он достигает в воздухе 11см, должна встретить сотни тысяч атомов. Если тем не менее путь ее остается прямолинейным, то это можно объяснить только тем, что -частица пролетает сквозь атомы. Более тщательное исследование этого явления показало, что при прохождении пучка параллельных лучей сквозь слой газа или тонкую металлическую пластинку выходят уже не параллельны, а несколько расходятся: происходит рассеяние -частиц, т.е. отклонение от их первоначального пути.Углы отклонения невелики, но всегда имеется небольшое число частиц (1/8000), которые отклоняются очень сильно, некоторые частицы отбрасываются назад, как если бы на пути встретилось что-то твердое непроницаемое.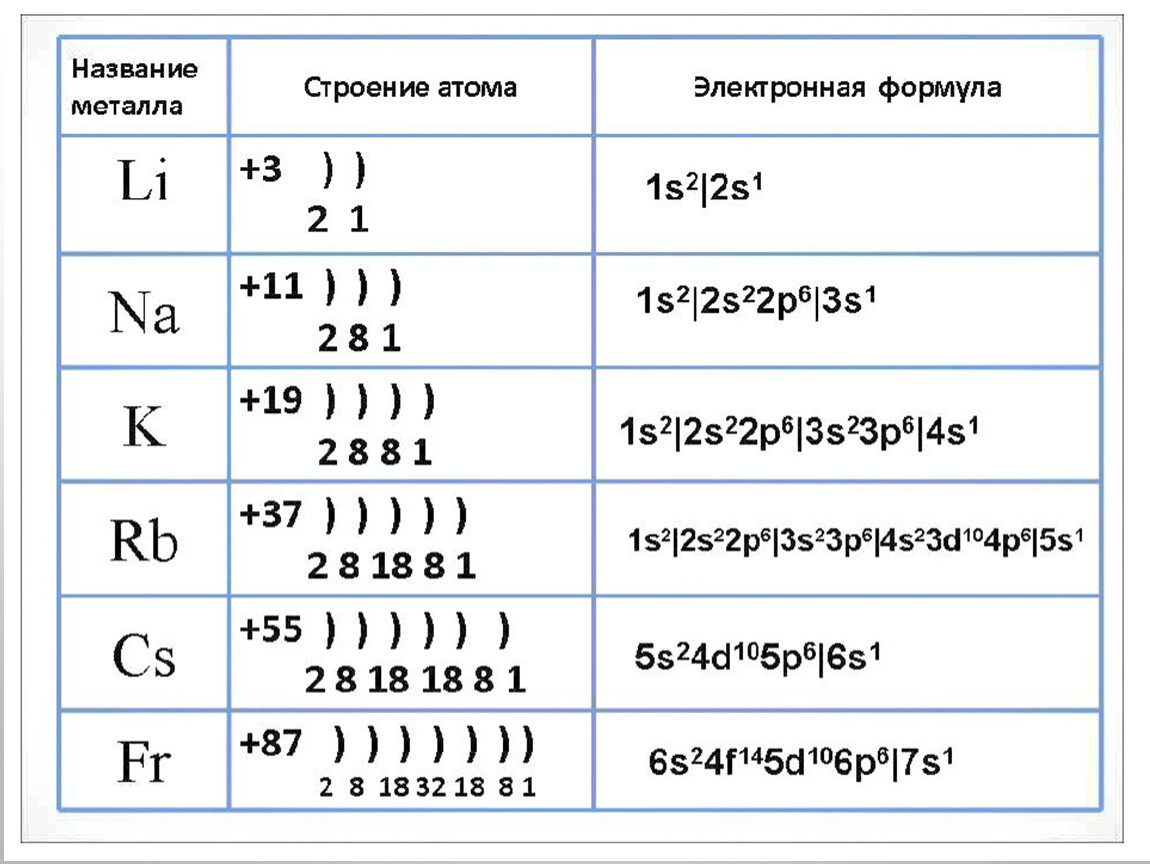 (добавить о том, что это не электроны их масса в 7500 раз меньше массы -частиц, отклонение из-за положительных частиц того же порядка, что и -частицы) Исходя из этих соображений, Резерфорд предложил следующую схему строения атома. В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вседствии этого остаются на определенных расстояниях от ядра. Так как масса электрона ничтожна мала, то почти вся масса сосредоточена в его ядре. Размеры атома и его отдельных частей выражается следующими числами: диаметр атома – 10 см., диаметр электрона – 10 см и диаметр ядра от 10 до 10 см. Отсюда ясно, что на долю ядра и электронов, число которых, как увидим дальше, сравнительно невелико, приходиться лишь, ничтожная часть всего пространства, занятого атомной системой. Предложенная Резерфордом схема строения атома или, как обыкновенной говорят, модель атома, легко объясняет явления отклонение -частиц.
(добавить о том, что это не электроны их масса в 7500 раз меньше массы -частиц, отклонение из-за положительных частиц того же порядка, что и -частицы) Исходя из этих соображений, Резерфорд предложил следующую схему строения атома. В центре атома находится положительно заряженное ядро, вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вседствии этого остаются на определенных расстояниях от ядра. Так как масса электрона ничтожна мала, то почти вся масса сосредоточена в его ядре. Размеры атома и его отдельных частей выражается следующими числами: диаметр атома – 10 см., диаметр электрона – 10 см и диаметр ядра от 10 до 10 см. Отсюда ясно, что на долю ядра и электронов, число которых, как увидим дальше, сравнительно невелико, приходиться лишь, ничтожная часть всего пространства, занятого атомной системой. Предложенная Резерфордом схема строения атома или, как обыкновенной говорят, модель атома, легко объясняет явления отклонение -частиц.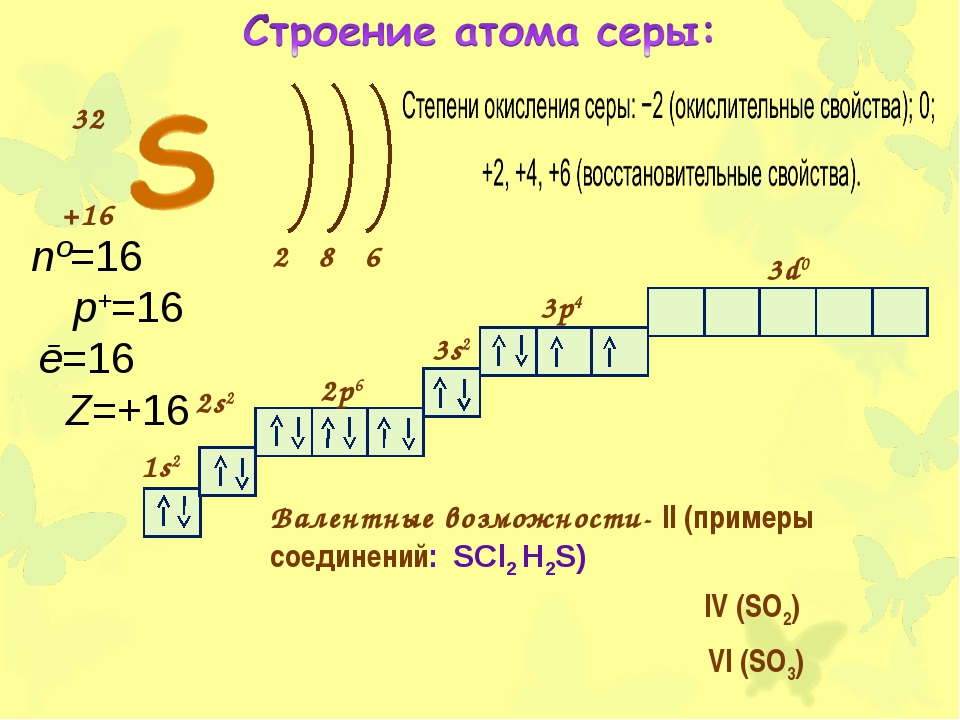 Действительно, размеры ядра и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство -частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда -частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние -частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов. В решении этой задачи этой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительно меньшей длиной волны. В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновских лучей лежат в пределах от 20 до 0,1 ангстрема.
Действительно, размеры ядра и электронов очень малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство -частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда -частицы очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяние -частиц положило начало ядерной теории атома. Одной из задач, стоявших перед теорией строения атома в начале ее развития, было определение величины заряда ядра различных атомов. Так как атом в целом электрически нейтрален, то, определив заряд ядра, можно было бы установить и число окружающих ядро электронов. В решении этой задачи этой большую помощь оказало изучение спектров рентгеновских лучей. Рентгеновские лучи возникают при ударе быстро летящих электронов о какое-либо твердое тело и отличаются от лучей видимого света только значительно меньшей длиной волны. В то время как короткие световые волны имеют длину около 4000 ангстремов (фиолетовые лучи), длины волн рентгеновских лучей лежат в пределах от 20 до 0,1 ангстрема. Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой. Теоретически для лучей с такой короткой длиной волны, как рентгеновские лучи, нужно было приготовить дифракционную решетку с 1000000 делений на 1 мм. Так как искусственно приготовить такую решетку невозможно, то долгое время спектр рентгеновских лучей не удавалось получить. В 1912 г. швейцарского физика Лауэ возникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновских лучей. Закономерное расположение атомов в кристаллах и весьма малые расстояния между ними давали основание предполагать, что кристалл как раз и может сыграть роль требуемой дифракционной решетки. Опыт блестяще подтвердил предположение Лауэ, вскоре удалось построить приборы, которые давали возможность получать спектры рентгеновских лучей почти всех элементов. Для получения рентгеновских спектров антикатод в рентгеновских трубках делают из того металла, спектр которого хотят получить, или же наносят соединение исследуемого элемента.
Чтобы получить спектр рентгеновских лучей, нельзя пользоваться обыкновенной призмой или дифракционной решеткой. Теоретически для лучей с такой короткой длиной волны, как рентгеновские лучи, нужно было приготовить дифракционную решетку с 1000000 делений на 1 мм. Так как искусственно приготовить такую решетку невозможно, то долгое время спектр рентгеновских лучей не удавалось получить. В 1912 г. швейцарского физика Лауэ возникла мысль использовать кристаллы в качестве дифракционной решетки для рентгеновских лучей. Закономерное расположение атомов в кристаллах и весьма малые расстояния между ними давали основание предполагать, что кристалл как раз и может сыграть роль требуемой дифракционной решетки. Опыт блестяще подтвердил предположение Лауэ, вскоре удалось построить приборы, которые давали возможность получать спектры рентгеновских лучей почти всех элементов. Для получения рентгеновских спектров антикатод в рентгеновских трубках делают из того металла, спектр которого хотят получить, или же наносят соединение исследуемого элемента. Экраном для спектра служит фотографическая пластинка или бумага; после проявления на ней видны все линии спектра. В 1913 г. английский ученый Мозли, изучая рентгеновские спектры нашел соотношение между длинами волн рентгеновских лучей и порядкового номерами соответствующих элементов – это носит название закона Мозли и может быть сформулированно следующим образом: Корни квадратные из обратных значений длин волн находятся в линейной зависимости от порядковых номеров элементов. Еще до работ Мозли некоторые теоретические соображения позволяли предположить, что порядковый номер элемента указывает число положительных зарядов ядра его атома. В тоже время Резерфорд, изучая рассеивание -частиц при прохождении через тонкие металлические пластинки, нашел, что если заряд электрона принять за единицу, то выражаемый в таких единицах заряд ядра приблизительно равен половине атомного веса элемента. Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомного веса.
Экраном для спектра служит фотографическая пластинка или бумага; после проявления на ней видны все линии спектра. В 1913 г. английский ученый Мозли, изучая рентгеновские спектры нашел соотношение между длинами волн рентгеновских лучей и порядкового номерами соответствующих элементов – это носит название закона Мозли и может быть сформулированно следующим образом: Корни квадратные из обратных значений длин волн находятся в линейной зависимости от порядковых номеров элементов. Еще до работ Мозли некоторые теоретические соображения позволяли предположить, что порядковый номер элемента указывает число положительных зарядов ядра его атома. В тоже время Резерфорд, изучая рассеивание -частиц при прохождении через тонкие металлические пластинки, нашел, что если заряд электрона принять за единицу, то выражаемый в таких единицах заряд ядра приблизительно равен половине атомного веса элемента. Порядковый номер, по крайне мере более легких элементов, тоже равняется примерно половине атомного веса. Все вместе взятое привело к выводу, что Заряд ядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента. Ядерная модель атома Резерфорда получила свое дальнейшее развитие благодаря работам Нильс Бора, в которых учение о строении атома неразрывно связывается с учением о происхождении спектров. Линейчатые спектры получаются при разложении света испускаемого раскаленными парами или газами. Каждому элементу отвечает свой спектр, отличающийся от спектров других элементов. Большинство металлов дает очень сложные спектры, содержащие огромное число линий (в железе до 5000), но встречаются и сравнительно простые спектры. Развивая ядерную теорию Резерфорда, ученые пришли к мысли, что сложная структура линейчатых спектров обусловлена происходящими внутри атомов колебаниями электронов. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона.
Все вместе взятое привело к выводу, что Заряд ядра численно равен порядковому номеру элемента. Таким образом, закон Мозли позволил определить заряды атомных ядер. Тем самым, ввиду нейтральности атомов, было установлено и число электронов, вращающихся вокруг ядра в атоме каждого элемента. Ядерная модель атома Резерфорда получила свое дальнейшее развитие благодаря работам Нильс Бора, в которых учение о строении атома неразрывно связывается с учением о происхождении спектров. Линейчатые спектры получаются при разложении света испускаемого раскаленными парами или газами. Каждому элементу отвечает свой спектр, отличающийся от спектров других элементов. Большинство металлов дает очень сложные спектры, содержащие огромное число линий (в железе до 5000), но встречаются и сравнительно простые спектры. Развивая ядерную теорию Резерфорда, ученые пришли к мысли, что сложная структура линейчатых спектров обусловлена происходящими внутри атомов колебаниями электронов. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, в следствие чего нарушается равновесие между ним и ядром; для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен “упасть” на ядро, и излучение света прекратится. Если бы на самом деле происходило такое непрерывное изменение движения электрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны. Кроме того, “падение” электрона на ядро означало бы разрушение атома и прекращения его существования. Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении линий спектра, ни и само существование линейчатых спектров.
Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн. Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, в следствие чего нарушается равновесие между ним и ядром; для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен “упасть” на ядро, и излучение света прекратится. Если бы на самом деле происходило такое непрерывное изменение движения электрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны. Кроме того, “падение” электрона на ядро означало бы разрушение атома и прекращения его существования. Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении линий спектра, ни и само существование линейчатых спектров. В 1913 г. Бор предложил сою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком. Сущность теории квантов сводится к тому, что лучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями – квантами энергии. Запас энергии излучающего тела изменяется скачками, квант за квантом;дробное число квантов тело не может ни испускать, ни поглощать. Величина кванта энергии зависит от частоты излучения : чем больше частота излучения, тем больше величина кванта. Обозначая квант энергии через , можно написать: = где – постоянная величина, так называемая константа Планка, равная 6,625 10 эрг сек. Кванты лучистой энергии называются также фотонами. Применив квантовые представления к вращению электронов вокруг ядра, Бор положил в основу своей теории очень смелые предположения, или постулаты.
В 1913 г. Бор предложил сою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком. Сущность теории квантов сводится к тому, что лучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями – квантами энергии. Запас энергии излучающего тела изменяется скачками, квант за квантом;дробное число квантов тело не может ни испускать, ни поглощать. Величина кванта энергии зависит от частоты излучения : чем больше частота излучения, тем больше величина кванта. Обозначая квант энергии через , можно написать: = где – постоянная величина, так называемая константа Планка, равная 6,625 10 эрг сек. Кванты лучистой энергии называются также фотонами. Применив квантовые представления к вращению электронов вокруг ядра, Бор положил в основу своей теории очень смелые предположения, или постулаты.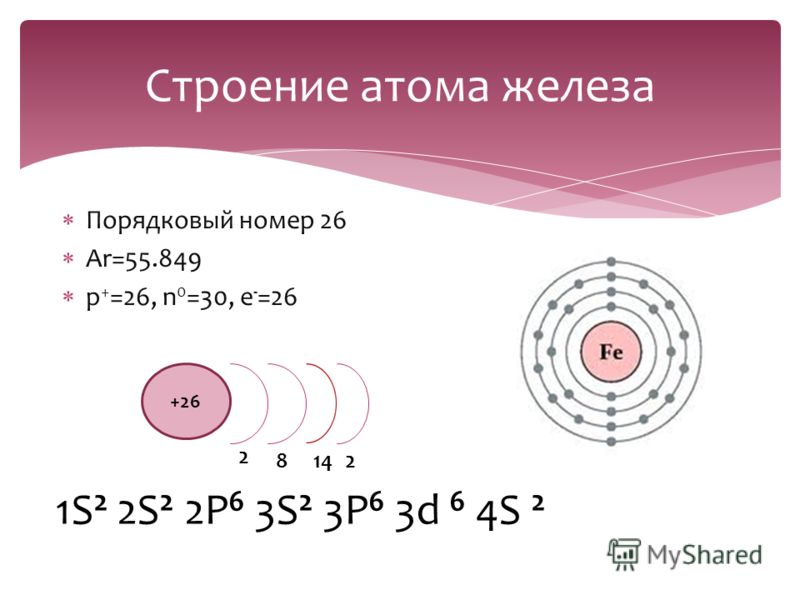 Хотя эти постулаты и противоречат законам классической электродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в том полнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через Е , а на более близкой через Е и разделив потерянную атомом энергию Е – Е на постоянную Планка, получим искомую частоту: =—— Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения.
Хотя эти постулаты и противоречат законам классической электродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в том полнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через Е , а на более близкой через Е и разделив потерянную атомом энергию Е – Е на постоянную Планка, получим искомую частоту: =—— Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения.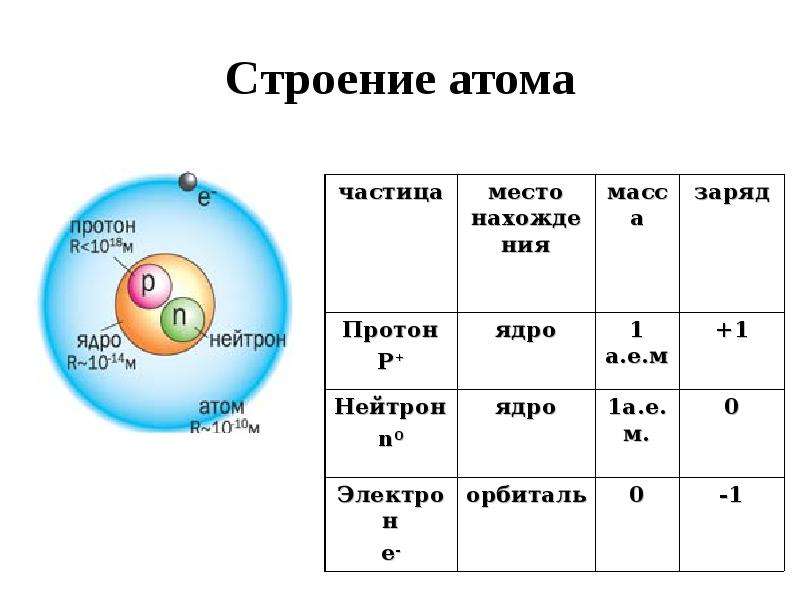 Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : … n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для таких расчетов. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связанно с некоторыми трудностями из-за ее новизны. Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : … n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для таких расчетов. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связанно с некоторыми трудностями из-за ее новизны. Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.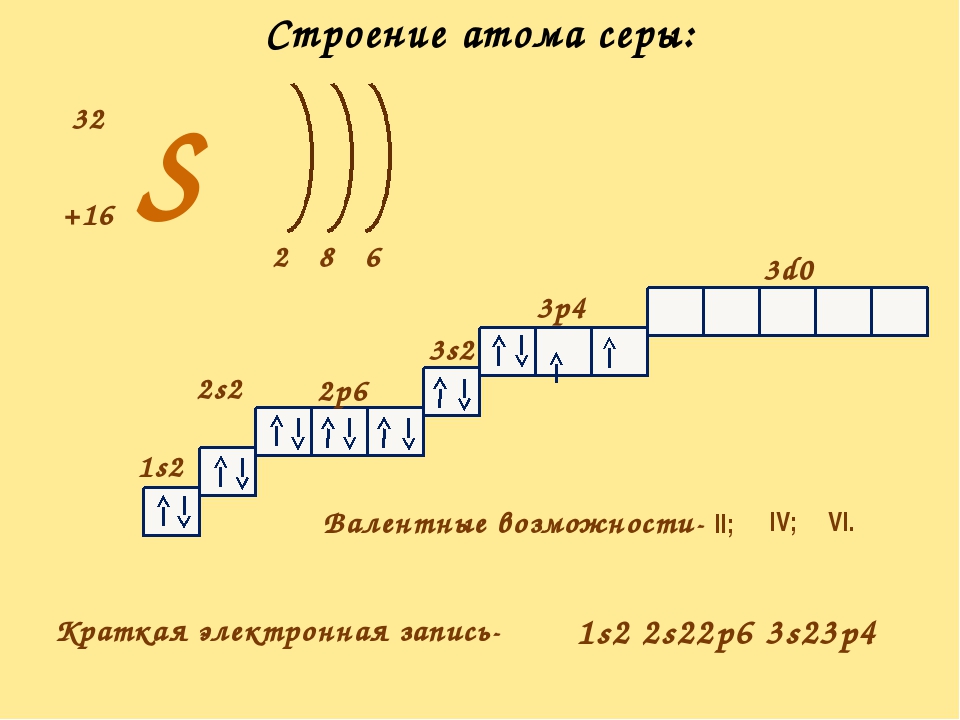 В настоящее время разработаны схемы строения атомов всех химических элементов. Однако, иметь ввиду, что все эти схемы это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как раньше уже было сказанно, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющие или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, могущих находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя: N=2n где n-номер слоя. Таким образом на 1-2, на 2-8, на 3-18 и т.
В настоящее время разработаны схемы строения атомов всех химических элементов. Однако, иметь ввиду, что все эти схемы это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как раньше уже было сказанно, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе. Электроны расположены по слоям, т.е. каждому слою принадлежит определенное заполняющие или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней. Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, могущих находиться на данном энергетическом уровне, равно удвоенному квадрату номера слоя: N=2n где n-номер слоя. Таким образом на 1-2, на 2-8, на 3-18 и т. д. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем – восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженные положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой – к выяснению структуры отдельных атомов и установлению связи между ними.
д. Кроме того, установлено, что число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем – восемнадцати. Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженные положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот атомы присоединившие электроны становятся заряженные отрицательно. Образующиеся таким путем заряженные частицы, качественно отличные от соответствующих атомов. называются ионами. Многие ионы в свою очередь могут терять или присоединять электроны, превращаясь при этом или в электронейтральные атомы, или в новые ионы с другим зарядом. Теория Бора оказала огромные услуги физике и химии, подойдя, с одной стороны, к раскрытию законов спектроскопии и объяснению механизма лучеиспускания, а с другой – к выяснению структуры отдельных атомов и установлению связи между ними.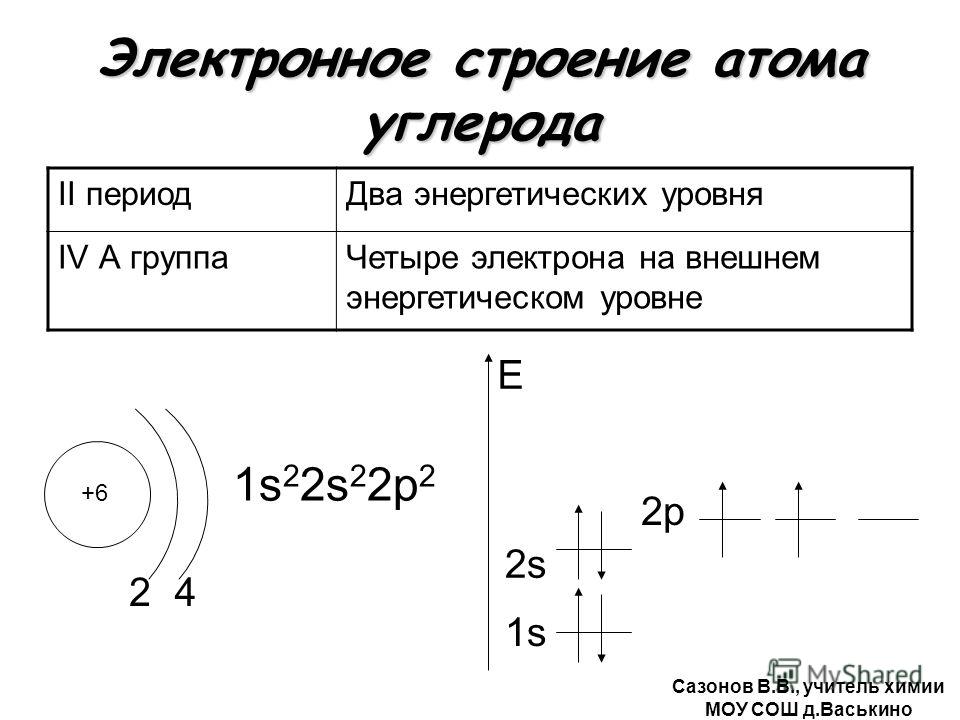 Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах рисовалось Бору до известной степени как простое механическое перемещение, между тем как оно является весьма сложным и своеобразным. Своеобразие движения электронов было раскрыто новой теорией – квантовой, или волновой, механикой. Квантовая механика показывает, что законы движения электронов имеют много общего с законами распространения волн. Я хочу лишь основное уравнение волновой механики, в связи с ее сложностью: связывающие длину волны для потока электронов с их скоростью и массой : =—– где h- постоянная Планка. Охватывая более широкий круг явлений, чем теория Бора, решает ряд вопросов, с которыми теория Бора справится не смогла. Так, например, при помощи волновой механики получает объяснение устойчивость лишь определенных электронных орбит. “Устойчивыми” являются лишь те орбиты, на которых укладывается целое число волн. Так как длина круговой орбиты с радиусом r равна 2 r,то устойчивость орбиты будет определятся ур-нием: 2 r=—— где n-целое число.
Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах рисовалось Бору до известной степени как простое механическое перемещение, между тем как оно является весьма сложным и своеобразным. Своеобразие движения электронов было раскрыто новой теорией – квантовой, или волновой, механикой. Квантовая механика показывает, что законы движения электронов имеют много общего с законами распространения волн. Я хочу лишь основное уравнение волновой механики, в связи с ее сложностью: связывающие длину волны для потока электронов с их скоростью и массой : =—– где h- постоянная Планка. Охватывая более широкий круг явлений, чем теория Бора, решает ряд вопросов, с которыми теория Бора справится не смогла. Так, например, при помощи волновой механики получает объяснение устойчивость лишь определенных электронных орбит. “Устойчивыми” являются лишь те орбиты, на которых укладывается целое число волн. Так как длина круговой орбиты с радиусом r равна 2 r,то устойчивость орбиты будет определятся ур-нием: 2 r=—— где n-целое число. Это и есть математическое выражение первого постулата Бора, которое он в 1913 г. положил в основу расчета движения электрона в атоме водорода. В приведенном выше ур-ние n-главное квантовое число. Принимает значения любого натурального числа. 1) Главное квантовое число n определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. Главное квантовое число определяет среднее радиальное распределение электронной плотности около ядра. Помимо главного квантового числа, состояние электрона в атоме характеризуется еще тремя другими квантовыми числами: l,m,s. 2) Побочное (азимутальное) квантовое число l характеризует момент количества движения электрона относительно центра орбиты. Оно определяет форму электронного облака (форму орбиты), его сплошность или разрывы и его вытянутость. (s,p,d орбитали) 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, согласно представления волновой механики, то направление, в котором вытянуто электронное облако.
Это и есть математическое выражение первого постулата Бора, которое он в 1913 г. положил в основу расчета движения электрона в атоме водорода. В приведенном выше ур-ние n-главное квантовое число. Принимает значения любого натурального числа. 1) Главное квантовое число n определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. Главное квантовое число определяет среднее радиальное распределение электронной плотности около ядра. Помимо главного квантового числа, состояние электрона в атоме характеризуется еще тремя другими квантовыми числами: l,m,s. 2) Побочное (азимутальное) квантовое число l характеризует момент количества движения электрона относительно центра орбиты. Оно определяет форму электронного облака (форму орбиты), его сплошность или разрывы и его вытянутость. (s,p,d орбитали) 3) Магнитное квантовое число m определяет положение плоскости орбиты электрона в пространстве или, согласно представления волновой механики, то направление, в котором вытянуто электронное облако.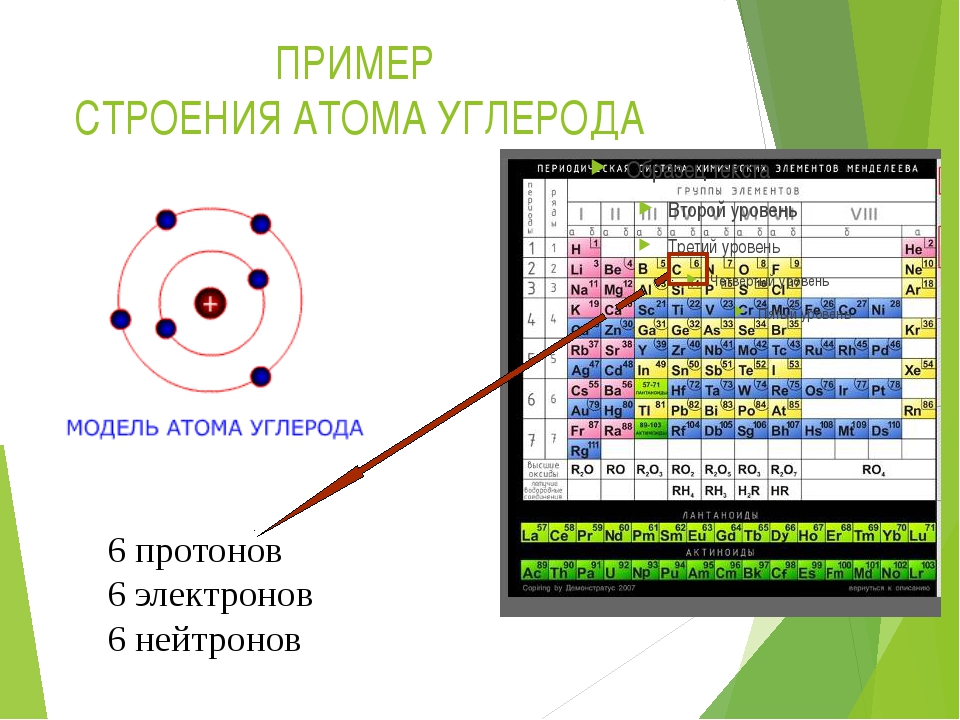 Равно по модулю l. 4) Спиновое квантовое число s определяет направление вращения электрона. может принимать только два значения. На основании анализа спектров и учета положения элементов в периодической системе физиком Паули был найден общий принцип, позволяющий избрать те сочетания квантовых чисел, которые отвечают реальной действительности. Согласно этому принципу два электрона в атоме не могут иметь четыре одинаковых квантовых числа.
Равно по модулю l. 4) Спиновое квантовое число s определяет направление вращения электрона. может принимать только два значения. На основании анализа спектров и учета положения элементов в периодической системе физиком Паули был найден общий принцип, позволяющий избрать те сочетания квантовых чисел, которые отвечают реальной действительности. Согласно этому принципу два электрона в атоме не могут иметь четыре одинаковых квантовых числа.
22.1 Структура атома
Эксперимент Резерфорда
В начале 1900-х годов общепринятой моделью атома была модель сливового пудинга . Предложенная в 1904 году Дж. Дж. Томсоном модель предполагала, что атом представляет собой сферический шар с положительным зарядом, по которому равномерно разбросаны отрицательно заряженные электроны. В этой модели положительные заряды составляли пудинг, а электроны действовали как отдельные сливы. За время своего короткого срока существования модель могла быть использована для объяснения того, почему большинство частиц были нейтральными, хотя при несбалансированном количестве «слив» электрически заряженные атомы могли существовать.
Когда Эрнест Резерфорд начал свой эксперимент с золотой фольгой в 1909 году, вряд ли кто-то ожидал, что модель сливового пудинга будет оспорена. Однако, используя радиоактивный источник, тонкий лист золотой фольги и фосфоресцирующий экран, Резерфорд обнаружил нечто настолько великое, что позже назвал бы это «самым невероятным событием, которое когда-либо происходило со мной в моей жизни» [Джеймс, Л.К. (1993). Нобелевских лауреатов по химии, 1901–1992 гг. . Вашингтон, округ Колумбия: Американское химическое общество.]
Эксперимент, разработанный Резерфордом, показан на рис. 22.2. Как вы можете видеть, радиоактивный источник был помещен в свинцовый контейнер с отверстием с одной стороны для получения пучка положительно заряженных частиц гелия, называемых альфа-частицами . Затем в пучок помещался тонкий лист золотой фольги. Когда высокоэнергетические альфа-частицы проходили через золотую фольгу, они рассеялись. Рассеяние наблюдалось от ярких пятен, которые возникали при попадании на люминофорный экран.
Рассеяние наблюдалось от ярких пятен, которые возникали при попадании на люминофорный экран.
Рис. 22.2. Эксперимент Резерфорда дал прямые доказательства размера и массы ядра путем рассеяния альфа-частиц на тонкой золотой фольге. Рассеяние частиц предполагает, что ядра золота очень малы и содержат почти всю массу атома золота. Особенно важную роль в показе размера ядра играют альфа-частицы, которые разлетаются на очень большие углы, как футбольный мяч, отскакивающий от головы вратаря.
Ожидание модели сливового пудинга заключалось в том, что альфа-частицы высокой энергии будут лишь слегка рассеиваться из-за наличия листа золота.Поскольку энергия альфа-частиц была намного выше, чем энергия, обычно связанная с атомами, альфа-частицы должны были пройти через тонкую фольгу так же, как сверхзвуковой шар для боулинга врезался бы через несколько десятков рядов кеглей. Ожидалось, что любое отклонение будет незначительным и в первую очередь из-за электростатической кулоновской силы между альфа-частицами и внутренними электрическими зарядами фольги.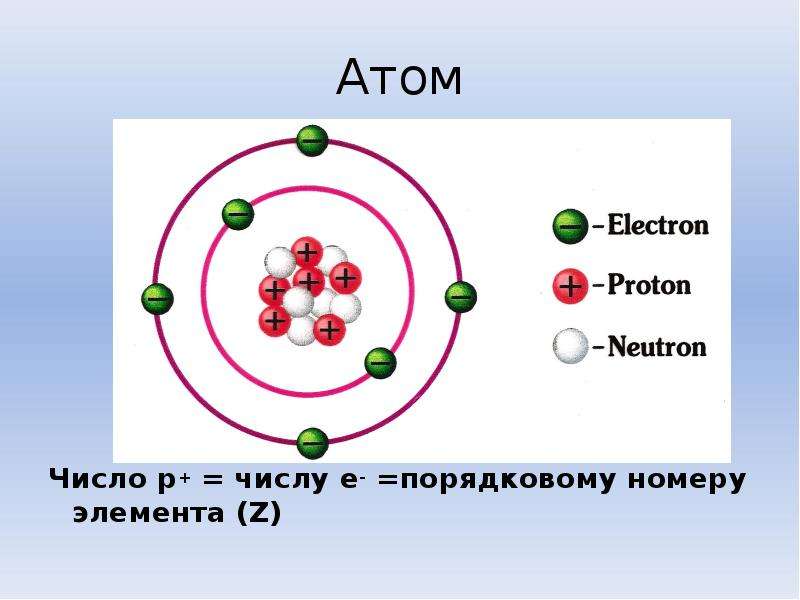
Однако истинный результат был совсем другим. Хотя большинство альфа-частиц беспрепятственно проходило через фольгу, Резерфорд и его сотрудники Ханс Гейгер и Эрнест Марсден обнаружили, что альфа-частицы иногда рассеиваются на большие углы, а некоторые даже возвращаются в том направлении, откуда пришли! Результат, названный рассеянием Резерфорда, означал, что ядра золота на самом деле были очень маленькими по сравнению с размером атома золота.Как показано на рис. 22.3, плотное ядро окружено в основном пустым пространством атома, идея подтверждается тем фактом, что только 1 из 8000 частиц была рассеяна назад.
Рис. 22.3. Увеличенное изображение атомов в золотой фольге в эксперименте Резерфорда. Кружками обозначены атомы диаметром около 10 −10 м, а точками – ядра диаметром около 10 −15 м. Чтобы быть видимыми, точки намного больше масштаба – если бы ядра действительно были размером с точки, каждый атом имел бы диаметр около пяти метров! Большинство альфа-частиц проникают сквозь них, но на них относительно не действуют из-за их высокой энергии и малой массы электрона. Некоторые, однако, ударяются о ядро и рассеиваются обратно. Детальный анализ их взаимодействия дает размер и массу ядра.
Некоторые, однако, ударяются о ядро и рассеиваются обратно. Детальный анализ их взаимодействия дает размер и массу ядра.
Хотя результаты эксперимента были опубликованы его коллегами в 1909 году, Резерфорду потребовалось два года, чтобы убедиться в их значении. Позже Резерфорд писал: «Это было почти так же невероятно, как если бы вы выстрелили 15-дюймовым снарядом по куску папиросной бумаги, а он вернулся и попал в вас. Подумав, понял, что это рассыпание назад… [означает] … большая часть массы атома была сосредоточена в крошечном ядре ». В 1911 году Резерфорд опубликовал свой анализ вместе с предложенной моделью атома, которая частично была основана на работе Гейгера за предыдущий год. В результате работы было определено, что размер ядра составляет примерно 10-1510-15 м, что в 100000 раз меньше размера атома. Это подразумевает огромную плотность порядка 1015 · 1015 г / см 3 , намного большую, чем у любой макроскопической материи.
Основываясь на размере и массе ядра, обнаруженных в его эксперименте, а также на массе электронов, Резерфорд предложил планетарную модель атома..PNG) Планетарная модель атома изображает электроны с малой массой, вращающиеся вокруг ядра с большой массой. Размеры электронных орбит велики по сравнению с размером ядра, а большая часть атома представляет собой вакуум. Модель аналогична тому, как планеты с малой массой в нашей солнечной системе вращаются вокруг Солнца с большой массой. В атоме кулоновская сила притяжения аналогична гравитации в планетной системе (см. Рис. 22.4).
Планетарная модель атома изображает электроны с малой массой, вращающиеся вокруг ядра с большой массой. Размеры электронных орбит велики по сравнению с размером ядра, а большая часть атома представляет собой вакуум. Модель аналогична тому, как планеты с малой массой в нашей солнечной системе вращаются вокруг Солнца с большой массой. В атоме кулоновская сила притяжения аналогична гравитации в планетной системе (см. Рис. 22.4).
Рис. 22.4. Планетарная модель атома Резерфорда включает характеристики ядра, электронов и размер атома.Модель была первой, кто распознал структуру атомов, в которой электроны с малой массой вращаются вокруг очень маленького массивного ядра по орбитам, намного большим, чем ядро. Атом в основном пуст и аналогичен нашей планетной системе.
Виртуальная физика
Резерфордское рассеяние
Как Резерфорд выяснил структуру атома, но не смог ее увидеть? Исследуйте ответ с помощью этой симуляции знаменитого эксперимента, в котором он опроверг модель сливового пудинга, наблюдая за отражением альфа-частиц от атомов и определив, что у них должно быть небольшое ядро.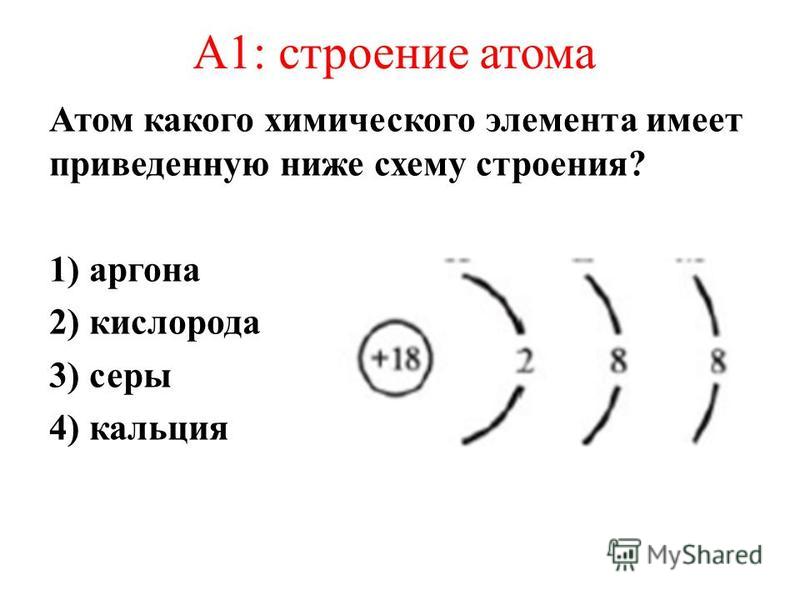
Советы для успеха
По мере того, как вы будете изучать модель атома, подумайте о влиянии экспериментов на научный процесс. Задайте себе следующий вопрос: какой была бы наша модель атома без эксперимента Резерфорда с золотой фольгой? Какого дальнейшего понимания атома не удалось бы получить? Как это повлияет на наши текущие технологии? Проводимые сегодня эксперименты, которые часто сбивают с толку, могут иметь аналогичный эффект.
Базовая атомная структура | Extron
Вся материя состоит из крошечных частиц, называемых атомами. Различные виды атомов называются элементами и отображаются на графическом дисплее, который называется периодической таблицей элементов. Большинство людей знакомы с названиями таких элементов, как кислород, азот, железо, золото и водород. Атомы всех элементов состоят из трех основных строительных блоков: протонов, нейтронов и электронов.| Периодическая система элементов |
Протоны – положительно заряженные частицы, нейтроны – незаряженные частицы, и оба они тяжелы в субатомной схеме вещей.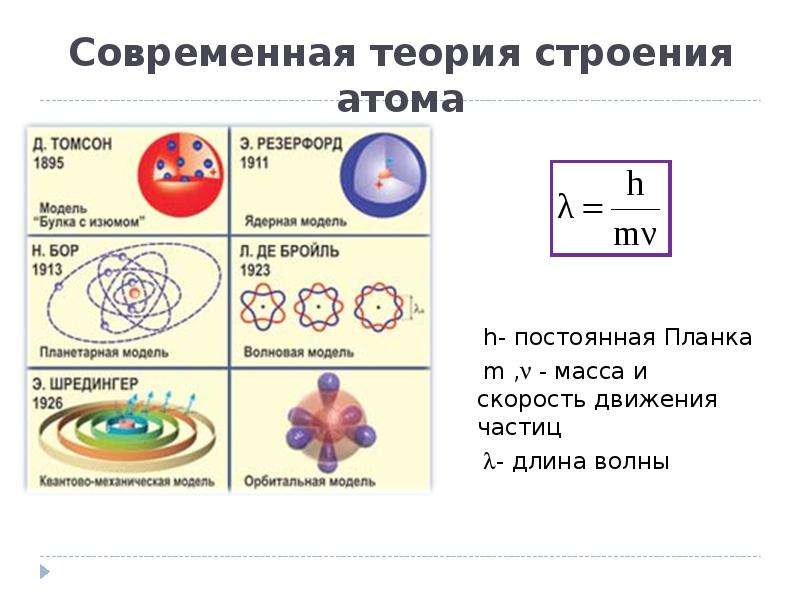 Электроны – это отрицательно заряженные частицы, относительно легкие по сравнению с протонами и нейтронами. Водород – самый простой из элементов; атом водорода состоит из одного протона и одного электрона. Структуру атома водорода можно представить как Землю и ее Луну. В центре – большая тяжелая Земля, а вокруг нее вращается меньшая луна. Точно так же тяжелый протон находится в центре атома водорода, а электрон вращается вокруг протона с большой скоростью. Все остальные элементы имеют такую же базовую структуру: протоны и нейтроны в центре и электроны, вращающиеся вокруг.Число протонов в атоме определяет, что это за элемент, и ожидается, что атом будет иметь такое же количество электронов, что и протоны, чтобы сбалансировать заряд атома. Например, гелий имеет два протона и два электрона.
Электроны – это отрицательно заряженные частицы, относительно легкие по сравнению с протонами и нейтронами. Водород – самый простой из элементов; атом водорода состоит из одного протона и одного электрона. Структуру атома водорода можно представить как Землю и ее Луну. В центре – большая тяжелая Земля, а вокруг нее вращается меньшая луна. Точно так же тяжелый протон находится в центре атома водорода, а электрон вращается вокруг протона с большой скоростью. Все остальные элементы имеют такую же базовую структуру: протоны и нейтроны в центре и электроны, вращающиеся вокруг.Число протонов в атоме определяет, что это за элемент, и ожидается, что атом будет иметь такое же количество электронов, что и протоны, чтобы сбалансировать заряд атома. Например, гелий имеет два протона и два электрона.
| Атом водорода |
Атом будет держать свои протоны и нейтроны при себе. Однако атомы разделяют электроны. Обычно атомам нравится сохранять нейтральный заряд, поэтому, если они заимствуют электрон у одного атома, они, как правило, делят его с другим атомом.Атомы будут делиться электронами с другими атомами, чтобы образовывать связи, создавая молекулы и соединения, твердые тела и газы – короче говоря, все материю. Кроме того, большое количество соседних атомов могут разделять электроны в длинной цепочке, от одного атома к следующему, и так далее, создавая поток электронов. Этот поток электронов и есть то, что мы называем электричеством.
Однако атомы разделяют электроны. Обычно атомам нравится сохранять нейтральный заряд, поэтому, если они заимствуют электрон у одного атома, они, как правило, делят его с другим атомом.Атомы будут делиться электронами с другими атомами, чтобы образовывать связи, создавая молекулы и соединения, твердые тела и газы – короче говоря, все материю. Кроме того, большое количество соседних атомов могут разделять электроны в длинной цепочке, от одного атома к следующему, и так далее, создавая поток электронов. Этот поток электронов и есть то, что мы называем электричеством.
Итак, у всей материи есть электроны, готовые течь, но электричество не гудит повсюду случайным образом, разбивая материал. Это связано с тем, что баланс между электрическими силами и сопротивлением электронному потоку сохраняется в материи большую часть времени.Чтобы электроны могли течь, электрические силы должны преодолевать сопротивление электронному потоку. Когда баланс опрокидывается, либо с большей электрической силой, либо с меньшим сопротивлением потоку электронов, создается электричество. Баланс между силой и сопротивлением будет количественно определен в разделе, посвященном электрическим цепям. Чтобы завершить обсуждение атомной структуры, давайте рассмотрим материалы, в которых текут электроны. Мы можем разделить материю на три категории в отношении потока электронов, проводников, изоляторов и полупроводников.
Баланс между силой и сопротивлением будет количественно определен в разделе, посвященном электрическим цепям. Чтобы завершить обсуждение атомной структуры, давайте рассмотрим материалы, в которых текут электроны. Мы можем разделить материю на три категории в отношении потока электронов, проводников, изоляторов и полупроводников.
Проводники – это материалы, которые легко проводят электричество. Требуется очень небольшая электрическая сила, чтобы вызвать поток электронов в проводниках. Это связано с электронами, называемыми «свободными электронами», которые существуют в атомах проводников. «Свободные электроны» – это электроны, которые очень слабо связаны с атомом. Имея очень небольшую силу, они могут быть проданы другим атомам или течь для создания электричества. Такие металлы, как медь, серебро и золото, являются хорошими проводниками.
Изоляторы довольно эгоистично делятся своими электронами.У них нет свободных электронов, и требуется большая электрическая сила, чтобы заставить электроны изолятора течь. Поток электронов в изоляторе относительно необычен, и когда он происходит, он обычно сопровождается сильным жаром, громким шумом, плавлением или взрывами, дымом и / или пламенем. Такие материалы, как резина и стекло, являются хорошими изоляторами.
Поток электронов в изоляторе относительно необычен, и когда он происходит, он обычно сопровождается сильным жаром, громким шумом, плавлением или взрывами, дымом и / или пламенем. Такие материалы, как резина и стекло, являются хорошими изоляторами.
Полупроводники – это изоляторы, которые не требуют обязательств. Атомы полупроводника не имеют свободных электронов; однако у них действительно есть электрон, который связан довольно слабо и может использоваться совместно с приложением умеренной электрической силы.Полупроводники могут проводить электричество на определенном уровне без повреждений; однако полупроводники могут быть повреждены слишком большой электрической силой.
Кремний – самый распространенный полупроводник. Хорошие изоляторы, проводники и полупроводники обычно представляют собой изысканные материалы.
Атомная структура
Курс геолого-геофизических исследований мистера Панико – Чартерная школа Odyssey – сентябрь 2012 г.
Модель атома и материя
Студенты: вся вселенная состоит из чрезвычайно маленьких частиц материи, называемых атомами .
Слово атом означает неделимый. Если атом разделен, то его уже нельзя будет распознать как материю
. Внутри атома находятся субатомных частиц трех типов: протонов, нейтронов и электронов.
| Часть 1 – Структура атома – Протоны, нейтроны и электроны |
Протоны, нейтроны и электроны
Протон – это частица, которая несет положительный электрический заряд и расположена в центре атома.Центр атома называется ядром . Второй тип частиц в ядре называется нейтроном. Нейтроны также расположены в ядре, и эти частицы не имеют электрического заряда и, следовательно, являются нейтральными .
Третий тип субатомных частиц называется электроном , и он намного меньше протона или нейтрона. Электроны вращаются вокруг атома в большой области пространства, окружающей ядро.Электрон имеет отрицательный электрический заряд . Мы знакомы с электронами в том смысле, что электроны текут по проводам как электричество .
Модель атома
Электроны вращаются вокруг ядра на разном расстоянии от ядра, при этом более энергичные электроны движутся дальше по орбите. Если бы мы могли создать точную в масштабе модель атома, мы бы увидели, что ядро очень маленькое, скажем, размером с бейсбольный мяч, а электроны подобны размеру изюма, вращающегося вокруг бейсбольного мяча с очень большого расстояния. примерно 5 футбольных полей, или 1500 футов.
Атомы состоят в основном из пустого пространства
Вы можете видеть, что эта модель истинного масштаба показывает, что существует огромное количество пространства, которое состоит из атомов, и поэтому атомов в основном состоят из пространства .
Число протонов определяет тип атома
Первичной субатомной частицей является протон, потому что число протонов внутри атома определяет тип атома . Например, все атомы, в ядре которых есть 8 протонов, являются атомами кислорода.Все атомы, у которых есть 6 протонов, являются атомами углерода. Лучше сказать, чтобы атом был атомом золота, он должен иметь 79 протонов, не больше и не меньше. Если бы атом мог изменить количество протонов, он стал бы атомом другого типа. (Изменение числа протонов в атоме происходит в природе, и это называется ядерным распадом).
94 известных типа атомов
Есть 94 естественных атома во Вселенной , о которых известно науке.Эти атомы представлены в Периодической таблице. Подробнее об этом позже…
Периодическая таблица
Элементы
Атомы также называют элементами. Элемент – это чистое вещество, состоящее только из одного типа атомов. Поскольку существует 94 типа атомов, существует 94 типа элементов. Железо – это один из видов элементов. Углерод – другое. Так же свинец и золото.
Поскольку существует 94 типа атомов, существует 94 типа элементов. Железо – это один из видов элементов. Углерод – другое. Так же свинец и золото.
Буквы представляют элементы
Буквы, которые вы видите в периодической таблице, представляют элементы.Ртуть – Hg . Золото – Au . Нержавеющая сталь состоит из нескольких элементов, поэтому она не представлена в периодической таблице. В Периодической таблице присутствуют только чистые элементы, а не смеси нескольких элементов.
Атомный номер = число протонов
Число протонов , которое имеет атом, называется его атомным номером . Атомный номер углерода равен 6, потому что атомы углерода имеют 6 протонов. Атомный номер кислорода равен 8, потому что атомы кислорода имеют в своем ядре 8 протонов.Атомный номер золота 79, потому что атомы золота имеют 79 протонов.
Здесь вы видите медь с атомным номером 29, потому что атомы меди содержат 29 протонов в своем ядре.
Атомы – это чистые химические элементы
Во Вселенной 94 естественных атома, это означает, что существует 94 естественных элемента . Элементы – это вещества, формы материи и газы, которые состоят из только одного типа атома .
По состоянию на май 2011 года было идентифицировано 118 элементов, последним из которых был унунокций в 2002 году. Считается, что из 118 известных элементов только первые 94 встречаются на Земле в естественных условиях. Из этих встречающихся в природе элементов 80 являются стабильными или практически стабильными, в то время как другие радиоактивны, распадаясь на другие, более легкие элементы в различных временных масштабах от часов до миллиардов лет. |
Когда только один тип атома составляет материю, тогда эта материя называется элементом. Если вы держали в руке кусок чистой меди, это означает, что в этом кусочке меди содержатся только атомы меди. Итак, это чистый кусок меди без каких-либо других типов атомов.Удерживать большой образец чистого элемента бывает редко. Большинство веществ, достаточно больших, чтобы их вместить, будут содержать смешанные с ними другие типы атомов.
Нержавеющая сталь, например, содержит несколько типов атомов, поэтому это не элемент, а смесь элементов.
3 протона и 3 электрона
| Часть 2 – Изотопы и атомная масса |
Число протонов = Число электронов = Нейтральный заряд Атома
Теперь в большинстве атомов число положительных протонов, которые он имеет, такое же, как число отрицательных электронов, которые у него есть. Итак, атом углерода с 6 протонами должен также иметь 6 электронов, чтобы быть нейтральным атомом . Атом алюминия имеет 13 протонов, поэтому у него также должно быть 13 электронов.
Итак, атом углерода с 6 протонами должен также иметь 6 электронов, чтобы быть нейтральным атомом . Атом алюминия имеет 13 протонов, поэтому у него также должно быть 13 электронов.
Помните, что количество протонов равно количеству электронов в нейтрально заряженных стабильных атомах . (Есть исключение, когда атом является ионом, как это объясняется ниже).
В некоторых атомах количество нейтронов будет отличаться от количества протонов. Этот факт называют изотопами.
В общем, меньшие атомы имеют такое же количество нейтронов, что и протоны, но это не относится ко всем атомам. Например, среди атомов углерода, каждый из которых имеет 6 протонов, большинство атомов углерода будут иметь 6 нейтронов, НО не все будут. У некоторых атомов углерода может быть 8 нейтронов, хотя у большинства – 6 нейтронов.
На этом изображении углерод-13 имеет 7 нейтронов, а углерод-14 – 8
Изотопы относятся к вариациям в количестве нейтронов внутри одного типа атома.
Ссылаясь на тот факт, что атомы любого типа будут иметь некоторые вариации количества нейтронов, которые они содержат, мы называем изотопами .У всех атомов углерода должно быть 6 протонов, чтобы быть атомом углерода. У большинства атомов углерода также будет 6 нейтронов, но у некоторых будет 8 нейтронов. Эти вариации числа нейтронов составляют изотопов углерода . Атом углерода с 6 нейтронами – это изотоп под названием углерод-12 . Атом углерода с 8 нейтронами – это изотоп под названием cabaron-14 . Изотоп Углерод-12 имеет 6 протонов и 6 нейтронов, следовательно, Углерод-12. Изотоп Углерод-14 имеет 6 протонов и 8 нейтронов, отсюда и его название Углерод-14.
19 протонов + 20 нейтронов = атомная масса 39
Атомная масса (атомный вес) – это количество протонов + нейтронов
Еще одно важное понятие для ученых – это атомная масса (также называемая атомной массой ). Атомная масса относится к весу или на самом деле массе атома. Каждая частица в ядре равна одной единице массы. Итак, 12 частиц в ядре атома равны массе 12. Если в ядре атома 6 протонов и 6 нейтронов, то общая масса этого атома = 12.У атома углерода 6 протонов и 6 нейтронов, поэтому его атомная масса = 12 ..
Атомная масса относится к весу или на самом деле массе атома. Каждая частица в ядре равна одной единице массы. Итак, 12 частиц в ядре атома равны массе 12. Если в ядре атома 6 протонов и 6 нейтронов, то общая масса этого атома = 12.У атома углерода 6 протонов и 6 нейтронов, поэтому его атомная масса = 12 ..
Если в ядре атома 8 протонов и 8 нейтронов, то этот атом имеет атомную массу 16.
Атомная масса атомов просто складывает протоны и нейтроны в его ядре .
Но количество нейтронов различается (изотопы)
Однако в любом типе атома будет некоторое изменение количества нейтронов, так как мы можем объявить точную атомную массу? Ученые просто используют среднее количество нейтронов для любого типа атома при определении атомной массы.Например, в углероде всего 6 протонов, но на самом деле в среднем 6,0107 нейтронов. Итак, атомная масса углерода равна 12,0107. , НО ДЛЯ НАШИХ ЦЕЛЕЙ МЫ МОЖЕМ ОКРУГНУТЬ АТОМНУЮ МАССУ ДО 12.
Кислород состоит из 8 протонов и 8 электронов. Хотя большинство атомов кислорода имеют 8 нейтронов, у некоторых может быть меньше, поэтому общее число нейтронов для кислорода составляет в среднем 7,9994. Но для наших целей мы можем просто сказать 8 нейтронов.
Хотя большинство атомов кислорода имеют 8 нейтронов, у некоторых может быть меньше, поэтому общее число нейтронов для кислорода составляет в среднем 7,9994. Но для наших целей мы можем просто сказать 8 нейтронов.
Короткое видео по атомам и изотопам:
Пожалуйста, послушайте – Отличное видео по изотопам – 5 минут
Символы периодической таблицы
Периодическая таблица – это организованное визуальное представление всей информации о 94 типах атомов (то есть элементов), аккуратно помещенное в таблицу данных.Каждый атом или элемент представлен символом, который дает информацию об атоме.
Здесь вы видите атомный символ в Периодической таблице углерода.
~ Атомный номер 6 (имеет 6 протонов)
~ Символ – C (для углерода, да).
~ Имя Углерод.
~ Средняя атомная масса 12.0107. Атомная масса – это протоны + нейтроны. У большинства атомов углерода 6 нейтронов, но у некоторых их больше. Таким образом, среднее количество нейтронов составляет 6,0 · 107. Итак, атомная масса 12,0107.Но для наших целей мы можем просто округлить до 12.
У большинства атомов углерода 6 нейтронов, но у некоторых их больше. Таким образом, среднее количество нейтронов составляет 6,0 · 107. Итак, атомная масса 12,0107.Но для наших целей мы можем просто округлить до 12.
Вот несколько периодических таблиц, которые вы можете увидеть в Интернете. Просмотрите эти диаграммы и ознакомьтесь с их информацией.
Простой цвет: http://go.hrw.com/resources/go_sc/periodic/SSHK1PER.PDF
Цвет: http://www.ktf-split.hr/periodni/download/en-color100.pdf
Черный и белый: http://www.ktf-split.hr/periodni/download/en-black.pdf
Подробнее о Периодической таблице (более тяжелые, большие атомы)
Периодическая таблица – это диаграмма, которая показывает возрастающее количество протонов с водородом (H) в верхнем левом углу в качестве первого элемента, потому что он имеет только 1 протон.Затем справа находится гелий (He), поскольку у него 2 протона. Затем вернитесь влево с литием (Li) с 3 протонами и так далее по таблице.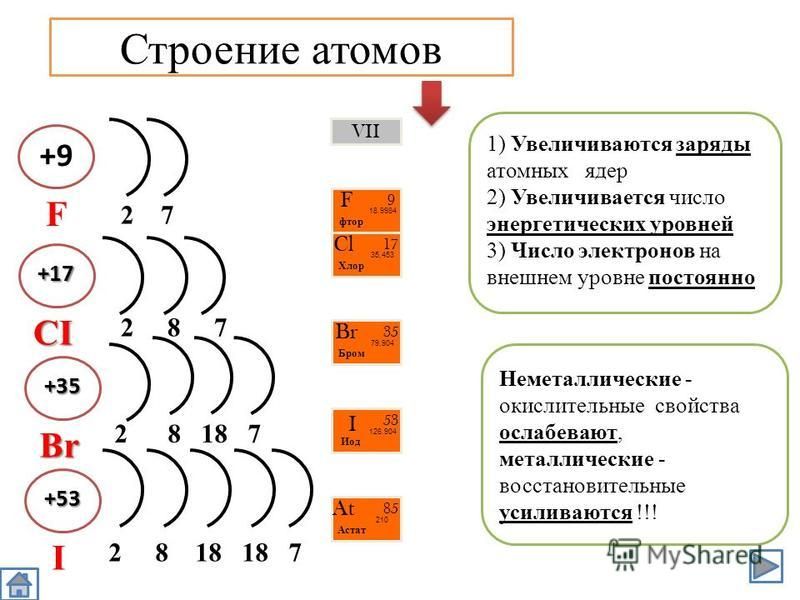
Обратите внимание на более крупные атомы, то есть атомы с большим количеством протонов и нейтронов расположены в нижней части таблицы. Эти «более тяжелые» элементы имеют большую массу на , то есть на частиц больше и буквально весят больше . У них также намного больше нейтронов, чем протонов. Правило состоит в том, что в целом у атома будет такое же количество нейтронов, как и у протонов, в основном применяется к меньшим атомам в первых 3 строках Периодической таблицы .
Тяжелый элемент борий (Bh) имеет 107 протонов, но его атомная масса равна 264. Итак, 264 – 107 = 157 нейтронов в среднем для атомов бория. Это много нейтронов и делает атом более массивным. Бориум и другие более тяжелые атомы определенно содержат больше нейтронов в ядре, чем протонов.
| Часть 3 – Материя, ионная и ковалентная связь (молекула и решетка) |
Дело
Когда одни и те же типы атомов объединяются, чтобы образовать вещество, материя называется элементом, потому что состоит только из одного типа атомов.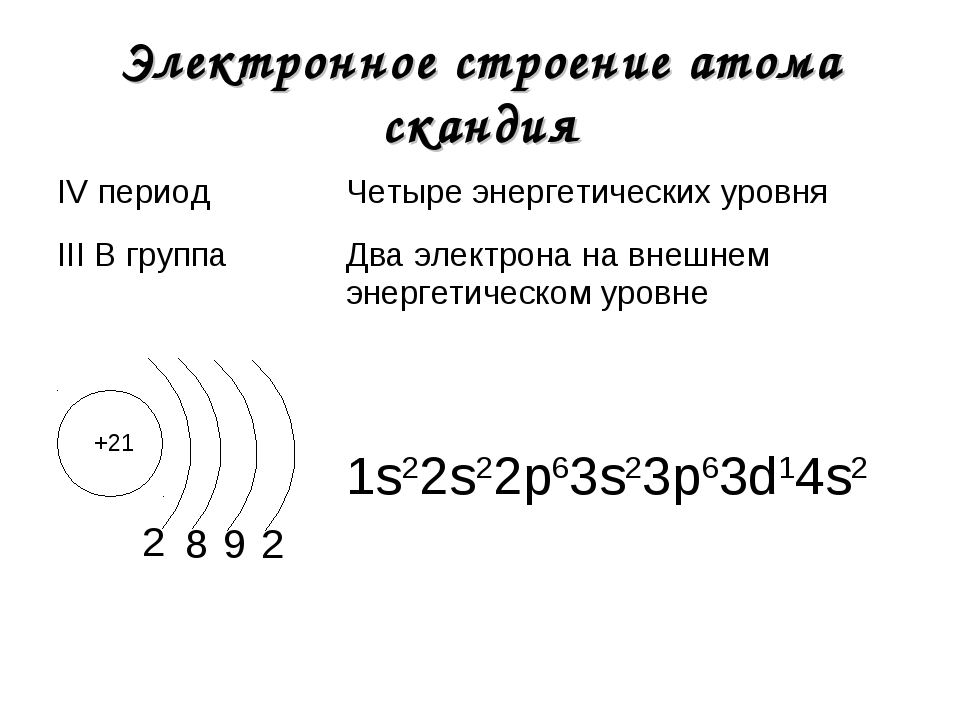 Но разные элементы могут объединяться вместе, образуя соединения.
Но разные элементы могут объединяться вместе, образуя соединения.
Соединения
Соединения – это вещества, которые образованы двумя или более типами элементов (атомов), которые объединяются для создания совершенно нового вещества, чем элементы, которые его составляют. Например, элемент хлор (Cl) может объединиться с элементом натрия (Na), и тогда будет создано новое вещество, поваренная соль (NaCl). Элемент кислород (газ) может соединиться с элементом водород (также газ), и тогда будет создано новое вещество – вода (h3O, жидкость).
Два типа связи атомов: ионная и ковалентная
Когда различные типы атомов объединяются (то есть связываются друг с другом), чтобы создать новое вещество, существует два типа связи атомов. Один называется ионной связью , а другой называется ковалентной связью .
Ковалентное связывание для воды; Внешние оболочки разделяют электроны
Ионная связь
Ионная связь – это положительные и отрицательные электрические заряды, притягивающие друг друга (аналогично тому, как северный и южный концы магнита притягивают друг друга).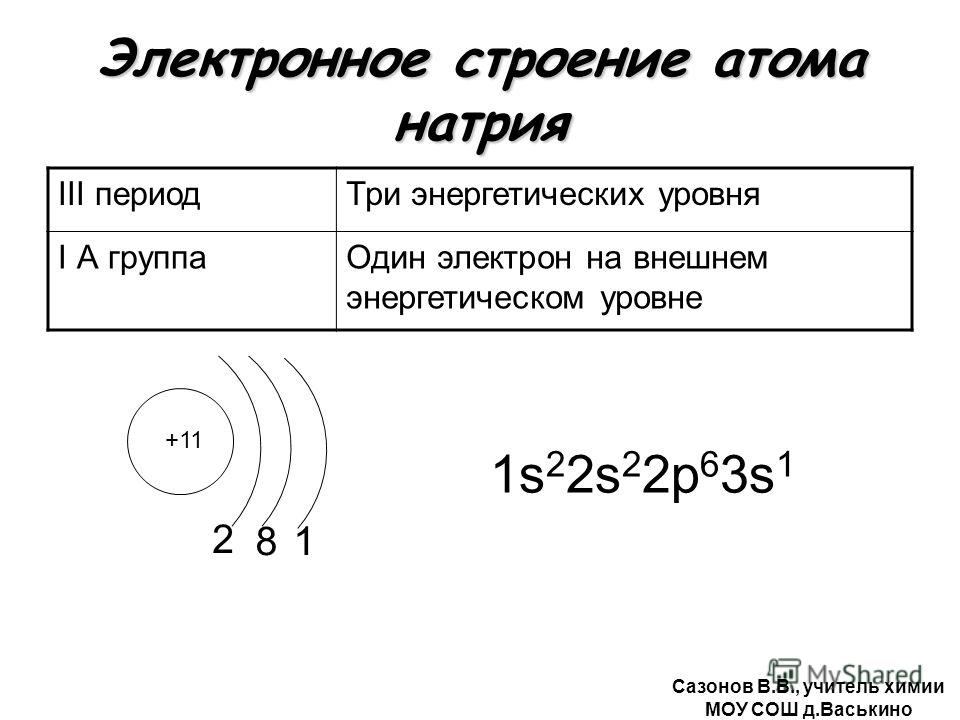
Ковалентная связь
Ковалентная связь – это самая внешняя оболочка электронов, разделяемая между другими атомами, которая является самой внешней оболочкой электронов. Молекулы воды являются примером ковалентной связи.
| Помните, ~ Ионная связь – это положительные и отрицательные ионы, притягивающие друг друга (как магниты). ~ Ковалентная связь – это две или более молекул, разделяющих одни и те же электроны. |
Ионы – это атомы, которые приобрели или потеряли электроны
Ион – это атом, который потерял или приобрел электроны, так что он больше не является нейтрально заряженным атомом.Например, атом кислорода может получить электрон и стать отрицательно заряженным атомом кислорода, потому что теперь у него на один отрицательный электрон больше, чем положительных протонов.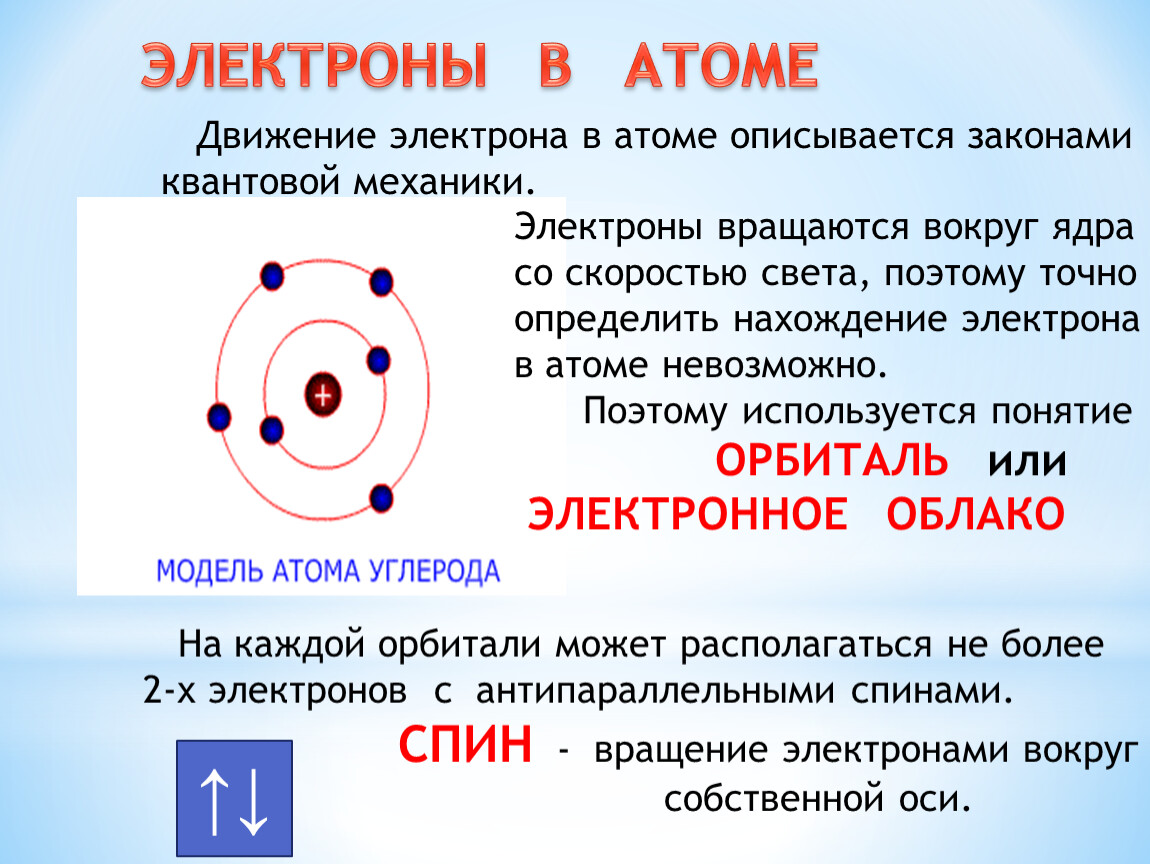
Или, если атом кислорода теряет электрон, он становится положительно заряженным ионом, потому что у него больше положительных протонов, чем отрицательных электронов.
Примеры молекул, образованных разными атомами
Молекулы
Молекулы – это группы атомов, связанных вместе, чтобы создать новый тип материи (то есть соединение).Молекулы образованы ковалентной связью (разделяя большинство внешних электронов) . Многие, но не все вещества создаются атомами, соединяющимися в молекулы.
Ионные атомы могут объединяться для создания соединений (Ионные связи).
Когда атомы приобретают или теряют электрон и, следовательно, становятся положительно или отрицательно заряженными, эти атомы могут притягиваться или связываться друг с другом. Отрицательно заряженные атомы притягиваются к положительно заряженным и наоборот. Таким образом, ионы могут связываться посредством притяжения.Например, отрицательно заряженные ионы хлора, притянутые к положительно заряженным ионам натрия, объединятся в поваренную соль.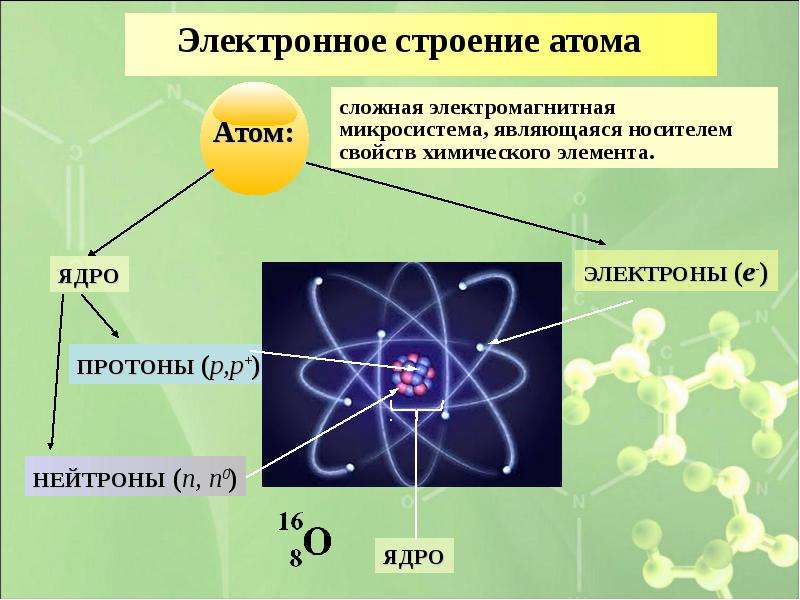
Ионная связь создает решетку (а не молекулы). Минералы имеют решетчатую структуру .
Ионная связь образует не молекулы, а скорее минеральное вещество.
Ковалентная связь образует молекулы. Ионная связь образует минералы. Минералы представляют собой комбинацию
различных типов элементов, которые связываются посредством положительно-отрицательного притяжения, а не путем образования молекул.
Структура решетки (также называемая матрицей), но не молекулы
Структура ионной связи называется решеткой или матрицей . Это повторяющаяся структура атомов, из которых состоят вещества. Ковалентное связывание формирует повторяющиеся молекулы, но ионное связывание формирует повторяющиеся решетчатые матрицы. В обоих случаях у вас есть много разных типов веществ, которые создаются связанными вместе атомами.
Смеси
Смесь веществ, без химической связи
Смеси (физические твердые частицы)
Когда различные соединения смешиваются вместе, получается смесь. Например, если вы взяли пакет соли и смешали его с пакетом перца, у вас получилась бы смесь соли и перца. Важным моментом здесь является то, что соль остается солью, а перец остается перцем, и никаких химических связей не происходит. Два типа веществ, соль и перец, просто смешиваются вместе, вот и все. Их можно было разделить.
Например, если вы взяли пакет соли и смешали его с пакетом перца, у вас получилась бы смесь соли и перца. Важным моментом здесь является то, что соль остается солью, а перец остается перцем, и никаких химических связей не происходит. Два типа веществ, соль и перец, просто смешиваются вместе, вот и все. Их можно было разделить.
Растворы – это частицы в жидкостях
В воде частицы могут быть очень маленькими; раствор
Растворы (частицы в жидкости)
Раствор – это раствор, примешанный к воде.Поскольку вода хорошо растворяет вещество, вещество в конечном итоге распадается на крошечные кусочки, которые не видны глазом. Эти крошечные кусочки подвешены в воде и могут быть невидимы или могут придавать воде цвет.
Например, если вы взяли сахар, налили его в банку с водой и перемешали воду, в конечном итоге, казалось бы, частицы сахара исчезнут, но, конечно, этого не произошло. Вместо этого сахар просто растворился в таких маленьких кусочках, что вы больше не можете их видеть. Пейте воду, она будет сладкой с сахаром. Это называется решением .
Пейте воду, она будет сладкой с сахаром. Это называется решением .
Четыре состояния материи
Вся материя обычно существует в 3 состояниях, хотя технически существует 4-е состояние материи:
твердое, жидкое, газообразное и плазменное . Вода – прекрасный пример трех состояний материи.
Вода, например, может быть льдом, , твердым телом, или водой, , жидкостью или паром в воздухе, , который находится в газообразном состоянии.
В твердых телах есть молекулы, расположенные близко друг к другу, что делает материю жесткой.У жидкостей есть молекулы, которые расположены дальше друг от друга и обладают большей энергией и, следовательно, более гибкими или текучими по свойствам. У газа есть молекулы, которые находятся далеко друг от друга и обладают еще большей энергией, поэтому он не имеет определенной формы и может расширяться в атмосферу.
Плазма – это настолько горячий газ, что атомы теряют часть своих электронов, которые перемещаются свободно и отделяются от атомов. Этот тип материи существует в звездах в космосе и на Земле в молниях и в лабораториях.
Этот тип материи существует в звездах в космосе и на Земле в молниях и в лабораториях.
ПЛАН УРОКА АТОМ – ПОЛНЫЙ УРОК НАУКИ С ИСПОЛЬЗОВАНИЕМ МЕТОДА ИНСТРУКЦИИ 5E
В конце этого плана урока по атомам студенты смогут описать структуру атомов, включая массы, электрические заряды и расположение протонов и нейтронов. , и электроны. Кроме того, студенты смогут определить, что протоны определяют идентичность элемента. Каждый урок разработан с использованием метода обучения 5E для обеспечения максимального понимания учащимися.
В следующем посте вы пройдете через все шаги и действия из плана урока по атомам.
ОБЯЗАТЕЛЬСТВО
Цель Введение
В начале урока класс выполняет «Подумай-попарно-поделись», чтобы обсудить цель.
Класс Деятельности
Задайте класс (используйте PowerPoint, чтобы показать вопросы):
- Какая самая маленькая часть материи?
- Что такое атом?
- Какие три основные части атома?
- Где в атоме расположены эти части?
- Что означает наличие у атомной частицы электрического заряда?
Деятельность учащихся
Используя шаблон модели Бора, включая PowerPoint, и леденцы трех разных цветов, попросите учащихся создать модели этих атомов.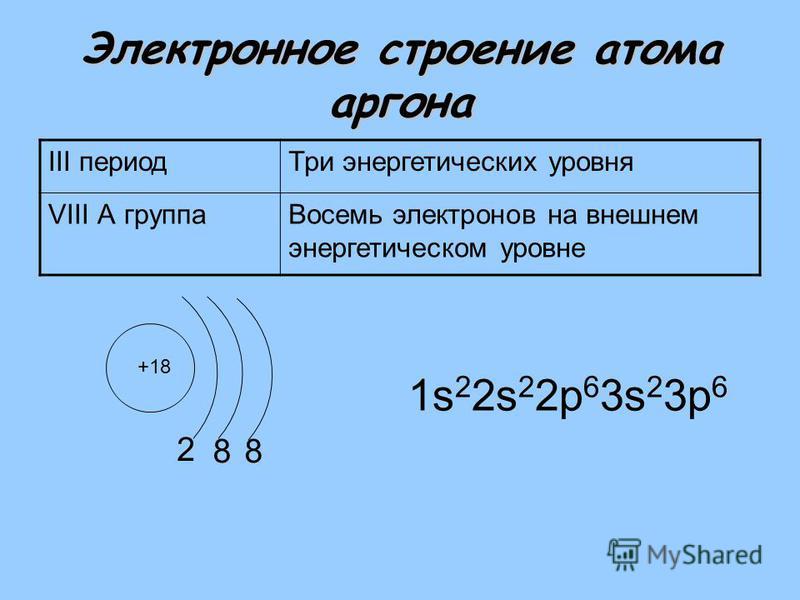 Назначьте код для протонов, нейтронов и электронов:
Назначьте код для протонов, нейтронов и электронов:
- Водород
- Гелий
- Литий
- Бериллий
- Бор – (Дебил)
По мере работы с этими моделями атомов попросите учащихся начать замечать какие-либо закономерности. Также введите атомную массу. Студенты будут практиковаться во время лабораторной работы на станции, так что это нормально, если они не уверены после этого задания.
Учитель поможет развеять любые заблуждения об атомах.Основное заблуждение состоит в том, что студенты могут думать, что атомы двумерны, используя эту модель.
Расчетное время занятий для помолвки: 20-30 минут
РАЗВЕДКА
Эта лабораторная станция, ориентированная на студентов, создана для того, чтобы студенты могли начать изучение кислот и оснований. Четыре станции считаются входными станциями, где учащиеся изучают новую информацию о естественном отборе, а четыре станции являются выходными станциями, где учащиеся будут демонстрировать свое мастерство входных станций. Каждая из станций отличается, чтобы бросить вызов студентам, использующим разный стиль обучения. Вы можете узнать больше о том, как я организовал лаборатории станции здесь.
Каждая из станций отличается, чтобы бросить вызов студентам, использующим разный стиль обучения. Вы можете узнать больше о том, как я организовал лаборатории станции здесь.
УЗНАЙТЕ ЭТО!
Студенты будут работать в парах над созданием моделей атомов с использованием шаблона Бора. Студенты должны будут следовать указаниям на карточках с заданиями и с помощью маленьких квадратов, которые представляют субатомные частицы (протоны, нейтроны и электроны), создают определенные атомы. Карты также проинформируют учащихся о зарядах каждой субатомной частицы.
ПОСМОТРИТЕ!
На этой станции студенты будут смотреть видео с описанием атомов. Затем студенты ответят на некоторые вопросы, относящиеся к видео, и запишут свои ответы на листах лабораторных станций. Например, что такое атом? Что находится в центре атома? Какие две субатомные частицы составляют центр атома? Какой заряд у протонов, нейтронов, и электронов ?
ИССЛЕДУЙТЕ ЭТО!
Исследовательская станция позволит студентам взаимодействовать с создателем виртуального атома с помощью веб-сайта PhET. Учащиеся будут следовать указаниям на карточках с заданиями для создания атомов на основе указанного числа протонов, нейтронов и электронов. Студентам нужно будет построить и идентифицировать атом. По мере того, как ученики строят случайный атом, они обнаруживают, какая субатомная частица определяет идентичность атома.
Учащиеся будут следовать указаниям на карточках с заданиями для создания атомов на основе указанного числа протонов, нейтронов и электронов. Студентам нужно будет построить и идентифицировать атом. По мере того, как ученики строят случайный атом, они обнаруживают, какая субатомная частица определяет идентичность атома.
ПРОЧИТАЙТЕ!
Эта станция предоставит студентам одну страницу для чтения об атомной структуре. В ходе чтения студенты узнают, что атом является самой маленькой единицей материи.Они узнают об основной структуре атома. Студенты узнают о зарядах каждой из частей, протонах, нейтронах, электронах. Учащиеся ответят на 4 дополнительных вопроса, чтобы продемонстрировать понимание прочитанного по предмету.
ОЦЕНИТЬ!
На этапе оценивания учащиеся проходят, чтобы доказать свое мастерство в концепциях, которые они изучали в лаборатории. Вопросы составлены в стандартизированном формате с несколькими вариантами ответов. Студентам будет задано несколько вопросов: Определите правильное утверждение из 4-х четырех вариантов, которые говорят об атомах.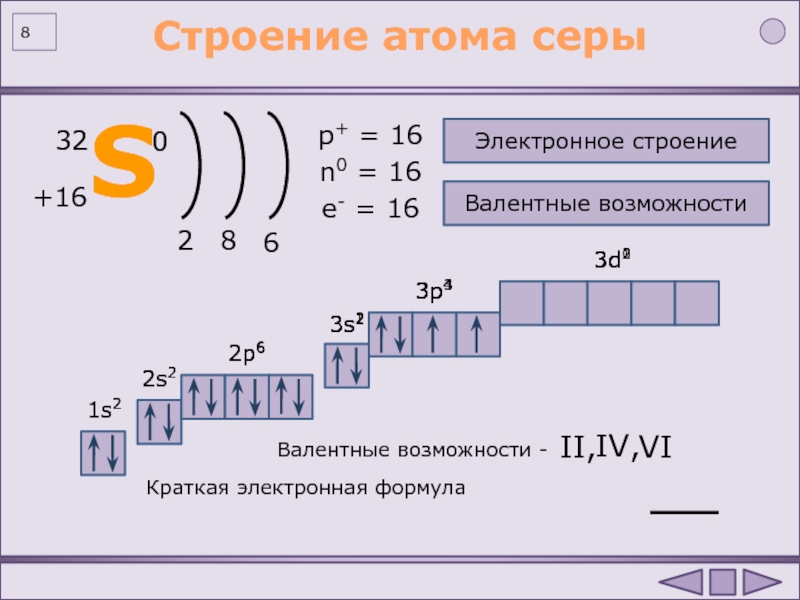 Какова роль электронов в атоме? Какие из следующих субатомных частиц определяют идентичность атома? Сколько электронов в литии?
Какова роль электронов в атоме? Какие из следующих субатомных частиц определяют идентичность атома? Сколько электронов в литии?
НАПИШИТЕ!
Студенты, которые могут ответить на открытые вопросы о лаборатории, действительно понимают изучаемые концепции. На этой станции студенты будут отвечать на три карточки с заданиями, чтобы объяснить разницу между протонами, нейтронами и электронами. Опишите ядро атома. Какая субатомная частица определяет идентичность атома?
ИЛЛЮСТРИРУЙТЕ ЭТО!
Вашим ученикам-наставникам понравится эта станция.Студенты воссоздают атом кислорода на своем лабораторном листе. Затем ученики должны будут маркировать все, что связано с их моделью.
ОРГАНИЗУЙТЕ ЭТО!
Станция «Организуйте ит» позволяет вашим ученикам размещать карточки в нужном столбце и строке, которые описывают расположение, заряд и размер протонов, нейтронов и электронов.
Расчетное время занятий для исследования: 1-2, 45-минутные периоды занятий
ПОЯСНЕНИЕ
Действия по объяснению станут намного более интересными для класса после того, как они завершат лабораторию на исследовательской станции.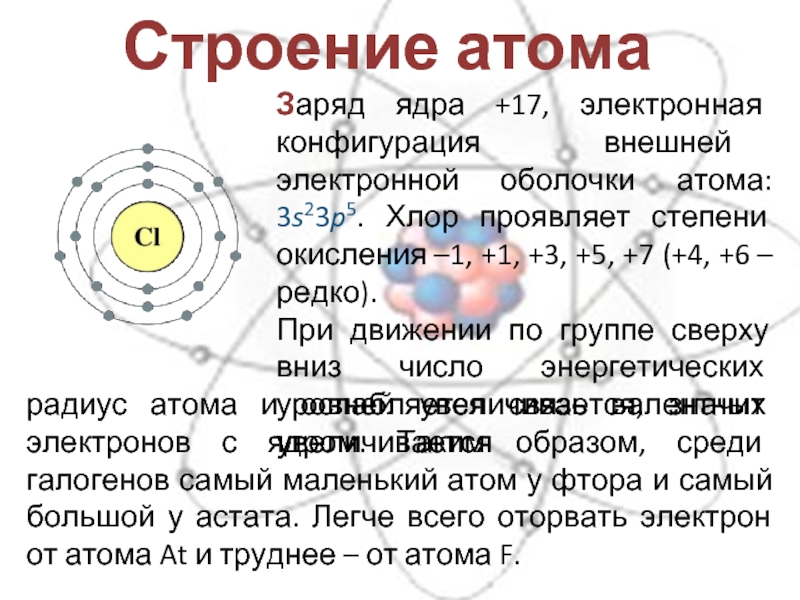 Во время объяснения учитель разъяснит любые неправильные представления об атомах с помощью интерактивного PowerPoint, якорных диаграмм и интерактивных занятий с записной книжкой.
Во время объяснения учитель разъяснит любые неправильные представления об атомах с помощью интерактивного PowerPoint, якорных диаграмм и интерактивных занятий с записной книжкой.
Урок по атомам включает в себя презентацию в формате PowerPoint с разбросанными по ней упражнениями, чтобы учащиеся были вовлечены.
Студенты также будут взаимодействовать со своими журналами, используя шаблоны INB для атомов. Каждое мероприятие INB предназначено для помощи студентам в разделении информации для лучшего понимания концепции.Шаблоны INB атомов позволяют студентам сосредоточить свои заметки на идентификации описаний и зарядов каждой субатомной частицы. Кроме того, шаблоны INB помогут учащимся понять информацию, представленную на химическом символе, и как определить атомную массу и количество протонов и электронов по символу, используя аббревиатуры APE-MAN.
Расчетное время занятий для исследования: 2-3 часа, 45 минут занятий
РАЗРАБОТКА
Раздел, посвященный описанию метода обучения 5E, предназначен для того, чтобы дать учащимся возможность выбрать, как они могут подтвердить свое владение концепцией. Когда ученикам предоставляется выбор, их «участие» намного больше, чем когда учитель говорит им о проекте, который им предстоит создать. Проект разработки позволит студентам создать презентацию об атомах.
Когда ученикам предоставляется выбор, их «участие» намного больше, чем когда учитель говорит им о проекте, который им предстоит создать. Проект разработки позволит студентам создать презентацию об атомах.
Расчетное время занятий на проработку: 2–3 урока по 45 минут (также можно использовать в качестве домашнего проекта)
ОЦЕНКА
Последняя часть модели 5E – оценка понимания учащимися. В каждый урок 5E входит домашнее задание, оценка и модифицированная оценка.Исследования показали, что домашнее задание должно быть значимым и применимым к реальной деятельности, чтобы быть эффективным. Когда это возможно, мне нравится давать открытые оценки, чтобы по-настоящему оценить понимание учащимся.
Расчетное время в классе для оценки: 1, 45 минут урока
СКАЧАТЬ ПОЛНЫЙ УРОК СЕЙЧАС
Полную версию урока можно загрузить в моем магазине TpT. Сэкономьте кучу времени и возьмите его сейчас.
атомов – что это такое? Что внутри них?
Атомы – что это такое? Что внутри них? – Объясни это Реклама org/Person”> Криса Вудфорда.Последнее изменение: 8 октября 2021 г.Предположим, вам пришлось построить себе мир, в точности похожий на тот, в котором мы живем. Где бы ты начинаешь? Вам понадобятся люди … машины … дома … животные … деревья … и миллиарды других вещей. Но если бы у вас было несколько десятков разных типа atom , вы могли бы построить все это и многое другое: вы бы просто соединять атомы вместе разными способами. Атомы крошечные строительные блоки, из которых построено все вокруг нас. Это Удивительно думать, что из атомов можно сделать что угодно, от змеи до океанский лайнер – но это абсолютная правда! Давай ближе Посмотрите.
Иллюстрации: От волос на голове до футболки на спине – все в мире состоит из атомов.
На этой иллюстрации я сильно преувеличил их размер. На моем экране каждая из атомных красных точек
примерно в 10 миллионов раз больше обычного атома.
(Ваш экран может быть больше или меньше моего или масштабироваться иначе, поэтому
примите это как очень грубое приближение.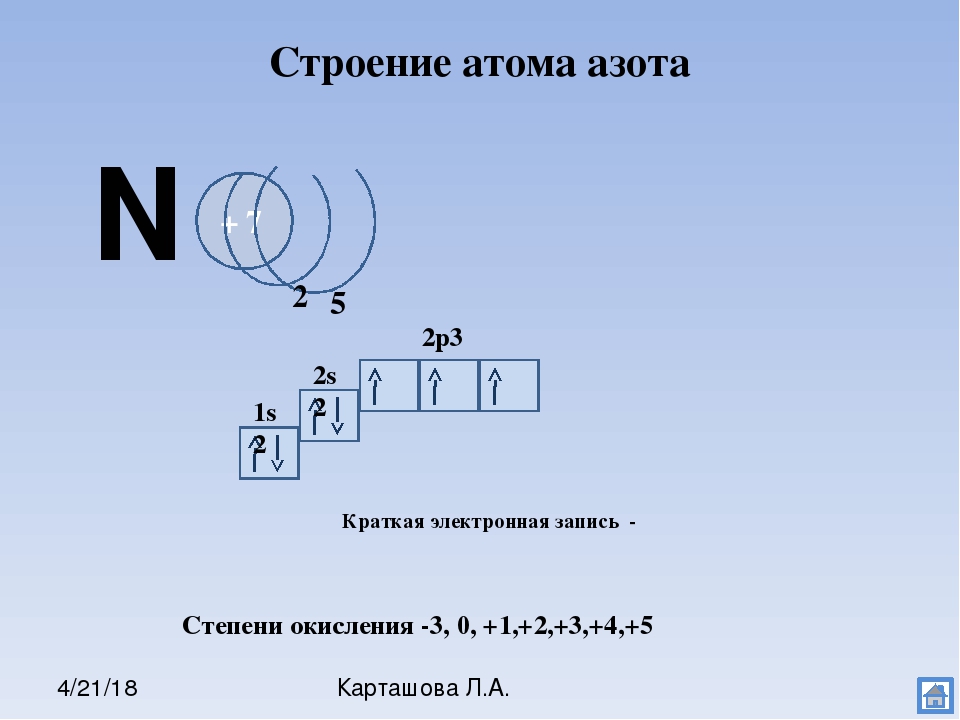 )
)
Что такое атом?
Разобрать что угодно и вы найдете что-то меньшее внутри.Внутри машин есть двигатели, косточки внутри яблок, сердца и легкие внутри людей, а также начинка внутри плюшевых мишек. Но что произойдет, если вы продолжите идти? Если вы сохраните разбирая вещи по частям, вы в конечном итоге обнаружите, что все имеют значение (все “вещи”, которые нас окружают) сделано из различные виды атомов. Например, живые существа в основном состоят из атомов. углерод, водород и кислород. Это всего три из более чем 100 химических элементов , которые есть у ученых обнаруженный.Другой элементы включают металлы, такие как медь, олово, железо и золото и газы как водород и гелий. Вы можете сделать практически все, что можете подумайте о соединении атомов разных элементов вместе, как крошечные LEGO® блоки.
Фото: Как выглядит атом? Вы можете увидеть его, если у вас есть
нужный микроскоп или фотоаппарат! На этом фото изображены атомы стронция. “летать” в кубе, стимулируясь при этом точным лазерным светом.
Предоставлено Национальным институтом стандартов и технологий (NIST).
“летать” в кубе, стимулируясь при этом точным лазерным светом.
Предоставлено Национальным институтом стандартов и технологий (NIST).
Атом самый маленький
возможное количество химического элемента – таким образом, атом золота является
наименьшее количество золота, которое вы можете иметь. По малому, я действительно
имею в виду абсолютно, наноскопически
крошечный: один атом
в сотни тысяч раз тоньше человеческого волоса, поэтому у вас нет абсолютно никаких
шанс когда-либо увидеть его, если у вас нет невероятно мощного
электронный микроскоп. В древности
раз, люди думали, что атомы
были самыми маленькими вещами в мире. Фактически, слово
атом происходит от греческого слова, означающего что-то, что не может быть разделено
дальше.Сегодня мы знаем, что это неправда. Теоретически, если бы у вас был нож
маленький и достаточно острый, вы могли бы расколоть атом золота на куски, и вы бы
найти внутри более мелкие вещи. Но тогда у тебя больше не было бы золота:
у тебя бы просто были биты. Все атомы состоят из одних и тех же битов,
которые называются субатомными частицами («субатомные»
означает меньше чем и это частицы меньше чем атомы). Так что если ты нарезал
атом железа и сложить куски в кучу, а затем измельчить
атом золота, и положите эти кусочки во вторую кучу, вы получите
две груды очень похожих бит – но не было бы ни железа, ни золота
левый.
Так что если ты нарезал
атом железа и сложить куски в кучу, а затем измельчить
атом золота, и положите эти кусочки во вторую кучу, вы получите
две груды очень похожих бит – но не было бы ни железа, ни золота
левый.
Какие части атома?
Большинство атомов имеют три
внутри них разные субатомные частицы: протонов , нейтронов ,
и электронов . Протоны и нейтроны равны
упакованы вместе
в центр атома (который называется ядром )
и электроны, которые намного меньше, кружатся вокруг
за пределами. Когда люди рисуют атомы, они показывают электроны.
как спутники, вращающиеся вокруг Земли на орбитах.По факту,
электроны движутся так быстро, что мы никогда не знаем точно, где они
от одного момента к другому. Представьте их как сверхбыстрые гоночные автомобили
движутся так невероятно быстро, что превращаются в расплывчатые
облака – они
почти везде одновременно. Вот почему вы увидите некоторые
книги рисуют электроны внутри нечетких областей, называемых орбиталями .
Работа: атомы содержат протоны и нейтроны, упакованные в центральную область, называемую ядром, в то время как электроны занимают пространство вокруг него.В простых описаниях атома мы часто говорим об электронах, “вращающихся вокруг” ядра как планеты, вращающиеся вокруг Солнца, или спутники, вращающиеся вокруг Земли, хотя это огромное упрощение. Также обратите внимание, что это изображение нарисовано не в масштабе! Большая часть атома – это пустое пространство. Если бы атом был размером с бейсбольный стадион, ядро было бы размером с горошину в самом центре, а электроны были бы где-то на внешнем крае.
Что отличает атом золота от атома железа, так это количество протонов,
нейтроны и электроны внутри него.Разрежьте один атом железа
и вы найдете 26 протонов и 30 нейтронов, сгруппированных вместе в
ядро и 26 электронов, носящихся снаружи. Атом золота
больше и тяжелее. Откройте его, и вы найдете 79 протонов и
118 нейтронов в ядре и 79 электронов, вращающихся по краю.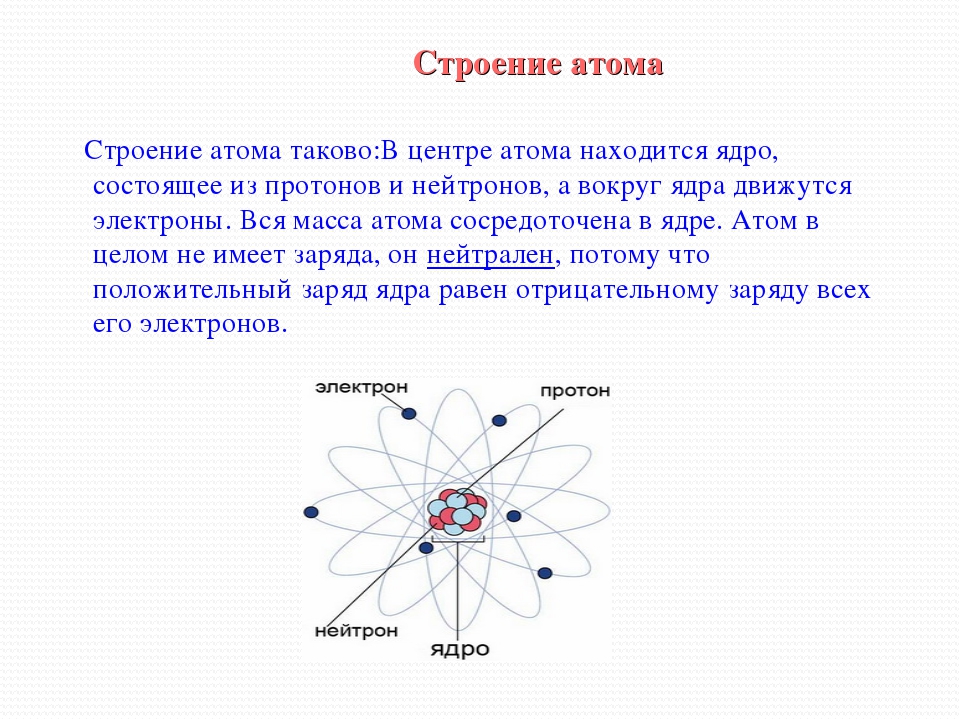 Протоны, нейтроны и электроны в атомах железа и золота равны
одинаковые – их просто разное количество. В теории,
вы можете превратить железо в золото, взяв атомы железа и добавив 53 протона,
88 нейтронов и 53 электрона каждому.Но если бы это было так просто, как
звучит, можно поспорить, что все химики мира были бы очень богаты
верно!
Протоны, нейтроны и электроны в атомах железа и золота равны
одинаковые – их просто разное количество. В теории,
вы можете превратить железо в золото, взяв атомы железа и добавив 53 протона,
88 нейтронов и 53 электрона каждому.Но если бы это было так просто, как
звучит, можно поспорить, что все химики мира были бы очень богаты
верно!
Но предположим, что вы может очень просто превращать атомы в другие атомы. Как бы вы сделали первые несколько химических элементов? Вы бы начали с самого простого атома, водород (символ H), который имеет один протон и один электрон, но не нейтроны. Если вы добавляете еще один протон, еще один электрон и два нейтрона, вы получаете атом гелия (символ He). Добавьте еще протон, еще один электрон, и два больше нейтронов, и у вас будет атом металлического лития (символ Ли).Добавьте один протон, один нейтрон и один электрон, и вы получите атом. бериллия (символ Ве).
Смотри как
оно работает? Во всех атомах количество протонов и количество
электроны всегда одинаковы. Итак, у азота 7 протонов и 7 электронов,
кальций имеет 20 протонов и 20 электронов, а олово имеет 50 протонов и
50 электронов.
Количество нейтронов очень приблизительно
столько же, сколько протонов, но иногда и больше.
Итак, бром имеет 35 протонов и 35 электронов, но 45 нейтронов.Платина имеет 78 нейтронов, 78 электронов и 117 нейтронов.
Число протонов в атоме называется атомный номер , и он говорит вам, какой у вас тип атома. Атомный номер 1
означает, что атом является водородом, атомный номер 2 означает гелий, 3 означает
литий, 4 – бериллий и так далее. Общее количество протонов и
сумма нейтронов называется относительной атомной массой .
Относительная атомная масса водорода равна 1, а относительная атомная масса гелия
атомная масса равна 4 (потому что есть два протона и два нейтрона
внутри).Другими словами, атом гелия в четыре раза тяжелее, чем
атом водорода, а атом бериллия в девять раз тяжелее.
Итак, у азота 7 протонов и 7 электронов,
кальций имеет 20 протонов и 20 электронов, а олово имеет 50 протонов и
50 электронов.
Количество нейтронов очень приблизительно
столько же, сколько протонов, но иногда и больше.
Итак, бром имеет 35 протонов и 35 электронов, но 45 нейтронов.Платина имеет 78 нейтронов, 78 электронов и 117 нейтронов.
Число протонов в атоме называется атомный номер , и он говорит вам, какой у вас тип атома. Атомный номер 1
означает, что атом является водородом, атомный номер 2 означает гелий, 3 означает
литий, 4 – бериллий и так далее. Общее количество протонов и
сумма нейтронов называется относительной атомной массой .
Относительная атомная масса водорода равна 1, а относительная атомная масса гелия
атомная масса равна 4 (потому что есть два протона и два нейтрона
внутри).Другими словами, атом гелия в четыре раза тяжелее, чем
атом водорода, а атом бериллия в девять раз тяжелее.
Что такое Периодическая таблица?
Предположим, вы составляете список химических элементов в порядке их атомного номера (количества протонов), начиная с водорода (H). Вы обнаружите, что элементы со схожими химическими свойствами (как они реагируют с вещами) и физическими свойствами (будь то металлы или неметаллы, как они проводят тепло и электричество и т. Д.) Появляются через регулярные промежутки времени – периодически , другими словами.Если вы перегруппируете свой список в таблицу так, чтобы похожие атомы располагались друг под другом, вы получите диаграмму, подобную этой, которая называется Периодической таблицей . Столбцы называются группами, а строки – точками.
Вы обнаружите, что элементы со схожими химическими свойствами (как они реагируют с вещами) и физическими свойствами (будь то металлы или неметаллы, как они проводят тепло и электричество и т. Д.) Появляются через регулярные промежутки времени – периодически , другими словами.Если вы перегруппируете свой список в таблицу так, чтобы похожие атомы располагались друг под другом, вы получите диаграмму, подобную этой, которая называется Периодической таблицей . Столбцы называются группами, а строки – точками.
Работа: Периодическая таблица элементов.
И что? Атомы в определенной группе (столбце) имеют похожие свойства. Так, например, красный столбец справа содержит благородные газы (гелий, неон, аргон, криптон и т. Д.), Которые относительно инертны.Розовый столбец слева содержит щелочные металлы (литий, натрий, калий и т. Д.), Которые являются относительно химически активными металлами (вы, вероятно, знаете, что некоторые из них бурно реагируют с водой, например, с образованием взрывоопасного газообразного водорода).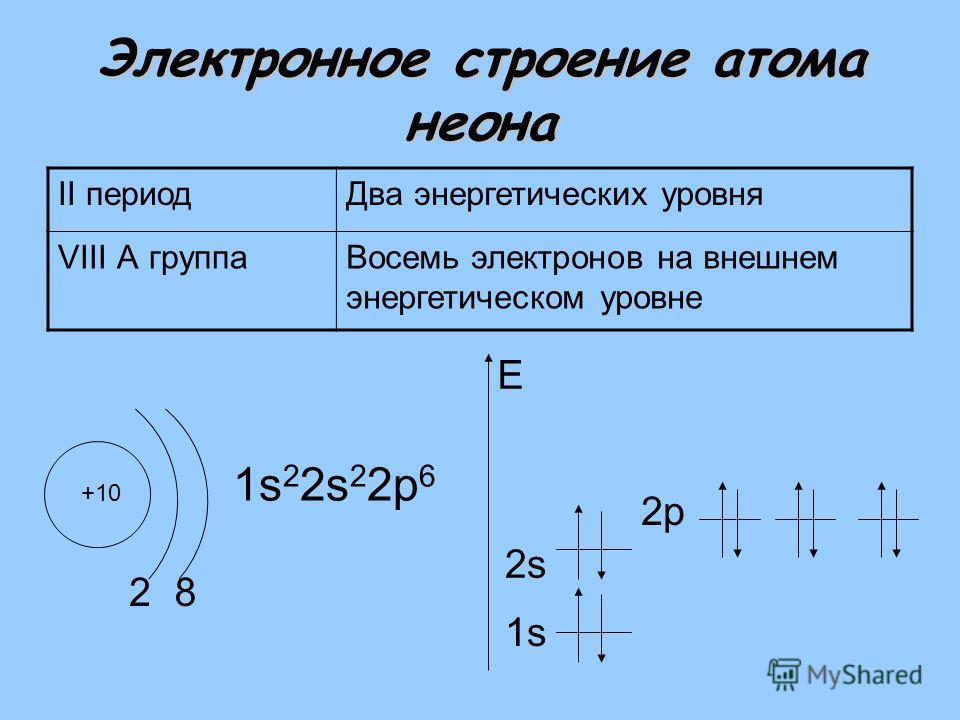 Если вы знаете, где находится определенный элемент в таблице, и немного знаете о свойствах элементов вверху, внизу и с обеих сторон, вы часто можете выяснить, какими будут свойства этого элемента.
Если вы знаете, где находится определенный элемент в таблице, и немного знаете о свойствах элементов вверху, внизу и с обеих сторон, вы часто можете выяснить, какими будут свойства этого элемента.
Как атомы образуют молекулы и соединения?
Атомы немного похожи люди: они обычно предпочитают компанию одиночеству.Много атомов предпочитают соединяться с другими атомами, потому что они более стабильны, чем способ. Таким образом, атомы водорода не существуют сами по себе: вместо этого они образуют пару. до того, что называется молекулой водород. Молекула – наименьшее количество соединения : a вещество, состоящее из двух или более атомов.
Некоторых сбивают с толку молекулы и соединения. Вот как
помните разницу. Если вы присоединитесь к двум
различные химические элементы вместе, часто можно полностью
новое вещество.Приклейте два атома водорода к
атом кислорода, и вы получите одну молекулу воды.
Вода – это соединение (потому что это два разных химических элемента, соединенных
вместе), но это также и молекула, потому что она образована путем объединения
атомы. Способ запоминания такой: соединения – это элементы.
соединены вместе, а молекулы – это атомы, соединенные вместе.
Способ запоминания такой: соединения – это элементы.
соединены вместе, а молекулы – это атомы, соединенные вместе.
Не все молекулы такие маленькие и простые, как вода. Молекулы пластмассы, например, могут быть сделаны из сотен или даже тысяч отдельных Атомы, соединенные вместе в невероятно длинные цепи, называются полимерами .Полиэтилен (также называемый полиэтиленом или полиэтиленом) – очень простой пример этого. Это полимер, полученный путем повторения базовой единицы, называемой мономером . снова и снова – точно так же, как поезд с углем, составленный из любого количества идентичных грузовиков, один за другим:
Что такое изотопы?
Чтобы усложнить
более того, мы иногда находим атомы химического элемента, которые являются
немного отличается от того, что мы ожидаем. Возьмем, к примеру, углерод. В
обыкновенный углерод, который мы находим в окружающем нас мире, иногда называют
углерод-12.В нем шесть протонов, шесть электронов и шесть нейтронов, поэтому
его атомный номер равен 6, а его относительная атомная масса равна 12. Но
есть еще одна форма углерода, называемая углерод-14, шесть
протоны, шесть электронов и восемь нейтронов. У него все еще есть атомный
число шесть, но его относительная атомная масса равна 14. Углерод-14 больше
нестабилен, чем углерод-12, поэтому он радиоактивен :
это естественно
распадается, выделяя в процессе субатомные частицы, чтобы превратить
в азот. Углерод-12 и углерод-14 называются изотопов углерода.Изотоп – это просто атом с другим числом
нейтроны, которые мы обычно ожидаем найти.
Но
есть еще одна форма углерода, называемая углерод-14, шесть
протоны, шесть электронов и восемь нейтронов. У него все еще есть атомный
число шесть, но его относительная атомная масса равна 14. Углерод-14 больше
нестабилен, чем углерод-12, поэтому он радиоактивен :
это естественно
распадается, выделяя в процессе субатомные частицы, чтобы превратить
в азот. Углерод-12 и углерод-14 называются изотопов углерода.Изотоп – это просто атом с другим числом
нейтроны, которые мы обычно ожидаем найти.
Как атомы образуют ионы?
Атомы – это не просто пакеты материи: они также содержат электрическую энергию. Каждый протон в
ядро атома имеет крошечный положительный заряд (электричество, которое остается в
одно место).
Мы говорим, что у него есть заряд +1, чтобы все было просто
(на самом деле заряд протона – длинное и сложное число: +0.00000000000000000016021892 C, чтобы быть
точный!).У нейтронов вообще нет заряда.
Это означает, что ядро атома представляет собой большую группу
положительный заряд. Электрон крошечный по сравнению с протоном, но у него точно такие же
сумма заряда. Фактически, электроны имеют заряд, противоположный
протонов (заряд −1 или −0,00000000000000000016021892 C, чтобы быть
абсолютно точно). Итак, протоны и электроны немного похожи на
два разных конца батареи: у них одинаковые и противоположные
электрические заряды. Поскольку в атоме одинаковое количество протонов и
электронов, у него нет общего заряда: положительные заряды на всех
протоны точно уравновешиваются отрицательными зарядами на всех
электроны.Но иногда атом может получить или потерять электрон, чтобы
стать тем, что называется ion . Если он получит
электрон, он имеет
немного слишком много отрицательного заряда, и мы называем это отрицательным ионом; Это
он теряет электрон, он становится положительным ионом.
Электрон крошечный по сравнению с протоном, но у него точно такие же
сумма заряда. Фактически, электроны имеют заряд, противоположный
протонов (заряд −1 или −0,00000000000000000016021892 C, чтобы быть
абсолютно точно). Итак, протоны и электроны немного похожи на
два разных конца батареи: у них одинаковые и противоположные
электрические заряды. Поскольку в атоме одинаковое количество протонов и
электронов, у него нет общего заряда: положительные заряды на всех
протоны точно уравновешиваются отрицательными зарядами на всех
электроны.Но иногда атом может получить или потерять электрон, чтобы
стать тем, что называется ion . Если он получит
электрон, он имеет
немного слишком много отрицательного заряда, и мы называем это отрицательным ионом; Это
он теряет электрон, он становится положительным ионом.
Иллюстрация: Атом лития (Li) образует положительный ион (Li +), «теряя» электрон. Атом фтора (F) образует отрицательный ион (F -), приобретая электрон.
Что такого хорошего в
ионы? Они очень важны во многих химических реакциях. За
Например, обычная поваренная соль (имеющая химическое название натриевая
хлорид) образуется, когда ионы натрия соединяются вместе с ионами, образующими
из хлора (которые называются хлорид-ионами). Ион натрия производится
когда атом натрия теряет
электрон и становится положительно заряженным. Хлорид-ион образуется в
наоборот, когда атом хлора получает электрон, чтобы стать
отрицательно заряженный. Так же, как два противоположных полюса магнита, положительный и
отрицательные заряды притягиваются друг к другу. Итак, каждый положительно заряжен
Ион натрия прикрепляется к отрицательно заряженному хлорид-иону, образуя
одиночная молекула хлорида натрия.Когда соединения образуются через два
или несколько ионов, соединяющихся вместе, мы называем это ионная связь . Таким образом образует свои соединения большинство металлов.
За
Например, обычная поваренная соль (имеющая химическое название натриевая
хлорид) образуется, когда ионы натрия соединяются вместе с ионами, образующими
из хлора (которые называются хлорид-ионами). Ион натрия производится
когда атом натрия теряет
электрон и становится положительно заряженным. Хлорид-ион образуется в
наоборот, когда атом хлора получает электрон, чтобы стать
отрицательно заряженный. Так же, как два противоположных полюса магнита, положительный и
отрицательные заряды притягиваются друг к другу. Итак, каждый положительно заряжен
Ион натрия прикрепляется к отрицательно заряженному хлорид-иону, образуя
одиночная молекула хлорида натрия.Когда соединения образуются через два
или несколько ионов, соединяющихся вместе, мы называем это ионная связь . Таким образом образует свои соединения большинство металлов.
Электрический заряд, которым обладают ионы, может быть полезен во всех отношениях. Ионы (а также
электроны) помогают проводить электричество через
батарейки при их подключении в цепь.
Сколько атомов в чем-то?
Если атомы такие крошечные, их должно быть бесчисленное количество миллиардов во всех вещах вокруг. нас… а сколько их, ровно ?
У химиков есть удобный способ определить количество этих огромных количеств атомов, используя довольно необычное слово крот. моль чего-то (чего угодно) содержит ровно 6,022 × 10 23 частиц, что является коротким способом сказать 602,200,000,000,000,000,000,000 или 602 миллиардов триллионов. Эта странная сумма называется числом Авогадро (или постоянной Авогадро). в честь итальянского химика Амедео Авогадро (1776–1856), который придумал эту идею.Первоначальная гипотеза Авогадро заключалась в том, что определенный объем любого газа будет содержать такое же количество молекул. как один и тот же объем любого другого газа, при условии, что оба газа имеют одинаковую температуру и давление.
Так сколько стоит родинка? Когда мы говорим об атомах, моль – это
относительная атомная масса в граммах. Итак, моль углерода составляет 12 г, потому что углерод
относительная атомная масса равна 12, и она содержит 620 миллиардов триллионов атомов.
Моль алюминия составляет 27 г, потому что относительная атомная масса алюминия равна 27.Моль алюминия также содержит 620 миллиардов триллионов атомов.
Итак, моль углерода составляет 12 г, потому что углерод
относительная атомная масса равна 12, и она содержит 620 миллиардов триллионов атомов.
Моль алюминия составляет 27 г, потому что относительная атомная масса алюминия равна 27.Моль алюминия также содержит 620 миллиардов триллионов атомов.
Мы также можем использовать родинки, чтобы говорить о молекулах. Моль соединения содержит 602 миллиарда триллионов молекул. Молекула воды имеет относительную молекулярную массу 18 (это 16 для атома кислорода плюс два атома водорода, что составляет 18). Моль воды весит 18 г и содержит 620 миллиардов триллионов молекул.
Фото: моль любого вещества содержит такое же количество элементарных
частицы (атомы, молекулы, ионы, электроны или что-то еще).Здесь вы можете увидеть 18 г воды,
12 г углерода, 63 г меди и 27 г алюминия. Каждый из них является кротом и содержит 602 миллиарда.
триллион атомов (или молекул, в случае воды). Фото любезно предоставлено
Цифровые коллекции Национального института стандартов и технологий, Гейтерсбург, Мэриленд 20899.
Откуда мы знаем, что атомы существуют?
Работа: Молекулы состоят из атомов: в начале 19 века английский химик Джон Дальтон (1766–1844) понял, что атомы соединяются в простые соотношения.Вода образуется, когда два атома водорода соединяются с одним кислородом. Подобные химические реакции имеет смысл, если элементы существуют как простые строительные блоки: другими словами, атомы.
Если мы не видим атомы, как мы узнаем, что они там? Это очень хороший вопрос! Наука основана на доказательствах, так какие у нас есть доказательства того, что атомы действительно существуют? Он бывает разных форм:
- Химики давно знают, что когда мы объединяем разные элементы в химических реакциях,
ингредиенты соединяются в простых пропорциях.Так, например, в воде мы знаем, что там
в два раза больше атомов водорода, чем атомов кислорода (h3O), что делает
соотношение 2: 1. В соли (хлориде натрия) одинаковое количество атомов натрия и хлора (NaCl),
поэтому соотношение 1: 1.
 Мы можем легко объяснить это, если химические элементы действительно существуют как
простые частицы (другими словами, атомы), которые соединяются, как строительные блоки.
Мы можем легко объяснить это, если химические элементы действительно существуют как
простые частицы (другими словами, атомы), которые соединяются, как строительные блоки. - Некоторые вещества радиоактивны: они естественным образом расщепляются на более простые вещества и выделяют крошечные частицы или энергия в процессе.Опять же, это имеет смысл, если атомы существуют и построены от более мелких частиц (протонов, нейтронов и электронов).
- Ученые могут разбивать большие атомы на более мелкие. В одном очень знаменитая серия экспериментов в начале 20 века, команда под руководством Эрнест Резерфорд (физик из Новой Зеландии) стрелял частицами по атомам и наблюдал, что происходит. Это показало, как биты расположены внутри типичного атома (с ядром в центре).
- У нас есть множество доказательств существования крошечных частиц, называемых электронами: они
силовые вещи, такие как электричество и магнетизм.Английский физик Дж. Дж. Томсон
открыл электроны в 1897 году.
 Открытие помогло ученым понять, что атомы состоят из еще более мелких частиц.
Открытие помогло ученым понять, что атомы состоят из еще более мелких частиц. - В отличие от этих более ранних ученых, мы действительно можем видеть атомы; просто посмотрите на фото атомов серы вверху! Увидеть эту картину обрадовало бы Резерфорда, Томсона и других пионеров атомной науки. Теперь ученые даже начинают заглядывать внутрь атомов. Благодаря разработке действительно мощных электронные микроскопы, мы можем заглянуть глубоко внутрь вещей на их внутренняя атомная структура.Например, в 2013 году ученые использовали квантовую микроскоп, чтобы получить первое изображение внутренней части атома водорода. Удивительный!
Есть еще много доказательств того, откуда это взялось, но для начала подойдет. Это показывает нам, что наша теория того, какие атомы
есть и то, как они построены, очень хорошо: теория согласуется с тем, что мы видим вокруг нас в мире, и это
подтверждается множеством различных свидетельств. Однако это не полная теория: нам еще предстоит многому научиться. об атомах и о частичках, скрывающихся внутри них!
об атомах и о частичках, скрывающихся внутри них!
Краткая история атомов
Кто открыл атом, как и когда? Давайте быстро пролистаем историю…
- 450 г. до н. Э.: Древнегреческие философы Левкипп и Демокрит стали первыми, кто предположил, что материя состоит из атомов.
- 1661: англо-ирландский химик Роберт Бойл (1627–1691) предположил, что химические элементы были простейшими формами материи.
- 1789: француз Антуан Лавуазье (1743–1794), широко известный как «отец современной химии», составил список химических элементов (которые он определил как вещества, которые не могут быть расщеплены посредством химической реакции) .Это была важная ступенька на пути к полной Периодической таблице.
- 1803: английский ученый Джон Дальтон (1766–1844) опубликовал атомную теорию вещества. Он понял, что каждый химический элемент состоит из атомов.
- 1815: английский врач Уильям Праут (1785–1850) предположил, что веса различных элементов просто кратны весу атома водорода – не совсем верно, но еще один важный ключ к пониманию
как сделаны атомы.

- 1869: Опираясь на идеи Лавуазье, Дальтона, Праута и других, русский химик по имени Дмитрий Менделеев (1834–1907) нашел логический способ организации химических элементов с четкой структурой, названной Периодической таблицей.
- 1896: французский физик Анри Беккерель (1852–1908) случайно обнаружил радиоактивность.
- 1917: английский физик из Новой Зеландии Эрнест Резерфорд (1871–1937) «расщепил» атом: он доказал, что атомы состоят из более мелких частиц, и в конечном итоге пришел к выводу, что у них есть тяжелое положительно заряженное ядро и практически пустая область вокруг их.
- 1919: британский физик Фрэнсис Астон (1852–1908) обнаружил большое количество атомных изотопов с помощью масс-спектрометрии.
- 1938: немецкие физики Отто Хан (1879–1978) и Fritz Strassmann (1902–1980) осуществили первое ядерное деление (разделение тяжелых атомов на более легкие).
- 1945: Соединенные Штаты сбросили атомные бомбы на японские города Хиросима и Нагасаки.

- 1960–1970-е годы: физики элементарных частиц выяснили, как несколько фундаментальных сил удерживают вместе маленькие «субатомные» частицы. делать атомы.Их идеи постепенно стали называть Стандартной моделью.
- 2013: Ученые использовали квантовый микроскоп, чтобы сделать первые снимки внутри атома водорода.
Узнать больше
На сайте
На других сайтах
- The Particle Adventure: Один из лучших простых веб-сайтов, объясняющих атомы и мир внутри них.
- Структура материи: это очень хорошее интерактивное слайд-шоу с веб-сайта Нобелевской премии объясняет на 22 слайдах все об атомах и других частицах внутри них.[Архивировано через Wayback Machine.]
- Темная материя и темная энергия: Большая часть «вещества» во Вселенной не является обычным веществом или энергией, как мы всегда представляли: это на самом деле «темная материя» и «темная энергия». На этом веб-сайте НАСА объясняется, что это такое и как они соотносятся с обычным веществом и энергией.

Статьи
Книги для юных читателей
- Вы чувствуете силу? пользователя Ричард Хаммонд. Дорлинг Киндерсли, 2015. Включает краткое введение в атомы, квантовую теорию и физику элементарных частиц.
- Периодическая таблица Адриана Дингла. Oxford University Press, 2014. .
- Атомы и молекулы Криса Вудфорда и Мартина Клоуса. Rosen, 2012. (Ранее опубликовано Blackbirch.) Одна из моих собственных книг, в которой представлена история теории атома с древних времен до наших дней.
- Расщепление атома Аланом Мортоном. Эванс, 2005. Краткая история теории атома.
- Как расщепить атом. Хейзел Ричардсон. Oxford University Press, 1999. Забавное и забавное руководство, которое понравится любителям серии «Ужасная наука».
- Очевидец: Дело Кристофера Купера. Дорлинг Киндерсли, 1992. Более сухое, но солидное вступление; подходит для школьных проектов.
Книги для старших читателей
- Атом от Пирса Бизони.
 Icon, 2017. История о том, как ученые пришли к пониманию атомов.
Icon, 2017. История о том, как ученые пришли к пониманию атомов. - Элементы: Визуальное исследование каждого известного атома во Вселенной Теодора Грея. Black Dog & Leventhal, 2012. Занимательное путешествие по таблице Менделеева.
- Мистер Томпкинс в мягкой обложке Георгия Гамова.Кембридж, 2012. Очень яркое введение в мир внутри атомов от одного из самых творческих физиков 20-го века. Подходит для подростков старшего возраста и старше.
- «Муха в соборе» Брайана Кэткарта. Фаррар, Страус и Жиру, 2005. Превосходный, легкий для понимания отчет о том, как Эрнест Резерфорд и его команда выяснили структуру атомов. Также опубликовано в мягкой обложке пользователя Penguin.
- Шесть легких пьес Ричарда Фейнмана. Penguin, 1998. Эта книга ни в коем случае не так “проста”, как предполагает ее название, но последняя глава действительно содержит содержательное объяснение квантовой теории и ее различных загадок, которые люди с базовыми физическими знаниями могут надеяться понять.

Видео
- Что такое бозон Хиггса ?: Дон Линкольн, ученый из Fermilab, объясняет самый острый вопрос в субатомной науке – в терминах, которые большинство из нас может понять!
- Что такое антивещество? Еще одно хорошее простое объяснение от Дона Линкольна.
- Как J.J. Томсон открыл электрон: это отличное небольшое видео, которое объясняет, как такие ученые, как Томсон, пришли к выводу, что электроны должны быть заряженными частицами внутри атомов.
Пожалуйста, НЕ копируйте наши статьи в блоги и другие сайты
статей с этого сайта зарегистрированы в Бюро регистрации авторских прав США.Копирование или иное использование зарегистрированных работ без разрешения, удаление этого или других уведомлений об авторских правах и / или нарушение смежных прав может привести к серьезным гражданским или уголовным санкциям.
Авторские права на текст © Крис Вудфорд 2007, 2021. Все права защищены. Полное уведомление об авторских правах и условиях использования.
Следуйте за нами
Сохранить или поделиться этой страницей
Нажмите CTRL + D, чтобы добавить эту страницу в закладки на будущее, или расскажите об этом своим друзьям с помощью:
Цитируйте эту страницу
Вудфорд, Крис.(2007/2021) Атомы. Получено с https://www.explainthatstuff.com/atoms.html. [Доступ (укажите дату здесь)]
Больше на нашем сайте …
атомов, молекул и ионов – атомная структура
атомная структура
Каждому атому нужна какая-то структура
Прежде чем мы сможем узнать обо всем, что касается атома, нам, вероятно, следует начать с самого основного вопроса: что такое атом?
Атом – единица материи и самая основная единица элемента.Его невозможно сломать никакими химическими процессами.
Помните нашего хорошего друга Джона Далтона? Он вообразил атом одновременно чрезвычайно маленьким и неделимым.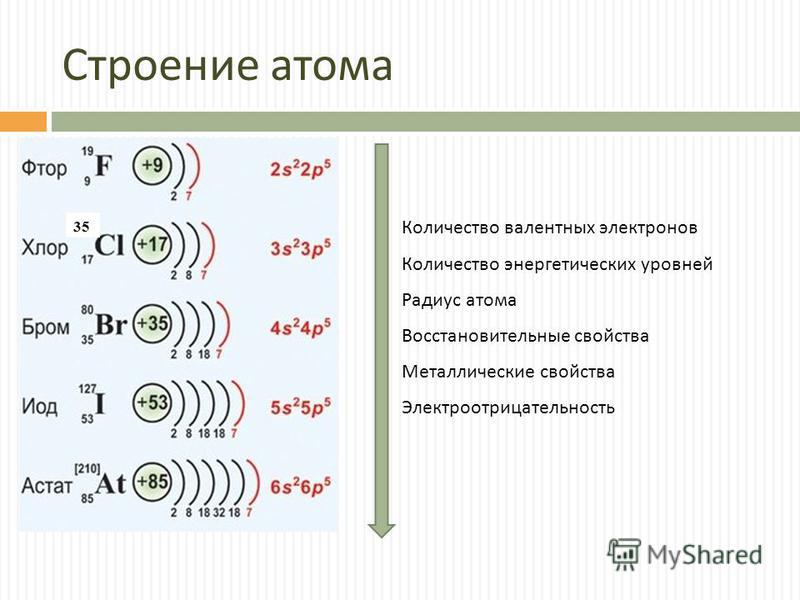 Это была хорошая отправная точка, но она не рассказывает всей истории. В 1850-х годах была завершена серия экспериментов, которые продемонстрировали, что атомы действительно обладают внутренней структурой и состоят из еще более мелких частиц, называемых субатомными частицами . Три самых основных субатомных частицы – это электронов , протонов и нейтронов .
Это была хорошая отправная точка, но она не рассказывает всей истории. В 1850-х годах была завершена серия экспериментов, которые продемонстрировали, что атомы действительно обладают внутренней структурой и состоят из еще более мелких частиц, называемых субатомными частицами . Три самых основных субатомных частицы – это электронов , протонов и нейтронов .
Мы хотели бы познакомить вас с еще одним известным ученым, Эрнестом Резерфордом. Он был ученым из Новой Зеландии и считается одним из величайших экспериментаторов всех времен. Если бы там был зал славы науки, он бы полностью в нем был. У него был способ во всем разбираться. Он известен как отец ядерной физики и получил Нобелевскую премию по химии в 1908 году за свою выдающуюся работу. 1
Эрнест Резерфорд 1871-1937 гг. (Изображение отсюда.)
Так что именно этот парень сделал, чтобы выглядеть таким самодовольным на этой фотографии? И при чем тут атом? Резерфорд был ученым, который обнаружил, что у атомов есть ядро (центр), содержащее протоны. Несколько лет спустя другие ученые обнаружили, что в ядре также находятся нейтрон и электрон.
Несколько лет спустя другие ученые обнаружили, что в ядре также находятся нейтрон и электрон.
Ядро невероятно маленькое. Мы имеем в виду очень маленькие. Он также очень плотный по сравнению с остальной частью атома. Обратите внимание на эти размеры: диаметр атома составляет около 10 –10 метра, в то время как диаметр ядра обычно составляет около 10 –15 метра. Если бы весь атом был увеличен до размеров бейсбольного стадиона, ядро было бы размером с арахис.
Давайте изучим субатомные особенности и сосредоточимся на них.
Субатомные частицы – электроны, протоны и нейтроны
Начнем с протона – этой милой положительно заряженной субатомной частицы. Эти парни находятся внутри ядра. Как все эти положительно заряженные частицы скапливаются в небольшом пространстве, если одинаковые заряды отталкиваются друг от друга? Это Сила, юный джедай. Силы внутри ядра противодействуют этому протон-протонному отталкиванию и удерживают ядро вместе. Физики называют эти силы ядерным клеем.
Физики называют эти силы ядерным клеем.
Мы знаем, что ядро сверхмалое по сравнению с остальной частью атома, поэтому было бы удивительно услышать, что оно на самом деле содержит большую часть массы атома. Для всех практических целей масса всего атома в значительной степени равна массе ядра. Сумасшедший, да?
Атомы несут нейтральный заряд. (Да, атомы могут быть заряжены положительно или отрицательно, но об этом мы поговорим позже). Чтобы уравновесить положительно заряженные протоны, нам нужна отрицательно заряженная субатомная частица: электрон.Химическая реакционная способность, химическая связь, форма молекул и даже электричество зависят от того, где расположены электроны в атоме. Пока мы только упомянули, что электроны не находятся в ядре. Где находятся электроны в атоме?
В самых ранних моделях атома электроны беспорядочно кружили вокруг ядра. Когда ученые завершили больше экспериментов и стали экспертами в атомной энергетике, они поняли, что это представление, вероятно, было неправильным. Сегодня ученые используют высоко математическую модель, называемую квантово-механической моделью, для определения местоположения электронов и лучшего представления структуры атома.А пока просто радуйтесь, что они это выяснили, а вам не пришлось.
Сегодня ученые используют высоко математическую модель, называемую квантово-механической моделью, для определения местоположения электронов и лучшего представления структуры атома.А пока просто радуйтесь, что они это выяснили, а вам не пришлось.
Эта сложная модель основана на квантовой теории, которая утверждает, что материя также имеет свойства, связанные с волнами. Другими словами, электроны – это частицы вещества с определенной массой, но они также ведут себя так, как если бы они были волной. На самом деле все материи (включая вас, меня и Леди Гагу) обладают свойствами частиц и волновыми свойствами. Чем меньше кусок материи, тем он более волнообразный и менее частичный.Вы и являетесь огромными кусками материи, поэтому наши волнообразные свойства практически отсутствуют. Просто помните, что квантовая теория и волны идут рука об руку.
Как это помогает нам определить местонахождение электрона? Согласно квантовой теории, невозможно узнать точное положение и импульс электрона одновременно. Это известно как принцип неопределенности . Другими словами, если вы знаете точное местоположение электрона, у вас есть нулевая информация о его импульсе (и вы помните, что электроны находятся в постоянном движении), или если вы знаете его точный импульс, вы ничего не знаете о его местонахождении.В следующий раз, когда мама спросит вас о вашем местонахождении, попробуйте сказать ей, что вы сейчас едете в машине и едете со скоростью 40 миль в час, поэтому вы не имеете ни малейшего представления о том, где вы находитесь. Это принцип неопределенности.
Это известно как принцип неопределенности . Другими словами, если вы знаете точное местоположение электрона, у вас есть нулевая информация о его импульсе (и вы помните, что электроны находятся в постоянном движении), или если вы знаете его точный импульс, вы ничего не знаете о его местонахождении.В следующий раз, когда мама спросит вас о вашем местонахождении, попробуйте сказать ей, что вы сейчас едете в машине и едете со скоростью 40 миль в час, поэтому вы не имеете ни малейшего представления о том, где вы находитесь. Это принцип неопределенности.
На данный момент мы все еще не уверены в местонахождении электрона. Вместо того чтобы быть одержимыми определением точного местоположения любого данного электрона в любое конкретное время, ученые решили, что это нормально – просто вычислить вероятность местоположения электрона в любой момент времени. Другими словами, они заменили уверенность вероятностью.Они знают, что есть большая вероятность, что электрон находится где-то в рассчитанном объеме вокруг атома. Из всего этого вероятностного материала пришла идея орбиталей (или электронных облаков).
Из всего этого вероятностного материала пришла идея орбиталей (или электронных облаков).
Орбитали – это объемы пространства, в которых с наибольшей вероятностью может находиться электрон. В следующих разделах вы узнаете все об орбиталях, включая их форму, энергию и все другие полезные вещи. А пока просто знайте, что электроны – это отрицательно заряженные субатомные частицы, расположенные вне ядра на орбиталях.
Орбитали бывают разных форм и размеров.
Нам осталось обсудить одну субатомную частицу: нейтрон. Нейтроны – ближайшие соседи протонов. Они также находятся в плотном и компактном ядре. Это электрически нейтральные частицы с массой немного больше, чем у протонов. Не все элементы одного и того же атома имеют одинаковое количество нейтронов, но мы немного забегаем вперед. Перейдите в следующий раздел, чтобы узнать все о нейтронах и о том, как они связаны с элементарными изотопами .
Brain Snack
Этот веб-сайт наполнен множеством домашних научных экспериментов, которые вы можете провести, чтобы удовлетворить все свои любознательные потребности.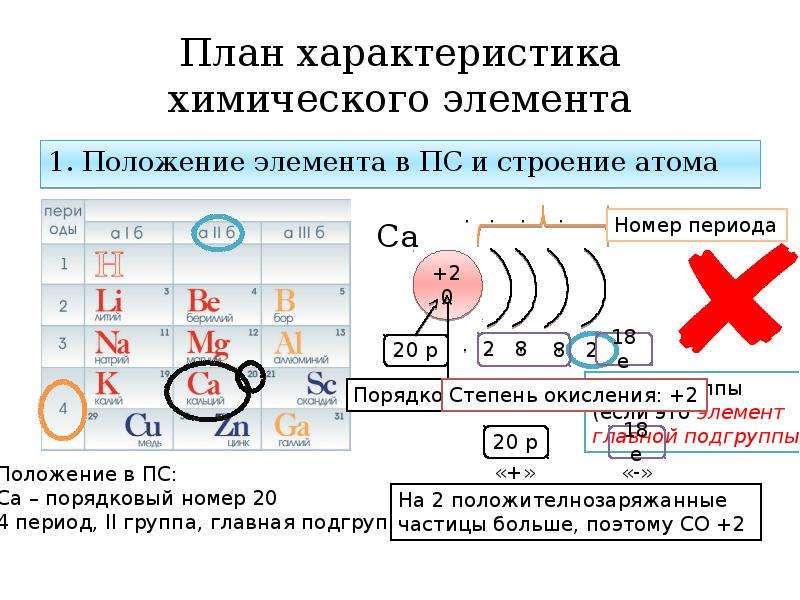

 2
2  3 6
3 6 





 Дополнительные элементы с более высокими атомными номерами, чем те, которые встречаются в природе, были получены технологически в последние десятилетия как продукты ядерных реакций.
Дополнительные элементы с более высокими атомными номерами, чем те, которые встречаются в природе, были получены технологически в последние десятилетия как продукты ядерных реакций.  Мы можем легко объяснить это, если химические элементы действительно существуют как
простые частицы (другими словами, атомы), которые соединяются, как строительные блоки.
Мы можем легко объяснить это, если химические элементы действительно существуют как
простые частицы (другими словами, атомы), которые соединяются, как строительные блоки. Открытие помогло ученым понять, что атомы состоят из еще более мелких частиц.
Открытие помогло ученым понять, что атомы состоят из еще более мелких частиц.

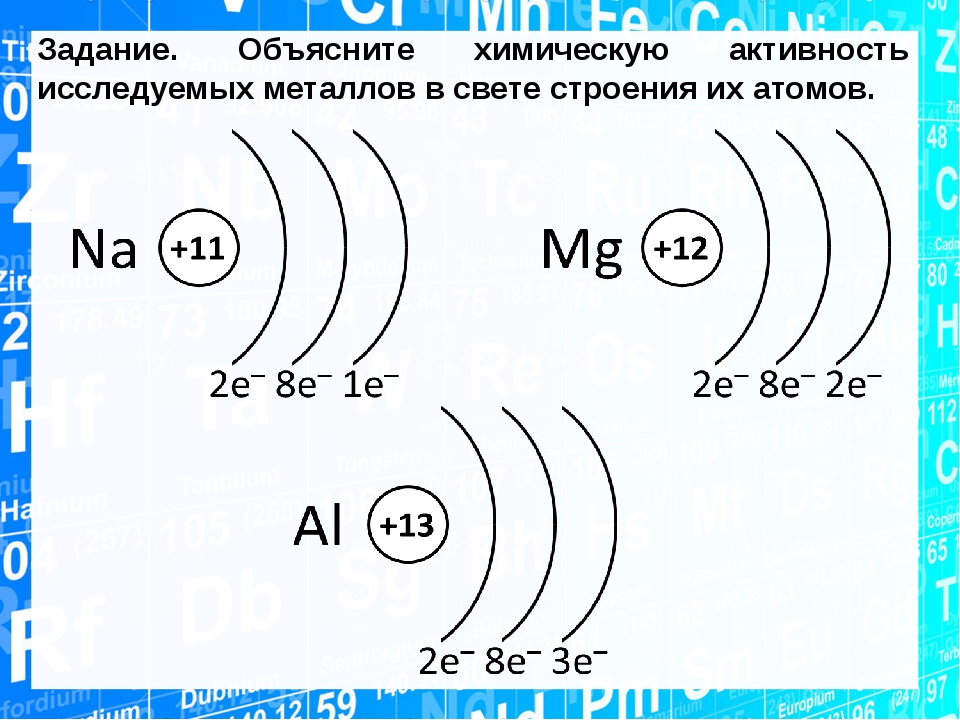
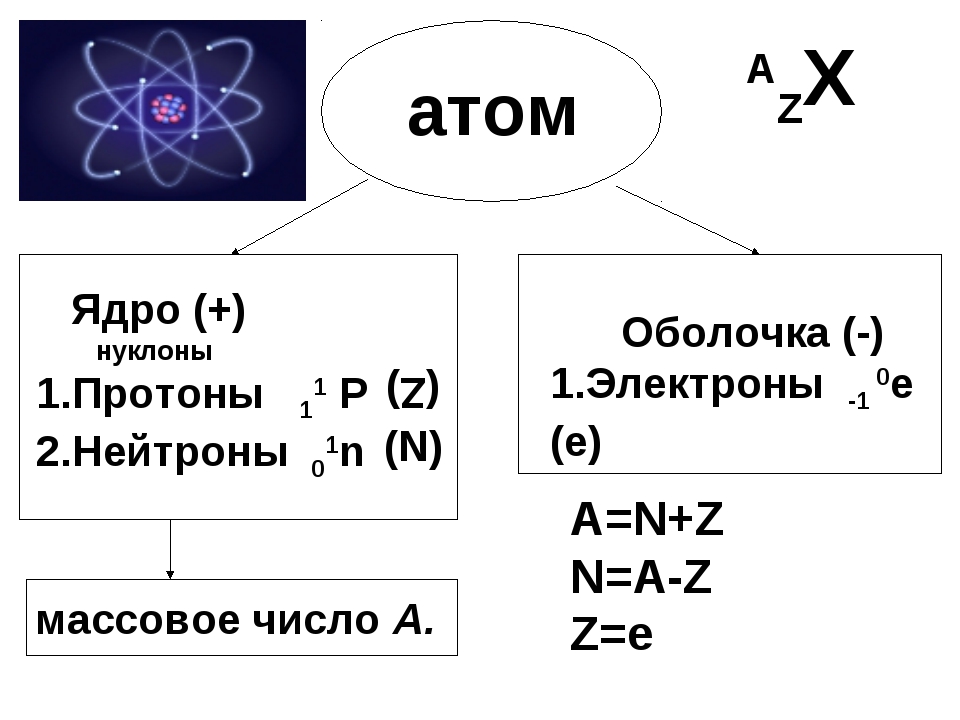 Icon, 2017. История о том, как ученые пришли к пониманию атомов.
Icon, 2017. История о том, как ученые пришли к пониманию атомов.