Строение атома. Электронные формулы атомов элементов
Задание 23.
Какое максимальное число электронов могут занимать s-, p-, d- и f- орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО. Исходя из этого, на s-подуровне максимальное число электронов может быть равно двум [2 (2 . 0 + 1) = 2], на р-подуровне – трём [2 (2 .
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→
→6d→7p.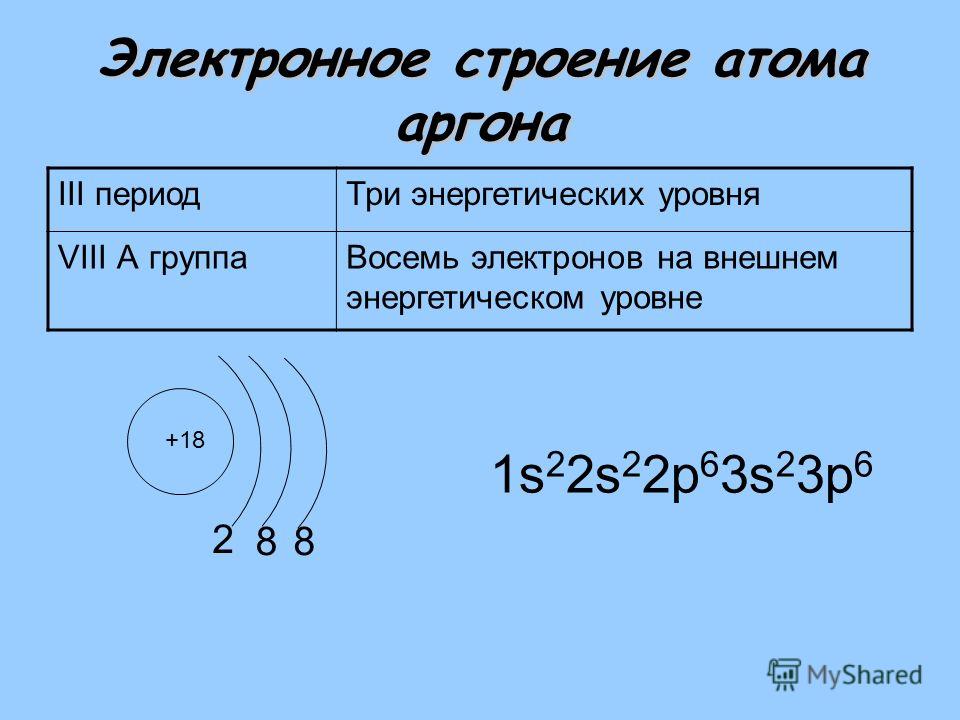
Так как число электронов в атоме элемента равно его порядковому номеру в таблице химических элементов Д. И. Менделеева, то для элементов №31 (галлий) электронная формула имеют вид:
+31Ga 1s2
Задание 24.
Напишите электронные формулы атомов с порядковыми номерами 25 и 34. К какому семейству относится каждый из этих элементов?
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в атомной орбитали (АО) могут находиться не более двух электронов, различающихся своими спинами ms = 1/2. Максимальное число электронов в подуровне определяется по формуле 2(2l + 1), где l-орбитальное квантовое число. На s-подуровне располагается одна квантовая ячейка на р-подуровне – три атомные орбитали (ячейки), на d-подуровне – пять АО, на f-подуровне – семь АО.
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→(5d1)→4f→5d→6p→7s→(6d1-2)→5f→
→6d→7p.
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элементов 25 и 34 электронные формулы будут иметь вид:
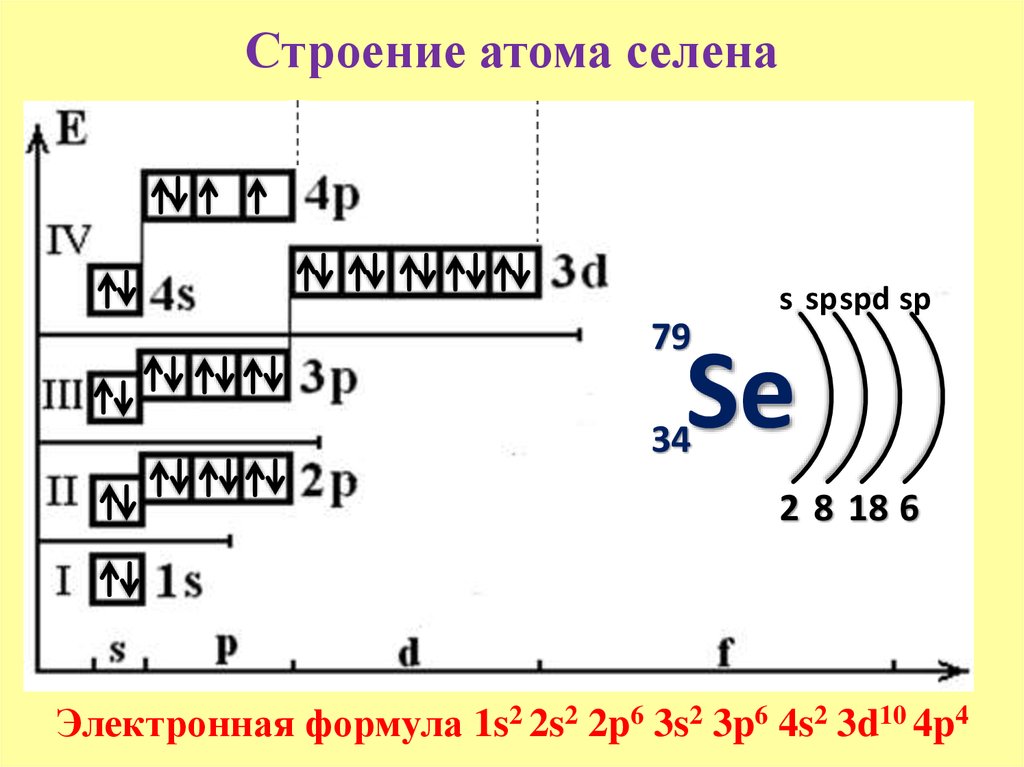
+25Mn 1s22s22p63s23p63d54s2; +34Se 1s22s22p63s23p63d104s24p
У атома марганца валентными электронами являются пять 3d-электрона и два 4s- электрона, поэтому марганец относится к семейству d-элементов. У атома селена валентными электронами являются два 4s- электрона и один 4р-электрон, поэтому селен относится к семейству р-элементов.
Задание 25
Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
Решение:
Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули
→6d→7p.
Так как на 4s-подуровне сумма n + l равна 4 (4 + 0 = 4), на 3d-подуровне – 5 (3 + 2 = 5), то сначала будет заполняться 4s-подуровень, где сумма чисел n + l наименьшая. На 5s-подуровне сумма n + l равна 5 (5 + 0 = 5), на 4р-подуровне – 5 (4 + 1 = 5), то, согласно правилу Клечковского, сначала будет заполняться 4р-подуровень, где главное квантовое число имеет меньшее значение (второе правило Клечковского).
Так как число электронов в атоме элемента равна его порядковому номеру в периодической системе химических элементов таблицы Д. И. Менделеева, то для элемента 21 (скандий) электронная формула будут иметь вид:
Студентка ИТМО разработала VR-игру для обучения химии.
 С ее помощью можно запоминать строение атома, управляя космическим кораблем
С ее помощью можно запоминать строение атома, управляя космическим кораблемИгру разработала студентка факультета программной инженерии и компьютерной техники (ПИиКТ) Университета ИТМО Анастасия Рычкова. До этого она не сталкивалась с химией, но погрузилась в область и смогла довести проект до потребителя. Итоги работы опубликованы в статье, которая вышла в Journal of Chemical Education.
Есть такие темы, которые из года в год даются студентам тяжело, как бы преподаватель ни пытался их донести. Такие вопросы есть в каждом предмете и зачастую мало зависят от подготовки лектора. Именно для таких трудных пунктов учебного плана особенно необходимо придумывать новые методы подачи и закрепления материала.
Как отмечает декан факультета биотехнологий и ведущий научный сотрудник химико-биологического кластера Университета ИТМО Михаил Курушкин, по его опыту такой непростой темой является электронное строение атома. В 2016 году он даже придумал настольную игру по принципу морского боя для того, чтобы в игровой форме мотивировать студентов изучить эту тему.
Михаил Курушкин
В 2018 году вместе с коллегами по вузу Михаил решил создать проект по изучению роли виртуальной реальности в химическом вузовском обучении. Тогда он вспомнил о своей старой игре и решил перенести ее в новый формат.
«Мы решили перенести эту бумажную игру в виртуальную реальность. Возможность использовать VR-версию с автоматическим контролем грамотности освоения материала может снять с преподавателя часть нагрузки по изучению электронного строения атома с большим количеством студентов одновременно», ― отмечает он.
VR-игра для обучения химии. Иллюстрация из статьи. Источник: pubs.acs.org
Чтобы игра по-настоящему помогла в обучении, она должна впечатлить студента. Поэтому для изначальной задумки нужно было придумать яркую оболочку.
«Я предложил перенести морской бой в космические просторы, чтобы игрок был капитаном космического корабля одной из воюющих друг с другом инопланетных рас и, стоя на мостике, пытался победить противника.
Я предложил Михаилу назвать расы ― лантаноиды и актиноиды, и ему это понравилось. Таким образом мы придумали не просто визуальный контент, но и добавили к нему определенный сторителлинг, чтобы повысить эффект сопричастности», ― вспоминает директор центра юзабилити и смешанной реальности, доцент факультета программной инженерии и компьютерной техники Университета ИТМО Артем Смолин.
Артем Смолин
Основная работа по программированию игры легла на студентку третьего курса бакалавриата образовательной программы «Компьютерные технологии в дизайне» Анастасию Рычкову. Ей предстояло решить, как именно перенести в мир виртуальной реальности идею космического боя на основе химических объектов и явлений.
«Мы начали с изучения движка, пришлось какое-то время разбираться, как это вообще можно сделать. Дело в том, что к тому времени гарнитура виртуальной реальности Oculus Go, которую мы использовали, была на рынке не так долго, информации было крайне мало, приходилось действовать методом “научного тыка”, ― рассказывает она.
― Затем подключился дизайнер Алексей Коротких, мы приступили к работе над самим проектом. Процесс напоминал игру “Сапер”. Самый большой “подрыв” произошел в прошлом ноябре, когда игра была почти закончена. Однако движок в этот момент обновился, и определенный функционал исчез. Поэтому нам пришлось искать альтернативу».
Анастасия Рычкова. Фото из личного архива
Серьезные проблемы возникли с тем, чтобы создать игру в режиме игрок против игрока. Как отмечает Артем Смолин, одна из главных неожиданностей заключалась в том, что для VR нет как такового мультиплеера. Проблему удалось решить, написав выделенный сервер, рассказывает Анастасия Рычкова.
«Сначала у нас работало автономно две гарнитуры, нам пришлось писать отдельную программу. Однако, в результате мы даже выиграли ― все гарнитуры могли подключаться к одному устройству», ― отмечает автор игры.
VR-игра для обучения химии. Иллюстрация из статьи. Источник: pubs.acs.org
Иллюстрация из статьи. Источник: pubs.acs.org
В своей механике игра сохранила базовые принципы морского боя. Игрок должен уничтожить флот противника до того, как тот успеет сбить все его корабли. Только вместо численно-буквенных координат он должен атаковать контейнеры со стрелками, которыми в химии изображается состояние электронов в атоме.
«Перед тобой в космосе висит враждебный флот в виде контейнеров, и по нему необходимо стрелять с помощью лазера, ― объясняет Михаил Курушкин. ― В качестве координат выступают квантовые числа, которыми записывается состояние электрона в атоме. По сути, для удачной игры вам надо понимать, как электроны распределяются по орбитальным диаграммам».
Перед каждым раундом игроки загадывают химический элемент, а затем, используя диаграмму из контейнеров, начинают угадывать элемент противника.
«У тебя есть две стратегии поведения. Первая ― ты стреляешь до самого конца и называешь химический элемент, когда ты в этом абсолютно уверен, ― объясняет Артем Смолин.
― Вторая стратегия более рискованная. Ты примерно пристрелялся, увидел некий диапазон возможных элементов, и ты рискуешь, называешь элемент. Если ты неправ ― ты проиграл, если прав ― выиграл. Поскольку тут в дело вступает азарт, игра затягивает, что помогает в конечном счете запоминанию предмета».
VR-игра для обучения химии. Иллюстрация из статьи. Источник: pubs.acs.org
Работы над игрой были почти закончены в начале этого года. В феврале первый прототип игры продемонстрировали на ITMO Open Science. Эта демонстрация выявила ряд неточностей, требовавших определенной доработки.
«Тогда мы смогли апробировать игру, посмотреть на пользователях, какие есть сложности, ― вспоминает Анастасия Рычкова. ― У людей часто встречались проблемы с точки зрения знания химии, и когда преподавателю необходимо был помочь, то приходилось снимать и надевать гарнитуры виртуальной реальности. Я поняла, что, чтобы этого избежать, надо создать своего рода средство мониторинга, чтобы преподаватель мог видеть, что происходит в гарнитурах виртуальной реальности учащихся.
Тут началась пандемия, и у меня появилась возможность доработать игру и убрать оставшиеся “косяки”. А к июню мы смогли опробовать наше детище».
ITMO Open Science-2020
Чтобы продемонстрировать эффективность разработки, Надежда Максименко, одна из ключевых участниц проекта из лаборатории «Нейропедагогика химического образования», провела педагогический эксперимент, на который пригласили студентов Университета ИТМО.
По итогам работы была опубликована статья в Journal of Chemical Education с описанием игры и возможностью для скачивания. В следующем году создатели намерены сделать онлайн-версию орбитального морского боя.
Источник https://news.itmo.ru/ru/education/trend/news/9799/
Структура основных единиц материи
Рон Б. Дэвис-младший, Джорджтаунский университет
Почему вообще существует периодическая таблица? Что делает некоторые материалы элементами, а большинство — нет? И что такого в элементах, что некоторые из их свойств настолько предсказуемы и упорядочены, что их можно организовать таким образом? Ответ на эти вопросы сводится к атомам, фундаментальным единицам материи.
 Атомы когда-то считались неделимыми единицами элементов. (Изображение: EDU WATANABE/Shutterstock)
Атомы когда-то считались неделимыми единицами элементов. (Изображение: EDU WATANABE/Shutterstock)Неопровержимые доказательства существования атомов
Джон Дальтон предложил наиболее убедительные доказательства существования атомов еще в начале 1800-х годов. Его аргумент был довольно прост. Он заметил, что соединения элементов всегда, казалось, соединялись в одних и тех же пропорциях по массе.
Например, олово и кислород объединились, чтобы получить соединение, состоящее из 88,1% олова по массе, и другое, состоящее из 78,8% олова, но никогда не промежуточное. Он назвал это «законом множественных пропорций» и утверждал, что это было бы возможно только в том случае, если бы элементы состояли из дискретных неделимых частиц. Если нет, то континуум пропорций должен быть возможен.
Дальтон был прав насчет существования атомов. И все же атомы, оказывается, на самом деле не неделимы, как все предполагали.
Эта статья взята непосредственно из серии видеороликов Understanding the Periodic Table .
Смотрите прямо сейчас на Wondrium.
Сложная структура атомов
Разделение атома превращает его в совершенно новый элемент. Атомы имеют сложную структуру, структуру, состоящую из частиц еще меньшего размера, чем атомы, — субатомных частиц.
Атомы имеют плотное ядро, состоящее из положительно заряженных протонов и незаряженных нейтронов. Атомы также имеют гораздо большую, но гораздо менее плотную область отрицательно заряженных электронов, окружающих ядро.
Атомы с разным числом нейтронов называются изотопами друг друга. (Изображение: zizou7/Shutterstock)Число протонов в атоме называется его «атомным номером». Это количество протонов придает каждому атому индивидуальность. Все атомы углерода, например, содержат в своем ядре шесть протонов — атомный номер 6. На один протон меньше, и этот атом не углерод, это бор с атомным номером 5.
Атомное ядро также содержит частицы второго типа, называемые нейтронами. Один нейтрон придает атому дополнительную массу, почти равную массе протона.
Но нейтроны нейтральны — у них нет заряда — поэтому количество нейтронов не меняет идентичности атома как элемента. Например, атом углерода может иметь шесть протонов и шесть нейтронов, но с таким же успехом он может иметь шесть протонов и семь нейтронов. Мы называем эти атомы «изотопами» друг друга и часто указываем, какой изотоп мы хотим обсудить, указывая общее количество протонов и нейтронов — например, углерод-12 или углерод-13. .
Протоны и нейтроны имеют одинаковые массы и составляют большую часть массы атома. Вот почему мы часто говорим об общей массе атома просто в терминах «атомных единиц массы» или а.е.м., где одна а.е.м. примерно равна массе одного протона или одного нейтрона.
Роли электронов
Электроны — третий тип субатомных частиц, но они намного меньше — примерно в 1000 раз менее массивны, чем протоны и нейтроны.
Электроны играют две важные роли в атоме. Во-первых, электроны уравновешивают положительный заряд протонов в ядре. Нашему атому углерода с шестью протонами нужно шесть электронов на орбите, чтобы в целом оставаться нейтральным. Удаление одного из этих электронов оставляет наш углерод с чистым положительным зарядом. Это уже не баланс. И наоборот, добавление дополнительного электрона к нейтральному углероду дает суммарный отрицательный заряд.
Нашему атому углерода с шестью протонами нужно шесть электронов на орбите, чтобы в целом оставаться нейтральным. Удаление одного из этих электронов оставляет наш углерод с чистым положительным зарядом. Это уже не баланс. И наоборот, добавление дополнительного электрона к нейтральному углероду дает суммарный отрицательный заряд.
В обоих случаях мы говорим, что атом углерода стал ионом углерода, что означает, что он имеет положительный или отрицательный общий заряд. Ионы могут вести себя совершенно иначе, чем их соответствующие нейтральные атомы.
Вторая, еще более важная роль электронов, вращающихся вокруг ядра на внешнем краю каждого атома или иона, заключается в том, что электроны напрямую взаимодействуют с миром вокруг каждого атома.
Электронные оболочки и периоды в периодической таблице
Электроны занимают области пространства вокруг ядра, называемые оболочками. Эти оболочки образуют сложные слои электронов вокруг ядра. Именно внешний слой электронов, называемый «валентной оболочкой», в первую очередь определяет, как атом взаимодействует с окружающим миром.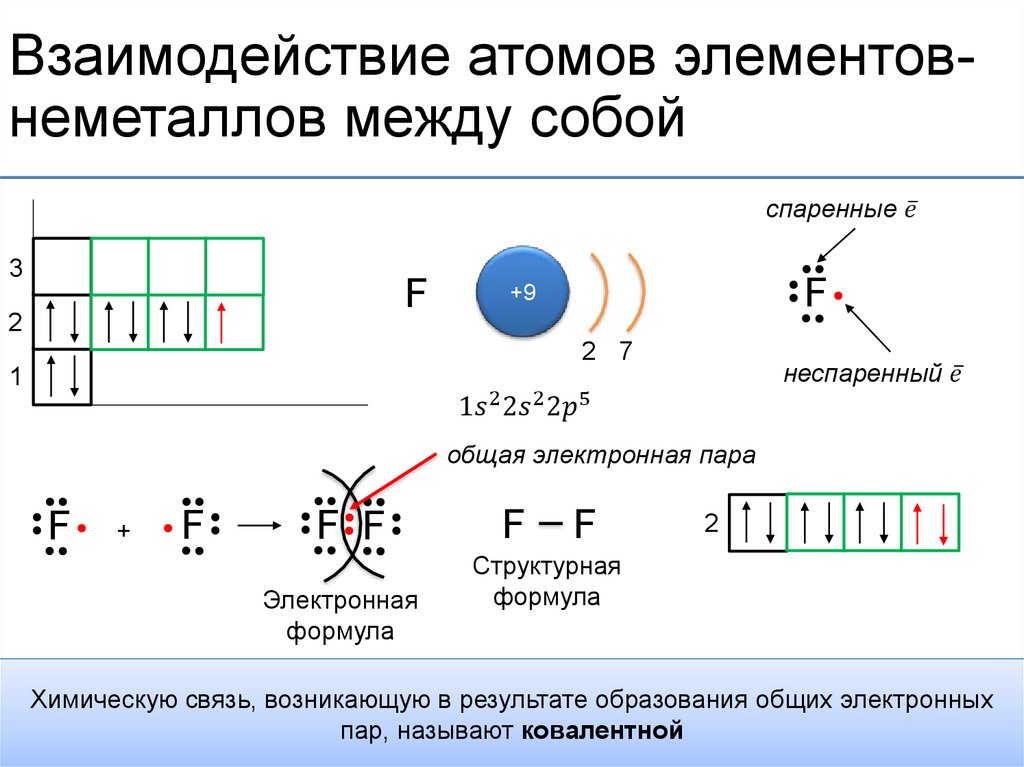
Когда одна скорлупа заполнена до отказа, начинает заполняться новая скорлупа, и начинается новый период на столе. Именно структура этих электронных оболочек определяет организацию периодов, давая периодической таблице ее название и характерную форму.
Периодическая таблица началась, когда Дмитрий Менделеев выстроил все известные ему элементы в порядке возрастания атомной массы. Сделав это, он заметил повторяющиеся закономерности химического поведения — в частности, отношения, в которых элементы соединяются с кислородом или водородом, — повторяющиеся через равные промежутки времени.
Он обнаружил, что, оборачивая таблицу и создавая точки, эти элементы, соединяющиеся с кислородом или водородом в тех же соотношениях, известных как их «валентность», часто можно было выровнять в столбце (или группе).
Секрет группировки элементов
Секрет способности таблицы Менделеева группировать элементы с похожими свойствами так давно заключается в том, что те свойства, которые он использовал, атомная масса и валентность, тесно связаны с определенными особенностями строения атома, в частности с атомным число и структура электронного облака, которые определяют организацию стола сегодня.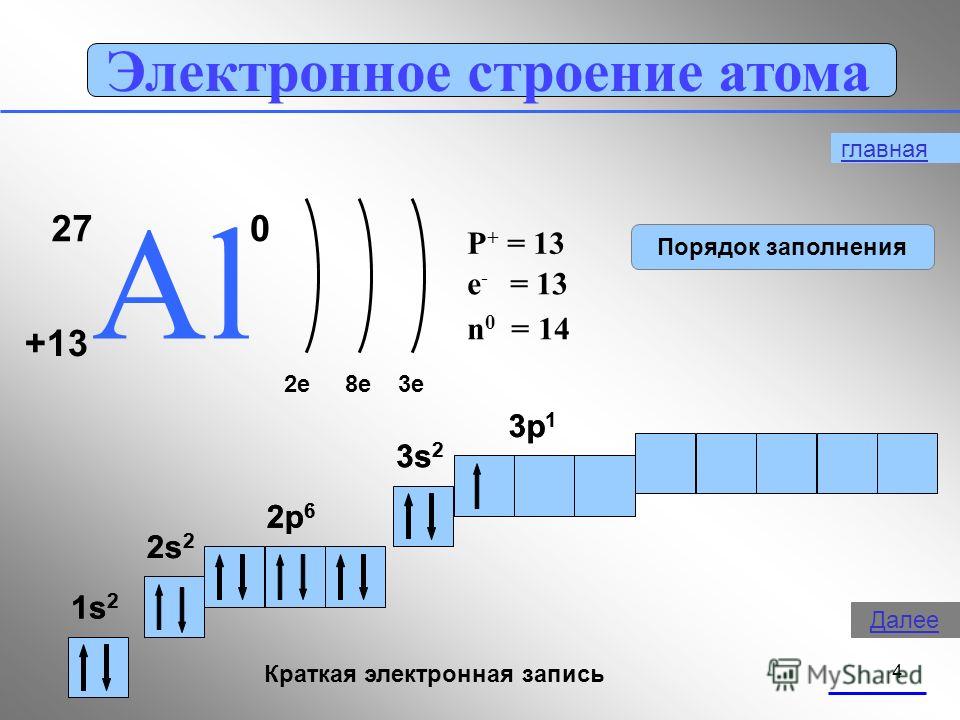
Место каждого элемента в таблице определяется его атомной структурой, а структура атома влияет на его свойства. Систематическая организация элементов в таблице с точки зрения их атомов предлагает поделиться потрясающими знаниями, когда речь идет об изобилии, распределении и свойствах элементов и соединений в окружающем нас мире.
Общие вопросы о структуре основных единиц материи
В: Какова структура атома?
Атомы имеют плотное ядро, состоящее из положительно заряженных протонов и незаряженных нейтронов. Атомы также имеют гораздо большую, но гораздо менее плотную область отрицательно заряженных электронов, окружающих ядро.
В: Что такое аму?
Единицы атомной массы или а.е.м. — это единица измерения, представляющая общую массу атома. Одна а.е.м. примерно равна массе одного протона или одного нейтрона.
В: Какие две роли играют электроны в атоме?
Электроны играют две важные роли в атоме. Во-первых, электроны уравновешивают положительный заряд протонов в ядре. Во-вторых, электроны напрямую взаимодействуют с миром вокруг каждого атома.
Во-первых, электроны уравновешивают положительный заряд протонов в ядре. Во-вторых, электроны напрямую взаимодействуют с миром вокруг каждого атома.
Продолжайте читать
История радиоактивных элементов
Великая работа Менделеева и основные причины химической связи
Взаимодействие света и материи на атомном уровне
Структура атома
Курс геонаук мистера Панико – Одиссей 2 Чартерная школа 0 – 1 сентября 2
Студенты вся вселенная состоит из очень маленьких частиц материи, называемых атомами .
Слово атом означает неделимый. Если атом разделен, то он уже не может быть признан
материей. Внутри атома находятся три типа субатомных частиц: протонов, нейтронов и электронов.
| Часть 1 – Атомная структура – протоны, нейтроны и электроны |
Протоны, нейтроны и электроны
Протон — это частица, несущая положительный электрический заряд и расположенная в центре атома. Центр атома называется ядром . Второй тип частиц в ядре называется нейтроном. Нейтроны также расположены в ядре, и эти частицы не имеют электрического заряда и, следовательно, нейтральны .
Центр атома называется ядром . Второй тип частиц в ядре называется нейтроном. Нейтроны также расположены в ядре, и эти частицы не имеют электрического заряда и, следовательно, нейтральны .
Третий тип субатомных частиц называется электроном и намного меньше протона или нейтрона. Электроны вращаются вокруг атома в большой области пространства, окружающей ядро. Электрон содержит отрицательных электрических зарядов . Мы знакомы с электронами в том смысле, что электроны текут по проводам как электричества .
Модель атома
Электроны вращаются вокруг ядра на разных расстояниях от ядра, причем более энергичные электроны вращаются дальше. Если бы мы могли создать модель атома в точном масштабе, мы бы увидели, что ядро очень маленькое, скажем, размером с бейсбольный мяч, а электроны размером с изюм вращаются вокруг бейсбольного мяча с очень большого расстояния. на расстоянии около 5 футбольных полей или 1500 футов.
на расстоянии около 5 футбольных полей или 1500 футов.
Атомы состоят в основном из пустого пространства
Вы можете видеть, что эта масштабная модель показывает, что существует огромное количество пространства, состоящего из атомов, и поэтому атомов в основном состоят из пространства .
Количество протонов определяет тип атома
Первичной субатомной частицей является протон, потому что количество протонов внутри атома определяет, к какому типу относится атом. Например, все атомы, имеющие в ядре 8 протонов, являются атомами кислорода. Все атомы, имеющие 6 протонов, являются атомами углерода. Лучше сказать, что для того, чтобы атом был атомом золота, он должен иметь 79протонов, не больше и не меньше. Если бы атом мог изменить количество протонов, он стал бы атомом другого типа. (Изменение количества протонов в атоме действительно происходит в природе, и это называется ядерным распадом).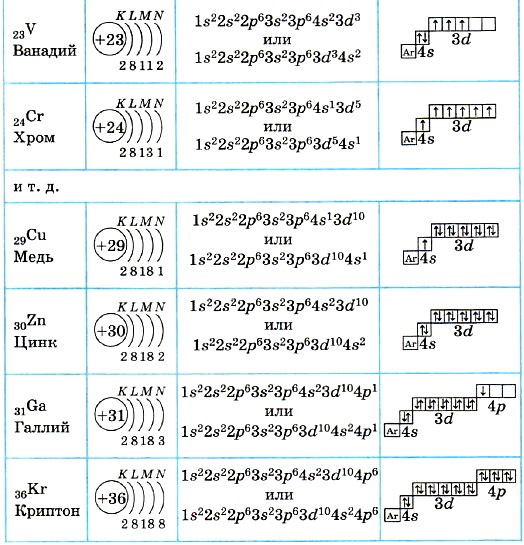
94 известных типа атомов
Во Вселенной известно 94 естественных атома. Эти атомы представлены в периодической таблице. Подробнее об этом позже…
Таблица Менделеева
Элементы
Атомы также называют элементами. Элемент – это чистое вещество, состоящее только из атомов одного типа. Так как существует 94 типа атомов, то есть 94 типа элементов. Железо — это один из элементов. Углерод это другое. Так свинец и золото.
Буквы обозначают элементы
Буквы, которые вы видите в периодической таблице, представляют элементы. Ртуть Hg . Золото Au . Нержавеющая сталь состоит из нескольких элементов, поэтому она не представлена в периодической таблице. В периодической таблице присутствуют только чистые элементы, а не смеси нескольких элементов.
Атомный номер = число протонов
число протонов атома называется его атомным номером .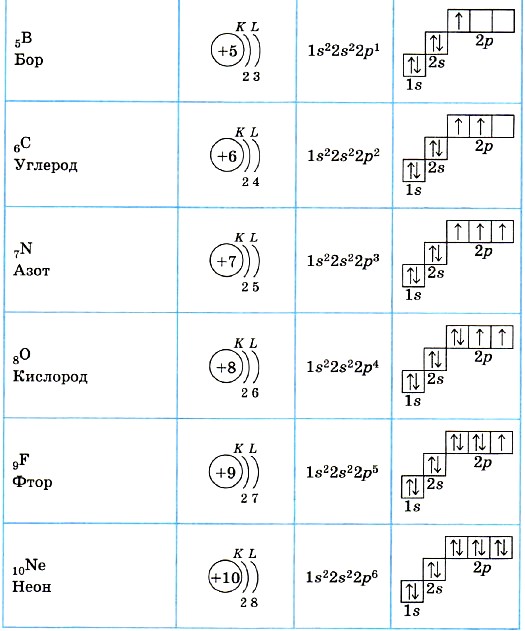 Атомный номер углерода равен 6, потому что атомы углерода имеют 6 протонов. Атомный номер кислорода равен 8, потому что атомы кислорода имеют 8 протонов в своем ядре. Атомный номер золота 79, потому что атомы золота имеют 79 протонов.
Атомный номер углерода равен 6, потому что атомы углерода имеют 6 протонов. Атомный номер кислорода равен 8, потому что атомы кислорода имеют 8 протонов в своем ядре. Атомный номер золота 79, потому что атомы золота имеют 79 протонов.
Здесь вы видите медь с атомным номером 29, потому что атомы меди имеют 29 протонов в своем ядре.
Атомы — это чистые химические элементы
Во Вселенной существует 94 природных атома, значит, существует 94 природных элемента . Элементы – это вещества, формы материи и газы, состоящие из атомов только одного типа .
По состоянию на май 2011 года было идентифицировано 118 элементов, последним из которых был унуноктий в 2002 году. Считается, что из 118 известных элементов только первые 94 встречаются в природе на Земле. Из этих встречающихся в природе элементов 80 стабильны или по существу таковы, в то время как остальные радиоактивны, распадаясь на другие, более легкие элементы в различных временных масштабах от часов до миллиардов лет. Дополнительные элементы с более высокими атомными номерами, чем встречающиеся в природе, были получены технологически в последние десятилетия как продукты ядерных реакций. |
Когда только один тип атома составляет кусок материи, тогда эта материя называется элементом. Если вы держали в руке кусок чистой меди, это означает, что в этом кусочке меди содержатся только атомы меди. Итак, это чистый кусок меди, в котором нет других типов атомов. Держать большой образец чистого элемента редко. Большинство веществ, достаточно больших, чтобы их можно было удержать, будут содержать атомы других типов, смешанные с ними.
Большинство веществ, достаточно больших, чтобы их можно было удержать, будут содержать атомы других типов, смешанные с ними.
Нержавеющая сталь, например, содержит несколько типов атомов, поэтому это не элемент, а скорее смесь элементов.
3 протона и 3 электрона
| Часть 2. Изотопы и атомная масса |
Количество протонов = количество электронов = нейтральный заряд атома
Теперь в большинстве атомов количество положительных протонов равно количеству отрицательных электронов. Итак, атом углерода с 6 протонами тоже должен иметь 6 электронов, чтобы он был нейтральный атом . Атом алюминия имеет 13 протонов, поэтому он также должен иметь 13 электронов.
Помните, что количество протонов равно количеству электронов в нейтрально заряженных стабильных атомах . (Есть исключение, когда атом является ионом, поясняется ниже).
В некоторых атомах количество нейтронов будет отличаться от количества протонов. Этот факт называется изотопами.
В общем, меньшие атомы имеют то же количество нейтронов, что и протоны, но это не относится ко всем атомам. Например, среди атомов углерода, каждый из которых имеет 6 протонов, большинство атомов углерода будет иметь 6 нейтронов, НО не все. Некоторые атомы углерода могут иметь 8 нейтронов, хотя большинство из них имеют 6 нейтронов.
На этом изображении Углерод-13 имеет 7 нейтронов, а Углерод-14 — 8
Изотопы Относится к вариациям в количестве нейтронов в пределах типа атома
Ссылаясь на тот факт, что любой тип атома будет иметь некоторые вариации в отношении количества содержащихся в них нейтронов, назовем изотопов . Все атомы углерода должны иметь 6 протонов, чтобы быть атомом углерода. У большинства атомов углерода также будет 6 нейтронов, но у некоторых будет 8 нейтронов. Эти вариации числа нейтронов составляют изотопы углерода . Атом углерода с 6 нейтронами представляет собой изотоп, называемый углерод-12 . Атом углерода с 8 нейтронами — это изотоп, называемый кабарон-14 . Изотоп Углерод-12 имеет 6 протонов и 6 нейтронов, следовательно, Углерод-12. Изотоп Углерод-14 имеет 6 протонов и 8 нейтронов, отсюда и его название Углерод-14.
Атом углерода с 6 нейтронами представляет собой изотоп, называемый углерод-12 . Атом углерода с 8 нейтронами — это изотоп, называемый кабарон-14 . Изотоп Углерод-12 имеет 6 протонов и 6 нейтронов, следовательно, Углерод-12. Изотоп Углерод-14 имеет 6 протонов и 8 нейтронов, отсюда и его название Углерод-14.
19 протонов + 20 нейтронов = атомная масса 39
Атомная Масса (Атомный Вес) – это Число Протонов + Нейтронов
Еще одно важное понятие для ученых – Атомная масса (также называемая Атомная масса ). Атомная масса относится к весу или действительно к массе атома. Каждая частица в ядре равна одной единице массы. Итак, 12 частиц в ядре атома равняются массе 12. Если в ядре атома 6 протонов и 6 нейтронов, то общая масса этого атома = 12. Атом углерода имеет 6 протонов и 6 нейтронов, поэтому его атомная масса = 12..
Если в ядре атома 8 протонов и 8 нейтронов, то атомная масса этого атома равна 16,9.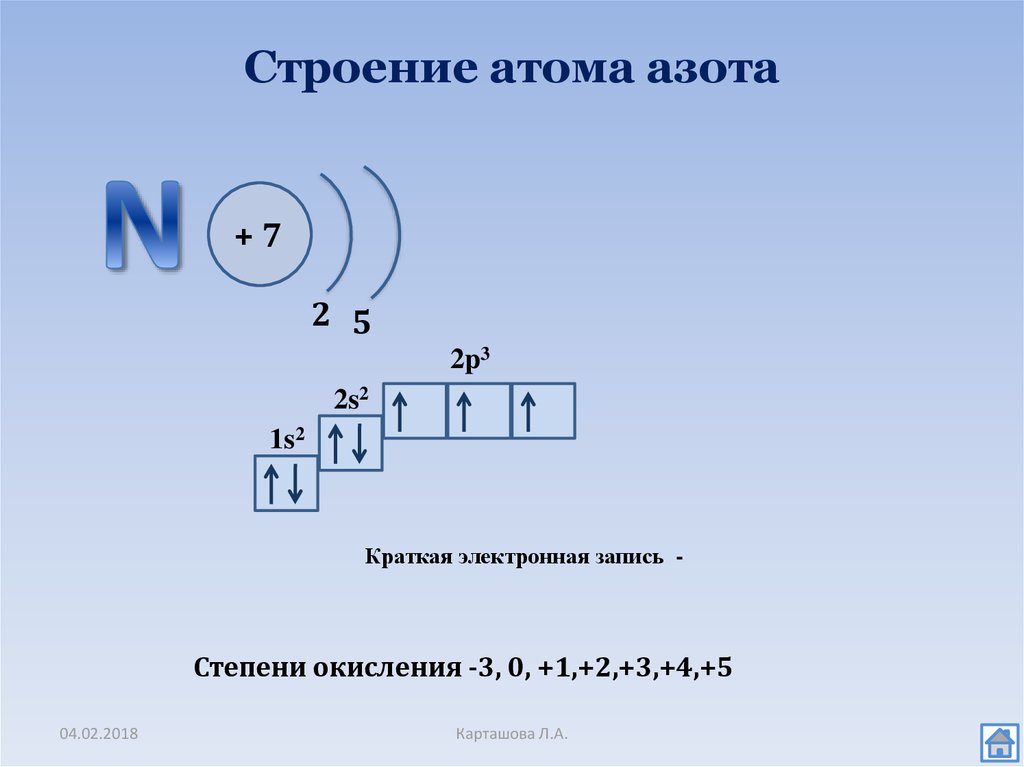 0100 Атомная масса атомов просто складывается из протонов и нейтронов в его ядре .
0100 Атомная масса атомов просто складывается из протонов и нейтронов в его ядре .
Но количество нейтронов различается (изотопы)
Однако в любом типе атома будут некоторые различия в количестве нейтронов, так как же мы можем объявить точную атомную массу? Что ж, ученые просто используют среднее число нейтронов для любого типа атома при определении атомной массы. Например, у углерода в целом 6 протонов, но на самом деле в среднем 6,0107 нейтронов. Таким образом, атомная масса углерода равна 12,0107. , НО ДЛЯ НАШИХ ЦЕЛЕЙ МОЖНО ОКРУГЛИТЬ АТОМНУЮ МАССУ ДО 12.
Кислород имеет 8 протонов и 8 электронов. Хотя большинство атомов кислорода имеют 8 нейтронов, у некоторых может быть меньше, поэтому общее число нейтронов для кислорода составляет в среднем 7,9994. Но для наших целей мы можем просто сказать 8 нейтронов.
Короткое видео об атомах и изотопах:
Символы периодической таблицы
Периодическая таблица представляет собой организованное визуальное представление всей информации о 94 типа атомов (то есть элементов), аккуратно размещенных в таблице данных. Каждый атом или элемент представлен символом, который дает информацию об атоме.
Каждый атом или элемент представлен символом, который дает информацию об атоме.
Здесь вы видите символ атома углерода в периодической таблице.
~ Атомный номер 6 (имеет 6 протонов)
~ Символ C (для углерода, да).
~ Имя Карбон.
~ Средняя атомная масса 12,0107. Атомная масса равна протонам + нейтронам. Большинство атомов углерода имеют 6 нейтронов, но у некоторых их больше. Таким образом, среднее число нейтронов равно 6,0107. Итак, атомная масса равна 12,0107. Но для наших целей мы можем просто округлить до 12,9.0009
Вот несколько периодических таблиц, которые вы можете найти в Интернете. Пожалуйста, просмотрите эти графики и ознакомьтесь с их информацией.
Простой цвет: http://go.hrw.com/resources/go_sc/periodic/SSHK1PER.PDF
Цвет: http://www.ktf-split.hr/periodni/download/en-color100.pdf
Черный и белый: http://www.ktf-split.hr/periodni/download/en-black.pdf
Еще о периодической таблице (более тяжелые и крупные атомы)
Периодическая таблица представляет собой диаграмму, показывающую увеличение количества протонов с водородом (H) в верхнем левом углу в качестве первого элемента, потому что он имеет только 1 протон. Затем справа находится гелий (He), так как у него 2 протона. Затем снова налево с литием (Li) с 3 протонами и так далее по схеме.
Затем справа находится гелий (He), так как у него 2 протона. Затем снова налево с литием (Li) с 3 протонами и так далее по схеме.
Обратите внимание, что более крупные атомы, то есть атомы, содержащие много протонов и нейтронов, расположены внизу диаграммы. Эти «более тяжелые» элементы имеют большую массу , то есть больше частиц и буквально весит больше . У них также намного больше нейтронов, чем протонов. Правило состоит в том, что обычно атом имеет то же количество нейтронов, что и протоны, в основном относится к меньшим атомам в первых 3-х рядах Периодической таблицы .
Тяжелый элемент борий (Bh) имеет 107 протонов, но его атомная масса равна 264. Итак, 264 – 107 = 157 нейтронов в среднем для атомов бория. Это много нейтронов и делает атом более массивным. Борий и другие более тяжелые атомы определенно содержат больше нейтронов в ядре, чем протонов.
Часть 3. Материя, ионная и ковалентная связь (молекула и решетка) Материя, ионная и ковалентная связь (молекула и решетка) |
Материя
Когда одни и те же типы атомов соединяются вместе, чтобы создать вещество, это вещество называется элементом, потому что оно состоит из атомов только одного типа. Но разные элементы могут соединяться вместе, образуя соединения.
Соединения
Соединения представляют собой вещества, образованные двумя или более типами элементов (атомов), объединяющимися для создания совершенно нового вещества, чем составляющие его элементы. Например, элемент хлор (Cl) может соединяться с элементом натрия (Na), и тогда создается новое вещество, поваренная соль (NaCl). Элемент кислород (газ) может соединяться с элементом водородом (тоже газ), и тогда создается новое вещество, вода (h3O, жидкость).
Два типа связи атомов: ионная и ковалентная
Когда разные типы атомов объединяются (то есть связываются друг с другом) для создания нового вещества, существует два типа связи атомов. Один называется ионная связь , а другая называется ковалентной связью .
Один называется ионная связь , а другая называется ковалентной связью .
Ковалентная связь для воды; Внешние оболочки имеют общие электроны
Ионная связь
Ионная связь – это положительные и отрицательные электрические заряды, притягивающие друг друга (аналогично северному и южному концам магнита, притягивающим друг друга).
Ковалентная связь
Ковалентная связь представляет собой самую внешнюю оболочку электронов, совместно используемую другими атомами за пределами большинства электронных оболочек. Молекулы воды являются примером ковалентной связи.
| Помните, ~ Ионная связь – это положительные и отрицательные ионы, притягивающие друг друга (как магниты). ~ Ковалентная связь — это две или более молекулы с общими электронами. 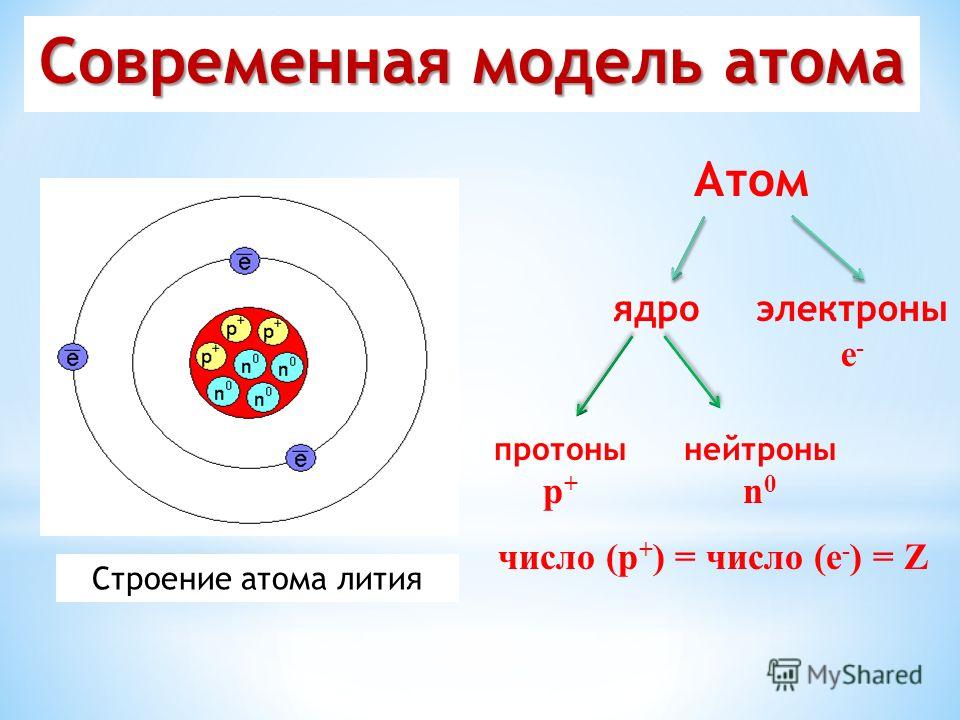 |
Ионы — это атомы, которые приобрели или потеряли электроны
Ион — это атом, который потерял или приобрел электроны, так что он больше не является нейтрально заряженным атомом. Например, атом кислорода может получить электрон и стать отрицательно заряженным атомом кислорода, потому что теперь у него на один отрицательный электрон больше, чем у положительных протонов.
Или, если атом кислорода теряет электрон, он становится положительно заряженным ионом, потому что у него больше положительных протонов, чем отрицательных электронов.
Примеры молекул, образованных различными атомами
Молекулы
Молекулы представляют собой группы атомов, связанных вместе для создания нового типа материи (то есть соединения). Молекулы образованы ковалентной связью (общие внешние электроны) . Многие, но не все вещества создаются атомами, соединяющимися в молекулы.
Атомы ионов могут объединяться, образуя соединения- (ионные связи)
Когда атомы приобретают или теряют электрон и поэтому становятся положительно или отрицательно заряженными, эти атомы могут притягиваться или связываться друг с другом. Отрицательно заряженные атомы притягиваются к положительно заряженным и наоборот. Таким образом, ионы могут связываться за счет притяжения. Например, отрицательно заряженные ионы хлора, притягиваясь к положительно заряженным ионам натрия, объединяются в поваренную соль.
Ионная связь создает решетку (не молекулы). Минералы состоят из решетчатой структуры .
Ионная связь образует не молекулы, а минеральное вещество
Ковалентная связь образует молекулы. Ионная связь образует минералы. Минералы представляют собой комбинацию 90 100 различных типов элементов, которые связываются за счет положительно-отрицательного притяжения, а не путем образования молекул.
Решетчатая структура (также называемая матрицей), но не молекулы
Структура ионной связи называется 9решетка 0017 или матрица .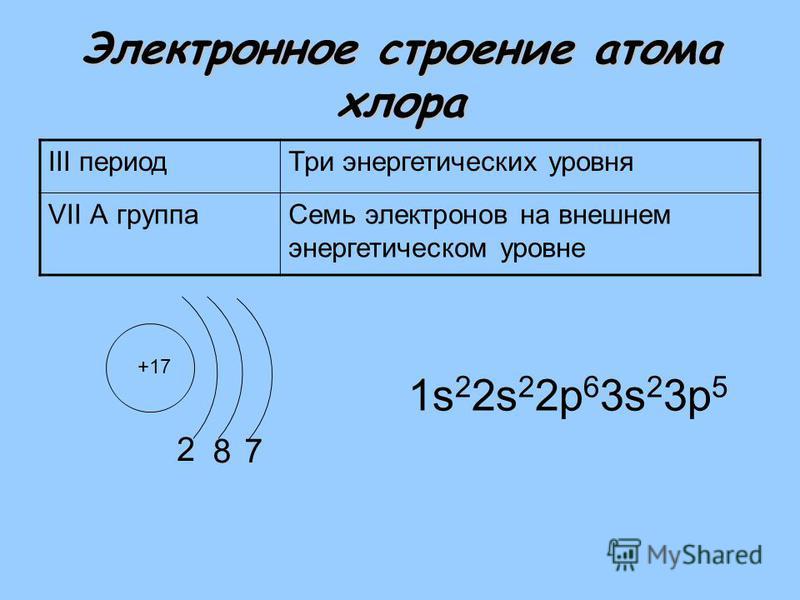 Это повторяющаяся структура атомов, которая образует вещества. Ковалентная связь образует повторяющиеся молекулы, а ионная связь образует повторяющиеся матрицы решетки. В обоих случаях у вас есть много разных типов веществ, созданных атомами, связанными друг с другом.
Это повторяющаяся структура атомов, которая образует вещества. Ковалентная связь образует повторяющиеся молекулы, а ионная связь образует повторяющиеся матрицы решетки. В обоих случаях у вас есть много разных типов веществ, созданных атомами, связанными друг с другом.
Смеси
A Смесь веществ без химической связи
Смеси (физические твердые частицы)
Когда разные соединения смешиваются вместе, получается смесь. Например, если взять пакет соли и смешать его с пакетом перца, получится смесь соли и перца. Важным моментом здесь является то, что соль остается солью, а перец остается перцем, и не происходит химической связи. Два типа материи, соль и перец, просто смешаны вместе, вот и все. Их можно было разлучить.
Растворы – это частицы в жидкостях
Частицы в воде могут быть очень маленькими; раствор
растворы (частицы в жидкости)
раствор – это когда тип вещества смешивается с водой. Поскольку вода хорошо растворяет вещество, оно в конечном итоге распадается на крошечные кусочки, невидимые для глаз. Эти крошечные кусочки взвешены в воде и могут быть невидимыми или придавать воде цвет.
Поскольку вода хорошо растворяет вещество, оно в конечном итоге распадается на крошечные кусочки, невидимые для глаз. Эти крошечные кусочки взвешены в воде и могут быть невидимыми или придавать воде цвет.
Например, если взять сахар, насыпать немного в банку с водой и размешать воду, в конце концов, частицы сахара, казалось бы, исчезнут, но, конечно же, это не так. Вместо этого сахар просто растворился в такие маленькие кусочки, что их уже не видно. Выпейте воду, и она будет сладкой с сахаром. Это называется решением .
Четыре состояния материи
Вся материя обычно существует в 3 состояниях, хотя технически существует 4-е состояние материи:
твердые, жидкие, газообразные и плазменные . Вода — прекрасный пример трех состояний материи.
Вода, например, может быть льдом , твердым телом, или водой , жидкостью или паром в воздухе , который находится в газообразном состоянии.

 Я предложил Михаилу назвать расы ― лантаноиды и актиноиды, и ему это понравилось. Таким образом мы придумали не просто визуальный контент, но и добавили к нему определенный сторителлинг, чтобы повысить эффект сопричастности», ― вспоминает директор центра юзабилити и смешанной реальности, доцент факультета программной инженерии и компьютерной техники Университета ИТМО Артем Смолин.
Я предложил Михаилу назвать расы ― лантаноиды и актиноиды, и ему это понравилось. Таким образом мы придумали не просто визуальный контент, но и добавили к нему определенный сторителлинг, чтобы повысить эффект сопричастности», ― вспоминает директор центра юзабилити и смешанной реальности, доцент факультета программной инженерии и компьютерной техники Университета ИТМО Артем Смолин. ― Затем подключился дизайнер Алексей Коротких, мы приступили к работе над самим проектом. Процесс напоминал игру “Сапер”. Самый большой “подрыв” произошел в прошлом ноябре, когда игра была почти закончена. Однако движок в этот момент обновился, и определенный функционал исчез. Поэтому нам пришлось искать альтернативу».
― Затем подключился дизайнер Алексей Коротких, мы приступили к работе над самим проектом. Процесс напоминал игру “Сапер”. Самый большой “подрыв” произошел в прошлом ноябре, когда игра была почти закончена. Однако движок в этот момент обновился, и определенный функционал исчез. Поэтому нам пришлось искать альтернативу». ― Вторая стратегия более рискованная. Ты примерно пристрелялся, увидел некий диапазон возможных элементов, и ты рискуешь, называешь элемент. Если ты неправ ― ты проиграл, если прав ― выиграл. Поскольку тут в дело вступает азарт, игра затягивает, что помогает в конечном счете запоминанию предмета».
― Вторая стратегия более рискованная. Ты примерно пристрелялся, увидел некий диапазон возможных элементов, и ты рискуешь, называешь элемент. Если ты неправ ― ты проиграл, если прав ― выиграл. Поскольку тут в дело вступает азарт, игра затягивает, что помогает в конечном счете запоминанию предмета». Тут началась пандемия, и у меня появилась возможность доработать игру и убрать оставшиеся “косяки”. А к июню мы смогли опробовать наше детище».
Тут началась пандемия, и у меня появилась возможность доработать игру и убрать оставшиеся “косяки”. А к июню мы смогли опробовать наше детище». Смотрите прямо сейчас на Wondrium.
Смотрите прямо сейчас на Wondrium. 