Строение атома и периодический закон
Строение атома. Периодический закон
Задача;Каков состав изотопа ?
Решение:
Число протонов, содержащихся в ядре, Z = 24. Так как сумма протонов и нейтронов, содержащихся в ядре, равна 52, то число нейтронов равно 28. Электронная оболочка состоит из числа электронов, число которых равно числу протонов, т.е. 28, так как атом электронейтрален.
Задача № 2. Найти число орбиталей, определенное следующим энергетическим состоянием: 5f, 2s, 3d, 4р. Определить максимальное число электронов, характеризующихся этими энергетическими состояниями.
Задача;Найти число орбиталей для энергетического состояния 5f.
Решение:
5f- пятый энергетический уровень — п = 5, подуровень f
(1 = 3). При 1 = 3 магнитное квантовое число принимает значения: -3, -2, -1, О, 1, 2, 3. Таким образом, число орбиталей равно 7. Каждая орбиталь может содержать максимально 2 электрона. Максимальное число электронов, характеризующихся энергетическим состоянием 5f, равно 14.
Каждая орбиталь может содержать максимально 2 электрона. Максимальное число электронов, характеризующихся энергетическим состоянием 5f, равно 14.
Описать орбиталь, характеризующуюся следующими квантовыми числами: .
Решение:
1 = 0- это s-орбиталь, имеющая сферическую конфигурацию, орбиталь находится на третьем энергетическом уровне (3s) и имеет единственно возможную ориентацию в пространстве .
Задача № 4. Составить электронную и электронно-графическую формулы в невозбужденном состоянии.
Составить электронную и электронно-графическую формулы Са.
Решение:
Задача № 5. Составить электронные формулы ионов:
Составить электронные формулы
Решение:
Задача;Дать полную характеристику кремния.
Порядковый номер — 14.
Число протонов в ядре — 14.
Заряд ядра — +14.
Относительная атомная масса — 28.
Число нейтронов в наиболее распространенном изотопе ()- 14.
Число электронов в электронной оболочке — 14.
Число электронных слоев — 3.
Число валентных электронов — 2 (холостые электроны, находящиеся на последнем энергетическом уровне).
Валентность атома:
а) в невозбужденном состоянии — 2;
б) в возбужденном состоянии — 4.
Местоположение кремния в периодической системе — кремний находится в третьем периоде, в главной подгруппе четвертой группы.
К какому семейству относится: Si — р-элемент?
Металл или неметалл согласно значению электроотрицательности: значение электроотрицательности кремния — 1,8, т.е. это химический элемент, занимающий промежуточное положение между металлами и неметаллами — переходный элемент.
Более или менее электроотрицателен, чем:
а) в сравнении с соседями по группе — кремний более электроотрицателен, чем германий, но менее электроотрицателен, чем углерод;
б) в сравнении с соседями по периоду — кремний более электроотрицателен, чем алюминий, но менее электроотрицателен, чем фосфор.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
Задачи к разделу основы строения атомов
Решение: Главное квантовое число n характеризует энергию и размер орбитали и принимает значения только целых чисел от 1 до ∞.
Побочное квантовое число (орбитальное) l характеризует геометрическую форму орбитали и для каждого энергетического уровня принимает значения целых чисел от 0 до (n-1).
В многоэлектронных атомах энергия электрона зависит и от значения l. Поэтому состояние электрона, характеризующееся различными значениями l называют энергетическими подуровнями:
l=0, s-орбитали имеют форму шара
l=1, p-орбитали имеют форму гантели
l=2, d-орбитали имеют более сложную форму
l=3, f-орбитали имеют более сложную форму
Магнитное квантовое число ml характеризует направление орбитали в пространстве и принимает значение от –l … 0 … +l .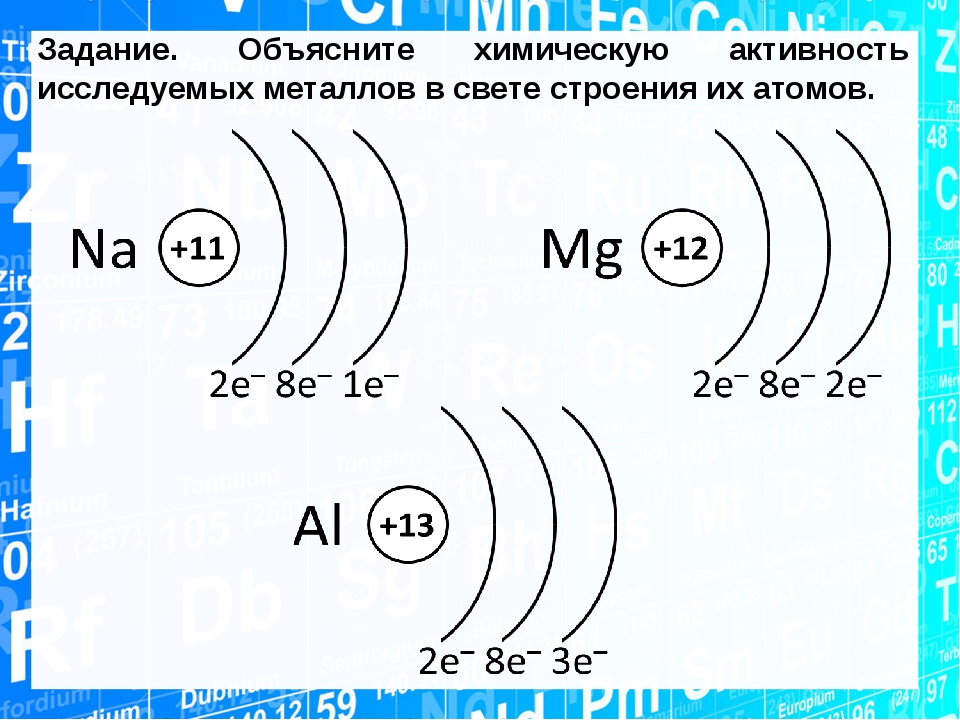
s-подуровень характеризуется значением l=0, ml= 0
p-подуровень характеризуется значением l=1, ml= -1; 0; +1 (3 орбитали)
d-подуровень характеризуется значением l=2, ml= -2; -1; 0; +1; +2 (5 орбиталей)
f-подуровень характеризуется значением l=3, ml= -3; -2; -1; 0; +1; +2; +3 (7 орбиталей)
ml определяет количество орбиталей на данном энергетическом подуровне атома.
Спиновое квантовое число ms характеризует вращение электрона вокруг своей оси и принимает значениея + ½ и – ½.
На 4 уровне для внешнего слоя атома возможны 4s, 4p, 4d энергетические состояния.
Распишем для них набор квантовых чисел:
4s: n =4, l = 0, ml= (2l+1)=1 (1 орбиталь), ms = ±½
4p: n =4, l = 1, ml= (2l+1)=3 (3 орбитали -1,0,+1), ms = ±3½
4d: n =4, l = 2, ml= (2l+1)=5 (5 орбитали -2,-1,0,+1,+2), ms = ±5½
ms указана для максимального числа электронов.
Максимальное число электронов на на p-подуровне равно 6 согласно принципу Паули:
2(2l+1)=2(2+1)=6
Решение задач по теме Строение атома и атомного ядра
Умение решать задачи — практическое искусство,
подобное плаванию или катанию на лыжах,
или игре на фортепиано: научиться этому можно,
лишь подражая избранным образцам и постоянно тренируясь.
Дьёрдь Пойа
В данной теме вспомним основные законы и понятия, а также закрепим знания при решении конкретных задач по данной теме.
Радиоактивность — это явление самопроизвольного превращения неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием частиц, обладающих большой проникающей способностью.
В
1911 году в результате проведения серии опытов Резерфорд предложил ядерную
модель атома согласно которой, в центре атома находится положительно
заряженное ядро, занимающее очень малый объем атома.
В результате опытов, Резерфорд обнаружил три вида ранее не известных излучения — a-, b- и g-излучения.
a-распад характеризуется вылетом ядра атома гелия.
b-распад состоит в том, что ядра самопроизвольно испускают электрон.
g-излучение —это поток g–квантов. Испускание γ-излучения не приводит к превращениям элементов, оно излучается не атомом, а ядром.
В 1932 году, когда был открыт нейтрон, советским физиком Дмитрием Дмитриевичем Иваненко и немецким физиком Вернером Гейзенбергом была предложена протонно-нейтронная модель строения ядер, справедливость которой была впоследствии подтверждена экспериментально.
По
этой теории все ядра состоят из двух видов частиц — протонов и нейтронов. Протоны и нейтроны называются нуклонами (от латинского нуклеус — ядро).
Протоны и нейтроны называются нуклонами (от латинского нуклеус — ядро).
Общее число нуклонов в ядре называется массовым числом
Число протонов в ядре называется зарядовым числом и обозначается буквой Z. Для каждого химического элемента зарядовое число равно порядковому номеру в таблице Менделеева.
Гипотеза о том, что атомные ядра состоят из протонов и нейтронов, подтверждалась многими экспериментальными фактами. Это свидетельствовало о справедливости протонно-нейтронной модели строения ядра.
Но возникал вопрос: почему ядра не распадаются на отдельные нуклоны под действием сил электростатического отталкивания между положительно заряженными протонами?
Расчеты
показывают, что нуклоны не могут удерживаться вместе за счет сил притяжения
гравитационной или магнитной природы, поскольку эти силы существенно меньше
электростатических. В поисках ответа на вопрос об устойчивости атомных ядер
ученые предположили, что между всеми нуклонами в ядрах действуют какие-то
особые силы притяжения, которые значительно превосходят электростатические силы
отталкивания между протонами. Эти силы назвали
В поисках ответа на вопрос об устойчивости атомных ядер
ученые предположили, что между всеми нуклонами в ядрах действуют какие-то
особые силы притяжения, которые значительно превосходят электростатические силы
отталкивания между протонами. Эти силы назвали
Ядерные силы — это силы, удерживающие нуклоны в ядре, представляющие собой большИе силы притяжения, действующие только на малых расстояниях.
Для того,чтобы разбить ядро на отдельные, не взаимодействующие между собой нуклоны, необходимо произвести работу по преодолению этих сил, т. е. сообщить ядру определенную энергию. И, наоборот, при соединении свободных нуклонов в ядро выделяется такая же энергия.
Минимальная энергия, необходимая для расщепления ядра на отдельные нуклоны, называется энергией связи ядра.
Дефект
массы — это недостаток массы ядра по сравнению с суммарной
массой составляющих его нуклонов.
Важной характеристикой ядра служит средняя энергия связи, приходящаяся на один нуклон (так называемая удельная энергия связи ядра). Чем она больше, тем сильнее связаны между собой нуклоны, тем прочнее ядро.
Таким образом, удельная энергия связи — это средняя энергия связи, приходящаяся на один нуклон.
Процесс взаимодействия атомного ядра с другим ядром или элементарной частицей, сопровождающийся изменением состава и структуры ядра и выделением большого количества энергии называется
Ядерная реакция характеризуется энергетическим выходом реакции, равной разности энергий покоя ядра и частиц до реакции и после нее.
Напомним, что радиоактивные излучения вызывают ионизацию атомов и молекул вещества, поэтому их часто называют ионизирующими излучениями.
Степень
и характер отрицательного воздействия радиации зависят от нескольких факторов,
в частности, от того, какая энергия передана потоком ионизирующих частиц
данному телу и какова масса этого тела.
Поглощенной дозой излучения называют величину, равную отношению энергии ионизирующего излучения, поглощенной облучаемым веществом, к массе этого вещества.
В связи с тем, что при одной и той же поглощенной дозе разные излучения вызывают различные биологические эффекты, то для оценки этих эффектов была введена величина, называемая эквивалентной дозой излучения.
Эквивалентная доза излучения — это величина, определяющая воздействие излучения на организм, и равная произведение поглощенной дозы на коэффициент качества.
Известно, что энергия является одним из факторов, определяющих степень отрицательного воздействия излучения на человека.
Поэтому важно было найти количественную зависимость, по которой можно было бы рассчитать, сколько радиоактивных атомов остается в веществе к любому заданному моменту времени.
Для
вывода этой зависимости мы ввели физическую величину, называемой периодом
полураспада.
Период полураспада — это промежуток времени, в течении которого распадается половина первоначального количества ядер.
В 1903 году Фредерик Содди получил формулу, являющуюся аналитическим выражением закона радиоактивного распада, по которой можно определить число распавшихся ядер за любой промежуток времени.
Для количественной характеристики числа распадов в единицу времени вводится физическая величина, называемая активностью радиоактивного элемента.
Задача 1. Определите, ядра каких элементов образуются в результате a-распада ядра и b-распада .
|
Дано: |
Решение: Рассмотрим α-распад ядра урана. В ядерных реакциях суммарный
электрический заряд во входном канале равен суммарному электрическому заряду
в выходном канале. 3.В ядерных реакциях сумма массовых чисел до реакции равна сумме массовых чисел после реакции. По таблице Дмитрия Ивановича Менделеева находим, что искомый элемент — изотоп тория. Рассмотрим β-распад ядра цезия. По таблице Менделеева находим, что искомый элемент — это изотоп бария. |
Ответ: , .
Задача 2. Определите удельную энергию связи ядра атома .
|
Дано: |
Решение: 1. По формуле N = A – Z определим количество протонов Z и нейтронов N в ядре атома Запишем формулу для энергии связи атомного ядра Запишем формулу для расчёта удельной энергии связи атомного ядра |
|
|
Ответ:
6,9274 МэВ/нуклон.
Задача 3. Определите полезный энергетический выход ядерной реакции, в которой при облучении изотопа протонами , энергия которых составляет 1,2 МэВ, образуется углерод и a-частица .
|
Дано: |
Решение: Запишем ядерную реакцию взаимодействия изотопа азота с протоном. Запишем формулу энергетического выхода ядерной реакции: Исходная ненулевая кинетическая энергия протона увеличивает кинетическую энергию продуктов реакции, но не изменяет ее полезного энергетического выхода. |
Задача
4.
Рассчитайте, какова электрическая мощность атомной электростанции, которая
расходует в сутки 220 грамм изотопа урана U-235
и имеющей КПД 25 %.
|
Дано: m = 220 г |
Решение: Дефект масс при делении 1 ядра атом урана Энергия связи Мощность рассчитывается по формуле Где общая энергия Е определяется по формуле Общее число ядер урана определяется по выражению Тогда электрическая мощность атомной электростанции равна |
|
P – ? |
Ответ: 53 МВт.
Задача
5.
Радиоактивный препарат в начальный момент времени содержит 800 радиоактивных
ядер. Вычислите количество не распавшихся радиоактивных ядер через время,
равное одному, двум, трем, четырем периодам полураспада. Полученные значения
внесите в таблицу. По данным таблицы постройте график зависимости числа
нераспавшихся ядер от времени в процессе радиоактивного распада.
Полученные значения
внесите в таблицу. По данным таблицы постройте график зависимости числа
нераспавшихся ядер от времени в процессе радиоактивного распада.
|
Дано: N = 800 t1 = T t2 = 2T t3 = 3T t4 = 4T |
Решение: Количество не распавшихся радиоактивных ядер зависит от времени жизни радиоактивного элемента, согласно закону радиоактивного распада, и определяется разностью между первоначальным количеством ядер и количеством распавшихся ядер за данный промежуток времени Тогда, за время, равное периоду полураспада, количество не распавшихся ядер будет равно За время, равное двум периодам полураспада, количество не распавшихся ядер равно За время, равное трем периодам полураспада А за время, равное четырем периодам полураспада Полученные значения заносим в таблицу и, по данным таблицы строим график зависимости числа нераспавшихся ядер от времени в процессе радиоактивного распада
|
||||||||||||
Подготовка к ЕГЭ по химии.
 Тематический тест №1
Тематический тест №1 Электронная конфигурация атома. Строение электронных оболочек. s-, p-, d-, f-элементы
Данный онлайн-тест – первый из серии тематических тестов по химии для подготовки к ЕГЭ. Вам предстоит ответить на несколько вопросов, которые могут встретиться на реальном ЕГЭ по химии.
Тематика данного теста соответствует тематике задания №1, предлагаемого в вариантах “настоящего” ЕГЭ. Обсуждаются следующие темы: “Строение атома”, “Строение электронных оболочек атомов”, “s-, p-, d- f- элементы”, “Основное и возбужденное состояния атомов”, “Распределение электронов по уровням”.
Чтобы сделать этот тест интересным для абитуриентов с разным уровнем подготовки, я разделил его на три части. Первые пять вопросов – самые легкие. Они предназначены для тех, кто готовится к ЕГЭ по химии “с нуля”. Вопросы 6 – 10 чуть сложнее – для выпускников “обычных” школ, добросовестно изучавших курс химии в течение 3 – 4 лет.
Задания 11-15 – наиболее сложные. Их уровень существенно выше уровня ЕГЭ. На вопросы 11 – 15 интересно будет отвечать тем ребятам, которые готовятся к олимпиадам по химии, мечтают сдать ЕГЭ на 90 – 100 баллов.
Не пытайтесь решать все задания, выбирайте те, которые будут интересны именно вам. Если вы только начинаете изучение химии, ограничьтесь первыми пятью задачами. Если вы учитесь в специализированном химическом классе, попробуйте пройти III часть теста.
Как интерпретировать результаты тестов?
Если вы набираете 4-5 баллов в первой части теста и 4-5 баллов во второй, можете считать, что тема “Строение электронных оболочек атомов” усвоена вами отлично. Если во второй части вы сможете решить правильно менее 4 заданий, советую еще немного поработать над данной темой.
Если вы не только легко справились с задачами 1-10, но и набрали хотя бы 3 балла в III части теста, положительная оценка на ЕГЭ за задание №1 гарантирована!
Другие материалы для подготовки к ЕГЭ по химии
Если вас интересуют полные тесты ЕГЭ или ОГЭ (ГИА) по химии или другие тематические тесты, рекомендую обратить внимание на следующие ссылки:
Тематический тест № 3 (подготовка к ЕГЭ по химии)Тематический тест № 5 (подготовка к ЕГЭ по химии)
Тематический тест № 8 (подготовка к ЕГЭ по химии)
Тематический тест № 14 (подготовка к ЕГЭ по химии)
Тест для подготовки к ОГЭ по химии (№ 1)
Тест для подготовки к ОГЭ по химии (№ 2)
Тест для подготовки к ЕГЭ по химии (№ 1)
Тест для подготовки к ЕГЭ по химии (№ 2)
Тест для выпускников, готовящихся к ЕГЭ (I часть)
Тест для выпускников, готовящихся к ЕГЭ (II часть)
Тест для выпускников, готовящихся к ЕГЭ (III часть)
Желаю всем успехов на экзаменах по химии!
Тест II уровня
Тест III уровня
Как решать строение атомов: алюминий Заранее спасибо
Найди побутову положение оптического центра линзы в фокусе и акация линза собирали началось сильно MN главная оптическая ось линзы а цветная точка А1 … её изображение
Пользуясь таблицей растворимости, определите какие вещества, могут образовывать перечисленные ниже ионы: K+, Sr2+, H+, Cl-, CO3²-, NO³-, NO3-, Sr²+
Выбери характеристику, не относящуюся к уравнению реакции. KNO3(тв) + 34,89 кДж = K* (водн) + NO 3(водн) Кинетическая энергия молекул продукта уменьша
… ется, Потенциальная энергия молекул продукта увеличивается. Температура реакционной смеси снижается. энтальпия отрицательна. СРОЧНО ПОМОГИТЕ ПОЖАЛУЙСТА
KNO3(тв) + 34,89 кДж = K* (водн) + NO 3(водн) Кинетическая энергия молекул продукта уменьша
… ется, Потенциальная энергия молекул продукта увеличивается. Температура реакционной смеси снижается. энтальпия отрицательна. СРОЧНО ПОМОГИТЕ ПОЖАЛУЙСТА
Уравнение диссоциации: KNO3, LiF, Na2SO4 Дать названия полученным ионам.
Насіння помідорів перед посівом упродовж доби витримують у розчині мідного купоросу з масовою часткою 0,2% або розчині марганцівки з масовою часткою 0 … ,5%. Обчисліть масу солей та води для приготування розчинів: I- масою 3 кг; II- масою 2 кг
100 баллов срочно аааа
ПОЖАЛУЙСТА ПОМОГИТЕ СРОЧНО ОЧЕНЬ НУЖНО ЗАДАНИЕ 1 Элементы с постоянной валентностью:NNaCrSHЗАДАНИЕ 2Определите валентность железа в соединении FeO.Отв
… ет запишите римской цифрой, используя английскую раскладку клавиатуры. Например: IVЗАДАНИЕ 3Установите соответствие между формулой вещества и валентностью серы.Ответ запишите в виде сочетания букв и цифр без пробелов и запятых, соблюдая алфавитную последовательность букв, например, а5б4в1. а) SO2 1. Iб) SO3 2. IIв) h3S 3. III 4. IV 5. V 6. VI 7. VII
а) SO2 1. Iб) SO3 2. IIв) h3S 3. III 4. IV 5. V 6. VI 7. VII
Вкажіть елементи, які мають найбільшу схильність до утворен- ня йонного зв’язку: S, N, Ca, K
определите где содержится больше атомов? в 10 грамма железа или 10 грамах серы? рассчитайте количества атомов железа? рассчитайте количества атомов се … ры? сравните какое вещество содержит большее количество атомов?
3. В термос с водой, температура которой 50°C, опустили кубик льда. Будет ли лед таять? 4 5 Может ли вода быть жидкой при температуре -50°С? Перепишит … е таблицу в тетрадь. Установите соответствие между температу- рами и агрегатным состоянием воды: Температура +100°С В 0°C d -20°С а Агрегатное состояние воды а) твердое б) жидкое в) газообразное +50°C – 200°С а задания 3, 4, 5 СРОЧНО! заранее огромное спасибо!
Строение атома кадмия,Магния, Радия и Таллия. Помогите решить ! 40баллов
1. Строение атома магния:
а) модель атома магния при помощи дуг:
₁₂Mg)₂)₈)₂
б) модель атома магния при помощи электронной формулы:
₁₂Mg1s²2s²2p⁶3s²
в) электронно-графическая модель атома магния:
3 уровень s ⇵
p ⇅⇅⇅
2 уровень s⇅
1 уровень s⇅
₁₂Mg
2. Строение атома радия:
Строение атома радия:
а) модель атома радия при помощи дуг:
₊₈₈Ra )₂)₈)₁₈)₃₂)₁₈)₈)₂
б) модель строения атома радия при помощи электронной формулы:
₊₈₈Ra 1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁶4d¹⁰4f¹⁴5s²5s²5p⁶5d¹⁰6s²6p⁶7s²
в) электронно-графическая модель атома радия:
7 уровень s ⇵
p ⇅⇅⇅
6 уровень s ⇵
d ⇅⇅⇅⇅⇅
p ⇅⇅⇅
5 уровень s ⇵
f ⇅⇅⇅⇅⇅⇅⇅
d ⇅⇅⇅⇅⇅
p ⇅⇅⇅
4
уровень s ⇵
d ⇅⇅⇅⇅⇅
p ⇅⇅⇅
3 уровень s ⇵
p
⇅⇅⇅
2 уровень s⇅
1 уровень s⇅
₊₈₈Ra
3. Строение атома таллия:
а) модель атома таллия при помощи дуг:
₊₈₁TI )₂)₈)₁₈)₃₂)₁₈)₃
б) модель строения атома таллия при помощи электронной формулы:
₊₈₁TI 1s²2s²2p⁶3s²3p⁶3d¹⁰4s²4p⁶4d¹⁰4f¹⁴5s²5s²5p⁶5d¹⁰6s²6p¹
в) электронно-графическая модель атома таллия:
p ↑
6 уровень s ⇵
d ⇅⇅⇅⇅⇅
p ⇅⇅⇅
5 уровень s ⇵
f ⇅⇅⇅⇅⇅⇅⇅
d ⇅⇅⇅⇅⇅
p ⇅⇅⇅
4 уровень s ⇵
d ⇅⇅⇅⇅⇅
p ⇅⇅⇅
3 уровень s ⇵
p ⇅⇅⇅
2 уровень s⇅
1 уровень s⇅
₊₈₁TI
Структура материи
Мир статического электричества во многом совпадает с повседневным миром, с которым вы сталкиваетесь. Одежда валяется в сушилке и слипается. Вы идете по ковру, чтобы выйти из комнаты, и получаете удар дверной ручки. Вы снимаете шерстяной свитер в конце дня и видите электрические искры. Во время засухи зимы вы выходите из машины и получаете удар дверью, когда пытаетесь закрыть дверь. Когда вы стягиваете шерстяное одеяло с простыни, видны электрические искры.Вы гладите кошку по шерсти и наблюдаете, как мех встает дыбом. Во время весенней грозы по вечернему небу мчатся молнии. И что самое трагичное, у тебя день с плохой прической. Все это явления статического электричества – события, которые можно объяснить только пониманием физики электростатики.
Одежда валяется в сушилке и слипается. Вы идете по ковру, чтобы выйти из комнаты, и получаете удар дверной ручки. Вы снимаете шерстяной свитер в конце дня и видите электрические искры. Во время засухи зимы вы выходите из машины и получаете удар дверью, когда пытаетесь закрыть дверь. Когда вы стягиваете шерстяное одеяло с простыни, видны электрические искры.Вы гладите кошку по шерсти и наблюдаете, как мех встает дыбом. Во время весенней грозы по вечернему небу мчатся молнии. И что самое трагичное, у тебя день с плохой прической. Все это явления статического электричества – события, которые можно объяснить только пониманием физики электростатики.
Не только электростатические явления пронизывают события повседневной жизни, без сил, связанных со статическим электричеством, жизнь, как мы знаем, была бы невозможна.Электростатические силы – как притягивающие, так и отталкивающие по своей природе – удерживают мир атомов и молекул вместе в идеальном равновесии. Без этой электрической силы материальные вещи не существовали бы. Атомы как строительные блоки материи зависят от этих сил. А материальные объекты, в том числе мы, земляне, состоят из атомов, и акты стояния и ходьбы, прикосновения и ощущения, обоняния и вкуса и даже мышления являются результатом электрических явлений. Электростатические силы – основа нашего существования.
Атомы как строительные блоки материи зависят от этих сил. А материальные объекты, в том числе мы, земляне, состоят из атомов, и акты стояния и ходьбы, прикосновения и ощущения, обоняния и вкуса и даже мышления являются результатом электрических явлений. Электростатические силы – основа нашего существования.
Один из основных вопросов, которые нужно задать в этом разделе «Класса физики»: как можно заряжать объект и какое влияние этот заряд оказывает на другие находящиеся поблизости объекты? Ответ на этот вопрос начинается с понимания структуры материи. Понимание заряда как фундаментальной величины требует, чтобы мы понимали структуру атома. Итак, мы начинаем этот раздел с того, что многим студентам может показаться кратким обзором раздела из курса химии.
История строения атома Поиск атома начался как философский вопрос. Именно натурфилософы Древней Греции начали поиск атома, задав такие вопросы, как: Из чего состоит материал , из которого состоит ? Как устроены материальные объекты? Есть ли базовая единица, из которой сделаны все предметы? Еще в 400 г.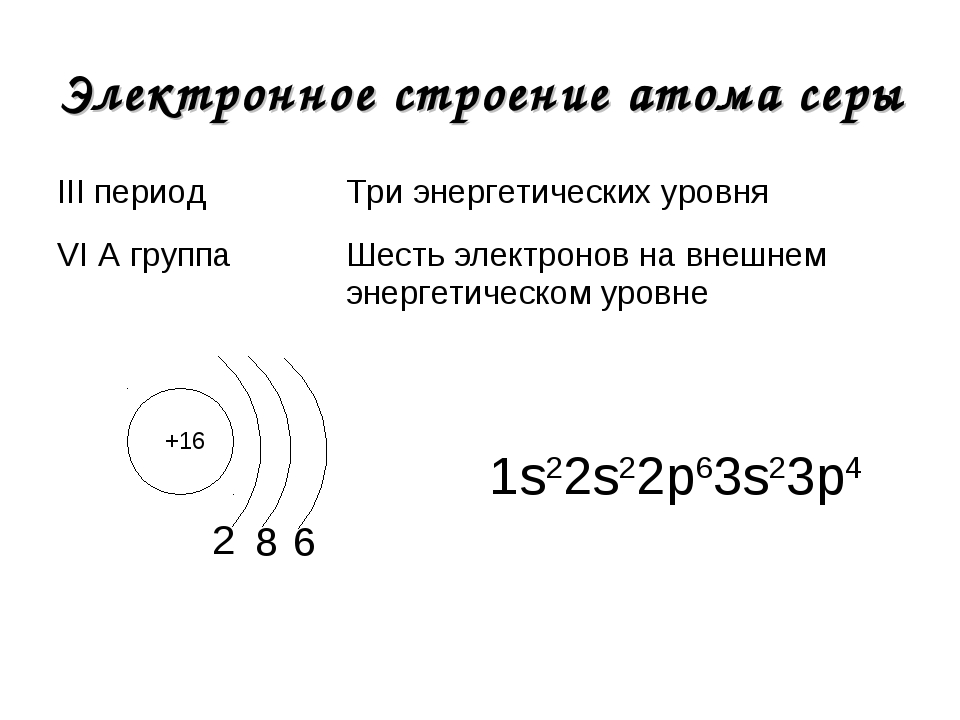 до н.э. некоторые греческие философы предположили, что материя состоит из неделимых строительных блоков, известных как atomos .( Atomos по-гречески означает «неделимый».) Для этих ранних греков материя не могла непрерывно дробиться и делиться бесконечно. Скорее, существовала базовая единица или строительный блок, который был неделим и лежал в основе его структуры. Этот неделимый строительный блок, из которого состоит вся материя, стал известен как атом.
до н.э. некоторые греческие философы предположили, что материя состоит из неделимых строительных блоков, известных как atomos .( Atomos по-гречески означает «неделимый».) Для этих ранних греков материя не могла непрерывно дробиться и делиться бесконечно. Скорее, существовала базовая единица или строительный блок, который был неделим и лежал в основе его структуры. Этот неделимый строительный блок, из которого состоит вся материя, стал известен как атом.
Ранние греки были просто философами. Они не проводили экспериментов для проверки своих теорий. Фактически, наука как экспериментальная дисциплина не стала заслуживающей доверия и популярной практикой до примерно 1600-х годов.Таким образом, поиск атома оставался философским вопросом на протяжении нескольких тысячелетий. С 1600-х годов по настоящее время поиск атома превратился в экспериментальное занятие. Известны несколько ученых; среди них Роберт Бойл, Джон Далтон, Дж. Дж. Томсон, Эрнест Резерфорд и Нилс Бор.
Исследования Бойля (с середины до конца 1600-х годов) газообразных веществ продвинули идею о существовании различных типов атомов, известных как элементы. Дальтон (начало 1800-х годов) провел множество экспериментов, чтобы показать, что различные элементы могут объединяться в фиксированных соотношениях масс с образованием соединений.Впоследствии Дальтон предложил одну из первых теорий поведения атомов, которая была подтверждена фактическими экспериментальными данными.
Английский ученый Дж. Дж. Эксперименты Томсона с электронно-лучевыми лучами (конец XIX века) привели к открытию отрицательно заряженного электрона и первым идеям о строении этих неделимых атомов. Томсон предложил « Plum Pudding Model », предполагая, что структура атома напоминает любимый английский десерт – сливовый пудинг.Изюм, рассыпанный среди сливового пудинга, аналогичен отрицательно заряженным электронам, погруженным в море положительного заряда.
Спустя почти десять лет после Томсона знаменитые эксперименты Эрнеста Резерфорда с золотой фольгой привели к созданию ядерной модели атомной структуры. Модель Резерфорда предполагает, что атом состоит из плотно упакованного ядра с положительным зарядом, известного как ядро , окруженного отрицательно заряженными электронами. Хотя ядро было уникальным для атома Резерфорда, еще более удивительным было предположение, что атом состоит в основном из пустого пространства.Большая часть массы была упакована в ядро, которое было аномально малым по сравнению с действительным размером атома.
Модель Резерфорда предполагает, что атом состоит из плотно упакованного ядра с положительным зарядом, известного как ядро , окруженного отрицательно заряженными электронами. Хотя ядро было уникальным для атома Резерфорда, еще более удивительным было предположение, что атом состоит в основном из пустого пространства.Большая часть массы была упакована в ядро, которое было аномально малым по сравнению с действительным размером атома.
Нилс Бор усовершенствовал ядерную модель Резерфорда (1913), объяснив, что электроны находятся на орбитах вне ядра. Электроны были ограничены определенными орбитами фиксированного радиуса, каждая из которых характеризовалась собственными дискретными уровнями энергии. Хотя электроны могут быть перемещены с одной орбиты на другую, они никогда не смогут занять пространство между орбитами.
Взгляд Бора на квантованные уровни энергии был предшественником современных квантово-механических взглядов на атомы. Математическая природа квантовой механики запрещает обсуждение ее деталей и ограничивает нас кратким концептуальным описанием ее особенностей. Квантовая механика предполагает, что атом состоит из множества субатомных частиц. Три основных субатомных частицы – это протон, электрон и нейтрон. Протон и нейтрон – самые массивные из трех субатомных частиц; они расположены в ядре атома, образуя плотное ядро атома.Протон заряжен положительно. Нейтрон не имеет заряда и считается нейтральным. Протоны и нейтроны прочно связаны внутри ядра атома. За пределами ядра находятся концентрические сферические области пространства, известные как электронных оболочек . Оболочки являются домом для отрицательно заряженных электронов. Каждая оболочка характеризуется своим уровнем энергии. Внешние оболочки имеют более высокий уровень энергии и характеризуются меньшей стабильностью. Электроны в оболочках с более высокой энергией могут перемещаться на вниз на к оболочкам с более низкой энергией; это движение сопровождается высвобождением энергии.Точно так же электроны в оболочках с более низкой энергией можно заставить перемещаться к внешним оболочкам с более высокой энергией путем добавления энергии к атому.
Квантовая механика предполагает, что атом состоит из множества субатомных частиц. Три основных субатомных частицы – это протон, электрон и нейтрон. Протон и нейтрон – самые массивные из трех субатомных частиц; они расположены в ядре атома, образуя плотное ядро атома.Протон заряжен положительно. Нейтрон не имеет заряда и считается нейтральным. Протоны и нейтроны прочно связаны внутри ядра атома. За пределами ядра находятся концентрические сферические области пространства, известные как электронных оболочек . Оболочки являются домом для отрицательно заряженных электронов. Каждая оболочка характеризуется своим уровнем энергии. Внешние оболочки имеют более высокий уровень энергии и характеризуются меньшей стабильностью. Электроны в оболочках с более высокой энергией могут перемещаться на вниз на к оболочкам с более низкой энергией; это движение сопровождается высвобождением энергии.Точно так же электроны в оболочках с более низкой энергией можно заставить перемещаться к внешним оболочкам с более высокой энергией путем добавления энергии к атому. Если обеспечить достаточную энергию, электрон может быть удален от атома и освобожден от его притяжения к ядру.
Если обеспечить достаточную энергию, электрон может быть удален от атома и освобожден от его притяжения к ядру.
Применение атомной структуры к статическому электричеству
Этот краткий экскурс в историю теории атома приводит к некоторым важным выводам о структуре материи, которые будут иметь огромное значение для нашего исследования статического электричества.Эти выводы кратко изложены здесь:
- Все материальные объекты состоят из атомов. Есть разные виды атомов, известные как элементы; эти элементы могут объединяться в соединения. Различные соединения обладают совершенно разными свойствами. Материальные объекты состоят из атомов и молекул этих элементов и соединений, благодаря чему разные материалы обладают разными электрическими свойствами.
- Атом состоит из ядра и обширной области пространства за пределами ядра.Электроны присутствуют в области пространства за пределами ядра. Они заряжены отрицательно и слабо связаны с атомом. Электроны часто удаляются из атома и добавляются к нему в повседневной жизни. Эти явления находятся в центре внимания раздела «Статическое электричество» Класса физики.
- Ядро атома содержит положительно заряженные протоны и нейтральные нейтроны. Эти протоны и нейтроны не могут быть удалены или возмущены обычными повседневными методами. Это потребовало бы появления ядер высокой энергии в какой-то форме, чтобы нарушить ядро и впоследствии вытеснить его положительно заряженные протоны.К счастью, эти явления с высокой энергией не являются повседневным явлением и, конечно же, не являются предметом данного раздела «Класса физики». Одна несомненная истина этого устройства заключается в том, что протоны и нейтроны останутся в ядре атома. Электростатическое явление нельзя объяснить движением протонов.
| Сводка субатомных частиц | ||
Протон | Нейтрон | Электрон |
В ядре Плотно связаны Положительный заряд массивный | В ядре Плотно связаны Бесплатно массивный | Внешнее ядро Слабая связь Отрицательный заряд Не очень массивный |
Разнообразные явления будут рассмотрены, исследованы и объяснены в ходе этого раздела «Статическое электричество».Каждое явление будет объяснено с использованием модели материи, описанной вышеупомянутыми тремя утверждениями. Явления будут варьироваться от прилипания резинового шара к деревянной двери до слипания одежды, упавшей в сушилку, до молнии, видимой в вечернем небе. Каждое из этих явлений будет объяснено с точки зрения движения электронов – как внутри атомов и молекул материала, так и от атомов и молекул одного материала к молекулам другого. В следующем разделе Урока 1 мы исследуем, как движение электронов можно использовать для объяснения того, как и почему объекты приобретают электростатический заряд.
Проверьте свое пониманиеИспользуйте свое понимание заряда, чтобы ответить на следующие вопросы. По завершении нажмите кнопку, чтобы просмотреть ответы.
1. ____ – заряженные части атома.
а. Только электроны
г. Только протоны
г. Только нейтронов
г.Электроны и нейтроны
e. Электроны и протоны
ф. Протоны и нейтроны
Как бы вы описали структуру атома
Как бы вы описали структуру атомаПосле открытия электрона и протона, ученые начали думать о расположении этих частиц в атоме.J.J. Томсон был первым ученым, предложившим модель строения атома. В основном предлагается три модели.
- Модель атома Томсона
- Модель атома Резерфорда
- Модель атома Бора
1. Модель атома Томсона
Томсон был первым, кто предложил детальную модель атома. Он предположил, что атом состоит из однородной сферы положительного электричества, в которой электроны распределены более или менее равномерно.Отрицательный и положительный заряд равны по величине. Таким образом, атом в целом электрически нейтрален. Эта модель атома известна как « Plum pudding model ».
2. Резерфорд модель атома
3. Модель атома Бора
Люди также спрашивают
Электронная структура атома
- Электроны расположены вокруг ядра в оболочках атома.
- Оболочки атома пронумерованы 1,2, 3 и так далее, начиная с ближайшей к ядру.
- Каждая оболочка может занимать определенное количество электронов, как показано на рисунке ниже. Для атомов с числом протонов от 1 до 20 два электрона могут занимать первую оболочку, восемь электронов во второй оболочке и восемь электронов в третьей оболочке. Любые дополнительные электроны будут помещены в четвертую оболочку.
Рисунок: Максимальное количество электронов, которое может занять каждую оболочку для элементов с числом протонов от 1 до 20.
Нахождение электронного расположения
Чтобы записать расположение электронов в атоме, выполните следующие действия:
Шаг 1 Узнайте число протонов в атоме. (Из таблицы Менделеева)
Шаг 2 Узнайте количество электронов в атоме.
Для нейтрального атома количество электронов такое же, как и количество протонов.
Step 3 Расположите электроны в оболочках. Электроны первыми занимают ближайшие к ядру оболочки.Электроны начинают занимать новую оболочку только тогда, когда уже занята предыдущая.
Определение расположения электронов Примеры задач с решениями
1. Каково электронное устройство атома хлора?
Решение:
Протонное число хлора равно 17.
Число электронов в атоме хлора равно 17.
17 электронов расположены как два в первой оболочке, восемь во второй оболочке и оставшиеся семь в третий снаряд.
Электронное расположение атома хлора L. можно записать как 2.8.7.
2. Каково электронное устройство атома калия?
Решение:
Протонное число калия равно 19.
Следовательно, число электронов в атоме калия равно 19.
19 электронов расположены как два в первой оболочке, восемь во второй оболочке, восемь в третья оболочка и оставшаяся в четвертой оболочке.
Расположение электронов можно записать как 2.8.8.1.
Примечание:
- Электроны можно представить в виде точек или крестиков.
- Всегда проверяйте, чтобы сумма электронов составляла правильное число – в данном случае 19.
Валентные электроны
1. Валентные электроны – это электроны, находящиеся во внешней занятой оболочке атома.
2. Самая внешняя занятая оболочка – это оболочка, наиболее удаленная от ядра.
3. Число валентных электронов в атоме можно определить по его электронному расположению.
4. Например, электронное расположение атома хлора равно 2.8.7. Во внешней занятой оболочке атома хлора находится 7 электронов. Следовательно, количество валентных электронов в атоме хлора равно 7.
Атомный номер
Число протонов, присутствующих в ядре атома элемента, называется его атомным номером.
Пример: У атома углерода 6 протонов, поэтому атомный номер углерода равен 6. Атомный номер обозначается Z.Теперь положительный заряд ядра обусловлен наличием в нем протонов, и каждый протон несет одну единицу положительного заряда. Следовательно, атомный номер элемента равен количеству положительных зарядов, переносимых ядром атома элемента.
Атомный номер элемента (Z)
= Число протонов (p)
= Число положительных зарядов, переносимых ядром атома
или = Число электронов (e)
Массовое число
Сумма количества протонов и нейтронов в атоме элемента.
Массовое число (A) = Кол-во протонов (p) + Кол-во нейтронов (n)
Пример: Атом гелия имеет 2 протона, 2 нейтрона и 2 электрона. Его массовое число равно 2 + 2 = 4.
Пример: Кислород имеет 8 протонов, 8 нейтронов и 8 электронов. его массовое число равно 16.
В некоторых случаях, особенно в более тяжелых элементах, количество нейтронов превышает количество протонов.
Пример: У Меркурия атомный номер 80.Итак, у него 80 протонов и 80 электронов. Но массовое число ртути равно 200. Следовательно, количество нейтронов в ртути составляет 200 – 80 = 120.
Обычно атом представлен символом элемента. Атомный номер написан в нижней части символа, а массовое число написано в верхней части.
A = массовое число
Z = атомное число
X = символ элемента
Пример: Указывает, что литий имеет атомный номер, равный 3, и массовое число, равное 7.
Связь между массовым числом и атомным номером
Массовое число = Кол-во протонов + Кол-во нейтронов
Массовое число = Атомный номер + Кол-во нейтронов
Пример 1: Атомное ядро элемента имеет массовое число 23 и количество нейтронов 12. Что такое атомный номер элемента?
Решение: Мы знаем, что
№ массы = № протонов + № нейтронов
23 = № протонов + 12
∴ № протонов = 23 – 12 = 11
Теперь, атомный № .= Количество протонов = 11.
Пример 2: Рассчитайте количество:
(i) электронов (ii) протонов
(iii) нейтронов и (iv) нуклонов
Решение: Массовый номер = 39
Атомный номер = 19
(i) Мы знаем, что
атомный номер = количество протонов = количество электронов
количество электронов = 19
(ii) количество протонов = 19
(iii) масса = количество нейтронов + Кол-во электронов
Кол-во нейтронов = массовое число – Кол-во нейтроновпротонов
= 39-19 = 20
(iv) Нуклоны = Кол-во протонов + Кол-во нейтронов
= 19 + 20 = 39
Структура атома и его частей – Химия для детей
Что такое атом?
Все в нашей Вселенной состоит из материи, а материя состоит из атомов. Атом можно описать как мельчайшую частицу, из которой состоит материя, и обладающую свойствами химического элемента. Атом крошечный по размеру, а типичные размеры – в пикометрах, десятимиллиардных метра.
Из чего состоят атомы?
Атом состоит из трех частей – протонов, нейтронов и электронов.
Каждая из этих частей имеет соответствующий заряд. Протоны несут положительный заряд, электроны имеют отрицательный заряд, а нейтрон не имеет заряда. Протоны и нейтроны составляют ядро атома, а электроны вращаются вокруг ядра на разных уровнях энергии.
Что такое атомный номер?
Атомный номер атома определяется количеством протонов в ядре атома.
Что такое атомная масса?
Атомная масса атома эквивалентна количеству протонов и нейтронов в атоме.
Части атома
Что такое протон?
Протон – это положительно заряженная частица, находящаяся в ядре атома. Резерфорд открыл их в своих экспериментах с электронно-лучевыми трубками.
Количество протонов в атоме определяет, что это за элемент. Это то, что называется атомным номером этого элемента.Число протонов также определяет химическое поведение этого элемента.
Что такое нейтрон?
Нейтрон – это нейтральная часть ядра атома, не имеющая электрического заряда и имеющая массу немного больше, чем у протона. Его открыл английский физик Джеймс Чедвик.
Нейтроны и протоны вместе составляют массу атома. Мы можем найти количество нейтронов, если мы знаем атомную массу и атомный номер элемента, используя это простое уравнение.
Атомная масса – атомный номер = количество нейтронов
Атомы одного и того же элемента могут иметь разное количество нейтронов. Добавление нейтронов изменяет радиоактивность элемента без изменения заряда атома. Это важно в ядерной физике.
Что такое электрон?
Электрон – это отрицательно заряженная часть атома, находящаяся вне ядра на орбитах и прикрепленная к протонам в атоме с помощью электромагнитной силы.Чем ближе электрон к ядру, тем сильнее электромагнитная сила между ними.
Электроны могут покинуть свою орбиту в ответ на приложение внешней энергии. Он также может изменить свое состояние на более высокий энергетический уровень, поглощая фотон с достаточной энергией, чтобы перевести его в новое квантовое состояние. Он также может опуститься до более низкого энергетического состояния, излучая избыточную энергию в виде фотона.
Атомы нейтральны, если количество протонов и электронов равно. Атомы с избытком или недостатком электронов называются ионами.Электроны не имеют внутренней структуры, хотя протоны и нейтроны, с другой стороны, состоят из кварков.
Модель атома Томсона
Модель атома Томсона была предложена Дж. Дж. Томсоном в 1897 году. Он открыл электроны, экспериментируя с электронно-лучевой трубкой. Электронно-лучевая трубка была заряжена отрицательно. Он также изучал положительно заряженные частицы в неоновом газе. Хотя его теория кое-что объясняла об атомах и электронах, она не давала достаточной информации о положительно заряженных частицах и ядре атома.
Модель атома Резерфорда
После того, как модель атома Томсона не смогла объяснить положительно заряженные частицы в атоме, Эрнест Резерфорд доказал наличие положительно заряженных частиц в ядре атома с помощью эксперимента с золотой фольгой. Эта теория доказала, что ядро атома содержит положительно заряженные частицы.
Модель атома Бора
Модель атома Бора была предложена Нилом Бором в 1915 году.Он уточнил, что электроны движутся по фиксированным орбитам / оболочкам, которые имеют фиксированные уровни энергии.
Что такое валентность?
Валентность – это мера реакционной способности атома. Он определяется способностью атома терять или приобретать валентные электроны в валентной оболочке.
Каждый атом хочет иметь 8 электронов в валентной оболочке, и это известно как правило октетов.
Что такое изотопы?
Изотопы – это атомы с одинаковым числом протонов, но с другим числом нейтронов.Поскольку атомный номер равен количеству протонов и нейтронов, изотопы имеют одинаковый атомный номер, но разные массовые числа.
Углерод 14, используемый при углеродном датировании для определения возраста действительно старых археологических и биологических останков, является изотопом углерода.
Тритий, изотоп водорода, используется для создания светящихся в темноте циферблатов на часах и наручных часах.
Что такое изобары?
Изобары – это атомы разных элементов, которые имеют одинаковое атомное массовое число, но разные атомные номера.
Углерод 14 и Азот имеют одинаковое массовое число, равное 14, следовательно, они являются изобарами.
Структура атома – Обзор, популярные атомные теории и атомная структура Резерфорда
Под атомной структурой понимается структура атома, содержащего ядро (в центре), в котором есть протоны (положительно заряженные), нейтроны (нейтральные) и электроны ( отрицательно заряженный), вращающийся вокруг ядра.
Одна из самых важных и фундаментальных глав программы NCERT Класса 11 – Структура атома.В этой главе вы познакомитесь с составными частями атома, различными атомными теориями, их недостатками и экспериментами, которые были проведены для подтверждения этих теорий. После того, как вы прочитали эту главу, вам нужно решить важные вопросы, которые предлагает вам глава 2 – Структура атома. Знание ответов на все эти вопросы поможет вам сформировать твердое понимание темы. На этой странице собраны все важные концепции, затронутые в главе, откуда вопросы обычно поступают на доску, а также на других конкурсных экзаменах после 12 класса.
Структура атома: обзор
История атомной структуры и квантовой механики повторяет только одно имя, которое впервые предположило, что материя состоит из атомов; имя Демокрит. Весь класс химических реакций, связей и их физических свойств глубоко коррелирует со структурой атома. После Демокрита именно Джон Далтон в 1800 году предложил первую научную теорию атомной структуры. Открытие атомной структуры привело ко многим другим изобретениям, таким как субатомные частицы.Все это фундаментальные частицы, составляющие структуру материи.
Подробное описание структуры атома
Структура атома состоит из его ядра и организации электронов вокруг него. Первичная структура атома состоит из протонов, электронов и нейтронов. Ядро атома состоит из протонов и нейтронов. Ядро атома окружено электронами. Общее количество протонов в ядре называется атомным номером.
В нейтральных атомах одинаковое количество протонов и электронов. Но для повышения своей стабильности атомы могут приобретать или терять электроны. В результате обнаруживается заряженный объект, который называется ионом.
Из-за разного числа протонов и электронов атомы разных элементов имеют различную атомную структуру. Вышеупомянутое явление приводит к уникальным характеристикам различных элементов.
Что такое атомная теория Дальтона?
Английский химик Джон Дальтон предложил теорию, согласно которой вся материя состоит из неделимых и неразрушимых атомов.Постулаты теории Дальтона приведены в следующем:
Все материи состоят из атомов.
Атомы неделимы и неразрушимы.
Каждый атом имеет свою постоянную массу, которая отличается от элемента к элементу.
В ходе химической реакции атом перестраивается.
Нет ни создания, ни разрушения атомов, возможно только преобразование из одной формы в другую.
Законы химических реакций были успешно объяснены атомной теорией Дальтона, которая включает Закон сохранения массы, Закон постоянных свойств, Закон множественных пропорций и Закон взаимных пропорций.
Недостатки атомной теории Дальтона:
Теория не объяснила существование изотопов.
Соответствующее объяснение строения атома отсутствовало.
Позднее открытие наличия частиц внутри атома доказало, что атомы делимы.
Какой была модель атома Томсона?
Английский химик сэр Джозеф Джон Томсон был более известен своим открытием электронов, за которое он получил Нобелевскую премию. Для изобретения электрона им был проведен следующий эксперимент:
Катодно-лучевой эксперимент:
Берут стеклянную трубку с двумя отверстиями, одно для вакуумного насоса, а другое для впуска, через которое закачивается газ.
(Изображение будет добавлено в ближайшее время)
Частичный вакуум поддерживается вакуумным насосом внутри стеклянной камеры.Источник высокого напряжения соединен с помощью электродов, то есть катод и анод помещены внутри стеклянной трубки.
Наблюдения:
При подключении высоковольтного источника питания от катода к аноду проходили лучи. «Флюоресцентные пятна» на экране ZnS подтверждают вышеупомянутый факт. Эти лучи были названы «катодными лучами».
Катодные лучи отклоняются в сторону положительного электрода, когда проецируется внешнее электрическое поле.Но в отсутствие электрического поля они находятся на прямой линии.
Кажется, что они вращаются, когда лопасти ротора зафиксированы на пути катодных лучей. Факт составления катодных лучей частицами определенной массы подтвержден этим фактом.
Собрав все свидетельства, Томсон пришел к выводу, что катодные лучи состоят из отрицательно заряженных частиц, называемых «электронами».
Отношение заряда к массе (э / м) было найдено путем приложения электрического и магнитного полей к катодному лучу (электронам).(e / m) для электрона: 17588 X 1011 e / bg
Малликин определил заряд электрона с помощью этого отношения в эксперименте с каплей масла. Заряд e- = 1,6 x 10-16 Кл и масса e- = 9,1093 x 10,31 кг
Томсон на основе своего эксперимента описал структуру атома как положительно заряженную сферу, в которой закреплены отрицательно заряженные электроны. Популярное название модели Томсона – «модель сливового пудинга», потому что ее можно рассматривать как блюдо для сливового пудинга, где пудинг означает положительно заряженный атом, а кусочки сливы – электроны.
Недостатки модели Томсона:
Резерфорд изобрел другую субатомную частицу, названную «ядром», изменив атомную структуру Дж. Дж. Дж. Томсон. Он выполнил эксперимент по рассеянию альфа-лучей:
Конструкция:
Была взята очень тонкая золотая фольга, состоящая из 1000 атомов толщиной.
Золотая фольга, которую предполагалось бомбардировать альфа-лучами (двухзарядный гелий He2 +).
Экран из ZnS расположен за золотой фольгой.
Выводы:
Резерфорд пришел к выводу, что максимальная часть атома пуста, потому что большая часть лучей прошла.
Немногочисленные лучи отразились, поскольку могло произойти отталкивание его положительного заряда каким-либо другим положительным зарядом внутри атома.
Было замечено, что 1/1000 лучей резко отклоняется в результате очень сильного положительного заряда в центре атома. Этот положительный заряд был назван «ядром».
Что такое атомная структура Резерфорда?
Большая часть запаса и массы атома сосредоточена в ядре.
Форма атома сферическая.
Ядро вращается электронами по круговой орбите.
Что такое субатомные частицы?
Субатомные частицы:
Протоны:
Положительный заряд протона равен 1e, что примерно равно 1.602 х 10-19. Масса протона составляет около 1,672 x 10-24. Электроны в 1800 раз легче протонов. Атомный номер элемента равен количеству протонов.
Нейтроны:
Масса нейтрона 1,674 x 10-24. Нейтроны – это электрически нейтральные субатомные частицы. Изотопы – это элементы с одинаковым числом протонов, но другим числом нейтронов.
Электроны:
Электрон состоит из заряда -1e, т.е. -1,602 x 10-19. Масса же около 9.1 х 10-31. При вычислении массы атома электронами пренебрегают из-за относительно незначительной массы электронов.
В теориях строения атома есть различные аргументы, но основная структура атома состоит из протонов, нейтронов и электронов. Ядро находится в центре атома.
Изучение химии: практические задачи по атомной структуре
Практические задачи по атомной структуре :1.) Рассчитайте частоту красного света с длиной волны 6.50 * 10 2 нм
2.) 6,42 * 10-19 Дж энергии требуется для удаления электрона из атом серебра. Какая максимальная длина волны света способна это сделать?
3.) Рассчитайте DE при следующих переход происходит в атоме водорода:
n = 3 —> n = 1
3b.) Рассчитайте длину волны света, испускаемого электроном водорода. перейти от n = 1 к n = 3
4.) Приведите квантовые числа l, m l и количество орбитали для n = 4
5.) Укажите электронные конфигурации для:
a.) Sr b.) Pt c.) S
6.) Рассчитайте энергию ионизации иона Li 2+ с электрон в основном состоянии.
7.) Найдите длину волны, излучаемой электроном (m = 9.11 * 10 -31 кг) при движении со скоростью 2,0 * 10 -8 м / с
1.) v = ц / л
c = 2,9979 * 10 8 м / с
l = 6,50 * 10 2 нм * (1 м / 10 9 нм) = 6,50 * 10 -9 м
(2,9979 * 10 8 м / с) / (6,50 * 10 -9 м) = 4,61 * 10 14 Гц
2.) DE = hv ( h = 6.6326 * 10 -34 Дж * с)
v = ц / л
Замените v в первом уравнении нижним уравнением:
DE = ( hc ) / л
Вставка всех констант (помните, что h и c являются константами), и подключившись к DE, ответ: 3,09 * 10 -7 , который преобразуется в 309 нм .
3.) E = -2,178 * 10 -18 Дж (Z 2 / n 2 )
E1 ==> n = 3 ===> -2,178 * 10 -18 (1 2 /3 2 ) = -2,42 * 10 -19
E2 ==> n = 1 ===> -2,178 * 10 -18 (1 2 /1 2 ) = -2,18 * 10 -18
DE = E2 – E1 = -2,18 * 10 -18 + 2,42 * 10 -19 = -1,936 * 10 -18 Дж
3б.) Выполняется тот же процесс, за исключением того, что E1 будет иметь n = 1, а E2 будет иметь n = 3. Последний шаг:
DE = E2 – E1 = -2,42 * 10 -19 + 2,18 * 10 -18 = 1,94 * 10 -18 Дж
Затем вы конвертируете в длину волны, используя l = hc / DE
l = 103 нм
4.)
л = (п-1) = 4
м л = -3, -2, -1, 0, 1, 2, 3
7 орбиталей (сосчитать м l )
5.)
a.) [Kr] 5s 2
b.) [Xe] 6s 2 4f 14 5d 8
c.) [Ne] 3s 2 3p 4
6.) Важно отметить, что это Li 2+ , а не Li 2+ имеет электронную конфигурацию 1s 1
E = – (Z 2 / n 2 ) * 1310 кДж / моль = – (3 2 /1 2 ) * 1310 кДж / моль = 1.18 * 10 2 кДж
7.) l = h / м v (v есть скорость, а не частота) (м в кг)
л = ч / (9,11 * 10 -31 ) (2,0 * 10 8 )
Из каких частей состоит атом?
С незапамятных времен люди стремились понять, из чего состоит Вселенная и все, что в ней находится. И в то время как древние маги и философы задумывали мир, состоящий из четырех или пяти элементов – земли, воздуха, воды, огня (и металла, или сознания) – классической древностью философы начали теоретизировать, что вся материя на самом деле состоит из крошечных элементов, невидимые и неделимые атомы.
С тех пор ученые продолжают процесс открытия атома, надеясь обнаружить его истинную природу и структуру. К 20 веку наше понимание улучшилось до такой степени, что мы смогли построить его точную модель. И в течение последнего десятилетия наше понимание продвинулось еще дальше, до такой степени, что мы пришли к подтверждению существования почти всех его теоретических частей.
Сегодня атомные исследования сосредоточены на изучении структуры и функций материи на субатомном уровне. Это не только состоит в идентификации всех субатомных частиц, которые, как считается, составляют атом, но и в исследовании сил, которые ими управляют. К ним относятся сильные ядерные силы, слабые ядерные силы, электромагнетизм и гравитация. Вот разбивка всего, что мы узнали об атоме на данный момент…
Состав:
Наша текущая модель атома может быть разбита на три составные части – протоны, нейтроны и электроны.Каждая из этих частей имеет связанный заряд: протоны несут положительный заряд, электроны имеют отрицательный заряд, а нейтроны не обладают чистым зарядом. В соответствии со Стандартной моделью физики элементарных частиц протоны и нейтроны составляют ядро атома, а электроны вращаются вокруг него в «облаке».
Электроны в атоме притягиваются к протонам ядра электромагнитной силой. Электроны могут покинуть свою орбиту, но только в ответ на приложение внешнего источника энергии.Чем ближе орбита электрона к ядру, тем больше сила притяжения; следовательно, более сильная внешняя сила необходима, чтобы заставить электрон ускользнуть.
Электроны вращаются вокруг ядра по нескольким орбитам, каждая из которых соответствует определенному энергетическому уровню электрона. Электрон может изменить свое состояние на более высокий энергетический уровень, поглощая фотон с энергией, достаточной для перехода его в новое квантовое состояние. Точно так же электрон в состоянии с более высокой энергией может перейти в состояние с более низкой энергией, излучая при этом избыточную энергию в виде фотона.
Атомы электрически нейтральны, если они имеют равное количество протонов и электронов. Атомы, у которых есть дефицит или избыток электронов, называются ионами. Электроны, которые находятся дальше всего от ядра, могут быть переданы другим соседним атомам или разделены между атомами. По этому механизму атомы могут соединяться в молекулы и другие типы химических соединений.
Все три из этих субатомных частиц являются фермионами, классом частиц, связанных с материей, которая является либо элементарной (электроны), либо составной (протоны и нейтроны) по своей природе. Это означает, что электроны не имеют известной внутренней структуры, тогда как протоны и нейтроны состоят из других субатомных частиц. называемые кварками. В атомах есть два типа кварков, которые имеют небольшой электрический заряд.
Протоны состоят из двух «верхних» кварков (каждый с зарядом +2/3) и одного «нижнего» кварка (-1/3), а нейтроны состоят из одного верхнего кварка и двух нижних кварков.Это различие объясняет разницу в заряде между двумя частицами, которая составляет +1 и 0 соответственно, в то время как электроны имеют заряд -1.
Другие субатомные частицы включают лептоны, которые соединяются с фермионами, образуя строительные блоки материи. В современной модели атома шесть лептонов: электронные, мюонные и тау-частицы и связанные с ними нейтрино. Различные разновидности лептонных частиц, обычно называемые «ароматизаторами», различаются по размеру и заряду, который влияет на уровень их электромагнитного взаимодействия.
Кроме того, существуют калибровочные бозоны, известные как «носители силы», поскольку они передают физические силы. Например, глюоны ответственны за сильное ядерное взаимодействие, которое удерживает кварки вместе, в то время как W- и Z-бозоны (все еще гипотетические) считаются ответственными за слабое ядерное взаимодействие, лежащее в основе электромагнетизма. Фотоны – это элементарные частицы, из которых состоит свет, в то время как бозон Хиггса отвечает за придание бозонам W и Z их массы.
Масса:
Большую часть массы атома составляют протоны и нейтроны, составляющие его ядро.Электроны – наименее массивные частицы, составляющие атом, с массой 9,11 x 10 -31 кг и размером слишком малым, чтобы его можно было измерить с помощью современных методов. Протоны имеют массу, которая в 1836 раз больше массы электрона, 1,6726 × 10 -27 кг, в то время как нейтроны являются самыми массивными из трех, 1,6929 × 10 -27 кг (в 1839 раз больше массы электрона. ).
Общее количество протонов и нейтронов в ядре атомов (называемых «нуклонами») называется массовым числом.Например, элемент Углерод-12 назван так, потому что он имеет массовое число 12 – производное от его 12 нуклонов (шесть протонов и шесть нейтронов). Однако элементы также располагаются на основе их атомных номеров, которые совпадают с числом протонов в ядре. В данном случае углерод имеет атомный номер 6.
.Реальную массу покоящегося атома очень трудно измерить, поскольку даже самые массивные атомы слишком легкие, чтобы выразить их в условных единицах. Таким образом, ученые часто используют единую атомную единицу массы (u), также называемую дальтон (Da), которая определяется как двенадцатая часть массы свободного нейтрального атома углерода-12, что составляет примерно 1.66 × 10 -27 кг.
Химики также используют моль, единицу, определяемую как один моль любого элемента, всегда имеющего одинаковое количество атомов (около 6,022 × 10 23 ). Это число было выбрано таким образом, чтобы, если элемент имеет атомную массу 1 u, моль атомов этого элемента имеет массу, близкую к одному грамму. Согласно определению единой атомной единицы массы, каждый атом углерода-12 имеет атомную массу ровно 12 u, поэтому моль атомов углерода-12 весит точно 0,012 кг.
Модель Нилса Бора атома азота.Кредит: britannica.comРадиоактивный распад:
Любые два атома с одинаковым числом протонов принадлежат одному химическому элементу. Но атомы с равным количеством протонов могут иметь разное количество нейтронов, которые определяются как разные изотопы одного и того же элемента. Эти изотопы часто нестабильны, и известно, что все изотопы с атомным номером больше 82 радиоактивны.
Когда элемент подвергается распаду, его ядро теряет энергию из-за испускания излучения, которое может состоять из альфа-частиц (атомов гелия), бета-частиц (позитронов), гамма-лучей (высокочастотная электромагнитная энергия) и конверсионных электронов.Скорость распада нестабильного элемента известна как его «период полураспада», то есть время, необходимое для того, чтобы элемент упал до половины своего первоначального значения.
На стабильность изотопа влияет соотношение протонов и нейтронов. Из 339 различных типов элементов, встречающихся в природе на Земле, 254 (около 75%) были помечены как «стабильные изотопы», то есть не подверженные распаду. Еще 34 радиоактивных элемента имеют период полураспада более 80 миллионов лет и также существуют с ранней Солнечной системы (поэтому их называют «первичными элементами»).
Наконец, еще 51 короткоживущий элемент, как известно, встречается в природе как «дочерние элементы» (т.е. ядерные побочные продукты) распада других элементов (таких как радий из урана). Кроме того, короткоживущие радиоактивные элементы могут быть результатом естественных энергетических процессов на Земле, таких как бомбардировка космическими лучами (например, углерод-14, который встречается в нашей атмосфере).
История обучения:
Самые ранние известные примеры атомной теории происходят из Древней Греции и Индии, где такие философы, как Демокрит, постулировали, что вся материя состоит из крошечных, неделимых и неразрушимых единиц.Термин «атом» был придуман в Древней Греции и положил начало философской школе, известной как «атомизм». Однако эта теория была скорее философской концепцией, чем научной.
Только в 19 веке теория атомов стала предметом науки, и были проведены первые эксперименты, основанные на доказательствах. Например, в начале 1800-х годов английский ученый Джон Дальтон использовал концепцию атома, чтобы объяснить, почему химические элементы реагируют определенными наблюдаемыми и предсказуемыми способами.
Дальтон начал с вопроса, почему элементы реагируют в соотношении малых целых чисел, и пришел к выводу, что эти реакции протекают в целых числах, кратных дискретным единицам – другими словами, атомам. С помощью серии экспериментов с газами Дальтон разработал так называемую атомную теорию Дальтона, которая остается одним из краеугольных камней современной физики и химии.
Теория сводится к пяти предпосылкам: элементы в чистом виде состоят из частиц, называемых атомами; все атомы определенного элемента одинаковы, вплоть до самого последнего атома; атомы разных элементов можно отличить по их атомному весу; атомы элементов объединяются в химические соединения; атомы не могут быть ни созданы, ни разрушены в химической реакции, меняется только группировка.
К концу 19 века ученые начали выдвигать теорию о том, что атом состоит более чем из одной фундаментальной единицы. Однако большинство ученых отважились, что эта единица будет размером с самый маленький из известных атомов – водорода. А затем в 1897 году, проведя серию экспериментов с катодными лучами, физик Дж. Дж. Томпсон объявил, что открыл элемент, который в 1000 раз меньше и в 1800 раз легче атома водорода.
Его эксперименты также показали, что они идентичны частицам, испускаемым фотоэлектрическим эффектом и радиоактивными материалами.Последующие эксперименты показали, что эта частица переносила электрический ток через металлические провода и отрицательные электрические заряды внутри атомов. Вот почему частица, которая изначально называлась «корпускулой», была позже изменена на «электрон» после частицы, предсказанной Джорджем Джонстоном Стоуни в 1874 году.
Однако Томсон также постулировал, что электроны распределены по всему атому, который представляет собой однородное море положительного заряда. Это стало известно как «модель сливового пудинга», что позже оказалось неверным.Это произошло в 1909 году, когда физики Ханс Гигер и Эрнест Марсден (под руководством Эрнеста Резерфода) провели свой эксперимент с использованием металлической фольги и альфа-частиц.
В соответствии с атомной моделью Дальтона они полагали, что альфа-частицы будут проходить прямо через фольгу с небольшим отклонением. Однако многие частицы отклонялись на углы более 90 °. Чтобы объяснить это, Резерфорд предположил, что положительный заряд атома сосредоточен в крошечном ядре в центре.
В 1913 году физик Нильс Бор предложил модель, в которой электроны вращались вокруг ядра, но могли делать это только на конечном наборе орбит. Он также предположил, что электроны могут прыгать между орбитами, но только с дискретными изменениями энергии, соответствующими поглощению или излучению фотона. Это не только усовершенствовало предложенную модель Резерфорда, но также привело к появлению концепции квантованного атома, в котором материя ведет себя в виде дискретных пакетов.
Элементарные частицы Стандартной модели.Предоставлено: PBS NOVA / Fermilab / Группа данных по частицам.Разработка масс-спектрометра, в котором магнит используется для изменения траектории пучка ионов, позволила измерять массу атомов с повышенной точностью. Химик Фрэнсис Уильям Астон использовал этот прибор, чтобы показать, что изотопы имеют разную массу. За этим, в свою очередь, последовал физик Джеймс Чедвик, который в 1932 году предложил нейтрон как способ объяснения существования изотопов.
В начале 20 века квантовая природа атомов получила дальнейшее развитие.В 1922 году немецкие физики Отто Штерн и Вальтер Герлах провели эксперимент, в котором пучок атомов серебра направлялся через магнитное поле, которое предназначалось для разделения пучка между направлениями углового момента (или спина) атомов.
Известный как эксперимент Штерна – Герлаха, в результате луч разделялся на две части, в зависимости от того, был ли спин атомов ориентирован вверх или вниз. В 1926 году физик Эрвин Шредингер использовал идею частиц, ведущих себя как волны, для разработки математической модели, которая описывала электроны как трехмерные волновые формы, а не просто частицы.
Следствием использования форм волны для описания частиц является то, что математически невозможно получить точные значения как для положения, так и для импульса частицы в любой момент времени. В том же году Вернер Гейзенберг сформулировал эту проблему и назвал ее «принципом неопределенности». Согласно Гейзенбергу, для данного точного измерения положения можно получить только диапазон вероятных значений импульса, и наоборот.
В 1930-х годах физики открыли деление ядер благодаря экспериментам Отто Хана, Лиз Мейтнер и Отто Фриша.Эксперименты Хана включали направление нейтронов на атомы урана в надежде создать трансурановый элемент. Вместо этого процесс превратил его образец урана-92 (Ur 92 ) в два новых элемента – барий (B 56 ) и криптон (Kr 27 ).
Мейтнер и Фриш подтвердили эксперимент и приписали его расщеплению атомов урана с образованием двух элементов с одинаковым общим атомным весом, процессом, который также высвобождает значительное количество энергии за счет разрыва атомных связей.В последующие годы начались исследования возможного вооружения этого процесса (т. Е. Ядерного оружия), которые привели к созданию первых атомных бомб в США к 1945 году.
В 1950-х годах разработка усовершенствованных ускорителей частиц и детекторов частиц позволила ученым изучить влияние атомов, движущихся с высокими энергиями. Исходя из этого, была разработана Стандартная модель физики элементарных частиц, которая до сих пор успешно объясняла свойства ядра, существование теоретизированных субатомных частиц и сил, которые управляют их взаимодействиями.
Массы всех 6 видов кварков с протоном и электроном (красная точка) показаны в нижнем левом углу для шкалы. Предоставлено: Википедия / Incnis Mrsi.Современные эксперименты:
Со второй половины 20-го века было сделано много новых и захватывающих открытий в области теории атома и квантовой механики. Например, в 2012 году долгие поиски бозона Хиггса привели к прорыву, когда исследователи, работающие в Европейской организации ядерных исследований (CERN) в Швейцарии, объявили о его открытии.
В последние десятилетия физики потратили много времени и энергии на разработку единой теории поля (также известной как теория великого объединения или теория всего). По сути, с тех пор, как Стандартная модель была впервые предложена, ученые стремились понять, как четыре фундаментальные силы Вселенной (гравитация, сильные и слабые ядерные взаимодействия и электромагнетизм) работают вместе.
Схема альфа- и бета-распада двух изотопов урана.Кредит: energy-without-carbon.orgВ то время как гравитацию можно понять с помощью теорий относительности Эйнштейна, а ядерные силы и электромагнетизм можно понять с помощью квантовой теории, ни одна из теорий не может объяснить все четыре силы, действующие вместе. Попытки решить эту проблему на протяжении многих лет привели к ряду предложенных теорий, от теории струн до петлевой квантовой гравитации. На сегодняшний день ни одна из этих теорий не привела к прорыву.
Наше понимание атома прошло долгий путь: от классических моделей, которые рассматривали его как инертное твердое тело, механически взаимодействующее с другими атомами, до современных теорий, согласно которым атомы состоят из энергичных частиц, которые ведут себя непредсказуемо.Хотя на это ушло несколько тысяч лет, наши знания о фундаментальной структуре всей материи значительно продвинулись.
И все же остается много загадок, которые еще предстоит разгадать. Со временем и постоянными усилиями мы, наконец, сможем раскрыть последние оставшиеся секреты атома. С другой стороны, вполне может быть, что любые новые открытия, которые мы делаем, только вызовут больше вопросов – и они могут быть еще более запутанными, чем те, которые были раньше!
Ядерное деление, при котором атом урана 92 расщепляется свободным нейтроном с образованием бария и криптона.Предоставлено: Physics.stackexchange.com.От древней Греции до Нобелевской премии: хронология Хиггса
Ссылка : Какие части атома? (2015, 16 декабря) получено 20 ноября 2021 г. с https: // физ.org / news / 2015-12-atom.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Атомная структура | Группа Грандинетти
Атомная структура
Атом состоит из трех типов субатомных частиц: протон , нейтрон и электрон .
| Частица | Масса / г | Заряд / $ q_e $ |
|---|---|---|
| Протон | 1,6727 x 10 -24 | +1 |
| Нейтрон | 1,67 | 0 |
| Электрон | 9,110 x 10 -28 | -1 |
Здесь $ q_e $ – элементарный заряд, фундаментальная константа природы, равная $ 1.{-19} $ кулонов.
Протроны и нейтронов имеют схожие массы, а электронов намного легче (более чем в 1000 раз легче).
Протоны и электронов имеют равные и противоположные заряды, в то время как нейтронов не имеют заряда.
У нас есть следующая простая картина атома .
Атом состоит из положительно заряженного ядра, состоящего из протонов и нейтронов. Это маленькое ядро окружено вращающимися электронами.Поскольку протоны и нейтроны намного массивнее электронов, практически вся масса атома сосредоточена в ядре . Легкие отрицательно заряженные электроны движутся по орбите в пространстве вокруг ядра.
Мы используем следующий символ для описания атома:
A = Z + N, где N – количество нейтронов.
Если вы добавите или вычтите протон из ядра, вы создадите новый элемент .
Если вы добавите или вычтете нейтронов из ядра, вы создадите новый изотоп того же элемента, с которого вы начали.
В нейтральном атоме количество положительно заряженных протонов в ядре равно количеству вращающихся вокруг электронов .
Атом водорода
Давайте посмотрим на простейший пример атома, атом водорода .
Атом состоит из протона и электрона, удерживаемых вместе посредством электромагнитной силы между положительно заряженным протоном и отрицательно заряженным электроном.
Электрон вращается вокруг протона, потому что это более легкая частица, вроде как Земля вращается вокруг Солнца. Однако есть большие различия в картине вращения Земли вокруг Солнца и вращения электрона вокруг ядра.1_1 $ H мы можем сделать изотопов водорода. Вот три распространенных изотопа водорода.
Если мы добавим к ядру водорода протон , мы получим гелий (другой элемент). Вот два распространенных изотопа гелия.
Другой пример – углерод.
Поскольку символ элемента и атомный номер являются избыточными, вы часто будете видеть изотопы, написанные без атомного номера. Например, вы увидите только 12 C.{35} _ {17} $ Cl?
Число протонов определяется атомным номером , нижним числом, поэтому число протонов равно 17. Это нейтральный атом , поэтому будет равное количество отрицательно заряженных электронов, чтобы уравновесить положительно заряженных протонов, таким образом, число электронов также равно 17.
Мы знаем, что атомная масса
А = Я + Н
где N – количество нейтронов. Переставляя уравнение, получаем
N = А – Я
Подставляя уже известные числа, получаем
N = 35-17 = 18 = количество нейтронов
Теперь вы можете подумать, что атомное ядро с большим количеством протонов (например, 12 C) разлетится из-за электрического отталкивания между положительно заряженными протонами.Оказывается, эти силы электрического отталкивания преодолеваются силой притяжения между протонами и нейтронами, называемой сильной ядерной силой. На малых расстояниях внутри ядра эта сила сильнее электромагнитных сил отталкивания, но на больших расстояния становится намного слабее.
Атомная масса
Грамм – не очень удобная единица измерения атомных масс, поэтому определена новая единица, называемая единицей атомной массы (u) .
1 u = 1.66053904 x 10 -24 г
Повторно выразив массы субатомных частиц в атомных единицах массы, мы получим
| Частица | Масса / г | Масса / ед. |
|---|---|---|
| протон | 1,672621898 x 10 -24 | 1.007276467284985 |
| электрон | 9.10938356 x 10 -28 | 0,000548579 87202 |
Используя инструмент, называемый масс-спектрометром , мы можем очень точно измерить массу атомов и молекул. Вот некоторые измеренные массы изотопов с помощью масс-спектрометра .
| Изотоп | Масса / ед. |
|---|---|
| 2 H | 2.01410177785 |
| 4 He | 4.00260325415 |
| 8 Be | 8.005305103 |
| 12 C | 12.000000 |
| 16 O | 15.99491461956 0609 | 15.99491461956 06098 | 15.99491461956 06098 900.9 То, что 12 C имеет массу ровно 12,000000 u, не случайно. Масс-спектрометр может точно измерять только разность масс .Для решения этой проблемы определено, что изотоп 12 C имеет массу точно 12 u. Тогда все остальное измеряется относительно 12 С. Как и следовало ожидать, разные изотопы одного и того же элемента будут иметь разные массы. Однако если вы посмотрите на таблицу Менделеева, вы заметите, что для массы каждого элемента указано только одно число. Как у вас может быть только одна масса, если существует более одного изотопа каждого элемента? Ответ состоит в том, что масса каждого элемента равна средневзвешенному значению масс всех изотопов этого элемента.В этом средневзвешенном значении веса представляют собой процентное содержание каждого изотопа, встречающегося в природе. Например, если вы проанализируете кусок чистого углерода с планеты Земля, вы обнаружите, что 98,89% всех атомов углерода на Земле составляют 12 атомов углерода и |

