Студентка ИТМО разработала VR-игру для обучения химии. С ее помощью можно запоминать строение атома, управляя космическим кораблем
Игроки выступают в качестве капитанов космических флотилий, которые должны победить флот противника. Чтобы сделать это, им надо вспомнить квантовые числа, обозначающие положение электрона в атоме. Именно эти значения и являются координатами вражеских кораблей.
Игру разработала студентка факультета программной инженерии и компьютерной техники (ПИиКТ) Университета ИТМО Анастасия Рычкова. До этого она не сталкивалась с химией, но погрузилась в область и смогла довести проект до потребителя. Итоги работы опубликованы в статье, которая вышла в Journal of Chemical Education.
Есть такие темы, которые из года в год даются студентам тяжело, как бы преподаватель ни пытался их донести. Такие вопросы есть в каждом предмете и зачастую мало зависят от подготовки лектора.
Как отмечает декан факультета биотехнологий и ведущий научный сотрудник химико-биологического кластера Университета ИТМО Михаил Курушкин, по его опыту такой непростой темой является электронное строение атома. В 2016 году он даже придумал настольную игру по принципу морского боя для того, чтобы в игровой форме мотивировать студентов изучить эту тему.
Михаил Курушкин
В 2018 году вместе с коллегами по вузу Михаил решил создать проект по изучению роли виртуальной реальности в химическом вузовском обучении. Тогда он вспомнил о своей старой игре и решил перенести ее в новый формат.
«Мы решили перенести эту бумажную игру в виртуальную реальность. Возможность использовать VR-версию с автоматическим контролем грамотности освоения материала может снять с преподавателя часть нагрузки по изучению электронного строения атома с большим количеством студентов одновременно», ― отмечает он.
VR-игра для обучения химии. Иллюстрация из статьи. Источник: pubs.acs.org
Чтобы игра по-настоящему помогла в обучении, она должна впечатлить студента. Поэтому для изначальной задумки нужно было придумать яркую оболочку.
«Я предложил перенести морской бой в космические просторы, чтобы игрок был капитаном космического корабля одной из воюющих друг с другом инопланетных рас и, стоя на мостике, пытался победить противника. Я предложил Михаилу назвать расы ― лантаноиды и актиноиды, и ему это понравилось. Таким образом мы придумали не просто визуальный контент, но и добавили к нему определенный сторителлинг, чтобы повысить эффект сопричастности», ― вспоминает директор центра юзабилити и смешанной реальности, доцент факультета программной инженерии и компьютерной техники Университета ИТМО Артем Смолин.
Артем Смолин
 Ей предстояло решить, как именно перенести в мир виртуальной реальности идею космического боя на основе химических объектов и явлений.
Ей предстояло решить, как именно перенести в мир виртуальной реальности идею космического боя на основе химических объектов и явлений.«Мы начали с изучения движка, пришлось какое-то время разбираться, как это вообще можно сделать. Дело в том, что к тому времени гарнитура виртуальной реальности Oculus Go, которую мы использовали, была на рынке не так долго, информации было крайне мало, приходилось действовать методом “научного тыка”
, ― рассказывает она. ― Затем подключился дизайнер Алексей Коротких, мы приступили к работе над самим проектом. Процесс напоминал игру “Сапер”. Самый большой “подрыв” произошел в прошлом ноябре, когда игра была почти закончена. Однако движок в этот момент обновился, и определенный функционал исчез. Поэтому нам пришлось искать альтернативу».
Анастасия Рычкова. Фото из личного архива
Серьезные проблемы возникли с тем, чтобы создать игру в режиме игрок против игрока. Как отмечает Артем Смолин, одна из главных неожиданностей заключалась в том, что для VR нет как такового мультиплеера.
«Сначала у нас работало автономно две гарнитуры, нам пришлось писать отдельную программу. Однако, в результате мы даже выиграли ― все гарнитуры могли подключаться к одному устройству», ― отмечает автор игры.
VR-игра для обучения химии. Иллюстрация из статьи. Источник: pubs.acs.org
В своей механике игра сохранила базовые принципы морского боя. Игрок должен уничтожить флот противника до того, как тот успеет сбить все его корабли. Только вместо численно-буквенных координат он должен атаковать контейнеры со стрелками, которыми в химии изображается состояние электронов в атоме.
«Перед тобой в космосе висит враждебный флот в виде контейнеров, и по нему необходимо стрелять с помощью лазера, ― объясняет Михаил Курушкин. ― В качестве координат выступают квантовые числа, которыми записывается состояние электрона в атоме.
По сути, для удачной игры вам надо понимать, как электроны распределяются по орбитальным диаграммам».
Перед каждым раундом игроки загадывают химический элемент, а затем, используя диаграмму из контейнеров, начинают угадывать элемент противника.
«У тебя есть две стратегии поведения. Первая ― ты стреляешь до самого конца и называешь химический элемент, когда ты в этом абсолютно уверен
, ― объясняет Артем Смолин. ― Вторая стратегия более рискованная. Ты примерно пристрелялся, увидел некий диапазон возможных элементов, и ты рискуешь, называешь элемент. Если ты неправ ― ты проиграл, если прав ― выиграл. Поскольку тут в дело вступает азарт, игра затягивает, что помогает в конечном счете запоминанию предмета».
VR-игра для обучения химии. Иллюстрация из статьи. Источник: pubs.acs.org
Работы над игрой были почти закончены в начале этого года. В феврале первый прототип игры продемонстрировали на ITMO Open Science.
«Тогда мы смогли апробировать игру, посмотреть на пользователях, какие есть сложности, ― вспоминает Анастасия Рычкова. ― У людей часто встречались проблемы с точки зрения знания химии, и когда преподавателю необходимо был помочь, то приходилось снимать и надевать гарнитуры виртуальной реальности. Я поняла, что, чтобы этого избежать, надо создать своего рода средство мониторинга, чтобы преподаватель мог видеть, что происходит в гарнитурах виртуальной реальности учащихся. Тут началась пандемия, и у меня появилась возможность доработать игру и убрать оставшиеся “косяки”. А к июню мы смогли опробовать наше детище
».
ITMO Open Science-2020
Чтобы продемонстрировать эффективность разработки, Надежда Максименко, одна из ключевых участниц проекта из лаборатории «Нейропедагогика химического образования», провела педагогический эксперимент, на который пригласили студентов Университета ИТМО.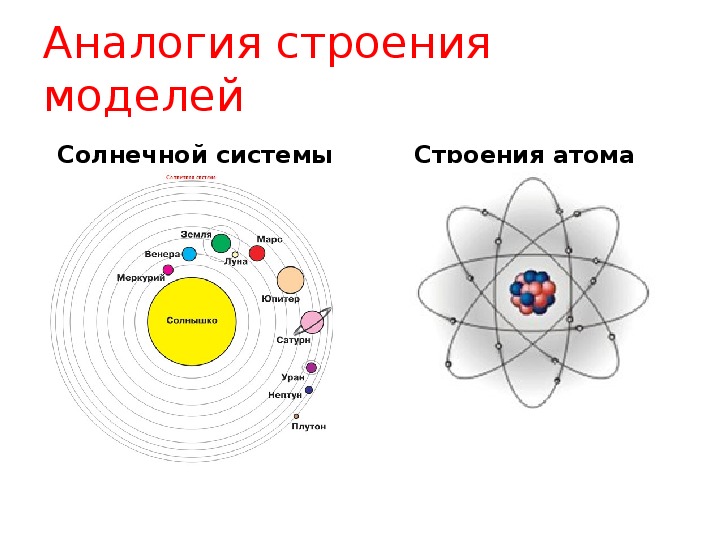
По итогам работы была опубликована статья в Journal of Chemical Education с описанием игры и возможностью для скачивания. В следующем году создатели намерены сделать онлайн-версию орбитального морского боя.
Нобелевская премия по химии: история и статистика
- Яна Литвинова
- Русская служба Би-би-си, Лондон
Автор фото, Getty Images
“… и еще одна часть пойдет тому человеку, которой сделает самое важное химическое открытие или изобретение…”
Из завещания Альфреда Нобеля
Химия, возможно, была самой важной наукой для самого Нобеля. Изобретение динамита, принесшее ему миллионы, также как и организация процесса производства, требовали глубоких химических знаний.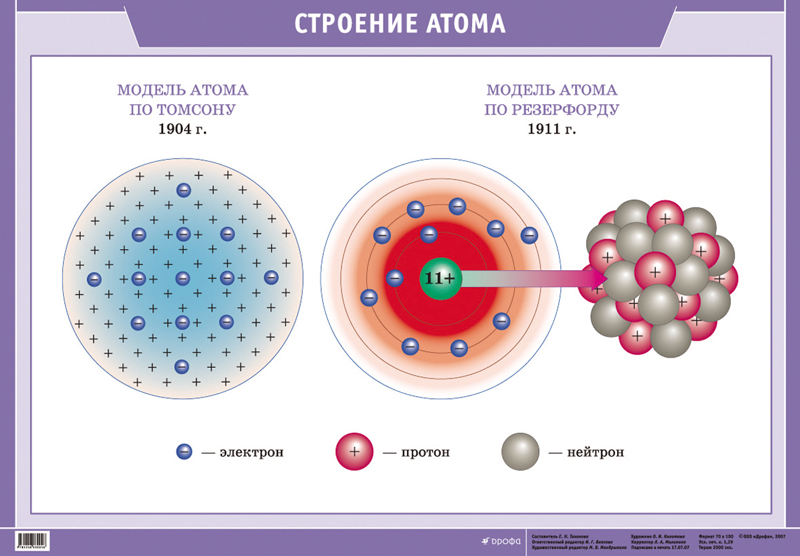 Химия стала второй научной дисциплиной, упомянутой Нобелем в завещании.
Химия стала второй научной дисциплиной, упомянутой Нобелем в завещании.
Премии по химии присуждаются Шведской академией наук.
На перекрестке наук
Нобелевский комитет по химии признает, что она занимает достаточно уникальное положение среди естественных наук: фундаментальные основы химии базируются на строении атома, которое находится в ведении физики.
И одновременно биология дает химикам широчайшее поле для исследований, учитывая, что живые организмы представляют собой сложнейшие химические системы.
Автор фото, istock
Подпись к фото,Многие исследования, получившие Нобелевскую премию по химии, можно было бы квалифицировать и как работы в медицине, и как физические исследования
Таким образом, как отметил член Нобелевского комитета по химии профессор Бертил Андерсон, “тот факт, что химические исследования расцвели пышным цветом в начале XX века, тесно связан с фундаментальными открытиями в физике”.
Химия? Физика? Медицина?
Нобелевский комитет часто сталкивается с тем, что один и тот же кандидат получает номинации и по физике, и по химии, и по медицине.
Первый раз эта проблема возникла уже на третий год существования Нобелевских премий в 1903 году, когда шведский ученый Сванте Аррениус был одновременно номинирован и на премию по физике, и на премию по химии.
Автор фото, Hulton Archive
Подпись к фото,Нобелевский комитет никак не мог решить, к какой же науке отнести работу Аррениуса
После продолжительных раздумий Нобелевский комитет по химии предложил, чтобы Аррениуса отметили по обеим категориям, и он бы получил половину химической, и половину физической премий. Идея эта, однако, не понравилась Нобелевскому комитету по физике, и химики решили наградить Аррениуса по своему департаменту.
Вот почему сейчас все три комитета по естественным наукам проводят совместные заседания, чтобы “распределить” кандидатов между собой.
Председатель Нобелевского комитета по химии в 1945 году, профессор Вестгрен заявил, что, по большому счету, по какой именно статье тот или иной ученый получит премию, не так уж и важно: “Большинство из нас согласны с тем, что самое главное, решить, достойна ли та или иная работа Нобелевской премии в принципе”.
Например, Питер Митчелл, получивший в 1978 году Нобелевскую премию по химии за изучение механизмов передачи биологической энергии, мог с тем же успехом получить награду в области физиологии или медицины.
Наука – дело семейное
Химия оказалась самой “семейной” наукой в нобелевском послужном списке. И самой успешной нобелевской семьей стала семья Кюри.
Автор фото, Hulton Archive
Подпись к фото,Мари Кюри с мужем Пьером и дочерью Ирэн. Все трое стали Нобелевскими лауреатами
Мари Кюри дважды стала Нобелевским лауреатом: первый раз вместе с мужем Пьером в 1903 году она получила премию по физике, во второй раз – в 1911 году – по химии. Старшая дочь Мари и Пьера Ирэн в 1935 году получила Нобелевскую премию по химии вместе с мужем Фредериком Жолио.
Старшая дочь Мари и Пьера Ирэн в 1935 году получила Нобелевскую премию по химии вместе с мужем Фредериком Жолио.
Немецкий ученый Ганс фон Эйлер-Хельпин стал Нобелевским лауреатом по химии в 1929 году, а его сын Ульф – получил премию по физиологии и медицине в 1970.
Американский биохимик Артур Корнберг стал Нобелевским лауреатом по физиологии и медицине в 1959 году (хотя с тем же успехом мог получить премию и по химии, учитывая, что его исследования касались синтеза ДНК и РНК), а его сын Роджер получил Нобелевскую премию по химии в 2006.
Химическая география
Автор фото, istock
Подпись к фото,Больше всего нобелевских лауреатов по химии в США
Больше всего Нобелевских премий по химии получили ученые из Соединенных Штатов – 49. Однако, большинство из них стали лауреатами уже после Второй мировой войны. До 1945 года США могли похвастаться только 3 Нобелевскими премиями по химии.
Химики из Германии находятся на втором месте – 26 лауреатов. Однако большинство из них (14 человек) получили премию до Второй мировой войны.
Однако большинство из них (14 человек) получили премию до Второй мировой войны.
Британия занимает третье место с 25 лауреатами. За ней идут Франция (7), Швеция и Швейцария (по 5), Нидерланды и Канада (по 3).
Вынужденный отказ
Адольф Гитлер запретил двум ученым Ричарду Куну и Адольфу Бутенандту принять Нобелевскую премию по химии в 1938 году. Правда, позднее, им было разрешено принять медали и дипломы, но не призовые деньги.
Обратная сторона медали
Автор фото, AFP
Подпись к фото,На церемонии награждения король Швеции вручает лауреату медаль и диплом
Нобелевские медали по химии и физике одинаковы. На обратной стороне отчеканено аллегорическое изображение Природы в виде богини, поднимающейся из облаков. В руках у нее рог изобилия. Ее лицо закрывает вуаль, которую приподнимает аллегория Науки.
Надпись по латыни гласит: “Inventas vitam juvat excoluisse per artes”. Эта строка взята из поэмы Вергилия “Энеида” и в приблизительном переводе звучит примерно так: “И те, кто улучшили жизнь на Земле своим вновь обретенным мастерством”.
Эта строка взята из поэмы Вергилия “Энеида” и в приблизительном переводе звучит примерно так: “И те, кто улучшили жизнь на Земле своим вновь обретенным мастерством”.
Медаль была создана шведским скульптором Эриком Линдбергом.
Химия – 247Планета дистанта
2. Прочитайте по учебнику параграфы 50, 51.
3. Запишите в тетради дату и тему урока.
4. Выпишите формулировку периодического закона
5. Письменно ответьте в тетради на вопросы 1, 2, 3 на странице 180 (“Подумай, ответь, выполни…”)
6. Сфотографируйте записи в тетради и отправьте по эл.почте на мой эл.адрес (его Вам написала Татьяна Евгеньевна) не позднее 15 апреля 2020
Ребята, два занятия внеурочной деятельности “Основы химического исследования” размещены в разделе 8а класс ВУД (где и все предметы). Предлагаю всему классу посетить виртуальную экскурсию в музей-архив Д.И.Менделеева.
Дата урока 10.04.2020
Здравствуйте, ребята! Сегодня мы пробуем провести пробный урок в zoom в 12. 30. Ссылку для участия Вам переслала Татьяна Евгеньевна (в группе ВК)
30. Ссылку для участия Вам переслала Татьяна Евгеньевна (в группе ВК)
Тема урока “Строение атома”
Если будут погрешности нашей встречи, то размещаю ссылку на материалы урока
Прочитайте параграф 52. Задания, указанные в этих ссылках или в конце параграфа, выполните устно.
Ответы присылать не надо.
Запишите в тетради дату и тему урока. Из параграфа выпишите все “определения” и “!важную информацию”.
Если Вы не смогли присутствовать на нашем видео-уроке, то сделайте в тетради записи по слайдам презентации к уроку:
Презентация, ИСПОЛЬЗОВАННАЯ на видео-уроке, прошедшем 10.04.2020,
Контролирующий тест ПО ССЫЛКЕ необходимо выполнить не позднее 12.00 15 апреля 2020 (ваши ответы прокомментирую в 14.00)Следующий урок в zoom в среду, 15 апреля, в 14.00 Рекомендую до урока прочитать параграф №53.
Дата урока 15.04.2020
Тема урока “Распределение электронов по электронным слоям (энергетическим уровням)”.
Презентация, ИСПОЛЬЗОВАННАЯ на видео-уроке, прошедшем 15.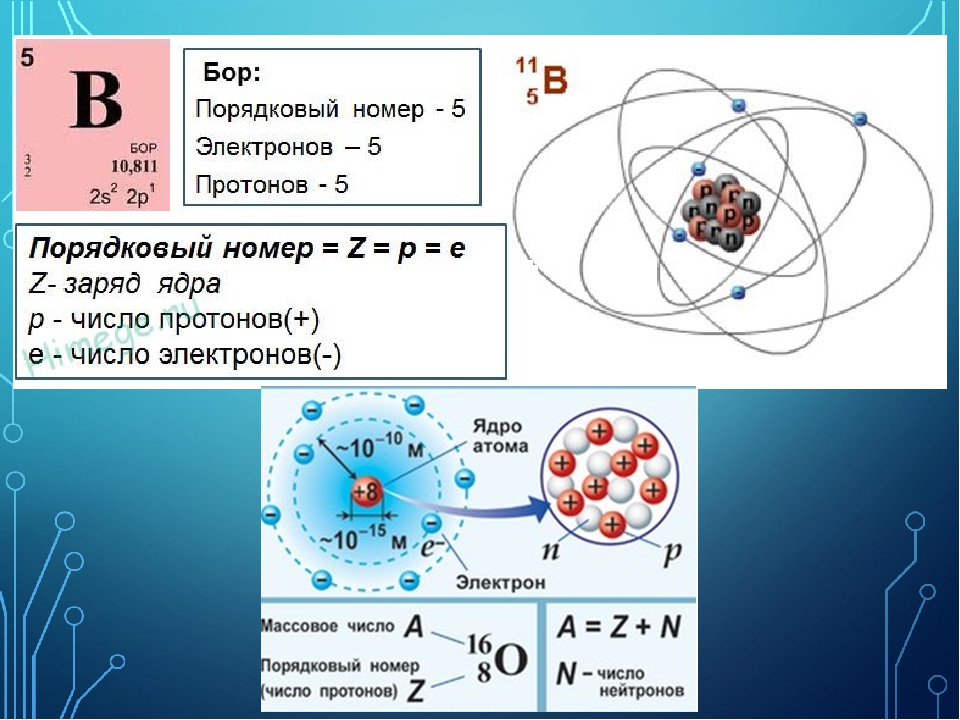 04.2020,
04.2020,
2.Изобразите схемы строения атомов элементов главных подгрупп Na, N, P, Ca
и элемента побочной подгруппы – V (№ 23, ванадий).
3. Из параграфа 54 выпишите в тетрадь значение периодического закона.
Дата урока 17.04.2020
Тема урока “Характеристика химического элемента” Урок в zoom в 13.00 ссылка для подключения ЗДЕСЬПрезентация, использованная на видео-уроке (правила, выводы, некоторые примеры необходимо выписать в тетрадь)
Контроль после видео-урока 17.04 до 19.00
(5 вопросов с выбором одного правильного ответа) ТЕСТДата урока 22.04.2020
Тема урока “Электроотрицательность химических элементов”
Задание на урок: 1. прочитайте параграф 55
2. Запишите в тетрадь дату и тему урока.
3. Выпишите в тетрадь “Важную информацию”, “Определение”
4. Внимательно рассмотрите таблицу 18.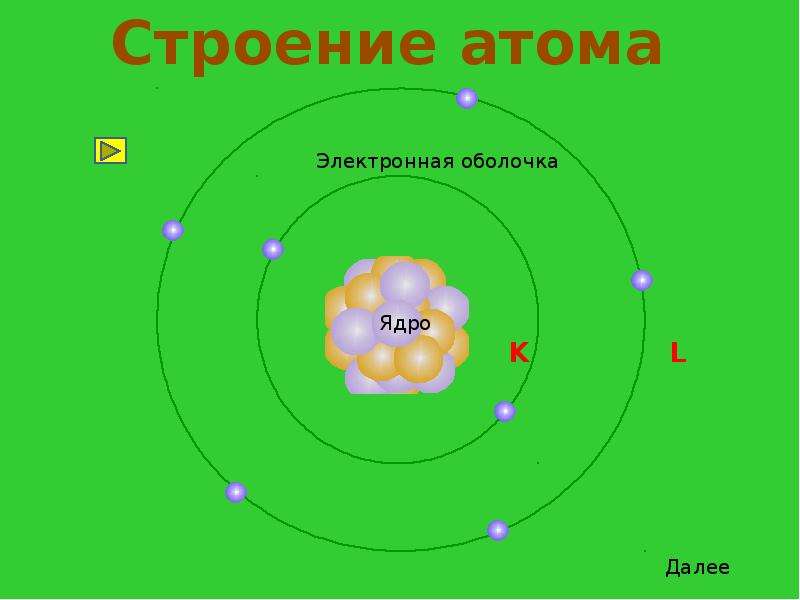 Попробуйте увидеть закономерности.
Попробуйте увидеть закономерности.
4. Письменно ответьте на вопрос 2 на стр.193, переписав тестовые вопросы,
выберите правильный ответ.
5. Фотографию записей в тетради по теме урока необходимо прислать на эл.почту учителя
не позднее урока 29.04.2020.
Занятие внеурочной деятельности “Основы химического исследования” от 22.04.2020 размещено в разделе 8а класс ВУД (где и все предметы). Предлагаю всему классу посмотреть материалы занятия “Химия в нашей жизни” (видео и игровой тренинг)
Дата урока 24.04.2020
Тема урока “Основные виды химической связи. Ковалентная и ионная связь”
1. Посмотрите два видео по теме урока
2. Запишите в тетради дату и тему урока.
3. Прочитайте параграф 56, из которого выпишите в тетрадь “Определения” (4 определения)
до конца учебного дня 24.04.2020 (ссылка открыта до 28.04.2020)
Дата урока 29.04.2020
Тема урока “Степень окисления”
1. Посмотрите два видео по теме урока
https://youtu. be/CP-XAXVDz2s (26 минут)
be/CP-XAXVDz2s (26 минут)
Ничего записывать в тетрадь не надо, только внимательно смотреть и слушать.
2. У кого нет технической возможности посмотреть видео, то прочитайте параграф 57.
3. Запишите в тетради дату и тему урока.
Выпишите определение степени окисления (стр.201)
4. Запишите:
степень окисления (С.О.) определяется числом отданных или принятых
электронов.
5. Выпишите в тетрадь (используйте сокращения)
правила вычисления степени окисления элементов (стр.201).
6. Задание после урока (“домашнее”):
Перескажите правила вычисления степени окисления элементов.
Выполните упражнение: из таблицы 15 (только на странице 170)
выпишите формулы высших оксидов, летучих водородных соединений,
солей (13 формул) и укажите над каждым элементом его степень окисления.
7. Фото выполненной работы необходимо прислать до конца дня 30.04
Занятие внеурочной деятельности “Основы химического исследования”
от 22. 04.2020 и 29.04.2020
04.2020 и 29.04.2020
размещено в разделе 8а класс ВУД (где и все предметы).
Предлагаю всему классу посмотреть материалы занятия “Химия в нашей жизни”
(видео и игровой тренинг).
Ваших Ответов НЕ ВИЖУ! Задание оставляю прежним до 30.04.2020
Дата урока 13 мая
Тема урока: Обобщение по теме «Периодический закон и система химических элементов Д.И.Менделеева. Строение атома. Химическая связь. Закон Авогадро»
Ребята, мы подошли к завершению последней темы курса химии 8 класса.
В начале наших занятий в апреле я опубликовала текст контрольной работы.
Для того, чтобы вы хорошо написали контрольную работу, надо вспомнить:
1. о типах кристаллических решеток – прочитайте стр.30 учебника
2. посмотрите видео о кристаллических решетках на 3 минуты
(о металлической кристаллической решетке более подробно
3. проводя повторение учебного материала (вопросы 1 – 3 контрольной работы),
Остался один вопрос, который необходимо вспомнить – это решение задач.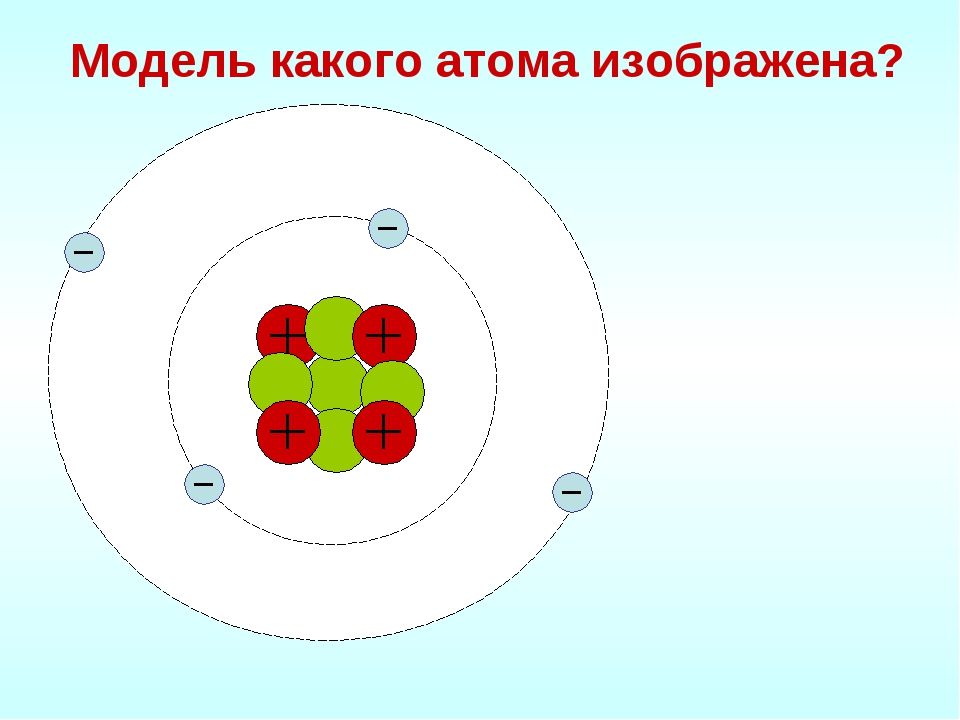
Главу 5 “Количественные отношения в химии” мы уже изучали.
4. Найдите записи в своих тетрадях, пролистайте, вспомните.
5. Прочитайте параграф 38.
7. Решите задачу №4 стр.128 (Подумай, ответь, выполни). Сфотографируйте решение и отправьте мне на почту для проверки до 15 мая (до контрольной работы, чтобы я смогла сделать комментарии)
Дата урока 15 мая
Тема урока: Контрольная работа по теме «Периодический закон и система химических элементов Д.И.Менделеева. Строение атома. Химическая связь. Закон Авогадро»
Ребята, выберите один вариант контрольной работы ПО ССЫЛКЕ и решите его в тетради.Текст заданий переписывать не надо.
Помните, что к работе вы готовились весь апрель, поэтому времени для
решения контрольной работы у вас мало.
Фотографию с решением необходимо прислать не позднее 17 мая.
(18 мая я буду выставлять отметки за четверть и год)
Дата урока 20 мая
Тема урока “Объемные отношения газов при химических реакциях”
2. Прочитайте параграф 39.
Прочитайте параграф 39.
3. Запишите дату и тему урока в тетрадь. Из параграфа выпишите в тетрадь
“Важную информацию” и Пример решения задачи.
4. Реши задачу №2 нс стр. 130 “Подумай, ответь, выполни”.
Фото присылать не надо. Полученный ответ в задаче сравни
с ответом на стр.205
Дата урока 22 мая
Тема урока “Генетическая связь между классами веществ. Химия вокруг нас”
Выпишите из видеоурока в тетрадь генетические ряды
(с них начнем курс химии (повторение) в 9 классе).
Прошу всех учащихся 8а класса зайти на страницу ВУД
от 20.05.2020 Основы химического исследования и написать ответы на вопросы.
строительные блоки молекул / Хабр
Если молекулы –
основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов.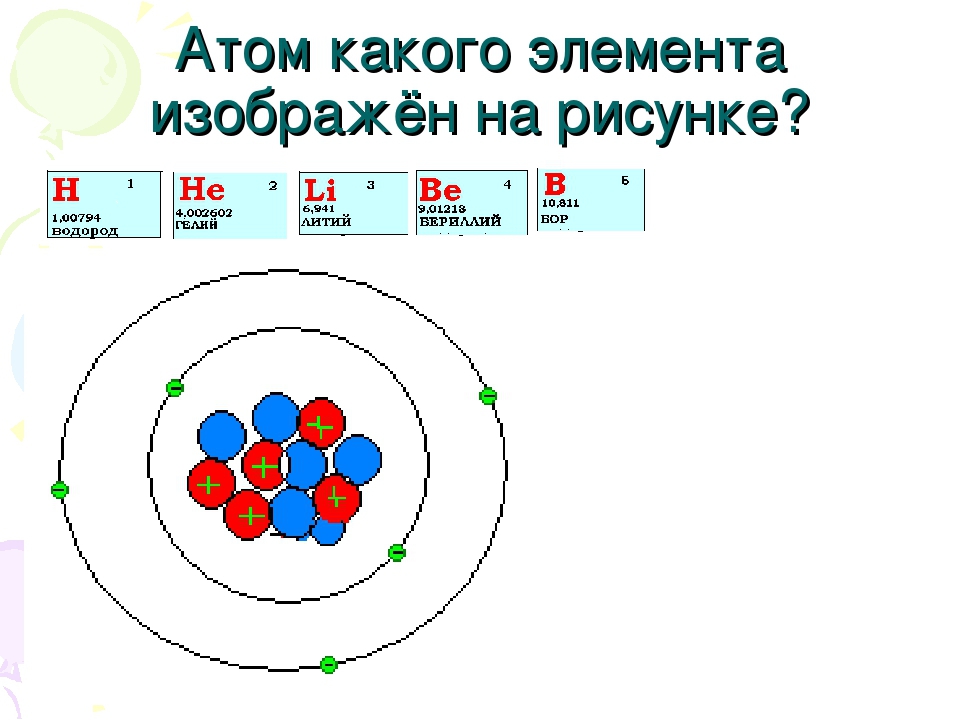 Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H
Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H
O содержит два атома водорода и один кислорода. Молекула столового сахара C
12H
22O
11содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).
На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра.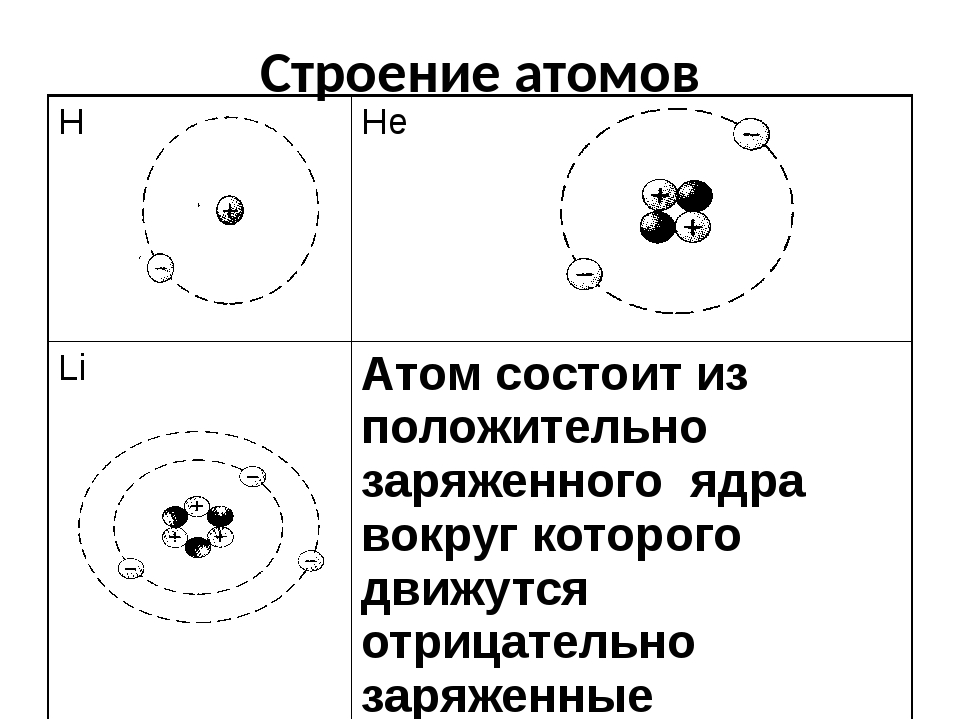 Ядро – это скопление протонов (красные) и нейтронов (белые).
Ядро – это скопление протонов (красные) и нейтронов (белые).
Рис. 1
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.
Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны.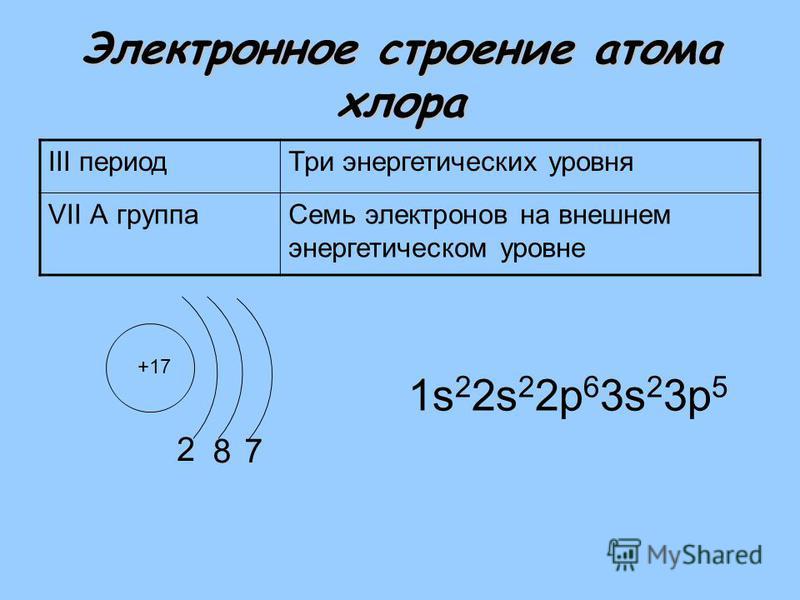 Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку.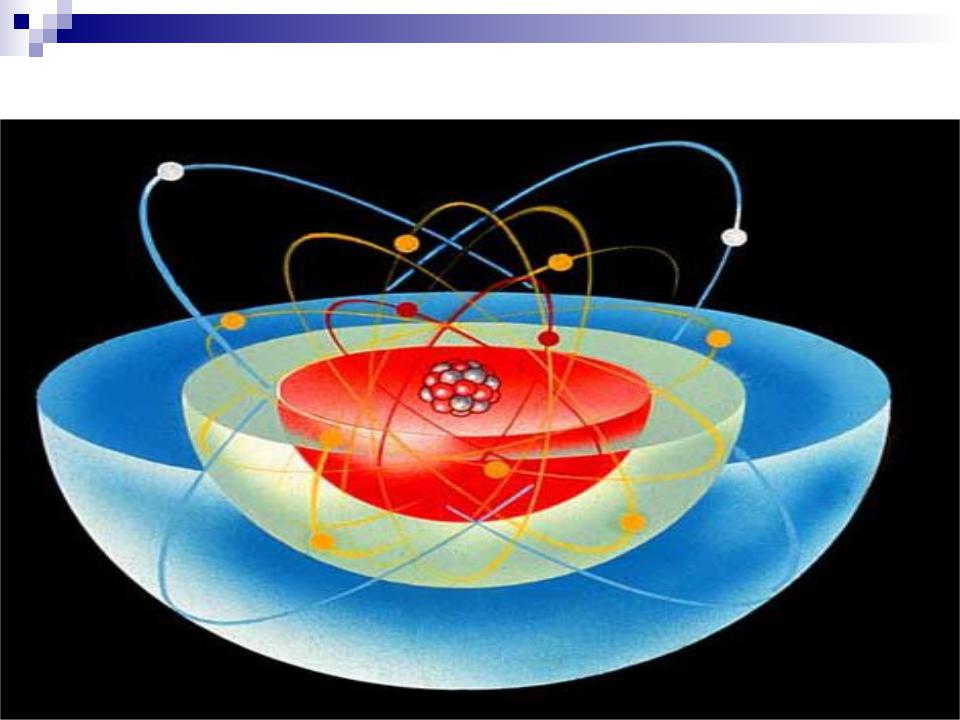 По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать.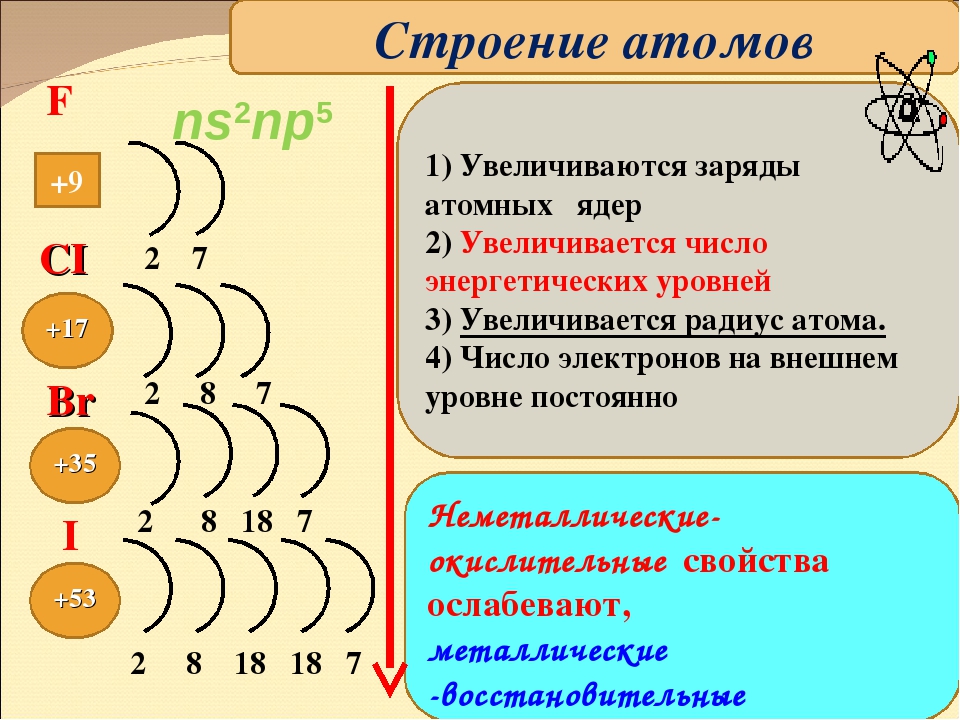 Так что пока просто примите это как странный факт.
Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.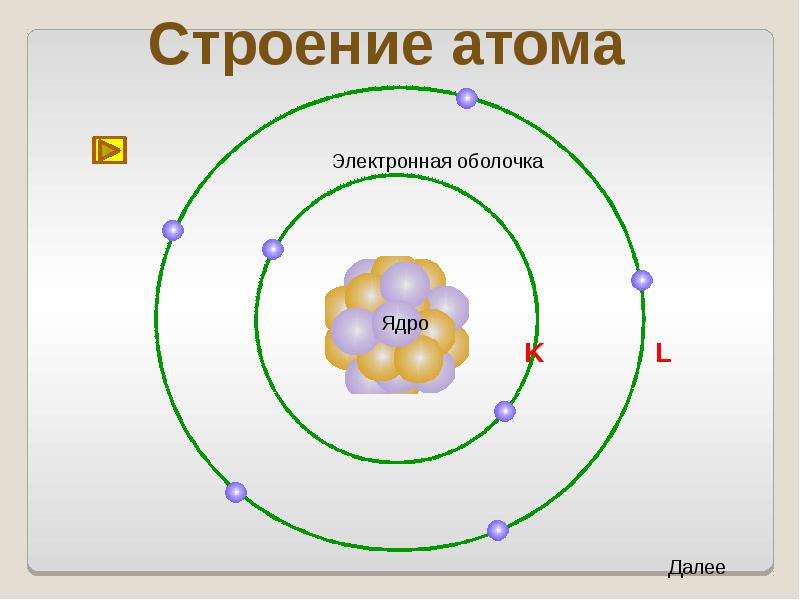
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
Дейтерий и тритий: водород, да не тот
Прошло более 85 лет с момента открытия тяжёлых изотопов водорода, тем не менее интерес к ним с каждым годом возрастает. Они дают надежду на выход из энергетического кризиса, но вместе с тем могут поставить под угрозу существование всего живого на нашей планете. Эту опасность человечество ощутило ещё полвека назад.
Они дают надежду на выход из энергетического кризиса, но вместе с тем могут поставить под угрозу существование всего живого на нашей планете. Эту опасность человечество ощутило ещё полвека назад.Натурные макеты атомной и водородной (на переднем плане) бомб в Музее ядерного оружия (г. Саров). Фото Александра Семёнова.
Соотношение тяжёлой и лёгкой воды в природной смеси. Фото Александра Семёнова.
Студент РХТУ Борис Иванов (слева) проходит практику в тритиевом отделе АО «ВНИИНМ». Справа — автор статьи. Фото: АО «ВНИИНМ».
Стеклянный баллон вакуумной установки, потемневший от многолетнего воздействия бета-излучения трития. Фото: АО «ВНИИНМ».
Радиолюминограмма образца нержавеющей стали, экспонированного в тритии. Разным цветом показаны участки, содержащие различное количество этого изотопа. Фото: АО «ВНИИНМ».
‹
›
В 1931—1932 годах американский физикохимик Гарольд Юри и его коллеги сумели выделить из обыкновенного, всем известного водорода необычную фракцию. Водород из этой фракции имел большие атомный вес и плотность, давал в эмиссионном спектре ранее незнакомые линии, напоминающие классические линии спектра водорода, но в то же время немного смещённые. Это означало, что в природном водороде присутствуют атомы нескольких сортов, отличные по своим свойствам. Так был открыт первый из тяжёлых изотопов водорода — дейтерий. Вскоре в чистом виде была получена «тяжёлая вода» — оксид дейтерия. Она имела на 10% бóльшую плотность, более высокие температуры плавления и кипения, чем вода обычная, сложнее разлагалась электрическим током, что вскоре легло в основу одного из первых способов её получения. Длительный, многоступенчатый электролиз воды позволял сконцентрировать дейтерий и очистить его от лёгкого изотопа водорода.
Водород из этой фракции имел большие атомный вес и плотность, давал в эмиссионном спектре ранее незнакомые линии, напоминающие классические линии спектра водорода, но в то же время немного смещённые. Это означало, что в природном водороде присутствуют атомы нескольких сортов, отличные по своим свойствам. Так был открыт первый из тяжёлых изотопов водорода — дейтерий. Вскоре в чистом виде была получена «тяжёлая вода» — оксид дейтерия. Она имела на 10% бóльшую плотность, более высокие температуры плавления и кипения, чем вода обычная, сложнее разлагалась электрическим током, что вскоре легло в основу одного из первых способов её получения. Длительный, многоступенчатый электролиз воды позволял сконцентрировать дейтерий и очистить его от лёгкого изотопа водорода.
Другой тяжёлый изотоп, тритий, открыли двумя годами позже в Кембриджском университете физики Эрнест Резерфорд, Марк Олифант и физикохимик Пауль Хартек при бомбардировке ядрами дейтерия мишеней из дейтерийсодержащих соединений.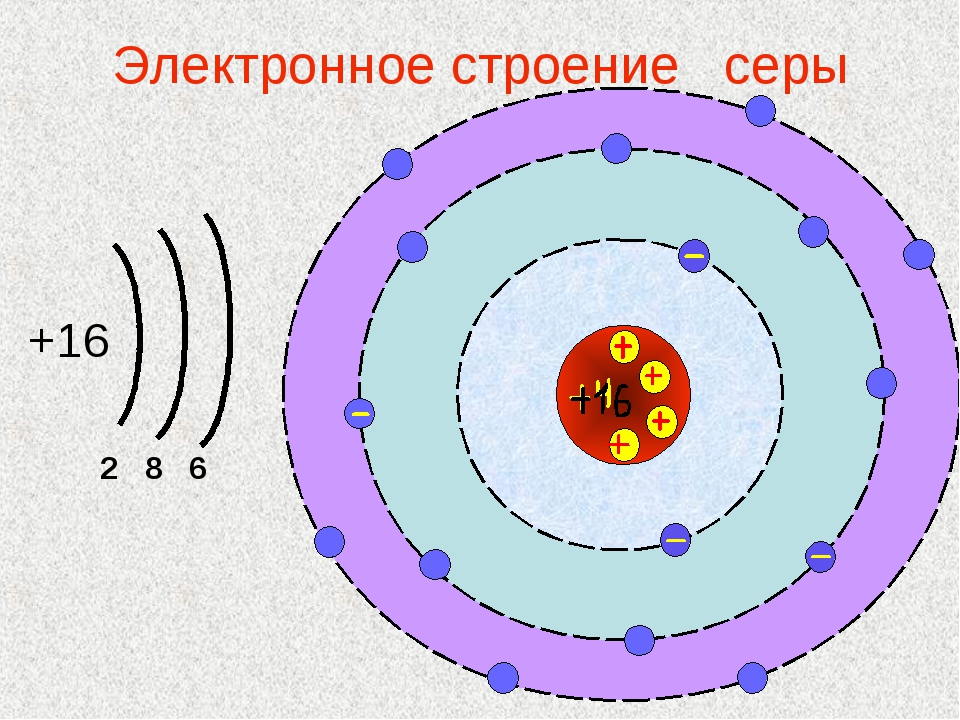 При этом исследователи впервые столкнулись с ядерным синтезом — искусственным превращением одних ядер в другие. Как оказалось, третий изотоп водорода сильно радиоактивен (период полураспада 12,32 года) и поэтому не может накапливаться в природе в сколько-нибудь значимых количествах.
При этом исследователи впервые столкнулись с ядерным синтезом — искусственным превращением одних ядер в другие. Как оказалось, третий изотоп водорода сильно радиоактивен (период полураспада 12,32 года) и поэтому не может накапливаться в природе в сколько-нибудь значимых количествах.
За открытие дейтерия Г. Юри в 1934 году был награждён Нобелевской премией по химии.
Поначалу дейтерий производили электролитическим методом, что требовало больших затрат электроэнергии и обходилось недёшево. А реакторная наработка весовых количеств трития даже по самым скромным подсчётам должна была стоить баснословных денег. Кто бы мог тогда подумать, что через два десятка лет после их открытия в нескольких государствах мира будут работать крупномасштабные производства и дейтерия и трития! Причина такой популярности тяжёлых изотопов водорода заключалась в том, что они стали основой самого мощного из всех существовавших когда-либо видов оружия. Это оружие получило название термоядерного или водородного.
Вспоминая эпоху «холодной войны», в которую довелось родиться автору этой статьи, стоит заметить, что зловещее и практически забытое сейчас выражение «водородная бомба» долгое время было у всех на слуху и вызывало неприятный холодок в душе жителя Советского Союза. Все жили под дамокловым мечом ядерной войны, которая, как казалось, могла начаться в любой момент. В политических карикатурах журнала «Крокодил» недобрый «дядя Сэм», как правило, доставал из-за пазухи или держал в руке выразительную чёрную бомбу с эмблемой «Н», что означало «водородная», или с эмблемой «N», что означало бомбу нейтронную, представляющую более современный тип бомбы водородной. Не все понимали, что идёт речь не о самом водороде, а только о его тяжёлых изотопах, составляющих термоядерный заряд. Изобилие карикатур на эту тему привело к тому, что атомные и водородные бомбы часто попадали в детские рисунки и были причиной многих детских страхов.
В чём же секрет небывалой мощи, скрытой в тяжёлых изотопах водорода? Он заключён в высоком энергетическом эффекте реакции слияния ядер дейтерия и трития и в рекордно малой величине энергетического барьера, который необходимо преодолеть, чтобы их ядра слились. Если обычный урановый или плутониевый ядерный заряд использовать для поджигания термоядерной реакции, то его энергию можно усилить в 600 раз и более. Большое достоинство такого заряда состоит в том, что дейтерий и тритий при слиянии не только не дают долгоживущих радиоактивных продуктов, но и способствуют более полному сгоранию самого ядерного запала. И значит, термоядерное оружие при его использовании наносит значительно меньший экологический урон, оставляя меньшее радиоактивное заражение местности, чем ядерное оружие той же мощности. Это открывало не только военные, но и мирные перспективы его использования — при сооружении подземных ёмкостей-хранилищ газа, при тушении пожаров на нефтяных скважинах, а также для быстрого и относительно безопасного создания искусственных котлованов и каналов серией небольших термоядерных взрывов.
Если обычный урановый или плутониевый ядерный заряд использовать для поджигания термоядерной реакции, то его энергию можно усилить в 600 раз и более. Большое достоинство такого заряда состоит в том, что дейтерий и тритий при слиянии не только не дают долгоживущих радиоактивных продуктов, но и способствуют более полному сгоранию самого ядерного запала. И значит, термоядерное оружие при его использовании наносит значительно меньший экологический урон, оставляя меньшее радиоактивное заражение местности, чем ядерное оружие той же мощности. Это открывало не только военные, но и мирные перспективы его использования — при сооружении подземных ёмкостей-хранилищ газа, при тушении пожаров на нефтяных скважинах, а также для быстрого и относительно безопасного создания искусственных котлованов и каналов серией небольших термоядерных взрывов.
Абсолютным рекордсменом среди всех видов взрывных устройств, когда-либо созданных человеком, следует назвать советскую водородную бомбу АН602, которая была испытана 30 октября 1961 года на ядерном полигоне «Сухой Нос» архипелага Новая Земля. С лёгкой руки Генерального секретаря Компартии СССР Н. С. Хрущёва эта бомба вошла во Всемирную историю под названием «Кузькина мать». Кроме того, по аналогии с Царь-пушкой и Царь-колоколом этот заряд часто называют «Царь-бомбой». Разработана она была под руководством академика АН СССР И. В. Курчатова. Её измеренная мощность в тротиловом эквиваленте составила 58,6 мегатонны.
С лёгкой руки Генерального секретаря Компартии СССР Н. С. Хрущёва эта бомба вошла во Всемирную историю под названием «Кузькина мать». Кроме того, по аналогии с Царь-пушкой и Царь-колоколом этот заряд часто называют «Царь-бомбой». Разработана она была под руководством академика АН СССР И. В. Курчатова. Её измеренная мощность в тротиловом эквиваленте составила 58,6 мегатонны.
Сколько же тяжёлых изотопов водорода в природе? Дейтерия в природе не так уж и мало. Его концентрация относительно протия составляет около 0,016% ат., но, учитывая широкую распространённость самого водорода, запасы дейтерия можно считать неисчерпаемыми. Наибольшие его количества находятся в Мировом океане; концентрация дейтерия в океанической воде также заметно выше, чем в водах рек, вследствие фракционирования изотопов воды в атмосферном водяном цикле (см. «Наука и жизнь» № 5, 2011 г., статья «Изотопная «дактилоскопия» для Шерлока Холмса»). Дейтерия в водах Мирового океана содержится даже больше, чем таких химических элементов, как фтор и йод. Природные вариации соотношения изотопов дейтерия и протия изменяются в диапазоне от 5500 до 11 000 атомов лёгкого водорода на один атом тяжёлого — это своеобразный рекорд среди природных вариаций всех стабильных изотопов. Наименьшие концентрации дейтерия наблюдаются в ледниках Антарктики, а наибольшие — в закрытых водоёмах пустыни Сахара.
Природные вариации соотношения изотопов дейтерия и протия изменяются в диапазоне от 5500 до 11 000 атомов лёгкого водорода на один атом тяжёлого — это своеобразный рекорд среди природных вариаций всех стабильных изотопов. Наименьшие концентрации дейтерия наблюдаются в ледниках Антарктики, а наибольшие — в закрытых водоёмах пустыни Сахара.
Трития в природе в десятки и сотни триллионов раз меньше, чем дейтерия. Из-за радиоактивного распада тритий практически отсутствует в объектах, изолированных от атмосферы, например в углеводородах нефти и природного газа. Естественная наработка трития на Земле постоянно происходит при воздействии космических лучей на ядра азота и кислорода в верхних слоях атмосферы, поэтому наиболее богаты природным тритием осадки: дождь и снег. Такая естественная наработка трития находится в равновесии с его распадом и составляет не более 7 кг на весь земной шар.
Во второй половине ХХ века количество трития в природе многократно возрастало в период интенсивных испытаний термоядерного оружия.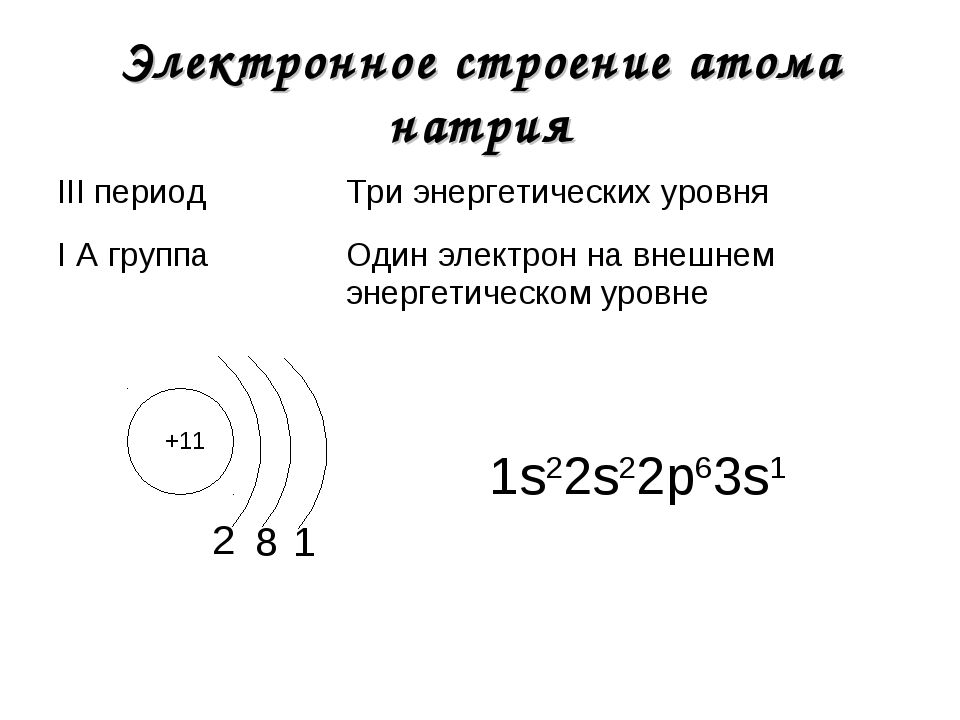 Так, при взрыве водородной бомбы мощностью одна мегатонна образуется и попадает в окружающую среду до 2 кг трития. За всё время наземных и воздушных испытаний термоядерного оружия в атмосфере накапливались сотни килограммов трития. После их запрета количество трития в земной атмосфере заметно снизилось за счёт его радиоактивного распада и сейчас не превышает десятков килограммов. Важный источник поступления трития в окружающую среду — атомные электростанции, которые ежегодно вырабатывают килограммы трития (сопоставимо с его природной наработкой). Из этого количества в окружающую среду попадает не более одной седьмой части.
Так, при взрыве водородной бомбы мощностью одна мегатонна образуется и попадает в окружающую среду до 2 кг трития. За всё время наземных и воздушных испытаний термоядерного оружия в атмосфере накапливались сотни килограммов трития. После их запрета количество трития в земной атмосфере заметно снизилось за счёт его радиоактивного распада и сейчас не превышает десятков килограммов. Важный источник поступления трития в окружающую среду — атомные электростанции, которые ежегодно вырабатывают килограммы трития (сопоставимо с его природной наработкой). Из этого количества в окружающую среду попадает не более одной седьмой части.
Как разделить изотопы водорода? Известный учёный и публицист академик И. В. Петрянов-Соколов в конце 1960-х годов, проведя несложные математические выкладки, показал, насколько утопичен миф о «накоплении тяжёлой воды» в чайнике при длительном кипячении. Чтобы получить хотя бы литр воды с обогащением по дейтерию всего в 10 раз больше природного, пришлось бы испарить такое её количество, масса которого во много раз превышает массу всей Солнечной системы. Причина — близость физико-химических свойств обычной и дейтериевой воды, малая величина коэффициента разделения этих изотопов при дистилляции. Эффективность разделения может быть значительно повышена, если использовать многоступенчатые противоточные процессы. Наиболее освоены и промышленно реализованы такие методы получения дейтерия, как ректификация жидкого водорода, двухтемпературный сероводородный метод, и метод, основанный на химическом обмене в системе «вода—водород». При получении концентрированного трития приходится считаться с его радиоактивностью. В этом случае могут быть применены лишь те методы, в которых водород присутствует в молекулярном виде, так как и вода и сероводород, содержащие тритий, сильно разлагаются вследствие авторадиолиза. При получении дейтерия в качестве исходного сырья используют природную воду. Тритий может быть получен только в реакторах, при облучении нейтронами одного из изотопов лития.
Причина — близость физико-химических свойств обычной и дейтериевой воды, малая величина коэффициента разделения этих изотопов при дистилляции. Эффективность разделения может быть значительно повышена, если использовать многоступенчатые противоточные процессы. Наиболее освоены и промышленно реализованы такие методы получения дейтерия, как ректификация жидкого водорода, двухтемпературный сероводородный метод, и метод, основанный на химическом обмене в системе «вода—водород». При получении концентрированного трития приходится считаться с его радиоактивностью. В этом случае могут быть применены лишь те методы, в которых водород присутствует в молекулярном виде, так как и вода и сероводород, содержащие тритий, сильно разлагаются вследствие авторадиолиза. При получении дейтерия в качестве исходного сырья используют природную воду. Тритий может быть получен только в реакторах, при облучении нейтронами одного из изотопов лития.
Приятно отметить, что наше предприятие, АО «ВНИИНМ» им. академика А. А. Бочвара, которое ранее называлось НИИ-9, стоит у истоков создания всех отечественных тритиевых технологий. И реакторная наработка трития, и его очистка от сопутствующих примесей, и проблемы безопасности обращения с ним — все эти вопросы были в своё время успешно решены.
А. Бочвара, которое ранее называлось НИИ-9, стоит у истоков создания всех отечественных тритиевых технологий. И реакторная наработка трития, и его очистка от сопутствующих примесей, и проблемы безопасности обращения с ним — все эти вопросы были в своё время успешно решены.
С самого начала Атомного проекта СССР проблема получения трития была по значимости на втором месте после изготовления ядерного заряда. Тритий предстояло нарабатывать реакторным путём из лёгкого изотопа лития — 6Li. Решение этой задачи было поручено коллективу НИИ-9, состоявшему из специалистов разных направлений. С их помощью в Советском Союзе создали тритиевое производство и ныне действующее на ФГУП «ПО «Маяк» (г. Озёрск).
Процессы разделения изотопов водорода в нашей стране большей частью разработаны в МХТИ (ныне — РХТУ им. Д. И. Менделеева). Там же в 1934 году А. И. Бродский получил первую советскую тяжёлую воду на специально разработанной лабораторной установке. Ежегодно кафедра технологии изотопов РХТУ даёт образование десяткам специалистов в этой области.
Наибольшее количество дейтерия в нашей стране, по-видимому, наработано методом низкотемпературной ректификации*, хотя на первом этапе для этого активно использовали очень энергозатратный способ получения тяжёлой воды электролизом. Производства дейтерия были распределены по всей стране, при этом ориентировались на наличие свободной электроэнергии и на возможность использования отходящего водорода, в частности на азотно-туковых заводах**. Одно из наиболее крупных производств дейтерия существовало в городе Чирчик; тяжёлую воду производили также в Днепродзержинске, Сталиногорске, Ленинграде, Норильске, Каменке, Березниках, Горловке и во многих других городах СССР. Меньшее распространение у нас получил двухтемпературный сероводородный метод производства тяжёлой воды, реализованный в городе Алексине, в то время как в мировом масштабе это один из основных методов её получения.
Исторически первой страной, производившей тяжёлую воду в крупнотоннажных масштабах, была Норвегия. Это связано с наличием в ней большого количества избыточной электроэнергии, необходимой для электролитического производства D2O. Принято считать, что если бы гитлеровская Германия получила в своё распоряжение запасы норвежской тяжёлой воды, то вполне могла бы успеть создать до своего разгрома собственное ядерное оружие. К счастью, этого не произошло благодаря проведённой спецоперации: парóм с норвежской тяжёлой водой, предназначенной для переправки в Германию, был уничтожен. На сегодня крупнейшие производители тяжёлой воды в мире — это Индия, Китай и Иран, активно развивающие тяжеловодное направление своей атомной энергетики. Огромными запасами тяжёлой воды владеют Канада и США, которым пришлось даже остановить ряд своих предприятий из-за перепроизводства и экологических проблем. При эксплуатации тяжеловодных АЭС Канаде приходится периодически очищать теплоноситель как от протия (он мешает ядерной реакции), так и от нарабатываемого трития (повышает радиационную нагрузку на персонал). При этом Канада попутно получает до 2 кг трития в год как ценный побочный продукт эксплуатации своих тяжеловодных АЭС. Собственное тяжеловодное производство имеет Румыния.
Принято считать, что если бы гитлеровская Германия получила в своё распоряжение запасы норвежской тяжёлой воды, то вполне могла бы успеть создать до своего разгрома собственное ядерное оружие. К счастью, этого не произошло благодаря проведённой спецоперации: парóм с норвежской тяжёлой водой, предназначенной для переправки в Германию, был уничтожен. На сегодня крупнейшие производители тяжёлой воды в мире — это Индия, Китай и Иран, активно развивающие тяжеловодное направление своей атомной энергетики. Огромными запасами тяжёлой воды владеют Канада и США, которым пришлось даже остановить ряд своих предприятий из-за перепроизводства и экологических проблем. При эксплуатации тяжеловодных АЭС Канаде приходится периодически очищать теплоноситель как от протия (он мешает ядерной реакции), так и от нарабатываемого трития (повышает радиационную нагрузку на персонал). При этом Канада попутно получает до 2 кг трития в год как ценный побочный продукт эксплуатации своих тяжеловодных АЭС. Собственное тяжеловодное производство имеет Румыния.
В нашей стране тяжёлую воду и дейтерий в настоящее время производит единственное предприятие — ПИЯФ им. Б. П. Константинова в Гатчине. В качестве исходного сырья используют запасы, накопленные в СССР. Из природного сырья дейтерий у нас в стране сейчас не выделяют.
Говоря об отечественных тритиевых технологиях, нельзя не упомянуть РФЯЦ-ВНИИЭФ (г. Саров), специалисты которого многие годы занимаются этим вопросом как в рамках оборонных задач, так и для нужд фундаментальной науки. В частности, они разработали тритиевую криомишень для получения сверхтяжёлых изотопов лёгких элементов, используемую в ОИЯИ (г. Дубна) на установке АКУЛИНА***, позволившую получить пятый изотоп водорода и до сих пор востребованную в фундаментальных исследованиях.
Где же применяют тритий и дейтерий? Так уж получилось, что открытые человеком колоссальные источники энергии деления и слияния ядер изначально предполагалось использовать для разрушения, и лишь потом было освоено их мирное использование. Кроме того, есть немало сфер применения этих изотопов, вообще не связанных с реакцией термоядерного синтеза.
Кроме того, есть немало сфер применения этих изотопов, вообще не связанных с реакцией термоядерного синтеза.
Один из основных отечественных потребителей трития и производителей тритиевой продукции — ФГУП «ВНИИА им. Н. Л. Духова». На этом предприятии разрабатывают и производят нейтронные генераторы — ускорительные устройства, в которых ядра дейтерия, ударяясь в мишень, вступают в ядерную реакцию с содержащимся в ней тритием. При этом выделяющиеся нейтроны имеют постоянную энергию 14,1 МэВ, а само устройство очень удобно в эксплуатации. При отсутствии ускоряющего напряжения нейтроны не излучаются (в отличие от радиоизотопных нейтронных источников), а радиоактивный тритий находится внутри нейтронной трубки и в таком виде практически безопасен (его мягкое бета-излучение не способно пробить даже лист бумаги).
Нейтронные генераторы используются везде, где требуются компактные автономные источники нейтронов. Очень востребованы они у геологов, которые используют их при гео-физическом исследовании скважин методом нейтронного каротажа. (Слово «каротаж» происходит от французского слова «carotte» — морковь, что объясняется сходством формы керна, извлекаемого из земли, с морковью.) Метод нейтронной активации при этом позволяет оперативно получить полную информацию о химическом составе всех горных пород по глубине скважины, просто опустив в неё нейтронный зонд с детектором. Нейтронный генератор, изготовленный во ВНИИА, есть даже на марсоходе «Curiosity» («Кьюриосити»; в переводе с английского означает «любопытство»), в составе прибора ДАН (Детектора альбедных нейтронов), созданного в ИКИ РАН. Главная задача этого прибора — поиск воды на Марсе под толщей грунта, и уже имеются первые положительные результаты. ВНИИНМ внёс свой вклад в этот международный проект, поставив для ВНИИА мишени, насыщенные тритием.
(Слово «каротаж» происходит от французского слова «carotte» — морковь, что объясняется сходством формы керна, извлекаемого из земли, с морковью.) Метод нейтронной активации при этом позволяет оперативно получить полную информацию о химическом составе всех горных пород по глубине скважины, просто опустив в неё нейтронный зонд с детектором. Нейтронный генератор, изготовленный во ВНИИА, есть даже на марсоходе «Curiosity» («Кьюриосити»; в переводе с английского означает «любопытство»), в составе прибора ДАН (Детектора альбедных нейтронов), созданного в ИКИ РАН. Главная задача этого прибора — поиск воды на Марсе под толщей грунта, и уже имеются первые положительные результаты. ВНИИНМ внёс свой вклад в этот международный проект, поставив для ВНИИА мишени, насыщенные тритием.
То, что тритий является мягким бета-излучателем с высокой радиоактивностью, обусловливает его использование в радиоизотопных источниках света и электроэнергии. Во многих часах и приборах со светящимися стрелками применяют люминофоры, активированные тритием. Тритиевая подсветка на оружейных прицелах существенно повышает точность стрельбы в ночное время.
Тритиевая подсветка на оружейных прицелах существенно повышает точность стрельбы в ночное время.
Сейчас АО «ВНИИНМ» по заказу Роскосмоса и под руководством ООО «Солар-Си» принимает участие в разработке отечественного бета-вольтаического источника питания на основе трития — «тритиевой батарейки». Этот источник питания нужен в тех ответственных узлах, где требуется стабильное бесперебойное электроснабжение в течение многих лет. Его создание решит актуальный вопрос импортозамещения, поскольку аналогичных источников электропитания Россия в настоящее время не производит.
Наибольшие количества дейтерия потребляются атомной энергетикой. Содержащая его тяжёлая вода — один из наилучших замедлителей нейтронов, настолько эффективный, что позволяет «зажечь» реакцию деления ядер даже в уране с природным обогащением по изотопу U-235, тогда как все остальные типы ядерных реакторов требуют обогащённого урана. Использование тяжёлой воды в качестве замедлителя позволяет повысить и степень выгорания ядерного топлива. По этому пути пошла атомная энергетика Канады, которая производит для себя и строит по всему миру на заказ тяжеловодные реакторы CANDU.
По этому пути пошла атомная энергетика Канады, которая производит для себя и строит по всему миру на заказ тяжеловодные реакторы CANDU.
И дейтерий и тритий активно применяют при производстве меченых соединений. В этой продукции заинтересованы в первую очередь биологи и медики, которые с помощью изотопной метки определяют механизмы биохимических реакций. У нас меченные тритием соединения традиционно производят в Институте молекулярной генетики РАН.
Самая заманчивая перспектива использования дейтерия и трития — создание управляемой термоядерной реакции. Если это удастся, человечество будет иметь в своём распоряжении неисчерпаемый источник энергии. К сожалению, эта задача оказалась чрезвычайно сложной. Более полувека в мире ведутся разработки в этой области, но всё равно мы очень далеки от создания такого термоядерного реактора, который производил бы энергии больше, чем потреблял. В настоящее время весь мир с надеждой смотрит на международный термоядерный реактор ИТЭР, создаваемый в городе Кадараш на юге Франции. С его помощью физики надеются приблизиться к созданию энергетики, использующей энергию слияния ядер трития и дейтерия, а в перспективе перейти к использованию одного дейтерия, чьи ядра могут взаимодействовать между собой.
В своё время на нашем предприятии пересказывали забавную историю, как один из вновь назначенных чиновников, проходя по территории ВНИИНМ, потребовал, чтобы ему «показали тритий», и был очень возмущён тем, что этого не сделали. Ему объясняли, что тритий — это газ, который прозрачен и потому невидим, тем не менее новый босс сурово резюмировал: «Что-то у вас здесь нечисто!». Давайте попытаемся понять, можно ли изотопы водорода «увидеть»?
Что касается трития, то, несомненно, да — можно, и без всяких дополнительных устройств. В концентрированном виде этот изотоп водорода даёт голубое свечение вследствие самоионизации. Поток бета-излучения трития способен при длительном контакте изменить цвет стекла, он вызывает потемнение эмульсии фотопластинок, на чём основан классический метод авторадиографического анализа, в котором по интенсивности потемнения фотоэмульсии определяют концентрацию радиоактивного изотопа. В последнее время приобретает популярность новый метод анализа трития, позволяющий визуализировать его распределение по поверхности образцов, — радиолюминография. Метод основан на образовании скрытого изображения в некоторых люминофорах под воздействием радиации. Это изображение считывается специальным лазерным сканером, причём интенсивность люминесценции пропорциональна активности образца. Концентрация трития с помощью радиолюминографии может быть представлена довольно наглядно и красочно. Радиоактивность трития даёт возможность определять даже ничтожные его количества методом жидкостной сцинтилляции, в котором определяют интенсивность свечения некоторых жидкостей, пропорциональную содержанию в них радиоактивного изотопа, и газовыми ионизационными методами, использующими свойство газовых смесей менять свои вольт-амперные характеристики при воздействии на них ионизирующего излучения. Кроме того, и дейтерий и тритий, так же как самый лёгкий из изотопов водорода протий, можно без труда «увидеть», используя современные методы атомно-эмиссионной, ИК- и масс-спектрометрии.
Не стоит забывать и об опасности, которую несут тяжёлые изотопы водорода. Самая грозная и зловещая из них скрыта в термоядерном оружии, произведённом за десятилетия «холодной войны». В своё время в прессе звучали сообщения, что мощности накопленного вооружения достаточно, чтобы неоднократно уничтожить всё живое на нашей планете. Даже малая его часть в случае использования способна вызвать глобальную экологическую катастрофу, известную под названием «ядерная зима». Несомненно, важнейшая задача всего человечества — не допустить развития такого сценария в мировой истории.
Но даже тот тритий, который не используется в вооружении, представляет для человека существенную опасность, так как является высокотоксичным радиоактивным изотопом. Риск облучения персонала, контактирующего с тритием, очень высок в связи с тем, что этот изотоп не удерживается современными фильтрующими системами защиты органов дыхания и способен проникать через кожу. При этом в форме тритированной воды тритий в 10 000 раз токсичнее, чем в виде молекулярного водорода, так как пары тритированной воды уже при комнатной температуре практически мгновенно обменивают изотопы водорода, моментально попадая за счёт этого в организм человека. Значительная часть трития при переработке радиоактивных отходов сбрасывается в атмосферу или попадает в Мировой океан. И обращение с отходами, содержащими тритий (особенно с низкоактивными, которых очень много), до сих пор представляет собой серьёзную проблему, ожидающую своего решения.
***
Кто бы мог предугадать 100 лет назад, что самый первый и самый простой из химических элементов — водород преподнесёт нам столько сюрпризов, столько радости и страхов, надежд и разочарований? Сегодня хочется верить, что все знания, полученные человечеством, будут направлены только на созидание, а не на разрушение, а изотопы водорода со своими удивительными свой-ствами помогут нам ещё не раз заглянуть в сокровенные тайники Природы и сделать немало интересных и полезных открытий.
Автор выражает благодарность Г. М. Тер-Акопьяну (ОИЯИ), А. А. Юхимчуку (РФЯЦ-ВНИИЭФ), Л. А. Ривкису, М. И. Белякову, А. Н. Букину, А. С. Аникину, Н. Е. Забировой, А. В. Лизунову и всему тритиевому отделу АО «ВНИИНМ» им. академика А. А. Бочвара, а также специалистам кафедры технологии изотопов РХТУ им. Д. И. Менделеева, особенно М. Б. Розенкевичу и Ю. С. Паку, которые оказали помощь при подготовке материала.
***
Не только тяжёлые изотопы водорода имеют собственные красивые имена. Привычный нам самый лёгкий и распространённый изотоп водорода тоже имеет специальное обозначение — протий. Все три названия этих изотопов появились ещё до открытия трития, когда Г. Юри, Д. Мерфи и Ф. Брикведде 5 июня 1933 года предложили их в письме редактору научного журнала «The Journal of Chemical Physics». Названия изотопов водорода происходят от греческих слов «protos» (первый), «deuteros» (второй) и «tritos» (третий). Интересно отметить, что название «протий» менее известно широкой общественности, чем имена тяжёлых и намного более редких его «собратьев». В последнее время в интернете появились такие названия, как «квадий», «пентий», «гексий» и «септий», отнесённые к чрезвычайно короткоживущим изотопам водорода массой от 4 до 7 и с периодами полураспада 10–22 — 10–23 с. Однако, по-видимому, эти названия не имеют под собой основы и являются одним из «фейков» интернета. В частности, профессор Г. М. Тер-Акопьян, который с коллективом ОИЯИ (г. Дубна) впервые получил в 2001 году ядра пятого изотопа водорода, названия «пентий» ему не давал и никогда не слышал упоминания такого термина в научных публикациях и на конференциях.
Комментарии к статье
* Ректификация — разделение жидких смесей на практически чистые компоненты, отличающиеся температурами кипения, путём многократных испарений жидкости и конденсации паров. Разделение сжиженных газовых смесей ректификацией проводят при очень низких температурах под избыточным давлением.
** На азотно-туковых заводах из природного газа получают дешёвые азотные удобрения.
*** Название АКУЛИНА происходит от английского «accurate line» — аккуратная (прецизионная) линия.
Презентация по химии по теме “Строение атома”
ОБЩАЯ ХИМИЯ
СТРОЕНИЕ АТОМОВ
ХИМИЧЕСКИХ
ЭЛЕМЕНТОВ
Найдите
в нижеприведенном
тексте противоречие .
Как Вы думаете,
почему оно
возникло?
Атом (от греч. аtomos – неделимый) –
электронно-ядерная система, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
ē, m → 0; заряд –1
р, m = 1; заряд +1
n, m = 1; заряд 0
АТОМ
(электронейтрален)
ЯДРО
ЭЛЕКТРОНЫ
ПРОТОНЫ
НЕЙТРОНЫ
Запомним:
Химический элемент – вид атомов с определенным одинаковым зарядом ядра , т.е. с одинаковым числом протонов ( Число нейтронов в атомах одного и того же химического элемента может быть разным!) (ИЗОТОПЫ)
Запомним:
Если атом отдает электрон, он превращается в ион с положительным зарядом – катион ( например, К 0 – ē = К + ) ;
Если атом присоединяет электрон, то становится отрицательным ионом – анионом ( например, F 0 + ē = F – ) .
4
Запомним:
( ∑ē = ∑р = № элемента )
Число электронов в атоме равно числу протонов и определяется по порядковому номеру элемента в ПС
Строение атомных ядер и их превращения – предмет ядерной физики.
В химии обычно рассматривают строение электронных оболочек атомов
МНОЖЕСТВО «ПОЧЕМУ?», «КАК?» И «ЗАЧЕМ?»…
– ПОЧЕМУ ОТРИЦАТЕЛЬНЫЕ ЭЛЕКТРОНЫ НЕ ПАДАЮТ НА ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННОЕ ЯДРО?
– ПОЧЕМУ НЕЛЬЗЯ ГОВОРИТЬ О ТОЧНОМ МЕСТОНАХОЖДЕНИИ ЭЛЕКТРОНОВ В АТОМЕ?
– КАК УСТРОЕНА ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА?
– ПОЧЕМУ ЭЛЕКТРОНЫ ОБРАЗУЮТ ЭЛЕКТРОННЫЕ СЛОИ, А НЕ РАСПОЛАГАЮТСЯ НА ОДНОМ РАССТОЯНИИ ОТ ЯДРА?
– КАК УЗНАТЬ КОЛИЧЕСТВО ЭЛЕКТРОНОВ НА КАЖДОМ ЭЛЕКТРОННОМ СЛОЕ?
– ЗАЧЕМ НУЖНО ЗНАТЬ СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ? …
1. Электроны располагаются вокруг ядра на электронных слоях (энергетических уровнях)
Электроны разных слоев отличаются запасом внутренней энергии: чем дальше слой от ядра, тем больше запас энергии.
2n 2
2. Количество электронных слоев (энергетических уровней) в атоме равно номеру периода, в котором находится химический элемент в ПС
3. Каждый энергетический уровень состоит из подуровней, которые обозначаются латинскими буквами s , p , d , f .
Граничные поверхности и число s -, p -, d -, f – орбиталей на каждом уровне показаны на рисунке
4. Каждый подуровень состоит из атомных орбиталей.
Атомная орбиталь – место в пространстве вокруг ядра, в котором вероятность нахождения электрона наибольшая (90-95%).
Электронное облако атома водорода
5. Графически атомные орбитали обозначают квантовыми ячейками – квадратиками.
1
s-подуровень
1
p-подуровень
1
d-подуровень
1
f-подуровень
6. Принцип паули:
На одной орбитали может находиться не более 2-х электронов с противоположным спином .
Спин – вращение электрона вокруг собственной оси.
НЕПРАВИЛЬНО
ПРАВИЛЬНО
7. Правило хунда:
Электроны занимают свободные ячейки, располагаясь в них сначала по одному, а лишь затем спариваются.
ПРАВИЛЬНО
НЕПРАВИЛЬНО
Порядок заполнения орбиталей электронами :
(указано максимальное количество электронов на подуровне)
1s 2 – 2s 2 – 2p 6 – 3s 2 – 3p 6 – 4s 2 – 3d 10
- 4p 6 – 5s 2 – 4d 10 – 5p 6 – 6s 2 – 4f 14 –
- 5d 10 – 6p 6 – 7s 2 – 5f 14 …
ПРИМЕР
Подуровень
2р 3
Число
электронов
на подуровне
Номер
энергетического
уровня
Задание
Сколько энергетических уровней в атомах:
А) углерода
Б) хрома
В) бария
Г) гелия?
Каким атомам принадлежат
эти графические формулы?
2
3
1
4
5
6
8
7
9
Задание
Запишите электронную формулу:
А) гелия
Б) углерода
Постройте электронно-графическую формулу, распределив электроны по квантовым ячейкам
11 Na 1 s 2 2 s 2 2 p 6 3 s 1
17 Cl 1 s 2 2 s 2 2 p 6 3s 2 3 p 5
18 Ar 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, то есть записывают сокращенные электронные формулы атомов химических элементов :
11 Na 2, 8, 1; 17 Cl 2, 8, 7; 18 Ar 2, 8, 8.
Изотопы –
разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра (одинаковое число протонов в нем), но разную относительную атомную массу (разное число нейтронов)
О 16
О 17
о 18
Домашнее задание
Составьте электронные формулы элементов с порядковыми номерами:
На отметку «3» – 5,13,
На отметку «4» – 19,22,
На отметку «5» – 35,50
Для одного из двух химических элементов составьте графическую электронную формулу
Атомная структура
Атомная структураАтомная структура
Вся материя состоит из основных строительных блоков, называемых атомов . Атомы состоят из еще более мелких частиц, называемых протонами , электронов и нейтронов . Протоны и нейтроны живут в ядре атома и практически идентичны по массе. Тем не мение, протоны имеют положительный заряд, тогда как нейтроны не имеют заряда.Электроны имеют отрицательный заряд и вращаются вокруг ядра в оболочках или электронов орбитали и намного менее массивны, чем другие частицы. С электроны в 1836 раз менее массивны, чем протоны или нейтроны, большинство из них масса атома находится в ядре, которое составляет лишь 1/100 000 размера атома. весь атом (!).
Организация атома водорода показана ниже:
Атом водорода
Красная точка – это протон в ядре.Имеет положительный заряд +1 ед. Синяя точка – электрон. Имеет отрицательный заряд -1 ед. Для любого нормального атома количество электронов и протоны равны, что означает, что электрический заряд уравновешен. Там это только одна орбиталь для водорода. Давайте посмотрим на атом углерода большего размера.
Атом углерода
В ядре появилась новая частица – нейтрон. (представлен белыми точками). В ядре также 6 протонов, всего 12 частиц.Кроме того, теперь есть 6 электронов. вращается вокруг ядра по двум орбиталям. Причина, по которой атом углерода нуждается в Вторая орбиталь сложна и выходит за рамки этого геологического класса. Но правила, управляющие атомами, гласят, что первая орбиталь может иметь только две электронов, на второй орбитали разрешено восемь электронов, на третьей – только восемь электронов и т. д. (См. стр. 27 вашего текста с номерами электронов на каждой орбитали для первых 20 элементов.)
В природе 91 элемент.Атомы – это самые маленькие из возможных элементов, и на самом деле слово «атом» происходит от греческого слова «томос», что означает «не резать» – то есть вы не можете вырезать меньше, чем это. Мы обычно представляют элементы их атомным символом. Водород представлен буквой «H»; углерод буквой “C”.
Для атомов изменение числа протонов меняет вид элемент . Итак, если бы я бросил дополнительный протон в ядра атома углерода, проиллюстрированного выше, у меня больше не будет углерода – я будет азот.Точно так же, если бы я убрал протон из углерода атом, у меня был бы другой элемент, бор. Число протонов в ядро атома совпадает с атомным номером этого атом. Если сложить количество протонов и нейтронов, получится атомных массовое число этого конкретного атома.
Быстрая викторина : Какой атомный номер показан атом водорода выше? Что это за атомное массовое число? Что такое атомный номер и массовое атомное число указанного выше атома углерода?
Ответы : атомный номер водорода 1 (посчитайте протоны).Атомно-массовое число водорода тоже , одно (есть нет нейтронов!). Для углерода атомный номер 6 , а атомный номер массовое число 12 (6 протонов плюс 6 нейтронов).
Посмотрите еще раз на изображение атома углерода. Что, если бы мы добавили нейтрон вместо протона? Будет ли у нас такой же элемент? да. Но атом был бы другим. A dding или вычитание нейтронов из ядра атома создает изотопы этого атома . Например, давайте добавим два нейтрона к атому углерода, обозначенному зеленым точки ниже:
Изотоп углерода
Добавление двух нейтронов меняет наш атом. Однако, поскольку количество протонов такое же, это все еще углерод, но теперь это изотоп углерода. Мы представляем изотопы с помощью химического символа («C» для углерода) и число. Первый атом углерода только с 6 нейтроны будут называться 12 C или углерод-12. Новый с 8 нейтроны будут 14 C или углерод-14.Обратите внимание, что число «14» также является атомным массовым числом для этого изотопа.
Химики работали над организацией элементов особым образом, называемым Периодическая таблица. Он упорядочен так, что элементы в каждом столбце имеют общие химические и физические свойства. Ниже приведено изображение Периодическая таблица:
* Изображение с http://www.chemtutor.com/perich.htm
Каждый элемент имеет атомарный символ и атомарный символ. количество.
Quick Quiz: Напомним, что атомный номер – это количество протонов в ядре.Сколько протонов в Атом натрия (Na)? Атом кислорода (O)? Атом урана (U)?
Ответы: Натрий имеет 11 протонов , Кислород 8 протонов и урана 92 протонов.
Продолжить и узнать об ионах.
Вернуться в главное меню.
Вернуться на страницу вводного курса наук о Земле.
(Для получения дополнительной информации по основам химии и атомной структуре, посетите http://www.chemtutor.com/.)
Органическая химия, молекулярная атомная структура, настольная деревянная фоторамка, дисплей, картина, искусство, живопись, несколько наборов –
В настоящее время недоступен.
Мы не знаем, когда и появится ли этот товар в наличии.
- Убедитесь, что это подходит введя номер вашей модели.
- Размер: подходит для фотографий 10,2 x 15,2 см (4 x 6 дюймов); Фактический размер рамы (готовый размер) составляет 18 x 13 см (5 x 7 дюймов), а ширина рамы – 2 см.
- Классификация: Каркас
- Особенность: – Традиционно спроектированная рама с удивительной прочностью. ; -Поставляется с легко открывающимися язычками сзади для легкого доступа. ; -Рамка снабжена настенными крючками (портретная и альбомная ориентация). ; -Полированное стекло спереди дает четкое представление о вашей фотографии и сохраняет жизнь вашей фотографии. ; -Чрезвычайно тщательно упакован, чтобы гарантировать безопасность доставки.; -Белая кайма
- Материал: Каркас из дерева. И перед рамкой есть кусок акрила (PMMA), чтобы защитить вашу картину.
- Количество в упаковке: 1 х рамка
4.2 Модели атома | Атом
4.2 Модели атома (ESAAN)
Важно понимать, что многое из того, что мы знаем о структуре атомов, было разработано за долгое время. промежуток времени. Часто так развивается научное знание, когда один человек опирается на чужие идеи. еще. Мы собираемся посмотреть, как наше современное понимание атома эволюционировало с течением времени.
Идея атомов была изобретена двумя греческими философами, Демокритом и Левкиппом в пятом веке до нашей эры.В Греческое слово ατoμoν (атом) означает неделимый , потому что они считали, что атомы не может быть разбит на более мелкие части.
В настоящее время мы знаем, что атомы состоят из положительно заряженного ядра в центре окружены отрицательно заряженными электронами . Однако в прошлом, до структуры атом был правильно понят, ученые придумали множество различных моделей или . изображений , описывающих, как выглядят атомы.
- Модель
Модель – это представление системы в реальном мире. Модели помогают нам понять системы и их характеристики.
Например, модель атома представляет, как может выглядеть структура атома на основе что мы знаем о поведении атомов. Это не обязательно истинная картина точной структуры атома.
Модели часто упрощаются.Маленькие игрушечные машинки, с которыми вы, возможно, играли в детстве, являются моделями. Они дают Вы хорошо представляете, как выглядит настоящая машина, но она намного меньше и проще. Модель не всегда может быть абсолютно точным, и важно, чтобы мы это осознавали, чтобы у нас не возникло неверное представление о чем-то.
Модель атома Дальтона (ESAAO)
Джон Дальтон предположил, что вся материя состоит из очень маленьких вещей, которые он назвал атомами.Это не было совершенно новая концепция, поскольку древние греки (особенно Демокрит) предположили, что вся материя состоит из небольшие неделимые (не поддающиеся разделу) предметы. Когда Дальтон предложил свою модель, электроны и ядро были неизвестный.
Рисунок 4.2: Атом по Дальтону.
Модель атома Томсона (ESAAP)
После открытия электрона Дж. Дж. Дж. Томсоном в 1897 году люди поняли, что атомы состоят даже из частицы меньшего размера, чем они думали ранее.Однако атомное ядро еще не было обнаружено и поэтому в 1904 году была предложена «модель сливового пудинга». В этой модели атом состоит из отрицательных электроны, которые плавают в «супе» с положительным зарядом, как сливы в пудинге или изюм в фруктовый торт (рис. 4.3). В 1906 году Томсон был награжден Нобелевскую премию за его работу в этой области. Однако даже с моделью сливового пудинга все еще не было понимание того, как были устроены эти электроны в атоме.
Рисунок 4.3: Атом согласно модели Plum Pudding.
Открытие излучения было следующим шагом на пути к построению точной картины атомная структура. В начале двадцатого века Мари и Пьер Кюри обнаружили, что некоторые элементы ( радиоактивных элементов) испускают частицы, которые могут проходить через вещество аналогично Рентген (подробнее об этом в 11 классе). Эрнест Резерфорд в 1911 году использовал это открытие для пересмотреть модель атома.
Две другие модели, предложенные для атома, – это кубическая модель и модель Сатурна. В кубической модели считалось, что электроны лежат в углах куба. В модели Сатурна электроны представлялись чтобы вращаться вокруг очень большого и тяжелого ядра.
Модель атома Резерфорда (ESAAQ)
Резерфорд провел несколько экспериментов, которые привели к изменению представлений об атоме. Его новая модель описала атом как крошечное, плотное, положительно заряженное ядро, называемое ядром, окруженное более легкими, отрицательно заряженными электроны.Другой способ мышления об этой модели заключался в том, что атом выглядел как миниатюрная солнечная система. где электроны вращаются вокруг ядра, как планеты, вращающиеся вокруг Солнца. Упрощенная картина этого показано рядом. Эту модель иногда называют планетарной моделью атома.
Рис. 4.4: Модель атома Резерфорда.
Модель атома Бора (ESAAR)
Однако с моделью Резерфорда были некоторые проблемы: например, она не могла объяснить саму суть модели. Интересное наблюдение, что атомы излучают свет только на определенных длинах волн или частотах.Нильс Бор решил это проблема, предполагая, что электроны могут вращаться вокруг ядра только по определенным специальным орбитам на разных уровни энергии вокруг ядра.
Рисунок 4.5: Модель атома Бора.
Джеймс Чедвик (ESAAS)
Резерфорд предсказал (в 1920 г.), что в ядре должен присутствовать другой вид частиц, наряду с протон. Он предсказал это, потому что если бы в ядре были только положительно заряженные протоны, то оно должно было бы быть разбиваются на куски из-за сил отталкивания между одноименно заряженными протонами! Чтобы убедиться, что атом остается электрически нейтральной, эта частица сама должна быть нейтральной.В 1932 году Джеймс Чедвик открыл нейтрон и измерил его массу.
Другие модели атома (ESAAT)
Хотя наиболее часто используемой моделью атома является модель Бора, ученые все еще разрабатывают новые и улучшенные теории о том, как выглядит атом. Один из важнейших вкладов в атомную теорию ( область науки, изучающая атомы) было развитием квантовой теории. Шредингер, Гейзенберг, Родился и многие другие сыграли роль в развитии квантовой теории.
Модели атома
Учебное упражнение 4.1Сопоставьте информацию в столбце A с указателем ключа в столбце B.
Столбец A | Колонка B |
1. Открытие электронов и сливовый пудинг модель | A. Нильс Бор |
2. Расположение электронов | B. Мария и Пьер Кюри |
3. Атомы как наименьший строительный блок материи | C. Древние греки и Далтон |
4. Открытие ядра | D. J.J. Томсон |
5. Открытие радиации | E. Резерфорд |
Решение пока недоступно.
Ученые сделали первые изображения молекул до и после реакции
Мечта каждого химика – сделать снимок химического вещества в атомном масштабе до и после его реакции – теперь сбылась благодаря новой методике, разработанной химиками и физиками из Калифорнийского университета в Беркли.
Используя современный атомно-силовой микроскоп, ученые сделали первые снимки атом за атомом, в том числе изображения химических связей между атомами, ясно показывающие, как структура молекулы изменилась во время реакции. До сих пор ученые могли вывести этот тип информации только на основе спектроскопического анализа.
Изображения, полученные с помощью бесконтактного атомно-силового микроскопа (nc-AFM) (в центре) молекулы до и после реакции, значительно улучшаются по сравнению с изображениями (вверху), полученными с помощью сканирующего туннельного микроскопа, и выглядят точно так же, как классические диаграммы молекулярной структуры (внизу).
«Несмотря на то, что я использую эти молекулы изо дня в день, возможность увидеть эти изображения поразила меня. Вот это да!” сказал ведущий исследователь Феликс Фишер, доцент химии Калифорнийского университета в Беркли. «Это то, что мои учителя говорили, что вы никогда не сможете на самом деле увидеть, и теперь это у нас есть».
Способность отображать молекулярные реакции таким образом поможет не только студентам-химикам, изучающим химические структуры и реакции, но также впервые покажет химикам продукты их реакций и поможет им точно настроить реакции для получения продуктов. они хотят.Фишер вместе с соавтором Майклом Кромми, профессором физики Калифорнийского университета в Беркли, сфотографировал эти изображения с целью создания новых графеновых наноструктур, которые сегодня являются горячей областью исследований для материаловедов из-за их потенциального применения в компьютерах следующего поколения.
«Однако последствия выходят далеко за рамки только графена», – сказал Фишер. «Этот метод найдет применение, например, при изучении гетерогенного катализа», который широко используется в нефтяной и химической промышленности.Гетерогенный катализ включает использование металлических катализаторов, таких как платина, для ускорения реакций, как в каталитическом нейтрализаторе автомобиля.
«Чтобы понять химию, которая на самом деле происходит на каталитической поверхности, нам нужен очень избирательный инструмент, который сообщает нам, какие связи на самом деле образовались, а какие были разорваны», – добавил он. «На данный момент этот метод уникален тем, что он дает вам структурную информацию. Я думаю, это новаторский “.
«Атомно-силовой микроскоп дает нам новую информацию о химической связи, которая невероятно полезна для понимания того, как соединяются различные молекулярные структуры и как можно преобразовать одну форму в другую», – сказал Кромми.«Это должно помочь нам в создании новых инженерных наноструктур, таких как связанные сети атомов, которые имеют определенную форму и структуру для использования в электронных устройствах. Это указывает путь вперед ».
Фишер и Кромми вместе с другими коллегами из Калифорнийского университета в Беркли в Испании и из Национальной лаборатории Лоуренса Беркли (LBNL) опубликовали свои результаты в Интернете 30 мая в журнале Science Express .
От тени к снимку
Традиционно Фишер и другие химики проводят подробный анализ для определения продуктов химической реакции, и даже в этом случае фактическое трехмерное расположение атомов в этих продуктах может быть неоднозначным.
«В химии вы бросаете что-то в колбу, и выходит что-то еще, но обычно вы получаете очень косвенную информацию о том, что у вас есть», – сказал Фишер. «Вы должны сделать это, снимая ядерный магнитный резонанс, инфракрасный или ультрафиолетовый спектры. Это больше похоже на головоломку: собрать всю информацию воедино, а затем определить, какова вероятная структура. Но это всего лишь тень. Здесь у нас действительно есть методика, с помощью которой мы можем взглянуть на нее и сказать, что это именно та молекула.Это все равно, что сделать снимок ».
Атомно-силовой микроскоп исследует молекулу, адсорбированную на поверхности, используя молекулу окиси углерода на кончике для повышения чувствительности.
Фишер разрабатывает новые методы создания графеновых наноструктур, которые демонстрируют необычные квантовые свойства, которые могут сделать их полезными в электронных устройствах нанометрового размера. Атомы углерода расположены гексагонально, как проволочная сетка. Вместо того, чтобы разрезать лист чистого углерода – графена – он надеется разместить на поверхности кучу более мелких молекул и заставить их соединиться в желаемую архитектуру.По его словам, проблема в том, как определить, что было сделано на самом деле.
Именно тогда он обратился к Кромми, который использует атомные силовые микроскопы для исследования поверхностей материалов с атомным разрешением и даже для перемещения атомов по отдельности на поверхности. Работая вместе, они разработали способ охлаждения реакционной поверхности и молекул до температуры жидкого гелия – около 4 Кельвинов, или 270 градусов по Цельсию ниже нуля, – что предотвращает покачивание молекул. Затем они использовали сканирующий туннельный микроскоп, чтобы определить местонахождение всех молекул на поверхности, и остановились на нескольких, чтобы более точно исследовать с помощью атомно-силового микроскопа.Чтобы улучшить пространственное разрешение своего микроскопа, они поместили одну молекулу окиси углерода на наконечник, метод, называемый бесконтактным АСМ, впервые был использован Герхардом Мейером и его сотрудниками в IBM Zurich для получения изображений молекул несколько лет назад.
После визуализации молекулы – «циклической» структуры с несколькими гексагональными углеродными кольцами, которую Фишер создал специально для этого эксперимента – Фишер, Кромми и их коллеги нагревали поверхность до тех пор, пока молекула не прореагировала, а затем снова охлаждали поверхность до 4 Кельвина и получали изображение. продукты реакции.
«Делая это на поверхности, вы ограничиваете реакционную способность, но у вас есть то преимущество, что вы действительно можете посмотреть на отдельную молекулу, дать этой молекуле имя или номер, а затем посмотреть, во что она превращается в продуктах», – сказал он. сказал.
«В конечном счете, мы пытаемся разработать новую химию поверхности, которая позволяет нам строить более упорядоченную архитектуру на поверхностях, и это может привести к таким приложениям, как создание электронных устройств, устройств хранения данных или логических вентилей из углеродных материалов.”
Соавторы исследования: Димас Г. де Отейза, Йен-Чиа Чен, Себастьян Викенбург, Александр Рис, Зара Педрамрази и Син-Зон Цай из физического факультета Калифорнийского университета в Беркли; Патрик Горман и Гриша Эткин с химического факультета; и Дункан Дж. Моубрей и Анхель Рубио из исследовательских центров в Сан-Себастьяне, Испания. Кромми, Фишер, Чен и Викенбург также записались на прием в Национальную лабораторию Лоуренса Беркли.
Работа спонсируется Управлением военно-морских исследований, Министерством энергетики и Национальным научным фондом.
СВЯЗАННАЯ ИНФОРМАЦИЯ
Получите самое высокое разрешение атомного изображения из когда-либо сделанных
Посмотрите на самое высокое разрешение когда-либо сделанных снимков атомов. Чтобы создать его, исследователи Корнельского университета захватили образец кристалла в трех измерениях и увеличили его в 100 миллионов раз, удвоив разрешение, которое принесло тем же ученым Книгу рекордов Гиннеса в 2018 году. эффективные телефоны, компьютеры и другая электроника, а также батареи с более длительным сроком службы.
Ученые получили изображение с помощью техники, называемой электронной птихографией. Он включает в себя попадание в материал мишени пучка электронов со скоростью около миллиарда в секунду. Луч движется бесконечно малым образом во время выстрела электронов, поэтому они попадают в образец под немного разными углами – иногда они проходят чисто; в других случаях они сталкиваются с атомами и отскакивают внутри образца, прежде чем выйти. Физик Корнелла Дэвид Мюллер сравнивает эту технику с игрой в вышибалы против противников, стоящих в темноте.Вышибалы – это электроны, а их мишени – отдельные атомы. Хотя Мюллер не может видеть цели, он может определить, где попадают «вышибалы». На основе спекл-паттерна, генерируемого миллиардами этих электронов при попадании в детектор, алгоритмы машинного обучения могут вычислить, где находятся атомы в образце и какова их форма, создавая таким образом изображение.
Раньше электронная птихография использовалась только для изображения очень плоских образцов толщиной от одного до нескольких атомов.Но новое исследование Мюллера и его коллег в Science описывает захват нескольких слоев толщиной от десятков до сотен атомов. Это делает метод более подходящим для материаловедов, которые обычно изучают свойства образцов толщиной от 30 до 50 нанометров. (Это меньше, чем длина ваших ногтей, которые вырастают за минуту, но во много раз толще, чем то, что электронная птихография могла изобразить в прошлом.) «Теперь они действительно могут смотреть на стопки атомов, так что это потрясающе», – говорит инженер Шеффилдского университета Эндрю Мейден, который помог развить птихографию, но не участвовал в новом исследовании.«Разрешение просто ошеломляет».
Этот результат знаменует собой важный шаг вперед в мире электронной микроскопии. Стандартные электронные микроскопы, изобретенные в начале 1930-х годов, позволили видеть такие объекты, как полиовирусы, которые меньше длины волны видимого света. Но у электронных микроскопов был предел: увеличение их разрешения требовало увеличения энергии электронного луча, и в конечном итоге необходимая энергия стала бы настолько большой, что могла бы повредить образец.
Птихография, напротив, использует детектор, который может регистрировать все углы, под которыми луч может рассеиваться в каждом положении луча, получая гораздо больше информации с той же длиной волны и той же линзой. Исследователи выдвинули гипотезу о птихографии в 1960-х годах и задумали ее использовать для преодоления ограничений электронных линз в 1980-х годах. Но из-за ограничений вычислений и детекторов и сложной математики этот метод не применялся на практике в течение десятилетий. Ранние версии работали намного лучше с видимым светом и рентгеновскими лучами, чем электроны, необходимые для изображения объектов атомного размера.Между тем ученые продолжали совершенствовать электронные микроскопы. «Вы должны были искренне верить в птихографию, чтобы обращать на нее внимание», – говорит Мюллер.
Буквально за последние несколько лет Мюллер и его команда разработали детектор, достаточно хороший, чтобы электронная птихография могла работать экспериментально. К 2018 году они выяснили, как реконструировать двумерные образцы с помощью этой техники, создав то, что Мюллер назвал «изображением с самым высоким разрешением любым методом в мире» (и выиграли этот рекорд Гиннеса).Исследователи достигли этого подвига, используя более низкую длину волны, чем другие методы, что позволило им лучше сохранить то, что они видели.
Следующей проблемой были более толстые образцы, в которых электронная волна отрикошетила от многих атомов, прежде чем достичь детектора: так называемая проблема множественного рассеяния. Члены группы обнаружили, что при наличии достаточного количества перекрывающихся спекл-паттернов и вычислительной мощности (и, по словам Мюллера, «грубой силы и невежества»), они могут работать в обратном направлении, чтобы определить, какое расположение атомов дает заданный паттерн.Для этого они настраивали модель до тех пор, пока образец, который она генерировал, не совпадал с экспериментально созданным.
Такие методы визуализации с высоким разрешением необходимы для разработки электронных устройств следующего поколения. Например, многие исследователи ищут более эффективные полупроводники, чем компьютерные микросхемы на основе кремния. Чтобы это произошло, инженерам необходимо знать, с чем они работают на атомарном уровне – что означает использование таких технологий, как электронная птихография.«У нас есть эти инструменты, которые ждут, чтобы помочь нам оптимизировать то, что станет следующим поколением устройств», – говорит Дж. Мюррей Гибсон, декан Инженерного колледжа Университета A&M Флориды и Университета штата Флорида, который не был частью нового учиться.
«Батареи– особенно многообещающая область для применения методов визуализации, таких как электронная птихография», – говорит Роджер Фальконе, физик из Калифорнийского университета в Беркли, который также не принимал участия в исследовании.Создание батарей, которые могут безопасно хранить много энергии, имеет решающее значение для перехода от ископаемого топлива к возобновляемым источникам энергии, включая ветер и солнце. «Технологии визуализации очень важны для улучшения аккумуляторов, потому что мы можем подробно изучить химические реакции», – говорит Фальконе.
Но впереди еще долгий путь. Для того, чтобы электронная пихография привела к прорыву в вашем сотовом телефоне или ноутбуке, она должна делать больше, чем просто реконструировать изображение – она должна точно определять местонахождение отдельного атома в материале.Хотя ученые показали, как их новый процесс может делать это в теории, они еще не продемонстрировали это экспериментально. «С любой новой техникой вашим коллегам-исследователям всегда требуется немного времени, чтобы опробовать ее и посмотреть, найдет ли она реальное практическое применение», – говорит Лесли Томпсон, эксперт по характеристике материалов в IBM, который не принимал участия в исследовании. новое исследование.
«Когда вы изобретаете новый инструмент, такой как микроскоп с высоким разрешением, я чувствую, что вы склонны удивляться [] тому, для решения какой проблемы он применяется», – говорит Фальконе.«Люди будут смотреть на вещи, которые мы даже представить себе не можем, и решать проблему, в которой мы даже не уверены».
Атомная структура с примерами | Интернет-уроки химии
Атомная структура с примерами
Атом – самая маленькая частица материи. Он состоит из трех частиц: протона, электрона и нейтрона. Протоны и нейтроны расположены в центре атома, а электроны – вокруг центра. На приведенном ниже рисунке показана структура атома и расположение протона, нейтрона и электрона в атоме.
Центр атома, включая протоны и нейтроны, также называется ядром, а круги вокруг ядра называются орбитами.
Протоны: Протоны – это положительно заряженные частицы атомов. Они расположены в ядре и имеют массу.Протоны обозначены буквой «р».
Электронов: Электроны представляют собой отрицательно заряженные движущиеся частицы атомов. Они расположены вокруг ядра на орбитах и не имеют массы. Мы показываем электроны буквой «е».
Neu тронов: Нейтроны – это беззарядные частицы атомов. Они расположены в ядре и имеют массу. Мы показываем нейтроны буквой «n».
атомный номер:
Атомный номер показывает количество протонов в каждом атоме.Он индивидуален для каждого атома и обозначается буквой «Z». В нейтральном атоме число протонов равно числу электронов. Таким образом;
Z = p = e
Атомный номер записывается как;
атомный номер X
Массовое число:
Масса нейтрона примерно равна массе протона. Мы пренебрегаем массой электрона, так как она слишком мала. Таким образом, масса атома равна сумме масс протонов и нейтронов.Показываем массовое число буквой «М». Массовое число не является специфическим для каждого атома. Различные атомы могут иметь одинаковое массовое число.
M = n + p
Мы показываем M на атоме как;
Z M X
Изотопы:
Изотопы имеют одинаковый атомный номер, но разное массовое число. Это означает, что атомы имеют одинаковое количество протонов, но разное количество нейтронов. Поскольку количество протонов одинаково, химические свойства атомов одинаковы, а поскольку количество нейтронов различно, физические свойства атомов различны.Изотопы водорода приведены ниже;
1 1 H,
1 2 H,
1 3 H
Изотоны:
Атомы изотона имеют одинаковое количество нейтронов и разное количество протонов.
Натрий и магний – изотонные атомы, у них одинаковое количество нейтронов.
11 23 Na и 12 24 Mg
Изобары:
Атомы изобары имеют разные атомные номера и разные нейтронные числа, но одинаковое массовое число.
11 24 Na и 12 24 Mg
Поскольку число протонов и число нейтронов в атомах различны, их физические и химические свойства также различны.
Пример: Какое из следующих утверждений одинаково для атомов изотопа
I. Число протонов
II. Количество нейтронов
III. Количество электронов
IV. Атомный номер
V. Химические свойства
VI. Физические свойства
Изотопы имеют одинаковый атомный номер, но разное массовое число. Это означает, что атомы изотопов имеют одинаковое количество протонов и разное количество нейтронов. Если атом нейтрален, то количество протонов в атоме равно количеству электронов. Поскольку количество протонов атомов одинаково, а количество нейтронов различно; химические свойства этих атомов одинаковы, но физические свойства у них разные.Таким образом;
I. III. IV. и V верно для атомов изотопов.
Пример: Найдите количество протонов атома, имеющего массовое число 65 и нейтронное число 35.
Массовое число равно сумме протонов и нейтронов.
M = п + п
65 = 35 + р
p = 30
Пример: Какие из следующих утверждений верны для 12 24 X и 11 24 Y атомов.
I. Число протонов X> Y
II. нейтронное число Y больше, чем нейтронное число X
III. Их массовые числа равны
.12 24 X:
X имеет 12 протонов и
24-12 = 12 нейтронов
Массовое число = 24
1 24 Y:
Y имеет 11 протонов и
24-11 = 13 нейтронов
Массовое число = 24
Таким образом, I. II. и III. верны.
Пример:
И. 26 56 Fe +2 , 26 56 Fe +3
II. 26 56 Fe, 27 56 Co
III. H 2 O, D 2 O
Какая из пар, приведенных выше, имеет одинаковые химические свойства. ( 1 1 H, 1 2 D)
Чтобы иметь одинаковые химические свойства, они должны иметь одинаковое количество протонов и электронов.
I. Оба они имеют одинаковое количество протонов 26, но их электронные числа разные. В первом 26-2 = 24 электрона, а во втором 26-3 = 23 электрона. Таким образом, они обладают разными химическими свойствами.
II. Поскольку оба они имеют разное количество протонов и электронов, они имеют разные химические свойства.
III. В этой паре у них одинаковое количество протонов и электронов, у них одинаковые химические свойства.
Исследования атомной структуры и решения проблем
| Далее> Электронная конфигурация с примерами |
|---|
Большая картина, Маленькая картинка
Сделай сейчас : Чтобы студенты начали думать об атоме, я прошу их прочитать страницу в своем тексте об атоме. (если у вас его нет, эта ссылка может дать часть той же информации). Я прошу их записать в свои записи три части атома и объяснить, где эти части расположены, каков их заряд и каков их относительный размер.Я выбираю это занятие, потому что оно должно быть обзорным и легкодоступным, что позволит мне контролировать посещаемость и следить за тем, чтобы класс был установлен.
Активатор : Я приглашаю студентов принять участие в задании по алюминиевой фольге, которое заключается в следующем: возьмите кусок фольги, разрежьте его пополам, затем разрежьте одну из половинок пополам. Возьмите одну из этих половинок и разрежьте ее пополам. Продолжайте повторять эту процедуру, пока не получите наименьший возможный кусок. Побеждает тот, у кого меньше всего.После того, как студенты проделали это примерно 2 минуты, я называю время.
Затем я прошу участников провести парадом по комнате, демонстрируя свою работу, и люди, которые не участвовали, должны были судить, какая часть самая маленькая. После того, как все прошли и объявили победителя, я объясняю, что есть еще один участник, который не участвовал в параде. Затем я выставляю напоказ свой палец, на котором, кажется, ничего нет.
Я хвастливо объясняю, что в то время как мои оппоненты выставляли напоказ миллионы или миллиарды атомов, только я выставлялся напоказ с одним атомом на пальце.Среди стонов и стонов я объясняю, что, хотя я веду себя глупо, правда в том, что вы можете разделить элемент только столько раз, и что наименьшее количество элемента, которое вы можете иметь, – это один атом, и это очень небольшая сумма.


 По сути, для удачной игры вам надо понимать, как электроны распределяются по орбитальным диаграммам».
По сути, для удачной игры вам надо понимать, как электроны распределяются по орбитальным диаграммам».