Графическая проверочная работа по теме “Строение атома”
Самостоятельная работа «Строение атома» – 1
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+7
8
2.
92
3.
50
4.
53
5.
56
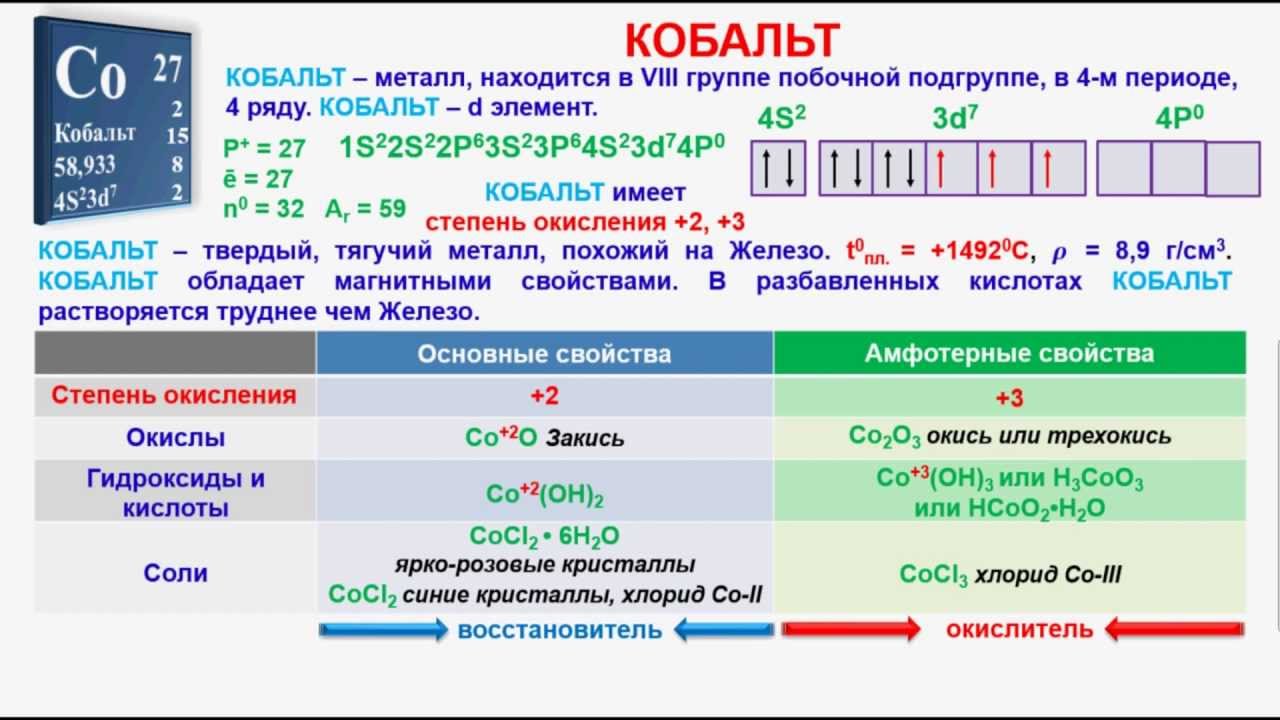
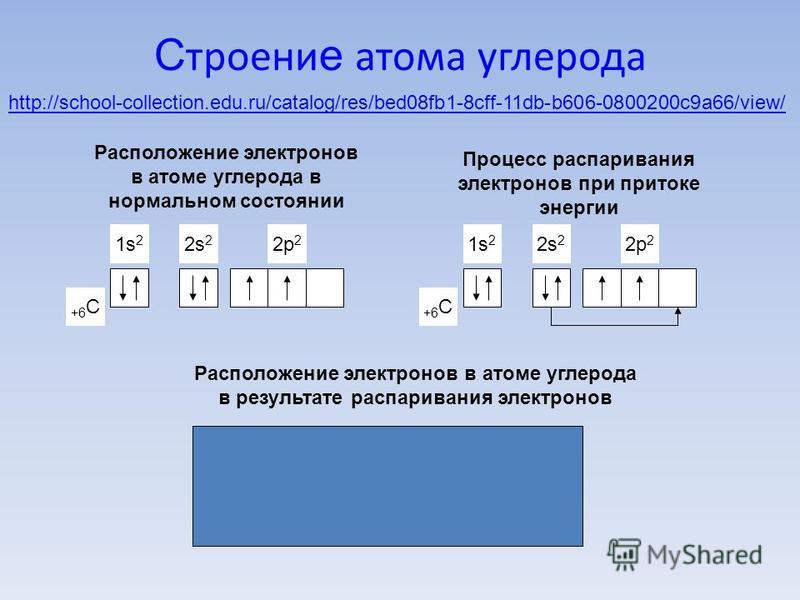
2. Составьте электронную формулу и полную электронно-графическую схему атома кобальта
____________________________________________________________________________
Самостоятельная работа «Строение атома» – 1
1. Заполните таблицу:
Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+7
8
2.
92
3.
50
53
5.
56
2. Составьте электронную формулу и полную электронно-графическую схему атома кобальта
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 1
1. Заполните таблицу:
элемент
Порядк. номер
номер
Заряд ядра
Число протонов
Число электронов
Массовое число
Заряд атома
1.
+7
8
2.
92
3.
50
4.
53
5.
56
2. Составьте электронную формулу и полную электронно-графическую схему атома кобальта
________________________________________________________________________________
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+7
8
2.
92
3.
4.
53
5.
56
2. Составьте электронную формулу и полную электронно-графическую схему атома кобальта
Самостоятельная работа «Строение атома» – 2
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+75
30
3.
16
15
4.
42
5.
101
2. Составьте электронную формулу и полную электронно-графическую схему атома ванадия
__________________________________________________________________________________
Самостоятельная работа «Строение атома» – 2
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+75
2.
30
3.
16
15
4.
42
101
2. Составьте электронную формулу и полную электронно-графическую схему атома ванадия
________________________________________________________________________________
Самостоятельная работа «Строение атома» – 2
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
2.
30
3.
16
15
4.
42
5.
101
2. Составьте электронную формулу и полную электронно-графическую схему атома ванадия
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 2
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+75
2.
30
3.
16
15
4.
42
5.
101
 Составьте электронную формулу и полную электронно-графическую схему атома ванадия
Составьте электронную формулу и полную электронно-графическую схему атома ванадияСамостоятельная работа «Строение атома» – 3
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+24
2.
49
3.
114
190
4.
82
5.
34
46
2. Составьте электронную формулу и полную электронно-графическую схему атома галлия
________________________________________________________________________________
Самостоятельная работа «Строение атома» – 3
1. Заполните таблицу:
Заполните таблицу:
элемент
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+24
2.
49
49
3.
114
190
4.
82
5.
34
46
2. Составьте электронную формулу и полную электронно-графическую схему атома галлия
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 3
1. Заполните таблицу:
Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+24
2.
49
49
3.
114
190
4.
82
5.
34
46
2. Составьте электронную формулу и полную электронно-графическую схему атома галлия
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 3
1. Заполните таблицу:
Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+24
2.
49
49
3.
114
190
4.
82
5.
34
46
2. Составьте электронную формулу и полную электронно-графическую схему атома галлия
Самостоятельная работа «Строение атома» – 4
1. Заполните таблицу:
элемент
Порядк. номер
номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+33
2.
57
3.
111
186
4.
63
5.
78
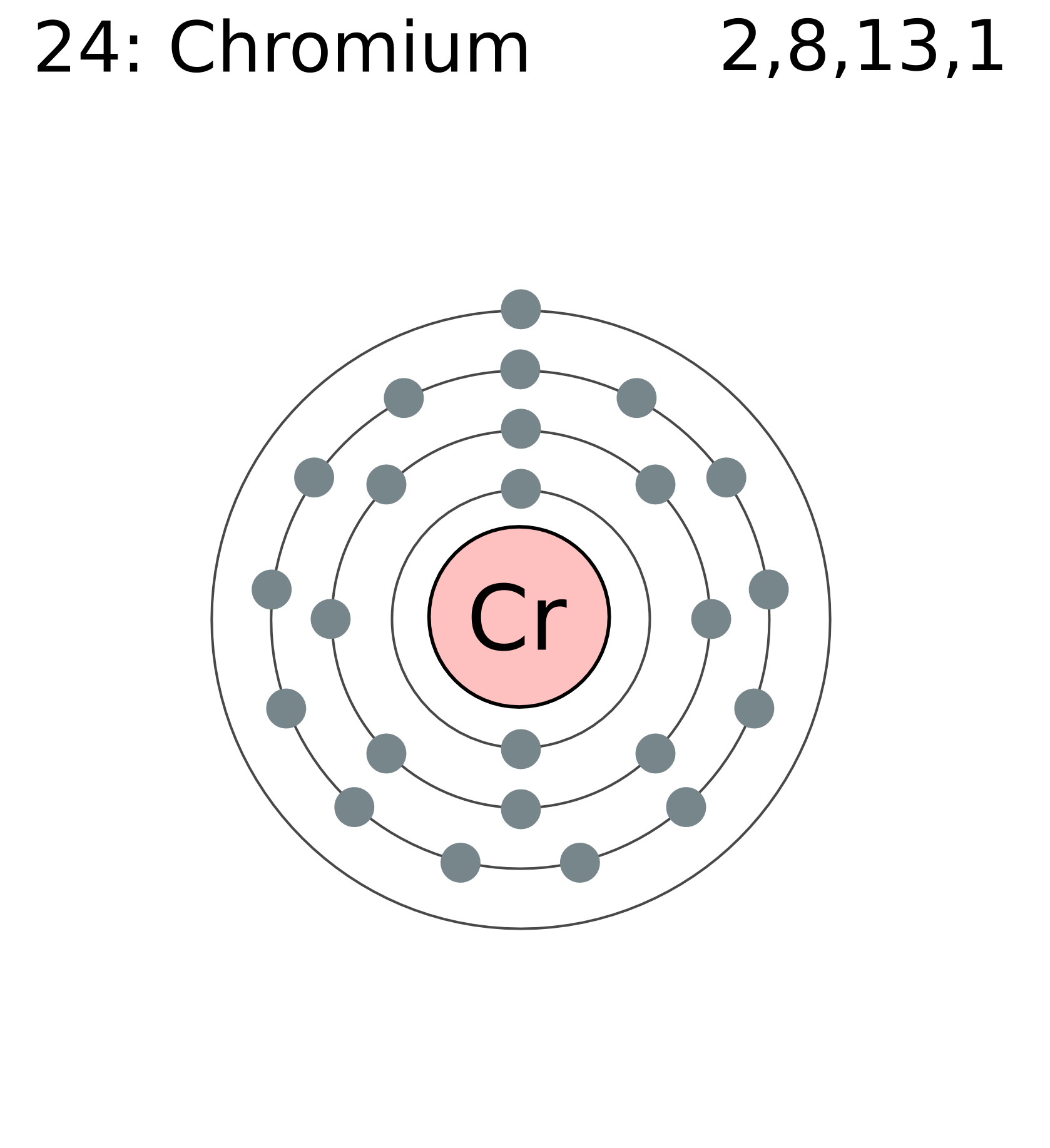
2. Составьте электронную формулу и полную электронно-графическую схему атома хрома
__________________________________________________________________________________
Самостоятельная работа «Строение атома» – 4
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+33
2.
57
3.
111
186
4.
63
5.
78
2. Составьте электронную формулу и полную электронно-графическую схему атома хрома
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 4
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+33
2.
57
3.
111
186
4.
63
5.
78
2. Составьте электронную формулу и полную электронно-графическую схему атома хрома
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 4
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+33
2.
57
3.
111
186
4.
63
5.
78
2. Составьте электронную формулу и полную электронно-графическую схему атома хрома
Самостоятельная работа «Строение атома» – 5
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+15
17
2.
41
3.
47
4.
60
106
5.
19
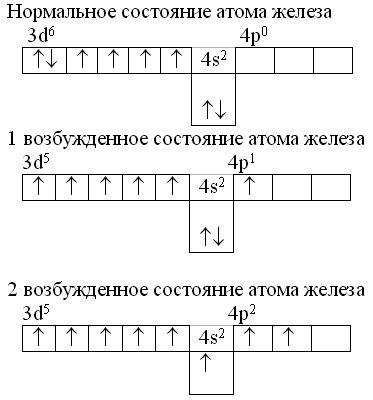
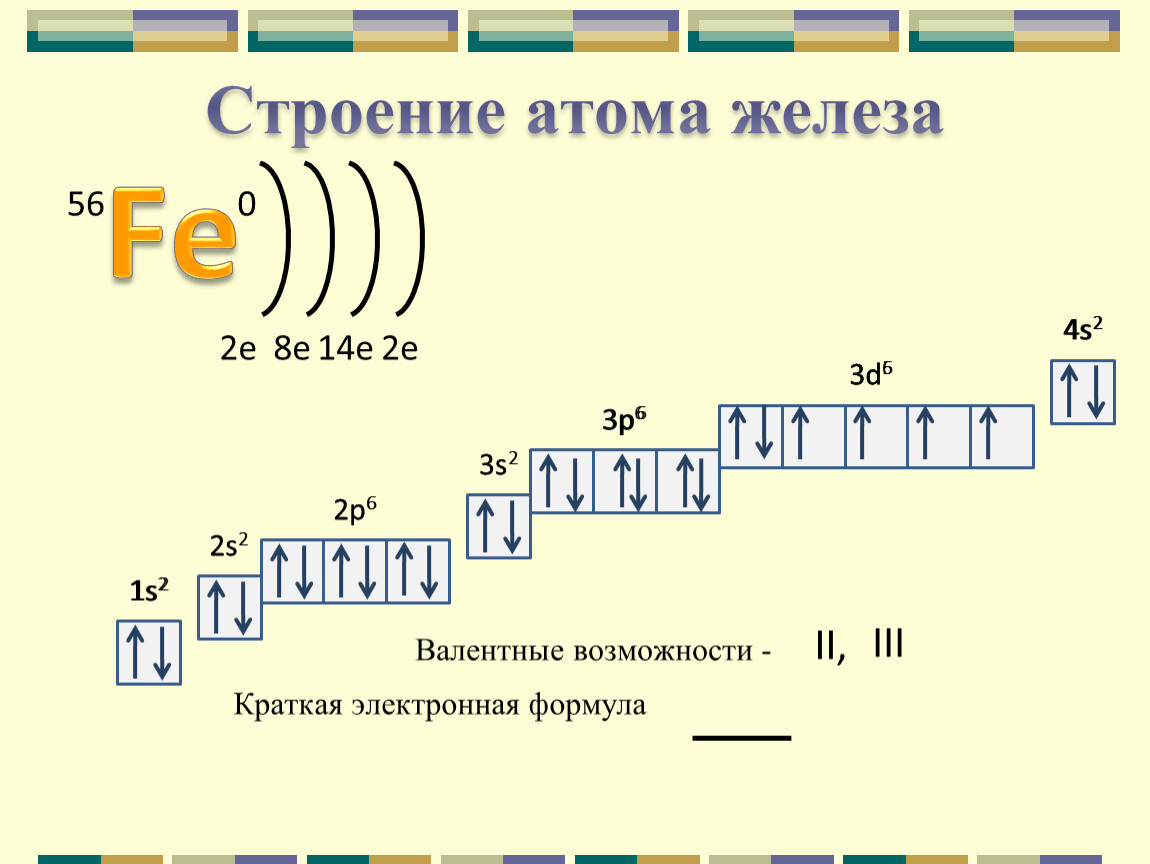
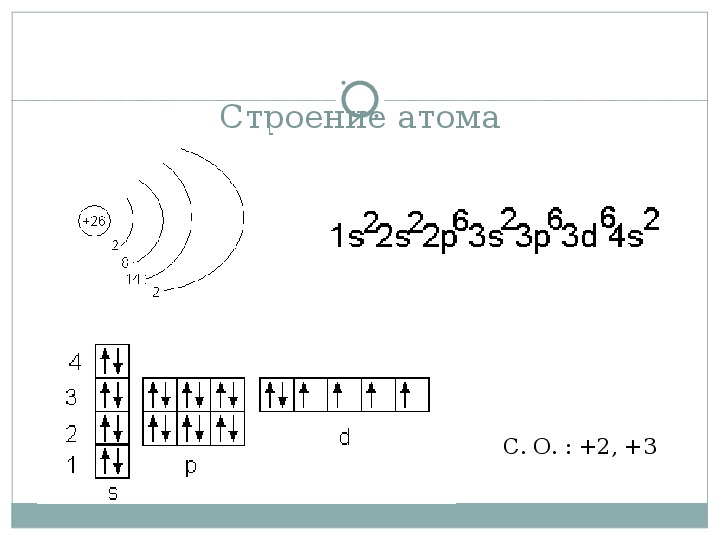
2. Составьте электронную формулу и полную электронно-графическую схему атома железа
__________________________________________________________________________________
Самостоятельная работа «Строение атома» – 5
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+15
17
2.
41
3.
47
4.
60
106
5.
19
2. Составьте электронную формулу и полную электронно-графическую схему атома железа
Составьте электронную формулу и полную электронно-графическую схему атома железа
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 5
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+15
17
2.
41
3.
47
4.
60
106
5.
19
2. Составьте электронную формулу и полную электронно-графическую схему атома железа
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 5
1. Заполните таблицу:
Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+15
17
2.
41
3.
47
4.
60
106
5.
19
2. Составьте электронную формулу и полную электронно-графическую схему атома железа
Самостоятельная работа «Строение атома» – 6
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
77
2.
+26
31
3.
18
4.
108
181
5.
13
2. Составьте электронную формулу и полную электронно-графическую схему атома меди
__________________________________________________________________________________
Самостоятельная работа «Строение атома» – 6
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
77
2.
+26
31
3.
18
4.
108
181
5.
13
2. Составьте электронную формулу и полную электронно-графическую схему атома меди
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 6
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
77
2.
+26
31
3.
18
4.
108
181
5.
13
2. Составьте электронную формулу и полную электронно-графическую схему атома меди
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 6
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
77
2.
+26
31
3.
18
4.
108
181
5.
13
2. Составьте электронную формулу и полную электронно-графическую схему атома меди
Самостоятельная работа «Строение атома» – 7
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+36
2.
51
3.
103
173
4.
10
5.
+47
107
2. Составьте электронную формулу и полную электронно-графическую схему атома никеля
Составьте электронную формулу и полную электронно-графическую схему атома никеля
__________________________________________________________________________________
Самостоятельная работа «Строение атома» – 7
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+36
2.
51
3.
103
173
4.
10
5.
+47
107
2. Составьте электронную формулу и полную электронно-графическую схему атома никеля
Составьте электронную формулу и полную электронно-графическую схему атома никеля
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 7
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+36
2.
51
3.
103
173
4.
10
5.
+47
107
2. Составьте электронную формулу и полную электронно-графическую схему атома никеля
Составьте электронную формулу и полную электронно-графическую схему атома никеля
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 7
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+36
2.
51
3.
103
173
4.
10
5.
+47
107
2. Составьте электронную формулу и полную электронно-графическую схему атома никеля
Составьте электронную формулу и полную электронно-графическую схему атома никеля
Самостоятельная работа «Строение атома» – 8
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+39
2.
+8
7
3.
30
55
4.
83
5.
60
2. Составьте электронную формулу и полную электронно-графическую схему атома мышьяка
__________________________________________________________________________________
Самостоятельная работа «Строение атома» – 8
1. Заполните таблицу:
Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+39
2.
+8
7
3.
30
55
4.
83
5.
60
2. Составьте электронную формулу и полную электронно-графическую схему атома мышьяка
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 8
1. Заполните таблицу:
элемент
Порядк. номер
номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+39
2.
+8
7
3.
30
55
4.
83
5.
60
2. Составьте электронную формулу и полную электронно-графическую схему атома мышьяка
_________________________________________________________________________________
Самостоятельная работа «Строение атома» – 8
1. Заполните таблицу:
элемент
Порядк. номер
Заряд ядра
Число протонов
Число электронов
Число нейтронов
Массовое число
Заряд атома
1.
+39
2.
+8
7
3.
30
55
4.
83
5.
60
2. Составьте электронную формулу и полную электронно-графическую схему атома мышьяка
Строение комплексных соединений
В настоящее время образование и свойства комплексных соединений объясняют с точки зрения теории метода валентных связей (ВС), теории кристаллического поля (ТКП) и теории молекулярных орбиталей (МО).
Далее кратко на примерах рассмотрим каждую из теорий.
Строение комплексных соединений с точки зрения теории метода валентных связей
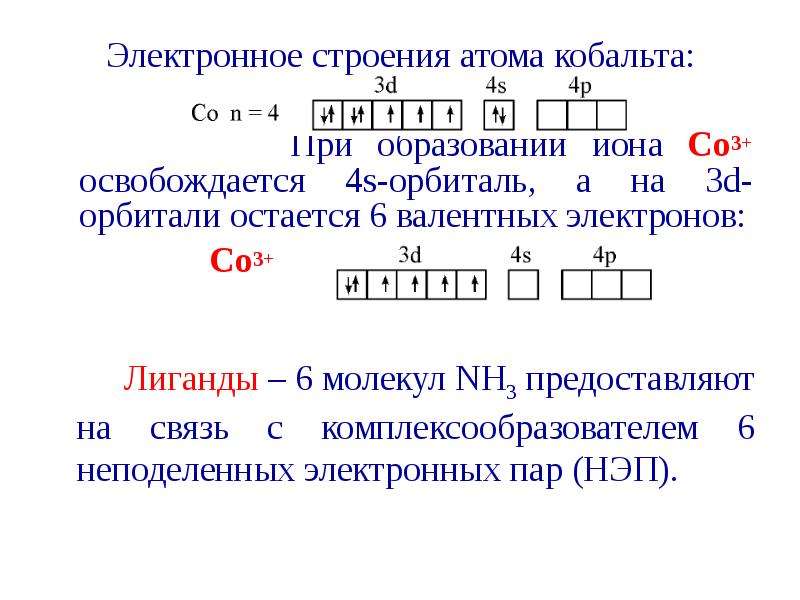
Теория метода валентных связей (ВС) рассматривает образование комплексных ионов как донорно-акцепторное взаимодействие неподеленных электронных пар лиганда и свободных орбиталей комплексообразователя.
Рассмотрим комплексный ион [Co(NH3)6]3+
Ион-комплексообразователь Co3+ имеет следующую электронную конфигурацию:
1s22s22p63s23p64s03d64p04d0
В соответствии с правилом Хунда электроны на внешнем энергетическом уровне располагаются следующим образом:
Комплексообразователь имеет координационное число к.ч. = 6, поэтому может присоединить 6 лигандов, каждый из которых имеет неподеленную электронную пару и является, таким образом, донором электронов. Акцептор (комплексообразователь) для размещения шести электронных пар должен предоставить шесть вакантных орбиталей.
При образовании комплексного иона [Co(NH3)6]3+ четыре неспаренных электрона в d – состоянии Co3+ сначала образуют электронные пары, в результате чего две 3d-орбитали освобождаются:
Затем образуется сам комплексный ион [Co(NH3)6]3+, имеющий следующее строение:
В образовании этого комплексного иона принимают участие внутренние 3d-орбитали и внешние 4s- и 4p-орбитали. Тип гибридизации — d2sp3.
Тип гибридизации — d2sp3.
Наличие только спаренных электронов говорит о диамагнитных свойствах иона.
Строение комплексных соединений с точки зрения теории кристаллического поля
Теория кристаллического поля основывается на допущении, что связь между комплексообразователем и лигандами частично ионная. Однако принимается во внимание влияние электростатического поля лигандов на энергетическое состояние электронов центрального иона.
Рассмотрим две комплексные соли:
K2[Zn(CN)4] и K3[Fe(CN)6]
K2[Zn(CN)4] – имеет тетраэдрическую пространственную структуру (sp3— гибридизация)
K3[Fe(CN)6] – имеет октаэдрическую пространственную структуру (sp3d2-гибридизация)
Комплексообразователи имеют следующую электронную конфигурацию:
d – электроны одного и того же энергетического уровня одинаковы в случае свободного атома или иона. Но действие электростатического поля лигандов способствует расщеплению энергетических уровней d – орбиталей в центральном ионе. И расщепление тем больше (при одном и том же комплексообразователе), чем сильнее поле, создаваемое лигандами. По своей способности вызывать расщепление энергетических уровней лиганды располагаются в ряд:
Но действие электростатического поля лигандов способствует расщеплению энергетических уровней d – орбиталей в центральном ионе. И расщепление тем больше (при одном и том же комплексообразователе), чем сильнее поле, создаваемое лигандами. По своей способности вызывать расщепление энергетических уровней лиганды располагаются в ряд:
CN— > NO2— > NH3 > SCN— > H2O > OH— > F— > Cl— > Br— > I—
Строение комплексного иона влияет на характер расщепления энергетических уровней комплексообразователя.
При октаэдрическом строении комплексного иона, dγ-орбитали (dz2-, dx2-y2-орбитали) подвержены сильному взаимодействию поля лигандов, и электроны этих орбиталей могут иметь большую энергию, чем электроны dε-орбитали (dxy, dxz, dyz – орбитали).
Расщепление энергетических уровней для электронов в d-состоянии в октаэдрическом поле лигандов можно представить в виде схемы:
Здесь Δокт – энергия расщепления в октаэдрическом поле лигандов.
При тетраэдрической структуре комплексного иона dγ-орбитали обладают более низкой энергией, чем dε-орбитали:
Здесь Δтетр– энергия расщепления в тетраэдрическом поле лигандов.
Энергию расщепления Δ определяют экспериментально по спектрам поглощения веществом квантов света, энергия которых равна энергии соответствующих электронных переходов. Спектр поглощения, а также и окраска комплексных соединений d-элементов, обусловлены переходом электронов с d-орбитали низшей энергии на d-орбиталь с более высокой энергией.
Так, в случае соли K3[Fe(CN)6], при поглощении кванта света, вероятен переход электрона с dε-орбитали на dγ-орбиталь. Этим объясняется, что гексацианоферрат(III) калия K3[Fe(CN)6] имеет оранжево-красную окраску. А соль тетрацианоцинкат калия K2[Zn(CN)4] не может поглощать свет и, вследствие этого, она бесцветна. Это объясняется тем, что переход электронов с dγ-орбитали на dε-орбиталь неосуществим.
Этим объясняется, что гексацианоферрат(III) калия K3[Fe(CN)6] имеет оранжево-красную окраску. А соль тетрацианоцинкат калия K2[Zn(CN)4] не может поглощать свет и, вследствие этого, она бесцветна. Это объясняется тем, что переход электронов с dγ-орбитали на dε-орбиталь неосуществим.
Строение комплексных соединений с точки зрения теории молекулярных орбиталей
Метод молекулярных орбиталей (МО) был ранее рассмотрен в разделе Химическая связь и строение молекул.
С помощью этого метода изобразим электронную конфигурацию высокоспинового комплексного иона [Ni(NH3)6]2+.
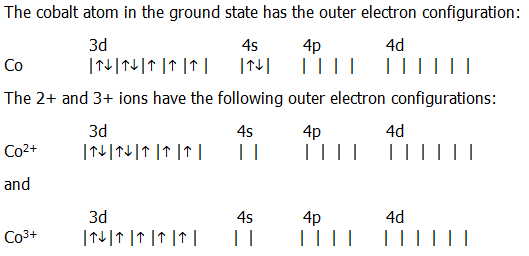
Электронная конфигурация иона Ni2+:
1s22s22p63s23p64s03d84p04d0 или …4s03d84p04d0
В комплексном ионе [Ni(NH3)6]2+ в образовании химической связи принимают участие 8 электронов центрального иона Ni2+ и 12 электронов шести лигандов NH3.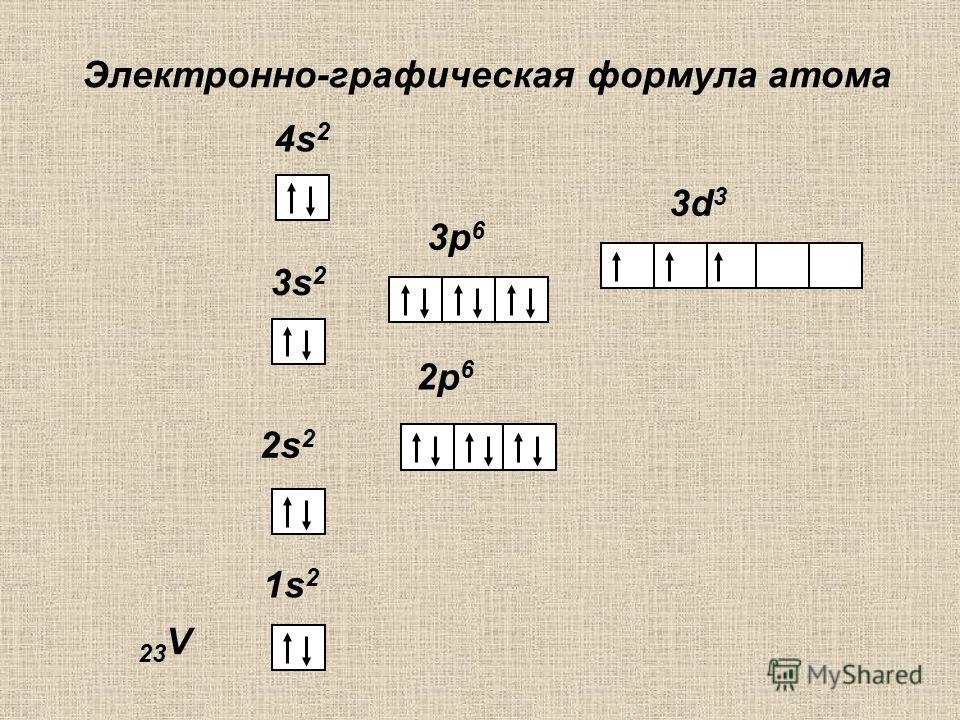
Комплексный ион имеет октаэдрическое строение. Образование МО возможно только в том случае, когда энергии исходных взаимодействующих частиц близки по своим значениям, а также ориентированы в пространстве соответствующим образом.
В нашем случае, орбиталь 4s иона Ni2+ равноценно перекрывается с орбиталями каждого из шести лигандов. В результате этого образуются молекулярные орбитали: связывающая σsсв и разрыхляющая σsразр.
Перекрывание трех 4p-орбиталей комплексообразователя с орбиталями лигандов приводит к образованию шести σp-орбиталей: связывающих σхсв , σyсв , σzсв и разрыхляющих σхразр , σyразр , σzразр.
Перекрывание dz2 и dx2—y2 комплексообразователя с орбиталями лигандов способствует образованию четырех молекулярных орбиталей: двух связывающих σсвх2—y2 , σсвz2 и двух разрыхляющих σразрх2— y2 , σразрz2.
Орбитали dxy, dxz, dyz иона Ni2+ не связываются с орбиталями лигандов, т.к. не направлены к ним. Вследствие этого, они не принимают участия в образовании σ-связи, и являются несвязывающими орбиталями: πxz, πxy, πyz.
Итого, комплексный ион [Ni(NH3)6]2+содержит 15 молекулярных орбиталей. Расположение электронов можно изобразить следующим образом:
(σsсв)2 (σхсв )2 (σyсв)2 (σzсв)2 (σсвх2—y2)2 (σсвz2)2 (πxz)2 (πxy)2 (πyz)2 (σразрх2— y2) (σразрz2)
Схематично образование молекулярных орбиталей изображено на диаграмме ниже:
Схемы распределения электронов по d-орбиталям центрального атома комплексного иона | Задачи 739
Магнитные свойства комплексных ионов
Задача 739.
Изобразить схему распределения электронов по и – орбиталям центрального атома в октаэдрическом комплексе [Cr(CN)6]3-. Указать магнитные свойства этого комплекса.
Решение:
На 3d – подуровне иона Cr3+ находятся три неспаренных электрона:
При образовании иона [Cr(CN)6]3- вследствие влияния сильного поля (ион CN–) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В этом случае энергетически наиболее выгодно размещение всех трёх электронов на – подуровне в соответствии со схемой:
В результате в ионе [Cr(CN)6]3- все электроны оказываются неспаренными, а сам ион – парамагнитен.
Задача 740.
Какими магнитными свойствами обладают ионы: a) [Fe(CN)6]3-;
б) [Fe(CN)6]2-.
Решение:
a) [Fe(CN)6]3-. На 3d – подуровне иона Fe3+ находятся пять электронов, которые, согласно правилу Хунда, неспаренные: . При образовании иона [Fe(CN)6]3-, вследствие влияния лиганда сильного поля (CN–) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. В данном случае энергетически более выгодно размещение всех пяти d – электронов на – подуровне в соответствии со схемой:
В результате в ионе[Fe(CN)6]3- четыре электрона оказываются спаренными, один электрон (пятый по счёту) – неспаренный. Поэтому данный комплексный ион парамагнитен (парамагнит).
б) [Fe(CN)6]2-. На 3d – подуровне иона Fe3+ находятся пять электронов, которые, согласно правилу Хунда, неспаренные: При образовании иона [Fe(CN)6]2-, вследствие влияния лиганда сильного поля (CN–) энергия расщепления d – подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов.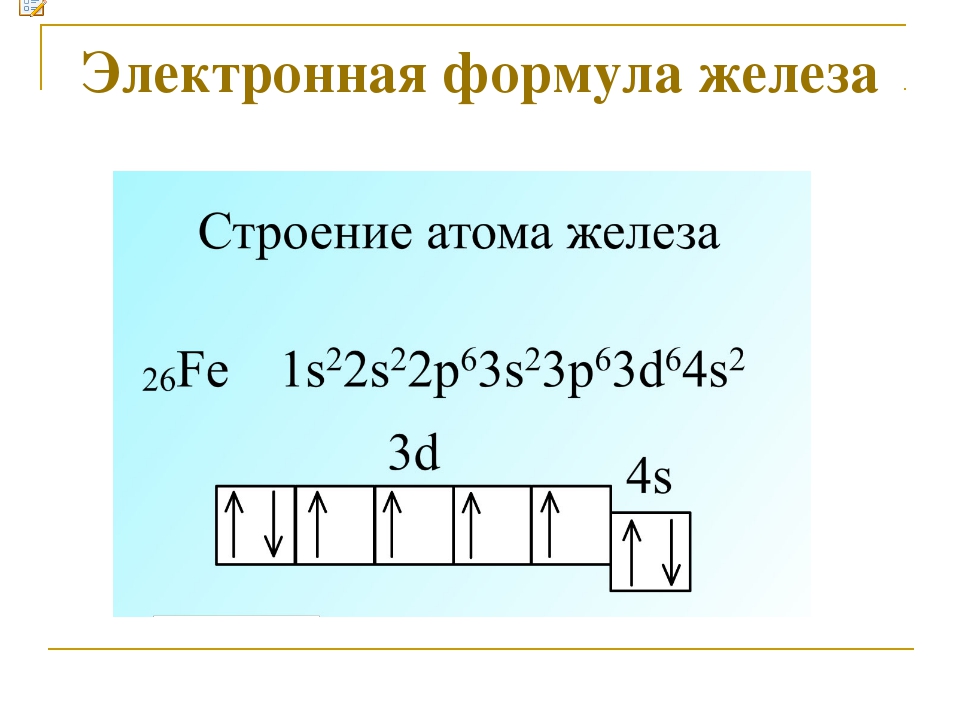 В данном случае энергетически более выгодно размещение всех шести d – электронов на подуровне в соответствии со схемой:
В данном случае энергетически более выгодно размещение всех шести d – электронов на подуровне в соответствии со схемой:
В результате в ионе [Fe(CN)6]2- все шесть электронов оказываются спаренными. Поэтому данный комплексный ион диамагнитен (диамагнит).
Ответ: а) Парамагнитен; б) диамагнитен.
Определение окраски комплексных ионов
Задача 741.
Объяснить, почему соединения меди(I) не окрашены, а соединения меди (II) – окрашены.
Решение:
Ион меди Cu+ имеет электронную конфигурацию (… 3d10). Все 3d – орбитали заполнены, и переход электронов с на подуровень невозможен. Что можно представить в виде схемы:
Ионы меди Cu2+ имеет электронную конфигурацию (… 3d9). Следовательно, на верхнем энергетическом подуровне имеется вакансия. Переход электронов с на подуровень при поглощении кванта света и определяет окраску соединений меди (II).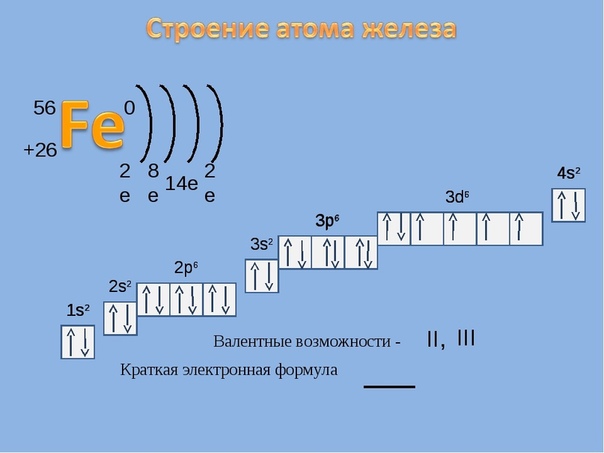 Что можно представить в виде схемы:
Что можно представить в виде схемы:
Задача 742.
Для комплексного нона [Cu(NH3)4]2+ максимум поглощения видимого света соответствует длине волны 304 нм, а для иона [Cu(H2O)4]2+ – длине волны 365 нм. Вычислить энергию расщепления d-подуровня в этих комплексных ионах. Как изменяется сила поля лиганда при переходе от NH3 к Н2O?
Решение:
а) Для расчета используем формулу:
где h – постоянная Планка, 6,6 . 10-34 Дж . с-1; с – скорость света в вакууме, 3 . 10-8 м . с-1; NA – число Авогадро, 6,02 . 1023 моль-1; – длина волны. Подставив значения в данную формулу, получим:
б) Теперь рассчитаем энергию в ионе [Cu(H2O)4]2+, получим:
Следовательно, сила поля лиганда от NH3 к Н2О уменьшается, поэтому лиганд Н2О вызывает меньшее расщепление энергии 3d – подуровня.
Ответ: а) 392 кДж . моль; б) 326 кДж . моль.
Задача 743.
Какова окраска соединений марганца (III) в водных растворах, если для иона [Mn(H2O)6]3+ = 250,5 кДж .моль? Какой длине волны соответствует максимум поглощения видимого света этим ионом?
Решение:
Для расчета используем формулу:
где h – постоянная Планка, 6,6 . 10-34 Дж . с-1; с – скорость света в вакууме, 3 . 10-8 м . с-1; NA – число Авогадро, 6,02 . 1023 моль-1; длина волны. Подставив значения в данную формулу, получим:
Следовательно, ион [Mn(H2O)6]3+ поглощает свет в голубой части спектра, а соединения марганца (III) в водных растворах окрашены в оранжевый (дополнительный к голубому) цвет.
Ответ: Оранжевый 476 нм.
Задача 744.
Для иона [Rh(H2O)6]3+ = 321,6 кДж.моль-1. Определить окраску этого нона и положение максимума поглощения.
Решение:
Для расчета используем формулу:
где h – постоянная Планка, 6,6 . 10-34 Дж . с-1; с – скорость света в вакууме, 3 . 10-8 м . с-1; NA – число Авогадро, 6,02 . 1023 моль-1; длина волны. Подставив значения в данную формулу, получим:
Следовательно, ион [Rh(H2O)6]3+ поглощает свет в невидимой части спектра, а соединения родия (III) в водных растворах будут бесцветны.
Ответ: Бесцветный 371 нм.
Co Информация об элементе кобальта: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История кобальта
Элемент Кобальт был открыт Георгом Брандтом в год. 1735 г. в Швеции
.
Кобальт
получил свое название от немецкого слова Kobold, что означает «гоблин».
1735 г. в Швеции
.
Кобальт
получил свое название от немецкого слова Kobold, что означает «гоблин».
Присутствие кобальта: изобилие в природе и вокруг нас
В таблице ниже показано содержание кобальта во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура кобальта
Кобальт имеет твердую шестигранную структуру .
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
250. 71 71 | 250,71 | 406.95 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства кобальта
Атомы кобальта имеют 27 электронов и структура электронной оболочки [2, 8, 15, 2] с символом атомного члена (квантовые числа) 4 F 9/2 .
Оболочечная структура кобальта – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 7 | |
| 4 | N | 2 |
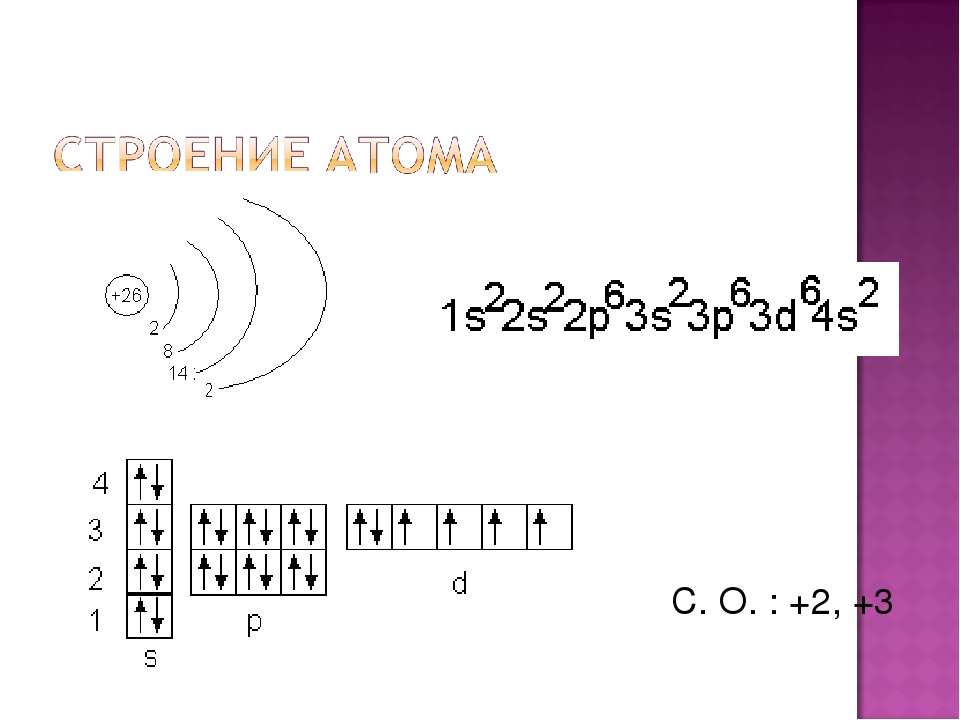
Электронная конфигурация основного состояния кобальта – нейтраль Атом кобальта
Электронная конфигурация нейтрального атома кобальта в основном состоянии
[Ar] 3d7 4s2. Часть конфигурации кобальта, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d7 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации кобальта, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d7 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрали Cobalt
Полная электронная конфигурация основного состояния для атома кобальта, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d7 4с2
Атомная структура кобальта
Атомный радиус кобальта 152 пм, а его ковалентный радиус 126 пм.
Атомный спектр кобальта
Химические свойства кобальта: Энергии ионизации кобальта и сродство к электрону
Электронное сродство кобальта составляет 63,7 кДж / моль.
Энергия ионизации кобальта
Энергии ионизации кобальта
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 760.4 |
| 2 | 1648 |
| 3 | 3232 |
| 4 | 4950 |
| 5 | 7670 |
| 6 | 9840 |
| 7 | 12440 |
| 8 | 15230 |
| 9 | 17959 |
| 10 | 26570 |
| 11 | 2. 94 × 104 94 × 104 |
| 12 | 3,24 × 104 |
| 13 | 3,66 × 104 |
| 14 | 3,97 × 104 |
| 15 | 4,28 × 104 |
| 16 | 49396 |
| 17 | 52737 |
| 18 | 134810 |
| 19 | 145170 |
| 20 | 1.547 × 105 |
| 21 | 1,674 × 105 |
Физические свойства кобальта
Физические свойства кобальта см. В таблице ниже.
| Плотность | 8,9 г / см3 |
| Молярный объем | 6. 62170786517 см3 62170786517 см3 |
Эластичные свойства
Твердость кобальта – Испытания для измерения твердости элемента
Электрические свойства кобальта
Кобальт – проводник электричества.Ссылаться на Таблица ниже электрические свойства кобальта
Теплопроводность и теплопроводность кобальта
Магнитные свойства кобальта
Оптические свойства кобальта
Акустические свойства кобальта
Термические свойства кобальта – энтальпии и термодинамика
Термические свойства кобальта
см. В таблице ниже.Энтальпия кобальта
Изотопы кобальта – ядерные свойства кобальта
Изотопы родия. Встречающийся в природе кобальт имеет
1 стабильный изотоп –
59Co.
Встречающийся в природе кобальт имеет
1 стабильный изотоп –
59Co.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 47Co | ||||
| 48Co | ||||
| 49Co | ||||
| 50Co | ||||
| 51Co | ||||
| 52Co | ||||
| 53Co | ||||
| 54Co | ||||
| 55Co | ||||
| 56Co | ||||
| 57Co | ||||
| 58Co | ||||
| 59Co | 100% | Стабильный | Нет данных | |
| 60Co | ||||
| 61Co | ||||
| 62Co | ||||
| 63Co | ||||
| 64Co | ||||
| 65Co | ||||
| 66Co | ||||
| 67Co | ||||
| 68Co | ||||
| 69Co | ||||
| 70Co | ||||
| 71Co | ||||
| 72Co | ||||
| 73Co | ||||
| 74Co | ||||
| 75Co |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Co Информация об элементе кобальта: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История кобальта
Элемент Кобальт был открыт Георгом Брандтом в год.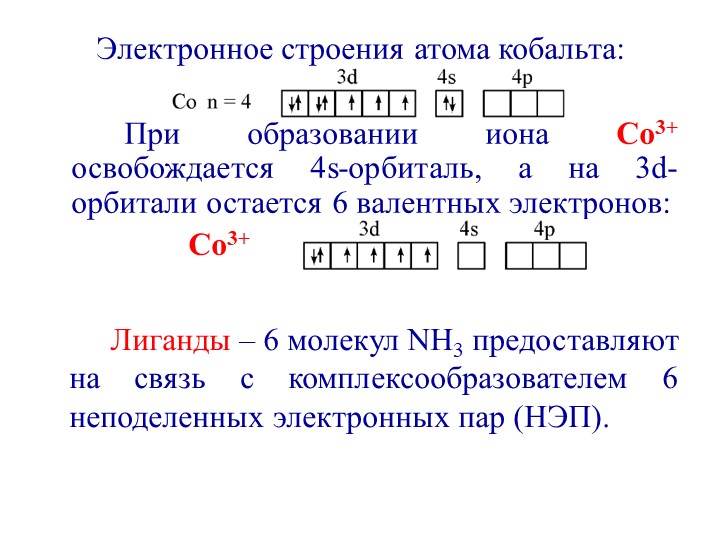 1735 г. в Швеции
.Кобальт
получил свое название от немецкого слова Kobold, что означает «гоблин».
1735 г. в Швеции
.Кобальт
получил свое название от немецкого слова Kobold, что означает «гоблин».
Присутствие кобальта: изобилие в природе и вокруг нас
В таблице ниже показано содержание кобальта во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура кобальта
Кобальт имеет твердую шестигранную структуру .
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
250. 71 71 | 250,71 | 406.95 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства кобальта
Атомы кобальта имеют 27 электронов и структура электронной оболочки [2, 8, 15, 2] с символом атомного члена (квантовые числа) 4 F 9/2 .
Оболочечная структура кобальта – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 7 | |
| 4 | N | 2 |
Электронная конфигурация основного состояния кобальта – нейтраль Атом кобальта
Электронная конфигурация нейтрального атома кобальта в основном состоянии
[Ar] 3d7 4s2.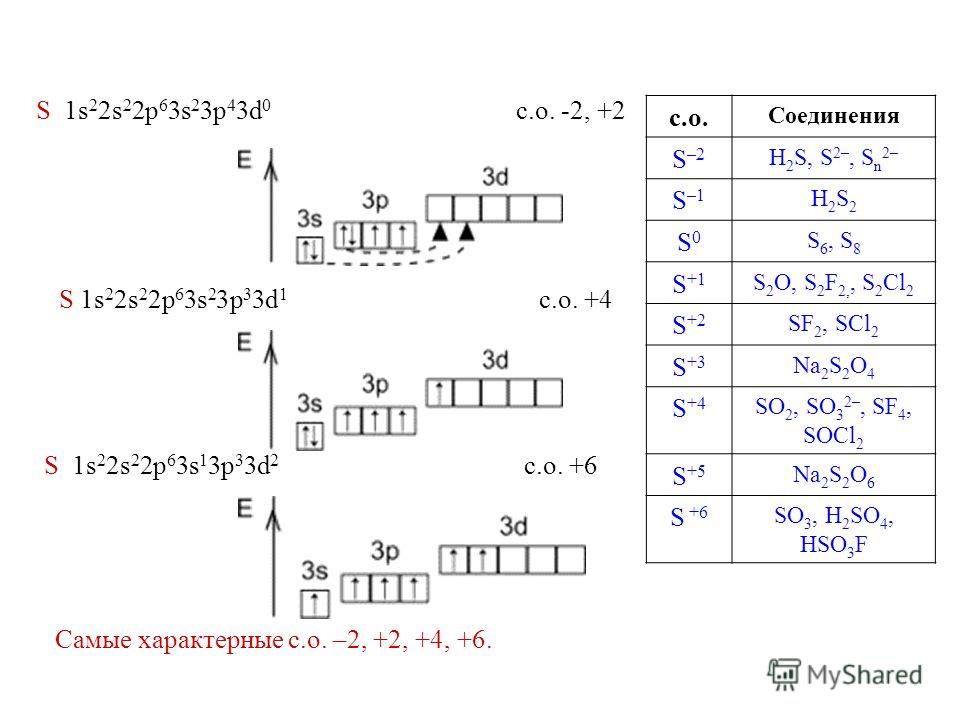 Часть конфигурации кобальта, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d7 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации кобальта, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d7 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрали Cobalt
Полная электронная конфигурация основного состояния для атома кобальта, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d7 4с2
Атомная структура кобальта
Атомный радиус кобальта 152 пм, а его ковалентный радиус 126 пм.
Атомный спектр кобальта
Химические свойства кобальта: Энергии ионизации кобальта и сродство к электрону
Электронное сродство кобальта составляет 63,7 кДж / моль.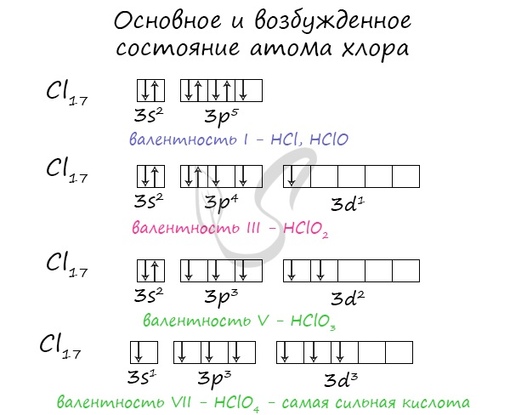
Энергия ионизации кобальта
Энергии ионизации кобальта
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 760.4 |
| 2 | 1648 |
| 3 | 3232 |
| 4 | 4950 |
| 5 | 7670 |
| 6 | 9840 |
| 7 | 12440 |
| 8 | 15230 |
| 9 | 17959 |
| 10 | 26570 |
| 11 | 2. 94 × 104 94 × 104 |
| 12 | 3,24 × 104 |
| 13 | 3,66 × 104 |
| 14 | 3,97 × 104 |
| 15 | 4,28 × 104 |
| 16 | 49396 |
| 17 | 52737 |
| 18 | 134810 |
| 19 | 145170 |
| 20 | 1.547 × 105 |
| 21 | 1,674 × 105 |
Физические свойства кобальта
Физические свойства кобальта см. В таблице ниже.
| Плотность | 8,9 г / см3 |
| Молярный объем | 6. 62170786517 см3 62170786517 см3 |
Эластичные свойства
Твердость кобальта – Испытания для измерения твердости элемента
Электрические свойства кобальта
Кобальт – проводник электричества.Ссылаться на Таблица ниже электрические свойства кобальта
Теплопроводность и теплопроводность кобальта
Магнитные свойства кобальта
Оптические свойства кобальта
Акустические свойства кобальта
Термические свойства кобальта – энтальпии и термодинамика
Термические свойства кобальта
см. В таблице ниже.Энтальпия кобальта
Изотопы кобальта – ядерные свойства кобальта
Изотопы родия. Встречающийся в природе кобальт имеет
1 стабильный изотоп –
59Co.
Встречающийся в природе кобальт имеет
1 стабильный изотоп –
59Co.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 47Co | ||||
| 48Co | ||||
| 49Co | ||||
| 50Co | ||||
| 51Co | ||||
| 52Co | ||||
| 53Co | ||||
| 54Co | ||||
| 55Co | ||||
| 56Co | ||||
| 57Co | ||||
| 58Co | ||||
| 59Co | 100% | Стабильный | Нет данных | |
| 60Co | ||||
| 61Co | ||||
| 62Co | ||||
| 63Co | ||||
| 64Co | ||||
| 65Co | ||||
| 66Co | ||||
| 67Co | ||||
| 68Co | ||||
| 69Co | ||||
| 70Co | ||||
| 71Co | ||||
| 72Co | ||||
| 73Co | ||||
| 74Co | ||||
| 75Co |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Co Информация об элементе кобальта: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История кобальта
Элемент Кобальт был открыт Георгом Брандтом в год. 1735 г. в Швеции
.Кобальт
получил свое название от немецкого слова Kobold, что означает «гоблин».
1735 г. в Швеции
.Кобальт
получил свое название от немецкого слова Kobold, что означает «гоблин».
Присутствие кобальта: изобилие в природе и вокруг нас
В таблице ниже показано содержание кобальта во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура кобальта
Кобальт имеет твердую шестигранную структуру .
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
250. 71 71 | 250,71 | 406.95 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | 2 π / 3 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.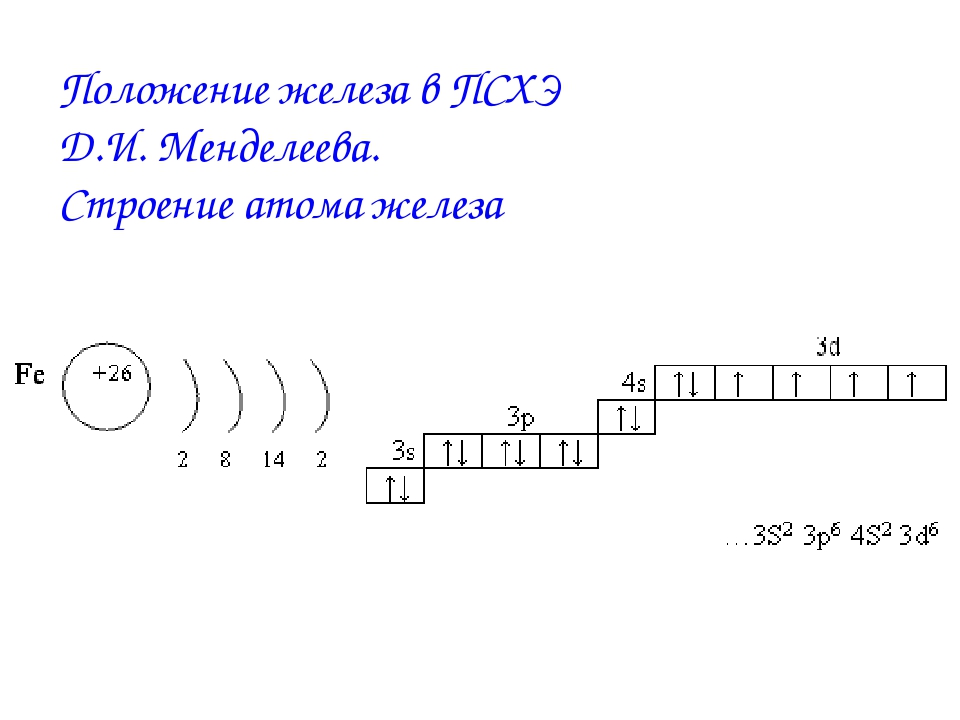
Атомные и орбитальные свойства кобальта
Атомы кобальта имеют 27 электронов и структура электронной оболочки [2, 8, 15, 2] с символом атомного члена (квантовые числа) 4 F 9/2 .
Оболочечная структура кобальта – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 7 | |
| 4 | N | 2 |
Электронная конфигурация основного состояния кобальта – нейтраль Атом кобальта
Электронная конфигурация нейтрального атома кобальта в основном состоянии
[Ar] 3d7 4s2. Часть конфигурации кобальта, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d7 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации кобальта, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d7 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрали Cobalt
Полная электронная конфигурация основного состояния для атома кобальта, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d7 4с2
Атомная структура кобальта
Атомный радиус кобальта 152 пм, а его ковалентный радиус 126 пм.
Атомный спектр кобальта
Химические свойства кобальта: Энергии ионизации кобальта и сродство к электрону
Электронное сродство кобальта составляет 63,7 кДж / моль.
Энергия ионизации кобальта
Энергии ионизации кобальта
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 760.4 |
| 2 | 1648 |
| 3 | 3232 |
| 4 | 4950 |
| 5 | 7670 |
| 6 | 9840 |
| 7 | 12440 |
| 8 | 15230 |
| 9 | 17959 |
| 10 | 26570 |
| 11 | 2. 94 × 104 94 × 104 |
| 12 | 3,24 × 104 |
| 13 | 3,66 × 104 |
| 14 | 3,97 × 104 |
| 15 | 4,28 × 104 |
| 16 | 49396 |
| 17 | 52737 |
| 18 | 134810 |
| 19 | 145170 |
| 20 | 1.547 × 105 |
| 21 | 1,674 × 105 |
Физические свойства кобальта
Физические свойства кобальта см. В таблице ниже.
| Плотность | 8,9 г / см3 |
| Молярный объем | 6. 62170786517 см3 62170786517 см3 |
Эластичные свойства
Твердость кобальта – Испытания для измерения твердости элемента
Электрические свойства кобальта
Кобальт – проводник электричества.Ссылаться на Таблица ниже электрические свойства кобальта
Теплопроводность и теплопроводность кобальта
Магнитные свойства кобальта
Оптические свойства кобальта
Акустические свойства кобальта
Термические свойства кобальта – энтальпии и термодинамика
Термические свойства кобальта
см. В таблице ниже.Энтальпия кобальта
Изотопы кобальта – ядерные свойства кобальта
Изотопы родия. Встречающийся в природе кобальт имеет
1 стабильный изотоп –
59Co.
Встречающийся в природе кобальт имеет
1 стабильный изотоп –
59Co.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 47Co | ||||
| 48Co | ||||
| 49Co | ||||
| 50Co | ||||
| 51Co | ||||
| 52Co | ||||
| 53Co | ||||
| 54Co | ||||
| 55Co | ||||
| 56Co | ||||
| 57Co | ||||
| 58Co | ||||
| 59Co | 100% | Стабильный | Нет данных | |
| 60Co | ||||
| 61Co | ||||
| 62Co | ||||
| 63Co | ||||
| 64Co | ||||
| 65Co | ||||
| 66Co | ||||
| 67Co | ||||
| 68Co | ||||
| 69Co | ||||
| 70Co | ||||
| 71Co | ||||
| 72Co | ||||
| 73Co | ||||
| 74Co | ||||
| 75Co |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Кобальтовая электронная конфигурация (Co) с орбитальной диаграммой
Кобальт Электронная конфигурация : Химический элемент Кобальт имеет атомный номер 27 th и его символ – «Со». Кобальт существует в земной коре и находится в химически комбинированной форме, его присутствие в виде небольших отложений природных сплавов метеороидного железа. Это серебристо-серый металл или твердый матовый элемент. Это внутренний переходный элемент, который присутствует в группе 4 -й периодической таблицы.
Кобальт существует в земной коре и находится в химически комбинированной форме, его присутствие в виде небольших отложений природных сплавов метеороидного железа. Это серебристо-серый металл или твердый матовый элемент. Это внутренний переходный элемент, который присутствует в группе 4 -й периодической таблицы.
Кобальтовая электронная конфигурация
Число электронов на орбитах атомов и молекул называется электронной конфигурацией. В этом случае кобальта есть 27 электронов, которые находятся на 4-х орбитах, и их распределение на орбите, которое представляет собой электронную конфигурацию, можно записать как:
1с 2 2с 2 2p 6 3s 2 3p 6 3d 7 4s 2 .
Электронная конфигурация для иона кобальтаРаспределение электронов в атоме или молекулах определяется как электронная конфигурация, а электронная конфигурация для иона кобальта может быть представлена как:
1с 2 2с 2 2p 6 3s 2 3p 6 3d 7 4s 2 . Или [Ar] 3d 7 4s 2 .
Или [Ar] 3d 7 4s 2 .
Полная электронная конфигурация может быть определена как распределение 27 электронов в 4-х оболочках элемента Co.На четырех орбитах кобальта присутствуют 2, 8, 15, 2 элемента, которые могут быть представлены в следующей форме: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4s 2 .
Какова электронная конфигурация кобальтаРаспределение электронов кобальта в s, p, d блоках по 4 орбиты равно 2, 8, 15, 2 и может быть записано как: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 7 4с 2 .
Сколько валентных электронов в кобальте Валентные электроны – это – (электроны) атома, находящегося во внешней оболочке. А в случае кобальта имеется 8 валентных электронов.
А в случае кобальта имеется 8 валентных электронов.
Определение кобальта, Факты, Символ, Открытие, Собственность, Использование
Что такое кобальт
Кобальт (произношение: КО-болт) – твердый, блестящий серебристо-синий элемент, принадлежащий к группе переходных металлов, и представлен химическим символом Co [1, 2, 3] .Он химически активен и может образовывать множество соединений [4] . Это ферромагнитный металл, который может быть намагничен и легирован никелем и алюминием для производства мощных магнитов [1, 4] .
Кобальтовый символ
Изотопы
Он имеет один стабильный, встречающийся в природе изотоп, 59 Co и 28 радиоизотопов, из которых наиболее стабильными являются 60 Co, 57 Co, 56 Co и 58 Co с периодом полураспада 5. .2714 лет, 271,8 дня, 77,27 дня и 70,86 дня соответственно [5] . Периоды полураспада других его радиоизотопов составляют менее 18 часов. [5] .
[5] .
Где находится кобальт
Кобальт в природе встречается в минеральных рудах в сочетании с другими элементами, такими как кобальтит (сульфид, содержащий кобальт, мышьяк, железо и никель), эритрит (гидратированный арсенат кобальта) и скуттерудит (арсенат кобальта) [1] . Обычно его получают как побочный продукт при добыче меди и никеля [1, 4] .
Марганцевые конкреции, обнаруженные на дне океана, представляют собой огромные запасы переходных металлов, содержащих тонны кобальта [1] . В тройку крупнейших держателей запасов кобальта входят Демократическая Республика Конго (ДРК), Австралия и Куба, а в тройку крупнейших производителей входят ДРК, Китай и Замбия [1] .
Кобальт
История
Происхождение названия : Название происходит от слова «кобальд», что по-немецки означает «гоблин», и от греческого слова «кобалос», означающего «мой». [1, 2] .
Кто его открыл : Элемент был обнаружен шведским химиком и минералогом Георгом Брандтом [1] .
Когда и как было обнаружено
В гробнице Тутанхамона, древнеегипетского фараона, правившего в 1361–1352 годах до нашей эры, был предмет из темно-синего стекла, сделанный из кобальта. [1] . В Китае кобальтовый синий использовался для изготовления глазурей для керамики [1] .
Помимо древнего происхождения, его недавнее открытие относится к 1730-м годам, когда Георг Брандт интересовался голубой рудой из некоторых местных рудников. [1] .Наконец, ему удалось доказать, что голубая руда содержит новый металл [1] . Он описал его свойства и опубликовал результаты в 1739 [1, 3] .
Его открытие было спорным, так как другие химики много лет оспаривали его открытия. [1] . Однако его коллега-шведский химик Торберн Бергман провел дальнейшие исследования и подтвердил открытие Георга Брандта в 1780 [1, 3] .
Идентификация кобальта | |||
| Атомный номер | 27 [1] | ||
| Номер CAS | 7440-48-4 [1] | ||
| Положение в таблице Менделеева | Группа | Период | Блок |
| 9 [1] | 4 [1] | d [1] | |
Где находится кобальт в Периодической таблице
Свойства и характеристики кобальта
Общая недвижимость | ||||||||||||||||
| Относительная атомная масса | 58. 933 [1] 933 [1] | |||||||||||||||
| Атомная масса | 58,933 а.е.м. [1] | |||||||||||||||
| Молярная масса | 58,50 ± 0,0000050 г / моль [6] | |||||||||||||||
| Молекулярный вес | 58,933 г / моль [7] | |||||||||||||||
Физические свойства | ||||||||||||||||
| Цвет | Серебристо-голубой, голубовато-белый [1, 4] | |||||||||||||||
| Точка плавления / замерзания | 1495 ° C, 2723 ° F [1] | |||||||||||||||
| Температура кипения | 2927 ° C, 5301 ° F [1] | |||||||||||||||
| Плотность | 8.86 г см -3 [1] | |||||||||||||||
| Состояние вещества при комнатной температуре (твердое / жидкое / газообразное) | Цельный [1, 4] | |||||||||||||||
| Твердость | ||||||||||||||||
| – Бринелл | 700 МПа [8] | |||||||||||||||
| – Моос | 5 [8] | |||||||||||||||
| – Виккерс | 1043 МПа [8] | |||||||||||||||
| Электропроводность | 1. 7 X 10 7 См / м [8] 7 X 10 7 См / м [8] | |||||||||||||||
| Ионный заряд | 3+ [9] | |||||||||||||||
| Теплопроводность | 100 Вт / (м · К) [8] | |||||||||||||||
| Удельная теплоемкость | 421 Дж кг -1 K -1 [1] | |||||||||||||||
| Объемный модуль | Неизвестно [1] | |||||||||||||||
| Модуль сдвига | Неизвестно [1] | |||||||||||||||
| Модуль Юнга | Неизвестно [1] | |||||||||||||||
| Давление пара | ||||||||||||||||
| – Температура (К) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Давление (Па) | – | – | – | 2. 09 Х 10 -10 09 Х 10 -10 | 1,00 Х 10 -6 | 4,19 Х 10 -4 | 0,0379 | 1,15 | 16 | – | – | |||||
Химические свойства | ||||||||||||||||
| Степени окисления | 3, 2, 0, -1 [1] | |||||||||||||||
| Изотопы | Изотоп | Масса | Обилие (%) | Период полураспада | Форма распада | |||||||||||
| 59 Ко | 58.933 | 100 | – | – | ||||||||||||
Точечная структура кобальта Льюиса
Атомные данные кобальта (элемент 27)
| Валентные электроны | 9 [10] | |||||||
| Квантовые числа | ||||||||
| – н | 3 [11] | |||||||
| – | 2 [11] | |||||||
| – м ℓ | -1 [11] | |||||||
| – м с | -1/2 [11] | |||||||
| Электронная конфигурация (конфигурация благородного газа) | [Ar] 3d 7 4s 2 [1] | |||||||
| Атомная структура | ||||||||
| – Количество электронов | 27 [4] | |||||||
| – Количество нейтронов | 32 [4] | |||||||
| – Число протонов | 27 [4] | |||||||
| Радиус атома | ||||||||
| – Атомный радиус | 2. 00 Å [1] 00 Å [1] | |||||||
| – Ковалентный радиус | 1,18 Å [1] | |||||||
| Электроотрицательность (шкала Полинга) | 1.88 [1] | |||||||
| Сродство к электрону | 63,873 кДж моль -1 [1] | |||||||
| Энергия ионизации (кДж моль -1 ) | 1-й | 2-я | 3-й | 4-я | 5-я | 6-й | 7-й | 8-й |
| 760.402 | 1648.356 | 3232,3 | 4949,7 | 7670,6 | 9842 | 12437 | 15225,4 | |
Кобальтовая электронная конфигурация (модель Бора)
Что такое кобальт, используемый в
- Кобальт легирован для использования в газотурбинных генераторах и реактивных турбинах из-за его жаропрочности и устойчивости к коррозии.
 [1, 4] .
[1, 4] . - Кобальт иногда используется в гальванике из-за его твердости и привлекательного внешнего вида. [1] .
- Обычно используется в качестве катодного материала в литий-ионных батареях. [4] .
- Соли кобальта используются для придания насыщенного синего цвета стеклу, фарфору, керамике, эмали и краскам. [1] .
- Радиоактивный 60 Co используется для лечения рака, а также при облучении пищевых продуктов для борьбы с патогенами и продления срока хранения [1] .
- Суперсплавы стеллита, состоящие из хрома, кобальта и вольфрама, используются для изготовления жаропрочных и износостойких режущих инструментов. [2] .
Токсичность кобальта и воздействие на здоровье
Отравление кобальтом может иметь место при случайном проглатывании, дыхании или контакте с кожей в больших количествах. [12] . В больших количествах кобальт может быть канцерогенным для человека и некоторых животных [1] .
Он содержится в следовых количествах в организме человека и является важным компонентом витамина B12. [1] . Некоторым животным также дают небольшие дозы кобальта для предотвращения дефицита у них минералов [1] .
Минерал кобальта (кобальтит)
Интересные факты
- Кобальт графически представлен «кобольдом» или гоблином (считавшимся неприятным для средневековых немецких рудокопов) с некоторым количеством китайского фарфора на заднем плане, имея в виду его использование в качестве глазури для керамики в древнем Китае. [1] .
- Кобальт может сохранять свои магнитные свойства до температуры (точка Кюри) 1121 ° C (2049,8 ° F), самой высокой из всех ферромагнитных элементов [3, 4] .
- В 2010 году немецкие ученые использовали атом кобальта, чтобы сделать первые снимки изменения спина [3] .
Цена кобальта
Стоимость чистого кобальта составляет около 0,21 доллара за грамм, а в больших количествах он стоит около 0,044 доллара за грамм. [4] .
[4] .
Список литературы
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https: //www.livescience.ru / 29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.Chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm
Произошла ошибка при установке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Встраивание атомарного кобальта в решетку графена для активации ферромагнетизма при комнатной температуре
Ли, Д. и Канер, Р. Б. Материалы на основе графена. Наука 320 , 1170–1171 (2008).
CAS PubMed Статья Google Scholar
Станкович С. и др. Композиционные материалы на основе графена. Природа 442 , 282–286 (2006).
ADS CAS PubMed Статья Google Scholar
Столлер М. Д., Парк С., Чжу Ю., Ан, Дж. И Руофф Р. С. Ультраконденсаторы на основе графена. Nano Lett. 8 , 3498–3502 (2008).
ADS CAS PubMed Статья Google Scholar
Ли, К., Вей, X., Кисар, Дж. У. и Хоун, Дж. Измерение упругих свойств и внутренней прочности однослойного графена. Наука 321 , 385–388 (2008).
ADS CAS PubMed Статья Google Scholar
Новоселов К.С. и др. Двумерный газ безмассовых дираковских фермионов в графене. Природа 438 , 197–200 (2005).
ADS CAS PubMed Статья Google Scholar
Banszerus, L. et al. Графеновые устройства сверхвысокой подвижности на основе химического осаждения из газовой фазы на многоразовую медь. Sci. Adv. 1 , e1500222 (2015).
ADS PubMed PubMed Central Статья Google Scholar
Баландин А.А. и др. Превосходная теплопроводность однослойного графена. Nano Lett. 8 , 902–907 (2008).
Nano Lett. 8 , 902–907 (2008).
ADS CAS PubMed Статья Google Scholar
Vicarelli, L. et al. Графеновые полевые транзисторы как детекторы терагерцового диапазона при комнатной температуре. Нац. Матер. 11 , 865–871 (2012).
ADS CAS PubMed Статья Google Scholar
Лю Ю., Донг X. и Чен П. Биологические и химические сенсоры на основе графеновых материалов. Chem. Soc. Ред. 41 , 2283–2307 (2012).
CAS PubMed Статья Google Scholar
Антолини, Э. Графен как новый углеродный носитель для низкотемпературных катализаторов топливных элементов. Заявл. Катал. B Environ. 123 , 52–68 (2012).
Артикул CAS Google Scholar
Tombros, N.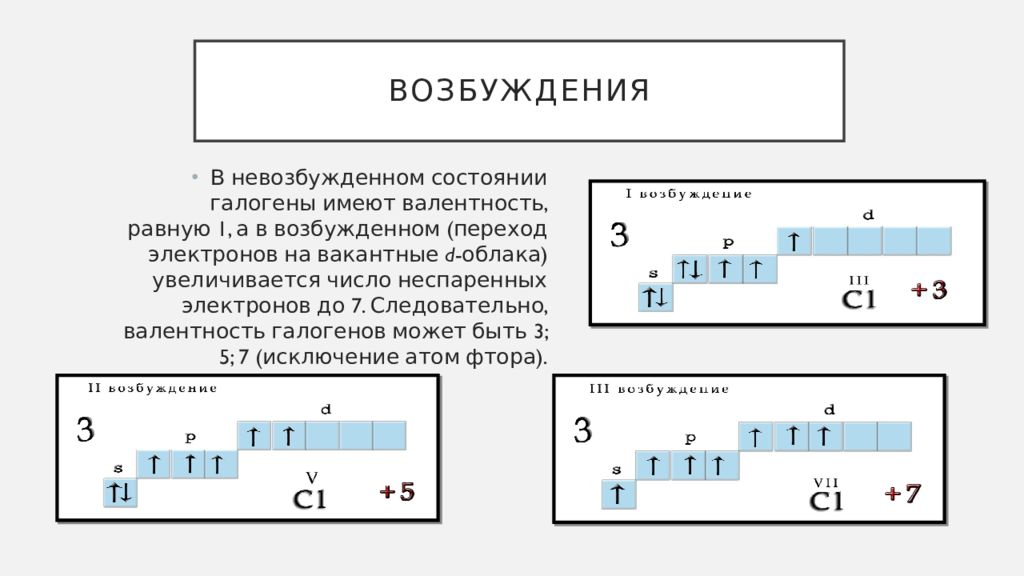 et al. Электронный спиновой транспорт и прецессия спина в одиночных слоях графена при комнатной температуре. Природа 448 , 571–574 (2007).
et al. Электронный спиновой транспорт и прецессия спина в одиночных слоях графена при комнатной температуре. Природа 448 , 571–574 (2007).
ADS CAS PubMed Статья Google Scholar
Георгакилас, В., Перман, Дж. А., Тучек, Дж. И Зборил, Р. Широкое семейство углеродных наноаллотропов: классификация, химия и применение фуллеренов, углеродных точек, нанотрубок, графена, наноалмазов и сочетания надстройки. Chem. Ред. 115 , 4744–4822 (2015).
CAS PubMed Статья Google Scholar
Sepioni, M. et al. Ограничения на собственный магнетизм в графене. Phys. Rev. Lett. 105 , 207205 (2010).
ADS CAS PubMed Статья Google Scholar
Tucek, J. et al. Легирование серой вызывает сильное ферромагнитное упорядочение в графене: эффект концентрации и механизм замещения.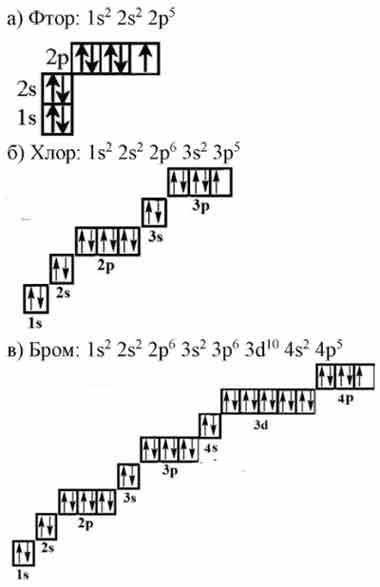 Adv. Матер. 28 , 5045–5053 (2016).
Adv. Матер. 28 , 5045–5053 (2016).
CAS PubMed Статья Google Scholar
Паласиос, Дж. Дж., Фернандес-Россье, Дж. И Брей, Л. Магнетизм, индуцированный вакансиями в графене и графеновых лентах. Phys. Ред. B 77 , 195428 (2008).
ADS Статья CAS Google Scholar
Tucek, J.и другие. Органические магниты, полученные при комнатной температуре, на основе функционализированного графена sp 3 . Нац. Commun. 8 , 14525 (2017).
ADS CAS PubMed PubMed Central Статья Google Scholar
Blonski, P. et al. Допирование графитовым азотом вызывает ферромагнетизм в графене. J. Am. Chem. Soc. 139 , 3171–3180 (2017).
CAS PubMed PubMed Central Статья Google Scholar

González-Herrero, H. et al. Управление магнетизмом графена на атомном уровне с помощью атомов водорода. Наука 352 , 437–441 (2016).
ADS PubMed Статья CAS Google Scholar
Magda, G.Z. et al. Магнитный порядок при комнатной температуре на зигзагообразных краях узких графеновых нанолент. Природа 514 , 608–611 (2014).
ADS CAS PubMed Статья Google Scholar
Ito, Y. et al. Настройка магнитных свойств углерода путем легирования его графеновых доменов азотом. J. Am. Chem. Soc. 137 , 7678–7685 (2015).
CAS PubMed Статья Google Scholar
Наир, Р. Р. и др. Спин-полупарамагнетизм в графене, вызванный точечными дефектами. Нац. Phys. 8 , 199–202 (2012).
CAS Статья Google Scholar

Liu, Y. et al. Элементное супердопирование графена и углеродных нанотрубок. Нац. Commun. 7 , 10921 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
Ahmed, S. et al. Магнитные свойства WSe 2 , легированного кобальтом путем имплантации. J. Alloy. Compd 731 , 25–31 (2018).
CAS Статья Google Scholar
Duan, H. et al. Превышение правила исключения против сосуществования устойчивой люминесценции и ферромагнетизма в монослоях халькогенидов. Нац. Commun. 10 , 1584 (2019).
ADS PubMed PubMed Central Статья CAS Google Scholar
Matsui, D. et al. Магнитные свойства кобальт-углеродных нанокомпозитов. Phys. Статус Солди К. 7 , 1264–1268 (2010).
CAS Google Scholar

Хота П., Ахтар А., Бхаттачарья С., Миа, М. и Саха, С. К. Ферромагнетизм в графене из-за переноса заряда от атомарного Со к графену. Заявл. Phys. Lett. 111 , 042402 (2017).
ADS Статья CAS Google Scholar
Wan, X. et al. Электрокатализатор Fe – N – C с плотными активными центрами и эффективным массопереносом для высокоэффективных топливных элементов с протонообменной мембраной. Нац. Катал. 2 , 259–268 (2019).
CAS Статья Google Scholar
Du, Z. et al. Кобальт в легированном азотом графене как одноатомный катализатор для литий-серных батарей с высоким содержанием серы. J. Am. Chem. Soc. 141 , 3977–3985 (2019).
CAS PubMed Статья Google Scholar
Сан, Т.и другие. Одноатомные центры кобальта, встроенные в иерархически упорядоченный пористый углерод, легированный азотом, как превосходный бифункциональный электрокатализатор. Proc. Natl Acad. Sci. США 115 , 12692–12697 (2018).
Proc. Natl Acad. Sci. США 115 , 12692–12697 (2018).
CAS PubMed Статья Google Scholar
Чабан В. В., Преждо О. В. Связи азота и азота подрывают стабильность графена с примесью азота. J. Am. Chem. Soc. 137 , 11688–11694 (2015).
CAS PubMed Статья Google Scholar
Sun, Y. L. et al. Блуждающие ферромагнитные полуметаллические пары кобальт-железо: перспективные бифункциональные электрокатализаторы для ORR и OER. J. Mater. Chem. А 7 , 27175–27185 (2019).
CAS Статья Google Scholar
Zhu, Y. et al. Однореакторный пиролиз с образованием N-легированного графена с одиночными атомными центрами Pt с высокой плотностью в качестве гетерогенного катализатора гидросилилирования алкена. ACS Catal. 8 , 10004–10011 (2018).
CAS Статья Google Scholar
Yang, Z. et al. Усиление катализа восстановления кислорода с помощью Fe-N 4 участков декорировали пористые угли в направлении топливных элементов. ACS Catal. 9 , 2158–2163 (2019).
CAS Статья Google Scholar
Zhu, C. et al.Иерархически пористые одноатомные электрокатализаторы M – N – C (M = Co и Fe) с устойчивыми активными фрагментами MN x позволяют повысить эффективность ORR. Adv. Energy Mater. 8 , 1801956 (2018).
Артикул CAS Google Scholar
Zhao, L. et al. Стратегия каскадного закрепления для общего массового производства высоконагруженных одноатомных металл-азотных катализаторов. Нац. Commun. 10 , 1278 (2019).
ADS PubMed PubMed Central Статья CAS Google Scholar

Fei, H. et al. Быстрый синтез одноатомных металлов на основе графена с помощью микроволнового излучения. Adv. Матер. 30 , 1802146 (2018).
Артикул CAS Google Scholar
Zheng, Y. et al. Выделение водорода безметалловым электрокатализатором. Нац. Commun. 5 , 3783 (2014).
ADS PubMed Статья Google Scholar
Алвес, М.М., Доделе, Дж., Гуай, Д., Ладусер, М. и Турийон, Г. Происхождение электрокаталитических свойств для восстановления кислорода некоторых термообработанных соединений полиакрилонитрила и фталоцианина кобальта, адсорбированных на угле. черный по результатам электрохимической и рентгеновской абсорбционной спектроскопии. J. Phys.Chem. 96 , 10898–10905 (1992).
CAS Статья Google Scholar
Zhang, T. et al. Окончательное рассмотрение электронной структуры CoPc: совместное исследование фотоэмиссионной и абсорбционной спектроскопии в газовой фазе и твердом теле. J. Phys. Chem. С 121 , 26372–26378 (2017).
Окончательное рассмотрение электронной структуры CoPc: совместное исследование фотоэмиссионной и абсорбционной спектроскопии в газовой фазе и твердом теле. J. Phys. Chem. С 121 , 26372–26378 (2017).
Артикул CAS Google Scholar
Willey, T. M. et al. Различия в электронной структуре высокоориентированных тонких пленок H 2 -, Fe-, Co- и Cu-фталоцианина, наблюдаемые с помощью спектроскопии NEXAFS. J. Chem. Phys. 139 , 034701 (2013).
ADS CAS PubMed Статья Google Scholar
Hebard, A. et al. Разработка высокотемпературного ферромагнетизма в разбавленных ионно-имплантированных магнитных полупроводниках. J. Phys.D Прил. Phys. 37 , 511–517 (2004).
ADS CAS Статья Google Scholar
Фельнер И. Особенности магнитных свойств и сверхпроводимости в аморфном углероде, легированном серой. Магнитохимия 2 , 34 (2016).
Магнитохимия 2 , 34 (2016).
Артикул CAS Google Scholar
Бандоу, С., Ямагути, Т. и Иидзима, С. Магнетизм адсорбированного кислорода на углеродных нанорнах. Chem. Phys. Lett. 401 , 380–384 (2005).
ADS CAS Статья Google Scholar
Бен Дор, О., Йохелис, С., Мэтью, С. П., Нааман, Р. и Палтиель, Ю. Устройство магнитной памяти на основе хиральной памяти без постоянного магнита. Нац. Commun. 4 , 2256 (2013).
ADS PubMed PubMed Central Статья CAS Google Scholar
Фельнер И. и Прилуцкий Е. Необычные магнитные свойства и сверхпроводимость в порошке аморфного углерода, легированного серой. J. Supercond. Nov. Magn. 25 , 2547–2555 (2012).
CAS Статья Google Scholar
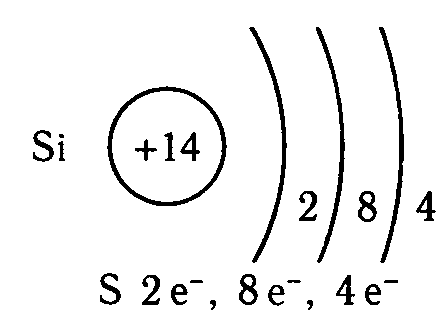
Гриффин К.А., Пахомов А.Б., Ван, К.М., Хилд, С.М. и Кришнан, К.М. Собственный ферромагнетизм в изолирующем анатазе, активированном кобальтом, TiO 2 . Phys. Ред.Lett. 94 , 157204 (2005).
ADS CAS PubMed Статья Google Scholar
Чжэн, Дж., Рен, З., Го, П., Фанг, Л. и Фан, Дж. Диффузия иона Li + на графене: исследование методом DFT. Заявл. Прибой. Sci. 258 , 1651–1655 (2011).
ADS CAS Статья Google Scholar
Маджиди Р.& Карами, А. Адсорбция формальдегида на графене и графине. Phys. Е 59 , 169–173 (2014).
CAS Статья Google Scholar
Стонер Э. К. Коллективный электронный ферромагнетизм. Proc. R. Soc. Лондон. 165 , 0372–0414 (1938).
ADS Google Scholar

Al Ma’Mari, F. et al. Превосходство критерия Стонера с использованием молекулярных интерфейсов. Nature 524 , 69 – U128 (2015).
ADS Статья CAS Google Scholar
Каттель, С., Атанасов, П. и Кифер, Б. Стабильность, электронные и магнитные свойства плоских дефектов в графене: исследование из первых принципов. J. Phys. Chem. С 116 , 8161–8166 (2012).
CAS Статья Google Scholar
Лисенков, С., Андриотис, А. Н., Менон, М. Магнитная анизотропия и инженерия магнитных свойств краев графеновых нанолент, внедренных в кобальт. Phys. Rev. Lett. 108 , 187208 (2012).
ADS PubMed Статья CAS Google Scholar
Крашенинников А.В., Лехтинен П.О., Фостер А.С., Пюкко П. и Ниеминен Р.М. Встраивание атомов переходных металлов в графен: структура, связь и магнетизм. Phys. Rev. Lett. 102 , 126807 (2009).
Phys. Rev. Lett. 102 , 126807 (2009).
ADS CAS PubMed Статья Google Scholar
Сантос, Э. Дж. Г., Санчес-Портал, Д. и Аюэла, А. Магнетизм примесей замещения Со в графене: реализация одиночных пи-вакансий. Phys. Ред. B 81 , 125433 (2010).
ADS Статья CAS Google Scholar
Парк, Х., Вадера, А., Уилкинс, Дж. У., Кастро Нето, А. Х. Спин-поляризованный электронный ток, индуцированный подрешеточной инженерией графеновых листов с бором / азотом. Phys. Ред. B 87 , 085441 (2013).
ADS Статья CAS Google Scholar
Андриотис А. Н. и Менон М. Магнетизм, индуцированный дефектами: совместное легирование и рецепт усиленного магнетизма. Phys. Ред. B 87 , 155309 (2013).
ADS Статья CAS Google Scholar

Андриотис, А. Н., Фтенакис, З. Г. и Менон, М. Последовательные спиновые поляризации, лежащие в основе нового вклада магнитной связи в разбавленных магнитных полупроводниках. J. Phys. Конденс. Дело 27 , 052202 (2015).
ADS PubMed Статья CAS Google Scholar
Коуи, Дж., Венкатесан, М. и Фитцджеральд, К. Обмен зон донорной примеси в разбавленных ферромагнитных оксидах. Нац. Матер. 4 , 173 (2005).
ADS CAS PubMed Статья Google Scholar
Hummers, W. S. Jr & Offeman, R. E. Получение оксида графита. J. Am. Chem. Soc. 80 , 1339–1339 (1958).
CAS Статья Google Scholar
Giannozzi, P. et al. QUANTUM ESPRESSO: модульный программный проект с открытым исходным кодом для квантового моделирования материалов. J.

 [1, 4] .
[1, 4] .