Литий электронное строение – Справочник химика 21
Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий и натрий Зл бериллий 2. и магний 3 , бор 25 2р и алюминий и т. д.). Такая [c.52]Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий 2 и натрий 3 бериллий 2 и магний 3 , бор 2 2p и алюминий 3 3р и т. д.). Такая закономерность будет соблюдаться и в последующих периодах. Именно этим объясняется периодическая повторяемость свойств элементов в периодах. В этом сущность и причина периодичности, обнаруженной Д. И. Менделеевым, который не располагал сведениями о строении атома. Итак, теория строения атома подтвердила истинность менделеевского открытия, подвела под него мощную базу. [c.44]
Электронное строение атома бериллия в газообразном состоянии — 15 25% Увеличение заряда ядра атома бериллия по сравнению с зарядом ядра атома лития наряду с тем, что 25-электроны только частично экранируют друг друга, приводит к двум эффектам 1) атом Ве имеет металлический радиус только 0,89 А, значительно меньше, чем в случае лития (1,22 А) 2) потенциалы ионизации Ве, 9,32 и 18,21 эв, гораздо большие, чем у Ы (5,39 эе), делают Ве значительно менее электроположительным, если рассматривать его хилшческие свойства в сравнении со свойствами Действительно, не существует никаких кристаллических соединений или растворов, в которых ионы Ве + существовали бы как таковые.

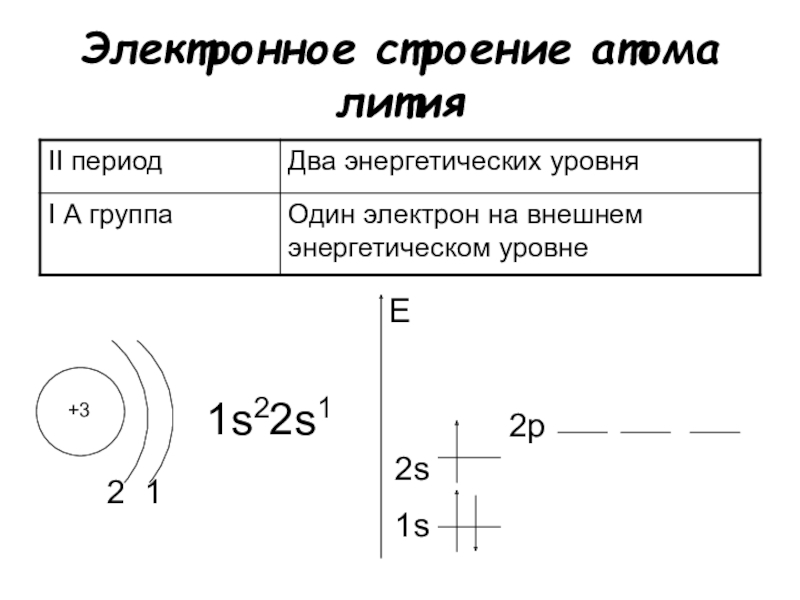
Рассмотрим теперь взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) выражается схемой
Таким образом, третий период, подобно второму, начинается с двух s-элементов, за которыми следует шесть р-элементов. Структура внешнего электронного слоя соответствующих элементов второго п третьего периодов оказывается, следовательно, аналогичной. Так, у атомов лития и натрия во внешнем электронном слое находится по одному s-электрону, у атомов азота и фосфора — по два S- и по три р-электрона и т. д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных слоев атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронно.пу строению их атомов. Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов п lix соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом.
д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных слоев атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронно.пу строению их атомов. Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов п lix соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом.
Все щелочные металлы — очень сильные восстановители, их стандартные электродные потенциалы (E ) отрицательные. Наиболее отрицателен Е° лития (см. табл. 6.1). Это связано с особенностями электронного строения атома лития (ls 2s ), наименьшим его радиу-
Сопоставление рис. ХП.2 и ХП.З показывает, что электронное строение внешней оболочки атомов элементов следующих за неоном в точности повторяет строение атомов, предшествующих ему, т.
 е. второго периода. Так, натрий имеет во внешнем слое один электрон подобно литию. Химические свойства этих элементов сходны они являются активными одновалентными металла- [c.150]
е. второго периода. Так, натрий имеет во внешнем слое один электрон подобно литию. Химические свойства этих элементов сходны они являются активными одновалентными металла- [c.150] Не составляет труда записать волновое уравнение Шрёдингера для атома лития, состоящего из ядра и трех электронов, или атома урана, состоящего из ядра и 92 электронов. Однако, к сожалению, эти дифференциальные уравнения невозможно решить. Нет ничего утешительного в том, что строение атома урана в принципе может быть найдено путем расчетов, если математические (хотя отнюдь не физические) трудности препятствуют получению этого решения. Правда, физики и физикохимики разработали для решения уравнения Шрёдингера множество приближенных методов, основанных на догадках и последовательных приближениях. Проведение последовательных приближений существенно облегчается использованием электронно-вычислительных машин. Однако главное достоинство применения теории Шрёдингера к атому водорода заключается в том, что она позволяет получить ясную качественную картину электронного строения многоэлектронных атомов без проведения дополнительных расчетов.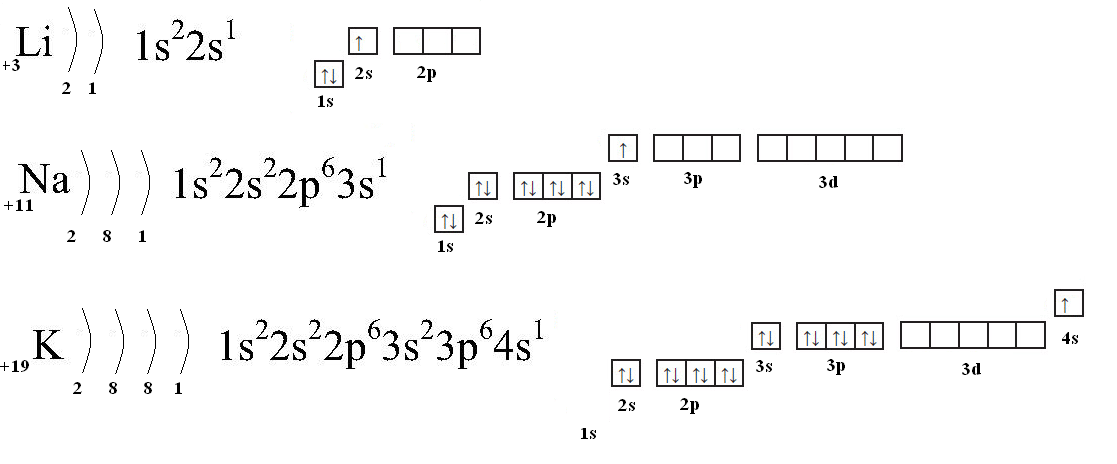
Для описания электронного строения атомов в основном состоянии часто применяется условное обозначение их электронной конфигурации группами символов п/, где п—главное квантовое число, указывающее энергетический уровень электрона, /—орбитальное квантовое число подуровня (вместо него обычно указывается соответствующий символ 5, р, 4 или а X — число электронов на данном подуровне. Например, электронное строение атома лития описывается конфигурацией 1.5 25 . Приведем еще не-
Рассматривая электронное строение атомов различных элементов в порядке возрастания их порядкового номера, мы убедились (с. 28), что атом водорода (1в ) одновалентен, тогда как валентность атома гелия (1з ) равна нулю. Валентность атома лития (ls 2s ) во всех соединениях равна единице, тогда как бериллий (18 2в ) становится двухвалентным благодаря переходу атома в возбужденное состояние (18 28 2р ). Это объясняется тем, что энергия, затрачиваемая на возбуждение атома, с избытком компенсируется при образовании
Это объясняется тем, что энергия, затрачиваемая на возбуждение атома, с избытком компенсируется при образовании
Эта энергетическая стабильность молекулы Lia связана с электронным строением атома лития Li(ls 2s ) или Li (K2s ) (здесь К—атомный остов, не принимающий участия в образовании МО). Образование молекулы можно в первом приближении схематически изобразить так [c.294]
Таким образом, электронную структуру всех рассмотренных элементов можно записать общей формулой п— 1)5 р /г5, которая не описывает электронное строение лишь атома лития, имеющего формулу п—1)52/15. Разница заключается в том, что, в отличие от всех других рассмотренных элементов, на предыдущем электронном слое атома лития находится два, а ие восемь электронов. На внешнем же электронном уровне число и характер электронов одни и те же — один электрон на 5-орбитали.
Формирование -слоя (п = 2) начинается с лития, у которого имеется три электрона. Два электрона, как у гелия, заполняют А -слой. Третий электрон лития не может находиться в этом слое, так как на 1 -орбитали электронных вакансий нет. Помещение третьего электрона на -орбиталь, максимальная электронная емкость которой равна двум, противоречило бы принципу Паули. У последнего элемента второго периода — неона — все я- и р-орбитали при и = 2 заполнены. Электронное строение атомов элементов в нормальном состоянии приведено в табл. 2. В ней квадратные скобки символизируют электронные структуры благородных газов, которые органически входят в строение атомов последующих элементов.
Два электрона, как у гелия, заполняют А -слой. Третий электрон лития не может находиться в этом слое, так как на 1 -орбитали электронных вакансий нет. Помещение третьего электрона на -орбиталь, максимальная электронная емкость которой равна двум, противоречило бы принципу Паули. У последнего элемента второго периода — неона — все я- и р-орбитали при и = 2 заполнены. Электронное строение атомов элементов в нормальном состоянии приведено в табл. 2. В ней квадратные скобки символизируют электронные структуры благородных газов, которые органически входят в строение атомов последующих элементов.
Литий имеет три электрона, два из которых находятся на уровне 15, а третий — на уровне 2 (п=2, /=0). Так как 25-электрон расположен гораздо дальше от ядра и частично экранирован двумя внутренними электронами от заряда ядра, равного +3, этот внешний электрон легко удалить и получить ион с электронным строением гелия. При переходе от лития к неону надо расположить восемь элементов этот ряд заканчивается неоном, который характеризуется устойчивой конфигурацией с восемью электронами (п=2).
Отсюда становится понятным принцип электронного строения атомов элементов периодической системы Менделеева. У самого легкого элемента — водорода — первая оболочка занята одним электроном. У следующего элемента — гелия — имеется два электрона, и, следовательно, первая оболочка занята полностью. С лития, имеющего три электрона, начинается заполнение второй оболочки, в которой может находиться 2-2 =8 электронов. Дальнейшее заполнение этой оболочки осуществляется в ряду элементов Ве, В, С, N. О, Р и заканчивается в элементе Ке. Далее начинается заполнение третьей оболочки, в которой может находиться 2-3 = 18 электронов, затем четвертой оболочки (2-4 =32 электрона) и т. д.
Щелочные металлы первой подгруппы имеют на внешней электронной оболочке по одному электрону и, следовательно, одновалентны.
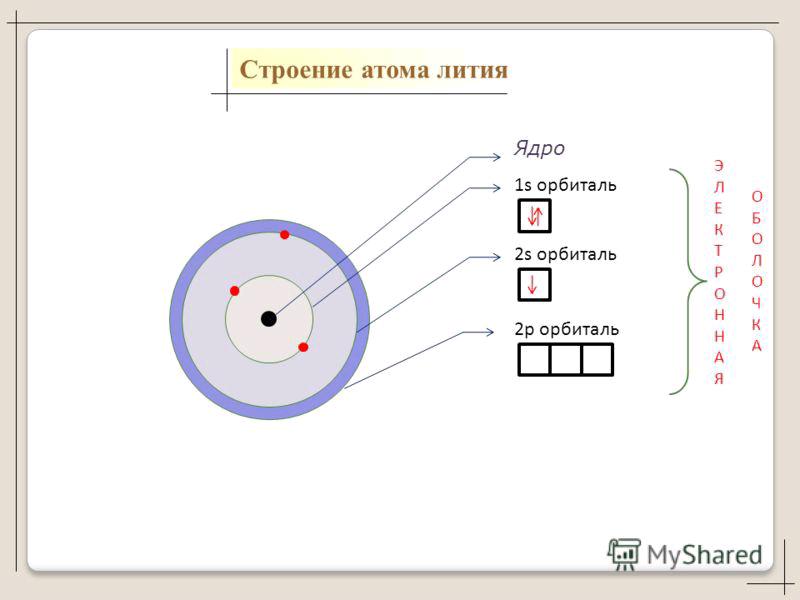
 Электронное строение лития показано на рисунке 58. [c.333]
Электронное строение лития показано на рисунке 58. [c.333]Далее рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2i) таково (см. рис. 1.33), что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания таких одиночных s-электронов можно ожидать образования молекулы Liz, аналогичной молекуле Нг. Действительно, молекула Уг существует. Энергия связи в молекуле Liz (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4.48 эВ). Это обусловлено наличием около ядра лития первого электронного слоя, из-за чего связь Li – Li значительно более длинная (267 пм), чем связь Н-Н (74 пм) кроме того, две пары электронов первого слоя в молекуле Liz сильно экранируют ядра и отталкиваются друг от друга. Все это приводит к значительному ослаблению связи Li – U. [c.87]
Согласно представлениям Гейтлера и Лондона, водород способен к образованию молекулы Нг потому, что в его атоме имеется один неспаренный электрон, а гелий не может образовать молекулу Нб2 ввиду того, что оба электрона в атоме Не являются спаренными. Аналогично рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) (рнс. 1.34) таково, что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания одиночных s-электронов можно ожидать образования молекулы LI2, аналогичной молекуле Нз. Действительно, молекула, LI2 существует. Энергия связи в молекуле Lis (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4,48 эВ). Это обусловлено наличием около ядра лития перв ого электронного слоя, поэтому связь Li —Li значительно более длин-” ная, чем связь Н—Н (267 пм вместо 74 пм в молекуле Нг) кроме того, две пары электронов первого слоя сильно экранируют заряд ядра и отталкипаются друг от друга. Все это приводит к значи- тельному ослаблению связи. [c.81]
Аналогично рассмотрим взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) (рнс. 1.34) таково, что в этом атоме имеется один неспаренный 25-электрон, поэтому за счет спаривания одиночных s-электронов можно ожидать образования молекулы LI2, аналогичной молекуле Нз. Действительно, молекула, LI2 существует. Энергия связи в молекуле Lis (1,03 эВ) приблизительно в четыре раза меньше энергии связи в молекуле Нг (4,48 эВ). Это обусловлено наличием около ядра лития перв ого электронного слоя, поэтому связь Li —Li значительно более длин-” ная, чем связь Н—Н (267 пм вместо 74 пм в молекуле Нг) кроме того, две пары электронов первого слоя сильно экранируют заряд ядра и отталкипаются друг от друга. Все это приводит к значи- тельному ослаблению связи. [c.81]
Гипотеза Григоровича. По мнению В. К. Григоровича, расположение атомов в твердых и жидких простых веществах определяется, в основном, их электронным строением [8]. В металлической решетке, где внешние электроны положительных ионов сильно возбуждены вследствие возмущающего действия соседних атомов, сравнительно небольшой прирост температуры может быть достаточным для наступления перекрытия и обменного взаимодействия внешних р оболочек ионов, не перекрывающихся при низких температурах ([8], стр. 202). Так, например, объемноцентрированная кубическая структура натрия, область существования которой простирается от 30 К до температуры плавления, по Григоровичу, может быть объяснена с помощью следующих соображений. Из экспериментальных данных (об оптических свойствах, эффекте Холла и т. д.) известно, что натрий в твердом и жидком состоянии имеет один электрон проводимости на атом. Это означает, что его валентный электрон с Зз уровня переходит в электронный газ. Атомы натрия в конденсированном состоянии имеют внешнюю 25 2р оболочку. Взаимодействие ионов с электронным газом приводит к сближению и перекрыванию р-орбиталей внешних р оболочек ионов, в результате чего возникают обменные / вухэлектронные о-связи, направленные по трем осям прямоугольных координат. Образование шести связей каждым атомом со своими соседями приводит к простой кубической ячейке со свободным объемом в центре, который может быть заполнен таким же ионом. Так, из двух простых кубических под-решеток, энергетически невыгодных, а потому редко реализующихся в металлах, образуется ОЦК структура, одна из трех типичных металлических структур.
202). Так, например, объемноцентрированная кубическая структура натрия, область существования которой простирается от 30 К до температуры плавления, по Григоровичу, может быть объяснена с помощью следующих соображений. Из экспериментальных данных (об оптических свойствах, эффекте Холла и т. д.) известно, что натрий в твердом и жидком состоянии имеет один электрон проводимости на атом. Это означает, что его валентный электрон с Зз уровня переходит в электронный газ. Атомы натрия в конденсированном состоянии имеют внешнюю 25 2р оболочку. Взаимодействие ионов с электронным газом приводит к сближению и перекрыванию р-орбиталей внешних р оболочек ионов, в результате чего возникают обменные / вухэлектронные о-связи, направленные по трем осям прямоугольных координат. Образование шести связей каждым атомом со своими соседями приводит к простой кубической ячейке со свободным объемом в центре, который может быть заполнен таким же ионом. Так, из двух простых кубических под-решеток, энергетически невыгодных, а потому редко реализующихся в металлах, образуется ОЦК структура, одна из трех типичных металлических структур. Гипотеза Григоровича иллюстрируется рис. 43. Точно так же обосновывается возникновение ОЦК структур и у других щелочных металлов. Для лития, ионы которого имеют 15 оболочку, возникновение ОЦК структуры связывается с предположением о переходе 8 электронов на р уровни. [c.175]
Гипотеза Григоровича иллюстрируется рис. 43. Точно так же обосновывается возникновение ОЦК структур и у других щелочных металлов. Для лития, ионы которого имеют 15 оболочку, возникновение ОЦК структуры связывается с предположением о переходе 8 электронов на р уровни. [c.175]
Лит. Григорович В. К. Периодический закон Менделеева и электронное строение металлов. М., 1966 Корнилов И. И. [и др.]. Метаплохимические свойства элементов периодической системы. М., 1966 О р м о н т Б. Ф. Современное содержание стехиометрических законов. Фазы и соединения переменного состава. Нестехиометрические соединения. В кн. Соединения переменного состава. Л., 1969 Сивертсен Д. М., Николь-с о н М. Е. Структура и свойства твердых растворов. Пер. с англ. М., 1964 Шуберт К. Объяснение химической связи пространственной корреляцией электронов. В кн. Интерметаллические соединения. Пер. с англ. М., 1970 Гольдшмидт X. Дж, Сплавы внедрения, в, 1. Пер. с англ. М., 1971 Тейлор К., Дарби М. Физика редкоземельных соединений. Пер. с англ. М., 1974. [c.487]
Пер. с англ. М., 1974. [c.487]
Из этой таблицы можно, в частности, видеть, что при одинаковом электронном строении анионы обладают большими размерами, чем катионы. Если взять ряд солей типа АБ, в которых анион Б остается неизменным, а размер катиона А последовательно увеличивается, то в таком ряду при достижении определенной величины отношения радиуса А к радиусу Б может произойти изменение структуры кристаллической решетки. Так, например, случае хлоридов щелочных металлов при достижении отношения радиуса катиона к радиусу аниона, равного 0,91, кристаллическая решетка типа Na l (в которой кристаллизуются хлориды лития, натрия и калия) ме1няется на тип s l (в которой кристаллизуется хлорид цезия). [c.14]
Ионная связь лития и кислорода. Схемы образования веществ с различным типом связи
Ответ на вопрос 5.
Элемент с порядковым номером 35 – это бром (Br). Заряд ядра его атома равен 35. Атом брома содержит 35 протонов, 35 электронов и 45 нейтронов.
§ 7 . Изменения в составе ядер атомов химических элементов. Изотопы
Ответ на вопрос 1.
Изотопы 40 19 K и40 18 Ar проявляют разные свойства, потому что имеют разный заряд ядра и разное количество электронов.
Ответ на вопрос 2.
Относительная атомная масса аргона близка к 40, т.к. в ядре его атома 18 протонов и 22 нейтрона, а в ядре атома калия 19 протонов и 20 нейтронов, поэтому его относительная атомная масса близка к 39. Так как число протонов в ядре атома калия больше, он стоит в таблице после аргона.
Ответ на вопрос 3.
Изотопы – это разновидности атомов одного элемента, имеющие одинаковое количество протонов и электронов и различное число нейтронов.
Ответ на вопрос 4.
Изотопы хлора схожи по свойствам, т.к. свойства определяются зарядом ядра, а не его относительной массой, даже при изменении относительной атомной массы изотопов хлора на 1 или 2 единицы масса изменяется незначительно, в отличие от изотопов водорода, где при добавлении одного или двух нейтронов масса ядра изменяется в 2 или 3 раза.
Ответ на вопрос 5.
Дейтериевая (тяжелая вода) – соединение, где 1 атом кислорода связан с двумя атомами изотопа водорода 2 1 D , формула D2 O. Сравнение свойств D2 O и Н2 О
Ответ на вопрос 6.
Вначале расположен элемент с большим значением относительной
атомной массы в парах:
Te-I (теллур-иод) 128 Te и127 I.
Th-Pa (торий-протактиний) 232 90 Th и231 91 Pa . U-Np (уран-нептуний) 238 92 U и237 93 Np .
§ 8 . Строение электронных оболочек атомов
Ответ на вопрос 1.
а) Al +13 | б) Р | в) О | |||||||
13 Al 2e– , 8e– , 3e– | 15 Р 2e– , 8e– , 5e– | 8 О 2e– , 6e– | |||||||
а) – схема строения атома алюминия; б) – схема строения атома фосфора; в) – схема строения атома кислорода.
Ответ на вопрос 2.
а) сравним строение атомов азота и фосфора.
7 N 2e– , 5e– | 15 Р 2e– , 8e– , 5e– | |||||
Cтроение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат 5 электронов. Однако у азота всего 2 энергетических уровня, а у фосфора их 3.
б) Сравним строение атомов фосфора и серы.
15 Р 2e– , 8e– , 5e– | 16 S 2e– , 8e– , 6e– | ||||||
Атомы фосфора и серы имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у фосфора на последнем энергетическом уровне 5 электронов, а у серы 6.
Ответ на вопрос 3.
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3. Число внешних электронов определяется номером группы и равно 4.
Ответ на вопрос 4.
Количество содержащихся в периоде элементов равно максимально возможному числу электронов на внешнем энергетическом уровне и это число определяется по формуле 2n2 , где n – номер периода.
Поэтому в первом периоде содержится только 2 элемента (2 12 ), а во втором периоде 8 элементов (2 22 ).
Ответ на вопрос 5.
В астрономии – Период вращения Земли вокруг своей оси 24 часа.
В географии – Смена сезонов с периодом 1 год.
В физике – Периодические колебания маятника.
В биологии – Каждая клетка дрожжей в оптимальных условиях раз в 20 мин. делится.
Ответ на вопрос 6.
Электроны и строение атома были открыты в начале XX века, чуть позже было написано это стихотворение, которое отражает во многом нуклеарную, или планетарную, теорию строения атома, а также автор допускает возможность, что и электроны тоже сложные частицы, строение которых мы еще просто не изучили.
Ответ на вопрос 7.
Приведенные в учебнике 2 четверостишия говорят об огромном поэтическом таланте В. Брюсова и гибком уме его, раз он мог так легко понять и принять все достижения современной ему науки, а также, по всей видимости, просвещенности и образованности в данной области.
§ 9 . Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
Ответ на вопрос 1.
а) Сравним строение и свойства атомов углерода и кремния
6 С 2e– , 4e– | 14 Si 2e– , 8e– , 4e– | ||||
По строению электронной оболочки эти элементы схожи: оба на последнем энергетическом уровне имеют по 4 электрона, но у углерода 2 энергетических уровня, а у кремния 3. Т.к. число электронов на внешнем уровне одинаково, то и свойства этих элементов будут похожи, но радиус атома кремния больше, поэтому по сравнению с углеродом он будет проявлять больше металлических свойств.
б) Сравним строение и свойства атомов кремния и фосфора:
14 Si 2e– , 8e– , 4e– | 15 Р 2e– , 8e– , 5e– | |||||
Атомы кремния и фосфора имеют по 3 энергетических уровня, причем у каждого последний уровень незавершенный, но у кремния на последнем энергетическом уровне 4 электрона, а у фосфора 5, поэтому радиус атома фосфора меньше и он в большей степени проявляет неметаллические свойства, чем кремний.
Ответ на вопрос 2.
а) Рассмотрим схему образования ионной связи между алюминием и кислородом.
1. Алюминий – элемент главной подгруппы III группы, металл. Его атому легче отдать 3 внешних электрона, чем принять недостающие
Al0 – 3e– → Al+ 3
2. Кислород – элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.
O0 + 2e– → О− 2
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 6(3 2). Чтобы атомы Al отдали 6
электронов, их нужно взять 2(6:3), чтобы атомы кислорода смогли принять 6 электронов, их нужно взять 3(6:2).
4. Схематично образование ионной связи между атомами алюминия и кислорода можно записать так:
2Al0 + 3O0 → Al2 +3 O3 –2 → Al2 O3
6e–
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
1. Литий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
Li0 – 1e– → Li+ 1
2. Фосфор – элемент главной подгруппы V группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения вешнего уровня, чем отдать 5 электронов:
Р0 + 3e– → Р− 3
3.
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3 1). Чтобы атомы лития отдали
Чтобы атомы лития отдали
3 электронов, их нужно взять 3(3:1), чтобы атомы фосфора смогли принять 5 электронов, нужно взять только 1 атом (3:3).
4. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
3Li0 – + P0 → Li3 +1 P–3 → Li3 P
в) Рассмотрим схему образования ионной связи между атомами магния и фтора.
1. Магний – элемент II группы главной подгруппы, металл. Его атому легче отдать 2 внешних электрона, чем принять недостающие
Mg0 – 2e– → Mg+ 2
2. Фтор – элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов:
F0 + 1e– → F− 1
3. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2 1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
4. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
Mg0 +– 2F0 → Mg+2 F2 –1 → MgF2
Ответ на вопрос 3.
Самые типичные металлы расположены в периодической системе
в начале периодов и в конце групп, таким образом, самым типичным металлом является франций (Fr). Типичные неметаллы расположены
в конце периодов и в начале групп. Таким образом, самый типичный неметалл фтор (F). (Гелий не проявляет каких-либо химических свойств).
Ответ на вопрос 4.
Инертные газы стали называть благородными, так же как и металлы, потому что в природе они встречаются исключительно в свободном виде и с большим трудом образуют химические соединения.
Ответ на вопрос 5.
Выражение «Улицы ночного города были залиты неоном» химически неверно, т.к. неон – инертный, малораспространенный газ, в воздухе его содержится очень мало. Однако неоном заполняют неоновые лампы и лампы дневного света, которые часто используются для подсветки вывесок, афиш, реклам ночью.
§ 10 . Взаимодействие атомов элементов-неметаллов между собой
Ответ на вопрос 1.
Электронная схема образования двухатомной молекулы галогена будет выглядеть так:
а + а→ аа
А структурная формула
Ответ на вопрос 2.
а) Схема образования химической связи для AlCl3 :
Алюминий – элемент III группы. Его атому легче отдать 3 внешних электрона, чем принять недостающие 5.
Al° – 3 e→ Al+3
Хлор – элемент VII группы. Его атому легче принять 1 электрон, которого не хватает до завершения внешнего уровня, чем отдать 7 электронов.
Сl° + 1 e → Сl–1
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3:1). Чтобы атомы алюминия отдали 3 электрона надо взять только 1 атом (3:3), чтобы атомы хлора смогли принять 3 электрона, их нужно взять 3(3:1)
Al° + 3Сl° → Al+3 Cl–1 → AlСl3
3 e –
Связь между атомами металла и неметалла носит ионный характер. б) Схема образования химической связи для Cl2 :
Хлор – элемент главной подгруппы VII группы. Его атомы имеют 7 электронов на внешнем уровне. Число непарных электронов равно
Связь между атомами одного и того же элемента ковалентна.
Ответ на вопрос 3.
Сера – элемент главной подгруппы VI группы. Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно (8–6)2. В молекулах S2
атомы связаны двумя общими электронными парами, поэтому связь двойная.
Ее атомы имеют 6 электронов на внешнем уровне. Число непарных электронов равно (8–6)2. В молекулах S2
атомы связаны двумя общими электронными парами, поэтому связь двойная.
Схема образования молекулы S2 будет выглядеть следующим образом:
Ответ на вопрос 4.
В молекуле S2 связь двойная, в молекуле Cl связь одинарная, в молекуле N2 – тройная. Поэтому самой прочной молекулой будет N2 , менее прочной S2 , а еще слабее Cl2 .
Длина связи самая маленькая в молекуле N2 , больше в молекуле S2 , еще больше в молекуле Cl2 .
§ 11 . Ковалентная полярная химическая связь
Ответ на вопрос 1.
Так как значения ЭО водорода и фосфора одинаковы, то химическая связь в молекуле Ph4 будет ковалентной неполярной.
Ответ на вопрос 2.
1. а) в молекуле S2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи будет следующей:
Сера – элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке.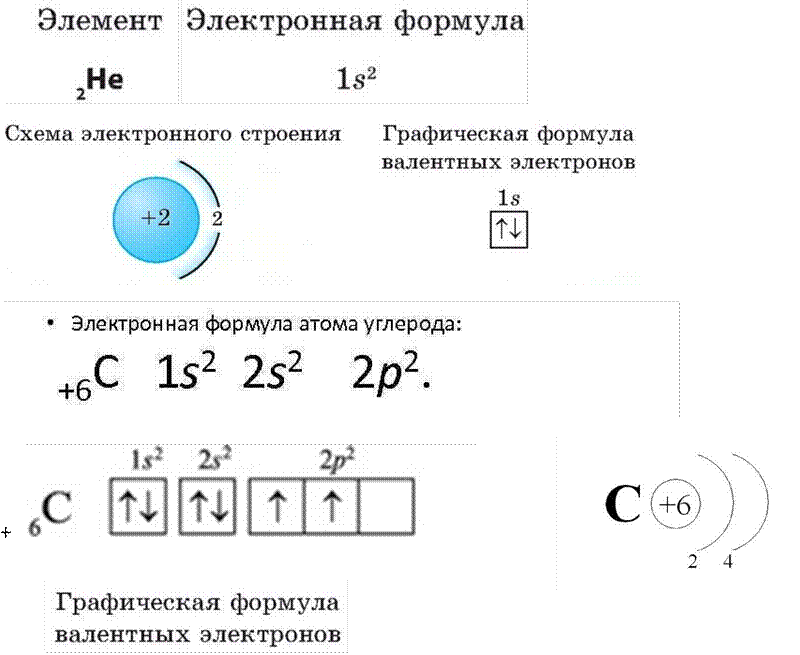 Непарных электронов будет: 8 – 6 = 2.
Непарных электронов будет: 8 – 6 = 2.
Обозначим внешние электроны S
б) в молекуле K2 O связь ионная, т.к. она образована атомами элементов металла и неметалла.
Калий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
K0 – 1e– → K+ 1
Кислород – элемент главной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, которых не хватает до завершения уровня, чем отдать 6 электронов:
O0 + 2e– → O− 2
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2 1). Чтобы атомы калия отдали 2 электрона, их нужно взять 2, чтобы атомы кислорода смогли принять 2 электрона, необходим только 1 атом:
2K2e 0 – + O0 → K2 +1 O–2 → K2 O
в) в молекуле h3 S связь ковалентная полярная, т.к. она образована атомами элементов с различной ЭО. Схема образования связи будет следующей:
Сера – элемент главной подгруппы VI группы. Ее атомы имеют по 6 электронов на внешней оболочке.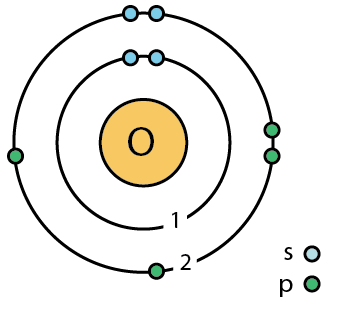 Непарных электронов будет: 8– 6=2.
Непарных электронов будет: 8– 6=2.
Водород – элемент главной подгруппы I группы. Его атомы содержат по 1 электрону на внешней оболочке. Непарным является 1 электрон (для атома водорода завершенным является двухэлектронный уровень). Обозначим внешние электроны:
Общие электронные пары смещены к атому серы, как более электроотрицательному
H δ+→ S 2 δ−← H δ+
1. а) в молекуле N2 связь ковалентная неполярная, т.к. она образована атомами одного и того же элемента. Схема образования связи следующая:
Азот – элемент главной подгруппы V группы. Его атомы имеют 5 электронов на внешней оболочке. Непарных электронов: 8 – 5 = 3.
Обозначим внешние электроны: N
N ≡ N
б) в молекуле Li3 N связь ионная, т.к. она образована атомами элементов металла и неметалла.
Литий – элемент главной подгруппы I группы, металл. Его атому легче отдать 1 электрон, чем принять недостающие 7:
Li0 – 1e– → Li+ 1
Азот – элемент главной подгруппы V группы, неметалл. Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
Его атому легче принять 3 электрона, которых не хватает до завершения внешнего уровня, чем отдать пять электронов с внешнего уровня:
N0 + 3e– → N− 3
Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3(3 1). Чтобы атомы лития отдали 3 электрона, необходимо 3 атома, чтобы атомы азота смогли принять 3 электрона, необходим только один атом:
3Li0 + N0 → Li3 +1 N–3 → Li3 N
3e–
в) в молекуле NCl3 связь ковалентная полярная, т.к. она образована атомами элементов-неметаллов с различными значениями ЭО. Схема образования связи следующая:
Азот – элемент главной подгруппы V группы. Его атомы имеют по 5 электронов на внешней оболочке. Непарных электронов будет: 8– 5=3.
Хлор – элемент главной подгруппы VII группы. Его атомы содержат по 7 электронов на внешней оболочке. Непарным остается
Данный урок посвящен обобщению и систематизации знаний о видах химической связи. В процессе урока будут рассмотрены схемы образования химической связи в различных веществах.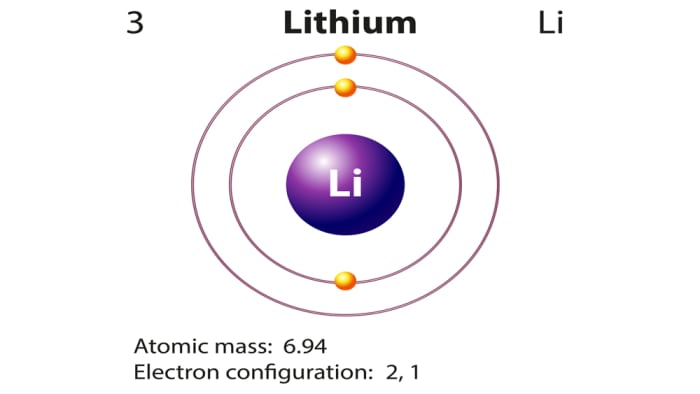 Урок поможет закрепить умение определять вид химической связи в веществе по его химической формуле.
Урок поможет закрепить умение определять вид химической связи в веществе по его химической формуле.
Тема: Химическая связь. Электролитическая диссоциация
Урок: Схемы образования веществ с различным типом связи
Рис. 1. Схема образования связи в молекуле фтора
Молекула фтора состоит из двух атомов одного химического элемента-неметалла с одинаковой электроотрицательностью, следовательно, в этом веществе реализуется ковалентная неполярная связь. Изобразим схему образования связи в молекуле фтора. Рис. 1.
Вокруг каждого атома фтора с помощью точек нарисуем семь валентных, то есть внешних, электронов. До устойчивого состояния каждому атому необходим еще один электрон. Таким образом, образуется одна общая электронная пара. Заменив ее черточкой, изобразим графическую формулу молекула фтора F-F.
Вывод: ковалентная неполярная связь образуется между молекулами одного химического элемента-неметалла. При таком типе химической связи образуются общие электронные пары, которые в равной степени принадлежат обоим атомам, то есть не происходит смещения электронной плотности ни к одному из атомов химического элемента
Рис. 2. Схема образования связи в молекуле воды
2. Схема образования связи в молекуле воды
Молекула воды состоит из атомов водорода и кислорода – двух элементов-неметаллов с разными значениями относительной электроотрицательности, следовательно, в этом веществе – ковалентная полярная связь.
Так как кислород – более электроотрицательный элемент, чем водород, общие электронные пары смещаются в сторону кислорода. На атомах водорода возникает частичный заряд, а на атоме кислорода – частичный отрицательный. Заменив обе общие электронные пары черточками, а точнее стрелками, показывающими смещение электронной плотности, запишем графическую формулу воды Рис. 2.
Вывод: ковалентная полярная связь возникает между атомами разных элементов-неметаллов, то есть с разными значениями относительной электроотрицательности. При этом типе связи образуются общие электронные пары, которые смещаются в сторону более электроотрицательного элемента .
1. №№ 5,6,7 (с.145) Рудзитис Г.Е. Неорганическая и органическая химия. 8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
8 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. М.: Просвещение. 2011 г.176с.:ил.
2. Укажите частицу с наибольшим и наименьшим радиусом: атом Ar, ионы: K + , Ca 2+ , Cl – .Ответ обоснуйте.
3. Назовите три катиона два аниона, которые имеют такую же электронную оболочку, что и ион F – .
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока :
- Сформировать понятие об химических связях на примере ионной связи. Добиться понимания образования ионной связи как крайнего случая полярной.
- Обеспечить в ходе урока усвоение следующих основных понятий: ионы (катион, анион), ионная связь.
- Развивать умственную деятельность учащихся через создание проблемной ситуации при изучении нового материала.

Задачи:
- научить распознавать виды химической связи;
- повторить строение атома;
- исследовать механизм образования ионной химической связи;
- научить составлять схемы образования и электронные формулы ионных соединений, уравнения реакций с обозначением перехода электронов.
Оборудование : компьютер, проектор, мультимедийный ресурс, периодическая система химических элементов Д.И. Менделеева, таблица «Ионная связь».
Тип урока: Формирование новых знаний.
Вид урока: Мультимедиа урок.
Х од урока I. Организационный момент . II. Проверка домашнего задания .Учитель: Как атомы могут принимать устойчивые электронные конфигурации? Каковы cпособы образования ковалентной связи?
Ученик: Полярная и неполярная ковалентные связи образованы по обменному механизму. К обменному механизму относят случаи, когда в образовании электронной пары от каждого атома участвует по одному электрону. Например, водород: (слайд 2)
Например, водород: (слайд 2)
Связь возникает благодаря образованию общей электронной пары за счет объединения неспаренных электронов. У каждого атома есть по одному s-электрону. Атомы Н равноценны и пары одинаково принадлежат обоим атомам. Поэтому же принципу происходит образование общих электронных пар (перекрывание р-электронных облаков) при образовании молекулы F 2 . (слайд 3)
Запись H· означает, что у атома водорода на внешнем электронном слое находится 1 электрон. Запись показывает, что на внешнем электронном слое атома фтора находится 7 электронов.
При образовании молекулы N 2 . Образуются 3 общие электронные пары. Перекрываются р-орбитали. (слайд 4)
Связь называется неполярная.
Учитель: Мы сейчас рассмотрели случаи, когда образуются молекулы простого вещества. Но вокруг нас множество веществ, сложного строения. Возьмем молекулу фтороводорода. Как в этом случае происходит образование связи?
Ученик: При образовании молекулы фтороводорода перекрывается орбиталь s-электрона водорода и орбиталь р-электрона фтора Н-F.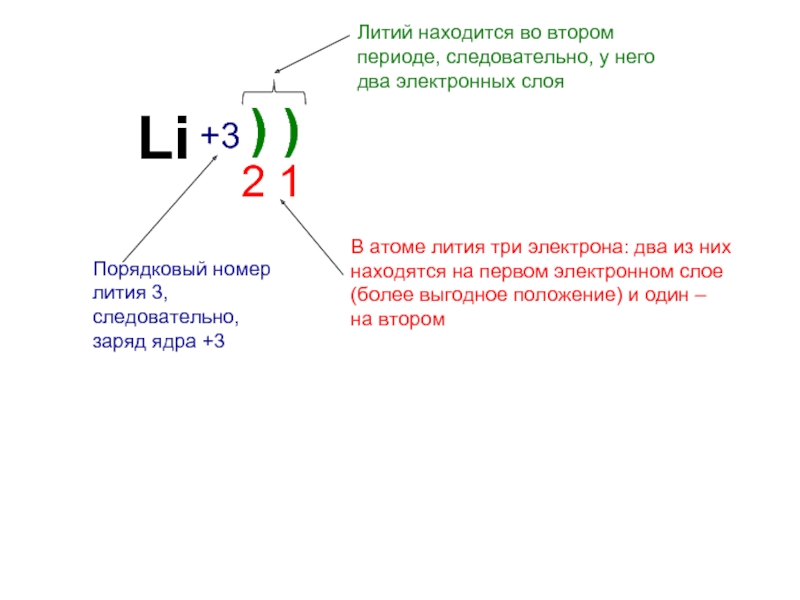 (слайд 5)
(слайд 5)
Связывающая электронная пара смещена к атому фтора, в результате чего образуется диполь . Связь называется полярная .
III. Актуализация знаний .Учитель: Химическая связь возникает вследствие изменений, которые происходят с наружными электронными оболочками соединяющихся атомов. Это возможно потому, что наружные электронные слои не завершены у элементов, кроме инертных газов. Химическая связь объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную конфигурации «ближайшего» к ним инертного газа.
Учитель: Записать схему электронного строения атома натрия (у доски). (слайд 6)
Ученик: Атому натрия для достижения устойчивости электронной оболочки необходимо либо отдать один электрон, либо принять семь. Натрий легко отдаст свой далекий от ядра и слабо связанный с ним электрон.
Учитель: Составить схему отдачи электрона.
Nа° – 1ē → Nа+ = Ne
Учитель: Записать схему электронного строения атома фтора (у доски).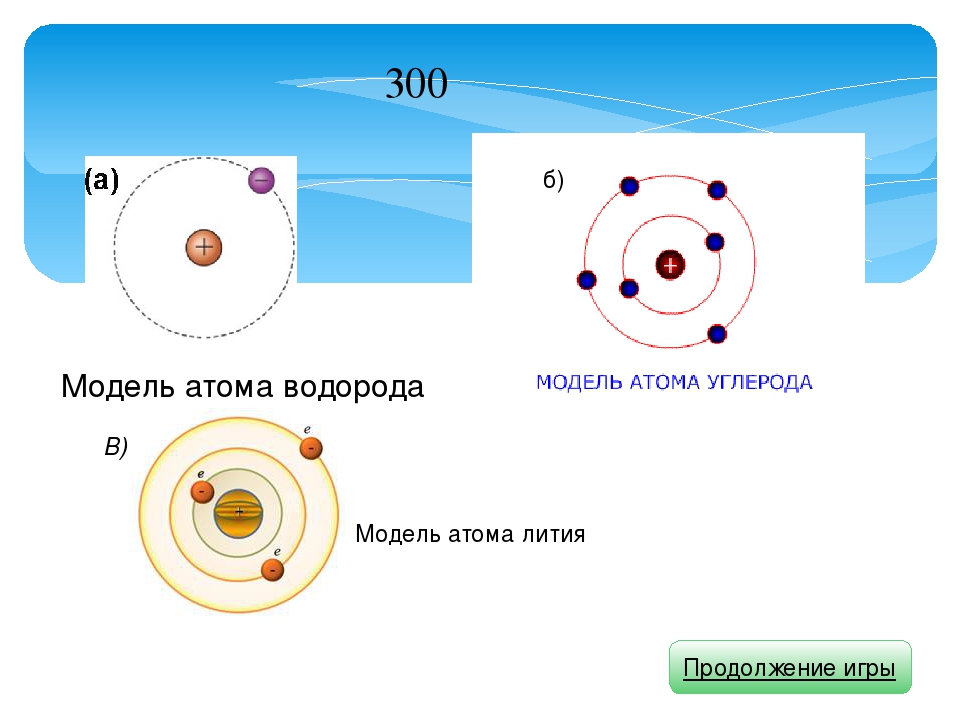
Учитель: Как добиться завершения заполнения электронного слоя?
Ученик: Атому фтора для достижения устойчивости электронной оболочки необходимо либо отдать семь электронов, либо принять один. Энергетически выгоднее фтору принять электрон.
Учитель: Составить схему приема электрона.
F° + 1ē → F- = Ne
IV. Изучение нового материал.Учитель обращается с вопросом к классу, в котором ставится задача урока:
Возможны ли другие варианты, при которых атомы могут принимать устойчивые электронные конфигурации? Каковы пути образования таких связей?
Сегодня мы рассмотрим один из видов связей – ионную связь. Сопоставим строение электронных оболочек уже названных атомов и инертных газов.
Беседа с классом.
Учитель: Какой заряд имели атомы натрия и фтора до реакции?
Ученик: Атомы натрия и фтора электронейтральны, т.к. заряды их ядер уравновешиваются электронами, вращающимися вокруг ядра.
Учитель: Что происходит между атомами при отдаче и принятии электронов?
Ученик: Атомы приобретают заряды.
Учитель дает пояснения: В формуле иона дополнительно записывают его заряд. Для этого используют верхний индекс. В нем цифрой указывают величину заряда (единицу не пишут), а потом – знак (плюс или минус). Например, ион Натрия с зарядом +1 имеет формулу Na + (читается «натрий-плюс»), ион Фтора с зарядом -1 – F – («фтор-минус»), гидроксид-ион с зарядом -1 – ОН – («о-аш-минус»), карбонат-ион с зарядом -2 – CO 3 2- («цэ-о-три-два-минус»).
В формулах ионных соединений сначала записывают, не указывая зарядов, положительно заряженные ионы, а потом – отрицательно заряженные. Если формула правильная, то сумма зарядов всех ионов в ней равна нулю.
Положительно заряженный ионназывается катионом ,аотрицательно заряженный ион- анионом.
Учитель: Записываем определение в рабочие тетради:
Ион – это заряженная частица, в которую превращается атом в результате принятия или отдачи электронов.
Учитель: Как определить величину заряда иона кальция Ca 2+ ?
Ученик: Ио́н – электрически заряженная частица, образующаяся в результате потери или присоединения одного или нескольких электронов атомом. У кальция на последнем электронном уровне находятся два электрона, ионизация атома кальция происходит при отдаче двух электронов. Ca 2+ – двухзарядный катион.
У кальция на последнем электронном уровне находятся два электрона, ионизация атома кальция происходит при отдаче двух электронов. Ca 2+ – двухзарядный катион.
Учитель: Что происходит с радиусами этих ионов?
При переходе электронейтрального атома в ионное состояние размер частицы сильно изменяется. Атом, отдавая свои валентные электроны, превращается при этом в более компактную частицу – катион. Например, при переходе атома натрия в катион Na+, имеющий, как указано выше, структуру неона, радиус частицы сильно уменьшается. Радиус аниона всегда больше радиуса соответствующего электронейтрального атома.
Учитель: Что происходит с разноименно заряженными частицами?
Ученик: Разноименно заряженные ионы натрия и фтора, возникающие в результате перехода электрона от атома натрия к атому фтора, взаимно притягиваются и образуют фторид натрия. (слайд 7)
Nа + + F – = NаF
Рассмотренная нами схема образования ионов показывает, как между атомом натрия и атомом фтора образуется химическая связь, которую называют ионной.
Ионная связь – химическая связь, образованная электростатическим притяжением друг к другу разноименно заряженных ионов.
Соединения, которые при этом образуются, называют ионными соединениями.
V. Закрепление нового материала .Задания для закрепления знаний и умений
1. Сравните строение электронных оболочек атома кальция и катиона кальция, атома хлора и хлорид – аниона:
Прокомментируйте схему образования ионной связи в хлориде кальция:
2. Для выполнения данного задания необходимо разделиться на группы по 3–4 человека. Каждый участник группы рассматривает один пример и результаты представляет всей группе.
Ответ учащихся:
1. Кальций – это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:
2. Хлор – это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2×1). Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, то есть надо взять один атом Са и два атома CI.
Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2 (2×1). Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, то есть надо взять один атом Са и два атома CI.
4. Схематично образование ионной связи между атомами кальция и хлора можно записать: (слайд 8)
Са 2+ + 2СI – → СаСI 2
Задания для самоконтроля
1. На основе схемы образования химического соединения составьте уравнение химической реакции: (слайд 9)
2. На основе схемы образования химического соединения составьте уравнение химической реакции: (слайд 10)
3. Дана схема образования химического соединения: (слайд 11)
Выберите пару химических элементов, атомы которых могут взаимодействовать в соответствии с этой схемой:
а) Na и O ;
б) Li и F ;
в) K и O ;
г) Na и F
Часть I
1. Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:
Атомы металлов, отдавая внешние электроны, превращаются в положительные ионы:
где n – число электронов внешнего слоя атома, соответствующее номеру группы химического элемента.
2. Атомы неметаллов, принимая электроны, недостающие до завершения внешнего электронного слоя , превращаются в отрицательные ионы:
3. Между разноимённо заряженными ионами возникает связь, которая называется ионной.
4. Дополните таблицу «Ионная связь».
Часть II
1. Дополните схемы образования положительно заряженных ионов. Из букв, соответствующих правильным ответам, вы составите название одного из древнейших природных красителей: индиго.
2. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы веществ с ионной химической связью.
3. Верны ли следующие утверждения?
3) верно только Б
4. Подчеркните пары химических элементов, между которыми образуется ионная химическая связь.
1) калий и кислород
3) алюминий и фтор
Составьте схемы образования химической связи между выбранными элементами.
5. Придумайте рисунок в стиле комиксов, отражающий процесс образования ионной химической связи.
6. Составьте схему образования двух химических соединений с ионной связью по условной записи:
Выберите химические элементы «А» и «Б» из следующего списка:
кальций, хлор, калий, кислород, азот, алюминий, магний, углерод, бром.
Подходят для данной схемы кальций и хлор, магний и хлор, кальций и бром, магний и бром.
7. Напишите небольшое литературное произведение (эссе, новеллу или стихотворение) об одном из веществ с ионной связью, которое человек применяет в быту или на производстве. Для выполнения задания используйте возможности Интернета.
Хлорид натрия – вещество с ионной связью, без него нет жизни, хотя, когда его много – это тоже нехорошо. Даже есть такая народная сказка, где рассказывается о том, что принцесса любила своего отца короля так сильно, как соль, за что была изгнана из королевства. Но, когда король однажды попробовал еду без соли и понял, что есть невозможно, он тогда понял, что дочь его очень сильно любила. Значит, соль – есть жизнь, но её потребление должно быть в
Но, когда король однажды попробовал еду без соли и понял, что есть невозможно, он тогда понял, что дочь его очень сильно любила. Значит, соль – есть жизнь, но её потребление должно быть в
меру. Потому что чрезмерное потребление соли сильно вредит здоровью. Избыток соли в организме приводит к заболеванию почек, меняет цвет кожи, задерживает излишнюю жидкость в организме, что приводит к отёкам и нагрузке на сердце. Поэтому, надо контролировать потребление соли. 0,9% раствор хлорида натрия – это физиологический раствор, используется для вливания лекарств в организм. Поэтому, очень трудно ответить на вопрос: полезна или вредна соль? Она нам нужна в меру.
Лови ответ.
а) Рассмотрим схему образования ионной связи между натрием и
кислородом.
1. Натрий – элемент главной подгруппы I группы, металл. Его атомму легче отдать I внешний электрон, чем принять недостающие 7:
2. Кислород- элемент главной подгруппы VI группы, неметалл.
Его атому легче принять 2 электрона, которых не хватает до завершения внешнего уровня, чем отдать 6 электронов с внешнего уровня.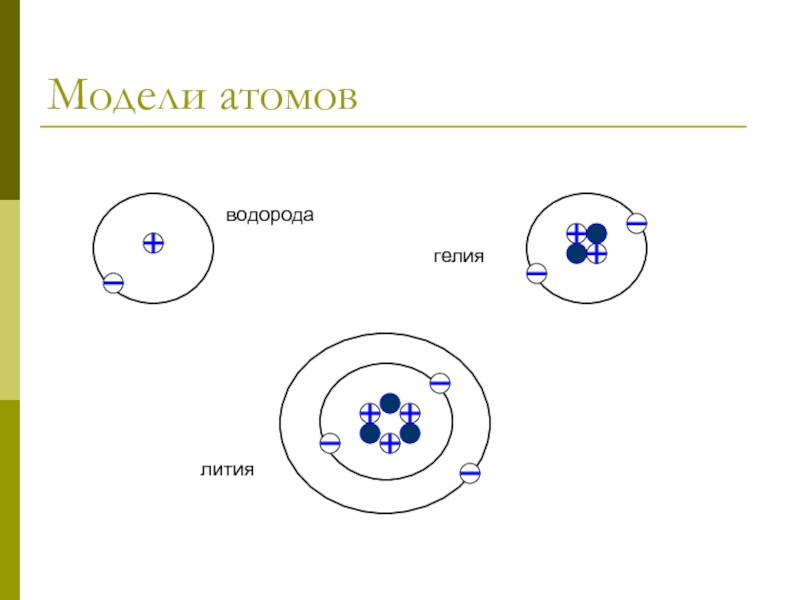
3. Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы Naотдали 2 электрона, их надо взять 2(2:1), чтобы атомы кислорода смогли принять 2 электрона, их нужно взять 1.
4. Схематично образование ионной связи между атомами натрия и кислорода можно записать так:
б) Рассмотрим схему образования ионной связи между атомами лития и фосфора.
I. Литий – элемент I группы главной подгруппы, металл. Его атому легче отдать 1 внешний электрон, чем принять недостающие 7:
2. Хлор- элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, чем отдать 7 электронов:
2. Наименьшее общее кратное 1, т.е. чтобы 1 атом лития отдал, а атом хлора принял 1 электрон, надо взять их по одому.
3. Схематично образование ионной связи между атомами лития и хлора можно записать так:
в) Рассмотрим схему образования ионной связи между атомами
магния и фтора.
1. Магний- элемент II группы главной подгруппы, металл. Его
Его
атому легче отдать 2 внешних электрона, чем принять недостающие 6:
2. Фтор – элемент главной подгруппы VII группы, неметалл. Его
атому легче принять 1 электрон, которого не хватает до завершения вешнего уровня, чем отдать 7 электронов:
2. Найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2∙1). Чтобы атомы магния отдали 2 электрона, нужен только один атом, чтобы атомы фтора смогли принять 2 электрона, их нужно взять 2(2:1).
3. Схематично образование ионной связи между атомами лития и фосфора можно записать так:
Ответы | § 35. Характеристика химического элемента по его положению в периодической системе — Химия, 8 класс
а) Литий
1) Название химического элемента – литий, химический знак Li, относительная атомная масса 7.
2) Атомный (порядковый) номер в периодической системе 3, элемент 2-го периода (малого), IA-группы (главной).
3) Заряд ядра атома 3+ , оно содержит 3 прогона; в ядре нуклида 37Li\mathrm{^7_3Li}37Li 4 нейтрона. -}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
-}.7N2e−,5e−. На внешнем (незавершенном) слое — пять электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества N2\mathrm{N_2}N2.
5) Валентность азота в высшем оксиде равна V, так как это элемент V группы. Валентность в летучем водородном соединении равна III.
6) Формула высшего оксида — N2O5\mathrm{N_2O_5}N2O5. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, предел являет собой кислоту HNO3\mathrm{HNO_3}HNO3.
7) Формула летучего водородного соединения — Nh4\mathrm{NH_3}Nh4.
в) Алюминий
1) Название химического элемента — алюминий, химический знак Al, относительная масса 27.
2) Атомный (порядковый) номер в периодической системе 13, элемент 3-го периода (малого), IIIA-группы (главной).
3) Заряд ядра атома 13+, оно содержит 13 протонов; в ядре нуклида 1327Al  14\mathrm{_{13}^{27}Al\,\, 14}1327Al14 нейтронов. -.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
-.}17Cl2e−,8e−,7e−. На внеш нем (незавершенном) слое семь электронов.
4) Элемент относится к группе неметаллов. Его простое вещество при обычных условиях находится в газообразном агрегатном состоянии. Формула простого вещества — Cl2\mathrm{Cl_2}Cl2.
5) Валентность хлора в высшем оксиде равна VII, так как это элемент VII-А группы. Валентность в летучем водородном соединении равна I.
6) Формула высшего оксида — Cl2O7\mathrm{Cl_2O_7}Cl2O7. Он принадлежит к кислотным оксидам. Гидроксид, соответствующий ему, представляет собой кислоту — HClO4\mathrm{HClO_4}HClO4.
7) Формула летучего водородного соединения — HCl\mathrm{HCl}HCl.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно.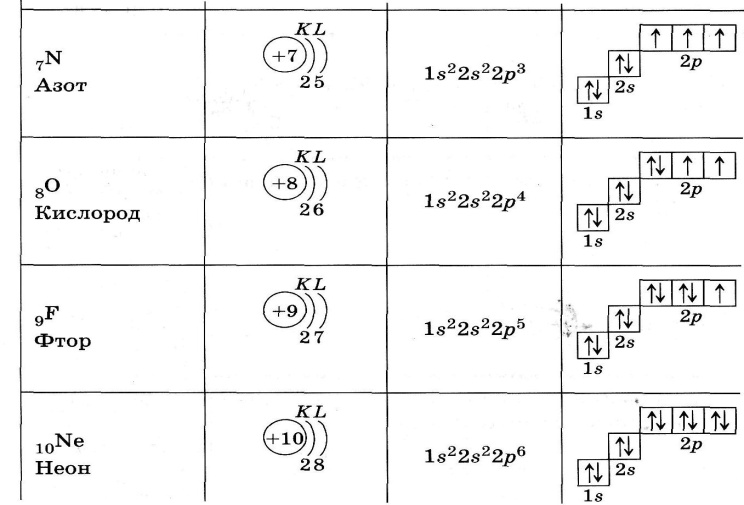 Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.
 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Скрытый структурный и химический порядок контролирует перенос лития в катионно-разупорядоченных оксидах для аккумуляторных батарей
Оливетти, Э.А., Седер, Г., Гаустад, Г.Г. критические металлы. Дж 1 , 229–243 (2017).
Артикул Google Scholar
Менг, Ю. С. и Арройо-де Домпабло, М.E. Последние достижения в первых принципах вычислительного исследования катодных материалов для литий-ионных аккумуляторов. Согл. хим. Рез. 46 , 1171–1180 (2012).
Согл. хим. Рез. 46 , 1171–1180 (2012).
ПабМед Статья Google Scholar
Lee, J. et al. Раскрытие потенциала катионно-разупорядоченных оксидов для перезаряжаемых литиевых батарей. Наука 343 , 519–522 (2014).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google Scholar
Урбан, А., Ли, Дж. и Седер, Г. Конфигурационное пространство оксидов типа каменной соли для электродов литиевых батарей большой емкости. Доп. Энергия Матер. 4 , 1400478 (2014).
Артикул Google Scholar
Yabuuchi, N. et al. Электродные материалы большой емкости для литиевых аккумуляторов: система на основе Li 3 NbO 4 с катионно-разупорядоченной структурой каменной соли. Проц. Натл акад. науч.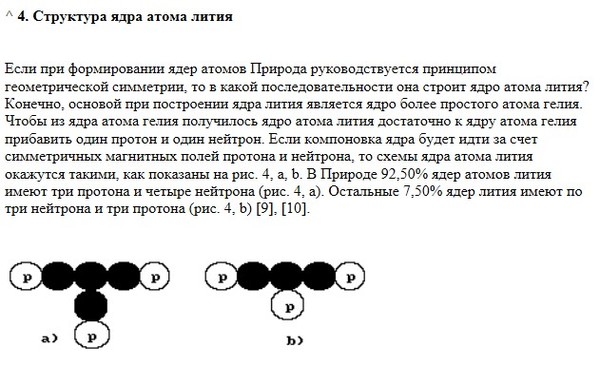 США 112 , 7650–7655 (2015).
США 112 , 7650–7655 (2015).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google Scholar
Yabuuchi, N. et al. Происхождение стабилизации и дестабилизации в твердофазной окислительно-восстановительной реакции ионов оксида для литий-ионных аккумуляторов. Нац. коммун. 7 , 13814 (2016).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google Scholar
Ли, Дж.и другие. Новый класс катионно-разупорядоченных оксидов большой емкости для литиевых аккумуляторов: оксиды Li–Ni–Ti–Mo. Энергетика Окружающая среда. науч. 8 , 3255–3265 (2015).
КАС Статья Google Scholar
Фрейре, М. и др. Новое активное соединение Li–Mn–O для литий-ионных аккумуляторов с высокой плотностью энергии. Нац. Матер. 15 , 173 (2016).
Матер. 15 , 173 (2016).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google Scholar
Чен Р.и другие. Определение окислительно-восстановительной активности катионно-разупорядоченных оксидных катодов Li–Fe–V–Ti для литий-ионных аккумуляторов. Физ. хим. хим. физ. 18 , 7695–7701 (2016).
КАС пабмед Статья Google Scholar
Чен Р. и др. Неупорядоченный богатый литием оксифторид как стабильный носитель для улучшенного хранения интеркаляции Li + . Доп. Энергия Матер. 5 , 1401814 (2015).
Артикул Google Scholar
Такеда, Н.и другие. Обратимое хранение Li для наноразмерных катион/анион-неупорядоченных оксифторидов каменной соли: LiMoO 2– x LiF (0 ≤ x ≤ 2) бинарная система. Дж. Источники питания 367 , 122–129 (2017).
Дж. Источники питания 367 , 122–129 (2017).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Lee, J. et al. Уменьшение потери кислорода для улучшения характеристик циклирования катодных материалов с высокой емкостью, неупорядоченных по катионам. Нац.коммун. 8 , 981 (2017).
ОБЪЯВЛЕНИЕ пабмед ПабМед Центральный Статья Google Scholar
House, R. A. et al. Оксифторид лития-марганца как новый катодный материал, проявляющий окислительно-восстановительный потенциал кислорода. Энергетика Окружающая среда. науч. 11 , 926–932 (2018).
КАС Статья Google Scholar
Lee, J. et al. Обратимый двойной окислительно-восстановительный потенциал Mn 2+ /Mn 4+ в катодных материалах с избытком лития. Природа 556 , 185 (2018).
Природа 556 , 185 (2018).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google Scholar
Ван дер Вен, А. и Седер, Г. Механизмы диффузии лития в слоистых интеркаляционных соединениях. J. Источники питания 97 , 529–531 (2001).
ОБЪЯВЛЕНИЕ Google Scholar
Канг К. и Седер Г. Факторы, влияющие на подвижность лития в слоистых оксидах переходных металлов лития. Физ. Ред. B 74 , 094105 (2006 г.).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Канг К., Менг Ю.С., Брегер Дж., Грей С.П. и Седер Г. Электроды высокой мощности и большой емкости для перезаряжаемых литиевых батарей. Наука 311 , 977–980 (2006).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google Scholar
Ружье, А., Gravereau, P. & Delmas, C. Оптимизация состава электродных материалов Li 1− z Ni 1+ z O 2 : структурные, магнитные и электрохимические исследования. Дж. Электрохим. соц. 143 , 1168–1175 (1996).
КАС Статья Google Scholar
Ван дер Вен, А., Бхаттачарья, Дж. и Белак, А.А. Понимание диффузии лития в интеркаляционных соединениях лития. Согл. хим. Рез. 46 , 1216–1225 (2012).
ПабМед Google Scholar
Урбан А., Сео Д.-Х. и Седер, Г. Вычислительное понимание литий-ионных аккумуляторов. нпдж Вычисл. Матер. 2 , 16002 (2016).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Вен С.Дж. и Хаггинс Р.А. Химическая диффузия в промежуточных фазах в системе литий-кремний. J. Solid State Chem. 37 , 271–278 (1981).
J. Solid State Chem. 37 , 271–278 (1981).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Ким, Дж. К., Сео, Д. Х., Чен, Х. и Седер, Г. Влияние антицентрального беспорядка и размера частиц на кинетику интеркаляции лития в моноклинном LiMnBO 3 . Доп. Энергия Матер. 5 , 1401916 (2015).
Артикул Google Scholar
Вэнь, К.Дж., Букамп Б., Хаггинс Р. и Веппнер В. Термодинамические и массопереносные свойства «LiAl». Дж. Электрохим. соц. 126 , 2258–2266 (1979).
КАС Статья Google Scholar
Kan, W.H. et al. Распутывание твердофазной окислительно-восстановительной химии в монокристаллическом катодном материале Li 1,3 Nb 0,3 Mn 0,4 O 2 . Хим. Матер. 30 , 1655–1666 (2018).
Хим. Матер. 30 , 1655–1666 (2018).
КАС Статья Google Scholar
Cowley, J.M. Рентгеновское измерение порядка в монокристаллах Cu 3 Au. Дж. Заявл. физ. 21 , 24–30 (1950).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Райнхард, Л. и др. Аномальное рентгеновское исследование локального порядка в ОЦК Fe 0,53 Cr 0,47 . Физ. Rev. B 45 , 2662 (1992).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Митоме, М. и др. Просвечивающая электронная микроскопия и электронографическое исследование структуры ближнего порядка α -LiFeO 2 . Acta Кристаллогр. Разд. Б Структура. 60 , 698–704 (2004).
Артикул Google Scholar
Хаук, Дж.Ближний порядок и сверхструктуры тройных оксидов AMO 2 , A 2 MO 3 и A 5 MO 6 одновалентных A и многовалентных M металлов, связанных со структурой NaCl. Acta Кристаллогр. Разд. Кристалл. 36 , 228–237 (1980).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Де Риддер Р., Ван Дайк Д., Ван Тенделу Г. и Амелинкс С. Кластерная модель переходного состояния и ее изучение с помощью электронной дифракции.II. Применение к некоторым конкретным системам. Физ. Status Solidi A 40 , 669–683 (1977).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Де Риддер, Р., Ван Тенделу, Г. и Амелинкс, С. Кластерная модель перехода от состояния ближнего порядка к состоянию дальнего порядка в двойных системах на основе ГЦК и ее изучение с помощью дифракция электронов. Acta Кристаллогр. Разд. Кристалл. 32 , 216–224 (1976).
Acta Кристаллогр. Разд. Кристалл. 32 , 216–224 (1976).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Де Фонтен, Д. Конфигурационная термодинамика твердых растворов, в Физика твердого тела 34 , 73–274 (Academic Press, Cambridge, 1979).
Урбан, А., Маттс, И., Абделлахи, А. и Седер, Г. Расчетный дизайн и подготовка катионно-неупорядоченных оксидов для литий-ионных аккумуляторов с высокой плотностью энергии. Доп. Энергия Матер. 6 , 1600488 (2016).
Артикул Google Scholar
Ричардс В. Д., Дацек С. Т., Кичаев Д. А. и Седер Г. Фторирование катодных материалов из оксида переходного металла с избытком лития. Доп. Энергия Матер. 8 , 1701533 (2018).
Артикул Google Scholar
Биллиндж, С.Дж. и Левин, И. Проблема определения атомной структуры в наномасштабе. Наука 316 , 561–565 (2007).
ОБЪЯВЛЕНИЕ КАС пабмед Статья Google Scholar
Кикучи Р. Теория кооперативных явлений. Физ. 81 , 988 (1951).
ОБЪЯВЛЕНИЕ MathSciNet МАТЕМАТИКА Статья Google Scholar
Ходо, Дж. Л., Марецио, М., Санторо, А. и Рот, Р. С. Уточнение нейтронного профиля структур Li 2 SnO 3 и Li 2 ZrO 1 3 . J. Solid State Chem. 45 , 170–179 (1982).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Дорриан, Дж. Ф. и Ньюнхэм, Р. Э. Уточнение структуры Li 2 TiO 3 . Матер. Рез. Бык. 4 , 179–183 (1969).
КАС Статья Google Scholar
Урбан А., Абделлахи А., Дачек С., Артрит Н. и Седер Г. Происхождение катионного беспорядка электронной структуры в оксидах переходных металлов. Физ. Преподобный Летт. 119 , 176402 (2017).
ОБЪЯВЛЕНИЕ пабмед Статья Google Scholar
Yabuuchi, N. et al. Синтез и электрохимические свойства Li 1,3 Nb 0,3 V 0,4 O 2 в качестве материала положительного электрода для перезаряжаемых литиевых батарей. Хим. коммун. 52 , 2051–2054 (2016).
КАС Статья Google Scholar
Брегер, Дж. и др. Ближний и дальний порядок в материале положительного электрода Li (NiMn) 0,5 O 2 : совместная рентгенография и нейтронография, анализ парных функций распределения и исследование ЯМР. Дж. Ам. хим. соц. 127 , 7529–7537 (2005).
Дж. Ам. хим. соц. 127 , 7529–7537 (2005).
ПабМед Статья Google Scholar
Цзэн Д., Кабана, Дж., Брегер, Дж., Юн, В.-С. & Grey, CP Упорядочивание катионов в Li [Ni x Mn x Co (1–2 x ) ]O 2 -слоистые катодные материалы: a ядерный магнитный резонанс парная функция распределения, рентгеновская спектроскопия поглощения и электрохимическое исследование. Хим. Матер. 19 , 6277–6289 (2007).
КАС Статья Google Scholar
Юн В.-С. и другие. Локальная структура и катионное упорядочение в оксидах лития-никеля-марганца O3 со стехиометрией Li[Ni x Mn (2- x )/3 Li (1-2 x )/3 1 0 2 9 ЯМР-исследования и основные расчеты. Электрохим. Твердотельный 7 , A167–A171 (2004 г. ).
).
КАС Статья Google Scholar
Фэрроу, К. и др. PDFfit2 и PDFgui: компьютерные программы для изучения наноструктуры в кристаллах. J. Phys. Конденс. Материя 19 , 335219 (2007).
КАС пабмед Статья Google Scholar
Крессе, Г. и Фуртмюллер, Дж. Эффективные итерационные схемы для неэмпирических расчетов полной энергии с использованием базисного набора плоских волн. Физ. B 54 , 11169 (1996).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Крессе, Г.и Фуртмюллер, Дж. Эффективность расчетов полной энергии ab-initio для металлов и полупроводников с использованием базисного набора плоских волн. Вычисл. Матер. науч. 6 , 15–50 (1996).
КАС Статья Google Scholar
Blöchl, PE Метод дополненной волны проектора. Физ. B 50 , 17953 (1994).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Пердью, Дж.П., Берк, К. и Эрнзерхоф, М. Упрощенное приближение обобщенного градиента. Физ. Преподобный Летт. 77 , 3865 (1996).
ОБЪЯВЛЕНИЕ КАС пабмед ПабМед Центральный Статья Google Scholar
Дударев С., Боттон Г., Саврасов С., Хамфрис К. и Саттон А. Спектры потерь энергии электронов и структурная стабильность оксида никеля: исследование LSDA + U. Физ. B 57 , 1505 (1998).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Джейн, А. и др. Высокопроизводительная инфраструктура для расчетов теории функционала плотности. Вычисл. Матер. науч. 50 , 2295–2310 (2011).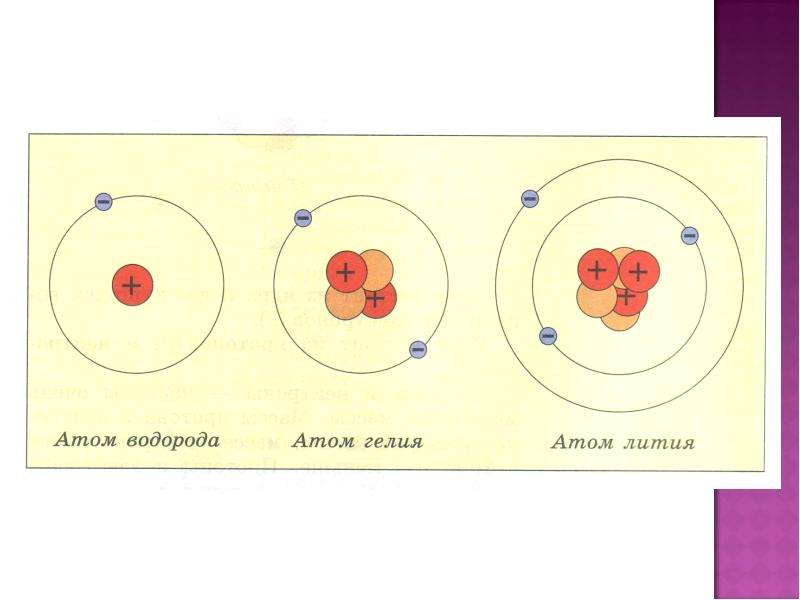
КАС Статья Google Scholar
Ван Л., Максиш Т. и Седер Г. Энергии окисления оксидов переходных металлов в каркасе GGA + U. Физ. B 73 , 195107 (2006 г.).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Онг С.П. и др. Python Materials Genomics (pymatgen): надежная библиотека Python с открытым исходным кодом для анализа материалов. Вычисл. Матер. науч. 68 , 314–319 (2013).
КАС Статья Google Scholar
Санчес, Дж. М., Дюкастель, Ф.и Гратиас, Д. Обобщенное кластерное описание многокомпонентных систем. Физ. Стат. мех. заявл. 128 , 334–350 (1984).
MathSciNet Статья Google Scholar
Нельсон Л.Дж. , Харт Г.Л., Чжоу Ф. и Озолиньш В. Измерение сжатия как парадигма построения физических моделей. Физ. Ред. B 87 , 035125 (2013).
, Харт Г.Л., Чжоу Ф. и Озолиньш В. Измерение сжатия как парадигма построения физических моделей. Физ. Ред. B 87 , 035125 (2013).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Гарбульский Г.Д. и Седер, Г. Влияние колебаний решетки на тенденции упорядочения в бинарных сплавах замещения. Физ. Rev. B 49 , 6327 (1994).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Ван Де Валле, А. и Седер, Г. Влияние колебаний решетки на термодинамику сплавов замещения. Ред. Мод. физ. 74 , 11 (2002).
ОБЪЯВЛЕНИЕ Статья Google Scholar
Фульц, Б., Энтони Л., Нагель Л.Дж., Никлоу Р.М. и Спунер С. Фононные плотности состояний и колебательные энтропии упорядоченного и неупорядоченного Ni 3 Al. Физ. Rev. B 52 , 3315 (1995).
Физ. Rev. B 52 , 3315 (1995).
ОБЪЯВЛЕНИЕ КАС Статья Google Scholar
Киркланд, Э. Дж. Передовые вычисления в электронной микроскопии . (Springer Sci. & Bus. Media, Берлин, 2010 г.).
Книга Google Scholar
Офус, К.Алгоритм быстрого моделирования изображений для сканирующей просвечивающей электронной микроскопии. Доп. Структура хим. Imaging 3 , 13 (2017).
ПабМед ПабМед Центральный Статья Google Scholar
| |||||||||||||||||||||||||||||||||||||||||||||||||
Прохождение ионов лития через твердый материал
Ученые из Университета США.Аргоннская национальная лаборатория Министерства энергетики США (DOE) в сотрудничестве с исследователями из Университета Пердью и Университета Рутгерса объединила материаловедение и физику конденсированного состояния в исследовании многообещающего твердого материала, проводящего ионы лития.
Перенос ионов или заряженных атомов через материалы играет решающую роль во многих электрических системах — от батарей до мозга. В настоящее время ведущими ионопроводящими материалами являются жидкие и органические материалы, но разработка твердых и неорганических ионных проводников может найти широкое применение в преобразовании энергии, биоинженерии и обработке информации.
В этом исследовании было показано, что никелат самария, материал, который также является твердым, быстро переносит ионы лития при определенных условиях. Исследование было опубликовано в Proceedings of the National Academy of Sciences USA.
«Мы определили материал, который имеет изоляционные свойства лучше, чем у жидкости, и ионную проводимость, редкую для твердого тела». — Субраманиан Санкаранараянан, научный сотрудник Аргоннского центра наноразмерных материалов
.
В исследовании сообщается, что для никелата самария квантовые явления, происходящие в его молекулярной структуре, влияют на свойства материала в более широком масштабе, а его необычные структурные особенности могут приводить к благоприятным электронным свойствам.
В более раннем исследовании ученые обнаружили, что небольшие ионы, такие как протоны, могут очень быстро перемещаться через материал никелата самария. «Затем мы спросили, что произойдет, если мы добавим в материал немного более крупные ионы, такие как литий», — сказал Шрирам Раманатан, соавтор исследования и профессор материаловедения в Университете Пердью.
Ионы лития играют важную роль в мире аккумуляторов: многие используемые сегодня аккумуляторы полагаются на перенос ионов лития через материал электролита для облегчения протекания электрического тока.
«Поскольку никелат самария может легко перемещать ионы лития через свою решетку при комнатной температуре, его можно использовать в качестве твердотельного электролита в батарее», — сказал Хуа Чжоу, физик из Аргонны. «Это относится к той же категории, что и лучшие твердые литий-ионные проводники, которые мы видели».
Никелат самария не только быстро переносит литий, но и демонстрирует уровень электрического сопротивления, желательный для электролитических материалов.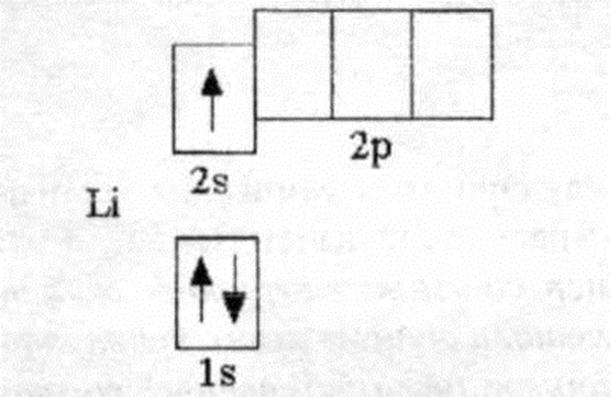 Сам по себе никелат самария ведет себя как металл, позволяя электронам свободно проходить через его кристаллическую решетку.Однако когда ученые вводят в материал ионы лития, способность свободных электронов проходить через него снижается на восемь порядков. Это сопротивление позволяет материалу избежать проблем, которые часто мешают другим обычно используемым жидким электролитам, таких как ненужные потери энергии и короткое замыкание.
Сам по себе никелат самария ведет себя как металл, позволяя электронам свободно проходить через его кристаллическую решетку.Однако когда ученые вводят в материал ионы лития, способность свободных электронов проходить через него снижается на восемь порядков. Это сопротивление позволяет материалу избежать проблем, которые часто мешают другим обычно используемым жидким электролитам, таких как ненужные потери энергии и короткое замыкание.
«Мы идентифицировали материал, который имеет изоляционные свойства лучше, чем жидкие электролиты, такие как алкилкарбонаты, которые обычно используются в современных батареях, и ионную проводимость, редкую для твердых тел», — сказал Субраманиан Санкаранараянан, ученый из Аргоннского центра наноразмерных материалов.
«Это довольно противоречивый результат, что добавление электронов в систему делает никелат более изолирующим», — сказал исследователь из Университета Рутгерса Мишель Котиуга.
Котюга провел первые расчеты, чтобы определить, как меняется электронная структура материала при введении в него лития.
Имея в руках эти расчеты, команда затем использовала возможности, предлагаемые уникальным набором пользовательских средств Управления науки Министерства энергетики Аргонны — усовершенствованным источником фотонов (APS), вычислительным центром Аргонна (ALCF) и Центром наноразмерных материалов (CNM). — получить более подробное описание механизмов, вызывающих такое поведение. Команда также использовала Национальный источник синхротронного света-II, созданный Министерством энергетики США в Брукхейвенской национальной лаборатории.
APS исследовал никелат самария с помощью высокоинтенсивного рентгеновского излучения по мере того, как ученые постепенно добавляли литий. В режиме реального времени ученые наблюдали за тем, как электронная структура и химическая связь эволюционировали вплоть до атомной длины.
В режиме реального времени ученые наблюдали за тем, как электронная структура и химическая связь эволюционировали вплоть до атомной длины.
Ученые также использовали ALCF и высокопроизводительный вычислительный кластер Carbon в CNM для моделирования движения ионов в решетке.
«Суперкомпьютеры становятся все более неотъемлемой частью разработки и исследования материалов», — сказала научный директор ALCF Кэтрин Райли.«С нашими системами передового класса исследователи могут исследовать материалы с беспрецедентным уровнем детализации, предоставляя информацию, которая в конечном итоге может быть использована для адаптации новых материалов для целевых приложений».
Используя суперкомпьютер Mira из ALCF, команда смоделировала динамику системы, чтобы предсказать, какие пути ионы лития могут пройти через никелат.
«Вычисление путей было важным дополнением к остальной части исследования, потому что оно помогает объяснить поведение, которое мы наблюдали», — сказал Санкаранараянан. «Мы можем использовать эти знания, чтобы воссоздать и контролировать эти эффекты в других материалах».
«Мы можем использовать эти знания, чтобы воссоздать и контролировать эти эффекты в других материалах».
Ученые планируют изучить другие материалы, которые могут проявлять аналогичные свойства, чтобы определить другие ионы, которые может проводить никелат самария.
Среди других аргоннских авторов Бадри Нараянан, Мэтью Черукара, Юнци Донг, Ронгуи Коу и Ченг-Джун Сун. Часть исследования Аргонна финансировалась Управлением науки, Национальным научным фондом и Управлением научных исследований ВВС.
границ | Кластерные кремний-литиевые наноструктуры: нанопроволока, заключенная внутри углеродной нанотрубки
Введение
Введение неорганических материалов в одностенные углеродные нанотрубки (ОУНТ), далее обозначаемые просто УНТ, позволяет инкапсулировать экстремальные нанопроволоки (ННК) с диаметры сравнимы с элементарной ячейкой исходного материала (Green, 1998; Sloan et al., 2002; Spencer et al., 2014). Хотя ННК аналогичного диаметра можно получить с использованием нескольких шаблонов, таких как цеолиты (Derouane, 1998), мезопористые фазы (Alba-Simionesco et al. , 2006; Ke et al., 2009) и материалов типа металлоорганического каркаса (MOF) (Lu et al., 2012), УНТ обладают многими преимуществами в качестве шаблонов; они атомарно гладкие, электронно-прозрачные, легкодоступные и могут быть заполнены объемной инфильтрацией для создания миллиграммовых количеств инкапсулированных нанопроволок, по крайней мере, в лабораторных масштабах. Таким образом, инкапсулированные НЗ-УНТ интересны с научной точки зрения не только сами по себе, но и как предшественники широкого спектра других экстремальных материалов нанопроволоки.
, 2006; Ke et al., 2009) и материалов типа металлоорганического каркаса (MOF) (Lu et al., 2012), УНТ обладают многими преимуществами в качестве шаблонов; они атомарно гладкие, электронно-прозрачные, легкодоступные и могут быть заполнены объемной инфильтрацией для создания миллиграммовых количеств инкапсулированных нанопроволок, по крайней мере, в лабораторных масштабах. Таким образом, инкапсулированные НЗ-УНТ интересны с научной точки зрения не только сами по себе, но и как предшественники широкого спектра других экстремальных материалов нанопроволоки.
В 2016 г. Иванов и соавт.опубликовали теоретическое предсказание спиральных литий-фосфорных нанопроволок, инкапсулированных в однослойные углеродные нанотрубки (LiP@CNT) (Иванов и др., 2016). Отметим, что спиральные скопления Li n P n ( n = 5–9) ранее сообщались как структуры глобального минимума (Иванов и др., 2012). Некоторые твердые фазы состоят из структурных мотивов, подобных атомным кластерам, т.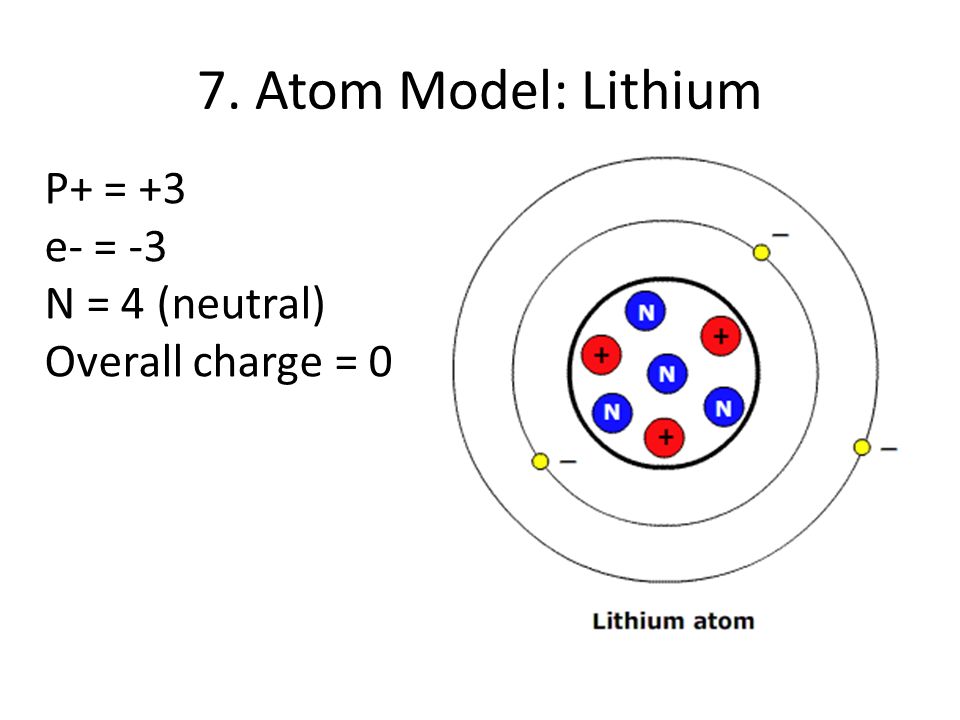 е. в фазах Цинтля. Эта связь обеспечивает согласованность использования моделей, основанных на стабильных кластерах, для генерации ННК внутри нанотрубок, как это было предложено в работе Иванова (Ivanov et al., 2012). Изучение этих кластеров внутри УНТ может дать актуальную информацию об этих гибридных материалах, например, об их жизнеспособности (анализ стабильности), их структурных характеристиках (анализ геометрии), их физических и химических свойствах (анализ их электронной структуры).
е. в фазах Цинтля. Эта связь обеспечивает согласованность использования моделей, основанных на стабильных кластерах, для генерации ННК внутри нанотрубок, как это было предложено в работе Иванова (Ivanov et al., 2012). Изучение этих кластеров внутри УНТ может дать актуальную информацию об этих гибридных материалах, например, об их жизнеспособности (анализ стабильности), их структурных характеристиках (анализ геометрии), их физических и химических свойствах (анализ их электронной структуры).
Благодаря своей превосходной способности накапливать энергию, кремний широко изучался экспериментально в качестве материала отрицательного электрода для литий-ионных аккумуляторов (Gao et al., 2001; Ryu et al., 2004; Li et al., 2006, Ли и др., 2008, Ли и др., 2009; Обровац и др., 2007; Сонг и др., 2014; Шин и др., 2020). Таким образом, Si литифицируется при высокой температуре (415°C) в расплаве LiCl-KCl, выявляя потенциальные плато, свидетельствующие о наличии кристаллических фаз 4 и Li 22 Si 5 (Wen and Huggins, 1981). В частности, бинарный (непарамагнитный) силицид Zintl-типа Li 12 Si 7 содержит полубесконечные сандвичеобразные линейные цепочки [Li6Si5]∞1, состоящие из пентагонов Si 5 , интеркалированных атомами Li (см. Схема 1).Обратите внимание, что элементарная ячейка фазы Zintl Li 12 Si 7 была рационализирована (Nesper, 1990; Chevrier et al., 2010; Köster et al., 2011; Kuhn et al., 2011a, Kuhn et al. , 2011b) AS (Li 6 6+ [Si 5 ] 6 ) 2 (Li 12 10+ [Si 4 ] 10 ) 2 , с два четко определенных кремниевых фрагмента: плоские кольца Si 5 и Y-образный фрагмент Si 4 . Такой структурный паттерн оправдывается приписыванием 26 электронов (20 от 6Si + 6 от 6Li) кольцу Si 5 6- в пользу ароматичности Хюккеля (Hückel, 1930, Hückel, 1931a, Hückel, 1931b; Zhao et al. ., 2017). Этот ароматический характер подтверждается экспериментальными данными о сдвиге в сильное поле (до -17,2 м.
В частности, бинарный (непарамагнитный) силицид Zintl-типа Li 12 Si 7 содержит полубесконечные сандвичеобразные линейные цепочки [Li6Si5]∞1, состоящие из пентагонов Si 5 , интеркалированных атомами Li (см. Схема 1).Обратите внимание, что элементарная ячейка фазы Zintl Li 12 Si 7 была рационализирована (Nesper, 1990; Chevrier et al., 2010; Köster et al., 2011; Kuhn et al., 2011a, Kuhn et al. , 2011b) AS (Li 6 6+ [Si 5 ] 6 ) 2 (Li 12 10+ [Si 4 ] 10 ) 2 , с два четко определенных кремниевых фрагмента: плоские кольца Si 5 и Y-образный фрагмент Si 4 . Такой структурный паттерн оправдывается приписыванием 26 электронов (20 от 6Si + 6 от 6Li) кольцу Si 5 6- в пользу ароматичности Хюккеля (Hückel, 1930, Hückel, 1931a, Hückel, 1931b; Zhao et al. ., 2017). Этот ароматический характер подтверждается экспериментальными данными о сдвиге в сильное поле (до -17,2 м. д.) Li (в центре фрагмента Li 6 на схеме 1) в соответствующем спектре ЯМР под магическим углом (MAS) (Kuhn et al. , 2011b; Köster et al., 2011). Примечательно, что структурный мотив Si 5 6- присутствует и в тройном соединении Li 8 MgSi 6 (Nesper et al., 1986a). С другой стороны, на уровне кластера наша группа определила, что глобальный минимум (GM) кластера Li 6 Si 5 состоит из ароматического пентагона Si 5 6-, окруженного 6 Li + противоионов (Tiznado et al., 2009; Перес-Перальта и др., 2011 г.; Контрерас и др., 2013; Васкес-Эспиналь и др., 2018). Совсем недавно мы идентифицировали ГМ-структуры олигомеров (Li 6 Si 5 ) 2 и (Li 6 Si 5 ) 3 (Yañez et al., 2011). -la-Cuba et al., 2021), которые также состоят из ароматических колец Si 5 , окруженных Li (см. схему 1). Однако укладка блоков Li 6 Si 5 не приводит к образованию нанопроволоки, идентифицированной в Li 12 Si 7 , что позволяет предположить, что Li 12 10+ [Si 4 10110 10+ ] – Компонент (с Y-образной частью Si 4 ) вносит решающий вклад в стабилизацию этого ННК.
д.) Li (в центре фрагмента Li 6 на схеме 1) в соответствующем спектре ЯМР под магическим углом (MAS) (Kuhn et al. , 2011b; Köster et al., 2011). Примечательно, что структурный мотив Si 5 6- присутствует и в тройном соединении Li 8 MgSi 6 (Nesper et al., 1986a). С другой стороны, на уровне кластера наша группа определила, что глобальный минимум (GM) кластера Li 6 Si 5 состоит из ароматического пентагона Si 5 6-, окруженного 6 Li + противоионов (Tiznado et al., 2009; Перес-Перальта и др., 2011 г.; Контрерас и др., 2013; Васкес-Эспиналь и др., 2018). Совсем недавно мы идентифицировали ГМ-структуры олигомеров (Li 6 Si 5 ) 2 и (Li 6 Si 5 ) 3 (Yañez et al., 2011). -la-Cuba et al., 2021), которые также состоят из ароматических колец Si 5 , окруженных Li (см. схему 1). Однако укладка блоков Li 6 Si 5 не приводит к образованию нанопроволоки, идентифицированной в Li 12 Si 7 , что позволяет предположить, что Li 12 10+ [Si 4 10110 10+ ] – Компонент (с Y-образной частью Si 4 ) вносит решающий вклад в стабилизацию этого ННК. В упомянутых кластерных исследованиях исследования поверхности потенциальной энергии проводились гибридными методами, включая генетические алгоритмы (Yañez et al., 2019a, Yañez et al., 2020).
В упомянутых кластерных исследованиях исследования поверхности потенциальной энергии проводились гибридными методами, включая генетические алгоритмы (Yañez et al., 2019a, Yañez et al., 2020).
Схема 1 . Структуры [Li6Si5]∞1 NW, Li 6 Si 5 , Li 12 Si 10 и Li 18 Si 15 структуры глобальных минимумов, где квадратные скобки показывают повторяющиеся структуры.
Построить новый класс материалов с желаемыми свойствами, используя в качестве строительных блоков атомные кластеры вместо атомов, — замечательная возможность.Однако это требует, чтобы атомные кластеры сохраняли свою идентичность при сборке, как впервые обрисовали Ханна и Джена, когда они придумали слово «кластерно-собранные материалы» (CAM) (Khanna and Jena, 1992). Эти авторы утверждали, что сцепление кластеров будет иметь уникальное влияние как на электронную структуру, так и на механические свойства собранного материала, что невозможно, когда сборочные блоки представляют собой атомы (Khanna and Jena, 1995; Jena et al.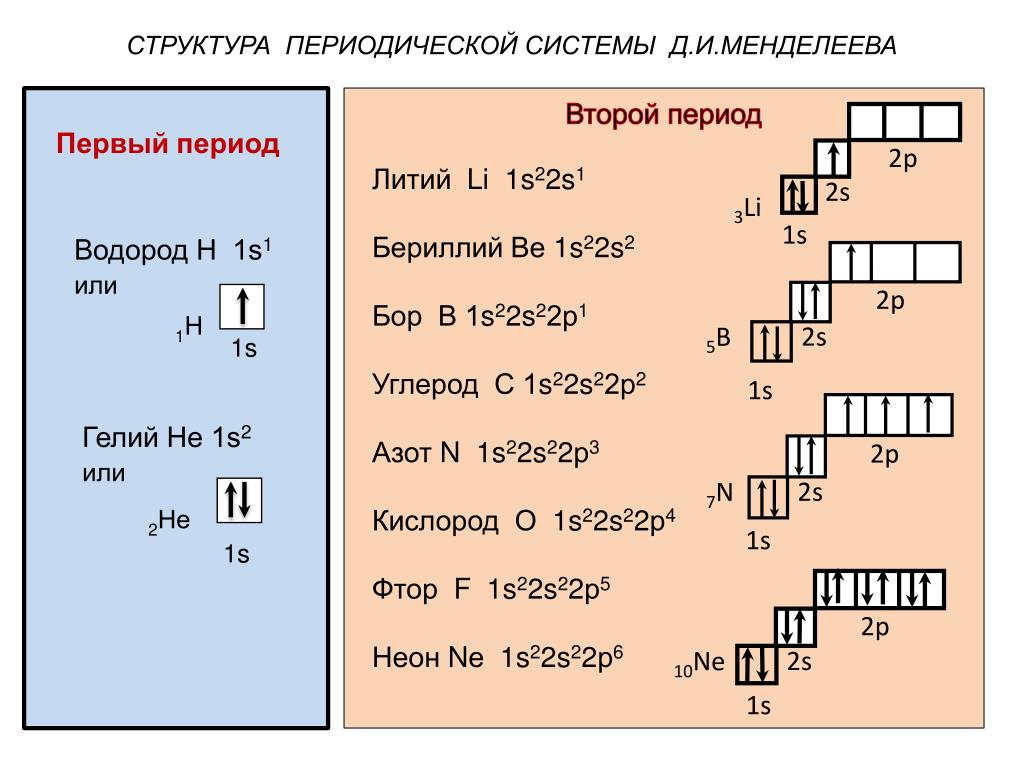 , 1996; Jena и др.). Ханна, 1996; Claridge et al., 2009; Йена и Сан, 2018). Более подробный и своевременный обзор достижений в сборке материалов из кластеров можно найти в следующих обзорах: (Chakraborty, Pradeep, 2017; Jena, Sun, 2018; Pinkard et al., 2018; Zheng et al., 2019). ; Доуд и др., 2020).
, 1996; Jena и др.). Ханна, 1996; Claridge et al., 2009; Йена и Сан, 2018). Более подробный и своевременный обзор достижений в сборке материалов из кластеров можно найти в следующих обзорах: (Chakraborty, Pradeep, 2017; Jena, Sun, 2018; Pinkard et al., 2018; Zheng et al., 2019). ; Доуд и др., 2020).
На этом фоне мы оценили, in silico , стабильность изолированного ННК [Li6Si5]∞1, а также его электронные свойства. Кроме того, мы исследовали гибридный материал, состоящий из ННК, заключенных в УНТ.Последнее было сосредоточено на поиске альтернативных способов стабилизации этой конформации и оценке влияния этой ассоциации на электронные свойства ННК. Наши расчеты по теории функционала плотности (DFT) показывают, что гибридные системы Li-Si@CNT обладают превосходной стабильностью и, таким образом, имеют потенциал для экспериментальной реализации.
Вычислительные методы
В конечных моделях (кластерах) оптимизация геометрии и частотные расчеты выполнялись на уровне PBE0 (Adamo and Barone, 1999)/Def2TZVP (Weigend and Ahlrichs, 2005) с помощью программы Gaussian 16 (M. Дж. Фриш, GW Trucks, HB Schlegel и др., 2016).
Дж. Фриш, GW Trucks, HB Schlegel и др., 2016).
Для твердотельного исследования мы выполнили первопринципные расчеты на основе DFT (Sham and Kohn, 1966; Kohn et al., 1996), реализованного в Венском пакете моделирования Ab Initio (VASP) (Kresse and Furthmüller, 1996). ). Обменно-корреляционные энергии рассчитаны на уровне PBE-D3 (Ernzerhof and Perdew, 1998; Grimme et al., 2010). Базис плоской волны был установлен с отсечкой кинетической энергии 400 эВ, и использовался метод дополненной волны проектора для взаимодействия ядра и валентности (Blöchl et al., 1994). ННК [Li6Si5]∞1 моделировались в большой элементарной ячейке объемом (20 × 20 × z 0 ) Å 3 с учетом периодических граничных условий вдоль направления СЗ, где z 0 равно периодичность. В этой суперячейке поперечное расстояние между изображениями NW установлено равным 15 Å. Мы используем (1 × 1 × 10) k-точечную сетку Монкхорста-Пака (Monkhorst and Pack, 1976). Мы также изучаем конечные (Li 6 Si 5 ) 4 структуры в свободном пространстве, также внутри как кресла, так и зигзагообразной одностенной углеродной нанотрубки (ОУНТ). Мы рассматриваем УНТ типа «кресло» с индексами хиральности (8,8), (9,9) и (10,10) диаметром 10,93, 12,27 и 13,63 Å, а также УНТ типа «зигзаг» с индексами хиральности (14,0), (15,0) и (16,0), которые имеют диаметры 11,04, 11,80 и 12,59 Å соответственно. Для моделирования (Li 6 Si 5 ) 4 @CNT (22 × 22 × z 0 ) Å 3 использован объем, где 1 – периодичность z УНТ. Всем исследованным структурам давали возможность свободно релаксировать без каких-либо ограничений до тех пор, пока силы, действующие на каждый атом, не стали меньше 25 мэВ/Å.Чтобы получить представление о стабильности моделей NW в свободном пространстве и внутри SWCNT, мы выполнили моделирование молекулярной динамики Борна-Оппенгеймера ab initio (BO-AIMD) в ансамбле NVT при разных температурах в течение общего времени моделирования 10 пс. , учитывая временной шаг 1 фс.
Мы рассматриваем УНТ типа «кресло» с индексами хиральности (8,8), (9,9) и (10,10) диаметром 10,93, 12,27 и 13,63 Å, а также УНТ типа «зигзаг» с индексами хиральности (14,0), (15,0) и (16,0), которые имеют диаметры 11,04, 11,80 и 12,59 Å соответственно. Для моделирования (Li 6 Si 5 ) 4 @CNT (22 × 22 × z 0 ) Å 3 использован объем, где 1 – периодичность z УНТ. Всем исследованным структурам давали возможность свободно релаксировать без каких-либо ограничений до тех пор, пока силы, действующие на каждый атом, не стали меньше 25 мэВ/Å.Чтобы получить представление о стабильности моделей NW в свободном пространстве и внутри SWCNT, мы выполнили моделирование молекулярной динамики Борна-Оппенгеймера ab initio (BO-AIMD) в ансамбле NVT при разных температурах в течение общего времени моделирования 10 пс. , учитывая временной шаг 1 фс.
Результаты и обсуждение
Тесты конечной модели для оценки оптимальной ширины ОУНТ
Первый вопрос, который возникает, заключается в том, какова оптимальная ширина ОУНТ для выращивания [Li6Si5]∞1 ННК? Это актуальный вопрос, учитывая, что электронная структура элементов группы 1, таких как Li, особенно чувствительна к ограничению (Robles-Navarro et al. , 2020). Чтобы получить представление о ширине нанотрубок, которые будут рассматриваться в нашем исследовании, мы сначала провели анализ конечной модели. Эта модель состоит из [n]циклаценов ( n = 13–20) в их оптимальной структуре (на уровне PBE0/Def2TZVP), охватывающих диапазон диаметров от 10,2 до 15,6 Å. Затем был размещен кластер Li 7 Si 5 + , центрируя его, имитируя модель роста в сторону нанопроволоки (см. схему 1). Мы выбрали звездообразный кластер D 5h -Li 7 Si 5 + в качестве подходящей модели для проектирования нанопровода внутри УНТ из-за его высокой симметрии и аналогии по электронной структуре с Li 6 Si 5 шт.В этом исследовании мы сохранили структуру [n] циклацена жесткой, позволив только оптимизировать структуру Li 7 Si 5 + (на уровне PBE0/Def2TZVP).
, 2020). Чтобы получить представление о ширине нанотрубок, которые будут рассматриваться в нашем исследовании, мы сначала провели анализ конечной модели. Эта модель состоит из [n]циклаценов ( n = 13–20) в их оптимальной структуре (на уровне PBE0/Def2TZVP), охватывающих диапазон диаметров от 10,2 до 15,6 Å. Затем был размещен кластер Li 7 Si 5 + , центрируя его, имитируя модель роста в сторону нанопроволоки (см. схему 1). Мы выбрали звездообразный кластер D 5h -Li 7 Si 5 + в качестве подходящей модели для проектирования нанопровода внутри УНТ из-за его высокой симметрии и аналогии по электронной структуре с Li 6 Si 5 шт.В этом исследовании мы сохранили структуру [n] циклацена жесткой, позволив только оптимизировать структуру Li 7 Si 5 + (на уровне PBE0/Def2TZVP).
В случае небольших [n]циклаценов ( n = 13–15) кластер Li 7 Si 5 + в процессе оптимизации претерпевает заметные изменения за счет эффектов конфайнмента. Напротив, при использовании [n]циклоценов с n = 16–20 кластер Li 7 Si 5 + сохраняет свою структуру в конце процесса оптимизации, что приводит к наилучшей энергии взаимодействия, [E int = E (Li 7 Si 5 + ат[n]циклацен)-(E (Li 7 Si 5 ) + E ([n]циклацен)) , с [16] циклаценом (-70.1 ккал моль 90 164 –1 90 165 на уровне PBE0/Def2TZVP). Поскольку этот анализ является лишь ссылкой для оценки наиболее подходящих диаметров нанотрубок для исследования в периодических расчетах, мы не включали поправки на ошибку суперпозиции базисного набора (BSSE). Наиболее стабильные структуры, а также E int показаны на рисунке 1. Структуры для других комплексов показаны на дополнительном рисунке S1, а их декартовы координаты — в дополнительной таблице S1. Эти результаты побудили нас использовать УНТ диаметром в диапазоне 11–14 Å на следующих этапах нашего исследования.
Напротив, при использовании [n]циклоценов с n = 16–20 кластер Li 7 Si 5 + сохраняет свою структуру в конце процесса оптимизации, что приводит к наилучшей энергии взаимодействия, [E int = E (Li 7 Si 5 + ат[n]циклацен)-(E (Li 7 Si 5 ) + E ([n]циклацен)) , с [16] циклаценом (-70.1 ккал моль 90 164 –1 90 165 на уровне PBE0/Def2TZVP). Поскольку этот анализ является лишь ссылкой для оценки наиболее подходящих диаметров нанотрубок для исследования в периодических расчетах, мы не включали поправки на ошибку суперпозиции базисного набора (BSSE). Наиболее стабильные структуры, а также E int показаны на рисунке 1. Структуры для других комплексов показаны на дополнительном рисунке S1, а их декартовы координаты — в дополнительной таблице S1. Эти результаты побудили нас использовать УНТ диаметром в диапазоне 11–14 Å на следующих этапах нашего исследования.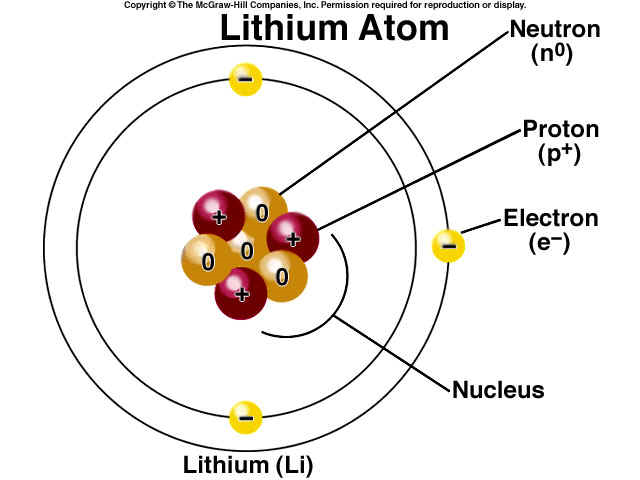
РИСУНОК 1 . (A) Виды сверху и сбоку оптимизированных структур Li 7 Si 5 + внутри как [16]циклацена, так и [17]циклацена на уровне PBE0/def2-TZVP. (B) Li 7 Si 5 + и энергия взаимодействия [n]циклацена (E int ), количество гексагональных колец и диаметр (в Å) [n]циклацена.
Взгляд на стабильность свободного [Li6Si5]∞1 NW.
Сначала мы исследовали устойчивость периодически повторяющихся единиц Li 6 Si 5 (Li 6 Si 5 -NW), которые уложены в стопку вдоль направления z , образуя одномерную структуру, как показано на рисунке 2.
РИСУНОК 2 . Стабильность изолированной модели [Li6Si5]∞1 (Li 6 Si 5 -NW), полученная из периодических DFT-расчетов: (A) Энергия как функция расстояния между единицами Li 6 Si 5 , (B) виды сверху и сбоку на равновесную геометрию, (C) распределение электронной плотности для изоповерхности 0,05 e /Å 3 .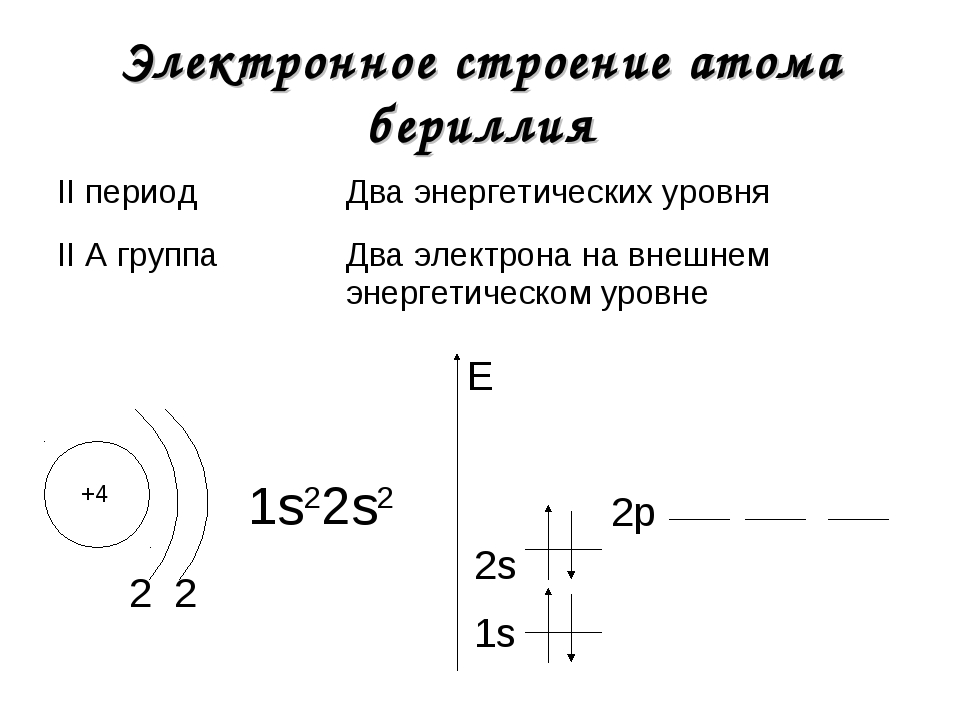
Мы обнаружили стабильную структуру с равновесным расстоянием между кольцами Si 5 , равным 4.04 Å, что является периодичностью элементарной ячейки Li 6 Si 5 . В равновесной геометрии расстояние между атомами Li границы составляет 3,33 Å, а расстояние по отношению к центральному – 2,83 Å. Расстояние Si-Si между соседними атомами составляет 2,37 Å, что очень близко к таковому в мономере Li 6 Si 5 (от 2,30 до 2,35 Å). Наши расчеты электронной зонной структуры Li 6 Si 5 -NW в примитивной элементарной ячейке предполагают металлический характер (см. рис. 3).Обратите внимание, что ширина запрещенной зоны Li 12 Si 7 была получена из экспериментальных измерений проводимости-температуры и составила 0,6 эВ (Nesper et al., 1986b).
РИСУНОК 3 . Расчет зонных структур Li 6 Si 5 -NW в элементарной ячейке. Штриховая линия указывает энергию Ферми.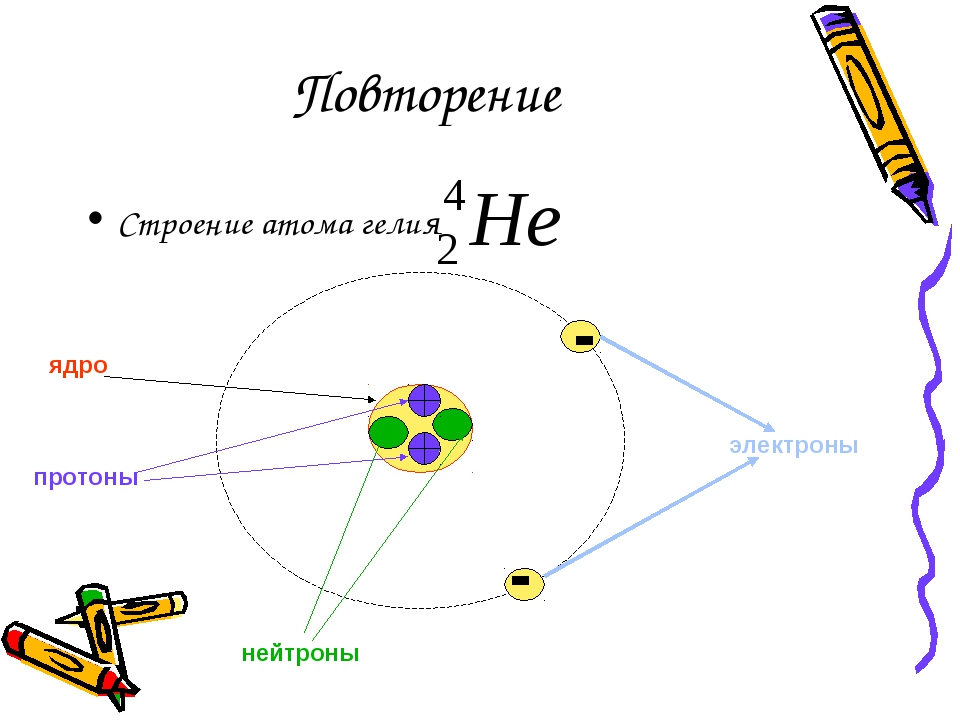
Стабильность Li 6 Si 5 -NW также была подтверждена моделированием BO-AIMD при 300 K и 500 K в течение времени моделирования 10 пс.Моделирование было выполнено путем рассмотрения четырех элементов Li 6 Si 5 в периодической элементарной ячейке, как показано на рисунке 4. Мы наблюдаем, что при 500 К Si 5 Li 6 СЗ сохраняет свою стабильность, показывая энергию флуктуации около 2 эВ. Вспомогательная информация содержит короткие видеоролики, извлеченные из моделирования BO-AIMD.
РИСУНОК 4 . Энергия как функция времени для молекулярно-динамического моделирования при 500 К бесконечной нанопроволоки Si 5 Li 6 .Элементарная ячейка для этого моделирования рассматривает четыре единицы Si 5 Li 6 . Правые изображения показывают вид сверху и сбоку снимка, сделанного при частоте 10 000 фс. (f-Li 6 Si 5 ) в свободном пространстве и инкапсулировали его внутри как кресла, так и зигзагообразных углеродных нанотрубок (f-Li 6 Si 5 @CNT).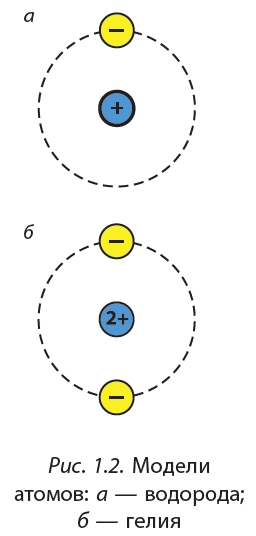 Для структуры f-Li 6 Si 5 мы рассматриваем четыре кольца Si 5 , окруженные пятью фрагментами Li 6 . Моделирование BO-AIMD дает представление об устойчивости системы f-Li 6 Si 5 в свободном пространстве при 300 К и 500 К. Мы обнаружили, что при 300 К f-Li 6 Si 5 Структура сохраняет свою стабильность. Тем не менее, при 500 К он имеет тенденцию образовывать связи Si-Si между соседними кольцами Si без потери своего одномерного массива, как показано на рисунке 5.Однако важно отметить, что эта модель не имеет точной стехиометрии NW, поскольку для сохранения симметрии добавляется дополнительная группа звеньев Li 6 , т.е. 5 ) 4 ].
Для структуры f-Li 6 Si 5 мы рассматриваем четыре кольца Si 5 , окруженные пятью фрагментами Li 6 . Моделирование BO-AIMD дает представление об устойчивости системы f-Li 6 Si 5 в свободном пространстве при 300 К и 500 К. Мы обнаружили, что при 300 К f-Li 6 Si 5 Структура сохраняет свою стабильность. Тем не менее, при 500 К он имеет тенденцию образовывать связи Si-Si между соседними кольцами Si без потери своего одномерного массива, как показано на рисунке 5.Однако важно отметить, что эта модель не имеет точной стехиометрии NW, поскольку для сохранения симметрии добавляется дополнительная группа звеньев Li 6 , т.е. 5 ) 4 ].
РИСУНОК 5 . Энергия как функция времени для моделирования молекулярной динамики при 500 К для конечной структуры Li 6 Si 5 (f-Li 6 Si 5 ). На изображениях справа показаны виды сверху и сбоку снимка, сделанного при частоте 10 000 фс. (9,9) и (10,10), а также три зигзагообразных УНТ с киральными индексами (14,0), (15,0) и (16,0).При таком выборе мы стремимся найти размер CNT, который лучше всего подходит для Li 6 Si 5 -NW внутри. Обратите внимание, что мы выбрали эти УНТ в соответствии с нашими предварительными выводами из модели Li 7 Si 5 + @[n]циклацена, предполагая диаметры от 12 до 15 Å. УНТ моделировались с периодическими граничными условиями вдоль ее оси с периодичностью z 0 = 30 Å. Последнее обеспечивает вакуумную область для инкапсулированной структуры f-Li 6 Si 5 размером 14 Å, что позволяет атомам двигаться внутри УНТ.Далее вычисляем Eint между инкапсулированным f-Li 6 Si 5 и УНТ по уравнению: где Etot(f–Li6Si5) и Etot(УНТ) – полные энергии изолированных f-Li 6 Si 5 и УНТ соответственно, а Etot(f–Li6Si5@CNT) – полная энергия f -Li 6 Si 5 блок внутри УНТ.
(9,9) и (10,10), а также три зигзагообразных УНТ с киральными индексами (14,0), (15,0) и (16,0).При таком выборе мы стремимся найти размер CNT, который лучше всего подходит для Li 6 Si 5 -NW внутри. Обратите внимание, что мы выбрали эти УНТ в соответствии с нашими предварительными выводами из модели Li 7 Si 5 + @[n]циклацена, предполагая диаметры от 12 до 15 Å. УНТ моделировались с периодическими граничными условиями вдоль ее оси с периодичностью z 0 = 30 Å. Последнее обеспечивает вакуумную область для инкапсулированной структуры f-Li 6 Si 5 размером 14 Å, что позволяет атомам двигаться внутри УНТ.Далее вычисляем Eint между инкапсулированным f-Li 6 Si 5 и УНТ по уравнению: где Etot(f–Li6Si5) и Etot(УНТ) – полные энергии изолированных f-Li 6 Si 5 и УНТ соответственно, а Etot(f–Li6Si5@CNT) – полная энергия f -Li 6 Si 5 блок внутри УНТ. Наши результаты для Eint показаны на рисунке 6. Кресло (9,9) и зигзаг (15,0) УНТ из 12.3 и 11,8 Å в диаметре, соответственно, демонстрируют более стабилизирующий Eint, являясь лучшими кандидатами для размещения внутри f-Li 6 Si 5 . Кроме того, f-Li 6 Si 5 лучше стабилизируется внутри зигзагообразной (15,0) УНТ, чем внутри кресельной (9,9) УНТ на 0,9 эВ. Следует отметить, что УНТ большего диаметра энергетически менее выгодны для инкапсулирования f-Li 6 Si 5 , как показано на рис. 6, в соответствии с Li 7 Si 5 + @[n] циклаценовая модель.Предположительно такое поведение связано с ван-дер-ваальсовым (вдВ) взаимодействием между f-Li 6 Si 5 и внутренними стенками УНТ, стабилизирующим систему. Графики индекса нековалентного взаимодействия (NCI) подтверждают нековалентный характер f-Li 6 Si 5 с УНТ [f-Li 6 Si 5 внутри зигзагообразной (15,0) УНТ ].
Наши результаты для Eint показаны на рисунке 6. Кресло (9,9) и зигзаг (15,0) УНТ из 12.3 и 11,8 Å в диаметре, соответственно, демонстрируют более стабилизирующий Eint, являясь лучшими кандидатами для размещения внутри f-Li 6 Si 5 . Кроме того, f-Li 6 Si 5 лучше стабилизируется внутри зигзагообразной (15,0) УНТ, чем внутри кресельной (9,9) УНТ на 0,9 эВ. Следует отметить, что УНТ большего диаметра энергетически менее выгодны для инкапсулирования f-Li 6 Si 5 , как показано на рис. 6, в соответствии с Li 7 Si 5 + @[n] циклаценовая модель.Предположительно такое поведение связано с ван-дер-ваальсовым (вдВ) взаимодействием между f-Li 6 Si 5 и внутренними стенками УНТ, стабилизирующим систему. Графики индекса нековалентного взаимодействия (NCI) подтверждают нековалентный характер f-Li 6 Si 5 с УНТ [f-Li 6 Si 5 внутри зигзагообразной (15,0) УНТ ]. В методе NCI (Johnson et al., 2010; Contreras-García et al., 2011) изоповерхность приведенного градиента плотности (s) окрашена плотностью, умноженной на знак второго собственного значения матрицы Гессе электронной плотности , λ 2 , чтобы различать взаимодействия притяжения и отталкивания.Используется следующий цветовой код: синий для притяжения, такого как водородные связи, зеленый для очень слабых взаимодействий, таких как vdW, и красный для стерического отталкивания. На рис. 7 показан второй (vdW) между f-Li 6 Si 5 и стенками УНТ.
В методе NCI (Johnson et al., 2010; Contreras-García et al., 2011) изоповерхность приведенного градиента плотности (s) окрашена плотностью, умноженной на знак второго собственного значения матрицы Гессе электронной плотности , λ 2 , чтобы различать взаимодействия притяжения и отталкивания.Используется следующий цветовой код: синий для притяжения, такого как водородные связи, зеленый для очень слабых взаимодействий, таких как vdW, и красный для стерического отталкивания. На рис. 7 показан второй (vdW) между f-Li 6 Si 5 и стенками УНТ.
РИСУНОК 6 . Энергия взаимодействия в зависимости от диаметра нанотрубок для конечных структур Li 6 Si 5 внутри УНТ типа «кресло» с хиральными индексами (8,8), (9,9) и (10,10) и зигзагообразных УНТ с хиральными индексами индексы (14,0), (15,0) и (16,0).
РИСУНОК 7 . f-Li 6 Si 5 @NTC оптимизированная структура, для зигзагообразных УНТ с индексами хиральности (15,0), с поверхностями NCI ( s = 0,3, цветовой диапазон: от −0,03 до 0,03 а. е.). Геометрия и плотность электронов были взяты из твердотельных расчетов.
е.). Геометрия и плотность электронов были взяты из твердотельных расчетов.
Мы также рассчитали зонную структуру Li 6 Si 5 -NW внутри зигзагообразной (15,0) УНТ. Важно отметить, что элементарные ячейки Li 6 Si 5 -NW и УНТ имеют рассогласование 5.7%, что означает, что Li 6 Si 5 -NW не находится в равновесной геометрии в элементарной ячейке Li 6 Si 5 -NW@CNT, где расстояние между кольцами Si 5 увеличивается на 0,23 Å. Однако это рассогласование относительно невелико и не должно влиять на электронные свойства системы. Для изолированных УНТ мы обнаружили небольшую ширину запрещенной зоны 0,02 эВ, как показано на рисунке 8А, что хорошо согласуется с измеренным значением 0,029 ± 0,004 эВ (Ouyang et al., 2001). В то время как система Li 6 Si 5 -NW@CNT демонстрирует металлические свойства, как показано на рисунке 8B, можно предположить, что Li 6 Si 5 -NW сохранит свои электронные свойства внутри УНТ, что можно сравнить с рисунком 3.
РИСУНОК 8 . Расчеты зонной структуры бесконечного Li 6 Si 5 -NW внутри зигзагообразных углеродных нанотрубок, (A) изолированных (15,0) УНТ и (B) Li 6 Si 5 – Система NW@CNT.Штриховая линия указывает энергию Ферми.
Наконец, мы изучаем стабильность структуры f-Li 6 Si 5 как внутри зигзагообразных (15,0), так и в виде кресла (9,9) УНТ, выполняя моделирование BO-AIMD. На рис. 9А показана равновесная геометрия структуры f-Si 5 Li 6 внутри УНТ (15,0). Мы находим, что структура остается почти неизменной по отношению к f-Si 5 Li 6 в свободном пространстве, показывая, что УНТ будут иметь небольшое влияние на стабильность ННК Li 6 Si 5 .Отметим только небольшое смещение ионов Li на краю структуры f-Li 6 Si 5 , которые движутся к стенке УНТ. Целостность структуры f-Li 6 Si 5 внутри УНТ (15,0) и (9,9) была исследована с помощью моделирования BO-AIMD при 300 К. Мы обнаружили, что f-Si 5 Структура Li 6 сохраняет свою стабильность, когда ионы Li перемещаются по кольцу Si 5 , не отрываясь. Аналогичные результаты получены для структуры f-Li 6 Si 5 внутри УНТ «кресло» (9,9), что свидетельствует о том, что формирование и стабильность ННК Li 6 Si 5 внутри УНТ не зависит от его хиральность.Этот результат предполагает, что Li 6 Si 5 -NW, вероятно, будет образовываться внутри УНТ в компактной форме, что позволит эффективно хранить ионы Li в УНТ, опосредованные кольцами Si 5 . На дополнительном рисунке S2 показано изменение общей энергии для моделирования BO-AIMD f-Li 6 Si 5 внутри УНТ (15,0) и (9,9) при 300 К. Мы наблюдаем колебания энергии около 5 эВ в обеих УНТ, сохраняя стабильность структуры f-Li 6 Si 5 .
Мы обнаружили, что f-Si 5 Структура Li 6 сохраняет свою стабильность, когда ионы Li перемещаются по кольцу Si 5 , не отрываясь. Аналогичные результаты получены для структуры f-Li 6 Si 5 внутри УНТ «кресло» (9,9), что свидетельствует о том, что формирование и стабильность ННК Li 6 Si 5 внутри УНТ не зависит от его хиральность.Этот результат предполагает, что Li 6 Si 5 -NW, вероятно, будет образовываться внутри УНТ в компактной форме, что позволит эффективно хранить ионы Li в УНТ, опосредованные кольцами Si 5 . На дополнительном рисунке S2 показано изменение общей энергии для моделирования BO-AIMD f-Li 6 Si 5 внутри УНТ (15,0) и (9,9) при 300 К. Мы наблюдаем колебания энергии около 5 эВ в обеих УНТ, сохраняя стабильность структуры f-Li 6 Si 5 .
РИСУНОК 9 . Структура f-Li 6 Si 5 внутри зигзагообразной (15,0) УНТ. (A) Виды сверху и сбоку равновесной геометрии при 0 K. (B) Виды сверху и сбоку снимка, сделанного при 2000 фс моделирования BO-AIMD при 300 K. Периодичность УНТ вдоль ее оси z 0 = 30 Å.
(A) Виды сверху и сбоку равновесной геометрии при 0 K. (B) Виды сверху и сбоку снимка, сделанного при 2000 фс моделирования BO-AIMD при 300 K. Периодичность УНТ вдоль ее оси z 0 = 30 Å.
Заключение
Используя периодические расчеты DFT и моделирование молекулярной динамики Борна-Оппенгеймера ab initio , мы показали, что единицы Li 6 Si 5 могут располагаться друг над другом, образуя одномерную структуру, связанную вместе. кулоновскими взаимодействиями.Это исследование дополняет предыдущие результаты, в которых мы продемонстрировали, что Li 6 Si 5 , (Li 6 Si 5 ) 2 и (Li 6 Si 1 1 1 1110 5 ) имеют самые низкие энергетические структуры. содержат одно, два и три ароматических кольца Si 5 6-, стабилизированных противоионами Li + . Кроме того, нанопроволока [Li6Si5]∞1 была идентифицирована в соединении Zintl Li 12 Si 7 , но сосуществовала с Y-образными фрагментами Si 4 . В этом случае мы поддерживаем стабильность изолированного Si-Li-нанопроволоки — кроме того, релаксированная структура (при комнатной температуре) проявляет металлические характеристики.
В этом случае мы поддерживаем стабильность изолированного Si-Li-нанопроволоки — кроме того, релаксированная структура (при комнатной температуре) проявляет металлические характеристики.
Мы также обнаружили, что конечные системы (Li 6 Si 5 ) 4 стабильны как внутри углеродных нанотрубок «кресло», так и в зигзагообразных углеродных нанотрубках диаметром около 12 Å, сохраняя свою стабильность при комнатной температуре, поддерживая жизнеспособное образование Li 6 Si 5 -СЗ внутри УНТ. Интересно, что гибридный нанокомпозит Li 6 Si 5 -NW@CNTs сохраняет металлический характер.Наконец, в Li 6 Si 5 -NW звенья Li 6 Si 5 связаны сильными электростатическими взаимодействиями (ароматические пентагоны Si 5 6- интеркалированы с фрагмент 6+ ) в соответствии с концепцией иона Zintl. В [Li 6 Si 5 -NW]@CNT NCI предсказывает, что Li 6 Si 5 -NW взаимодействует со стенками УНТ посредством ван-дер-ваальсовых взаимодействий Frisch et al. , 2016.
, 2016.
Данные Заявление о доступности
Первоначальные материалы, представленные в исследовании, включены в статью/дополнительный материал. Дальнейшие запросы можно направлять соответствующему автору.
Вклад авторов
Все перечисленные авторы внесли существенный, непосредственный и интеллектуальный вклад в работу и одобрили ее для публикации.
Финансирование
Мы благодарим Национальное агентство исследований и разработок (ANID) за финансовую поддержку через проекты ECOS170045, FONDECYT 1211128 (WT), 1181121 (CC) и 1170480 (WO). FONDECYT Postdoctorado 3180119 (R.P.-R.), ANID/PIA ACT1 (O.Y.). Powered@NLHPC: Это исследование было частично поддержано суперкомпьютерной инфраструктурой NLHPC (ECM-02) Университета Чили.Вычислительные ресурсы для периодических вычислений DFT и моделирования BO-AIMD были предоставлены Fenix HCP из Университета Андреса Белло. CC признает Центр развития нанонауки и нанотехнологий CEDENNA AFB180001.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Примечания издателя
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций, издателя, редакторов и рецензентов.Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fchem.2021.767421/full#supplementary-material
Ссылки
Adamo, C. и Бароне В. (1999). На пути к надежным функциональным методам плотности без регулируемых параметров: модель PBE0. J. Chem. физ. 110, 6158–6170. doi:10.1063/1.478522
CrossRef Полный текст | Google Scholar
Альба-Симионеско К., Коасне Б., Доссе Г., Дудзяк Г., Губбинс К. Э., Радхакришнан Р. и др. (2006). Влияние заключения на замораживание и таяние. J. Phys. Конденс. Материя 18, R15–R68. doi:10.1088/0953-8984/18/6/r01
J. Phys. Конденс. Материя 18, R15–R68. doi:10.1088/0953-8984/18/6/r01
Полный текст CrossRef | Google Scholar
Blöchl, PE, Jepsen, O. и Andersen, O.K. (1994). Усовершенствованный метод тетраэдра для интегрирования зоны Бриллюэна. Физ. Ред. B 49, 16223–16233. doi:10.1103/physrevb.49.16223
Полный текст CrossRef | Google Scholar
Чакраборти И. и Прадип Т. (2017). Атомарно точные кластеры благородных металлов: возникающая связь между атомами и наночастицами. Хим. Ред. 117, 8208–8271. doi:10.1021/acs.chemrev.6b00769
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шеврие В.Л., Цванцигер Дж.В. и Дан Дж.Р. (2010). Первые принципы исследования кристаллических фаз Li-Si: перенос заряда, электронная структура и колебания решетки. J. Alloys Compd. 496, 25–36. doi:10.1016/j.jallcom.2010.01.142
Полный текст CrossRef | Google Scholar
Claridge, S.A., Castleman, A.W., Khanna, S. N., Murray, C.B., Sen, A., and Weiss, P.S. (2009). Кластерные материалы. ACS Nano 3, 244–255. doi:10.1021/nn800820e
N., Murray, C.B., Sen, A., and Weiss, P.S. (2009). Кластерные материалы. ACS Nano 3, 244–255. doi:10.1021/nn800820e
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Контрерас М., Осорио Э., Ферраро Ф., Пуга Г., Дональд К. Дж., Харрисон Дж. Г. и др. (2013).Анализ разложения энергии изомеризации для высокоионных систем: пример звездообразных кластеров E5Li7+. Хим. Евро. J. 19, 2305–2310. doi:10.1002/chem.201203329
Полный текст CrossRef | Google Scholar
Contreras-García, J., Johnson, E.R., Keinan, S., Chaudret, R., Piquemal, J.-P., Beratan, D.N., et al. (2011). NCIPLOT: программа для построения областей нековалентного взаимодействия. J. Chem. Теор. вычисл. 7, 625–632. doi:10.1021/ct100641a
CrossRef Полный текст | Google Scholar
Деруан Э.Г. (1998). Цеолиты как твердые растворители1 Доклад, представленный на Международном симпозиуме “Органическая химия и катализ” по случаю 65-летия профессора Х. Ван Беккума, Делфт, Нидерланды, 2-3 октября 1997 г.1. Дж. Мол. Катал. А: Хим. 134, 29–45. doi:10.1016/s1381-1169(98)00021-1
Ван Беккума, Делфт, Нидерланды, 2-3 октября 1997 г.1. Дж. Мол. Катал. А: Хим. 134, 29–45. doi:10.1016/s1381-1169(98)00021-1
Полный текст CrossRef | Google Scholar
Доуд, Э. А., Воеводин, А., Хочули, Т. Дж., Шамсор, А. М., Наколлс, К., и Рой, X. (2020). Суператомы в материаловедении. Нац.Преподобный Матер. 5, 371–387. doi:10.1038/s41578-019-0175-3
CrossRef Full Text | Google Scholar
Ernzerhof, M., and Perdew, JP (1998). Обобщенная градиентная аппроксимация к усредненному по углу и системе обменному отверстию. J. Chem. физ. 109, 3313–3320. doi:10.1063/1.476928
Полный текст CrossRef | Google Scholar
Frisch, M. J., Trucks, G. W., Schlegel, H. B., Scalmani, G., Robb, M. A., Cheeseman, J. R., et al. (2016). Гауссиан 16, Inc.Ревис. Б.01 . (Уоллингфорд, Коннектикут: Гаусс).
Google Scholar
Гао Б., Синха С., Флеминг Л. и Чжоу О. (2001). Сплавообразование в наноструктурированном кремнии. Доп. Матер. 13, 816–819. doi:10.1002/1521-4095(200106)13:11<816:aid-adma816>3.0.co;2-p
Доп. Матер. 13, 816–819. doi:10.1002/1521-4095(200106)13:11<816:aid-adma816>3.0.co;2-p
CrossRef Полный текст | Google Scholar
Грин, Массачусетс (1998). Открытие и заполнение одностенных углеродных нанотрубок (SWT). Хим. коммун. (3), 347–348. doi:10.1039/a707632k
Полный текст CrossRef | Google Scholar
Гримм, С., Энтони Дж., Эрлих С. и Криг Х. (2010). Последовательная и точная параметризация Ab Initio коррекции функциональной дисперсии плотности (DFT-D) для 94 элементов H-Pu. J. Chem. физ. 132, 154104. doi:10.1063/1.3382344
CrossRef Full Text | Google Scholar
Иванов А.С., Кар Т., Болдырев А.И. (2016). Наноразмерная стабилизация соединений Zintl: 1D ионная двойная спираль Li-P, заключенная внутри углеродной нанотрубки. Наномасштаб 8, 3454–3460. дои: 10.1039/c5nr07713c
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Иванов А.С., Моррис А.Дж., Боженко К.В. , Пикард С.Дж., Болдырев А.И. (2012). Неорганические структуры двойной спирали необычайно простых литий-фосфорных соединений. Анжю. хим. Междунар. Эд. 51, 8330–8333. doi:10.1002/anie.201201843
, Пикард С.Дж., Болдырев А.И. (2012). Неорганические структуры двойной спирали необычайно простых литий-фосфорных соединений. Анжю. хим. Междунар. Эд. 51, 8330–8333. doi:10.1002/anie.201201843
Полный текст CrossRef | Google Scholar
Джена П. и Ханна С. Н. (1996). Физика кластерно-собранных материалов. Матер. науч.англ. А 217-218, 218-222. doi:10.1016/s0921-5093(96)10361-0
Полный текст CrossRef | Google Scholar
Джена П.К., Ханна С.Н. и Рао Б.К. (1996). Стабильность и электронная структура кластерных материалов. Msf 232, 1–26. doi:10.4028/www.scientific.net/msf.232.1
Полный текст CrossRef | Google Scholar
Джонсон Э. Р., Кейнан С., Мори-Санчес П., Контрерас-Гарсия Дж., Коэн А. Дж. и Ян В. (2010). Выявление нековалентных взаимодействий. Дж. Ам. хим. соц. 132, 6498–6506. doi:10.1021/ja100936w
CrossRef Full Text | Google Scholar
Ke, J., Su, W., Howdle, S.M., George, M.W., Cook, D.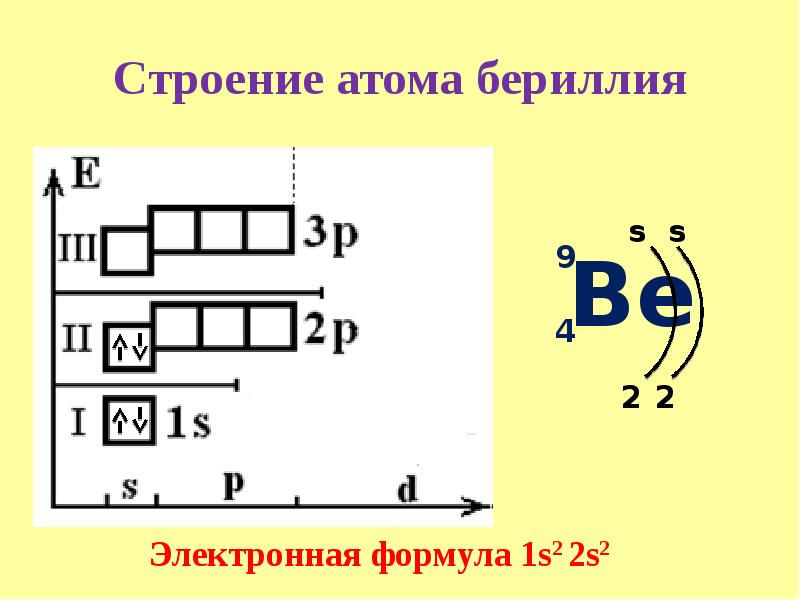 , Perdjon-Abel, M., et al. (2009). Электроосаждение металлов из сверхкритических флюидов. Проц. Натл. акад. науч. 106, 14768–14772. doi:10.1073/pnas.0
, Perdjon-Abel, M., et al. (2009). Электроосаждение металлов из сверхкритических флюидов. Проц. Натл. акад. науч. 106, 14768–14772. doi:10.1073/pnas.0
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кон, В., Бекке, А.Д., и Парр, Р.Г. (1996). Функциональная теория плотности электронной структуры. J. Phys. хим. 100, 12974–12980. doi:10.1021/jp960669l
Полный текст CrossRef | Google Scholar
Кёстер Т.К.-Дж., Салагер Э., Моррис А.Дж., Ки Б., Сезнец В., Моркретт М. и др. (2011). Разрешение различных кремниевых кластеров в Li12Si7 с помощью твердотельной ЯМР-спектроскопии 29Si и 6,7Li. Анжю. хим. Междунар. Эд. 50, 12591–12594. doi:10.1002/anie.201105998
Полный текст CrossRef | Google Scholar
Крессе Г. и Фуртмюллер Дж.(1996). Эффективные итерационные схемы для расчетов начальной полной энергии с использованием базисного набора плоских волн. Физ. Ред. B 54, 11169–11186. doi:10. 1103/physrevb.54.11169
1103/physrevb.54.11169
Полный текст CrossRef | Google Scholar
Кун А., Шрирадж П., Пёттген Р., Вимхёфер Х.-Д., Вилкенинг М. и Хейтянс П. (2011a). Диффузия ионов лития в анодном материале Li12Si7: сверхбыстрая квазиодномерная диффузия и два отчетливых быстрых трехмерных прыжковых процесса, отдельно выявленные с помощью ЯМР-релаксометрии 7Li. Дж.Являюсь. хим. соц. 133, 11018–11021. doi:10.1021/ja2020108
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Кун А., Шрирадж П., Пёттген Р., Вимхёфер Х.-Д., Вилкенинг М. и Хейтянс П. (2011b). Спектроскопия ЯМР Li на кристаллическом Li12Si7: экспериментальные доказательства ароматичности плоских циклопентадиенил-аналогов Si56- колец. Анжю. хим. Междунар. Эд. 50, 12099–12102. doi:10.1002/anie.201105081
Полный текст CrossRef | Google Scholar
Ли, Дж., Christensen, L., Obrovac, M.N., Hewitt, K.C., and Dahn, J.R. (2008). Влияние термической обработки кремниевых электродов с использованием поливинилиденфторидного связующего. Дж. Электрохим. соц. 155, А234. doi:10.1149/1.2830545
Дж. Электрохим. соц. 155, А234. doi:10.1149/1.2830545
Полный текст CrossRef | Google Scholar
Ли, Дж., Льюис, Р. Б., и Дан, Дж. Р. (2006). Карбоксиметилцеллюлоза натрия: потенциальное связующее для кремниевых отрицательных электродов литий-ионных аккумуляторов. Электрохим. Твердое состояние. лат. 10, А17. doi:10.1149/1.2398725
Полный текст CrossRef | Google Scholar
Ли, Дж., Smith, A., Sanderson, R.J., Hatchard, T.D., Dunlap, R.A., and Dahn, J.R. (2009). In Situ [sup 119]Sn Исследование эффекта Мессбауэра в реакции лития с Si с использованием зонда Sn. Дж. Электрохим. соц. 156, А283. doi:10.1149/1.3073879
Полный текст CrossRef | Google Scholar
Лу Г., Ли С., Го З., Фарха О. К., Хаузер Б. Г., Ци X. и др. (2012). Придание функциональности металлоорганическому каркасному материалу путем контролируемой инкапсуляции наночастиц. Нац. Хим. 4, 310–316. doi:10.1038/nchem.1272
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Манрике-де-ла-Куба, М. Ф., Лейва-Парра, Л., Иностроза, Д., Гомес, Б., Васкес-Эспиналь, А., Гарса, Дж., и др. (2021). Li8Si8, Li10Si9 и Li12Si10: сборки литий-кремниевых ароматических блоков. ChemPhysChem 22 (10), 906–910. doi:10.1002/cphc.202001051
Ф., Лейва-Парра, Л., Иностроза, Д., Гомес, Б., Васкес-Эспиналь, А., Гарса, Дж., и др. (2021). Li8Si8, Li10Si9 и Li12Si10: сборки литий-кремниевых ароматических блоков. ChemPhysChem 22 (10), 906–910. doi:10.1002/cphc.202001051
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Monkhorst, H. J.и Пак, Дж. Д. (1976). Специальные точки для интеграции с зоной Бриллюэна. Физ. Ред. B 13, 5188–5192. doi:10.1103/physrevb.13.5188
Полный текст CrossRef | Google Scholar
Неспер Р., Курда Дж. и фон Шнеринг Х.Г. (1986a). Li8MgSi6, новое соединение Zintl, содержащее квазиароматические кольца Si5. J. Твердотельный. хим. 62, 199–206. doi:10.1016/0022-4596(86)
-xПолный текст CrossRef | Google Scholar
Неспер, Р. (1990). Структура и химическая связь в Zintl-фазах, содержащих литий. Прог. Твердое состояние. хим. 20, 1–45. doi:10.1016/0079-6786(90)-2
Полный текст CrossRef | Google Scholar
Неспер Р. , фон Шнеринг Х.Г. и Курда Дж. (1986b). Li12Si7, eine Verbindung mit trigonal-planaren Si4-Clustern und isometrischen Si5-Ringen. Хим. Бер. 119, 3576–3590. doi:10.1002/cber.198611
, фон Шнеринг Х.Г. и Курда Дж. (1986b). Li12Si7, eine Verbindung mit trigonal-planaren Si4-Clustern und isometrischen Si5-Ringen. Хим. Бер. 119, 3576–3590. doi:10.1002/cber.198611
Полный текст CrossRef | Google Scholar
Обровац, М. Н., Кристенсен, Л., Ле, Д. Б., и Дан, Дж. Р. (2007). Конструкция сплава для анодов литий-ионных аккумуляторов. Дж. Электрохим. соц. 154, А849. doi:10.1149/1.2752985
Полный текст CrossRef | Google Scholar
Перес-Перальта Н., Контрерас М., Тизнадо В., Стюарт Дж., Дональд К. Дж. и Мерино Г. (2011). Стабилизация углерод-литиевых звезд. Физ. хим. хим. физ. 13, 12975–12980. doi:10.1039/C1CP21061K
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пинкард А., Шамсор А. М. и Рой X. (2018). Молекулярные кластеры: наноразмерные строительные блоки для твердотельных материалов. Согл. хим. Рез. 51, 919–929. doi:10.1021/acs.accounts.8b00016
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Роблес-Наварро А. , Фуэнтеальба П., Муньос Ф. и Карденас К. (2020). Электронная структура атомов первого и второго ряда в условиях гармонического удержания. Междунар. Дж. Куан. хим. 120, е26132.
, Фуэнтеальба П., Муньос Ф. и Карденас К. (2020). Электронная структура атомов первого и второго ряда в условиях гармонического удержания. Междунар. Дж. Куан. хим. 120, е26132.
Google Scholar
Рю, Дж. Х., Ким, Дж. В., Сун, Ю.-Э., и О, С. М. (2004). Режимы отказа отрицательного электрода из кремниевого порошка в литиевых вторичных батареях. Электрохим. Твердотельный латыш. 7, А306. doi:10.1149/1.17
Полный текст CrossRef | Google Scholar
Шам, Л. Дж., и Кон, В. (1966). Одночастичные свойства неоднородного взаимодействующего электронного газа. Физ. Ред. 145, 561–567. doi:10.1103/physrev.145.561
Полный текст CrossRef | Google Scholar
Шин, Х.-Дж., Хван, Дж.-Ю., Квон, Х.Дж., Квак, У.-Дж., Ким, С.-О., Ким, Х.-С., и др. . (2020). Стратегия устойчивой инкапсуляции наночастиц кремния в микроуглеродной сфере для высокопроизводительного анода литий-ионного аккумулятора. ACS Sustain. хим. англ. 8, 14150–14158. doi:10.1021/acssuschemeng.0c04828
doi:10.1021/acssuschemeng.0c04828
Полный текст CrossRef | Google Scholar
Слоан Дж., Киркланд А.И., Хатчисон Дж.Л. и Грин М.Л.Х. (2002). Интегральные архитектуры атомных слоев одномерных кристаллов, вставленных в одностенные углеродные нанотрубки. Хим. коммун. 2010, 1319–1332. doi:10.1039/b200537a
Полный текст CrossRef | Google Scholar
Спенсер Дж. Х., Несбитт Дж. М., Трюитт Х., Каштибан Р.Дж., Белл Г., Иванов В.Г. и соавт. (2014). Рамановская спектроскопия оптических переходов и энергии колебаний экстремальных нанопроволок HgTe размером ~1 нм в одностенных углеродных нанотрубках. ACS Nano 8, 9044–9052. doi:10.1021/nn5023632
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Тизнадо В., Перес-Перальта Н., Ислас Р., Торо-Лаббе А., Угальде Дж. М. и Мерино Г. (2009). Проектирование трехмерных молекулярных звезд. Дж. Ам. хим. соц. 131, 9426–9431. дои: 10.1021/ja4d
Полнотекстовая перекрестная ссылка | Google Scholar
Васкес-Эспиналь А.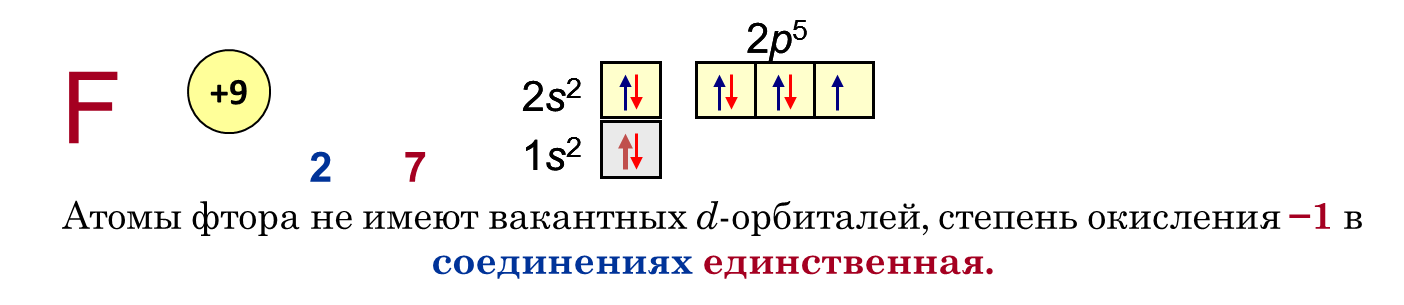 , Паласио-Родригес К., Равелл Э., Ороско-Ик М., Барросо Дж., Пан С. и др. (2018). E5M7+ (E= C-Pb, M= Li-Cs): источник жизнеспособных звездообразных скоплений. Хим. Азиат Дж. 13, 1751–1755. doi:10.1002/asia.201800654
, Паласио-Родригес К., Равелл Э., Ороско-Ик М., Барросо Дж., Пан С. и др. (2018). E5M7+ (E= C-Pb, M= Li-Cs): источник жизнеспособных звездообразных скоплений. Хим. Азиат Дж. 13, 1751–1755. doi:10.1002/asia.201800654
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Вейгенд Ф. и Альрихс Р. (2005). Сбалансированные базовые наборы расщепленной валентности, тройной дзета-валентности и четырехкратной дзета-валентности для качества от H до Rn: проектирование и оценка точности. Физ. хим. хим. физ. 7, 3297–3305. doi:10.1039/b508541a
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Wen, CJ, and Huggins, R.A. (1981). Химическая диффузия в промежуточных фазах в системе литий-кремний. J. Твердотельный. хим. 37, 271–278. doi:10.1016/0022-4596(81)
-4
Полный текст CrossRef | Google Scholar
Яньес О., Баэс-Грез Р., Иностроза Д., Рабаналь-Леон В. А., Пино-Риос Р., Гарса Дж. и др.(2019а). АВТОМАТ: программа, сочетающая вероятностные клеточные автоматы и генетический алгоритм поиска глобального минимума кластеров и молекул. J. Chem. Теор. вычисл. 15, 1463–1475. doi:10.1021/acs.jctc.8b00772
АВТОМАТ: программа, сочетающая вероятностные клеточные автоматы и генетический алгоритм поиска глобального минимума кластеров и молекул. J. Chem. Теор. вычисл. 15, 1463–1475. doi:10.1021/acs.jctc.8b00772
Полный текст CrossRef | Google Scholar
Яньес О., Гарсия В., Гарса Дж., Орельяна В., Васкес-Эспиналь А. и Тизнадо В. (2019b). (Li 6 Si 5 ) 2-5 : Наименьшие кластерные материалы на основе ароматических колец Si 5 6-. Хим. Евро.J. 25, 2467–2471. doi:10.1002/chem.201805677
Полный текст CrossRef | Google Scholar
Яньес О., Иностроза Д., Усуга-Асеведо Б., Васкес-Эспиналь А., Пино-Риос Р., Табило-Сепульведа М. и др. (2020). Оценка ограниченных вероятностных клеточных автоматов при исследовании поверхности потенциальной энергии Be6B11−. Теор. хим. Акк. 139, 41. doi:10.1007/s00214-020-2548-5
CrossRef Full Text | Google Scholar
Чжао, Л., Гранде-Ацтаци, Р., Foroutan-Nejad, C., Ugalde, JM, and Frenking, G. (2017). Ароматичность, правило Хюккеля 4 N+2 и магнитный ток. ХимияВыберите 2, 863–870. doi:10.1002/slct.201602080
Ароматичность, правило Хюккеля 4 N+2 и магнитный ток. ХимияВыберите 2, 863–870. doi:10.1002/slct.201602080
Полный текст CrossRef | Google Scholar
Zheng, X.-Y., Xie, J., Kong, X.-J., Long, L.-S., and Zheng, L.-S. (2019). Последние достижения в сборке высокоядерных кластеров лантанидов. Координ. хим. Ред. 378, 222–236. doi:10.1016/j.ccr.2017.10.023
Полный текст CrossRef | Google Scholar
Столб с гетероатомным мостиком[4]хинон: эволюционный активный катодный материал для литий-ионных аккумуляторов с использованием теории функционала плотности
Новак П., Мюллер К., Сантанам С.В. и Хасс О. 1997 Электрохимически активные полимеры для перезаряжаемых аккумуляторов Chem.Ред. 97 207
CAS Google Scholar
Арман М. и Тараскон Дж. М. 2008 Создание лучших батарей Природа 451 652
Google Scholar
Poizot P и Dolhem F 2011 Чистая энергия Новое предложение для устойчивого мира: от источников энергии, не содержащих CO 2 , до более экологичных электрохимических накопителей Energy Environ.науч. 4 2003
КАС Статья Google Scholar
Liang Y, Tao Z and Chen J 2012 Органические электродные материалы для перезаряжаемых литиевых батарей Adv. Энергия Матер. 2 742
КАС Статья Google Scholar
Nishide H и Oyaizu K 2008 В направлении гибких батарей Science 319 737
CAS пабмед Статья ПабМед Центральный Google Scholar
Guo W, Yin Y X, Xin S, Guo Y G и Wan L J 2012 Превосходный радикальный полимерный катодный материал с двухэлектронной окислительно-восстановительной реакцией, стимулируемой графеном Energy Environ. науч. 5 5221
науч. 5 5221
КАС Статья Google Scholar
Janoschka T, Hager MD и Schubert U S 2012 Carbonyls: мощные органические материалы для вторичных батарей Adv. Матер. 24 6397
КАС пабмед Статья ПабМед Центральный Google Scholar
Li Y J, Zhan H, Kong L B, Zhan C M и Zhou Y H 2007 Электрохимические свойства PABTH в качестве катодных материалов для перезаряжаемой литиевой батареи Electrochem.коммун. 9 1217
КАС Статья Google Scholar
Fanous J, Wegner M, Grimminger J, Andresen A и Buchmeiser MR 2011 Структурная электрохимия композитных катодных материалов сера-поли(акрилонитрил) для перезаряжаемых литиевых батарей Chem. Матер. 23 5024
КАС Статья Google Scholar
Амин К., Мао Л. и Вей З. 2019 Недавний прогресс в области полимерных электродных материалов на основе карбонила для литий-ионных и натрий-ионных аккумуляторов Macromol.Быстрое общение. 40 1800565
Артикул КАС Google Scholar
Song Z P, Zhan H и Zhou Y H 2010 Полиимиды: перспективные материалы для хранения энергии Angew. хим. Междунар. Эд. 49 8444
КАС Статья Google Scholar
Song Z P, Xu T, Gordin M L, Jiang Y B, Bae I T, Xiao Q F, Zhan H, Liu J and Wang D H 2012 Полимер-графеновые нанокомпозиты в качестве катодов сверхбыстрой зарядки и разрядки для перезаряжаемых литиевых батарей Nano.лат. 12 2205
КАС Статья пабмед ПабМед Центральный Google Scholar
Nokami T, Matsuo T, Inatomi Y, Hojo N, Tsukagoshi T, Yoshizawa H, Shimizu A, Kuramoto H, Komae K, Tsuyama H and Yoshida Ji 2012 Полимерсвязанный пирен-4,5,9,10- тетраон для быстрой зарядки и разрядки литий-ионных аккумуляторов большой емкости Дж. Ам. хим. соц. 134 19694
Ам. хим. соц. 134 19694
КАС пабмед Статья ПабМед Центральный Google Scholar
Hanyu Y и Honma I 2012 Перезаряжаемая квазитвердотельная литиевая батарея с органическим кристаллическим катодом Sci. 2 453
PubMed ПабМед Центральный Статья КАС Google Scholar
Liang Y L, Zhang P, Yang S Q, Tao Z L and Chen J 2013 Плавленые гетероароматические органические соединения для мощных электродов перезаряжаемых литиевых батарей Adv. Энергия Матер. 3 600
КАС Статья Google Scholar
Хуан В., Чжу З., Ван Л., Ван С., Ли Х., Тао З., Ши Дж., Гуань Л. и Чен Дж. 2013 Ангью.хим. Междунар. Эд. 52 9162
КАС Статья Google Scholar
Chen H, Armand M, Demailly G, Dolhem F, Poizot P и Tarascon J M 2008 От биомассы к возобновляемому Li x C 6 O 6 Органический электрод для устойчивых литий-ионных аккумуляторов. ChemSusChem 1 348
Liu K, Zheng J, Zhong G and Yang Y 2011 Поли(2,5-дигидрокси-1,4-бензохинонилсульфид) (PDBS) в качестве катодного материала для литий-ионных аккумуляторов Дж.Матер. хим. 21 4125
КАС Статья Google Scholar
Лян Ю. Л., Чжан П., Тао З. Л. и Чен Дж. 2013 Функционально-ориентированный дизайн электродов на основе сопряженных карбонильных соединений для литиевых батарей высокой энергии Chem. науч. 4 1330
КАС Статья Google Scholar
Чжу З., Хун М., Го Д., Ши Дж., Тао З. и Чен Дж. 2014 Полностью твердотельная литий-органическая батарея с композитным полимерным электролитом и пиллар[5]хиноновым катодом J. Являюсь. хим. соц. 136 16461
Являюсь. хим. соц. 136 16461
КАС пабмед Статья ПабМед Центральный Google Scholar
Huan L, Xie J, Chen M, Diao G W, Zhao R F и Zuo TF 2017 Теоретическое исследование пиллар[4]хинона в качестве катодного активного материала для литий-ионных аккумуляторов J. Mol. Модель. 23 105
ПабМед Статья КАС ПабМед Центральный Google Scholar
Huan L, Xie J, Huang Z L, Chen M, Diao G W и Zuo TF 2017 Вычислительная электрохимия катодного материала столба[5]хинона для литий-ионных аккумуляторов Comp.Матер. науч. 137 233
КАС Статья Google Scholar
Yokoji T, Matsubara H и Satoh M 2014 Перезаряжаемые органические литий-ионные батареи с использованием электронодефицитных бензохинонов в качестве материалов положительного электрода с высоким напряжением разряда J. Mater. хим. А 2 19347
Mater. хим. А 2 19347
КАС Статья Google Scholar
Assary R S, Brushett F R and Curtiss L A 2014 Прогнозы восстановительного потенциала некоторых ароматических азотсодержащих молекул RSC Adv. 4 57442
КАС Статья Google Scholar
Lao K and Yu C 2011 Компьютерное исследование уникальных свойств столб[n]хинонов: самосборка в трубчатые структуры и потенциальное применение в качестве акцепторов электронов и распознавателей анионов J. Comput. хим. 32 2716
КАС пабмед Статья ПабМед Центральный Google Scholar
Kumagai H, Hasegawa M, Miyanan S, Sugawa Y, Sato Y, Hori T, Ueda T, Kamiyama H and Miyano S 1997 Легкий синтез п-трет-бутилтиакаликс[4]арена по реакции п-трет -бутилфенол с элементарной серой в присутствии основания. Тетраэдр Летт. 38 3971
Тетраэдр Летт. 38 3971
König B and Fonseca M H 2000 Каликсарены с гетероатомным мостиком Eur. Дж. Неорг. хим. 11 2303
Артикул Google Scholar
Katz J L, Feldman M B и Conry R R 2005 Синтез функционализированных оксакаликс[4]аренов Org. лат. 7 91
КАС пабмед Статья ПабМед Центральный Google Scholar
Wang MX 2012 Азотные и кислородные мостиковые каликсароматики: синтез, структура, функционализация и молекулярное распознавание Acc.хим. Рез. 45 182
КАС пабмед Статья ПабМед Центральный Google Scholar
Thomas J, Rossom W V, Hecke K V, Meervelt LV, Smet M, Maes W and Dehaen W 2012 Селенаксаликс[3]триазины: синтез и химия «хозяин-гость» Chem. коммун. 48 43
коммун. 48 43
КАС Статья Google Scholar
Томас Дж., Добржанска Л., Ван Х.К., Сонаван М.П., Робейнс К., Ван М.Л., Возняк К., Смет М., Меас В. и Дехаен В. 2012 Гомоселенакаликс[4]арены: синтетические исследования и металлосупрамолекулярная химия Org.биомол. хим. 10 6526
КАС пабмед Статья ПабМед Центральный Google Scholar
Zuo C, Wiest O and Wu Y 2011 Структуры и конформации каликсаренов с гетероатомными мостиками J. Phys. Орг. хим. 24 1157
КАС Статья Google Scholar
Xie J, Shen C, Shi H, Luo S, He M и Chen M 2020 Теоретическое предсказание структур и свойств включения пиллар[n]аренов с гетероатомными мостиками Struct.хим. 31 329
КАС Статья Google Scholar
Шивакумар К.И. и Санджаян Г.Дж. 2013 Простой и многограммовый синтез пиллар[5]хинона путем окисления гипервалентным йодом 1,4-диметоксипиллар[5]арена PG, Freunberger SA, Hardwick LJ и Tarascon JM 2012 Li-O 2 и Li-S аккумуляторы с высоким запасом энергии Nature Mat. 11 19
Frisch M J, Trucks GW, Schlegel HB, Scuseria GE, Robb MA, Cheeseman JR, Scalmani G, Barone V, Mennucci B, Petersson GA, Nakatsuji H, Caricato M, Li X, Hratchian Х.П., Измайлов А.Ф., Блоино Дж., Чжэн Г., Зонненберг Дж.Л., Хада М., Эхара М., Тойота К., Фукуда Р., Хасегава Дж., Исида М., Накадзима Т., Хонда Й., Китао О., Накаи Х., Вревен Т., Монтгомери Дж.А. Jr, Peralta JE, Ogliaro F, Bearpark M, Heyd J J, Brothers E, Kudin K N, Staroverov V N, Kobayashi R, Normand J, Raghavachari K, Rendell A, Burant JC, Iyengar SS, Tomasi J, Cossi M, Рега Н., Миллам Дж. М., Клене М., Нокс Дж. Э., Кросс Дж. Б., Баккен В., Адамо С., Джарамилло Дж., Гомпертс Р., Стратманн Р. Е., Языев О., Остин А. Дж., Камми Р., Помелли С., Охтерски Дж. В., Мартин Р. Л., Морокума К., Закжевски В.Г., Вот Г.А., Сальвадор П., Данненберг Дж.Дж., Дапприх С., Дэниэлс А.Д., Фаркас О., Форесман Дж.Б., Ортиз Дж.В., Чиословски Дж. и Фокс Д.Дж. 2010 Gaussian 09, Редакция B.01. Gaussian, Inc., Wallingford, CT
Е., Языев О., Остин А. Дж., Камми Р., Помелли С., Охтерски Дж. В., Мартин Р. Л., Морокума К., Закжевски В.Г., Вот Г.А., Сальвадор П., Данненберг Дж.Дж., Дапприх С., Дэниэлс А.Д., Фаркас О., Форесман Дж.Б., Ортиз Дж.В., Чиословски Дж. и Фокс Д.Дж. 2010 Gaussian 09, Редакция B.01. Gaussian, Inc., Wallingford, CT
Zhao Y and Truhlar DG 2008 Функционалы плотности с широким применением в химии Chem. Рез. 41 157
КАС Статья Google Scholar
Zhao Y and Truhlar DG 2008 Набор функционалов плотности M06 для термохимии основных групп, термохимической кинетики, нековалентных взаимодействий, возбужденных состояний и переходных элементов: два новых функционала и систематическое тестирование четырех функционалов класса M06 и 12 других функционалов Теор.хим. Акк . 120 215
КАС Статья Google Scholar
Гленденинг Э. Д., Рид А. Э., Карпентер Дж. Э. и Вейнхольд Ф., NBO 3.1 Программа , реализованная в пакете Gaussian 09.
Ланге А.В. и Герберт Дж.М. 2010 Поляризуемые континуальные модели сольватации реакционного поля, дающие гладкие поверхности потенциальной энергии J. Phys. хим. лат. 1 556
КАС Статья Google Scholar
Jouyban A и Soltanpour S 2010 Прогнозирование диэлектрической проницаемости бинарных растворителей при различных температурах Дж.хим. англ. Данные 55 2961
Google Scholar
Zu C X и Li H 2011 Термодинамический анализ плотности энергии батарей Energy Environ. науч. 4 2614
КАС Статья Google Scholar
Bachman J E, Curtiss L A и Assary R S 2014 Исследование окислительно-восстановительной химии производных антрахинона с использованием теории функционала плотности J.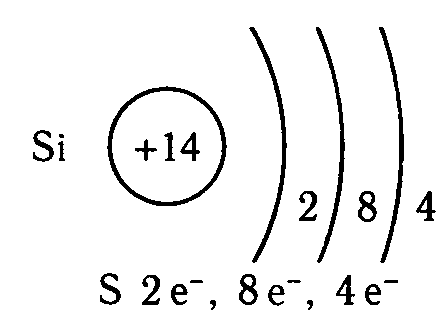 физ. хим. А 118 8852
физ. хим. А 118 8852
КАС пабмед Статья ПабМед Центральный Google Scholar
Dardenne N, Blase X, Hautier G, Charlier J-C и Rignanese G-M 2015 Ab initio расчеты напряжения с открытыми элементами в литий-ионных батареях с органическими радикалами J. Phys. хим. C 119 23373
КАС Статья Google Scholar
Маренич А.В., Хо Дж., Кут М.Л., Крамер С.Дж. и Трухлар Д.Г. 2014 Вычислительная электрохимия: предсказание потенциалов восстановления в жидкой фазе Phys.хим. хим. физ. 16 15068
КАС пабмед Статья ПабМед Центральный Google Scholar
Хамфри В., Далке А. и Шультен К. 1996 VMD: Visual Molecular Dynamics J. Mole. Графика 14 33
CAS Статья Google Scholar
Fallah-Bagher-Shaidaei H, Wannere C S, Corminboeuf C, Puchta R и Schleyer PVR 2006 Какой индекс ароматичности NICS для плоских π-колец является лучшим Org.лат. 8 863
КАС пабмед Статья ПабМед Центральный Google Scholar
Lu T и Chen F W 2012 Multiwfn: Многофункциональный анализатор волновой функции J. Comput. хим. 33 58
Google Scholar
Kim K C, Liu T, Lee S W и Jang S S 2016 Теория функционала плотности из первых принципов, моделирование связывания Li: термодинамика и окислительно-восстановительные свойства производных хинона для литий-ионных аккумуляторов J.Являюсь. хим. соц. 138 2374
КАС пабмед Статья ПабМед Центральный Google Scholar
Ченг Б. и Кайфер А.



 Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере. Далее
Далее  Мы также рассматриваем влияние теории относительности, орбитальный угловой момент L и схему связи спинового углового момента S (LS-связь) и поправку высокого порядка эффективного потенциала к сдвигу уровня. Расщепление тонкой структуры (N=5-12, L=4-9, J=L±1/2) и интервалы уровней в ридберговских состояниях рассчитаны по приведенной выше формуле и сопоставлены с последними экспериментальными данными.
Мы также рассматриваем влияние теории относительности, орбитальный угловой момент L и схему связи спинового углового момента S (LS-связь) и поправку высокого порядка эффективного потенциала к сдвигу уровня. Расщепление тонкой структуры (N=5-12, L=4-9, J=L±1/2) и интервалы уровней в ридберговских состояниях рассчитаны по приведенной выше формуле и сопоставлены с последними экспериментальными данными. 70.Джз
70.Джз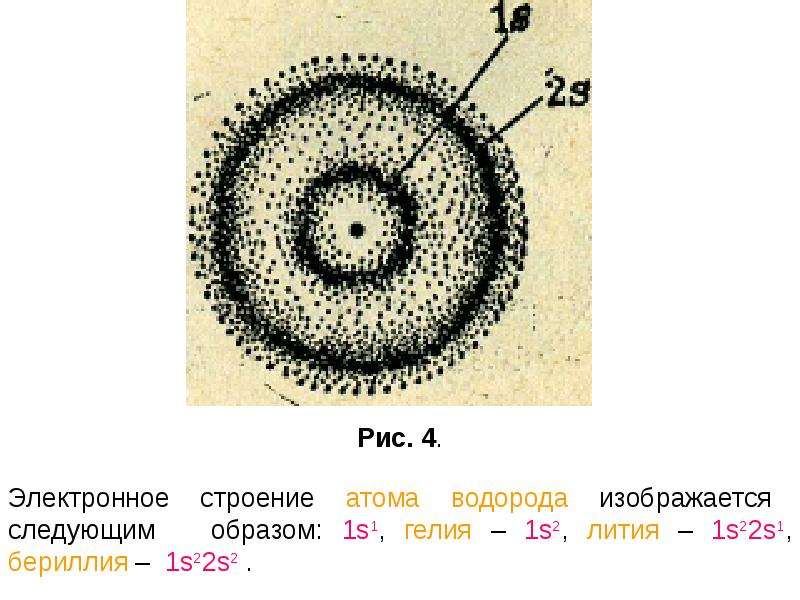 Каждая цветная нить в круге представляет собой отдельный тип онлайн-внимания. Число в центре — это альтметрическая оценка. Социальные сети и основные средства массовой информации являются основными источниками, которые подсчитывают баллы. Справочные менеджеры, такие как Mendeley, также отслеживаются, но не влияют на оценку. Старые статьи часто оцениваются выше, потому что у них было больше времени, чтобы их заметили. Чтобы учесть это, Altmetric включил контекстные данные для других статей того же возраста.
Каждая цветная нить в круге представляет собой отдельный тип онлайн-внимания. Число в центре — это альтметрическая оценка. Социальные сети и основные средства массовой информации являются основными источниками, которые подсчитывают баллы. Справочные менеджеры, такие как Mendeley, также отслеживаются, но не влияют на оценку. Старые статьи часто оцениваются выше, потому что у них было больше времени, чтобы их заметили. Чтобы учесть это, Altmetric включил контекстные данные для других статей того же возраста.