Планетарная модель атома
Литературный обзор
Модели
Первые модели строения атома появляются в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца. Однако наиболее широкое распространение получила т.н. кексовая модель атома: в 1902 г. Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца.
Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н.  опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу.
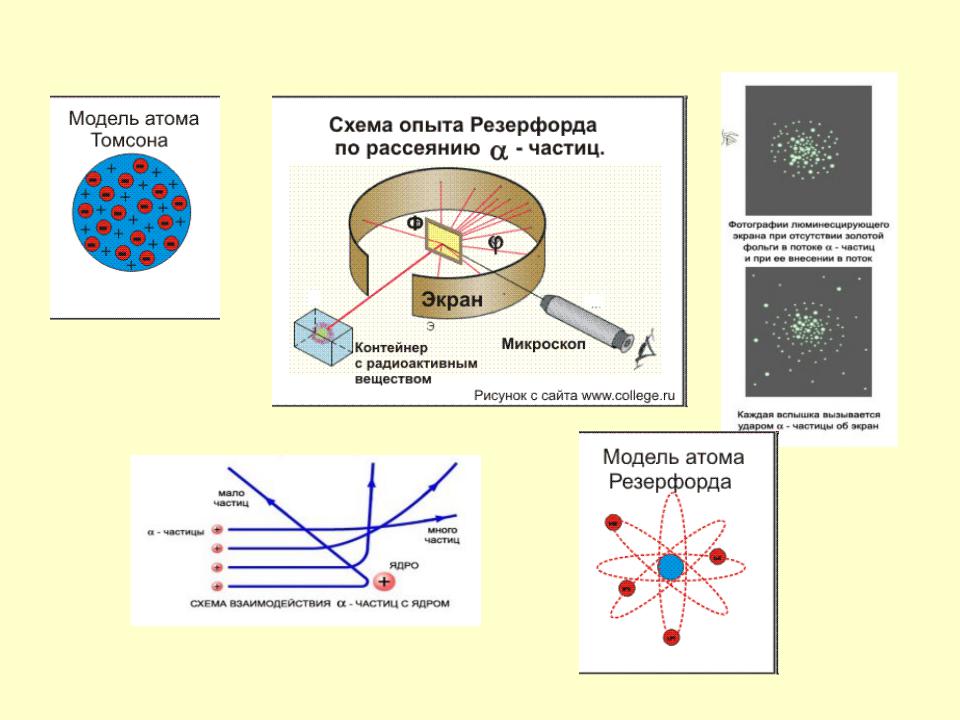
Все упомянутые модели – Томсона-Томсона, Перрена-Нагаоки и Ленарда являлись сугубо гипотетическими и исключительно качественными. В 1906-1909 гг. Ганс Гейгер, Эрнст Марсден и Эрнест Резерфорд, пытаясь найти экспериментальные подтверждения модели Томсона, провели свои знаменитые опыты по рассеиванию α-частиц на золотой фольге. Они использовали α-частицы вместо электронов, т.к. благодаря своей большей массе (в 7350 раз больше массы электрона) α-частицы не претерпевают заметного отклонения при столкновении с электронами, что позволяет регистрировать только столкновения с положительной частью атома. В качестве источника α-частиц ими был взят радий, а частицы, претерпевавшие рассеяние в тонкой золотой фольге, регистрировались по сцинтилляционным вспышкам на экране из сульфида цинка, находящемся в затемненной комнате.
Результат опытов оказался совершенно противоположным ожидаемому. Большинство α-частиц проходило через золотую фольгу по прямым или почти прямым траекториям, но в то же время некоторые α-частицы отклонялись на очень большие углы, что свидетельствовало о наличии в атоме чрезвычайно плотного положительно заряженного образования. Основываясь на этих экспериментальных фактах, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым.
Основываясь на этих экспериментальных фактах, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым.
С. И. ЛЕВЧЕНКОВ
КРАТКИЙ ОЧЕРК ИСТОРИИ ХИМИИ
Учебное пособие для студентов химфака РГУ
Copyright © С.И.Левченков, 2006.
В 1911 г. Дж.Резерфорд на основании анализа результатов эксперимента по рассеянию альфа-частиц на атомах выдвинул планетарную модель строения атома. Согласно этой модели атом состоит из тяжелого положительно заряженного ядра очень малых размеров (~1014 м), вокруг которого по некоторым орбитам движутся электроны. Радиусы этих орбит составляют порядка 10-9м. Название “планетарная” у такой модели атома отражает очевидную аналогию с Солнечной системой, в которой планеты движутся по определенным орбитам вокруг массивного притягивающего центра – Солнца.
Дж.Резерфорд на основании анализа результатов эксперимента по рассеянию альфа-частиц на атомах выдвинул планетарную модель строения атома. Согласно этой модели атом состоит из тяжелого положительно заряженного ядра очень малых размеров (~1014 м), вокруг которого по некоторым орбитам движутся электроны. Радиусы этих орбит составляют порядка 10-9м. Название “планетарная” у такой модели атома отражает очевидную аналогию с Солнечной системой, в которой планеты движутся по определенным орбитам вокруг массивного притягивающего центра – Солнца.
Однако, в отличие от планетарной модели Солнечной системы, планетарная модель атома оказывается противоречивой с точки зрения классической физики. И это, прежде всего, связано с наличием у электрона заряда.
Согласно законам классической электродинамики вращающийся вокруг ядра электрон, как и любая ускоренно движущаяся заряженная частица, будет излучать электромагнитные волны. Спектр такого излучения должен быть непрерывным, то есть содержать электромагнитные волны с любой длиной волны.
Кроме того, непрерывное излучение будет уменьшать энергию электрона. Поэтому радиус орбиты движущегося электрона обязан уменьшаться, и, в конце концов, электрон должен упасть на ядро. Иными словами, планетарная модель атома с точки зрения классической физики оказывается неустойчивой.
“Физика в техническом университете”
В рамках решения вопроса природы химической связи нами было доказано, что молекулы являются устойчивой системой, а связывающие их электроны движутся с центростремительным ускорением и при этом энергия электронов (как потенциальная, так и кинетическая) не меняется.
Этот экспериментальный факт подтверждает раз, что теории основанные на ложной модели не могут быть корректными.
18.11.2009
Строение атома. Опыты Резерфорда – Класс!ная физика
Строение атома. Опыты Резерфорда
- Подробности
- Просмотров: 713
«Физика – 11 класс»
Открытие сложного строения атома — важнейший этап становления современной физики, наложивший отпечаток на все ее дальнейшее развитие.
В процессе создания количественной теории строения атома, позволившей объяснить атомные спектры, были открыты новые законы движения микрочастиц — законы квантовой механики.
Модель Томсона
Первая модель атома была предложена английским физиком Дж. Дж. Томсоном, открывшим электрон.
По мысли Томсона, положительный заряд атома занимает весь объем атома и распределен в этом объеме с постоянной плотностью.
Простейший атом (атом водорода) представляет собой положительно заряженный шар радиусом около 10-8 см, внутри которого находится электрон.
У более сложных атомов в положительно заряженном шаре находится несколько электронов, так что атом подобен кексу, в котором роль изюминок выполняют электроны.
Однако модель атома Томсона оказалась в полном противоречии с известными уже к тому времени свойствами атома, главным из которых является
Опыты Резерфорда
Масса электронов в несколько тысяч раз меньше массы атомов.
Так как атом в целом нейтрален, то, следовательно, основная масса атома приходится на его положительно заряженную часть.
Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц.
Эти частицы возникают при распаде радия и некоторых других элементов.
Это не что иное, как полностью ионизированные атомы гелия.
Скорость α-частиц очень велика: она составляет 1/15 скорости света.
Этими частицами Резерфорд бомбардировал атомы тяжелых элементов.
Электроны вследствие своей малой массы не могут заметно изменить траекторию а-частицы, подобно тому как камушек в несколько десятков граммов при столкновении с автомобилем не может значительно изменить его скорость.
Рассеяние (изменение направления движения) α-частиц может вызвать только положительно заряженная часть атома.
Таким образом, по рассеянию α-частиц можно определить характер распределения положительного заряда и массы внутри атома.
Схема опытов Резерфорда:
Радиоактивный препарат, например радий, помещался внутри свинцового цилиндра 1, вдоль которого был высверлен узкий канал.
Пучок -частиц из канала падал на тонкую фольгу 2 из исследуемого материала (золото, медь и пр.).
После рассеяния α-частицы попадали на полупрозрачный экран 3, покрытый сульфидом цинка.
Столкновение каждой частицы с экраном сопровождалось вспышкой света (сцинтилляцией), которую можно было наблюдать в микроскоп 4.
Весь прибор размещался в сосуде, из которого был откачан воздух.
При хорошем вакууме внутри прибора в отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных тонким пучком α-частиц.
Но когда на пути пучка помещали фольгу, α-частицы из-за рассеяния распределялись на экране по кружку большей площади.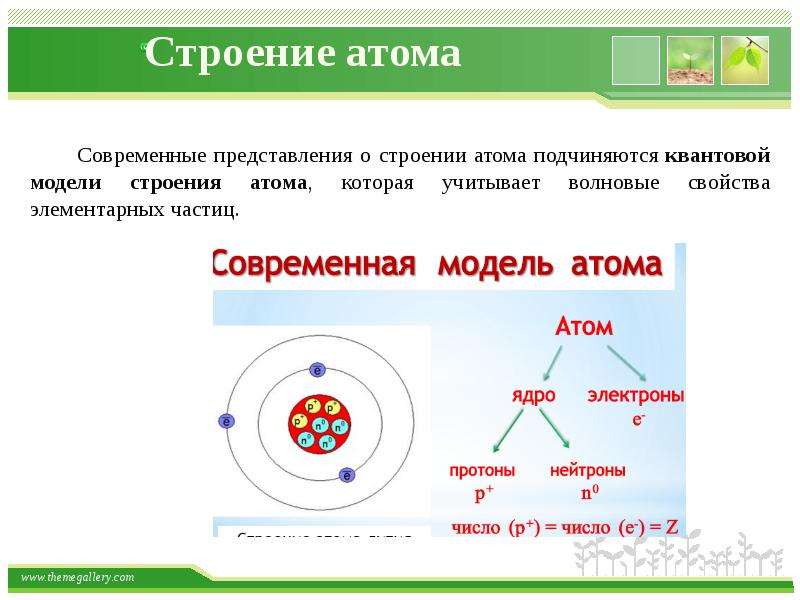
Модифицируя экспериментальную установку, Резерфорд попытался обнаружить отклонение α-частиц на большие углы.
Для этого он окружил фольгу сцинтилляциоными экранами и определил число вспышек на каждом экране.
Совершенно неожиданно оказалось, что небольшое число α-частиц (примерно одна из двух тысяч) отклонилось на углы, большие 90°.
Позднее Резерфорд признался, что, предложив своим ученикам провести эксперимент по наблюдению за рассеянием α-частиц на большие углы, он сам не верил в положительный результат.
В самом деле, предвидеть этот результат на основе модели Томсона было нельзя.
При распределении по всему атому положительный заряд не может создать достаточно сильное электрическое поле, способное отбросить α-частицу назад.
Максимальная сила отталкивания может быть определена по закону Кулона:
где
qα — заряд α-частицы;
q – положительный заряд атома;
R — его радиус;
k — коэффициент пропорциональности.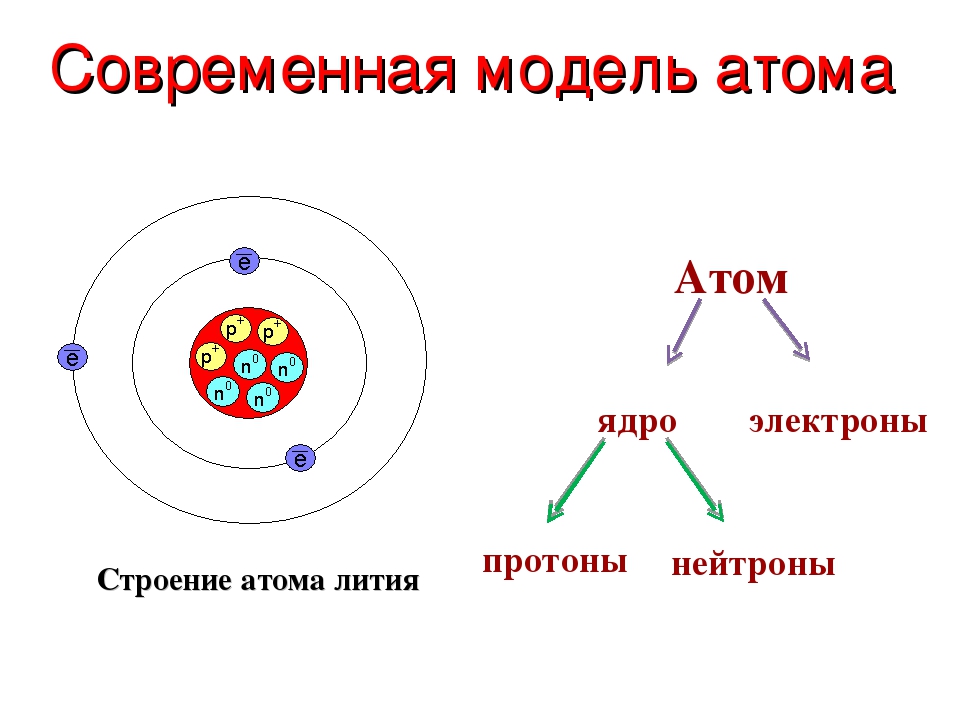
Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру.
Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
Резерфорд понял, что α-частица могла быть отброшена назад лишь в том случае, если положительный заряд атома и его масса сконцентрированы в очень малой области пространства.
Так Резерфорд пришел к мысли о существовании атомного ядра — тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
На рисунке показаны траектории α-частиц, пролетающих на различных расстояниях от ядра.
Подсчитывая число α-частиц, рассеянных на различные углы, Резерфорд смог оценить размеры ядра.
Оказалось, что ядро имеет диаметр порядка 10-12—10-13 см (у разных ядер диаметры различны).
Размер же самого атома 10-8 см, т.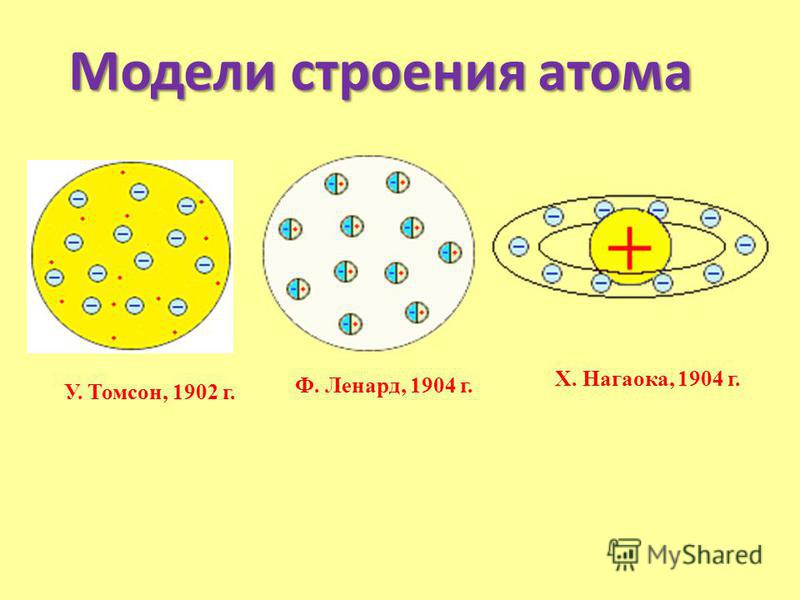 е. в 10—100 тысяч раз превышает размеры ядра.
е. в 10—100 тысяч раз превышает размеры ядра.
Впоследствии удалось определить и заряд ядра.
При условии, что заряд электрона принят за единицу, заряд ядра в точности равен номеру данного химического элемента в периодической системе Д. И. Менделеева.
Планетарная модель атома
На основе своих опытов Резерфорд создал планетарную модель атома.
В центре атома расположено положительно заряженное ядро, в котором сосредоточена почти вся масса атома.
В целом атом нейтрален.
Поэтому число внутриатомных электронов, как и заряд ядра, равно порядковому номеру элемента в периодической системе.
Ясно, что покоиться электроны внутри атома не могут, так как они упали бы на ядро.
Они движутся вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Такой характер движения электронов определяется действием кулоновских сил притяжения со стороны ядра.
В атоме водорода вокруг ядра обращается всего лишь один электрон.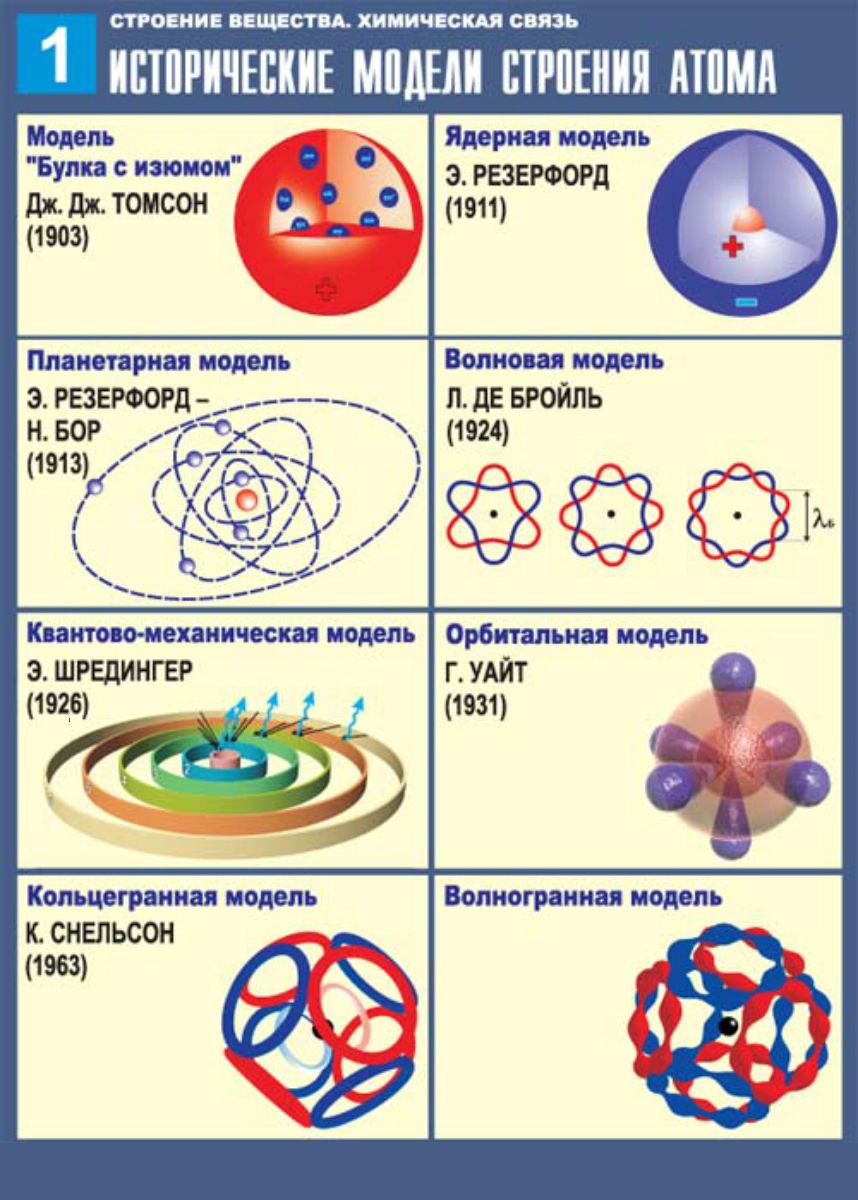
Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу, примерно в 1836,1 раза бо́льшую массы электрона.
Это ядро было названо протоном и стало рассматриваться как элементарная частица.
Размер атома водорода — это радиус орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование.
Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц.
Но на основе этой модели нельзя объяснить факт существования атома, его устойчивость.
Ведь движение электронов по орбитам происходит с ускорением, причем весьма немалым.
Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра.
Излучение сопровождается потерей энергии.
Теряя энергию, электроны должны приближаться к ядру, подобно тому как спутник приближается к Земле при торможении в верхних слоях атмосферы.
Как показывают расчеты, основанные на механике Ньютона и электродинамике Максвелла, электрон за ничтожно малое время (порядка 10-8 с) должен упасть на ядро.
Атом должен прекратить свое существование.
В действительности ничего подобного не происходит.
Атомы устойчивы и в невозбужденном состоянии могут существовать неограниченно долго, совершенно не излучая электромагнитные волны.
Не согласующийся с опытом вывод о неизбежной гибели атома вследствие потери энергии на излучение — это результат применения законов классической физики к явлениям, происходящим внутри атома.
Отсюда следует, что к таким явлениям законы классической физики неприменимы.
Резерфорд создал планетарную модель атома: электроны обращаются вокруг ядра, подобно тому как планеты обращаются вокруг Солнца.
Эта модель проста, обоснована экспериментально, но не позволяет объяснить устойчивость атома.
Источник: «Физика – 11 класс», учебник Мякишев, Буховцев, Чаругин
Атомная физика.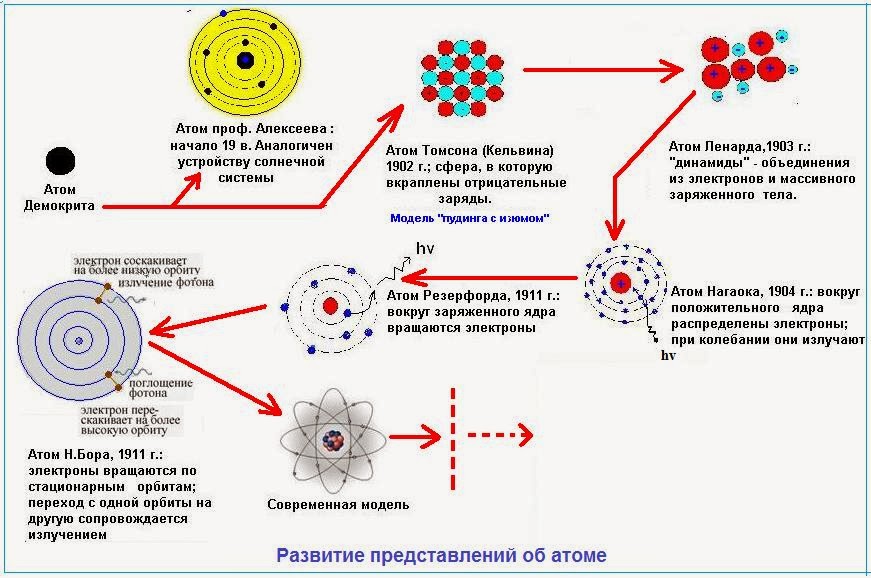 Физика, учебник для 11 класса – Класс!ная физика
Физика, учебник для 11 класса – Класс!ная физика
Строение атома. Опыты Резерфорда — Квантовые постулаты Бора. Модель атома водорода по Бору. Трудности теории Бора. Квантовая механика — Лазеры — Краткие итоги главы
просто и понятно о его модели в физике
ИсторияИстория
Еще с давних времен мыслители, философы и первые ученые мужи предполагали, что все сущее, материя, воздух, вода, все состоит из неких мельчайших частиц – атомов. Основоположником атомарной теории строения мира был древнегреческий философ и ученый Демокрит, хотя, скорее всего не он был первым автором этой идеи – Демокрит много путешествовал по тогдашней ойкумене и учение о строении атомов мог перенять у халдейских и/или египетских жрецов, по совместительству блестящих ученых древнего мира.
Согласно учению Демокрита даже человеческая душа состоит из атомов. Он также объяснял многие особенности разных веществ, например, огонь, согласно Демокриту, потому печет, что атомы из которых он состоит острые, а твердые тела именно потому твердые, что атомы из которых они состоят крепко сцеплены между собой.
Учение Демокрита вызвало многие споры среди античных философов (в целом охочих к этому занятию), в частности частым предметом дискуссий и рассуждений был вопрос о делимости/неделимости атома и если атом таки делится, рассуждали философы, то делятся ли в свою очередь его мельчайшие частицы, и до каких пор происходит это деление? Некоторые же мудрецы считали атом мельчайшей неделимой частицей, ведь само название этого слова «atomos» на древнегреческом означало «неделимый».
Правда античные мудрецы дальше теоретических дискуссий так и не зашли, затем на смену античности пришло мрачное средневековье и стало не до атомов. Новый интерес к атомам, основным сведениям об их строении уже возник в XIX веке, времени нового расцвета науки и техники. Так уже с практическими опытами ученым стало понятно, что атом не является неделимым, а в 1860 году было сформулировано академическое понятие атома и молекулы.
Так уже с практическими опытами ученым стало понятно, что атом не является неделимым, а в 1860 году было сформулировано академическое понятие атома и молекулы.
XX век стал подлинным временем прорыва наших знаний об атоме, в том числе блестящие ученые физики Нильс Бор и Эрнест Резерфорд предложили так званую планетарную модель атома, сравнив его с планетной системой, где подобно тому как планеты вращаются вокруг Солнца, электроны в атоме вращаются вокруг атомного ядра, состоящего из протонов и нейтронов. Любопытно, что подобные рассуждения перекликаются с представлениями древних, ведь еще легендарный Гермес Трисмегист говорил «что вверху, то внизу», или другими словами строение планетных систем и галактик подобно строению мельчайшей частицы – атома.
Модели
Помимо модели Бора/Резерфорда были и другие, например, модель Томпсона, полагавшего, что атом является положительно заряженным телом, внутри которого располагаются электроны. Эту модель опроверг Резерфорд.
Также стоит отметить планетарную модель атома Нагаоки, предполагавшего, что строение атома подобно планете Сатурн, у которого вокруг ядра вращаются объединенные в кольца электроны.
Закономерным развитием общепризнанной планетарной модели Бора/Резерфорда стала квантовая модель строения атома, утверждающая, что в ядре атома находятся не имеющие заряда нейтроны, положительно заряженные протоны, а вокруг летают отрицательно заряженные электроны. При этом траектории движения электронов согласно законам квантовой механики наперед не заданы.
Разумеется, все модели строение атомы являются весьма упрощенными вариантами, подлинное строение атома куда более сложное.
Периодический закон Менделеева
Строение и свойства атомов различных химических элементов прямо связаны с местом последних в знаменитой таблице Менделеева. Там они расположены согласно электрическим зарядам своих ядер, зависящего от количества протонов (как помним заряженных положительно) и электронов, летающих вокруг ядра и заряженных отрицательно.
Электронная оболочка атомов
Электронная оболочка атомов имеет ровно столько электронов, сколько есть в его ядре протонов, именно благодаря этому атом является нейтрально заряженным – количество положительно и отрицательно заряженных частиц уравнивают друг друга.
Формула
Наряду с появлением планетарной теории строения атома появились и формулы, описывающие это самое строение для атомов разных химических элементов. Например, формулу строения атома азота можно описать как – 1s22s22p3, строение атома натрия – 1s22s22p63s1. Эти формулы показывают, какое количество электронов движется по каждой из орбит того или иного химического элемента.
Современная модель
В наше время физика не стоит на месте и с момент создания канонической планетарной модели атома Бора/Резерфорда было сделано много интересных открытий относительно устройства атома. Так, например, мы уже знаем что протоны, из которых состоит атомное ядро, сами в свою очередь состоят из еще более мелких элементарных частиц – кварков. Но кварки, также далеко не самые мелкие частицы, меньше их открытые загадочные нейтрино, о которых на нашем сайте есть интересная статья.
Видео
И в завершение познавательное видео про электронное строение атома и атомного ядра.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
“Строение атома. Планетарная модель атома” (2 курс)
Строение атома. Опыт Резерфорда.
В 1897 г. английский физик Дж. Томсон открыл электрон. Существование в веществе электронов наводило на мысль, что эти отрицательно сраженные частицы входят в состав нейтральных атомов. Но отсюда следовало, что в атоме должны находиться и положительно заряженные частицы. Как расположены заряженные частицы внутри атома?
Как расположены заряженные частицы внутри атома?
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой положительно заряженная часть атома является равномерно заряженным шаром. В этот шар «вкраплены» электроны в таком количестве, чтобы атом в целом был нейтральным (рис. 8.1). (рис. 8.1).
Эта модель получила шутливое название «пудинг-модель», поскольку электроны в ней были уподоблены изюминкам в пудинге. Для подтверждения правильности этой модели необходимо было провести опытное исследование распределения заряда внутри атома.
Такое исследование в 1911 г. было осуществлено Э. Резерфордом и его сотрудниками с помощью α-частиц. Альфа-частицы представляют собой положительно заряженные частицы с зарядом +2е и массой, приблизительно в 4 разя большей, чем масса атома водорода. Скорость α-частиц достигает порядка 10 м/с. С помощью таких частиц, обладающих достаточно большими энергиями, «простреливали» металлическую фольгу и изучали рассеяние а-частиц, т. е. их отклонение от первоначального направления движения.
е. их отклонение от первоначального направления движения.
Альфа-частицы испускались источником 1, помещенным внутри полости с каналом 2, сделанным в куске свинца (рис. 8.2). Все частицы, кроме движущихся вдоль канала, поглощались свинцом. Узкий пучок а-частиц попадал на металлическую фольгу 3 перпендикулярно ее поверхности. Прошедшие сквозь фольгу, а-частицы, при столкновении с полупрозрачным экраном 4 вызывали вспышки света, которые наблюдались в микроскоп 5.
Условия эксперимента обеспечивали достаточный вакуум в пространстве между фольгой и экраном, чтобы не происходило дополнительного рассеяния а-частиц в воздухе.
Было обнаружено, что почти все а-частицы, прошедшие сквозь фольгу, сохраняли прежнее направление своего движения или отклонялись на малые углы. Однако некоторые а-частицы отклонялись на большие углы (почти до 180°). Э. Резерфорд по этому поводу говорил, что это было «невероятно так же, как если бы вы выстрелили пятнадцатифунтовым снарядом в папиросную бумагу, а снаряд отскочил бы обратно и попал в вас».
Этому неожиданному факту надо было дать объяснение. Резерфорд предположил, что это возможно, если весь положительный заряд внутри атома сосредоточен в его ядре — области, занимающей весьма малый объем по сравнению со всем объемом атома. Электроны движутся вокруг ядра, иначе они упали бы на ядро. Полный отрицательный заряд электронов равен положительному заряду ядра (рис. 8.3) .
Эта модель атома Резерфорда напоминает Солнечную систему: в центре находится «солнце» — ядро, а вокруг него по орбитам движутся «планеты»— электроны. Поэтому модель получила название – планетарной. Согласно этой модели ядро имеет линейные размеры порядка 10–15—10 -14 м, вокруг ядра в области размером
10 -10 м по орбитам движутся электроны. Почти вся масса атома сосредоточена в ядре. С помощью планетарной модели атома были объяснены результаты опыта по рассеянию а-частиц. Почти все а-частицы проходят сквозь вещество практически не отклоняясь, так как большая часть пространства атома пуста
(рис. 8.4). Альфа-частицы, которые встречаются с электронами на своем пути в фольге, также практически не рассеиваются, и только немногие а-частицы — те, которые проходят вблизи от ядра, испытывают значительные отклонения под действием электрического поля ядра.
8.4). Альфа-частицы, которые встречаются с электронами на своем пути в фольге, также практически не рассеиваются, и только немногие а-частицы — те, которые проходят вблизи от ядра, испытывают значительные отклонения под действием электрического поля ядра.
Таким образом, на основе планетарной модели можно было объяснить результаты опытов по рассеянию а-частиц. Однако объяснить стабильность атомов не удавалось. Рассмотрим простейший атом — атом водорода, состоящий из ядра — протона и одного электрона (рис. 8.5).
Движение электрона в атоме по замкнутой орбите происходит с ускорением. В соответствии с классической электродинамикой это движение электрона должно было сопровождаться излучением электромагнитных волн, в результате чего энергия электрона в атоме непрерывно уменьшалась бы. Электрон стал бы приближаться к ядру по спирали и должен бы упасть на него, причем это должно произойти за 10 -8 с. Однако атом стабилен. Следовательно, планетарная модель атома противоречила законам классической физики.
Выполнить задания по тексту:
1.Согласно планетарной модели атома заряд и почти вся масса атома сосредоточены , а электроны _________________________.
2.Заполни таблицы:
Опыт по рассеянию а-частиц:
Небольшое число α-частиц отклоняется на угол, равный = 180°3.Ответить на вопросы:
Строение атома (ядро + электроны) напоминает строение Солнечной системы (Солнце + планеты). В чем различие между ними?
Под действием каких сил а-частицы отклонялись от прямолинейных траекторий в опыте Резерфорда?
В чем недостатки планетарной модели атома?
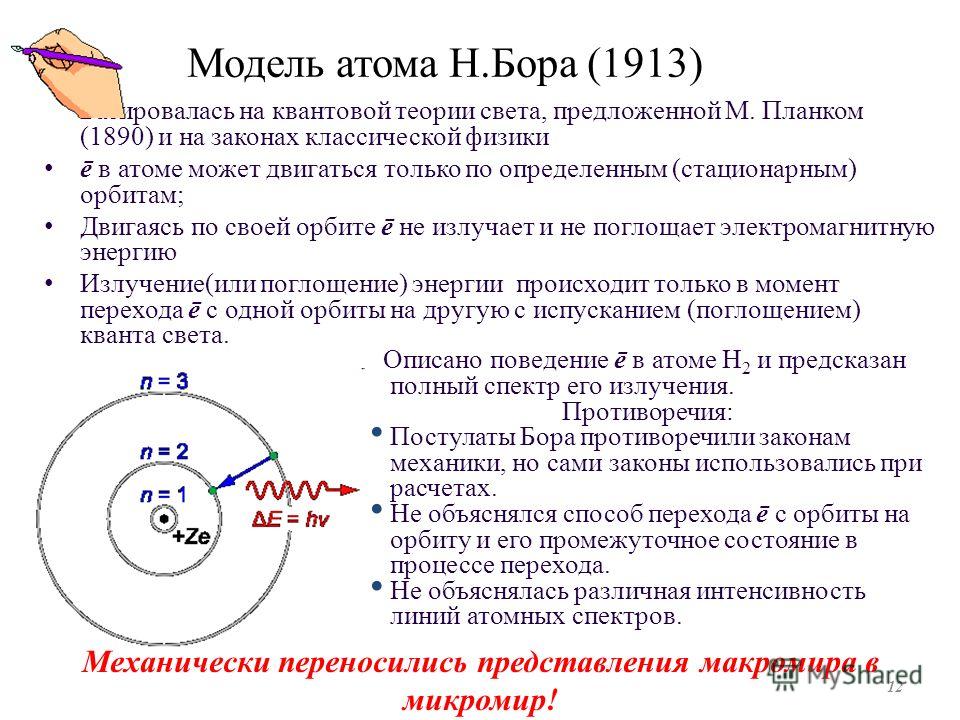
Квантовые постулаты Бора.
Важным этапом в развитии современной физики стала модель построения
неклассической теории атома, предложенная Н. Бором в 1913 г.
В основе боровской теории строения атома лежала идея объединить планетарную модель атома Резерфорда и квантовую теорию излучения и поглощения электромагнитных волн.
Для осуществления этой идеи Н. Бор не отказался от применения законов классической физики к описанию поведения электронов в атоме, но дополнил его некоторыми ограничениями, которые накладывались на возможные состояния электронов в атоме. Эти ограничения были сформулированы в виде постулатов, которые называют постулатами Бора.
Первый постулат Бора (постулат стационарных состоянии) заключается в следующем:
Существуют стационарные состояния атома, находясь в которых он не излучает электромагнитных волн.
Стационарным состояниям атома соответствуют вполне определенные (стационарные) орбиты, по которым движутся электроны. При этом, несмотря на то что электроны движутся по своим орбитам с ускорением, они не излучают электромагнитных волн. Таким образом, в первом постулате Бора содержится отказ от вывода электродинамики о том, что ускоренно движущийся электрический заряд всегда излучает электромагнитные волны.
Второй постулат Бора (правило частот) устанавливает следующее:
При переходе атома из одного стационарного состояния в другое испускается или поглощается один фотон, энергия которого равна разности энергий атома в двух его стационарных состояниях:
ΔЕ = Еm −En = hv, (8. 1)
1)
где Еm и Еп — энергии атома, находящегося в состояниях тип соответственно.
Излучение фотона происходит при переходе атома из состояния с большей энергией в состояние с меньшей энергией, например при переходе электрона с
орбиты, более удаленной от ядра, на ближнюю к ядру орбиту (рис. 8.6, а).
Поглощение фотона сопровождается переходом атома в состояние с большей
энергией (рис. 8.6, б).
Для наглядного представления возможных энергетических состояний атомов используются диаграммы, на которых каждое стационарное состояние атома,
характеризуемое определенной энергией, отмечается горизонтальной линией.
Энергетический уровень, соответствующий состоянию атома с минимальной энергией Е1 называется основным и располагается ниже всех остальных на диаграмме. Над ним расположены энергетические уровни других стационарных состояний, называемых возбужденными.
Переходу электрона со стационарной орбиты под номером т на стационарную орбиту под номером п (рис. 8.7, а) соответствует переход атома из состояния с энергией Еm
8.7, а) соответствует переход атома из состояния с энергией Еm
в состояние с энергией Еп. Этот переход на энергетической диаграмме обозначается вертикальной стрелкой от уровня, соответствующего энергии Еm, к уровню, соот-
ветствующему энергии Еn (рис. 8.7, б).
Выразим из формулы 8.1 частоту света, излучаемого при переходе из состояния m в состояние n:
Из второго постулата Бора следует, что атомы поглощают излучение той же самой частоты, которую они сами испускают.
Постулат Бора о существовании стационарных состояний атомов и правило частот Бора в дальнейшем экспериментально подтвердились в опытах Франка
и Герца.
Теория Бора сыграла огромную роль в создании атомной физики, однако в ней с самого начала обнаружились существенные недостатки. Главным из них была внутренняя противоречивость теории. Наиболее серьезной неудачей в теории Бора явилась невозможность создать с ее помощью теорию атома гелия, содержащего помимо ядра два электрона.
Выполнить задания по тексту:
1.Заполни таблицу:
2. Постулаты Бора (дописать предложения)
1. Существуют_________________________________состояния атома, находясь
в которых он ___________________________________________________________ .
2.При переходе атома из одного стационарного состояния в другое испускается или поглощается , энергия которого равна _____________ .
3. Составить энергетическую диаграмму излучения и поглощения света атома водорода.
Заполни таблицу:
Самостоятельная работа на тему: «Строение атома. Опыт Резерфорда».
Вариант1
1.Согласно планетарной модели атома заряд и почти вся масса атома сосредоточены _______________, а электроны _________________________.
2.Заполни таблицу:
Спектр атома непрерывный
Ответить на вопрос: Под действием каких сил α-частицы отклонялись от прямолинейных траекторий в опыте Резерфорда?
Ответ____________________________________________________________________________________________________________________________________________________
Самостоятельная работа на тему: «Строение атома.
 Опыт Резерфорда».
Опыт Резерфорда».Вариант2
Строение атома (ядро + электроны) напоминает строение Солнечной системы (Солнце + планеты). В чем различие между ними?
Ответ_______________________________________________________________________________________________________________________________________________________________________________________________________________
2.Заполни таблицу:
Альфа-частицы представляют собой_____________________
_____________________________________ с зарядом +2е и массой, приблизительно в__________________________, чем масса атома _____________________________ .
4. Постулаты Бора (дописать предложения)
1. Существуют_______________________состояния атома, находясь в которых он __________________________.
2.При переходе атома из одного стационарного состояния в другое испускается или поглощается________________________ ______________________энергия которого равна _____________ .

5. Составить энергетическую диаграмму излучения и поглощения света атома водорода.
Студент___________________________ группы__________
Дата________________________ Оценка________________
4. Постулаты Бора (дописать предложения)
1. Существуют_______________________состояния атома, находясь в которых он __________________________.
2.При переходе атома из одного стационарного состояния в другое испускается или поглощается________________________ ______________________энергия которого равна _____________ .
5. Заполни таблицу:
Студент___________________________ группы__________
Дата________________________ Оценка________________
Самостоятельная работа на тему: «Строение атома. Опыт Резерфорда».
Вариант3
В чем недостатки планетарной модели атома?
Ответ:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ .

Заполни таблицу: Опыт по рассеянию а-частиц:
Небольшое число α-частиц отклоняется на угол,равный = 180°
В 1903 г. Дж. Томсон предложил модель строения атома, согласно которой _______________________часть атома является _____________________________заряженным шаром. В этот шар «вкраплены»_______________________, чтобы атом в целом был _________________________________________ .
4. Постулаты Бора (дописать предложения)
1. Существуют_______________________состояния атома, находясь в которых он __________________________.
2.При переходе атома из одного стационарного состояния в другое испускается или поглощается________________________ ______________________энергия которого равна _____________
_____________________________________________________ .
5. Заполни таблицу:Студент___________________________ группы__________
Дата________________________ Оценка________________
§ 33 учебника физики для 11 класса (К.
 Ю. Богданов)
Ю. Богданов)§ 33. строение атома. опыты резерфорда
Атом состоит из компактного и массивного положительно заряженного ядра и отрицательно заряженных легких электронов, обращающихся вокруг него.
Раздел физики, изучающий строение и состояние атомов, называют атомной
физикой. Реальные сомнения в том, что атом является неделимой материальной
частицей, появились в конце 19-го века, когда английский физик Дж. Томсон
открыл электрон, входящий в состав электронейтрального атома. Из экспериментов
следовало, что масса электрона примерно в 2000 раз меньше массы самого лёгкого
атома, а значит, основная часть массы атома заряжена положительно. В 1903 г.
Томсон предложил модель строения атома, согласно которой атом имеет форму шара
диаметром около 10-10 м (расстояние между узлами кристаллической
решётки твёрдых тел), внутри которого равномерно распределён положительный
заряд, а отрицательно заряженные электроны находятся внутри этого шара, как
изюминки в кексе (рис.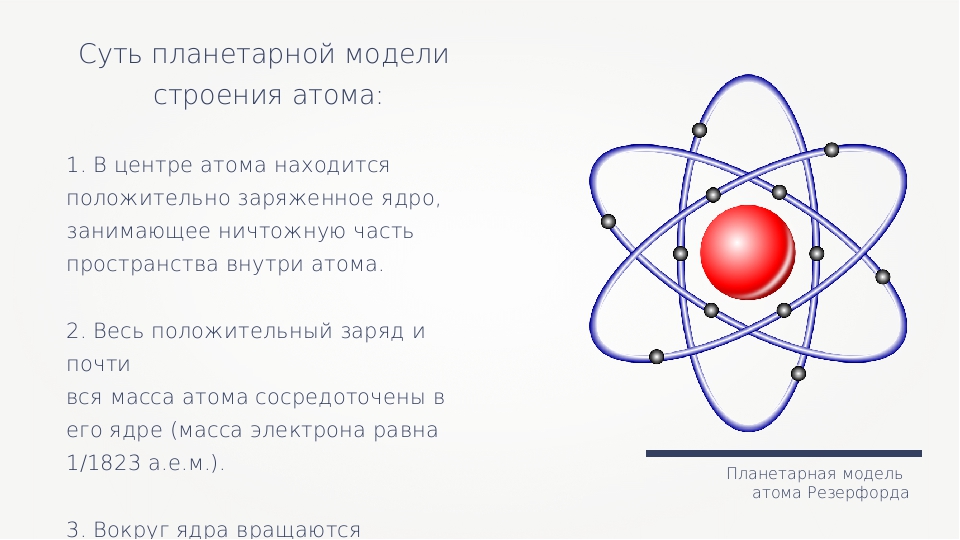 33а).
33а).
В 1909–1911 годах английский физик Э. Резерфорд и его сотрудники Х. Гейгер и Э. Марсден исследовали структуру атома с помощью быстрых положительно заряженных частиц. В качестве таких частиц были использованы так называемые a-частицы, возникающие при распаде радия и некоторых других радиоактивных элементов. Заряд a-частиц равен двум элементарным, а масса – примерно 4 а.е.м. Установка, использованная Резерфордом в этих опытах (рис. 33б), состояла из свинцового контейнера 1, содержащего крупицу радия, из которого вдоль узкого канала вылетал пучок a-частиц 2, падающий на лист тонкой металлической фольги 3. За фольгой был помещен полупрозрачный цилиндрический экран 4, покрытый кристаллами сульфида цинка, свечение которых под ударами a-частиц наблюдали с помощью микроскопа 5.
В опытах Резерфорда a-частицы
сталкиваются с атомами фольги, и при каждом таком столкновении a-частица,
пролетая через электрическое поле атома, изменяет направление движения (испытывает
рассеяние).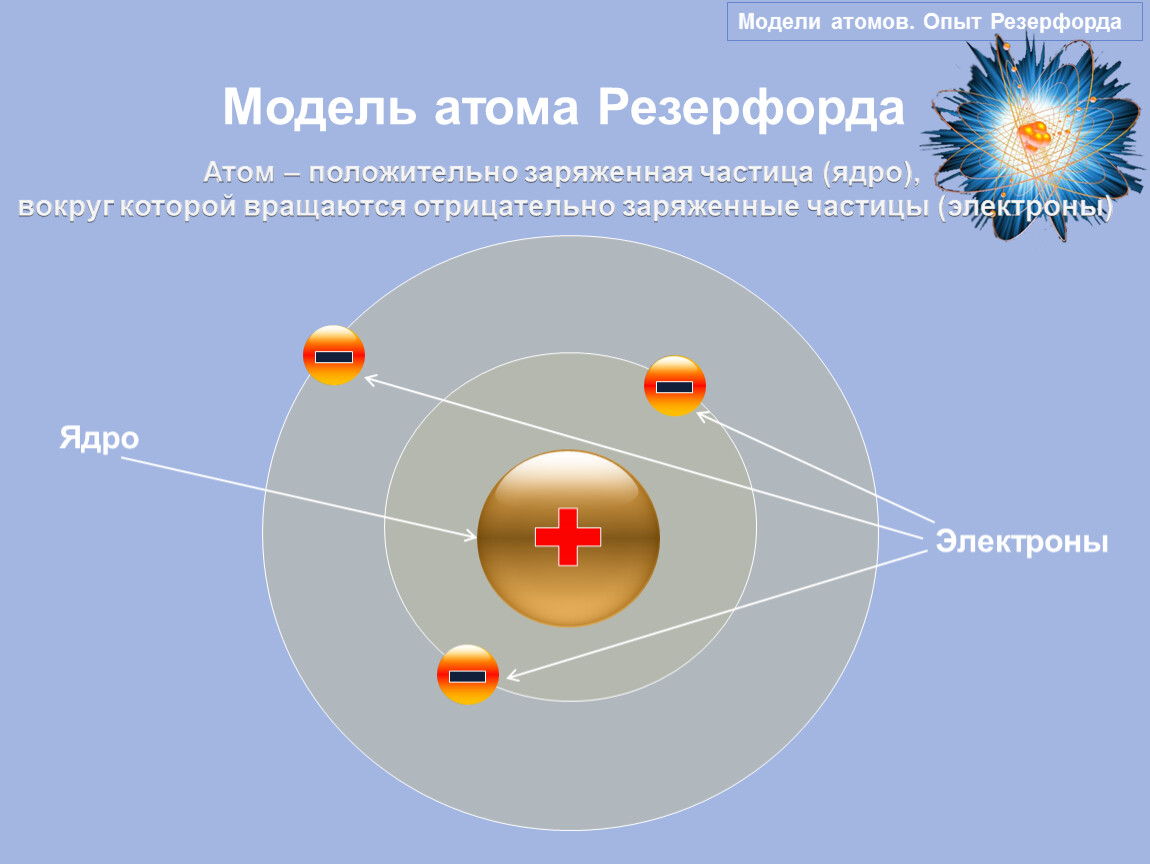 Электроны, имеющие гораздо меньшую массу, чем a-частица,
не могут изменять направление движения a-частиц. Поэтому, изучая
рассеяние a-частиц можно оценить размеры положительно
заряженной части атома. Оказалось, что бóльшая часть a-частиц,
несущихся со скоростью около 1/15 скорости света, проходит через тонкую фольгу
почти не рассеиваясь, что соответствовало модели атома Томсона, в которой
положительный заряд был равномерно распределён по объёму всего атома (рис. 33а).
Однако очень малая доля a-частиц отклонялась
на углы более 90°(см. рис. 33б), что было невозможно объяснить,
пользуясь моделью Томсона, т.к. электрическое поле однородно заряженного
шара недостаточно велико на его поверхности и убывает до нуля по мере
приближения к центру шара.
Электроны, имеющие гораздо меньшую массу, чем a-частица,
не могут изменять направление движения a-частиц. Поэтому, изучая
рассеяние a-частиц можно оценить размеры положительно
заряженной части атома. Оказалось, что бóльшая часть a-частиц,
несущихся со скоростью около 1/15 скорости света, проходит через тонкую фольгу
почти не рассеиваясь, что соответствовало модели атома Томсона, в которой
положительный заряд был равномерно распределён по объёму всего атома (рис. 33а).
Однако очень малая доля a-частиц отклонялась
на углы более 90°(см. рис. 33б), что было невозможно объяснить,
пользуясь моделью Томсона, т.к. электрическое поле однородно заряженного
шара недостаточно велико на его поверхности и убывает до нуля по мере
приближения к центру шара.
Чтобы объяснить, почему некоторые a-частицы
могут быть отброшены назад атомом, Резерфорд предложил принципиально новую модель
атома, в которой весь положительный заряд атома и почти вся его масса
сконцентрированы в теле очень малых размеров атомном ядре. Такую модель
атома называют ядерной. Согласно оценкам Резерфорда диаметр атомных ядер
должен составлять 10-14 – 10-15 м. Таким образом, размеры
атома в 104-105 раз превышают размеры его ядра, а
максимальная напряжённость электрического поля в ядерной модели атома превышает
его напряжённость в модели Томсона в 108-1010 раз, что и
делает возможным рассеяние быстрых a-частиц на большие
углы.
Такую модель
атома называют ядерной. Согласно оценкам Резерфорда диаметр атомных ядер
должен составлять 10-14 – 10-15 м. Таким образом, размеры
атома в 104-105 раз превышают размеры его ядра, а
максимальная напряжённость электрического поля в ядерной модели атома превышает
его напряжённость в модели Томсона в 108-1010 раз, что и
делает возможным рассеяние быстрых a-частиц на большие
углы.
Основываясь основе ядерной модели атома, Резерфорд предположил,
что атом устроен подобно солнечной системе – вокруг ядра, как вокруг Солнца, обращаются
электроны, как планеты (рис. 33в). При этом в нейтральном атоме
суммарный отрицательный заряд электронов должен компенсировать положительный
заряд ядра. Такая модель строения атома была названа планетарной. В планетарной
модели электроны должны обращаться вокруг ядра, чтобы не упасть на него под
действием кулоновских сил притяжения.
Вопросы для повторения:
· Какую модель строения атома предложил Томсон?
· Какие результаты были получены в опытах Резерфорда?
· Какую модель строения атома и почему предложил Резерфорд?
Рис. 33. (а) –модель строения атома, предложенная Томсоном; (б) – схема опытов Резерфорда; (в) – планетарная модель строения атома.
Какие модели строения атома вы знаете?
Известно множество моделей строения атома. Кратко рассмотрим некоторые (наиболее известные) из них. В 1902 году У. Кельвином была предложена первая модель строения атома. Его рассматривали в форме шара, равномерно заряженного положительным электричеством. Внутри атома, согласно данной модели, неподвижно располагались электроны. В 1902 – 1903 годах Дж. Дж. Томсон усовершенствовал модель У. Кельвина. Он рассчитал, что самое благоприятное расположение электронов в положительно заряженном облаке будет в том случае, если электроны будут претерпевать движение по оболочкам. Данная модель существовала 9 лет в качестве единственно верной. Она позволила дать обоснование таким явлениям как: дисперсия, поляризация атомов, электропроводность металлов, но модель Кельвина-Томсона не могла ответить на вопрос: почему же атомы имеют такую большую устойчивость и могут существовать в свободном сколь угодно долгое время.
Данная модель существовала 9 лет в качестве единственно верной. Она позволила дать обоснование таким явлениям как: дисперсия, поляризация атомов, электропроводность металлов, но модель Кельвина-Томсона не могла ответить на вопрос: почему же атомы имеют такую большую устойчивость и могут существовать в свободном сколь угодно долгое время.Резерфордом была опровергнута первая теория строения атома. В 1907 году он создал планетарную модель, согласно которой строение атома схоже со строением солнечной системы. В центре каждого атома химического элемента располагается положительно заряженное ядро, имеющее радиус приблизительно равный 10⁻¹⁰ м, вокруг которого подобно планетам по орбитам вращаются электроны. Практически вся масса атома сосредоточена в ядре. Данная модель не смогла объяснить все свойства атомов.
Следующим шагом с развитии учения о теориях строения атома является квантовая модель, предложенная Н. Бором. Она основывается на следующих постулатах:
1. Отрицательно заряженная частица – электрон вращается вокруг ядра лишь по строго определенным (стационарным) круговым орбитам.
2. Атомная система способна находиться только в определённых стационарных или квантовых состояниях, каждому из которых соответствует некоторая энергия Е (атом не излучает энергию в стационарных состояниях).
3. Испускание или поглощение энергии имеет место только в случае перехода атома из одного стационарного состояния (основного или возбужденного) в другое. Энергия данного кванта электромагнитного излучения при переходе из стационарного состояния с энергией Еm в состояние с энергией Еn определяется разностью энергий данного атома в двух квантовых состояниях:
∆Е = Еm – Еn = hν, где v – частота излучения, h = 6,62 ∙ 10⁻³⁴ Дж ∙с – постоянная Планка.
Рассмотрим современную теорию строения атома. Ее основой является дополненная и усовершенствованная планетарная модель. В состав ядра атома химического элемента входят протоны (положительно заряженные частицы) и нейроны (не имеющие заряда частицы, но обладающие массой). Вокруг атомного ядра по неопределённым траекториям движутся отрицательно заряженные частицы – электроны.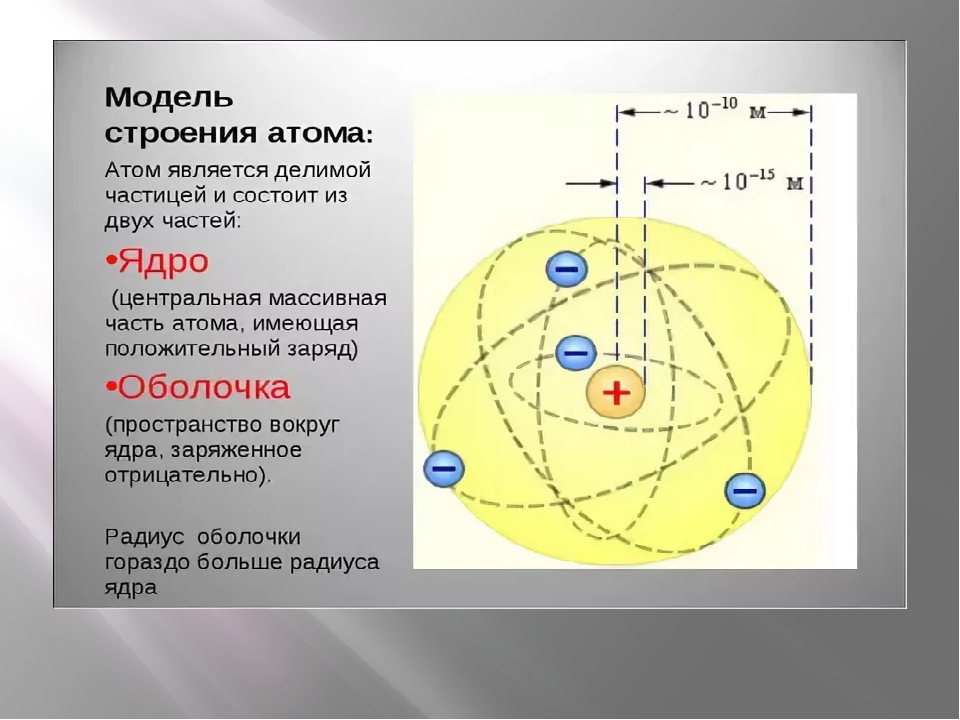
Из чего состоит атом? Инфографика | Инфографика
В 1913 году датский физик Нильс Бор предложил свою теорию строения атома. За основу он взял планетарную модель атома, разработанную физиком Резерфордом. В ней атом уподоблялся объектам макромира — планетарной системе, где планеты двигаются по орбитам вокруг большой звезды. Аналогично в планетарной модели атома электроны движутся по орбитам вокруг расположенного в центре тяжёлого ядра.
Бор ввёл в теорию атома идею квантования. Согласно ей, электроны могут двигаться только по фиксированным орбитам, соответствующим определённым энергетическим уровням. Именно модель Бора стала основой для создания современной квантово-механической модели атома. В этой модели ядро атома, состоящее из положительно заряженных протонов и не имеющих заряда нейтронов, тоже окружено отрицательно заряженными электронами. Однако согласно квантовой механике, для электрона нельзя определить какую-то точную траекторию или орбиту движения — есть только область, в которой находятся электроны с близким энергетическим уровнем.
Что находится внутри атома?
Атомы состоят из электронов, протонов и нейтронов. Нейтроны были открыты после того, как физиками была разработана планетарная модель атома. Лишь в 1932 году, проводя серию опытов, Джеймс Чедвик обнаружил частицы, не имеющие никакого заряда. Отсутствие заряда подтверждалось тем, что эти частицы никак не реагировали на электромагнитное поле.
Само ядро атома образуют тяжёлые частицы — протоны и нейтроны: каждая из этих частиц почти в две тысячи раз тяжелее электрона. Протоны и нейтроны также имеют схожие размеры, но протоны обладают положительным зарядом, а нейтроны не имеют заряда вообще.
В свою очередь, протоны и нейтроны состоят из элементарных частиц, называемых кварками. В современной физике кварки являются самой маленькой, основной частицей материи.
Размеры самого атома во много раз превышают размеры ядра. Если увеличить атом до размеров футбольного поля, то размеры его ядра могут быть сопоставимы с теннисным мячиком в центре такого поля.
В природе существует множество атомов, различающихся размерами, массой и другими характеристиками. Совокупность атомов одного вида называется химическим элементом. На сегодняшний день известно более ста химических элементов. Их атомы различаются размерами, массой, а также строением.
Электроны внутри атома
Отрицательно заряженные электроны двигаются вокруг ядра атома, образуя своего рода облако. Массивное ядро притягивает электроны, но энергия самих электронов позволяет им «убегать» дальше от ядра. Таким образом, чем больше энергия электрона, тем дальше от ядра он находится.
Значение энергии электронов не может быть произвольным, оно соответствует чётко определенному набору энергетических уровней в атоме. То есть энергия электрона изменяется скачкообразно от одного уровня к другому. Соответственно, и двигаться электрон может только в рамках ограниченной электронной оболочки, соответствующей тому или иному энергетическому уровню — в этом смысл постулатов Бора.
Получив больше энергии, электрон «перескакивает» в более высокий от ядра слой, потеряв энергию — наоборот, в более низкий слой. Таким образом, облако электронов вокруг ядра упорядочено в виде нескольких «нарезанных» слоев.
История представлений об атоме
Само слово «атом» происходит от греческого «неделимый» и восходит к идеям древнегреческих философов о наименьшей неделимой части материи. В средние века химики убедились в том, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы. Такие наименьшие частицы вещества и получили название атомов. В 1860 году на международном съезде химиков в Германии это определение было официально закреплено в мировой науке.
В конце XIX — начале XX века физиками были открыты субатомные частицы и стало ясно, что атом в действительности не является неделимым. Сразу же были выдвинуты теории о внутреннем строении атома, одной из первых среди которых стала модель Томсона или модель «пудинга с изюмом».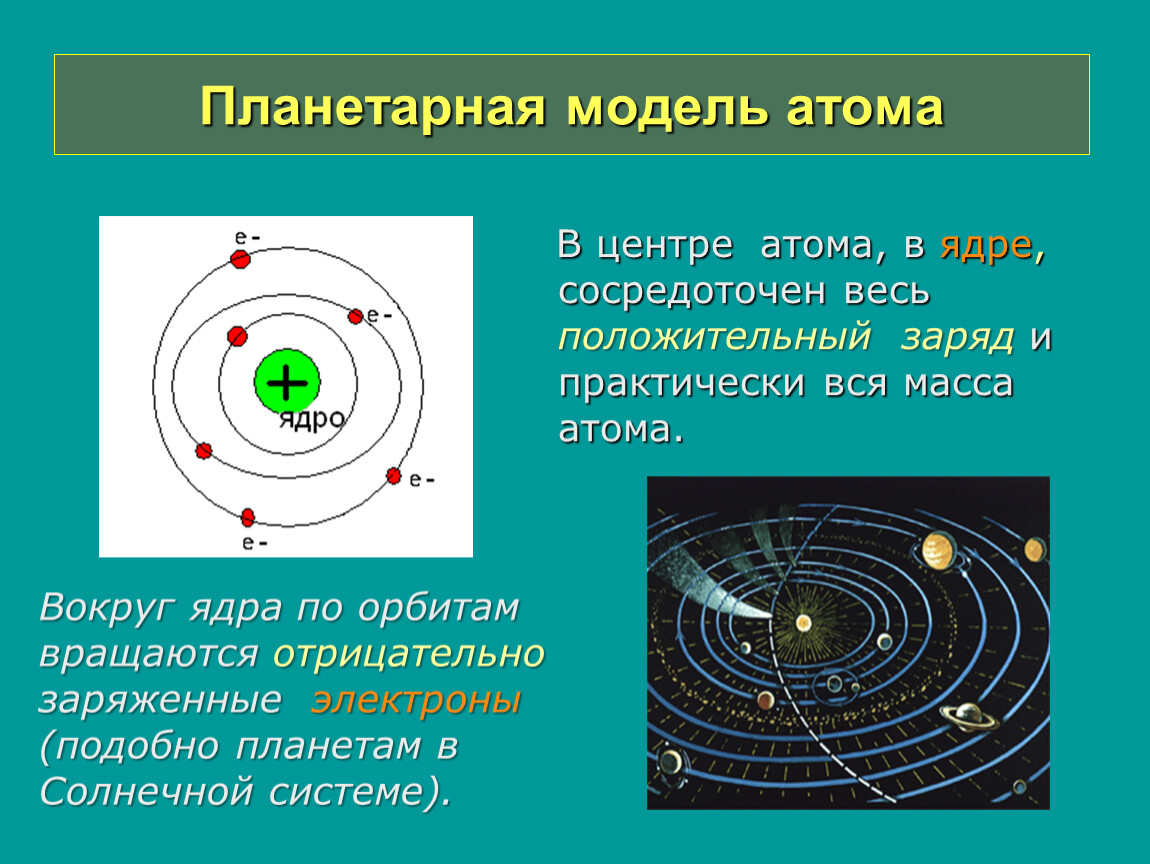 Согласно этой модели, маленькие электроны находились внутри массивного положительно заряженного тела — как изюм внутри пудинга. Однако, практические эксперименты химика Резерфорда опровергли эту модель и привели того к созданию планетарной модели атома.
Согласно этой модели, маленькие электроны находились внутри массивного положительно заряженного тела — как изюм внутри пудинга. Однако, практические эксперименты химика Резерфорда опровергли эту модель и привели того к созданию планетарной модели атома.
Развитие планетарной модели Бором наряду с открытием в 1932 году нейтронов сформировало основу для современной теории о строении атома. Следующие этапы в развитии знаний об атоме уже связаны с физикой элементарных частиц: кварков, лептонов, нейтринов, фотонов, бозонов и других.
Смотрите также:
Атомная структура
Планковские концепции квантования можно увидеть в постулатах Бора 1 и 3. Когда электрон находится в стационарном состоянии, Бор предположил, что законы Ньютона, закон Кулона и закон сохранения энергии действительны. Бор показал, что угловой момент электрона с массой м , движущегося со скоростью v по круговой орбите радиусом r , квантуется как
, где n – целое число, а h – постоянная Планка.
Кроме того, он вывел выражение для радиуса водорода из электростатической силы (закон Кулона), установленной равной центростремительной силе:
Когда n = 1, радиус называется радиусом Бора , который является наименьшей орбитой водорода.
Чтобы найти выражение для полной энергии электрона, вращающегося вокруг атома, используйте классическую формулу для полной энергии, затем подставьте r n сверху и v из углового момента, чтобы получить следующее:
Когда n = 1, состояние атома с наименьшей энергией называется основным состоянием .Значение основного состояния водорода составляет -13,6 электрон-вольт, что прекрасно согласуется с экспериментально наблюдаемой энергией ионизации водорода – энергией, необходимой для удаления электрона в основном состоянии из атома.
Объединение этого результата с уравнением постулата Бора 2 дает
Поскольку c = f λ, уравнение принимает вид
Из предыдущего уравнения можно рассчитать постоянную Ридберга.
Все эти константы известны, и теоретическое значение для постоянной Ридберга такое же, как и полученное R . Это продемонстрированное согласие примечательно, и оно подтвердило постулаты Бора.
Ряд Бальмера, найденный экспериментально, можно объяснить с помощью модели атома Бора следующим образом. На рисунке 1 представлена диаграмма возможных энергетических переходов для водорода.
| ||
Для серии Бальмера электрон водорода перескакивает из начального возбужденного состояния ( n = 3,4,5,…) в конечное состояние на уровне n = 2. При этом он испускает фотон с энергией, равной разности энергий начального и конечного состояний. Другая серия, показанная на рисунке, иллюстрирует другую серию линий, найденную Теодором Лайманом и Луи Пашеном.Этот тип диаграммы называется диаграммой уровней энергии , потому что она иллюстрирует дискретные разрешенные уровни энергии и допустимые переходы для вращающегося электрона.
При этом он испускает фотон с энергией, равной разности энергий начального и конечного состояний. Другая серия, показанная на рисунке, иллюстрирует другую серию линий, найденную Теодором Лайманом и Луи Пашеном.Этот тип диаграммы называется диаграммой уровней энергии , потому что она иллюстрирует дискретные разрешенные уровни энергии и допустимые переходы для вращающегося электрона.
Следующей задачей было предположить, почему возможны только определенные дискретные уровни энергии. Де Бройль предполагал, что орбита будет стабильной, только если она содержит целое число или кратные целому числу электронных волн де Бройля. На рисунке показано изображение стоячей круговой волны трех длин волн.
| ||
Изображенная орбита будет допустимой орбитой с квантовым числом 3, то есть n = 3. Этот визуальный способ понимания квантования показывает, что волновая природа материи является основой модели атома.Более сложные формулировки квантовой физики, которые были разработаны позже, основывались на этих концепциях.
Модель атома Резерфорда
: определение и схема – видео и стенограмма урока
Открытие атома
Атом был впервые задуман греческим философом Демокритом примерно в 400 г. до н. Э. Эта концепция была утеряна в темные века Европы до 1803 года, когда британский ученый Джон Дальтон предположил, что все состоит из очень крошечных неделимых частиц, называемых атомами.
Простая модель атома Дальтона существовала до 1897 года, когда другой британский физик, Дж. Дж. Томсон обнаружил, что атомы содержат крошечные отрицательно заряженные частицы, называемые электронами. С 1897 по 1909 годы ученые думали, что атомы состоят из электронов, равномерно распределенных по положительно заряженной матрице. J.J. Модель Томсона была известна как модель сливового пудинга .
Дж. Томсон обнаружил, что атомы содержат крошечные отрицательно заряженные частицы, называемые электронами. С 1897 по 1909 годы ученые думали, что атомы состоят из электронов, равномерно распределенных по положительно заряженной матрице. J.J. Модель Томсона была известна как модель сливового пудинга .
Модель атома Дальтона изображает крошечную твердую неделимую сферу.Модель сливового пудинга Томсона показывает электроны (зеленые кружки), распределенные в положительно заряженной матрице.
Разработка модели Резерфорда
В 1909 году Резерфорд провел свой знаменитый эксперимент с золотой фольгой . В эксперименте Резерфорд и его коллега Ханс Гейгер бомбардировали кусок золотой фольги положительно заряженными альфа-частицами, ожидая, что они пройдут прямо через фольгу. Вместо этого многие альфа-частицы отрикошетили от фольги, предполагая, что эти частицы сталкиваются с чем-то положительным.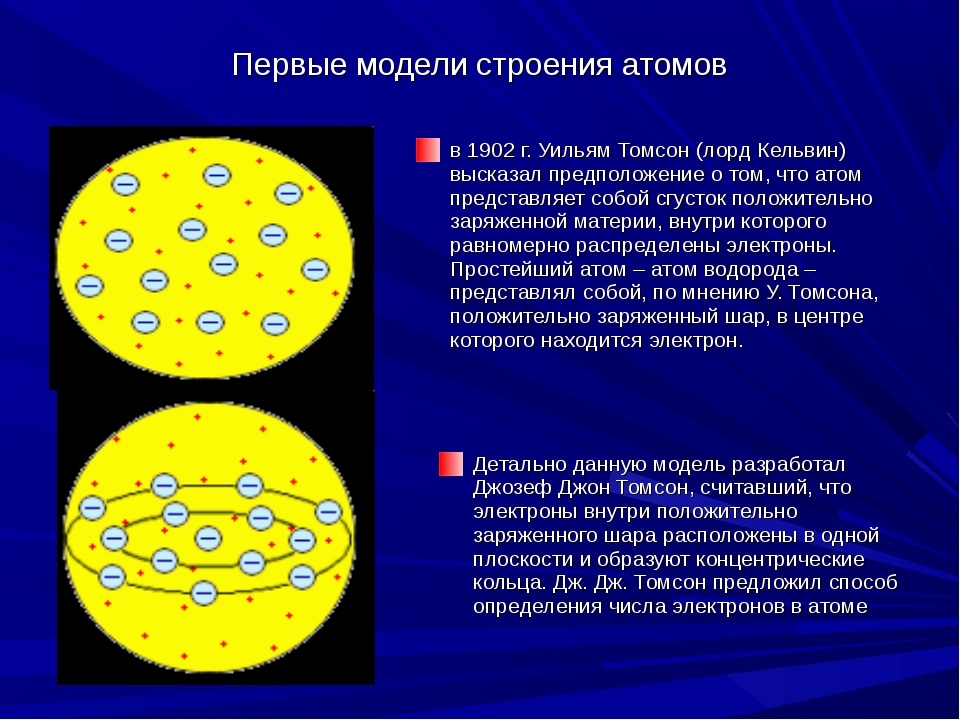 Они назвали эту положительную силу ядром . Модель Резерфорда была создана на основе этих новых данных.
Они назвали эту положительную силу ядром . Модель Резерфорда была создана на основе этих новых данных.
На этой диаграмме показаны ожидаемые и фактические результаты эксперимента с золотой фольгой. На диаграмме слева показаны частицы, проходящие через положительно заряженную матрицу модели сливового пудинга. На диаграмме справа показаны частицы, рикошетирующие от ядра в центре атома.
Проблемы с моделью Резерфорда
Спустя годы после того, как Резерфорд открыл ядро, химики и физики элементарных частиц обнаружили, что поведение электронов намного сложнее, чем это изображено в модели Резерфорда.Электроны не двигались по заданному пути, их скорости были непостоянными, а их расположение вокруг ядра могло меняться в зависимости от того, сколько энергии они имели. Было некорректно изображать электроны движущимися по прямым путям. Вместо этого физики начали представлять их в виде электронного облака, которое могло предполагать, где электроны могут быть в любой момент времени. Модель электронного облака – это текущая модель атома.
Модель электронного облака – это текущая модель атома.
Исследования электронов и ядра показали, что размеры этих частиц были значительно меньше, чем показывает модель Резерфорда.Таким образом, в более новых моделях ядро представлялось очень маленькой массой, а электроны – практически ничем. Исследования также показали, что ядро содержит небольшие положительно заряженные частицы, называемые протонами, и небольшие нейтрально заряженные частицы, называемые нейтронами.
Краткое содержание урока
Модель Резерфорда показывает, что атом в основном представляет собой пустое пространство, а электроны вращаются вокруг фиксированного, положительно заряженного ядра по заданным предсказуемым траекториям. До Резерфорда популярной моделью атома была модель сливового пудинга , популяризированная Дж.J. Thomson , в котором электроны считались равномерно распределенными по положительно заряженной матрице.
Модель Резерфорда была создана после его знаменитого эксперимента, в котором он бомбардировал золотую фольгу положительно заряженными альфа-частицами. Вместо того, чтобы пройти прямо сквозь них, некоторые из частиц отрикошетили, предположив, что эти частицы столкнулись с чем-то положительным. Он назвал эту положительную силу «ядром». В конце концов было обнаружено, что эта модель неточно отражает поведение электронов или размеры частиц.Модель Резерфорда – одна из самых популярных моделей атома, хотя она считалась точной только с 1909 по 1913 год.
Примечательные термины
- Ядро : Ядро – это центр атома, вокруг которого вращаются электроны.
- Plum Pudding Model : Эта модель была дорезерфордовской, согласно которой электроны равномерно распределялись через положительно заряженную матрицу.
- Модель Резерфорда : Последняя модель атома представляет атом в основном как пространство с электронами, вращающимися вокруг неподвижного ядра.

Результаты обучения
Тщательно просмотрите содержание этого урока, чтобы:
- Охарактеризовать модель атома Резерфорда
- Изучите историю различных моделей атома
- Выделите проблемы, связанные с моделью Резерфорда
| |
Атомный флэшбэк: Век Бора модель
В июле 1913 года Нильс Бор опубликовал первую из серии из трех статей, в которых была представлена его модель атома.
Наиболее узнаваемое изображение атома напоминает миниатюрную солнечную систему с концентрическими траекториями электронов, образующими планетные орбиты, и ядром в центре, подобным Солнцу.В июле 1913 года датский физик Нильс Бор опубликовал первую из серии из трех статей, в которых была представлена эта модель атома, которая стала известна просто как атом Бора.
Бор, один из пионеров квантовой теории, взял модель атома, представленную несколькими годами ранее физиком Эрнестом Резерфордом, и придал ей квантовый поворот.
Резерфорд сделал поразительное открытие, что большая часть атома представляет собой пустое пространство. Подавляющая часть его массы находится в положительно заряженном центральном ядре, которое в 10 000 раз меньше самого атома.Плотное ядро окружено роем крошечных отрицательно заряженных электронов.
Бор, проработавший ключевой период в 1912 году в лаборатории Резерфорда в Манчестере, Великобритания, беспокоился о некоторых несоответствиях в этой модели. Согласно правилам классической физики, электроны в конечном итоге будут спускаться по спирали в ядро, вызывая коллапс атома. Модель Резерфорда не учитывала стабильность атомов, поэтому Бор обратился за ответами к развивающейся области квантовой физики, которая имеет дело с микроскопическим масштабом.
Бор предположил, что вместо того, чтобы беспорядочно гудеть вокруг ядра, электроны обитают на орбитах, расположенных на фиксированном расстоянии от ядра. На этом изображении каждая орбита связана с определенной энергией, и электрон может менять орбиту, излучая или поглощая энергию дискретными порциями (называемыми квантами). Таким образом Бор смог объяснить спектр света, излучаемого (или поглощаемого) водородом, простейшим из всех атомов.
Таким образом Бор смог объяснить спектр света, излучаемого (или поглощаемого) водородом, простейшим из всех атомов.
Бор опубликовал эти идеи в 1913 году и в течение следующего десятилетия вместе с другими разработал теорию, пытаясь объяснить более сложные атомы.В 1922 году за свои работы он был удостоен Нобелевской премии по физике.
Однако эта модель вводила в заблуждение по нескольким причинам и в конечном итоге обречена на провал. Развитие квантовой механики показало, что невозможно знать положение и скорость электрона одновременно. Четко определенные орбиты Бора были заменены вероятностными «облаками», где, скорее всего, находится электрон.
Но эта модель открыла путь для многих научных достижений. Все эксперименты по исследованию атомной структуры – в том числе некоторые в ЦЕРНе, например, с антиводородом и другими экзотическими атомами в антипротонном замедлителе и в онлайн-сепараторе изотопной массы (ISOLDE) – можно проследить до революции в атомной теории, которую Резерфорд и Бор начал столетие назад.
«Вся атомная и субатомная физика построена на наследии этих выдающихся джентльменов», – говорит Питер Батлер из Ливерпульского университета, работающий над ISOLDE.
Модель атома– Вселенная сегодня
[/ caption] Самая распространенная модель атома – это модель Нильса Бора. Модель Бора была впервые представлена в 1913 году. Эта модель атома изображает небольшое положительно заряженное ядро, окруженное электронами, которые движутся по круговым орбитам вокруг ядра, подобно тому, как планеты движутся вокруг Солнца, но электростатические силы производят притяжение, а не гравитацию.Ключевой успех модели заключался в объяснении формулы Ридберга для спектральных эмиссионных линий атомарного водорода. По сути, это модификация модели Резерфорда, используемой для целей квантовой физики.
Модель Бора была усовершенствованием более старых атомных моделей, но она также устарела в результате продолжающихся научных исследований. Хотя он считается устаревшим, он все еще преподается как введение в квантовую механику и в начальных классах средней школы. Когда студенты достаточно продвинуты в своем понимании, они знакомятся с более точным атомом валентной оболочки.Когда-нибудь в будущем эта модель атома может оказаться слишком жесткой по своим масштабам.
Когда студенты достаточно продвинуты в своем понимании, они знакомятся с более точным атомом валентной оболочки.Когда-нибудь в будущем эта модель атома может оказаться слишком жесткой по своим масштабам.
Модель Бора построена на теории Резерфорда. Резерфорд предположил, что электроны вращаются вокруг ядра, как планета вокруг Солнца. Недостатком теории было то, что, согласно его теории, электроны будут излучать (терять) свой заряд и закручиваться в ядро по спирали, делая все атомы нестабильными. Бор предложил несколько изменений к этой модели: электроны могут перемещаться только по особым орбитам на определенном наборе расстояний от ядра с определенными энергиями, электроны не теряют энергию непрерывно при движении.Они могут только набирать и терять энергию, перепрыгивая с одной разрешенной орбиты на другую, поглощая или испуская электромагнитное излучение с частотой, определяемой разностью энергий уровней в соответствии с соотношением Планка, и что частота излучения, испускаемого на орбите, равна величина, обратная классическому периоду обращения. Эта модель имеет несколько ограничений, но позволяет классической механике объяснять многие вещи с учетом квантовых правил.
Эта модель имеет несколько ограничений, но позволяет классической механике объяснять многие вещи с учетом квантовых правил.
Модель Бора начинает сталкиваться с проблемами с более тяжелыми атомами.Другие недостатки модели: дает неправильное значение для орбитального углового момента основного состояния, не может объяснить большую часть спектров более крупных атомов, а также модель нарушает принцип неопределенности, поскольку она считает, что электроны имеют известные орбиты и определяют радиус . Эти две вещи нельзя познать напрямую одновременно.
Вот хорошие чернила о модели атома Бора. Здесь, в Universe Today, у нас есть пара замечательных статей по этой теме: одна о модели Бора, а другая о докторе Докторе.Сам Бор. Astronomy Cast предлагает хороший эпизод о том, как молекулы ведут себя в космосе.
Нравится:
Нравится Загрузка …
Почему можно учить неправильным идеям в физике
Еще в 1913 году все приветствовали новую модель атома Нильса Бора. На нем изображены электроны, вращающиеся вокруг центрального ядра, как планеты вокруг Солнца, и это все еще самая распространенная картина атома сегодня. Вы можете найти его на бесчисленных научных футболках и в телешоу, таких как The Big Bang Theory , но вот проверка реальности: ученые заменили его еще в 1920-х годах.
На нем изображены электроны, вращающиеся вокруг центрального ядра, как планеты вокруг Солнца, и это все еще самая распространенная картина атома сегодня. Вы можете найти его на бесчисленных научных футболках и в телешоу, таких как The Big Bang Theory , но вот проверка реальности: ученые заменили его еще в 1920-х годах.
Но прежде чем мы начнем настаивать на большей точности в наших средствах массовой информации (а я думаю, что мы должны это сделать), эта старая модель все же может научить нас тому, как ученые сегодня решают большие проблемы.
Физика быстро менялась в начале 20 -го века, когда молодой Нильс Бор пытался доказать свою ценность. В колледже он одержимо работал в конкурсе, предназначенном для зрелых ученых, и выиграл его золотую медаль. К тому времени, когда он получил докторскую степень, Бор уже был силой, с которой нужно было считаться.Он получил работу у профессора, лауреата Нобелевской премии. Когда эти отношения быстро испортились, он просто договорился о работе с другим лауреатом Нобелевской премии по имени Эрнест Резерфорд. В 1912 году он роковым образом взялся за старый проект своего наставника: строение атома.
В 1912 году он роковым образом взялся за старый проект своего наставника: строение атома.
Несколькими годами ранее Резерфорд примерно открыл, как устроен атом, но его модель не могла объяснить, как он работает, во многом как набросок велосипеда без шестерен. Удивительно, но Бору понадобился всего год, чтобы вдохнуть жизнь в модель своего начальника и сделать ее своей собственной.Среди своих успехов модель водорода Бора объяснила, почему водородные лампы (изображающие неоновые вывески) светятся красным, а не другим цветом. Другими словами, он сделал набросок велосипеда и кропотливо нарисовал рабочие механизмы. Не все были согласны с моделью Резерфорда, но упорный труд Бора закрепил ее место в науке. Норвежский Нобелевский комитет поспешно (для них!) Присудил Бору премию по физике в 1922 году.
Но весь этот успех не означает, что модель была идеальной. Он получил водород правильно, но он совершенно не смог описать другие элементы.Бор и другие провели 1910-е и 1920-е годы, обсуждая, как улучшить модель. Один ученый получил лучшие результаты, когда попытался использовать орбиты овальной формы, которые быстро стали нормой. Другой ученый высказал идею, что два электрона могут иметь общую орбиту, и эта идея в конечном итоге пережила саму модель Бора.
Один ученый получил лучшие результаты, когда попытался использовать орбиты овальной формы, которые быстро стали нормой. Другой ученый высказал идею, что два электрона могут иметь общую орбиту, и эта идея в конечном итоге пережила саму модель Бора.
К сожалению, не все эти проблемы можно исправить. Всего через четыре года после присуждения Нобелевской премии огромные изменения в физике сделали модель Бора устаревшей. Новая модель, называемая квантовой механикой, взяла у Бора страницу, но подняла ее на совершенно новый уровень.Она объясняет жизнь атомов намного лучше, чем модель Бора, и наука никогда не отступала.
И все же именно модель атома Бора сегодня люди узнают больше всего. Найдите изображение по запросу «атом» в Интернете, и подавляющее большинство результатов покажет его атомную солнечную систему. Практически нет результатов, показывающих странные, похожие на шары формы, которые точно описывают самые глубокие процессы химии на протяжении почти столетия.
Модель атома на основе квантовой механики. Предоставлено: общественное достояние через Wikimedia Commons
Предоставлено: общественное достояние через Wikimedia Commons. Так почему же атом Бора остался? «Это хорошее место для начала разговора о составе атома», – говорит учитель химии в средней школе доктор Джейсон Дайк. Это сложный материал, а картина атома Бора проста и работает достаточно хорошо, так что это хорошее введение. Когда дело доходит до более современных моделей, Дайк говорит, что «мы стараемся коснуться их лишь вкратце и оставить позади», потому что сейчас не время. После школы люди склонны вспоминать образ, с которым они проводили больше времени.
Однако Дайк говорит, что заменить модель Бора в его учебной программе будет сложно, и не только потому, что ее легче усвоить. Он говорит, что использует его, чтобы научить студентов, что «даже [информация], которая в некоторой степени неверна, может быть чрезвычайно полезна для […] изменения мыслительного процесса в определенной области». В самом деле, может показаться неудачным вручение Нобелевской премии модели, которая была быстро заменена, но это знаменует большой шаг вперед, сделанный наукой в ходе беседы. Используя ошибочную модель Бора, он и другие ученые выдвинули идеи, которые остались сильными в 21 и веке.
Используя ошибочную модель Бора, он и другие ученые выдвинули идеи, которые остались сильными в 21 и веке.
Отрицатели науки часто используют изменяющиеся научные модели, чтобы поставить под сомнение то, что мы знаем, но история Бора учит нас твердо стоять на своем. Точно так же, как злополучная модель Бора правильно объяснила свечение водорода, сегодняшние несовершенные модели в климатологии и фармакологии могут помочь нам понять изменение климата и улучшить медицину. То, как мы постепенно улучшаем несовершенные модели, позволяет нам по крупицам решать огромные и сложные проблемы, и это работает. И когда нам нужно обновить наше понимание –, это, конечно, не означает, что мы должны выбросить ребенка вместе с водой из ванны.
Признаюсь, у меня возникает соблазн объяснить «настоящую науку», когда я вижу атом Бора, но это может быть больше, чем просто педантичное исправление футболок. Это возможность поговорить о развивающихся моделях и спорах, которые способствуют нашему пониманию мира. В следующий раз, когда вы увидите атом Бора в дикой природе, я надеюсь, вы тоже задумаетесь над этим.
В следующий раз, когда вы увидите атом Бора в дикой природе, я надеюсь, вы тоже задумаетесь над этим.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie.
 Если вы подозреваете это, попробуйте другой браузер.
Если вы подозреваете это, попробуйте другой браузер. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.

 Опыт Резерфорда».
Опыт Резерфорда».




 Поскольку эти орбитали находятся в электронных оболочках все дальше и дальше от атомного центра, они удерживают электроны с все большим и большим количеством энергии.
Поскольку эти орбитали находятся в электронных оболочках все дальше и дальше от атомного центра, они удерживают электроны с все большим и большим количеством энергии. Эти объемы космоса называются орбиталями .
Эти объемы космоса называются орбиталями . Элемент водород, например, имеет один протон (и один электрон), и поэтому ему присвоен атомный номер один (1). Элемент дейтерий также имеет один протон в центре и, следовательно, имеет тот же атомный номер, что и водород (1).Элемент тритий также имеет атомный номер, равный единице, и один протон в центре. У этих трех элементов один и тот же атомный номер, но они отличаются друг от друга.
Элемент водород, например, имеет один протон (и один электрон), и поэтому ему присвоен атомный номер один (1). Элемент дейтерий также имеет один протон в центре и, следовательно, имеет тот же атомный номер, что и водород (1).Элемент тритий также имеет атомный номер, равный единице, и один протон в центре. У этих трех элементов один и тот же атомный номер, но они отличаются друг от друга.
 Если вы подозреваете это, попробуйте другой браузер.
Если вы подозреваете это, попробуйте другой браузер.