Строение атома алюминия, электронная оболочка и схема элемента
4.6
Средняя оценка: 4.6
Всего получено оценок: 440.
4.6
Средняя оценка: 4.6
Всего получено оценок: 440.
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Строение
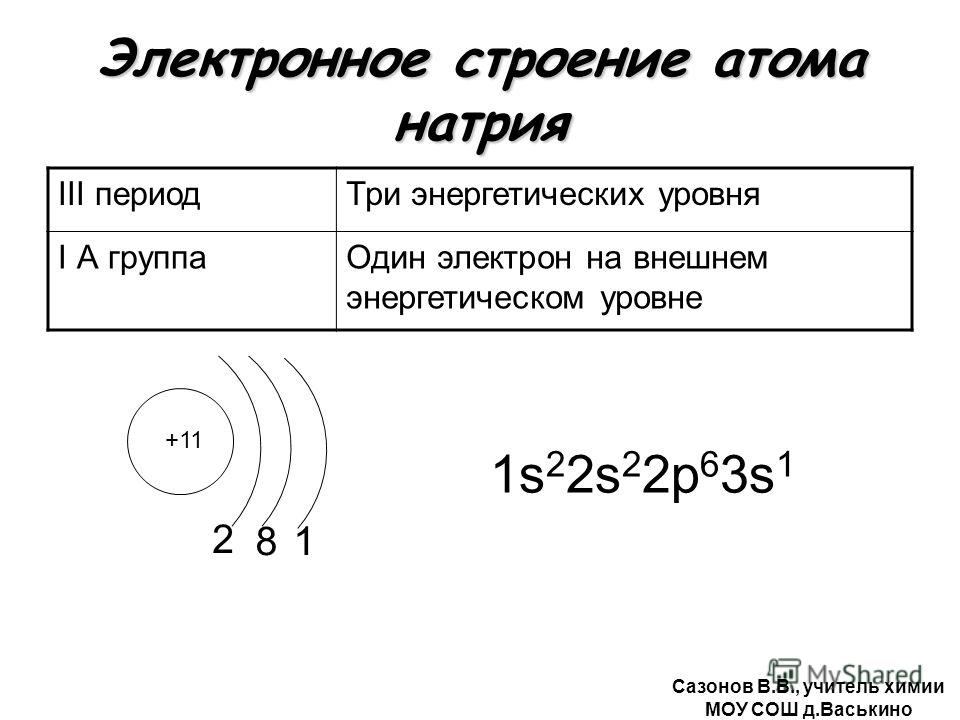
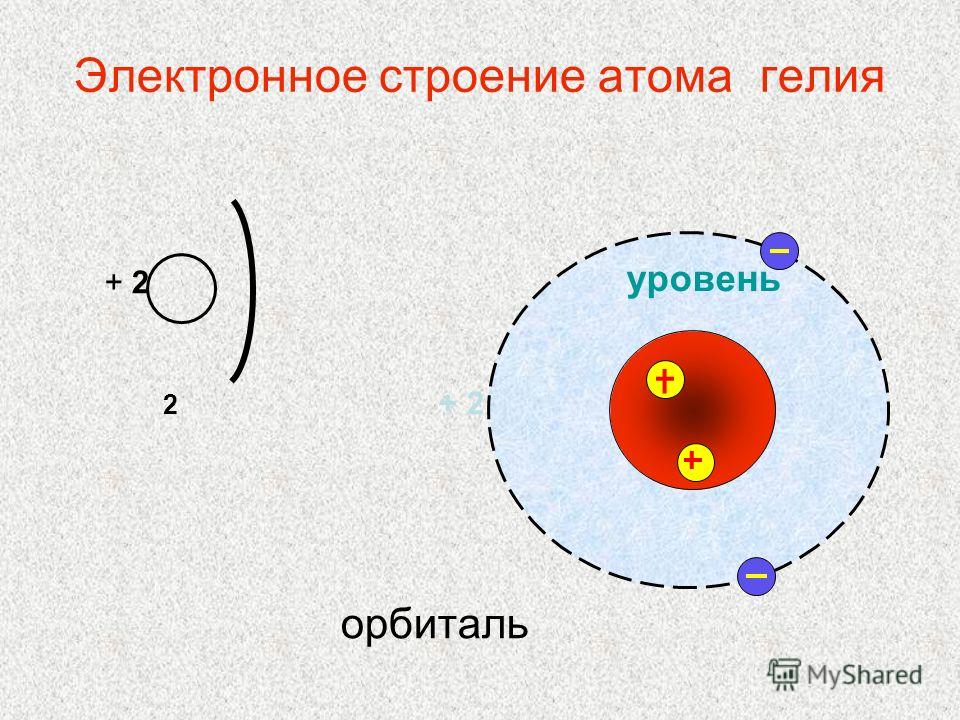
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Рис. 1. Алюминий в периодической таблице.Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.
Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
Основные химические свойства элемента описаны в таблице.
Взаимодействие | Ход реакции | |
С водой | Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия | 2Al + 6H2O → 2Al(OH)3 + 3H2 |
С кислородом | Образуется оксид алюминия | 4Al + 3O2 → 2Al2O3 + Q |
С галогенами | При комнатной температуре. С йодом – в присутствии катализатора | 2Al + 3Cl2 → 2AlCl3 |
С серой | При температуре выше 200°С, образуется сульфид алюминия | 2Al + 3S → Al2S3 |
С фосфором | При температуре 500°С, образуется фосфид алюминия | Al + P → AlP |
С азотом | При температуре 800°С, образуется нитрид алюминия | 2Al + N2 → 2AlN |
С углеродом | При температуре 2000°С, образуется карбид алюминия | 4Al + 3C → Al4C3 |
С кислотами | При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. | – 2Al + 3H2SO4 → Al2(SO4)3 + 3H2; – 2Al + 6HCl → 2AlCl3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
Со щелочами | Реагируют растворы и сплавы | – 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
С оксидами | Вытесняет металлы | 2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.
Что мы узнали?
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
El’nore Christopher
5/5
Александр Котков
5/5
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 440.
А какая ваша оценка?
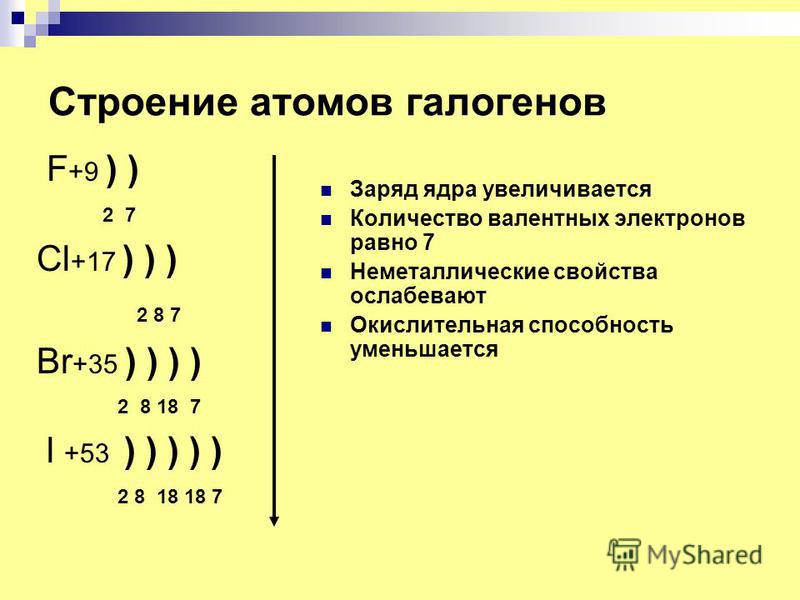
Ответы | 2. По приведённому в тексте параграфа плану составьте описание следующих химических элементов: а) сера; б) хлор; в) алюминий; г) натрий. — Химия, 11 класс
а) сера
1. Элемент сера имеет химический знак S, атомный номер Z = 16. Сера расположена в третьем периоде, малом, в VI A-группе, главной. Относительная атомная масса Ar(S) = 32.
Сера расположена в третьем периоде, малом, в VI A-группе, главной. Относительная атомная масса Ar(S) = 32.
2. Строение атома:
а) заряд ядра атома серы +16. В состав ядра атома серы входят 16 протонов. Самый распространённый в природе изотоп — это нуклид 32S. Число нейтронов в ядре этого нуклида равно 32 – 16 = 16;
б) электронная оболочка атомов серы содержит 16 электронов, которые распределены по трем энергетическим уровням; электронная схема: 16S 2e, 8e, 6e; формула электронной конфигурации: 16S 1s22s22p63s23p4; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p4, значит, сера — р-элемент.
3. Степени окисления атомов элемента: высшая +6, так как на внешнем энергетическом уровне атома находится 6 электронов, низшая –2. Электроотрицательность: x(S) = 2.5. megaresheba.ru megareslieba.ru
4. Простое вещество азот является неметаллом, агрегатное состояние при н.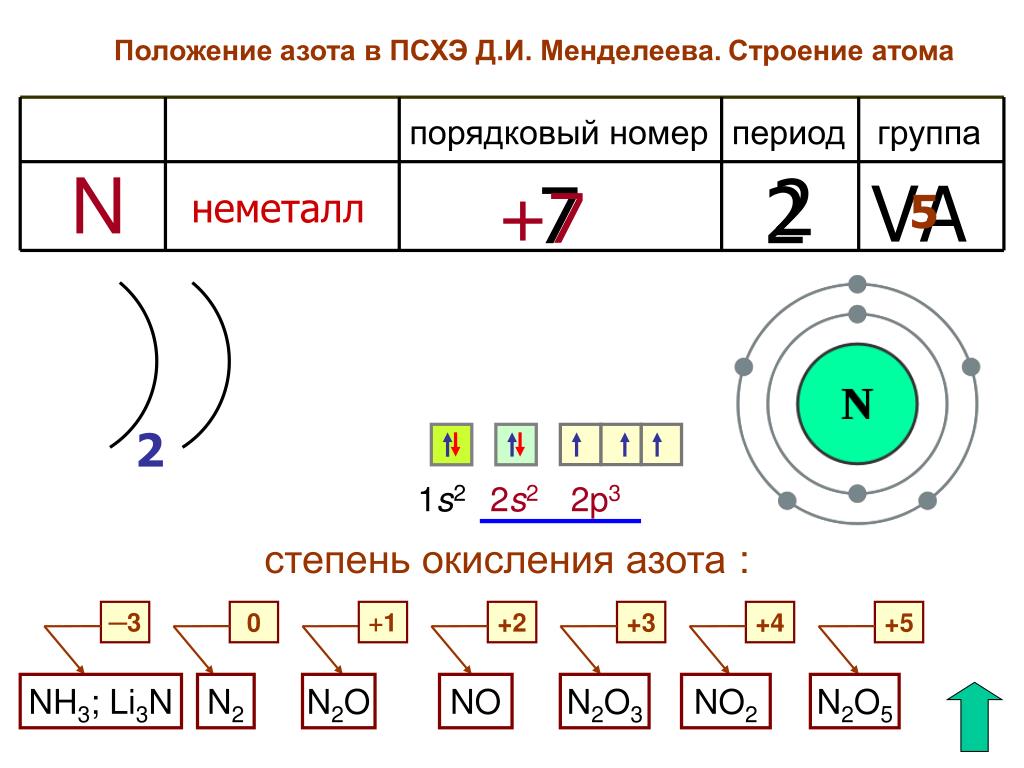 у. — твердое, химическая формула S.
у. — твердое, химическая формула S.
5. Формула высшего оксида S+6O3, оксид серы (VI), кислотный; формула гидроксида, соответствующего высшему оксиду, H2S+6O4, гидроксид кислотный, серная кислота; водородное соединение H2S-2, летучее, так как сера является неметаллом.
б) хлор
1. Элемент хлор имеет химический знак Cl, атомный номер Z = 17. Хлор расположен в третьем периоде, малом, в VII A-группе, главной. Относительная атомная масса Ar(Сl) = 35.5.
2. Строение атома:
а) заряд ядра атома хлора +17. В состав ядра атома хлора входят 17 протонов. Самый распространённый в природе изотоп — это нуклид 35Cl. Число нейтронов в ядре этого нуклида равно 35 – 17 = 18.
б) электронная оболочка атомов содержит 17 электронов, которые распределены по трем энергетическим уровням; электронная схема: 17Cl 2e, 8e, 7e; формула электронной конфигурации: 17Cl 1s22s22p63s23p5; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p5, значит, хлор — р-элемент.
3. Степени окисления атомов элемента: высшая +7, так как на внешнем энергетическом уровне атома находится 7 электронов, низшая –1. Электроотрицательность: х(Сl) = 3.0.
4. Простое вещество хлор является неметаллом, агрегатное состояние при н. у. — газ, химическая формула Cl2.
5. Формула высшего оксида Cl+72O7, оксид серы (VII), кислотный; формула гидроксида, соответствующего высшему оксиду, HCl+7O4, гидроксид кислотный, хлорная кислота; водородное соединение HCl-1, летучее, так как хлор является неметаллом.
в) алюминий
1. Элемент алюминий имеет химический знак Al, атомный номер Z = 13. Алюминий расположен в третьем периоде, малом, в III A-группе, главной. Относительная атомная масса Ar(Al) = 27.
2. Строение атома:
а) заряд ядра атома алюминия +13. В состав ядра атома входят 13 протонов. Единственный в природе изотоп — это нуклид 27Al.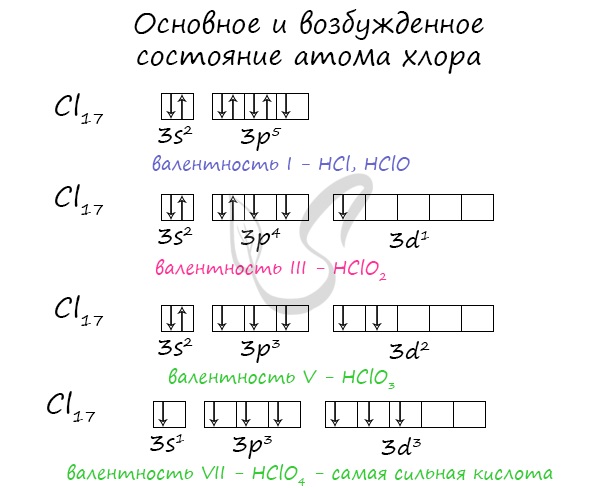 Число нейтронов в ядре этого нуклида равно 27 – 13 = 14.
Число нейтронов в ядре этого нуклида равно 27 – 13 = 14.
б) электронная оболочка атомов содержит 13 электронов, которые распределены по трем энергетическим уровням; электронная схема: 13Al 2e, 8e, 3e; формула электронной конфигурации: 13Al 1s22s22p63s23p1; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s23p1, значит, алюминий — р-элемент.
3. Степени окисления атомов элемента: высшая +3, так как на внешнем энергетическом уровне атома находится 3 электронов, низшая 0. Электроотрицательность: х(Al) = 1.5.
4. Простое вещество алюминий является металлом, агрегатное состояние при н. у. —твердое, химическая формула Al.
5. Формула высшего оксида Al+32O3, оксид алюминия, амфотерный; формула гидроксида, соответствующего высшему оксиду, Al(OH)3, гидроксид алюминия, амфотерный; водородное соединение Al-3H3, нелетучее, так как алюминий является метал.
г) натрий
1. Элемент натрий имеет химический знак Na, атомный номер Z = 11. Натрий расположен в третьем периоде, малом, в I A-группе, главной. Относительная атомная масса Ar(Na) = 23.
2. Строение aтома:
а) заряд ядра атома натрия +11. В состав ядра атома входят 11 протонов. Самый распространённый в природе изотоп — это нуклид 23Na. Число нейтронов в ядре этого нуклида равно 23 – 11 = 12.
б) электронная оболочка атомов содержит 11 электронов, которые распределены по трем энергетическим уровням; электронная схема: 11Na 2e, 8e, 1e; формула электронной конфигурации: 11Na 1s22s22p63s1; электронно-графическая схема:
в) конфигурация внешнего электронного слоя: 3s1, значит, натрий — s-элемент.
3. Степени окисления атомов элемента: высшая +1, так как на внешнем энергетическом уровне атома находится 1 электронов, низшая 0. Электроотрицательность: x(Na) = 0. 9.
9.
4. Простое вещество натрий является металлом, агрегатное состояние при н. у. — твердое, химическая формула Na.
5. Формула высшего оксида Na+12O, оксид натрия, основный; формула гидроксида, соответствующего высшему оксиду, NaOH, гидроксид натрия, основный (щелочь), водородное соединение Al-3H3 нелетучее, гак как алюминий является металлом.
Натрий, свойства атома, химические и физические свойства
Натрий, свойства атома, химические и физические свойства.
Na 11 Натрий
22,98976928(2) 1s2 2s2 2p6 3s1
Натрий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 11. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), третьем периоде периодической системы.
Атом и молекула натрия. Формула натрия. Строение натрия
Изотопы и модификации натрия
Свойства натрия (таблица): температура, плотность, давление и пр.
Физические свойства натрия
Химические свойства натрия. Взаимодействие натрия. Реакции с натрием
Получение натрия
Применение натрия
Таблица химических элементов Д.И. Менделеева
Атом и молекула натрия. Формула натрия. Строение натрия:
Натрий (лат. Natrium, от лат. слова natrium, которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего – «сода», «едкий натр») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Na и атомным номером 11. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), третьем периоде периодической системы.
Натрий, свойства атома, химические и физические свойства
Натрий – металл. Относится к группе щелочных металлов, а также лёгких, цветных металлов.
Натрий обозначается символом Na.
Как простое вещество натрий при нормальных условиях представляет собой мягкий щелочной металл серебристо-белого цвета в тонких слоях с фиолетовым оттенком.
Молекула натрия одноатомна.
Химическая формула натрия Na.
Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1. Потенциал ионизации (первый электрон) атома натрия равен 495,85 кДж/моль (5,1390769(3) эВ).
Строение атома натрия. Атом натрия состоит из положительно заряженного ядра (+11), вокруг которого по трем оболочкам движутся 11 электронов. При этом 10 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку натрий расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома натрия – на 3s-орбитали находится один неспаренный электрон.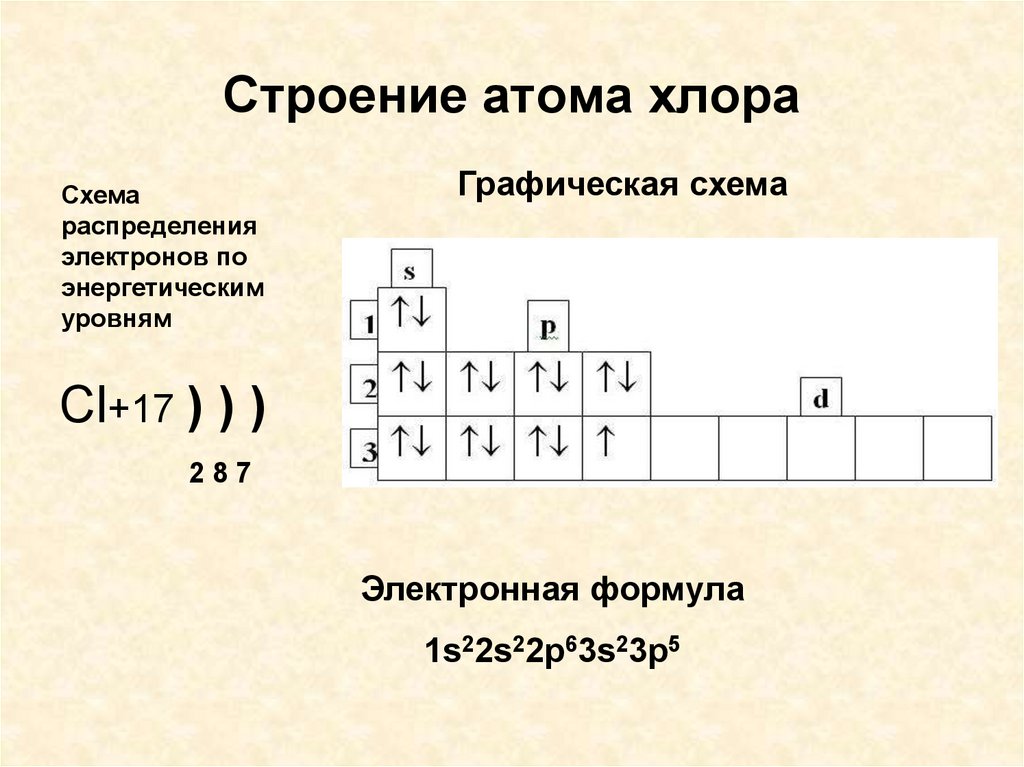 В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов. Натрий относится к элементам s-семейства.
В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов. Натрий относится к элементам s-семейства.
Радиус атома натрия (вычисленный) составляет 190 пм.
Атомная масса атома натрия составляет 22,98976928(2) а. е. м.
Натрий – шестой по распространённости элемент в земной коре. Содержание его в земной коре составляет 2,3 %, в океанах и морях – 1,1 %.
Натрий очень легко вступает в химические реакции.
Изотопы и модификации натрия:
Свойства натрия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Натрий |
| 102 | Прежнее название | |
| 103 | Латинское название | Natrium |
| 104 | Английское название | Sodium |
| 105 | Символ | Na |
| 106 | Атомный номер (номер в таблице) | 11 |
| 107 | Тип | Металл |
| 108 | Группа | Щелочной, лёгкий, цветной металл |
| 109 | Открыт | Хемфри Дэви, Великобритания, 1807 г. |
| 110 | Год открытия | 1807 г. |
| 111 | Внешний вид и пр. | Мягкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – натрий с кубической объёмно-центрированной кристаллической решёткой, – натрий с гексагональной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 23Na |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,3 % |
| 120 | Содержание в морях и океанах (по массе) | 1,1 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,002 % |
| 122 | Содержание в Солнце (по массе) | 0,004 % |
| 123 | Содержание в метеоритах (по массе) | 0,55 % |
| 124 | Содержание в организме человека (по массе) | 0,14 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 22,98976928(2) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s1 |
| 203 | Электронная оболочка | K2 L8 M1 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 180 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Na+ 1,13 (4) пм, 1,16 (6) пм, 1,32 (8) пм, 1,53 (12) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 227 пм |
| 209 | Электроны, Протоны, Нейтроны | 11 электронов, 11 протонов, 12 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1; 0; +1 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 0,93 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 495,85 кДж/моль (5,1390769(3) эВ) |
| 305 | Электродный потенциал | Na+ + e– → Na, Eo = -2,714 В |
| 306 | Энергия сродства атома к электрону | 52,867(3) кДж/моль (0,547926(25) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,9725 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело), 0,968 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 0,956 г/см3 (при 77 °C и иных стандартных условиях, состояние вещества – твердое тело), 0,927 г/см3 (при температуре плавления 97,794 °C и иных стандартных условиях, состояние вещества – жидкость), 0,926 г/см3 (при 100 °C и иных стандартных условиях, состояние вещества – жидкость), 0,921 г/см3 (при 127 °C и иных стандартных условиях, состояние вещества – жидкость), 0,897 г/см3 (при 227 °C и иных стандартных условиях, состояние вещества – жидкость), 0,826 г/см3 (при 527 °C и иных стандартных условиях, состояние вещества – жидкость), 0,778 г/см3 (при 727 °C и иных стандартных условиях, состояние вещества – жидкость), 0,742 г/см3 (при 877 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 97,794 °C (370,944 K, 208,029 °F) |
| 403 | Температура кипения* | 882,940 °C (1156,090 K, 1621,292 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,60 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 97,42 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 1,225 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость | 28,23 Дж/(K·моль) |
| 411 | Молярный объём | 23,74976 см³/моль |
| 412 | Теплопроводность | 142 Вт/(м·К) (при стандартных условиях), 142 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 4,2820 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 150 К |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 521 | Кристаллическая решётка #2 | |
| 522 | Структура решётки | Гексагональная
|
| 523 | Параметры решётки | a = 3,767 Å, c = 6,154 Å |
| 524 | Отношение c/a | 1,633 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P63/mmc |
| 527 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-23-5 |
Примечание:
205* Эмпирический радиус атома натрия [1] составляет 186 пм.
20* Ковалентный радиус натрия согласно [1] составляет 166±9 пм.
401* Плотность натрия согласно [3] составляет 0,971 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело), согласно [4] составляет 0,928 г/см3 (при 98 °C и иных стандартных условиях, состояние вещества – жидкость).
402* Температура плавления натрия согласно [3] составляет 97,81 °C (370,96 К, 208,06 °F).
403* Температура кипения натрия согласно [3] составляет 882,95 °C (1156,1 К, 1621,31 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) натрия согласно [3] составляет 2,64 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) натрия согласно [3] и [4] составляет 97,9 кДж/моль и 86,36 кДж/моль соответственно.
Физические свойства алюминия:
Химические свойства натрия. Взаимодействие натрия. Реакции с натрием:
Получение натрия:
Применение натрия:
Таблица химических элементов Д. И. Менделеева
И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34.
 Селен
Селен - 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67.
 Гольмий
Гольмий - 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100.
 Фермий
Фермий - 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Sodium
- https://de.wikipedia.org/wiki/Natrium
- https://ru.wikipedia.org/wiki/Натрий
- http://chemister.ru/Database/properties.php?dbid=1&id=170
- https://chemicalstudy.ru/natriy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www. pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
натрий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле натрия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 3 146
3.2: Ионы – Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 165433
Развитие навыков
- Дайте определение двум типам ионов.

- Используйте диаграммы Льюиса, чтобы проиллюстрировать образование ионов.
Большинство атомов не имеют восьми электронов в своей валентной электронной оболочке. Некоторые атомы имеют только несколько электронов на своей внешней оболочке, в то время как некоторым атомам не хватает только одного или двух электронов, чтобы иметь октет. В случаях, когда атом имеет три или меньше валентных электронов, атом может довольно легко потерять эти валентные электроны, пока не останется нижняя оболочка, содержащая октет. Атомы, которые теряют электроны, в результате приобретают положительный заряд, потому что у них остается меньше отрицательно заряженных электронов, чтобы уравновесить положительные заряды протонов в ядре. Положительно заряженные ионы называются катионами. Большинство металлов становятся катионами, когда образуют ионные соединения.
Некоторые атомы имеют почти восемь электронов в своей валентной оболочке и могут приобретать дополнительные валентные электроны, пока не получат октет. Когда эти атомы приобретают электроны, они приобретают отрицательный заряд, потому что теперь у них больше электронов, чем протонов. Отрицательно заряженные ионы называются анионами. Большинство неметаллов становятся анионами, когда они образуют ионные соединения.
Когда эти атомы приобретают электроны, они приобретают отрицательный заряд, потому что теперь у них больше электронов, чем протонов. Отрицательно заряженные ионы называются анионами. Большинство неметаллов становятся анионами, когда они образуют ионные соединения.
Названия положительных и отрицательных ионов произносятся как CAT-eye-ons (катионы) и ANN-eyes-ons (анионы) соответственно.
Электронный перенос
Мы можем использовать электронные конфигурации, чтобы проиллюстрировать процесс электронного переноса между атомами натрия и атомами хлора.
NA: 1 S 2 2 S 2 2 P 6 3 S 1
Как продемонстрировано здесь, Atom ATOM). третий главный энергетический уровень. Вероятно, он достигнет октета в своей внешней оболочке, потеряв один валентный электрон. Катион, полученный таким образом, Na + , называется ионом натрия, чтобы отличить его от элемента.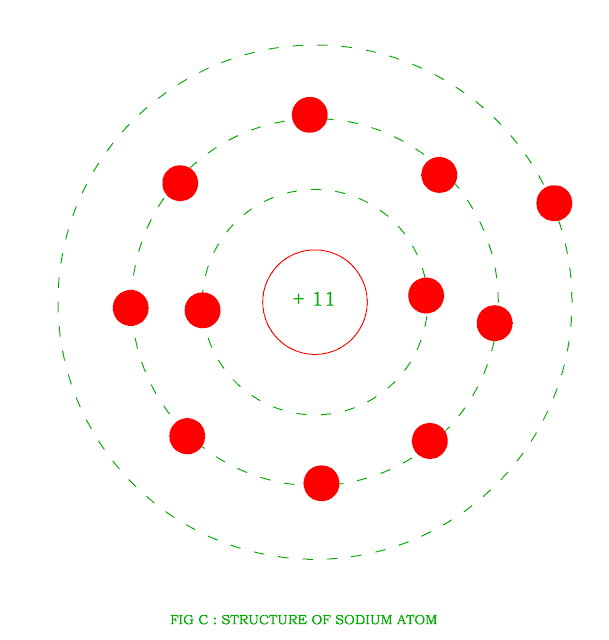 Ион натрия Na + имеет электронную конфигурацию с октетом электронов со второго основного энергетического уровня. Теперь он такой же, как у благородного газа неона. Термин изоэлектронный относится к атому и иону другого атома (или двум разным ионам), которые имеют одинаковую электронную конфигурацию. Ион натрия изоэлектронен атому неона. Приведенное ниже уравнение иллюстрирует этот процесс. 96 \: \text{(octet)} \end{array}\]
Ион натрия Na + имеет электронную конфигурацию с октетом электронов со второго основного энергетического уровня. Теперь он такой же, как у благородного газа неона. Термин изоэлектронный относится к атому и иону другого атома (или двум разным ионам), которые имеют одинаковую электронную конфигурацию. Ион натрия изоэлектронен атому неона. Приведенное ниже уравнение иллюстрирует этот процесс. 96 \: \text{(octet)} \end{array}\]
Рисунок \(\PageIndex{1}\) представляет собой графическое изображение этого процесса.
Рисунок \(\PageIndex{1}\): образование иона натрия. Слева атом натрия имеет 11 электронов. Справа ион натрия имеет только 10 электронов и заряд 1+.
Теперь рассмотрим атом хлора, Cl: 1 s 2 2 s 2 2 p 6 3 3
44 2
3 p 5 Для получения октета в валентной оболочке хлора требуется всего один электрон. Когда атом хлора приобретает электрон, его самый внешний главный энергетический уровень достигает октета. В этом случае ион имеет ту же внешнюю оболочку, что и первоначальный атом, но теперь в этой оболочке восемь электронов. Еще раз, правило октета было выполнено. Образующийся анион Cl – называется ионом хлорида; обратите внимание на небольшое изменение суффикса (- 96 \text{(octet)} \end{array}\]
Когда атом хлора приобретает электрон, его самый внешний главный энергетический уровень достигает октета. В этом случае ион имеет ту же внешнюю оболочку, что и первоначальный атом, но теперь в этой оболочке восемь электронов. Еще раз, правило октета было выполнено. Образующийся анион Cl – называется ионом хлорида; обратите внимание на небольшое изменение суффикса (- 96 \text{(octet)} \end{array}\]
Рисунок \(\PageIndex{2}\) представляет собой графическое изображение этого процесса.
Рисунок \(\PageIndex{2}\): Образование иона хлора. Слева атом хлора имеет 17 электронов. Справа ион хлорида имеет 18 электронов и имеет заряд 1-.
Между двумя противоположно заряженными ионами возникает электростатическое притяжение, поскольку притягиваются противоположные заряды. Полученная комбинация представляет собой соединение хлорида натрия. Заметьте, что нет остаточных электронов. Количество электронов, потерянных атомом натрия (один), равно количеству электронов, полученных атомом хлора (один), поэтому соединение электрически нейтрально. В макроскопических образцах хлорида натрия содержатся миллиарды и миллиарды ионов натрия и хлорида, хотя всегда присутствует одинаковое количество катионов и анионов.
В макроскопических образцах хлорида натрия содержатся миллиарды и миллиарды ионов натрия и хлорида, хотя всегда присутствует одинаковое количество катионов и анионов.
Пример \(\PageIndex{1}\)
Запишите электронную конфигурацию атома алюминия (Z=13). Сколько электронов должен потерять/приобрести Al, чтобы получить октет? Напишите формулу образовавшегося иона и его электронную конфигурацию.
Solution
The electron configuration of Al atom is 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 . Вторая оболочка имеет октет (2 s 2 2 p 6 ), а валентная оболочка имеет 3 электрона (3 s 2 3 p 1 ). Mg может достичь октета, потеряв 3 валентных электрона. Полученный катион представляет собой Al 3+ с электронной конфигурацией, 1 s 2 2 s 2 2 p 6 .
Упражнение \(\PageIndex{1}\)
Напишите электронную конфигурацию атома кислорода (Z=8). Сколько электронов O должен потерять/приобрести, чтобы получить октет? Напишите формулу образовавшегося иона и его электронную конфигурацию.
- Ответить
Электронная конфигурация атома O: 1 s 2 2 s 2 2 p 4 . Вторая оболочка имеет шесть электронов (2 s 2 2 p 4 ) и нуждается в двух электронах для достижения октета. Кислород получит 2 электрона. Образовавшийся анион O 2 − с электронной конфигурацией, 1 с 2 2 с 2 2 р 6 .
Во многих случаях элементы, принадлежащие к одной и той же группе (вертикальный столбец) периодической таблицы, образуют ионы с одинаковым зарядом, потому что они имеют одинаковое количество валентных электронов. Таким образом, периодическая таблица становится инструментом для запоминания зарядов многих ионов. Например, все ионы из щелочных металлов, первого столбца периодической таблицы, имеют заряд 1+. Ионы из щелочноземельных металлов, второй группы периодической таблицы, имеют заряд 2+. На другой стороне периодической таблицы предпоследний столбец, галогены, образуют ионы, имеющие заряд 1-. На рисунке \(\PageIndex{3}\) показано, как можно предсказать заряд многих ионов по положению элемента в периодической таблице. Обратите внимание на то, что сначала пишут число, а затем знак многозарядного иона. Катион бария пишется Ba 2 + , не Ba +2 .
Таким образом, периодическая таблица становится инструментом для запоминания зарядов многих ионов. Например, все ионы из щелочных металлов, первого столбца периодической таблицы, имеют заряд 1+. Ионы из щелочноземельных металлов, второй группы периодической таблицы, имеют заряд 2+. На другой стороне периодической таблицы предпоследний столбец, галогены, образуют ионы, имеющие заряд 1-. На рисунке \(\PageIndex{3}\) показано, как можно предсказать заряд многих ионов по положению элемента в периодической таблице. Обратите внимание на то, что сначала пишут число, а затем знак многозарядного иона. Катион бария пишется Ba 2 + , не Ba +2 .
Пример \(\PageIndex{2}\)
Какой из этих ионов вряд ли образуется?
- Мг +
- К +
Раствор
(a) Mg относится к группе 2А и имеет два валентных электрона. Он достигает октета, теряя два электрона с образованием катиона Mg 2+ . Потеря всего одного электрона с образованием Mg + не дает октета, следовательно, Mg + вряд ли сформируется.
Он достигает октета, теряя два электрона с образованием катиона Mg 2+ . Потеря всего одного электрона с образованием Mg + не дает октета, следовательно, Mg + вряд ли сформируется.
Упражнение \(\PageIndex{2}\)
Какой из этих ионов вряд ли образуется?
- С 3 −
- Н 3 −
- Ответить
(a) S находится в группе 6A и имеет шесть валентных электронов. Он достигает октета, приобретая два электрона с образованием аниона S 2 − . Получение трех электронов с образованием S 3 – не делает его октетом, следовательно, S 3 – вряд ли сформируется.
Диаграммы Льюиса
Химики используют простые диаграммы, чтобы показать валентные электроны атома и то, как они переносятся. Эти диаграммы имеют два преимущества перед диаграммами электронных оболочек. Во-первых, они показывают только валентные электроны. Во-вторых, вместо круга вокруг химического символа, обозначающего электронную оболочку, они имеют до восьми точек вокруг символа; каждая точка представляет собой валентный электрон. Эти точки располагаются справа и слева, сверху и снизу от символа, причем не более двух точек на стороне. Например, представление для натрия выглядит следующим образом:
Эти диаграммы имеют два преимущества перед диаграммами электронных оболочек. Во-первых, они показывают только валентные электроны. Во-вторых, вместо круга вокруг химического символа, обозначающего электронную оболочку, они имеют до восьми точек вокруг символа; каждая точка представляет собой валентный электрон. Эти точки располагаются справа и слева, сверху и снизу от символа, причем не более двух точек на стороне. Например, представление для натрия выглядит следующим образом:
, а для хлора используется следующее:
Для приведенных выше диаграмм не имеет значения, с какой стороны на диаграмме Льюиса расположены точки, если на каждой стороне имеется не более двух точек.
Эти диаграммы называются электронно-точечные диаграммы Льюиса или просто диаграммы Льюиса в честь Гилберта Н. Льюиса, американского химика, который их представил. Чтобы написать символ точки Льюиса элемента, поместите точки, представляющие его валентные электроны, по одной вокруг химического символа элемента. До четырех точек помещаются сверху, снизу, слева и справа от символа (в любом порядке, если элементы с четырьмя или менее валентными электронами имеют не более одной точки в каждой позиции). Следующие точки для элементов с более чем четырьмя валентными электронами снова распределяются по одной, каждая в паре с одним из первых четырех. Другими словами, поместите точки по отдельности с каждой стороны, прежде чем соединять их. Электронно-точечная диаграмма Льюиса фтора, например, с семью валентными электронами строится следующим образом:
До четырех точек помещаются сверху, снизу, слева и справа от символа (в любом порядке, если элементы с четырьмя или менее валентными электронами имеют не более одной точки в каждой позиции). Следующие точки для элементов с более чем четырьмя валентными электронами снова распределяются по одной, каждая в паре с одним из первых четырех. Другими словами, поместите точки по отдельности с каждой стороны, прежде чем соединять их. Электронно-точечная диаграмма Льюиса фтора, например, с семью валентными электронами строится следующим образом:
На рисунке \(\PageIndex{4}\) показаны электронные конфигурации и диаграммы Льюиса элементов от лития до неона, что соответствует всему второму периоду периодической таблицы. Для элементов основной группы число валентных электронов равно , что и группа номер , указанная в верхней части периодической таблицы.
Рисунок \(\PageIndex{4}\): Электронно-точечные диаграммы Льюиса элементов от лития до неона
Перенос электронов можно легко проиллюстрировать диаграммами Льюиса:
В окончательной формуле точки опущены.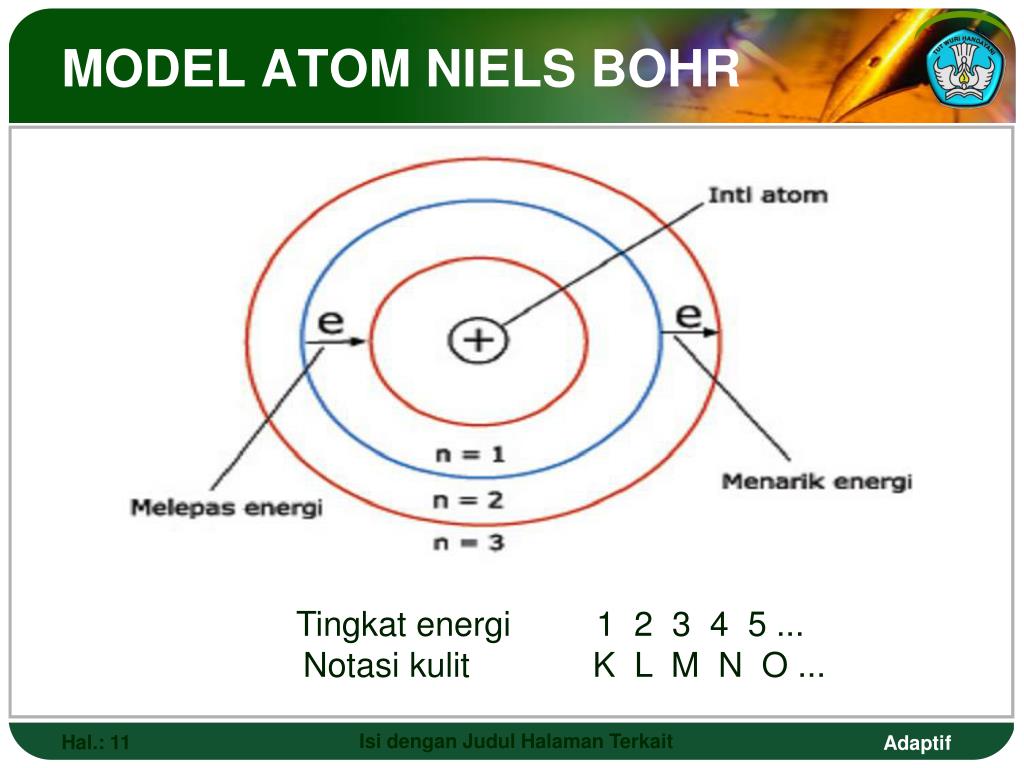
Пример \(\PageIndex{3}\)
Начав с атомов лития и брома, используйте диаграммы Льюиса, чтобы показать образование ионного соединения LiBr.
РЕШЕНИЕ
Из таблицы Менделеева мы видим, что литий находится в том же столбце, что и натрий, поэтому он будет иметь такую же конфигурацию электрона валентной оболочки. Это означает, что нейтральный атом лития будет иметь ту же диаграмму Льюиса, что и атом натрия. Точно так же бром находится в той же колонке, что и хлор, поэтому у него будет та же диаграмма Льюиса, что и у хлора. Следовательно,
Упражнение \(\PageIndex{3}\)
Начав с атомов магния и кислорода, используйте диаграммы Льюиса, чтобы показать образование ионного соединения MgO.
- Ответ:
Некоторые ионные соединения имеют разное количество катионов и анионов. В этих случаях перенос электрона происходит между более чем одним атомом. Например, вот образование MgBr 2 :
Например, вот образование MgBr 2 :
Обратите внимание, что в этом примере на каждый ион магния (заряд 2+) требуется два иона бромида (заряд 1–), чтобы общий заряд соединения равняться нулю. это называется остаток заряда . Номер каждого типа иона указан в формуле нижним индексом.
Большинство элементов, образующих ионные соединения, образуют ион с характерным зарядом. Например, натрий образует ионные соединения, в которых ион натрия всегда имеет заряд 1+. Хлор образует ионные соединения, в которых ион хлора всегда имеет заряд 1-. Некоторые элементы, особенно переходные металлы, могут образовывать многозарядные ионы. На рисунке \(\PageIndex{5}\) показаны характерные заряды некоторых из этих ионов. Как мы видели на рисунке \(\PageIndex{1}\), для зарядов многих ионов основной группы существует закономерность, но нет простой закономерности для ионов переходных металлов (или для более крупных элементов основной группы).
Рисунок \(\PageIndex{5}\): Заряды одноатомных ионов.
 Обратите внимание, что некоторые атомы обычно образуют ионы с переменным зарядом.
Обратите внимание, что некоторые атомы обычно образуют ионы с переменным зарядом.
Ключевые выводы
- Ионы могут быть заряжены положительно или отрицательно.
- Диаграмма Льюиса используется, чтобы показать, как электроны передаются для образования ионов и ионных соединений.
Упражнения
Какие два типа ионов существуют?
Используйте диаграммы Льюиса, чтобы проиллюстрировать образование ионного соединения из атома калия и атома йода.
3. Когда следующие атомы становятся ионами, какой заряд они приобретают?
- Ли
- С
- Са
- Ф
4. Идентифицируйте каждый из них как катион, анион или ни то, ни другое.
- Н +
- Кл −
- О 2
- Ба 2 +
- СН 4
- КС 2
5. Определите каждый из них как катион, анион или ни то, ни другое.
Определите каждый из них как катион, анион или ни то, ни другое.
- НХ 3
- Бр −
- Н −
- рт.ст. 2 +
- ССl 4
- СО 3
6. Напишите электронную конфигурацию для каждого иона.
- Ли +
- мг 2 +
- Ф −
- С 2−
7. Напишите электронную конфигурацию для каждого иона.
- Нет данных +
- Be 2 +
- Кл −
- О 2−
8. Нарисуйте диаграммы Льюиса для ионов, перечисленных в упражнении 6. Также включите диаграммы Льюиса для соответствующих нейтральных атомов для сравнения.
9. Нарисуйте диаграммы Льюиса для ионов, перечисленных в упражнении 7. Также включите диаграммы Льюиса для соответствующих нейтральных атомов для сравнения.
Также включите диаграммы Льюиса для соответствующих нейтральных атомов для сравнения.
10. Используя диаграммы Льюиса, покажите перенос электрона при образовании LiF.
11. Используя диаграммы Льюиса, покажите перенос электрона при образовании MgO.
12. Используя диаграммы Льюиса, покажите перенос электронов для образования Li 2 O.
13. С помощью диаграмм Льюиса покажите перенос электронов для образования CaF 2 .
14. Какой характерный заряд имеют атомы в первом столбце периодической таблицы, когда они становятся ионами?
15. Какой характерный заряд имеют атомы во втором столбце периодической таблицы, когда они становятся ионами?
16. Какой характерный заряд имеют атомы в предпоследнем столбце периодической таблицы, когда они становятся ионами?
17. Какой характерный заряд имеют атомы в предпоследнем столбце периодической таблицы, когда они становятся ионами?
Ответы
Катионы имеют положительный заряд, а анионы — отрицательный.

- 1+
- 2−
- 2+
- 1−
4.
- катион
- анион
- ни
- катион
- ни
- ни
5.
- ни один
- анион
- анион
- катион
- ни
- ни
6.
- 1 с 2
- 1 с 2 2 с 2 2 р 6
- 1 с 2 2 с 2 2 р 6
- 1 S 2 2 S 2 2 P 6 3 S 2 3 P 6
7.
- 1 с 2 2 с 2 2 р 6
- 5
- 1 с 2
- 1 с 2 2 с 2 2 с 6 3 с 4 3 3 0044 6
- 1 с 2 2 с 2 2 р 6
8.
9.
10.
11.
12.
13.
14. 1 +
15. 2+
16. 2−
17. 1−
3.2: Ионы распространяются под лицензией CC BY-SA и были созданы, изменены и/или курированы LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Показать страницу TOC
- № на стр.
- Теги
- остаток заряда
Уровни энергии, электроны и ионная связь | Глава 4: Периодическая таблица и связь
Вам это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Спасибо!
Урок 4.5
Ключевые понятия
- Притяжение между протонами и электронами атомов может заставить электрон полностью перейти от одного атома к другому.
- Когда атом теряет или приобретает электрон, он называется ионом.
- Атом, потерявший электрон, становится положительным ионом.
- Атом, получивший электрон, становится отрицательным ионом.
- Положительный и отрицательный ион притягиваются друг к другу и образуют ионную связь.
Резюме
Учащиеся будут смотреть анимационные ролики и делать рисунки ионной связи хлорида натрия (NaCl). Студенты увидят, что и ионная, и ковалентная связь начинаются с притяжения протонов и электронов между различными атомами. Но при ионной связи электроны передаются от одного атома к другому, а не разделяются, как при ковалентной связи. Учащиеся будут использовать шарики из пенопласта для создания моделей ионной связи в хлориде натрия (соли).
Цель
Учащиеся смогут объяснить процесс образования ионов и ионных связей.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки.
Материалы для каждой группы
- Черная бумага
- Соль
- Чашка с солью из выпаренной соленой воды
- Лупа
- Перманентный маркер
Материалы для каждого учащегося
- 2 маленьких пенопластовых шарика
- 2 больших пенопластовых шарика
- 2 зубочистки
Примечание. В веществе с ионными связями, таком как NaCl, наименьшее соотношение положительных и отрицательных ионов, связанных вместе, называется «формульной единицей», а не «молекулой». С технической точки зрения термин «молекула» относится к двум или более атомам, которые связаны друг с другом ковалентно, а не ионно. Для простоты вы можете использовать термин «молекула» как для ковалентно, так и для ионных связей веществ.
Для простоты вы можете использовать термин «молекула» как для ковалентно, так и для ионных связей веществ.
Покажите видео реакции металлического натрия с газообразным хлором.
Спроецируйте видео Реакция натрия и хлора.
Перед просмотром видео скажите учащимся, что хлор — это зеленоватый ядовитый газ, а натрий — блестящий, мягкий и очень активный металл. Но когда они реагируют, они образуют хлорид натрия (поваренную соль). Скажите учащимся, что на видео капля воды помогает обнажить атомы на поверхности натрия, чтобы они могли реагировать с хлором. Образование кристаллов соли высвобождает много энергии.
Примечание. Если учащиеся спросят, производится ли соль, которую они едят, на соляных фабриках таким образом, ответ будет отрицательным. Соль на Земле была произведена миллиарды лет назад, но, вероятно, не из чистого газообразного хлора и металлического натрия. В наши дни мы получаем соль, добывая ее из минерала под названием галит или выпаривая морскую воду.

Покажите анимацию, знакомящую с процессом ионной связи.
Проект анимации Ионная связь в хлориде натрия.
Напомните учащимся, что при ковалентной связи атомы имеют общие электроны. Но есть и другой тип связи, при котором атомы не делятся, а вместо этого либо принимают, либо отдают электроны. Это называется ионной связью. Эта анимация показывает очень упрощенную модель образования ионов натрия и хлорида.
Примечание. Для упрощения модели ионной связи показаны отдельные атомы натрия и хлора. В действительности атом хлора был бы связан с другим атомом хлора в составе газа Cl 2 . Атом натрия был бы одним из миллиардов триллионов атомов натрия, связанных вместе в виде твердого тела. Сочетание этих веществ представляет собой сложную реакцию между атомами двух веществ. Анимация показывает отдельные отдельные атомы, чтобы проиллюстрировать идею образования ионов и ионных связей.
Объясните, что происходит во время анимации.

Скажите учащимся, что притяжение протонов натрия и хлора к электронам других атомов сближает атомы. Хлор сильнее притягивает электроны, чем натрий (показано более толстой стрелкой). В какой-то момент во время этого процесса электрон от натрия передается хлору. Натрий теряет электрон, а хлор приобретает электрон.
Скажите учащимся, что когда атом приобретает или теряет электрон, он становится ионом.
- Натрий теряет электрон, оставляя 11 протонов, но только 10 электронов. Поскольку в нем на 1 протон больше, чем электронов, натрий имеет заряд +1, что делает его положительным ионом.
- Хлор получает электрон, оставляя 17 протонов и 18 электронов. Поскольку у него на 1 электрон больше, чем у протонов, хлор имеет заряд -1, что делает его отрицательным ионом.
- Когда образуются ионы, атомы приобретают или теряют электроны, пока их внешний энергетический уровень не заполнится.
- Например, когда натрий теряет один внешний электрон с третьего энергетического уровня, второй уровень становится новым внешним энергетическим уровнем и заполняется.
 Поскольку эти электроны находятся ближе к ядру, они крепче удерживаются и не уйдут.
Поскольку эти электроны находятся ближе к ядру, они крепче удерживаются и не уйдут. - Когда хлор получает электрон, его третий энергетический уровень становится заполненным. Дополнительный электрон не может присоединиться, потому что он должен прийти на четвертом энергетическом уровне. Так далеко от ядра электрон не будет чувствовать достаточного притяжения со стороны протонов, чтобы быть стабильным.
- Например, когда натрий теряет один внешний электрон с третьего энергетического уровня, второй уровень становится новым внешним энергетическим уровнем и заполняется.
- Затем положительный ион натрия и отрицательный ион хлорида притягиваются друг к другу и образуют ионную связь. Ионы более стабильны, когда они связаны, чем в виде отдельных атомов.
Предложите учащимся описать процесс образования ионной связи в хлориде натрия на своих рабочих листах.
Раздайте каждому учащемуся лист с заданиями.
Предложите учащимся написать краткую подпись под каждой картинкой, чтобы описать процесс ковалентной связи и ответить на первые три вопроса. Остальная часть рабочего листа будет выполнена в классе, в группах или индивидуально в зависимости от ваших инструкций.

Спроецируйте изображение Ионная связь в хлориде натрия.
Просмотрите вместе с учащимися процесс ионной связи, показанный в анимации.
Помогите учащимся написать короткую подпись рядом с каждой картинкой, описывающую процесс образования ионной связи в ионах натрия и хлорида.
- Атомы натрия и хлора находятся рядом друг с другом.
- Протоны двух атомов притягивают электроны другого атома. Более толстая стрелка показывает, что хлор сильнее притягивает электроны, чем натрий.
- При взаимодействии между атомами электрон внешнего энергетического уровня натрия переходит на внешний энергетический уровень атома хлора.
- Поскольку натрий потерял электрон, у него 11 протонов, но только 10 электронов. Это делает натрий положительным ионом с зарядом +1. Поскольку хлор получил электрон, у него 17 протонов и 18 электронов. Это делает хлорид отрицательным ионом с зарядом -1.
- Положительный ион натрия и отрицательный ион хлорида притягиваются друг к другу.
 Они образуют ионную связь и образуют ионное соединение NaCl.
Они образуют ионную связь и образуют ионное соединение NaCl.
Покажите учащимся модель кристалла хлорида натрия и попросите их определить ионы.
Спроецируйте изображение Кристалл хлорида натрия.
Повторите вместе с учащимися процесс ионной связи, показанный в анимации, чтобы учащиеся поняли, почему ионы натрия положительные, а ионы хлорида отрицательные.
Напомните учащимся, что масштаб любой модели атомов, ионов или молекул огромен по сравнению с реальным размером. В одной крупинке соли содержатся миллиарды триллионов ионов натрия и хлора.
Спросите студентов:
- Какой ион является большим шаром с отрицательным зарядом?
- Ион хлора.
- Что сделало его отрицательным?
- Он получил электрон.
- Какой ион имеет положительный заряд?
- Ион натрия.
- Что сделало его положительным?
- Он потерял электрон.
Предложите учащимся понаблюдать за настоящими кристаллами хлорида натрия и сравнить их форму с молекулярной моделью.

Это задание, состоящее из двух частей, поможет учащимся увидеть взаимосвязь между расположением ионов в модели кристалла хлорида натрия и кубической формой реальных кристаллов хлорида натрия.
Подготовка учителя
За день до урока растворить около 10 граммов соли в 50 мл воды. Используйте чашки Петри или используйте ножницы, чтобы вырезать 5 или 6 прозрачных пластиковых чашек, чтобы сделать неглубокие пластиковые чашки. Налейте достаточно соленой воды, чтобы только покрыть дно каждой тарелки (по 1 на каждую группу). Оставьте посуду на ночь, чтобы она испарилась, чтобы образовались новые кристаллы соли.
Материалы для каждой группы
- Черная бумага
- Соль
- Чашка с солью из выпаренной соленой воды
- Лупа
- Перманентный маркер
Материалы на каждого учащегося
- 2 маленьких пенопластовых шарика
- 2 больших пенопластовых шарика
- 2 зубочистки
Процедура, часть 1
Обратите внимание на кристаллы хлорида натрия.

- Положите несколько крупинок соли на лист черной бумаги. Используйте лупу, чтобы внимательно рассмотреть соль.
- Используйте лупу, чтобы посмотреть на кристаллы соли в чашке.
Проецирование изображения Кубический хлорид натрия.
На изображении показан увеличенный вид обычной поваренной соли и модель ионов натрия и хлора, составляющих кристалл соли.
Проект анимации Кристалл хлорида натрия.
Зеленые сферы представляют собой отрицательно заряженные ионы хлора, а серые сферы представляют собой положительно заряженные ионы натрия.
Спросите студентов:
- Что фотография, молекулярная модель и ваши наблюдения за реальными кристаллами соли говорят вам о структуре соли?
- В каждом случае соль имеет форму куба.
Предложите учащимся построить трехмерную модель хлорида натрия.
Каждый ученик изготовит 1 единицу хлорида натрия. Учащиеся в каждой группе собирают свои единицы хлорида натрия вместе.
 Вы можете помочь группам объединить свои структуры в классную модель кристалла хлорида натрия.
Вы можете помочь группам объединить свои структуры в классную модель кристалла хлорида натрия.Процедура, часть 2
Сделать единицы NaCl.
- Используйте маркер, чтобы поставить «-» на больших шарах, которые представляют ионы хлора.
- Используйте маркер, чтобы поставить «+» на маленькие шарики, которые представляют ионы натрия.
- Разломите две зубочистки пополам. Используйте одну из полузубочисток, чтобы соединить центры малых и больших ионов вместе, чтобы получилась единица хлорида натрия (NaCl). Проделайте то же самое с другим маленьким и большим мячом.
Используйте другую половину зубочистки, чтобы соединить два блока NaCl по прямой линии, как показано на рисунке.
Соедините ионы NaCl вместе, чтобы получился один слой ионов.
- Внесите свой ряд ионов в свою группу и расположите их так, чтобы получился квадрат из ионов 4×4.
Используйте полузубочистки, чтобы соединить концы каждой линии, чтобы скрепить ионы.
 Вам нужно только поместить зубочистки в шарики в конце каждой линии.
Вам нужно только поместить зубочистки в шарики в конце каждой линии.
Соберите кристалл хлорида натрия класса.
Отдайте учителю слой ионов вашей группы. Ваш учитель сложит их, чтобы построить модель кристалла хлорида натрия.
Обратите внимание: куда бы вы ни посмотрели на кристалл, ион натрия и ион хлорида всегда окружены противоположно заряженным ионом. Эти противоположные заряды удерживают ионы вместе в кристалле.
Спросите студентов
- Основываясь на том, как ионы натрия и хлорида связываются друг с другом, почему кристаллы соли имеют форму кубов?
- Размер и расположение ионов образуют куб на молекулярном уровне. Поскольку узор повторяется снова и снова одним и тем же образом, форма остается неизменной, даже когда кристалл становится нормального размера, который мы можем видеть.
Покажите учащимся, как атомы кальция и хлора связываются, образуя ионное соединение хлорида кальция.

Расскажите учащимся, что есть еще одно распространенное вещество, называемое хлоридом кальция (CaCl 2 ). Это соль, которая используется на обледенелых тротуарах и дорогах. Объясните, что когда кальций и хлор реагируют, они образуют ионы, такие как натрий и хлор, но ион кальция отличается от иона натрия.
Спросите студентов:
- Как вы думаете, из каких ионов состоит CaCl 2 ?
- Один ион кальция и два иона хлорида.
Анимационный проект Хлорид кальция Ионная связь.
Укажите, что кальций теряет два электрона, становясь ионом +2. Каждый из двух атомов хлора получает один из этих электронов, что делает их ионами −1. Помогите учащимся понять, что 1 ион кальция связывается с 2 ионами хлорида, образуя хлорид кальция (CaCl 2 ), который является нейтральным.
Некоторые атомы приобретают или теряют более 1 электрона. Кальций теряет 2 электрона, когда становится ионом. Когда ионы собираются вместе, образуя ионную связь, они всегда объединяются в количестве, которое точно уравновешивает положительный и отрицательный заряд.

Спроецируйте изображение Хлорид кальция Ионная связь.
Просмотрите вместе с учащимися процесс ионной связи, показанный в анимации.
Предложите учащимся написать краткую подпись под каждой картинкой, описывающую процесс образования ионной связи в ионах натрия и хлорида.
- Один кальций и два хлора рядом друг с другом.
- Протоны атома кальция притягивают электроны от атома хлора. Протоны двух атомов хлора сильнее притягивают электроны от атома кальция, как показано более толстыми стрелками.
- Во время взаимодействия между атомами два электрона внешнего энергетического уровня кальция переходят на внешний энергетический уровень каждого из атомов хлора.
- Поскольку кальций потерял два электрона, у него 20 протонов, но только 18 электронов. Это делает кальций положительным ионом с зарядом 2+. Поскольку каждый атом хлора получил электрон, у каждого из них есть 17 протонов и 18 электронов. Это делает каждый хлорид отрицательным ионом с зарядом -1.

- Противоположные ионы притягиваются друг к другу, образуя ионную связь. Связанные ионы более стабильны, чем отдельные атомы.
Ionic Bonds – Introductory Chemistry – 1st Canadian Edition
Глава 9. Химические связи
- Укажите правило октетов.
- Дайте определение ионной связи .
- Продемонстрировать перенос электронов между атомами для образования ионных связей.
В разделе «Электронно-точечные диаграммы Льюиса» мы видели, как образуются ионы, теряя электроны, образуя катионы, или приобретая электроны, образуя анионы. Проницательный читатель мог кое-что заметить: многие образующиеся ионы имеют восемь электронов на валентной оболочке. Либо атомы приобретают достаточно электронов, чтобы иметь восемь электронов на валентной оболочке и становятся соответствующим образом заряженным анионом, либо теряют электроны в своей исходной валентной оболочке. Нижняя оболочка , теперь валентная оболочка, содержит восемь электронов, поэтому атом становится положительно заряженным.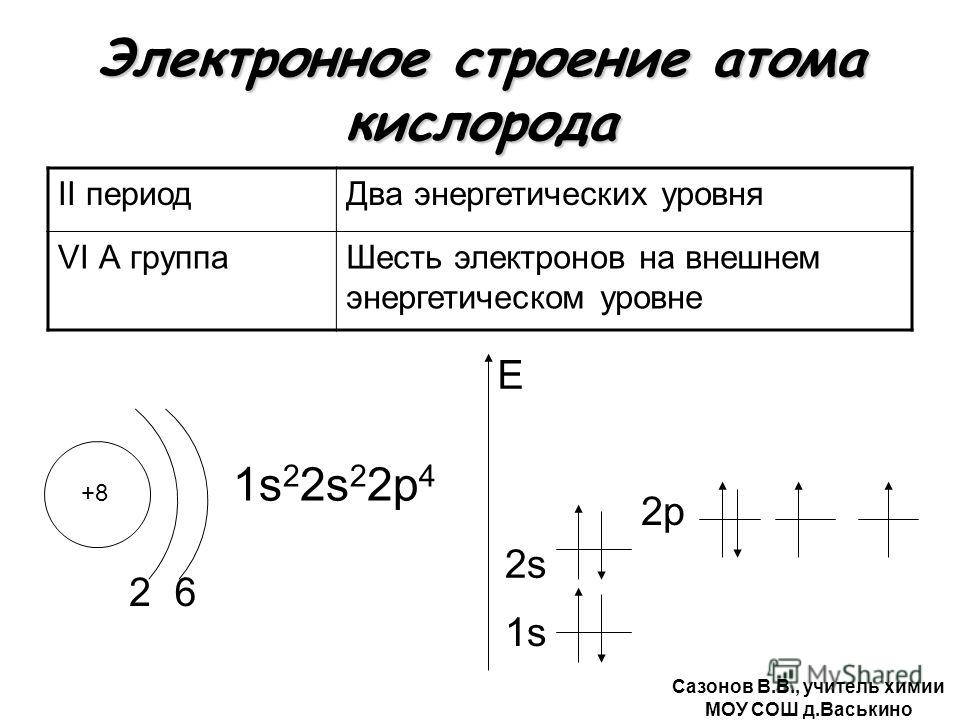 По какой-то причине наличие восьми электронов на валентной оболочке является особенно энергетически стабильным расположением электронов. Тенденция, согласно которой атомы хотят иметь восемь электронов на своей валентной оболочке, называется . Когда атомы образуют соединения, правило октетов не всегда выполняется для всех атомов в любое время, но это очень хорошее практическое правило для понимания типов соединений, которые могут образовывать атомы.
По какой-то причине наличие восьми электронов на валентной оболочке является особенно энергетически стабильным расположением электронов. Тенденция, согласно которой атомы хотят иметь восемь электронов на своей валентной оболочке, называется . Когда атомы образуют соединения, правило октетов не всегда выполняется для всех атомов в любое время, но это очень хорошее практическое правило для понимания типов соединений, которые могут образовывать атомы.
Невозможно нарушить правило октетов. Рассмотрим натрий: в своей элементарной форме он имеет один валентный электрон и стабилен. Однако он довольно реакционноспособен и не требует много энергии, чтобы удалить этот электрон и создать ион Na + . Мы могли бы удалить еще один электрон, добавив еще больше энергии иону, чтобы получить ион Na 2+ . Однако для этого требуется гораздо больше энергии, чем обычно доступно в химических реакциях, поэтому натрий останавливается на заряде 1+ после потери одного электрона. Оказывается, Na 9Ион 0044 + имеет полный октет в своей новой валентной оболочке, оболочке n = 2, которая удовлетворяет правилу октета. Правило октета является результатом тенденций изменения энергий и полезно для объяснения того, почему атомы образуют те ионы, которые они образуют.
Оказывается, Na 9Ион 0044 + имеет полный октет в своей новой валентной оболочке, оболочке n = 2, которая удовлетворяет правилу октета. Правило октета является результатом тенденций изменения энергий и полезно для объяснения того, почему атомы образуют те ионы, которые они образуют.
Теперь рассмотрим атом Na в присутствии атома Cl. Два атома имеют следующие электронные точечные диаграммы Льюиса и электронные конфигурации:
Чтобы атом Na получил октет, он должен потерять электрон; чтобы атом Cl получил октет, он должен получить электрон. Электрон переходит от атома Na к атому Cl:
В результате образуются два иона — ион Na + и ион Cl − :
Оба вида теперь имеют полные октеты, а электронные оболочки энергетически стабильны. Из основ физики мы знаем, что противоположные заряды притягиваются. Вот что происходит с ионами Na + и Cl – :
Где мы написали окончательную формулу (формулу хлорида натрия) в соответствии с соглашением для ионных соединений, без явного указания зарядов. Притяжение между противоположно заряженными ионами называется ионами и является одним из основных типов химических связей в химии. Ионные связи образуются электронами перенос с одного атома на другой.
Притяжение между противоположно заряженными ионами называется ионами и является одним из основных типов химических связей в химии. Ионные связи образуются электронами перенос с одного атома на другой.
При переносе электронов количество потерянных электронов должно равняться количеству полученных электронов. Мы видели это в образовании NaCl. Аналогичный процесс происходит между атомами Mg и атомами O, за исключением того, что в этом случае передаются два электрона:
Каждый из двух ионов имеет октеты в качестве валентной оболочки, и две противоположно заряженные частицы притягиваются, образуя ионную связь:
Помните, что в окончательной формуле ионного соединения мы не пишем заряды ионов.
Что происходит, когда атом Na взаимодействует с атомом O? Атому O нужно два электрона, чтобы завершить свой октет валентности, но атом Na поставляет только один электрон:
. Атом О по-прежнему не имеет октета электронов. Что нам нужно, так это второй атом Na, чтобы отдать второй электрон атому O:
Что нам нужно, так это второй атом Na, чтобы отдать второй электрон атому O:
Эти три иона притягиваются друг к другу, образуя в целом нейтрально заряженное ионное соединение, которое мы записываем как Na 2 O. Необходимость в том, чтобы число потерянных электронов равнялось числу полученных электронов, объясняет, почему ионные соединения имеют соотношение катионов в анионы, что они и делают. Этого требует и закон сохранения материи.
Стрелками показан перенос электронов с образованием хлорида кальция от атомов Са и атомов Cl.
Решение
Атом Ca имеет два валентных электрона, тогда как атом Cl имеет семь электронов. Атому Cl нужен только еще один электрон, чтобы завершить свой октет, в то время как атомам Ca нужно потерять два электрона. Таким образом, нам нужно два атома Cl, чтобы принять два электрона от одного атома Ca. Процесс переноса выглядит следующим образом:
Противоположные ионы притягиваются друг к другу, образуя CaCl 2 .
Стрелками показан перенос электронов с образованием сульфида калия от атомов K и атомов S.
Ответить
Прочность ионной связи зависит от двух основных характеристик: величины заряда и размера иона. Чем больше величина заряда, тем прочнее ионная связь. Чем меньше ион, тем прочнее ионная связь (поскольку меньший размер иона позволяет ионам сближаться). Измеренная сила ионной связи называется . Некоторые значения энергии решетки приведены в таблице 9..1 «Энергии решетки некоторых ионных соединений».
| Соединение | Энергия решетки (кДж/моль) |
|---|---|
| ЛиФ | 1036 |
| LiCl | 853 |
| NaCl | 786 |
| NaBr | 747 |
| мгф 2 | 2 957 |
| На 2 О | 2 481 |
| MgO | 3 791 |
Натрий — очень активный металл; при возможности он будет реагировать с потом на ваших руках и образовывать гидроксид натрия, который является очень едким веществом. Элемент хлора представляет собой бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитой природы. Однако соедините эти два опасных вещества, и они вступят в реакцию с образованием ионного соединения хлорида натрия, известного просто как соль. Натрий, хлор и хлорид натрия можно увидеть на рисунке 9..1 ниже.
Элемент хлора представляет собой бледно-желтый едкий газ, который нельзя вдыхать из-за его ядовитой природы. Однако соедините эти два опасных вещества, и они вступят в реакцию с образованием ионного соединения хлорида натрия, известного просто как соль. Натрий, хлор и хлорид натрия можно увидеть на рисунке 9..1 ниже.
Соль необходима для жизни. Ионы Na + являются одними из основных ионов в организме человека и необходимы для регулирования баланса жидкости в организме. Ионы Cl – необходимы для правильной работы нервной системы и дыхания. Оба этих иона поставляются солью. Вкус соли — один из основных вкусов; соль, вероятно, самый древний известный ароматизатор и один из немногих камней, которые мы едим.
Влияние слишком большого количества соли на здоровье все еще обсуждается, хотя в отчете Министерства сельского хозяйства США за 2010 г. сделан вывод о том, что «чрезмерное потребление натрия… повышает кровяное давление, общепризнанный и чрезвычайно распространенный фактор риска инсульта, ишемической болезни сердца». и болезни почек». [1] Очевидно, что большинство людей потребляют больше соли, чем требуется их организму, и большинство диетологов рекомендуют ограничивать потребление соли. Любопытно, что люди, которые страдают от пониженного содержания соли (называется гипонатрий ) делают это не потому, что потребляют слишком мало соли, а потому, что пьют слишком много воды. Спортсмены, занимающиеся выносливостью, и другие лица, занимающиеся длительными напряженными упражнениями, должны следить за потреблением воды, чтобы содержание соли в их организме не разбавлялось до опасного уровня.
сделан вывод о том, что «чрезмерное потребление натрия… повышает кровяное давление, общепризнанный и чрезвычайно распространенный фактор риска инсульта, ишемической болезни сердца». и болезни почек». [1] Очевидно, что большинство людей потребляют больше соли, чем требуется их организму, и большинство диетологов рекомендуют ограничивать потребление соли. Любопытно, что люди, которые страдают от пониженного содержания соли (называется гипонатрий ) делают это не потому, что потребляют слишком мало соли, а потому, что пьют слишком много воды. Спортсмены, занимающиеся выносливостью, и другие лица, занимающиеся длительными напряженными упражнениями, должны следить за потреблением воды, чтобы содержание соли в их организме не разбавлялось до опасного уровня.
- Тенденция к образованию видов, имеющих восемь электронов на валентной оболочке, называется правилом октета.
- Притяжение противоположно заряженных ионов, вызванное переносом электрона, называется ионной связью.

- Прочность ионной связи зависит от величины зарядов и размеров ионов.
- Комментарий о возможном образовании иона К 2+ . Почему его образование маловероятно?
- Комментарий о возможном образовании иона Cl 2− . Почему его образование маловероятно?
- Сколько электронов должен потерять атом Ва, чтобы в его валентной оболочке образовался полный октет?
- Сколько электронов должен потерять атом Pb, чтобы в его валентной оболочке образовался полный октет?
- Сколько электронов должен получить атом Se, чтобы иметь полный октет в своей валентной оболочке?
- Сколько электронов должен получить атом N, чтобы иметь полный октет в своей валентной оболочке?
- Стрелками показан перенос электронов с образованием хлорида калия от атомов К и атомов Cl.
- Стрелками показан перенос электронов с образованием сульфида магния от атомов Mg и атомов S.
- Стрелками показан перенос электронов с образованием фторида скандия из атомов Sc и атомов F.

- Стрелками показан перенос электронов с образованием фосфида рубидия от атомов Rb и атомов P.
- Какое ионное соединение имеет большую энергию решетки — KI или MgO? Почему?
- Какое ионное соединение имеет большую энергию решетки — KI или LiF? Почему?
- Какое ионное соединение имеет большую энергию решетки — BaS или MgO? Почему?
- Какое ионное соединение имеет большую энергию решетки — NaCl или NaI? Почему?
- Образование иона K 2+ маловероятно, поскольку K 9Ион 0044 + уже удовлетворяет правилу октетов и достаточно стабилен.
- два
- два
- MgO, потому что ионы имеют более высокий заряд.
- MgO, потому что ионы меньше.
Атрибуция СМИ
Рисунок 9.1
- «Кусочки металлического натрия в масле» Wilco Oelen © CC BY-SA (Attribution-ShareAlike)
- «Хлор в бутылке» Wilco Oelen © CC BY-SA (Attribution-ShareAlike)
- «Кристаллы соли» Марка Шеллхейза © CC BY-SA (Attribution-ShareAlike)
- Комитет Министерства сельского хозяйства США по политике и продвижению питания, «Отчет Консультативного комитета по диетическим рекомендациям по диетическим рекомендациям для американцев», по состоянию на 5 января 2010 г.



 Селен
Селен.png?1464966794) Гольмий
Гольмий Фермий
Фермий



 Поскольку эти электроны находятся ближе к ядру, они крепче удерживаются и не уйдут.
Поскольку эти электроны находятся ближе к ядру, они крепче удерживаются и не уйдут.
 Они образуют ионную связь и образуют ионное соединение NaCl.
Они образуют ионную связь и образуют ионное соединение NaCl.

 Вы можете помочь группам объединить свои структуры в классную модель кристалла хлорида натрия.
Вы можете помочь группам объединить свои структуры в классную модель кристалла хлорида натрия.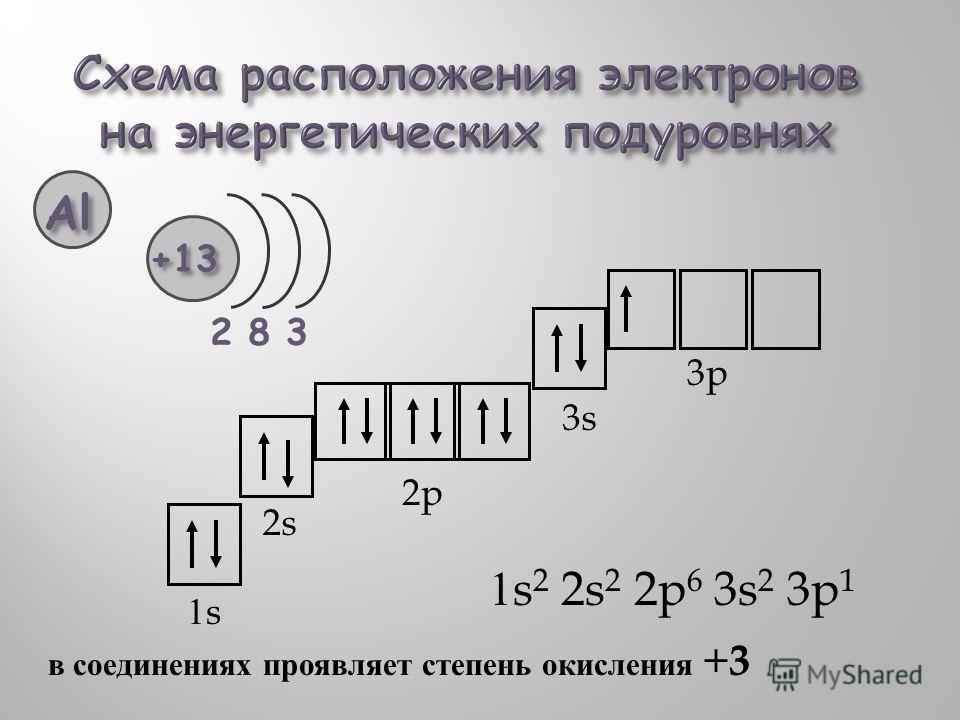 Вам нужно только поместить зубочистки в шарики в конце каждой линии.
Вам нужно только поместить зубочистки в шарики в конце каждой линии.