Строение атома
Строение атома
Оськин Виктор
Инженер-электрик
пенсионер
Чтобы понять из чего состоит атом необходимо вспомнить об открытиях, сделанных великими учёными прошлого века.
Н. Тесла считал, что «Материя – всего лишь сгущённый свет». Э. Ферми (1901—1954) наряду с другими физиками [1] высказал предположение, что электроны и нейтрино до своего вылета из радиоактивного ядра не существую в ядре, так сказать, в готовом виде, но образуются в процессе излучения. Подтверждением этому являются расчёты Э. Шрёдингера, согласно которым электроны в атомах являются волнами вероятности, плещущимися внутри атомов, а после излучения этих волн из атомов оставляют на регистрирующих экранах следы то пучков ЭМ волн, которые образовались из этих волн, то – как волны, не сформировавшиеся в пучки. .[2]
А. Эйнштейн в своих работах также показывал:[3] «Элементарные частицы — это сгущения электромагнитного поля», «То, что действует на наши чувства в виде вещества, есть на деле огромная концентрация энергии в сравнительно малом пространстве» ,1951 г.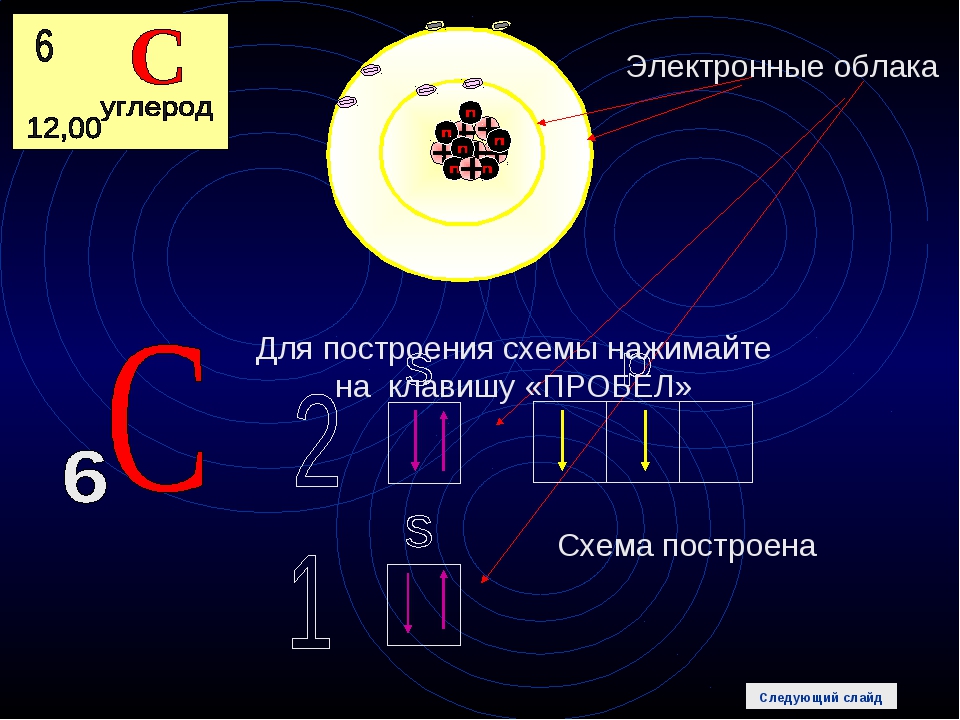 Основным элементом, или кирпичиком, реальности следует вместо массы считать поле… переход от массы к полю.
Основным элементом, или кирпичиком, реальности следует вместо массы считать поле… переход от массы к полю.
Исходя из приведённых высказываний – в атомах и клетках присутствует только поле, то есть энергия и никаких протонов и т.д. частиц нет. А носителем и источником энергии являются ЭМ волны. Хотя официальная наука до сих пор исходит из никем и ничем не доказанной гипотезы Н. Бора о строении атомов из электронов, протонов и нейтронов, а последние якобы в свою очередь состоят из более мелких частиц, последние из ещё более мелких и так до безконечности. То есть атомы – это склад «элементарных частиц», что просто абсурдно.
Исходя из того, что атомы состоят из ЭМ волн, которые двигаются самостоятельно и находиться в атомах могут только во вращательном виде. Но т. к. ЭМ волны состоят из электрической и магнитной энергии, то вращение магнитной составляющей энергии образует на концах оси вращения – ЭДС, а вращение электрической составляющей энергии образуют магнитную ось с магнитной оболочкой как границу атома. Таким образом, атомы – это маленький магнит и одновременно это маленькая батарейка. Подтверждением этому является то, что в твёрдых телах атомы притянуты друг к другу, т. к. у каждого атома есть свой атомный вес – а это и есть притяжение, гравитация.
Таким образом, атомы – это маленький магнит и одновременно это маленькая батарейка. Подтверждением этому является то, что в твёрдых телах атомы притянуты друг к другу, т. к. у каждого атома есть свой атомный вес – а это и есть притяжение, гравитация.
Согласно закону Ньютона – чем больше масса – тем больше гравитация. А любая масса состоит их атомов и клеток. А т.к. атомы – это маленькие магнитики, то огромное количество атомов в составе планет (и любого тела) составляет огромное магнитное поле, которое называется гравитационным. Отличие магнита от гравитации в том, что все атомы магнита направлены в одну сторону и их общее притяжение равно сумме магнитной энергии всех атомов на концах магнита. При этом их магнитная энергия замыкается вокруг магнита аналогично как вокруг атома.
А в случае гравитации – все атомы находятся в хаотическом состоянии и их магнитная энергия направлена вверх от тела.
Если поместить провод в магнитное поле – то все атомы выстроятся по силовой линии. Также их плюсы соединяются с минусами. В результате на концах провода образуется суммарная ЭДС всех атомов по длине.
Также их плюсы соединяются с минусами. В результате на концах провода образуется суммарная ЭДС всех атомов по длине.
Различные элементы таблицы Менделеева имеют разные спектры излучения. То есть состоят из ЭМ волн различной длины периода. Поэтому у каждого свои химические и механические свойства, свои атомные веса. Так в 1913 г. ученик Резерфорда английский ученый Мозли, исследуя спектры лучей Рентгена для различных элементов, установил простое соотношение между длиной волны рентгеновских лучей и порядковым номером элемента, а, следовательно, и с соответствующим атомным весом. Хотя в их формуле указана частота, которая обратно пропорциональна длине волны. А порядковый номер физически никак не относится к весу и массе атома. Поэтому следует вывод: атомный вес соответствует длине волны, из которой состоит атом. И чем длиннее волна, тем массивней атом. При этом чем больше атомный вес, тем меньший период распада данного элемента. Если же взять шаровые молнии, которые также состоят из энергии ЭМ волн, на которые они мгновенно распадаются при соприкосновении с материей, то шаровая молния – это огромный атом из ЭМ волн большой длины.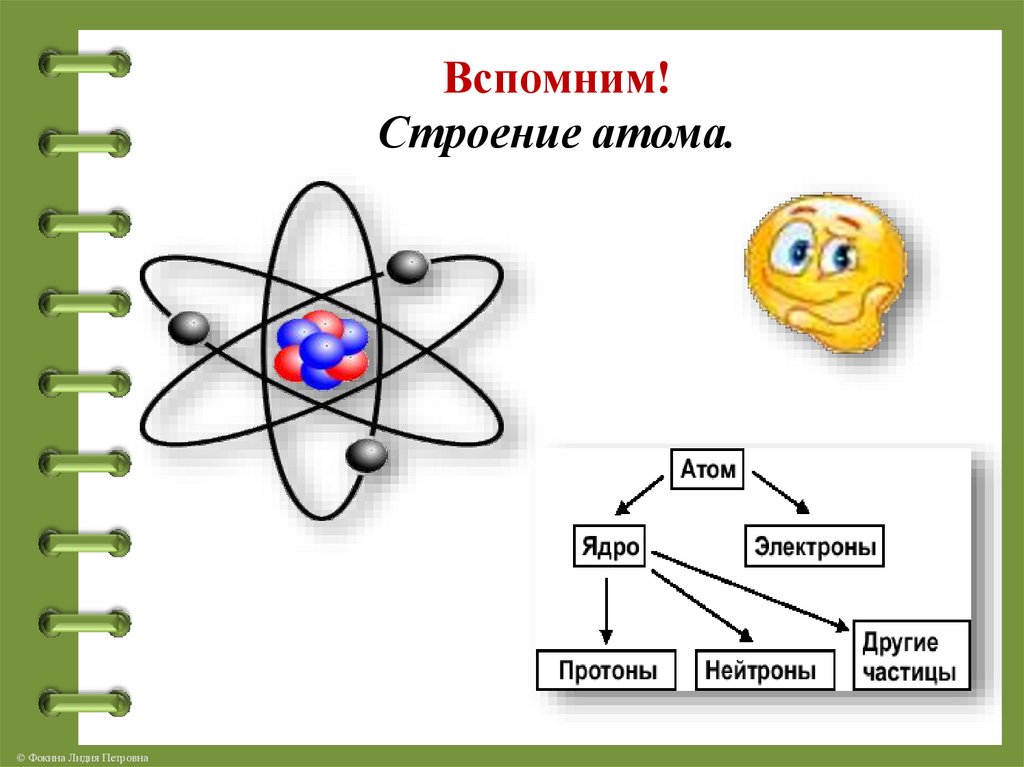
Список ссылок
[1] Ферми предположил https://helpiks.org/2-68310.html
http://www.bwbooks.net/index.php?id1=4&category=fizika&author=devis-p&book=1989&page=42
[2] http://elementy.ru/trefil/complementary_principle?context=20442&discuss=28&return=1 Природа науки/ Принцип дополнительности / Уравнение Шрёдингера 12.2016. С.1-2
[3] Альберт Эйнштейн Собрание научных трудов в 4 томах, Москва, 1965 — 1967г.
1920 г. «Элементарные частицы — это сгущения электромагнитного поля» том 1, стр. 689
1938 г. «То, что действует на наши чувства в виде вещества, есть на деле огромная концентрация энергии в сравнительно малом пространстве» Том 4, стр. 511. книга Эволюция физики.
1951 г. Основным элементом, или кирпичиком, реальности следует вместо массы считать поле… переход от массы к полю. Том 4, стр. 329
©Оськин В.В.
Строение электронных оболочек атомов » HimEge.ru
Атомы, первоначально считавшиеся неделимыми, представляют собой сложные системы.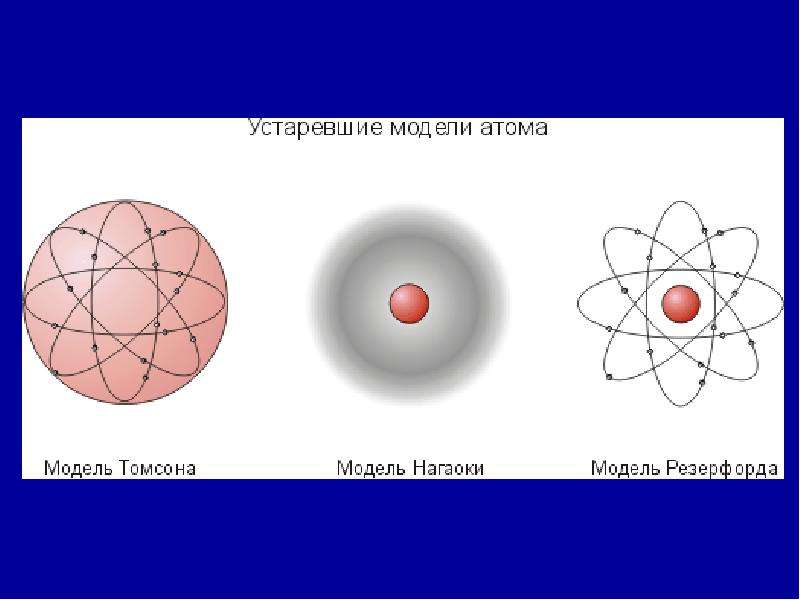
•Атом состоит из ядра и электронной оболочки
•Электронная оболочка – совокупность движущихся вокруг ядра электронов
•Ядра атомов заряжены положительно, они состоят из протонов (положительно заряженных частиц) p+ и нейтронов (не имеющих заряда) no
•Атом в целом электронейтрален, число электронов е– равно числу протонов p+, равно порядковому номеру элемента в таблице Менделеева.
На рисунке изображена планетарная модель атома, согласно которой электроны движутся по стационарным круговым орбитам. Она очень наглядна, но не отражает сути, т.к в действительности законы микромира подчиняются на классической механике, а квантовой, которая учитывает волновые свойства электрона.
Согласно квантовой механике электрон в атоме не движется по определенным траекториям, а может находиться в
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью (не путать с орбитой!) или электронным облаком.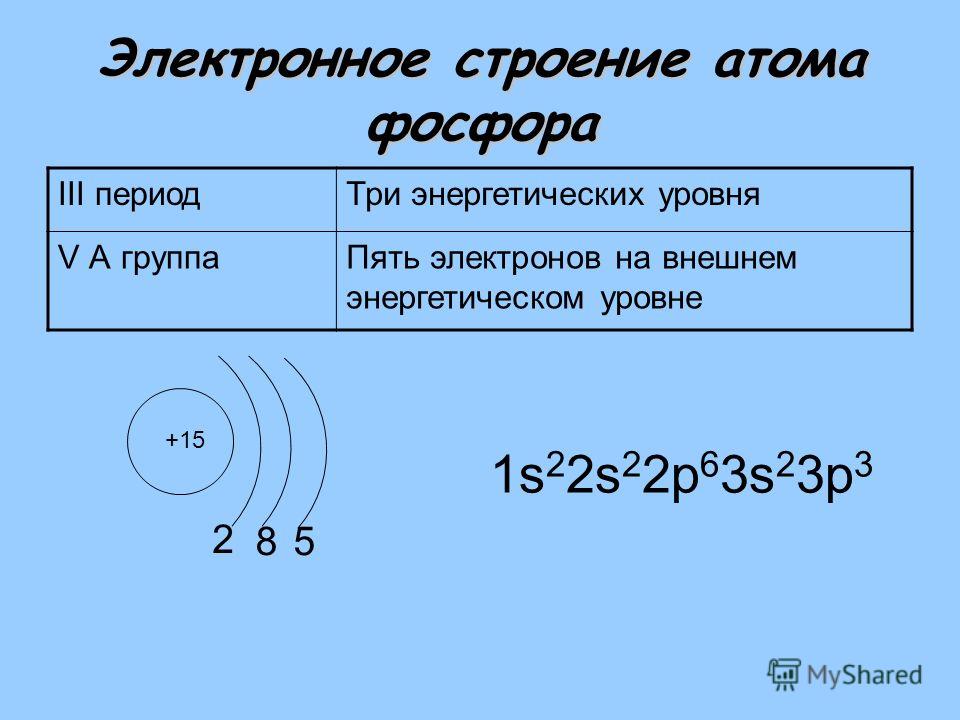
Т.е у электрона отсутствует понятие «траектория», электроны не движутся ни по круговым орбитам, ни по каким-либо другим. Самая большая сложность квантовой механики заключается в том, что это невозможно представить, мы все привыкли к явлениям макромира, подчиняющегося классической механике, где любая движущаяся частица имеет свою траекторию.
Итак, электрон имеет сложное движение, может находится в любом месте пространства около ядра, но с разной вероятностью. Давайте теперь рассмотрим те части пространства, где вероятность нахождения электрона достаточно высока — орбитали — их формы и последовательность заполнения орбиталей электронами.
Представим себе трехмерную систему координат, в центре которой находится ядро атома.
Вначале идет заполнение 1s орбитали, она располагается ближе всего к ядру и имеет форму сферы.
Обозначение любой орбитали складывается из цифры и латинской буквы. Цифра показывает уровень энергии, а буква — форму орбитали.
1s орбиталь имеет наименьшую энергию и электроны находящиеся на этой орбитали имеют наименьшую энергию.
На этой орбитали могут находиться не более двух электронов. Электроны атомов водорода и гелия (первых двух элементов) находятся именно на этой орбитали.
Электронная конфигурация водорода: 1s1
Электронная конфигурация гелия: 1s2
Верхний индекс показывает количество электронов на этой орбитали.
Следующий элемент — литий, у него 3 электрона, два из которых располагаются на 1s орбитали, а где же располагается третий электрон?
Он занимает следующую по энергии орбиталь — 2s орбиталь . Она также имеет форму сферы, но большего радиуса (1s орбиталь находится внутри 2s орбитали).
Электроны, находящиеся на этой орбитали имеют большую энергию, по сравнению с 1s орбиталью, т.к они расположены дальше от ядра. Максимум на этой орбитали может находится также 2 электрона.
Электронная конфигурация лития: 1s2 2s1
Электронная конфигурация бериллия: 1s2 2s2
У следующего элемента — бора — уже 5 электронов, и пятый электрон будет заполнять орбиталь, обладающую ещё большей энергией- 2р орбиталь.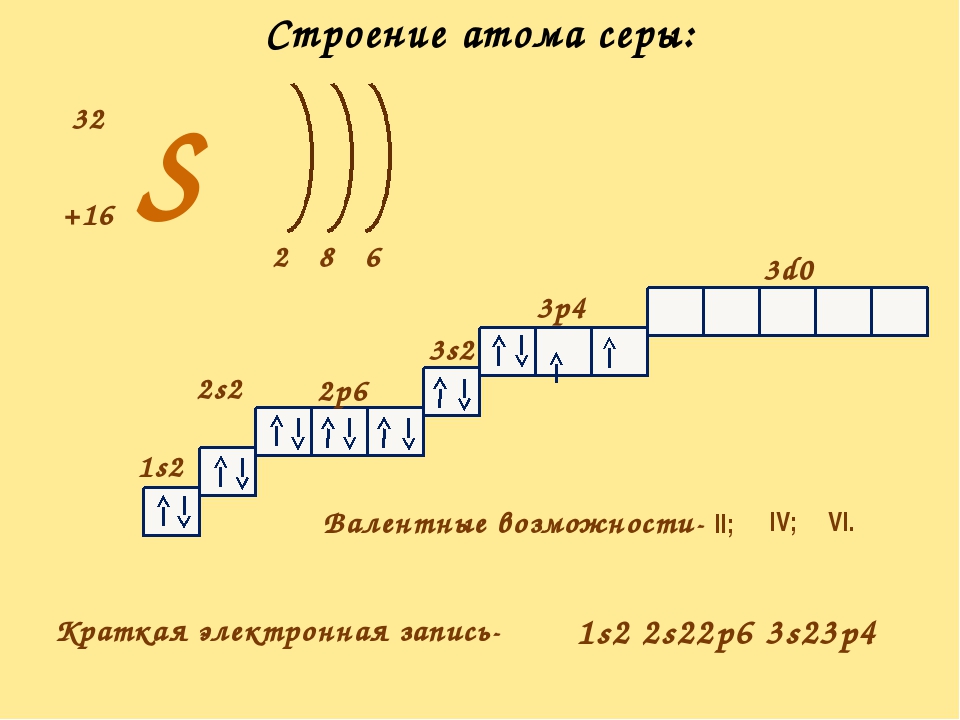
На каждой р-орбитали может находится не более двух электронов, таким образом на трех р-орбиталях — не более шести. Валентные электроны следующих шести элементов заполняют р-орбитали, поэтому их относят к р-элементам.
Электронная конфигурация атома бора: 1s2 2s2 2р1
Электронная конфигурация атома углерода: 1s2 2s2 2р2
Электронная конфигурация атома азота: 1s2 2s2 2р3
Электронная конфигурация атома кислорода: 1s2 2s2 2р4
Электронная конфигурация атома фтора: 1s
Электронная конфигурация атома неона: 1s2 2s2 2р6
Графически электронные формулы этих атомов изображены ниже:
Квадратик — это орбиталь или квантовая ячейка, стрелочкой обозначается электрон, направление стрелочки — это особая характеристика движения электрона — спин (упрощенно можно представить как вращение электрона вокруг своей оси по часовой и против часовой стрелки).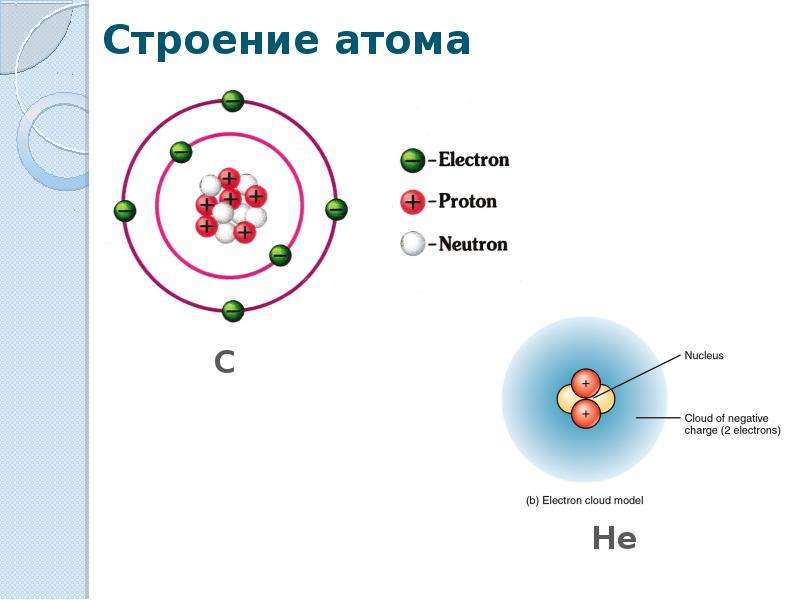 Нужно знать то, что на одной орбитали не может быть двух электронов с одинаковыми спинами (в одном квадратике нельзя рисовать две стрелочки в одном направлении!). Это и есть
Нужно знать то, что на одной орбитали не может быть двух электронов с одинаковыми спинами (в одном квадратике нельзя рисовать две стрелочки в одном направлении!). Это и есть
Существует ещё одно правило (правило Гунда), по которому электроны расселяются на одинаковых по энергии орбиталях сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами, такие электроны называют спаренными.
Атом неона имеет завершенный внешний уровень из восьми электронов (2 s-электрона+6 p-электронов =8 электронов на втором энергетическом уровне), такая конфигурация является энергетически выгодной, и её стремятся приобрести все другие атомы. Именно поэтому элементы 8 А группы — благородные газы — столь инертны в химическом отношении.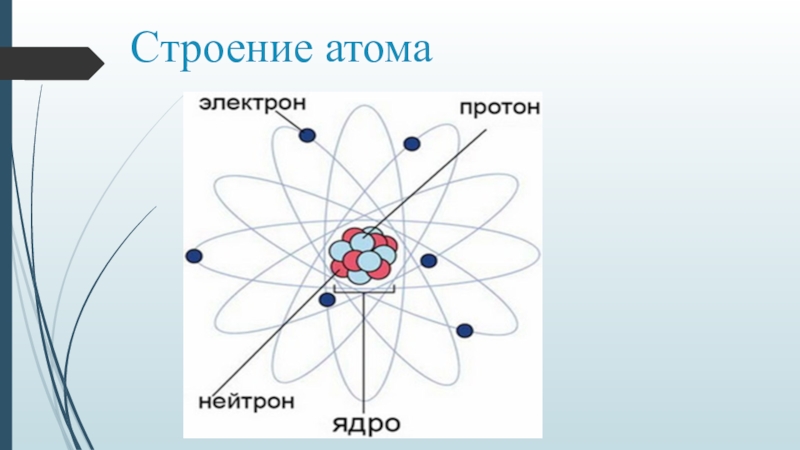
Следующий элемент — натрий, порядковый номер 11, первый элемент третьего периода, у него появляется ещё один энергетический уровень — третий. Одиннадцатый электрон будет заселять следующую по энергии орбиталь -3s орбиталь.
Электронная конфигурация атома натрия: 1s2 2s2 2р6 3s1
Далее происходит заполнение орбиталей элементов третьего периода, сначала заполняется 3s подуровень с двумя электронами, а потом 3р подуровень с шестью электронами (аналогично второму периоду) до благородного газа аргона, имеющего, подобно неону, завершенный восьмиэлектронный внешний уровень. Электронная конфигурация атома аргона (18 электронов): 1s
Четвертый период начинается с элемента калия (порядковый номер 19), последний внешний электрон которого располагается на 4s орбитали. Двадцатый электрон кальция также заполняет 4s орбиталь.
За кальцием идет ряд из 10 d-элементов, начиная со скандия (порядковый номер 21) и заканчивая цинком (порядковый номер 30).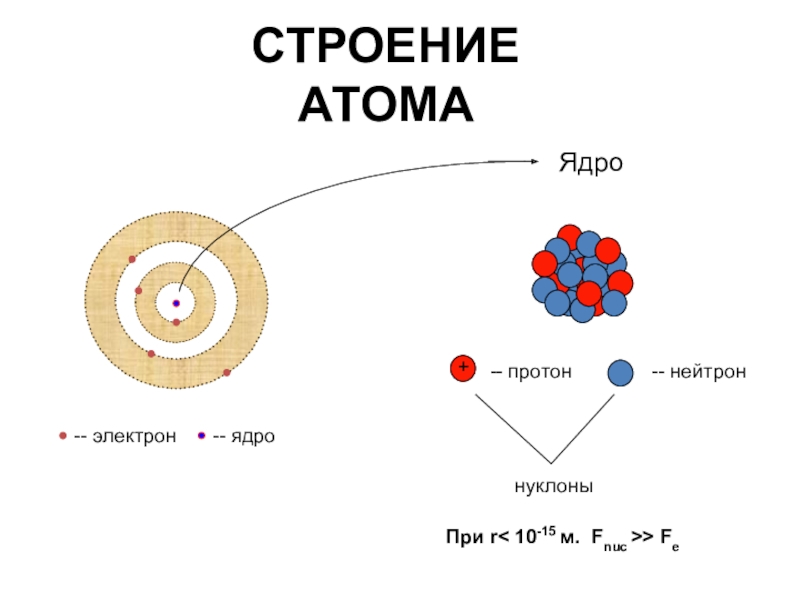
Далее идут шесть р-элементов (происходит заполнение 4р орбиталей). Заканчивается четвертый период инертным газом криптоном, электронная конфигурация которого 1s2 2s2 2р6 3s2 3p6 4s2 3d10 4р6
Итак, подведем итоги:
- Энергетические уровни соответствуют номеру периода. Энергетические уровни делятся на подуровни (первый уровень состоит из одного подуровня, второй уровень из двух подуровней, третий — из трех и т.д).
- s подуровень состоит из одной s орбитали, p подуровень — из трех р орбиталей, d подуровень из 5 d орбиталей.
- На каждой орбитали может находится не более двух электронов.
Смотрите также Атомная теория
и явление «проскока» электрона.
Можно ли сфотографировать строение атома? — Детский технопарк «Кванториум»
Чтобы понять, можно ли сфотографировать структуру атома, нужно выяснить, что этот самый атом из себя представляет.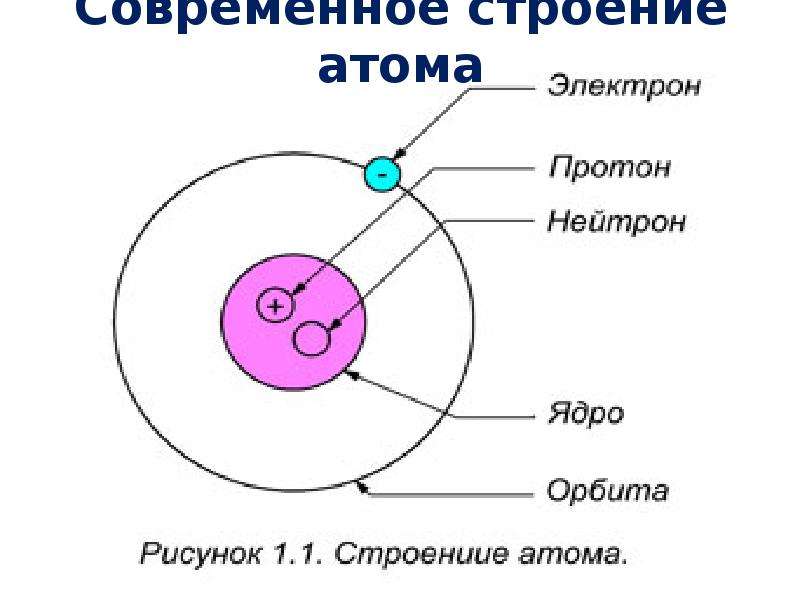 Каждый хотя бы раз видел картинку, которой обычно изображают строение атома.
Каждый хотя бы раз видел картинку, которой обычно изображают строение атома.
В его центре находится ядро (так называемый нуклон – протоны и нейтроны, соединенные сильным взаимодействием между собой), а вокруг ядра по орбиталям крутятся электроны. Но такая схема часто вводит в заблуждение: орбитали показаны на ней как тонкие линии, а электроны выступают в качестве частиц. Все это напоминает движение космических тел по орбитам. Но на самом деле, эта схема передает лишь общие черты строения атома.
Давайте представим, что мы смогли сфотографировать атом водорода, у которого есть только один электрон, в определенный момент времени.Желтая точка – это ядро, а синяя – электрон. Запомним его местоположение и сфотографируем атом в другой момент времени.
Электрон поменял свое местоположение, что логично. А что будет, если сделать несколько десятков таким снимков и наложить их друг на друга? Давайте посмотрим.
Ничего себе! Получается, электрон может находиться практически в любой точке атома? Верно, но если присмотреться, можно обнаружить, что вероятность его обнаружения в определенной окружности (выделена серым цветом) выше, чем в других местах. Именно эта область и называется «орбиталь», а вся область, в которой может находиться электрон, будет называться «электронным облаком».
Именно эта область и называется «орбиталь», а вся область, в которой может находиться электрон, будет называться «электронным облаком».
Вы сказали вероятность? Почему нельзя точно вычислить местоположение электрона в атоме? Здесь следует вспомнить, что электрон – это элементарная частица, и в определенной ситуации может вести себя как частица, а в другой ситуации – как волна. То есть его местоположение в атоме задается распределением вероятности.
Когда атом не подвергается воздействию, электрон ведет себя как волна, но достаточно лишь посмотреть на него, как он становится частицей и предстает перед нами в точке, в которой совсем не должен находиться. То есть, при любой попытке сфотографировать строение атома, вся система рушится, и мы не можем увидеть электрон в его действительном состоянии.
Получается, сфотографировать реальное состояние атома невозможно? Решение задачи существует и оно похоже на то, что мы делали выше на схеме. То есть фиксировали положение электрона вокруг ядра в различные моменты времени, а затем накладывали фотографии друг на друга. Получается, электрон как бы находится везде в электронном облаке, но в то же время его нет ни в какой определенной точке.
Получается, электрон как бы находится везде в электронном облаке, но в то же время его нет ни в какой определенной точке.
Конечно же, не существует такого фотоаппарата, который мог бы сфотографировать структуру атома в определенный момент времени, поэтому ученым и центра исследований элементарных частиц, пришлось действовать другими методами.
Чтобы упростить эксперимент, был выбран атом водорода, так как он содержит только один электрон. Далее атом поместили в герметичную камеру между двух лазеров, которые, ионизируя атом, заставляли электрон срываться с орбитали. Электромагнитное поле внутри камеры направляло электрон в сторону пластины-детектора, где он отмечался в виде точки. При этом его положение на пластине совпадает с тем положением, которое он занимал в атоме в момент обстрела. Повторив эксперимент около двух тысяч раз, физики получили картину, которую можно считать изображением структуры атома водорода. Чем краснее точка, тем больше вероятность нахождения в ней электрона.
Информация об элементе Neon Neon: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
История неона
Элемент Неон был обнаружен Моррисом Траверсом в году. 1898 г. в Соединенном Королевстве . Неон получил свое название от греческого neos, что означает «новый».
Неоновое присутствие: изобилие в природе и вокруг нас
В таблице ниже показано количество Неона во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура неона
Твердотельная структура Neon – это Face Centered Cubic.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в
три
пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки
края
Константы решетки (
| а | b | c |
|---|---|---|
| 442.9 | 442,9 | 442,9 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений (
x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства неона
Атомы неона имеют 10 электронов и структура электронной оболочки [2, 8] с символом атомного члена (квантовые числа) 1 S 0 .
Оболочечная структура неона – количество электронов на энергию уровень
Основное состояние Электронная конфигурация неона – нейтраль Неоновый атом
Электронная конфигурация нейтрального атома неона в основном состоянии
[Он] 2с2 2п6. Часть конфигурации Неона, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [He]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 2s2 2p6, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации Неона, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [He]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 2s2 2p6, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального Неона
Полная электронная конфигурация в основном состоянии для атома Неона, Полная электронная конфигурация
1с2 2с2 2п6
Атомная структура неона
Атомный радиус неона 38 пм, а его ковалентный радиус 69 пм.
Атомный спектр неона
Неоновые химические свойства: Энергии ионизации неона и сродство к электрону
Электронное сродство Неона составляет 0 кДж / моль.
Энергия ионизации неона
Энергия ионизации неона
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 2080.7 |
| 2 | 3952,3 |
| 3 | 6122 |
| 4 | 9371 |
| 5 | 12177 |
| 6 | 15238 |
| 7 | 19999 |
| 8 | 23069.5 |
| 9 | 115379,5 |
| 10 | 131432 |
Физические свойства неона
Физические свойства неона см. В таблице ниже
В таблице ниже
| Плотность | 0,9 г / л |
| Молярный объем | 22.4218888889 см3 |
Эластичные свойства
Твердость неона – Испытания для измерения твердости элемента
Неоновые электрические свойства
Неон – нет электричества. Ссылаться на стол ниже электрические свойства неона
Неоновые свойства теплопроводности и теплопроводности
Магнитные свойства неона
Оптические свойства неона
Акустические свойства неона
Тепловые свойства неона – энтальпии и термодинамика
Температурные свойства неона
см. В таблице ниже.
В таблице ниже.Энтальпии неона
Неоновые изотопы – ядерные свойства неона
Изотопы родия.Неон, встречающийся в природе, имеет 3 стабильный изотоп – 20Не, 21Нэ, 22Нэ.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 16Ne | ||||
| 17Ne | ||||
| 18Ne | ||||
| 19Ne | ||||
| 20Ne | 90. 48% 48% | Стабильный | Нет данных | |
| 21Ne | 0.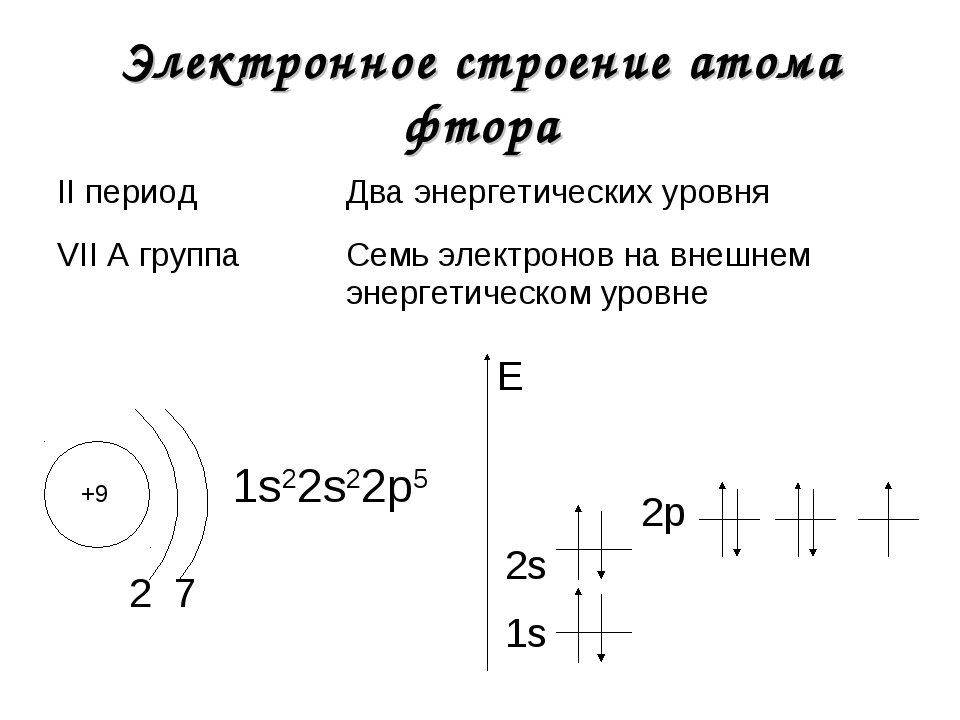 27% 27% | Стабильный | Нет данных | |
| 22Ne | 9.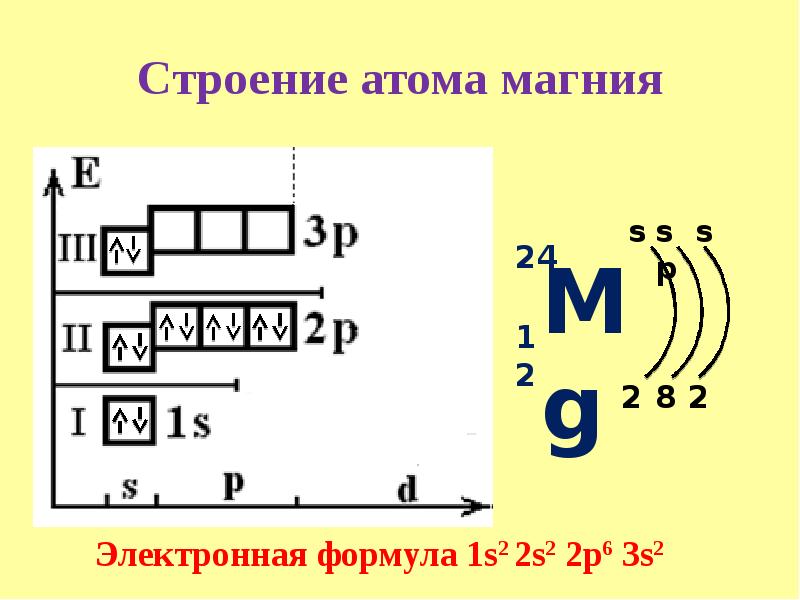 25% 25% | Стабильный | Нет данных | |
| 23Ne | ||||
| 24Ne | ||||
| 25Ne | ||||
| 26Ne | ||||
| 27Ne | ||||
| 28Ne | ||||
| 29Ne | ||||
| 30Ne | ||||
| 31Ne | ||||
| 32Ne | ||||
| 33Ne | ||||
| 34Не |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Нуклид, атомное число, массовое число
Атом – это наименьшая единица элемента, которая может существовать.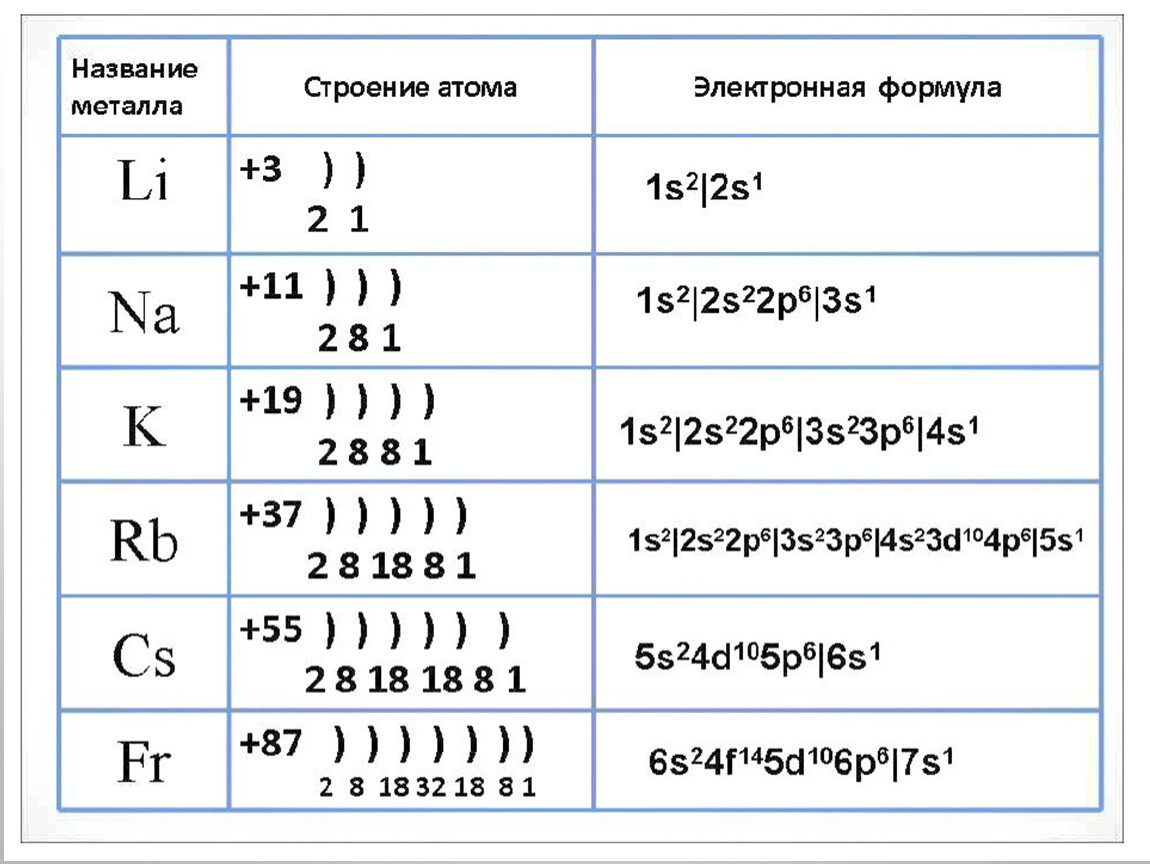 Каждый атом состоит из протонов, нейтронов и электронов. Эти частицы определяют нуклид и его химические свойства и были открыты в начале 20 -х годов века и описаны современной атомной теорией.
Каждый атом состоит из протонов, нейтронов и электронов. Эти частицы определяют нуклид и его химические свойства и были открыты в начале 20 -х годов века и описаны современной атомной теорией.
Нуклид
Нуклиды – это особые типы атомов или ядер. Каждый нуклид имеет символ химического элемента (E), а также атомный номер (Z), количество протонов в ядре и массовое число (A), общее количество протонов и нейтронов в ядре.{20} _ {10} Ne \]
Нуклид имеет измеримое количество энергии и существует измеримое количество времени. Стабильные нуклиды могут существовать в одном и том же состоянии неограниченное время, но нестабильные нуклиды радиоактивны и со временем распадаются. Некоторые нестабильные нуклиды встречаются в природе, но другие синтезируются искусственно посредством ядерных реакций. Они излучают энергию (\ (\ alpha \), \ (\ beta \) или \ (\ gamma \) излучения), пока не достигнут стабильности.
Атомный номер
Каждый элемент имеет определяющий атомный номер с символом «Z». Если атом заряжен нейтрально, в нем столько же протонов и электронов. Если он заряжен, протонов может быть больше, чем электронов, или наоборот, но атомный номер остается прежним. В символе элемента заряд идет с правой стороны элемента. Например, O 2- представляет собой анион кислорода. O 2- по-прежнему имеет атомный номер 8, соответствующий 8 протонам, но имеет 10 электронов. Каждый элемент имеет свой атомный номер от 1 до 100.В периодической таблице элементы расположены в порядке атомных номеров через период. Атомный номер обычно располагается над символом элемента. Например, водород состоит из одного протона и одного электрона, поэтому его атомный номер равен 1. Атомный номер меди равен 29 для 29 протонов.
Если атом заряжен нейтрально, в нем столько же протонов и электронов. Если он заряжен, протонов может быть больше, чем электронов, или наоборот, но атомный номер остается прежним. В символе элемента заряд идет с правой стороны элемента. Например, O 2- представляет собой анион кислорода. O 2- по-прежнему имеет атомный номер 8, соответствующий 8 протонам, но имеет 10 электронов. Каждый элемент имеет свой атомный номер от 1 до 100.В периодической таблице элементы расположены в порядке атомных номеров через период. Атомный номер обычно располагается над символом элемента. Например, водород состоит из одного протона и одного электрона, поэтому его атомный номер равен 1. Атомный номер меди равен 29 для 29 протонов.
| Атомный номер | 3 | 4 | 5 |
| Обозначение элемента | B | С | N |
Средняя атомная масса изотопов всех элементов | 10.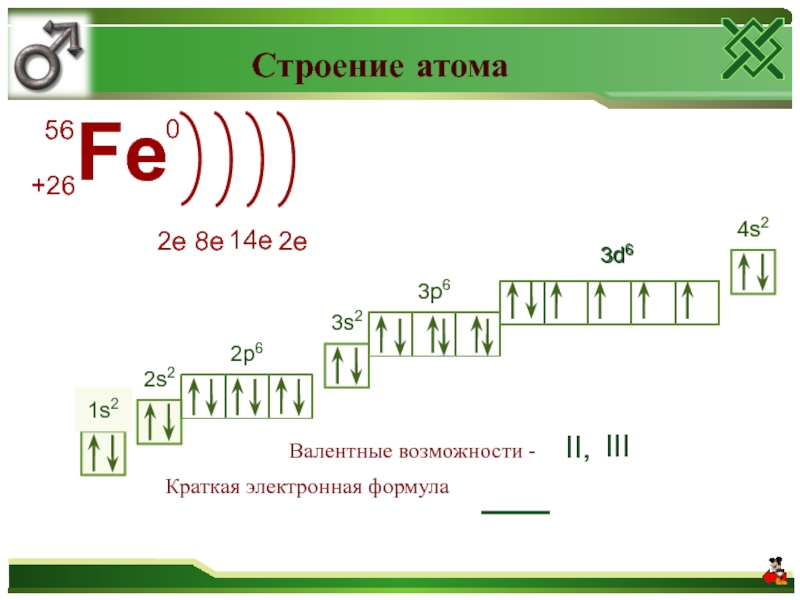 811 811 | 12.011 | 14.007 |
Атомный номер и химические свойства
Атомный номер определяет химические свойства элемента. Количество электронов в атоме определяет связь и другие химические свойства. В нейтральном атоме атомный номер Z также является числом электронов. Эти электроны находятся в облаке, окружающем ядро, вероятно, в электронных оболочках или орбиталях.Самая удаленная от ядра оболочка – это валентная оболочка. Электроны в этой валентной оболочке участвуют в химической связи и показывают поведение атома. Связующие электроны влияют на геометрию молекулы и структуру атома. Они взаимодействуют друг с другом и с другими атомами в химических реакциях. Атомный номер уникален для каждого атома и определяет его характеристики связи, поведения или реакционной способности. Следовательно, каждый атом с разным атомным номером действует по-разному.+ + п \]
Элементы также могут иметь изотопы с одинаковым атомным номером, но разным числом нейтронов. Может быть на несколько больше или на несколько меньше нейтронов, и поэтому масса будет увеличиваться или уменьшаться. В периодической таблице массовое число обычно располагается под символом элемента. Указанное массовое число представляет собой среднюю массу всех изотопов элемента. Каждый изотоп имеет определенное процентное содержание в природе, которое складывается и усредняется для получения среднего массового числа.
Может быть на несколько больше или на несколько меньше нейтронов, и поэтому масса будет увеличиваться или уменьшаться. В периодической таблице массовое число обычно располагается под символом элемента. Указанное массовое число представляет собой среднюю массу всех изотопов элемента. Каждый изотоп имеет определенное процентное содержание в природе, которое складывается и усредняется для получения среднего массового числа.
Например, 4 Он имеет массовое число 4. Его атомный номер равен 2, что не всегда включается в обозначения, поскольку Он определяется атомным номером 2.
Список литературы
- Петруччи, Ральф. Общая химия: принципы и современные приложения . Нью-Джерси. Пирсон Прентис Холл, 2006.
- Housecraft, Кэтрин Э. и Алан Г. Шарп. Неорганическая химия . Третье изд.
- ИЮПАК. Сборник химической терминологии, 2-е изд.(«Золотая книга»). Составлено А. Д. Макнотом и А. Уилкинсоном. Научные публикации Блэквелла, Оксфорд (1997).
 Онлайновая исправленная версия XML: goldbook.iupac.org (2006-), созданная М. Ником, Дж. Джиратом, Б. Косатой; обновления составлены А. Дженкинсом. ISBN 0-9678550-9-8. DOI: 10.1351 / goldbook.
Онлайновая исправленная версия XML: goldbook.iupac.org (2006-), созданная М. Ником, Дж. Джиратом, Б. Косатой; обновления составлены А. Дженкинсом. ISBN 0-9678550-9-8. DOI: 10.1351 / goldbook. - science.uwaterloo.ca/~cchieh/…k/nuclide.html
Проблемы
- Сколько протонов, нейтронов и электронов есть в атомах хлора?
- Масса золота (Au) 197, сколько в нем нейтронов?
- Углерод имеет несколько изотопов. 14 C сколько протонов, электронов и нейтронов?
- Какой атомный номер у Li + ? Сколько протонов и электронов у Li + ?
- Что означает массовое число в периодической таблице?
Ответы
- Поскольку хлор имеет атомный номер 17, у хлора 17 протонов, 18 нейтронов и 17 электронов
- 118 нейтронов
- 6 протонов, 8 нейтронов и 6 электронов
- Z = 3, 3 протона, 2 электрона
- Массовое число представляет собой среднюю массу всех изотопов этого конкретного элемента.

Структура и периодичность атома

 Конфигурации благородных газов очень стабильны.
Конфигурации благородных газов очень стабильны. г .:
г .:

WebElements Periodic Table »Neon» Свойства свободных атомов
Атомы неона имеют 10 электронов, а структура оболочки – 2.8.
Электронная конфигурация основного состояния газообразного нейтрального неона в основном состоянии – это [ He ]. 2с 2 . 2p 6 , а символ термина – 1 S 0 .
Атомный спектр
Изображение атомного спектра неона.
Энергии ионизации и сродство к электрону
Электронное сродство неона 0 кДж моль -1 .Энергии ионизации неона приведены ниже.
| Число энергии ионизации | Энтальпия / кДж моль ‑1 |
|---|---|
| 1-й | 2080,66 |
| 2-й | 3952,32 |
| 3-й | 6119,42 |
| 4-й | 9377,41 |
| 5-й | 12181.0 |
| 7-й | 19998,6 |
| 8-й | 23069,3 |
| 9-й | 115378 |
| 10-й | 131432 |
Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
| 1с | 9.6421 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 5,76 | 2 пол | 5,76 | ||||
| 3с | (нет данных) | 3п | (нет данных) | 3d | (нет данных) | ||
| 4s | (нет данных) | 4p | (нет данных) | 4d | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5p | (нет данных) | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.
 Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686. - Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 870,2 [2] |
| L I | 2s | 48,5 [2] |
| L II | 2p 1/2 | 21,7 [2] |
| L III | 2p 3/2 | 21,6 [2] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- Д.Р. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Ионы | |
| Протоны и электроны | На каждый протон в атомном центре, где-то на орбитали, будет электрон. Протон несет положительный заряд (+), а электрон несет отрицательный заряд (-), поэтому атомы элементов нейтральны, все положительные заряды нейтрализуют все отрицательные заряды. Протон несет положительный заряд (+), а электрон несет отрицательный заряд (-), поэтому атомы элементов нейтральны, все положительные заряды нейтрализуют все отрицательные заряды. Атомы отличаются друг от друга количеством содержащихся в них протонов, нейтронов и электронов. Однако их расположение всегда следует одним и тем же принципам. |
| Вопрос стабильности | Водород и гелий иллюстрируют тот факт, что не все атомы обладают одинаковыми свойствами.Оба являются газами, но газообразный водород очень взрывоопасен, тогда как газообразный гелий полностью инертен и не может вступать в какие-либо химические реакции при нормальных обстоятельствах. Атомы водорода имеют один протон в центре и один электрон на самом низком энергетическом уровне. Атомы гелия, с другой стороны, имеют два протона и два электрона на самом низком энергетическом уровне. Самый низкий энергетический уровень заполнен максимальным количеством электронов. Водород имеет только один электрон на самом низком уровне энергии. Это очень нестабильная структура, и газообразный водород претерпевает множество реакций, чтобы достичь стабильной электронной конфигурации, в которой его энергетический уровень либо пуст от электронов, либо заполнен электронами. Атомы наиболее стабильны, когда их внешний энергетический уровень либо пуст от электронов, либо заполнен электронами. |
| Ионы | Атомы натрия имеют 11 электронов.Два из них находятся на самом низком энергетическом уровне, восемь – на втором энергетическом уровне, а затем один электрон – на третьем энергетическом уровне. Это очень нестабильное устройство, и элемент натрия представляет собой смертоносное белое полутвердое вещество с высокой реакционной способностью, которое воспламеняется при контакте с воздухом или прожигает человеческую плоть при контакте.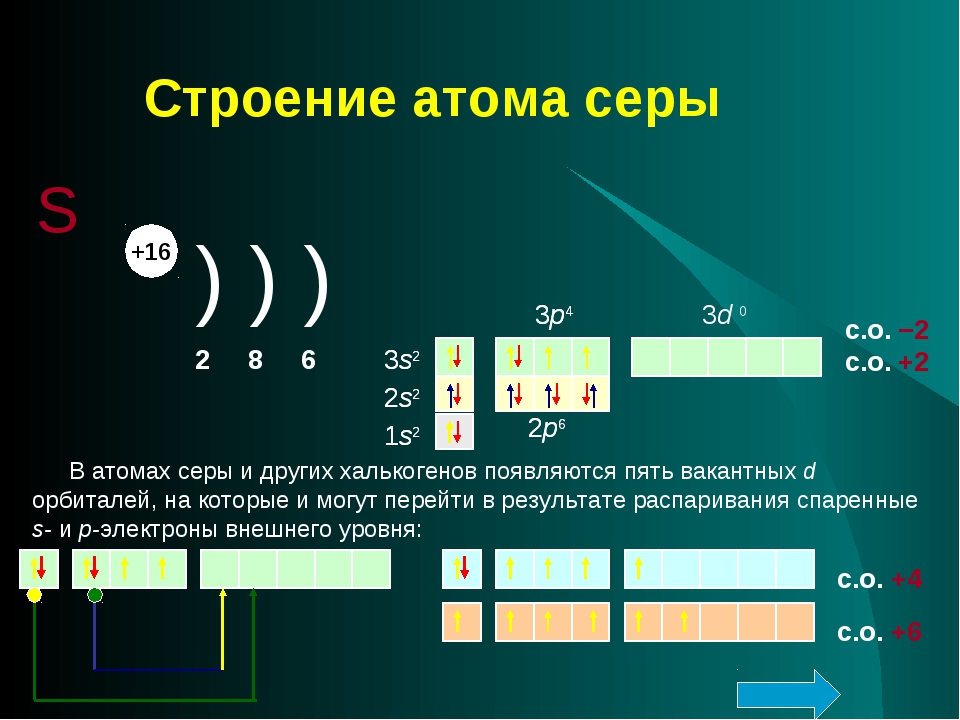 Реактивное вещество. Реактивное вещество.Атомы хлора имеют 17 электронов. Два на низшем уровне, восемь на втором и 7 на третьем энергетическом уровне. Это тоже очень нестабильное устройство.Этот элемент представляет собой газ при комнатной температуре и использовался во время Первой мировой войны в качестве ядовитого атакующего оружия из-за его высокой реактивности с человеческими легкими. Эти два атома созданы друг для друга. Атомы натрия легко отдают единственный электрон на самой внешней орбитали. Этот электрон немедленно улавливается атомом хлора и помещается в последнее пустое пространство на своей внешней орбитали. Теперь оба атомных устройства намного стабильнее. У них обоих есть крайние орбитали, заполненные электронами. Однако за эту стабильность приходится платить. Отказавшись от электрона, атом натрия потерял отрицательный электрический заряд. В нем все еще есть все положительно заряженные протоны, поэтому оставшаяся структура больше не является электрически нейтральной. |
| Ионные связи | Ионные связи – это тип связи, образованный притяжением между противоположно заряженными ионами. Такие связи образуются, когда внешние электроны одного атома (например, натрия) постоянно переносятся на другой атом (например, хлор). Атом, потерявший электрон, становится положительно заряженным ионом (называемым катионом ), а атом, который улавливает лишний электрон, становится отрицательно заряженным ионом (называемым анионом ). Противоположные заряды притягиваются друг к другу, в то время как одинаковые заряды отталкиваются. Итак, ионы ориентируются таким образом, что каждый положительный ион оказывается окруженным отрицательными ионами, а каждый отрицательный ион становится окруженным положительными ионами. 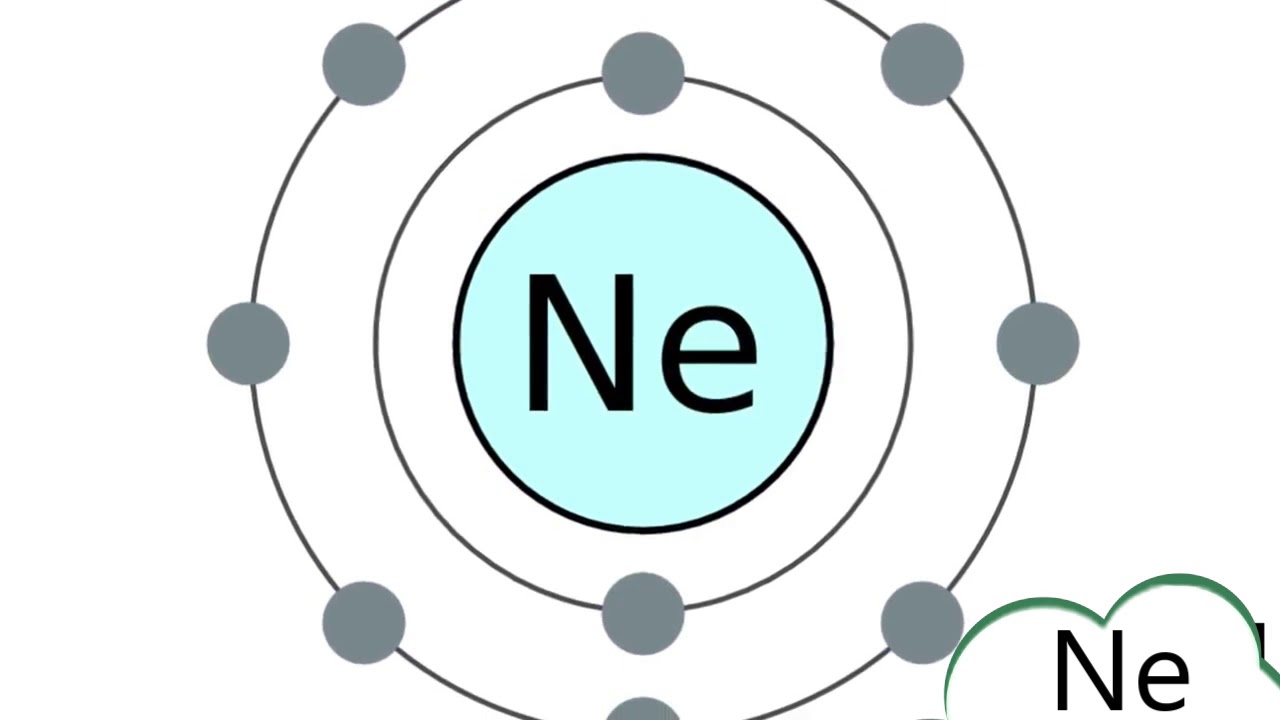 Ионы располагаются так, что положительные и отрицательные заряды чередуются и уравновешивают друг друга. Ионы располагаются так, что положительные и отрицательные заряды чередуются и уравновешивают друг друга.Хлорид натрия – это твердая пищевая добавка, более стабильная, чем любая из составляющих ее частей, все потому, что внешние энергетические уровни его атомов заполнены электронами. |
| … теперь вы исследуете ionss для себя. | |
Квантовые числа
Квантовые числа и электрон Конфигурации
Квантовые числа
Модель Бора была одномерной моделью, которая использовала одно квантовое число для описания распределение электронов в атоме.Единственная важная информация – размер . орбиты, которая описывалась квантовым числом n . Модель Шренгера позволил электрону занять трехмерное пространство. Следовательно, потребовалось три координаты, или три квантовых числа , чтобы описать орбитали, на которых электроны можно найти.
Три координаты, которые происходят из волновых уравнений Шренгера, являются главными ( n ), угловые ( l ) и магнитные ( m ) квантовые числа.Эти квантовые числа описывают размер, форму и ориентацию в пространстве орбиталей атома.
Главное квантовое число ( n ) описывает размер орбитали. Например, орбитали, для которых n = 2, больше, чем те, для которых n = 1.
Поскольку они имеют противоположные электрические заряды, электроны притягиваются к ядру
атом. Следовательно, энергия должна быть поглощена, чтобы возбудить электрон с орбитали, на которой
электрон приближается к ядру ( n = 1) на орбиталь, в которой он находится дальше
из ядра ( n = 2).Таким образом, главное квантовое число косвенно
описывает энергию орбитали.
Например, орбитали, для которых n = 2, больше, чем те, для которых n = 1.
Поскольку они имеют противоположные электрические заряды, электроны притягиваются к ядру
атом. Следовательно, энергия должна быть поглощена, чтобы возбудить электрон с орбитали, на которой
электрон приближается к ядру ( n = 1) на орбиталь, в которой он находится дальше
из ядра ( n = 2).Таким образом, главное квантовое число косвенно
описывает энергию орбитали.
Угловое квантовое число ( l ) описывает форму орбитали. Орбитали имеют форму, которую лучше всего описать как сферическую ( l = 0), полярную ( l = 0). = 1) или клеверный лист ( l = 2). Они могут даже принимать более сложные формы, поскольку углового квантового числа становится больше.
Существует только один способ ориентирования сферы ( l = 0) в пространстве.Однако орбитали полярной ( l = 1) или клеверной ( l = 2) формы могут
указывают в разные стороны. Поэтому нам нужно третье квантовое число, известное как магнитное число .
квантовое число ( м ), чтобы описать ориентацию в пространстве определенного
орбитальный. (Его называют магнитным квантовым числом из-за влияния различных
ориентации орбиталей впервые наблюдались в присутствии магнитного поля.)
Поэтому нам нужно третье квантовое число, известное как магнитное число .
квантовое число ( м ), чтобы описать ориентацию в пространстве определенного
орбитальный. (Его называют магнитным квантовым числом из-за влияния различных
ориентации орбиталей впервые наблюдались в присутствии магнитного поля.)
Правила, регулирующие разрешенные комбинации Квантовые числа
- Три квантовых числа ( n , l и m ), которые описывают орбитальный являются целыми числами: 0, 1, 2, 3 и т. д.
- Главное квантовое число ( n ) не может быть нулевым. Допустимые значения n поэтому равны 1, 2, 3, 4 и т. д.
- Угловое квантовое число ( l ) может быть любым целым числом от 0 до n – 1.Если n = 3, например, l может быть 0, 1 или 2.
- Магнитное квантовое число ( м ) может быть любым целым числом от – до .
 и + l . Если l = 2, m может иметь значение -2, -1, 0, +1 или +2.
и + l . Если l = 2, m может иметь значение -2, -1, 0, +1 или +2.
Оболочки и подоболочки орбиталей
Орбитали с одинаковым значением главного квантового числа образуют оболочку .Орбитали внутри оболочки делятся на подоболочки , которые имеют одинаковое значение угловое квантовое число. Химики описывают оболочку и подоболочку, в которых орбитальный принадлежит с двухсимвольным кодом, например 2 p или 4 f . Первый персонаж обозначает оболочку ( n = 2 или n = 4). Второй символ обозначает подоболочка. По соглашению следующие строчные буквы используются для обозначения различных подоболочки.
| с : | л = 0 | |
| p : | л = 1 | |
| d : | л = 2 | |
| f : | л = 3 |
Хотя в первых четырех буквах нет шаблона ( s , p , d , f ),
буквы продвигаются в алфавитном порядке с этой точки ( g , h и т. д.).Некоторые
разрешенных комбинаций квантовых чисел n и l показаны в
рисунок ниже.
д.).Некоторые
разрешенных комбинаций квантовых чисел n и l показаны в
рисунок ниже.
Третье правило, ограничивающее допустимые комбинации n , l и m квантовые числа имеют важное следствие. Он заставляет количество подоболочек в оболочке быть равным главному квантовому числу оболочки. Оболочка n = 3, для Например, содержит три подоболочки: 3 s , 3 p и 3 d орбитали.
Возможные комбинации квантовых чисел
В оболочке n = 1 только одна орбиталь, потому что в ней есть только один путь. который сфера может быть ориентирована в пространстве. Единственная допустимая комбинация квантовых чисел для которого n = 1 следующее.
В оболочке n = 2 четыре орбитали.
| 2 | 1 | -1 | ||||
| 2 | 1 | 0 | 2п | |||
| 2 | 1 | 1 |
В подоболочке 2 s только одна орбиталь. Но есть три орбитали в
подоболочка 2 p , потому что существует три направления, в которых орбитальная оболочка p может
точка. Одна из этих орбиталей ориентирована по оси X , другая – по оси Y .
ось, а третья – по оси Z системы координат, как показано на рисунке
ниже. Следовательно, эти орбитали известны как 2 p x , 2 p y ,
и 2 p z орбитали.
Но есть три орбитали в
подоболочка 2 p , потому что существует три направления, в которых орбитальная оболочка p может
точка. Одна из этих орбиталей ориентирована по оси X , другая – по оси Y .
ось, а третья – по оси Z системы координат, как показано на рисунке
ниже. Следовательно, эти орбитали известны как 2 p x , 2 p y ,
и 2 p z орбитали.
В оболочке n = 3 девять орбиталей.
| № | л | м | ||||
| 3 | 0 | 0 | 3 с | |||
| 3 | 1 | -1 | ||||
| 3 | 1 | 0 | 3 п | |||
| 3 | 1 | 1 | ||||
| 3 | 2 | -2 | ||||
| 3 | 2 | -1 | 3 д | |||
| 3 | 2 | 0 | ||||
| 3 | 2 | 1 | ||||
| 3 | 2 | 2 |
Имеется одна орбиталь в подоболочке 3 s и три орбитали в подоболочке 3 p подоболочка. Однако оболочка n = 3 также включает 3 орбитали d .
Однако оболочка n = 3 также включает 3 орбитали d .
Пять различных ориентаций орбиталей в подоболочке 3 d показаны на рисунок ниже. Одна из этих орбиталей лежит в плоскости XY самолета XYZ системы координат и называется орбитальной 3 d xy . The 3 d xz и 3 d yz орбитали имеют одинаковую форму, но лежат между осями система координат в плоскостях XZ и YZ .Четвертая орбиталь в этом подоболочка расположена вдоль осей X и Y и называется 3 d x 2 – y 2 орбитальный. Большая часть пространства, занимаемого пятой орбиталью, лежит вдоль оси Z и эта орбиталь называется орбиталью 3 d z 2 .
Число орбиталей в оболочке – это квадрат главного квантового числа: 1 2 = 1, 2 2 = 4, 3 2 = 9. В подоболочке s ( l = 0), три орбитали в подоболочке p ( l = 1) и пять орбиталей в подоболочке d подоболочка ( л, = 2). Таким образом, количество орбиталей в подоболочке равно 2 ( l ) +
1.
В подоболочке s ( l = 0), три орбитали в подоболочке p ( l = 1) и пять орбиталей в подоболочке d подоболочка ( л, = 2). Таким образом, количество орбиталей в подоболочке равно 2 ( l ) +
1.
Прежде чем мы сможем использовать эти орбитали, нам нужно знать количество электронов, которые могут занимают орбитали и как их можно отличить друг от друга. Экспериментальный данные свидетельствуют о том, что орбиталь может содержать не более двух электронов.
Чтобы различать два электрона на орбитали, нам нужен четвертый квант
количество. Это называется спиновым квантовым числом ( s ), потому что электроны ведут себя
как если бы они вращались либо по часовой стрелке, либо против часовой стрелки. Один из
электронам на орбитали произвольно назначается s квантовое число +1/2,
другому присваивается квантовое число s -1/2. Таким образом, требуется три квантовых числа
чтобы определить орбитальное, но четыре квантовых числа, чтобы идентифицировать один из электронов, который может
занимают орбиталь.
Допустимые комбинации квантовых чисел n , l и m для Первые четыре оболочки приведены в таблице ниже. Для каждой из этих орбиталей есть два допустимые значения спинового квантового числа, с .
Сводка разрешенных комбинаций Quantum Номера
| № | л | м | Обозначение подоболочки | Число орбиталей в подоболочке | Число электронов, необходимых для заполнения подоболочки | Общее количество электронов в подоболочке | |||||
| 1 | 0 | 0 | 1 с | 1 | 2 | 2 | |||||
| 2 | 0 | 0 | 2с | 1 | 2 | ||||||
| 2 | 1 | 1,0, -1 | 2п | 3 | 6 | 8 | |||||
| 3 | 0 | 0 | 3с | 1 | 2 | ||||||
| 3 | 1 | 1,0, -1 | 3 пол. | 3 | 6 | ||||||
| 3 | 2 | 2,1,0, -1, -2 | 3д | 5 | 10 | 18 | |||||
| 4 | 0 | 0 | 4с | 1 | 2 | ||||||
| 4 | 1 | 1,0, -1 | 4 пол. | 3 | 6 | ||||||
| 4 | 2 | 2,1,0, -1, -2 | 4д | 5 | 10 | ||||||
| 4 | 3 | 3,2,1,0, -1, -2, -3 | 4f | 7 | 14 | 32 | |||||
Относительные энергии атомных орбиталей
Из-за силы притяжения между объектами противоположного заряда наибольшая
важным фактором, влияющим на энергию орбитали, является ее размер и, следовательно, значение
главного квантового числа n . Для атома, содержащего только один электрон,
нет разницы между энергиями различных подоболочек внутри оболочки. В
3 s , 3 p и 3 d орбитали, например, имеют одинаковую энергию в
атом водорода. Модель Бора, которая определяла энергии орбит в терминах ничего
больше, чем расстояние между электроном и ядром, поэтому работает для этого
атом.
Для атома, содержащего только один электрон,
нет разницы между энергиями различных подоболочек внутри оболочки. В
3 s , 3 p и 3 d орбитали, например, имеют одинаковую энергию в
атом водорода. Модель Бора, которая определяла энергии орбит в терминах ничего
больше, чем расстояние между электроном и ядром, поэтому работает для этого
атом.
Однако атом водорода необычен.Как только атом содержит более одного электрона разные подоболочки больше не имеют одинаковой энергии. В данной оболочке орбитали s всегда имеют самую низкую энергию. Энергия подоболочек постепенно становится больше по мере увеличения значения углового квантового числа.
Относительные энергии: с < p < d < f
В результате два фактора управляют энергией орбиты для большинства
атомы: размер орбитали и ее форма, как показано на рисунке ниже.
Можно сконструировать очень простое устройство для оценки относительной энергии атомных орбиталей. Допустимые комбинации n и l квант числа организованы в таблицу, как показано на рисунке ниже, а стрелки нарисованы на 45 углы градусов, указывающие на нижний левый угол таблицы.
Затем считывают порядок увеличения энергии орбиталей, следуя этим стрелки, начиная с верхней части первой строки и затем переходя ко второй, третьей, четвертые строки и так далее.Эта диаграмма предсказывает следующий порядок увеличения энергии для атомных орбиталей.
1 с <2 с <2 p <3 с <3 p <4 с <3 d <4 p <5 с <4 d <5 p <6 с <4 с <5 с <6 с <7 с <5 с <6 d <7 p <8 s . ..
..
Электронные конфигурации, принцип Ауфбау, Вырожденные орбитали и правило Хунда
Электронная конфигурация атома описывает орбитали, занятые электроны на атоме. В основе этого прогноза лежит правило, известное как aufbau. принцип , который предполагает, что электроны добавляются к атому по одному, начиная с самой низкой энергетической орбиталью, пока все электроны не будут помещены в соответствующий орбитальный.
Атом водорода ( Z = 1) имеет только один электрон, который переходит в наименьшую энергию. орбитальный, орбитальный 1 s . Об этом свидетельствует написание надстрочного индекса «1». после символа орбиты.
H ( Z = 1): 1 с 1
Следующий элемент имеет два электрона, и второй электрон заполняет орбиталь 1 s потому что есть только два возможных значения спинового квантового числа, используемого для различения
между электронами на орбитали.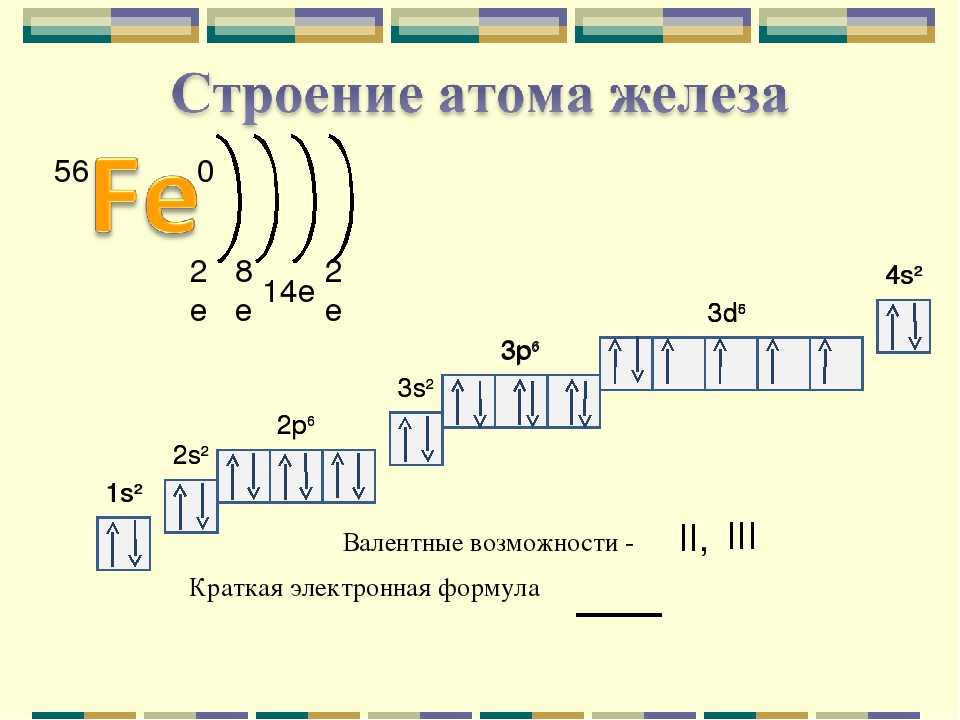
He ( Z = 2): 1 с 2
Третий электрон переходит на следующую орбиталь на энергетической диаграмме 2 с орбитальный.
Li ( Z = 3): 1 с 2 2 с 1
Четвертый электрон заполняет эту орбиталь.
Be ( Z = 4): 1 с 2 2 с 2
После заполнения орбиталей 1 с и 2 с , следующая самая низкая энергия орбитали – это три орбитали 2 p .Пятый электрон, следовательно, переходит в один из эти орбитали.
B ( Z = 5): 1 с 2 2 с 2 2 p 1
Когда приходит время добавить шестой электрон, электронная конфигурация очевидна.
C ( Z = 6): 1 с 2 2 с 2 2 p 2
Однако в подоболочке 2 p есть три орбитали. Второй электрон
попадает на ту же орбиталь, что и первый, или переходит на одну из других орбиталей в
эта подоболочка?
Второй электрон
попадает на ту же орбиталь, что и первый, или переходит на одну из других орбиталей в
эта подоболочка?
Чтобы ответить на этот вопрос, нам нужно понять концепцию вырожденных орбиталей . К По определению, орбитали являются вырожденными , когда они имеют одинаковую энергию. Энергия орбиталь зависит как от ее размера, так и от формы, потому что электрон тратит больше время дальше от ядра атома по мере того, как орбиталь становится больше или форма становится более сложным.Однако в изолированном атоме энергия орбитали не зависят от направления, в котором он указывает в пространстве. Орбитали, которые различаются только своим ориентация в пространстве, например 2 p x , 2 p y и 2 p z орбитали, поэтому вырождены.
Электроны заполняют вырожденные орбитали в соответствии с правилами, впервые сформулированными Фридрихом Хундом. Hund’s
правила можно резюмировать следующим образом.
- Один электрон добавляется к каждой из вырожденных орбиталей в подоболочке перед двумя электроны добавляются к любой орбитали подоболочки.
- Электроны добавляются к подоболочке с тем же значением спинового квантового числа, пока каждая орбиталь подоболочки имеет по крайней мере один электрон.
Когда приходит время поместить два электрона в подоболочку 2 p , мы помещаем один электрон на каждую из двух орбиталей.(Выбор между 2 p x , 2 p y и 2 p z орбитали являются чисто произвольными.)
C ( Z = 6): 1 с 2 2 с 2 2 p x 1 2 п y 1
Тот факт, что оба электрона в подоболочке 2 p имеют одинаковый спин квантовое число можно показать, представив электрон, для которого s = +1/2 с
стрелка вверх и электрон, для которого s = -1/2 со стрелкой, указывающей
вниз.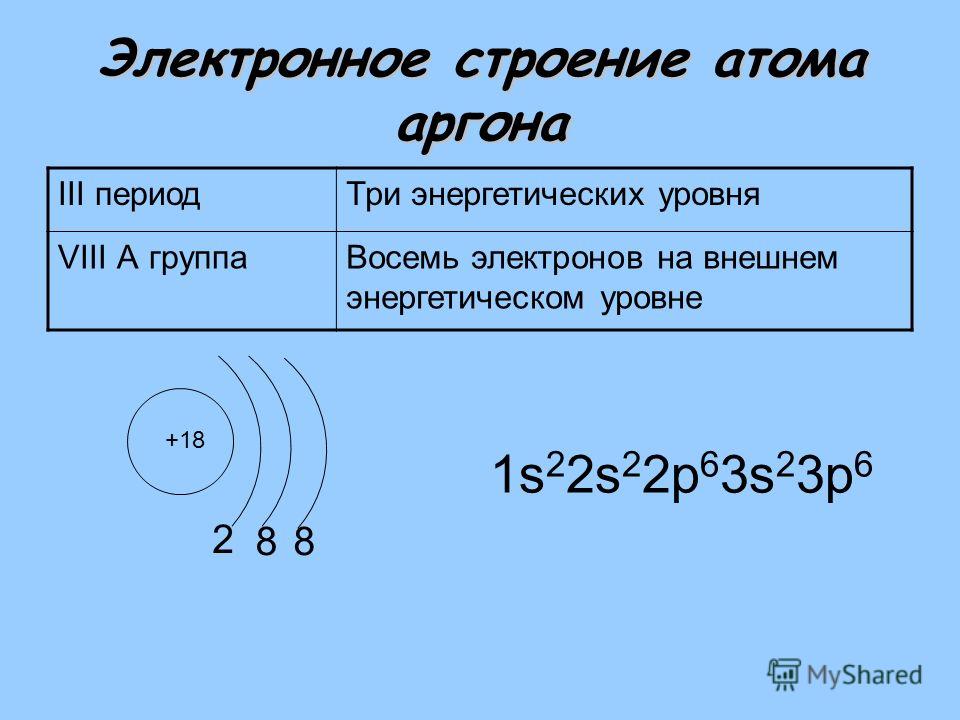
Таким образом, электроны на орбиталях 2 p на углероде могут быть представлены как следует.
Когда мы дойдем до N ( Z = 7), мы должны поместить по одному электрону в каждый из трех вырожденные 2 p орбитали.
| N ( Z = 7): | 1 с 2 2 с 2 2 п 3 |
Поскольку каждая орбиталь в этой подоболочке теперь содержит один электрон, следующий электрон добавленный к подоболочке, должен иметь противоположное квантовое число спина, тем самым заполняя одно из орбитали 2 p .
| O ( Z = 8): | 1 с 2 2 с 2 2 п 4 |
Девятый электрон заполняет вторую орбиталь этой подоболочки.
| F ( Z = 9): | 1 с 2 2 с 2 2 п 5 |
Десятый электрон завершает подоболочку 2 p .
| Ne ( Z = 10): | 1 с 2 2 с 2 2 п 6 |
Есть что-то необычно стабильное в атомах, таких как He и Ne, у которых есть электроны.
конфигурации с заполненными оболочками орбиталей.Поэтому по соглашению мы пишем
сокращенные электронные конфигурации с точки зрения количества электронов за пределами
предыдущий элемент с электронной конфигурацией заполненной оболочки. Электронные конфигурации
следующие два элемента в периодической таблице, например, можно было бы записать следующим образом.
Электронные конфигурации
следующие два элемента в периодической таблице, например, можно было бы записать следующим образом.
Na ( Z = 11): [Ne] 3 с 1
Mg ( Z = 12): [Ne] 3 s 2
Процесс aufbau можно использовать для прогнозирования электронной конфигурации элемента.Фактическая конфигурация, используемая элементом, должна быть определена экспериментально. В экспериментально определенные электронные конфигурации для элементов в первых четырех рядах периодической таблицы Менделеева приведены в таблице в следующем разделе.
Электронные конфигурации элементов
(элементы 1-го, 2-го, 3-го и 4-го ряда)
| Атомный номер | Символ | Электронная конфигурация | ||
| 1 | H | 1 с 1 | ||
| 2 | He | 1 s 2 = [He] | ||
| 3 | Li | [He] 2 с 1 | ||
| 4 | Be | [He] 2 с 2 | ||
| 5 | B | [He] 2 с 2 2 с 1 | ||
| 6 | С | [He] 2 с 2 2 с 2 | ||
| 7 | N | [He] 2 с 2 2 с 3 | ||
| 8 | O | [He] 2 с 2 2 с 4 | ||
| 9 | F | [He] 2 с 2 2 с 5 | ||
| 10 | Ne | [He] 2 s 2 2 p 6 = [Ne] | ||
| 11 | Na | [Ne] 3 с 1 | ||
| 12 | мг | [Ne] 3 с 2 | ||
| 13 | Al | [Ne] 3 с 2 3 с 1 | ||
| 14 | Si | [Ne] 3 с 2 3 с 2 | ||
| 15 | -P | [Ne] 3 с 2 3 с 3 | ||
| 16 | S | [Ne] 3 с 2 3 с 4 | ||
| 17 | Класс | [Ne] 3 с 2 3 с 5 | ||
| 18 | Ar | [Ne] 3 с 2 3 p 6 = [Ar] | ||
| 19 | К | [Ar] 4 с 1 | ||
| 20 | Ca | [Ar] 4 с 2 | ||
| 21 | Sc | [Ar] 4 с 2 3 d 1 | ||
| 22 | Ti | [Ar] 4 с 2 3 d 2 | ||
| 23 | В | [Ar] 4 с 2 3 d 3 | ||
| 24 | Cr | [Ar] 4 с 1 3 d 5 | ||
| 25 | Mn | [Ar] 4 с 2 3 d 5 | ||
| 26 | Fe | [Ar] 4 с 2 3 d 6 | ||
| 27 | Co | [Ar] 4 с 2 3 d 7 | ||
| 28 | Ni | [Ar] 4 с 2 3 d 8 | ||
| 29 | Cu | [Ar] 4 с 1 3 d 10 | ||
| 30 | Zn | [Ar] 4 с 2 3 d 10 | ||
| 31 | Ga | [Ar] 4 с 2 3 d 10 4 p 1 | ||
| 32 | Ge | [Ar] 4 с 2 3 d 10 4 p 2 | ||
| 33 | As | [Ar] 4 с 2 3 d 10 4 p 3 | ||
| 34 | SE | [Ar] 4 с 2 3 d 10 4 p 4 | ||
| 35 | Br | [Ar] 4 с 2 3 d 10 4 p 5 | ||
| 36 | Кр | [Ar] 4 s 2 3 d 10 4 p 6 = [Kr] | ||
Исключения из прогнозируемых электронных конфигураций
Есть несколько шаблонов в электронных конфигурациях, перечисленных в таблице в
предыдущий раздел. Одним из наиболее поразительных является поразительный уровень согласия между
эти конфигурации и конфигурации, которые мы могли бы спрогнозировать. Есть только два
исключения среди первых 40 элементов: хром и медь.
Одним из наиболее поразительных является поразительный уровень согласия между
эти конфигурации и конфигурации, которые мы могли бы спрогнозировать. Есть только два
исключения среди первых 40 элементов: хром и медь.
Строгое соблюдение правил процесса aufbau предсказывает следующее: электронные конфигурации для хрома и меди.
| предсказанные электронные конфигурации: | Cr ( Z = 24): [Ar] 4 s 2 3 d 4 | |
| Cu ( Z = 29): [Ar] 4 s 2 3 d 9 |
Экспериментально определенные конфигурации электронов для этих элементов немного отличаются друг от друга. другой.
| актуальные электронные конфигурации: | Cr ( Z = 24): [Ar] 4 s 1 3 d 5 | |
| Cu ( Z = 29): [Ar] 4 s 1 3 d 10 |
В каждом случае один электрон был переведен с орбитали 4 s на орбиталь 3 d орбитали, хотя предполагается, что орбитали 3 d находятся на более высоком уровне, чем
4 с орбитальный.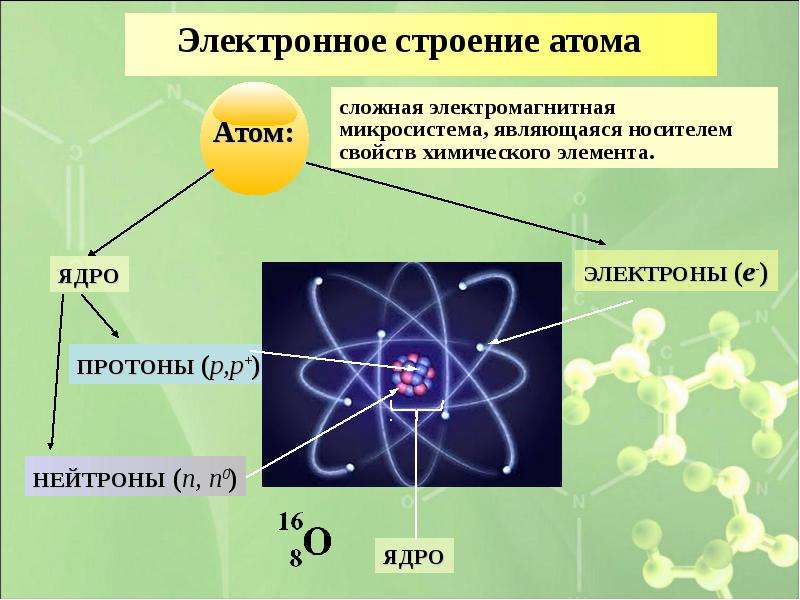
Как только мы выйдем за пределы атомного номера 40, разница между энергиями соседних орбитали достаточно малы, чтобы переносить электрон с одной орбитально к другому. Большинство исключений из электронной конфигурации, предсказанных из поэтому показанная ранее диаграмма aufbau встречается среди элементов с атомными номерами больше 40. Хотя заманчиво сосредоточить внимание на горстка элементов, электронная конфигурация которых отличается от предсказанной с диаграммой aufbau удивительно то, что эта простая диаграмма работает для очень многих элементы.
Электронные конфигурации и периодическая таблица
Когда данные электронной конфигурации расположены так, что мы можем сравнивать элементы в одном из горизонтальные строки периодической таблицы, мы обнаруживаем, что эти строки обычно соответствуют заполнение оболочки орбиталей. Вторая строка, например, содержит элементы в которой заполнены орбитали в оболочке n = 2.
| Li ( Z = 3): | [He] 2 с 1 | |
| Be ( Z = 4): | [He] 2 с 2 | |
| B ( Z = 5): | [He] 2 с 2 2 с 1 | |
| C ( Z = 6): | [He] 2 с 2 2 с 2 | |
| N ( Z = 7): | [He] 2 с 2 2 с 3 | |
| O ( Z = 8): | [He] 2 с 2 2 с 4 | |
| F ( Z = 9): | [He] 2 с 2 2 с 5 | |
| Ne ( Z = 10): | [He] 2 с 2 2 с 6 |
В вертикальных столбцах или группах периодических стол тоже.Элементы в группе имеют схожую конфигурацию самых внешних электроны. Это соотношение можно увидеть, посмотрев на электронные конфигурации элементы в столбцах по обе стороны периодической таблицы.
| Группа IA | Группа VIIA | |||||
| H | 1 с 1 | |||||
| Li | [He] 2 с 1 | F | [He] 2 с 2 2 с 5 | |||
| Na | [Ne] 3 с 1 | Класс | [Ne] 3 с 2 3 с 5 | |||
| К | [Ar] 4 с 1 | Br | [Ar] 4 с 2 3 d 10 4 p 5 | |||
| руб | [Kr] 5 с 1 | I | [Kr] 5 s 2 4 d 10 5 p 5 | |||
| CS | [Xe] 6 с 1 | в | [Xe] 6 s 2 4 f 14 5 d 10 6 p 5 |
На рисунке ниже показана взаимосвязь между периодической таблицей и орбиталями. заполняется во время процесса aufbau.Два столбца в левой части периодической таблица соответствует заполнению орбитали s . Следующие 10 столбцов включают элементы, в которых заполнены пять орбиталей в подоболочке d . Шесть столбцов на справа представляют заполнение трех орбиталей в подоболочке p . Наконец, 14 столбцов внизу таблицы соответствуют заполнению семи орбиталей в подоболочка f .
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.
 Онлайновая исправленная версия XML: goldbook.iupac.org (2006-), созданная М. Ником, Дж. Джиратом, Б. Косатой; обновления составлены А. Дженкинсом. ISBN 0-9678550-9-8. DOI: 10.1351 / goldbook.
Онлайновая исправленная версия XML: goldbook.iupac.org (2006-), созданная М. Ником, Дж. Джиратом, Б. Косатой; обновления составлены А. Дженкинсом. ISBN 0-9678550-9-8. DOI: 10.1351 / goldbook.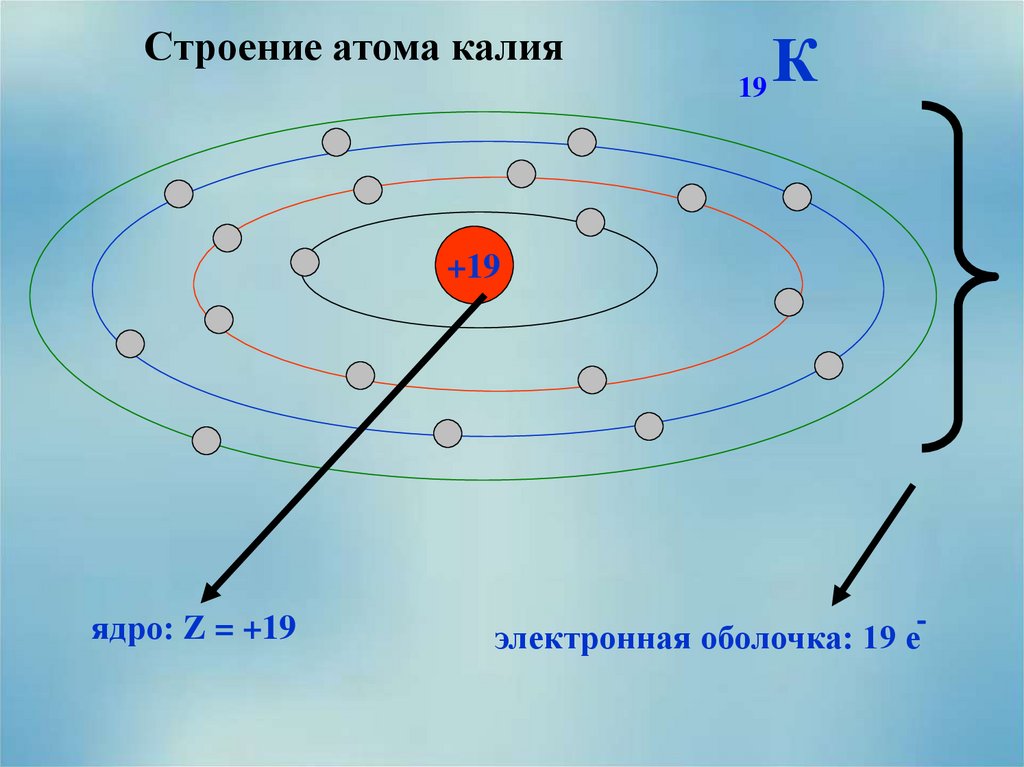
 Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686. Это очень стабильное устройство, и, как следствие, гелий представляет собой инертный газ с незначительными химическими свойствами.
Это очень стабильное устройство, и, как следствие, гелий представляет собой инертный газ с незначительными химическими свойствами.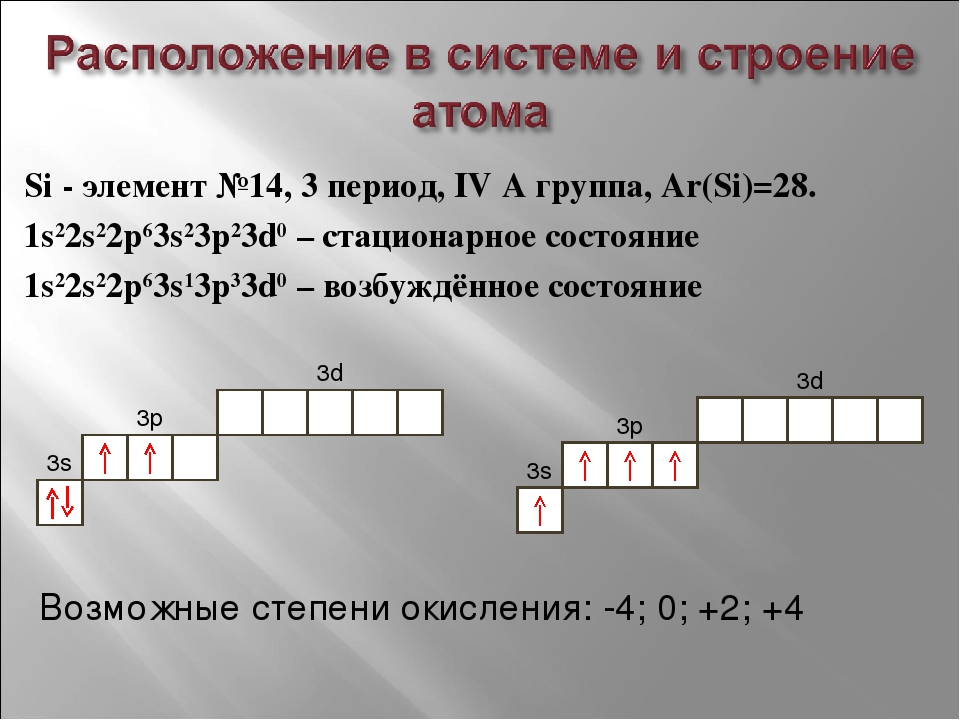 Имеет чистый положительный заряд (+). Точно так же атом хлора получил этот дополнительный отрицательный заряд и никаких дополнительных протонов, поэтому теперь он несет чистый отрицательный заряд (-). Эти новые атомные структуры называются ионами , а процесс электронного обмена называется ионизацией .
Имеет чистый положительный заряд (+). Точно так же атом хлора получил этот дополнительный отрицательный заряд и никаких дополнительных протонов, поэтому теперь он несет чистый отрицательный заряд (-). Эти новые атомные структуры называются ионами , а процесс электронного обмена называется ионизацией .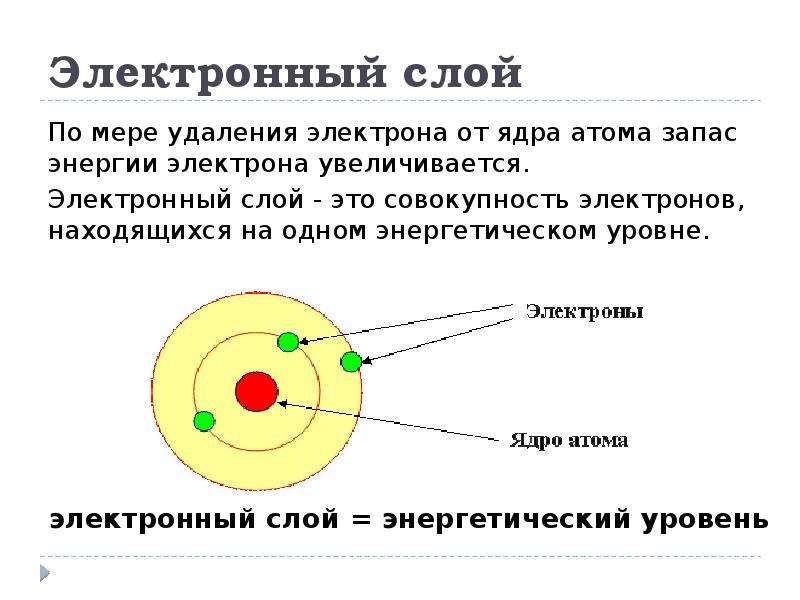 и + l . Если l = 2, m может иметь значение -2, -1, 0, +1 или +2.
и + l . Если l = 2, m может иметь значение -2, -1, 0, +1 или +2.