Никель, свойства атома, химические и физические свойства
Никель, свойства атома, химические и физические свойства.
Поделиться в:
Ni 28 Никель
58,6934(4) 1s2 2s2 2p6 3s2 3p6 3d8 4s2
Никель — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 28. Расположен в 10-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Атом и молекула никеля. Формула никеля. Строение атома никеля
Цена на никель
Изотопы и модификации никеля
Свойства никеля (таблица): температура, плотность, давление и пр.
Физические свойства никеля
Химические свойства никеля. Взаимодействие никеля. Химические реакции с никелем
Получение никеля
Применение никеля
Таблица химических элементов Д. И. Менделеева
И. Менделеева
Атом и молекула никеля. Формула никеля. Строение атома никеля:
Никель (лат. Niccolum, от ср. нем. Nickel – «озорник») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ni и атомным номером 28. Расположен в 10-й группе (по старой классификации – побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Никель – металл. Относится к переходным металлам, а также к группе тяжёлых, цветных металлов.
Никель обозначается символом Ni.
Как простое вещество никель при нормальных условиях представляет собой ковкий, пластичный металл серебристо-белого цвета.
Молекула никеля одноатомна.
Химическая формула никеля Ni.
Электронная конфигурация атома никеля 1s2 2s2 2p6 3s2 3p6 3d8 4s2. Потенциал ионизации (первый электрон) атома никеля равен 737,14 кДж/моль (7,639878(17) эВ).
Строение атома никеля. Атом никеля состоит из положительно заряженного ядра (+28), вокруг которого по четырем оболочкам движутся 28 электронов. При этом 26 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку никель расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома никеля на 3d-орбитали находится шесть спаренных и два неспаренных электрона. На внешнем энергетическом уровне атома никеля – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома никеля состоит из 28 протонов и 31 нейтрон.
На внешнем энергетическом уровне атома никеля – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома никеля состоит из 28 протонов и 31 нейтрон.
Радиус атома никеля (вычисленный) составляет 149 пм.
Атомная масса атома никеля составляет 58,6934(4) а. е. м.
Никель химически малоактивен.
Никель, свойства атома, химические и физические свойства
Изотопы и модификации никеля:
Свойства никеля (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Никель |
| 102 | Прежнее название | |
| 103 | Латинское название | Niccolum |
| 104 | Английское название | Nickel |
| 105 | Символ | Ni |
| 106 | Атомный номер (номер в таблице) | 28 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, цветной металл |
| 109 | Открыт | Аксель Фредрик Кронстедт, Швеция, 1751 г. |
| 110 | Год открытия | 1751 г. |
| 111 | Внешний вид и пр. | Ковкий, пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0089 % |
| 120 | Содержание в морях и океанах (по массе) | 2,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,006 % |
| 122 | Содержание в Солнце (по массе) | 0,008 % |
| 123 | Содержание в метеоритах (по массе) | 1,3 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 58,6934(4) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d8 4s2 |
| 203 | Электронная оболочка | K2 L8 M16 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 149 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 124 пм |
| 207 | Радиус иона (кристаллический) | Ni2+ low spin 83 (6) пм, Ni3+ low spin 70 (6) пм, Ni4+ low spin 62 (6) пм, Ni3+ high spin 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 163 пм |
| 209 | Электроны, Протоны, Нейтроны | 28 электронов, 28 протонов, 31 нейтрон |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 10-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, -1, 0, +1, +2 , +3, +4 |
| 302 | Валентность | II, III |
| 303 | Электроотрицательность | 1,91 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 737,14 кДж/моль (7,639878(17) эВ) |
| 305 | Электродный потенциал | Ni2+ |
| 306 | Энергия сродства атома к электрону | 111,65(2) кДж/моль (1,15716(12) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 8,908 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 7,81 г/см3 (при температуре плавления 1455 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1455 °C (1728 K, 2651 °F) |
| 403 | Температура кипения* | 2730 °C (3003 K, 4946 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 17,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 379 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,439 Дж/г·K (при 20°C) |
| 410 | Молярная теплоёмкость* | 26,07 Дж/(K·моль) |
| 411 | Молярный объём | 6,58884 см³/моль |
| 412 | Теплопроводность | 90,9 Вт/(м·К) (при стандартных условиях), 90,9 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 3,524 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 375 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-02-0 |
Примечание:
205* Эмпирический радиус атома никеля согласно [1] и [3] составляет 124 пм.
206* Ковалентный радиус никеля согласно [1] и [3] составляет 124±4 пм и 115 пм соответственно.
401* Плотность никеля согласно [3] и [4] составляет 8,902 г/см3 (при 0 °C и иных стандартных условиях
402* Температура плавления никеля согласно [3] составляет 1453 °C (1726 K, 2647 °F).
403* Температура кипения никеля согласно [3] и [4] составляет 2732 °C (3005 K, 4949 °F) и 3173,15 °C (2900 K, 5252 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) никеля согласно [3] и [4] составляет 17,61 кДж/моль и 17,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) никеля согласно [3] и [4] составляет 378,6 кДж/моль и 369,9 кДж/моль соответственно.
410* Молярная теплоемкость никеля согласно [3] составляет 26,1 Дж/(K·моль).
Физические свойства никеля:
Химические свойства никеля. Взаимодействие никеля. Химические реакции с никелем:
Получение никеля:
Применение никеля:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25.
 Марганец
Марганец - 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59.
 Празеодим
Празеодим - 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92.
 Уран
Уран - 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Nickel
- https://de.
 wikipedia.org/wiki/Nickel
wikipedia.org/wiki/Nickel - https://ru.wikipedia.org/wiki/Никель
- http://chemister.ru/Database/properties.php?dbid=1&id=237
- https://chemicalstudy.ru/nikel-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
никель атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле никеля
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 471
2.
 Железо, кобальт, никель. Строение атомов, со. Их отношение к к-там. Оксиды, гидроксиды, соли, комплексные соединения этих элементов.
Железо, кобальт, никель. Строение атомов, со. Их отношение к к-там. Оксиды, гидроксиды, соли, комплексные соединения этих элементов.3d-элементы Fe, Co, Ni составляют семейство железа. относительно лёгкие ме, тугоплавки.
Элемент | Степени окисления |
Fe | II, III, VI |
Co | II, III |
Ni | II, III |
Fe
co
ni
явл ме средней активности. Наиболее
активным явл железо. Во влажном воздухе
железо подвергается коррозии
4Fe+2h3O+3O2=2Ge2O3*h3O образующаяся ржавчина не
защищает железо от дальнейшего
разрушения. Co ni устойчивы к воздействию воды, т.к.
защищены оксидной плёнкой. Кобальт и
никель взаим-ют с серой и галогенами
только при нагр, а железо в обычн усл. Fe co ni вытесняют водород из разб кислот:
Э+HCl=ЭCl2+H2,
но не реаг с р-рами щелочей.
Наиболее
активным явл железо. Во влажном воздухе
железо подвергается коррозии
4Fe+2h3O+3O2=2Ge2O3*h3O образующаяся ржавчина не
защищает железо от дальнейшего
разрушения. Co ni устойчивы к воздействию воды, т.к.
защищены оксидной плёнкой. Кобальт и
никель взаим-ют с серой и галогенами
только при нагр, а железо в обычн усл. Fe co ni вытесняют водород из разб кислот:
Э+HCl=ЭCl2+H2,
но не реаг с р-рами щелочей.
Сo+2H2SO4(конц)=CoSO4+SO2+2H2O (нагр) (без нагр – пассивируют)
Fe+6HNO3=Fe(NO3)3+3NO2+3H2O (нагр) (без нагр – пассивируют)
Очень разб азотная к-а окисляет железо до +2: 4Fe+10HNO3=4Fe(NO3)2+NH4NO3+3H2O
При взаим-ии железа с кислородом обр красно-бурый Fe2O3, при нагр чёрный Fe3O4 и чёрный FeO
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Оксид
и гидроксид железа (II) проявляют основные св-ва. Оксид
и гидроксид железа (III) амфотерны с преобладанием осн св-в. Fe(OH)3, Fe2O3 р-ряются в к-тах с обр солей катионного
типа. Анионные соли (ферраты) получаются
только при сплавл этих соед со щел и
водой: Fe2O3+Na2CO3=2NaFeO2+CO2
Оксид
и гидроксид железа (III) амфотерны с преобладанием осн св-в. Fe(OH)3, Fe2O3 р-ряются в к-тах с обр солей катионного
типа. Анионные соли (ферраты) получаются
только при сплавл этих соед со щел и
водой: Fe2O3+Na2CO3=2NaFeO2+CO2
Fe(OH)2 – белый, Fe(OН)2 – бурый. Получают действием щел на соотв соли.
4Fe(OH)2+O2+2h3O=4Fe(OH)3, поэтому получ в лаб усл Fe(OH)2 имеет грязный зелёный цвет.
В CO VI железо обр соли неизвестной в свободном сост железной к-ты – ферраты, кот можно получить ок-ем соед железа (III) в сильнощелочной среде: 2Fe(OH)3+10KOH+3Br2=2K2FeO4+6KBr+8h3O или при сплавл с ок-лями оксидов: Fe2O3+3BaO2=2BaFeO4+BaO
Ферраты – сильные ок-ли в нейтри кислой среде: 2K2FeO4+2NH3+2H2O=4KOH+N2+2Fe(OH)3
В
ряду Fe(OH)2, Co(OH)2, Ni(OH)2 увелич устойч гидроксидов и уменьш
восс-ные св-ва.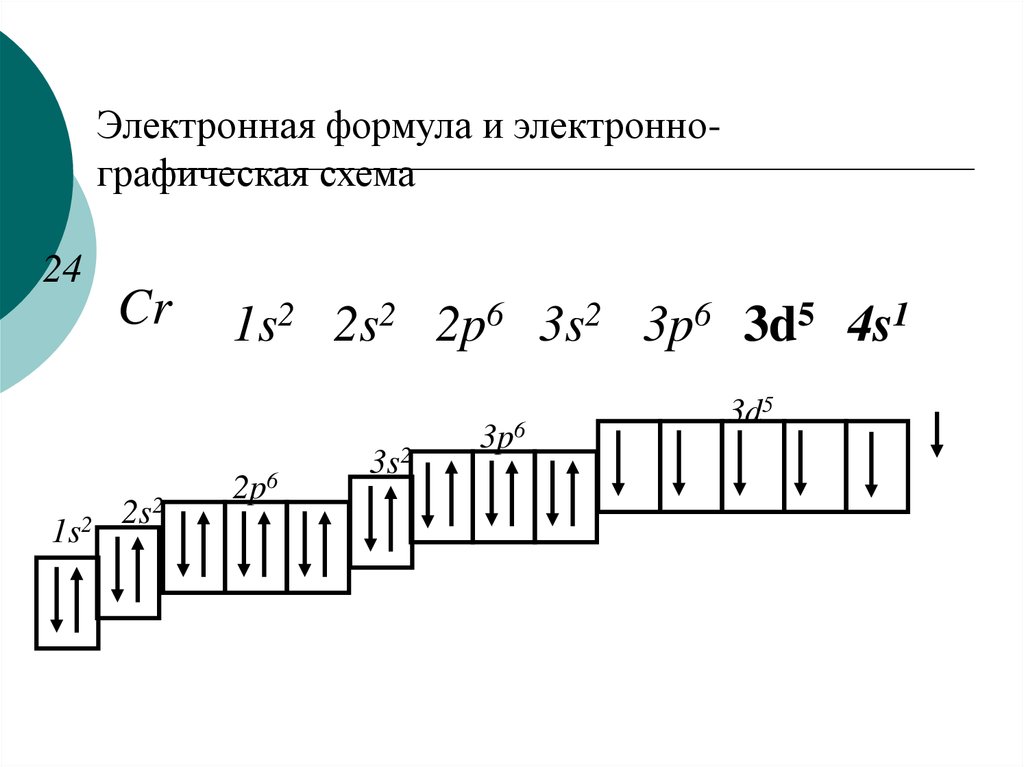
В ряду Fe(OH)3, Co(OH)3, Ni(OH)3 устойч гидроксидов уменьш, ок-льные св-ва возрастают. 2Ni(OH)3+6HCl=2NiCl2+Cl+6H2O
4Ni(OH)3+4h3SO4=4NiSO4+O2+10h3O. соли катионного типа для Fe(III) устойч, для Co(III) редки, для Ni(III) неизвестны.
Комплексные соединения:
желтая кровная соль K4[Fe(CN)6], красная кровяная соль K3[Fe(CN)6]
Кобальт(II) и никель (II) склонны к обр компл соедс координационными числами 4 и 6: Ni(CO)4, H2[CoCl4]
Кобальт (III) образует прочные связи с лигандами, содержащие донорный атом азота: 4[Co(Nh4)6]Cl2+3h3O+O2=4[Co(Nh4)6](OH)Cl2
Билет 20
Атом
— частица в-ва микроскопических размеров
и массы, наименьшая часть хим эл-та,
являющаяся носителем его св-в. Атом
состоит из атомного ядра и электронов.
Если число протонов в ядре совпадает
с числом электронов, то атом в целом
оказывается электрически нейтр. В
противном случае он обладает некоторым
+ или – зарядом и называется ионом.
Атом
состоит из атомного ядра и электронов.
Если число протонов в ядре совпадает
с числом электронов, то атом в целом
оказывается электрически нейтр. В
противном случае он обладает некоторым
+ или – зарядом и называется ионом.
Квантовые числа Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое – вокруг собственной оси.
Главное квантовое число (n). Опр энергетический уровень электрона. Принимает целые значения (n = 1, 2, 3 …) и соответствует номеру периода.
Орбитальное квантовое число (l) характеризует геом форму орбитали. Принимает значение целых чисел от 0 до (n – 1).
Для
l=0 s- подуровень, s- орбиталь – орбиталь сфера
l=1 p- подуровень, p- орбиталь – орбиталь гантель
l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы
Магнитное квантовое число (m) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0
Для
s- орбитали (l = 0) такое положение одно и
соответствует m = 0. Сфера не может иметь
разные ориентации в пространстве.
Сфера не может иметь
разные ориентации в пространстве.
Для p- орбитали (l = 1) : m = -1, 0, +1.
Для d- орбитали (l = 2) m = -2, -1, 0, +1, +2.
Таким образом, на s- подуровне – одна, на p- подуровне – три, на d- подуровне – пять, на f- подуровне – 7 орбиталей.
Спиновое квантовое число (s) Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения
nglos324 – никель
nglos324 – никель
| ||||||||||
никель
представляет собой металл VIII группы периодической таблицы с атомным номером 29. , ан
атомный вес 58,71 и плотность 8,9. Он имеет температуру плавления
1453 г. , ан
атомный вес 58,71 и плотность 8,9. Он имеет температуру плавления
1453 г.электронная конфигурация атома Ni: (Ar)(3d) 10 (4s) 2 , атомный радиус 0,124 нм. В при комнатной температуре кристаллическая структура гранецентрированно-кубическая с основанием одного атома Ni. Показана элементарная ячейка ГЦК. Э = 207 ГПа, с г = 70 МПа, UTS = 400 МПа, деформация разрушения 0,65. | ||||||||||
| От кого: Каллистер, «Материаловедение и инженерия», Wiley (1997) | .||||||||||
Никель, атомная структура — Стоковая фотография — C018/3709
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3709
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Никель (Ni).

 Марганец
Марганец Празеодим
Празеодим Уран
Уран wikipedia.org/wiki/Nickel
wikipedia.org/wiki/Nickel