Примеры заданий по теме: Строение атома. Строение электронных оболочек атомов | Материал для подготовки к ЕГЭ (ГИА) по химии (9 класс) на тему:
Опубликовано 23.11.2018 – 16:35 – Трубникова Елена Евгеньевна
Разработка представляет собой подборку заданий по теме: “Строение атома. Строение электронных оболочек атома”(задание 1). Задания могут быть использованы как учителями на уроках, так и обучающимися для самостоятельной подготовки к сдаче ОГЭ и ВПР по химии …
Скачать:
Предварительный просмотр:
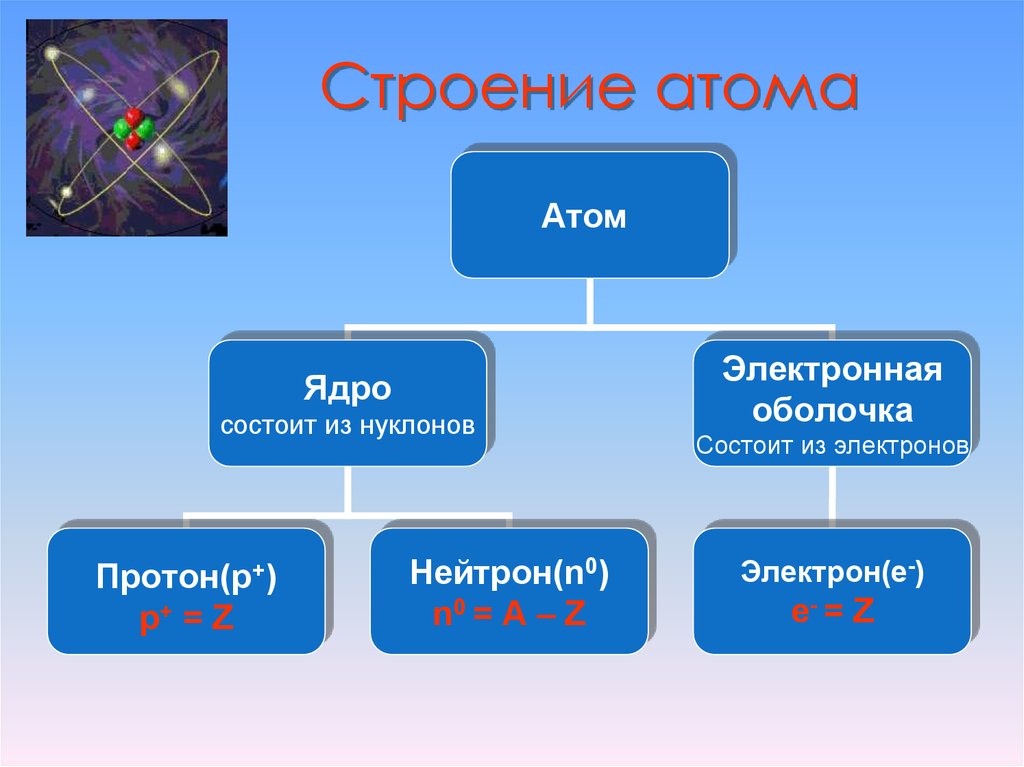
Строение атома. Строение электронных оболочек атомов
Выберите 1 правильный ответ из 4 предложенных
- Пять электронов находятся во внешнем электронном слое атома
1) бора
2) стронция
3) фосфора
4) неона
- Три электрона находятся во внешнем электронном слое атома
1) углерода
2) мышьяка
3) алюминия
4) лития
- Сколько электронов находится во внешнем электронном слое атома, в ядре которого 14 протонов?
1) 2
2) 4
3) 8
4) 14
- Порядковый номер химического элемента всегда равен
1) атомной массе
2) заряду ядра атома
3) числу валентных электронов атома
4) числу нейтронов в ядре атома
- Число электронов во внешнем электронном слое атома, ядро которого содержит 10 протонов, равно
1) 8
2) 2
3) 6
4) 4
- Число электронов у атома, ядро которого содержит 12 протонов, равно
1) 4
2) 6
3) 8
4) 12
- Распределению электронов в атоме химического элемента соответствует ряд чисел: 2, 8, 3.
 В Периодической системе Д. И. Менделеева этот элемент расположен
В Периодической системе Д. И. Менделеева этот элемент расположен
1) в 3-м периоде, IIIА группе
2) в 3-м периоде, IIA группе
3) во 2-м периоде, IIA группе
4) во 2-м периоде, IIIA группе
- Заряд ядра атома химического элемента, расположенного во 2-м периоде, IVA группе равен
1) +4
2) +12
3) +8
4) +6
- Химическому элементу 3-го периода VA-группы соответствует схема распределения электронов по слоям:
1) 2, 8, 5
2) 2, 8, 3
3) 2, 5
4) 2, 3
- Четыре электронных слоя и семь электронов во внешнем электронном слое имеет атом
1) углерода
2) калия
3) брома
4) кремния
- Химическому элементу, степень окисления которого в высшем оксиде +6, соответствует схема распределения электронов в атоме:
1) 2, 8, 6
2) 2, 8, 8, 2
3) 2, 8, 3
4) 2, 6
- В атоме элемента два энергетических уровня заполнены электронами, а на третьем находятся 4 электрона.
 Какой это элемент?
Какой это элемент?
1) кремний
2) углерод
3) кислород
4) сера
- В атоме химического элемента электроны находятся на двух энергетических уровнях, на внешнем уровне – 5 электронов. Этот элемент —
1) бор
2) азот
3) неон
4) фосфор
- В атоме химического элемента электроны находятся на трёх энергетических уровнях, на внешнем уровне — 4 электрона. Этот элемент —
1) литий
2) углерод
3) кремний
4) аргон
- Сколько электронов находится на внешнем уровне элемента с порядковым номером 13?
1) 3
2) 5
3) 8
4) 13
По теме: методические разработки, презентации и конспекты
Тест “Строение атома. Строение электронных оболочек атомов”
Ученикам: Выберите один правильный ответ. Обратите внимание вы должны уметь расписывать электронное строение атомов 20 первых элементов расположенных в ПСХЭ Д.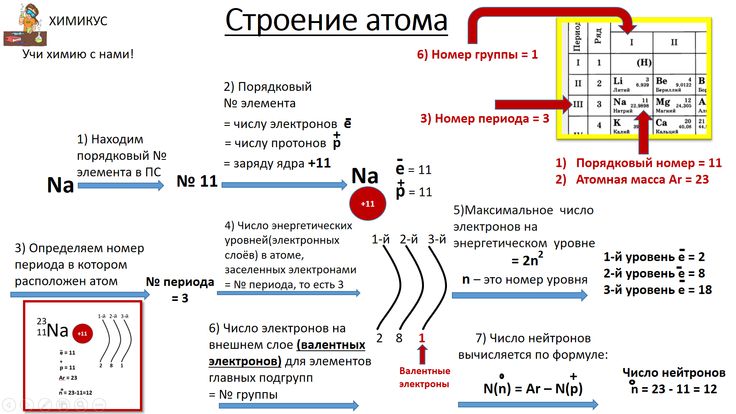 И.Менделеева. Удачи!
Тест для 9 класса. …
И.Менделеева. Удачи!
Тест для 9 класса. …
презентация по химии Строение электронных оболочек атомов в ПСХЭ
В данной презентации показано, как происходит в атоме заполнение электронами внешних оболочек у атомов № 1-20 в ПСХЭ Д.И.Мендлеева…
план-конспект урока Тема урок: Строение электронных оболочек атомов химических элементов №1-20
Тема: Строение электронных оболочек атомов химических элементов №1-20Цель: сформировать у учащихся представления об электронной оболочке атома и энергетических уровнях;рассмотреть электронное строение…
Электроны. Строение электронных оболочек атомов химических элементов
Урок химии в 8 классе…
Открытый урок по химии в 8 классе по теме «Электроны. Строение электронных оболочек атомов химических элементов № 1 – 20»
Учебное занятие по изучению и первичному закреплению новых знаний и способов деятельности сформировать у учащихся представления об электронной оболочке атома и энергетических уровнях;рассмотреть .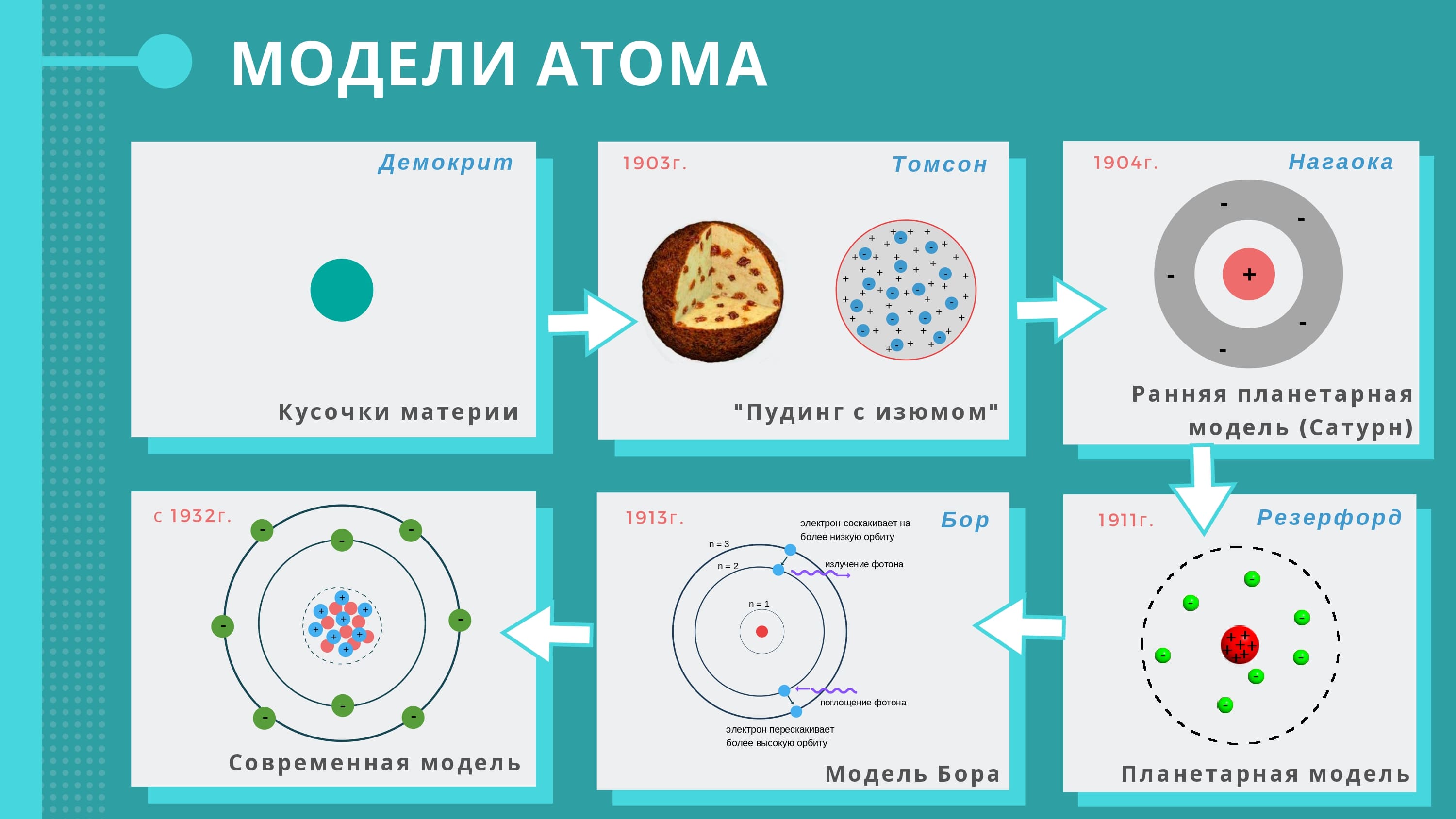 ..
..
8 класс Состав и важнейшие характеристики атомов. Строение электронных оболочек атомов.
УМК Н.Е.Кузнецовой…
ТЕХНОЛОГИЧЕСКАЯ КАРТА УЧЕБНОГО ЗАНЯТИЯ тема занятия: «Строение электронных оболочек атомов химических элементов с 1 по 20»
Технологическая карта учебного занятия по теме «Строение электронных оболочек атомов химических элементов с 1 по 20»…
Поделиться:
Атом в химии: строение, формула, определение
Добавлено: 11 декабря 2021 в 15:14
Содержание
Если не учитывать вводные темы, то в 7 классе школьный курс химии начинается со строения атома, которое определяет свойства химических элементов и, в конечном итоге, химических веществ. От того, как все устроено, зависит с чем может соединиться железо или углерод, и сколькими способами. Атом это в химии пример многообразия возможностей, о которых мы поговорим в сегодняшней статье.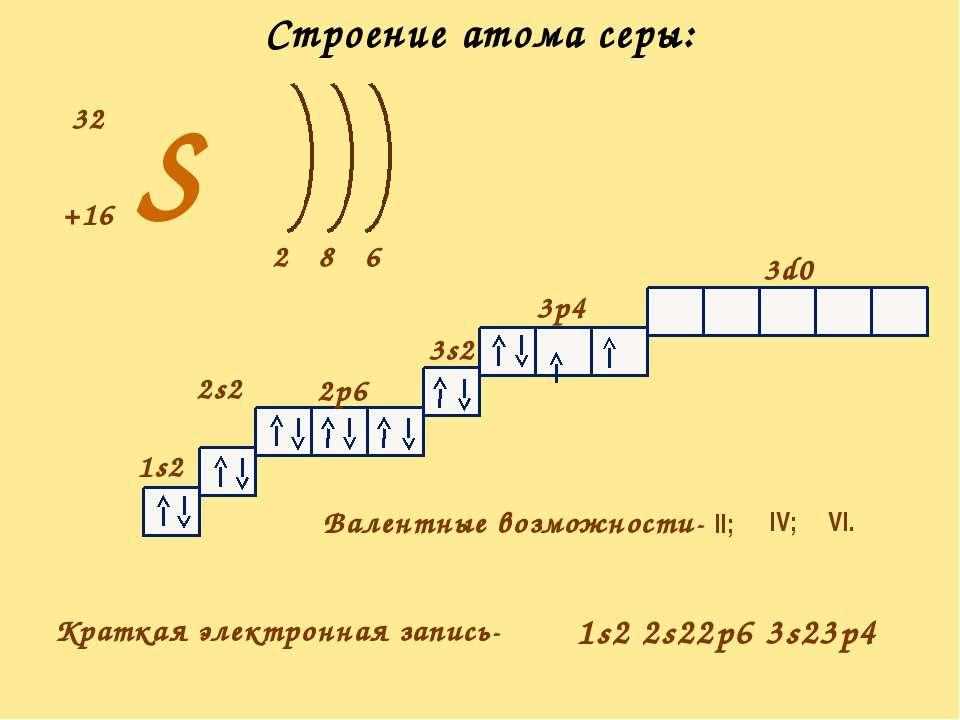
Впервые концепция атома была высказана еще древними философами. В V веке до нашей эры идея о том, что все на свете состоит из универсальных неделимых частиц, высказывалась Левкиппом и Демокритом, а позже была поддержана Аристотелем. За три века до этого менее известные, но более ранние мысли о неделимости мелких частиц материи высказывали индийские ученые. С точки зрения рассуждения о Вселенной это было логичное и вполне жизнеспособное рассуждение, которое таковым и оставалось до недавнего времени.
Новый толчок к изучению веществ сделала промышленная революция, когда попытки заглянуть в вещество или хотя бы догадаться, как оно устроено, были подкреплены не только любопытством, но практической пользой. Особенно значимым для науки оказалась необходимость повысить КПД парового двигателя.
Работа пара в паровом двигателе
Одним из первых математическую базу атомизма в XVIII веке заложил хорват Руджер Бошкович, а уже в XIX веке более известный широкой публике Джон Дальтон высказал мысль, что атомы первичных элементов уникальны. Его похвалили, поскольку работы помогали двигать технику, но посчитали идеи Дальтона не более, чем разминкой ума.
Его похвалили, поскольку работы помогали двигать технику, но посчитали идеи Дальтона не более, чем разминкой ума.
Людвиг Больцман также стал приверженцем атомизма и вместе с коллегами создал ряд уравнений, которые показывают, как воображаемые атомы могут управлять паровой машиной. Формулы были внедрены в жизнь, но на атомистов стали давить сильнее, обвинив их в материализме. Это оказало сильное влияние на Больцмана, который повесился в 1906 году, хотя еще за год до этого один ученый доказал существование атомов.
Броуновское движение
Этим ученым был Альберт Эйнштейн, который присмотрелся к так называемому «броуновскому движению» и для простое, но элегантное объяснение этого явления. Роберт Броун (который на самом деле Браун) заметил, что цветочная пыльца, высыпанная на поверхность воды, «пляшет» и хаотически движется. А Эйнштейн понял, что пыльца не просто «пляшет» — она колеблется из-за толчков элементарных частиц, то есть атомов. Так было доказано существование атома, но началась новая научная война о его строении.
Альберт Эйнштейн
Строение атома
Уже в 1911 году загадка строения атома, казалось, была разгадана. В 1907 году Эрнест Резерфорд стал заведующим кафедрой в Манчестерском университете. Под его руководством Ганс Гейгер (в честь которого назван одноименный счетчик) и Эрнст Марсден собрали несложную установку, чтобы посмотреть «что будет».
В ее состав входила радиевая пушка, которая излучала альфа-частицы и фосфоресцирующий экран, на котором эти частицы фиксировались. Была еще тончайшая золотая фольга, через которую они пролетали. Подручным Резерфорда нужно было всего лишь сидеть в темноте и считать вспышки от альфа-частиц, поэтому, когда руководитель сказал «поставить экран перед фольгой и смотреть, что будет», они послушно выполнили его распоряжение. Успех пришел не сразу, но чрез несколько недель все же стало понятно, что одна из 8 тыс. частиц попадает в фольгу и отлетает назад.
Строение атома
Резерфорд сделал из этого такие выводы:
- почти все частицы проходят через материю беспрепятственно, как сквозь пустоту;
- редко альфа-частица во что-то ударялась и отскакивала назад;
- атом состоит из ядра, которое в 10 тыс.
 раз меньше атома, и электронов, которые вращаются вокруг, будто планеты;
раз меньше атома, и электронов, которые вращаются вокруг, будто планеты; - атом практически полностью состоит из пустоты.
Пример. Если удалить все пустоты атомов, из которых состоит человек, то все 7,5 миллиардов человек на нашей планете поместились бы в банке из-под Coca-Cola.
Проблема планетарной модели атома
Проблема планетарной модели атомаВ результате появилась планетарная модель атома, которую в основном запоминают школьники. Но от нее довольно быстро отказался сам Резерфорд, потому что согласно законам физики электроны, вращаясь вокруг ядра, должны были падать на ядро, а человечество — сжаться до объема яблока. Но все же остановимся подробней на планетарной модели атома — это в химии пример, когда красивая, но неправильная «картинка» просто объясняет существование чего-то реального.
При ближайшем рассмотрении оказалось, что атом состоит из следующих элементов:
- электронов — отрицательно заряженных частиц, которые находятся где-то за пределами ядра;
- протонов — положительно заряженных частиц, которые составляют ядро;
- нейтронов — нейтральных частиц, которые соседствуют в ядре с протонами.

«Модель» атома лития
Свойства того или иного элемента зависят от количества этих частиц. У водорода-1 есть 1 протон и 1 электрон (но нет нейтронов), у гелия (№2 в таблице Менделеева) — 2 протона, 2 нейтрона и 2 электрона, у лития — по 3 протона, нейтрона и электрона. У каждого следующего элемента этот набор отличается на 1, поэтому они имеют разные свойства. Более того, литию для чтобы оставаться литием, достаточно иметь всего 2 протона (число нейтронов у разных изотопов лития может отличаться).
То же касается и остальных элементов, для которых в дело вступает еще и размещение электронов на разных орбиталях, от которого зависит, насколько охотно и в каком сочетании этот элемент будет соединяться с другими.
Свойства того или иного элемента зависят от количества этих частиц
В этом состоит вся химия, но модель атома, описанная Резерфордом, оказалась нерабочей. Достаточно скоро ей на смену пришла высказанная Нильсом Бором и усовершенствованная его последователями квантово-механическая модель, актуальная на сегодняшний момент.
Просто эту модель объяснить нельзя, но очень грубо можно сказать, что электрон не вращается вокруг ядра, а просто существует в каком-то положении и меняет его (не перемещается), поглощая или испуская фотон. С человеческой точки зрения это абсурд, но так работает микромир и это доказано экспериментами.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:
Владислав Барышников
Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все медиа
- Ключевые люди:
- Эрнест Резерфорд
Нильс Бор
Лев Давидович Ландау
Стивен Чу
Уильям Д.
 Филлипс
Филлипс
- Похожие темы:
- субатомная частица радиоактивность изотоп атомизм периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10
Из чего состоит масса атома?
Масса атома состоит из массы ядра плюс массы электронов. Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Это означает, что единица атомной массы не совсем такая же, как масса протона или нейтрона.
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статье Большая часть атома представляет собой пустое пространство.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц,
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10
Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10
Основные свойства
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z ), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, поэтому положительные и отрицательные заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Например, если атом имеет Z из 6, это углерод, а Z из 92 соответствует урану. Нейтральный атом имеет равное количество протонов и электронов, поэтому положительные и отрицательные заряды точно уравновешиваются. Поскольку именно электроны определяют, как один атом взаимодействует с другим, в конечном итоге именно количество протонов в ядре определяет химические свойства атома.
Атом | Определение, структура, история, примеры, схема и факты
модель атомной оболочки
Посмотреть все медиа
- Ключевые люди:
- Эрнест Резерфорд Нильс Бор Лев Давидович Ландау Стивен Чу Уильям Д. Филлипс
- Похожие темы:
- субатомная частица радиоактивность изотоп атомизм периодическая таблица
Просмотреть весь связанный контент →
Популярные вопросы
Что такое атом?
Атом является основным строительным элементом химии. Это наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц.
Все ли атомы одного размера?
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем, определяемый как 10 −10 метра.
Из чего состоит масса атома?
Как определяется атомный номер атома?
Единственной наиболее важной характеристикой атома является его атомный номер (обычно обозначаемый буквой Z), который определяется как количество единиц положительного заряда (протонов) в ядре. Например, если атом имеет Z, равный 6, это углерод, а Z, равный 92, соответствует урану.
Сводка
Прочтите краткий обзор этой темы
атом , наименьшая единица, на которую можно разделить материю без высвобождения электрически заряженных частиц. Это также наименьшая единица материи, обладающая характерными свойствами химического элемента. Таким образом, атом является основным строительным блоком химии.
Исследование различных конфигураций электронов в электронных оболочках вокруг ядра атома
Просмотреть все видео к этой статьеБольшая часть атома представляет собой пустое пространство. Остальное состоит из положительно заряженного ядра протонов и нейтронов, окруженного облаком отрицательно заряженных электронов. Ядро маленькое и плотное по сравнению с электронами, которые являются самыми легкими заряженными частицами в природе. Электроны притягиваются к любому положительному заряду своей электрической силой; в атоме электрические силы связывают электроны с ядром.
Из-за природы квантовой механики ни одно изображение не было полностью удовлетворительным для визуализации различных характеристик атома, что вынуждает физиков использовать дополнительные изображения атома для объяснения различных свойств. В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
В некотором отношении электроны в атоме ведут себя как частицы, вращающиеся вокруг ядра. В других электроны ведут себя как волны, застывшие вокруг ядра. Такие волновые структуры, называемые орбиталями, описывают распределение отдельных электронов. Эти орбитальные свойства сильно влияют на поведение атома, а его химические свойства определяются орбитальными группировками, известными как оболочки.
Эта статья начинается с широкого обзора фундаментальных свойств атома и составляющих его частиц и взаимодействий. После этого обзора следует исторический обзор наиболее влиятельных концепций об атоме, которые были сформулированы на протяжении веков. Для получения дополнительной информации, касающейся структуры ядра и элементарных частиц, см. субатомные частицы.
Большая часть материи состоит из скоплений молекул, которые можно относительно легко разделить. Молекулы, в свою очередь, состоят из атомов, соединенных химическими связями, которые труднее разорвать. Каждый отдельный атом состоит из более мелких частиц, а именно электронов и ядер. Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Эти частицы электрически заряжены, и электрические силы на заряде ответственны за удержание атома вместе. Попытки разделить эти более мелкие составляющие частицы требуют все большего количества энергии и приводят к созданию новых субатомных частиц, многие из которых заряжены.
Как отмечалось во введении к этой статье, атом в основном состоит из пустого пространства. Ядро является положительно заряженным центром атома и содержит большую часть его массы. Он состоит из протонов, имеющих положительный заряд, и нейтронов, не имеющих заряда. Протоны, нейтроны и окружающие их электроны являются долгоживущими частицами, присутствующими во всех обычных атомах природного происхождения. Другие субатомные частицы могут быть обнаружены в ассоциации с этими тремя типами частиц. Однако они могут быть созданы только с добавлением огромного количества энергии и очень недолговечны.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Все атомы примерно одинакового размера, независимо от того, имеют ли они 3 или 90 электронов. Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе.
Приблизительно 50 миллионов атомов твердого вещества, выстроенных в ряд, будут иметь размер 1 см (0,4 дюйма). Удобная единица длины для измерения размеров атомов — ангстрем (Å), определяемый как 10 −10 метра. Радиус атома составляет 1–2 Å. По сравнению с общим размером атома ядро еще меньше. Он находится в такой же пропорции к атому, как шарик к футбольному полю. По объему ядро занимает всего 10 −14 метра пространства в атоме, т. е. 1 часть на 100 000. Удобная единица длины для измерения размеров ядер — фемтометр (фм), который равен 10 −15 метра. Диаметр ядра зависит от числа содержащихся в нем частиц и колеблется примерно от 4 фм для легкого ядра, такого как углерод, до 15 фм для тяжелого ядра, такого как свинец. Несмотря на малые размеры ядра, в нем сосредоточена практически вся масса атома. Протоны — это массивные положительно заряженные частицы, тогда как нейтроны не имеют заряда и немного массивнее протонов. Тот факт, что ядра могут иметь от 1 до почти 300 протонов и нейтронов, объясняет их большие различия в массе.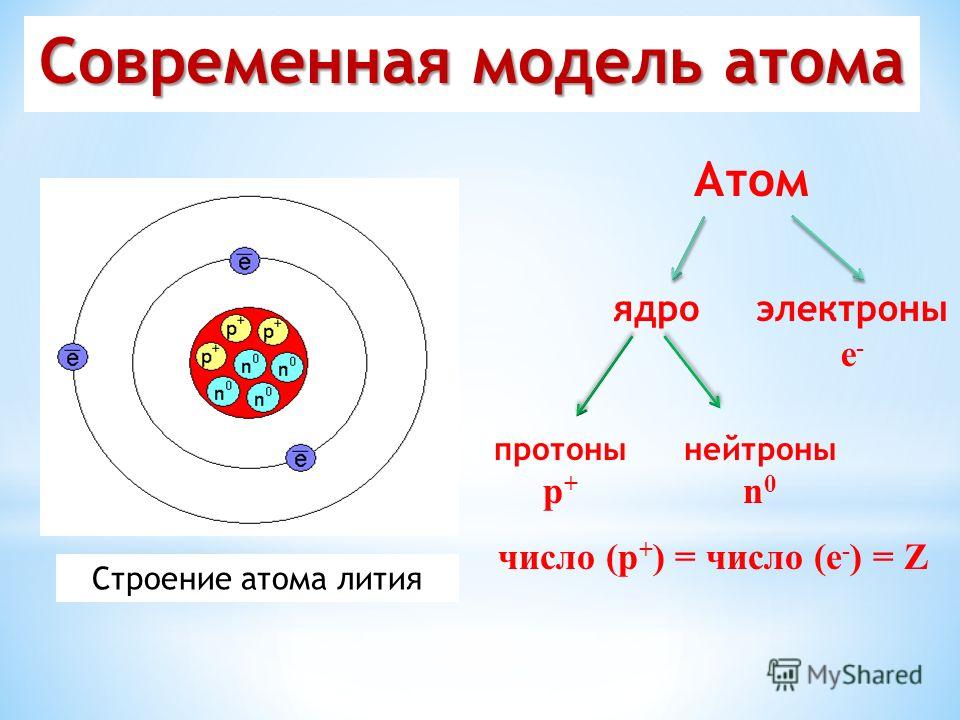

 В Периодической системе Д. И. Менделеева этот элемент расположен
В Периодической системе Д. И. Менделеева этот элемент расположен