химический элемент Прометий Promethium — “Химическая продукция”
Что такое
Прометий, promethium, характеристики, свойстваПрометий — это химический элемент Pm химический элемент, относящийся к группе лантаноидов. В природе практически не встречается, так как все его изотопы радиоактивны. Впервые был получен искусственно в 1945 году. Самый долгоживущий изотоп — прометий-145 имеет период полураспада 18 лет.
Прометий класс химических элементов
Элемент Pm — относится к группе, классу хим элементов (…)
Элемент Pm свойство химического элемента Прометий Promethium
Основные характеристики и свойства элемента Pm…, его параметры.
формула химического элемента Прометий Promethium
Химическая формула Прометия:
Атомы Прометий Promethium химических элементов
Атомы Promethium хим. элемента
Promethium Прометий ядро строение
Строение ядра химического элемента Promethium — Pm,
История открытия Прометий Promethium
Открытие элемента Promethium — Прометий как короткоживущий радиоактивный элемент находится в природе в исчезающе малых количествах (по оценкам, его содержание в земной коре составляет несколько сот грамм) и не мог быть открыт аналитическим способом, несмотря на усилия многих исследователей.
Однако некоторые видные исследователи редких земель, в частности, Б. Браунер, полагали, что в серии редких земель между неодимом и самарием должен существовать ещё один элемент, так как разница в атомной массе этих двух элементов была аномально высока.
После того, как Г. Мозли установил связь заряда ядра атома с местом в Периодической системе, стало очевидным отсутствие в группе редкоземельных элементов элемента 61, и в 1920-х годах начались его интенсивные поиски.
В 1924—1926 годах были заявления об открытии элемента 61 флоренций в Италии (из бразильского минерала монацита) и иллиний в Иллинойском университете в Урбана-Шампейн в США, впоследствии оказавшиеся ошибочными.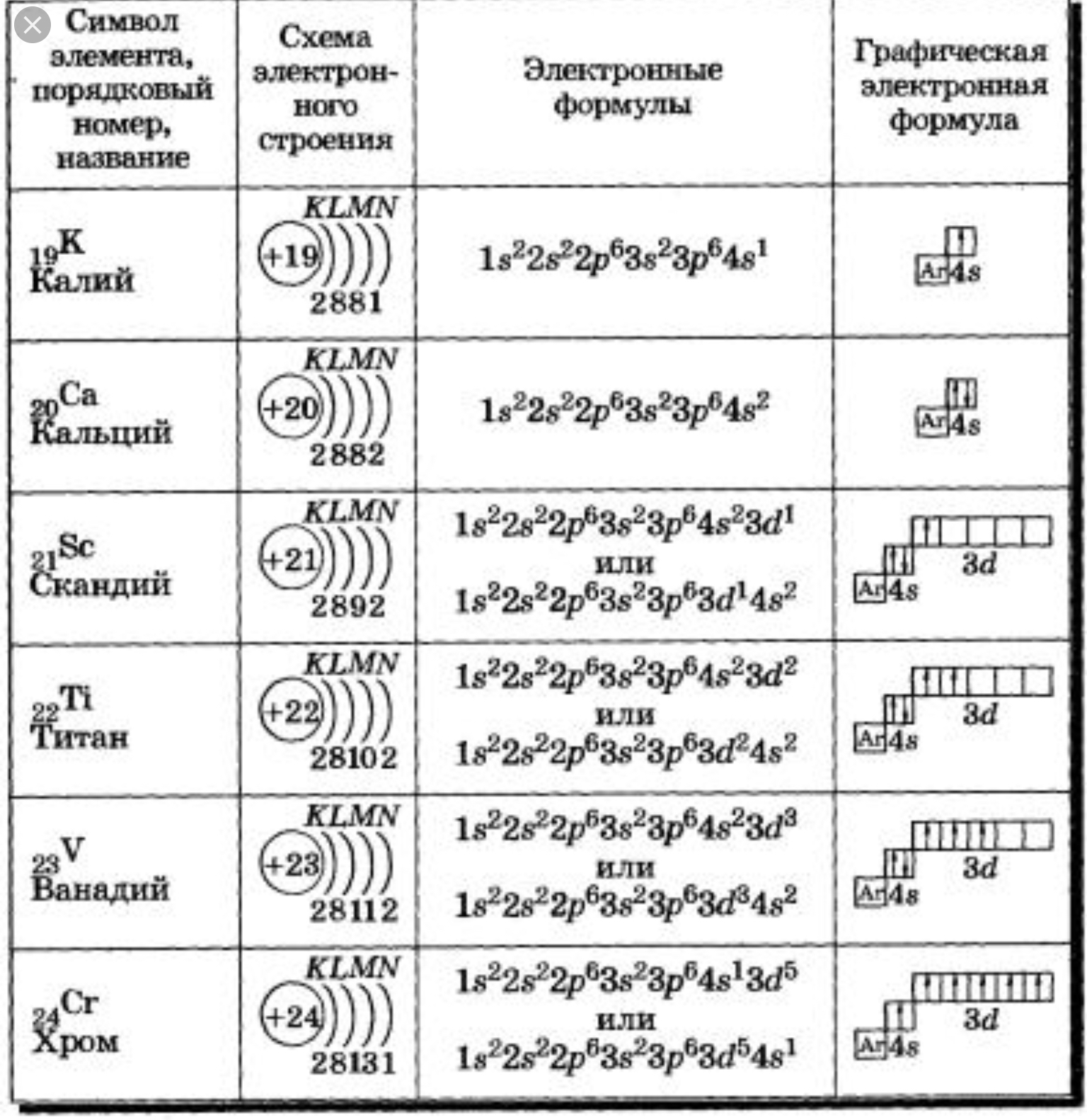 В 1945 г. американские химики Д. Маринский, Л. Гленденин и Ч. Кориэлл выделили прометий из продуктов деления урана с помощью ионообменных смол. В 1947 г., благодаря исследованиям химических свойств прометия, было доказано существование нового элемента
В 1945 г. американские химики Д. Маринский, Л. Гленденин и Ч. Кориэлл выделили прометий из продуктов деления урана с помощью ионообменных смол. В 1947 г., благодаря исследованиям химических свойств прометия, было доказано существование нового элемента
Изотопы
Происхождение названия
От имени мифического героя — титана Прометея , защитника людей, похитившего у Зевса огонь и передавшего его людям.
В 1950 г. Комиссия по атомным весам IUPAC дала элементу 61 название прометий, все старые названия — иллиний, флоренций, циклоний и прометей — были отвергнуты.
Получение
Металлический прометий получают металлотермией из PmF 3 . Выделяется 147 Pm из смеси радиоактивных изотопов различных элементов, образующихся в ядерных реакторах.
Применение
Прометий-147 (период полураспада 2,64 года) испытывает бета-распад в самарий-147 и используется для производства радиоизотопных источников тока , где он применяется в виде оксида Pm 2 O3 , и благодаря тому, что в его излучении при распаде отсутствуют гамма-лучи , он сравнительно безопасен.
Мощность, выделяющаяся в оксиде прометия (при плотности в спеченном состоянии около 6,6 г/см³), приближается к 1,1 Вт/см³.
Используется как добавка в радио люминофоры , заставляя их светиться от β — излучения. При этом, в отличие от возбудителя на базе α-излучения, не приводит к быстрому старению радиолюминофора
Прометий электронное строение – Справочник химика 21
Размещение лантаноидов по группам, сделанное на основании их электронного строения, т. е. по сумме /-, d-, s-электронов вне устойчивых конфигураций, представлено в табл. 3. Цезий, имеющий один электрон на 6 -уровне, относится к I группе, барий с двумя электронами на этом же уровне — ко второй, а лантан (d s ) — к третьей. Церий с двумя электронами на внутренней незаполненной 4/-оболочке и двумя электронами на внешней б8-оболочке является элементом IV группы, празеодим (4/ 6s ) — элементом V группы, неодим (4/ 6s ) — VI группы, прометий (4/ 6s ) —Работы Г.
 Мозли (1887—1915) показали, что действительной основой периодического закона являются не атомные массы, а положительные заряды ядер атомов, численно равные порядковому номеру элемента в периодической системе. На основании периодического закона и работ Г. Мозли был решен важный вопрос о числе еще неоткрытых злементов. Было установлено, например, что между водородом и гелием или между натрием и магнием новых элементов быть не может. Открытие и дальнейшее развитие периодического закона не только избавило исследователей во многих случаях от бесполезной и трудоемкой работы по поиску новых элементов, но и позволило установить число неоткрытых элементов и их порядковые номера в периодической системе. Однако знание только порядкового номера не давало еще оснований помещать элемент в определенную группу периодической системы. Этот вопрос решался с помощью электронной теории строения атома. Применение этой теории показало, например, что неоткрытый элемент № 72 должен быть аналогом циркония, а не лантаноидов.
Мозли (1887—1915) показали, что действительной основой периодического закона являются не атомные массы, а положительные заряды ядер атомов, численно равные порядковому номеру элемента в периодической системе. На основании периодического закона и работ Г. Мозли был решен важный вопрос о числе еще неоткрытых злементов. Было установлено, например, что между водородом и гелием или между натрием и магнием новых элементов быть не может. Открытие и дальнейшее развитие периодического закона не только избавило исследователей во многих случаях от бесполезной и трудоемкой работы по поиску новых элементов, но и позволило установить число неоткрытых элементов и их порядковые номера в периодической системе. Однако знание только порядкового номера не давало еще оснований помещать элемент в определенную группу периодической системы. Этот вопрос решался с помощью электронной теории строения атома. Применение этой теории показало, например, что неоткрытый элемент № 72 должен быть аналогом циркония, а не лантаноидов.
В группу редкоземельных элементов, нлл лантанидов (лантаноидов), входят 14 элементов церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий и лютеций. По числу входящих в нее элементов и по своеобразию их свойств эта группа занимает особое положение в неорганической химии. Весьма интересна и увлекательна даже история открытия входящих в нее элементов, охватывающая почти полтораста лет (церий был открыт в 1803 г., прометий — в 1942—1947 гг.), включающая непрерывное последовательное обнаружение новых элементов в ранее казавшихся индивидуальными препаратах.
Группа актиноидов несомненно аналогична группе лантаноидов. Исходя из электронного строения атомов, каждому лантаноиду отвечает его электронный аналог — актиноид. Это соответствие не строгое, и, конечно, празеодим и протактиний, неодим и уран, прометий и нептуний, самарий и плутоний, европий и америций не являются полными химическими аналогами. Естественно, что оболочка 5/ более лабильна, чем 4/, благодаря этому для актиноидов возможно образование соединений с более выср кой, чем у лантаноидов, степенью окисления.
Прометий, свойства атома, химические и физические свойства
Прометий, свойства атома, химические и физические свойства.
Pm 61 Прометий
144,9127 1s2 2s2 2p6 3s2 3p6 3d
Прометий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 61. Расположен в 3-й группе (по старой классификации — побочной подгруппе третьей группы), шестом периоде периодической системы. Относится к группе лантаноидов.
Атом и молекула прометия. Формула прометия. Строение атома прометия
Изотопы и модификации прометия
Свойства прометия (таблица): температура, плотность, давление и пр.
Физические свойства прометия
Химические свойства прометия. Взаимодействие прометия.
Получение прометия
Применение прометия
Таблица химических элементов Д.И. Менделеева
Атом и молекула прометия. Формула прометия. Строение атома прометия:
Прометий (лат. Promethium, назван по имени мифического героя – титана Прометея) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Pm и атомным номером 61. Расположен в 3-й группе (по старой классификации – побочной подгруппе третьей группы), шестом периоде периодической системы.
Прометий – металл. Относится к редкоземельным элементам, а также к группе переходных металлов и к лантаноидам.
Как простое вещество прометий
Радиоактивен, не имеет стабильных изотопов.
Молекула прометия одноатомна.
Химическая формула прометия Pm.
Электронная конфигурация атома прометия 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f5 5s2 5p6 6s2. Потенциал ионизации (первый электрон) атома прометия равен 538,1 кДж/моль (5,58187(4) эВ).
Строение атома прометия. Атом прометия состоит из положительно заряженного ядра (+61), вокруг которого по шести оболочкам движется 61 электрон. При этом 59 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку прометий расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и пятая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлены s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома прометия на 4f-орбитали находятся четыре неспаренных электрона. На внешнем энергетическом уровне атома прометия на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома прометия состоит из 61 протона и 84 нейтронов. Прометий относится к элементам f-семейства.
На внутреннем энергетическом уровне атома прометия на 4f-орбитали находятся четыре неспаренных электрона. На внешнем энергетическом уровне атома прометия на 6s-орбитали находятся два спаренных электрона. В свою очередь ядро атома прометия состоит из 61 протона и 84 нейтронов. Прометий относится к элементам f-семейства.
Радиус атома прометия (вычисленный) составляет 205 пм.
Атомная масса атома прометия составляет 144,9127 а. е. м.
Прометий в природе встречается только в следовых количествах. По оценкам ученых, его содержание в земной коре составляет несколько сот грамм. Получен путем синтеза.
Изотопы и модификации прометия:
Свойства прометия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Прометий |
| 102 | Прежнее название | |
| 103 | Латинское название | Promethium |
| 104 | Английское название | Promethium |
| 105 | Символ | Pm |
| 106 | Атомный номер (номер в таблице) | 61 |
| 107 | Тип | Металл |
| 108 | Группа | Лантаноид.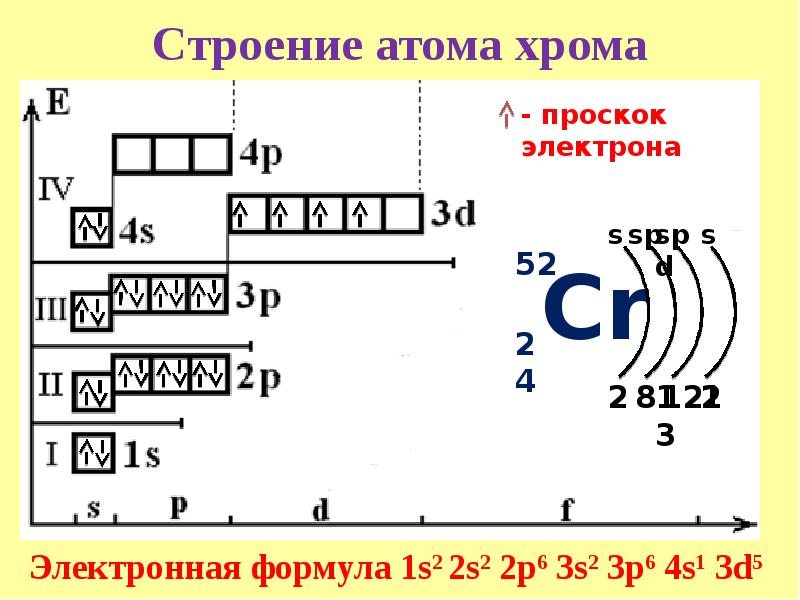 Переходный, радиоактивный, редкоземельный металл Переходный, радиоактивный, редкоземельный металл |
| 109 | Открыт | Чарльз Дюбуа Кориэлл, Лоуренс Элджин Гленденин и Джейкоб Акиба Маринский, США, 1945 г. |
| 110 | Год открытия | 1945 г. |
| 111 | Внешний вид и пр. | Светло-серый, радиоактивный, короткоживущий металл |
| 112 | Происхождение | Получен путем синтеза. В природе встречается только в следовых количествах |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-прометий с двойной гексагональной плотноупакованной кристаллической решёткой, – β-прометий с кубической объёмноцентрированной кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | ~0 % |
| 120 | Содержание в морях и океанах (по массе) | 0 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0 % |
| 122 | Содержание в Солнце (по массе) | 0 % |
| 123 | Содержание в метеоритах (по массе) | 0 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 144,9127 а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f5 5s2 5p6 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N23 O8 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 205 пм |
| 205 | Эмпирический радиус атома* | 185 пм |
| 206 | Ковалентный радиус | 199 пм |
| 207 | Радиус иона (кристаллический) | Pm3+ 111 (6) пм, 123 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 61 электрон, 61 протон, 84 нейтрона |
| 210 | Семейство (блок) | элемент f-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 3-я группа (по старой классификации – побочная подгруппа 3-ей группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | +2, +3 |
| 302 | Валентность | III |
| 303 | Электроотрицательность | 1,1 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 538,1 кДж/моль (5,58187(4) эВ) |
| 305 | Электродный потенциал | Pm3+ + 3e– → Pm, Eo = -2,423 В |
| 306 | Энергия сродства атома к электрону | 50 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 7,26 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 1042 °C (1315 K, 1908 °F) |
| 403 | Температура кипения* | 3000 °C (3273 K, 5432 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 7,13 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 289 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 27,6 Дж/(K·моль) |
| 411 | Молярный объём | 19,96 см³/моль |
| 412 | Теплопроводность | 17,9 Вт/(м·К) (при стандартных условиях), 17,9 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-прометий |
| 512 | Структура решётки | Двойная гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 3,65 Å, c = 11,65 Å |
| 514 | Отношение c/a | 3,19 |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-12-2 |
Примечание:
205* Эмпирический радиус атома прометия согласно [1] и [3] составляет 183 пм.
401* Температура плавления прометия согласно [3] и [4] составляет 1167,85 °C (1441 K, 2134,13 °F) и 1170 °C (1443,15 K, 2138 °F).
402* Температура кипения прометия согласно [3] и [4] составляет ~3000 °C (~3273 K, ~5432 °F) и 3000 °C (3273,15 K, 4940,33 °F) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) прометия согласно [3] составляет 330,5 кДж/моль.
Физические свойства прометия:
Химические свойства прометия. Взаимодействие прометия. Химические реакции с прометием:
Получение прометия:
Применение прометия:
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Promethium
- https://de.wikipedia.org/wiki/Promethium
- https://ru.wikipedia.org/wiki/Прометий
- http://chemister.ru/Database/properties.php?dbid=1&id=271
- https://chemicalstudy.ru/prometiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.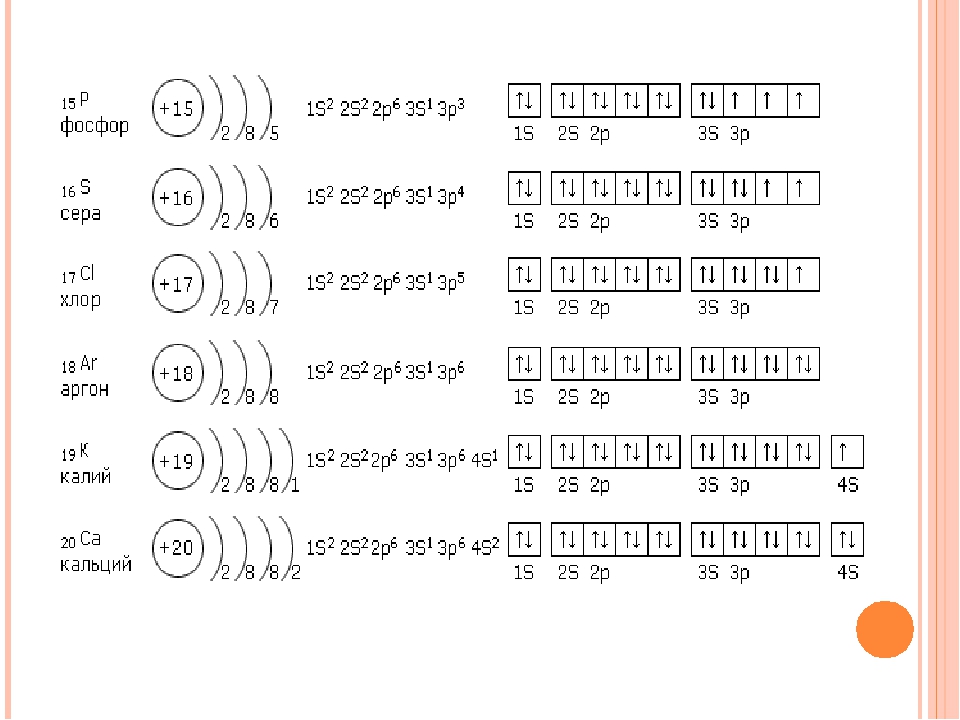 pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
карта сайта
прометий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
Коэффициент востребованности 282
Электронно-графические формулы f-элементов 6 периода. Задача 59
Задача 59.
Напишите электронно-графическую формулу для f-элементов 6-го периода, определите их валентные электроны и охарактеризуйте их с помощью квантовых чисел.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n – главное квантовое число, l – орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение – s, p, d, f), x – число электронов в данном подуровне (орбитали).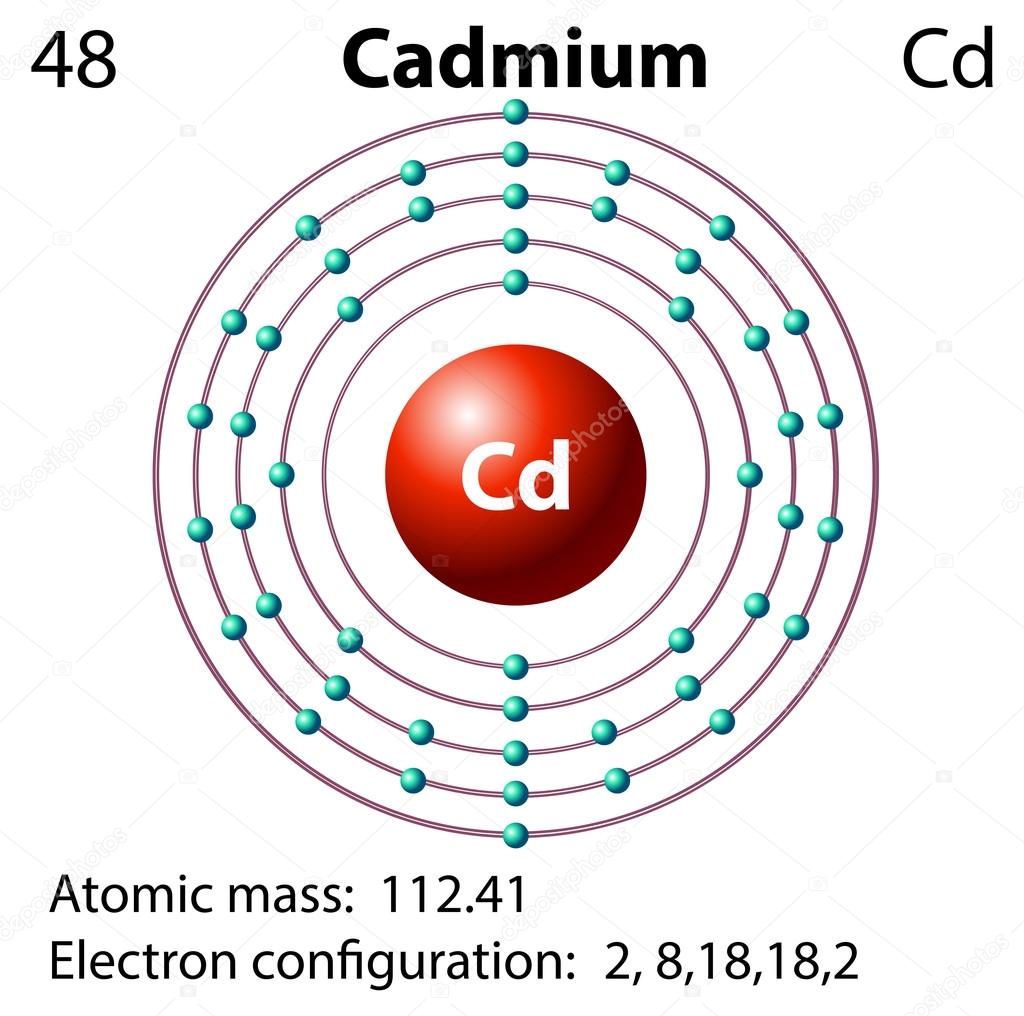 При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n+1 (правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
1s►2s►2р►3s►3р►4s►3d►4р►5s►4d►5р►6s►(5d1)►4f►5d►6р►7s►(6d1-2)►5f►6d►7р
а) Элемент № 58
Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для 58 элемента – церия (Ce – порядковый № 58) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f2
Поскольку при большой энергетической близости 4f- и 5d-состояний для лантаноидов 4f-состояние оказывается энергетически более выгодным. Поэтому у церия электрон с 5d1- состояния переходит в 4f-состояние. Согласно правилу Хунда у церия электрон с 5d-подуровня заполняет вторую ячейку на 4f-подуровне.
Согласно правилу Хунда у церия электрон с 5d-подуровня заполняет вторую ячейку на 4f-подуровне.
Валентными электронами церия, как и всех лантаноидов обычно являются 5d1 и 6s2, но иногда у церия валентными электронами являются электроны в 6s2 и 4f2– состоянии. На валентной орбитали атома Ce в норме находится 3 электрона. Поэтому элемент помещают в третью группу периодической системы Д.И.Менделеева. Церий является f-элементом семейства лантаноидов.
б) Элемент № 59
Для элемента № 59 – празеодима (Pr – порядковый № 59) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f3
Валентные электроны празеодима 6s2 и 4f3 – находятся на 6s- и 4f-подуровнях. Энергетически выгодным состоянием празеодима является 6s2 4f3-состояние валентного слоя его атома. На валентной орбитали атома Pr находятся 3 электрона. Празеодим является f-элементом семейства лантаноидов.
Энергетически выгодным состоянием празеодима является 6s2 4f3-состояние валентного слоя его атома. На валентной орбитали атома Pr находятся 3 электрона. Празеодим является f-элементом семейства лантаноидов.
в) Элемент № 60
Для элемента № 60- неодима (Nd – порядковый № 60) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f4
Валентные электроны неодима 6s2 4f4 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Nd находится 6 электронов. Неодим является f-элементом семейства лантаноидов.
г) Элемент № 61
Для элемента № 61 – прометия (Pm – порядковый № 61) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f5
Валентные электроны прометия 6s2 и 4f5 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Hf находится 7 электронов. Прометий является f-элементом семейства лантаноидов.
На валентных орбиталях атома Hf находится 7 электронов. Прометий является f-элементом семейства лантаноидов.
д) Элемент № 62
Для элемента № 62- самария (Sm – порядковый № 62) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f6
Валентные электроны ниобия 6s2 4f5 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Sm находится 8 электронов. Самарий является f-элементом семейства лантаноидов.
е) Элемент № 63 – европия (Eu – порядковый № 63) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f7
Валентные электроны европия 6s2 4f7 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Eu находится 9 электронов. Европий является f-элементом семейства лантаноидов.
На валентных орбиталях атома Eu находится 9 электронов. Европий является f-элементом семейства лантаноидов.
ж) Элемент № 64 – гадолиния (Gd – порядковый № 64) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f7 5d1
Валентные электроны гадолиния 6s2 4f7 5d1 – находятся на 6s-, 4f- и 5d-подуровнях. На валентных орбиталях атома Gd находится 10 электронов. Поскольку у гадолиния 4f7-состояние стабильно и, следующий электрон располагается на 5d-подуровне. Поэтому конфигурация валентной оболочки атома гадолиния 6s2 4f7 5d1 энергетически более выгодна, чем 6s2 4f7. Гадолинием заканчивается первый ряд лантаноидов.
з) Элемент № 65 тербий (Tb – порядковый № 65) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f9
Валентные электроны тербия 6s2 4f9 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Tb находится 11 электронов. У атома тербия валентное состояние 6s2 4f9 энергетически выгоднее, чем 6s2 4f7 5d2. Поэтому у тербия начинается заполнение 4f-орбиталей по второму электрону, срузу 2 электрона с 5d-подуровня переходят на 4f-подуровень. Тербием начинается второй ряд лантаноидов.
к) Элемент № 66 – диспрозий (Dy – порядковый № 66) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f10
Валентные электроны диспрозия 6s2 4f10 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Dy находится 12 электронов. Диспрозий является элементом второго ряда лантаноидов.
На валентных орбиталях атома Dy находится 12 электронов. Диспрозий является элементом второго ряда лантаноидов.
л) Элемент № 67 – гольмий (Ho – порядковый № 67) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f11
Валентные электроны гольмия 6s2 4f11 – находятся на 6s- и 4f-подуровне. На валентной орбитали атома Ho находится 13 электронов. Гольмий является элементом второго ряда лантаноидов.
м) Элемент № 68 – эрбий (Er – порядковый № 68) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f12
Валентные электроны эрбия 6s2 4f12 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Er находится 14 электронов. Эрбий является элементом второго ряда лантаноидов.
На валентных орбиталях атома Er находится 14 электронов. Эрбий является элементом второго ряда лантаноидов.
н) Элемент № 69 – тулий (Tm – порядковый № 69) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f13
Валентные электроны тулия 6s2 4f13 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Tm находится 15 электронов. Тулий является элементом второго ряда лантаноидов.
о) Элемент № 70 – иттербий (Yb – порядковый № 70) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14
Валентные электроны иттербия 6s2 4f14 – находятся на 6s- и 4f-подуровнях. На валентных орбиталях атома Yb находится 16 электронов. У иттербия происходит полное заполнение электронами 4f-подуровня, т.е. образуется сверхустойчивое 6s2 4f14-состояние. Иттербий является элементом второго ряда лантаноидов.
На валентных орбиталях атома Yb находится 16 электронов. У иттербия происходит полное заполнение электронами 4f-подуровня, т.е. образуется сверхустойчивое 6s2 4f14-состояние. Иттербий является элементом второго ряда лантаноидов.
п) Элемент № 71 – лютеций (Lu – порядковый № 71) электронная формула имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4р6 5s2 4d10 5p6 6s2 4f14 5d1
Валентные электроны лютеция 6s2 4f14 5d1 – находятся на 6s-, 4f- и 5d-подуровнях. На валентных орбиталях атома Lu находится 17 электронов. Дополнительный электрон (сверхустойчивой конфигурации s2 и f14) у лютеция, как и у лантана и кадмия, находится в 5d-состоянии. Поэтому лютецием заканчивается ряд лантаноидов.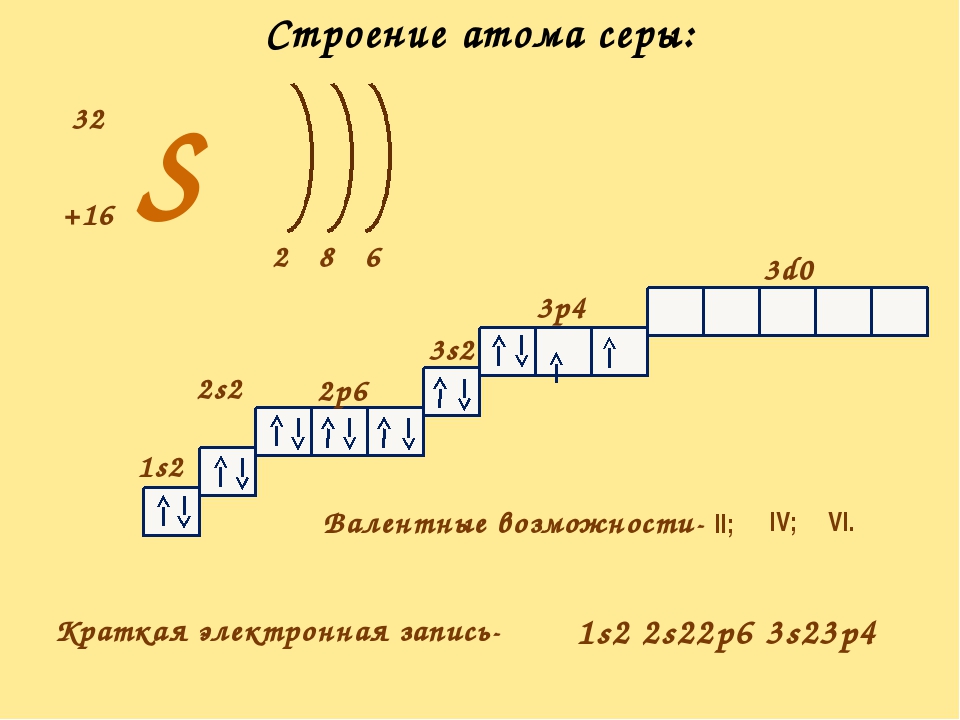
Таким образом, у лантаноидов при незначительном возбуждении один из 4f-электронов (очень редко два) переходят в 5d-состояние. Остальные же 4f-электроны, экранированные от внешнего воздействия 5s2 5p6-электронами, на химические свойства некоторых лантаноидов существенного влияния не оказывают. Поэтому свойства лантаноидов в основном определяют 6s2 5d1. Такие элементы как Pr, Pm, Gd, Dy, Но, Er и Lu проявляют как и La степень окисления равную +3; Се Nd и Tb – проявляют степень окисления равную +3 и +4; Sm, Eu, Tm и Yb – степень окисления равную +2 и +3. Все лантаноиды проявляют большое сходство с элементами 3-й группы скандием и его аналогами. Наибольшее сходство лантаноиды проявляют с иттрием и лантаном, атомные и ионные радиусы и имеют близкое значение. Так как отличие в структуре атомов элементов семейства проявляется лишь в 4f-подуровне, очень мало влияющем на химические свойства элементов, лантаноиды сходны по свойствам друг с другом.
При исключительной близости некоторые свойства лантаноидов все же изменяются монотонно в ряду Се – Lu, другие – периодически. Постепенное уменьшение радиусов атомов и ионов в ряду Се – Lu называется “лантаноидным сжатием”, объясняет монотонное изменение свойств элементов семейства.
Периодический характер заполнения 4f-орбиталей сначала по одному, а затем по два электрона предопределяет внутреннюю периодичность в изменении свойств лантаноидов и их соединений.
Элементы семейства лантаноидов встречаются в природе всегда вместе друг с другом, как с лантаном, так и с иттрием. Прометий – радиоактивный элемент, который практически в природе не встречается.
Электронные формулы атомов химических элементов
Электронные формулы атомов химических элементов, слои расположены в порядке заполнения подуровней. Электронные слои атомов заполняются электронами в порядке, согласно правилу Клечковского.
Порядок заполнения атомных орбиталей по мере увеличения энергии следующий: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f ≈ 5d < 6p < 7s < 5f ≈ 6d < 7p < 8s. При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного (орбитального) квантового числа l , т.е. n + l , имеет меньшее значение.
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного (орбитального) квантового числа l , т.е. n + l , имеет меньшее значение.
| s-элементы | d-элементы | f-элементы | p-элементы |
| № | Знак | Элемент | Электронная формула |
| I период | |||
| 1 | H | водород | 1s1 |
| 2 | He | гелий | 1s2 |
| № | Знак | Элемент | Электронная формула |
| II период | |||
| 3 | Li | литий | 1s2 2s1 |
| 4 | Be | бериллий | 1s2 2s2 |
| 5 | B | бор | 1s2 2s2 2p1 |
| 6 | C | углерод | 1s2 2s2 2p2 |
| 7 | N | азот | 1s2 2s2 2p3 |
| 8 | O | кислород | 1s2 2s2 2p4 |
| 9 | F | фтор | 1s2 2s2 2p5 |
| 10 | Ne | неон | 1s2 2s2 2p6 |
| № | Знак | Элемент | Электронная формула |
| III период | |||
| 11 | Na | натрий | 1s2 2s2 2p6 3s1 |
| 12 | Mg | магний | 1s2 2s2 2p6 3s2 |
| 13 | Al | алюминий | 1s2 2s2 2p6 3s2 3p1 |
| 14 | Si | кремний | 1s2 2s2 2p6 3s2 3p2 |
| 15 | P | фосфор | 1s2 2s2 2p6 3s2 3p3 |
| 16 | S | сера | 1s2 2s2 2p6 3s2 3p4 |
| 17 | Cl | хлор | 1s2 2s2 2p6 3s2 3p5 |
| 18 | Ar | аргон | 1s2 2s2 2p6 3s2 3p6 |
| № | Знак | Элемент | Электронная формула |
| IV период | |||
| 19 | K | калий | 1s2 2s2 2p6 3s2 3p6 4s1 |
| 20 | Ca | кальций | 1s2 2s2 2p6 3s2 3p6 4s2 |
| 21 | Sc | скандий | 1s2 2s2 2p6 3s2 3p6 4s2 3d1 |
| 22 | Ti | титан | 1s2 2s2 2p6 3s2 3p6 4s2 3d2 |
| 23 | V | ванадий | 1s2 2s2 2p6 3s2 3p6 4s2 3d3 |
| 24 | Cr | хром | 1s2 2s2 2p6 3s2 3p6 4s1 3d5 |
| 25 | Mn | марганец | 1s2 2s2 2p6 3s2 3p6 4s2 3d5 |
| 26 | Fe | железо | 1s2 2s2 2p6 3s2 3p6 4s2 3d6 |
| 27 | Co | кобальт | 1s2 2s2 2p6 3s2 3p6 4s2 3d7 |
| 28 | Ni | никель | 1s2 2s2 2p6 3s2 3p6 4s2 3d8 |
| 29 | Cu | медь | 1s2 2s2 2p6 3s2 3p6 4s1 3d10 |
| 30 | Zn | цинк | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 |
| 31 | Ga | галлий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p1 |
| 32 | Ge | германий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2 |
| 33 | As | мышьяк | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 |
| 34 | Se | селен | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 |
| 35 | Br | бром | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 |
| 36 | Kr | криптон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 |
| № | Знак | Элемент | Электронная формула |
| V период | |||
| 37 | Rb | рубидий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 |
| 38 | Sr | стронций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 |
| 39 | Y | иттрий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1 |
| 40 | Zr | цирконий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2 |
| 41 | Nb | ниобий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d4 |
| 42 | Mo | молибден | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5 |
| 43 | Tc | технеций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5 |
| 44 | Ru | рутений | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d7 |
| 45 | Rh | родий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d8 |
| 46 | Pd | палладий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s0 4d10 |
| 47 | Ag | серебро | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 |
| 48 | Cd | кадмий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 |
| 49 | In | индий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1 |
| 50 | Sn | олово | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2 |
| 51 | Sb | сурьма | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s22 4d10 5p3 |
| 52 | Te | теллур | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4 |
| 53 | I | йод | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5 |
| 54 | Xe | ксенон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 |
| № | Знак | Элемент | Электронная формула |
| VI период | |||
| 55 | Cs | цезий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 |
| 56 | Ba | барий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 |
| 57 | La | лантан | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 |
| 58 | Ce | церий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f2 |
| 59 | Pr | празеодим | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f3 |
| 60 | Nd | неодим | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4 |
| 61 | Pm | прометий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f5 |
| 62 | Sm | самарий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f6 |
| 63 | Eu | европий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 |
| 64 | Gd | гадолиний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 5d1 |
| 65 | Tb | тербий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f9 |
| 66 | Dy | диспрозий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f10 |
| 67 | Ho | гольмий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f11 |
| 68 | Er | эрбий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12 |
| 68 | Tm | тулий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f13 |
| 70 | Yb | иттербий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 |
| 71 | Lu | лютеций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d1 |
| 72 | Hf | гафний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 |
| 73 | Ta | тантал | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d3 |
| 74 | W | вольфрам | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4 |
| 75 | Re | рений | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d5 |
| 76 | Os | осмий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d6 |
| 77 | Ir | иридий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d7 |
| 78 | Pt | платина | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d9 |
| 79 | Au | золото | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d10 |
| 80 | Hg | ртуть | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 |
| 81 | Tl | таллий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p1 |
| 82 | Pb | свинец | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p2 |
| 83 | Bi | висмут | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p3 |
| 84 | Po | полоний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p4 |
| 85 | At | астат | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p5 |
| 86 | Rn | радон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 5p6 6s2 4f14 5d10 6p6 |
| № | Знак | Элемент | Электронная формула |
| VII период | |||
| 87 | Fr | франций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1 |
| 88 | Ra | радий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 |
| 89 | Ac | актиний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d1 |
| 90 | Th | торий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d2 5f0 |
| 91 | Pa | протактиний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f2 6d1 |
| 92 | U | уран | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f3 6d1 |
| 93 | Np | нептуний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f4 6d1 |
| 94 | Pu | плутоний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f5 6d1 |
| 95 | Am | америций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f7 |
| 96 | Cm | кюрий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f7 6d1 |
| 97 | Bk | берклий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f8 6d1 |
| 98 | Cf | калифорний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f10 |
| 99 | Es | эйнштейний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f11 |
| 100 | Fm | фермий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f12 |
| 101 | Md | менделеевий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f13 |
| 102 | No | нобелий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 |
| 103 | Lr | лоуренсий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d1 |
| 104 | Rf | резерфордий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d2 |
| 105 | Db | дубний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d3 |
| 106 | Sg | сиборгий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d4 |
| 107 | Bh | борий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d5 |
| 108 | Hs | хассий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d6 |
| 109 | Mt | мейтнерий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d7 |
| 110 | Ds | дармштадтий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d8 |
| 111 | Rg | рентгений | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d9 |
| 112 | Cn | коперниций | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 |
| 113 | Nh | нихоний | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p1 |
| 114 | Fl | флеровий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2 |
| 115 | Mс | московий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p3 |
| 116 | Lv | ливерморий | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p4 |
| 117 | Ts | теннесcин | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p5 |
| 118 | Og | оганесон | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6 |
Электронные конфигурации элементов со 105 по 118
Электронные конфигурации элементов со 105 по 118 приведены согласно данных сайта WebElements
- 105 Db : [Rn].
 5f14.6d3.7s2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2
5f14.6d3.7s2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2 - 106 Sg : [Rn].5f14.6d4.7s2 (догадка, основанная на электронной конфигурации вольфрама) ; 2.8.18.32.32.12.2
- 107 Bh : [Rn].5f14.6d5.7s2 (догадка, основанная на электронной конфигурации рения) ; 2.8.18.32.32.13.2
- 108 Hs : [Rn].5f14.6d6.7s2 (догадка, основанная на электронной конфигурации осмия) ; 2.8.18.32.32.14.2
- 109 Mt : [Rn].5f14.6d7.7s2 (догадка, основанная на электронной конфигурации иридия) ; 2.8.18.32.32.15.2
- 110 Ds : [Rn].5f14.6d9.7s1 (догадка, основанная на электронной конфигурации платины) ; 2.8.18.32.32.17.1
- 111 Rg : [Rn].5f14.6d10.7s1 (догадка, основанная на электронной конфигурации золота) ; 2.8.18.32.32.18.
 1
1 - 112 Cn : [Rn].5f14.6d10.7s2 (догадка, основанная на электронной конфигурации ртути) ; 2.8.18.32.32.18.2
- 113 Uut : [Rn].5f14.6d10.7s2.7p1 (догадка, основанная на электронной конфигурации таллия) ; 2.8.18.32.32.18.3
- 114 Fl : [Rn].5f14.6d10.7s2.7p2 (догадка, основанная на электронной конфигурации свинца) ; 2.8.18.32.32.18.4
- 115 Uup : [Rn].5f14.6d10.7s2.7p3 (догадка, основанная на электронной конфигурации висмута) ; 2.8.18.32.32.18.5
- 116 Lv : [Rn].5f14.6d10.7s2.7p4 (догадка, основанная на электронной конфигурации полония) ; 2.8.18.32.32.18.6
- 117 Uus : [Rn].5f14.6d10.7s2.7p5 (догадка, основанная на электронной конфигурации астата) ; 2.8.18.32.32.18.7
- 118 Uuo : [Rn].5f14.
 6d10.7s2.7p6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8
6d10.7s2.7p6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8
Эмпирическое правило Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами орбиталей 4f, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Источники:
- Atomic, Molecular, & Optical Physics Handbook, Ed.
 Gordon W. F. Drake, American Institute of Physics, Woodbury, New York, USA, 1996.
Gordon W. F. Drake, American Institute of Physics, Woodbury, New York, USA, 1996. - R.L. DeKock and H.B. Gray in Chemical Structure and bonding, Benjamin/Cummings, Menlo Park, California, USA, 1980.
- A.M. James and M.P. Lord in Macmillan’s Chemical and Physical Data, Macmillan, London, UK, 1992.
- J.E. Huheey, E.A. Keiter, and R.L. Keiter in Inorganic Chemistry : Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA, 1993.
Прометий
| Прометий | |
|---|---|
| Атомный номер | 61 |
| Внешний вид простого вещества | неизвестен |
| Свойства атома | |
|
Атомная масса (молярная масса) |
144,9127 а. е. м. (г/моль) е. м. (г/моль) |
| Радиус атома | n/a пм |
|
Энергия ионизации (первый электрон) |
536,0(5,56) кДж/моль (эВ) |
| Электронная конфигурация | [Xe] 4f5 6s2 |
| Химические свойства | |
| Ковалентный радиус | 163 пм |
| Радиус иона | (+3e)97,9 пм |
|
Электроотрицательность (по Полингу) |
1,1 |
| Электродный потенциал | Pm←Pm3+ -2,29В |
| Степени окисления | 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,2 г/см³ |
| Молярная теплоёмкость | 27,6Дж/(K·моль) |
| Теплопроводность | 17,9 Вт/(м·K) |
| Температура плавления | 1441 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 3000 K |
| Теплота испарения | n/a кДж/моль |
| Молярный объём | n/a см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | |
| Параметры решётки | n/a Å |
| Отношение c/a | n/a |
| Температура Дебая | n/a K |
| Pm | 61 |
| 144,9127 | |
| 4f56s2 | |
| Прометий | |
Прометий — химический элемент, относящийся к группе лантаноидов. В природе практически не встречается, так как все его изотопы радиоактивны. Впервые был получен искусственно в 1945 году.
В природе практически не встречается, так как все его изотопы радиоактивны. Впервые был получен искусственно в 1945 году.
История
Прометий как короткоживущий радиоактивный элемент находится в природе в исчезающих количествах (780 грамм) и не мог быть открыт аналитическим способом несмотря на усилия многих исследователей.
Только в 1945 г. американские химики Д. Маринский, Л. Гленденин и Ч. Кориэлл выделили прометий из продуктов деления урана с помощью ионообменных смол.
Происхождение названия
От имени мифического героя Прометея, похитившего у Зевса огонь и передавшего его людям.
Получение
Металлический прометий получают металлотермией из PmF3. Выделяется 147Pm из смеси радиоактивных изотопов различных элементов, образующихся в ядерных реакторах.
Применение
Прометий-147 (период полураспада 2,64 года) используется для производства радиоизотопных источников тока, где он применяется в виде окиси, и благодаря тому что в его излучении при распаде отстутствуют гамма-лучи, он сравнительно безопасен.
Мощность выделяющаяся в оксиде прометия(при плотности в спеченном состоянии около 6,6 г/см) приближается к 1,1 Вт/см³. Самый долгоживущий изотоп — прометий-145 (период полураспада 18 лет).
Строение атома. Есть ли предел таблицы Менделеева? реферат по естествознанию
Пермский государственный педагогический университет Реферат по теме Эволюция представлений о строении атома. Есть ли предел системе элементов Менделеева? Выполнил студент 141 группы Попов Илья Пермь 2002 ОГЛАВЛЕНИЕ 1 Возникновение атомистики…………………………………………………………………………………………………………………….. 3 1.1 Атомистика в послеаристотелевскую эпоху…………………………………………………………………………………………….. 5 1.2 Дальнейшее развитие атомистики (XIX в.)………………………………………………………………………………………………. 5 2 Периодический закон. Есть ли граница системы элементов Менделеева?…………………………………………………. 6 2.1 Интерпретация периодического закона……………………………………………………………………………………………………. 10 3 Aтом Резерфорда-Бора……………………………………………………………………………………………………………………………. 10 3.1 Модели atоma до бора…………………………………………………………………………………………………………………………….. 10 3.2 Открытие атомного ядра…………………………………………………………………………………………………………………………. 11 3.3 Atom бора………………………………………………………………………………………………………………………………….. 13 4 Возникновение квантовой механики (1925— 1930 гг)…………
Есть ли граница системы элементов Менделеева?…………………………………………………. 6 2.1 Интерпретация периодического закона……………………………………………………………………………………………………. 10 3 Aтом Резерфорда-Бора……………………………………………………………………………………………………………………………. 10 3.1 Модели atоma до бора…………………………………………………………………………………………………………………………….. 10 3.2 Открытие атомного ядра…………………………………………………………………………………………………………………………. 11 3.3 Atom бора………………………………………………………………………………………………………………………………….. 13 4 Возникновение квантовой механики (1925— 1930 гг)…………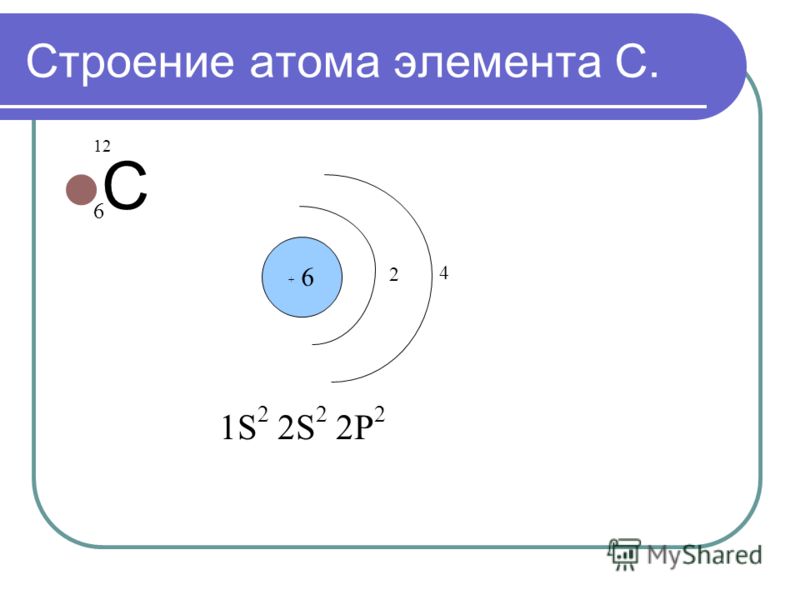 …………………………………………………………………… 16 4.1 Трудности теории бора……………………………………………………………………………………………………………………………. 16 4.2 Идеи де Бройля………………………………………………………………………………………………………………………………….. 17 4.3 Открытие спина………………………………………………………………………………………………………………………………….. 18 5 Список использованной литературы……………………………………………………………………………………………………….. 18 2 Атомистика в послеаристотелевскую эпоху 0 0 1 FВойны Александра Македонского изменили лицо древнего мира и при вели в соприкосновение 0 0 1 F 0 0 1 Fгреческую и восточную цивилизации. Из этого кон такта возник сплав культуры, игра ющий большую роль в мировой истории.
…………………………………………………………………… 16 4.1 Трудности теории бора……………………………………………………………………………………………………………………………. 16 4.2 Идеи де Бройля………………………………………………………………………………………………………………………………….. 17 4.3 Открытие спина………………………………………………………………………………………………………………………………….. 18 5 Список использованной литературы……………………………………………………………………………………………………….. 18 2 Атомистика в послеаристотелевскую эпоху 0 0 1 FВойны Александра Македонского изменили лицо древнего мира и при вели в соприкосновение 0 0 1 F 0 0 1 Fгреческую и восточную цивилизации. Из этого кон такта возник сплав культуры, игра ющий большую роль в мировой истории.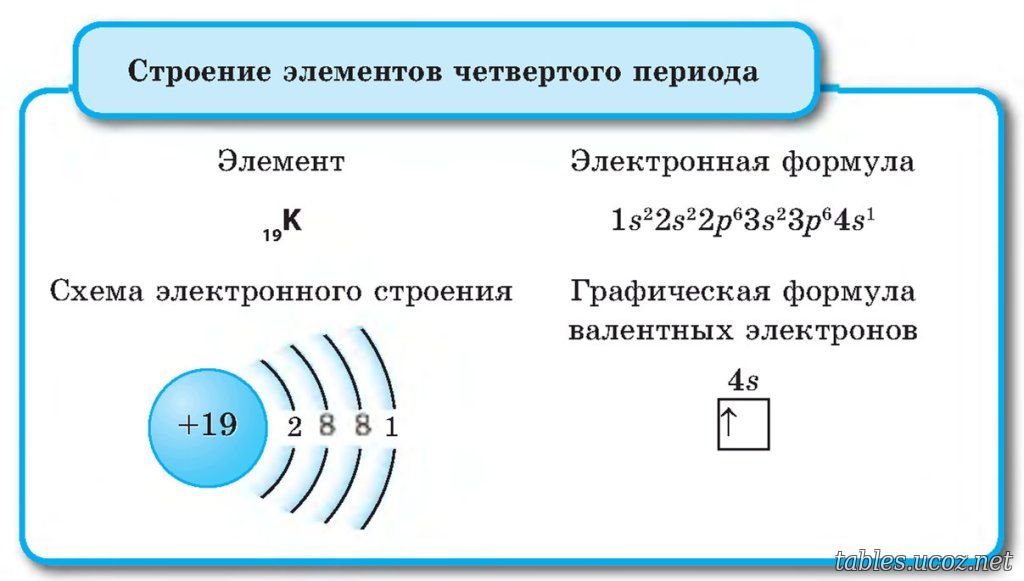 0 0 1 F 0 0 1 FВ истории науки и культуры древ него мира начался новый период, полу чивший название 0 0 1 Fэллинистического, продолжавшийся от образования эллинистических госу дарств (конец IV—начало III в. до н.э.). Последним блестящий представитель афинской науки был Эпикур (341—270 гг. до н. э.), развивший 0 0 1 Fучение Демокрита о при роде. Учение Эпикура о природе основано на концепции атомов Демокрита, но несколько отличном. 0 0 1 FЗначителен размах атомной теории. Существованием атомов Эпи кур, а за ним и Лукреций пытаются 0 0 1 Fобъяснить все естественные, психиче ские и социальные явления. Само представление об атомах выводится из хорошо известных фактов. Так, белье сохнет потому, что под действием солнца и ветра от него отрываются невидимые частицы воды, рука медной статуи у городских ворот, к которой прикасаются 0 0 1 Fв поцелуе губы входя щих в город, заметно тоньше по сравнению с другой рукой, так как при поцелуе губы уносят частицы меди. Атомы находятся в беспорядочном движении, и Лукреций рисует модель движения атомов, уподобляя 0 0 1 Fего дви жению пылинок в солнечном луче, ворвавшемся в темную комнату.
0 0 1 F 0 0 1 FВ истории науки и культуры древ него мира начался новый период, полу чивший название 0 0 1 Fэллинистического, продолжавшийся от образования эллинистических госу дарств (конец IV—начало III в. до н.э.). Последним блестящий представитель афинской науки был Эпикур (341—270 гг. до н. э.), развивший 0 0 1 Fучение Демокрита о при роде. Учение Эпикура о природе основано на концепции атомов Демокрита, но несколько отличном. 0 0 1 FЗначителен размах атомной теории. Существованием атомов Эпи кур, а за ним и Лукреций пытаются 0 0 1 Fобъяснить все естественные, психиче ские и социальные явления. Само представление об атомах выводится из хорошо известных фактов. Так, белье сохнет потому, что под действием солнца и ветра от него отрываются невидимые частицы воды, рука медной статуи у городских ворот, к которой прикасаются 0 0 1 Fв поцелуе губы входя щих в город, заметно тоньше по сравнению с другой рукой, так как при поцелуе губы уносят частицы меди. Атомы находятся в беспорядочном движении, и Лукреций рисует модель движения атомов, уподобляя 0 0 1 Fего дви жению пылинок в солнечном луче, ворвавшемся в темную комнату. Это первая в истории науки 0 0 1 Fкартина моле кулярного движения, написанная древним автором. Само хаотическое движение атомов 0 0 1 FЭпикур объясняет иначе, чем Демокрит. Эпикур не признает различия в ско рости падения малых и 0 0 1 Fбольших ато мов; в пустом пространстве все частицы движутся с одинаковой скоростью. Но в некоторые 0 0 1 Fмоменты самопроиз вольно возникают случайные небольшие отклонения той или иной частицы от прямолинейного пути. Эти отклонения Эпикур считал необходимыми, чтобы объяснить свободную волю людей, так что атомы как бы также обладают некоей «свободой воли». Гениальные догадки древних атомистов предопределили будущий успех атомной теории материи. Атомистика Эпикура — Лукреция продолжала линию научного развития доаристотелевского периода. Но атомистика послеаристотелевской эпохи носит и существенно новые черты: она более конкретна, более 0 0 1 F«физична», чем теория Аристотеля и атомистика Демокрита. Атомы Де мокрита по существу чисто 0 0 1 Fгеометри ческие образы, они характеризуются только формой и объемом.
Это первая в истории науки 0 0 1 Fкартина моле кулярного движения, написанная древним автором. Само хаотическое движение атомов 0 0 1 FЭпикур объясняет иначе, чем Демокрит. Эпикур не признает различия в ско рости падения малых и 0 0 1 Fбольших ато мов; в пустом пространстве все частицы движутся с одинаковой скоростью. Но в некоторые 0 0 1 Fмоменты самопроиз вольно возникают случайные небольшие отклонения той или иной частицы от прямолинейного пути. Эти отклонения Эпикур считал необходимыми, чтобы объяснить свободную волю людей, так что атомы как бы также обладают некоей «свободой воли». Гениальные догадки древних атомистов предопределили будущий успех атомной теории материи. Атомистика Эпикура — Лукреция продолжала линию научного развития доаристотелевского периода. Но атомистика послеаристотелевской эпохи носит и существенно новые черты: она более конкретна, более 0 0 1 F«физична», чем теория Аристотеля и атомистика Демокрита. Атомы Де мокрита по существу чисто 0 0 1 Fгеометри ческие образы, они характеризуются только формой и объемом.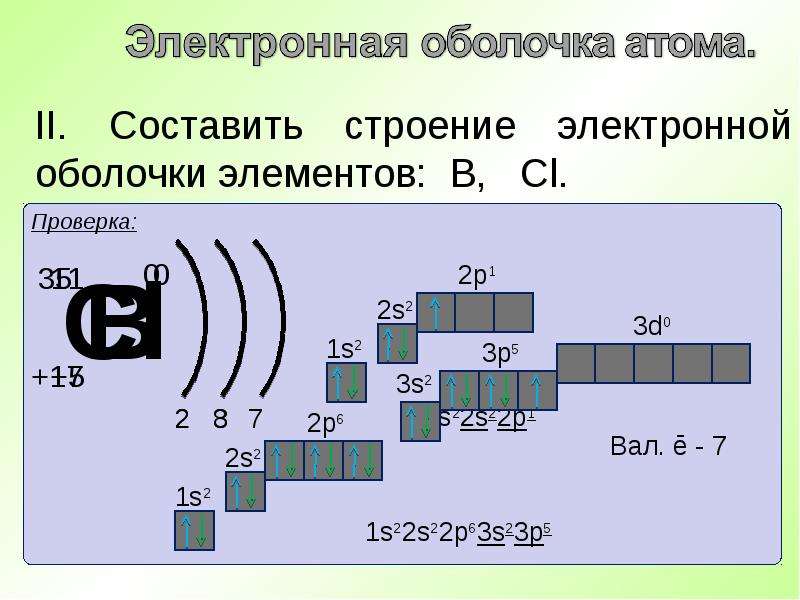 У Эпикура и Лукреция атомы 0 0 1 Fобладают весом, плотностью (твердостью) и, наконец, внутренней способностью к само произвольным 0 0 1 Fотклонениям от пря молинейного движения. 0 0 1 FЕстествознание в эту эпоху стало переходить из сферы отвлеченно го, философского размышления о природе в сферу конкретных фактов и явлений. Евклид (жил в III 0 0 1 F 0 0 1 F в. до н.э.) подыто жил и систематизировал математичес кие знания своих предшественников, из коих его учителем был знаменитый ученый Евдокс Книдский. «Начала» Евклида 0 0 1 Fпредставляют собой изложе ние той геометрии, которая известна и поныне под названием евклидовой геометрии. 0 0 1 FЕвклидово пространство пустое, безгра ничное, изотропное, имеющее три измерения. Евклид придал 0 0 1 F 0 0 1 Fмате матическую определенность атомис тической идее пустого пространства, в котором движутся 0 0 1 F 0 0 1 Fатомы. Простей шим геометрическим объектом у Ев клида является точка, которую он определяет как то, что не имеет частей. Другими словами, точка— это неделимый атом пространства.
У Эпикура и Лукреция атомы 0 0 1 Fобладают весом, плотностью (твердостью) и, наконец, внутренней способностью к само произвольным 0 0 1 Fотклонениям от пря молинейного движения. 0 0 1 FЕстествознание в эту эпоху стало переходить из сферы отвлеченно го, философского размышления о природе в сферу конкретных фактов и явлений. Евклид (жил в III 0 0 1 F 0 0 1 F в. до н.э.) подыто жил и систематизировал математичес кие знания своих предшественников, из коих его учителем был знаменитый ученый Евдокс Книдский. «Начала» Евклида 0 0 1 Fпредставляют собой изложе ние той геометрии, которая известна и поныне под названием евклидовой геометрии. 0 0 1 FЕвклидово пространство пустое, безгра ничное, изотропное, имеющее три измерения. Евклид придал 0 0 1 F 0 0 1 Fмате матическую определенность атомис тической идее пустого пространства, в котором движутся 0 0 1 F 0 0 1 Fатомы. Простей шим геометрическим объектом у Ев клида является точка, которую он определяет как то, что не имеет частей. Другими словами, точка— это неделимый атом пространства. Дальнейшее развитие атомистики (XIX в.) 0 0 1 FВсеобъемлемость принципов термо динамики, открытых и разработанных к этому времени и, в частности, второго начала, заставляла физиков-теоретиков искать причины универсальной мощи термодинамики. 0 0 1 FВ результате в науке возникли два направления: феноме нологическое и атомистическое. 0 0 1 F 0 0 1 F 0 0 1 FФено менологическое направление не счи тало необходимым искать более глубо ких причин физических 0 0 1 F 0 0 1 Fпроцессов, оно ограничивало задачу изучения приро ды описанием явлений на основе экс периментально 0 0 1 F 0 0 1 Fустановленных принци пов. Энергетики Гельм, Оствальд и другие считали энергию основным по нятием 0 0 1 Fнауки, а такие понятия, как «ма терия», «сила», производными и даже излишними. 0 0 1 F 0 0 1 FЧто касается представления об ато мах и молекулах, то энергетики, а так же венский физик Эрнст 0 0 1 F 0 0 1 FМах, один из видных сторонников феноменологи ческого направления, считали эти пред ставления 0 0 1 Fпродуктами чистой фанта зии, аналогичными представлениям о ведьмах и привидениях.
Дальнейшее развитие атомистики (XIX в.) 0 0 1 FВсеобъемлемость принципов термо динамики, открытых и разработанных к этому времени и, в частности, второго начала, заставляла физиков-теоретиков искать причины универсальной мощи термодинамики. 0 0 1 FВ результате в науке возникли два направления: феноме нологическое и атомистическое. 0 0 1 F 0 0 1 F 0 0 1 FФено менологическое направление не счи тало необходимым искать более глубо ких причин физических 0 0 1 F 0 0 1 Fпроцессов, оно ограничивало задачу изучения приро ды описанием явлений на основе экс периментально 0 0 1 F 0 0 1 Fустановленных принци пов. Энергетики Гельм, Оствальд и другие считали энергию основным по нятием 0 0 1 Fнауки, а такие понятия, как «ма терия», «сила», производными и даже излишними. 0 0 1 F 0 0 1 FЧто касается представления об ато мах и молекулах, то энергетики, а так же венский физик Эрнст 0 0 1 F 0 0 1 FМах, один из видных сторонников феноменологи ческого направления, считали эти пред ставления 0 0 1 Fпродуктами чистой фанта зии, аналогичными представлениям о ведьмах и привидениях. Однако такие видные представители науки, как Клаузиус, Максвелл, а затем Больцман, с успехом 5 разрабатывали молекулярно-кинетическую теорию. 0 0 1 FМаксвелл, Клаузиус, Больцман, Гиббс, развивая физическую атомистику, иска ли законы, управляющие 0 0 1 Fповедением коллектива атомов и молекул, делая по возможности простые гипотезы о строе нии самих атомов. В XIX 0 0 1 F 0 0 1 F в. единствен ным средством наблюдать взаимодей ствия атомов и определять их 0 0 1 Fиндивиду альные особенности были химические реакции. Именно в недрах химической атомистики 0 0 1 Fродилась первая гипотеза о строении всех атомов из атомов водо рода (Проут, 1815). В 1859 г. было сделано важное открытие в оптике, физик Густав Кирхгос (1824-1887) и химик Роберт Бунзен (1811—1899) 0 0 1 F открыли спектральный ана лиз, давший в руки химикам новое мощное средство исследования. Периодический закон. Есть ли граница системы элементов Менделеева? В 1869 г. уже было известно 63 химических элемента. В этом же году Д.И.Менделеев открыл 0 0 1 F 0 0 1 Fфундаменталь ный закон распределения элементов в систему, которую он назвал периоди ческой системой химических элементов.
Однако такие видные представители науки, как Клаузиус, Максвелл, а затем Больцман, с успехом 5 разрабатывали молекулярно-кинетическую теорию. 0 0 1 FМаксвелл, Клаузиус, Больцман, Гиббс, развивая физическую атомистику, иска ли законы, управляющие 0 0 1 Fповедением коллектива атомов и молекул, делая по возможности простые гипотезы о строе нии самих атомов. В XIX 0 0 1 F 0 0 1 F в. единствен ным средством наблюдать взаимодей ствия атомов и определять их 0 0 1 Fиндивиду альные особенности были химические реакции. Именно в недрах химической атомистики 0 0 1 Fродилась первая гипотеза о строении всех атомов из атомов водо рода (Проут, 1815). В 1859 г. было сделано важное открытие в оптике, физик Густав Кирхгос (1824-1887) и химик Роберт Бунзен (1811—1899) 0 0 1 F открыли спектральный ана лиз, давший в руки химикам новое мощное средство исследования. Периодический закон. Есть ли граница системы элементов Менделеева? В 1869 г. уже было известно 63 химических элемента. В этом же году Д.И.Менделеев открыл 0 0 1 F 0 0 1 Fфундаменталь ный закон распределения элементов в систему, которую он назвал периоди ческой системой химических элементов. До этого на протяжении более ста лет в научном мире господствовала картина мира, которую вполне выразил 1808 году своим трудом «Новая система химической философии» Джон Дальтон. Уже было известно, что водород, кислород, сера и другие вещества – простые тела состоят из атомов одного сорта, а вода, аммиак, углекислый газ и др. – сложные, созданы комбинацией атомов разных веществ. Это вполне подтверждалось опытами того времени. Химические реакции, по Дальтону, заключаются в том, что атомы вступают друг с другом в разные комбинации, 0 0 1 Fобразуя «сложные атомы» (молекулы), затем эти молеку лы распадаются, образуются новые молекулы и т. д., 0 0 1 Fпо добно тому как танцоры, переходя от одного танца к другому; образуют новые комбинации. Но сами атомы при этом остаются неизменными и вечными: меняется только их распределение. «Каждая частица воды,— 0 0 1 F 0 0 1 F гово рит Дальтон в своей „Химической философии”,— в точ ности похожа на любую другую частицу воды; каждая частица водорода в точности похожа на любую другую частицу 0 0 1 Fводорода и т.
До этого на протяжении более ста лет в научном мире господствовала картина мира, которую вполне выразил 1808 году своим трудом «Новая система химической философии» Джон Дальтон. Уже было известно, что водород, кислород, сера и другие вещества – простые тела состоят из атомов одного сорта, а вода, аммиак, углекислый газ и др. – сложные, созданы комбинацией атомов разных веществ. Это вполне подтверждалось опытами того времени. Химические реакции, по Дальтону, заключаются в том, что атомы вступают друг с другом в разные комбинации, 0 0 1 Fобразуя «сложные атомы» (молекулы), затем эти молеку лы распадаются, образуются новые молекулы и т. д., 0 0 1 Fпо добно тому как танцоры, переходя от одного танца к другому; образуют новые комбинации. Но сами атомы при этом остаются неизменными и вечными: меняется только их распределение. «Каждая частица воды,— 0 0 1 F 0 0 1 F гово рит Дальтон в своей „Химической философии”,— в точ ности похожа на любую другую частицу воды; каждая частица водорода в точности похожа на любую другую частицу 0 0 1 Fводорода и т. д. Химическое разложение и хи мическое соединение означают лишь то, что атомы 0 0 1 Fуда ляются друг от друга или же снова сцепляются вместе. Но химик не способен уничтожить материю или создать ее вновь. Пытаться создать или уничтожить хотя бы один атом водорода так же безнадежно, как 0 0 1 F 0 0 1 Fпытаться приба вить еще одну планету к Солнечной системе или уничто жить какую-нибудь из существующих планет. Все, что мы можем сделать,— 0 0 1 F это разъединить атомы, соединив шиеся или 0 0 1 Fсцепившиеся друг с другом, или же соеди нить те атомы, которые сейчас находятся на большом расстоянии друг от друга». «Химическая философия», изложенная в этих строках Дальтона, действительно стала философией целого ряда поколений химиков и физиков. Невозможность создания хотя бы одного нового атома данного 0 0 1 F 0 0 1 Fхимического эле мента, невозможность превращения одних атомов в дру гие — все это было 0 0 1 F 0 0 1 Fнеобходимым выводом из всего огром ного опытного материала, на котором основывалась науч ная химия.
д. Химическое разложение и хи мическое соединение означают лишь то, что атомы 0 0 1 Fуда ляются друг от друга или же снова сцепляются вместе. Но химик не способен уничтожить материю или создать ее вновь. Пытаться создать или уничтожить хотя бы один атом водорода так же безнадежно, как 0 0 1 F 0 0 1 Fпытаться приба вить еще одну планету к Солнечной системе или уничто жить какую-нибудь из существующих планет. Все, что мы можем сделать,— 0 0 1 F это разъединить атомы, соединив шиеся или 0 0 1 Fсцепившиеся друг с другом, или же соеди нить те атомы, которые сейчас находятся на большом расстоянии друг от друга». «Химическая философия», изложенная в этих строках Дальтона, действительно стала философией целого ряда поколений химиков и физиков. Невозможность создания хотя бы одного нового атома данного 0 0 1 F 0 0 1 Fхимического эле мента, невозможность превращения одних атомов в дру гие — все это было 0 0 1 F 0 0 1 Fнеобходимым выводом из всего огром ного опытного материала, на котором основывалась науч ная химия. В этом пункте Дальтон не совсем сходился с Бойлем, который в 1661 году писал, что хотя атомы 0 0 1 Fостают ся неизменными при всех химических явлениях, но тем не менее когда-нибудь будет найден некий «сильный и тонкий агент», с помощью которого удастся разбить атомы на более мелкие части и превратить 0 0 1 Fодни атомы в дру гие. 0 0 1 FЭта мысль Бойля казалась Дальтону чистой фантази ей: ни один химический факт не указывал на то, что атомы возможно разбивать на части и превращать друг в друга. В 1816 0 0 1 F грду неожиданно нашелся один сторонник Бойля, пытавшийся под твердить ее фактами. Это 0 0 1 Fбыл Уильям Праут, который напечатал в жур нале «Философские анналы» статью, где обращал особенное 0 0 1 Fвнимание на тот факт, что все атомные массы, которые определил Дальтон, выража ются целыми числами. Это — 0 0 1 F очень замечательный факт, говорил Праут, ведь если бы атомы всех химических эле ментов были 0 0 1 Fпервичными, основными частицами, подлин ными «кирпичами мироздания», неразложимыми на частя и нисколько не связанными друг с другом, то какая могла бы быть причина того, что атом азота ровно в пять 0 0 1 Fраз превосходит по массе атом водорода, а атом кислоро да — ровно в семь раз? 0 0 1 FМнение Праута вот ка кое: атом азота, который, по Дальтону, ровно в пять раз превосходит по массе атом водорода,— это и есть пять атомов водорода, очень тесно сцепленных друг с другом; атом кислорода — 0 0 1 Fэто семь атомов водорода, тесно сцеп ленных друг с другом; атом ртути—это 167 0 0 1 F тесно при жавшихся 0 0 1 Fдруг к другу водородных атомов и т.
В этом пункте Дальтон не совсем сходился с Бойлем, который в 1661 году писал, что хотя атомы 0 0 1 Fостают ся неизменными при всех химических явлениях, но тем не менее когда-нибудь будет найден некий «сильный и тонкий агент», с помощью которого удастся разбить атомы на более мелкие части и превратить 0 0 1 Fодни атомы в дру гие. 0 0 1 FЭта мысль Бойля казалась Дальтону чистой фантази ей: ни один химический факт не указывал на то, что атомы возможно разбивать на части и превращать друг в друга. В 1816 0 0 1 F грду неожиданно нашелся один сторонник Бойля, пытавшийся под твердить ее фактами. Это 0 0 1 Fбыл Уильям Праут, который напечатал в жур нале «Философские анналы» статью, где обращал особенное 0 0 1 Fвнимание на тот факт, что все атомные массы, которые определил Дальтон, выража ются целыми числами. Это — 0 0 1 F очень замечательный факт, говорил Праут, ведь если бы атомы всех химических эле ментов были 0 0 1 Fпервичными, основными частицами, подлин ными «кирпичами мироздания», неразложимыми на частя и нисколько не связанными друг с другом, то какая могла бы быть причина того, что атом азота ровно в пять 0 0 1 Fраз превосходит по массе атом водорода, а атом кислоро да — ровно в семь раз? 0 0 1 FМнение Праута вот ка кое: атом азота, который, по Дальтону, ровно в пять раз превосходит по массе атом водорода,— это и есть пять атомов водорода, очень тесно сцепленных друг с другом; атом кислорода — 0 0 1 Fэто семь атомов водорода, тесно сцеп ленных друг с другом; атом ртути—это 167 0 0 1 F тесно при жавшихся 0 0 1 Fдруг к другу водородных атомов и т.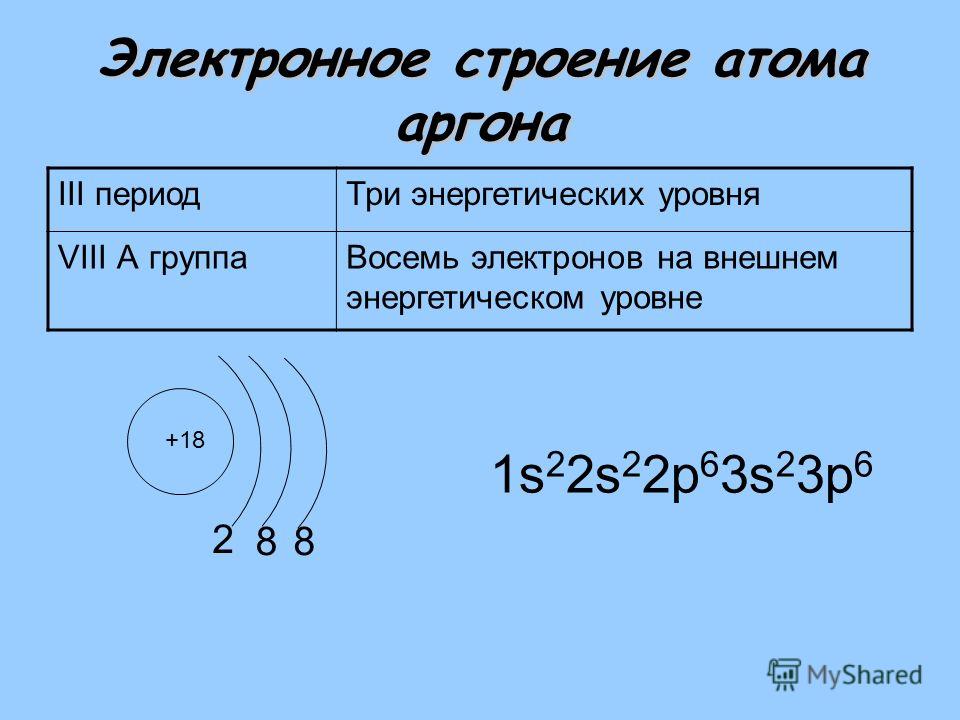 д. Выходит, что все на свете состоит в конечном счете из водо рода. А чем же объяснить, что все-таки в химических опытах никак не удается, например, разложить кислород на водород? Очень просто, отвечает Праут, все дело в том, что когда семь атомов водорода сцепляются, 6 чтобы образовать атом кислорода, то они сцепляются гораздо теснее, чем тогда, когда, например, атом водорода и атом кислорода сцепляются, чтобы образовать молекулу воды. Поэтому-то в химических опытах 0 0 1 Fи удается разложить мо лекулу воды на атом водорода и атом кислорода, но ни как не удается разложить атом кислорода на семь атомов водорода. Статья Праута была очень убедительна,— 0 0 1 F многие по верили в то, что водород есть действительно «первичное вещество», из которого состоит все на свете. Одна только была беда — те химические анализы, 0 0 1 Fосновываясь на ко торых Дальтон вычислил свои атомные массы, были очень уж неточны. Если провести 0 0 1 F 0 0 1 Fанализы тщательнее и вычис лить атомные массы точнее, то окажутся ли они по-преж нему целыми числами? За грандиозную работу точного определения атомных масс взялся знаменитый шведский химик Йене Якоб Берцелиус.
д. Выходит, что все на свете состоит в конечном счете из водо рода. А чем же объяснить, что все-таки в химических опытах никак не удается, например, разложить кислород на водород? Очень просто, отвечает Праут, все дело в том, что когда семь атомов водорода сцепляются, 6 чтобы образовать атом кислорода, то они сцепляются гораздо теснее, чем тогда, когда, например, атом водорода и атом кислорода сцепляются, чтобы образовать молекулу воды. Поэтому-то в химических опытах 0 0 1 Fи удается разложить мо лекулу воды на атом водорода и атом кислорода, но ни как не удается разложить атом кислорода на семь атомов водорода. Статья Праута была очень убедительна,— 0 0 1 F многие по верили в то, что водород есть действительно «первичное вещество», из которого состоит все на свете. Одна только была беда — те химические анализы, 0 0 1 Fосновываясь на ко торых Дальтон вычислил свои атомные массы, были очень уж неточны. Если провести 0 0 1 F 0 0 1 Fанализы тщательнее и вычис лить атомные массы точнее, то окажутся ли они по-преж нему целыми числами? За грандиозную работу точного определения атомных масс взялся знаменитый шведский химик Йене Якоб Берцелиус. Берцелиусу, больше чем кому-нибудь другому, химия обязана тем, что она стала точной 0 0 1 F 0 0 1 Fнаукой. В течение своей жизни Берцели ус проанализировал больше двух тысяч различных хими ческих соединений, и результаты его анализов отличаются от самых точных теперешних результатов не больше чем на 1—2%. 0 0 1 FБерце лиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно 0 0 1 Fбольшее число хи мических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех — одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов — одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя 0 0 1 Fработы Берцелиуса и дали блестящее под тверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры — атомные массы — 0 0 1 F оказа лись сплошь неверны. 0 0 1 F 0 0 1 FТаким образом, гипотеза Праута, ко торая была основана на том, что атомные массы элемен тов — точные целые числа в то время не подтвердилась.
Берцелиусу, больше чем кому-нибудь другому, химия обязана тем, что она стала точной 0 0 1 F 0 0 1 Fнаукой. В течение своей жизни Берцели ус проанализировал больше двух тысяч различных хими ческих соединений, и результаты его анализов отличаются от самых точных теперешних результатов не больше чем на 1—2%. 0 0 1 FБерце лиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно 0 0 1 Fбольшее число хи мических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех — одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов — одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя 0 0 1 Fработы Берцелиуса и дали блестящее под тверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры — атомные массы — 0 0 1 F оказа лись сплошь неверны. 0 0 1 F 0 0 1 FТаким образом, гипотеза Праута, ко торая была основана на том, что атомные массы элемен тов — точные целые числа в то время не подтвердилась. Таблица химических элементов, их символов и атомных масс *) № Название и символ Ат. масса № Название и символ Ат. масса 1 Водород Н 1,008 37 Рубидий Rb 85,468 2 Гелий Не 4,003 38 Стронций Sr 87,62 3 Литий Li 6,941 39 Иттрий Y 88,906 4 Бериллий Be 9,012 40 Цирконий Zr 91,22 5 Бор В 10,811 41 Ниобий Nb 92,906 6 Углерод С 12,011 42 Молибден Мо 95,94 7 Дзот N 14,007 43 Технеций Те 98,906 8 Кислород 0 15,9994 44 Рутений Ru 101,07 9 Фтор F 18,998 45 Родий Rh 102,905 10 Неон Ne 20,179 46 Палладий Pd 106,4 11 12 Натрий Na Магний Mg 22,990 24,305 47 48 Серебро Ag Кадмий Cd 107,868 112,40 13 Алюминий AI 26,981 49 Индий In 114,82 14 Кремний Si 28,086 50 Олово Sn 118,69 15 Фосфор Р 30,974 51 Сурьма Sb 121,75 16 Сера S 32,06 52 Теллур Те 127,60 17 Хлор С1 35,453 53 Йод I 126,905 18 Аргон Аг 39,948 54 Ксенон Хе 131,30 19 Калий К 39,098 55 Цезий Cs 132,905 20 Кальций Са 40,08 56 Барий Ва 137,33 21 Скандий Sc 44,956 57 Лантан La 138,906 22 Титан Ti 47,90 58 Церий Се 140,12 23 Ванадий V 50,941 59 Празеодим Рг 140,908 24 Хром Сг 51,996 60 Неодим Nd 144,24 25 Марганец Мп 54,938 61 Прометий Рш 146 26 Железо Fe 55,847 62 Самарий Sm 150,4 27 Кобальт Со 58,933 63 Европий Ей 151,96 28 Никель^ Ni 58,70 64 Гадолиний Gd 157,25 29 Медь Си 63,546 65 Тербий ТЬ 158,925 30 Цинк Zn 65,38 66 Диспрозий Dy 162,50 7 0 0 1 Fстрочки (пе риоды) могут становиться длиннее к концу таблицы.
Таблица химических элементов, их символов и атомных масс *) № Название и символ Ат. масса № Название и символ Ат. масса 1 Водород Н 1,008 37 Рубидий Rb 85,468 2 Гелий Не 4,003 38 Стронций Sr 87,62 3 Литий Li 6,941 39 Иттрий Y 88,906 4 Бериллий Be 9,012 40 Цирконий Zr 91,22 5 Бор В 10,811 41 Ниобий Nb 92,906 6 Углерод С 12,011 42 Молибден Мо 95,94 7 Дзот N 14,007 43 Технеций Те 98,906 8 Кислород 0 15,9994 44 Рутений Ru 101,07 9 Фтор F 18,998 45 Родий Rh 102,905 10 Неон Ne 20,179 46 Палладий Pd 106,4 11 12 Натрий Na Магний Mg 22,990 24,305 47 48 Серебро Ag Кадмий Cd 107,868 112,40 13 Алюминий AI 26,981 49 Индий In 114,82 14 Кремний Si 28,086 50 Олово Sn 118,69 15 Фосфор Р 30,974 51 Сурьма Sb 121,75 16 Сера S 32,06 52 Теллур Те 127,60 17 Хлор С1 35,453 53 Йод I 126,905 18 Аргон Аг 39,948 54 Ксенон Хе 131,30 19 Калий К 39,098 55 Цезий Cs 132,905 20 Кальций Са 40,08 56 Барий Ва 137,33 21 Скандий Sc 44,956 57 Лантан La 138,906 22 Титан Ti 47,90 58 Церий Се 140,12 23 Ванадий V 50,941 59 Празеодим Рг 140,908 24 Хром Сг 51,996 60 Неодим Nd 144,24 25 Марганец Мп 54,938 61 Прометий Рш 146 26 Железо Fe 55,847 62 Самарий Sm 150,4 27 Кобальт Со 58,933 63 Европий Ей 151,96 28 Никель^ Ni 58,70 64 Гадолиний Gd 157,25 29 Медь Си 63,546 65 Тербий ТЬ 158,925 30 Цинк Zn 65,38 66 Диспрозий Dy 162,50 7 0 0 1 Fстрочки (пе риоды) могут становиться длиннее к концу таблицы. 0 0 1 FУже в четвертой строке таблицы классифика ция потребовала оставления пустых мест. На этих пустых 0 0 1 Fместах должны находиться какие-то еще не открытые эле менты. Три таких элемента Менделеев заочно точно описал и позже они были открыты. Также нет ничего невозможного в существовании в природе элементов с атомной массой, большей урана. В наши дни такие «трансурановые» элементы были получены искусственно. Вполне можно утверждать, что предела таблицы не существует и получение или нахождение других трансурановых элементов – это дело будущего. Таково, в общих чертах, учение об атомах химических элементов, созданное Дальтоном и определившее 0 0 1 Fвсе даль нейшее развитие химии в XIX столетии. 0 0 1 F, с помощью которого в итоге был рас шифрован периодический закон. Испускание а-частицы 0 0 1 Fприводит к смещению радиоэлемента на два места влево в периодической си стеме (в направлении 0 0 1 Fуменьшения массы). Но прохождение радио активных рядов через периодическую систему не прямолинейное, а зигзагообразное, так что превращающийся радиоэлемент часто возвращается назад—на то же место, которое занимал ранее в периодической системе его материнский продукт.
0 0 1 FУже в четвертой строке таблицы классифика ция потребовала оставления пустых мест. На этих пустых 0 0 1 Fместах должны находиться какие-то еще не открытые эле менты. Три таких элемента Менделеев заочно точно описал и позже они были открыты. Также нет ничего невозможного в существовании в природе элементов с атомной массой, большей урана. В наши дни такие «трансурановые» элементы были получены искусственно. Вполне можно утверждать, что предела таблицы не существует и получение или нахождение других трансурановых элементов – это дело будущего. Таково, в общих чертах, учение об атомах химических элементов, созданное Дальтоном и определившее 0 0 1 Fвсе даль нейшее развитие химии в XIX столетии. 0 0 1 F, с помощью которого в итоге был рас шифрован периодический закон. Испускание а-частицы 0 0 1 Fприводит к смещению радиоэлемента на два места влево в периодической си стеме (в направлении 0 0 1 Fуменьшения массы). Но прохождение радио активных рядов через периодическую систему не прямолинейное, а зигзагообразное, так что превращающийся радиоэлемент часто возвращается назад—на то же место, которое занимал ранее в периодической системе его материнский продукт. Когда это происходит, то оказывается, что материнский радиоэлемент и его последующий продукт распада — изотоп (занимающий то же с, мое место в периодической системе) имеют одинаковые химические свойства, несмотря на различие в их атомных массах. Интерпретация периодического закона В 1911 0 0 1 F г. был сформулирован закон ра диоактивных смещений (периодический закон), который в его 0 0 1 Fзаконченной формули ровке оказался чрезвычайно простым и не допускающим никаких исключений. Он стал подлинным фундаментом. Согласно этому закону, испускание F 0 6 2-частицы ведет к смещению 0 0 1 Fрадиоэлемента на одно место вправо в перио дической системе, а испускание а-частицы — к смещению 0 0 1 Fрадиоэле мента на два места в обратном направлении. Поскольку многие а-распады сопровождаются двумя последующими ( F 0 6 2-распадами, то в таких случаях третий продукт распада всегда возвращается — на фоне периодической системы — на место исходного а-излучателя, являясь химически тождественным с ним, несмотря на разницу в четыре единицы в их атомных массах. В 1913 г. они были названы изотопами или изотопными элементами; этот термин означает, что они занимают одно и то же место в периодической 0 0 1 Fсистеме. Изотопы двух разных элементов могут иметь одинаковую атом ную массу, и тогда их называют изобарами. Реже изотопы одного и того же элемента могут иметь одинаковую атомную массу, но разную стабильность, т. е. один из них радиоактивен, а другой— нет. Поскольку а-частица обладает зарядом в две положительные единицы, а заряд F 0 6 2-частицы равен единице со знаком минус, то сразу стало очевидным, что периодический закон отражает связь между химическими свойствами н внутриатомным зарядом, но не массой. В настоящее время периодический закон является in cxtcnto 0 0 1 F (повсюду) выражением, во-первых, атомной (дискрет ной) природы электричества и, во-вторых, 0 0 1 Fнового вида атомисти ки. Aтом Резерфорда-Бора Модели atоma до бора Но вернемся к последовательному изложению развития представлений о строении атома. 0 0 1 FРазвитие исследований радиоактив ного излучения, с одной стороны, и квантовой теории — с другой, привели к созданию квантовой модели атома Резерфорда — Бора. Но созданию этой модели 0 0 1 F 0 0 1 Fпредшествовали попытки по строить модель атома на основе пред ставлений классической 0 0 1 Fэлектродина мики и механики. В 1904 0 0 1 F г. появились публикации о строении атома, при надлежащие одна японскому физику Хантаро Нагаока, другая— английскому физику Д. Томсону. 0 0 1 FНагаока исходил из исследований Максвелла об устойчивости колец Са турна и представил строение 0 0 1 F 0 0 1 Fатома ана логичным строению солнечной систе мы: роль Солнца играет положительно заряженная 0 0 1 Fцентральная часть атома, вокруг которой по установленным коль цеобразным орбитам движутся 0 0 1 F«плане ты»—электроны. При незначительных смещениях электроны возбуждают электромагнитные волны, периоды которых, по расчетам Нагаоки, того же порядка, что и частоты спектральных линий 10 некоторых элементов. В атоме Томсона положительное электричество «размазано» по сфере, в которую вкраплены, как изюм в 0 0 1 Fпудинг, электроны. В простейшем атоме водо рода электрон находится в центре положительно заряженной сферы. При смещении из центра на электрон действует квазиупругая сила 0 0 1 Fэлектро статического 0 0 1 F 0 0 1 Fпритяжения, под действи ем которой электрон совершает колеба ния. Частота этих колебаний 0 0 1 F 0 0 1 Fопреде ляется радиусом сферы, зарядом и мас сой электрона, и если радиус сферы имеет порядок радиуса атома, частота этих колебаний совпадает с частотой колебания спектральной линии атома. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял пытку теоретически объяснить периодическую систему элементов Д. И. Менделеева. Эту попытку Бор позднее назвал «знаменитой» и указал, что со времени этой попытки «идея о разделении электронов в атоме на группы сделалась исходным пунктом и более новых воззрений». Отметив, что теория Томсона оказалась несовместимой с опытными фактами, Бор тем не менее считал, что эта теория «содержит много оригинальных мыслей и оказала большое влияние на развитие атомной теории». В 1905 г. В. Вин выступал с докладом об электронах на съезде немецких естествоиспытателей и врачей в Мюнхене. Здесь он, в частности, указывал на трудность объяснения линейчатых спектров атомов с точки зрения электронной теории. Он говорил: «Проще всего было бы понимать каждый атом как планетную систему, которая состоит из положительно заряженного центра, вокруг которого обращаются электроны как планеты. Но такая система не может быть устойчивой вследствие излучаемой электронами энергии. Поэтому мы вынуждены обратиться к системе, в которой электроны находятся в относительном покое или обладают ничтожными скоростями, хотя такое представление содержит много сомнительного». Такой статической моделью был атом Кельвина — Томсона. И эта модель была общепринятой по причинам, указанным Вином. В конце концов оказалось, что новые опытные факты опровергают модель Томсона и, наоборот, свидетельствуют в пользу планетарной модели, факты эти были открыты Резерфордом. 24 мая 1907 г. в Манчестере Резерфорд развернул огромную, привлекая молодых ученых из разных стран мира. Одним из его деятельных сотрудников был немецкий физик Ганс Гейгер, создатель первого счетчика элементарных частиц — счетчика Гейгера. В Манчестере с Резерфордом работали Э. Марсден, К. Фаянс, Г. Мозли, Г. Хевеши и другие физики и химики. В Манчестер в 1912 г. приехал Нильс Бор. В этой атмосфере коллективного научного творчества родились крупные научные достижения 0 0 1 FРезерфорда, из которых в первую очередь следует отметить разгадку природы а-час тиц и открытие ядерного строение атома. Сюда же следует присоединить знаменитые статьи Бора по квантовой теории планетарного атома. В Манчестере было положено начало квантовой и ядерной физике. Открытие атомного ядра Уподобление атома планетной системе делалось еще в самом начале XX в. Но эту модель было трудно 0 0 1 Fсо вместить с законами электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 0 0 1 F 0 0 1 F г. на чались исследования, приведшие к ут верждению планетарной модели. Одна из тем, выдвинутая Резерфордом в Манчестере,—рассеяние а-частиц. Она была поручена Гейгеру и Марсдену. Метод, применявшийся для исследования, заключался в следующем: а-частицы, испускаемые 0 0 1 Fисточ ником, диафрагмировались щелью попадали на экран из сернистого цинка. на котором получалось 0 0 1 Fизображение щели в виде узкой полоски. Затем между щелью и экраном помещали тон кую 0 0 1 Fметаллическую пластинку, изобра жение щели размывалось, что указывало на рассеяние а-частиц веществом пластинки. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы. 0 0 1 FНо наиболее поразительным ока зался факт, открытый Гейгером и Марсденом в 1909 г., — 0 0 1 Fсуществование боль ших углов рассеяния. Некоторая, очень небольшая часть а-частиц (примерно 1/8000) рассеивается на угол, больший прямого, отбрасываясь, таким образом обратно к источнику. Тонкая 0 0 1 Fпластине отбрасывала частицы, летящие с боль шой скоростью. Как раз в том же, 1909 году Резерфорд и 0 0 1 FРойдс неопровержимо доказали, что а-частицы являются дважды ионизированными атомами ге лия. Для 0 0 1 Fтаких тяжелых быстро движу щихся частиц рассеивание на углы большие прямого, казалось весьма 0 0 1 Fне вероятным. Резерфорд говорил, что это так же невероятно, как если бы пуля отскакивала от листа 11 папиросной бумаги. Одно из возможных объяснений аномального рассеяния состояло в том что оно складывается из многих 0 0 1 Fнеболь ших углов отклонений, вызванные атомами рассеивающего вещества. 0 0 1 F 0 0 1 FИсходя из модели Томсона, Резер форд подсчитал, что это не может да вать больших отклонений даже 0 0 1 Fпри многих столкновениях с частицей. И здесь Резерфорд обратился к плане тарной модели. Когда а-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду а-частицы и обратно пропорциональной квадрату расстояния между ними, она движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее 0 0 1 Fпрямолинейный путь, таким обра зом, искривляется, и она отклоняется на угол рассеяния ф. 1 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад «Рассеяние а- и F 0 6 2- 0 0 1 Fлучей и строение атома». В докладе он говорил: «Рассеяние заряжен ных частиц может быть объяснено, 0 0 1 F 0 0 1 Fесли предположить такой атом, кото рый состоит из центрального электри ческого заряда, 0 0 1 Fсосредоточенного в точке и окруженного однородным сфе рическим распределением 0 0 1 Fпротиво положного 0 0 1 Fэлектричества равной ве личины. При таком устройстве атома а- и F 0 6 2-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала». Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов п 0 0 1 F 0 0 1 F 0 0 1 Fв еди нице рассеивающего материала, тол щине рассеивающей пластинки и вели чине b2, выражаемой 0 0 1 Fследующей фор мулой: где Ne— 0 0 1 F заряд в центре атома, Е—за ряд отклоняемой частицы, т—ее масса, и—ее скорость. Кроме 0 0 1 F 0 0 1 Fтого, эта вероят ность зависит от угла рассеяния ф, так что число рассеянных частиц на едини цу площади пропорционально cosec4 (Ф/2). 0 0 1 FВажным следствием теории Резерфорда было указание на заряд атом ного центра, который Резерфорд 0 0 1 Fполо жил равным ± Ne. 0 0 1 F Заряд оказался про порциональным атомному весу. В 1913 0 0 1 F 0 0 1 F г. Гейгер и Марсден предпри няли новую экспериментальную про верку формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими сцинтилляционным вспышкам. Из этих исследований 0 0 1 Fи возникло представле ние о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу. В 1913 г. Ван ден Брук показал, что заряд ядра совпадает с номером элемента в таблице Менделеева. В том же1913 г. Ф. Содди и К. Фаянс пришли закону смещения Содди—Фаянса, ее гласно которому при а- 0 0 1 Fраспаде радио активный продукт смещается в менделеевской таблице на два номера выше а при F 0 6 2-распаде —на номер ниже. К этому же времени Содди пришел представлению об изотопах как разновидностях одного и того же элемент ядра атомов которых имеют одинаковый заряд, но разные массы. В богатом событиям 1913 г. были опубликованы три знаменитые статьи Бора «О строении атомов и молекул», открывшие путь к атомной квантовой механике. Томас Рис Вильсон (1869-1959) 0 0 1 F изо брел замечательный прибор, известный ныне под названием 0 0 1 F«камера Виль сона». Этот прибор позволяет видеть заряженную частицу по оставляемому ею туманному следу. Позднее ученик и сотрудник Резерфорда Блэккет (1897—1974) получил вильсоновскую фотографию 0 0 1 Fрасщеп ления ядра азота а-частицей, первой ядерной реакции, открытой Резерфордом. В этом же году Бор, имевший возможность поработать с автором первой модели атома, а затем с автором планетарной модели, на основе последней создает свою теорию атома Резерфорда-Бора. Знаменитая статья Бора, в которой были заключены основы этой теории, начиналась с указания на модели Резерфорда и Томсона и обсуждения их особенностей и различий. 0 0 1 FРезерфорд сразу понял ре волюционный характер идей Бора и высказал критические замечания по 0 0 1 Fсамым фундаментальным пунктам теории Бора. После длительных ди скуссий статья Бора и две его 0 0 1 F 0 0 1 Fпосле дующие статьи были опубликованы. Однако окончательный ответ на возра жения Резерфорда был 0 0 1 Fдан только со зданием квантовой механики. В 1915 0 0 1 F г. Бор опубли ковал работы «О сериальном спектре водорода и строении атома» и «Спектр водорода и гелия», «О квантовой теории излучения в структуре атома». Он развил исследования, выполненные им в Манчестере в августе 1912 0 0 1 F г., и опу бликовал их под названием «Теория торможения заряженных частиц при их прохождении через вещество». В декабре 1915 и январе 1916 0 0 1 F г. Ар нольд Зоммерфельд (1868—1951) развил теорию Бора, рассмотрев 0 0 1 F 0 0 1 Fдви жение электрона по эллиптическим орбитам и обобщив правила квантова ния Бора. Зоммерфельд дал 0 0 1 Fтакже теорию тонкой структуры спектральных линий, введя релятивистское измене ние массы со 12 0 0 1 Fобязаны переходам электронов на вакантные места во внутренних оболочках. Оно бы ло дано 0 0 1 FЗоммерфельдом в его фунда ментальной работе 1916 г. В том же 1916 г. П. Дебай и П. Шеррер 0 0 1 F 0 0 1 F 0 0 1 Fразработа ли новую методику рентгеновского ана лиза кристаллов в порошке, получив шую широкое распространение в рентгеноструктурном анализе. 0 0 1 FИдеи Бора получили эксперимен тальное подтверждение в опытах Джеймса Франка (1882—1964) и Густава Герца, которые начиная с 1913 г. изучали соударения электронов с атомами паров и газов. Оказалось, что электрон может сталкиваться с атомами газов упруго и неупруго. При упругом ударе 0 0 1 F 0 0 1 Fэлектрон отскакивает от тяжелого атома (напри мер, ртути), не теряя энергии, при не упругом ударе его 0 0 1 Fэнергия теряется и передается атому, который при этом либо возбуждается, либо ионизирует ся. Порции 0 0 1 Fэнергии, затрачиваемые на возбуждение атома, вполне определен ные: так, электрон при столкновении с атомами ртути теряет энергию 4,9 0 0 1 F эВ, что соответствует энергии кванта ультра фиолетового света длиной волны 2537 А. 0 0 1 FКвантовый характер поглощения энергии атомом был продемонстриро ван в опытах Франка, Герца и 0 0 1 Fдругих физиков с поразительной нагляд ностью. За эти исследования, которые продолжались ряд лет, в 1925 г. Франк и Герц были удостоены Нобелевской премии. 0 0 1 FКвантовый характер излучения и по глощения энергии атомом лег в основу теоретического 0 0 1 F 0 0 1 Fисследования о свето вых квантах, выполненного Эйнштей ном в 1916—1917 0 0 1 F гг. В этом исследо вании 0 0 1 FЭйнштейн вывел формулу Планка, исходя из представления о на правленном излучении. Атом излучает и поглощает энергию квантами. Выстреливая квант в определенном направлении, атом сообщает ему не только энергию hv , но и импульс . При излучении молекула газа переходит из энергетического состояния Zm c 0 0 1 F энер гией F 0 6 5m в состояние Zn с энергией F 0 6 5n излучая энергию F 0 6 5m – F 0 6 5n. Поглощая такую же энергию, молекула переходит из состояния Zn в состояние Zm 0 0 1 F. Моле кула может перейти из состояния Zm в состояние Zn 0 0 1 F самопроизвольно, спон танно. Вероятность такого перехода за время dt 0 0 1 F пропорциональна этому про межутку времени dt: 0 0 1 FНо, кроме этого спонтанного перехода, впервые введенного Бором при объя снении спектров, по 0 0 1 FЭйнштейну, для молекул и атомов, находящихся в свето вом поле, возможны индуцированные переходы 0 0 1 Fпод действием светового излучения. Вероятность такого «ин дуцированного излучения»: где p 0 0 1 F —объемная плотность световой энергии. Точно так же вероятность по глощения энергии 0 0 1 Fмолекулой, находя щейся в состоянии Zn и перехода ее на высший энергетический уровень Zm будет: В равновесном состоянии атом в среднем столько же поглощает энергии, сколько и излучает. Поэтому: 0 0 1 Fгде по закону статистики Больцмана число молекул, находящихся в состоя нии Zn, пропорционально: Из предыдущего равенства получается: Положим ет — en =hv, для высоких частот, применяя закон Вина, получим формулу Планка: 0 0 1 FИдея Эйнштейна об индуцирован ном излучении нашла в современной физике и технике важное применение в лазерах. Как было уже сказано, в 1916 г. Зоммерфельд обобщил теорию Бора, введя правила квантования для 0 0 1 Fсистем с не сколькими степенями свободы в виде . 0 0 1 FОн рассмотрел движение по эллип су, введя азимутальные и радиальные квантовые числа. Введя далее 0 0 1 F 0 0 1 Fпростран ственное квантование и третье кванто вое число, он дал теорию нормального эффекта Зеемана. 0 0 1 FНаконец, он дал те орию тонкой структуры спектральных линий и объяснение рентгеновских спектров. 0 0 1 FВсе эти результаты были по дробно разработаны им в классической монографии «Строение атомов и 0 0 1 Fспект ры», первое издание которой вышло в 1917 г. До 1924 г. включительно эта книга выдержала четыре издания. Последнее издание ее уже в двух томах вышло в 1951 г. и русский перевод— в 1956 г. Таким образом, к 1917 г. идеи Бора получили всестороннее развитие как в работах самого Бора, так и 0 0 1 F 0 0 1 Fдругих авто ров. Они были экспериментально под тверждены, и теория Бора получила всеобщее 0 0 1 Fпризнание. Но те трудные во просы, которые были поставлены Резерфордом, еще не были сняты, а многие 0 0 1 Fтрудности, с которыми сталкивалась теория в попытках рассмотреть много электронные атомы, 0 0 1 Fаномальный эффект Зеемана и многое другое, пока зали, что в теории Бора при всех ее успехах есть 15 серьезные недостатки принципиального характера. Трудности и противоречия накопились, и надо было искать выход. Возникновение квантовой механики (1925— 1930 гг) Трудности теории бора 0 0 1 FТеория Бора с самого начала вызы вала многие вопросы, остававшиеся без ответа. Эти вопросы были 0 0 1 F 0 0 1 Fпостав лены Резерфордом еще при обсужде нии рукописи его первой статьи. Как понимать сочетание 0 0 1 Fидей Бора и классической механики, в кото рой нет места для квантовых скачков, и откуда электрон знает, 0 0 1 Fна какую орби ту ему следует перескакивать? В 1896 г. голландский физик Питер Зееман (1865—1943) произвел опыт, который пытался осуществить 0 0 1 Fеще Фарадей. Пламя натриевой горелки он помещал между полюсами электромаг нита и наблюдал в спектроскоп ее спектр. По оси электромагнита был просверлен канал, так что явление можно было 0 0 1 Fнаблюдать не только пер пендикулярно силовым линиям поля (поперечный эффект), но и вдоль поля 0 0 1 F(продольный эффект). При на блюдении поперек поля, кроме линии с частотой колебаний vo, равной 0 0 1 F 0 0 1 Fчасто те колебаний в отсутствие поля, на блюдались две линии с частотами v1=v0- F 0 4 4v и v2=v0- F 0 4 4v. Все три линии линейно поляризованы. Несмещенная линия соответствует колебаниям вдоль силовых линий, 0 0 1 Fсмещен ные — колебаниям, перпендикулярным силовым линиям. При наблюдении вдоль поля 0 0 1 Fнесмещенная компонента отсутствует, смещенные линии поляризованы по кругу в проти воположных направлениях. Лоренц в 1897 г. дал простую теорию эффекта, исходя из представлений, что в атомах электроны 0 0 1 F 0 0 1 Fсовершают круго вые движения с циклической часто той w0 0 0 1 F. В магнитном поле на них дей ствует сила 0 0 1 FЛоренца и частота обра щения изменяется на величину F 0 4 4w 0 0 1 F, рав ную приближенно: Лармор (1857-1942) в 1899 0 0 1 F г. интер претировал действие магнитного поля как действие поля тяжести на 0 0 1 Fволчок. Волчок прецессирует вокруг направле ния силы тяжести с угловой частотой F 0 4 4w. Точно так же вращающиеся электроны в атоме прецессируют вокруг силовых линий магнитного поля с круговой частотой . Зоммерфельд, развивая теорию Бора, ввел идею пространственного квантования. Движение электрона по орбите определяется радиальным и азимутальным квантовыми числами или главным квантовым числом п, 0 0 1 F оп ределяющим энергию электрона, и побочным квантовым числом k, 0 0 1 F опре деляющим форму орбиты. 0 0 1 FПоложение орбиты в пространстве определяется третьим магнитным квантовым чис лом т. Введение 0 0 1 F 0 0 1 Fэтого числа и кван тование направлений оси по отноше нию к магнитному полю позволяет дать объяснение эффекта Зеемана. Однако это объяснение в известном смысле было хуже объяснения, данного Лоренцем. Оно ничего не говорило о поляризации линий. Вообще теория спектров, по Бору и Зоммерфельду, говорила лишь о частотах линий и не могла объяснить их интенсивность и поляризацию. 0 0 1 FЧтобы теория могла что-то сказать об этом, Бор ввел прин цип соответствия. 0 0 1 F 0 0 1 FСогласно этому принципу «сущест вует далеко идущее соответствие» меж ду квантовым и 0 0 1 Fклассическим описа нием излучения. В квантовом описании линии спектра излучения обусловлены 0 0 1 F 0 0 1 Fпереходами из одного состояния в дру гое, в классическом эти линии опре деляются разложением движения электрона в ряд Фурье. При этом, как указывает Н. Бор, «частота излучения, испускаемого при 0 0 1 F 0 0 1 Fпереходе между ста ционарными состояниями, характери зуемыми числами п’ и п”, большим по сравнению с их разностью, совпадает с частотой одной из компонент излучения, которую можно ожидать 0 0 1 Fпри избранном движении электрона в ста ционарном состоянии на основании обычных представлений. 0 0 1 FДалее Бор пишет: «Задаваясь вопросом о более глубоком значении найденного соответ ствия, мы вправе, 0 0 1 Fестественно, ожидать, что соответствие не ограничивается совпадением частот спектральных ли ний, 0 0 1 F 0 0 1 Fвычисленных тем и другим мето дом, но простирается и на их интен сивности. Такое ожидание равносильно тому, что вероятность определенного перехода между двумя стационарными состояниями 0 0 1 Fсвязана известным обра зом с амплитудой, соответствующей гармонической компоненте». 0 0 1 F 0 0 1 FПрименение принципа соответст вия позволило определить и поляриза цию в нормальном эффекте Зеемана. Квантовый переход, соответствующий изменению магнитного квантового числа на ± 1, дает 0 0 1 Fкруговую поляриза цию в плоскости, перпендикулярной к силовым линиям. Квантовый переход Am = 0 0 0 1 Fсоответствует линейной поляри зации, параллельной силовым линиям. Но нормальный эффект Зеемана представляет скорее исключение, чем норму. На опыте встречается 16 0 0 1 Fболее сложный эффект: расчленение на не сколько компонентов (мультиплетов). Мультиплетами 0 0 1 F 0 0 1 Fоказываются и линии спектров элементов. Аномальный эф фект и мультиплетная структура спект ров не укладывались в рамки обычной теории Бора. 0 0 1 FС вопросом о сложной структуре линий был тесно связан вопрос о маг нитных свойствах атома. Еще Д. 0 0 1 FС. Рож дественский в своем докладе 15 0 0 1 F декаб ря 1919 г. предполагал, что дублеты п триплеты 0 0 1 Fспектральных линий обуслов лены действием магнитных сил, вы званных движением электронов. 0 0 1 F 0 0 1 F«Маг нитная задача должна лежать в основе задачи об атомах»,—говорил Рождест венский. О.Штерн (1888-1969) и В. Герлах (род. в 1889 г.) в 1921 г. пропустили молекулярный пучок через 0 0 1 Fнеоднород ное магнитное поле и неопровержимо доказали наличие у атомов магнитного момента. Но 0 0 1 F 0 0 1 Fдетали опыта (расщепле ние пучка на два) опять не уклады вались в теорию Бора — Зоммерфельда. В том же, 1921 г. А.Ланде (1888-1975) дал формальную схему описания мультиплетов с помощью векторной модели и ввел связанный с квантовыми числами k и s множитель Ланде. Он также получил 0 0 1 F«двойной магнетизм»: отношение между магнитным и враща тельным моментом атомного остова (т.е. ядра и всех электронов, кроме оптического) оказалось вдвое больше того, который следует из теории Бора — 0 0 1 FЗоммерфельда. Противоречия с теори ей Бора в ее первоначальном варианте накапливались на каждом 0 0 1 Fшагу, и кван товое описание спектроскопических фактов все более и более усложнялось. 0 0 1 FОсобенно тягостное положение со здалось в теории света. Эйнштейн в своей классической работе 1917 г. о световых квантах сделал дальнейший шаг в сторону корпускулярной теории света. Он предположил, 0 0 1 Fчто атом излу чает, «выстреливая» квант света в том или ином направлении (игольчатое излучение). При 0 0 1 F 0 0 1 Fэтом квант света об ладает всеми свойствами материаль ной частицы: энергией Е = hv, массой m. 0 0 1 FЭта идея нашла блестящее под тверждение в открытии, сделанном американским физиком Артуром Комптоном. В 1922 г. Комптон, изучая рассеяние рентгеновских лучей веществом, содержащим слабо 0 0 1 Fсвязан ные электроны (графитом), установил, что частота (длина волны) рассеянных рентгеновских лучей 0 0 1 F 0 0 1 Fизменяется в зави симости от угла рассеяния. С увеличе нием угла рассеяния она уменьшается (длина 0 0 1 Fволны увеличивается), излуче ние становится более «мягким». В 1923 0 0 1 F г. А. Комптон и независимо от него П.Дебай дали теорию «эффек та Комптона». Теория была 0 0 1 Fоснована на идее Эйнштейна: квант света сталки вается с электроном по закону упругого удара. Применяя 0 0 1 Fзаконы сохранения энергии и импульса, Комптон и Дебай получили формулу для изменения дли ны волны рассеянного излучения: 0 0 1 FДебай написал эту формулу в несколько изме ненном виде. Это простое и наглядное объяснение 0 0 1 Fэффекта в сильной степени способствовало укреплению представ ления о кванте света как частице, для 0 0 1 Fкоторой Комптоном был предложен термин «фотон», ставший общеупотре бительным. К 1924 г. в науке о свете создалось тягостное положение, которое очень наглядно охарактеризовал О. Д. Хвольсон. Разделив мелом доску на две части Л и В, он вписал на одной стороне факты, объясняемые 0 0 1 Fволновой теорией света, на другой— факты, объясняемые квантовой теори ей. «Ни волновая, ни квантовая 0 0 1 F 0 0 1 Fтео рии,—говорил в связи с этим принимав ший участие в съезде Эренфест,—не в состоянии охватить все 0 0 1 Fобласти свето вых явлений». Всеобъемлющей теории света, как это констатировал Хвольсон, не было. 0 0 1 F 0 0 1 FВ поисках выхода из тяжелого поло жения авторы предложили даже отка заться от требования 0 0 1 Fприменения зако на сохранения энергии к отдельным актам излучения и поглощения света атомом. Однако гипотеза Бора, Крамерса и Слэтера была опровергнута экспериментами, в которых 0 0 1 Fдоказы валось, что 0 0 1 Fкаждый акт взаимодей ствия света с веществом подчиняется закону сохранения энергии. Идеи де Бройля В 1923 г. в докладах Парижской Академии наук были опубликованы три статьи французского физика Луи де Бройля: «Волны и кванты», «Кванты света, дифракция и интерференция». «Кванты, кинетическая 0 0 1 F 0 0 1 Fтеория газов и принцип ферма», в которых выдви галась совершенно новая идея, перено сящая дуализм в теории света на сами частицы материи. Де Бройль рассматривает некоторый волновой процесс, связанный с телом. движущимся со скоростью v = F 0 6 2с. Эта волна обладает частотой, определяемой соотношением E= hv = mc2, и движется в направлении 0 0 1 Fдвижения тела со ско ростью u=c F 0 6 2. 0 0 1 F «Мы будем рассматривать ее лишь как фиктивную волну, связан ную с перемещением движущегося 0 0 1 F 0 0 1 Fте ла». Де Бройль показывает далее, что для электрона, движущегося по замкну той траектории с 0 0 1 F 0 0 1 Fпостоянной ско ростью, меньшей скорости света, траек тория будет устойчива, если на ней укладывается 0 0 1 Fцелое число таких волн. Условие это совпадает с квантовым усло вием Бора. Скорость частицы v = ре является скоростью группы волн, обладающих частотами, мало отличающимися друг от друга и 0 0 1 Fсоот ветствующими частоте — Эта волна, которую де Бройль называл «волной фазы», пилотирует 17
Когда это происходит, то оказывается, что материнский радиоэлемент и его последующий продукт распада — изотоп (занимающий то же с, мое место в периодической системе) имеют одинаковые химические свойства, несмотря на различие в их атомных массах. Интерпретация периодического закона В 1911 0 0 1 F г. был сформулирован закон ра диоактивных смещений (периодический закон), который в его 0 0 1 Fзаконченной формули ровке оказался чрезвычайно простым и не допускающим никаких исключений. Он стал подлинным фундаментом. Согласно этому закону, испускание F 0 6 2-частицы ведет к смещению 0 0 1 Fрадиоэлемента на одно место вправо в перио дической системе, а испускание а-частицы — к смещению 0 0 1 Fрадиоэле мента на два места в обратном направлении. Поскольку многие а-распады сопровождаются двумя последующими ( F 0 6 2-распадами, то в таких случаях третий продукт распада всегда возвращается — на фоне периодической системы — на место исходного а-излучателя, являясь химически тождественным с ним, несмотря на разницу в четыре единицы в их атомных массах. В 1913 г. они были названы изотопами или изотопными элементами; этот термин означает, что они занимают одно и то же место в периодической 0 0 1 Fсистеме. Изотопы двух разных элементов могут иметь одинаковую атом ную массу, и тогда их называют изобарами. Реже изотопы одного и того же элемента могут иметь одинаковую атомную массу, но разную стабильность, т. е. один из них радиоактивен, а другой— нет. Поскольку а-частица обладает зарядом в две положительные единицы, а заряд F 0 6 2-частицы равен единице со знаком минус, то сразу стало очевидным, что периодический закон отражает связь между химическими свойствами н внутриатомным зарядом, но не массой. В настоящее время периодический закон является in cxtcnto 0 0 1 F (повсюду) выражением, во-первых, атомной (дискрет ной) природы электричества и, во-вторых, 0 0 1 Fнового вида атомисти ки. Aтом Резерфорда-Бора Модели atоma до бора Но вернемся к последовательному изложению развития представлений о строении атома. 0 0 1 FРазвитие исследований радиоактив ного излучения, с одной стороны, и квантовой теории — с другой, привели к созданию квантовой модели атома Резерфорда — Бора. Но созданию этой модели 0 0 1 F 0 0 1 Fпредшествовали попытки по строить модель атома на основе пред ставлений классической 0 0 1 Fэлектродина мики и механики. В 1904 0 0 1 F г. появились публикации о строении атома, при надлежащие одна японскому физику Хантаро Нагаока, другая— английскому физику Д. Томсону. 0 0 1 FНагаока исходил из исследований Максвелла об устойчивости колец Са турна и представил строение 0 0 1 F 0 0 1 Fатома ана логичным строению солнечной систе мы: роль Солнца играет положительно заряженная 0 0 1 Fцентральная часть атома, вокруг которой по установленным коль цеобразным орбитам движутся 0 0 1 F«плане ты»—электроны. При незначительных смещениях электроны возбуждают электромагнитные волны, периоды которых, по расчетам Нагаоки, того же порядка, что и частоты спектральных линий 10 некоторых элементов. В атоме Томсона положительное электричество «размазано» по сфере, в которую вкраплены, как изюм в 0 0 1 Fпудинг, электроны. В простейшем атоме водо рода электрон находится в центре положительно заряженной сферы. При смещении из центра на электрон действует квазиупругая сила 0 0 1 Fэлектро статического 0 0 1 F 0 0 1 Fпритяжения, под действи ем которой электрон совершает колеба ния. Частота этих колебаний 0 0 1 F 0 0 1 Fопреде ляется радиусом сферы, зарядом и мас сой электрона, и если радиус сферы имеет порядок радиуса атома, частота этих колебаний совпадает с частотой колебания спектральной линии атома. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Томсоном. Томсон считал каждую такую конфигурацию определяющей химические свойства атомов. Он предпринял пытку теоретически объяснить периодическую систему элементов Д. И. Менделеева. Эту попытку Бор позднее назвал «знаменитой» и указал, что со времени этой попытки «идея о разделении электронов в атоме на группы сделалась исходным пунктом и более новых воззрений». Отметив, что теория Томсона оказалась несовместимой с опытными фактами, Бор тем не менее считал, что эта теория «содержит много оригинальных мыслей и оказала большое влияние на развитие атомной теории». В 1905 г. В. Вин выступал с докладом об электронах на съезде немецких естествоиспытателей и врачей в Мюнхене. Здесь он, в частности, указывал на трудность объяснения линейчатых спектров атомов с точки зрения электронной теории. Он говорил: «Проще всего было бы понимать каждый атом как планетную систему, которая состоит из положительно заряженного центра, вокруг которого обращаются электроны как планеты. Но такая система не может быть устойчивой вследствие излучаемой электронами энергии. Поэтому мы вынуждены обратиться к системе, в которой электроны находятся в относительном покое или обладают ничтожными скоростями, хотя такое представление содержит много сомнительного». Такой статической моделью был атом Кельвина — Томсона. И эта модель была общепринятой по причинам, указанным Вином. В конце концов оказалось, что новые опытные факты опровергают модель Томсона и, наоборот, свидетельствуют в пользу планетарной модели, факты эти были открыты Резерфордом. 24 мая 1907 г. в Манчестере Резерфорд развернул огромную, привлекая молодых ученых из разных стран мира. Одним из его деятельных сотрудников был немецкий физик Ганс Гейгер, создатель первого счетчика элементарных частиц — счетчика Гейгера. В Манчестере с Резерфордом работали Э. Марсден, К. Фаянс, Г. Мозли, Г. Хевеши и другие физики и химики. В Манчестер в 1912 г. приехал Нильс Бор. В этой атмосфере коллективного научного творчества родились крупные научные достижения 0 0 1 FРезерфорда, из которых в первую очередь следует отметить разгадку природы а-час тиц и открытие ядерного строение атома. Сюда же следует присоединить знаменитые статьи Бора по квантовой теории планетарного атома. В Манчестере было положено начало квантовой и ядерной физике. Открытие атомного ядра Уподобление атома планетной системе делалось еще в самом начале XX в. Но эту модель было трудно 0 0 1 Fсо вместить с законами электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 0 0 1 F 0 0 1 F г. на чались исследования, приведшие к ут верждению планетарной модели. Одна из тем, выдвинутая Резерфордом в Манчестере,—рассеяние а-частиц. Она была поручена Гейгеру и Марсдену. Метод, применявшийся для исследования, заключался в следующем: а-частицы, испускаемые 0 0 1 Fисточ ником, диафрагмировались щелью попадали на экран из сернистого цинка. на котором получалось 0 0 1 Fизображение щели в виде узкой полоски. Затем между щелью и экраном помещали тон кую 0 0 1 Fметаллическую пластинку, изобра жение щели размывалось, что указывало на рассеяние а-частиц веществом пластинки. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы. 0 0 1 FНо наиболее поразительным ока зался факт, открытый Гейгером и Марсденом в 1909 г., — 0 0 1 Fсуществование боль ших углов рассеяния. Некоторая, очень небольшая часть а-частиц (примерно 1/8000) рассеивается на угол, больший прямого, отбрасываясь, таким образом обратно к источнику. Тонкая 0 0 1 Fпластине отбрасывала частицы, летящие с боль шой скоростью. Как раз в том же, 1909 году Резерфорд и 0 0 1 FРойдс неопровержимо доказали, что а-частицы являются дважды ионизированными атомами ге лия. Для 0 0 1 Fтаких тяжелых быстро движу щихся частиц рассеивание на углы большие прямого, казалось весьма 0 0 1 Fне вероятным. Резерфорд говорил, что это так же невероятно, как если бы пуля отскакивала от листа 11 папиросной бумаги. Одно из возможных объяснений аномального рассеяния состояло в том что оно складывается из многих 0 0 1 Fнеболь ших углов отклонений, вызванные атомами рассеивающего вещества. 0 0 1 F 0 0 1 FИсходя из модели Томсона, Резер форд подсчитал, что это не может да вать больших отклонений даже 0 0 1 Fпри многих столкновениях с частицей. И здесь Резерфорд обратился к плане тарной модели. Когда а-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду а-частицы и обратно пропорциональной квадрату расстояния между ними, она движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее 0 0 1 Fпрямолинейный путь, таким обра зом, искривляется, и она отклоняется на угол рассеяния ф. 1 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад «Рассеяние а- и F 0 6 2- 0 0 1 Fлучей и строение атома». В докладе он говорил: «Рассеяние заряжен ных частиц может быть объяснено, 0 0 1 F 0 0 1 Fесли предположить такой атом, кото рый состоит из центрального электри ческого заряда, 0 0 1 Fсосредоточенного в точке и окруженного однородным сфе рическим распределением 0 0 1 Fпротиво положного 0 0 1 Fэлектричества равной ве личины. При таком устройстве атома а- и F 0 6 2-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала». Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов п 0 0 1 F 0 0 1 F 0 0 1 Fв еди нице рассеивающего материала, тол щине рассеивающей пластинки и вели чине b2, выражаемой 0 0 1 Fследующей фор мулой: где Ne— 0 0 1 F заряд в центре атома, Е—за ряд отклоняемой частицы, т—ее масса, и—ее скорость. Кроме 0 0 1 F 0 0 1 Fтого, эта вероят ность зависит от угла рассеяния ф, так что число рассеянных частиц на едини цу площади пропорционально cosec4 (Ф/2). 0 0 1 FВажным следствием теории Резерфорда было указание на заряд атом ного центра, который Резерфорд 0 0 1 Fполо жил равным ± Ne. 0 0 1 F Заряд оказался про порциональным атомному весу. В 1913 0 0 1 F 0 0 1 F г. Гейгер и Марсден предпри няли новую экспериментальную про верку формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими сцинтилляционным вспышкам. Из этих исследований 0 0 1 Fи возникло представле ние о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу. В 1913 г. Ван ден Брук показал, что заряд ядра совпадает с номером элемента в таблице Менделеева. В том же1913 г. Ф. Содди и К. Фаянс пришли закону смещения Содди—Фаянса, ее гласно которому при а- 0 0 1 Fраспаде радио активный продукт смещается в менделеевской таблице на два номера выше а при F 0 6 2-распаде —на номер ниже. К этому же времени Содди пришел представлению об изотопах как разновидностях одного и того же элемент ядра атомов которых имеют одинаковый заряд, но разные массы. В богатом событиям 1913 г. были опубликованы три знаменитые статьи Бора «О строении атомов и молекул», открывшие путь к атомной квантовой механике. Томас Рис Вильсон (1869-1959) 0 0 1 F изо брел замечательный прибор, известный ныне под названием 0 0 1 F«камера Виль сона». Этот прибор позволяет видеть заряженную частицу по оставляемому ею туманному следу. Позднее ученик и сотрудник Резерфорда Блэккет (1897—1974) получил вильсоновскую фотографию 0 0 1 Fрасщеп ления ядра азота а-частицей, первой ядерной реакции, открытой Резерфордом. В этом же году Бор, имевший возможность поработать с автором первой модели атома, а затем с автором планетарной модели, на основе последней создает свою теорию атома Резерфорда-Бора. Знаменитая статья Бора, в которой были заключены основы этой теории, начиналась с указания на модели Резерфорда и Томсона и обсуждения их особенностей и различий. 0 0 1 FРезерфорд сразу понял ре волюционный характер идей Бора и высказал критические замечания по 0 0 1 Fсамым фундаментальным пунктам теории Бора. После длительных ди скуссий статья Бора и две его 0 0 1 F 0 0 1 Fпосле дующие статьи были опубликованы. Однако окончательный ответ на возра жения Резерфорда был 0 0 1 Fдан только со зданием квантовой механики. В 1915 0 0 1 F г. Бор опубли ковал работы «О сериальном спектре водорода и строении атома» и «Спектр водорода и гелия», «О квантовой теории излучения в структуре атома». Он развил исследования, выполненные им в Манчестере в августе 1912 0 0 1 F г., и опу бликовал их под названием «Теория торможения заряженных частиц при их прохождении через вещество». В декабре 1915 и январе 1916 0 0 1 F г. Ар нольд Зоммерфельд (1868—1951) развил теорию Бора, рассмотрев 0 0 1 F 0 0 1 Fдви жение электрона по эллиптическим орбитам и обобщив правила квантова ния Бора. Зоммерфельд дал 0 0 1 Fтакже теорию тонкой структуры спектральных линий, введя релятивистское измене ние массы со 12 0 0 1 Fобязаны переходам электронов на вакантные места во внутренних оболочках. Оно бы ло дано 0 0 1 FЗоммерфельдом в его фунда ментальной работе 1916 г. В том же 1916 г. П. Дебай и П. Шеррер 0 0 1 F 0 0 1 F 0 0 1 Fразработа ли новую методику рентгеновского ана лиза кристаллов в порошке, получив шую широкое распространение в рентгеноструктурном анализе. 0 0 1 FИдеи Бора получили эксперимен тальное подтверждение в опытах Джеймса Франка (1882—1964) и Густава Герца, которые начиная с 1913 г. изучали соударения электронов с атомами паров и газов. Оказалось, что электрон может сталкиваться с атомами газов упруго и неупруго. При упругом ударе 0 0 1 F 0 0 1 Fэлектрон отскакивает от тяжелого атома (напри мер, ртути), не теряя энергии, при не упругом ударе его 0 0 1 Fэнергия теряется и передается атому, который при этом либо возбуждается, либо ионизирует ся. Порции 0 0 1 Fэнергии, затрачиваемые на возбуждение атома, вполне определен ные: так, электрон при столкновении с атомами ртути теряет энергию 4,9 0 0 1 F эВ, что соответствует энергии кванта ультра фиолетового света длиной волны 2537 А. 0 0 1 FКвантовый характер поглощения энергии атомом был продемонстриро ван в опытах Франка, Герца и 0 0 1 Fдругих физиков с поразительной нагляд ностью. За эти исследования, которые продолжались ряд лет, в 1925 г. Франк и Герц были удостоены Нобелевской премии. 0 0 1 FКвантовый характер излучения и по глощения энергии атомом лег в основу теоретического 0 0 1 F 0 0 1 Fисследования о свето вых квантах, выполненного Эйнштей ном в 1916—1917 0 0 1 F гг. В этом исследо вании 0 0 1 FЭйнштейн вывел формулу Планка, исходя из представления о на правленном излучении. Атом излучает и поглощает энергию квантами. Выстреливая квант в определенном направлении, атом сообщает ему не только энергию hv , но и импульс . При излучении молекула газа переходит из энергетического состояния Zm c 0 0 1 F энер гией F 0 6 5m в состояние Zn с энергией F 0 6 5n излучая энергию F 0 6 5m – F 0 6 5n. Поглощая такую же энергию, молекула переходит из состояния Zn в состояние Zm 0 0 1 F. Моле кула может перейти из состояния Zm в состояние Zn 0 0 1 F самопроизвольно, спон танно. Вероятность такого перехода за время dt 0 0 1 F пропорциональна этому про межутку времени dt: 0 0 1 FНо, кроме этого спонтанного перехода, впервые введенного Бором при объя снении спектров, по 0 0 1 FЭйнштейну, для молекул и атомов, находящихся в свето вом поле, возможны индуцированные переходы 0 0 1 Fпод действием светового излучения. Вероятность такого «ин дуцированного излучения»: где p 0 0 1 F —объемная плотность световой энергии. Точно так же вероятность по глощения энергии 0 0 1 Fмолекулой, находя щейся в состоянии Zn и перехода ее на высший энергетический уровень Zm будет: В равновесном состоянии атом в среднем столько же поглощает энергии, сколько и излучает. Поэтому: 0 0 1 Fгде по закону статистики Больцмана число молекул, находящихся в состоя нии Zn, пропорционально: Из предыдущего равенства получается: Положим ет — en =hv, для высоких частот, применяя закон Вина, получим формулу Планка: 0 0 1 FИдея Эйнштейна об индуцирован ном излучении нашла в современной физике и технике важное применение в лазерах. Как было уже сказано, в 1916 г. Зоммерфельд обобщил теорию Бора, введя правила квантования для 0 0 1 Fсистем с не сколькими степенями свободы в виде . 0 0 1 FОн рассмотрел движение по эллип су, введя азимутальные и радиальные квантовые числа. Введя далее 0 0 1 F 0 0 1 Fпростран ственное квантование и третье кванто вое число, он дал теорию нормального эффекта Зеемана. 0 0 1 FНаконец, он дал те орию тонкой структуры спектральных линий и объяснение рентгеновских спектров. 0 0 1 FВсе эти результаты были по дробно разработаны им в классической монографии «Строение атомов и 0 0 1 Fспект ры», первое издание которой вышло в 1917 г. До 1924 г. включительно эта книга выдержала четыре издания. Последнее издание ее уже в двух томах вышло в 1951 г. и русский перевод— в 1956 г. Таким образом, к 1917 г. идеи Бора получили всестороннее развитие как в работах самого Бора, так и 0 0 1 F 0 0 1 Fдругих авто ров. Они были экспериментально под тверждены, и теория Бора получила всеобщее 0 0 1 Fпризнание. Но те трудные во просы, которые были поставлены Резерфордом, еще не были сняты, а многие 0 0 1 Fтрудности, с которыми сталкивалась теория в попытках рассмотреть много электронные атомы, 0 0 1 Fаномальный эффект Зеемана и многое другое, пока зали, что в теории Бора при всех ее успехах есть 15 серьезные недостатки принципиального характера. Трудности и противоречия накопились, и надо было искать выход. Возникновение квантовой механики (1925— 1930 гг) Трудности теории бора 0 0 1 FТеория Бора с самого начала вызы вала многие вопросы, остававшиеся без ответа. Эти вопросы были 0 0 1 F 0 0 1 Fпостав лены Резерфордом еще при обсужде нии рукописи его первой статьи. Как понимать сочетание 0 0 1 Fидей Бора и классической механики, в кото рой нет места для квантовых скачков, и откуда электрон знает, 0 0 1 Fна какую орби ту ему следует перескакивать? В 1896 г. голландский физик Питер Зееман (1865—1943) произвел опыт, который пытался осуществить 0 0 1 Fеще Фарадей. Пламя натриевой горелки он помещал между полюсами электромаг нита и наблюдал в спектроскоп ее спектр. По оси электромагнита был просверлен канал, так что явление можно было 0 0 1 Fнаблюдать не только пер пендикулярно силовым линиям поля (поперечный эффект), но и вдоль поля 0 0 1 F(продольный эффект). При на блюдении поперек поля, кроме линии с частотой колебаний vo, равной 0 0 1 F 0 0 1 Fчасто те колебаний в отсутствие поля, на блюдались две линии с частотами v1=v0- F 0 4 4v и v2=v0- F 0 4 4v. Все три линии линейно поляризованы. Несмещенная линия соответствует колебаниям вдоль силовых линий, 0 0 1 Fсмещен ные — колебаниям, перпендикулярным силовым линиям. При наблюдении вдоль поля 0 0 1 Fнесмещенная компонента отсутствует, смещенные линии поляризованы по кругу в проти воположных направлениях. Лоренц в 1897 г. дал простую теорию эффекта, исходя из представлений, что в атомах электроны 0 0 1 F 0 0 1 Fсовершают круго вые движения с циклической часто той w0 0 0 1 F. В магнитном поле на них дей ствует сила 0 0 1 FЛоренца и частота обра щения изменяется на величину F 0 4 4w 0 0 1 F, рав ную приближенно: Лармор (1857-1942) в 1899 0 0 1 F г. интер претировал действие магнитного поля как действие поля тяжести на 0 0 1 Fволчок. Волчок прецессирует вокруг направле ния силы тяжести с угловой частотой F 0 4 4w. Точно так же вращающиеся электроны в атоме прецессируют вокруг силовых линий магнитного поля с круговой частотой . Зоммерфельд, развивая теорию Бора, ввел идею пространственного квантования. Движение электрона по орбите определяется радиальным и азимутальным квантовыми числами или главным квантовым числом п, 0 0 1 F оп ределяющим энергию электрона, и побочным квантовым числом k, 0 0 1 F опре деляющим форму орбиты. 0 0 1 FПоложение орбиты в пространстве определяется третьим магнитным квантовым чис лом т. Введение 0 0 1 F 0 0 1 Fэтого числа и кван тование направлений оси по отноше нию к магнитному полю позволяет дать объяснение эффекта Зеемана. Однако это объяснение в известном смысле было хуже объяснения, данного Лоренцем. Оно ничего не говорило о поляризации линий. Вообще теория спектров, по Бору и Зоммерфельду, говорила лишь о частотах линий и не могла объяснить их интенсивность и поляризацию. 0 0 1 FЧтобы теория могла что-то сказать об этом, Бор ввел прин цип соответствия. 0 0 1 F 0 0 1 FСогласно этому принципу «сущест вует далеко идущее соответствие» меж ду квантовым и 0 0 1 Fклассическим описа нием излучения. В квантовом описании линии спектра излучения обусловлены 0 0 1 F 0 0 1 Fпереходами из одного состояния в дру гое, в классическом эти линии опре деляются разложением движения электрона в ряд Фурье. При этом, как указывает Н. Бор, «частота излучения, испускаемого при 0 0 1 F 0 0 1 Fпереходе между ста ционарными состояниями, характери зуемыми числами п’ и п”, большим по сравнению с их разностью, совпадает с частотой одной из компонент излучения, которую можно ожидать 0 0 1 Fпри избранном движении электрона в ста ционарном состоянии на основании обычных представлений. 0 0 1 FДалее Бор пишет: «Задаваясь вопросом о более глубоком значении найденного соответ ствия, мы вправе, 0 0 1 Fестественно, ожидать, что соответствие не ограничивается совпадением частот спектральных ли ний, 0 0 1 F 0 0 1 Fвычисленных тем и другим мето дом, но простирается и на их интен сивности. Такое ожидание равносильно тому, что вероятность определенного перехода между двумя стационарными состояниями 0 0 1 Fсвязана известным обра зом с амплитудой, соответствующей гармонической компоненте». 0 0 1 F 0 0 1 FПрименение принципа соответст вия позволило определить и поляриза цию в нормальном эффекте Зеемана. Квантовый переход, соответствующий изменению магнитного квантового числа на ± 1, дает 0 0 1 Fкруговую поляриза цию в плоскости, перпендикулярной к силовым линиям. Квантовый переход Am = 0 0 0 1 Fсоответствует линейной поляри зации, параллельной силовым линиям. Но нормальный эффект Зеемана представляет скорее исключение, чем норму. На опыте встречается 16 0 0 1 Fболее сложный эффект: расчленение на не сколько компонентов (мультиплетов). Мультиплетами 0 0 1 F 0 0 1 Fоказываются и линии спектров элементов. Аномальный эф фект и мультиплетная структура спект ров не укладывались в рамки обычной теории Бора. 0 0 1 FС вопросом о сложной структуре линий был тесно связан вопрос о маг нитных свойствах атома. Еще Д. 0 0 1 FС. Рож дественский в своем докладе 15 0 0 1 F декаб ря 1919 г. предполагал, что дублеты п триплеты 0 0 1 Fспектральных линий обуслов лены действием магнитных сил, вы званных движением электронов. 0 0 1 F 0 0 1 F«Маг нитная задача должна лежать в основе задачи об атомах»,—говорил Рождест венский. О.Штерн (1888-1969) и В. Герлах (род. в 1889 г.) в 1921 г. пропустили молекулярный пучок через 0 0 1 Fнеоднород ное магнитное поле и неопровержимо доказали наличие у атомов магнитного момента. Но 0 0 1 F 0 0 1 Fдетали опыта (расщепле ние пучка на два) опять не уклады вались в теорию Бора — Зоммерфельда. В том же, 1921 г. А.Ланде (1888-1975) дал формальную схему описания мультиплетов с помощью векторной модели и ввел связанный с квантовыми числами k и s множитель Ланде. Он также получил 0 0 1 F«двойной магнетизм»: отношение между магнитным и враща тельным моментом атомного остова (т.е. ядра и всех электронов, кроме оптического) оказалось вдвое больше того, который следует из теории Бора — 0 0 1 FЗоммерфельда. Противоречия с теори ей Бора в ее первоначальном варианте накапливались на каждом 0 0 1 Fшагу, и кван товое описание спектроскопических фактов все более и более усложнялось. 0 0 1 FОсобенно тягостное положение со здалось в теории света. Эйнштейн в своей классической работе 1917 г. о световых квантах сделал дальнейший шаг в сторону корпускулярной теории света. Он предположил, 0 0 1 Fчто атом излу чает, «выстреливая» квант света в том или ином направлении (игольчатое излучение). При 0 0 1 F 0 0 1 Fэтом квант света об ладает всеми свойствами материаль ной частицы: энергией Е = hv, массой m. 0 0 1 FЭта идея нашла блестящее под тверждение в открытии, сделанном американским физиком Артуром Комптоном. В 1922 г. Комптон, изучая рассеяние рентгеновских лучей веществом, содержащим слабо 0 0 1 Fсвязан ные электроны (графитом), установил, что частота (длина волны) рассеянных рентгеновских лучей 0 0 1 F 0 0 1 Fизменяется в зави симости от угла рассеяния. С увеличе нием угла рассеяния она уменьшается (длина 0 0 1 Fволны увеличивается), излуче ние становится более «мягким». В 1923 0 0 1 F г. А. Комптон и независимо от него П.Дебай дали теорию «эффек та Комптона». Теория была 0 0 1 Fоснована на идее Эйнштейна: квант света сталки вается с электроном по закону упругого удара. Применяя 0 0 1 Fзаконы сохранения энергии и импульса, Комптон и Дебай получили формулу для изменения дли ны волны рассеянного излучения: 0 0 1 FДебай написал эту формулу в несколько изме ненном виде. Это простое и наглядное объяснение 0 0 1 Fэффекта в сильной степени способствовало укреплению представ ления о кванте света как частице, для 0 0 1 Fкоторой Комптоном был предложен термин «фотон», ставший общеупотре бительным. К 1924 г. в науке о свете создалось тягостное положение, которое очень наглядно охарактеризовал О. Д. Хвольсон. Разделив мелом доску на две части Л и В, он вписал на одной стороне факты, объясняемые 0 0 1 Fволновой теорией света, на другой— факты, объясняемые квантовой теори ей. «Ни волновая, ни квантовая 0 0 1 F 0 0 1 Fтео рии,—говорил в связи с этим принимав ший участие в съезде Эренфест,—не в состоянии охватить все 0 0 1 Fобласти свето вых явлений». Всеобъемлющей теории света, как это констатировал Хвольсон, не было. 0 0 1 F 0 0 1 FВ поисках выхода из тяжелого поло жения авторы предложили даже отка заться от требования 0 0 1 Fприменения зако на сохранения энергии к отдельным актам излучения и поглощения света атомом. Однако гипотеза Бора, Крамерса и Слэтера была опровергнута экспериментами, в которых 0 0 1 Fдоказы валось, что 0 0 1 Fкаждый акт взаимодей ствия света с веществом подчиняется закону сохранения энергии. Идеи де Бройля В 1923 г. в докладах Парижской Академии наук были опубликованы три статьи французского физика Луи де Бройля: «Волны и кванты», «Кванты света, дифракция и интерференция». «Кванты, кинетическая 0 0 1 F 0 0 1 Fтеория газов и принцип ферма», в которых выдви галась совершенно новая идея, перено сящая дуализм в теории света на сами частицы материи. Де Бройль рассматривает некоторый волновой процесс, связанный с телом. движущимся со скоростью v = F 0 6 2с. Эта волна обладает частотой, определяемой соотношением E= hv = mc2, и движется в направлении 0 0 1 Fдвижения тела со ско ростью u=c F 0 6 2. 0 0 1 F «Мы будем рассматривать ее лишь как фиктивную волну, связан ную с перемещением движущегося 0 0 1 F 0 0 1 Fте ла». Де Бройль показывает далее, что для электрона, движущегося по замкну той траектории с 0 0 1 F 0 0 1 Fпостоянной ско ростью, меньшей скорости света, траек тория будет устойчива, если на ней укладывается 0 0 1 Fцелое число таких волн. Условие это совпадает с квантовым усло вием Бора. Скорость частицы v = ре является скоростью группы волн, обладающих частотами, мало отличающимися друг от друга и 0 0 1 Fсоот ветствующими частоте — Эта волна, которую де Бройль называл «волной фазы», пилотирует 17
WebElements Periodic Table »Прометий» Свойства свободных атомов
Атомы прометия имеют 61 электрон, а структура оболочки – 2.8.18.23.8.2.
Электронная конфигурация основного состояния газообразного нейтрального прометия в основном состоянии равна [ Xe ]. 4ф 5 . 6s 2 , а символ термина – это 6 H 5/2 .
Схематическая электронная конфигурация прометия.Косселевская оболочка прометия.Атомный спектр
Представление атомного спектра прометия.
Энергии ионизации и сродство к электрону
Сродство к электрону прометия составляет 50 кДж моль ‑1 . Энергии ионизации прометия приведены ниже.
Энергии ионизации прометия.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff .Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 59,80 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 44,97 | 2 пол. | 56,74 | ||||
| 3с | 41,18 | 3 пол. | 41,55 | 3d | 47,10 | ||
| 4с | 31,64 | 4п | 30.62 | 4д | 27,74 | 4f | 23,13 |
| 5с | 18,84 | 5 пол | 16,41 | 5d | (нет данных) | ||
| 6с | 9,40 | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди, В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 45184 [1] |
| L I | 2s | 7428 [1] |
| L II | 2p 1/2 | 7013 [1] |
| L III | 2p 3/2 | 6459 [1] |
| M I | 3s | – |
| M II | 3п 1/2 | 1471.4 [1] |
| M III | 3p 3/2 | 1357 [1] |
| M IV | 3d 3/2 | 1052 [1] |
| M V | 3d 5/2 | 1027 [1] |
| N I | 4s | – |
| N II | 4p 1/2 | 242 [1] |
| N III | 4p 3/2 | 242 [1] |
| N IV | 4d 3/2 | 120 [1] |
| N V | 4d 5/2 | 120 [1] |
| N VI | 4f 5/2 | – |
| N VII | 4f 7/2 | – |
| 5s | – | |
| O II | 5p 1/2 | – |
| O III | 5p 3/2 | – |
Банкноты
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов.Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- Д.Р. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Promethium – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: прометий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Мира Сентилингам
На этой неделе мы вступаем в мир греческой мифологии, чтобы раскрыть великие силы элемента прометия.
Брайан Клегг
Из всех фигур греческого мифа Прометей должен быть одним из самых значимых для науки. Этот Титан принес человечеству огонь. За этот дар он был наказан тем, что орел каждый день выклевывал ему печень. Такова была награда за то, что он был первым технологом.
В других легендах Прометей дал нам математику и науку, сельское хозяйство и медицину – или даже создал людей. Эта неуверенность в том, за что был ответственен Прометей, перекликается с неуверенностью в том, кто открыл элемент прометий, номер 61 в периодической таблице.
Мы знаем, кто это назвал. Это была Грейс Кориелл, жена Чарльза Кориелла, которая вместе с коллегами Джейкобом Марински и Лоуренсом Гленденином производила прометий в Национальной лаборатории Ок-Ридж, недалеко от Ноксвилла, штат Теннесси, в 1945 году.Миссис Кориелл якобы чувствовала, что они, как Прометей, крадут огонь у богов – предположительно, это отсылка к программе создания атомной бомбы, а не к чему-либо значительному в отношении самого прометия. Но это не первое упоминание об элементе 61.
Еще в 1902 году высказывались подозрения, что такой элемент должен существовать. Прометий находится в лантаноидах, плавающем стержне элементов, который протискивается между барием и лютецием. Редкоземельные элементы по обе стороны от него, неодим и самарий, по-видимому, не имели правильного соотношения по своим химическим свойствам, чтобы быть соседями.Как будто между ними был разрыв, и чешский химик Джон Богуслав Браннер подозревал, что недостающий элемент заполнил этот промежуток.
Это подозрение было усилено Генри Мозли, английским физиком, который структурировал понятие атомного числа, понимая, что оно отражает количество протонов в ядре атома. То, что до этого было довольно произвольной системой нумерации, получило особое значение – и в 1914 году Мозли понял, что в числе 61 отсутствует элемент.
До того, как группа Кориелла выделила прометий, в 1920-х годах было по крайней мере двое других, которые утверждали, что нашли элемент 61. Итальянская группа обнаружила то, что они назвали флорентием в честь своего города, а американская группа в Иллинойсе придумала иллиний. Обе эти находки были объявлены в 1926 году, первыми опубликовали американцы, а за ними сразу же последовали итальянцы, заявившие о приоритете, потому что результаты у них были заперты в сейфе, датируемом двумя годами ранее. Но на практике ни один из этих результатов не мог быть воспроизведен, и, за исключением неудачной попытки в 1938 году в Университете штата Огайо, открытие оставалось невостребованным до выделения прометия в 1945 году.Это был побочный продукт уранового топлива в одном из первых реакторов, который использовался для производства плутония для атомной бомбы. Команда Кориелла намеревалась назвать его клинтонием в честь лабораторий Клинтона, где они работали, пока миссис Кориелл не убедила их, что классическое название лучше.
Одна из причин, по которой прометий был настолько неуловимым для элемента с относительно низким атомным номером, заключается в том, что он не имеет стабильного состояния – это один из двух элементов ниже 83, который имеет только радиоактивные изотопы, а другим является технеций.Самая стабильная форма прометия имеет период полураспада всего 17,7 лет – это прометий 145 – поэтому неудивительно, что его оказалось трудно определить, хотя он действительно встречается в крошечных количествах в рудной урановой обманке, когда уран-238 самопроизвольно расщепляется. Добываемые количества настолько малы – около триллионной грамма на тонну руды, – что прометий вряд ли удастся обнаружить таким способом. Однако было бы неправильно сказать, что прометий в природе незначителен. Он был обнаружен с помощью спектроскопов, устройств, которые анализируют материалы по испускаемому ими свету, на звезде HR465 в созвездии Андромеды.Никто не совсем уверен, почему эта звезда выкачивает, должно быть, значительные количества прометия.
Этот серый металлический элемент испускает бета-частицы – электроны из ядра – при распаде. Они сами по себе могут вызвать радиоактивное повреждение, но прометей, вероятно, наиболее опасен, потому что эти бета-частицы генерируют рентгеновские лучи, когда попадают в тяжелые ядра, заставляя образец прометия омывать окружающую среду постоянным низкодозированным рентгеновским лучом.
Первоначально он использовался для замены радия в светящихся циферблатах, когда стало ясно, что радий слишком опасен.Хлорид прометия смешивали с люминофором, который светится желто-зеленым или синим светом при попадании на них радиации. Однако, когда опасность радиоактивных свойств элемента стала очевидной, он тоже был исключен с внутреннего рынка светящихся в темноте, а теперь используется только в специализированных приложениях.
Очевидно, что прометий используется для портативных рентгеновских устройств, хотя это приложение еще не было разработано должным образом. Вместо этого бета-излучение элемента использовалось в промышленности для измерения толщины материалов, а изотоп прометий 147 использовался в ядерных батареях.Это источники питания с длительным сроком службы, которые используют бета-излучение (которое, в конце концов, состоит из электронов, источника электрического тока) для выработки энергии. Такие батареи, часто менее сантиметра в диаметре, могут проработать около пяти лет, что в два раза превышает период полураспада прометия 147. Их использовали во всем, от ракет до кардиостимуляторов.
На заре своего существования атомная энергетика, казалось, обещала огромное количество дешевой портативной энергии. В научной фантастике того времени были представлены генераторы размером с грецкий орех, которые могли управлять домашним хозяйством, и все они работали на ядерном расщеплении.В ядерных батареях прометий максимально приближен к портативному источнику энергии на ядерной энергии. Так что, по крайней мере, в этом небольшом смысле он соответствует титану, в честь которого был назван – Прометею, несущему огонь.
Meera Senthilingam
Таким образом, поставщик портативных и долговечных источников энергии назван в честь разжигателя огня. Это научный писатель Брайан Клегг рассказал нам о мощной и мифологической химии прометия. А на следующей неделе элемент, который буквально уносит нас в космос.
Ричард Корфилд
Несмотря на свою редкость и опасность, кажется уместным, что элемент, впервые синтезированный во время глобального конфликта, в результате которого были разработаны транспортные средства, которые однажды доставят нас на Луну и дальше, теперь имеет решающее значение для освоения космоса , предоставляя нашим пионерам робототехники не только мощность, но и возможность анализировать внеземные материалы.
Meera Senthilingam
Пытаетесь угадать, что это за чудесный элемент? Присоединяйтесь к Ричарду Корфилду, чтобы узнать об открытии, химии и применении элемента кюрия в химии в его элементе на следующей неделе.А пока я Мира Сентилингам, и спасибо за внимание.
(Промо)
(Окончание промо)
прометий | химический элемент | Britannica
прометий (Pm) , химический элемент, единственный редкоземельный металл из ряда лантанидов периодической таблицы, не встречающийся в природе на Земле.
Неопровержимое химическое доказательство существования прометия, последнего из редкоземельных элементов, которые были обнаружены, было получено в 1945 году (но не объявлено до 1947 года) американскими химиками Джейкобом А.Маринский, Лоуренс Э. Гленденин и Чарльз Д. Кориелл, которые выделили радиоактивные изотопы прометия-147 (период полураспада 2,62 года) и прометия-149 (период полураспада 53 часа) из продуктов деления урана в лабораториях Клинтона (ныне Национальная лаборатория Ок-Ридж) в Теннесси. Идентификация была твердо установлена с помощью ионообменной хроматографии. (Ранее исследователи думали, что они нашли элемент с атомным номером 61 в редких землях, встречающихся в природе, и преждевременно назвали его иллинием и флорентием.)
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов. Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
Прометий-147 эффективно отделяется от других продуктов деления редкоземельных элементов методом ионного обмена. Прометий был также получен бомбардировкой медленными нейтронами изотопа неодима-146; образующийся изотоп, неодим-147, распадается посредством электронной эмиссии до прометия-147. Сам металл был впервые получен в 1963 году путем восстановления фторида PmF 3 литием. Известны две аллотропные (структурные) модификации прометия: α-фаза является двойной плотноупакованной гексагональной с a = 3.65 Å и c = 11,65 Å при комнатной температуре. Β-фаза является объемно-центрированной кубической с a = 4,10 Å (оценка) при 890 ° C (1634 ° F).
Все изотопы прометия нестабильны; самым долгоживущим является прометий-145 (период полураспада 17,7 года). За исключением ядерных изомеров, всего известно 38 радиоактивных изотопов прометия. Их масса составляет от 126 до 163. Наименее стабильный изотоп, прометий-128, имеет период полураспада в одну секунду. Из-за коротких периодов полураспада его изотопов любой прометий, который может возникнуть в результате спонтанного деления урана в урановых рудах, будет обнаруживаться в бесконечно малых концентрациях.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасИзвестные применения прометия связаны с его радиоактивностью. Его мягкое излучение бета-частиц может быть преобразовано в электричество в миниатюрных батареях, образованных путем размещения прометия между пластинами полупроводника, такого как кремний; эти батареи работают при экстремальных температурах до пяти лет. Другое использование – в качестве источников бета-излучения, например, в источниках света, в которых используются люминофоры для поглощения бета-излучения и преобразования его в видимый свет.
По своим физическим и химическим свойствам прометий аналогичен типичным редкоземельным элементам. Он трехвалентен по своим соединениям и растворам, большинство из которых розовые или розовые.
| атомный номер | 61 |
|---|---|
| наиболее стабильный изотоп | (145) |
| точка плавления | 1,042 ° C (1,908 ° F) |
| точка кипения | 3000 ° C (5432 ° F) (расчетная) |
| удельный вес | 7.264 (при 24 ° C [75 ° F]) |
| степень окисления | 3 |
| электронная конфигурация | [Xe] 4 f 5 6 s 2 |
Прометий (PM) | АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ ®
О прометии
Все изотопы прометия радиоактивны и имеют короткий период полураспада, поэтому заметные количества не встречаются в природных источниках. Существование неизвестного элемента с атомным номером 61 было предсказано в 1914 году Генри Мосли, но этот металл не был успешно произведен и полностью охарактеризован до 1945 года.Это было достигнуто Джейкобом А. Маринским, Лоуренсом Э. Гленденином и Чарльзом Д. Кориеллом в Национальной лаборатории Ок-Ридж путем разделения и анализа продуктов деления урана. Название произошло от Титана в греческой мифологии, который украл огонь с горы Олимп, чтобы передать его людям, Прометей. Поскольку элемент можно получить только в лаборатории, у него мало приложений. Единственный изотоп прометия, используемый вне исследований, – это прометий-147, который производится и используется в очень малых (миллиграммах) количествах в атомных батареях и сигнальных лампах, содержащих люминофоры, которые излучают свет в ответ на поглощение излучения, испускаемого изотопом.Поскольку этот относительно стабильный изотоп излучает рентгеновское излучение, теоретически его можно использовать для портативных источников рентгеновского излучения.
Promethium Свойства
Прометий – это элемент блока F, группы 3, периода 6. Число электронов в каждой из оболочек Прометия равно 2, 8, 18, 23, 8, 2, а его электронная конфигурация – [Xe] 4f 5 6s 2 . Атом прометия имеет радиус 183.pm, а радиус Ван-дер-Ваальса равен 236.pm. В своей элементарной форме, CAS 7440-12-2, прометий имеет металлический вид.Прометий был открыт Чиен Шиунг Ву, Эмилио Сегре и Хансом Бете в 1942 году. Впервые он был выделен Дж. А. Маринским, Лоуренсом Гленденином и Чарльзом Д. Кориеллом в 1945 году. Название элемента происходит из греческой мифологии в честь титана Прометея, который украл огонь Зевса и дал его человечеству.
Прометий радиоактивен. Информация о Promethium, включая технические данные, свойства и другие полезные факты, указана ниже. Включены научные факты, такие как атомная структура, энергия ионизации, изобилие на Земле, проводимость и тепловые свойства.
| Символ: | вечера |
|---|---|
| атомный номер: | 61 |
| Атомный вес: | 145 |
| Категория элемента: | Лантаноид |
| Группа, период, блок: | н / д, 6, ф |
| Цвет: | серебристо-белый / металлик |
| Другие имена: | Prometio, Promécio |
| Точка плавления: | 1042 ° С, 1907 г.6 ° F, 1315,15 К |
|---|---|
| Температура кипения: | 3000 ° С, 5432 ° F, 3273,15 К |
| Плотность: | 7,26 г · см 3 |
| Плотность жидкости при температуре плавления: | НЕТ |
| Плотность при 20 ° C: | 7,220 г / см 3 |
| Плотность твердого вещества: | 7264 кг · м 3 |
| Удельная теплоемкость: | НЕТ |
| Температура сверхпроводимости: | НЕТ |
| Тройная точка: | НЕТ |
| Критическая точка: | НЕТ |
| Теплота плавления (кДж · моль -1 ): | около 7.7 |
| Теплота испарения (кДж · моль -1 ): | 290 |
| Теплота распыления (кДж · моль -1 ): | около 350 |
| Теплопроводность: | 17,9 Вт · м -1 · К -1 |
| Тепловое расширение: | (r.t.) (поли) оценка 11 мкм / (м · К) |
| Удельное электрическое сопротивление: | (г.т.) оцен. 0,75 нОм · м |
| Прочность на разрыв: | НЕТ |
| Молярная теплоемкость: | НЕТ |
| Модуль Юнга: | (форма) оценка 46 ГПа |
| Модуль сдвига: | (форма) оцен. 18 ГПа |
| Модуль объемной упругости: | (форма) оцен. 33 ГПа |
| Коэффициент Пуассона: | (форма) оценка 0.28 |
| Твердость по шкале Мооса: | НЕТ |
| Твердость по Виккерсу: | НЕТ |
| Твердость по Бринеллю: | НЕТ |
| Скорость звука: | НЕТ |
| Pauling Электроотрицательность: | НЕТ |
| Sanderson Электроотрицательность: | НЕТ |
| Allred Rochow Электроотрицательность: | 1.07 |
| Mulliken-Jaffe Электроотрицательность: | НЕТ |
| Allen Электроотрицательность: | НЕТ |
| Полинг Электропозитивность: | НЕТ |
| Отражательная способность (%): | НЕТ |
| Показатель преломления: | НЕТ |
| Электронов: | 61 |
|---|---|
| Протонов: | 61 |
| Нейтронов: | 84 |
| Электронная конфигурация: | [Xe] 4f 5 6s 2 |
| Атомный радиус: | 183 вечера |
| Атомный радиус, несвязанный (Å): | 2.38 |
| Ковалентный радиус: | 199 вечера |
| Ковалентный радиус (Å): | 1.86 |
| Van der Waals Радиус: | 236 часов |
| Степени окисления: | 3 (слабощелочная окись) |
| Фаза: | Цельный |
| Кристаллическая структура: | шестиугольник |
| Магнитный Заказ: | парамагнитный |
| Сродство к электрону (кДж · моль -1 ) | Неизвестно |
| 1 st Энергия ионизации: | 538.39 кДж · моль -1 |
| 2 nd Энергия ионизации: | 1051,70 кДж · моль -1 |
| 3 rd Энергия ионизации: | 2151,64 кДж · моль -1 |
| Номер CAS: | 7440-12-2 |
|---|---|
| Номер ЕС: | НЕТ |
| Номер в лей: | НЕТ |
| Beilstein Номер: | НЕТ |
| SMILES Идентификатор: | [мкм] |
| Идентификатор InChI: | дюймов = 1S / Pm |
| Ключ InChI: | VQMWBBYLQSCNPO-UHFFFAOYSA-N |
| PubChem CID: | 23944 |
| ChemSpider ID: | 22386 |
| Земля – Всего: | НЕТ |
|---|---|
| Меркурий – Всего: | НЕТ |
| Венера – Всего: | НЕТ |
| Земля – морская вода (океаны), частей на миллиард по массе: | НЕТ |
| Земля – морская вода (океаны), частей на миллиард по атомам: | НЕТ |
| Земля – кора (горные породы), частей на миллиард по массе: | НЕТ |
| Земля – Кора (горные породы), частей на миллиард по атомам: | НЕТ |
| Солнце – Всего, частей на миллиард по массе: | НЕТ |
| Солнце – Всего, ppb по атомам: | НЕТ |
| Поток, частей на миллиард по массе: | НЕТ |
| Поток, ppb по атомам: | НЕТ |
| Метерорит (углеродистый), частей на миллиард по массе: | НЕТ |
| Метерорит (углеродистый), частей на миллиард по атомам: | НЕТ |
| Типичное человеческое тело, частей на миллиард по массе: | НЕТ |
| Типичное человеческое тело, частей на миллиард на атом: | НЕТ |
| Вселенная, весовых частей на миллиард: | НЕТ |
| Вселенная, частей на миллиард на атом: | НЕТ |
| Обнаружил: | Чиен Шиунг Ву, Эмилио Сегре, Ханс Бете |
|---|---|
| Дата открытия: | 1942 |
| Первая изоляция: | Чарльз Д.Кориелл, Джейкоб А. Марински, Лоуренс Э. Гленденин, Гарольд Г. Рихтер (1945) |
Изотопы прометия
Прометий (Pm) не существует в природе (за исключением следовых количеств от спонтанного деления и альфа-распада 151 Eu). В нем нет стабильных изотопов.
| Нуклид | Изотопная масса | Период полураспада | Режим распада | Nuclear Spin | Магнитный момент | Энергия связи (МэВ) | Естественное изобилие (% по атомам) | |
|---|---|---|---|---|---|---|---|---|
| 126 пм | 125.95752 (54) # | 0,5 # с | Неизвестно | НЕТ | НЕТ | 996.05 | – | |
| 127 PM | 126.95163 (64) # | 1 # с | Неизвестно | 5/2 + # | Н / Д | 1004,13 | – | |
| 128 PM | 127,94842 (43) # | 1,0 (3) с | ß + по 128 Nd; p по номеру 127 Nd | 6 + # | N / A | 1021.53 | – | |
| 129 Pm | 128.94316 (43) # | 3 # s [> 200 нс] | ß + до 129 Nd | 5/2 + # | N / A | 1029,61 | – | |
| 130 Pm | 129,94045 (32) # | 2,6 (2) с | ß + до 130 Nd; ß + + p до 129 Pr | (5 +, 6 +, 4 +) | Н / Д | 1037.68 | – | |
| 131 Pm | 130.93587 (21) # | 6,3 (8) s | ß + + p до 130 Pr; ß + до 131 Nd | 5/2 + # | НЕТ | 1055.08 | – | |
| 132 PM | 131,93375 (21) # | 6,2 (6) с | ß + до 132 Nd; ß + + p до 131 Pr | (3+) | НЕТ | 1063.16 | – | |
| 133 PM | 132, (5) | 15 (3) с | ß + до 133 Nd | (3/2 +) | Н / Д | 1080,55 | – | |
| 134 Pm | 133, (6) | 22 (1) с | ß + до 134 Nd | (5+) | НЕТ | 1088.63 | – | |
| 135 Пм | 134. (6) | 49 (3) с | ß + до 135 Nd | (5/2 +, 3/2 +) | Н / Д | 1096,71 | – | |
| 136 Pm | 135. (8) | 107 (6) s | ß + до 136 Nd | (5-) | Н / Д | 1104,79 | – | |
| 137 Pm | 136.9 (14) | 2 # min | ß + до 137 Nd | 5/2 + # | N / A | 1112.87 | – | |
| 138 Pm | 137. | 8 (30) | 10 (2) с | ß + до 138 Nd | 1 + # | N / A | 1130.26 | – |
| 139 Pm | 138, | 4,15 (5) мин | ß + до 139 Nd | (5/2) + | Н / Д | 1138,34 | – | |
| 140 PM | 139. | (4) | 9,2 (2) с | ß + до 140 Nd | 1+ | НЕТ | 1146,42 | – |
| 141 Pm | 140.5 (15 ) | 20,90 (5) мин | ß + до 141 Nd | 5/2 + | НЕТ | 1154,5 | – | |
| 142 Pm | 141, | 4 (27)40,5 (5) с | ß + от до 142 Nd | 1+ | Н / Д | 1162.58 | – | |
| 143 Pm | 142. | 3 (4) | 265 (7) d | EC до 143 Nd | 5/2 + | 3.8 | 1170.66 | – |
| 144 Pm | 143. | 1 (3)363 (14) d | EC к 144 Nd | 5- | 1,7 | 1178,73 | – | |
| 145 Pm | 144.9 (3) | 17.7 (4) y | EC до 145 Nd; от a до 141 Pr | 5/2 + | НЕТ | 1186,81 | – | |
| 146 Pm | 145. | |||||||
| 5,53 (5) y | EC к 146 Nd; ß – до 146 Sm | 3- | НЕТ | 1194,89 | – | |||
| 147 Pm | 146, | 85 (26)2,6234 (2) y | ß – С по 147 Sm | 7/2 + | 2.6 | 1202.97 | – | |
| 148 Pm | 147. | 5 (7)5,368 (2) d | ß – до 148 Sm | 1- | 2 | 1211.05 | – | |
| 149 Pm | 148. | 4 (4)53,08 (5) h | ß – до 149 Sm | 7/2 + | 3.3 | 1219.13 | – | |
| 150 Пм | 149. | 4 (22) | 2,68 (2) h | ß – до 150 Sm | (1-) | НЕТ | 1217,89 | – |
| 151 Pm | 150. | 7 (6) | 28,40 (4) h | ß – до 151 Sm | 5/2 + | 1,8 | 1225,97 | – |
| 152 Pm | 151, | |||||||
| 4,12 (8) мин. | ß – от до 152 Sm | 1+ | НЕТ | 1234.05 | – | |||
| 153 Pm | 152. | |||||||
| 5,25 (2) мин | ß – до 153 Sm | 5 / 2- | НЕТ | 1242,13 | – | |||
| 154 Pm | 153, (5) | 1,73 (10) мин | ß – до 154 Sm | (0,1) | НЕТ | 1250,21 | – | |
| 155 МП | 154. (3) | 41,5 (2) с | ß – от до 155 Sm | (5 / 2-) | Н / Д | 1258,28 | – | |
| 156 PM | 155.93106 (4) | 26.70 (10) s | ß – до 156 Sm | 4- | Н / Д | 1257.05 | – | |
| 157 Pm | 156.93304 ( 12) | 10,56 (10) с | ß – до 157 Sm | (5 / 2-) | Н / Д | 1265.13 | – | |
| 158 Pm | 157.93656 (14) | 4,8 (5) с | ß – до 158 Sm | НЕТ | НЕТ | 1273,2 | – | |
| 159 Pm | 158.93897 (21) # | 1,47 (15) с | ß – до 159 Sm | 5 / 2- # | N / A | 1281,28 | – | |
| 160 МП | 159.94299 (32) # | 2 # s | ß – от до 160 Sm | НЕТ | НЕТ | 1280.05 | – | |
| 161 PM | 160.94586 (54 ) # | 700 # мс | ß – от до 161 Sm | 5 / 2- # | НЕТ | 1288.12 | – | |
| 162 Pm | 161.95029 (75) # | 500 # ms | ß – от до 162 Sm | НЕТ | НЕТ | 1286.89 | – | |
| 163 Pm | 162.95368 (86) # | 200 # мс | ß – до 163 Sm | 5 / 2- # | N / A | 1294.96 | – |
Прометий – Энциклопедия Нового Света
| Общие | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Имя, символ, номер | прометий, Pm, 61 | |||||||||||||||||||||||||||
| Химическая серия | лантаноидов | |||||||||||||||||||||||||||
| Группа, Период, Блок | н / д, 6, ф | |||||||||||||||||||||||||||
| Внешний вид | металлик | |||||||||||||||||||||||||||
| Атомная масса | [145] (0) г / моль | |||||||||||||||||||||||||||
| Электронная конфигурация | [Xe] 4f 5 6s 2 | |||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 23, 8, 2 | |||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||
| Фаза | твердый | |||||||||||||||||||||||||||
| Плотность (около р.т.) | 7,26 г / см³ | |||||||||||||||||||||||||||
| Температура плавления | 1315 К (1042 ° С, 1908 ° F) | |||||||||||||||||||||||||||
| Температура кипения | 3273 К (3000 ° C, 5432 ° F) | |||||||||||||||||||||||||||
| Теплота плавления | 7,13 кДж / моль | |||||||||||||||||||||||||||
| Теплота испарения | 289 кДж / моль | |||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||
| Кристаллическая структура | шестиугольник | |||||||||||||||||||||||||||
| Степени окисления | 3 (слабощелочная окись) | |||||||||||||||||||||||||||
| Электроотрицательность | ? 1.13 (шкала Полинга) | |||||||||||||||||||||||||||
| Энергии ионизации (подробнее) | 1st: 540 кДж / моль | |||||||||||||||||||||||||||
| 2-я: 1050 кДж / моль | ||||||||||||||||||||||||||||
| 3-я: 2150 кДж / моль | ||||||||||||||||||||||||||||
| Атомный радиус | 185 вечера | |||||||||||||||||||||||||||
| Атомный радиус (расч.) | 205 вечера | |||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||||
| Магнитный заказ | нет данных | |||||||||||||||||||||||||||
| Удельное электрическое сопротивление | (г.т.) оцен. 0,75 мкОм · м | |||||||||||||||||||||||||||
| Теплопроводность | (300 K) 17,9 Вт / (м · K) | |||||||||||||||||||||||||||
| Тепловое расширение | (r.t.) (α, поли) оцен. 11 мкм / (м · К) | |||||||||||||||||||||||||||
| Скорость звука (тонкий стержень) | (r.t.) (α-форма) оценка 46 м / с | |||||||||||||||||||||||||||
| Модуль сдвига | (α-форма) оцен. 18 ГПа | |||||||||||||||||||||||||||
| Объемный модуль | (α-форма) оцен. 33 ГПа | |||||||||||||||||||||||||||
| Коэффициент Пуассона | (форма α) оцен.0,28 | |||||||||||||||||||||||||||
| Регистрационный номер CAS | 7440-12-2 | |||||||||||||||||||||||||||
| Известные изотопы | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Прометий (химический символ Pm , атомный номер 61) – это металлический элемент, который является членом ряда химических элементов лантаноидов.Все его изотопы радиоактивны. В качестве источника бета-излучения он используется в толщиномерах и в световых сигналах, в которых люминофор активируется бета-лучами. Он также используется в виде ядерной батареи. В будущем его можно будет использовать в качестве портативного источника рентгеновского излучения или в качестве источника дополнительного тепла или энергии для космических зондов и спутников.
появление
Прометий может образовываться в результате деления урана. В урановых рудах природного происхождения можно найти только следовые количества.Например, было обнаружено, что образец урана содержит прометий в концентрации четыре части на квинтиллион (10 18 ) по массе. [1]
Прометий также был идентифицирован в спектре звезды HR 465 в Андромеде и, возможно, HD 101065 (звезда Пшибыльского) и HD 965. [2]
История
Существование прометия было впервые предсказано Богуславом Браунером в 1902 году; это предсказание было поддержано Генри Мозли в 1914 году, который обнаружил пробел для недостающего элемента, который имел бы атомный номер 61, но был неизвестен (однако у Мозли, конечно, не было образца элемента, чтобы проверить это).Несколько групп заявили, что создали этот элемент, но не смогли подтвердить свои открытия из-за сложности отделения прометия от других элементов. Прометий был впервые произведен и доказано, что существует в Окриджской национальной лаборатории (ORNL) в 1945 году Якобом А. Марински, Лоуренсом Э. Гленденином и Чарльзом Д. Кориеллом путем разделения и анализа продуктов деления уранового топлива, облученного в графитовом реакторе; однако, будучи слишком заняты оборонными исследованиями во время Второй мировой войны, они не объявили о своем открытии до 1947 года. [3] Название прометий происходит от Прометея в греческой мифологии, который украл небесный огонь и передал его человечеству. Название было предложено Грейс Мэри Кориелл, женой Чарльза Кориелла, которая чувствовала, что они крадут огонь у богов.
В 1963 году ионообменные методы были использованы в ORNL для получения около десяти граммов прометия из отходов переработки топлива ядерных реакторов.
Сегодня прометий все еще получают из побочных продуктов деления урана; он также может быть получен путем бомбардировки 146 Nd нейтронами, превращая его в 147 Nd, который распадается на 147 Pm посредством бета-распада с периодом полураспада 11 дней.
Известные характеристики
Прометий – это внутренний переходный металл (или лантаноид), который находится в шестом периоде периодической таблицы, между неодимом и самарием. Чистый прометий существует в двух аллотропных формах, и его химический состав аналогичен химическому составу других лантаноидов.
Прометий имеет один полустабильный изотоп (145), который является мягким бета-излучателем. Он не излучает гамма-лучи, но бета-частицы, падая на элементы с большими атомными номерами, могут генерировать рентгеновские лучи. Соли прометия светятся в темноте бледно-голубым или зеленоватым светом из-за их высокой радиоактивности.
Изотопы
Было охарактеризовано36 радиоизотопов прометия, наиболее стабильными из которых являются 145 Pm с периодом полураспада 17,7 лет, 146 Pm с периодом полураспада 5,53 года и 147 Pm с периодом полураспада. 2,6234 года. Все оставшиеся радиоактивные изотопы имеют период полураспада менее 364 дней, а у большинства из них период полураспада менее 27 секунд. Этот элемент также имеет 11 мета-состояний, наиболее стабильным из которых является 148 Pm m (T ½ 41.29 дней), 152 вечера м 2 (T ½ 13,8 минут) и 152 вечера м (T ½ 7,52 минуты).
Изотопы прометия имеют атомный вес от 127,9482600 ед ( 128 мкм) до 162,9535200 ед ( 163 мкм). Первичная мода распада перед самым долгоживущим изотопом 145 Pm – это захват электронов, а первичная мода после распада – бета-минус распад. Первичные продукты распада до 145 Pm представляют собой изотопы неодима (Nd), а первичные продукты после этого – изотопы самария (Sm).
Стабильность изотопов прометия
Помимо технеция, прометий является одним из двух элементов с числом атомов меньше 83, который имеет исключительно нестабильные изотопы, что является редко встречающимся эффектом модели жидкой капли и стабильности изотопов соседних элементов.
Соединения
Соединения прометия включают:
- Хлориды
- Бромиды
- Оксиды
Приложения
Прометий используется для следующих целей:
- Источник бета-излучения для толщиномеров.
- Источник света для сигналов, требующих надежной независимой работы (с использованием люминофора для поглощения бета-излучения и получения света).
- В ядерной батарее, в которой фотоэлементы преобразуют свет в электрический ток, обеспечивая срок службы около пяти лет при использовании 147-мкм.
- Хлорид прометия (III) (PmCl 3 ), смешанный с сульфидом цинка (ZnS), некоторое время использовался в качестве светящейся краски для часов после того, как производство радия было прекращено. До сих пор используется для некоторых светящихся красок.
- Возможно, в будущем в качестве портативного источника рентгеновского излучения, в качестве вспомогательного источника тепла или энергии для космических зондов и спутников.
Меры предосторожности
С прометием следует обращаться с большой осторожностью из-за его высокой радиоактивности . В частности, прометий может излучать рентгеновские лучи во время своего бета-распада. Обратите внимание, что его период полураспада меньше, чем у плутония-239, в несколько десятков тысяч раз. Прометий не играет биологической роли.
См. Также
Банкноты
- ↑ Attrep, Moses, Jr.и П. К. Курода (май 1968 г.). Прометий в уране. Журнал неорганической и ядерной химии 30 (3): 699–703.
- ↑ Коули, К. Р. и У. П. Бидельман, С. Хубриг, Г. Матис и Д. Дж. Борд (2004). О возможном присутствии прометия в спектрах HD 101065 (звезда Пшибыльского) и HD 965. Astronomy & Astrophysics 419: 1087–1093.
- ↑ (2003). Открытие прометия. Обзор ORNL 36 (1). Проверено 14 декабря 2007 г.
Список литературы
- Чанг, Раймонд. 2006. Химия . 9 изд. Нью-Йорк: McGraw-Hill Science / Engineering / Math. ISBN 0073221031
- Коттон, Ф. Альберт и Джеффри Уилкинсон. 1980. Продвинутая неорганическая химия . 4-е изд. Нью-Йорк: Вили. ISBN 0-471-02775-8
- Гринвуд, Н. и А. Эрншоу. 1998. Химия элементов . 2-е изд. Оксфорд, Великобритания; Берлингтон, Массачусетс: Баттерворт-Хайнеманн, Elsevier Science.ISBN 0750633654
- «Прометий» Лос-Аламосская национальная лаборатория, химический отдел . Проверено 14 декабря 2007 г.
- Stwertka, Альберт. 1998. Путеводитель по элементам . Ред. Оксфорд, Великобритания: Издательство Оксфордского университета. ISBN 0-19-508083-1
Внешние ссылки
Все ссылки получены 15 июня 2019 г.
Кредиты
Энциклопедия Нового Света писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
прометий – база данных элементов
Таблица Менделеева -> прометийПрометий Детали
Прометий Символ: Pm
Прометий Атомный номер: 61
Прометий Атомный вес: 144,91
Что такое прометий?
Прометий (атомный номер 61, символ Pm) – металл, который редко встречается в природе. Это искусственно созданный радиоактивный элемент и земляной металл. Его можно получить из продуктов деления других элементов, включая плутоний, торий и уран.В очень небольших количествах этот элемент содержится в составе урановых руд. Астрономы наблюдали прометий в спектрах звезд, принадлежащих галактике Андромеды.Этот элемент является парамагнитным, имеет 9 изотопов и гексагональную кристаллическую структуру. Его электроотрицательность по Полингу, ионный радиус и радиус Ван-дер-Ваальса неизвестны. Металл находится в твердом состоянии при комнатной температуре, а его температура кипения составляет 2460 C. Химические свойства прометия мало изучены, поскольку он радиоактивен.Считается, что он ведет себя аналогично другим редкоземельным элементам, таким как церий, скандий, европий и неодим. Его энергия гидратации и температура плавления ниже, чем у самария, но выше, чем у неодима. К настоящему времени создано более 30 соединений прометия, в том числе бинарные соединения с водородом, кислородом и галогенами. Соли прометия имеют зеленоватое или бледно-голубое свечение.
Элемент не имеет стабильных изотопов, а его ядерных изомеров всего 18. Прометий-151 имеет период полураспада 1,18 дня, а прометий-148 имеет период полураспада около 43 дней.Единственный изотоп, имеющий коммерческое применение, – это прометий-147. Все изотопы элемента радиоактивны, что означает, что они имеют нестабильные ядра и самопроизвольно испускают излучение. Все элементы периодической таблицы содержат хотя бы один радиоактивный изотоп. Однако есть только два элемента с атомным номером ниже 83, прометий и технеций, которые имеют только радиоактивные изотопы. Сам элемент не имеет стабильного состояния.
Прометий-147 используется в атомных батареях.Элемент можно использовать как источник энергии, потому что он выделяет энергию. Батареи на основе прометия являются альтернативой слишком большим или тяжелым батареям других типов. Они являются эффективным источником энергии на космических аппаратах и спутниках, но очень дороги для повседневного использования. Ожидается, что такие батареи будут обеспечивать питание до 5 лет. Другие возможные применения прометия – это производство батарей для кардиостимуляторов, часов и ракет.
Прометий был открыт американским химиком Якобом Марински в 1945 году.Лоуренс Гленденин и Якоб Марински использовали нейтроны для бомбардировки неодима и получили прометий. Им также удалось извлечь металл из продуктов деления. И только в 1963 году был получен образец прометия. Сегодня ученые используют ускорители частиц, чтобы искусственно изолировать элемент. Спектроскопы использовались для обнаружения прометия и его изотопов.
Элемент не играет биологической роли. Его океаническое и коровое изобилие неизвестно. Учитывая, что прометий – редкий металл, он не представляет угрозы для жизни животных и растений.Лабораторные исследования показали, что металл накапливается на поверхности костей. Чтобы освободиться от тела, нужно время. Прометий очень радиоактивен, и с ним следует обращаться осторожно. Необходимо надевать защитную одежду, защитные очки и перчатки. Все соединения прометия очень токсичны, поэтому с металлической пылью следует обращаться осторожно. Представляет собой взрывоопасную и пожарную опасность.
Прометий изначально присутствовал на Земле, но теперь обнаружен в следовых количествах. Он исчез из-за радиоактивного распада.Элемент обрабатывается только на ядерных установках и в исследовательских лабораториях.
Вы можете перейти по ссылке на эту страницу , используя приведенный ниже код:
прометий – Периодическая таблица
Периодическая таблица | банки
© ElementsDatabase.com 2015 | Конфиденциальность | О нас | Контакт
Promethium Pm (элемент 61) периодической таблицы
61 мкм (прометий)
Иллюстрация Прометия
Прометий – мягкий редкоземельный металл с бета-излучением .
Рентгеновское излучение может образовываться, когда бета-частицы сталкиваются с элементами с большим атомным номером.
Соли прометия имеют розовый или красный цвет, который светится в темноте бледно-голубым или зеленоватым оттенком из-за их высокой радиоактивности.
Это очень редкое явление, поэтому его химические и физические свойства точно не определены.
Прометий в свете
Прометий, светится в темноте
Идентификационный номер
Номер CAS: CAS7440-12-2
Произношение: Proh-mee-the-am
Внешний вид: Металлик
Массовое число: 145
Стандартный Атомный вес: 146.915 г / моль
Атомный номер (Z): 61
Электроны: 61
Протоны: 61
Нейтроны: 84
Период: 6
Блок: f
Категория элемента: лантанид
Электронов на оболочку: K2, L8, M18, N23, O8, P2
Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 4f 5 6s 2
Фаза: твердое вещество
Точка плавления: 1315 K (1042 o C, 1908 o F)
Точка кипения: 3273 K (1900 o C, 5432 o F)
Теплота плавления: 7.13 кДж / моль
Теплота испарения: 289 кДж / моль
Молярная теплоемкость: 24,3 Дж / (моль К)
Тепловое расширение: 9,0 мкм / (м ∙ К)
Теплопроводность: 17,9 Вт / (м ∙ К)
Электропроводность: 1,3 × 10 6 См / м
a Удельное электрическое сопротивление: прибл. 0,75 мкОм ∙ м
a Электрический тип: проводник
Магнитный тип: парамагнитный
Физические свойства прометия Плотность: 7.26 г / см 3
Молярный объем: 0,00001996 м 3 / моль
Модуль Юнга: α форма: прибл. 46 ГПа
Модуль сдвига: α форма: прибл. 18 ГПа
Объемный модуль: α форма: прибл. 33 ГПа
Коэффициент Пуассона: форма α: оценка 0,28
Твердость по Виккеру: 410-440 МПа
Твердость по Бринеллю: 440-600 МПа
Скорость звука: 2130 м / с
Степени окисления: 3 , 2
Валентные электроны: 4f 5 6s 2
Заряд ионов: Pm 3+
Энергия ионизации: 1-я: 540 кДж.моль 2-я: 1050 кДж / моль 3-я: 2150 кДж / моль
Ионный радиус: 97,9 пм
Атомный радиус: 236 пм (Ван-дер-Ваальс)
Ковалентный радиус: 199 пм
Заполняющая орбиталь: 4f 5
Кристаллическая структура: двойной гексагональный плотно упакованный (изменение на Body-center cubic выше 890 o C)
Параметры сетки: a = 3,65 Å c = 11,65 Å
Отношение c / a: 3,19
Двойной шестиугольник с плотной упаковкой (DHCP)
Телоцентрированный куб (BCC)
Реакционная способность прометия Электроотрицательность: шкала полоскания: 1.13
Валентность: +3
Сродство к электрону: 50 кДж / моль
Период полураспада: 17,725 y
Время жизни: 25,558 y
Квантовое число: 6 H 5/2
Нейтронное сечение (Бранс): 8000
Режим распада: Захват электронов
Изотопы: 145 мкм 146 мкм 147 мкм
| Изотоп | Обилие (%) | Атомная масса г / моль | Период полураспада (т 1/2 ) |
| 145 пм | След | 144.913 | 17,7 года |
| 146 пм | Syn | – | 5.53 y |
| 147 пм | След | 146,915 | 2.623 y |
Discovery: Chien Shiung Wu, Emilio Segre, Hans Bethe (1942)
Discovery Location: Oak Ridge Tennennee, США
Первая изоляция: Charles D.Кориелл, Джейкоб А. Марински, Лоуренс Э. Гленденин, Гарольд Г. Рихтер (1945)
Имя: Грейс Мэри Кориелл (1945)
Большая часть прометия используется только в исследовательских целях, за исключением прометия-147
Прометий-147 имеет срок службы около 5 лет , который может использоваться в качестве источника бета-излучения для устройств измерения толщины , и он может поглощаться люминофором, давая светового света.
Он также используется в специализированных миниатюрных (размером примерно с канцелярскую кнопку) Ядерных батареях (улавливающих свет в фотоэлементах, которые преобразуют его в электрический ток) для управляемых ракет, часов, кардиостимуляторов, радиоприемников, и так далее. источник света для знаков или сигналов.
Возможно, что в будущем прометий будет использоваться в качестве источника рентгеновского излучения , , и он может стать полезным в качестве источника тепла для обеспечения вспомогательной энергии для спутников космических зондов и .
Прометий-145 является наиболее долгоживущим изотопом и имеет удельную активность 940 Ки / г.
Самый долгоживущий изотоп прометия имеет период полураспада всего 18 лет. По этой причине не обнаружено естественно на Земле, полностью отсутствует в земной коре.

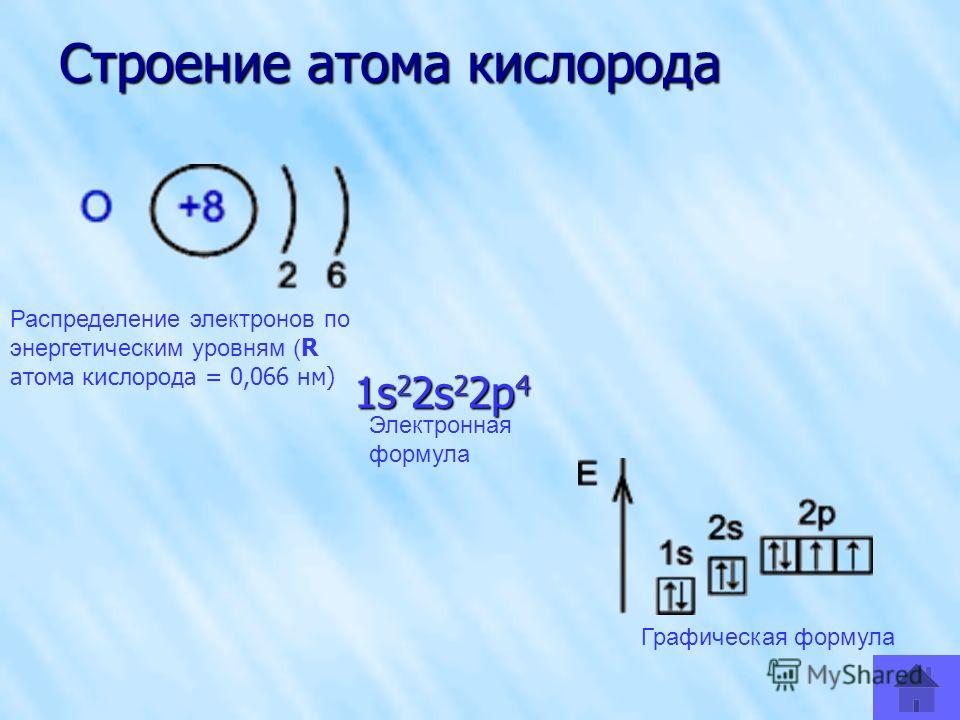 5f14.6d3.7s2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2
5f14.6d3.7s2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2 1
1 6d10.7s2.7p6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8
6d10.7s2.7p6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8