Строение атома платины (Pt), схема и примеры
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Общие сведения о строении атома платины
Относится к элементам d-семейства. Металл. Обозначение – Pt. Порядковый номер – 78. Относительная атомная масса – 195,84 а.е.м.
Электронное строение атома платины
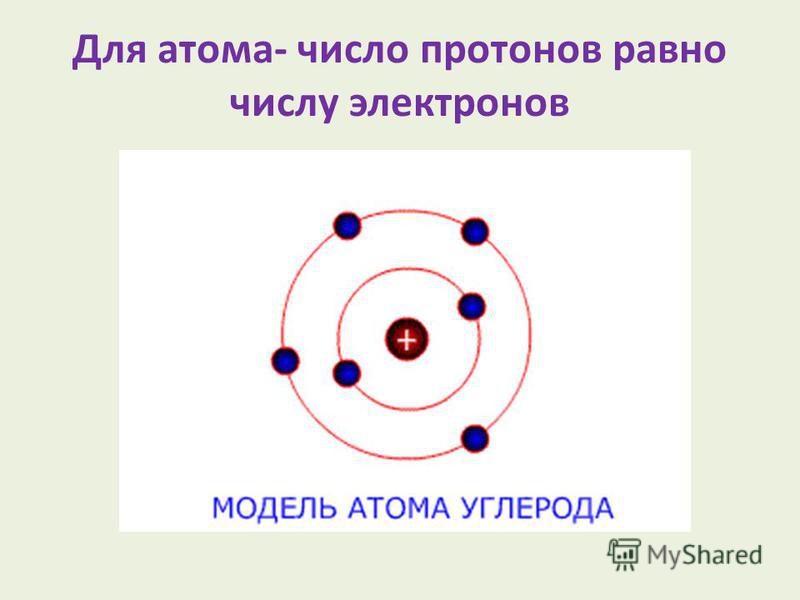
Атом платины состоит из положительно заряженного ядра (+78), внутри которого есть 78 протонов и 118 нейтронов, а вокруг, по шести орбитам движутся 78 электронов.
Рис.1. Схематическое строение атома платины.
Распределение электронов по орбиталям выглядит следующим образом:
+78Pt)2)8)18)32)17)1;
1s22s
Валентными электронами платины являются расположенные на 5d— и 6s-подуровнях электроны. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома платины можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Подуровень |
n |
l |
ml |
s |
|
s |
6 |
0 |
0 |
+1/2 |
|
d |
5 |
|
-2 |
+1/2 |
|
d |
5 |
2 |
-1 |
+1/2 |
|
d |
5 |
2 |
0 |
+1/2 |
|
|
5 |
2 |
+1 |
+1/2 |
|
d |
5 |
2 |
+2 |
+1/2 |
|
d |
5 |
2 |
|
-1/2 |
|
d |
5 |
2 |
-1 |
-1/2 |
|
d |
5 |
2 |
0 |
-1/2 |
|
d |
5 |
2 |
+1 |
-1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Платина, свойства атома, химические и физические свойства
Платина, свойства атома, химические и физические свойства.

Pt 78 Платина
195,084(9) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p7 5d9 6s1
Платина — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 78. Расположен в 10-й группе (по старой классификации — побочной подгруппе восьмой группы), шестом периоде периодической системы.
Атом и молекула платины. Формула платины. Строение атома платины
Цена на платину
Изотопы и модификации платины
Свойства платины (таблица): температура, плотность, давление и пр.
Физические свойства платины
Химические свойства платины. Взаимодействие платины. Химические реакции с платиной
Получение платины
Применение платины
Таблица химических элементов Д.И. Менделеева
Атом и молекула платины. Формула платины.
 Строение атома платины:
Строение атома платины:Платина (лат. Platinum, от исп. Plata – «маленькое серебро», «серебришко») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Pt и атомным номером 78. Расположен в 10-й группе (по старой классификации – побочной подгруппе восьмой группы), шестом периоде периодической системы.
Платина – металл. Относится к группе переходных металлов, а также к драгоценным и цветным металлам.
Платина обозначается символом Pt.
Как простое вещество платина при нормальных условиях представляет собой мягкий, тяжёлый, блестящий металл серебристо-белого цвета.
Молекула платины одноатомна.
Химическая формула платины Pt.
Электронная конфигурация атома платины 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d9 6s1. Потенциал ионизации (первый электрон) атома платины равен 864,4 кДж/моль (8,95883(10) эВ).
Строение атома платины. Атом платины состоит из положительно заряженного ядра (+78), вокруг которого по шести оболочкам движутся 78 электронов. При этом 77 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку платина расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлены s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью.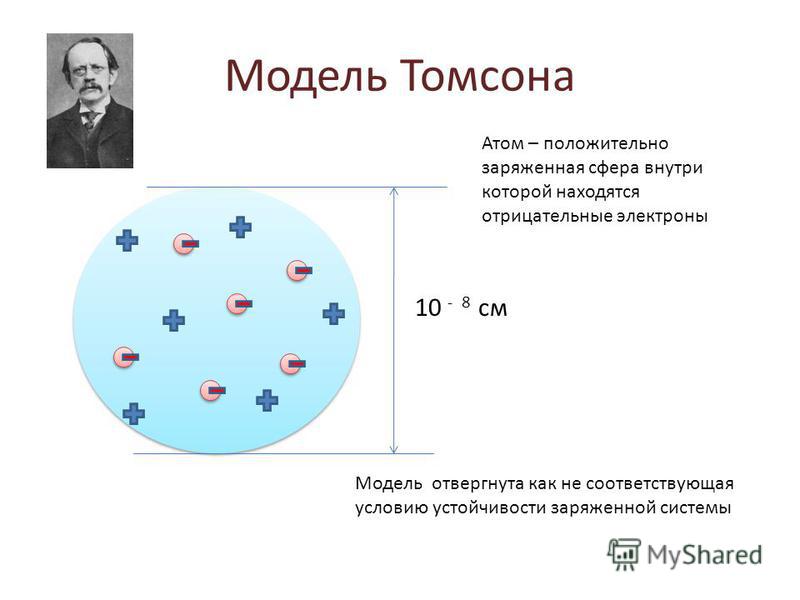 На внутреннем энергетическом уровне атома платины на 5d-орбитали находятся восемь спаренных электронов и один неспаренный электрон. На внешнем энергетическом уровне атома платины на 6s-орбитали находится один неспаренный электрон. В свою очередь ядро атома платины состоит из 78 протонов и 117 нейтронов. Платина относится к элементам d-семейства.
На внутреннем энергетическом уровне атома платины на 5d-орбитали находятся восемь спаренных электронов и один неспаренный электрон. На внешнем энергетическом уровне атома платины на 6s-орбитали находится один неспаренный электрон. В свою очередь ядро атома платины состоит из 78 протонов и 117 нейтронов. Платина относится к элементам d-семейства.
Радиус атома платины (вычисленный) составляет 177 пм.
Атомная масса атома платины составляет 195,084(9) а. е. м.
Платина, свойства атома, химические и физические свойства
Изотопы и модификации платины:
Свойства платины (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Платина |
| 102 | Прежнее название | |
| 103 | Латинское название | Platinum |
| 104 | Английское название | Platinum |
| 105 | Символ | Pt |
| 106 | Атомный номер (номер в таблице) | 78 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, драгоценный, цветной металл |
| 109 | Открыт | Антонио де Ульоа, Испания, 1735 г. |
| 110 | Год открытия | 1735 г. |
| 111 | Внешний вид и пр. | Мягкий, тяжёлый, блестящий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 3,7·10-6 % |
| 120 | Содержание в морях и океанах (по массе) | |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 9,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000098 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 195,084(9) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d9 6s1 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O17 P1 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 177 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 136 пм |
| 207 | Радиус иона (кристаллический) | Pt2+ 74 (4) пм, 94 (6) пм, Pt4+ 76,5 (6) пм, Pt5+ 71 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 175 пм |
| 209 | Электроны, Протоны, Нейтроны | 78 электронов, 78 протонов, 117 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 10-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,28 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 864,4 кДж/моль (8,95883(10) эВ) |
| 305 | Электродный потенциал | Pt2+ + 2e– → Pt, Eo = +1,188 В |
| 306 | Энергия сродства атома к электрону | 205,041(5) кДж/моль (2,12510(5) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 21,45 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 19,77 г/см3 (при температуре плавления 1768,3 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1768,3 °C (2041,4 K, 3214,9 °F) |
| 403 | Температура кипения* | 3825 °C (4098 K, 6917 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 22,17 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 510 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,133 Дж/г·K (при 25 °C) |
| 410 | Молярная теплоёмкость* | 25,86 Дж/(K·моль) |
| 411 | Молярный объём | 9,249786 см³/моль |
| 412 | Теплопроводность | 71,6 Вт/(м·К) (при стандартных условиях), 71,6 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 3,920 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 230 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-06-4 |
Примечание:
205* Эмпирический радиус атома платины согласно [1] и [3] составляет 139 пм.
206* Ковалентный радиус платины согласно [1] и [3] составляет 136±5 пм и 130 пм соответственно.
401* Плотность платины согласно [3] составляет 21,09 – 21,45 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления платины согласно [4] составляет 1769 °C (2042,15 K, 3216,2 °F).
403* Температура кипения платины согласно [4] составляет 3800 °C (4073,15 K, 6872 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) платины согласно [3] и [4] составляет 21,76 кДж/моль и 19,7 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) платины согласно [3] и [4] составляет ~470 кДж/моль и 510,4 кДж/моль соответственно.
410* Молярная теплоёмкость платины согласно [3] составляет 25,85 Дж/(K·моль).
Физические свойства платины:
Химические свойства платины. Взаимодействие платины. Химические реакции с платиной:
Получение платины:
Применение платины:
Таблица химических элементов Д. И. Менделеева
И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
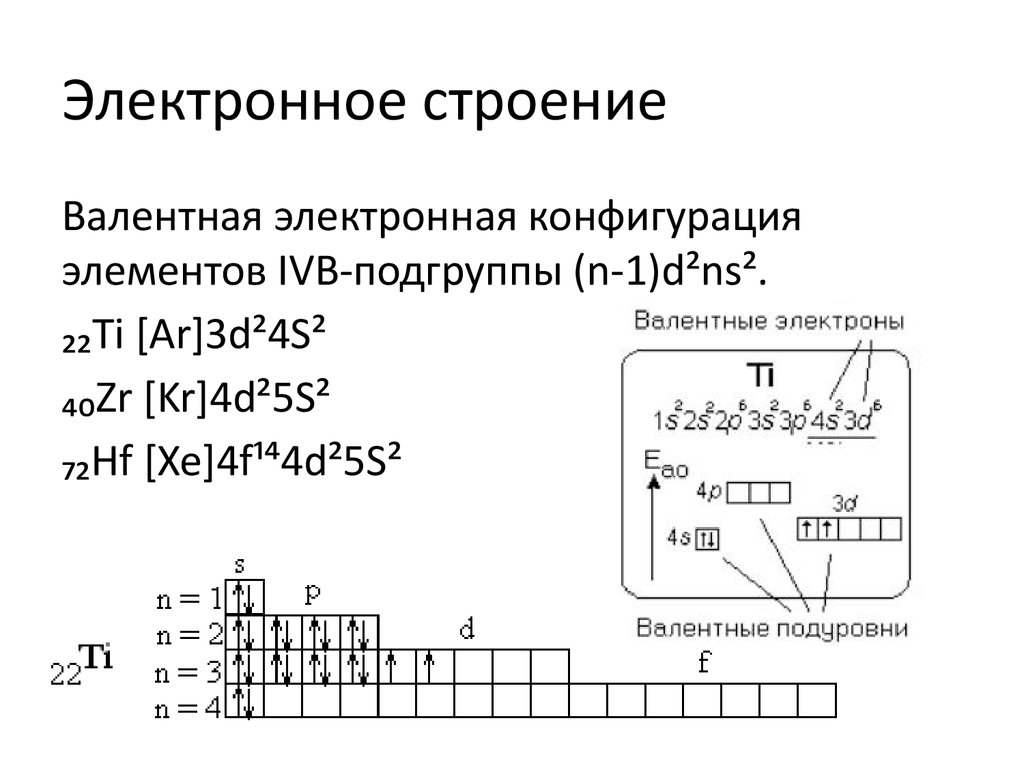
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34.
 Селен
Селен - 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
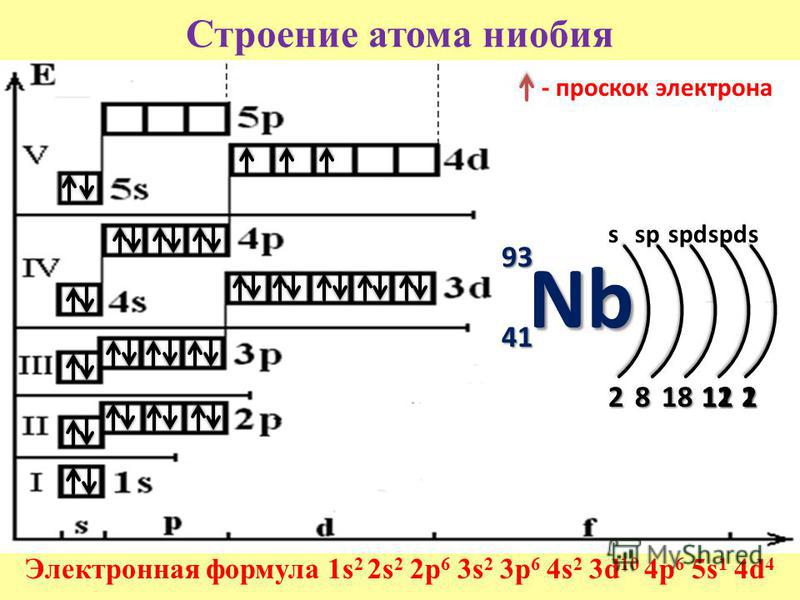
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67.
 Гольмий
Гольмий - 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100.
 Фермий
Фермий - 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Platinum
- https://de.wikipedia.org/wiki/Platin
- https://ru.wikipedia.org/wiki/Платина
- http://chemister.ru/Database/properties.php?dbid=1&id=288
- https://chemicalstudy.ru/platina-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www. pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
платина атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле платины платина
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 486
Строение атома и электронные конфигурации 1.0
На этой странице вы узнаете- Чем атом похож на Солнечную систему?
- Один водород, но три лучше: что такое изотопы?
- Как умеет скакать электрон?
Атом можно представить как конструктор «Лего», который можно собрать из более простых “элементарных” частиц.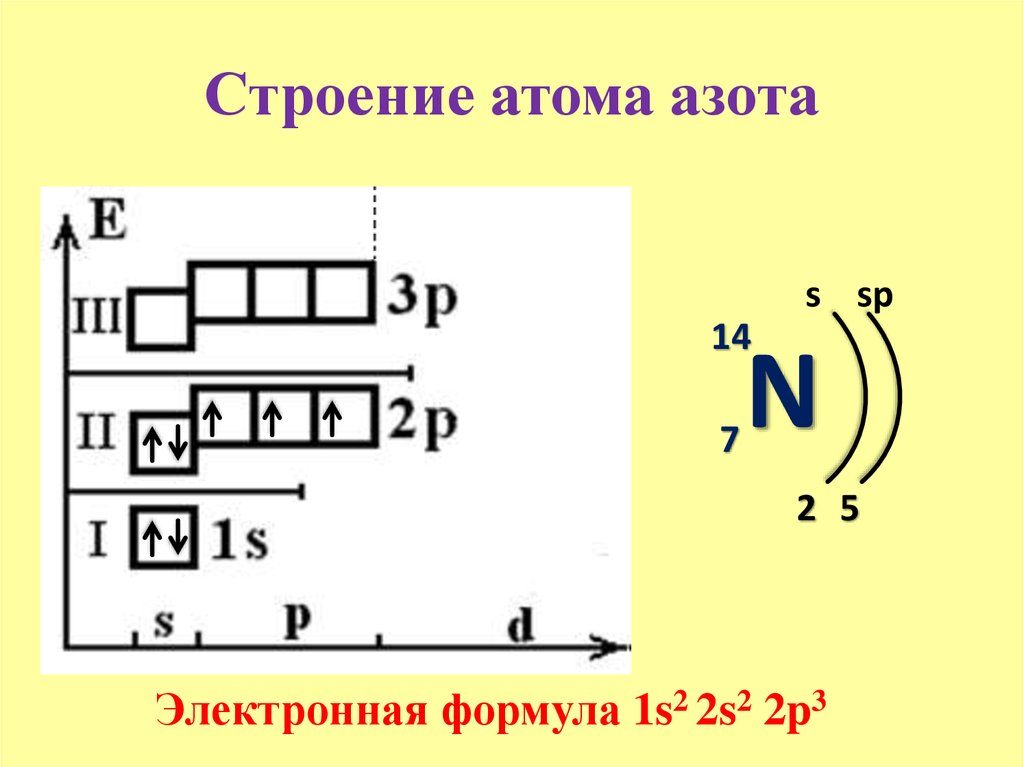 У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
У каждого атома число “деталек” может быть различным. Об этом и о других особенностях строения атома поговорим в статье.
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы. Можно провести аналогию:
- атом — отдельный человек,
- молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).

Молекула — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки учёные-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē).
В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
| Чем атом похож на Солнечную систему? Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться этими представлениями. |
Тогда более точно определение атома будет звучать так:
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.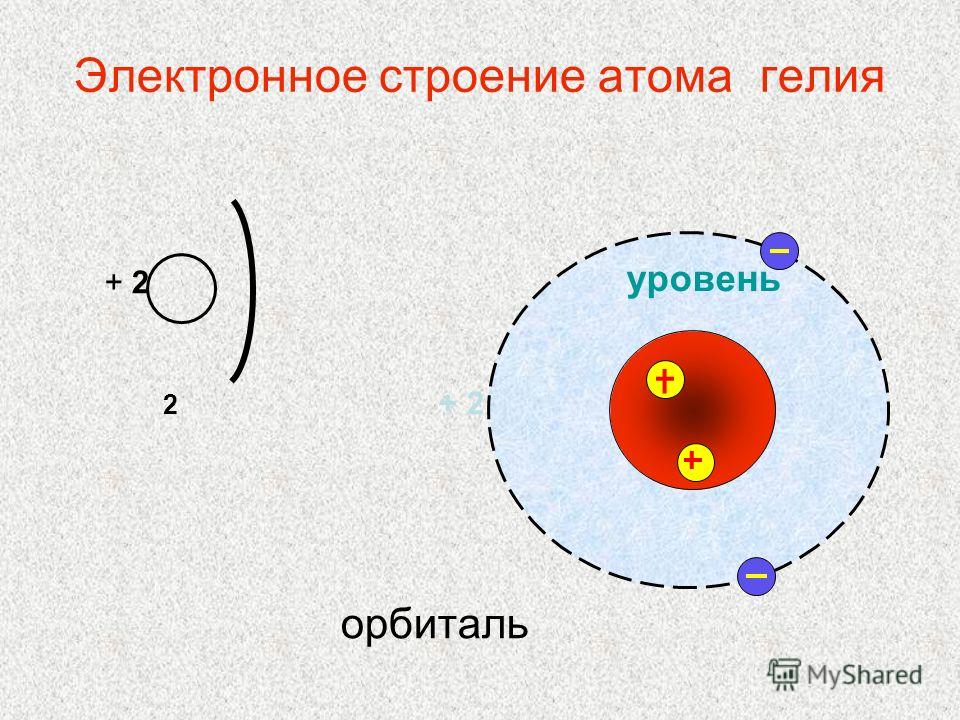
Каждая из элементарных частиц в атоме имеет свой заряд и массу:
Характеристика элементарных частицИз таблички видно, что вся масса атома сосредоточена в протонах и нейтронах, то есть в ядре. При этом само ядро положительно заряжено, а вокруг ядра вращаются отрицательно заряженные электроны.
В разновидностях одного и того же химического элемента может быть различное число элементарных частиц. Давай рассмотрим это на примере атома водорода.
Первый случай: ядро атома водорода состоит из одного протона (масса ядра = 1 а.е.м.). Такой атом называется протием, именно он указан в периодической системе Д.И. Менделеева.
Добавим к этому ядру один нейтрон, тогда масса ядра будет равна 2 а.е.м.. Мы получили вторую разновидность атома водорода — дейтерий.
Если добавить второй нейтрон к такому ядру, то мы получим тритий.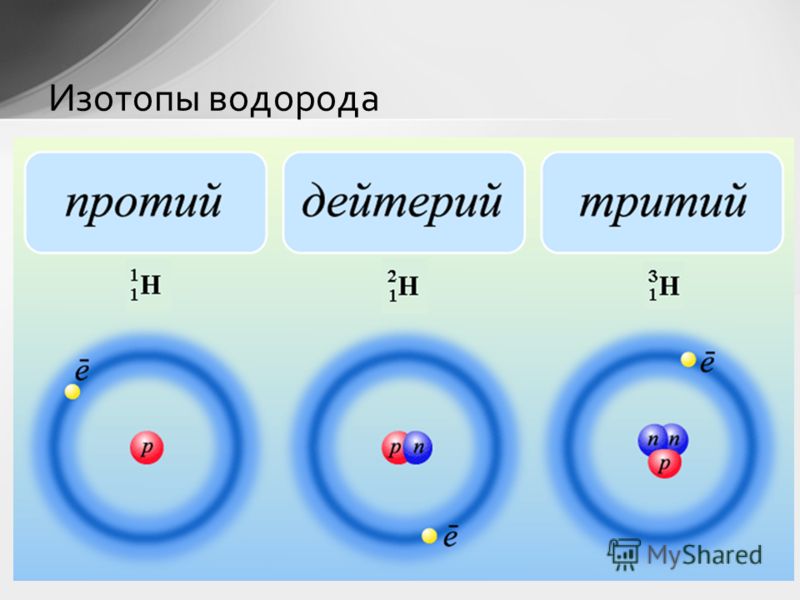 Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
Так вот, разновидности одного и того же химического элемента, которые различаются числом нейтронов в ядре, называются изотопами.
| Один водород, но три лучше: что такое изотопы? Изотопы — атомы одного химического элемента с разным числом нейтронов: равные заряды ядра, равное число e и p, но разное число n! |
Сейчас мы научимся определять количество протонов, нейтронов и электронов в атоме любого химического элемента. В этом нам поможет периодическая система Д.И. Менделеева.
Давай рассмотрим ячейку в периодической системе с углеродом:
В верхней части ячейки располагается порядковый номер элемента (это целое число), под ним располагается относительная атомная масса. Она является нецелым числом, поэтому её легко определять. Относительная атомная масса, округленная до целого числа, называется массовым числом.
Относительная атомная масса, округленная до целого числа, называется массовым числом.
Эти характеристики связаны с количеством элементарных частиц в атоме следующим образом:
| Порядковый номер элемента = число протонов в ядре = заряд ядра атома = число электронов в атоме (№ элемента = p = Z = ē) Число нейтронов = массовое число – порядковый номер (n = Ar — № элемента) |
Давай рассмотрим основные определения и положения, связанные с характеристикой элемента и числовыми операциями:
- Орбиты, на которых располагаются электроны, называются электронными слоями (или энергетическими уровнями). Нумерация слоев начинается с ближайшего к ядру электронного слоя.
- На каждом электронном слое может находиться не более 2N2 электронов (где N — номер слоя).
- Число занятых электронами слоев в атоме элемента совпадает с номером периода, в котором он находится.

- Последний энергетический уровень называют внешним (максимальное число ē на внешнем уровне = 8). Обычно на нем находятся валентные электроны, то есть электроны на внешней (валентной) оболочке атома.
- Число валентных электронов, как правило, совпадает с номером группы, в котором находится элемент.
На примере атома углерода определим количество элементарных частиц в его атоме.
Порядковый номер углерода равен 6, значит, заряд его атома + 6, число протонов и число электронов совпадает и тоже равно 6.
Относительная атомная масса равна 12,01, а число нейтронов равно 12 – 6 = 6.
Углерод находится во втором периоде, IV группе. Это показывает нам, что занято лишь 2 электронных слоя, при этом на внешнем электронном уровне располагаются 4 электрона.
При заполнении электронами ячеек мы описываем так называемое основное состояние. Это такое состояние атома, при котором энергия системы минимальна. Его состояние можно определить как “веселое”: в атоме всё спокойно и в порядке.
Но может быть и другая ситуация, когда на электроны оказывается какое-то воздействие. Тогда происходит процесс, похожий на развод пары в человеческом мире. В результате воздействия те электроны, которые находились на орбитали вдвоем и были спаренными, могут друг с другом “поссориться” и “разъехаться” по разным орбиталям.
Тогда атом можно определить как “грустный”: электроны ссорятся, атома грустит. В химии это состояние и называется возбужденным. Такой “развод” возможен только в пределах одного энергетического уровня.
Атомные подуровни заполняются электронами в порядке увеличения их энергии. Этот порядок выглядит следующим образом:
Этот порядок выглядит следующим образом:
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … |
| Как умеет скакать электрон? Иногда при заполнении энергетических подуровней мы нарушаем порядок заполнения подуровней. В первую очередь, это связано с заполнением s- и d-подуровней . Электрон перемещается с внешнего s- на предвнешний d-подуровень. Так образуется более устойчивая заполненная или полузаполненная конфигурация. |
Это явление характерно для элементов IB и VIB групп, например, Cr, Cu, Ag.
Например, у меди электронная оболочка должна выглядеть как ..3d94s2. Но так как для заполнения d-подуровня не хватает одного электрона, то более выгодной становится ситуация, когда с s-подуровня электрон “перепрыгивает” на внутренний d-подуровень. В результате, конфигурация меди выглядит как 3d104s11
В результате, конфигурация меди выглядит как 3d104s11
| Итог: иметь конфигурации nd5 и nd10 более энергетически выгодно, чем nd4 и nd9. Поэтому у таких элементов, как Cu, Cr, Ag, Au, Nb, Mo, Ru, Pt, Pd происходит проскок (провал) электрона: электрон с верхнего “этажа” как будто проваливается на нижний. |
Классификация химических элементов: s-,p-,d-,f-элементы
В зависимости от положения “последнего электрона” бывают s-, p-, d-, f-элементы:
- s-элементы: IA и IIA группы;
- p-элементы: IIIA-VIIIA группы;
- d-элементы: элементы побочных подгрупп;
- f-элементы: вынесены в отдельную группу лантаноидов и актиноидов.
У s- и p-элементов валентные электроны находятся на внешнем уровне.
У d-элементов — на внешнем s- и на предвнешнем d-подуровнях.
Далее приведены электронные формулы атомов элементов первых четырех периодов. Благодаря этой шпаргалке всегда можно сверить свой вариант электронной конфигурации и проверить себя.
Продолжение темы читайте в статье «Строение атома и электронные конфигурации 2.0».
Фактчек- Атом — электронейтральная частица, состоящая из ядра и вращающихся вокруг него электронов.
- Электроны располагаются на электронных подуровнях, причем их число определяется порядковым номером элемента.
- Существует группа атомов одного и того же химического элемента, у которых имеется разное число нейтронов. Такие элементы называют изотопами.
- Электроны располагаются по ячейкам так, чтобы энергия системы была минимальна.
- Иногда для достижения минимума энергии некоторые правила нарушаются — таковым является проскок электрона.

Задание 1.
Ядро атома состоит из:
- Протонов и нейтронов
- Протонов и электронов
- Нейтронов и электронов
- Протонов, нейтронов и электронов
Задание 2.
У изотопов различается число:
- Протонов
- Нейтронов
- Электронов
- Нейтронов и электронов
Задание 3.
Проскок электрона характерен для элемента:
- Натрия
- Алюминия
- Ксенона
- Меди
Задание 4.
На третьем электронном слое может находиться максимально:
- 8 электронов
- 18 электронов
- 2 электрона
- 32 электрона
Ответы: 1. — 1; 2. — 2; 3. — 4; 4. — 2.
Pt Информация об элементе платины: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура платины
Твердотельная структура платины Гранецентрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ребер ячейки Константы решетки (a, b и c)
| a | b | c |
|---|---|---|
| 392.42 pm | 392.42 pm | 392.42 pm |
and the angles between them Lattice Angles (alpha, beta and gamma).
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
The positions of the atoms inside the unit cell are described by the set атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). Степени окисления
Платиновые атомные и орбитальные свойства 82, 32, 82, 82, 82, Электроны, и Электроны. , 17, 1] с символом атомарного члена (квантовые числа)
3 D 3 .| Атомный номер | 78 |
| Число электронов (бесплатно) | 78 |
| Number of Protons | 78 |
| Mass Number | 195 |
| Number of Neutrons | 117 |
| Shell structure (Electrons per energy level) | 2, 8, 18, 32, 17, 1 |
| Электронная конфигурация | [xe] 4F14 5D9 6S1 |
| Валентные электроны | 5D9 6S1 |
| (валентность) | |
| (валентность) | |
| (валентность) | |
. 0027 6 0027 6 | |
| Основные состояния окисления | 2, 4 |
| Состояния окисления | -3, -2, -1, 0, 2, 3, 4, 5, 6 |
| ATOMIC. Symbol (Quantum numbers) | 3 D 3 |
Атомная модель BOHR Atomic Platinum – Electrons Per Energy Level
Наземная конфигурация Electronic of Platinum – нейтральная платиновая платиновая платину
110 9007Основа Платина
Сокращенная электронная конфигурация основного состояния нейтрального атома платины: [Xe] 4f14 5d9 6s1. Часть платиновой конфигурации, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 5d9 6s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтральной платины
Полная электронная конфигурация основного состояния атома платины. Полная электронная конфигурация
Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d9 6s1 Принцип исключения и правило Хунда.
Атомная структура платины
Атомный радиус платины составляет 177 пм, а ковалентный радиус — 128 пм.
| Расчетный атомный радиус | 177 пм (1,77 Å) |
| Радиус Эмпирический радиус | 135 вечера (1,35 Å) |
| 9,09 CM3/Мол | |
| COVEN 9,09 CM3/моли | |
COVLE 9.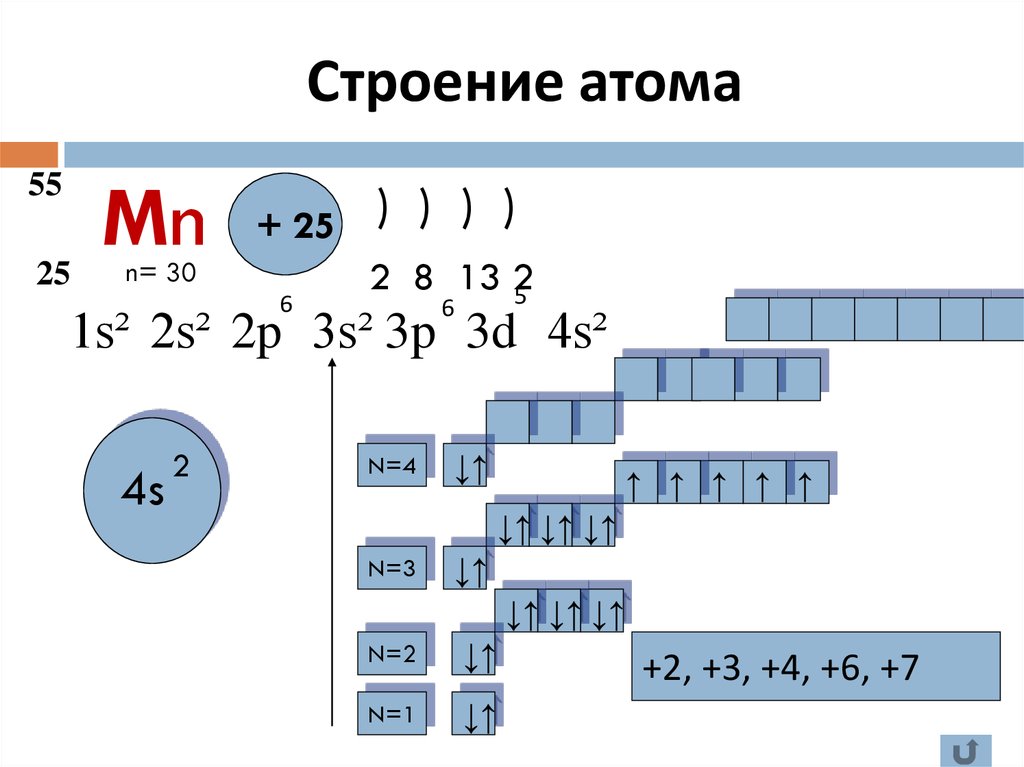 09.09/мол 09.09/мол | |
| COVEL 9.09.09/мол | |
| COVEL 9.09. Waals Radius | 175 PM |
| Нейтронный сечение | 10 |
| Абсорбция нейтронной массы | 0,002 |
АТАМИЧЕСКА0011
Химические свойства платины: Энергия ионизации платины и сродство к электрону
Сродство к электрону платины составляет 205,3 кДж/моль.
| Valence | 6 |
| Electronegativity | 2.28 |
| ElectronAffinity | 205.3 kJ/mol |
Ionization Energy of Platinum
Refer to table below for Ionization energies of Platinum
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 870 |
| 2nd | 1791 |
Platinum Physical Properties
Refer to below table for Platinum Physical Properties
| Плотность | 21,09 г/см3 (для жидкости при т. пл. плотность 19,77 г/см3) пл. плотность 19,77 г/см3) |
| Молярный объем | 9,09 см3/моль |
Elastic Properties
| Young Modulus | 168 |
| Shear Modulus | 61 GPa |
| Bulk Modulus | 230 GPa |
| Poisson Ratio | 0.38 |
Твердость платины – испытания для измерения твердости элемента
| Твердость по Моосу | 3,5 МПа |
| Твердость по Виккерсу | 549 МПа |
| Твердость по Бринеллю | 392 МПа |
Электрические свойства платины
Платина является проводником электричества. Refer to table below for the Electrical properties ofPlatinum
| Electrical Conductivity | 9400000 S/m |
| Resistivity | 1. 1e-7 m Ω 1e-7 m Ω |
| Superconducting Point | – |
Platinum Heat and Conduction Properties
| Thermal Conductivity | 72 W/(m K) |
| Thermal Expansion | 0.0000088 /K |
Platinum Magnetic Properties
| Magnetic Type | Парамагнетик |
| Точка Кюри | – |
| Массовая магнитная восприимчивость | 1.22e-8 м3/кг |
| Молярная магнитная восприимчивость | 2.38e-9 m3/mol |
| Volume Magnetic Susceptibility | 0.0002573 |
Optical Properties of Platinum
| Refractive Index | – |
Acoustic Properties of Platinum
| Скорость звука | 2680 м/с |
Тепловые свойства платины – энтальпии и термодинамика
Тепловые свойства платины см. в таблице ниже
в таблице ниже
| Melting Point | 2041.4 K (1768.25°C, 3214.85 °F) |
| Boiling Point | 4098 K (3824.85°C, 6916.7300000000005 °F) |
| Critical Temperature | – |
| Сверхпроводящая точка | – |
Энтальпии платины
| Тепло слияния | 20 кДж/моль |
| Hate of vaporifit of vaporifiz0027 490 кДж/моль | |
| Теплота сгорания | – |
Изотопы платины. Ядерные свойства платины Платина имеет 5 стабильных естественных изотопов.
Изотопы платины – Природные стабильные изотопы: 192Pt, 194Pt, 195Pt, 196Pt, 198Pt.
| Изотоп | Z | N | Изотоп Масса | % Abundance | T half | Decay Mode | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 166Pt | 78 | 88 | 166 | Synthetic | ||||||||||||||
| 167Pt | 78 | 89 | 167 | Synthetic | ||||||||||||||
| 168Pt | 78 | 90 | 168 | Synthetic | ||||||||||||||
| 169Pt | 78 | 91 | 169 | Synthetic | ||||||||||||||
| 170Pt | 78 | 92 | 170 | Synthetic | ||||||||||||||
| 171Pt | 78 | 93 | 171 | Synthetic | ||||||||||||||
| 172PT | 78 | 94 | 172 | Синтетик | ||||||||||||||
| 173PT | 78 | 900 2 | 7777778 | 900 2 | 77777778 | 7777778 | 7777778 | 7777778 | 7777778 | 777778 | 7. | |||||||
| 174Pt | 78 | 96 | 174 | Synthetic | ||||||||||||||
| 175Pt | 78 | 97 | 175 | Synthetic | ||||||||||||||
| 176Pt | 78 | 98 | 176 | Synthetic | ||||||||||||||
| 177Pt | 78 | 99 | 177 | Synthetic | ||||||||||||||
| 178Pt | 78 | 100 | 178 | Synthetic | ||||||||||||||
| 179Pt | 78 | 101 | 179 | Synthetic | ||||||||||||||
| 180Pt | 78 | 102 | 180 | Synthetic | ||||||||||||||
| 181Pt | 78 | 103 | 181 | Synthetic | ||||||||||||||
| 182Pt | 78 | 104 | 182 | Synthetic | ||||||||||||||
| 183Pt | 78 | 105 | 183 | Synthetic | ||||||||||||||
| 184Pt | 78 | 106 | 184 | Синтетический | ||||||||||||||
| 185PT | 78 | 107 | 185 | Синтетик | ||||||||||||||
| 186PT | ||||||||||||||||||
| 186PT | ||||||||||||||||||
| 186PT | ||||||||||||||||||
186PT. 0028 0028 | 108 | 186 | Synthetic | |||||||||||||||
| 187Pt | 78 | 109 | 187 | Synthetic | ||||||||||||||
| 188Pt | 78 | 110 | 188 | Synthetic | ||||||||||||||
| 189Pt | 78 | 111 | 189 | Synthetic | ||||||||||||||
| 190Pt | 78 | 112 | 190 | 0.014% | Stable | N/A | ||||||||||||
| 191Pt | 78 | 113 | 191 | Synthetic | ||||||||||||||
| 192Pt | 78 | 114 | 192 | 0.782 % | Stable | N/A | ||||||||||||
| 193Pt | 78 | 115 | 193 | Synthetic | ||||||||||||||
| 194Pt | 78 | 116 | 194 | 32.967% | Stable | N/A | ||||||||||||
| 195Pt | 78 | 117 | 195 | 33. 832% 832% | Stable | |||||||||||||
| 196Pt | 78 | 118 | 196 | 25.242% | Stable | N/A | ||||||||||||
| 197Pt | 78 | 119 | 197 | Synthetic | ||||||||||||||
| 198Pt | 78 | 120 | 198 | 7.163% | Stable | N/A | ||||||||||||
| 199Pt | 78 | 121 | 199 | Synthetic | ||||||||||||||
| 200Pt | 78 | 122 | 200 | Synthetic | ||||||||||||||
| 201Pt | 78 | 123 | 201 | Synthetic | ||||||||||||||
| 202Pt | 78 | 124 | 202 | Синтетический |
PT Platinum Element ИНФОРМАЦИЯ: Факты, свойства, Тренды, использование и сравнение – Периодическая таблица.
 структура состояния Platinum Face Centered Cubic .
структура состояния Platinum Face Centered Cubic .Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 392,42 пм | 392,42 пм | 392,42 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | Gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
. Положения атомов внутри единичной клетки описываются наборами положения Atomic (x . y i , z i ) измеряется от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | Fm_ 3m | |
| Oxidation States | Space Group Number | 225 |
| Crystal Structure | Face Centered Cubic |
Platinum Atomic and Orbital Properties
Атомы платины имеют 78 электронов и структуру электронной оболочки [2, 8, 18, 32, 17, 1] с символом атомного термина (квантовые числа) 3 Д 3 .
| Atomic Number | 78 |
| Number of Electrons (with no charge) | 78 |
| Number of Protons | 78 |
| Mass Number | 195 |
| Number нейтронов | 117 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 18, 32, 17, 1 |
| Электронная конфигурация | [Xe] 4f14 5d9 6s1 |
| Valence Electrons | 5d9 6s1 |
| Valence (Valency) | 6 |
| Main Oxidation States | 2, 4 |
| Oxidation States | – 3, -2, -1, 0, 1, 2, 3, 4, 5, 6 |
| Символ атомного термина (квантовые номера) | 3 D 3 |
9005 BORAMIC ATOMIC ATOMIC ATOMIC ATOMIC ATOMIC
9005 BOHR ATOMIC Модель платины – Электроны на энергетический уровень
Электронная конфигурация основного состояния платины – нейтральный атом платины
Сокращенная электронная конфигурация платины
Сокращенная электронная конфигурация основного состояния нейтрального атома платины: [Xe] 4f14 5d9 6s1.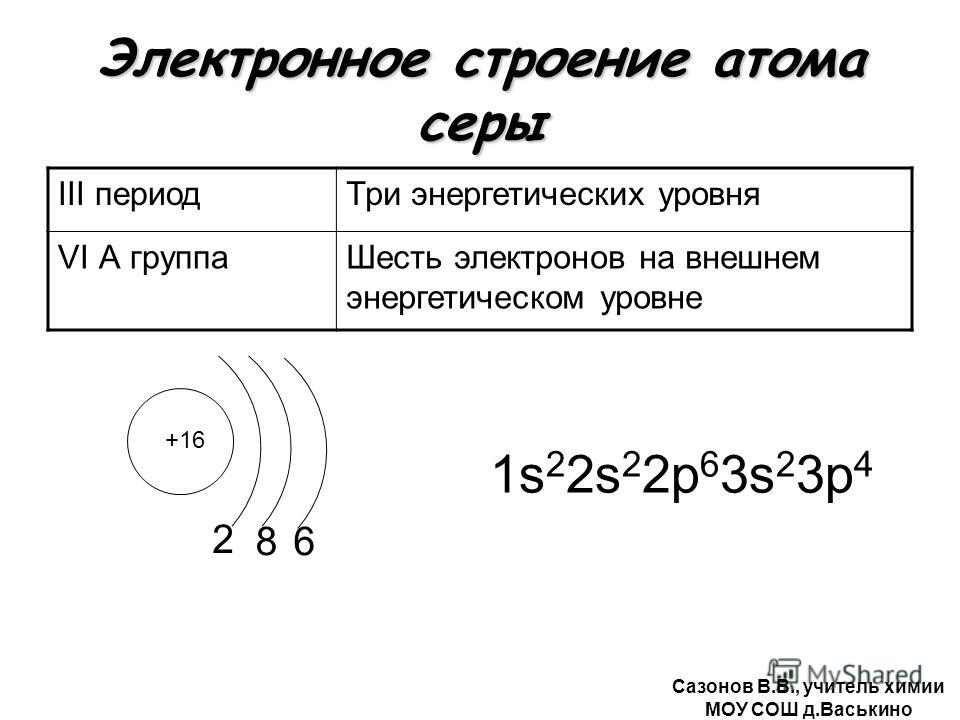 Часть платиновой конфигурации, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, так как это валентные электроны 5d96s1, электроны на внешней оболочке, определяющие химические свойства элемента.
Часть платиновой конфигурации, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, так как это валентные электроны 5d96s1, электроны на внешней оболочке, определяющие химические свойства элемента.
Незащитная электронная конфигурация нейтральной платины
Полная электронная конфигурация заземляющего состояния для атома платины, неисправная электронная конфигурация
1S2 2S2 2P6 3S2 3P6 3D10 4S2 4P6 4D10 5S2 5P6 4F14 5D9 6S19 4S2 9P6 4D10 5S2 5P6 4F14 5D9 6S1
9000 7. порядок, определяемый принципом Ауфбау, принципом исключения Паули и правилом Хунда. По этому принципу электроны заполняются в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. …
По этому принципу электроны заполняются в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. …Атомная структура платины
Атомный радиус платины составляет 177 пм, а ее ковалентный радиус равен 128 пм.
| Atomic Radius Calculated | 177 pm (1.77 Å) |
| Atomic Radius Empirical | 135 pm (1.35 Å) |
| Atomic Volume | 9.09 cm3/mol |
| Ковалентный радиус | 128 пм (1,28 Å) |
| Ван-дер-ваальсовый радиус | 175 pm |
| Neutron Cross Section | 10 |
| Neutron Mass Absorption | 0. 002 002 |
Atomic Spectrum of Platinum
Platinum Chemical Properties: Platinum Ionization Energies and electron affinity
The сродство к электрону платины 205,3 кДж/моль.
| Валентность | 6 |
| Электроотрицательность | 2,28 |
| Электронафинность | 205,3 кДж/моль |
Ионизационная энергия
7. Свладайте таблицу ниже для ионизационной энергии| 1-й | 870 |
| 2-й | 1791 |
Платина Физические свойства ниже
007
| Density | 21.09 g/cm3(when liquid at m.p density is $19.77 g/cm3) |
| Molar Volume | 9.09 cm3/mol |
Elastic Properties
| Young Modulus | 168 | ||||||||||||||||||||||||||||
| Модуль сдвига | 61 GPA | ||||||||||||||||||||||||||||
| Модуль | 230 GPA | ||||||||||||||||||||||||||||
| Ratio | |||||||||||||||||||||||||||||
. 0035 0035Hardness of Platinum – Tests to Measure of Hardness of Element
Platinum Электрические свойстваПлатина является проводником электричества. См. таблицу ниже для получения информации об электрических свойствах платины
Platinum Heat and Conduction Properties
Платина Магнитные свойства
Оптические свойства платины
Акустические свойства платины
Платиновые тепловые свойства – энтузиазлы и термодинамикаСм. Таблицу ниже для термических свойств 1118 9004 4004. °C, 3214,85 °F) | |||||||||||||||||||||||||||||
| Температура кипения | 4098 K (3824,85°C, 6916,7300000000005 °F) | ||||||||||||||||||||||||||||
| – | Критическая температура | 0016Сверхпроводящая точка | – |
Энтальпии платины
| ОТРИТЕЛЬНАЯ НАСТОЯЩИЕ | 20 KJ/моль |
| HEAT | 20 KJ/MOL |
| HEAT of VAPORIT | – |
Изотопы платины.
 Ядерные свойства платины
Ядерные свойства платиныПлатина состоит из 37 изотопов, содержащих от 166 до 202 нуклонов. Платина имеет 5 стабильных естественных изотопов.
Изотопы платины – Встречающиеся в природе стабильные изотопы: 192Pt, 194Pt, 195Pt, 196Pt, 198Pt.
| Isotope | Z | N | Isotope Mass | % Abundance | T half | Decay Mode |
|---|---|---|---|---|---|---|
| 166Pt | 78 | 88 | 166 | Synthetic | ||
| 167Pt | 78 | 89 | 167 | Synthetic | ||
| 168Pt | 78 | 90 | 168 | Synthetic | ||
| 169Pt | 78 | 91 | 169 | Synthetic | ||
| 170Pt | 78 | 92 | 170 | Synthetic | ||
| 171Pt | 78 | 93 | 171 | Synthetic | ||
| 172Pt | 78 | 94 | 172 | Synthetic | ||
| 173Pt | 78 | 95 | 173 | Synthetic | ||
| 174Pt | 78 | 96 | 174 | Синтетический | ||
| 175PT | 97 | 175 | Синтетик |
 0027 78
0027 78 014%
014%Pt Информация об элементе платины: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура платины
Твердотельная структура платины Face Centered Cubic .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 392,42 пм | 392,42 пм | 392,42 пм |
и углы между ними Решетка углов и углов (альфа, бета).
| alpha | beta | gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
The positions of the atoms inside the unit cell are described by the set атомных позиций ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). Степени окисления
Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219 различных типов или 230, если считать киральными копиями различными). Степени окисления
Атомные и орбитальные свойства платины с символом атомного термина (квантовые числа)
3 D 3 .| Атомный номер | 78 |
| Число электронов (без заряда) | 78 |
| Количество протонов | 78 |
| MASS № | 195 |
| Номер нейтронов | |
| HOLLE | |
| HOLLES | |
| HOLLENS | |
| HOLLENS | . , 17, 1|
| Electron Configuration | [Xe] 4f14 5d9 6s1 |
| Valence Electrons | 5d9 6s1 |
| Valence (Valency) | 6 |
| Основные степени окисления | 2, 4 |
| Степени окисления | -3, -2, -1, 0, 1, 2, 3, 4, 5, 7 Symbolic (Quantum Atomic |
| 3 D 3 |
Bohr Atomic Model of Platinum – Electrons per energy level
Ground State Electronic Configuration of Platinum – neutral Platinum atom
Abbreviated electronic configuration of Platinum
Сокращенная электронная конфигурация основного состояния нейтрального атома платины: [Xe] 4f14 5d9 6s1. Часть платиновой конфигурации, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 5d9 6s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Часть платиновой конфигурации, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Xe]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 5d9 6s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтральной платины
Полная электронная конфигурация основного состояния атома платины. Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 4f14 5d9 6s1 Принцип исключения и правило Хунда.
Атомная структура платины
Атомный радиус платины составляет 177 пм, а ковалентный радиус — 128 пм.
| Расчетный атомный радиус | 177 пм (1,77 Å) |
| Радиус Эмпирический радиус | 135 вечера (1,35 Å) |
| 9,09 CM3/Мол | |
| COVEN 9,09 CM3/моли | |
| COVLE 9.09.09/мол | |
| COVEL 9.09.09/мол | |
| COVEL 9.09. Waals Radius | 175 PM |
| Нейтронный сечение | 10 |
| Абсорбция нейтронной массы | 0,002 |
АТАМИЧЕСКА0011
Химические свойства платины: Энергия ионизации платины и сродство к электрону
Сродство к электрону платины составляет 205,3 кДж/моль.
| Valence | 6 |
| Electronegativity | 2.28 |
| ElectronAffinity | 205.3 kJ/mol |
Ionization Energy of Platinum
Refer to table below for Ionization energies of Platinum
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 870 |
| 2nd | 1791 |
Platinum Physical Properties
Refer to below table for Platinum Physical Properties
| Плотность | 21,09 г/см3 (для жидкости при т.пл. плотность 19,77 г/см3) |
| Молярный объем | 9,09 см3/моль |
Elastic Properties
| Young Modulus | 168 |
| Shear Modulus | 61 GPa |
| Bulk Modulus | 230 GPa |
| Poisson Ratio | 0. 38 38 |
Твердость платины – испытания для измерения твердости элемента
| Твердость по Моосу | 3,5 МПа |
| Твердость по Виккерсу | 549 МПа |
| Твердость по Бринеллю | 392 МПа |
Электрические свойства платины
Платина является проводником электричества. Refer to table below for the Electrical properties ofPlatinum
| Electrical Conductivity | 9400000 S/m |
| Resistivity | 1.1e-7 m Ω |
| Superconducting Point | – |
Platinum Heat and Conduction Properties
| Thermal Conductivity | 72 W/(m K) |
| Thermal Expansion | 0.0000088 /K |
Platinum Magnetic Properties
| Magnetic Type | Парамагнетик |
| Точка Кюри | – |
| Массовая магнитная восприимчивость | 1.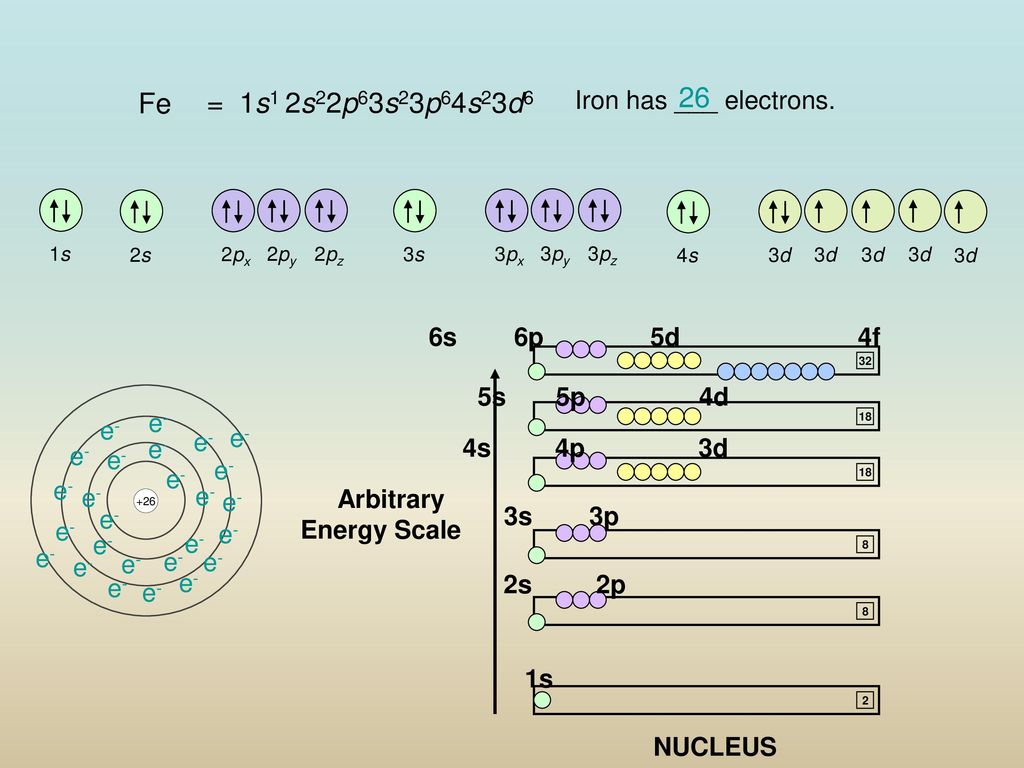 22e-8 м3/кг 22e-8 м3/кг |
| Молярная магнитная восприимчивость | 2.38e-9 m3/mol |
| Volume Magnetic Susceptibility | 0.0002573 |
Optical Properties of Platinum
| Refractive Index | – |
Acoustic Properties of Platinum
| Скорость звука | 2680 м/с |
Тепловые свойства платины – энтальпии и термодинамика
Тепловые свойства платины см. в таблице ниже
| Melting Point | 2041.4 K (1768.25°C, 3214.85 °F) |
| Boiling Point | 4098 K (3824.85°C, 6916.7300000000005 °F) |
| Critical Temperature | – |
| Сверхпроводящая точка | – |
Энтальпии платины
| Тепло слияния | 20 кДж/моль |
| Hate of vaporifit of vaporifiz0027 490 кДж/моль | |
| Теплота сгорания | – |
Изотопы платины.
 Ядерные свойства платины Платина имеет 5 стабильных естественных изотопов.
Ядерные свойства платины Платина имеет 5 стабильных естественных изотопов.Изотопы платины – Природные стабильные изотопы: 192Pt, 194Pt, 195Pt, 196Pt, 198Pt.
| Изотоп | Z | N | Изотоп Масса | % Abundance | T half | Decay Mode | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 166Pt | 78 | 88 | 166 | Synthetic | ||||||||||||||
| 167Pt | 78 | 89 | 167 | Synthetic | ||||||||||||||
| 168Pt | 78 | 90 | 168 | Synthetic | ||||||||||||||
| 169Pt | 78 | 91 | 169 | Synthetic | ||||||||||||||
| 170Pt | 78 | 92 | 170 | Synthetic | ||||||||||||||
| 171Pt | 78 | 93 | 171 | Synthetic | ||||||||||||||
| 172PT | 78 | 94 | 172 | Синтетик | ||||||||||||||
| 173PT | 78 | 900 2 | 7777778 | 900 2 | 77777778 | 7777778 | 7777778 | 7777778 | 7777778 | 777778 | 7. | |||||||
| 174Pt | 78 | 96 | 174 | Synthetic | ||||||||||||||
| 175Pt | 78 | 97 | 175 | Synthetic | ||||||||||||||
| 176Pt | 78 | 98 | 176 | Synthetic | ||||||||||||||
| 177Pt | 78 | 99 | 177 | Synthetic | ||||||||||||||
| 178Pt | 78 | 100 | 178 | Synthetic | ||||||||||||||
| 179Pt | 78 | 101 | 179 | Synthetic | ||||||||||||||
| 180Pt | 78 | 102 | 180 | Synthetic | ||||||||||||||
| 181Pt | 78 | 103 | 181 | Synthetic | ||||||||||||||
| 182Pt | 78 | 104 | 182 | Synthetic | ||||||||||||||
| 183Pt | 78 | 105 | 183 | Synthetic | ||||||||||||||
| 184Pt | 78 | 106 | 184 | Синтетический | ||||||||||||||
| 185PT | 78 | 107 | 185 | Синтетик | ||||||||||||||
| 186PT | ||||||||||||||||||
| 186PT | ||||||||||||||||||
| 186PT | ||||||||||||||||||
186PT. 0028 0028 | 108 | 186 | Synthetic | |||||||||||||||
| 187Pt | 78 | 109 | 187 | Synthetic | ||||||||||||||
| 188Pt | 78 | 110 | 188 | Synthetic | ||||||||||||||
| 189Pt | 78 | 111 | 189 | Synthetic | ||||||||||||||
| 190Pt | 78 | 112 | 190 | 0.014% | Stable | N/A | ||||||||||||
| 191Pt | 78 | 113 | 191 | Synthetic | ||||||||||||||
| 192Pt | 78 | 114 | 192 | 0.782 % | Stable | N/A | ||||||||||||
| 193Pt | 78 | 115 | 193 | Synthetic | ||||||||||||||
| 194Pt | 78 | 116 | 194 | 32.967% | Stable | N/A | ||||||||||||
| 195Pt | 78 | 117 | 195 | 33.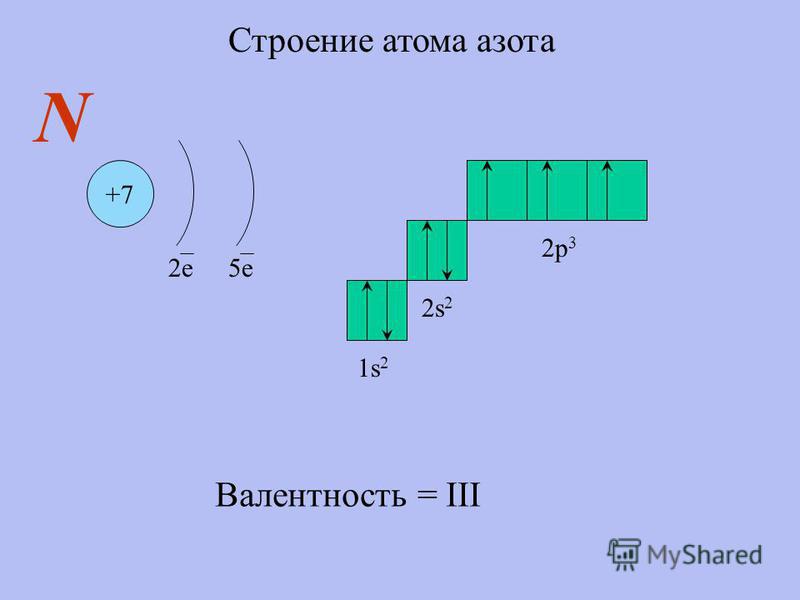 |

 Селен
Селен Гольмий
Гольмий Фермий
Фермий


 0027 Synthetic
0027 Synthetic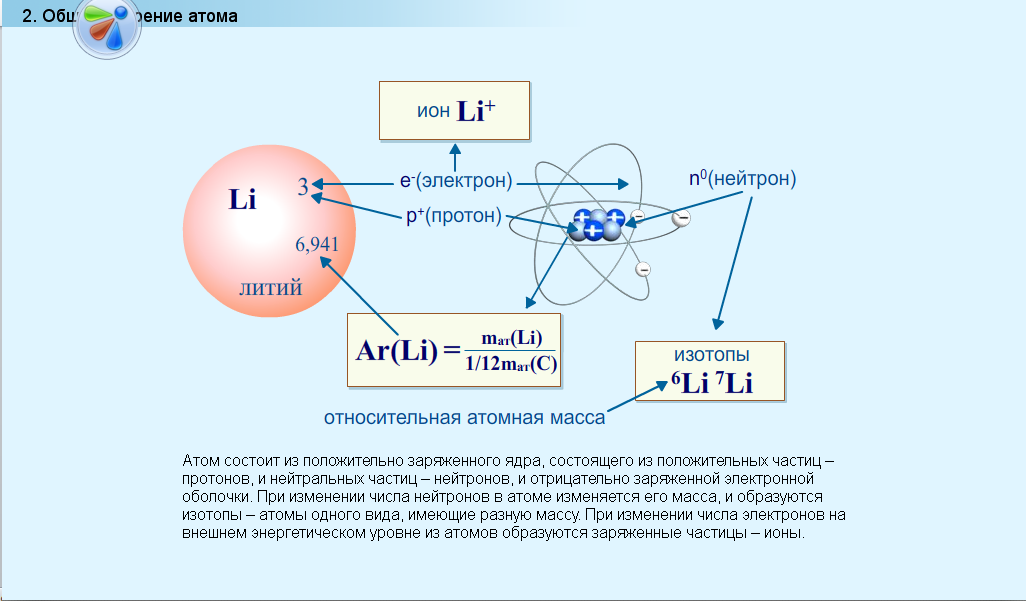 22e-8 m3/kg
22e-8 m3/kg 0027 Synthetic
0027 Synthetic