Электронная конфигурация кальция. Строение атома кальция и схема электронной оболочки
Содержание
- Что представляет собой кальций
- Общие сведения
- Ядро атома
- Информация об электронах
- Атомная структура
- Атомная масса, изотопы
- Каково отличие атомов от ионов
- Физико-химические свойства кальция
- Электронная оболочка
- Электронная схема кальция
- Количество электронов
- Степень окисления кальция
- Ионы кальция
- Валентность Ca
- Квантовые числа Ca
- Энергия ионизации
- Технология получения
- Применение
- Промышленность
- Наука
- Другие сферы
- Биологическая роль
- Жизненные процессы
- Питание
- Нормы
- Какую роль играет внутри организма
Что представляет собой кальций
Кальций – это химический элемент периодической системы Д. И. Менделеева под №20. Мягкий серебристо-белый металл блестит, но затем тускнеет под пленкой-оксидом.
Состоит из шести стабильных изотопов, при этом 97% состава приходится на Ca40.
Относится к щелочноземельным металлам.
Международное обозначение – Calcium (Ca).
Общие сведения
Каждый химический элемент состоит из молекул, компонентами которых являются атомы. Последние состоят из следующих структурных единиц:
- Ядра.
- Электроны.
Последние вращаются вокруг ядра по орбитам, которые только отображаются на чертежах (графической схеме). Орбита — условное обозначение расстояния между ядром и электронами, удерживающимися посредством сил кулоновского притяжения. На основании анализа структуры кристаллической решетки ученые открыли некоторые очень важные физико-химические свойства веществ. Например, благодаря изучению строения атома калия, его поместили в ряд щелочных металлов. Он вступает в мгновенную реакцию с водой, образуя щелочь.
Ядро атома
Ядро — основной компонент атома, в котором сосредоточена основная масса. Оно имеет положительный заряд, притягивающий электроны, и состоит из протонов и нейтронов.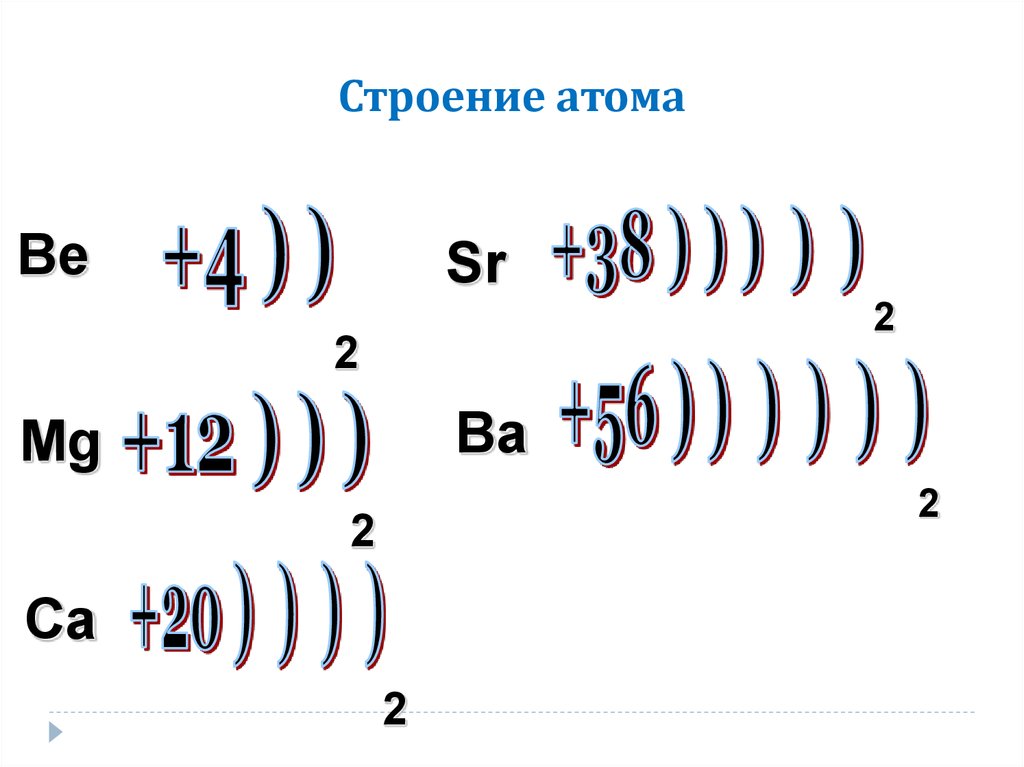 Протий (легкий изотоп водорода) — единственный химический элемент, не содержащий нейтроны. Если ядро рассматривать в качестве частицы, то химики и физики называют его нуклидом, а нуклоны — совокупность положительно заряженных атомарных единиц.
Протий (легкий изотоп водорода) — единственный химический элемент, не содержащий нейтроны. Если ядро рассматривать в качестве частицы, то химики и физики называют его нуклидом, а нуклоны — совокупность положительно заряженных атомарных единиц.
Количество протонов обозначается литерой «Z», а нейтронов — N. Эти 2 коэффициента, как правило, равны. Однако иногда N превышает или меньше показателя Z. В этом случае говорят, что химический элемент является изотопом или изотоном, т. е. нестандартным. Чтобы их отличать между собой, следует запомнить 2 правила:
- Одинаковое Z и разное N — изотопы.
- Одинаковое N и разное Z — изотоны.
Число «Z» соответствует порядковому номеру в таблице Д. И. Менделеева. Алгебраическая сумма Z и N эквивалентна массовому атомарному числу А, которое также указывается в периодической системе. Оно имеет и другое название — молекулярная масса химического элемента. Кроме того, у ядра существуют и другие характеристики. К основным из них относятся следующие:
- Заряд.

- Масса.
Коэффициент Z определяет уровень электрического заряда. Впервые его открыл ученый Г. Мозли в 1913 году опытным путем, измеряя длину электромагнитной волны водорода. Для других элементов была установлена такая же зависимость от порядкового номера элемента. Заряд протонов, входящих в состав ядра, действует на электроны, которые вращаются вокруг него. Следует отметить, что положительная частица не может притянуть отрицательную, поскольку поле, создающее связь между ними, не способно это сделать.
В некоторых случаях заряд не может удержать электрон. При этом последний «отрывается» с орбитали. В результате такого процесса образуется ион, т. е. атом, который может взаимодействовать с другими.
Структуру строения можно интерпретировать с планетами, вращающимися вокруг Солнца. Последнее не может притянуть их, поскольку недостаточно силы притяжения, которая зависит от расстояния и массы.
Следующей характеристикой ядра является масса. Она измеряется в атомарных единицах массы — а. е. м. Одна «а.е.м.» эквивалентна 1/12 массы атома углерода, который обозначается литерой «С».
Она измеряется в атомарных единицах массы — а. е. м. Одна «а.е.м.» эквивалентна 1/12 массы атома углерода, который обозначается литерой «С».
Информация об электронах
Электрон — элементарная частица, имеющая отрицательный заряд. Ее масса намного меньше, чем у ядра. У каждой частицы есть своя орбиталь, которая показывает валентность химического элемента. Электроны не только входят в состав атома, но и бывают свободными, т. е. влияют на электрическую проводимость веществ. На основании этого утверждения ученые сделали вывод, что материалы могут классифицироваться на проводники, полупроводники и диэлектрики.
Первые имеют свободные электроны, во вторых они появляются только при воздействии каких-либо внешних сил, способных «вырвать» отрицательно заряженные элементарные частицы с орбитали. В диэлектриках или изоляторах они отсутствуют.
Атомная структура
Рассмотрим строение атома кальция. Ядро несет положительный заряд (+20). Внутри него имеются 20 нейтронов и столько же протонов, вокруг ядра движутся по 4 орбитам 20 электронов, распределенных по 2:8:8:2.
Ядро несет положительный заряд (+20). Внутри него имеются 20 нейтронов и столько же протонов, вокруг ядра движутся по 4 орбитам 20 электронов, распределенных по 2:8:8:2.
Степень окисления кальция равняется +2. На внешнем энергетическом уровне атом содержит 2 спаренных s-электрона, которые он легко отдает при химических реакциях.
Они определяют валентность элемента. Электронное строение атома кальция: 1s2 2s2 2p6 3s2 3p6 4s2 (коротко 4s2).
Внимание! Моль — это определенное (6,02 · 1023) количество молекул. Моль одного вещества имеет массу, отличающуюся от массы моля другого вещества, поскольку строение молекул и, соответственно, их вес будут разными.
Молярная масса кальция — это отношение массы вещества к числу молей: Формула, по которой рассчитывается масса в молях:
,Где M — молярная масса.
m — масса вещества.
n — количество моль.
Молярная масса кальция составляет 40,08 г/моль.
Атомная масса, изотопы
Относительная атомная масса кальция 40. 07 а. е. м. У элемента есть шесть природных изотопов. Разница между ними определяется числом нейтронов.
07 а. е. м. У элемента есть шесть природных изотопов. Разница между ними определяется числом нейтронов.
Возможное количество нейтронов в Ca:
- 40,
- 42,
- 43,
- 44,
- 46,
- 48.
Все изотопы кальция устойчивые, не обладают радиоактивностью. Самый распространенный 40.
Каково отличие атомов от ионов
Ионы — это частицы, образованные при удалении или присоединении электронов к атому. Бывают положительно (катион) или отрицательно (анион) заряженными при потере или получении дополнительных электронов. Могут существовать как в составе молекул химических соединений, так и в самостоятельном виде (плазма, газ или жидкость).
Строение атома кальция отличается от иона. Атом представляет собой нейтральную частицу с одинаковым количеством электронов и протонов. В этом заключается основное отличие атома от иона.
Атом кальция отличается от иона своим зарядом и свойствами. Строение атома кальция таково, что на внешней оболочке находятся 2 электрона, которые могут вступать в различные связи. При соединении элемента 2 внешних электрона переходят на орбиты других атомов, превращая нейтральный атом в положительно заряженный ион Ca++. При этом атом имеет восстановительные свойства, а ион — окислительные.
При соединении элемента 2 внешних электрона переходят на орбиты других атомов, превращая нейтральный атом в положительно заряженный ион Ca++. При этом атом имеет восстановительные свойства, а ион — окислительные.
Физико-химические свойства кальция
Кальций — химический элемент, относящийся к щелочно-земельным металлам. Он обозначается литерой «Са». В периодической системе находится под порядковым номером «20». Кроме того, обладает атомарной массой, равной 40 а. е. м. (А = 40 а. е. м.). Основным его источником в природе является карбонат кальция или мел, химическая формула которого имеет вид CaCO3.
Температура плавления Са составляет 854 градусов по шкале Цельсия. Под высоким давлением пропускает электрический ток в одном направлении. При взаимодействии с кислородом, входящим в состав атмосферного воздуха, окисляется (Ca2O). Примером окислительной реакции является мел, которые крошится, а при ударе — разбивается на части.
В лабораторных условиях его можно получить при электролизе расплавленного CaCl2. Последнее вещество называется хлоридом кальция. Электролиз — физико-химический процесс, при котором через какое-либо вещество пропускают постоянный ток. В этом случае ионы (заряжены положительно) направляются к электроду (катоду), имеющему отрицательный потенциал (-), а катионы — к положительному (аноду). При этом распад хлорида кальция можно записать в таком виде: ион (Ca2+) и катион (Cl 2 2-).
Последнее вещество называется хлоридом кальция. Электролиз — физико-химический процесс, при котором через какое-либо вещество пропускают постоянный ток. В этом случае ионы (заряжены положительно) направляются к электроду (катоду), имеющему отрицательный потенциал (-), а катионы — к положительному (аноду). При этом распад хлорида кальция можно записать в таком виде: ион (Ca2+) и катион (Cl 2 2-).
Схема строения атома и электронная конфигурация кальция определяют его другие химические свойства. Он реагирует с большинством веществ, являющимися сложными и простыми. Сохранить его в чистом виде довольно сложно. Например, чтобы сберечь «чистый» Ca, нужно покрыть его парафином или керосином в емкости без дополнительного доступа кислорода.
Электронная оболочка
Электронная оболочка атома — форма, позволяющая научным путем доказать возможность взаимодействия элемента с другими веществами. Принципы ее образования имеют следующие формулировки:
Принципы ее образования имеют следующие формулировки:
- Минимум энергии: определяет энергетический обмен между электронами, заполняющими орбитали.
- Паули: на орбитали могут находиться только 2 отрицательно заряженные частицы с противоположными спинами (векторами вращения).
- Хунда: заполнение орбиталей с максимальным количеством электронов с учетом спинов.
Ядро атома имеет положительный заряд «+20», который соответствует порядковому номеру в периодической таблице элементов. Количество Z = 20 и N = 20. Следовательно, вокруг ядра двигаются 20 электронов, поскольку количество положительных нуклонов равняется числу отрицательно заряженных частиц.
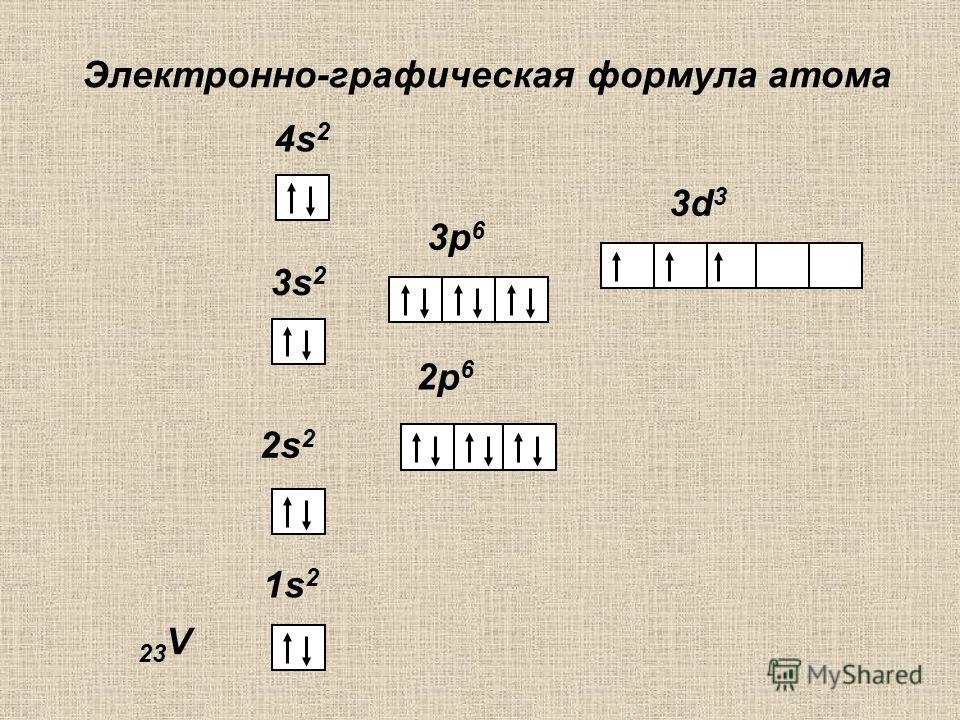
Схематически обозначение структуры, состоящей из четырех орбит, имеет такой вид: +20 Ca)2)8)8)2. В этом случае можно записать электронную конфигурацию элемента: 1 s2 2 s2 2 p6 3 s2 3 p6 4 s2. Если сложить показатели степеней подуровней орбит, получается «20», т. е. 2+2+6+2+6+2. Электронная формула заполняется по такому алгоритму:
- Выписывается порядковый номер: 20.

- На первом подуровне должно быть не более 2: 1 s2. Первая орбиталь заполнена.
- Вторая орбита (до 6 на подуровне 2р и 2 на 2s): 2s22p6.
- Третья состоит из двух подуровней, на каждом из которых может находиться 2 и 6 частиц соответственно: 3s2 3 p6 .
- Четвертая также включает 2 подуровня 4s и 4p, но частиц хватает только на 4s: 4 s2.
- Проверка количества электронов: 2+2+6+2+6+2 = 20 (результат соответствует действительности, т. е. равен Z).
На основании электронной конфигурации можно определить еще один параметр Cа, который называется валентностью. Она равна 2, поскольку последняя орбиталь имеет только 2 электрона.
Таким образом, кальций является двухвалентным элементом и обладает физическими и химическими свойствами, которые присущи щелочно-земельным металлам.
Электронная схема кальция
Ca: 1s2 2s2 2p6 3s2 3p6 4s2 → Ca2+: 1s22s22p63s23p64s0
You need to enable JavaScript to run this app.
Одинаковую электронную конфигурацию имеют ион кальция +2 и -4Si, -3P, -2S, -1Cl, Ar, +1K, +3Sc, +4Ti, +5V, +7Mn
Порядок заполнения оболочек атома кальция (Ca2+) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Кальций имеет 20 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
Количество электронов
Элемент находится в четвертом периоде таблицы Менделеева. Значит, электроны находятся рядом с ядром на четырех орбиталях:
- на первой — 2 e—;
- на второй — 8 e—;
- на третьей — 8 e—;
- на четвертой — 2 e—.
Электроны одинаковы по массе, силе заряда и строению, но имеют разные направления движения и траектории:
- s-электроны — вращаются вокруг собранных в ядро протонов и нейтронов, образуя сферу.

- p-электроны — описывают восьмерки по трем плоскостям.
В природе есть электроны, двигающиеся по более сложным схемам. Они описывают вокруг ядра двойные и четверные восьмерки в различных плоскостях. Но в атоме Ca их нет.
Если расписать строение с учетом электронных орбит, получится следующая формула: 1s22s22p63s23p64s2. Графическая формула (электронная конфигурация кальция) выглядит как [Ar] 4s².
Благодаря двум свободным s-электронам на четвертом энергетическом уровне Ca химически активен. Он почти никогда не находится в свободном состоянии, соединяясь в природе с водой или кислородом.
Состав распространенных соединений кальция:
- CaO — известняк;
- Ca CO3 — известняк, мрамор, мел;
- CaSO 4 ·2H 2 O — гипс;
- cacl2 — пищевая добавка.
При взаимодействии с водой идет образование щелочи — гидроксида кальция. Реакция проходит с выделением водорода.
Каждый атом Ca присоединяет 2 группы OH.
В результате формула гидроксида выглядит как Cа (OH)2.
Степень окисления кальция
Атомы кальция в соединениях имеют степени окисления 2.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Степень окисления иона Ca2+ = 2
Ионы кальция
2+Ca Ca 0
Валентность Ca
Атомы кальция в соединениях проявляют валентность II.
Валентность кальция характеризует способность атома Ca к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ca
Квантовые числа определяются последним электроном в конфигурации, для атома Ca эти числа имеют значение N = 4, L = 0, Ml = 1, Ms = -½
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Энергия ионизации Ca:
Eo = 590 кДж/моль
Технология получения
Конечный продукт промышленного производства – металлический кальций.
Металлический Кальций
Получение металла проходит двумя методами:
- Электролиз. Расплавляют CaCl2, задействуя медно-кальциевый анод. Из полученного медно-кальциевого сплава (2:1) отгоняют металл.
- Алюминотермия. Прокаливается смесь CaO и порошковый алюминий.
 Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.
Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.
Для обоих способов получения металла требуется вакуум и 960-1900°С.
Единственный производитель кальция в Европе – Чепецкий механический завод. Его открыли в 1949 году для нужд отечественной урановой промышленности. Уже тогда СССР отработал процесс восстановления урана кальцием. Сегодняшний ассортимент шире.
Применение
Главное применение металлического кальция — это использование его как восстановителя при получении металлов, особенно никеля, меди и нержавеющей стали. Кальций и его гидрид используются также для получения трудно восстанавливаемых металлов, таких, как хром, торий и уран. Сплавы кальция со свинцом применяются в некоторых видах аккумуляторных батарей и при производстве подшипников. Кальциевые гранулы используются также для удаления следов воздуха из электровакуумных приборов. Чистый металлический кальций широко применяется в металлотермии при получении редкоземельных элементов.
Кальций широко применяется в металлургии для раскисления стали наряду с алюминием или в сочетании с ним. Внепечная обработка кальцийсодержащими проволоками занимает ведущее положение в связи с многофакторностью влияния кальция на физико-химическое состояние расплава, макро- и микроструктуры металла, качество и свойства металлопродукции и является неотъемлемой частью технологии производства стали. В современной металлургии для ввода в расплав кальция используется инжекционная проволока, представляющая из себя кальций (иногда силикокальций или алюмокальций) в виде порошка или прессованного металла в стальной оболочке. Наряду с раскислением (удалением растворенного в стали кислорода) использование кальция позволяет получить благоприятные по природе, составу и форме неметаллические включения, не разрушающиеся в ходе дальнейших технологических операций.
Изотоп 48Ca — один из эффективных и употребительных материалов для производства сверхтяжёлых элементов и открытия новых элементов таблицы Менделеева. Это связано с тем, что кальций-48 является дважды магическим ядром, поэтому его устойчивость позволяет ему быть достаточно нейтроноизбыточным для лёгкого ядра; при синтезе сверхтяжёлых ядер необходим избыток нейтронов.
Это связано с тем, что кальций-48 является дважды магическим ядром, поэтому его устойчивость позволяет ему быть достаточно нейтроноизбыточным для лёгкого ядра; при синтезе сверхтяжёлых ядер необходим избыток нейтронов.
Промышленность
Львиная доля продукции металлургических комбинатов достается промышленному комплексу.
Здесь миссия кальция многогранна:
- Восстановление редкоземельных, тугоплавких элементов из соединений. Речь о хроме, никеле, меди, тории, уране.
- Удаление серы из бензина, керосина, других нефтепродуктов.
- Раскисление стали и сплавов цветных металлов.
- Получение антифрикционных сплавов.
- Очистка электровакуумных приборов от воздуха, других газов.
- Обезвоживание органических растворителей.
Металл используется при производстве аккумуляторных батарей, подшипников, оболочек кабелей.
Наука
Изотоп Ca-48 – материал с высоким КПД для производства сверхтяжелых элементов.
Кальцием восстанавливают уран.
С его помощью ученые пополняют таблицу Менделеева.
Другие сферы
Кальциевые материалы нашли применение на бытовом уровне:
- Строительный материал (известняк, гипс, мрамор).
- Сырье при производстве гипса, включая медицинский.
- Дезинфектор (хлорка).
- Мелки для рисования.
- Аптечные препараты, БАДы (особенно с витамином D).
Эстетично выглядящие образцы (флюорит, кальцинит, мрамор) попадают в минералогические коллекции.
Биологическая роль
Кальций — распространённый макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция (извести) состоят «скелеты» большинства групп беспозвоночных (губки, коралловые полипы, моллюски и др. ). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10−4 ммоль/л, в межклеточных жидкостях около 2,5 ммоль/л.
). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы — мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов. Концентрация кальция в цитоплазме клеток человека составляет около 10−4 ммоль/л, в межклеточных жидкостях около 2,5 ммоль/л.
Потребность в кальции зависит от возраста. Для взрослых в возрасте 19—50 лет и детей 4—8 лет включительно дневная потребность (RDA) составляет 1000 мг, а для детей в возрасте от 9 до 18 лет включительно — 1300 мг в сутки . В подростковом возрасте потребление достаточного количества кальция очень важно из-за интенсивного роста скелета. Однако по данным исследований в США всего 11 % девочек и 31 % мальчиков в возрасте 12—19 лет достигают своих потребностей. В сбалансированной диете большая часть кальция (около 80 %) поступает в организм ребёнка с молочными продуктами. Оставшийся кальций приходится на зерновые (в том числе цельнозерновой хлеб и гречку), бобовые, апельсины, зелень, орехи. Всасывание кальция в кишечнике происходит двумя способами: через клетки кишечника (трансцеллюлярно) и межклеточно (парацелюллярно). Первый механизм опосредован действием активной формы витамина D (кальцитриола) и её кишечными рецепторами. Он играет большую роль при малом и умеренном потреблении кальция. При большем содержании кальция в диете основную роль начинает играть межклеточная абсорбция, которая связана с большим градиентом концентрации кальция. За счёт чрезклеточного механизма кальций всасывается в большей степени в двенадцатиперстной кишке (из-за наибольшей концентрации там рецепторов в кальцитриолу). За счёт межклеточного пассивного переноса абсорбция кальция наиболее активна во всех трёх отделах тонкого кишечника. Всасыванию кальция парацеллюлярно способствует лактоза (молочный сахар).
Всасывание кальция в кишечнике происходит двумя способами: через клетки кишечника (трансцеллюлярно) и межклеточно (парацелюллярно). Первый механизм опосредован действием активной формы витамина D (кальцитриола) и её кишечными рецепторами. Он играет большую роль при малом и умеренном потреблении кальция. При большем содержании кальция в диете основную роль начинает играть межклеточная абсорбция, которая связана с большим градиентом концентрации кальция. За счёт чрезклеточного механизма кальций всасывается в большей степени в двенадцатиперстной кишке (из-за наибольшей концентрации там рецепторов в кальцитриолу). За счёт межклеточного пассивного переноса абсорбция кальция наиболее активна во всех трёх отделах тонкого кишечника. Всасыванию кальция парацеллюлярно способствует лактоза (молочный сахар).
Усвоению кальция препятствуют некоторые животные жиры (включая жир коровьего молока и говяжий жир, но не сало) и пальмовое масло. Содержащиеся в таких жирах пальмитиновая и стеариновая жирные кислоты отщепляются при переваривании в кишечнике и в свободном виде прочно связывают кальций, образуя пальмитат кальция и стеарат кальция (нерастворимые мыла). В виде этого мыла со стулом теряется как кальций, так и жир. Этот механизм ответственен за снижение всасывания кальция, снижение минерализации костей и снижение косвенных показателей их прочности у младенцев при использовании детских смесей на основе пальмового масла (пальмового олеина). У таких детей образование кальциевых мыл в кишечнике ассоциируется с уплотнением стула, уменьшением его частоты, а также более частым срыгиванием и коликами.
В виде этого мыла со стулом теряется как кальций, так и жир. Этот механизм ответственен за снижение всасывания кальция, снижение минерализации костей и снижение косвенных показателей их прочности у младенцев при использовании детских смесей на основе пальмового масла (пальмового олеина). У таких детей образование кальциевых мыл в кишечнике ассоциируется с уплотнением стула, уменьшением его частоты, а также более частым срыгиванием и коликами.
Концентрация кальция в крови из-за её важности для большого числа жизненно важных процессов точно регулируется, и при правильном питании и достаточном потреблении обезжиренных молочных продуктов и витамина D дефицита не возникает. Длительный дефицит кальция и/или витамина D в диете приводит к увеличению риска остеопороза, а в младенчестве вызывает рахит.
Избыточные дозы кальция и витамина D могут вызвать гиперкальцемию. Максимальная безопасная доза для взрослых в возрасте от 19 до 50 лет включительно составляет 2500 мг в сутки (около 340 г сыра Эдам).
Периодическая система химических элементов Д. И. Менделеева
Электрохимический ряд активности металлов
Жизненные процессы
Макроэлемент аккумулируется костями и зубами.
Известь (карбонат кальция) – строительный материал ракушек, кораллов, яичной скорлупы, накипи в чайнике.
Вещество задействовано в следующих процессах:
- Свертывание крови.
- Сокращение мышц.
- Секреция гормонов.
Тело человека массой 60 кг содержит полтора килограмма кальция.
Достаточное количество металла критично для детей и подростков: их скелет растет каждую минуту. У младенцев может проявиться рахитичность.
Питание
Макроэлемент поступает в организм во время еды. В детском возрасте продукт номер один – молоко.
Рацион взрослых разнообразнее. Веществом насыщены продукты всех групп:
- Цельнозерновой хлеб, гречка.
- Морепродукты, рыба (особенно мягкие кости).
- Бобовые.

- Орехи, свежий кунжут.
- Листовой салат, укроп, петрушка, спаржа.
Всасыванию кальция содействует лактоза, препятствуют кофе, углеводы, пальмовое масло, животные жиры (кроме сала).
Нормы
Суточная потребность в макроэлементе определяется возрастом (г):
| Возраст (лет) | Количество кальция (мг) |
| 0-6 | 1490 |
| 7-9 | 750 |
| 10-12 (мальчики) | 910 |
| 10-12 (девочки) | 1250 |
| 13-19 | 1250 |
| 20-49 | 1050 |
| 49+ | 1150-1350 |
Беременным и кормящим матерям требуется повышенная норма вещества.
Какую роль играет внутри организма
Имеет важное структурное значение, являясь строительным материалом для твердых покровов, костей, зубов, роговых пластин, копыт животных. Раковины моллюсков практически полностью состоят из кальцинированных соединений. Велика биологическая роль кальция. В организме человека он осуществляет массу функций, участвуя в большинстве жизненно важных процессов:
Велика биологическая роль кальция. В организме человека он осуществляет массу функций, участвуя в большинстве жизненно важных процессов:
- регулирует мышечные сокращения, секрецию нейромедиаторов,
- воздействуя на кровеносную систему, регулирует давление,
- принимает активное участие в регулировании свертывания крови и обмена веществ внутри клеток,
- участвует в постоянном обновлении состава костей,
- укрепляет иммунную систему,
- способствует синтезу ферментов и гормонов,
- воздействует на мышцы, регулирует сердечные сокращения,
- влияет на внутриклеточные процессы,
- защищает клетку, регулируя проницаемость мембраны.
Суточное пополнение организма человека кальцием должно составлять не менее 800-1250 мг, предельная норма — 2500 мг/сут.
Важно! Это единственный элемент, способный нормализовать кислотно-щелочной баланс в организме. Преобладание кислоты вызывает активное образование солей, камней в почках, создаст предпосылки к возникновению сердечно-сосудистых заболеваний.
Свойства кальция и его соединений
Источники
- https://jgems.ru/metally/kaltsij
- https://www.prostudenta.ru/article-2263.html
- https://tvercult.ru/nauka/kakova-biologicheskaya-rol-i-harakteristika-himicheskogo-elementa-kaltsiya
- https://Sprint-Olympic.ru/uroki/himija/99040-atom-kalciia-osobennosti-stroenie-iadra-i-elektronnoi-obolochki.html
- https://k-tree.ru/tools/chemistry/periodic.php?element=Ca&oxidation=2
- https://k-tree.ru/tools/chemistry/periodic.php?element=Ca
- https://chem.ru/kalcij.html
Ваша оценка?
Петр Иваныч
Возможно этот человек ответит на ваши вопросы
Задать вопрос
S-элементы | Дистанционные уроки
10-Авг-2012 | комментария 2 | Лолита Окольнова
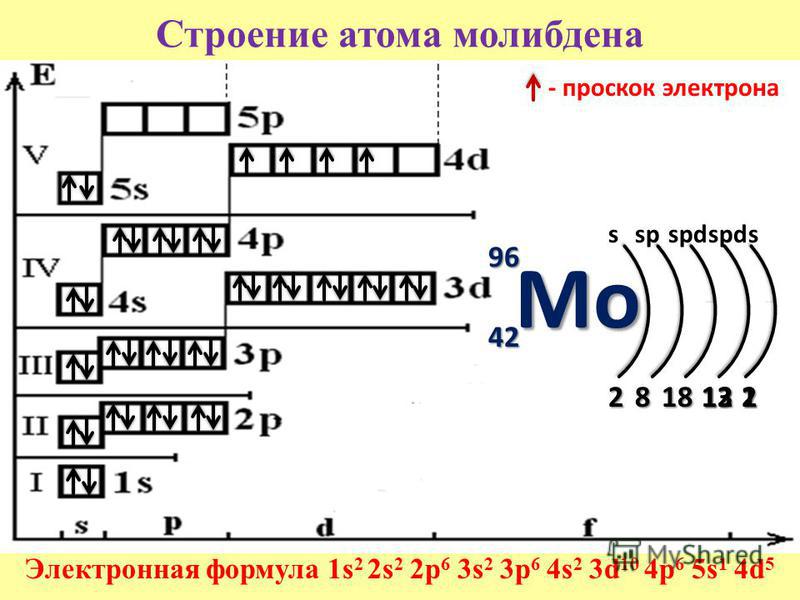
Чтобы рассмотреть строение электронных оболочек атомов элементов, нам надо понимать строение атома и периодическую систему.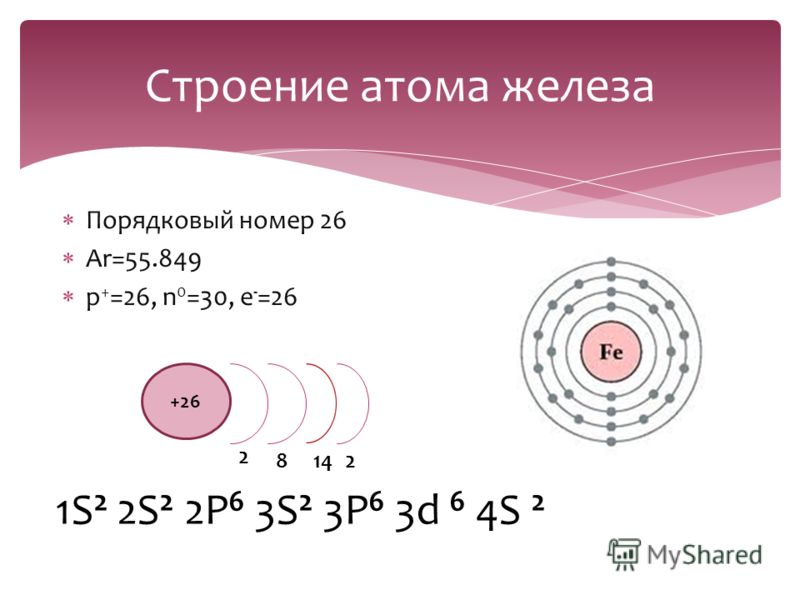
Допустим, что с этим мы разобрались.
Теперь подробно рассмотрим строение электронных оболочек атомов
В школьной периодической системе элементов они обозначены красным цветом — «красненькие«.
Помимо этого, это элементы главных подгрупп, т.е. электроны s-орбитали у них валентные
А что следует из того, что у элемента электроны располагаются на S-орбитали?
- Каждый энергетический уровень атома начинается с этой орбитали. Это значит, что если у атома появится возможность отдать электроны с этого уровня, он приблизится к стабильному состоянию — достижению 8-ми электронной оболочки, как у благородных газов!
- Значит, в основном, S-элементы проявляют металлические свойства — восстановительные
- На нем могут располагаться максимум 2 электрона! Т.
 е. их валентность равна 1 или 2
е. их валентность равна 1 или 2
s- элементы
1- й группы главной подгруппы
Как видно из рисунка, элементы 1-й группы периодической системы имеют на внешнем энергетическом уровне только 1 электрон, поэтому их валентность=1 , степень окисления — +1.
Внизу таблички есть подсказка: формула высшего оксида:
+1 -2
R2O
Т.е. из правил составления химических формул можно легко определить валентность R
Общая электронная конфигурация этих элементов будет выглядеть так:
Если расписать строение подробно, например, для K, то вот «полный отчет»:
s- элементы
2 — й группы главной подгруппы
Элементы 2-й группы периодической системы имеют на внешнем энергетическом уровне 2 электрона, поэтому их валентность=2 , степень окисления — +2.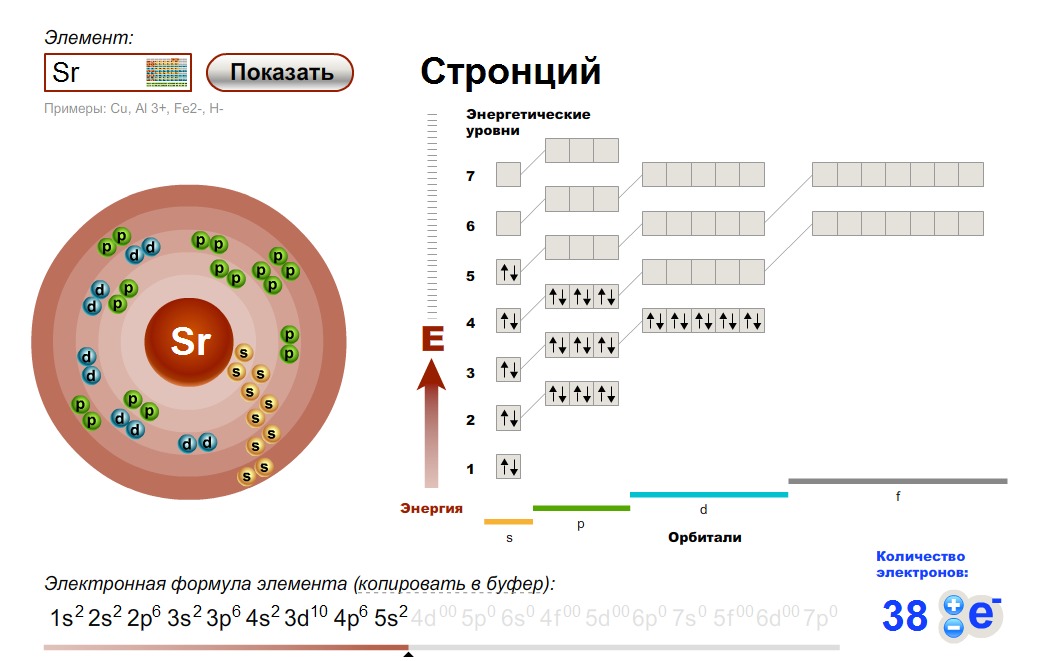
Внизу таблички есть подсказка: формула высшего оксида:
+2 -2
RO
Т.е. из правил составления химических формул можно легко определить валентность R
Общая электронная конфигурация этих элементов будет выглядеть так:
Ну и если расписать строение подробно, например, для Ca, то вот «полный отчет»:
- примеры вопросов ЕГЭ по этой теме
- примеры вопросов ГИА (ОГЭ)
Категории: |
(Правила комментирования)
Структура атома – Класс 9 Научные заметки
Открытие атомов было революционным началом нового и подробного мира науки. Каким бы маленьким ни был атом, внутри него заключено множество важных понятий. Это должным образом объяснено в главе «Структура атома» класса 9. Эта глава познакомит вас с такими важными темами, как фундаментальные составляющие атома, различные модели атома, распределение электронов, валентности, атомный номер и массовое число.
Эта глава познакомит вас с такими важными темами, как фундаментальные составляющие атома, различные модели атома, распределение электронов, валентности, атомный номер и массовое число.
Этот блог включает в себя:
- Fundamental Constituents of an Atom
- Electron
- Protons
- Neutrons
- Atomic Structure of Carbon
- Atomic Structure of Oxygen
- Atomic Structure of Hydrogen
- Atomic Structure of Helium
- Different Models on Structure of атом
- Модель Томсона ATOM
- Модели Резерфорда ATOM
- модели BOHR ATOM
- Распределение электронов в различных оболочках
- Валентность
- Atomic Number (Z)
- Mass Number (A)
- ISOMIC ATOMIC (Z)
- (A)
- ISOTOPES ISTOMIC (Z)
- . Изобары
- Изотопы
- Изобары
- Важные вопросы и ответы
- Часто задаваемые вопросы
Класс 9 Программа ICSE по химии 90 06014 Класс 9 ICSE Maths Атом состоит из трех основных частиц, а именно протонов, нейтронов и электронов. Дж. Дж. Томсон в 1897 году обнаружил отрицательно заряженные частицы, испускаемые катодом по направлению к аноду, в эксперименте с электронно-лучевым излучением. Эти отрицательно заряженных частиц — это электроны. Эрнест Гольдштейн в 1886 году обнаружил, что при различных условиях в той же камере анод испускает положительно заряженных частиц, известных как канальные лучи или позже названных протонами. Дж. Чедвик открыл субатомную частицу с без заряда и массой, эквивалентной протонам в ядрах всех атомов. Эти нейтрально заряженные частицы — нейтроны. Атом углерода содержит шесть протонов, шесть электронов и шесть нейтронов, что составляет его массовое число 12. Атом кислорода содержит восемь протонов, восемь электронов и восемь нейтронов, составляющих его массу. номер 16. Атом водорода (H) содержит только один протон, один электрон и не содержит нейтронов. Атом гелия содержит два протона, два электрона и два нейтрона, что делает его массовое число равным 2. Фундаментальная единица жизни Класс 9 Примечания Со времени открытия атомов существует множество теорий, которые были сформулированы многими известными учеными. Упомянутые ниже важные теории о структуре атома в соответствии с главой. Дж. Недостатки модели Томсона: Томсоновская структура атома не смогла объяснить расположение протонов и электронов в его структуре. Класс 9: Работа, энергия и мощность Примечания Резерфорд провел эксперимент по бомбардировке альфа-(α)-частицами золотой фольги. Это постулаты, высказанные Резерфордом с использованием эксперимента по рассеянию альфа-(α)-частиц на золотой фольге. Недостатки модели: Хотя Резерфорд представил совершенно новую модель строения атома, было много недостатков, которые он не смог объяснить, а именно: Формат написания сюжета для класса 9 Класс 9 ICSE Physics 7
Основные составляющие атома
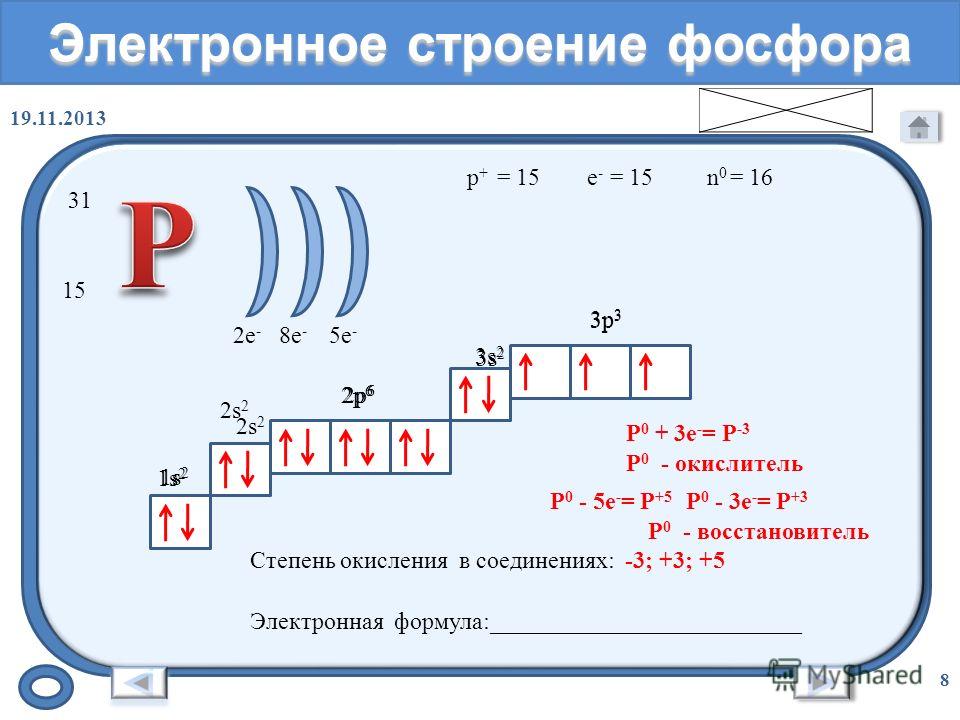 Ядро атома содержит протоны и нейтроны, где протоны заряжены положительно, а нейтроны нейтральны. Электроны расположены в самых внешних областях, называемых электронной оболочкой.
Ядро атома содержит протоны и нейтроны, где протоны заряжены положительно, а нейтроны нейтральны. Электроны расположены в самых внешних областях, называемых электронной оболочкой. Электрон
Протоны
Нейтроны
Атомная структура углерода

Атомная структура кислорода
Атомная структура водорода
Атомная структура гелия
Различные модели строения атома
Модель атома Томсона
 Дж. Томсон предположил, что структура атома аналогична структуре рождественского пудинга, где электроны встроены в сферу, как смородина. Он предложил:
Дж. Томсон предположил, что структура атома аналогична структуре рождественского пудинга, где электроны встроены в сферу, как смородина. Он предложил: Модель атома Резерфорда

Кредиты: AMRITACREATE Когда электроны вращаются, они теряют энергию. Вскоре электроны сколлапсируют в ядро. Эта тенденция сделала бы атом очень нестабильным, в то время как атом очень стабилен
Когда электроны вращаются, они теряют энергию. Вскоре электроны сколлапсируют в ядро. Эта тенденция сделала бы атом очень нестабильным, в то время как атом очень стабилен Модели Bohr’s Model at Atom
9001
Модели Bohr’s Model at Atom
9001. которую подняла модель Резерфорда. Итак, он сформулировал следующие постулаты:- Атом допускает только дискретное количество орбиталей для электронов на орбите и образует внешнюю структуру атома
- При вращении отрицательно заряженные частицы не теряют энергию на этих орбиталях или энергетических уровнях
- Когда электрон перескакивает с одной энергетической оболочки на другую, происходит изменение величины
Модель Бора дает подробное объяснение строения атома и преодолевает возражения, с которыми сталкиваются все другие модели строения атома.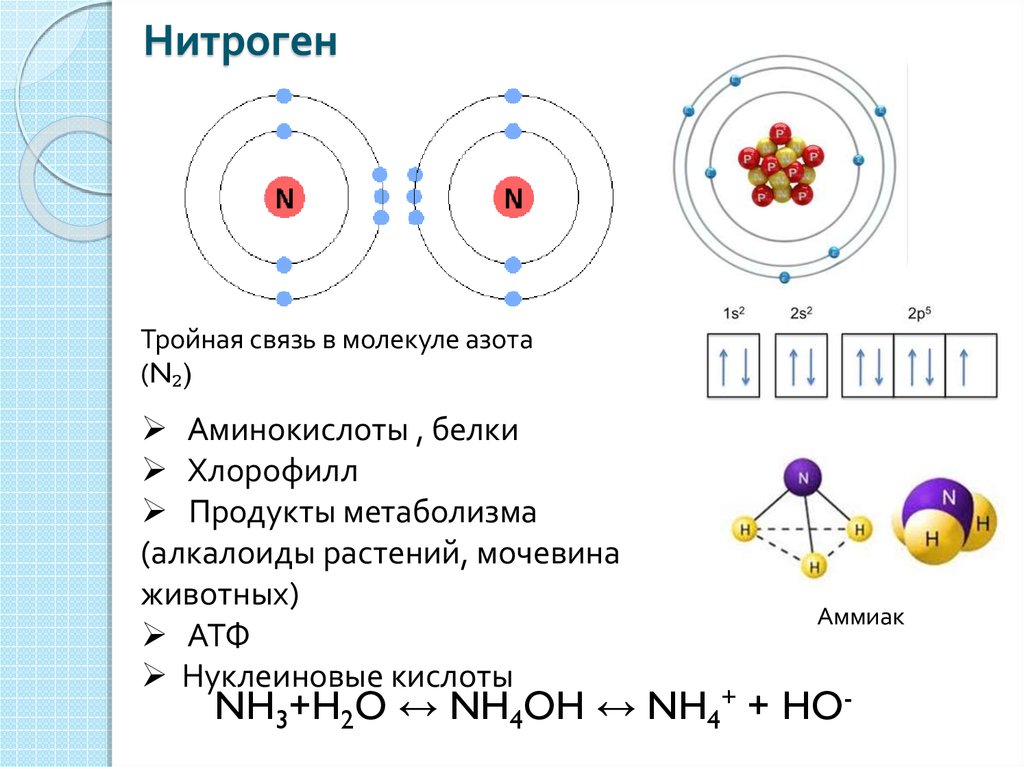
Распределение электронов по различным оболочкам
92 дает размещение максимального количества электронов в каждой оболочке, n=1, 2, 3, 4 для K=2, L=8, M=18, N=32 Количество электронов в K-оболочке: n = 1
2n 2 = 2 × 1 2 = 2
Максимальное количество электронов в 92 число электронов на любой оболочке можно рассчитать.
Валентность
Следующим важным понятием в наших заметках о структуре атома является валентность. Отрицательно заряженные частицы, присутствующие во внешней оболочке, называются валентными электронами. Эти валентные электроны отвечают за валентность атома.
Валентность – это склонность атома реагировать с другими атомами того же или различных элементов. Атомы, которые заполняют крайние пути, проявляют химическую активность по отношению к другим валентным электронам. Эта реакционная способность отвечает за образование молекул между двумя или более атомами.
Атомы, которые заполняют крайние пути, проявляют химическую активность по отношению к другим валентным электронам. Эта реакционная способность отвечает за образование молекул между двумя или более атомами.
Валентность становится нулевой для атома, когда внешние границы имеют восемь электронов или не теряют ни одного электрона. Частица с восемью электронами на самой внешней оболочке представляет собой октет, и эти молекулы в основном инертны по своей природе.
Магний (Mg) имеет конфигурацию (2, 8 и 2), поэтому валентность два . Кислород (O) (2, 8 и 6) имеет валентность два , поскольку количество электронов, которое он может получить, равно двум для достижения упакованного внешнего энергетического уровня. Точно так же Гелий (Не) имеет 2 электрона во внешней оболочке, Неон (Ne) (2, 8 и 8) имеет восемь электронов во внешней оболочке. Следовательно, они не проявляют никакой химической активности.
Следовательно, они не проявляют никакой химической активности.
Примеры химии в повседневной жизни
Атомный номер (Z)
Ядро атома состоит из протонов , а атомный номер равен числу протонов, присутствующих в одном атоме элемента . Поскольку атом электрически нейтрален, количество протонов и электронов одинаково. Обозначение Z обозначает атомный номер. Атомный номер водорода равен единице, поскольку он имеет только один протон.
Понимание этих основных моментов главы структуры атома будет полезно для вас-
Количество протонов, присутствующих в атоме = Атомный номер (Z)
Количество электронов, присутствующих в атоме = Атомный номер ( Z)
Количество нейтронов = Массовое число (A)- Атомный номер (Z)
Массовое число (A)
Массовое число является мерой общего числа протонов и нейтронов в ядре атома. Обозначение A указывает на массовый номер . Обозначение N означает общее число нейтронов .
Обозначение A указывает на массовый номер . Обозначение N означает общее число нейтронов .
Массовое число = Атомный номер + Количество нейтронов в ядре
A = Z + n°
Массовое число также называют нуклонным числом.
Изотопы и изобары
Изотопы и изобары — важные понятия, которые вы должны понимать, чтобы лучше понять главу.
Изотопы
Атомы одних и тех же элементов с одинаковым атомным номером и разными массовыми числами. Водород имеет три изотопа: Протий, Дейтерий, Тритий .
Примеры:
Изобары
Атомы разных молекул с одинаковым массовым числом. Например, в кальции с атомным номером 20 и аргоне с атомным номером 18 массовое число обоих этих элементов равно 40. Это показывает, что общее число нуклонов в атомах одинаково.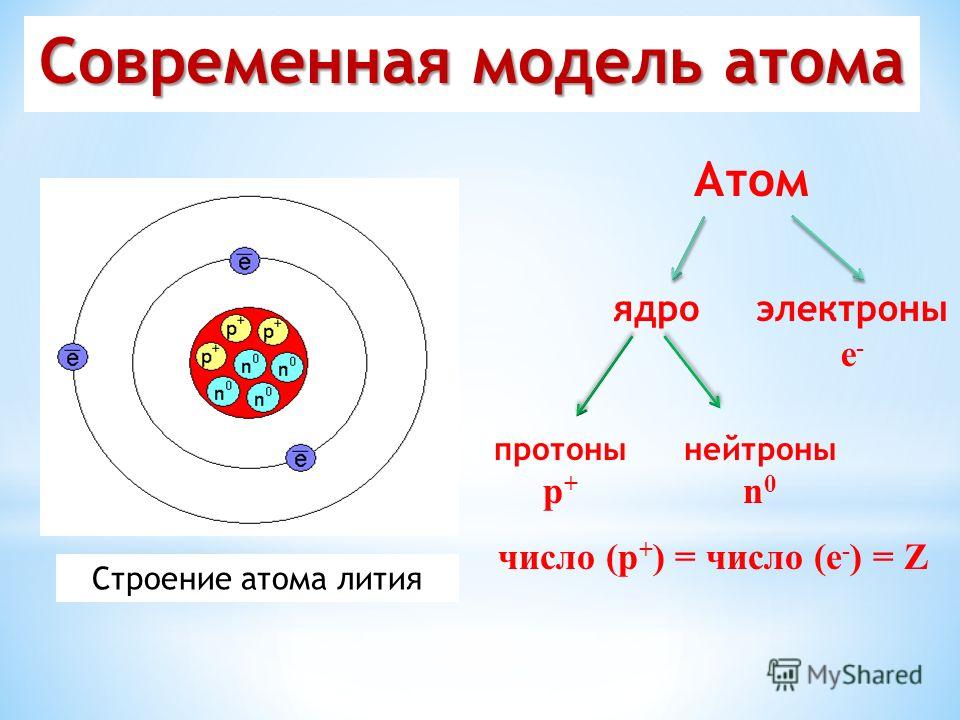
Примеры:
Важные вопросы и ответыQ1. Назовите свойства электронов, протонов и нейтронов.
Сол:
| Недвижимость | Электроны | | Нейтроны |
| Плата | Отрицательно заряженный | Положительно заряженный | Бесплатно |
| Аффинити | Притягивается к положительно заряженным | Притягивается к отрицательно заряженным | Не привлекайте ни положительное, ни отрицательное |
| Вес | Масса пренебрежимо мала | 1 час ночи | 1 час ночи |
| Местоположение | Вне ядра | Внутри ядра | Внутри ядра |
Q2. Опишите ограничения модели атома Дж. Дж. Томсона.
Сол: Согласно этой модели, электроны полностью погружены в положительно заряженные сферы. Но эксперименты показали, что протоны присутствуют только в центре атома, а электроны распределены вокруг ядра атома.
Q3. Укажите ограничения модели атома Резерфорда.
Sol: Согласно этой модели, электроны вращаются по круговой орбите вокруг ядра. Любая такая частица, вращающаяся вокруг ядра, претерпевала бы ускорение и излучала бы энергию. Вращающийся электрон потерял бы свою энергию и в конце концов упал бы на ядро, атом был бы крайне нестабилен. Хотя атомы достаточно стабильны.
Q4. Опишите модель атома Бора.
Sol: проверьте следующие утверждения:
- В центре атома находится ядро.
- Отрицательно заряженные электроны вращаются вокруг ядра.
- Атомы ядра содержат различные орбиты электронов.
- Электроны не излучают энергию при вращении по определенным орбитам
- Эти орбиты или оболочки обозначаются буквами K,L,M,N или цифрами 1,2,3,4.

Q5. Приведите сравнение всех предложенных моделей атома, приведенных в этой главе.
Сол:
| Томсон | Резерфорд | Бор |
| Сфера заряжена положительно. | Положительно заряженная сфера в центре называется ядром. | Положительный заряд в центре называется ядром. |
| Электроны вращаются вокруг ядра по орбитам. | Электроны вращаются по дискретным орбитам и не излучают энергию. | |
| Положительный заряд = Отрицательный заряд. Атом электрически нейтрален. | Размер ядра очень мал по сравнению с размером атома. | Орбиты обозначались как энергетические оболочки буквами K, L, M, N или цифрами 1,2,3,4. |
Кредиты: Britannica Модель атома Резерфорда
Кредиты: Модель атома COCCBohr
Кредиты: Classnotes
Часто задаваемые вопросы
Как лучше всего описать структуру атома?
Базовая структура атома включает крошечное относительно массивное ядро, содержащее по крайней мере один протон и обычно один или несколько нейтронов . Вне ядра находятся энергетические уровни (также называемые оболочками), которые содержат один или несколько электронов.
Вне ядра находятся энергетические уровни (также называемые оболочками), которые содержат один или несколько электронов.
Можно ли уничтожить атом?
Согласно закону сохранения энергии материя не может быть ни создана, ни уничтожена. Следовательно, атом не может быть разрушен и не может быть разбит на более мелкие частицы.
Какие 3 части атома?
Учитывая, что эти частицы состоят из атомов, их часто называют субатомными частицами. Есть три субатомные частицы: протоны, нейтроны и электроны.
Таким образом, мы надеемся, что этот блог о структуре атома поможет вам лучше понять учебный план по естественным наукам класса 9 . Вы также можете обратиться к нашим экспертам Leverage Edu за помощью в принятии важных карьерных решений.
Структура атома — модели атомов, протоны, нейтроны, теории, часто задаваемые вопросы
Структура атома — это структура атома, состоящая из ядра в центре, содержащего нейтроны и протоны, а электроны вращаются вокруг ядра. Поскольку атомы состоят из очень крошечного положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Термин «атомная структура» объясняет структуру атома, который имеет ядро (центр), содержащее как протоны (положительно заряженные), так и нейтроны (нейтральные). Центр ядра окружают отрицательно заряженные электроны.
Поскольку атомы состоят из очень крошечного положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Термин «атомная структура» объясняет структуру атома, который имеет ядро (центр), содержащее как протоны (положительно заряженные), так и нейтроны (нейтральные). Центр ядра окружают отрицательно заряженные электроны.
Демокриту, ученому, который первоначально утверждал, что материя состоит из атомов, приписывают разработку концепций строения атома и квантовой механики. Многое можно узнать о химических реакциях, связях и их физических характеристиках, изучая структуру атома. Позже, в 1800-х годах, Джон Дальтон выдвинул первую научную теорию строения атома.
Что такое атомная структура?
Состав ядра элемента и то, как его электроны расположены вокруг него, называются атомной структурой элемента. Протоны, электроны и нейтроны составляют большую часть атомной структуры материи.
Ядро атома, состоящее из протонов и нейтронов, окружено собственными электронами атома. Общее количество протонов в ядре элемента выражается атомным номером элемента. Протоны и электроны равномерно распределены среди нейтральных атомов. Но атомы могут получать или терять электроны, чтобы сделать их более стабильными, и получившийся в результате заряженный объект известен как ион. Поскольку атомы разных элементов содержат разное количество протонов и электронов, их атомная структура также различна. Это объясняет, почему разные элементы обладают уникальными свойствами.
Общее количество протонов в ядре элемента выражается атомным номером элемента. Протоны и электроны равномерно распределены среди нейтральных атомов. Но атомы могут получать или терять электроны, чтобы сделать их более стабильными, и получившийся в результате заряженный объект известен как ион. Поскольку атомы разных элементов содержат разное количество протонов и электронов, их атомная структура также различна. Это объясняет, почему разные элементы обладают уникальными свойствами.
Атомные модели
Многие ученые использовали атомные модели, чтобы понять структуру атома в первые века. Каждая из этих моделей имела свои преимущества и недостатки и сыграла значительную роль в развитии современной модели атома. Такие ученые, как Джон Далтон, Дж.Дж. Томсон, Эрнест Резерфорд и Нильс Бор внесли наиболее заметный вклад в науку.
В этом разделе настоящей статьи обсуждаются их теории относительно строения атома:
Атомная теория Дальтона
Джон Дальтон был британским химиком и предположил, что все вещества состоят из атомов. А также то, что атомы неделимы и неразрушимы. Он также предположил, что все атомы определенного вещества одинаковы, но атомы разных элементов имеют разные размеры и массы.
А также то, что атомы неделимы и неразрушимы. Он также предположил, что все атомы определенного вещества одинаковы, но атомы разных элементов имеют разные размеры и массы.
Согласно атомной теории Дальтона, химические реакции включают перегруппировку атомов для образования продуктов. Согласно постулатам, предложенным в его теории, атомная структура состоит из атомов, и они являются мельчайшими частицами, ответственными за протекание химических реакций.
Постулаты теории Дальтона
- Все существующее вещество состоит из атомов.
- Атомы неделимы.
- Конкретный элемент содержит только один тип атома.
- Атом имеет постоянную массу, которая варьируется для каждого элемента.
- Во время химической реакции происходит перегруппировка атомов
- Атомы не могут ни создаваться, ни разрушаться, а могут только переходить из одной формы в другую.
Атомная теория Дальтона смогла успешно объяснить Законы химических реакций, названные Законом сохранения массы, Законом постоянных свойств, Законом кратных пропорций и Законом обратных пропорций.
- Эта теория не могла объяснить существование изотопов.
- Не было дано надлежащего объяснения относительно структуры атомов.
- Позднее было обнаружено, что атомы делимы, и утверждение Дальтона о неделимости атомов оказалось ошибочным.
Открытие составляющих частиц атомов привело к лучшему пониманию химических веществ, эти составляющие частицы называются субатомными частицами.
Модель атома Томсона
Сэр Джозеф Джон Томсон также был английским химиком, известным своим открытием электронов, известным как модель атома Томсона, за которое он также получил Нобелевскую премию. Он провел эксперимент с катодными лучами, чтобы изобрести электроны. В этом опыте берется стеклянная трубка с двумя отверстиями. Одно отверстие предназначено для вакуумного насоса, а другое — для всасывания, через которое в трубку вдувается газ. С помощью вакуумного насоса внутри стеклянной камеры поддерживается частичный вакуумный насос.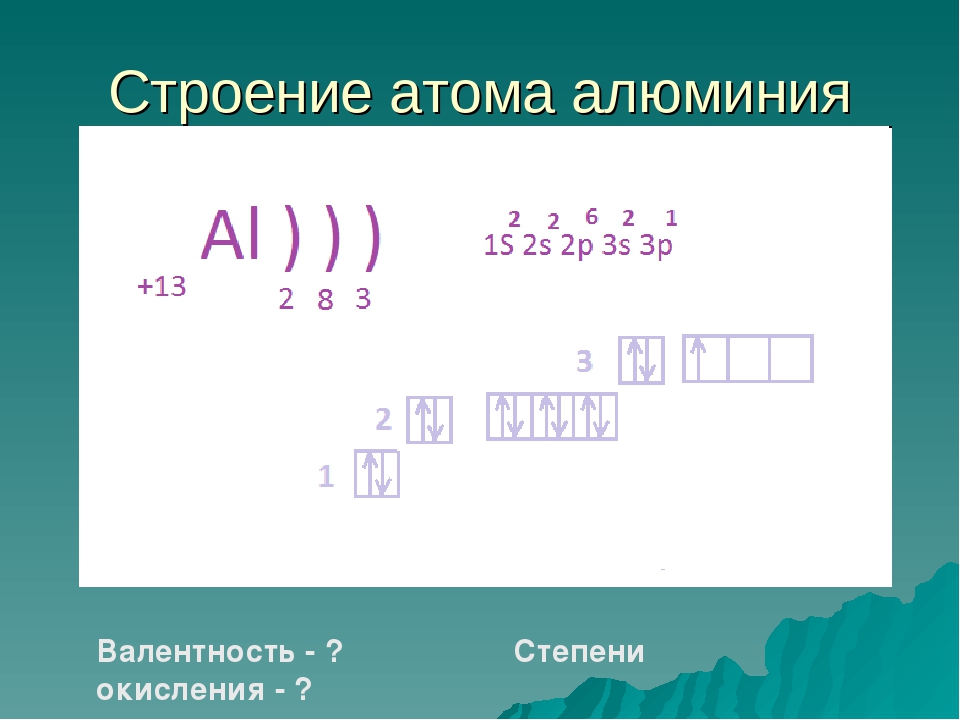 С помощью электродов подключается высоковольтный источник питания. Проще говоря, внутри стеклянной трубки помещаются катод и анод.
С помощью электродов подключается высоковольтный источник питания. Проще говоря, внутри стеклянной трубки помещаются катод и анод.
Наблюдения атомной модели ТомсонаСледующие наблюдения были сделаны, когда ток протекал между катодом и анодом.
- Когда питание высокого напряжения подключено и включено, лучи передавались от катода к аноду. На экране ZnS наблюдались флуоресцентные пятна, что подтверждало факт пропускания лучей. Эти лучи получили название катодных лучей 9.0004 .
- При проецировании на трубку внешнего электрического поля лучи отклонялись в сторону положительного электрода. Но в отсутствие электрического поля лучи возвращались прямолинейно.
- Но когда лопасти ротора были закреплены на пути катодных лучей, казалось, что лучи вращаются. Это доказывало, что катодные лучи состоят из частиц, обладающих массой.
- Используя все доказательства, Томсон пришел к выводу, что катодные лучи состоят из отрицательно заряженных частиц, называемых электронов .
- Путем воздействия электрического и магнитного полей на катодный луч было найдено отношение заряда к массе (e/m). Значение e/m для электронов оказалось равным 17588 × 10 11 e/bg
Малликин провел эксперимент с каплей масла, чтобы найти заряд электрона, используя отношение e/m. Он нашел заряд электрона = 1,6 х 10 -16 Кл и массу электрона = 9,1093 х 10 -31 кг. Томсон описал структуру атома как положительно заряженную сферу, в которой закрепились отрицательно заряженные электроны. Популярное название, данное этой модели, — «модель сливового пудинга», потому что ее можно рассматривать как блюдо для сливового пудинга, где положительно заряженный атом означает пудинг, а кусочки сливы — электроны.
Причина неудачи модели Томсона в том, что эта модель не дает ясного представления об устойчивости атома. Эта модель не могла приспособиться к другим субатомным частицам, открытым в будущем.
Эксперимент по рассеянию альфа-лучей и атомная теория Резерфорда
Резерфорд, ученик Дж. Дж. Томсона, открыл еще одну субатомную частицу, названную ядром. Это открытие внесло огромные изменения в атомную структуру. Наблюдения, сделанные Томсоном в его эксперименте, были использованы Резерфордом, чтобы предложить свою теорию строения атома посредством эксперимента, названного Резерфордовским экспериментом по рассеянию альфа-лучей.
Дж. Томсона, открыл еще одну субатомную частицу, названную ядром. Это открытие внесло огромные изменения в атомную структуру. Наблюдения, сделанные Томсоном в его эксперименте, были использованы Резерфордом, чтобы предложить свою теорию строения атома посредством эксперимента, названного Резерфордовским экспериментом по рассеянию альфа-лучей.
Резерфорд использовал явление радиоактивности при проведении своего эксперимента. Он использовал радиоактивный материал бромид радия (RaBr). RaBr испускает α-частицы, что является формой излучения. В установку был помещен тонкий металлический лист золотого цвета. Затем на этот лист бомбардировали α-частицами. Для наблюдения за отклонением частиц использовали экран из сульфида цинка (ZnS), который помещали за золотой фольгой. Далее Резерфорд разработал детектор для подсчета количества радиоактивных частиц. Первоначально он записывал скорость счета RaBr, поскольку вел подсчет α-частиц, испускаемых в минуту.
Наблюдение за моделью РезерфордаСледующие наблюдения были сделаны Резерфордом и сделаны выводы:
Заключение модели Резерфорда
- Большинство α-частиц прошло через тонкие листы.
Это означает, что большая часть пространства атома пуста.
- Другое наблюдение заключалось в том, что некоторые из α-частиц немного отклонялись во всех направлениях. Это приводит к выводу, что положительный заряд не распределен равномерно по всему атому.
- Очень немногие α-частицы отклоняются назад по пути, по которому они двигались. Это произошло из-за того, что заряды отталкивались друг от друга. Увидев это, Резерфорд пришел к выводу, что положительный заряд в атоме существует в очень малом объеме.
- Не только положительно заряженные частицы, но и большая масса также сосредоточена в очень маленьком объеме. Резерфорд назвал эту область Ядром.
- Резерфорд также выдвинул аргумент о том, что электроны находятся на орбитах вокруг своих орбит, подобно планетам в Солнечной системе. Электроны заряжены отрицательно и вращаются вокруг ядра.
- Электроны и ядра удерживаются электростатической силой притяжения, потому что они заряжены отрицательно и положительно соответственно.
Делая выводы из всех вышеизложенных наблюдений, Резерфорд предложил свою атомную структуру, которая обладала следующими свойствами –
Ограничения модели Резерфорда
- Ядро находится в центре атома, а максимум заряда и масса сосредоточена только там.
- Атомы имеют сферическую форму.
- Электроны вращаются вокруг ядра по круговой орбите.
Как и другие модели атома, модель Резерфорда также имела много недостатков.
- Чтобы вращаться вокруг ядра, им придется затратить энергию, а это тоже против сильной силы притяжения со стороны ядра. Электроны потратят много энергии и в итоге потеряют всю энергию и попадут в ядро. Это поднимает серьезные вопросы о стабильности атома.
- Если электроны непрерывно вращаются вокруг ядра, то спектр, который они излучают, должен быть непрерывным спектром, но то, что мы наблюдаем, является линейчатым спектром.
Субатомные частицы
Протоны- Протоны имеют положительный заряд. Этот заряд равен 1e, что примерно равно 1,602 × 10 -19
- Масса протона примерно равна 1,672 × 10 -24
- Протоны более чем в 1800 раз тяжелее электронов.
- Общее количество протонов в атомах элемента и атомный номер элемента всегда равны.
- Масса нейтрона почти аналогична массе протона, т.е. 1,674 × 10 -24
- Нейтроны всегда являются электрически нейтральными частицами и не несут никакого заряда.
- Изотопы элемента имеют одинаковое количество протонов, но разное количество протонов в соответствующих ядрах.
- Заряд электрона равен -1e, что приблизительно равно -1,602 × 10 -19
- Масса электрона составляет приблизительно 9,1 × 10 -391 901.

- Масса электрона практически ничтожна по сравнению с массой атома, поэтому масса электрона игнорируется при расчете массы атома.
Атомная структура изотопов
Все компоненты объединены под названием Нуклоны атома. Это может быть нейтрон или протон. Количество протонов уникально для каждого элемента, что обозначается его уникальным атомным номером. Элемент может иметь несколько атомных структур, но иметь разное количество нуклонов. Эти варианты элемента имеют разное количество нуклонов. Эти варианты называются изотопами элементов. Это приводит к тому, что изотопы имеют одинаковое количество протонов, но разное количество нейтронов.
Для описания структуры изотопа используется символ элемента, а также атомный номер и массовое число изотопа. Например, у водорода есть 3 изотопа: протий, дейтерий и тритий. Стабильность изотопов различна. Периоды полураспада тоже разные. Но обычно они имеют сходное химическое поведение, потому что имеют одинаковую электронную структуру.
Теория атома Бора
Бор предложил свою модель в 1915 году, и это наиболее широко используемая модель атома, основанная на теории квантования Планка. Теория Бора применима к модифицированной атомной структуре. Это объясняет, что электроны всегда движутся только по фиксированным орбиталям, а не везде в атоме. Бор также объяснил, что каждая орбита представляет собой фиксированный уровень энергии. Орбиту также называют оболочкой. Резерфорд объяснил только ядро атома. Бор внес изменения в эту модель и добавил электроны и энергетические уровни.
Модель Бора представляет собой маленькое положительно заряженное ядро, окруженное отрицательными электронами, которые движутся по орбитам. Бор обнаружил, что чем больше расстояние электрона от ядра, тем больше его энергия.
Постулаты атомной теории БораОграничения атомной теории Бора
- Внутри атомов электроны находятся на дискретных орбитах, называемых «стационарными орбитами».
- Квантовые числа используются для представления энергетических уровней этих оболочек.
- Электроны могут переходить на более высокие уровни, поглощая энергию, и переходить на более низкие энергетические уровни, теряя или испуская часть энергии.
- Только когда электрон остается на своей орбите, не происходит ли поглощения или испускания энергии?
- Электроны вращаются только по этим стационарным орбитам.
- Энергия стационарных орбит квантуется.
- Работает только для одноэлектронных соединений, таких как H, He + , Li 2+ , Be 3+ , ….
- Когда для наблюдения за эмиссионным спектром водорода использовался более точный спектрометр, каждый линейчатый спектр представлял собой комбинацию нескольких более мелких дискретных линий.
- Теория Бора не могла объяснить эффекты Штарка и Зеемана.
Краткая информация об атомной структуре
- Атом – Определяющая структура и основные единицы вещества элемента называются атомами.
 Термин «атом» произошел от греческого слова, означающего неделимый, потому что раньше считалось, что атом — это мельчайшие вещи во Вселенной, которые нельзя разделить9.0014
Термин «атом» произошел от греческого слова, означающего неделимый, потому что раньше считалось, что атом — это мельчайшие вещи во Вселенной, которые нельзя разделить9.0014 - Атомная структура – Структура атома, состоящая из ядра, в котором присутствуют протоны и нейтроны. Отрицательно заряженные частицы, называемые электронами, вращаются вокруг центра ядра.
- Ядро — Совокупность частиц, называемых протонами и нейтронами, называется Ядром. Протоны заряжены положительно, а нейтроны электрически нейтральны. Протоны и нейтроны состоят из частиц, называемых кварками. Химический элемент атома определяется количеством протонов или атомным номером Z ядра.
- Протон . Положительно заряженные частицы внутри атомных ядер называются протонами. Резерфорд открыл протон в своем знаменитом эксперименте с катодными лучами, который проводился между 1911 и 1919 годами. Протоны примерно на 99,86% массивнее нейтронов. Количество протонов в атоме уникально для каждого элемента
- Электрон – Электроны очень малы по сравнению с протонами и нейтронами, примерно в 1800 раз меньше, чем протон или нейтрон.
 Электроны всего на 0,054% тяжелее нейтронов. Электроны были открыты в 189 г.7 Джозефом Джоном (Дж. Дж.) Томсоном, британским физиком. Электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам
Электроны всего на 0,054% тяжелее нейтронов. Электроны были открыты в 189 г.7 Джозефом Джоном (Дж. Дж.) Томсоном, британским физиком. Электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам - Нейтрон . Резерфорд предположил существование нейтрона в 1920 г. и позже открыл Чедвик в 1932 г. бериллий. Высвобождались субатомные частицы без заряда, которые были названы нейтронами. Нейтроны — это незаряженные частицы, присутствующие во всех атомных ядрах 9.0014
- Изотопы — Элементы одного семейства элементов, имеющие одинаковое количество протонов, но разное количество нейтронов, называются изотопами. Количество протонов в ядре определяет атомный номер элемента в периодической таблице. Все изотопы обладают уникальными свойствами, как и все члены семейства имеют свои качества.
Часто задаваемые вопросы на основе атомной структуры
Вопрос 1: Каковы преимущества периодической таблицы?
Ответ:
В периодической таблице элементы расположены в табличной форме.
Это позволяет легко запомнить свойства элементов, если известно положение элемента. Также соединения, образованные элементами, предсказуемы, если известно положение элемента. Периодическая таблица позволила легко и систематически изучать химию
Вопрос 2: Если число электронов и число протонов в атоме равны, то почему неправильно говорить, что атомный номер элемента равен количество электронов?
Ответ:
Неправильно говорить, что атомный номер элемента равен количеству электронов, потому что атом может терять или приобретать электроны, поэтому количество электронов постоянно меняется, и они никогда не исчезают. постоянный. В то время как количество протонов никогда не меняется для элемента. Вот почему атомный номер берется из числа протонов.
Вопрос 3. Электроны вносят отрицательный заряд, а протоны – положительный. У атома есть и то, и другое, но почему нет заряда?
Ответ:
Согласно модели атома Томсона количество электронов и количество протонов в атоме равны.
Электроны заряжены отрицательно, а протоны положительно заряжены, поэтому + и – заряды нейтрализуются друг другом, что делает атомы в целом нейтральными
Вопрос 4. Почему модель Резерфорда не могла объяснить стабильность атома?
Ответ:
Согласно электромагнитной теории Максвелла, при ускорении заряженных частиц они должны излучать электромагнитное излучение. Точно так же электрон на своей орбите движется с очень высокой скоростью и испускает излучение; тогда орбита будет продолжать сжиматься, и электрон в конечном итоге падает на ядро, чего не происходит в атоме.
Вопрос 5. Каковы ограничения атомной теории Дальтона?
Ответ:
В атомной теории Дальтона было обнаружено множество недостатков. Самый большой недостаток заключался в том, что атомы не являются элементарными частицами материи, а подразделяются на три основные категории, известные как электроны, протоны и нейтроны.




 В результате формула гидроксида выглядит как Cа (OH)2.
В результате формула гидроксида выглядит как Cа (OH)2. Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.
Конденсат из кальциевых паров аккумулируется на охлаждаемой поверхности.

 е. их валентность равна 1 или 2
е. их валентность равна 1 или 2

 Это означает, что большая часть пространства атома пуста.
Это означает, что большая часть пространства атома пуста.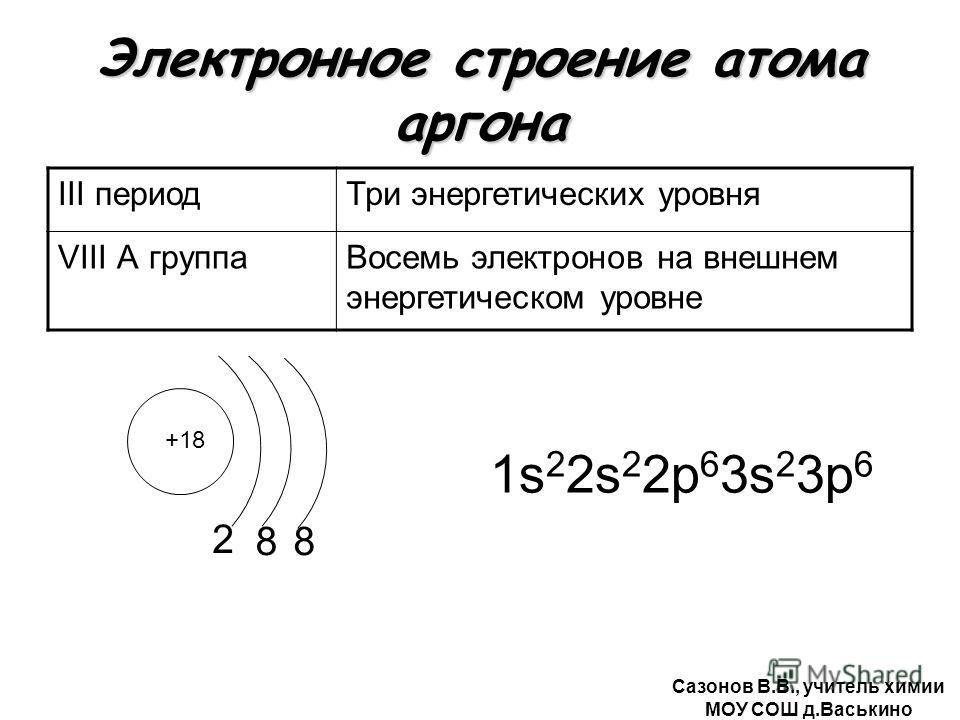



 Термин «атом» произошел от греческого слова, означающего неделимый, потому что раньше считалось, что атом — это мельчайшие вещи во Вселенной, которые нельзя разделить9.0014
Термин «атом» произошел от греческого слова, означающего неделимый, потому что раньше считалось, что атом — это мельчайшие вещи во Вселенной, которые нельзя разделить9.0014 Электроны всего на 0,054% тяжелее нейтронов. Электроны были открыты в 189 г.7 Джозефом Джоном (Дж. Дж.) Томсоном, британским физиком. Электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам
Электроны всего на 0,054% тяжелее нейтронов. Электроны были открыты в 189 г.7 Джозефом Джоном (Дж. Дж.) Томсоном, британским физиком. Электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам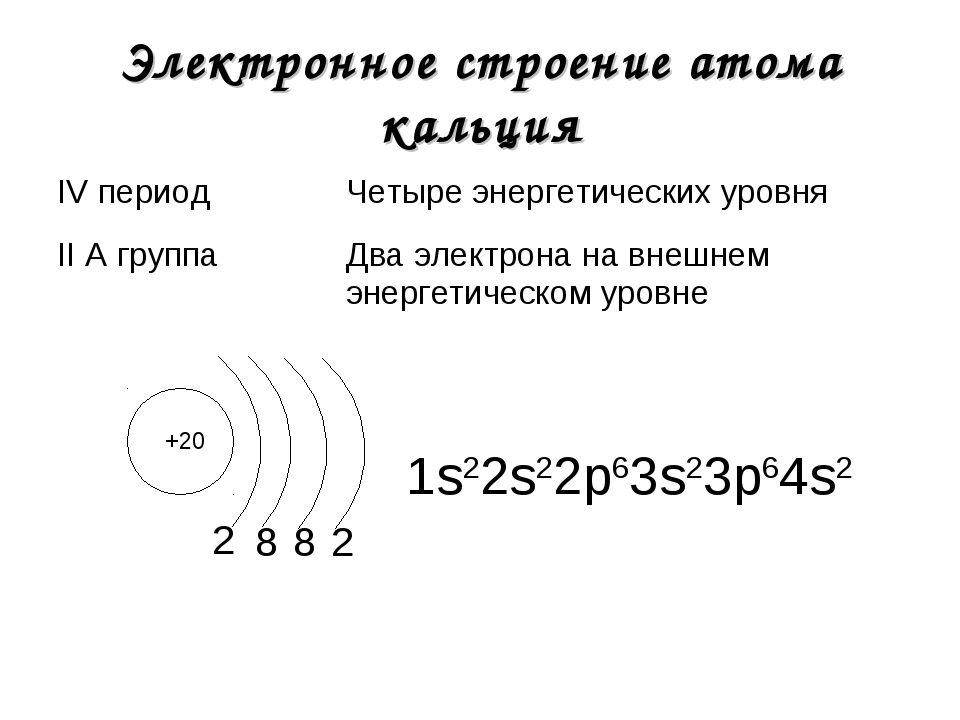 Это позволяет легко запомнить свойства элементов, если известно положение элемента. Также соединения, образованные элементами, предсказуемы, если известно положение элемента. Периодическая таблица позволила легко и систематически изучать химию
Это позволяет легко запомнить свойства элементов, если известно положение элемента. Также соединения, образованные элементами, предсказуемы, если известно положение элемента. Периодическая таблица позволила легко и систематически изучать химию Электроны заряжены отрицательно, а протоны положительно заряжены, поэтому + и – заряды нейтрализуются друг другом, что делает атомы в целом нейтральными
Электроны заряжены отрицательно, а протоны положительно заряжены, поэтому + и – заряды нейтрализуются друг другом, что делает атомы в целом нейтральными