Строение атома рубидия (Rb), схема и примеры
Общие сведения о строении атома рубидия
Относится к элементам s-семейства. Металл. Обозначение – Rb. Порядковый номер – 37. Относительная атомная масса – 85,468 а.е.м.
Электронное строение атома рубидия
Атом рубидия состоит из положительно заряженного ядра (+37), внутри которого есть 37 протонов и 48 нейтронов, а вокруг, по пяти орбитам движутся 37 электронов.
Рис.1. Схематическое строение атома рубидия.
Распределение электронов по орбиталям выглядит следующим образом:
+37Rb)2)8)18)8)1;
1s22s22p63s23p63d104s24p65s1.
Внешний энергетический уровень атома рубидия содержит 1 электрон, который является валентным.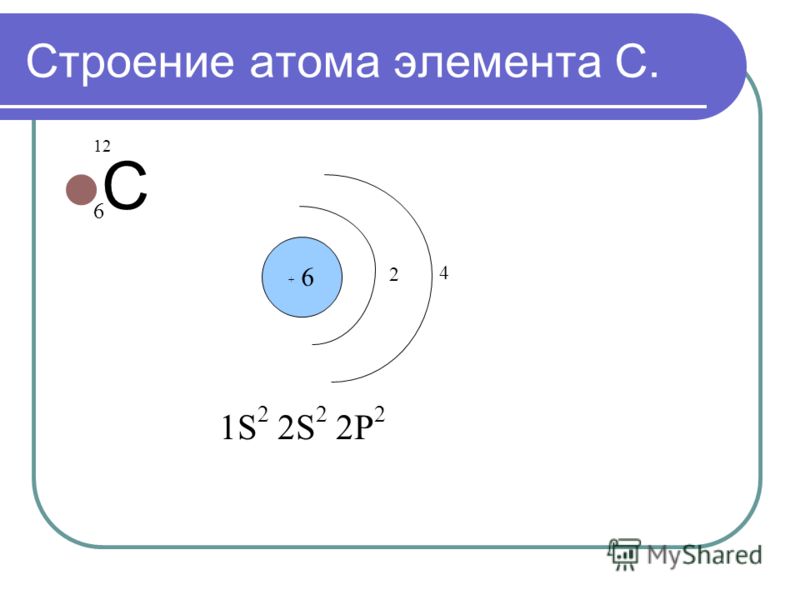 Энергетическая диаграмма основного состояния принимает следующий вид:
Энергетическая диаграмма основного состояния принимает следующий вид:
Валентный электрон атома рубидия можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
Наличие одного неспаренного электрона свидетельствует о том, что степень окисления рубидия равна +1.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Строение атома цезия (Cs), схема и примеры
Общие сведения о строении атома цезия
Электронное строение атома цезия
Атом цезия состоит из положительно заряженного ядра (+55), внутри которого есть 55 протонов и 78 нейтронов, а вокруг, по шести орбитам движутся 55 электронов.
Рис.1. Схематическое строение атома цезия.
Распределение электронов по орбиталям выглядит следующим образом:
+55Cs)2)8)18)18)
1s22s22p63s23p63d104s24p64d105s25p66s1.
Внешний энергетический уровень атома цезия содержит 1 электрон, который является валентным. Возбужденного состояния нет. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентный электрон атома цезия можно охарактеризовать набором из четырех квантовых чисел:
|
Подуровень |
n |
l |
ml |
s |
|
s |
6 |
0 |
0 |
|
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
начертите схему строения атома рубидия
между собой молекулы кислорода и водорода различаются а массой б температурой плавления в качественным составом к число атомов
Помогите пожалуйста 6.
Некоторый порошок массой 5 г полностью растворили в небольшом количестве кипящей воды. При охлаждении образовались кристаллы массой 3 г. Эти кристаллы … отфильтровали и растворили снова в таком же количестве кипящей воды; при охлаждении снова образовались кристаллы массой 2,9 г. Исходный порошок являлся чистым веществом или смесью веществ? Ответ поясните.
MA II. КИСЕНЬ 1. Контрольні запитання Опишіть фізичні властивості кисню. 2. Опишіть поширеність кисню й озону на Землі. 3. Чи є хімічною реакцією пере … творення рідкого кисню на газуватий? А на твердий? Відповідь поясніть. Яка поширеність Оксигену в різних оболонках Землі? 5. Які сполуки Оксигену є у складі земної кори? 6. Наведіть приклади найпоширеніших і найважливіших сполук Оксиге- ну, що трапляються в природі. 7. Які речовини називають оксидами? Завдання.7 класс
В четыре пробирки, наполненные газами ( азот, кислород, смесь водорода с воздухом, водород), внесли поочерёдно тлеющую лучинку. В первой пробирке прои
… зошёл глухой хлопок, во второй – хлопок со свистом, в третьей пробирке лучинка воспламенилась, а в четвёртой – погасла.
Ответьте на вопросы.
1) Какие газы находились в каждой из пробирок? Составьте соответствующие уравнения химических реакций.
2) Почему в пробирках, в которых был водород, горение происходило по – разному?
3) Что такое гремучий газ?
В первой пробирке прои
… зошёл глухой хлопок, во второй – хлопок со свистом, в третьей пробирке лучинка воспламенилась, а в четвёртой – погасла.
Ответьте на вопросы.
1) Какие газы находились в каждой из пробирок? Составьте соответствующие уравнения химических реакций.
2) Почему в пробирках, в которых был водород, горение происходило по – разному?
3) Что такое гремучий газ?
Визначте масу розчинів KOH з масовою часткою KOH 10% і 50%, необхідний для приготування 800г розчину з W(KOH)=25%
Чему равна Ar Бария
Яку кількість речовини ферум (ІІІ) оксиду можна добути в результаті термічного розкладу відповідної основи масою 4,28 г?
определите массу осадка который выделится при взаимодействии 200 г 18,8 раствора нитрата меди с избытком раствора сульфида натрия
Генетический ряд Fe+2 : оксид и гидроксид., соли. Их получение и химические свойства.Генетический ряд Fe+3 : оксид и гидроксид., соли. Их получение … и химические свойства
Рубидий, свойства атома, химические и физические свойства
Рубидий, свойства атома, химические и физические свойства.

Rb 37 Рубидий
85,4678(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1
Рубидий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 37. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), пятом периоде периодической системы.
Атом и молекула рубидия. Формула рубидия. Строение атома рубидия
Изотопы и модификации рубидия
Свойства рубидия (таблица): температура, плотность, давление и пр.
Физические свойства рубидия
Химические свойства рубидия. Взаимодействие рубидия. Химические реакции с рубидием
Получение рубидия
Применение рубидия
Таблица химических элементов Д.И. Менделеева
Атом и молекула рубидия. Формула рубидия. Строение атома рубидия:
Рубидий (лат. Rubidium, от лат. rubidus – «красный», «тёмно-красный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Rb и атомным номером 37. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), пятом периоде периодической системы.
rubidus – «красный», «тёмно-красный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Rb и атомным номером 37. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), пятом периоде периодической системы.
Рубидий – щелочной металл. Относится к группе легких металлов.
Как простое вещество рубидий при нормальных условиях представляет собой мягкий, легкоплавкий, щелочной металл серебристо-белого цвета.
Молекула рубидия одноатомна.
Химическая формула рубидия Rb.
Электронная конфигурация атома рубидия
 Потенциал ионизации (первый электрон) атома рубидия равен 403,03 кДж/моль (4,1771280(12) эВ).
Потенциал ионизации (первый электрон) атома рубидия равен 403,03 кДж/моль (4,1771280(12) эВ).Строение атома рубидия. Атом рубидия состоит из положительно заряженного ядра (+37), вокруг которого по пяти оболочкам движутся 37 электронов. При этом 36 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку рубидий расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома рубидия на 5s-орбитали находится один неспаренный электрон. В свою очередь ядро атома рубидия состоит из 37 протонов и 48 нейтронов. Рубидий относится к элементам s-семейства.
Радиус атома рубидия (вычисленный) составляет 265 пм.
Атомная масса атома рубидия составляет 85,4678(3) а. е. м.
е. м.
Рубидий является первым щелочным металлом в группе, плотность которого выше, чем у воды, поэтому он тонет, в отличие от металлов над ним в группе.
Изотопы и модификации рубидия:
Свойства рубидия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Рубидий |
| 102 | Прежнее название | |
| 103 | Латинское название | Rubidium |
| 104 | Английское название | Rubidium |
| 105 | Символ | Rb |
| 106 | Атомный номер (номер в таблице) | 37 |
| 107 | Тип | Металл |
| 108 | Группа | Лёгкий, щелочной металл |
| 109 | Открыт | Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф, Германия, 1861 г. |
| 110 | Год открытия | 1861 г. |
| 111 | Внешний вид и пр. | Мягкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 85Rb, 87Rb |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,006 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000012 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 3,0·10-6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00032 % |
| 124 | Содержание в организме человека (по массе) | 0,00046 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 85,4678(3) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N8 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 265 пм |
| 205 | Эмпирический радиус атома* | 235 пм |
| 206 | Ковалентный радиус* | 220 пм |
| 207 | Радиус иона (кристаллический) | Rb+ 166 (6) пм, 175 (8) пм, 180 (10) пм, 186 (12) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 303 пм |
| 209 | Электроны, Протоны, Нейтроны | 37 электронов, 37 протонов, 48 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, +1 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 0,82 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 403,03 кДж/моль (4,1771280(12) эВ) |
| 305 | Электродный потенциал | Rb+ + e– → Rb, Eo = -2,925 В |
| 306 | Энергия сродства атома к электрону | 46,9 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 1,532 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), 1,475 г/см3 (при 39 °C и иных стандартных условиях, состояние вещества – твердое тело), |
| 402 | Температура плавления* | 39,30 °C (312,45 K, 102,74 °F) |
| 403 | Температура кипения* | 688 °C (961 K, 1270 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,19 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 69 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,36 Дж/г·K (при 25 °C), 0,379 Дж/г·K (при 50 °C) |
| 410 | Молярная теплоёмкость* | 31,060 Дж/(K·моль) |
| 411 | Молярный объём | 55,9 см³/моль |
| 412 | Теплопроводность | 58,2 Вт/(м·К) (при стандартных условиях), 58,2 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 5,710 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 56 К |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-17-7 |
Примечание:
205* Эмпирический радиус атома рубидия согласно [1] и [3] составляет 248 пм.
206* Ковалентный радиус рубидия согласно [1] и [3] составляет 220±9 пм и 216 пм соответственно.
402* Температура плавления рубидия согласно [3] составляет 39,05 °С (312,2 K, 102,29 °F).
403* Температура кипения рубидия согласно [4] составляет 690 °С (963,15 K, 1274 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) рубидия согласно [3] и [4] составляет 2,20 кДж/моль и 2,18 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) рубидия согласно [3] и [4] составляет 75,8 кДж/моль и 75,77 кДж/моль соответственно.
410* Молярная теплоёмкость рубидия согласно [3] составляет 31,1 Дж/(K·моль).
Физические свойства рубидия:
Химические свойства рубидия. Взаимодействие рубидия. Химические реакции с рубидием:
Получение рубидия:
Применение рубидия:
Таблица химических элементов Д.И. Менделеева
- 1.
 Водород
Водород - 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35.
 Бром
Бром - 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68.
 Эрбий
Эрбий - 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101.
 Менделеевий
Менделеевий - 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Rubidium
- https://de.wikipedia.org/wiki/Rubidium
- https://ru.wikipedia.org/wiki/Рубидий
- http://chemister.ru/Database/properties.php?dbid=1&id=247
- https://chemicalstudy.ru/rubidiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www. pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
карта сайта
рубидий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле рубидия
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 021
Рубидий электронные оболочки – Справочник химика 21
Рассмотрим возможные причины сходства элементов. Сходство элемента с его соседями сверху и снизу есть внутригрупповое сходство элементов-аналогов оно обусловлено прежде всего близким строением самых внешних электронных оболочек. Наибольшее сходство и изоморфизм проявляют тяжелые аналоги с близким строением внешних электронных оболочек, например калий и рубидий, серебро и золото, кальций и стронций, цинк и кадмий, скандий и иттрий, иттрий и гадолиний-лютеций, цирконий и гафний, ниобий и тантал, железо и никель, кобальт и никель и т. д. Значительные же различия свойств элементов-аналогов в высших валентных состояниях, когда все электроны уходят с внешней оболочки, большей частью обусловлено несходством строения внешних оболочек ионов (литий и натрий, бериллий и магний, бор и алюминий, углерод и кремний и т. д.). [c.158]
Сходство элемента с его соседями сверху и снизу есть внутригрупповое сходство элементов-аналогов оно обусловлено прежде всего близким строением самых внешних электронных оболочек. Наибольшее сходство и изоморфизм проявляют тяжелые аналоги с близким строением внешних электронных оболочек, например калий и рубидий, серебро и золото, кальций и стронций, цинк и кадмий, скандий и иттрий, иттрий и гадолиний-лютеций, цирконий и гафний, ниобий и тантал, железо и никель, кобальт и никель и т. д. Значительные же различия свойств элементов-аналогов в высших валентных состояниях, когда все электроны уходят с внешней оболочки, большей частью обусловлено несходством строения внешних оболочек ионов (литий и натрий, бериллий и магний, бор и алюминий, углерод и кремний и т. д.). [c.158]
Д. И. Менделеев, открывший объективный закон природы, не имел возможности вскрыть причины периодического изменения свойств элементов. Причины периодичности в изменении свойств элементов были раскрыты только с помощью теории строения атома.
 Эта теория показала, что в ходе развития электронных оболочек атомов (стр. 45) периодически повторяются одинаковые конфигурации внешних электронов, от которых более всего зависят химические свойства. Таким образом, периодическое изменение свойств элементов является следствием периодического возвращения электронных оболочек атомов к одним и тем же конфигурациям электронов внешнего слоя. Например, свойства самых активных щелочных металлов периодически повторяются у лития, натрия, калия, рубидия, цезия и франция потому именно, что в наружном слое их атомов периодически повторяется одноэлектронная конфигурация. Подобно этому свойства наиболее активных неметаллов — галогенов — периодически повторяются у фтора, хлора, брома, йода и астата, так как атомы их имеют по семь электронов во внешнем слое. [c.79]
Эта теория показала, что в ходе развития электронных оболочек атомов (стр. 45) периодически повторяются одинаковые конфигурации внешних электронов, от которых более всего зависят химические свойства. Таким образом, периодическое изменение свойств элементов является следствием периодического возвращения электронных оболочек атомов к одним и тем же конфигурациям электронов внешнего слоя. Например, свойства самых активных щелочных металлов периодически повторяются у лития, натрия, калия, рубидия, цезия и франция потому именно, что в наружном слое их атомов периодически повторяется одноэлектронная конфигурация. Подобно этому свойства наиболее активных неметаллов — галогенов — периодически повторяются у фтора, хлора, брома, йода и астата, так как атомы их имеют по семь электронов во внешнем слое. [c.79] Учитывая, что первые электроны после образования замкнутой оболочки благородного газа криптона. Кг, поступают в рубидии, КЬ, и стронции, 8г, на 5х-орбиталь, объясните, почему 2п” имеет валентную электронную конфигурацию 4 “, а не 5 “, как 8г [c. 458]
458]
Однако положительные однозарядные ионы этих элементов, в виде которых все они (кроме водорода) большей частью содержатся в соединениях, различаются по числу электронов на внешнем уровне. Ион водорода Н представляет собой ядро атома, полностью лишенное электронной оболочки ион лития имеет два электрона, ионы натрия, калия, рубидия, цезия и франция содержат на внешнем уровне по 8 электронов, а однозарядные ионы меди, серебра и золота — по 18 электронов. Различия в строении электронной оболочки ионов являются одной из причин значительного отличия свойств меди, серебра и золота (и их соединений) от свойств остальных элементов первой группы (и их соединений). [c.48]
У рубидия НЬ (№ 37) — первого элемента пятого периода — последний электрон занимает энергетический -подуровень пятого уровня, который расположен ниже -подуровня четвертого уровня (см. рис. 9). Затем -подуровень насыщается у атомов стронция 8г (№ 38) (Кг)5 , после чего образуются электронные оболочки последующих десяти -элементов с иттрия V (№ 39) по кадмий С(1 (№ 48) — (Kr )5 Ч . Начиная с индия 1п (№ 49), электроны занимают три р-орбитали пятого уровня. Пятый период завершается шестым после индия р-элементом — благородным газом ксеноном Хе (№ 54) — (Kг )5 Ч °5p — и включает, та1 им образом, 18 элементов. [c.44]
Начиная с индия 1п (№ 49), электроны занимают три р-орбитали пятого уровня. Пятый период завершается шестым после индия р-элементом — благородным газом ксеноном Хе (№ 54) — (Kг )5 Ч °5p — и включает, та1 им образом, 18 элементов. [c.44]
Исследования элементов при высоких давлениях, кардинальным образом изменяющих строение и степень перекрытия внешних электронных оболочек, привели к обнаружению неизвестных ранее модификаций рубидия, цезия, бария, галлия, индия, таллия, кремния, германия, олова, свинца, сурьмы, висмута, титана, циркония и других элементов. Круг полиморфных металлов расширился настолько, что можно полагать, что в природе вообще не существует элементов, сохраняющих одну и ту же структуру в достаточно широком диапазоне давлений и температур. [c.196]
Начало построения новых оболочек происходит в атомах элементов основной подгруппы первой группы периодической системы (водород, литий, натрий, калий, рубидий, цезий и франций). Единственный электрон, находящийся в наружной оболочке этих атомов, всегда сравнительно слабо удерживается атомом. При переходе к следующим за ними элементам (основным элементам второй группы — бериллию, магнию, кальцию, стронцию, барию и радию) появляющийся на наружной оболочке второй электрон значительно стабилизирует ее, и прочность связи этих электронов с атомом возрастает. Дальнейшая достройка наружной оболочки [c.35]
Единственный электрон, находящийся в наружной оболочке этих атомов, всегда сравнительно слабо удерживается атомом. При переходе к следующим за ними элементам (основным элементам второй группы — бериллию, магнию, кальцию, стронцию, барию и радию) появляющийся на наружной оболочке второй электрон значительно стабилизирует ее, и прочность связи этих электронов с атомом возрастает. Дальнейшая достройка наружной оболочки [c.35]
Строение электронных оболочек лития, рубидия и цезия следующее литий — 2, 1 рубидий — 2, 8, 18, 8, 1 цезий — 2, 8, 18, 18, 8, 1. В связи с таким строением электронных оболочек все три элемента обладают только одной валентностью — они всегда одновалентны. [c.458]
Хорошо известно, что водород занимает исключительное положение в периодической таблице. Он является первым членом первой группы, в которую входят также литий, натрий, калий, рубидий и цезий, ils различных свойств химических элементов, которым посвящена гл. V, здесь рассматривается только способность атомов терять электрон и превращаться в положительные ионы Н, ЬГ, Na, К, Rb и s. Катноны элементов первой группы являются достаточно стабильными в растворителях, препятствующих соединению их с такими анионами, как F, СГ, Вг и J. Атомы всех элементов первой группы содержат один электрон, свойства которого резко отличаются от остальных этот электрон обусловливает химическое поведение и оптические свойства элемента. Остальная часть атома щелочного металла состоит из ядра с зарядом -fZe, где Z — целое число, и Z — 1 электронов, суммарный магнитный момент которых равен нулю. Можно считать, что они занимают замкнутые электронные оболочки. Таким образом, нет ничего необычного в том факте, что спектры щелочных металлов напоминают спектр атома водорода, хотя эти спектры и обладают рядом существенных отличий. [c.123]
V, здесь рассматривается только способность атомов терять электрон и превращаться в положительные ионы Н, ЬГ, Na, К, Rb и s. Катноны элементов первой группы являются достаточно стабильными в растворителях, препятствующих соединению их с такими анионами, как F, СГ, Вг и J. Атомы всех элементов первой группы содержат один электрон, свойства которого резко отличаются от остальных этот электрон обусловливает химическое поведение и оптические свойства элемента. Остальная часть атома щелочного металла состоит из ядра с зарядом -fZe, где Z — целое число, и Z — 1 электронов, суммарный магнитный момент которых равен нулю. Можно считать, что они занимают замкнутые электронные оболочки. Таким образом, нет ничего необычного в том факте, что спектры щелочных металлов напоминают спектр атома водорода, хотя эти спектры и обладают рядом существенных отличий. [c.123]
Электронный захват представляет собой захват ядром электрона из электронной оболочки, окружающей ядро. Распад подобного типа испытывает рубидий-81 [c. 247]
247]
Пятый период содержит элементы от рубидия (2 = 37) до ксенона (2 = 54). Заполнение электронами оболочек атомов этих элементов аналогично заполнению оболочек элементов четвертого периода после НЬ и 5г у 10 элементов — с иттрия (2 = 39) по кадмий (2 = = 48) — заполняются 4й-орбитали, после чего электроны занимают 5р-орбитали. [c.47]
А-группу периодической системы элементов Менделеева составляют литий, натрий, калий, рубидий, цезий и франций. У атомов этих элементов на наружном уровне электронной оболочки находится по одному з-электрону. Ими начинаются 2—7-й периоды системы Менделеева. Бериллий, магний, кальций, стронций, барий и радий образуют ИА-группу. У атомов этих элементов на наружном уровне электронной оболочки содержится по два з-электрона. Таким образом, в атомах элементов этих групп валентными являются только 5-элек-троны. [c.33]
Эти элементы дают ярко окрашенные соединения, являются энергичными окислителями и восстановителями. Возможно, что с особенностями строения электронных оболочек связана и каталитическая активность соединений этих металлов. Наоборот, элементы с постоянной валентностью отличаются меньшихм разнообразием химических соединений и редко образуют окрашенные соединения. Из редких металлов лишь немногие относятся к этому типу—литий, рубидий, бериллий, отчасти галлий, индий и таллий. [c.16]
Возможно, что с особенностями строения электронных оболочек связана и каталитическая активность соединений этих металлов. Наоборот, элементы с постоянной валентностью отличаются меньшихм разнообразием химических соединений и редко образуют окрашенные соединения. Из редких металлов лишь немногие относятся к этому типу—литий, рубидий, бериллий, отчасти галлий, индий и таллий. [c.16]
Многие физико-химические свойства рубидия и цезия тесно связаны со структурой их электронных оболочек, конфигурацию которых можно представить в виде 55 (Кг) и 65 (Хе). Вследствие небольшой разницы в энергиях атомных орбиталей Ы и 5з Ъй и б5 атомы рубидия и цезия легко возбуждаются. Это непосредственно выражается в хорошей электропроводности, фотоэффекте, в низких значениях ионизационных потенциалов (см. табл. 3). [c.78]
Рубидий и цезий в связи со стабильностью своих электронных оболочек и небольшой величиной напряженности ионного поля обладают минимальной способностью к комплексообразованию. Во всех своих комплексных соединениях они выполняют функции [c.145]
Во всех своих комплексных соединениях они выполняют функции [c.145]
В данном случае литий при ионизации отдает внешний электрон. Тогда электронная оболочка лития будет содержать два электрона и по своему характеру имитировать инертный газ гелий, а фтор, восприняв электрон, будет иметь на внешней оболочке восемь электронов и поэтому соответствовать инертному газу неону. То же самое можно сказать о натрии, калии, рубидии при их реагировании с любым галоидом, только в отличие от лития при отдаче электрона они будут иметь, как и галоиды, на внешней оболочке по восьми электронов. Атом магния, стоящий во второй группе таблицы Менделеева, имеет на внешней оболочке два электрона, которые он может отдать, атом алюминия, относящийся к третьей группе, имеет три электрона. [c.67]
Так иногда называют натрий. Это не совсем справедливо в менделеевско таблице нарастание металлических свойств происходит по мере продвижения справа налево и сверху вниз. Так что у аналогов натрия по группе — франция, рубидия, цезия, калия — металлические свойства выражены сильнее, чем у натрия. (Конечно, имеются в виду только химические свойства.) Но и у натрия есть полный комплекс металлических химических свойств. Он легко отдает свои валентные электроны (по одному на ато.м), всегда проявляет валситность 1-Ь, обладает ярко выраженными восстановптелъными свойствами. Гидроокиси типичных металлов должны быть основаниями. Гвдроокись натрия NaOH — сильная щелочь. Все это объясняется строением атома натрия, на внешней оболочке которого только один электрон, и с ним атом легко расстается. [c.182]
Так что у аналогов натрия по группе — франция, рубидия, цезия, калия — металлические свойства выражены сильнее, чем у натрия. (Конечно, имеются в виду только химические свойства.) Но и у натрия есть полный комплекс металлических химических свойств. Он легко отдает свои валентные электроны (по одному на ато.м), всегда проявляет валситность 1-Ь, обладает ярко выраженными восстановптелъными свойствами. Гидроокиси типичных металлов должны быть основаниями. Гвдроокись натрия NaOH — сильная щелочь. Все это объясняется строением атома натрия, на внешней оболочке которого только один электрон, и с ним атом легко расстается. [c.182]
Начало построения новых оболочек происходит в атомах элементов основной подгруппы первой группы периодической системы (водород, литий, натрий, калий, рубидий, цезий и франций). Единственный электрон, находящийся в наружной оболочке этих [c.35]
Пятый период системы элементов начинается с рубидия. При этом снова при незаполненных 4й- и 4/-обо-лочках начинает заполняться 5з-уровень, Оболочка Ай начинает заполняться после стронция в атоме иттрия, подобно тому как З -оболочка начинала заполняться в скандии.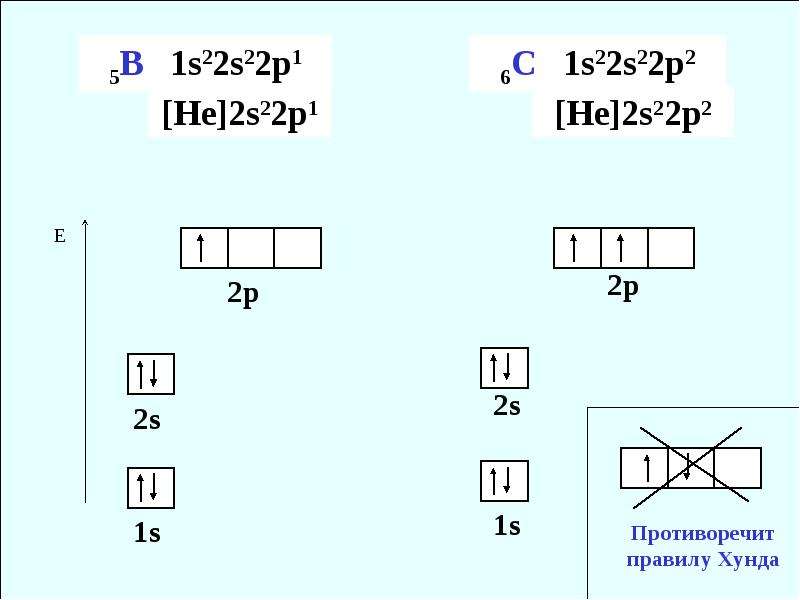 Завершается заполнение 4й-состояний в палладии Рс1 (1) (2) (3) (45)2(4р) (4й) , и пятый период заканчивается ксеноном Хе (1) (2) (3) (45)2(4р) (4й ) ° 55)2 (5р) . Валентный электрон цезия, оставляя пустыми оболочки 41 и 5 , занимает состояние 6з и, таким образом, начинает шестой период. После бария Ва(1)(2)(3) (48)2(4р) (4й ) °(55)2(5р) (2 )2 начинает заполняться оболочка М в атоме следующего элемента лантана Ьа(1)(2)(3)(45)2(4р)б(4 ) (58)2(5р)б(5 )Мб5)2. Таким образом, лантан трехвалентен. В следующих за ним не продолжается заполнение 5с/-оболочки, а начинает заполняться забытая оболочка 4/. На этой оболочке всего может разместиться 14 электронов [2 (2-3-1-1)]. В результате ее заполнение завершается на лютеции Ьи(1)(2)(3)(4)(58)2(5р)б(5 ) (б5)2. Эти 14 элементов весьма близки по своим свойствам к лантану. Их называют лантанидами, или редкоземельными. [c.318]
Завершается заполнение 4й-состояний в палладии Рс1 (1) (2) (3) (45)2(4р) (4й) , и пятый период заканчивается ксеноном Хе (1) (2) (3) (45)2(4р) (4й ) ° 55)2 (5р) . Валентный электрон цезия, оставляя пустыми оболочки 41 и 5 , занимает состояние 6з и, таким образом, начинает шестой период. После бария Ва(1)(2)(3) (48)2(4р) (4й ) °(55)2(5р) (2 )2 начинает заполняться оболочка М в атоме следующего элемента лантана Ьа(1)(2)(3)(45)2(4р)б(4 ) (58)2(5р)б(5 )Мб5)2. Таким образом, лантан трехвалентен. В следующих за ним не продолжается заполнение 5с/-оболочки, а начинает заполняться забытая оболочка 4/. На этой оболочке всего может разместиться 14 электронов [2 (2-3-1-1)]. В результате ее заполнение завершается на лютеции Ьи(1)(2)(3)(4)(58)2(5р)б(5 ) (б5)2. Эти 14 элементов весьма близки по своим свойствам к лантану. Их называют лантанидами, или редкоземельными. [c.318]
Указать сходство и различие в свойствах натрия и рубидия, исходя из их электронных формул и из структур электронных оболочек. [c.73]
[c.73]
Система атомных радиусов элементов дана на рис. 45 (см. стр. 125). Можно видеть, что в общих чертах изменение атомных (металлических и ковалентных) радиусов подобно сдвигам в табл. 10 и 11, выполненным нэ основе анализа строения трех внешних электронных оболочек. Так, взаимное расположение подгрупп и специфические изломы кривых атомных радиусов элементов первых трех групп в точности отвечают их взаимному расположению в табл. 10 и 11, Такое же соответствие имеет место для элементов IV—Vni групп. Однако металлические радиусы обнаруживают и дополнительные тонкие отклонения, обусловленные особенностями строения более глубоких оболочек, чем учитываемые в табл. 10 и И. Так, лантаноидное сжатие проявляется в небольшом уменьшении атомных радиусов последующих элементов, что приводит к некоторому дополнительному смещению вправо франция, радия, актиния и всех актиноидов. Обнаруживается небольшой перелом на рубидии. [c.159]
Химические связи рубидия с калием определяются тем, что оба эти элемента относятся к группе щелочных металлов, характеризуются аналогичным строением электронных оболочек и близостью всех основных химических свойств.
 Их кристаллохимическая близость определяется тем, что имея одинаковую валентность и явно выраженный ионный характер связи с кислородом, опи имеют близкие ионные радиусы (К+ — [c.151]
Их кристаллохимическая близость определяется тем, что имея одинаковую валентность и явно выраженный ионный характер связи с кислородом, опи имеют близкие ионные радиусы (К+ — [c.151]В рассмотренных примерах структура линии церия чисто изотопическая, обусловленная изотопическим смещением линий, в то время как на линиях рубидия проявляется помимо изотопического смещения так называемая сверхтонкая структура, которая обусловлена расщеплением линий одного и того же изотопа на несколько компонент. Из этих примеров видно, что в образовании сложной структуры линий играют роль два эффекта изотопическое смещение и сверхтонкое расщепление линий. Эти оба эффекта являются результатом взаимодействия электронной оболочки атома с ядром, и обычно в структуре линий они 206 проявляются вместе. Поэтому [c.118]
При п + / = 5 заполняются уровни л = 3, 1 = 2 (М), л = 4, / = 1 (4р) и, наконец, л = 5, / = О (55). Если до кальция заполнение электронных уровней шло в порядке возрастания номеров электронных оболочек (15, 25, 2р, Зз, Зр, 45), то после заполнения 5-мест четвёртой электронной оболочки вместо продолжения заполнения этой оболочки /7-электронами начинается заполнение предыдущей, третьей, оболочки -электронами. Всего в каждой оболочке может быть, как ясно из сказанного выше, 10 -электронов. Соответственно этому за кальцием в периодической системе следуют 10 элементов от скандия (3 452) до цинка (3 452), в атомах которых заполняется -слой третьей оболочки, и лишь затем заполняется р-слой четвёртой оболочки—от галлия (3( Щз р) до криптона ЗйЩз р ). В рубидии и стронции, начинающих пятый период, появляются 55- и 552-электроны. [c.19]
Всего в каждой оболочке может быть, как ясно из сказанного выше, 10 -электронов. Соответственно этому за кальцием в периодической системе следуют 10 элементов от скандия (3 452) до цинка (3 452), в атомах которых заполняется -слой третьей оболочки, и лишь затем заполняется р-слой четвёртой оболочки—от галлия (3( Щз р) до криптона ЗйЩз р ). В рубидии и стронции, начинающих пятый период, появляются 55- и 552-электроны. [c.19]
По той же причине, что и у калия, у рубидия (№ 37) — первого элемента 5-го периода — последний электрон располагается в -орбитали 5-го слоя. Затем следует ее насыщение у атомов стронция (№ 38) (Кг)5 , после чего образуются электронные оболочки последующих десяти -элементов с иттрия по кадмий — (Kг)5s 4 . Начиная с индия (№ 49), электроны занимают три р-орбитали 5-го слоя. 5-й период завершается шестым после индия р-элеМентом — [c.47]
Пятый период. Переходим к построению электронной оболочки атома, у которого 1 = 37. Это — атом рубидия. Очевидно, 3-й электрон должен поместиться в х-подуровне 5-го квантового слоя. Вторым электроном этот слой пополняется у 38 элемента — стронция. Конфигурация 15 25 р 35 р с11 452р 55 . Далее процесс формирования оболочки протекает так же, как и в четвертом периоде, т. е., начиная с атома иттрия (2 = 39) и кончая атомом кадмия (2 = 48), идет пополнение -подуровня незавершенного 4-го квантового уровня затем, начиная с атома индия (2 = 49) и кончая атомом ксенона (2 = 54), пополняется р-подуровень [c.27]
Это — атом рубидия. Очевидно, 3-й электрон должен поместиться в х-подуровне 5-го квантового слоя. Вторым электроном этот слой пополняется у 38 элемента — стронция. Конфигурация 15 25 р 35 р с11 452р 55 . Далее процесс формирования оболочки протекает так же, как и в четвертом периоде, т. е., начиная с атома иттрия (2 = 39) и кончая атомом кадмия (2 = 48), идет пополнение -подуровня незавершенного 4-го квантового уровня затем, начиная с атома индия (2 = 49) и кончая атомом ксенона (2 = 54), пополняется р-подуровень [c.27]
В эту подгруппу входят щелочные металлы литий, натрий, калий, рубидий, цезий и франций. Для электронных конфигураций их атомов характерно наличие оболочки благородного газа и одного электрона [c.150]
У элементов с 2 = 39, 40, 43 на внешнем уровне по 2 электрона. В атоме палладия происходит двойной провал , т. е. у него на внешнем уровне число электронов равно 0. Это единственное исключение подобного провала во всей системе.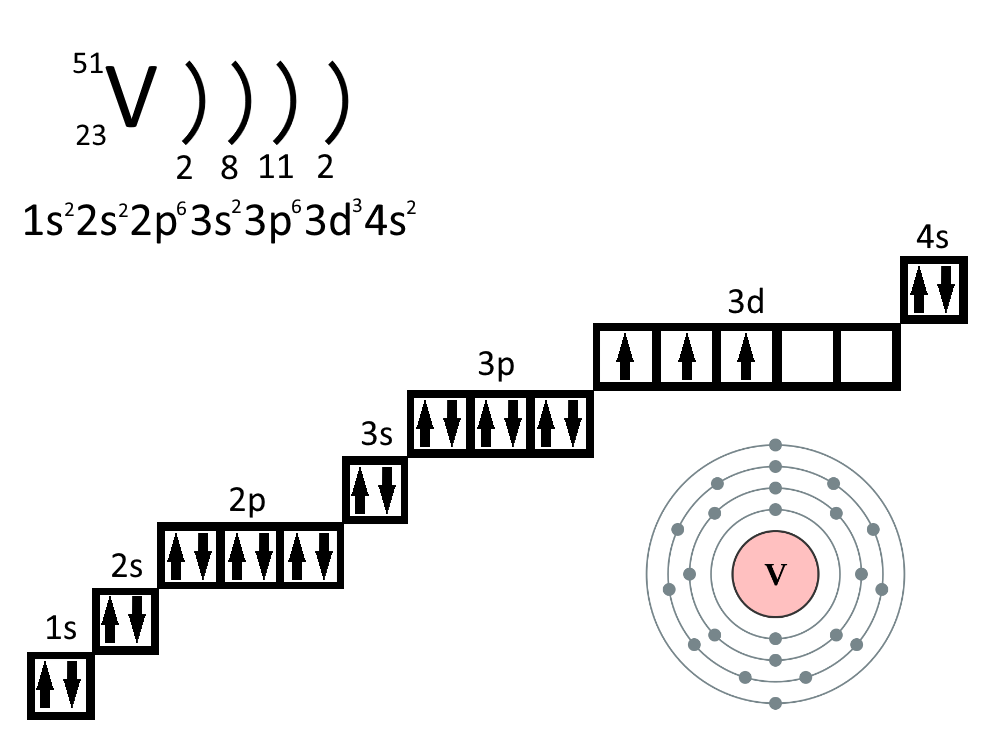 Итак, в периоде после рубидия и стронция (5х и 55 ) далее следует десять элементов (от иттрия до кадмия), у которых заполняются -подуровни четвертого уровня. После кадмия следует шесть элементов (индий, олово, сурьма, теллур, иод, ксенон), у которых происходит достраивание р-подуровней внешнего уровня (от 5р до 5р ) и период заканчивается благородным газом — ксеноном (55 5р ). У этих элементов на предвнешнем уровне по 18 электронов (4s 4p 4 ). Снова период завершен, но недостроенными остаются не только пятая, но и четвертая электронные оболочки. В шестом периоде после цезия и бария (б5 и б5 ) следует только один элемент — лантан, у которого заполняется 5 -пoдypoвeнь. После лантана у элементов с 2 = 58 71 (лантаноиды) идет заполнение /-подуровня четвертого уровня от 4/ у церия до 4/ у лютеция. После лютеция завершается заполнение 5 -пoдypoвня от гафния до ртути. От таллия к радону происходит заполнение бр-подуровня. Период вновь заканчивается благородным газом (бх бр ). [c.46]
Итак, в периоде после рубидия и стронция (5х и 55 ) далее следует десять элементов (от иттрия до кадмия), у которых заполняются -подуровни четвертого уровня. После кадмия следует шесть элементов (индий, олово, сурьма, теллур, иод, ксенон), у которых происходит достраивание р-подуровней внешнего уровня (от 5р до 5р ) и период заканчивается благородным газом — ксеноном (55 5р ). У этих элементов на предвнешнем уровне по 18 электронов (4s 4p 4 ). Снова период завершен, но недостроенными остаются не только пятая, но и четвертая электронные оболочки. В шестом периоде после цезия и бария (б5 и б5 ) следует только один элемент — лантан, у которого заполняется 5 -пoдypoвeнь. После лантана у элементов с 2 = 58 71 (лантаноиды) идет заполнение /-подуровня четвертого уровня от 4/ у церия до 4/ у лютеция. После лютеция завершается заполнение 5 -пoдypoвня от гафния до ртути. От таллия к радону происходит заполнение бр-подуровня. Период вновь заканчивается благородным газом (бх бр ). [c.46]
Напомним, что у атомов калия и кальция еще до заполнения третьей электронной оболочки началось заселение 4 5-орбиталей. Подобно этому у сходных с ними, но более тяжелых рубидия и стронция до заполнения 4 -орбиталей начинается заселение 5 -орбиталей. После стронция вновь замедляется развитие свойств атомов и происходит заполнение более глубоких 4 -орбиталей, завершающиеся у палладия (2=46). В результате возникает второй ряд из десяти переходных элементов. Следующий сорок седьмой электрон в атоме серебра занимает не свободную 4/-орбиталь, а 5 -орбиталь. 4/-орбитали оказываются настолько энергетически невыгодными для заселения , что даже после заполнения 5 -орбиталей они остаются пустыми. В результате после индия (2=49) начинается заполнение 5р-орбиталей, которое завершается у атома инертного газа — ксенона (2=54). Затем у атома цезия электрон занимает 6 -орбиталь, а у бария заполнение это1 орбитали завершается вторым электроном. В следующем после бария атоме лантана пятьдесят седьмой электрон вместо заполнения 6 р-орби-талей заселяет ранее пустовавшую 5 -орбиталь, [c.261]
Подобно этому у сходных с ними, но более тяжелых рубидия и стронция до заполнения 4 -орбиталей начинается заселение 5 -орбиталей. После стронция вновь замедляется развитие свойств атомов и происходит заполнение более глубоких 4 -орбиталей, завершающиеся у палладия (2=46). В результате возникает второй ряд из десяти переходных элементов. Следующий сорок седьмой электрон в атоме серебра занимает не свободную 4/-орбиталь, а 5 -орбиталь. 4/-орбитали оказываются настолько энергетически невыгодными для заселения , что даже после заполнения 5 -орбиталей они остаются пустыми. В результате после индия (2=49) начинается заполнение 5р-орбиталей, которое завершается у атома инертного газа — ксенона (2=54). Затем у атома цезия электрон занимает 6 -орбиталь, а у бария заполнение это1 орбитали завершается вторым электроном. В следующем после бария атоме лантана пятьдесят седьмой электрон вместо заполнения 6 р-орби-талей заселяет ранее пустовавшую 5 -орбиталь, [c.261]
Ионная поляризация является причиной роста энергии кристаллической структуры.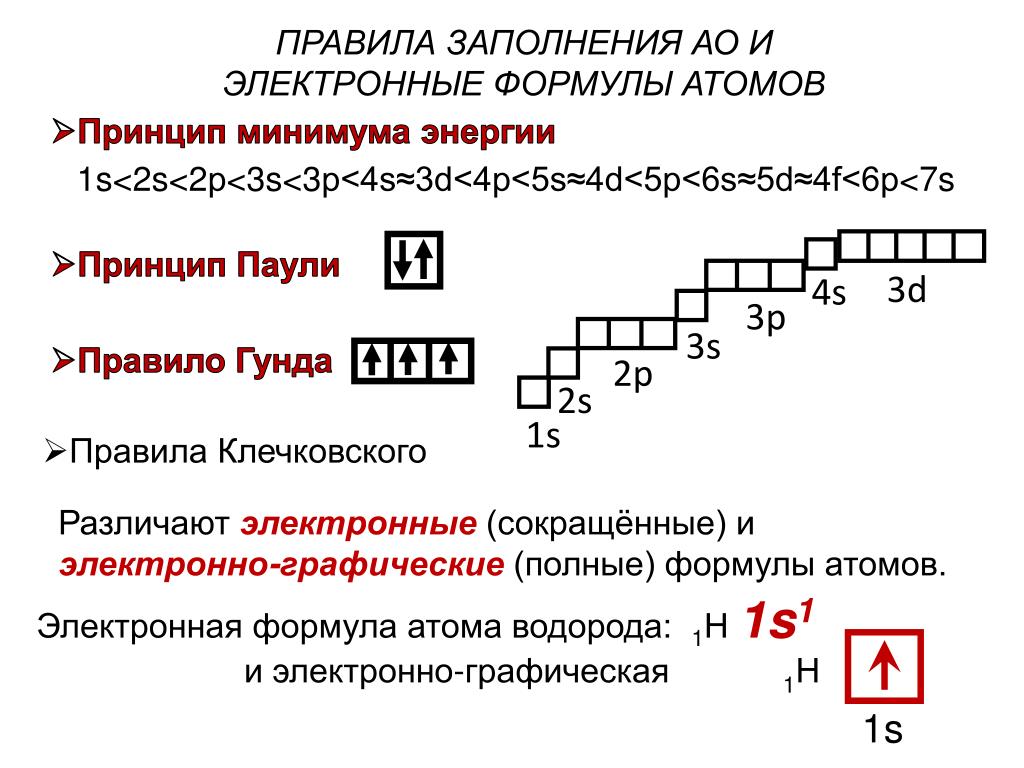 Так, несмотря на одинаковый размер катионов (Т1+—1,49 А Rb+—1,49 А), энергия кристаллических структур солей таллия больше (табл. 5.49), чем солей рубидия, так как таллий обладает более сильным поляризующим действием (на последней оболочке 18 электронов). [c.205]
Так, несмотря на одинаковый размер катионов (Т1+—1,49 А Rb+—1,49 А), энергия кристаллических структур солей таллия больше (табл. 5.49), чем солей рубидия, так как таллий обладает более сильным поляризующим действием (на последней оболочке 18 электронов). [c.205]
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — хпмпч. элементы литий Ь1, натрий Ка, калий К, рубидий НЬ, цезий Сз и франций Гг (радиоактивный элемент), составляющие главную подгруппу I гр. нериодич. системы Менделеева. Названы щелочными потому, что их гидроокиси — самые сильные основания (щелочи). Внешняя электронная оболочка атомов 1Ц. м. содержит 1 -электрон, ей предшествует законченная оболочка из 8 р-электронов. Щ. м. обладают большими атомными радиусами, низкими потенциалами ионизации и вследствие этого крайне электроположительны (легко отдают валентный электрон) и химически активны их активность возрастает от к Сз (и Рг). [c.455]
Из таблицы видно, что ПП кристаллов растут вместе с увеличением ковалентности связи в рядах МРА 1 = пс8Т—/гш>г. [c.267]
[c.267]
Во всех трех больших периодах при переходе от металла I группы (калия, рубидия и цезия) к металлам VI группы (хрому, молибдену и вольфраму) наблюдается сильное уменьшение межатомных расстояний и диаметров атомов, соответствующее предлагаемой гипотезе о полном отделении всех валентных электронов и обнажении р -оболочек ионов. Чем больше избыточный заряд таких ионов с одинаковыми электронными конфигурациями, тем, естественно, сильнее притяжение р-электронов к ядру и тем меньше диаметр этих ионов и короче расстояния между ними. Этому сокращению расстояний способствует и повышение электронной концентрации. Атомные диаметрых-мар-ганца (плотная кубическая модификация) и б-марганца (объемноцентрированная кубическая модификация) резко увеличены по сравнению с соответствующим диаметром атомов хрома и железа, что вновь указывает на пониженную степень ионизации атомов марганца (1- -). Железо, кобальт и никель имеют меньшие атомные диаметры вследствие того, что они двухкратно ионизированы. От железа к никелю межатомные расстояния уменьшаются в связи с сокращением размеров внешней электронной оболочки. Уменьшение межатомного расстояния продолжается в VII и VIII группах в связи с переходом от объемноцентрированной к плотнейшим упаковкам и достигает минимума у рутения и осмия. Межатомные расстояния от рутения к палладию и от осмия к платине слегка увеличиваются вследствие уменьшения электронной концентрации от 4 до 2 элЫтом и соответствующего понижения энергии межатомной связи. Далее к побочным металлам второй группы (цинку, кадмию и ртути) межатомные расстояния и атомные диаметры продолжают возрастать в связи с уменьшением концентрации свободных электронов. Атомные радиусы [c.233]
От железа к никелю межатомные расстояния уменьшаются в связи с сокращением размеров внешней электронной оболочки. Уменьшение межатомного расстояния продолжается в VII и VIII группах в связи с переходом от объемноцентрированной к плотнейшим упаковкам и достигает минимума у рутения и осмия. Межатомные расстояния от рутения к палладию и от осмия к платине слегка увеличиваются вследствие уменьшения электронной концентрации от 4 до 2 элЫтом и соответствующего понижения энергии межатомной связи. Далее к побочным металлам второй группы (цинку, кадмию и ртути) межатомные расстояния и атомные диаметры продолжают возрастать в связи с уменьшением концентрации свободных электронов. Атомные радиусы [c.233]
ЩЕЛОЧНЫЕ МЕТАЛЛЫ литий, натрий, калий, рубидий, цезий, франций. Имеют на внеш. оболочке атома по одному -электрону, на предшествующей — два 4- й шесть р-электронов (кроме Ь1) степень окисл. -М. Обладают близкими физ. и хим. св-вами (особенно К, КЬ и Ся). Легкоплавки, имеют серебристо-белый цвет и малую плотность. Характеризуются высокой хим. активностью, возрастающей от 1.1 к Се энергично взаимод. с водой, Оз, галогенами, при нагрев.— с Нз, 8 и др. Раств. в мииер. к-тах, жидком КНз. [c.691]
Характеризуются высокой хим. активностью, возрастающей от 1.1 к Се энергично взаимод. с водой, Оз, галогенами, при нагрев.— с Нз, 8 и др. Раств. в мииер. к-тах, жидком КНз. [c.691]
Ионы металлов в водных растворах обычно гидратированы. Положительный заряд иона притягивает диполи воды, и таким образом получается гидратная оболочка. Очень часто, особенно у ионов щелочных и щелочноземельных Металлов, эта гидратная оболочка удерживается только при помощи электрсстатическсго притяжения, и статистическое среднее число водных молекул,окружающих ион металла, называется средним числом гидратации. Некоторые ионы, обладающие малой величиной заряда с большим радиусом электронрюй оболочки, как, например, ионы рубидия, цезия и аналогичного им одновалентного таллия, практически вообще не гидратированы, так как их электронная оболочка закрывает положительный заряд ядра. [c.19]
ЩЕЛОЧНЫЕ МЕТАЛЛЫ литий, натрий, калий, рубидий, цезий, франций. Имеют ва внеш. оболочке атома по одному -электоону, на предшествующей — два – и шесть -электронов 0[c.691]
оболочке атома по одному -электоону, на предшествующей — два – и шесть -электронов 0[c.691]
Как известно, уже начиная с калия и кальция после заполнения двух подгрупп (Зу и Зр) с главным квантовым числом, равным 3, происходит заполнение подгруппы 4я с главным квантовым числом, равным 4, тогда как третья подгруппа (Зс ) с д = 3 еще остается свободной, незаполненной электронами. Подобные же отклонения от регулярного заполнения электронных подгрупп по возрастающим значениям п встречаются снова у рубидия и стронция, когда подгруппа 5 с ге = 5 заполняется ранее двух подгрупп Ы и 4/) с главным квантовым числом, равным 4, и далее у серебра, кадмия и следующих за ними элементов, в электронной оболочке нейтральных невозбужденных атомов которых заполняются подгруппы 5з и Ьр) с п = 5 при наличии незаполненной подгруппы (4/) с и = 4. Еще более значительны отклонения в этом отношении у цезия и бария, в электронной оболочке нейтральных невозбужденных атомов которых заполняется подгруппа 6я с га = 6, а свободными, незаполненными электронами остаются подгруппа 4 /сга=4 и две подгруппы 5(1 и 5д) с га= 5. Наконец, у франция и радия заполнение подгруппы 7з) с п = 1 происходит при наличии двух незаполненных подгрупп (5/ и 5g) с главным квантовым числом, равным 5, и четырех подгрупп (6й, 6/, 6g и 6Ь) с главным квантовым числом 6. Все эти факты объясняются увеличением роли углового момента и соответственно уменыненизм относительной роли числа узлов радиальной составляющзй волновой функции в определении уровня [c.55]
Наконец, у франция и радия заполнение подгруппы 7з) с п = 1 происходит при наличии двух незаполненных подгрупп (5/ и 5g) с главным квантовым числом, равным 5, и четырех подгрупп (6й, 6/, 6g и 6Ь) с главным квантовым числом 6. Все эти факты объясняются увеличением роли углового момента и соответственно уменыненизм относительной роли числа узлов радиальной составляющзй волновой функции в определении уровня [c.55]
В элементах от меди (Z==29) до криптона (Z=36) в установленной последовательности заполнятся электронами iV-оболочка, а в рубидии (Z = 37) и стронции (Z=38) — 5s-ypoB6Hb Q-оболочки. [c.36]
Большие п(1 размерам щелочные металлы—калий, рубидий и цезий— также образуют подобные молекулы с тремя молекулами альдегида, в которых металл находится в шестерной координации. Если не считать небольшого числа соединений такого типа, то химия щелочных металлов почти целиком является химией ионов, образующихся из атомов металлов при потере последними одного электрона внешней квантовой оболочки. Однако в подгруппе В мы на.кодим совершенно другое положение. Электронные структуры атомов в этой подгруппе следующие [c.577]
Однако в подгруппе В мы на.кодим совершенно другое положение. Электронные структуры атомов в этой подгруппе следующие [c.577]
Тематический тест на строение атома для подготовки к ЕГЭ по химии.
Задание №1
Четыре электрона на внешнем энергетическом уровне имеют атомы химических элементов:
- 1. Na
- 2. K
- 3. Si
- 4. Mg
- 5. C
Задание №2
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. V
- 3. As
- 4. Al
- 5. Li
Задание №3
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Se
- 3. Fe
- 4. S
- 5. Al
Задание №4
Одинаковое число валентных электронов имеют атомы:
- 1. Ca
- 2. Al
- 3. Cl
- 4. Fe
- 5. Mn
Задание №5
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1.
 Cr
Cr - 2. Al
- 3. K
- 4. N
- 5. Cl
Задание №6
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Al
- 2. N
- 3. Ca
- 4. P
- 5. O
Задание №7
Одинаковое число неспаренных электронов в основном состоянии имеют атомы:
- 1. Na
- 2. Ca
- 3. As
- 4. Cr
- 5. Al
Задание №8
Три неспаренных электрона в основном состоянии имеют атомы:
- 1. B
- 2. V
- 3. O
- 4. As
- 5. Ne
Задание №9
Одинаковое число неспаренных электронов в основном состоянии содержат атомы:
- 1. Ti
- 2. Al
- 3. C
- 4. Ba
- 5. N
Задание №10
Один неспаренный электрон в основном состоянии имеют атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5.
 Ca
Ca
Задание №11
В основном состоянии все валентные электроны расположены только на s-подуровне у атомов:
- 1. Sb
- 2. Ra
- 3. Fe
- 4. B
- 5. Na
Задание №12
Валентные электроны, расположенные на s- и d-подуровнях, содержат атомы:
- 1. Rb
- 2. Cr
- 3. Sr
- 4. V
- 5. P
Задание №13
Все валентные электроны расположены на третьем энергетическом уровне у атомов:
- 1. Cl
- 2. N
- 3. C
- 4. Be
- 5. P
Задание №14
К s-элементам относятся:
- 1. Cu
- 2. Rb
- 3. Sc
- 4. Al
- 5. Ra
Задание №15
К s-элементам относятся:
- 1. He
- 2. P
- 3. Al
- 4. Cl
- 5. Li
Задание №16
К p-элементам относятся:
- 1. Cu
- 2.
 B
B - 3. Cr
- 4. Ba
- 5. Sb
Задание №17
К d-элементам относятся:
- 1. Cs
- 2. Zn
- 3. Cl
- 4. Te
- 5. Mn
Задание №18
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. K
- 2. Sr
- 3. Mn
- 4. Ca
- 5. Br
Задание №19
Химические элементы, атомы которых не содержат электронов на d-подуровне:
- 1. Cl
- 2. F
- 3. Br
- 4. Cu
- 5. Fe
Задание №20
Валентных электронов на d-подуровне не содержат атомы химических элементов:
- 1. Ti
- 2. Br
- 3. Se
- 4. Sc
- 5. Ni
Задание №21
Одинаковое число нейтронов и протонов содержат атомы наиболее распространенных изотопов:
- 1. S
- 2. Al
- 3. K
- 4. Ca
- 5. Na
Задание №22
Число нейтронов большее, чем число протонов содержат ядра наиболее распространенных изотопов:
- 1.
 Ar
Ar - 2. Si
- 3. K
- 4. Mg
- 5. O
Задание №23
Не могут переходить в возбужденное состояние атомы:
- 1. N
- 2. Ca
- 3. F
- 4. Sr
- 5. Se
Задание №24
Не могут переходить в возбужденное состояние атомы:
- 1. O
- 2. S
- 3. He
- 4. As
- 5. P
Задание №25
Не могут переходить в возбужденное состояние атомы:
- 1. Cl
- 2. F
- 3. B
- 4. Ne
- 5. C
Задание №26
Не могут переходить в возбужденное состояние атомы:
- 1. P
- 2. Br
- 3. Be
- 4. O
- 5. N
Задание №27
Не могут переходить в возбужденное состояние атомы:
- 1. Ca
- 2. P
- 3. O
- 4. F
- 5. S
Задание №28
Возможен переход в возбужденное состояние для атомов:
- 1.
 Cs
Cs - 2. C
- 3. Al
- 4. Rb
- 5. N
Задание №29
Один неспаренный электрон в основном состоянии содержат атомы:
- 1. Ba
- 2. Al
- 3. N
- 4. Cl
- 5. Ca
Задание №30
Из предложенного перечня химических элементов выберите два таких, наиболее устойчивые катионы которых имеют одинаковые электронные конфигурации:
- 1. Al
- 2. Ca
- 3. Ba
- 4. Na
- 5. I
Задание №31
Три неспаренных электрона в основном состоянии содержат атомы:
- 1. B
- 2. N
- 3. Al
- 4. Se
- 5. P
Задание №32
В возбужденном состоянии электронную форму внешнего электронного уровня ns1np2 имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Задание №33
Электронную формулу внешнего энергетического уровня ns1 в основном состоянии имеют атомы:
- 1.
 Cr
Cr - 2. Ca
- 3. Cs
- 4. Cl
- 5. Br
Задание №34
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. As
- 2. B
- 3. P
- 4. F
- 5. Al
Задание №35
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 4s24p6
- 1. Sr
- 2. Br
- 3. Rb
- 4. As
- 5. Se
Задание №36
Определите элементы, катионы которых имеют электронную формулу внешнего энергетического уровня 2s22p6
- 1. Na
- 2. Al
- 3. Br
- 4. Cu
- 5. Se
Задание №37
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np3 имеют атомы:
- 1. Cu
- 2. N
- 3. P
- 4. Cr
- 5. Fe
Задание №38
Схожую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1.
 Al
Al - 2. Mg
- 3. Br
- 4. F
- 5. Na
Задание №39
Полностью завершенный второй энергетический уровень имеют атомы:
- 1. Ne
- 2. He
- 3. Na
- 4. F
- 5. O
Задание №40
Двух электронов до завершения внешнего энергетического уровня не хватает атомам:
- 1. Cr
- 2. Zn
- 3. O
- 4. S
- 5. Fe
Задание №41
Одного электрона до завершения внешнего энергетического уровня не хватает атому:
- 1. Na
- 2. Br
- 3. K
- 4. Ca
- 5. Cl
Задание №42
В основном состоянии электронную формулу внешнего энергетического уровня ns2np4 имеют атомы:
- 1. P
- 2. Se
- 3. Si
- 4. Cr
- 5. S
Задание №43
Атомы каких из указанных в ряду элементов в основном состоянии имеют только один неспаренный электрон:
- 1.
 P
P - 2. Cu
- 3. Zn
- 4. Si
- 5. Cl
Задание №44
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Задание №45
Электронную конфигурацию ns1 имеют атомы:
- 1. Na
- 2. S
- 3. Se
- 4. K
- 5. O
Задание №46
Валентные электроны и на s- и на d-подуровнях содержат атомы:
- 1. Cr
- 2. C
- 3. Ge
- 4. Fe
- 5. Pb
Задание №47
До полного заполнения внешнего энергетического уровня не хватает одного электрона атомам:
- 1. N
- 2. Li
- 3. H
- 4. F
- 5. O
Задание №48
В основном состоянии во внешнем слое содержат один неспаренный электрон атомы:
- 1. Al
- 2. S
- 3. Cr
- 4. P
- 5.
 Si
Si
Задание №49
Одинаковое число валентных электронов содержат атомы:
- 1. Na
- 2. Cl
- 3. Si
- 4. Mn
- 5. Cr
Задание №50
Электронную конфигурацию ns1np3 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Задание №51
Электронную конфигурацию ns1np2 в возбужденном состоянии имеют атомы:
- 1. B
- 2. Al
- 3. F
- 4. Fe
- 5. N
Задание №52
Электронную конфигурацию внешнего энергетического уровня ns2 в основном состоянии имеют атомы:
- 1. Na
- 2. Al
- 3. Fe
- 4. Ba
- 5. P
Задание №53
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома неона:
- 1.
 Mg
Mg - 2. Ca
- 3. Al
- 4. Li
- 5. Be
Задание №54
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома неона:
- 1. Cl
- 2. О
- 3. Br
- 4. F
- 5. S
Задание №55
Из предложенного перечня химических элементов, выберите такие, устойчивые анионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. Cl
- 2. S
- 3. F
- 4. Br
- 5. O
Задание №56
Из предложенного перечня химических элементов, выберите такие, устойчивые катионы которых имеют электронную конфигурацию, как у атома аргона:
- 1. S
- 2. Ca
- 3. Cl
- 4. K
- 5. Br
Задание №57
Содержат один неспаренный электрон в основном состоянии атомы:
- 1. S
- 2. Na
- 3. Al
- 4. Si
- 5. Mg
Задание №58
Шесть валентных электронов имеют атомы:
- 1. P
- 2. C
- 3. Si
- 4. Cr
- 5. S
Задание №59
Неспаренных электронов не содержат атомы:
- 1. C
- 2. N
- 3. F
- 4. Be
- 5. Ne
Задание №60
Как на s-, так и на d-подуровне расположены валентные электроны атомов:
- 1. Si
- 2. Cr
- 3. Mn
- 4. Br
- 5. C
Задание №61
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Cr
- 2. P
- 3. Mg
- 4. O
- 5. H
Задание №62
До завершения внешнего электронного слоя одного электрона не хватает атомам:
- 1. Ba
- 2. O
- 3. K
- 4. Cl
- 5. H
Задание №63
В основном состоянии один неспаренный электрон имеют атомы:
- 1. B
- 2. Mg
- 3. C
- 4. S
- 5. Rb
Задание №64
Электронную формулу внешнего энергетического уровня ns1np2 в возбужденном состоянии имеют атомы:
- 1. Al
- 2. P
- 3. Cl
- 4. Cr
- 5. B
Задание №65
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. C
- 2. As
- 3. B
- 4. H
- 5. Ne
Задание №66
Одинаковое число d-электронов в основном состоянии содержат атомы:
- 1. Cr
- 2. V
- 3. Cu
- 4. Mn
- 5. Na
Задание №67
Одинаковое число валентных электронов имеют атомы:
- 1. O
- 2. Ba
- 3. P
- 4. Sr
- 5. C
Задание №68
Одинаковое число энергетических уровней, содержащих электроны, имеют атомы:
- 1. Ag
- 2. Rb
- 3. Li
- 4. Na
- 5. Cu
Задание №69
Определите химические элементы, анионы которых имеют конфигурацию внешнего электронного слоя 2s22p6:
- 1. Na
- 2. Cl
- 3. Mg
- 4. F
- 5. O
Задание №70
Одинаковую электронную конфигурацию внешнего энергетического уровня имеют атомы:
- 1. Cr
- 2. Sb
- 3. Ne
- 4. Cu
- 5. Fe
Задание №71
Из предложенного перечня выберите p-элементы:
- 1. Sc
- 2. Fe
- 3. Li
- 4. Sb
- 5. Sn
Задание №72
Одинаковое число неспаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Si
- 2. Be
- 3. N
- 4. Rb
- 5. K
Задание №73
Из предложенного перечня выберите d-элементы:
- 1. Cs
- 2. As
- 3. Mn
- 4. Te
- 5. Zn
Задание №74
Одинаковое количество неспаренных электронов в основном состоянии содержат атомы:
- 1. S
- 2. Br
- 3. P
- 4. B
- 5. Zn
Задание №75
В наиболее распространенных изотопах атомов каких элементов число нейтронов больше, чем число электронов:
- 1. O
- 2. Se
- 3. S
- 4. Ar
- 5. Ca
Задание №76
На внешнем энергетическом уровне только два электрона содержат атомы:
- 1. Ca
- 2. Br
- 3. N
- 4. Cr
- 5. He
Задание №77
Атомам каких элементов для приобретения электронной конфигурации как у благородного газа не хватает двух электронов:
- 1. Cl
- 2. P
- 3. N
- 4. Se
- 5. S
Задание №78
Одного электрона до завершения внешнего электронного слоя не хватает атомам:
- 1. Al
- 2. Na
- 3. Cl
- 4. H
- 5. O
Задание №79
В возбужденном состоянии электронную конфигурацию внешнего энергетического уровня ns1np3 имеют атомы:
- 1. Al
- 2. Si
- 3. Mg
- 4. C
- 5. N
Задание №80
Одинаковое число валентных электронов имеют атомы:
- 1. Cr
- 2. Si
- 3. Li
- 4. Ti
- 5. B
Задание №81
Одинаковое число спаренных электронов на внешнем энергетическом уровне в основном состоянии содержат атомы:
- 1. Ca
- 2. F
- 3. Al
- 4. S
- 5. Na
Задание №82
К d-элементам относятся:
- 1. Ge
- 2. Te
- 3. S
- 4. Ni
- 5. Zn
Задание №83
К p-элементам относятся:
- 1. Ge
- 2. Sr
- 3. Se
- 4. Ni
- 5. Cu
Задание №84
d-Электроны содержат атомы:
- 1. Ca
- 2. P
- 3. Cu
- 4. Cl
- 5. Rb
Задание №85
Одинаковую электронную конфигурацию внешнего энергетического уровня в основном состоянии имеют наиболее распространенные изотопы элементов:
- 1. Li
- 2. Na
- 3. Al
- 4. N
- 5. С
Задание №86
Один электрон на s-подуровне внешнего энергетического уровня имеют в основном состоянии атомы:
- 1. V
- 2. Cr
- 3. Fe
- 4. Mn
- 5. Cu
Задание №87
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. O
- 2. S
- 3. Na
- 4. Mg
- 5. F
Задание №88
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. Si
- 4. Al
- 5. V
Задание №89
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Ti
- 2. Mg
- 3. F
- 4. Ne
- 5. V
Задание №90
Одинаковое число нейтронов содержат наиболее распространенные изотопы элементов:
- 1. Cu
- 2. V
- 3. Mg
- 4. Li
- 5. Cr
Задание №91
Электронную конфигурацию внешнего энергетического уровня в основном состоянии ns2np2 имеют атомы:
- 1. Se
- 2. Sn
- 3. S
- 4. Sb
- 5. Si
Задание №92
Не содержат неспаренных электронов в основном состоянии атомы:
- 1. Zn
- 2. Ti
- 3. Sr
- 4. Cs
- 5. V
Задание №93
Три неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. P
- 2. Ti
- 3. As
- 4. Al
- 5. B
Задание №94
Четыре неспаренных электрона в возбужденном состоянии содержат атомы:
- 1. С
- 2. P
- 3. Al
- 4. V
- 5. Si
Задание №95
Одинаковое число валентных электронов содержат атомы:
- 1. As
- 2. V
- 3. Cl
- 4. Se
- 5. Na
Задание №96
Десять электронов на 3d-подуровне содержат атомы:
- 1. Cu
- 2. Mn
- 3. Ni
- 4. Co
- 5. Se
Задание №97
Пять электронов на 3d-подуровне содержат атомы:
- 1. Ga
- 2. Cr
- 3. As
- 4. Mn
- 5. V
Задание №98
Атомы каких химических элементов при потере двух электронов приобретают электронную конфигурацию как у благородного газа:
- 1. Ba
- 2. Al
- 3. Fe
- 4. Co
- 5. Be
Задание №99
Атомы каких химических элементов при потере одного электрона приобретают электронную конфигурацию как у благородного газа:
- 1. H
- 2. Rb
- 3. Cr
- 4. Mn
- 5. Cs
Задание №100
Наиболее стабильные анионы вида Э2- образуют химические элементы:
- 1. Ca
- 2. Zn
- 3. Se
- 4. Br
- 5. S
Задание №101
Наиболее стабильные катионы вида Э2+ образуют химические элементы:
- 1. Cl
- 2. S
- 3. Ca
- 4. Br
- 5. Zn
Схема строения rb – vh8ewtc.getenjoyment.net
Скачать схема строения rb EPUB
Начертите схему строенья атома рубидия Rb. Сравните ее со схемами строения атомов натрия и цезия. Электронная формула Теннесcин Ts (графическая схема строения атома). 1 Начертите схему строения атома рубидия Rb. Сравните её со схемами строения атомов натрия и цезия. Электронно-графическая формула и схема строения элемента Электронная формула Оганесон Og (графическая схема строения атома).
В году при помощи недавно изобретенного метода спектрального анализа был открыт новый химический элемент – рубидий. Затем, с открытием в году Д. И. Менделеевым периодического закона, рубидий вместе с другими элементами занял свое место в таблице, которая внесла порядок в химическую науку. Дальнейшее изучение рубидия показало, что этот элемент обладает целым рядом интересных и ценных свойств. Мы рассмотрим здесь наиболее характерные и важные из них. На этом уроке вы узнаете об электронных оболочках атома, что такое атомные модели Бора.
Вы повторите строение атомного ядра, после чего приступите к рассмотрению современных взглядов при изучении электронных оболочек атома, условные изображения электронных уровней и подуровней. Также вы рассмотрите атомные модели Бора. Постулаты Н. Бора. Электронная формула атома: Rb – 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1. Электронно-графическая формула и схема строения элемента Электронная формула Оганесон Og (графическая схема строения атома).
спросил 10 Ноя, 18 от асянка в категории школьный раздел. 1 ответ. Электронная формула Теннесcин Ts (графическая схема строения атома). спросил 10 Ноя, 18 от асянка в категории школьный раздел. 1 ответ. Рубидий. Символ. Rb. Руби́дий — элемент 1-й группы (по устаревшей классификации — главной подгруппы первой группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером Обозначается символом Rb (лат. Rubidium). Простое вещество рубидий — мягкий легкоплавкий щелочной металл серебристо-белого цвета.
Металлический рубидий имеет сходство с металлическим калием и металлическим цезием по внешнему виду, мягкости и проводимости.
PDF, fb2, PDF, PDF схема остеобластаRb Информация об элементе рубидия: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Рубидий История
Элемент рубидий был открыт Робертом Бунзеном в год. 1861 г. в Германии . Рубидий получил свое название от латинского rubidus, что означает «темно-красный».
Наличие рубидия: изобилие в природе и вокруг нас
В таблице ниже показано содержание рубидия во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура рубидия
Твердотельная структура рубидия – это телесно-центрированная кубическая форма.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | b | c |
|---|---|---|
| 558.5 | 558,5 | 558,5 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства рубидия
Атомы рубидия имеют 37 электронов и структура электронной оболочки [2, 8, 18, 8, 1] с символом атомного члена (квантовые числа) 2 S 1/2 .
Оболочечная структура рубидия – количество электронов на энергию уровень
| n | с | п. | d | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 6 | 10 | |
| 4 | N | 2 | 6 | ||
| 5 | O | 1 |
Основное состояние электронной конфигурации рубидия – нейтраль Атом рубидия
Электронная конфигурация нейтрального атома рубидия в основном состоянии [Kr] 5s1.Часть конфигурации рубидия, которая эквивалентна благородному газу предыдущий период сокращенно обозначается [Kr]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используются сокращенные обозначения. электроны валентности 5s1, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального рубидия
Полная электронная конфигурация в основном состоянии для атома рубидия, полная электронная конфигурация
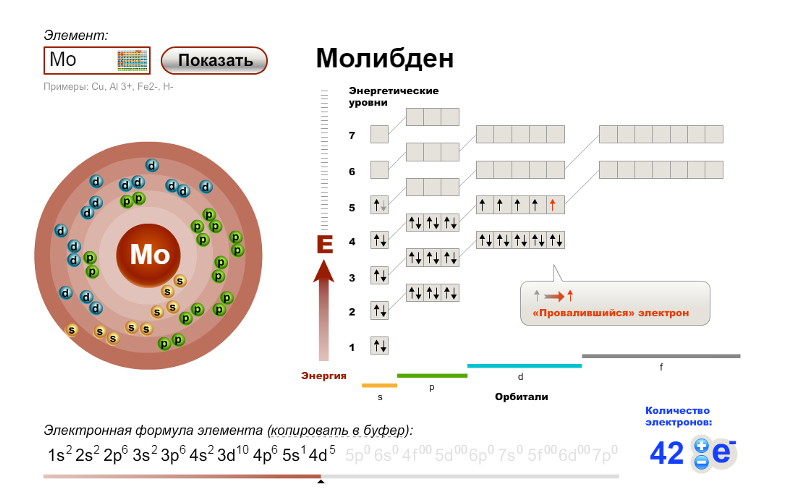
1с2 2с2 2п6 3с2 3п6 3d10 4с2 4п6 5с1
Атомная структура рубидия
Атомный радиус рубидия 265 пм, а его ковалентный радиус 211 пм.
Атомный спектр рубидия
Рубидий Химические свойства: Энергии ионизации рубидия и сродство к электрону
Электронное сродство рубидия составляет 46,9 кДж / моль.
Энергия ионизации рубидия
Энергии ионизации рубидия
см. В таблице ниже.| Число энергии ионизации | Энтальпия – кДж / моль |
|---|---|
| 1 | 403 |
| 2 | 2633 |
| 3 | 3860 |
| 4 | 5080 |
| 5 | 6850 |
| 6 | 8140 |
| 7 | 9570 |
| 8 | 13120 |
| 9 | 1.45 × 104 |
| 10 | 26740 |
Физические свойства рубидия
Физические свойства рубидия
см. В таблице ниже.| Плотность | 1,532 г / см3 |
| Молярный объем | 55.788381201 см3 |
Эластичные свойства
Твердость рубидия – Испытания для измерения твердости элемента
Электрические свойства рубидия
Рубидий – проводник электричества.Ссылаться на стол ниже электрические свойства рубидия
Рубидий Теплопроводные свойства
Магнитные свойства рубидия
Оптические свойства рубидия
Акустические свойства рубидия
Термические свойства рубидия – энтальпии и термодинамика
Термические свойства рубидия
см. В таблице ниже.Энтальпия рубидия
Изотопы рубидия – ядерные свойства рубидия
Изотопы родия.Встречающийся в природе рубидий имеет 1 стабильный изотоп – 85рб.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 71Rb | ||||
| 72Рб | ||||
| 73Rb | ||||
| 74Рб | ||||
| 75р | ||||
| 76Рб | ||||
| 77Rb | ||||
| 78Рб | ||||
| 79Rb | ||||
| 80рб | ||||
| 81Рб | ||||
| 82Рб | ||||
| 83Рб | ||||
| 84Rb | ||||
| 85рб | 72.17% | Стабильный | N / A | |
| 86Рб | ||||
| 87Рб | 27.83% | |||
| 88Rb | ||||
| 89Рб | ||||
| 90р | ||||
| 91Rb | ||||
| 92рб | ||||
| 93р | ||||
| 94Rb | ||||
| 95рб | ||||
| 96Рб | ||||
| 97Рб | ||||
| 98Рб | ||||
| 99р | ||||
| 100р | ||||
| 101Рб | ||||
| 102р |
Нормативно-правовое регулирование и здравоохранение – Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
WebElements Periodic Table »Рубидий» Свойства свободных атомов
Атомы рубидия имеют 37 электронов, а структура оболочки – 2.8.18.8.1.
Электронная конфигурация основного состояния газообразного нейтрального рубидия в основном состоянии – это [ Kr ]. 5s 1 , а символ термина – 2 S 1/2 .
Схематическая электронная конфигурация рубидия. Косселевская оболочка рубидия.Атомный спектр
Представление атомного спектра рубидия.
Энергии ионизации и сродство к электрону
Электронное сродство рубидия 46.9 кДж моль ‑1 . Энергии ионизации рубидия приведены ниже.
Энергии ионизации рубидия.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Для получения более подробной информации и графиков в различных форматах перейдите по гиперссылкам.
| 1с | 36,21 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 27.16 | 2-пол. | 33,04 | ||||
| 3 с | 21,84 | 3 пол. | 21,30 | 3d | 21,68 | ||
| 4с | 12,39 | 4 пол | 10,88 | 4d | (нет данных) | 4f | (нет данных) |
| 5с | 4,98 | 5p | (нет данных) | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди и В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1 с | 15200 [1] |
| L I | 2 с | 2065 [1] |
| L II | 2p 1/2 | 1864 [1] |
| L III | 2p 3/2 | 1804 [1] |
| M I | 3s | 326.7 [2] |
| M II | 3p 1/2 | 248,7 [2] |
| M III | 3p 3/2 | 239,1 [2] |
| M IV | 3d 3/2 | 113 [2] |
| M V | 3d 5/2 | 112 [2] |
| N I | 4s | 30,5 [2] |
| N II | 4p 1/2 | 16.3 [2] |
| N III | 4p 3/2 | 15,3 [2] |
Примечания
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электрона. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev.Мод. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, “Энергии связи на уровне ядра в металлах”, J.Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Рубидий – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: рубидий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества.
(Конец промо)
Meera Senthilingam
На этой неделе у нас есть радиоактивный элемент, который хорошо держит время, но также имеет небольшой огонь в брюхе. Более подробно о химии рубидия можно прочитать у Тома Бонд.
Tom Bond
В каком-то смысле история рубидия начинается в 1859 году, когда немецкие химики Роберт Бунзен и Густав Кирхоф изобрели спектроскоп и, в свою очередь, открыли дверь в новую эру химического анализа.До этого была разработана горелка Бунзена для исследования цветного пламени, которое они видели при сжигании различных металлов и солей. Бунзен и Кирхгоф смогли выяснить, что, используя внешний источник света и призму, они могут разделить длины волн в спектрах излучения в этом пламени, и так родился спектроскоп.
Цезий был их первым крупным открытием с помощью спектроскопа, за которым в 1861 году быстро последовал рубидий, который был обнаружен по красному пламени, образовавшемуся при сжигании минерала лепидолита, который содержит небольшое количество рубидия.Бунзен и Кирхгоф поняли, что этот цвет произошел от неизвестного вещества, и затем смогли очистить небольшое количество рубидия. Его название происходит от латинского слова rubidus , что означает самый глубокий красный цвет, который относится к цвету, наблюдаемому после возбуждения одиночного электрона в его внешней оболочке.
Рубидий на самом деле является одним из наиболее распространенных элементов, и, в зависимости от того, какой источник информации вы смотрите, это примерно 16 -й самый распространенный элемент в земной коре с концентрацией где-то около 90 частей на миллион.Хотя его относительно много по сравнению с другими элементами, такими как медь, он находится не в чистом виде, а в виде незначительной доли в различных минералах. Большая часть рубидия получается как побочный продукт экстракции лепидолита, основной целью которого является производство лития. Чистый рубидий часто получают восстановлением хлорида рубидия с использованием металлического кальция при температуре около 750 ºC и низком давлении.
Рубидий является одним из щелочных металлов, иначе известных как группа первая периодической таблицы.Щелочные металлы имеют один электрон во внешней оболочке, что делает их очень реактивными с кислородом, водой и галогенами, а также означает, что их степень окисления никогда не превышает +1. По мере того, как вы двигаетесь вниз по Группе 1 периодической таблицы, реакционная способность элементов увеличивается, что соответствует увеличению энергии внешнего электрона.
В то время как литий и натрий, добавленные в воду, являются частью школьных экспериментов по химии, дополнительная реакционная способность рубидия означает, что эквивалентная реакция требует осторожности и не для слабонервных.Когда небольшое количество рубидия бросается в воду, эффект довольно впечатляющий и настолько сильный, что выделяющийся водород может воспламениться. Рубидий настолько реактивен, что может спонтанно воспламениться на воздухе, а это означает, что его нужно хранить в инертных условиях.
По своим физическим свойствам элементы группы 1 представляют собой мягкие металлы с низкой температурой плавления. Рубидий не является исключением из этого правила, поскольку он серебристо-белый и плавится при 39 ºC. Элемент имеет два встречающихся в природе изотопа.Рубидий-85 является доминирующей формой, составляющей 72% от общего количества, в то время как большая часть остального – радиоактивный рубидий-87, период полураспада которого составляет 50 миллиардов лет. Радиоактивный изотоп распадается с образованием стронция-87. Этот процесс позволяет определять возраст горных пород путем измерения изотопов рубидия и стронция с помощью масс-спектрометрии, а затем вычисления отношения радиоактивных форм к продуктам их распада.
Хотя этот элемент интересен с химической точки зрения, в настоящее время он имеет относительно немного коммерческих применений, но объем исследовательской деятельности предполагает, что существует множество возможностей.Одно из современных применений – атомные часы, хотя рубидий считается менее точным, чем цезий. Рубидиевая версия атомных часов использует переход между двумя состояниями сверхтонкой энергии изотопа рубидий-87. Эти часы используют микроволновое излучение, которое настраивается до тех пор, пока оно не соответствует сверхтонкому переходу, и в этот момент интервал между гребнями волн излучения может использоваться для калибровки самого времени.
Рубидий был выбран для исследования необычных свойств чрезвычайно низкотемпературных жидкостей, известных как конденсаты Бозе-Эйнштейна, которые имеют нулевую вязкость и способность самопроизвольно вытекать из своих емкостей.Их существование было предсказано в 1925 году самим Эйнштейном, который расширил работу индийского физика С. Н. Бозе, предположив, что бозонные атомы при температурах, близких к абсолютному нулю, будут формировать свое самое низкое возможное энергетическое состояние, которое могло бы позволить изучить квантовое поведение. Между прочим, бозоны определяются как атомы с целым спином, в то время как несколько бозонов могут занимать одно и то же энергетическое состояние. Только в конце 20-го и -го века технический прогресс сделал охлаждающие элементы близкими к абсолютному нулю.Первый чистый конденсат Бозе-Эйнштейна был создан с использованием рубидия-87 группой из Университета Колорадо в США, и за это достижение они получили Нобелевскую премию по физике 2001 года.
Рубидий не особенно опасен для человека, и, попав в организм, его ионы быстро выводятся с потом и мочой. Хлорид рубидия использовался для изучения переноса ионов калия у людей, поскольку ионы рубидия в природе не обнаруживаются в организме, и когда они присутствуют, с ними обращаются так, как если бы они были калием.Аналогичным образом, поскольку он имеет тенденцию накапливаться внутри клеток, особенно опухолей, радиоактивный изотоп Rb-82 можно использовать для обнаружения опухолей головного мозга.
Низкая токсичность рубидия подтверждается исследованием 1971 года, целью которого была оценка возможности использования хлорида рубидия в качестве антидепрессанта, поскольку аналогичные эффекты наблюдались у обезьян. После того, как доброволец получил 23 грамма рубидия в течение 75 дней, у него не было никаких вредных побочных эффектов. Тем не менее, это заставляет задуматься, можно ли провести аналогичные клинические исследования сейчас.Между тем, клиническое применение рубидия в психиатрии еще не реализовано. Итак, у нас есть рубидий, взрывоопасный красный элемент под номером 37 в периодической таблице.
Meera Senthilingam
Таким образом, этот взрывной элемент может иметь минимальное коммерческое применение, но может использоваться в атомных часах и имеет изотопы, которые могут определять местонахождение опухолей головного мозга. Неплохо, учитывая, что на него наткнулись при анализе минерала лепидолита. Это был Том Бонд с историей о рубидии.На следующей неделе мы познакомимся с элементом, который сделал возможным наш современный образ жизни.
John Whitfield
Смесь порошкообразного тантала и оксида тантала используется в конденсаторах мобильных телефонов, компонентах, которые накапливают электрический заряд и регулируют протекание тока. Что делает этот элемент идеальным для телефонов и других изящных электронных устройств, таких как портативные игровые консоли, ноутбуки и цифровые камеры, так это то, что металл чрезвычайно хорошо проводит как тепло, так и электричество, а это означает, что его можно использовать в небольших компонентах, которые не ломайся под давлением.
Meera Senthilingam
И Джон Уитфилд объяснит, почему у нас есть тантал, за который мы должны благодарить, когда в следующий раз будем играть в новейшие компьютерные игры, делать сотни фотографий в отпуске или когда мы загружаем этот подкаст на наши ноутбуки. Так что присоединяйтесь к Джону на следующей неделе в Chemistry in its Element. А пока я Мира Сентилингам, и спасибо за внимание.
(Промо)
(Окончание промо)
рубидий | химический элемент | Britannica
рубидий (Rb) , химический элемент группы 1 (Ia) в периодической таблице, группа щелочного металла.Рубидий – второй по активности металл, он очень мягкий, с серебристо-белым блеском.
Рубидий был открыт (1861 г.) спектроскопически немецкими учеными Робертом Бунзеном и Густавом Кирхгофом и назван в честь двух ярких красных линий его спектра. Рубидий и цезий часто встречаются в природе вместе. Рубидий, однако, более широко разбросан и редко образует природный минерал; он обнаруживается только в качестве примеси в других минералах, в таких минералах, как лепидолит, поллуцит и карналлит, его содержание колеблется до 5 процентов.Также были проанализированы пробы рассола, которые содержат до 6 частей на миллион рубидия.
Британская викторина
Периодическая таблица элементов
Проверьте свою связь с периодической таблицей элементов в этой викторине по всем 118 химическим элементам и их символам. Возможно, вы знакомы с химическими символами водорода и кислорода, но можете ли вы сопоставить такие низкопрофильные элементы, как гадолиний и эрбий, с их соответствующими символами?
В основном промышленном процессе производства рубидия небольшие количества рубидия получают из смеси карбонатов щелочных металлов, остающихся после экстракции солей лития из лепидолита.В первую очередь карбонат калия, этот побочный продукт также содержит примерно 23 процента рубидия и 3 процента карбонатов цезия.
Основная трудность, связанная с производством чистого рубидия, заключается в том, что он всегда находится в природе вместе с цезием, а также в смеси с другими щелочными металлами. Поскольку эти элементы очень похожи химически, их разделение представляло многочисленные проблемы до появления методов ионного обмена и ионно-специфических комплексообразующих агентов, таких как краун-эфиры.После получения чистых солей их несложно превратить в свободный металл. Это можно сделать электролизом конденсированного цианида или восстановлением кальцием или натрием с последующей фракционной перегонкой.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасС рубидием трудно обращаться, потому что он самовоспламеняется на воздухе и бурно реагирует с водой с образованием раствора гидроксида рубидия (RbOH) и водорода, который воспламеняется; рубидий поэтому хранится в сухом минеральном масле или в атмосфере водорода.Если металлический образец имеет достаточно большую площадь поверхности, он может гореть с образованием супероксидов. Супероксид рубидия (RbO 2 ) представляет собой желтый порошок. Пероксиды рубидия (Rb 2 O 2 ) могут быть образованы путем окисления металла необходимым количеством кислорода. Рубидий образует два других оксида (Rb 2 O и Rb 2 O 3 ).
Он используется в фотоэлементах и в качестве «геттера» в электронных лампах для удаления следов запечатанных газов. Атомные часы с рубидием или эталоны частоты были сконструированы, но они не так точны, как атомные часы цезия.Однако, помимо этих применений, металлический рубидий имеет немногочисленное коммерческое применение и имеет очень незначительное экономическое значение. Высокие цены и неопределенное и ограниченное предложение препятствуют развитию коммерческого использования.
Природный рубидий составляет около 0,01 процента земной коры; он существует как смесь двух изотопов: рубидия-85 (72,15 процента) и радиоактивного рубидия-87 (27,85 процента), который излучает бета-лучи с периодом полураспада около 6 × 10 11 лет. Искусственно получено большое количество радиоактивных изотопов, от рубидия-79 до рубидия-95.Одна оценка возраста Солнечной системы в 4,6 миллиарда лет основана на соотношении рубидия-87 и стронция-87 в каменном метеорите. Рубидий легко теряет один валентный электрон, но не другие, учитывая его степень окисления +1, хотя было синтезировано несколько соединений, содержащих анион Rb – .
Рубидий и цезий смешиваются во всех пропорциях и полностью растворяются в твердых веществах; достигается минимум температуры плавления 9 ° C (48 ° F). Рубидий образует ряд ртутных амальгам.Из-за повышенного удельного объема рубидия по сравнению с более легкими щелочными металлами существует меньшая тенденция к образованию систем сплавов с другими металлами.
| атомный номер | 37 |
|---|---|
| атомный вес | 85,47 |
| точка плавления | 38,9 ° C (102 ° F) |
| точка кипения | 688 ° C (1270 ° F) |
| удельный вес | 1.53 (при 20 ° C или 68 ° F) |
| степени окисления | +1, -1 (редко) |
| электронная конфигурация. | 2-8-18-8-1 или [Kr] 5 s 1 |
Рубидий (Rb) | АМЕРИКАНСКИЕ ЭЛЕМЕНТЫ ®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Металлический рубидий
Номер продукта: Все применимые коды продуктов American Elements, например РБ-М-02
CAS #: 7440-17-7
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
1093 Broxton Ave.Suite 2000
Лос-Анджелес, CA
Тел .: +1 310-208-0551
Факс: +1 310-208-0351
Телефон экстренной связи:
Внутренний, Северная Америка +1 800-424-9300
Международный +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси в соответствии с 29 CFR 1910 (OSHA HCS)
GHS02 Flame
Water-react. 1 h360 При контакте с водой выделяет легковоспламеняющиеся газы, которые могут самовоспламеняться.
GHS05 Коррозия
Skin Corr.1B h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Eye Dam. 1 h418 Вызывает серьезное повреждение глаз.
Опасности, не классифицированные иным образом Информация отсутствует.
Элементы маркировки
Элементы маркировки GHS Продукт классифицируется и маркируется в соответствии с 29 CFR 1910 (OSHA HCS)
Пиктограммы опасности
GHS02 GHS05
Сигнальное слово Опасно
Краткая характеристика опасности
h360 При контакте с водой выделяются легковоспламеняющиеся газы, которые могут самовоспламеняться.
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P231 + P232 Работать в среде инертного газа. Беречь от влаги.
P260 Избегать вдыхания пыли / дыма / газа / тумана / паров / аэрозолей.
P303 + P361 + P353 При попадании на кожу (или волосы): немедленно снять всю загрязненную одежду. Промыть кожу водой / принять душ.
P305 + P351 + P338 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть, и это легко сделать. Продолжайте полоскание.
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Классификация WHMIS
B6 – Реактивный горючий материал
D2B – Токсичный материал, вызывающий другие токсические эффекты
E – Коррозионный материал
Система классификации
Рейтинги HMIS (шкала 0-4)
(Система идентификации опасных материалов)
ЗДОРОВЬЕ
ПОЖАР
РЕАКТИВНОСТЬ
3
3
3
Здоровье (острые эффекты) = 3
Воспламеняемость = 3
Физическая опасность = 3
Другие опасности
Результаты оценки PBT и vPvB
PBT: Неприменимо.
vPvB: не применимо.
РАЗДЕЛ 3. СОСТАВ / ИНФОРМАЦИЯ ОБ ИНГРЕДИЕНТАХ
Химические характеристики: Вещества
Номер CAS Описание:
7440-17-7 Рубидий
Идентификационный номер (а):
Номер ЕС: 231-126-6
РАЗДЕЛ 4. ПЕРВАЯ ПОМОЩЬ
Описание мер первой помощи
Общая информация Немедленно снимите всю одежду, загрязненную продуктом.
При вдыхании
Обеспечьте свежий воздух. При необходимости сделайте искусственное дыхание.Держите пациента в тепле.
Немедленно обратитесь за медицинской помощью.
При контакте с кожей
Немедленно промыть водой с мылом и тщательно сполоснуть.
Немедленно обратитесь за медицинской помощью.
При попадании в глаза Промыть открытый глаз под проточной водой в течение нескольких минут. Тогда обратитесь к врачу.
После проглатывания Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и воздействия, как острые, так и проявляющиеся с задержкой
Вызывает серьезные ожоги кожи.
Вызывает серьезное повреждение глаз.
Указание на необходимость немедленной медицинской помощи и специального лечения Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 5. МЕРЫ ПОЖАРОТУШЕНИЯ
Средства пожаротушения
Надлежащие средства тушения В случае пожара используйте песок, двуокись углерода или порошковое средство тушения. Никогда не используйте воду.
Средства пожаротушения, непригодные из соображений безопасности Вода
Особые опасности, исходящие от вещества или смеси
Бурно реагирует с водой
При пожаре могут образоваться следующие вещества:
Оксид рубидия
Рекомендации для пожарных
Защитное снаряжение:
Наденьте автономный респиратор.
Надеть полностью защитный непромокаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры личной безопасности, защитное снаряжение и порядок действий в чрезвычайной ситуации.
Надевайте защитное снаряжение. Не подпускайте незащищенных людей.
Обеспечьте соответствующую вентиляцию.
Держите подальше от источников возгорания.
Меры по защите окружающей среды: Не допускайте попадания продукта в канализацию или водоемы.
Методы и материалы для локализации и очистки:
Использовать нейтрализующий агент.
Утилизируйте зараженный материал как отходы в соответствии с разделом 13.
Обеспечьте соответствующую вентиляцию.
Не смывать водой или водными чистящими средствами.
Предотвращение вторичных опасностей: Хранить вдали от источников возгорания.
Ссылка на другие разделы
См. Раздел 7 для получения информации о безопасном обращении.
См. Раздел 8 для получения информации о средствах индивидуальной защиты.
См. Раздел 13 для получения информации об утилизации.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности при обращении
Обращение в атмосфере сухого защитного газа.
Хранить контейнер плотно закрытым.
Хранить в сухом прохладном месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Реагирует бурно с водой
Информация о защите от взрывов и пожаров: Информация отсутствует.
Условия безопасного хранения с учетом несовместимости
Хранение
Требования, предъявляемые к складским помещениям и таре: Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от воды / влаги.
Хранить вдали от воздуха.
Хранить вдали от окислителей.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Беречь от влаги и воды.
Хранить контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытой таре.
Специфическое конечное использование Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ / ЛИЧНАЯ ЗАЩИТА
Дополнительная информация о конструкции технических систем:
Правильно работающий вытяжной шкаф для химических веществ, рассчитанный на опасные химические вещества и имеющий среднюю скорость движения не менее 100 футов в минуту.
Контрольные параметры
Компоненты с предельными значениями, требующие контроля на рабочем месте:
Продукт не содержит каких-либо значимых количеств материалов с критическими значениями, которые необходимо контролировать на рабочем месте.
Дополнительная информация: Нет данных
Контроль воздействия
Средства индивидуальной защиты
Общие защитные и гигиенические меры
Следует соблюдать обычные меры предосторожности при обращении с химическими веществами.
Хранить вдали от продуктов питания, напитков и кормов.
Немедленно снимайте всю грязную и загрязненную одежду.
Мойте руки перед перерывами и по окончании работы.
Избегать контакта с глазами и кожей.
Поддерживайте эргономически соответствующую рабочую среду.
Дыхательное оборудование: При высоких концентрациях используйте подходящий респиратор.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа P100 (США) или P3 (EN 143) в качестве резервного средства технического контроля. Следует провести оценку рисков, чтобы определить, подходят ли респираторы
для очистки воздуха.Используйте только оборудование, проверенное и одобренное соответствующими государственными стандартами.
Защита рук:
Непроницаемые перчатки
Проверяйте защитные перчатки перед каждым использованием на предмет их надлежащего состояния.
Выбор подходящих перчаток зависит не только от материала, но и от качества. Качество будет варьироваться от производителя к производителю.
Материал перчаток Нитрилкаучук, NBR
Время проницаемости материала перчаток (в минутах) 480
Толщина перчаток 0,11 мм
Защита глаз:
Плотно закрытые очки
Полная защита лица
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Общая информация
Внешний вид:
Форма: Твердый
Цвет: Серебристо-белый
Запах: Не определено
Пороговое значение запаха: Не определено.
Значение pH: Не применимо.
Изменение состояния
Точка плавления / интервал плавления: 38,9 ° C (102 ° F)
Точка кипения / интервал кипения: 688 ° C (1270 ° F)
Температура сублимации / начало: Не определено
Воспламеняемость (твердое, газообразное) Контакт с водой выделяет легковоспламеняющиеся газы.
Температура возгорания: Не определено
Температура разложения: Не определено
Самовоспламенение: Не определено.
Взрывоопасность: Не определено.
Пределы взрываемости:
Нижний: Не определено
Верхнее: Не определено
Давление пара: Не применимо.
Плотность при 20 ° C (68 ° F): 1,532 г / см³ (12,785 фунта / галлон)
Относительная плотность Не определено.
Плотность пара Не применимо.
Скорость испарения Не применимо.
Растворимость в / Смешиваемость с
Вода: Реагирует бурно.
При контакте с водой выделяются горючие газы.
Коэффициент распределения (н-октанол / вода): Не определено.
Вязкость:
динамическая: Не применимо.
кинематическая: не применимо.
Другая информация Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Реагирует бурно с водой.
При контакте с водой выделяет горючие газы, которые могут самовоспламеняться.
Химическая стабильность Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать: При использовании и хранении в соответствии со спецификациями разложения не происходит.
Возможность опасных реакций
Реагирует с сильными окислителями
При контакте с водой выделяет горючие газы
Реагирует бурно с водой
Условия, вызывающие опасные изменения Отсутствует какая-либо соответствующая информация.
Несовместимые материалы:
Воздух
Окисляющие вещества
Вода / влага
Опасные продукты разложения: Оксид рубидия
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Проглатывание приводит к сильному разъеданию рта и глотки и к опасности перфорации пищевода и желудка.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности этого вещества. Значения
LD / LC50, имеющие отношение к классификации: Нет данных
Раздражение или разъедание кожи: Вызывает серьезные ожоги кожи.
Раздражение или коррозия глаз: Вызывает серьезное повреждение глаз.
Сенсибилизация: сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность: Нет данных о классификации канцерогенных свойств этого материала от EPA, IARC, NTP, OSHA или ACGIH.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая системная токсичность, поражающая отдельные органы-мишени – многократное воздействие: Эффекты неизвестны.
Специфическая системная токсичность, поражающая отдельные органы-мишени – однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Воздействие неизвестно.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация: Насколько нам известно, острая и хроническая токсичность этого вещества полностью не изучена.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Токсичность для водной среды: Отсутствует какая-либо соответствующая информация.
Стойкость и разлагаемость Отсутствует какая-либо соответствующая информация.
Способность к биоаккумуляции Отсутствует какая-либо соответствующая информация.
Подвижность в почве Отсутствует какая-либо соответствующая информация.
Дополнительная экологическая информация:
Общие примечания:
Не допускать попадания неразбавленного продукта или больших количеств продукта в грунтовые воды, водоемы или канализацию.
Избегать попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: Не применимо.
vPvB: не применимо.
Другие побочные эффекты Отсутствует какая-либо соответствующая информация.
РАЗДЕЛ 13. УТИЛИЗАЦИЯ
Методы обработки отходов
Рекомендация Проконсультируйтесь с государственными, местными или национальными правилами, чтобы обеспечить надлежащую утилизацию.
Неочищенная тара:
Рекомендация: Утилизация должна производиться в соответствии с официальными предписаниями.
РАЗДЕЛ 14. ТРАНСПОРТНАЯ ИНФОРМАЦИЯ
Номер ООН
DOT, IMDG, IATA UN1423
Собственное транспортное наименование ООН
DOT Рубидий
IMDG, IATA RUBIDIUM
Класс (ы) опасности при транспортировке
DOT
Class 4.3 Вещества, выделяющие легковоспламеняющиеся газы при соприкосновении с водой.
Этикетка 4.3
Класс 4.3 (W2) Вещества, выделяющие легковоспламеняющиеся газы при соприкосновении с водой
Этикетка 4.3
IMDG, IATA
Класс 4.3 Вещества, выделяющие легковоспламеняющиеся газы при контакте с водой.
Этикетка 4.3
Группа упаковки
DOT, IMDG, IATA I
Опасность для окружающей среды: Не применимо.
Особые меры предосторожности для пользователя Предупреждение: Вещества, которые выделяют горючие газы при соприкосновении с водой
Номер EMS: F-G, S-N
Транспортировка наливом в соответствии с Приложением II MARPOL73 / 78 и Кодексом IBC Не применимо.
Транспорт / Дополнительная информация:
DOT
Морской загрязнитель (DOT): №
Типовой регламент ООН: UN1423, Рубидий, 4.3, I
РАЗДЕЛ 15. НОРМАТИВНАЯ ИНФОРМАЦИЯ
Нормы безопасности, здоровья и окружающей среды / законодательные акты, относящиеся к веществу или смеси
Элементы маркировки GHS Продукт классифицирован и маркирован в соответствии с 29 CFR 1910 (OSHA HCS)
Пиктограммы опасности
GHS02 GHS05
Сигнальное слово Опасно
Формулировки опасности
h360 При контакте с водой выделяет горючие газы, которые могут самовоспламеняться.
h414 Вызывает серьезные ожоги кожи и повреждения глаз.
Меры предосторожности
P231 + P232 Работать в среде инертного газа. Беречь от влаги.
P260 Избегать вдыхания пыли / дыма / газа / тумана / паров / аэрозолей.
P303 + P361 + P353 При попадании на кожу (или волосы): немедленно снять всю загрязненную одежду. Промыть кожу водой / принять душ.
P305 + P351 + P338 ПРИ ПОПАДАНИИ В ГЛАЗА: осторожно промыть глаза водой в течение нескольких минут. Снимите контактные линзы, если они есть, и это легко сделать. Продолжайте полоскание.
P405 Хранить под замком.
P501 Утилизировать содержимое / контейнер в соответствии с местными / региональными / национальными / международными правилами.
Национальные правила
Все компоненты этого продукта перечислены в Реестре химических веществ в соответствии с Законом о контроле за токсичными веществами Агентства по охране окружающей среды США.
Все компоненты этого продукта внесены в Канадский список веществ, не предназначенных для домашнего использования (NDSL).
SARA Раздел 313 (списки конкретных токсичных химических веществ) Вещество не указано.
California Proposition 65
Prop 65 – Химические вещества, вызывающие рак. Вещества не указаны.
Предложение 65 – Токсичность для развития Вещество не указано.
Предложение 65 – Токсичность для развития, женская Вещество не перечислено.
Предложение 65 – Токсичность для развития, мужские вещества Вещество не указано.
Информация об ограничении использования: Для использования только технически квалифицированными специалистами.
Другие постановления, ограничения и запретительные постановления
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (EC) № 1907/2006. Вещества нет в списке.
Должны соблюдаться условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке
и использования.
Вещества нет в списке.
Приложение XIV Правил REACH (требуется разрешение на использование) Вещество не указано.
Оценка химической безопасности: Оценка химической безопасности не проводилась.
16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Вышеупомянутая информация считается правильной, но не претендует на исчерпывающий характер и должна использоваться только в качестве руководства. Информация в этом документе основана на текущем уровне наших знаний и применима к продукту с учетом соответствующих мер безопасности.Это не является гарантией свойств продукта. American Elements не несет ответственности за любой ущерб, возникший в результате обращения или контакта с вышеуказанным продуктом. Дополнительные условия продажи см. На обратной стороне счета-фактуры или упаковочного листа. АВТОРСКИЕ ПРАВА 1997-2016 AMERICAN ELEMENTS. ЛИЦЕНЗИОННЫМ ДАННЫМ РАЗРЕШЕНО ИЗГОТОВЛЕНИЕ НЕОГРАНИЧЕННЫХ КОПИЙ БУМАГИ ТОЛЬКО ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ.
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы просмотреть полную информацию о цитировании этой записи)
Олбрайт, Томас А., и Джереми К. Бёрдетт. Проблемы теории молекулярных орбиталей. Нью-Йорк: Oxford University Press, 1992.
Аллен, Лиланд К. «Электроотрицательность – это средняя энергия одного электрона валентной оболочки в свободных атомах в основном состоянии». Журнал Американского химического общества, том 111, номер 25, 1989 г., стр. 9003–9014. DOI: 10.1021 /
Allred, A. L. «Значения электроотрицательности из термохимических данных». Журнал неорганической и ядерной химии, том 17, номер 3-4, 1961 г., стр.215–221. DOI: 10.1016 /
Allred, A. L. и E. G. Rochow. «Шкала электроотрицательности, основанная на электростатической силе». Журнал неорганической и ядерной химии, том 5, номер 4, 1958, стр. 264–268. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta, том 53, номер 1, 1989 г., стр. 197–214. DOI: 10.1016 /
Андерсен, Т., Х. К. Хауген и Х. Хотоп. “Энергии связи в атомной Отрицательные ионы: III. “Журнал физических и химических справочных данных, том 28, номер 6, 1999 г., стр. 1511–1533.
Бацанов, С.С.” Ван-дер-Ваальсовые радиусы элементов. “Неорганические материалы, том 37, номер 9 , 2001, pp. 871–885. См. Реферат
Bedford, RE, G. Bonnier, H. Maas, and F. Pavese. “Рекомендуемые значения температуры по Международной температурной шкале 1990 г. для выбранного набора вторичных контрольных точек. .”Metrologia, volume 33, number 2, 1996, pp. 133–154. Doi: 10.1088 /
Bowen, HJM Environmental Chemistry of the Elements. Лондон”. : Academic Press, Inc., 1979.
Bratsch, Steven G. “Пересмотренные значения электроотрицательности Малликена: I. Расчет.
и преобразование в единицы Полинга “. Журнал химического образования, том 65, номер 1, 1988 г., стр. 34–41. doi: 10.1021 /
Campbell, J.L. “Выходы флуоресценции и вероятности Костера – Кронига для
the Atomic L Subshells. “Atomic Data and Nuclear Data Tables, volume 85, number 2, 2003, pp. 291–315. doi: 10.1016 /
Cardarelli, François. Справочник по материалам : Краткий Настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
Чейз, Малкольм В., редактор. Монография JPCRD № 9: Термохимические таблицы NIST-JANAF (Часть I и Часть II). Вудбери, штат Нью-Йорк: Американское химическое общество и Американский институт физики, 1998 г.
Чи, Т. К. “Удельное электрическое сопротивление щелочных элементов”. Справочный журнал физических и химических данных, том 8, номер 2, 1979 г., стр. 339–438.
Клементи, Э., Д. Л. Раймонди и В. П. Рейнхардт. “Атомный скрининг
Константы из функций SCF. II. Атомы с 37 до 86 электронов ». Журнал химической физики, том 47, номер 4, 1967, стр. 1300–1307. Doi: 10.1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Редакторы Тригг Настольный справочник по физике AlP, 3-е издание.Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации IUPAC 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверрия, Эдуард Кремадес, Флавия Барраган и Сантьяго Альварес. «Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
Cox, P.А. Элементы: их происхождение, изобилие и распространение. Oxford: Oxford University Press, 1989.
Кронан, Д. С. «Базальные металлические отложения восточной части Тихого океана». Бюллетень Геологического общества Америки, том 87, номер 6, 1976 г., стр. 928–934. DOI: 10.1130 /
де Подеста, Майкл. Понимание свойств материи, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Донохью, Джерри. Структуры элементов, 2-е издание.Малабар, Флорида: издательство Robert E. Krieger Publishing Company, 1974.
Дронсковски, Ричард. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д. и Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание.Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли, с помощниками редакторов Корал М. Баглин, С. Ю. Франк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Галассо, Фрэнсис С. Структура и свойства неорганических твердых тел. Oxford: Pergamon Press, 1970.
Ghosh, Dulal C., and Kartick Gupta. “Новая шкала электроотрицательности
54 элемента периодической таблицы на основе поляризуемости атомов.”Журнал теоретической и вычислительной химии, том 5, номер 4, 2006 г., стр. 895–911. Doi: 10.1142 /
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
Гвин Уильямс. Энергии связи электронов. http: //
Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор.”Журнал физических и химических справочных данных, том 3, приложение 1, 1974 г., стр. I – 1 – I – 796.
Хорват, А.Л.” Критическая температура элементов и периодическая система “. Журнал химического образования, том 50 , номер 5, 1973, стр. 335–336. doi: 10.1021 /
Хотоп, Х., и В.К. Линебергер. «Энергии связи в атомных отрицательных ионах: II.» Журнал физических и химических справочных данных, том 14, номер 3, 1985, стр. 731–750.
Huheey, James E., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: основы структуры и реакционной способности, 4-е издание. Нью-Йорк: издательство HarperCollins College, 1993.
Ihde, Аарон Дж. Развитие современной химии. Нью-Йорк: Dover Publications, Inc., 1984.
Кинг, Х. У. «Аллотропные структуры элементов, зависящие от давления». Бюллетень фазовых диаграмм сплавов, том 4,
№ 4, 1983, с. 449–450. DOI: 10.1007 /
Киттель, Чарльз.Введение в физику твердого тела, 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Краузе, М. О. «Атомные радиационные и безызлучательные выходы для K- и L-оболочек». Справочный журнал физических и химических данных, том 8, номер 2, 1979 г., стр. 307–327.
Li, Y.-H., and J. E. Schoonmaker. «Химический состав и минералогия Морские отложения. “С. 1–36 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Либофф, Ричард Л. Введение в квантовую механику, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998.
Лид, Дэвид Р., редактор. CRC Справочник по химии и физике, 88-е издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Манн, Джозеф Б., Терри Л. Мик и Лиланд К. Аллен. «Энергии конфигурации основных элементов группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. DOI: 10.1021 /
Мануэль, О., редактор. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года. Нью-Йорк: Kluwer Academic Publishers, 2000.
Маршалл, Джеймс Л. Открытие элементов: поиск фундаментальных принципов Вселенной, 2-е издание. Бостон, Массачусетс: Pearson Custom Publishing, 2002.
Мартин У. К. «Электронная структура элементов». Европейский физический журнал C – Частицы и поля, том 15, номер 1–4, 2000 г., стр. 78–79. DOI: 10.1007 /
McDonough, W.F. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Oxford: Elsevier Ltd., 2005.
Mechtly, Eugene A. «Свойства материалов». pp. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь. Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. doi: 10.1016 /
Мисслер, Гэри Л. и Дональд А.Tarr. Неорганическая химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2004.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112,
№ 12, 1990, с. 4741–4747. DOI: 10.1021 /
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». стр. 191–222 в отложениях, диагенез, и осадочные породы. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Окстоби, Дэвид У., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Thomson Brooks / Cole, 2008.
Palme, H., and H. Beer. «Метеориты и состав солнечной фотосферы». стр. 204–206 в книге Ландольта – Бернштейна – Группа VI: Астрономия и астрофизика. Под редакцией Х. Х. Фойгта. Нью-Йорк: Springer – Verlag, 1993. doi: 10.1007 /
Пальме, Х. и Хью Сент-К. О’Нил. «Космохимические оценки состава мантии.”стр. 1–38 в” Мантия и ядро ”. Под редакцией Ричарда У. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа химической связи, 3-е издание. Итака, Нью-Йорк: издательство Корнельского университета, 1960.
Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: применение в неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. DOI: 10.1021 /
Pekka Pyykkö. Самосогласованные ковалентные радиусы 2009 г. http: //
Pyykkö, Pekka, and Michiko Atsumi. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112». Химия – Европейский журнал, том 15, номер 46, 2009 г., стр. 12770–12779. DOI: 10.1002 / 2
Pyykkö, Pekka и Michiko Atsumi. «Молекулярные ковалентные радиусы одинарной связи для элементов 1-118». Химия – Европейский журнал, том 15, номер 1, 2009 г., стр.186–197. DOI: 10.1002 /
Рингнес, Виви. «Происхождение названий химических элементов». Журнал химического образования, том 66, номер 9, 1989 г., стр. 731–738. DOI: 10.1021 /
Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Издательство Кембриджского университета, 2001.
Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Сандерсон Р. Т. Простые неорганические вещества. Малабар, Флорида: Robert E. Krieger Publishing Co., Inc., 1989.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общая природа». Журнал химического образования, том 65, номер 2, 1988 г., стр. 112–118. DOI: 10.1021 /
Сандерсон, Р. Т. Полярная ковалентность. Нью-Йорк: Academic Press, Inc., 1983.
Сансонетти, Дж. Э. «Длины волн, вероятности переходов и уровни энергии для спектров рубидия (Rb I – Rb XXXVII).”Журнал физических и химических справочных данных, том 35, номер 1, 2006 г., стр. 301–421. Doi: 10.1063 /
Scientific Group Thermodata Europe (SGTE). Pure
Вещества: Часть 1 – Элементы и соединения от AgBr до Ba3N2. Под редакцией И. Уртадо и Д. Нойшютца. Берлин: Springer-Verlag, 1999. doi: 10.1007 /
Шеннон, Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования
Межатомные расстояния в галогенидах и халькогенидах.”Acta Crystallographica Section A, volume 32, number 5, 1976, pp. 751–767. Doi: 10.1107 /
Silbey, Robert J., Robert A. Alberty, and Moungi G. Bawendi. Physical Chemistry, 4th издание. Хобокен, штат Нью-Джерси: John Wiley & Sons, Inc., 2005.
Сингман, Чарльз Н. «Атомный объем и аллотропия элементов». Журнал химического образования, том 61, номер 2, 1984, стр. 137– 142. doi: 10.1021 /
Слейтер, Дж. К. «Атомные радиусы в кристаллах.”Журнал химической физики, том 41, номер 10, 1964 г., стр. 3199–3204. DOI: 10.1063 /
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химического образования, том 67, номер 11, 1990 г., стр. 911–914. DOI: 10.1021 /
Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Издательство Кембриджского университета, 1990.
Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 /
Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 /
Тари, А. Удельная теплоемкость вещества при низких температурах. Лондон: Imperial College Press, 2003.
Министерство транспорта США (DOT), Транспорт Канады (TC), Секретариат транспорта и коммуникаций Мексики (SCT) и Centro de Información Química para Emergencias (CIQUIME).2008 Чрезвычайная ситуация Руководство по реагированию.
Вайнштейн, Борис К., Владимир М. Фридкин, Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995.
Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993.
. Waber, J. T. и Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965 г., стр.4116–4123. DOI: 10.1063 /
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э.
Троски и Джошуа Дж. Пирсон. «Проценты скрининга на основе эффективного ядерного заряда Слейтера как универсальный инструмент для обучения периодическим тенденциям». Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. DOI: 10.1021 /
Weeks, Мэри Эльвира и Генри М. Лестер. Открытие Стихий, 7-е издание. Истон, Пенсильвания: Журнал химического образования, 1968.
Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет IUPAC)». Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. DOI: 10.1351 /
Yaws, Карл Л. «Плотность жидкости в элементах». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46.
Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: Gulf Publishing Company, 2005.
Факты о рубидии – Rb or Element 37
Рубидий – это щелочной металл серебристого цвета с температурой плавления немного выше температуры тела.Элемент имеет атомный номер 37 с символом элемента Rb. Вот коллекция фактов об элементе рубидий.
Быстрые факты: рубидий
- Название элемента : Рубидий
- Элемент Обозначение : Rb
- Атомный номер : 37
- Внешний вид : Серый металл
- Группа : Группа 1 (щелочные металлы)
- Период : Период 5
- Discovery : Роберт Бунзен и Густав Кирхгоф (1861)
- Интересный факт : Период полураспада радиоактивного изотопа Rb-87 составляет 49 миллиардов лет, что более чем в три раза превышает возраст Вселенной.
Основные сведения о рубидии
атомный номер: 37
Символ: руб.
Атомный вес: 85,4678
Открытие: Р. Бунзен, Г. Кирхгоф 1861 (Германия) обнаружили рубидий в минерале петалит по его темно-красным спектральным линиям.
Электронная конфигурация: [Kr] 5s 1
Происхождение слова: Латинский: rubidus: темно-красный.
Изотопы: Известно 29 изотопов рубидия.Природный рубидий состоит из двух изотопов: рубидия-85 (стабильный с содержанием 72,15%) и рубидий-87 (содержание 27,85%, бета-излучатель с периодом полураспада 4,9 x 10 10 лет). Таким образом, природный рубидий радиоактивен и обладает достаточной активностью, чтобы экспонировать фотопленку в течение 110 дней.
Свойства: Рубидий может быть жидким при комнатной температуре. Он самовоспламеняется на воздухе и бурно реагирует в воде, поджигая выделившийся водород. Таким образом, рубидий необходимо хранить в сухом минеральном масле, в вакууме или в инертной атмосфере.Это мягкий серебристо-белый металлический элемент щелочной группы. Рубидий образует амальгамы с ртутью и сплавы с золотом, натрием, калием и цезием. Рубидий светится красно-фиолетовым светом при испытании пламенем.
Классификация элемента: Щелочной металл
Биологические эффекты : Рубидий обладает степенью окисления +1, как натрий и калий, и проявляет биологическую активность, аналогичную активности ионов калия. Рубидий концентрируется внутри клеток во внутриклеточной жидкости.Биологический период полураспада ионов рубидия в организме человека составляет от 31 до 46 дней. Ионы рубидия не особенно токсичны, но крысы умирают, когда более половины калия в сердечной мышце заменяется рубидием. Хлорид рубидия был испытан в качестве средства для лечения депрессии. Исследователи обнаружили, что диализные пациенты, страдающие депрессией, имеют тенденцию испытывать снижение уровня рубидия. Этот элемент не считается необходимым для питания человека, хотя в небольших количествах он присутствует почти во всех тканях человека и животных.
Физические характеристики рубидия
Рубидиевые мелочи
- Рубидий плавится чуть выше температуры тела.
- Рубидий был обнаружен с помощью спектроскопии. Когда Бунзен и Кирхгоф исследовали свой образец петалита, они обнаружили две красные спектральные линии глубоко в красной части спектра. Они назвали свой новый элемент рубидием в честь латинского слова rubidus , означающего «самый глубокий красный».
- Рубидий – второй по величине электроположительный элемент.
- Рубидий можно использовать для придания фейерверкам красно-фиолетового цвета.
- Рубидий – 23 rd элемент, наиболее распространенный в земной коре.
- Хлорид рубидия используется в биохимии в качестве биомаркера для отслеживания того, где калий поглощается живыми организмами.
- Сверхтонкая электронная структура рубидия-87 используется в некоторых атомных часах для поддержания точности.
- Изотоп Ru-87 был использован Эриком Корнеллом, Вольфгангом Кеттерле и Карлом Вименом для производства конденсата Бозе-Эйнштейна.Это принесло им Нобелевскую премию по физике 2001 года.
Источники
- Campbell, N. R .; Вуд, А. (1908). «Радиоактивность рубидия». Труды Кембриджского философского общества . 14: 15.
- Fieve, Ronald R .; Meltzer, Herbert L .; Тейлор, Реджинальд М. (1971). «Проглатывание хлорида рубидия добровольцами: начальный опыт». Психофармакология . 20 (4): 307–14. DOI: 10.1007 / BF00403562
- Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press. п. 4.122. ISBN 1439855110.
- Мейтес, Луи (1963). Справочник по аналитической химии (Нью-Йорк: McGraw-Hill Book Company.
